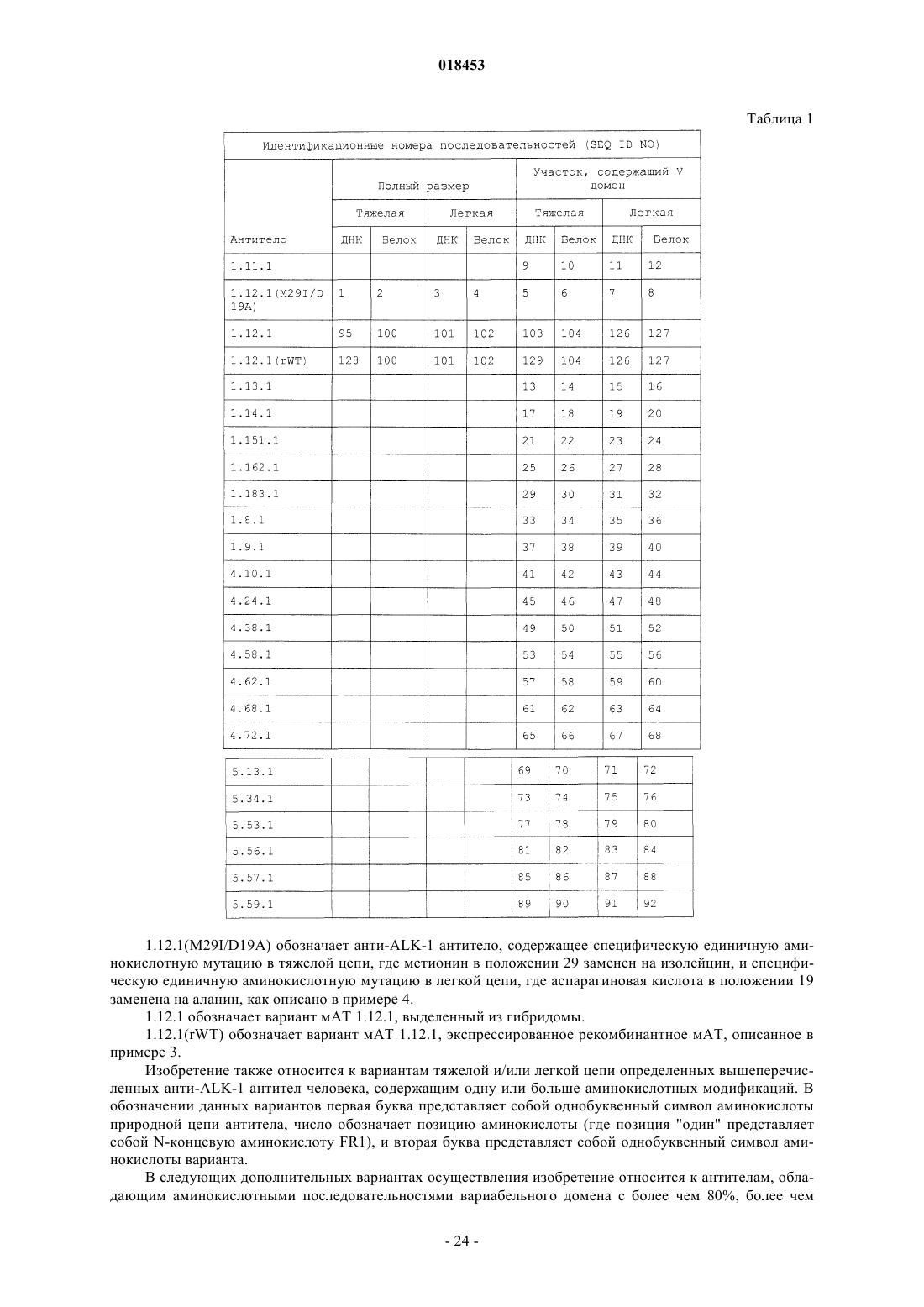
Моноклональные антитела человека к киназе-1, подобной рецептору активина, и их применение
Номер патента: 18453
Опубликовано: 30.08.2013
Авторы: Цзян Синь, Амундсон Карин Кристина, Карличек Шеннон Мари, Норт Майкл Айдан, Чжан Цзинчуань, Белуски Шелли Симс, Бедиан Вахе, Томсон Джеймс Артур, Ван Цзяньин, Ху-Леуе Дана Дан, Уикман Грант Рэймонд, Келлерманн Зирид-Аймее
Формула / Реферат
1. Моноклональное антитело или его антигенсвязывающий участок, которые связываются с киназой-1, подобной рецептору активина (ALK-1), где антитело выбрано из группы, состоящей из
(a) антитела, которое содержит аминокислотные последовательности CDR1, CDR2 и CDR3 последовательности VH-домена, имеющей любую из последовательностей SEQ ID NO: 6, 14, 18, 26, 30, 38, 46, 50, 54, 58, 62, 66, 70 или 104, или последовательность, кодируемую нуклеотидной последовательностью плазмидной вставки клона E.coli, депонированного под номером РТА-6864 в АТСС;
(b) антитела, которое содержит аминокислотные последовательности CDR1, CDR2 и CDR3 последовательности VL-домена, имеющей любую из последовательностей SEQ ID NO: 8, 16, 20, 28, 32, 40, 48, 52, 56, 60, 64, 68, 72 или 127, или последовательность, кодируемую нуклеотидной последовательностью плазмидной вставки клона E.coli, депонированного под номером РТА-6865 в АТСС;
(c) антитела, которое содержит VH-домен, который по меньшей мере на 90% идентичен любой из последовательности SEQ ID NO: 6; 14; 18; 26; 30; 38; 46; 50; 54; 58; 62; 66; 70 или 104; и
(d) антитела, которое содержит VL-домен, который по меньшей мере на 90% идентичен любой из последовательности SEQ ID NO: 8; 16; 20; 28; 32; 40; 48; 52; 56; 60; 64; 68; 72 или 127.
2. Антитело или его антигенсвязывающий участок по п.1, где антитело выбрано из группы, состоящей из
(a) антитела, которое содержит VH-домен с любой из последовательностей SEQ ID NO: 6, 14, 18, 26, 30, 38, 46, 50, 54, 58, 62, 66, 70 или 104; и
(b) антитела, которое содержит VL-домен с любой из последовательностей SEQ ID NO: 8, 16, 20, 28, 32, 40, 48, 52, 56, 60, 64, 68, 72 или 127.
3. Антитело или его антигенсвязывающий участок по п.1, где антитело содержит последовательности CDR1, CDR2 и CDR3 вариабельных доменов тяжелой и легкой цепи, соответственно, имеющих SEQ ID NO: 6 и 8.
4. Антитело или его антигенсвязывающий участок по п.3, содержащие тяжелую цепь с последовательностью VH-домена SEQ ID NO: 6 и легкую цепь с последовательностью VL-домена SEQ ID NO: 8.
5. Моноклональное антитело или его антигенсвязывающий участок, которые связываются с ALK-1, содержащие вариабельный домен тяжелой цепи, содержащий SEQ ID NO: 6, и вариабельный домен легкой цепи, содержащий SEQ ID NO: 8.
6. Моноклональное антитело, которое связывается с ALK-1, содержащее аминокислотную последовательность тяжелой цепи SEQ ID NO:2 и аминокислотную последовательность легкой цепи SEQ ID NO:4.
7. Моноклональное антитело, которое связывается с ALK-1, содержащее аминокислотную последовательность тяжелой цепи SEQ ID NO: 100 и аминокислотную последовательность легкой цепи SEQ ID NO: 102.
8. Моноклональное антитело по п.4 или 5, где моноклональное антитело представляет собой молекулу IgG1 или IgG2.
9. Антитело или его антигенсвязывающий участок по п.1, которые обладают по меньшей мере одним свойством, выбранным из группы, состоящей из следующих свойств:
a) связывают внеклеточный домен ALK-1 приматов с величиной авидности, равной 5 нМ или меньшей, что определено при помощи поверхностного плазмонного резонанса;
b) связывают внеклеточный домен ALK-1 человека с величиной авидности, равной 250 пМ или меньшей, что определено при помощи поверхностного плазмонного резонанса;
c) обладают степенью диссоциации (koff) для ALK-1 человека, равной 5´10-3 с-1 или меньше, что определено при помощи поверхностного плазмонного резонанса;
d) связывают ALK-1 приматов с KD, равной 50 нМ или меньше, что определено при помощи проточной цитометрии;
e) обладают KD (грызунов)/KD (приматов), которое является больше 1,5;
f) обладают IC50, равной 150 нМ или меньше, что определено по ингибированию повышенной регуляции специфического гена-мишени ALK-1 "следующего этапа сигнального пути", Id1;
g) обладают IC50, равной 150 нМ или меньше, что определено по ингибированию фосфорилирования Smadl, определенному при помощи вестерн-блоттинга;
h) ингибируют ангиогенез сосудов человека у мыши SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали опухолевые клетки меланомы M24met человека, по меньшей мере на 40% по сравнению с контрольным образцом, где ингибирование определяли иммуногистохимическим анализом на CD-31 человека;
i) ингибируют ангиогенез сосудов человека у мыши SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали коллаген, по меньшей мере на 50% по сравнению с контрольным образцом, где ингибирование определяли иммуногистохимическим анализом на CD-31 человека;
j) конкурируют за связывание ALK-1 с антителом, выбранным из группы, состоящей из 1.12.1; 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.12.1(rWT); 1.13.1; 1.14.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.9.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1 и 5.13.1, раскрытым в описании;
k) перекрестно конкурируют за связывание ALK-1 с антителом, выбранным из группы, состоящей из 1.12.1; 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.12.1(rWT); 1.13.1; 1.14.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.9.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1 и 5.13.1, раскрытым в описании;
l) связывают тот же эпитоп ALK-1, что и антитело, выбранное из группы, состоящей из 1.12.1; 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.12.1(rWT); 1.13.1; 1.14.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.9.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1 и 5.13.1, раскрытым в описании;
m) связывают ALK-1 с такой же, по существу, KD, что и антитело, выбранное из группы, состоящей из 1.12.1; 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.12.1(rWT); 1.13.1; 1.14.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.9.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1 и 5.13.1, раскрытое в описании; и
n) связывают ALK-1 с такой же, по существу, koff, что и антитело, выбранное из группы, состоящей из 1.12.1; 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.12.1(rWT); 1.13.1; 1.14.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.9.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1 и 5.13.1, раскрытое в описании.
10. Антитело или антигенсвязывающий участок по п.1, выбранные из группы, состоящей из
a) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 6, или отличающейся от SEQ ID NO: 6 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 8, или отличающейся от SEQ ID NO: 8 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
b) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 14, или отличающейся от SEQ ID NO: 14 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 16, или отличающейся от SEQ ID NO: 16 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
c) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 18, или отличающейся от SEQ ID NO: 18 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 20, или отличающейся от SEQ ID NO: 20 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
d) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 26, или отличающейся от SEQ ID NO: 26 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 28, или отличающейся от SEQ ID NO: 28 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
e) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 30, или отличающейся от SEQ ID NO: 30 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 32, или отличающейся от SEQ ID NO: 32 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
f) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 38, или отличающейся от SEQ ID NO: 38 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 40, или отличающейся от SEQ ID NO: 40 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
g) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 46, или отличающейся от SEQ ID NO: 46 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 48, или отличающейся от SEQ ID NO: 48 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
h) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 50, или отличающейся от SEQ ID NO: 50 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 52, или отличающейся от SEQ ID NO: 52 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
i) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 54, или отличающейся от SEQ ID NO: 54 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 56, или отличающейся от SEQ ID NO: 56 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
j) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 58, или отличающейся от SEQ ID NO: 58 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 60, или отличающейся от SEQ ID NO: 60 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
k) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 62, или отличающейся от SEQ ID NO: 62 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 64, или отличающейся от SEQ ID NO: 64 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
l) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 66, или отличающейся от SEQ ID NO: 66 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 68, или отличающейся от SEQ ID NO: 68 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
m) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 70, или отличающейся от SEQ ID NO: 70 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 72, или отличающейся от SEQ ID NO: 72 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
n) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 104, или отличающейся от SEQ ID NO: 104 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 127, или отличающейся от SEQ ID NO: 127 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности;
о) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 6, или отличающейся от SEQ ID NO: 6 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 127, или отличающейся от SEQ ID NO: 127 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности; и
р) антитела или его участка, которые содержат VH-домен с последовательностью SEQ ID NO: 104, или отличающейся от SEQ ID NO: 104 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности, и VL-домен с последовательностью SEQ ID NO: 8, или отличающейся от SEQ ID NO: 8 по меньшей мере одной консервативной аминокислотной заменой, где указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности.
11. Антитело или его антигенсвязывающий участок по п.1, которые содержат тяжелую цепь, которую кодирует VH 4-31, VH 3-11, VH 4-61 или VH 4-59 ген человека, причем по меньшей мере одна консервативная аминокислотная замена имеет место в VH 4-31, VH 3-11, VH 4-61 или VH 4-59 гене человека, и указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности.
12. Антитело или антигенсвязывающий участок по п.1, которые содержат легкую цепь, которую кодирует VK A27, VK A2, VK В3 или VK L2 ген человека, причем по меньшей мере одна консервативная аминокислотная замена имеет место в VK A27, VK А2, VK В3 или VK L2 гене человека, и указанная последовательность по меньшей мере с одной консервативной аминокислотной заменой по меньшей мере на 90% идентична незамещенной последовательности.
13. Антитело по любому из пп.1-5 и 9-14, которое представляет собой молекулу IgG, IgM, IgE, IgA или IgD.
14. Выделенная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, которая кодирует тяжелую цепь или ее антигенсвязывающий участок, или легкую цепь или ее антигенсвязывающий участок, или и тяжелую цепь или ее антигенсвязывающий участок и легкую цепь или ее антигенсвязывающий участок антитела по любому из пп.1-13.
15. Выделенная молекула нуклеиновой кислоты по п.14, содержащая нуклеотидную последовательность SEQ ID NO: 1, 3, 5, 7, 95, 101, 103, 126, 128, 129, 13, 15, 17, 19, 25, 27, 29, 31, 37, 39, 45, 47, 49, 51, 53, 57, 59, 61, 63, 65, 67, 69 или 71.
16. Гибридома АТСС РТА-6808, которая продуцирует моноклональное антитело 1.21.1 против ALK-1, раскрытое в описании.
17. Антитело, имеющее ту же аминокислотную последовательность, как антитело, продуцируемое гибридомой по п.16; или антигенсвязывающий участок этого антитела.
18. Моноклональное антитело или его антигенсвязывающий участок, которые связывают ALK-1, где антитело или его участок содержат аминокислотную последовательность, выбранную из группы, состоящей из
a) SEQ ID NO: 2;
b) SEQ ID NO: 4;
c) SEQ ID NO: 6;
d) SEQ ID NO: 8;
e) SEQ ID NO: 100;
f) SEQ ID NO: 102;
g) SEQ ID NO: 104;
h) SEQ ID NO: 127;
i) аминокислотной последовательности VH, кодируемой нуклеотидной последовательностью плазмидной вставки клона E.coli, депонированного под номером РТА-6864 в АТСС; и
j) аминокислотной последовательности VL, кодируемой нуклеотидной последовательностью плазмидной вставки клона E.coli, депонированного под инвентарным номером РТА-6865 в АТСС.
19. Антитело или его антигенсвязывающий участок по п.18, содержащие аминокислотную последовательность тяжелой цепи и аминокислотную последовательность легкой цепи, выбранные из группы, состоящей из
а) аминокислотной последовательности тяжелой цепи SEQ ID NO: 2 и аминокислотной последовательности легкой цепи SEQ ID NO: 102 и
b) аминокислотной последовательности тяжелой цепи SEQ ID NO: 100 и аминокислотной последовательности легкой цепи SEQ ID NO: 4.
20. Антитело или его антигенсвязывающий участок по любому из пп.1-13 и 17-19, раскрытые в описании.
21. Антитело или его антигенсвязывающий участок по любому из пп.1-13 и 17-19, связанные с другой молекулой.
22. Антитело или его антигенсвязывающий участок по п.21, где указанная молекула представляет собой пептид или белок.
23. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий участок по любому из пп.1-13 или 17-22 и физиологически приемлемый носитель.
24. Способ ингибирования ангиогенеза у млекопитающего, включающий стадию введения указанному млекопитающему терапевтически эффективного количества антитела или его антигенсвязывающего участка по любому из пп.1-13 или 17-22 или фармацевтической композиции по п.23.
Текст
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К КИНАЗЕ-1, ПОДОБНОЙ РЕЦЕПТОРУ АКТИВИНА, И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится к антителам, включая антитела человека и их антигенсвязывающие участки, которые связывают внеклеточный домен (ECD) киназы-1, подобной рецептору активина (ALK-1), и которые действуют, нарушая ALK-1/TGF-бета-1/Smad1 сигнальный путь. Изобретение также относится к иммуноглобулинам с тяжелой и легкой цепью, производным от анти-ALK-1 антител человека, и молекулам нуклеиновых кислот, кодирующим подобные иммуноглобулины. Настоящее изобретение также относится к способам получения анти-ALK-1 антител человека, композициям, содержащим данные антитела, и способам применения антител и композиций. По настоящей заявке испрашивается приоритет в соответствии с 35 U.S.С.119(e) относительно предварительной заявки на патент США 60/715292, поданной 7 сентября 2005 г., содержание которой приведено в настоящем описании в качестве ссылки в полном объеме. Область изобретения Настоящее изобретение относится к моноклональным антителам человека и их антигенсвязывающим участкам, которые связывают внеклеточный домен (ECD) киназы-1, подобной рецептору активина(ALK-1). Изобретение также относится к молекулам нуклеиновой кислоты, кодирующим такие антитела и антигенсвязывающие участки, способам получения анти-ALK-1 антител человека и антигенсвязывающих участков, композициям, содержащим эти антитела и антигенсвязывающие участки, а также способам применения антител, антигенсвязывающих участков и композиций. Уровень техники изобретенияALK-1 представляет собой поверхностный клеточный рецептор типа I рецептора типа 1 трансформирующего фактора роста бета (TGF1). ALK-1 человека представляет собой полипептид из 503 аминокислот, который включает сигнальную последовательность (аминокислоты: 1-21), N-концевой внеклеточный связывающий лиганд TGF1 домен или ECD (аминокислоты: 22-118), единичный трансмембранный домен (аминокислоты: 119-141), регуляторный домен, богатый глицином/серином (GS) (аминокислоты: 142-202) и С-концевой домен сериновой-треониновой киназы (202-492). Аминокислотная последовательность ALK-1 человека, описанная Attisano et al. Cell, 1993, vol. 75, pp. 671-680 содержит Ser в положении 172 (запись в Genbank L17075), тогда как в патенте США 6316217 заявлена аминокислотная последовательность ALK-1 человека с Thr в положении 172 (запись в Genbank NM000020). ГенACVRL1, кодирующий полноразмерную ALK-1 человека, описанную Attisano et al., доступен на рынке от Invitrogen Inc., клон ID IOH21048. Несмотря на то, что ALK-1 обладает в общей сложности 60-80% гомологией с другими рецепторами типа I (ALK-2 - ALK-7), ECD у ALK-1 существенно отличается отECD других членов семейства ALK. Например, у человека только ECD ALK-2 является в значительной степени родственным ECD ALK-1 (идентичность составляет примерно 25% аминокислот). Патент США 6316217; ten Dijke et al. Oncogene, 1993, vol. 8, pp. 2879-2887; Attisano et al. Cell, 1993, vol. 75, pp. 671-680. Обычно лиганды суперсемейства TGF- проявляют свою биологическую активность посредством связывания с гетеромерными рецепторными комплексами двух типов (I и II) сериновых/треониновых киназ. Рецепторы типа II являются конститутивно активными киназами, которые при связывании лиганда фосфорилируют рецептор типа I. В свою очередь, активированные киназы типа I фосфорилируют сигнальные молекулы следующего этапа сигнального пути, включая различные Smad, которые перемещаются в ядро и приводят к транскрипционному ответу. Heldin et al. Nature, 1997, vol. 390, pp. 465-471. В случае ALK-1, авторы изобретения показали, что Smad1 является специфически фосфорилированной и перемещается в ядро, где непосредственно регулирует экспрессию восприимчивых к Smadl генов Id1 иEphB2. Высокая степень экспрессии и селективность ALK-1 отмечена в эндотелиальных клетках и других высоковаскуляризированых тканях, таких как плацента или головной мозг. Авторы изобретения продемонстрировали с помощью профилирования Affymetrix и ОТ-ПЦР в режиме реального времени, что экспрессия ALK-1 в эндотелиальных клетках намного превосходит экспрессию ее сорецепторов активина типа II и эндоглина, ее лиганда TGF1 или ALK-5. Мутации ALK-1 связаны с наследственной геморрагической телеангиэктазией (ННТ), что свидетельствует о важной роли ALK-1 для контроля развития или восстановления кровеносных сосудов. Abdalla et al. J. Med. Genet, 2003, vol. 40, pp. 494-502; Sadick et al.Hematologica/The Hematology J., 2005, vol. 90, 818-828. Более того, в двух независимых исследованиях с нокаутом ALK-1 у мышей были получены in vivo ключевые свидетельства роли ALK-1 в процессе ангиогенеза. Oh et al. Proc. Natl. Acad. Sci. USA, 2000, vol. 97, pp. 2626-2631; Urness et al. Nature Genetics, 2000,vol. 26, pp. 328-331. Ангиогенез представляет собой физиологический процесс, заключающийся в образовании новых кровеносных сосудов из предсуществующих сосудов и/или циркулирующих эндотелиальных стволовых клеток. Это является нормальным процессом при росте и развитии, а также при заживлении ран. Однако это также является обязательной стадией при переходе опухолей из латентного состояния в злокачественное. Hanahan and Folkman, "Patterns and Emerging Mechanisms of the Angiogenic Switch During Tumorigenesis", Cell, 86 (3):353-364, 1996; Carmeliet, "Angiogenesis in Health and Disease", Nature Medicine,9(6):653-660, 2003; Bergers and Benjamin, "Tumoreigenesis and the Angiogenic Switch", Nature Reviews,3:401-410, 2003. При таких болезнях, как рак, организм теряет способность поддерживать сбалансированный ангиогенез. Новые кровеносные сосуды питают пораженные ткани, разрушая нормальные ткани,и при некоторых раковых заболеваниях новые сосуды могут способствовать выходу опухолевых клеток в кровоток и оседанию их в других органах (опухолевые метастазы) . Ингибиторы ангиогенеза, включая моноклональные антитела (мАТ), являются многообещающим классом лекарственных средств, направленных против такого патологического процесса, для блокирования или замедления роста опухоли. Кроме роли в развитии солидных опухолей и метастазов, ангиогенная компонента присутствует и при других важных состояниях, например артрите, псориазе, неоваскулярной возрастной дегенерацииAdamis et al. "Angiogenesis and ophthalmic disease", Angiogenesis, 1999, vol. 3, pp. 9-14. Полагают, что антиангиогенная терапия будет постоянной. Поэтому мишени с высокоселективной эндотелиальной функцией, такие как ALK-1, являются предпочтительными для уменьшения истощения,возникающего в результате побочных эффектов. Кроме того, вследствие существенного отличия ECDALK-1 от ECD других членов семейства ALK, ожидают, что мАТ против ECD ALK-1 человека, будут избирательно нацелены на ALK-1. Исходя из данных соображений, моноклональное антитело против внеклеточного домена ALK-1, которое может ингибировать димеризацию с рецептором типа II и в результате блокировать фосфорилирование Smad1 и транскрипционный ответ следующего этапа сигнального пути является крайне желательным.RD Systems, Inc. производит и продает моноклональное антитело против ALK-1 человека (кат.МАВ 370), продуцируемое гибридомой, полученной от слияния миеломы мыши с В-клетками мыши, иммунизированной очищенным NSO-производным рекомбинантным внеклеточным доменом ALK-1 человека. Авторы изобретения показали, что это антитело не нейтрализует взаимодействие между ALK-1 иTGF1 и не препятствует фосфорилированию Smad1. Была получена кроличья антисыворотка против синтетического пептида, соответствующего части внутриклеточного околомембранного участка ALK-1(аминокислотные остатки 145-166), связанного с гемоцианином виноградной улитки (KLH) (патент США 6692925), а также против целого внеклеточного домена ALK-1 за исключением лидирующей последовательности (Lux et al., J. Biol. Chem., 1999, vol. 274, pp. 9984-9992). Abdalla et al. (Human Mol. Gen.,2000, vol. 9, pp. 1227-1237) сообщают о получении поликлональных антител против ALK-1 с использованием конструкции с рекомбинантным вирусом коровьей оспы. RD Systems, Inc. производит и продает поликлональные анти-ALK-1 человека антитела (кат.AF370), получаемые от коз, иммунизированных очищенным NSO-производным рекомбинантным внеклеточным доменом ALK-1 человека. До настоящего времени не сообщалось о полностью человеческих моноклональных антителах против ECD ALK-1, и никто не показал эффективность любого моноклонального антитела против ECDALK-1 при нарушении ALK-l/TGF1/Smad1 сигнального пути. Сущность изобретения Настоящее изобретение относится к выделенным нейтрализующим анти-ALK-l моноклональным антителам или их антигенсвязывающим участкам, которые связывают ALK-1 приматов, предпочтительно ECD ALK-1 приматов, более предпочтительно ECD ALK-1 человека. В предпочтительном варианте осуществления нейтрализующие антитела представляют собой полностью человеческие моноклональные антитела или их антигенсвязывающие участки. В другом аспекте настоящее изобретение относится к анти-ALK-1 антителу или его антигенсвязывающему участку, где антитело или его антигенсвязывающий участок блокирует ALK-1/TGF1/Smad1 сигнальный путь. В предпочтительном варианте осуществления антитела представляют собой полностью человеческие моноклональные антитела или их антигенсвязывающие участки. В другом аспекте настоящее изобретение относится к анти-ALK-1 антителу или его антигенсвязывающему участку, где антитело или его антигенсвязывающий участок является антагонистом TGF1 стимулированного ангиогенеза. В предпочтительном варианте осуществления антитела представляют собой полностью человеческие моноклональные антитела или их антигенсвязывающие участки. В другом аспекте настоящее изобретение относится к полностью анти-ALK-1 человека антителу или его антигенсвязывающему участку, где антитело или его антигенсвязывающий участок является антагонистом TGF1-стимулированного опухолевого ангиогенеза. В другом аспекте настоящее изобретение относится к хорошо переносимому инъецируемому полностью человеческому анти-ALK-1 антителу или его антигенсвязывающему участку, где антитело или его антигенсвязывающий участок является антагонистом TGF1-стимулированного ангиогенеза. В другом аспекте настоящее изобретение относится к анти-ALK-1 антителу или его антигенсвязывающему участку, где антитело или его антигенсвязывающий участок ингибирует повышенную регуляцию специфического гена-мишени ALK-1 "следующего этапа сигнального пути", Id1. В предпочтительном варианте осуществления антитела представляют собой полностью человеческие моноклональные антитела или их антигенсвязывающие участки. В другом аспекте настоящее изобретение относится к анти-ALK-l моноклональному антителу или его антигенсвязывающему участку, где антитело или его антигенсвязывающий участок описывают на основании по меньшей мере одного из нескольких функциональных свойств, как описано ниже. Например, в одном из вариантов осуществления антитело или его антигенсвязывающий участок связывает внеклеточный домен ALK-1 приматов с величиной авидности, равной 1 мкМ или меньше, что определено при помощи поверхностного плазмонного резонанса. В дополнительном варианте осуществления антитело или участок связывает внеклеточный домен ALK-1 приматов с величиной авидности меньшей чем 100 нМ, меньшей чем 5 нМ, меньшей чем 1 нМ, меньшей чем 500 пМ, меньшей чем 100 пМ, меньшей чем 50 пМ, меньшей чем 20 пМ, меньшей чем 10 пМ или меньшей чем 1 пМ, как определяли при помощи поверхностного плазмонного резонанса. В определенных вариантах осуществления величина авидности составляет от 0,1 пМ до 1 мкМ. В других вариантах осуществления величина авидности составляет от 1 пМ до 100 нМ. В других вариантах осуществления величина авидности составляет от 1 пМ до 5 нМ. В других вариантах осуществления величина авидности составляет от 1 до 500 пМ. В других вариантах осуществления величина авидности составляет от 1 до 100 пМ. В других вариантах осуществления величина авидности составляет от 1 до 10 пМ. В другом варианте осуществления антитело или его антигенсвязывающий участок связывает внеклеточный домен ALK-1 человека с величиной авидности, равной 100 нМ или меньше, что определено при помощи поверхностного плазмонного резонанса. В дополнительном варианте осуществления антитело или участок связывает внеклеточный домен ALK-1 человека с величиной авидности меньшей чем 10 нМ, меньшей чем 5 нМ, меньшей чем 1 нМ, меньшей чем 500 пМ, меньшей чем 100 пМ, меньшей чем 50 пМ, меньшей чем 20 пМ, меньшей чем 10 пМ или меньшей чем 1 пМ, как определяли при помощи поверхностного плазмонного резонанса. В определенных вариантах осуществления величина авидности составляет от 1 пМ до 100 нМ. В других вариантах осуществления величина авидности составляет от 1 пМ до 5 нМ. В других вариантах осуществления величина авидности составляет от 1 до 500 пМ. В других вариантах осуществления величина авидности составляет от 1 до 100 пМ. В других вариантах осуществления величина авидности составляет от 1 до 10 пМ. В другом варианте осуществления антитело или его участок обладает степенью диссоциации (koff) для ALK-1 человека, равной 510-3 с-1 или меньшей, как определено при помощи поверхностного плазмонного резонанса. Например, в определенных вариантах осуществления антитело или участок обладаетkoff для ALK-1 человека меньшей чем 10-3 с-1, меньшей чем 510-4 с-1, меньшей чем 10-4 с-1, меньшей чем 510-5 с-1, меньшей чем 10-5 с-1, меньшей чем 510-6 с-1. В других вариантах осуществления koff составляет от 10-6 до 10-4 с-1. В других вариантах осуществления koff составляет от 10-6 до 510-5 с-1. В другом варианте осуществления антитело или его участок связывает ALK-1 приматов с KD, равной 1000 нМ или меньшей. В дополнительном варианте осуществления антитело или участок связываетALK-1 человека с KD меньшей чем 500 нМ, меньшей чем 100 нМ, меньшей чем 50 нМ, меньшей чем 20 нМ, меньшей чем 10 нМ или меньшей чем 1 нМ, как определяли при помощи поверхностного плазмонного резонанса. В определенных вариантах осуществления KD составляет от 1 мкМ до 100 нМ. В других вариантах осуществления KD составляет от 100 до 10 нМ. В других вариантах осуществления KD составляет от 50 до 0,1 нМ. Подобные значения KD можно измерять при помощи любого метода, известного специалистам в данной области, такого как варианты ELISA, варианты RIA, проточная цитометрия или поверхностный плазмонный резонанс, такой как BIACORE. В другом варианте осуществления антитело или его участок обладает большей аффинностью связывания для ALK-1 приматов (KD(P, чем для ALK-1 грызунов (KD(R. В одном из вариантов осуществления антитела или их антигенсвязывающие участки по настоящему изобретению обладают KD(R)/KD(P),большим или равным 1,5. В дополнительном варианте осуществления антитела или их антигенсвязывающие участки по настоящему изобретению обладают KD(R)/KD(P), большим или равным 2, большим или равным 3, большим или равным 5, большим или равным 10, большим или равным 20, большим или равным 50, большим или равным 100, большим или равным 200, большим или равным 500 или большим или равным 1000. Подобные значения KD как для ALK-1 приматов, так и для ALK-1 грызунов можно измерять при помощи любого метода, известного специалистам в данной области, такого как проточная цитометрия, ELISA, RIA, или поверхностный плазмонный резонанс, такой как BIACORE. В другом варианте осуществления анти-ALK-1 антитело или его участок обладает IC50, равной 500 нМ или меньшей, что определено по их способности ингибировать повышенную регуляцию специфического гена-мишени ALK-1 "следующего этапа сигнального пути", Id1. В дополнительном варианте осуществления указанная IC50 составляет меньше 300 нМ, меньше 200 нМ, меньше 150 нМ, меньше 100 нМ,меньше 50 нМ, меньше 20 нМ, меньше 10 нМ или меньше 1 нМ. В определенных вариантах осуществления IC50 составляет от 1 до 500 нМ. В других вариантах осуществления IC50 составляет от 5 до 250 нМ. В других вариантах осуществления IC50 составляет от 10 до 100 нМ. В другом варианте осуществления анти-ALK-1 антитело или его участок обладает IC50, равной 250 нМ или меньшей, что определено по их способности ингибировать фосфорилирование Smad1, определенной при помощи вестерн-блоттинга с использованием инфракрасной системы изображения Odyssey. В дополнительном варианте осуществления указанная IC50 составляет меньше 200 нМ, меньше 150 нМ,меньше 100 нМ, меньше 50 нМ, меньше 20 нМ, меньше 10 нМ или меньше 1 нМ. В определенных вариантах осуществления IC50 составляет от 1 до 250 нМ. В других вариантах осуществления IC50 составляет от 5 до 200 нМ. В других вариантах осуществления IC50 составляет от 10 до 100 нМ. В другом варианте осуществления анти-ALK-1 антитело или его участок ингибирует ангиогенез сосудов человека у мышей SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали опухолевые клетки меланомы M24met человека, как определяли ИГХ (IHC) анализом теста на человеческий CD-31 сигнал, по меньшей мере на 40% по сравнению с контрольным образцом. В дополнительном варианте осуществления анти-ALK-l антитело или его участок ингибирует ангиогенез сосудов человека у мышей SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали опухолевые клетки меланомы M24met человека по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50% или по меньшей мере на 60% по сравнению с контрольным образцом. В другом варианте осуществления анти-ALK-1 антитело или его участок обладает ЕС 50, равной 500 нМ или меньше, что определено по их способности ингибировать ангиогенез человеческих сосудов у мышей SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали опухолевые клетки меланомы M24met человека. В дополнительном варианте осуществления указанная ЕС 50 составляет меньше 400 нМ, меньше 300 нМ, меньше 200 нМ, меньше 150 нМ, меньше 100 нМ, меньше 50 нМ, меньше 25 нМ или меньше 5 нМ. В определенных вариантах осуществления ЕС 50 составляет от 5 до 500 нМ. В других вариантах осуществления ЕС 50 составляет от 25 до 300 нМ. В других вариантах осуществления ЕС 50 составляет от 50 до 150 нМ. В другом варианте осуществления анти-ALK-1 антитело или его участок ингибирует ангиогенез сосудов человека у мышей SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали смесь коллагена плюс макроваскулярные эндотелиальные клетки человека, что определено ИГХ анализом теста на CD-31 сигнал человека по меньшей мере на 25% по сравнению с контрольным образцом. Вдополнительном варианте осуществления анти-ALK-1 антитело или его участок ингибирует ангиогенез сосудов человека у мышей SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали коллаген, по меньшей мере на 50% по сравнению с контрольным образцом. В дополнительном варианте осуществления анти-ALK-l антитело или его участок ингибирует по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по сравнению с контролем. В другом варианте осуществления анти-ALK-l антитело или его участок конкурирует за связывание с ALK-1 с антителом, выбранным из группы, состоящей из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. В другом варианте осуществления анти-ALK-l антитело или его участок перекрестно конкурирует за связывание ALK-1 с антителом, выбранным из группы, состоящей из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A) ; 1.12.1(M29I) ; 1.12.1 (D19A) ; 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. В другом варианте осуществления анти-ALK-l антитело или его участок связывает тот же эпитопALK-1, что и антитело, выбранное из группы, состоящей из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. В другом варианте осуществления анти-ALK-1 антитело или его участок связывает ALK-1 с такой же, по существу, KD, что и антитело, выбранное из группы, состоящей из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. В другом варианте осуществления анти-ALK-l антитело или его участок связывает ALK-1 с такой же, по существу, koff, что и антитело, выбранное из группы, состоящей из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. Дополнительный аспект настоящего изобретения относится к антителу или его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, и содержащемуVH домен, который по меньшей мере на 90% идентичен по аминокислотной последовательности любой из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104. В одном варианте осуществления указанный VH домен является по меньшей мере на 91%, по меньшей мере на 93%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или на 100% идентичным по аминокислотной последовательности любой из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104. В дополнительном варианте осуществления антитело или его участок обладает по меньшей мере одним из функциональных свойств, описанных ранее, и содержит VH домен, который представляет собой любую из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104 или отличается от любой из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104 тем, что имеет по меньшей мере одну консервативную аминокислотную замену. Например, VH домен может отличаться 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативными аминокислотными заменами от любой SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104. В дополнительном варианте осуществления любая из этих консервативных аминокислотных замен может иметь место в CDR1, CDR2, и/или CDR3 участках. Дополнительный аспект настоящего изобретения относится к антителу или его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, и содержащемуVL домен, который является по меньшей мере на 90% идентичным по аминокислотной последовательности любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127. В одном варианте осуществления указанный VL домен по меньшей мере на 91%, по меньшей мере на 93%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или на 100% идентичен по аминокислотной последовательности любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127. В дополнительном варианте осуществления антитело или его участок обладает по меньшей мере одним из функциональных свойств, описанных ранее, и содержит VL домен, который представляет собой любую из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127, или отличается от любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127 тем, что имеет по меньшей мере одну консервативную аминокислотную замену. Например, VL домен может отличаться 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативными аминокислотными заменами от любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127. В дополнительном варианте осуществления любая из этих консервативных аминокислотных замен может иметь место в CDR1, CDR2, и/или CDR3 участках. Другой аспект настоящего изобретения относится к антителу или его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где каждый из VL и VH доменов по меньшей мере на 90% идентичен по аминокислотной последовательности VL и VH доменам,соответственно, любого из моноклональных антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. Например,каждый из VL и VH доменов по меньшей мере на 91%, 93%, 95%, 97%, 99% или 100% идентичен по аминокислотным последовательностям VL и VH доменам, соответственно, любого из моноклональных антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. Другой аспект настоящего изобретения относится к моноклональному антителу или его антигенсвязывающему участку, которые выбираны из группы, состоящей из а) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 6, и VL домен, как указано в SEQ ID NO: 8; b) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 10, и VL домен, как указано вSEQ ID NO: 12; с) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 14, иVL домен, как указано в SEQ ID NO: 16; d) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 18, и VL домен, как указано в SEQ ID NO: 20; е) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 22, и VL домен, как указано в SEQ ID NO: 24; f) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 26, и VL домен, как указано вSEQ ID NO: 28; g) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 30,и VL домен, как указано в SEQ ID NO: 32; h) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 34, и VL домен, как указано в SEQ ID NO: 36; i) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 38, и VL домен, как указано в SEQ ID NO:40; j) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 42, и VL домен, как указано вSEQ ID NO: 44; k) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 46,и VL домен, как указано в SEQ ID NO: 48; l) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 50, и VL домен, как указано в SEQ ID NO: 52; m) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 54, и VL домен, как указано в SEQ ID NO: 56; n) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 58, и VL домен, как указано в SEQ ID NO: 60; о) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 62,и VL домен, как указано в SEQ ID NO: 64; р) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 66, и VL домен, как указано в SEQ ID NO: 68; q) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 70, и VL домен, как указано в SEQ ID NO: 72; r) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 74, и VL домен, как указано вSEQ ID NO: 76; s) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 78, иVL домен, как указано в SEQ ID NO: 80; t) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 82, и VL домен, как указано в SEQ ID NO: 84; u) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 86, и VL домен, как указано в SEQ ID NO: 88; v) антителаSEQ ID NO: 92; w) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 104,и VL домен, как указано в SEQ ID NO: 127; х) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 6, и VL домен, как указано в SEQ ID NO: 127; и у) антитела или его участка, который содержит VH домен, как указано в SEQ ID NO: 104, и VL домен, как указано в SEQ ID NO: 8. В дополнительном варианте осуществления для любого из антител или их участков, как описано выше в группах от а) до v), VH и/или VL домены могут отличаться от определенных перечисленных SEQID NO по меньшей мере с одной консервативной аминокислотной заменой. Например, VH и/или VL домены могут отличаться от перечисленных SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативными аминокислотными заменами. В дополнительном варианте осуществления любая из данных консервативных аминокислотных замен может иметь место в CDR1, CDR2, и/или CDR3 участках. В другом варианте осуществления настоящее изобретение относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где VH домен независимо выбирают из любой SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104, или последовательности, которая отличается от любойSEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104 по меньшей мере одной консервативной аминокислотной заменой, и VL домен независимо выбирают из любой SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127,или последовательности, которая отличается от любой SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127 по меньшей мере одной консервативной аминокислотной заменой. Например, VH и VL домены могут каждый отличаться от SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104, а также 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127, соответственно, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативными аминокислотными заменами. В дополнительном варианте осуществления настоящее изобретение относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где указанное антитело или участок содержит CDR1, CDR2 и CDR3 последовательности VH, независимо выбранные из CDR1, CDR2 или CDR3 последовательностей тяжелой цепи,соответственно, обнаруженных в любой из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104, или последовательности, которая отличается от любой из SEQ IDNO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104 по меньшей мере одной консервативной аминокислотной заменой. Например, VH CDR1, CDR2 и CDR3 могут отличаться от CDR1, CDR2 и CDR3, соответственно, любой из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104 по 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативным аминокислотным заменам. В дополнительном варианте осуществления настоящее изобретение относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где указанное антитело или участок содержит CDR1, CDR2 и CDR3 последовательности VL, независимо выбранные из CDR1, CDR2 или CDR3 последовательностей легкой цепи,соответственно, обнаруженных в любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127, или последовательности, которая отличается от любой из SEQ IDNO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127 по меньшей мере одной консервативной аминокислотной заменой. Например, VL CDR1, CDR2 и CDR3 могут отличаться от CDR1, CDR2 и CDR3, соответственно, любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127 по 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативным аминокислотным заменам. Настоящее изобретение также относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где указанное антитело или антигенсвязывающий участок содержит VH и VL CDR1, VH и VL CDR2, а также VH и VLCDR3, как обнаружено в любом из моноклональных антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. Настоящее изобретение дополнительно относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где указанное антитело или антигенсвязывающий участок содержит тяжелую цепь, которая кодируется VH 431, VH 3-11, VH 3-15, VH 3-33, VH 4-61 или VH 4-59 геном человека. В некоторых вариантах осуществления тяжелая цепь кодируется VH 3-33 геном человека, D 6-19 геном человека и JH 3B геном человека; VH 4-31 геном человека, D 6-19 геном человека и JH 4 В геном человека; VH 4-61 геном человека, D 6-19 геном человека и JH 4B геном человека; VH 4-31 геном человека, D 3-3 геном человека и JH 3 В геном человека; VH 4-31 геном человека и JH 3 В геном человека; VH 4-59 геном человека, D 6-19 геном человека и JH 4B геном человека; VH 3-11 геном человека, D 3-22 геном человека и JH 6B геном человека; VH 3-15 ге-6 018453 ном человека, D 3-22 геном человека и JH 4B геном человека; VH 4-31 геном человека, D 5-12 геном человека и JH 6B геном человека; VH 4-31 геном человека, D 4-23 геном человека и JH 4B геном человека; VH 4-31 геном человека, D 2-2 геном человека и JH 5B геном человека; VH 4-31 геном человека и JH 6B геном человека; VH 3-15 геном человека, D 1-1 геном человека и JH 4B геном человека; VH 3-11 геном человека,D 6-19 геном человека и JH 6B геном человека; VH 3-11 геном человека, D 3-10 геном человека и JH 6B геном человека или VH 3-11 геном человека, D 6-6 геном человека и JH 6B геном человека. Настоящее изобретение дополнительно относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где указанное антитело или антигенсвязывающий участок содержит легкую цепь, которая кодируется VK А 27, VK А 2, VK A1, VK A3, VK B3, VK B2, VK L1 или VK L2 геном человека. В некоторых вариантах осуществления легкая цепь кодируется VK L1 геном человека и JK 4 геном человека; VK A27 геном человека и JK 5 геном человека или JK 4 геном человека; VK B3 геном человека и JK 1 геном человека; VK L2 геном человека и JK 3 геном человека; VK A2 геном человека и JK 1 геном человека; VK A3 геном человека и JK 4 геном человека; VK A1 геном человека и JK 1 геном человека; VK B2 геном человека и JK 4 геном человека или VK A2 геном человека и JK 1 геном человека. Настоящее изобретение дополнительно относится к моноклональному антителу или к его антигенсвязывающему участку по меньшей мере с одним из функциональных свойств, описанных ранее, где указанное антитело или антигенсвязывающий участок содержит одну или больше FR1, FR2, FR3 или FR4 аминокислотных последовательностей тяжелой цепи и/или легкой цепи, как обнаружено в любом из моноклональных антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1. 12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. Настоящее изобретение также относится к моноклональному антителу, содержащему аминокислотные последовательности, приведенные в a) SEQ ID NO: 2 и SEQ ID NO: 4; b) SEQ ID NO: 2 и SEQ ID NO: 102; c) SEQ ID NO: 100 и SEQ ID NO: 4; а также d) SEQ ID NO: 100 и SEQ ID NO: 102. Дополнительный вариант осуществления настоящего изобретения относится к любому из антител,описанных ранее, которое представляет собой молекулу IgG, IgM, IgE, IgA или IgD или является его производным. Например, антитело может представлять собой IgG1 или IgG2. Другой вариант осуществления относится к любому из антител или антигенсвязывающих участков,описанных выше, которое представляет собой Fab фрагмент, F(ab')2 фрагмент, FV фрагмент, одноцепочечный FV фрагмент, одноцепочечный VH фрагмент, одноцепочечный VL фрагмент, гуманизированное антитело, химерное антитело или биспецифическое антитело. Дополнительный вариант осуществления относится к производному антителу или антигенсвязывающему участку, содержащему любое из антител или их участков, как описано ранее, и по меньшей мере один дополнительный молекулярный фрагмент. Например, по меньшей мере один дополнительный молекулярный фрагмент может представлять собой другое антитело (например, биспецифическое антитело или димер), средство детекции, метку, цитотоксическое средство, фармацевтическое средство и/или белок или пептид, который может опосредовать связывание антитела или фрагмента антитела с другой молекулой (такой как активная зона стрептавидина или полигистидиновый маркер). Например, средства детекции, которые можно использовать и с которыми можно получать производное антитело или антигенсвязывающий участок по изобретению, включают флуоресцентные соединения, в томчисле флуоресцеин, флуоресцеинизотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин,лантанидные люминофоры и тому подобное. Антитело также можно метить ферментами, которые применяют для детекции, такими как пероксидаза хрена, -галактозидаза, люцифераза, щелочная фосфатаза,глюкозоксидаза и т.п. В дополнительном варианте осуществления антитела или их участки по настоящему изобретению можно также метить биотином или заранее определенным полипептидным эпитопом,узнаваемым вторичным репортером (например, парами последовательностей с лейциновыми застежками, участками связывания для вторичных антител, металлсвязывающими доменами, эпитопными маркерами). В еще дополнительном варианте осуществления настоящего изобретения из любых антител или их участков можно также получать производные при помощи химической группы, такой как полиэтиленгликоль (PEG), метиловая или этиловая группа или углеводная группа. В некоторых вариантах осуществления анти-ALK-1 антитела или антигенсвязывающие участки,описанные в настоящем описании, связаны с твердой подложкой. В некоторых вариантах осуществления С-концевой лизин тяжелой цепи любого из анти-ALK-1 антител по изобретению является отщепленным. В различных вариантах осуществления изобретения тяжелая и легкая цепи анти-ALK-1 антител могут необязательно содержать сигнальную последовательность. Настоящее изобретение также относится к фармацевтической композиции, содержащей любое из антител или их антигенсвязывающих участков, как описано выше, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует любое из антител или их антигенсвязывающих участков, как описано в настоящем описании. В одном из конкретных вариантов осу-7 018453 ществления выделенная молекула нуклеиновой кислоты имеет нуклеотидную последовательность, SEQID NO: 1, где последовательность кодирует тяжелую цепь. В другом конкретном варианте осуществления выделенная молекула нуклеиновой кислоты имеет нуклеотидную последовательность SEQ ID NO: 3,где последовательность кодирует легкую цепь. В другом конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит полинуклеотид, содержащий открытую рамку считывания последовательности кДНК клона, депонированного под инвентарным номером АТСС РТА-6864. В другом конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит полинуклеотид, содержащий открытую рамку считывания последовательности кДНК клона, депонированного под инвентарным номером АТСС РТА-68 65. В другом конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO: 95 или 128, где каждая из последовательностей кодирует тяжелую цепь. В другом конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO: 101, где последовательность кодирует легкую цепь. Изобретение дополнительно относится к вектору, содержащему любую из молекул нуклеиновой кислоты, описанных в настоящем описании, где вектор необязательно содержит контролирующую экспрессию последовательность, функционально связанную с молекулой нуклеиновой кислоты. Другой вариант осуществления относится к клетке-хозяину, содержащей любой из векторов, описанных в настоящем описании, или содержащей любую из молекул нуклеиновой кислоты, описанных в настоящем описании. Настоящее изобретение также относится к выделенной клеточной линии, которая продуцирует любое из антител или антигенсвязывающих участков, как описано в настоящем описании,или которая продуцирует тяжелую или легкую цепь любого из указанных антител или указанных антигенсвязывающих участков. В другом варианте осуществления настоящее изобретение относится к способу получения антиALK-1 антитела или его антигенсвязывающего участка, включающему культивирование любой из клеток-хозяев или клеточных линий, описанных в настоящем описании, в соответствующих условиях и извлечение указанного антитела или антигенсвязывающего участка. Настоящее изобретение также относится к трансгенному животному, не являющемуся человеком,или трансгенному растению, содержащему любую из нуклеиновых кислот, описанных в настоящем описании, где трансгенное животное, не являющееся человеком, или трансгенное растение экспрессирует указанную нуклеиновую кислоту. Настоящее изобретение также относится к способу выделения антитела или его антигенсвязывающего участка, которые связывают ALK-1, включающему этап выделения антитела из трансгенного животного, не являющемуся человеком, или трансгенного растения, как описано в настоящем описании. В другом варианте осуществления изобретение относится к гибридоме, депонированной под инвентарным номером АТСС РТА-6808. Настоящее изобретение также относится к способу определения того, ингибирует ли вещество повышенную регуляцию специфического гена-мишени ALK-1 "следующего этапа сигнального пути", Id1,где способ включает приведение первого образца клеток, которые экспрессируют Id1, в контакт с веществом и определение того, ингибируется ли экспрессия Id1, где пониженный уровень экспрессии Id1 в первом образце клеток, приведенных в контакт с веществом, по сравнению с контрольным образцом клеток, свидетельствует о том, что указанное вещество ингибирует экспрессию Id1. Настоящее изобретение также относится к способу, где вещество представляет собой антитело, которое связывает внеклеточный домен ALK-1. Настоящее изобретение также относится к способу лечения патологического клеточного роста у млекопитающего, включающему этап введения указанному млекопитающему любого из антител или их антигенсвязывающих участков или любой из фармацевтических композиций, как описано в настоящем описании. Настоящее изобретение также относится к способу лечения патологического клеточного роста у млекопитающего, с помощью антитела или его антигенсвязывающего участка, которые связываютALK-1, включающему этапы введения указанному млекопитающему эффективного количества любой из молекул нуклеиновой кислоты, описанных в настоящем описании, в соответствующих условиях, которые допускают экспрессию указанных молекул нуклеиновой кислоты. В другом варианте осуществления способ лечения патологического клеточного роста также включает введение количества одного или больше веществ, выбранных из противоопухолевых средств, антиангиогенных средств, ингибиторов передачи сигнала и антипролиферативных средств, количества которых совместно являются эффективными в лечении указанного патологического клеточного роста. В конкретных вариантах осуществления указанный патологический клеточный рост является раком. Настоящее изобретение также относится к выделенному белку ALK-1 яванского макака, имеющему аминокислотную последовательность SEQ ID NO: 93. Настоящее изобретение также относится к выделенной молекуле нуклеиновой кислоты, кодирующей белок, обладающий аминокислотной последовательностью SEQ ID NO: 93. Настоящее изобретение также относится к выделенной молекуле нуклеино-8 018453 вой кислоты SEQ ID NO: 94. Краткое описание фигур На фиг. 1 представлен пример данных эпитопного связывания. Антитело 1.12.1(M29I/D19A) вводили в течение 10 мин, а затем в течение еще 10 мин вводили антитело 1.12.1(M29I/D19A). Это определяет максимальный ответ 20-минутного введения данного антитела. Максимальный ответ 20-минутного введения аналогичным образом определяли для антитела 1.27.1. Антитело 1.12.1(M29I/D19A) вводили в течение 10 мин, а затем в течение 10 мин вводили антитело 1.27.1. Если общий ответ снижается между определенными максимальными ответами, значит два антитела должны связывать один и тот же эпитоп. Если общий ответ превышает наибольший максимальный ответ, значит, антитела должны связывать различные эпитопы. Эксперимент повторяли, меняя порядок введения на обратный, как описано в примере 9. На фиг. 2 представлен сравнительный анализ последовательностей белков ALK-1 человека и Cyno. На фиг. 3 представлено определение KD связывания рекомбинантного антитела 1.12.1 с ALK-1 клеточной поверхности, (а) человек, (b) Cyno. 1.12.1(rWT) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ. 1.12.1(M29I/D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее две специфические аминокислотные мутации (метионин в положении 29 в тяжелой цепи заменен на изолейцин и аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин). 1.12.1(M29I) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где метионин в положении 29 в тяжелой цепи заменен на изолейцин. 1.12.1(D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин. На фиг. 4 представлены примеры титрований ID1 с использованием Taqman анализа ID1 для вариантов антитела 1.12.1. 1.12.1 обозначает вариант мАТ 1.12.1, выделенный из гибридомы. 1.12.1(rWT) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ. 1.12.1(M29I/D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее две специфические аминокислотные мутации (метионин в положении 29 в тяжелой цепи заменен на изолейцин и аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин). 1.12.1(М 29I) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где метионин в положении 29 в тяжелой цепи заменен на изолейцин. 1.12.1 (D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин. На фиг. 5 представлены примеры титрований ID1 с использованием Taqman анализа ID1 для вариантов последовательности антитела 1.12.1 и производного Fab. 1.12.1 обозначает вариант мАТ 1.12.1, выделенный из гибридомы. 1.12.1(rWT) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ. 1.12.1(M29I) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где метионин в положении 29 в тяжелой цепи заменен на изолейцин. 1.12.1(D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин. 1.12.1(M29I/D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее две специфические аминокислотные мутации (метионин в положении 29 в тяжелой цепи заменен на изолейцин и аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин).Fab 1.12.1(M29I/D19A) обозначает Fab-фрагмент мАТ 1.12.1(M29I/D19A), полученный расщеплением 1.12.1(М 29I/D19 А) IgG1 с помощью папаина. На фиг. 6 представлена интернализация ALK-1, (а) контрольное нейтрализующее антитело, остающееся на поверхности клетки, (b) контрольный остающийся поверхностный рецептор ALK-1. На фиг. 7 А представлен сравнительный анализ последовательностей вариабельного домена антиALK-1 антител по изобретению с гаметическими последовательностями. Мутации относительно гаметической последовательности показаны жирным шрифтом. CDR последовательности подчеркнуты. На фиг. 7 В представлен сравнительный анализ предсказанных аминокислотных последовательностей вариабельных доменов легкой цепи для анти-ALK-1 антител 1.12.1, 1.14.1, 1.162.1, 1.31.1, 4.62.1 и 4.72.1 с гаметической последовательностью А 27 VK человека. На фиг. 7 С и 7D представлен сравнительный анализ предсказанных аминокислотных последовательностей вариабельных доменов тяжелой и легкой цепи анти-ALK-1 антител 1.12.1, 1.151.1, 1.162.1, 1.8.1, 4.24.1, 4.38.1, 4.58.1, 4.62.1, 4.68.1, 4.72.1, 5.13.1 и 5.34.1 с гаметической последовательностью 4-31 VH человека. На фиг. 8 представлен образец гистологического анализа (окрашивание НЕ) среза привитой кожи человека после хирургической операции. На фиг. 9(А) представлено трехкрасочное окрашивание коллагена в мыши-химере с привитой кожей человека. На фиг. 9(В) представлено выявление человеческих сосудов в коллагеновом геле, имплантированном в мышь-химеру с привитой кожей крайней плоти человека. Тех-красный: сосуды человека.FITC: сосуды мыши. Желтый: совместное окрашивание. На фиг. 10 представлено иммунофлуоресцентное изображение человеческих (красный) и мышиных(зеленый) сосудов опухоли M2 4met в мыши-химере SCID с привитой кожей крайней плоти человека. На фиг. 11 представлено ИГХ изображение человеческих сосудов (коричневый) опухоли M24met в мыши-химере SCID с привитой кожей крайней плоти человека. На фиг. 12 представлены характерные иммунофлуоресцентные изображения человеческих (красный) и мышиных (зеленый) сосудов контрольной и обработанной антителом 1.12.1(M29I/D19A) (10 мг/кг) опухолей M24met в мыши-химере SCID с привитой кожей крайней плоти человека. На фиг. 13 представлено дозозависимое ингибирование роста сосудов человеческой опухоли антителом 1.12.1(M29I/D19A) на модели мыши-химеры SCID с привитой кожей крайней плоти человека. На фиг. 14 представлена концентрация антитела 1.12.1(M29I/D19A) в плазме мыши SCID. На фиг. 15 представлена расчетная ЕС 50 для антитела 1.12.1(M29I/D19A) на модели SCID-химеры с привитой кожей крайней плоти человека и опухолью M24met. Для построения графика контрольному значению 100% была искусственно задана сывороточная концентрация, равная 0,1 нМ. Это не изменяло кажущуюся ЕС 50. Подробное описание изобретения Определения и основные методы. Если не указано иного, значения научных и технических терминов, применяемых в настоящем описании, такие, какие обычно понимают специалисты в данной области. Кроме того, если по контексту не требуется иного, термины в единственном числе будут включать множественное число, а термины во множественном числе будут включать единственное число. В основном, номенклатура, используемая применительно к, и методы, относящиеся к культуре клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетике, а также химии белков и нуклеиновых кислот и гибридизации, описанные в настоящем описании, являются хорошо известными и используются в данных областях. Способы и методы по настоящему изобретению, по существу, осуществляют в соответствии с общепринятыми способами, хорошо известными в данной области, и как описано в различных литературных источниках общего и более специального назначения, которые цитируют и обсуждают в настоящем описании, если не указано иное. См., например, Sambrook J.Russell D. Molecular Cloning: A LaboratoryProtocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology,Wiley, JohnSons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science,Wiley, JohnSons, Inc. (2003), приведенные в настоящем описании в качестве ссылок. Ферментативные реакции и методы очистки применяют в соответствии с инструкциями производителей, как обычно принято в данной области или как описано в настоящем описании. Номенклатура, используемая применительно к, а также лабораторные способы и методы, относящиеся к аналитической химии, химии органического синтеза, а также медицинской и фармацевтической химии, описанные в настоящем описании,являются хорошо известными и используются в данных областях. Следующие термины, если не указано иначе, нужно понимать в следующих значениях. Как используют в настоящем описании, термин "ALK-1" обозначает киназу-1, подобную рецептору активина млекопитающих. Подразумевают, что термин ALK-1 относится также к рекомбинантной ALK1 и рекомбинантным химерным формам ALK-1, которые можно получать стандартными способами рекомбинантной экспрессии. Как используют в настоящем описании, аббревиатура "мАТ" обозначает моноклональное антитело. Как используют в настоящем описании, антитело, обозначенное номером, представляет собой моноклональное антитело (мАТ), которое получили из гибридомы под тем же номером. Например, моноклональное антитело 1.12.1 получали из гибридомы 1.12.1. 1.12.1 обозначает вариант мАТ 1.12.1, который продуцирует гибридома. 1.12.1(rWT) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ. 1.12.1(M29I/D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее две специфические аминокислотные мутации (метионин в положении 29 в тяжелой цепи заменен на изолейцин и аспарагиновая кислота в положении 19 в легкой цепи заменена на аланин). 1.12.1(М 291) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где метионин в положении 29 в тяжелой цепи заменен на изолейцин. 1.12.I(D19A) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, содержащее специфическую единичную аминокислотную мутацию, где аспарагиновая кислота в положении 19 в лег- 10018453 кой цепи заменена на аланин. Как используют в настоящем описании, "патологический клеточный рост", если не указано иное,обозначает клеточный рост, который не зависит от нормальных регуляторных механизмов (например,утрачено контактное ингибирование). Как используют в настоящем описании, термином "соседний" обозначают нуклеотидные последовательности, которые непосредственно примыкают одна к другой, без вставок посторонних нуклеотидов. В качестве примера пентануклеотид 5'-ААААА-3' является соседним для тринуклеотида 5'-ТТТ-3', если они связаны следующим образом: 5'-АААААТТТ-3' или 5'-ТТТААААА-3', но не в том случае, если они связаны следующим образом: 5'-АААААСТТТ-3'. Термин "средство" употребляют в данном случае для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, полученного из биологических материалов. Как используют в настоящем описании, под "облегчением течения" болезни, нарушения или состояния понимают снижение тяжести симптомов болезни, нарушения или состояния. Под этим термином понимают, но этим не ограничиваясь, влияние на размер, рост и/или массу опухоли, распространенность или прогрессирование метастазов и т.п. у пациента по сравнению с теми же самыми показателями у пациента до применения или в отсутствие применения способа лечения. Как используют в настоящем описании, аббревиатура "Id1" обозначает специфический ген-мишеньALK-1 "следующего этапа сигнального пути", ген Id1, который является важным для ангиогенеза. Сообщали, что ген Id1 контролирует каскад реакций ангиогенеза при определенных формах рака, выключая продукцию белка тромбоспондина-1 (TSP-1), природного супрессора ангиогенеза. Например, сообщали,что ген Id1, уровень экспрессии которого высок при меланоме, раке груди, головы и шеи, мозга, шейки матки, простаты, поджелудочной железы и яичек, приводит к снижению экспрессии TSP-1 и увеличению образования кровеносных сосудов опухоли. Volpert, Olga V. et al., "Id1 regulates angiogenesis through transcriptional repression of thrombospondin-1", Cancer Cell, Dec. 2002, Vol. 2, pp. 473-483. Как используют в настоящем описании, термин "Smad" обозначает белки с доменом Smad, обнаруженные у целого ряда видов от нематод до человека. Эти высококонсервативные белки содержат Nконцевой домен МН 1, который контактирует с ДНК и отделен коротким линкерным участком от Сконцевого домена МН 2, последний обладает поразительным сходством с forkhead-ассоциированными(FHA) доменами. FHA и Smad (MH2) домены обладают общей структурой, состоящей из сэндвича из одиннадцати -цепей в двух плоскостях с топологией греческого ключа. Белки Smad опосредуют передачу сигнала при помощи цитокинов TGF-/активин/ВМР-2/4 от рецептора Ser/Thr протеинкиназ на клеточной поверхности к ядру. Smad белки делят на три функциональных класса: регулируемые рецепторомSmad (R-Smad), включая Smad1, -2, -3, -5 и -8, каждый из которых вовлечен в лиганд-специфический сигнальный каскад реакций; сомедиаторные Smad (co-Smad), включая Smad4, которые взаимодействуют с R-Smads для передачи сигнала, и ингибиторные Smad (I-Smad), включая Smad-6 и -7, которые блокируют активацию R-Smad и Со-Smad, тем самым, отрицательно регулируя сигнальные каскады реакций. Как используют в настоящем описании, термин "TGF-" обозначает трансформирующие факторы роста бета, которые составляют семейство многофункциональных цитокинов (TGF- 1-5), которые регулируют клеточный рост и дифференциацию. Трансформирующий фактор роста (TGF) является одним из многих охарактеризованных природных факторов роста. Он может играть важные роли в организме мышей "SCID" с тяжелым комбинированным иммунодефицитом. Многие клетки синтезируют TGF-, и практически все обладают специфическими рецепторами для данного пептида. TGF- регулирует действие многих других пептидных факторов роста и определяет положительное или отрицательное направление их эффектов. TGF- представляет собой подавляющий опухоли цитокин с ингибирующим рост действием на эпителиальные клетки. TGF- может также действовать как стимулятор опухолей, вызывая эпителиально-мезенхимальный переход. TGF- инактивирует некоторые белки, вовлеченные в прогрессию клеточного цикла и тем самым оказывает свое ингибирующее рост влияние на эпителиальные клетки, вызывая остановку их развития на фазе G1 клеточного цикла. Белок функционирует как дисульфидно-связанный гомодимер. Его последовательность характеризуется наличием нескольких С-концевых остатков цистеина, которые образуют взаимно соединяющие дисульфидные связи, топологически расположенные в виде узла. Аналогичное расположение в виде "цистеинового узла" отмечено в структурах некоторых ферментных ингибиторов и нейротоксинов, которые связываются с потенциалозависимыми Са 2+ каналами, хотя точная топология отличается. Гены TGF- экспрессируются дифференциально, что свидетельствует о том, что различные виды TGF- могут обладать различными физиологическими функциями in vivo. Как используют в настоящем описании, термин "TGF1" обозначает рецептор типа 1 трансформирующего фактора роста, который представляет собой пептид размером 112 аминокислотных остатков,полученный в результате протеолитического расщепления с С-конца белка-предшественника. Исследование уровней мРНК TGF1 в тканях взрослых мышей свидетельствует о том, что экспрессия имеет место преимущественно в селезенке, легких и плаценте. Считают, что TGF1 играет важную роль в патологических процессах. Как используют в настоящем описании, термин "SCID" обозначает мышей с тяжелым комбинированным иммунодефицитом. Как используют в настоящем описании, термин "HUVEC" обозначает эндотелиальные клетки пупочной вены человека. Как используют в настоящем описании, "аминокислоты" представлены их полными названиями,соответствующими им трехбуквенными кодами, или соответствующими им однобуквенными кодами,как указано в следующей таблице. Как используют в настоящем описании, двадцать обычных аминокислот и их аббревиатуры применяют общепринятым образом. См. Immunology-A Synthesis (2nd Edition, E.S. Golub and D.R. Gren, Eds.,Sinauer Associates, Sunderland, Mass. (1991, которая приведена в настоящем описании в качестве ссылки."Консервативная аминокислотная замена" представляет собой замену, при которой остаток аминокислоты заменен на другой остаток аминокислоты, обладающий R-группой боковой цепи с такими же химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная аминокислотная замена существенно не изменяет функциональные свойства белка. В тех случаях, когда две или больше аминокислотных последовательностей отличаются друг от друга консервативными заменами,процент идентичности последовательностей или степень сходства можно также корректировать, чтобы сделать поправку на консервативную природу замены. Способы проведения такой коррекции хорошо известны специалистам в данной области. См., например, Pearson, Methods Mol. Biol. 243:307-31 (1994). Примеры групп аминокислот, которые обладают боковыми цепями со сходными химическими свойствами, включают аминокислоты 1) с алифатическими боковыми цепями: глицин, аланин, валин,лейцин и изолейцин; 2) с алифатическими-гидроксильными боковыми цепями: серин и треонин; 3) с амидсодержащими боковыми цепями: аспарагин и глютамин; 4) с ароматическими боковыми цепями: фенилаланин, тирозин и триптофан; 5) с основными боковыми цепями: лизин, аргинин и гистидин; 6) с кислыми боковыми цепями: аспарагиновая кислота и глютаминовая кислота и 7) с серосодержащими боковыми цепями: цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глютамат-аспартат и аспарагин-глютамин. Альтернативно, консервативная замена представляет собой любое изменение, имеющее положительное значение в матрице логарифмического правдоподобия РАМ 250, описанной в Gonnet et al., Science 256:1443-45 (1992), приведенной в описании в качестве ссылки. "Умеренно консервативное" заме- 12018453 щение представляет собой любое изменение, имеющее неотрицательное значение в матрице логарифмического правдоподобия РАМ 250. В определенных вариантах осуществления аминокислотными заменами для анти-ALK-1 антитела или его антигенсвязывающего участка являются замены, которые (1) уменьшают чувствительность к протеолизу, (2) уменьшают подверженность окислению, (3) изменяют аффинность связывания для образования белковых комплексов и (4) придают или изменяют другие физико-химические или функциональные свойства подобных аналогов, однако, все еще сохраняют специфическое связывание с ALK-1. Аналоги могут содержать различные замены в обычной пептидной последовательности. Например, единичные или множественные аминокислотные замены, предпочтительно консервативные аминокислотные замены, можно проводить в обычной последовательности, например во фрагменте полипептида за пределами домена(ов), образующих межмолекулярные контакты. Можно также проводить аминокислотные замены в домене(нах), образующих межмолекулярные контакты, которые могут повышать активность полипептида. Консервативная аминокислотная замена не должна существенно изменять структурные характеристики исходной последовательности; например аминокислотная замена не должна изменять антипараллельный -слой, который образует иммуноглобулинсвязывающий домен, существующий в исходной последовательности, или разрушать другие типы вторичной структуры, характерные для исходной последовательности. В основном, глицин и пролин не следует использовать в антипараллельном-слое. Примеры известных в данной области вторичных и третичных структур полипептидов описаны вIntroduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N. Y. (1991; и Thornton et al., Nature 354:105 (1991), приведенных в настоящем описании в качестве ссылок. Сходство последовательностей полипептидов, которое также называют идентичностью последовательностей, обычно определяют, используя компьютерные программы для анализа структур. Программа для анализа белков сопоставляет сходные последовательности, используя критерии сходства, присвоенные различным заменам, делециям и другим модификациям, включая консервативные аминокислотные замены. Например, GCG содержит программы, такие как "Gap" и "Bestfit", которые можно применять с параметрами, используемыми по умолчанию, для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды разных видов организмов или между белком дикого типа и его мутантной формой. См., например, GCG версия 6.1. Полипептидные последовательности можно также сравнивать, используя FASTA с применением параметров по умолчанию или рекомендованных параметров, программа вGCG версии 6.1. FASTA (например, FASTA2 и FASTA3) выполняет сравнительный анализ и определяет процент идентичности последовательностей в участках, наилучшим образом перекрывающихся в запрошенной и изучаемой последовательностях (Pearson, Methods Enzymol. 183: 63-98 (1990); Pearson, MethodsMol. Biol. 132: 185-219 (2000. Другим предпочтительным алгоритмом при сравнении последовательности по изобретению с базой данных, содержащей большое количество последовательностей из различных организмов, является компьютерная программа BLAST, особенно blastp или tblastn с применением параметров по умолчанию. См., например, Altschul et al., J. Mol. Biol. 215: 403-410 (1990); Altschul et al.,Nucleic Acids Res. 25: 3389-402 (1997); которые приведены в настоящем описании в качестве ссылок. Длина полипептидных последовательностей, сравниваемых в отношении гомологии, обычно должна составлять по меньшей мере примерно 16 аминокислотных остатков, обычно по меньшей мере примерно 20 остатков, чаще всего по меньшей мере примерно 24 остатка, обычно по меньшей мере примерно 28 остатков и предпочтительно больше чем примерно 35 остатков. При поиске в базе данных, содержащей последовательности из большого числа различных организмов, предпочтительно сравнивать аминокислотные последовательности. Термин "аналог", как используют в настоящем описании, обозначает полипептиды, которые состоят из сегмента длиной по меньшей мере 25 аминокислот, который обладает существенной идентичностью с участком установленной природной аминокислотной последовательности, и который обладает по меньшей мере одним из свойств природного полипептида. Обычно полипептидные аналоги содержат консервативную аминокислотную замену (или вставку или делению) относительно природной последовательности. Аналоги обычно обладают длиной по меньшей мере 20 аминокислот, предпочтительно по меньшей мере 50 аминокислот или больше, и часто могут быть такими же длинными как полноразмерный природный полипептид. Пептидные аналоги обычно применяют в фармацевтической промышленности в качестве непептидных лекарственных средств со свойствами, аналогичными таковым у матричного пептида. Данные виды непептидных соединений называют "пептидные миметики" или "пептидомиметики" . Fauchere,J. Adv. Drug Res. 15: 29 (1986); Veber and Freidinger TINS p. 392 (1985); и Evans et al. J. Med. Chem. 30: 1229 (1987), которые приведены в настоящем описании в качестве ссылок. Подобные соединения часто разрабатывают при помощи компьютеризированного молекулярного моделирования. Пептидные миметики, которые сходны по структуре с терапевтически применяемыми пептидами,можно использовать для получения эквивалентного терапевтического или профилактического эффекта. Обычно пептидомиметики являются сходными по структуре с эталонным полипептидом (т.е. полипеп- 13018453 тидом, который обладает биохимическим свойством или фармакологической активностью), таким как антитело человека, но у которого одна или больше пептидных связей необязательно заменяют на связи,выбранные из группы, состоящей из -CH2NH-, -CH2S-, -СН 2-СН 2-, -СН=СН- (цис и транс), -СОСН 2-,-СН(ОН)СН 2- и CH2SO-, способами, хорошо известными в данной области. Систематическую замену одной или большего количества аминокислот консенсусной последовательности D-аминокислотами того же типа (например, D-лизин вместо L-лизина) можно использовать для получения более стабильных пептидов. Кроме того, пептиды неприродной формы, обладающие консенсусной последовательностью или вариантом последовательности, в значительной степени идентичным консенсусной, можно получать способами, известными в данной области (Rizo and Gierasch Алл. Rev. Biochem. 61: 387 (1992), приведенная в настоящем описании в качестве ссылки в полном объеме); например добавлением внутренних цистеиновых остатков, способных образовывать внутримолекулярные дисульфидные мосты, которые циклизуют пептид. Интактное "антитело" или "иммуноглобулин" (Ig) содержит по меньшей мере две тяжелые (Н) цепи(примерно 50-70 кДа) и две легкие (L) цепи (примерно 25 кДа), связанные между собой дисульфидными связями. Существует только два типа легких цепейи . У людей они схожи, но только один тип присутствует в каждом антителе. Тяжелые цепи подразделяют на , , ,или , и они определяют изотип антитела как IgM, IgD, IgG, IgA и IgE соответственно. См. в основном, Fundamental Immunology Ch. 7(Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989 (для всех целей приведенную в настоящем описании в качестве ссылки в полном объеме). В предпочтительном варианте осуществления антитело является IgG и представляет собой подтип IgG1, IgG2, IgG3 или IgG4. В более предпочтительном варианте осуществления анти-ALK-1 антитело представляет собой подкласс IgG2. Каждая тяжелая цепь состоит из вариабельного домена тяжелой цепи (VH) и константного участка тяжелой цепи (CH). Константный участок тяжелой цепи состоит из трех доменов, СН 1, СН 2 и СН 3. Каждая легкая цепь состоит из вариабельного домена легкой цепи (VL) и константного участка легкой цепи. Константный участок легкой цепи состоит из одного домена, CL. В составе легкой и тяжелой цепей вариабельные и константные участки соединены при помощи J-участка длиной примерно 12 или больше аминокислот, при этом тяжелая цепь также содержит D-участок длиной примерно 3 или больше аминокислот. Участки VH и VL можно также подразделять на участки гипервариабельности, называемые "определяющими комплементарность участками" (CDR), перемежающиеся с участками, которые являются более консервативными, называемыми "каркасными участками" (FR). Каждый VH И VL составлен из трехCDR и четырех FR, организованных от аминоконца к карбоксильному концу в следующем порядке: FR1,CDR1, FR2, CDR2, FR3, CDR3, FR4. Соотношение аминокислот с каждым доменом находится в соответствии с определениями Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health,Bethesda, MD (1987 and 1991, или ChothiaLesk, J. Mol. Biol. 196: 901-917 (1987); Chothia et al., Nature 342: 878-883 (1989). Вариабельные домены каждой пары тяжелая/легкая цепь (VH и VL) образует центр связывания антитела, который взаимодействует с антигеном. Таким образом, интактное антитело IgG, например, обладает двумя центрами связывания. За исключением бифункциональных или биспецифических антител два центра связывания являются одинаковыми. Константные участки антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы(например, эффекторные клетки) и первый компонент (CIq) классической системы комплемента. Антитела должны обладать достаточным разнообразием антигенсвязывания для распознавания любого возможного патогена (много V участков), при этом поддерживая биологическую эффективность их С участков (мало С участков). Гены Ig случайным образом сплайсированы вместе из генных сегментов,что позволяет сочетать множество V участков с небольшим количеством С участков. Генные сегменты,кодирующие Ig H,ицепи, обнаружены в трех различных хромосомах. В процессе развития В-клетки ферменты рекомбиназы удаляют интроны и некоторые экзоны из ДНК и сплайсируют сегменты в функциональные гены Ig. Генные сегменты Ig млекопитающих составляют группы "вариабельных" (V), "разнообразия" (D),"связывающих" (J) и "константных" (С) экзонов. Каждый из V сегментов кодирует первые два CDR и три FR V участка -цепи, плюс несколько остатков CDR3. Каждый из J сегментов кодирует оставшиесяCDR3 и четвертый FR. С кодирует полный С участок легкой цепи . ДНК, кодирующая -цепь человека, содержит приблизительно 40 функциональных V сегментов, пять J сегментов и один С генный сегмент, а также некоторые генные сегменты, которые содержат стоп-кодоны ("псевдогены"). ДНКцепи человека содержит приблизительно 30 функциональных V сегментов и четыре функциональных набора из J и С сегментов. Конкретная J всегда образует пару с соответствующей ей С в отличие отJ, все из которых образуют пару с теми же самыми С. ДНК Н-цепи человека содержит приблизительно 50 функциональных VH сегментов, 30 DH сегментов и шесть JH сегментов. Первые два CDR и три FR вариабельного домена тяжелой цепи кодирует VH. CDR3 кодируют несколько нуклеотидов VH, все из DH, и частично JH, тогда как FR4 кодируют остатки генного сегмента JH. Существуют также отдельные генные сегменты в ДНК для каждого домена тяжелой цепи и мембранного участка каждого изотипа, организо- 14018453 ванные в том порядке, в котором их экспрессируют В-клетки. Термин "полипептид" охватывает природные или искусственно полученные белки, белковые фрагменты и полипептидные аналоги белковой последовательности. Полипептид может являться мономерным или полимерным. Термин "выделенный белок", "выделенный полипептид" или "выделенное антитело" обозначает белок, полипептид или антитело, которые в силу их происхождения или источника получения (1) не являются связанными с природными компонентами, которые сопутствуют им в их естественном состоянии,(2) являются свободными от других белков из тех же самых видов, (3) экспрессированы клеткой из других видов или (4) не являются природными. Таким образом, полипептид, который является химически синтезированным или синтезированным в клеточной системе, отличной от клетки, из которой он происходит естественным образом, будет являться "выделенным" из компонентов, связанных с ним естественным образом. Белок можно также переводить в состояние, в основном свободное от природных компонентов, посредством выделения, применяя методы очистки белков, хорошо известные в данной области. Примеры выделенных антител включают, но ими не ограничиваются, следующие антитела: антиALK-1 антитело, которое аффинно очищали, используя ALK-1, и анти-ALK-1 антитело, которое синтезировали при помощи клеточной линии in vitro. Белок или полипептид является "по существу, чистым", "по существу, гомогенным" или "по существу, очищенным", если по меньшей мере примерно от 60 до 75% образца представляет собой один вид полипептида. Полипептид или белок может являться мономерным или многомерным. По существу, чистый полипептид или белок может обычно составлять примерно 50, 60, 70, 80 или 90% в/в белкового образца, чаще всего примерно 95% и предпочтительно может являться больше чем 99% чистоты. Чистоту или гомогенность белка можно определять с помощью целого ряда способов, хорошо известных в данной области, таких как электрофорез белкового образца в полиакриламидном геле, с последующей визуализацией единственной полипептидной полосы при окрашивании геля красителем, хорошо известным в данной области. Для определенных целей можно обеспечивать более высокое разрешение, используя ВЭЖХ или другие способы, хорошо известные в области очистки. Термин "полипептидный фрагмент", как используют в настоящем описании, обозначает полипептид, который обладает аминоконцевой и/или карбоксиконцевой делецией, но где оставшаяся аминокислотная последовательность является идентичной соответствующим положениям в природной последовательности. В некоторых вариантах осуществления длина фрагментов составляет по меньшей мере 5, 6, 8 или 10 аминокислот, В других вариантах осуществления длина фрагментов составляет по меньшей мере 14, по меньшей мере 20, по меньшей мере 50 или по меньшей мере 70, 80, 90, 100, 150 или 200 аминокислот. Термин "аналог" или "полипептидный аналог", как используют в настоящем описании, обозначает полипептид, который представляет собой сегмент, который существенно идентичен некоторой контрольной аминокислотной последовательности и обладает в основном той же самой функцией или активностью, что и аминокислотная последовательность сравнения. Обычно полипептидные аналоги содержат консервативную аминокислотную замену (или вставку или делецию) относительно последовательности сравнения. Длина аналогов может составлять по меньшей мере 20 или 25 аминокислот или по меньшей мере 50, 60, 70, 80, 90, 100, 150 или 200 аминокислот или длиннее, и часто могут быть такими же длинными, как полноразмерный полипептид. Некоторые варианты осуществления изобретения включают антитела из полипептидных фрагментов или полипептидного аналога с 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15, 16 или 17 заменами относительно гаметической аминокислотной последовательности. Специалисты в данной области, следуя указаниям в данном описании, могут легко получить фрагменты или аналоги антител или молекул иммуноглобулинов. Термин "антигенсвязывающий участок" антитела (или просто "участок антитела"), как используют в настоящем описании, обозначает один или большее количество фрагментов антитела, которые сохраняют способность специфически связывать антиген (например, ALK-1 или ECD ALK-1). Показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охваченных термином "антигенсвязывающий участок" антитела, включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из VL, VH, CL И CH1 доменов; (ii) F(ab')2 фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостом в шарнирной области; (iii) Fd-фрагмент, состоящий из VH и CH1 доменов; (iv) Fv-фрагмент, состоящий изVL и VH доменов одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341: 544-546), который состоит из VH домена; и (vi) выделенный определяющий комплементарность участок (CDR). Кроме того, хотя два домена Fv-фрагента, VL and VH кодируют отдельные гены, их можно соединять, используя способы рекомбинации с применением синтетического линкера, который позволяет получать из них одну белковую цепь, в которой VL и VH участки образуют пары для получения одновалентных молекулet al. Proc. Natl. Acad. Sci. USA 85: 5879-5883 (1988. Подразумевают, что подобные одноцепочечные антитела также охватывает термин "антигенсвязывающий участок" антитела. Также охваченными являются другие формы одноцепочечных антител, такие как димеры. Димеры являются двухвалентными,- 15018453 биспецифическими антителами, в которых VH и VL домены экспрессированы на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы допустить образование пар между двумя доменами на одной и той же цепи, тем самым вынуждая домены образовывать пары с комплементарными доменами другой цепи и создавая два антигенсвязывающих центра (см., например,Holliger et al. Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993); Poljak et al. Structure 2: 1121-1123 (1994. Более того, антитело или его антигенсвязывающий участок может являться частью более крупных иммуносцепленных молекул, образованных ковалентным или нековалентным связыванием антитела или участка антитела с одним или большим количеством других белков или пептидов. Примеры подобных иммуносцепленных молекул включают использование активной зоны стрептавидина для получения тетрамерной молекулы scFv (Kipriyanov et al. Human Antibodies and Hybridomas 6: 93-101 (1995, а также использование остатка цистеина, маркерного пептида и С-концевой полигистидиновой метки для получения двухвалентных и биотинилированных молекул scFv (Kipriyanov et al. Mol. Immunol. 31: 1047-1058(1994. Другие примеры включают случаи, когда один или несколько CDR антитела включены в молекулу либо ковалентно, либо нековалентно для получения иммуноадгезина, который специфически связывает интересующий антиген, такой как ALK-1 или ECD из ALK-1. В таких вариантах осуществленияCDR может(гут) являться частью большей по размеру полипептидной цепи, может быть ковалентно связан с другой полипептидной цепью или может быть включен в состав нековалентно. Участки антител, такие как Fab или F(ab')2-фрагменты можно получать из целых антител общепринятыми методами, такими как расщепление целых антител папаином или пепсином соответственно. Кроме того, антитела, участки антител и иммуносцепленные молекулы можно получать, применяя стандартные методы рекомбинантных ДНК, как описано в настоящем описании. Как используют в настоящем описании, термин "антитело человека" обозначает любое антитело, в котором последовательности вариабельного и константного доменов являются последовательностями человека. Этот термин охватывает антитела с последовательностями человеческих генов, но которые изменены, например, для уменьшения возможной иммуногенности, повышения аффинности, исключения остатков цистеина, которые могут вызвать нежелательную укладку молекулы, и так далее. Термин также охватывает такие антитела, полученные рекомбинантными способами в клетках, не имеющих отношения к человеку, которые могут осуществлять гликозилирование, нетипичное для клеток человека. Эти антитела можно получать при помощи целого ряда способов, как описано ниже. Как используют в настоящем описании, термин "нейтрализующее антитело", "ингибиторное антитело" или "антагонистическое антитело" обозначает антитело, которое ингибирует сигнальный каскад реакций ALK-1/TGF1/Smad1. В предпочтительном варианте осуществления антитело ингибирует сигнальный каскад реакций ALK-1/TGF1/Smad1 по меньшей мере на примерно 20%, предпочтительно на 40%, более предпочтительно на 60%, еще более предпочтительно на 80% или еще более предпочтительно на 85%. Нейтрализующий или ингибирующий потенциал анти-ALK-1 антител человека можно определять, например, по их способности ингибировать повышенную регуляцию специфического генамишени ALK-1 "следующего этапа сигнального пути", Id1, как представлено в примере 12; ингибировать фосфорилирование Smad1, что определяют при помощи вестерн-блоттинга с использованием инфракрасной системы изображения Odyssey от LI-COR Biosciences, как представлено в примере 13. Термин "химерное антитело", как используют в настоящем описании, обозначает антитело, которое содержит участки из двух или больше различных антител. Например, один или больше CDR химерного антитела могут происходить из анти-ALK-1 антитела человека. В другом примере все CDR могут происходить из анти-ALK-1 антител человека. В другом примере CDR из более чем одного анти-ALK-1 антитела человека можно комбинировать в химерном антителе. Например, химерное антитело может содержать CDR1 легкой цепи первого анти-ALK-1 антитела человека, CDR2 легкой цепи второго анти-ALK-1 антитела человека и CDR3 легкой цепи третьего анти-ALK-1 антитела человека, a CDR тяжелой цепи могут происходить из одного или большего количества других анти-ALK-1 антител. Кроме того, каркасные участки могут происходить из одного из анти-ALK-1 антител, из которых взяты один или большеCDR, или из одного или большего количества других антител человека. Кроме того, как обсуждалось в настоящем описании ранее, химерное антитело включает антитело, содержащее участок, происходящий из гаметических последовательностей больше чем одного вида. В некоторых вариантах осуществления химерное антитело по изобретению представляет собой гуманизированное анти-ALK-1 антитело. Гуманизированное анти-ALK-1 антитело по изобретению содержит аминокислотную последовательность одного или больше каркасных участков и/или аминокислотную последовательность по меньшей мере из участка константной области одного или больше антиALK-1 антител человека по изобретению и также содержит последовательности, происходящие из антиALK-1 антитела, не имеющего отношения к человеку, например CDR последовательности. Как используют в настоящем описании, термин "ELISA" обозначает твердофазный иммуноферментный анализ. Этот анализ хорошо известен специалистам в данной области. Примеры данного анализа можно найти в Vaughan, T.J. et al., Nature Biotech. 14: 309-314 (1996), а также в примере 2 настоящей заявки. Термин "поверхностный плазмонный резонанс", как используют в настоящем описании, обозначает оптический феномен, который позволяет анализировать в режиме реального времени биоспецифические взаимодействия посредством регистрации изменений белковых концентраций внутри биосенсорной матрицы, например, используя систему BIACORE (Pharmacia Biosensor AB, Uppsala, Sweden и Piscataway,N. J.). Для дополнительных описаний см. Jonsson et al., Ann. Biol. Clin. 51: 19-26 (1993); Jonsson et al.,Biotechniques 11: 620-627 (1991); Jonsson et al., J. Mol. Recognit. 8: 125-131 (1995); и Johnsson et al., Anal.Biochem. 198: 268-277 (1991). Термин "аффинность" обозначает степень притяжения между антигеном и антителом. Присущее антителу притяжение к антигену обычно выражают в виде константы аффинности связывания (KD) для конкретного взаимодействия антиген-антитело. Говорят, что антитело специфически связывает антиген,когда KD составляет 1 мМ, предпочтительно 100 нМ. Константу аффинности связывания KD можно измерить с помощью поверхностного плазмонного резонанса, например, используя систему BIACORE,как обсуждают в примерах 7 и 8. Термин "koff" обозначает константу скорости диссоциации для конкретного взаимодействия антиген-антитело. Константу скорости диссоциации koff можно измерить с помощью поверхностного плазмонного резонанса, например, используя систему BIACORE, как обсуждают в примерах 7 и 8. Термин "авидность" обозначает функциональную комбинированную силу связывания антитела с его антигеном, которая основана как на аффинности, так и на валентностях антитела. Как используют в настоящем описании, этот термин описывает повышенную аффинность, которая имеет место в результате наличия у иммуноглобулина множественных центров связывания антигена. Как используют в настоящем описании, термин "молекулярная селективность" обозначает аффинность связывания антитела для определенного антигена большую, чем для других антигенов. Например,антитела по настоящему изобретению могут быть селективными для ALK-1 в большей степени, чем дляALK-2 вплоть до ALK-7, что означает, что аффинность связывания антитела для ALK-1 является по меньшей мере в 2 раза большей, например в 4 раза, или в 10 раз, или в 50 раз, или в 100 раз или более чем для ALK-2 вплоть до ALK-7. Такие аффинности связывания можно измерять, используя стандартные методы, известные специалистам в данной области. Термин "эпитоп" включает любую белковую детерминанту, способную специфически связывать иммуноглобулин или Т-клеточный рецептор, или иначе взаимодействовать с молекулой. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые цепи углеводов или сахаров, и обычно обладают специфическими трехмерными структурными характеристиками, а также специфическими зарядными характеристиками. Эпитоп может являться "линейным" или "конформационным". В линейном эпитопе все точки взаимодействия между белком и взаимодействующей молекулой (такой как антитело) расположены линейно вдоль первичной аминокислотной последовательности белка. В конформационном эпитопе точки взаимодействия проходят через аминокислотные остатки на белке, которые отделены друг от друга. Когда нужный эпитоп антигена определен, становится возможным получение антител к данному эпитопу, например, применяя методы по настоящему изобретению. Альтернативно, в процессе поиска, получения и характеристики антител можно пролить свет на информацию о желательных эпитопах. Исходя из данной информации затем становится возможным конкурентно отбирать антитела по связыванию с тем же самым эпитопом. Подходом к достижению этого является проведение исследований по перекрестной конкуренции для обнаружения антител, которые конкурентно связываются по отношению друг к другу, т.е. антитела конкурируют за связывание с антигеном. Высокопроизводительный способ для "биннинга" антител, основанный на их перекрестной конкуренции, описан в международной патентной заявкеWO 03/48731. Как используют в настоящем описании, термин "биннинг" обозначает способ группирования антител, основанный на их антигенсвязывающих свойствах. Распределение бинов является до некоторой степени произвольным в зависимости от того, насколько различными являются наблюдаемые картины связывания для всех тестируемых антител. Вследствие этого бины не всегда коррелируют с эпитопами, определенными другими способами, и их не следует использовать для определения эпитопов. Термин "конкурировать", как используют в настоящем описании в отношении антитела, означает,что первое антитело или его антигенсвязывающий участок конкурирует за связывание антигена со вторым антителом или его антигенсвязывающим участком, если связывание первого антитела с узнаваемым им эпитопом является заметно сниженным в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернативный вариант, когда связывание второго антитела с его эпитопом также заметно снижается в присутствии первого антитела, возможен, но не обязателен. То есть первое антитело может ингибировать связывание второго антитела с его эпитопом без того, чтобы второе антитело ингибировало связывание первого антитела с соответствующим ему эпитопом. Однако если каждое из антител заметно ингибирует связывание другого антитела с узнаваемым им эпитопом или лигандом в той же самой, большей или меньшей степени, говорят, что антитела "перекрестно конкурируют" друг с другом за связывание соответствующего им эпитопа(пов). Как конкурирующие, так и перекрестно конкурирующие антитела находятся в рамках настоящего изобретения. Безотно- 17018453 сительно механизма, лежащего в основе подобной конкуренции или перекрестной конкуренции (например, стерическое препятствие, конформационное изменение или связывание с общим эпитопом либо его участком и т.п.), специалисту в данной области будет очевидно, исходя из предложенных в настоящем описании идей, что подобные конкурирующие и/или перекрестно конкурирующие антитела находятся в рамках настоящей заявки и могут быть использованы для способов, описанных в настоящем описании. Термин "полинуклеотид", как указано в настоящем описании, обозначает полимерную форму нуклеотидов длиной по меньшей мере 10 оснований, либо рибонуклеотидов, либо дезоксирибонуклеотидов или модифицированной формы любого типа нуклеотида. Термин охватывает одно- и двухцепочечные формы. Термин "выделенный полинуклеотид", как указано в настоящем описании, обозначает полинуклеотид геномного, кДНК или синтетического происхождения либо разные их сочетания, когда в силу своего происхождения "выделенный полинуклеотид" (1) является не связанным со всеми или частью полинуклеотидов, с которыми "выделенный полинуклеотид" находят в природе, (2) является функционально связанным с полинуклеотидом, с которым он не связан в природе, или (3) не встречается в природе в виде части большей по размеру последовательности. Термин "природные нуклеотиды", как используют в настоящем описании, включает дезоксирибонуклеотиды и рибонуклеотиды. Термин "модифицированные нуклеотиды", как используют в настоящем описании, включает нуклеотиды с модифицированными или замещенными сахарными группами и т.п. Термин "олигонуклеотидные связи", как используют в настоящем описании, включает связи олигонуклеотидов, такие как фосфортиоат, фосфордитиоат, фосфорселеноат, фосфордиселеноат, фосфоранилотиоат,фосфораниладат, фосфорамидат и т.п. См., например, LaPlanche et al., Nucl. Acids Res. 14: 9081 (1986);and Peyman, Chemical Reviews 90: 543 (1990), описания которых приведены в настоящем описании в качестве ссылок в полном объеме. Олигонуклеотид может содержать метку для обнаружения, если необходимо."Функционально связанные" последовательности включают как последовательности, контролирующие экспрессию, которые граничат с интересующим геном, так и последовательности, контролирующие экспрессию, которые действуют в транс положении или на расстоянии, контролируя интересующий ген. Термин "последовательность, контролирующая экспрессию", как используют в настоящем описании, обозначает полинуклеотидные последовательности, которые необходимы для влияния на экспрессию и процессинг кодирующих последовательностей, с которыми они связаны. Последовательности, контролирующие экспрессию, включают соответствующие последовательности инициации транскрипции, терминации, промоторные и энхансерные; сигналы эффективного процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые усиливают эффективность трансляции(т.е. консенсусная последовательность Kozak); последовательности, которые повышают белковую стабильность; и, когда нужно, последовательности, которые усиливают белковую секрецию. Природа подобных контролирующих последовательностей различается в зависимости от организма хозяина; у прокариот подобные контролирующие последовательности обычно содержат промотор, рибосомальный связывающий центр и последовательность терминации транскрипции; у эукариот обычно подобные контролирующие последовательности содержат промоторы и последовательность терминации транскрипции. Предполагают, что термин "контролирующие последовательности" включает, как минимум, все компоненты, чье присутствие является обязательным для экспрессии и процессинга, и может также включать дополнительные компоненты, чье присутствие является полезным, например лидерные последовательности и последовательности слияния. Термин "вектор", как используют в настоящем описании, обозначает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она связана. В некоторых вариантах осуществления вектор представляет собой плазмиду, т.е. кольцевой двухцепочечный фрагмент ДНК, в который можно лигировать дополнительные сегменты ДНК. В некоторых вариантах осуществления вектор представляет собой вирусный вектор, где дополнительные сегменты ДНК можно лигировать в вирусный геном. В некоторых вариантах осуществления векторы являются способными к автономной репликации в клетке-хозяине, в которую их ввели (например, бактериальные векторы, обладающие бактериальной точкой начала репликации и эписомальные векторы млекопитающих). В других вариантах осуществления векторы (например, неэписомальные векторы млекопитающих) могут встраиваться в геном клетки-хозяина при введении в клетку-хозяина, и вследствие этого реплицируются вместе с геномом хозяина. Более того, определенные векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы в настоящем описании называют "рекомбинантные экспрессирующие векторы" (или просто "экспрессирующие векторы"). Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин"), как используют в настоя- 18018453 щем описании, обозначает клетку, в которую ввели рекомбинантный экспрессирующий вектор. Следует понимать, что "рекомбинантная клетка-хозяин" и "клетка-хозяин" обозначает не только клетку конкретного индивида, но также потомство такой клетки. Поскольку определенные модификации могут иметь место в следующих поколениях вследствие либо мутации, либо влияния факторов окружающей среды,такое потомство может, конечно, не быть идентичным родительской клетке, однако по-прежнему находится в рамках термина "клетка-хозяин", как используют в настоящем описании. Как используют в настоящем описании, термин "гаметическая" обозначает нуклеотидные последовательности и аминокислотные последовательности генов и генных сегментов антител, при их передаче от родителей потомству через половые клетки. Такая гаметическая последовательность отличается от нуклеотидной последовательности, кодирующей антитела в зрелых В-клетках, которая изменялась в результате случаев рекомбинации и гипермутации в процессе созревания В-клетки. Антитело, которое "кодирует" конкретная гамета, обладает нуклеотидной или аминокислотной последовательностью, которая в наибольшей степени совпадает с нуклеотидной последовательностью данной гаметы или аминокислотной последовательностью, которую она определяет. Такие антитела часто являются мутированными по сравнению с гаметической последовательностью. Термин "процентная идентичность последовательности" в контексте последовательностей нуклеиновых кислот обозначает остатки в двух последовательностях, которые являются одинаковыми при проведении анализа на максимальное совпадение. Длина последовательности, которую сравнивают на идентичность, может составлять отрезок по меньшей мере в примерно девять нуклеотидов, обычно по меньшей мере примерно 18 нуклеотидов, чаще всего по меньшей мере примерно 24 нуклеотида, типично по меньшей мере примерно 28 нуклеотидов, более типично по меньшей мере примерно 32 нуклеотидов и предпочтительно по меньшей мере примерно 36, 48 или более нуклеотидов. Существует целый ряд различных алгоритмов, известных в данной области, которые можно использовать для определения идентичности нуклеотидных последовательностей. Например, полинуклеотидные последовательности можно сравнивать, используя FASTA, Gap или Bestfit, которые представляют собой программы в WisconsinPackage версия 10.0, Genetics Computer Group (GCG), Madison, Wisconsin. FASTA, которая включает, например, программы FASTA2 и FASTA3, выполняет сравнительный анализ и определяет процентную идентичность последовательностей в участках, наилучшим образом перекрывающихся в запрошенной и изучаемой последовательностях (Pearson, Methods Enzymol. 183: 63-98 (1990); Pearson, Methods Mol. Biol. 132: 185-219 (2000); Pearson, Methods Enzymol. 266: 227-258 (1996); Pearson, J. Mol. Biol. 276: 71-84(1998); приведенные в настоящем описании в качестве ссылок). Если не указано иное, применяют параметры по умолчанию для конкретной программы или алгоритма. Например, процентную идентичность последовательностей между последовательностями нуклеиновых кислот можно определять, используяFASTA с ее параметрами по умолчанию (разрядность 6 и NOPAM фактор для матрицы количественной оценки) или используя Gap с ее параметрами по умолчанию, как предложено в GCG версия 6.1, приведенные в настоящем описании в качестве ссылок. Ссылка на нуклеотидную последовательность охватывает и ее комплемент, если не указано иное. Так, ссылку на нуклеиновую кислоту, обладающую конкретной последовательностью, следует понимать как охватывающую комплементарную ей цепь с ее комплементарной последовательностью. Термин "значительное сходство" или "значительное сходство последовательностей", когда речь идет о нуклеиновой кислоте или ее фрагменте, означает, что при оптимальном проведении сравнения, с учетом соответствующих нуклеотидных вставок или делеций, с другой нуклеиновой кислотой (или ее комплементарной цепью), имеет место идентичность нуклеотидных последовательностей равная по меньшей мере примерно 85%, предпочтительно по меньшей мере примерно 90% и более предпочтительно по меньшей мере примерно 95, 96, 97, 98 или 99% нуклеотидных оснований, как определяют при помощи хорошо известного алгоритма идентичности последовательностей, такого как FASTA, BLAST илиGap, как обсуждали выше. Термин "процентная идентичность последовательности" в контексте аминокислотных последовательностей обозначает остатки в двух последовательностях, которые являются одинаковыми при проведении анализа на максимальное совпадение. Длина последовательности, которую сравнивают на идентичность, может составлять отрезок по меньшей мере в примерно пять аминокислот, обычно, по меньшей мере примерно 20 аминокислот, чаще всего, по меньшей мере примерно 30 аминокислот, типично по меньшей мере примерно 50 аминокислот, более типично по меньшей мере примерно 100 аминокислот и еще более типично по меньшей мере примерно 150, 200 или более аминокислот. Существует целый ряд различных алгоритмов, известных в данной области, которые можно использовать для определения идентичности аминокислотных последовательностей. Например, аминокислотные последовательности можно сравнивать, используя FASTA, Gap или Bestfit, которые представляют собой программы в Wisconsin Package версия 10.0, Genetics Computer Group (GCG), Madison, Wisconsin. Применительно к полипептидам термин "значительная идентичность" или "значительное сходство" означает, что две аминокислотные последовательности при оптимальном сравнительном анализе, таком как при помощи программ GAP или BESTFIT с применением значений пробелов по умолчанию, предоставленных программами, обладают по меньшей мере 70, 75 или 80% идентичностью последовательно- 19018453 стей, предпочтительно по меньшей мере 90 или 95% идентичностью последовательностей и более предпочтительно по меньшей мере 97, 98 или 99% идентичностью последовательностей. В определенных вариантах осуществления позиции остатков, которые не являются идентичными, различаются в результате консервативных аминокислотных замен. Термин "сигнальная последовательность", также называемая сигнальным пептидом, лидерным пептидом, обозначает сегмент размером примерно от 15 до 30 аминокислот на N-конце белка, который дает возможность белку секретироваться (проходить через клеточную мембрану). После того как белок секретирован, сигнальная последовательность удаляется. Как используют в настоящем описании, термины "метка" или "меченый" обозначает введение в состав антитела другой молекулы. В одном варианте осуществления метка представляет собой детектируемый маркер, например введение в состав радиоактивно меченой аминокислоты или присоединение к полипептиду биотиниловых фрагментов, которые можно обнаружить при помощи меченого авидина (например, стрептавидина, содержащего флуоресцентный маркер или ферментативную активность, которую можно обнаружить оптическими или колориметрическими способами). В другом варианте осуществления метка или маркер могут являться терапевтическими, например лекарственный конъюгат или токсин. Различные способы мечения полипептидов и гликопротеинов известны в данной области и их можно применять. Примеры меток для полипептидов включают, но ими не ограничиваются следующие метки: радиоактивные изотопы или радионуклиды (например, 3 Н, 14 С, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, FITC, родамин, лантанидные люминофоры), ферментативные метки (например, пероксидаза хрена, -галактозидаза, люцифераза, щелочная фосфатаза), хемилюменисцентные маркеры, биотиниловые группы, заранее определенные полипептидные эпитопы, узнаваемые вторичным репортером (например, парами последовательностей с лейциновыми застежками, участками связывания для вторичных антител, металлсвязывающими доменами, эпитопными маркерами), магнитные средства,такие как хелаты гадолиния, токсины, такие как коклюшный токсин, таксол, цитохалазин В, грамицидинD, бромистый этидий, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин,доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1 дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги и гомологи. В некоторых вариантах осуществления метки присоединяют при помощи спейсерных участков различной длины для уменьшения потенциальных стерических препятствий. Термин "примат" обозначает млекопитающее рода приматов, который включает человекообразных и прообезьян, которое характеризуется усовершенствованным развитием рук и ног, укороченной мордой и большим мозгом. Млекопитающие рода приматов включают людей, человекообразных обезьян, обезьян и прообезьян, или низших приматов."Терапевтически эффективное количество" обозначает такое количество введенного терапевтического средства, которое облегчает до определенной степени один или больше симптомов болезни, на которую направлено лечение. Применительно к лечению рака терапевтически эффективное количество означает такое количество, которое обладает по меньшей мере одним из следующих эффектов: уменьшение размера опухоли; ингибирование (а именно, замедление роста до определенной степени, предпочтительно остановку) метастазирования опухоли; ингибирование до определенной степени (а именно, замедление роста до определенной степени, предпочтительно остановку) роста опухоли и облегчение до определенной степени (или предпочтительно снятие) одного или больше симптомов, связанных с раком."Лечить", "лечение" и "излечение" обозначает способ облегчения или устранения биологического нарушения и/или сопутствующих ему симптомов. Применительно к раку эти термины просто означают,что шансы на выживание больного, страдающего раком, возрастают или что один или больше симптомов болезни будут уменьшены."Приведение в контакт" обозначает сведение вместе антитела или его антигенсвязывающего участка по настоящему изобретению и мишеневую ALK-1 или ее эпитоп таким образом, что антитело может оказывать влияние на биологическую активность ALK-1. Такое "приведение в контакт" можно осуществлять "in vitro", т.е. в пробирке, чашке Петри или т.п. В пробирке в контакт можно приводить только антитело или его антигенсвязывающий участок и ALK-1, или ее эпитоп, или контакт может затрагивать целые клетки. Клетки можно также поддерживать или выращивать в чашках для клеточных культур и приводить их в контакт с антителами или их антигенсвязывающими участками в данной среде. В данном контексте способность конкретного антитела или его антигенсвязывающего участка оказывать влияние на болезнь, связанную с ALK-1, т.е. IC50 антитела, можно определять прежде, чем пытаться применять данное антитело in vivo с более сложными живыми организмами. Для клеток вне организма существует множество способов, и они хорошо известны специалистам в данной области, приводить ALK-1 в контакт с антителами или их антигенсвязывающими участками. Аббревиатура "FACS" обозначает сортировку флуоресцентно активированных клеток. Аббревиатуру FACS и проточную цитометрию используют как взаимозаменяемые. Флуоресцентное мечение позволяет исследовать клеточную структуру и функцию. Иммунофлуоресценция, наиболее широкоиспользуемое применение включает окрашивание клеток антителами, конъюгированными с флуоресцентными красителями, такими как флуоресцеин и фикоэритрин. Данный способ часто используют, чтобы метить молекулы на поверхности клеток, однако антитела можно направлять на мишени в цитоплазме. При прямой иммунофлуоресценции антитело с молекулой является напрямую конъюгированным с флуоресцентным красителем, и клетки окрашивают в один этап. При непрямой иммунофлуоресценции первичное антитело не метят и добавляют второе флуоресцентно конъюгированное антитело, которое является специфическим для первого антитела. Анти-ALK-1 антитела. Настоящее изобретение относится к выделенным нейтрализующим анти-ALK-1 моноклональным антителам или их антигенсвязывающим участкам, которые связывают ALK-1 приматов, предпочтительно ECD ALK-1 приматов, более предпочтительно ECD ALK-1 человека. В предпочтительном варианте осуществления изобретение относится к выделенным нейтрализующим антителам, которые представляют собой полностью моноклональные антитела человека или их антигенсвязывающие участки. Предпочтительно антитела человека представляют собой рекомбинантные анти-ALK-1 антитела человека, которые обладают большей аффинностью для ALK-1, чем для ALK-2 вплоть до ALK-7. В некоторых вариантах осуществления анти-ALK-l антитела человека получают, иммунизируя трансгенное животное, не являющееся человеком, например кролика, чей геном содержит гены иммуноглобулинов человека, так что трансгенное животное продуцирует антитела человека. Различные аспекты изобретения относятся к таким антителам и антигенсвязывающим участкам, и фармацевтическим композициям из них, а также к нуклеиновым кислотам, рекомбинантным экспрессирующим векторам и клеткам-хозяевам для получения таких антител и антигенсвязывающих участков. Способы применения антител и антигенсвязывающих участков по настоящему изобретению для отмены сигнального каскада реакций ALK-1/TGFl/Smad1 или для обнаружения ALK-1 in vitro или in vivo, также охвачены настоящим изобретением. Анти-ALK-1 антитело по изобретению может содержать - или -легкую цепь человека или аминокислотную последовательность, производную от них. В некоторых вариантах осуществления, включающих легкую цепь , вариабельный домен легкой цепи (VL) кодирует А 27, А 2, А 1, A3, В 3, В 2, L1 или L2VK ген человека. В некоторых вариантах осуществления легкую цепь кодирует VK L1 ген человека и JK 4 ген человека; VK A27 ген человека и JK 5 ген человека или JK 4 ген человека; VK В 3 ген человека и JK 1 ген человека; VK L2 ген человека и JK 3 ген человека; VK A2 ген человека и JK 1 ген человека; VK A3 ген человека и JK 4 ген человека; VK A1 ген человека и JK 1 ген человека; VK B2 ген человека и JK 4 ген человека; или VK A2 ген человека и JK 1 ген человека. В некоторых вариантах осуществления VL анти-ALK-1 антитела содержит одну или больше аминокислотных замен, делеций или вставок (добавлений) относительно гаметической аминокислотной последовательности VK. В некоторых вариантах осуществления VL анти-ALK-1 антитела содержит 1, 2, 3, 4, 5,6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных замен относительно гаметической аминокислотной последовательности VK. В некоторых вариантах осуществления одна или больше замен относительно гаметической последовательности находятся в CDR участках легкой цепи. В некоторых вариантах осуществления аминокислотные замены в VK относительно гаметической последовательности находятся на одной или большем количестве тех же самых позиций, что замены относительно гаметической последовательности, обнаруженные в одном или большем количестве VL антител, предложенных в настоящем описании, как показано, например, на фиг. 7. В некоторых вариантах осуществления аминокислотные изменения находятся на одной или большем количестве тех же самых положений, но затрагивают другие замены, нежели в антителе сравнения. В некоторых вариантах осуществления аминокислотные замены относительно гаметической последовательности находятся в одном или больше тех же самых положений, что и замены относительно гаметической последовательности в любом из VL антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1, однако замены могут представлять собой консервативные аминокислотные замены в таких положениях относительно аминокислоты в антителе сравнения. Например,если конкретное положение в одном из этих антител является измененной относительно гаметической и представляет собой глютамат, то можно произвести замену на аспартат на данном положении. Аналогично, если аминокислотная замена по сравнению с гаметической последовательностью в иллюстративном антителе представляет собой серин, можно консервативно заменить треонином серин в данном положении. Консервативные аминокислотные замены обсуждены выше. В некоторых вариантах осуществления анти-ALK-1 антитело содержит аминокислотную последовательность легкой цепи, соответствующую SEQ ID NO: 4. В других вариантах осуществления легкая цепь обладает аминокислотной последовательностью легкой цепи антитела 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1. В некоторых вариантах осуществления легкая цепь анти-ALK-1 антитела человека содержит VL аминокислотную последовательность антитела 1.12.1 (SEQ ID NO: 8); 1.11.1 (SEQ ID NO: 12); 1.13.1NO: 84); 5.57.1 (SEQ ID NO: 88) или 5.59.1 (SEQ ID NO: 92); или указанная аминокислотная последовательность имеет вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных аминокислотных замен и/или в общей сложности вплоть до 3 неконсервативных аминокислотных замен. В других вариантах осуществления легкая цепь анти-ALK-1 антитела человека содержит VL аминокислотную последовательность антитела 1.27.1; 1.29.1 или 1.31.1. В некоторых вариантах осуществления легкая цепь обладает аминокислотной последовательностью от начала CDR1 до конца CDR3 любого из вышеуказанных антител. В некоторых вариантах осуществления легкая цепь может иметь аминокислотной последовательностью участков CDR1, CDR2 и CDR3, независимо выбранные из участков CDR1, CDR2 и CDR3 легкой цепи, соответственно, двух или больше моноклональных антител, выбранных из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1 (D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1, или указанных CDR участков, каждый из которых имеет меньше 3 или меньше 2 консервативными аминокислотными заменами и/или в общей сложности тремя или меньше неконсервативными аминокислотными заменами. В определенных вариантах осуществления легкая цепь анти-ALK-1 антитела содержит аминокислотные последовательности участков CDR1, CDR2 и CDR3 легкой цепи антитела, выбранного из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(М 29I/D19 А); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1, или указанных CDR участков, каждый из которых обладает меньше 3 или меньше 2 консервативными аминокислотными заменами и/или в общей сложности тремя или меньше неконсервативными аминокислотными заменами. Что касается тяжелой цепи, то в некоторых вариантах осуществления вариабельный домен (VH) кодирует VH 4-31, VH 3-11, VH 3-15, VH 3-33, VH 4-61 или VH 4-59 ген человека. В некоторых вариантах осуществления VH последовательность анти-ALK-l антитела содержит одну или несколько аминокислотных замен, делений или вставок (добавлений), в собирательном значении называемых "мутациями", относительно гаметической аминокислотной последовательности VH. В некоторых вариантах осуществления вариабельный домен тяжелой цепи содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 мутаций относительно гаметической аминокислотной последовательности VH. В некоторых вариантах осуществления мутация(и) представляют собой неконсервативные замены по сравнению с гаметической аминокислотной последовательностью. В некоторых вариантах осуществления мутации находятся в CDR участках тяжелой цепи. В некоторых вариантах осуществления тяжелую цепь кодирует VH 3-33 ген человека, D 6-19 ген человека и JH 3B ген человека; VH 4-31 ген человека, D 6-19 ген человека и JH 4 В ген человека; VH 461 ген человека, D 6-19 ген человека и JH 4B ген человека; VH 4-31 ген человека, D 3-3 ген человека и JH 3B ген человека; VH 4-31 ген человека и JH 3 В ген человека; VH 4-59 ген человека, D 6-19 ген человека иVH 4-31 ген человека, D 4-23 ген человека и JH 4B ген человека; VH 4-31 ген человека, D 2-2 ген человека и JH 5B ген человека; VH 4-31 ген человека и JH 6B ген человека; VH 3-15 ген человека, D 1-1 ген человека и JH 4B ген человека; VH 3-11 ген человека, D 6-19 ген человека и JH 6B ген человека; VH 3-11 ген человека, D 3-10 ген человека и JH 6B ген человека; или VH 3-11 ген человека, D 6-6 ген человека и JH 6B ген человека. В некоторых вариантах осуществления аминокислотные замены находятся на одной или большем количестве тех же самых положений, что и замены относительно гаметической последовательности в любом одном или большем количестве VH антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19 А); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1. В некоторых вариантах осуществления аминокислотные изменения находятся на одной или большем количестве тех же самых позиций, но затрагивают другие замены, чем в антителе сравнения. В некоторых вариантах осуществления тяжелая цепь обладает аминокислотной последовательностью SEQ ID NO: 2. В других вариантах осуществления тяжелая цепь обладает аминокислотной последовательностью тяжелой цепи антитела 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1. В некоторых вариантах осуществления тяжелая цепь обладает VH аминокислотной последовательностью антитела 1.12.1 (SEQ ID 5.53.1 (SEQ ID NO: 78); 5.56.1 (SEQ ID NO: 82); 5.57.1 (SEQ ID NO: 86) или 5.59.1 (SEQ ID NO: 90); или указанная аминокислотная последовательность VH обладает вплоть до 1, 2, 3, 4, 6, 8, 9, 10 или 11 консервативных аминокислотных замен и/или в общей сложности вплоть до 3 неконсервативных аминокислотных замен. В других вариантах осуществления тяжелая цепь обладает VH аминокислотной последовательностью антитела 1.27.1; 1.29.1 или 1.31.1. В некоторых вариантах осуществления тяжелая цепь обладает аминокислотной последовательностью от начала CDR1 до конца CDR3 любого из вышеуказанных антител. В некоторых вариантах осуществления тяжелая цепь представляет собой CDR1, CDR2 и CDR3 участки тяжелой цепи антитела 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1. 12. 1 (M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1, или указанные CDR участки, каждый из которых обладает меньше 8, меньше 6, меньше 4 или меньше 3 консервативными аминокислотными заменами и/или в общей сложности тремя или меньше неконсервативными аминокислотными заменами. В некоторых вариантах осуществления CDR участки тяжелой цепи независимо выбираны из CDR участков двух или больше антител, выбранных из антител 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1. В другом варианте осуществления антитело содержит легкую цепь, как описано выше, и тяжелую цепь, как описано выше. В дополнительном варианте осуществления участки CDR легкой цепи и CDR тяжелой цепи являются участками одного и того же антитела. В различных вариантах осуществления анти-ALK-1 антитела обладают полноразмерной аминокислотной последовательностью тяжелой цепи и полноразмерной аминокислотной последовательностью легкой цепи, VH и VL аминокислотными последовательностями, аминокислотными последовательностями CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, или аминокислотной последовательностью тяжелой цепи от начала CDR1 до конца CDR3 и аминокислотной последовательностью легкой цепи от начала CDR1 до конца CDR3 анти-ALK-1 антитела, предложенного в настоящем описании. Один тип аминокислотной замены, которую можно осуществлять, представляет собой замену в антителе одного или больше цистеинов, которые могут являться химически активными, на другой остаток,такой как, без ограничений, аланин или серин. В одном варианте осуществления существует замена неканонического цистеина. Замену можно осуществлять в CDR или каркасном участке вариабельного домена, или в константном домене антитела. В некоторых вариантах осуществления цистеин является каноническим. Другой тип аминокислотной замены, которую можно осуществлять, представляет собой удаление возможных протеолитических центров в антителе. Такие центры могут находиться в CDR или каркасном участке вариабельного домена или в константном домене антитела. Замена остатков цистеина и удаление протеолитических центров могут уменьшить риск гетерогенности антительного продукта и, тем самым,повысить его гомогенность. Другой тип аминокислотной замены представляет собой удаление пар аспарагин-глицин, которые образуют потенциальные центры дезамидирования, посредством изменения одного или обоих остатков. В некоторых вариантах осуществления С-концевой лизин в тяжелой цепи анти-ALK-1 антитела по изобретению является расщепленным. В различных вариантах осуществления изобретения тяжелая и легкая цепи анти-ALK-1 антител могут, по желанию, содержать сигнальную последовательность. В одном из аспектов изобретение относится к двадцати пяти ингибиторным анти-ALK-1 моноклональным антителам человека и гибридомным клеточным линиям, которые продуцируют их. В определенных вариантах осуществления антитела по настоящему изобретению представляют собой IgG, обозначенные как 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1. В предпочтительных вариантах осуществления антиALK-1 антитело человека представляет собой антитело 1.12.1, 1.12.1(M29I/D19A), 1.12.1(M29I),1.12.1(D19A), 1.27.1, 1.14.1, 1.162.1, 1.31.1, 4.62.1 или 4.72.1. Антитела распознают экспонированные на поверхности эпитопы антигенов как участки с линейной(первичной) последовательностью или структурной (вторичной) последовательностью. BIAcore использовали для определения функционального расположения эпитопов и определения эпитопной исключительности анти-ALK-1 антител, предложенных по настоящему изобретению. В табл. 1 представлены идентификационные номера последовательностей (SEQ ID NO) нуклеиновых кислот, кодирующих полноразмерные тяжелые и легкие цепи вариантов антитела 1.12.1 и участков,содержащих вариабельный домен анти-ALK-1 антител по изобретению, а также соответствующие выведенные аминокислотные последовательности. 1.12.1(M29I/D19A) обозначает анти-ALK-1 антитело, содержащее специфическую единичную аминокислотную мутацию в тяжелой цепи, где метионин в положении 29 заменен на изолейцин, и специфическую единичную аминокислотную мутацию в легкой цепи, где аспарагиновая кислота в положении 19 заменена на аланин, как описано в примере 4. 1.12.1 обозначает вариант мАТ 1.12.1, выделенный из гибридомы. 1.12.1(rWT) обозначает вариант мАТ 1.12.1, экспрессированное рекомбинантное мАТ, описанное в примере 3. Изобретение также относится к вариантам тяжелой и/или легкой цепи определенных вышеперечисленных анти-ALK-1 антител человека, содержащим одну или больше аминокислотных модификаций. В обозначении данных вариантов первая буква представляет собой однобуквенный символ аминокислоты природной цепи антитела, число обозначает позицию аминокислоты (где позиция "один" представляет собой N-концевую аминокислоту FR1), и вторая буква представляет собой однобуквенный символ аминокислоты варианта. В следующих дополнительных вариантах осуществления изобретение относится к антителам, обладающим аминокислотными последовательностями вариабельного домена с более чем 80%, более чем 85%, более чем 90%, более чем 95%, более чем 96%, более чем 97%, более чем 98% или более чем 99% идентичностью последовательности по отношению к аминокислотной последовательности вариабельного домена любого из вышеперечисленных анти-ALK-1 антител человека. Класс и подкласс анти-ALK-1 антител. Класс и подкласс анти-ALK-1 антител можно определять любым способом, известным в данной области. В основном, класс и подкласс антитела можно определять, используя антитела, которые являются специфичными для конкретного класса и подкласса антитела. Такие антитела являются коммерчески доступными. Класс и подкласс можно определять с помощью ELISA, вестерн-блоттинга, а также других методов. Альтернативно, класс и подкласс антитела можно определять, секвенируя все или части константных доменов тяжелой и/или легкой цепей антител, сравнивая их аминокислотные последовательности с известными аминокислотными последовательностями различных классов и подклассов иммуноглобулинов и определяя класс и подкласс антител. Класс анти-ALK-1 антитела, полученного, как описано выше, можно изменять на другой. В одном аспекте изобретения молекулу нуклеиновой кислоты, кодирующую VL или VH, выделяют, применяя способы, хорошо известные в данной области, так, что она не содержит последовательности нуклеиновой кислоты, кодирующие CL или СН. "Antibody Engineering" (KontermannDubel, Eds., Springer-Verlag, Berlin (2001. Молекулы нуклеиновой кислоты, кодирующие VL или VH затем оперативно присоединяют к последовательности нуклеиновой кислоты, кодирующей CL или СН, соответственно, из молекулы иммуноглобулина другого класса. Это можно осуществить, используя вектор или молекулу нуклеиновой кислоты, которая представляет собой CL или СН цепь, как описано выше. Например, класс анти-ALK-1 антитела, которое изначально представляло собой IgM, можно изменить на IgG. Более того, изменение класса можно применять, чтобы превратить один подкласс IgG в другой, например из IgG1 в IgG2. Предпочтительный способ получения антитела по изобретению, представляющего собой нужный изотип,включает этапы выделения молекулы нуклеиновой кислоты, кодирующей тяжелую цепь анти-ALK-1 антитела, и нуклеиновой кислоты, кодирующей легкую цепь анти-ALK-1 антитела, получения вариабельного домена тяжелой цепи, лигирования вариабельного домена тяжелой цепи с константным доменом тяжелой цепи нужного изотипа, экспрессирования легкой цепи и лигированной тяжелой цепи в клетке и сбора анти-ALK-1 антитела нужного изотипа. В некоторых вариантах осуществления анти-ALK-1 антитело представляет собой моноклональное антитело. Анти-ALK-1 антитело может представлять собой молекулу IgG, IgM, IgE, IgA или IgD. В предпочтительном варианте осуществления анти-ALK-1 антитело является IgG и представляет собой подкласс IgG1, IgG2, IgG3, IgG4. В другом предпочтительном варианте осуществления антитело представляет собой подкласс IgG2. Идентификация эпитопов ALK-1, узнаваемых анти-ALK-1 антителами. Изобретение относится к анти-ALK-1 моноклональному антителу человека, которое связываетALK-1 и конкурирует или перекрестно конкурирует с и/или связывает тот же эпитоп, что и (а) антитело,выбранное из 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.KM29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 и 5.59.1; (b) антитело, которое содержит вариабельный домен тяжелой цепи, обладающий аминокислотной последовательностью VH домена в любой из SEQ ID NO: 6; 10; 14; 18; 22; 26; 30; 34; 38; 42; 46; 50; 54; 58; 62; 66; 70; 74; 78; 82; 86; 90 или 104, (с) антитело, которое содержит вариабельный домен легкой цепи, обладающий аминокислотной последовательностью VL домена в любой из SEQ ID NO: 8; 12; 16; 20; 24; 28; 32; 36; 40; 44; 48; 52; 56; 60; 64; 68; 72; 76; 80; 84; 88; 92 или 127, и (d) антитело, которое содержит как вариабельный домен тяжелой цепи, как определено в (b),так и вариабельный домен легкой цепи, как определено в (c). Определять, связывает ли антитело тот же самый эпитоп или конкурирует ли перекрестно за связывание с анти-ALK-1 антителом, можно способами, известными в данной области. В одном варианте осуществления анти-ALK-1 антителу по изобретению дают связать ALK-1 в условиях насыщения и затем измеряют способность тестируемого антитела связывать ALK-1. Если тестируемое антитело способно связывать ALK-1 в то же время, что и анти-ALK-1 антитело сравнения, значит тестируемое антитело связывает другой эпитоп нежели анти-ALK-1 антитело сравнения. Однако если тестируемое антитело не способно связывать ALK-1 в то же время, значит тестируемое антитело связывает тот же эпитоп, перекрывающийся эпитоп или эпитоп, который находится в непосредственной близости от эпитопа, связанного анти-ALK-1 антителом по изобретению. Данный эксперимент можно проводить, используя ELISA,RIA, BIACORE или проточную цитометрию. Чтобы определить, конкурирует ли перекрестно антиALK-1 антитело с другим анти-ALK-1 антителом, можно применять способ конкуренции, описанный выше, в двух направлениях, т.е. определяя, блокирует ли известное антитело тестируемое антитело, и наоборот. В предпочтительном варианте осуществления эксперимент проводят, используя BIACORE. Аффинность связывания анти-ALK-1 антител с ALK-1. Аффинность связывания (KD) и константу диссоциации (koff) анти-ALK-1 антитела или его антигенсвязывающего участка с ALK-1 можно определять способами, известными в данной области. Аффинность связывания можно определять с помощью вариантов ELISA, RIA, проточной цитометрии или по- 25018453 верхностного плазмонного резонанса, такого как BIACORE. Константу диссоциации можно определять с помощью поверхностного плазмонного резонанса. Предпочтительно аффинность связывания и константу диссоциации измеряют с помощью поверхностного плазмонного резонанса. Более предпочтительно аффинность связывания и константу диссоциации измеряют с помощью BIACORE. Можно определять, обладает ли антитело, в основном, такой же KD, что и анти-ALK-1 антитело, используя способы, известные в данной области. Такие способы определения KD и koff можно использовать во время начальной стадии отбора, а также во время последующих стадий оптимизации. Ингибирование активности ALK-1 анти-ALK-1 антителом. Анти-ALK-1 моноклональные антитела, которые ингибируют связывание ALK-1, можно определять, применяя целый ряд анализов. Например, нейтрализующие анти-ALK-1 антитела можно определять по ингибированию ими повышенной регуляции специфического гена-мишени ALK-1 "следующего этапа сигнального пути", Id1, как описано в примере 12. Предпочтительные анти-ALK-1 антитела обладают IC50 не большей чем 500, 300, 200, 150, 100, 50, 20, 10 или 1 нМ. Можно также определять способность анти-ALK-1 антитела ингибировать фосфорилированиеSmad1, определяемую с помощью вестерн-блоттинга с использованием инфракрасной системы изображения Odyssey, как описано в примере 13. В различных вариантах осуществления анти-ALK-1 антитело обладает IC50 в данном анализе не большей чем 250, 200, 150, 100, 50, 20, 10 или 1 нМ. Ингибирование ангиогенеза анти-ALK-1 антителом. В другом варианте осуществления анти-ALK-1 антитело или его участок ингибирует ангиогенез человеческих сосудов, как показано на мыши SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали опухолевые клетки меланомы M24met человека, как определяли ИГХ анализом теста на CD-31 сигнал человека по меньшей мере на 40% по сравнению с контрольным образцом,как описано в примере 17 и представлено в табл. 13. В другом варианте осуществления анти-ALK-1 антитело или его участок ингибирует ангиогенез человеческих сосудов, как показано на мыши SCID с привитой тканью крайней плоти человека, в которую внутрикожно имплантировали коллаген, как определяли ИГХ анализом теста на CD-31 сигнал человека по меньшей мере на 50% по сравнению с контрольным образцом, как описано в примере 16 и представлено в табл. 12. Видовая и молекулярная избирательность. В другом аспекте изобретения анти-ALK-1 антитела проявляют как видовую, так и молекулярную избирательность. Следуя идеям данного описания, можно определять видовую или молекулярную избирательность анти-ALK-1 антитела, применяя способы, хорошо известные в данной области. Например,можно определять видовую избирательность, используя вестерн-блоттинг, поверхностный плазмонный резонанс, например BIAcore, ELISA, иммунопреципитацию или RIA. В некоторых вариантах осуществления анти-ALK-1 антитело связывает ALK-1 приматов с KD, которая является по меньшей мере в два раза меньшей чем его KD для ALK-1 грызунов. В дополнительном варианте осуществления KD для ALK-1 приматов является по меньшей мере в 3 раза, по меньшей мере в 10 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 200 раз, по меньшей мере в 500 раз или по меньшей мере в 1000 меньшей чем его KD для ALK-1 грызунов, как определяли проточной цитометрией. В других вариантах осуществления анти-ALK-1 антитело обладает избирательностью для ALK-1 большей, чем для ALK-2 вплоть до ALK-7. В некоторых вариантах осуществления анти-ALK-1 антитело не проявляет сколько-нибудь ощутимого специфического связывания с любым другим белком, кромеALK-1. Предпочтительно анти-ALK-1 антитело связывает ECD ALK-1 человека. Способы получения антител и продуцирующие антитело клеточные линии Иммуноген ALK-1. В некоторых вариантах осуществления иммуноген ALK-1, или антиген, представляет собой выделенную и/или очищенную ALK-1. В предпочтительных вариантах осуществления иммуноген ALK-1 представляет собой ALK-1 человека. В предпочтительных вариантах осуществления иммуноген ALK-1 представляет собой ECD ALK-1 человека. ALK-1 человека или ее антигенные участки можно получать способами, хорошо известными специалистам в данной области, или можно приобретать у коммерческих поставщиков. Аминокислотная и нуклеотидная последовательности ALK-1 человека являются известными (см., например, инвентарный номер реестра Genbank L17075). Ген ACVRL1, кодирующий полноразмерную ALK-1, является коммерчески доступным у Invitrogen Inc., ID клона IOH21048. Например,RD Systems, Inc. продает рекомбинантную химеру ALK-1/Fc человека (кат.370-AL), полученную посредством экспрессии в клеточной линии мышиной миеломы последовательности ДНК, кодирующей аминокислотные остатки 1-118 ECD ALK-1, где последовательность ДНК была слита с последовательностью ДНК, кодирующей Fc фрагмент IgG человека через последовательность ДНК, кодирующую полипептидный линкер. Рекомбинантная зрелая химера ALK-1/Fc человека представляет собой дисульфидносвязанный гомодимерный белок, обладающий Asp 22 на аминоконце. Кроме того, в примере 1 описывают получение ALK-1 ECD His-Tag белка, который использовали для получения гибридом, продуцирующих анти-ALK-1 антитела по настоящему изобретению. В других вариантах осуществления антиген ALK-1 представляет собой клетку, которая экспрессирует или избыточно экспрессирует ALK-1. В других вариантах осуществления антиген ALK-1 представляет собой рекомбинантный белок, экспрессируемый в дрожжах, клетках насекомых, бактериях, таких как Е. coli, или других источниках с помощью рекомбинантных методов. Иммунизация. В некоторых вариантах осуществления человеческие антитела получают иммунизацией антигеномALK-1 трансгенного животного, не являющегося человеком, которое содержит в своем геноме некоторые или все локусы тяжелой цепи и легкой цепи иммуноглобулина человека. В предпочтительном варианте осуществления животным, не принадлежащим к человеческому роду, является животноеXENOMOUSE (Abgenix, Inc., Fremont, CA). Мыши XENOMOUSE представляют собой искусственно созданные линии мышей, которые содержат большие фрагменты локусов тяжелой цепи и легкой цепи иммуноглобулина человека и у которых нарушена продукция мышиных антител. См., например, Green et al., Nature Genetics 7: 13-21 (1994) и патенты США 5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598, 6130364, 6162963 и 6150584. См. также WO 91/10741, WO 94/02602, WO 96/34096, WO 96/33735, WO 98/16654, WO 98/24893, WO 98/50433, WO 99/45031, WO 99/53049, WO 00/09560 и WO 00/037504. В другом аспекте изобретение относится к способу получения анти-ALK-1 антител из отличных от мышей животных, не принадлежащих к человеческому роду, посредством иммунизации антигеном ALK1 трансгенного животного, не являющегося человеком, которое содержит локусы иммуноглобулина человека. Таких животных можно создавать с применением способов, описанных в вышеуказанных документах. Способы, описанные в данных документах, можно модифицировать, как описано в патенте США 5994619, который приведен в настоящем описании в качестве ссылки. Патент США 5994619 описывает способы получения новых клеток и клеточных линий с культивированной внутренней клеточной массой(CICM), полученных от свиней и коров, а также трансгенных клеток CICM, в которые вставили гетерологичную ДНК. Трансгенные клетки CICM можно использовать для получения клонированных трансгенных эмбрионов, плодов и потомства. В патенте '619 также описывают способы получения трансгенных животных, которые способны передавать гетерологичную ДНК своему потомству. В предпочтительных вариантах осуществления настоящего изобретения животные, не принадлежащие к человеческому роду, представляют собой млекопитающих, в частности крыс, овец, свиней, коз, крупный рогатый скот, лошадей или кур. Мыши XENOMOUSE продуцируют репертуар полностью антител человека, соответствующий взрослому человеку, и производят антиген-специфические антитела человека. В некоторых вариантах осуществления мыши XENOMOUSE содержат приблизительно 80% V-генного репертуара антител человека в результате введения мегабазных гаметической конфигурации фрагментов локусов тяжелой цепи и локусов легкой -цепи человека в дрожжевую искусственную хромосому (YAC). В других вариантах осуществления мыши XENOMOUSE также содержат приблизительно все локусы легкой лямбдацепи человека. См. Mendez et al., Nature Genetics 15: 146-156 (1997), Green and Jakobovits, J. Exp. Med. 188: 483-495 (1998), и WO 98/24893, описание которых приведено в качестве ссылок. В некоторых вариантах осуществления животные, не принадлежащие к человеческому роду, обладающие генами иммуноглобулинов человека, представляют собой животных, которые обладают "минилокусом" иммуноглобулина человека. При "минилокусном" подходе экзогенный локус Ig имитируют посредством включения отдельных генов из локуса Ig. Таким образом, один или больше генов VH, один или больше генов DH, один или больше генов JH, константный домени второй константный домен(предпочтительно константный домен ) вставляют в конструкт для введения животному. Данный подход описан, в числе прочего, в патентах США 5545807, 5545806, 5569825, 5625126, 5633425,5661016, 5770429, 5789650, 5814318, 5591669, 5612205, 5721367, 5789215 и 5643763, приведенных в настоящем описании в качестве ссылок. В другом аспекте изобретение относится к способу получения гуманизированных анти-ALK-1 антител. В некоторых вариантах осуществления животных, не принадлежащих к человеческому роду, иммунизируют антигеном ALK-1, как описано ниже, в условиях, которые делают возможным продукцию антител. Клетки, продуцирующие антитела, выделяют из животных и нуклеиновые кислоты, кодирующие тяжелую и легкую цепи интересующего анти-ALK-1 антитела выделяют из выделенных клеток,продуцирующих антитела, или из иммортализованной клеточной линии, полученной из таких клеток. Данные нуклеиновые кислоты затем конструируют, применяя методы, известные специалистам в данной области, и, как также описано ниже, чтобы уменьшить количество не относящейся к человеку последовательности, т.е., чтобы гуманизировать антитело для снижения иммунного ответа у людей. Иммунизировать животных можно любым способом, известным в данной области. См., например,Harlow and Lane, Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Press, 1990. Способы иммунизации животных, не принадлежащих к человеческому роду, таких как мыши, крысы, овцы, козы,свиньи, крупный рогатый скот и лошади, хорошо известны в данной области. См., например, Harlow andLane, выше, а также патент США 5994619. В предпочтительном варианте осуществления антиген ALK-1 вводят с адъювантом для стимулирования иммунного ответа. Типичные адъюванты включают полный или неполный адъювант Фрейнда, RIBI (мурамилдипептиды) или ISCOM (иммуностимулирующие комплексы). Подобные адъюванты могут защитить полипептид от быстрого распространения, изолируя его в локальном депо, или они могут содержать вещества, которые стимулируют хозяина секретировать факторы, являющиеся хемотаксическими для макрофагов и других компонентов иммунной системы. Предпочтительно, если вводят полипептид, схема иммунизации включает два или больше введений полипептида на протяжении нескольких недель. В примере 2 поясняют способ получения анти-ALK-1 моноклональных антител в мышах XENOMOUSE. Получение антител и продуцирующих антитела клеточных линий. После иммунизации животного антигеном ALK-1 от данного животного можно получать антитела и/или продуцирующие антитела клеточные линии. В некоторых вариантах осуществления сыворотку,содержащую анти-ALK-1 антитела, получали от животного путем забора крови или забоя данного животного. Сыворотку можно применять в том виде, в котором ее получили от животного, можно получать из сыворотки иммуноглобулиновую фракцию или из сыворотки можно очищать анти-ALK-1 антитела. В некоторых вариантах осуществления из клеток, выделенных из иммунизированного животного,получали продуцирующие антитела клеточные линии. После иммунизации животное забивали и Вклетки из лимфатических узлов и/или селезенки иммортализовали способами, известными в данной области. Способы иммортализации клеток включают, но не ограничиваются их трансфекцией онкогенами,их инфицированием онкогенными вирусами и их культивированием в условиях, избирательных для иммортализованных клеток, воздействием на них канцерогенных или мутагенных соединений, гибридизацией их с иммортализованными клетками, например с миеломными клетками, и инактивацией генасупрессора опухолей. См., например, выше: Harlow and Lane. Если применяют слияние с миеломными клетками, предпочтительно, чтобы миеломные клетки не секретировали иммуноглобуллиновые полипептиды (несекретирующая клеточная линия). Скрининг иммортализованных клеток проводили с помощью ALK-1 или ее фрагмента. В предпочтительном варианте осуществления первичный скрининг проводили с помощью иммуноферментного анализа (ELISA) или радиоиммунного анализа. Пример скрининга с помощью ELISA приведен в WO 00/37504, приведенном в настоящем описании в качестве ссылки. Клетки, продуцирующие анти-ALK-1 антитела, например гибридомы, выбирали, клонировали и затем проводили скрининг на наличие желательных характеристик, включая устойчивый рост, высокую продукцию антител и желательные характеристики антител, как дополнительно обсуждают ниже. Гибридомы можно наращивать in vivo в сингенных животных, в животных, у которых отсутствует иммунная система, например в голых мышах, или клеточных культурах in vitro. Способы селекции, клонирования и наращивания гибридом хорошо известны специалистам в данной области. В предпочтительном варианте осуществления иммунизированным животным является животное, не являющееся человеком, которое экспрессирует гены иммуноглобулинов человека, и селезеночные Вклетки сливают с линией миеломных клеток того же биологического вида, что и животное, не являющееся человеком. В более предпочтительном варианте осуществления иммунизованным животным является мышь XENOMOUSE, а линия миеломных клеток представляет собой несекретирующую миелому мышей. В еще более предпочтительном варианте осуществления линия миеломных клеток является Р 3-Х 63Ag8.653 (Американская коллекция типовых культур). См., например, пример 2. Таким образом, в одном варианте осуществления изобретение относится к способам получения клеточной линии, которая продуцирует моноклональное антитело человека или его фрагмент, направленные против ALK-1, включающим: а) иммунизацию описанного в настоящем описании трансгенного животного, не являющегося человеком, ALK-1, частью ALK-1, либо клетками или тканью, экспрессирующейALK-1; (b) предоставление трансгенному животному возможности наращивать иммунный ответ к ALK1; (с) выделение из трансгенного животного клеток, продуцирующих антитела; (d) иммортализацию клеток, продуцирующих антитела; (е) создание индивидуальных моноклональных популяций иммортализованных клеток, продуцирующих антитела, и (f) скрининг иммортализованных клеток, продуцирующих антитела, для выявления антитела, направленного против ALK-1. В другом аспекте изобретение относится к клеточной линии, которая продуцирует анти-ALK-1 антитело человека. В некоторых вариантах осуществления клеточная линия является гибридомной клеточной линией. В некоторых вариантах осуществления гибридомы представляют собой гибридомы мыши,как описано выше. В других вариантах осуществления гибридомы производят в отличных от человека и мыши биологических видах, таких как крысы, овцы, свиньи, козы, коровы или лошади. В другом варианте осуществления гибридомы являются гибридомами человека. В другом варианте осуществления трансгенное животное иммунизируют антигеном ALK-1, первичные клетки, например В-клетки селезенки или периферической крови выделяют из иммунизированного трансгенного животного и определяют индивидуальные клетки, продуцирующие антитела, специфичные для желаемого антигена. Выделяют полиаденилированную мРНК из каждой индивидуальной клетки и проводят полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР) (RT-PCR), ис- 28018453 пользуя смысловые праймеры, которые комплементарны последовательностям вариабельного домена,например вырожденные праймеры, распознающие гены большинства или всех FR1 участков вариабельных доменов тяжелой и легкой цепи человека и антисмысловые праймеры, которые комплементарны последовательностям константной или связывающей области. Затем кДНК вариабельных доменов тяжелой и легкой цепи клонируют и экспрессируют в любой подходящей клетке-хозяине, например миеломной клетке, в виде химерных антител с соответствующими константными участками иммуноглобулинов,такими как константные домены тяжелой цепи и - или -цепи. См. Babcook, J.S. et al., Proc. Natl. Acad.Sci. USA 93:7843-48, 1996, приведенную в настоящем описании в качестве ссылки. Анти-ALK-1 антитела затем можно определять и выделять, как описано в настоящем описании. В другом варианте осуществления можно применять методы фагового дисплея, чтобы получить библиотеки, содержащие репертуар антител с различными аффинностями к ALK-1. Для получения подобных репертуаров нет необходимости иммортализовать В-клетки от иммунизированного животного. Точнее, первичные В-клетки можно использовать непосредственно в качестве источника ДНК. Смесь кДНК из В-клеток, например, полученных из селезенок, применяют для получения экспрессирующей библиотеки, например библиотеки фагового дисплея, трансфецированной в E.coli. Полученные клетки тестируют на иммунореактивность к ALK-1. Способы оппеделения высокоаффинных человеческих антител из таких библиотек описаны Griffiths et al., EMBO J., 13: 3245-3260 (1994); Nissim et al., там же, стр. 692-698 и Griffiths et al., там же, 12: 725-734, которые приведены в настоящем описании в качестве ссылок. В конечном счете, определяют клоны из библиотеки, которые обладают аффинностями связывания антигена желаемой величины, и ДНК, кодирующую продукт, ответственный за такое связывание, восстанавливают и подготавливают для стандартной рекомбинантной экспрессии. Библиотеки фаговых дисплеев также можно создавать с помощью заранее подготовленных нуклеотидных последовательностей и проводить скрининг схожим образом. В целом, кДНК, кодирующие тяжелую и легкую цепи, поставляют независимо или связывают для получения Fv аналогов для производства в фаговой библиотеке. Затем проводят скрининг фаговых библиотек на антитела с наибольшими аффинностями для ALK-1 и из соответствующего клона восстанавливают генетический материал. Последующие раунды скрининга могут увеличить аффинность выделенных оригинальных антител. Нуклеиновые кислоты, векторы, клетки-хозяева и рекомбинантные способы получения антител Нуклеиновые кислоты. Настоящее изобретение также охватывает молекулы нуклеиновой кислоты, кодирующие анти-ALK1 антитела или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления различные молекулы нуклеиновой кислоты кодируют тяжелую цепь и легкую цепь анти-ALK-1 иммуноглобулина. В других вариантах осуществления одна и та же молекула нуклеиновой кислоты кодирует тяжелую цепь и легкую цепь анти-ALK-1 иммуноглобулина. В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая вариабельный домен легкой цепи (VL), использует А 27, А 2, A1, A3, В 3, В 2, L1 или L2 VK ген человека, а также J5, J1,J3 или J4 ген человека. В некоторых вариантах осуществления молекула нуклеиновой кислоты использует А 27 VK ген человека и J5 ген человека. В других вариантах осуществления молекула нуклеиновой кислоты использует А 2 ген человека и J1 ген человека. В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая легкую цепь, кодирует аминокислотную последовательность, содержащую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 замен относительно гаметической аминокислотной последовательности(тей). В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность VL,содержащую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных аминокислотных замен и/или 1, 2 или 3 неконсервативные замены по сравнению с гаметическими VL и JK последовательностями. Замены могут быть в CDR участках, каркасных участках или в константном домене. В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует аминокислотную последовательность VL, содержащую одну или больше мутаций относительно гаметической последовательности, которые идентичны мутациям относительно гаметической последовательности, обнаруженным в VL любого из антител: 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1. В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует по меньшей мере три аминокислотные замены по сравнению с гаметической последовательностью, которые идентичны мутациям относительно гаметической последовательности, обнаруженным в VL любого из антител: 1.11.1; 1.12.1; 1.12.1(rWT); 1.12.1(M29I/D19A); 1.12.1(M29I); 1.12.1(D19A); 1.13.1; 1.14.1; 1.151.1; 1.162.1; 1.183.1; 1.27.1; 1.29.1; 1.31.1; 1.8.1; 1.9.1; 4.10.1; 4.24.1; 4.38.1; 4.58.1; 4.62.1; 4.68.1; 4.72.1; 5.13.1; 5.34.1; 5.53.1; 5.56.1; 5.57.1 или 5.59.1. В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7, 11, 15, 19, 23, 27, 31, 35, 39, 43,47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91 или 126, которая кодирует аминокислотную последователь- 29
МПК / Метки
МПК: A61K 39/395, C07K 16/40
Метки: моноклональные, подобной, антитела, рецептору, человека, киназе-1, применение, активина
Код ссылки
<a href="https://eas.patents.su/30-18453-monoklonalnye-antitela-cheloveka-k-kinaze-1-podobnojj-receptoru-aktivina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Моноклональные антитела человека к киназе-1, подобной рецептору активина, и их применение</a>
Предыдущий патент: Узел пакета топливных элементов и способ работы узла пакета топливных элементов с улучшенным распределением газового потока
Следующий патент: Способ управления жидкостью в трубопроводах многофазной текучей среды
Случайный патент: Способ получения 16,17-[(циклогексилметилен)бис(окси)] -11,21-дигидроксипрегна-1,4-диен-3,20-диона или его 21-изобутирата транскетализацией.