Способы лечения с использованием гликопэгилированного g-csf
Формула / Реферат
1. Способ повышения продукции стволовых клеток у донора, где указанный способ включает введение указанному донору эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
2. Способ по п.1, где указанная полимерная модифицирующая группа представляет собой водорастворимый полимер.
3. Способ по п.2, где указанный водорастворимый полимер представляет собой полиэтиленгликоль.
4. Способ по п.2, где указанный водорастворимый полимер выбирается из линейного водорастворимого полимера и разветвленного водорастворимого полимера.
5. Способ по п.1, где указанная полимерная модифицирующая группа и указанная гликозильная связывающая группа ковалентно соединены посредством линкера.
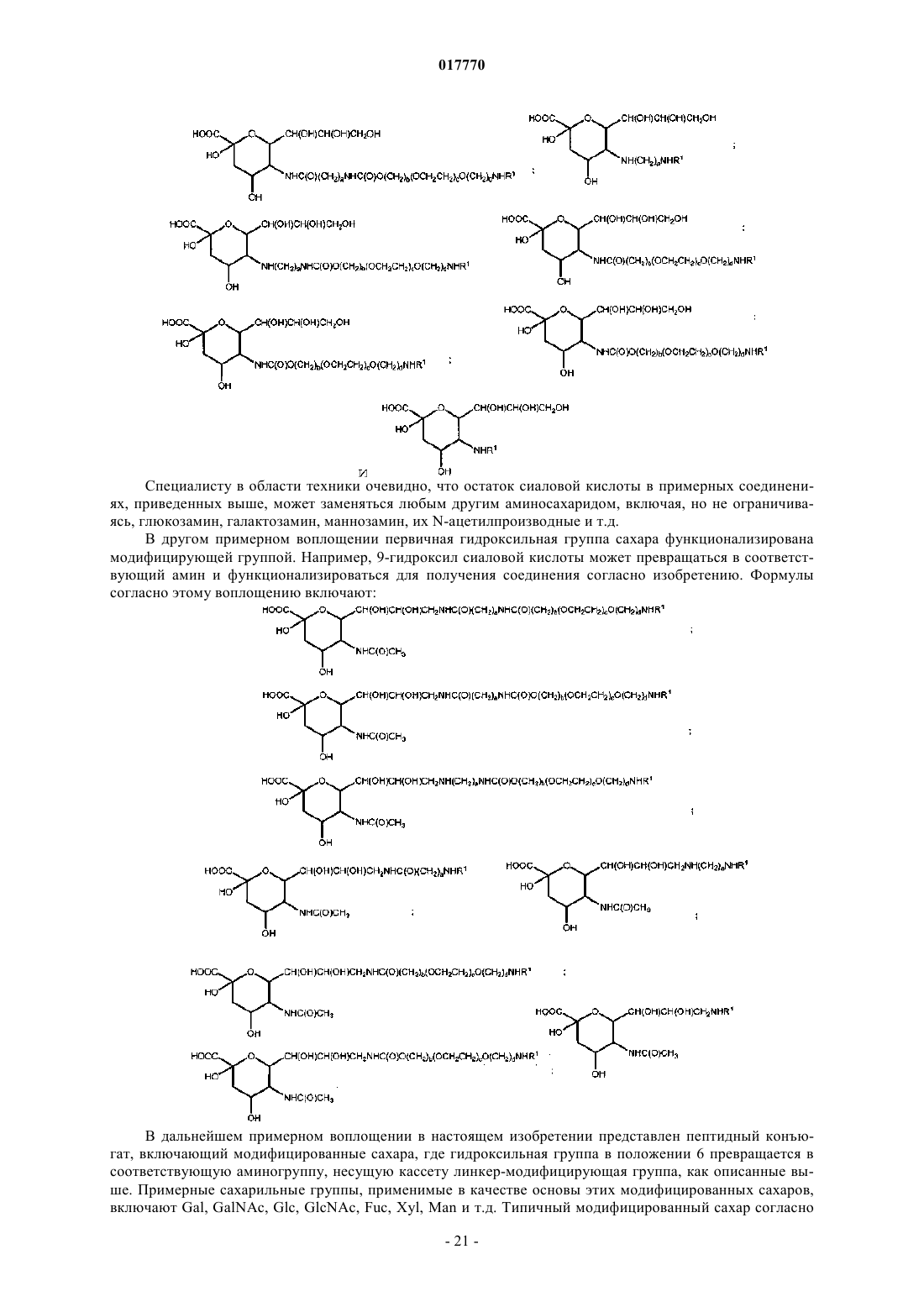
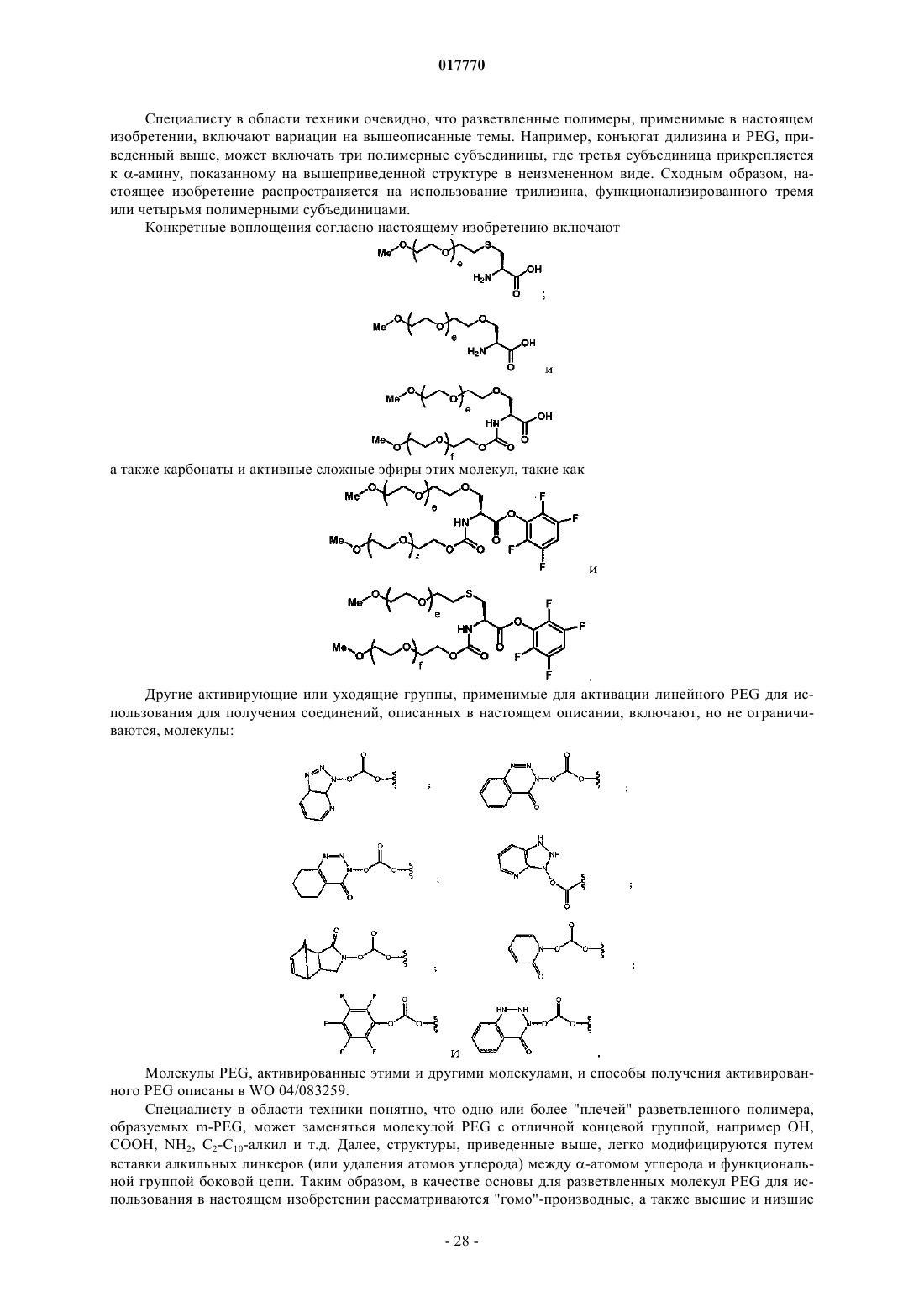
6. Способ по п.5, где указанная гликозильная связывающая группа включает модифицированный остаток сиаловой кислоты и где указанный модифицированный остаток сиаловой кислоты имеет структуру согласно формуле
где R означает указанную полимерную модифицирующую группу, указанная полимерная модифицирующая группа присоединена к указанному остатку сиаловой кислоты посредством указанного линкера.
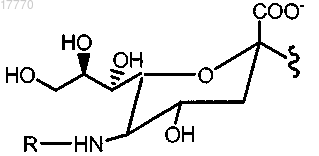
7. Способ по п.6, где указанный модифицированный остаток сиаловой кислоты имеет структуру согласно формуле
где n означает целое число от 1 до 2000.
8. Способ по п.1, где указанная полимерная модифицирующая группа имеет, по существу, гомодисперсное распределение молекулярных масс.
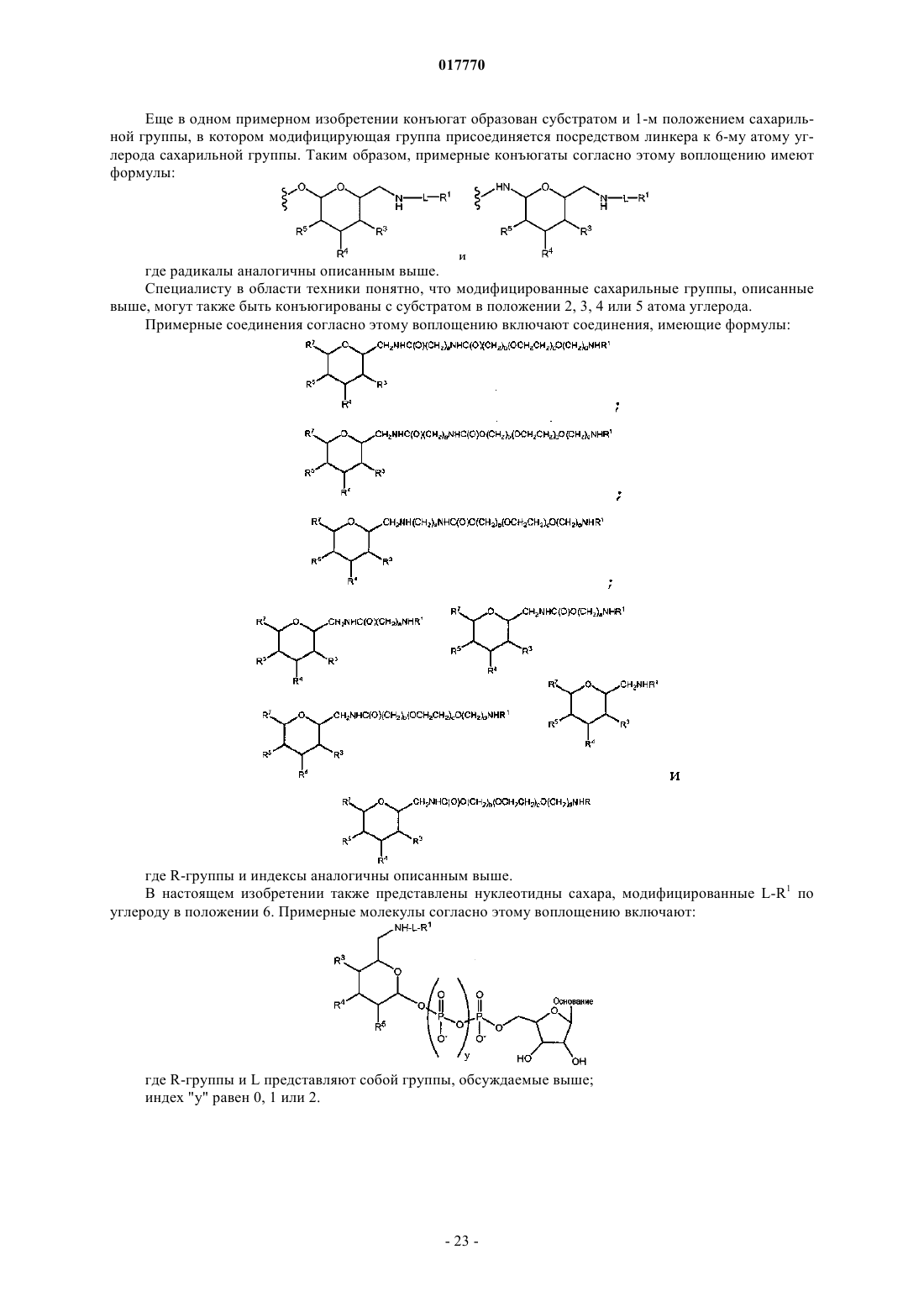
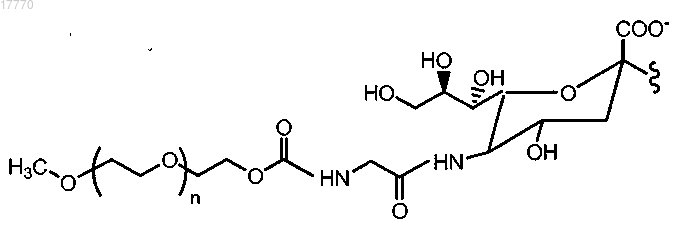
9. Способ по п.1, где указанная гликозильная связывающая группа содержит модифицированный остаток сиаловой кислоты, имеющий формулу
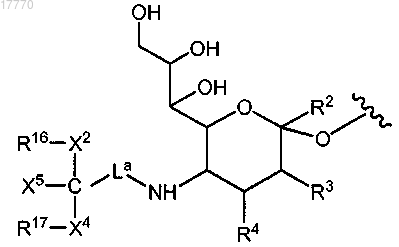
где R2 представляет собой Н, CH2OR7, COOR7 или OR7, R7 означает Н, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил;
R3 и R4 независимо выбраны из Н, замещенного или незамещенного алкила, OR8, NHC(O)R9, R8 и R9 независимо выбраны из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила или сиаловой кислоты;
La означает линкер, выбранный из связи, замещенного или незамещенного алкила и замещенного или незамещенного гетероалкила;
R16 и R17 означают независимо выбранные полимерные "плечи";
X2 и X4 означают независимо выбранные связывающие фрагменты, соединяющие полимерные группы R16 и R17 с С; и
X5 представляет собой нереактивную группу.
10. Способ по п.1, где указанный аминокислотный остаток выбирается из серина и треонина.
11. Способ по п.1, где указанный пептид G-CSF имеет аминокислотную последовательность SEQ ID NO:1.
12. Способ по п.11, где указанный аминокислотный остаток представляет собой треонин в положении 134 SEQ ID NO:1.
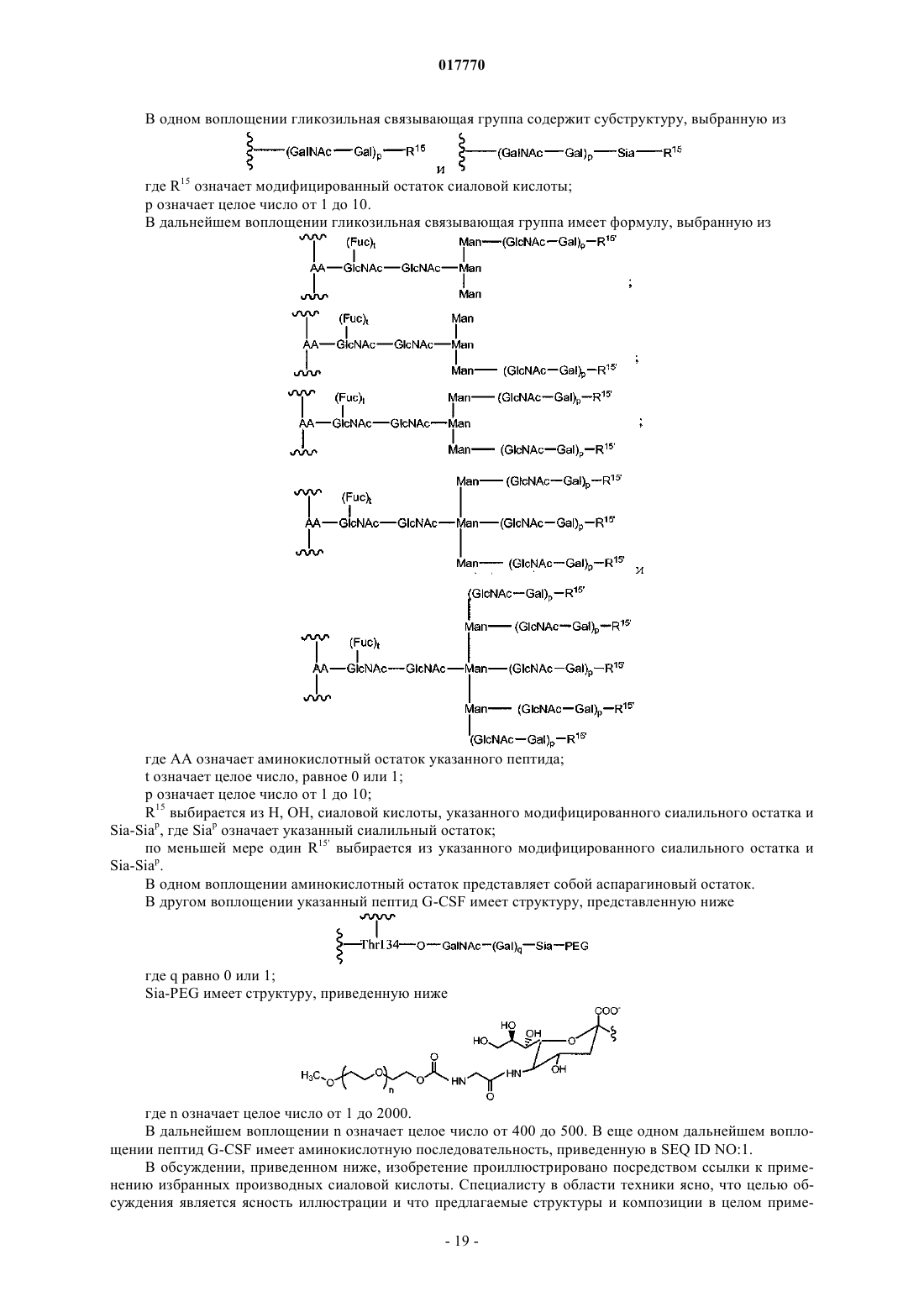
13. Способ по п.6, где указанная гликозильная связывающая группа содержит субструктуру, выбираемую из
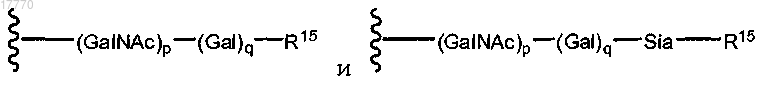
где R15 означает указанный модифицированный остаток сиаловой кислоты и
р и q означают независимые целые числа, выбираемые из 0 или 1.
14. Способ по п.13, где q равняется 0.
15. Способ по п.6, где указанная гликозильная связывающая группа имеет формулу, выбираемую из
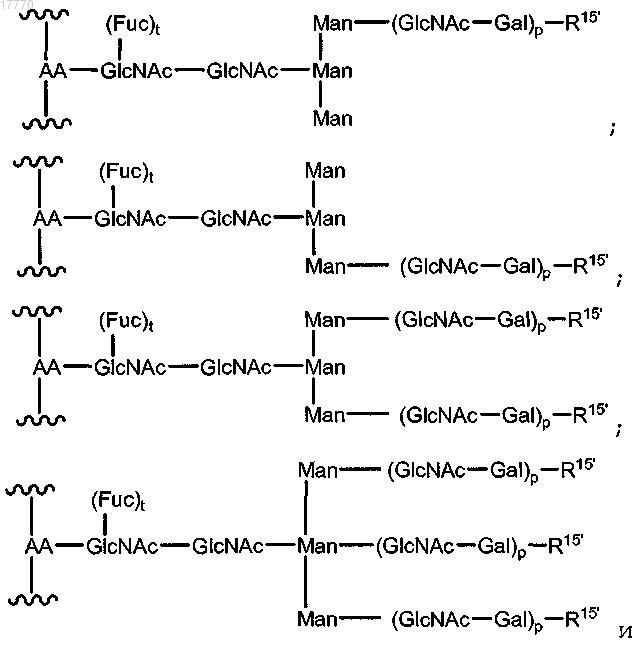
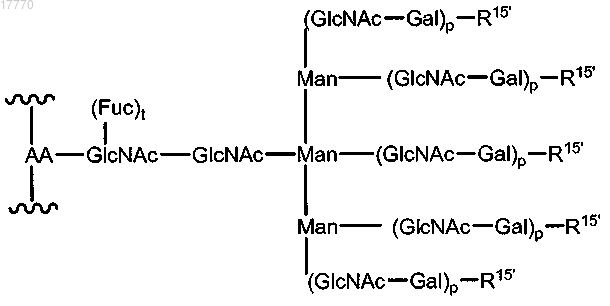
где AA означает аминокислотный остаток указанного пептида;
t означает целое число, равное 0 или 1;
р означает целое число от 1 до 10 и
R15 выбирается из Н, OH, сиаловой кислоты, указанного модифицированного сиалильного остатка и
Sia-Siap, Siap означает указанный сиалильный остаток, где по меньшей мере один R15' выбирается из указанного модифицированного сиалильного остатка и Sia-Siap.
16. Способ по п.15, где указанный аминокислотный остаток представляет собой остаток аспарагина.
17. Способ увеличения числа гранулоцитов у субъекта, где указанный субъект подходит для трансплантации костного мозга, где указанный способ включает введение указанному субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанный пептид G-CSF имеет аминокислотную последовательность, приведенную в SEQ ID NO:1, и где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду G-CSF в области указанного пептида G-CSF, начинающейся глицином в положении 126 и заканчивающейся серином в положении 143.
18. Способ повышения продукции стволовых клеток у субъекта, где указанный способ включает введение указанному субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанный пептид G-CSF включает структуру согласно формуле
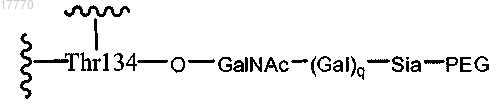
где q равно 0 или 1 и
Sia-PEG имеет структуру согласно формуле
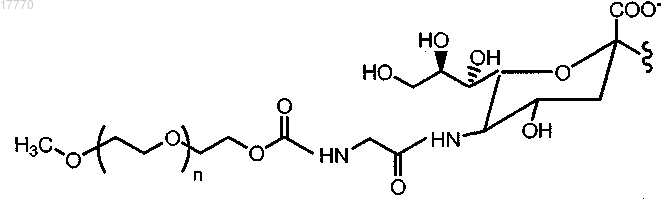
где n означает целое число от 1 до 2000.
19. Способ по п.18, где n означает целое число от 400 до 500.
20. Способ по п.18, где указанный пептид G-CSF имеет аминокислотную последовательность SEQ ID NO:1.
21. Способ предотвращения, лечения или ослабления миелосупрессии, обусловленной противораковой терапией, где указанный способ включает введение реципиенту указанной противораковой терапии эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
22. Способ по п.21, где указанная противораковая терапия выбирается из радиационной терапии и химиотерапии.
23. Способ по п.21, где указанная полимерная модифицирующая группа и указанная гликозильная связывающая группа ковалентно соединены посредством линкера.
24. Способ по п.23, где указанная гликозильная связывающая группа представляет собой остаток сиаловой кислоты, где указанный остаток сиаловой кислоты имеет структуру согласно формуле
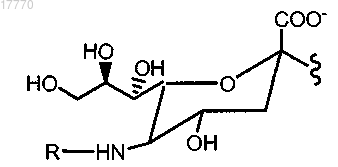
где R означает указанную полимерную модифицирующую группу, указанная полимерная модифицирующая группа присоединена к указанному остатку сиаловой кислоты посредством указанного линкера.
25. Способ лечения заболевания у субъекта, нуждающегося в лечении, где указанное заболевание характеризуется подавлением продукции белых кровяных клеток у указанного субъекта, где указанный способ включает стадию введения указанному субъекту некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы, где указанное количество эффективно для облегчения указанного заболевания у указанного субъекта.
26. Способ по п.25, где указанное подавление продукции белых кровяных клеток обусловлено химиотерапией, радиационной терапией или идиопатической тромбоцитопенической пурпурой.
27. Способ лечения нейтропении у млекопитающего, включающий введение фармацевтически эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
28. Способ лечения тромбоцитопении у млекопитающего, включающий введение фармацевтически эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
29. Способ увеличения популяции кроветворных стволовых клеток в культуре, где указанный способ включает стадию добавления к указанным стволовым клеткам эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
30. Способ повышения гематопоэза у субъекта, где указанный способ включает стадию введения указанному субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
31. Способ увеличения количества кроветворных клеток-предшественников у субъекта, где указанный способ включает введение указанному субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
32. Способ по п.31, где указанные кроветворные клетки-предшественники представляют собой клетки CD34+.
33. Способ обеспечения длительного приживления трансплантата костного мозга, где указанный способ включает:
(a) введение донору указанного костного мозга пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы;
(b) выделение указанного костного мозга из указанного донора и
(с) инфузию указанного костного мозга реципиенту.
34. Способ по п.33, где донор представляет собой то же лицо, что и реципиент.
35. Способ по п.34, где донор представляет собой лицо, отличное от реципиента.
36. Способ увеличения числа кроветворных клеток-предшественников у субъекта, где указанный способ включает введение указанному субъекту:
(a) первой композиции, содержащей соединение формулы (1), представляющее 1,1'-1,4-фенилен-бис-(метилен)-бис-1,4,8,11-тетраазациклотетрадекан (AMD3100); и
(b) второй композиции, содержащей пептид, представляющий собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы.
37. Способ по п.36, где указанная первая композиция и указанная вторая композиция вводятся последовательно и в любом порядке.
38. Способ по п.36, где указанная первая композиция и указанная вторая композиция вводятся одновременно.
39. Способ по п.36, где указанные кроветворные клетки-предшественники представляют собой клетки CD34+.
40. Дозированная форма для перорального введения, включающая компоненты:
(a) пептид, представляющий собой ковалентный конъюгат пептида G-CSF и водорастворимого полимера, где указанный водорастворимый полимер ковалентно присоединен к указанному пептиду G-CSF у гликозильного или аминокислотного остатка указанного пептида G-CSF посредством интактной гликозильной связывающей группы;
(b) поверхностно-активное вещество (вещества);
(c) жирную кислоту (кислоты);
(d) кишечно-растворимый материал,
где указанные компоненты (а) (b) и (с) смешивают в жидкой фазе и лиофилизируют перед объединением с компонентом (d).
41. Способ повышения продукции стволовых клеток у донора, включающий введение указанному донору пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы, в количестве от 1 до 20 мг.
42. Способ повышения продукции стволовых клеток у донора, включающий введение указанному донору пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы, где указанная полимерная модифицирующая группа ковалентно присоединена к указанному пептиду у гликозильного или аминокислотного остатка указанного пептида посредством гликозильной связывающей группы, в количестве, находящемся в единичной дозированной форме, выбираемой из 25, 50, 100 и 200 мкг/кг.
Текст
В изобретении представлен гликопэгилированный G-CSF, обладающий терапевтической активностью и обладающий фармакокинетическими параметрами и свойствами, улучшенными по сравнению с идентичным или близко аналогичным пептидом G-CSF, который не гликопэгилирован. Далее, в изобретении представлены способы стимуляции гематопоэза у субъекта, в особенности у субъекта, который подвергался или будет подвергаться радиационной или химической терапии. Способы и композиции согласно изобретению могут далее применяться для предотвращения,облегчения и лечения миелосупрессивных эффектов таких терапий. Перекрестные ссылки на родственные заявки По заявке на данное изобретение испрашивается приоритет согласно датам подачи предварительной заявки на патент США 60/909917, поданной 3 апреля 2007 г.; предварительной заявки на патент США 60/911788, поданной 13 апреля 2007 г.; и предварительной заявки на патент США 60/986240,поданной 7 ноября 2007 г., содержание которых полностью включено посредством ссылки в настоящее описание для любых целей. Предпосылки изобретения Гранулоцитарный колониестимулирующий фактор (G-CSF) представляет собой гликопротеин, стимулирующий выживание, пролиферацию, дифференцировку и функцию клеток-предшественников нейтрофильных гранулоцитов и зрелых нейтрофилов. Обе формы рекомбинантного человеческого G-CSF,использующиеся в клинике, представляют собой мощные стимуляторы гранулопоэза нейтрофилов, эффективные в отношении предотвращения инфекционных осложнений некоторых нейтропенических состояний. Они могут использоваться для ускорения восстановления популяции нейтрофилов после миелосупрессивных воздействий.G-CSF уменьшает болезненность противораковой химиотерапии путем снижения частоты фебрильной нейтропении, болезненность высокодозной химиотерапии с одновременной трансплантацией костного мозга, а также частоту и длительность инфекционных заболеваний у пациентов с тяжелой хронической нейтропенией. Кроме того, было показано, что G-CSF обладает терапевтическим эффектом при введении пациенту после начала инфаркта миокарда. Хорошо известно, что острая миелосупрессия вследствие цитотоксической химиотерапии является дозоограничивающим фактором при терапии рака. Также наблюдаются побочные эффекты в отношении других нормальных тканей, однако костный мозг обладает наибольшей чувствительностью по отношению к способам лечения, специфичным для пролиферирующих клеток, таким как химиотерапия и радиационная терапия. Для некоторых онкологических больных гематопоэтическая токсичность часто ограничивает возможность повышения дозы химиотерапии. Повторные или высокодозные курсы химиотерапии могут приводить к истощению пула кроветворных стволовых клеток и их потомства. Предотвращение и защита от побочных эффектов химиотерапии и радиационной терапии могут принести большую пользу онкологическим больным. Было показано, что G-CSF и другие факторы роста уменьшают тяжесть таких побочных эффектов путем увеличения количества критических клетокмишеней, в особенности кроветворных клеток-предшественников. Человеческий G-CSF был клонирован в 1986 году группами исследователей из Японии и США (см.,например, Nagata et al., Nature, 319, 415-418, 1986). Существует две формы природного человеческого гликопротеина, одна из которых содержит 175, а другая 178 аминокислот. Для разработки фармацевтических продуктов с применением технологии рекомбинантной ДНК использовалась более часто встречающаяся и более активная форма, содержащая 175 аминокислот. Рекомбинантный человеческий G-CSF, синтезированный в системе экспрессии Е.coli, называется филграстим. Структура филграстима незначительно отличается от природного гликопротеина. Другая форма человеческого рекомбинантного G-CSF называется ленограстим и синтезируется в клетках яичников китайского хомячка (CHO).hG-CSF представляет собой мономерный протеин, который димеризует рецептор G-CSF путем образования комплекса 2:2 из 2 молекул G-CSF и 2 рецепторов (Horan et al., Biochemistry, 35(15):4886-96(1996. С помощью метода рентгеновской кристаллографии были обнаружены следующие остатки в составе G-CSF, формирующие часть молекулы, взаимодействующую с рецептором: G4, P5, A6, S7, S8,L9, Р 10, Q11, S12, L15, K16, E19, Q20, L108, D109, D112, Т 115, Т 116, Q119, E122, E123 и L124 (см., например, Aritomi et al. (1999), Nature. 401:713). Имеющиеся в продаже формы rhG-CSF обладают кратковременным фармакологическим действием и часто должны вводиться пациенту более одного раза в день в продолжение лейкопенического состояния. Более долгое время полужизни молекулы в циркуляции позволило бы уменьшить количество введений, необходимых для облегчения лейкопении и предотвращения инфекций. Другая проблема имеющихся в продаже продуктов rhG-CSF заключается в возникновении дозозависимой боли в костях. Поскольку боль в костях, испытываемая пациентами, является значительным побочным эффектом терапии rhG-CSF,желательна разработка продукта rG-CSF, не вызывающего боли в костях, либо путем разработки продукта, не обладающего этим эффектов в силу своей природы или эффективности в малых дозах, недостаточных для развития боли в костях. Таким образом, очевидна необходимость разработки улучшенных рекомбинантных молекул G-CSF. Были описаны искусственно полученные варианты hG-CSF (см. патенты США 5581476, 5214132,5362853, 4904584 и Riedhaar-Olson et al., Biochemistry. 35:9034-9041, 1996). Также была описана модификация hG-CSF и других полипептидов путем введения по меньшей мере одной дополнительной углеводной цепи по сравнению с нативным полипептидом (патент США 5218092). Кроме того, были описаны и изучены полимерные модификации нативного hG-CSF, включая добавление PEG-групп (см., например,Satake-Ishikawa et al. (1992), Cell Structure and Function. 17:157; Bowen et al. (1999), Experimental Из уровня техники известно присоединение синтетических полимеров к полипептидной цепи с целью улучшения фармакокинетических свойств гликопротеиновых лекарственных средств. Типичным примером полимера, конъюгируемого с пептидами, является полиэтиленгликоль (PEG, ПЭГ). Было показано, что использование PEG для дериватизации пептидных лекарственных средств понижало иммуногенность пептидов. Например, в патенте США 4179337 (Davis et al.) раскрываются неиммуногенные полипептиды, такие как ферменты и пептидные гормоны, связанные с полиэтиленгликолем или полипропиленгликолем. Для таких пептидов, помимо пониженной иммуногенности, характерно увеличенное время клиренса из циркуляции в связи с увеличением размера конъюгатов рассматриваемых пептидов сPEG. Один метод присоединения PEG (и его производных) к пептидам представляет собой неспецифическое связывание через аминокислотный остаток пептида (см., например, патенты США 4088538,4414147, 4055635, а также РСТ WO 87/00056). Другой метод присоединения PEG к пептидам представляет собой неспецифическое окисление гликозильных остатков на гликопептиде (см., например,WO 94/05332). При использовании этих неспецифических методов полиэтиленгликоль присоединяется случайно и неспецифически к реактивным остаткам в составе пептидной цепи. Очевидно, что для случайного присоединения молекул PEG характерен ряд недостатков, включая гетерогенность конечного продукта и вероятность снижения биологической или ферментативной активности пептида. Таким образом, для производства лекарственных пептидов предпочтительна стратегия дериватизации, приводящая к получению специфически меченого, легко характеризуемого и практически гомогенного продукта. Такие способы разработаны. Специфически меченные, гомогенные пептидные лекарственные средства можно получать in vitro с помощью ферментов. В отличие от типичных неспецифических способов присоединения к пептиду синтетического полимера или другой метки, синтезы, основанные на ферментах, обладают преимуществами региоселективности и стереоселективности. Два главных класса ферментов, применимых для синтеза меченых пептидов включают гликозилтрансферазы (например, сиалилтрансферазы, олигосахарилтрансферазы, N-ацетилглюкозаминилтрансферазы) и гликозидазы. Эти ферменты можно использовать для специфического присоединения сахаров, которые далее можно модифицировать для получения лекарственного вещества. В качестве альтернативы гликозилтрансферазы и модифицированные гликозидазы могут использоваться для прямого переноса модифицированных сахаров на полипептидную цепь (см.,например, патент США 6399336 и публикации заявок на патент США 20030040037, 20040132640,20040126838 и 20040142856, каждая из которых включена в настоящее описание посредством ссылки). Также известны способы, комбинирующие элементы как химического, так и ферментативного синтеза(см., например, Yamamoto et al., Carbohydr. Res. 305:415-422 (1998) и публикацию заявки на патент США 20040137557, включенные в настоящее описание посредством ссылки). В ответ на потребность в улучшенном лекарственном G-CSF, в настоящем изобретении представлен гликопэгилированный G-CSF, обладающий терапевтической активностью, а также улучшенными фармакокинетическими параметрами и свойствами по сравнению с негликопэгилированными идентичным пептидом G-CSF или его близким аналогом. Далее в настоящем изобретении представлены способы усиления гематопоэза у субъекта, в особенности у субъекта, который получал или будет получать лечение в виде радиационной или химиотерапии. Сущность изобретения В соответствии с вышесказанным в одном аспекте в настоящем изобретении представлены способы и композиции, стимулирующие продукцию стволовых клеток у реципиента трансплантата костного мозга. Эти способы и композиции включают введение реципиенту трансплантата костного мозга некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В одном аспекте полимерная модифицирующая группа ковалентно присоединена к пептиду у гликозильного или аминокислотного остатка пептида через интактную гликозильную связывающую группу. В другом аспекте в настоящем изобретении представлены способы и композиции, увеличивающие число гранулоцитов у субъекта. Этот способ включает стадию введения субъекту некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В одном аспекте пептид G-CSF имеет аминокислотную последовательность, приведенную вSEQ ID NO:1, а полимерная модифицирующая группа ковалентно присоединена к пептиду G-CSF в области аминокислотной последовательности, начинающейся глицином в положении 126 и заканчивающейся серином в положении 143. Еще в одном аспекте в настоящем изобретении представлены способы и композиции, повышающие продукцию стволовых клеток у субъекта. Эти способы включают стадию введения субъекту некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В дальнейшем аспекте пептид G-CSF включает структуру согласно формулеSia-PEG имеет структуру согласно формуле где n означает целое число от 1 до 2000. В одном аспекте в настоящем изобретении представлены способы предотвращения, лечения или ослабления миелосупрессии, в особенности миелосупрессии, обусловленной противоопухолевой терапией. В одном аспекте этот способ включает введение реципиенту некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. В другом аспекте в настоящем изобретении представлены способы лечения заболевания у субъекта,для которого характерно подавление продукции белых кровяных клеток у субъекта. В одном аспекте способ лечения заболевания включает стадию введения субъекту некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. Количество пептида, вводимого субъекту, достаточно для эффективного облегчения состояния субъекта. Еще в одном аспекте в настоящем изобретении представлены способы лечения нейтропении у млекопитающего. Эти способы включают стадию введения фармацевтически эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. Еще в одном аспекте в настоящем изобретении представлены способы лечения тромбоцитопении у млекопитающего. Эти способы включают стадию введения фармацевтически эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. В одном аспекте в настоящем изобретении представлены способы увеличения популяции кроветворных стволовых клеток в культуре. Эти способы включают стадию добавления к культуре стволовых клеток эффективного количества пептида, представляющего собой ковалентный конъюгат пептидаG-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. В другом аспекте в настоящем изобретении представлены способы стимуляции гематопоэза у субъекта. Эти способы включают стадию введения субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептидуG-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. Еще в одном аспекте в настоящем изобретении представлены способы увеличения числа кроветворных клеток-предшественников у субъекта. Эти способы включают стадию введения субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептидаG-CSF посредством интактной гликозильной связывающей группы. В одном аспекте в настоящем изобретении представлены способы стимуляции продукции стволовых клеток у донора. Эти способы включают стадию введения донору эффективного количества пептида,представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. В другом аспекте в настоящем изобретении представлены способы повышения длительного приживления трансплантата костного мозга у реципиента. Эти способы включают стадию введения реципиенту костного мозга пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептидаG-CSF посредством интактной гликозильной связывающей группы. Еще в одном аспекте в настоящем изобретении представлены способы стимуляции кроветворных клеток-предшественников у субъекта. Эти способы включают стадию введения субъекту первой композиции, содержащей соединение формулы 1,1'-1,4-фенилен-бис-(метилен)-бис-1,4,8,11-тетраазациклотетрадекан (AMD3100) и второй композиции, содержащей пептид, представляющий собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа ковалентного конъюгата может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы. Первая и вторая композиции могут вводиться субъекту последовательно в любом порядка или одновременно. В одном аспекте в настоящем изобретении представлена дозированная форма для перорального введения. Эта дозированная форма для перорального введения может содержать следующие компоненты: (а) пептид, представляющий собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа может ковалентно присоединяться к пептидуG-CSF у гликозильного или аминокислотного остатка пептида G-CSF посредством интактной гликозильной связывающей группы; (b) поверхностно-активное вещество (вещества); (с) жирную кислоту (кислоты) и (d) кишечно-растворимый материал. В одном аспекте компоненты (а) (b) и (с) смешивают в жидкой фазе и лиофилизируют перед объединением с компонентом (d). В другом аспекте в настоящем изобретении представлен способ повышения продукции стволовых клеток у донора, где способ включает стадии введения донору некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В дальнейшем аспекте полимерная модифицирующая группа ковалентного конъюгата присоединяется к пептиду у гликозильного или аминокислотного остатка пептида посредством интактной гликозильной связывающей группы. Еще в одном аспекте изобретения количество пептида, вводимого донору, находится в интервале от 1 до приблизительно 20 мг. Еще в одном аспекте изобретения представлен способ повышения продукции стволовых клеток у донора, где способ включает стадии введения донору некоторого количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В дальнейшем аспекте полимерная модифицирующая группа присоединяется к пептиду у гликозильного или аминокислотного остатка пептида посредством интактной гликозильной связывающей группы. Еще в одном аспекте количество пептида, вводимого донору, может быть в виде единичной дозированной формы. В одном воплощении единичная доза выбирается из 25, 50, 100 и 200 мкг/кг. Описание чертежей На фиг. 1 приведены данные, относящиеся к абсолютному количеству нейтрофилов (ANC) в ответ на XM22 (25; 50; 100 мкг/кг) и нейласту (100 мкг/кг). На фиг. 2 приведены данные, относящиеся к количеству CD34+ клеток в ответ на ХМ 22 (25; 50; 100 мкг/кг) и нейласту (100 мкг/кг). Фиг. 3 представляет собой таблицу данных, относящихся к фармакокинетическим параметрам для четырех различных опытных групп. На фиг. 4 приведены данные, относящиеся к абсолютному количеству нейтрофилов (ANC) в ответ на ХМ 22 (6 мг) и нейласту (6 мг). На фиг. 5 приведены данные, относящиеся к количеству CD34+ клеток в ответ на ХМ 22 (6 мг) и нейласту (6 мг). На фиг. 6 приведены данные фармакодинамики, относящиеся к количеству нейтрофилов в ответ наG-CSF, глико-PEG-G-CSF, нейласту и контрольную композицию у яванских макак. На фиг. 7 приведены данные фармакокинетики, относящиеся к концентрации указанных композиций в плазме у яванских макак. На фиг. 8 приведена схематическая модель структуры глико-PEG-G-CSF и его рецептора. На фиг. 9 приведены данные, относящиеся к концентрации XM22 и нейласты в сыворотке крови после введения трех различных доз XM22 и 100 мкг/кг нейласты. На фиг. 10 приведены данные, относящиеся к концентрации ХМ 22 и нейласты в сыворотке крови после введения 6 мг ХМ 22 и 6 мг нейласты. Подробное описание изобретения и предпочтительных воплощений Сокращения В описании приняты следующие обозначения:"G-CSF" означает гранулоцитарный колониестимулирующий фактор. Определения. Если не определено иначе, значение всех технических и научных терминов, использующихся в настоящем описании, в целом совпадает с общепринятыми значениями, известными специалисту в области техники, к которой относится настоящее изобретение. В общем, используемые в настоящем описании номенклатура и лабораторные процедуры, относящиеся к культуре клеток, молекулярной генетике, органической химии и химии и гибридизации нуклеиновых кислот хорошо известны и широко применяются в уровне техники. Для синтеза пептидов и нуклеиновых кислот используются стандартные техники. В общем, техники и процедуры проводятся согласно общепринятым способам, известным из уровня техники и различных общих руководств (см. Sambrook et al., Molecular Cloning: A Laboratory Manual, 2-е изд.(1989), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, включенное в настоящее описание посредством ссылки), ссылки на которые приводятся в тексте настоящего документа. Используемые в настоящем описании номенклатура и лабораторные процедуры, относящиеся к аналитической химии и органическому синтезу, описанные ниже, хорошо известны и широко применяются в уровне техники. Для химических синтезов и химических анализов используются стандартные техники или их модификации. Все олигосахариды, рассмотренные в настоящем изобретении, описываются полным или сокращенным названием нередуцирующего сахарида (т.е. Gal), за которым следует конфигурация гликозидной связи ( или ), связь с кольцом (1 или 2), положение в кольце редуцирующего сахарида, участвующего в связи (2, 3, 4, 6 или 8) и полное или сокращенное название редуцирующего сахарида (например,GlcNAc). Каждый сахарид предпочтительно представляет собой пиранозу. В обзоре Essentials ofGlycobiology, ред. Varki et al., CSHL Press (1999) рассматривается общепринятая гликобиологическая номенклатура. Предполагается, что у олигосахаридов имеется редуцирующий и нередуцирующий концы независимо от того, является ли сахарид на редуцирующем конце редуцирующим сахаридом. В соответствии с принятой номенклатурой в настоящем изобретении олигосахариды изображаются с нередуцирующим концом слева и редуцирующим концом справа. Термин "сиаловая кислота" относится к любому представителю семейства девятиуглеродных карбоксилированных сахаров. Наиболее часто встречающийся представитель семейства сиаловых кислот представляет собой N-ацетилнейраминовую кислоту (2-кето-5-ацетамидо-3,5-дидезокси-D-глицеро-Dгалактононулопираноз-1-оновую кислоту (часто сокращается до Neu5Ac, NeuAc или NANA). Второй представитель семейства представляет собой N-гликолилнейраминовую кислоту (Neu5Gc или NeuGc),где N-ацетильная группа NeuAc гидроксилирована. Третий представитель семейства сиаловых кислот представляет собой 2-кето-3-дезоксинонулозоновую кислоту (KDN) (Nadano et al. (1986), J. Biol. Chem. 261:11550-11557; Kanamori et al., J. Biol. Chem. 265:21811-21819 (1990. Также сюда включаются 9-замещенные сиаловые кислоты, такие как 9-O-C1-C6-ацил-Neu5Ac, как 9-O-лактил-Neu5Ac или 9-О-ацетил-Neu5Ac, 9-дезокси-9-фтор-Neu5Ac и 9-азидо-9-дезокси-Neu5Ac. См. обзор семейства сиаловых кислот Varki, Glycobiology. 2:25-40 (1992), Sialic Acids: Chemistry, Metabolism and Function, ред.R. Schauer (Springer-Verlag, New York (1992. Синтез и использование соединений сиаловых кислот в процедуре сиализации раскрыты в заявке на международный патент WO 92/16640, опубликованной 1 октября 1992 г. Термин "пептид" обозначает полимер, который состоит из мономеров-аминокислот, связанных между собой амидными связями, также называемый полипептидом. Кроме того, сюда включаются неприродные аминокислоты, такие как -аланин, фенилглицин и гомоаргинин. Также в настоящем изобретении могут использоваться аминокислоты, не кодируемые генами. Далее, в настоящем изобретении могут использоваться модифицированные аминокислоты, содержащие реактивные группы, сайты гликозилирования, полимеры, лекарственные вещества, биомолекулы и т.д. Все аминокислоты, использующиеся в настоящем изобретении, могут представлять собой как D-, так и L-изомеры. В общем случае предпочтителен L-изомер. Кроме того, в настоящем изобретении могут использоваться другие пептидомиметики. При использовании в настоящем описании "пептид" обозначает как гликозилированные, так и негликозилированные пептиды. Также сюда включаются пептиды, не полностью гликозилируемые в системе экспрессии пептида. См. обзор Spatola et al., в Chemistry and Biochemistry of Amino Acids, Peptides andProteins, ред. В. Weinstein, Marcel Dekker, New York, с. 267 (1983). Аминокислотная или нуклеотидная последовательность пептида "гомологична" другой последовательности, если они до некоторой степени идентичны. Предпочтительно, чтобы гомологичная последовательность была по меньшей мере приблизительно на 85% идентична эталонной последовательности,предпочтительно идентична приблизительно на 90-100%, более предпочтительно идентична по меньшей мере приблизительно на 91%, идентична по меньшей мере приблизительно на 92%, идентична по меньшей мере приблизительно на 93%, идентична по меньшей мере приблизительно на 94%, еще более предпочтительно идентична по меньшей мере приблизительно на 95-99%, предпочтительно идентична по меньшей мере приблизительно на 96%, идентична по меньшей мере приблизительно на 97%, идентична по меньшей мере приблизительно на 98%, еще более предпочтительно идентична по меньшей мере приблизительно на 99% и идентична приблизительно на 100% референской аминокислотной или нуклеотидной последовательности. Термин "конъюгат пептида" относится к разновидности изобретения, где пептид конъюгируется с модифицированным сахаром, как описано в настоящем изобретении. Термин "аминокислота" относится к природным и синтетическим аминокислотам, а также к производным и миметикам аминокислот, имеющим сходную функцию с природными аминокислотами. Природными аминокислотами являются аминокислоты, кодируемые генетическим кодом, а также аминокислоты, подвергающиеся последующей модификации, например гидроксипролин, -карбоксиглутамат и О-фосфосерин. Аналоги аминокислот обозначают соединения, имеющие базовую химическую структуру, идентичную природным аминокислотам, т.е. содержащие -углеродный атом с присоединенными водородом, карбоксильной группой, аминогруппой и R-группой, т.е. гомосерин, норлейцин, метионин сульфоксид, метионин метилсульфоний. Такие аналоги имеют модифицированные R-группы (например,норлейцин) или модифицированные пептидные цепи, но сохраняют базовую химическую структуру,идентичную природным аминокислотам. Аминокислотные миметики обозначают химические соединения, которые имеют структуру, отличающуюся от базовой химической структуры аминокислот, но чья функция сходна с функцией природных аминокислот. При использовании в настоящем описании термин "модифицированный сахар" обозначает природный или неприродный сахар, присоединенный ферментативным способом к аминокислотному или гликозильному остатку пептида в способе настоящего изобретения. Модифицированный сахар выбирают из субстратов ферментов, включая, но не ограничиваясь, нуклеотиды сахаров (моно-, ди- и трифосфаты),активированные сахара, (например, гликозилгалиды, гликозилмезилаты) и сахара, которые не являются ни активированными, ни нуклеотидами сахаров. "Модифицированный сахар" ковалентно функционализирован "модифицирующей группой". Применимые модифицирующие группы включают, но не ограничиваются, фрагменты PEG, лекарственные фрагменты, диагностические фрагменты, биомолекулы и т.д. Модифицирующая группа предпочтительно представляет собой неприродный или немодифицированный сахар. Точка функционализации модифицирующей группой выбирается таким образом, чтобы она не препятствовала присоединению "модифицированного сахара" ферментативным путем к пептиду. Термин "водорастворимый" означает фрагменты, обладающие некоторой обнаруживаемой растворимостью в воде. Способы обнаружения и/или измерения растворимости в воде хорошо известны из уровня техники. Типичные водорастворимые полимеры включают пептиды, сахариды, полиэфиры, полиамины, поликарбоксокислоты и т.д. Пептиды могут иметь смещаемые последовательности или состоять из одной аминокислоты, как, например, полилизин. Типичным полисахаридом является полисиаловая кислота. Типичным полимером является полиэтиленгликоль. Полиэтиленимин представляет собой типичный полиамин, и полиакриловая кислота представляет собой типичную поликарбоновую кислоту. Полимерная цепь водорастворимого полимера может представлять собой полиэтиленгликоль (т.е.PEG). Однако следует понимать, что другие родственные полимеры также применимы в настоящем изобретении и что в этой связи термин PEG или полиэтиленгликоль является включающим, а не отличающим. Термин PEG включает полиэтиленгликоль в любой форме, включая алкокси-PEG, дифункциональный PEG, многоплечий PEG, раздвоенный PEG, разветвленный PEG, подвешенный PEG (т.е. PEG или родственные полимеры, чья одна или более функциональных групп подвешены на полимерной цепи) илиPEG, содержащий разрушаемые связи. Полимерная цепь может быть линейной или разветвленной. Разветвленные полимерные цепи известны из уровня техники. Обычно разветвленный полимер состоит из центральной части и множества линейных полимерных цепей, связанных с центральной частью. Обычно используют разветвленные формы PEG, получаемые путем добавления этиленоксида к различным полиолам, таким как глицерин, пентаэритрит и сорбит. Центральная часть также может состоять из нескольких аминокислот, таких как лизин. Разветвленный полиэтиленгликоль может в общем быть представлен формулой R(-PEG-OH)m, где R обозначает центральную часть, такую как глицерин или пентаэритрит, a m обозначает количество ветвей. Также в качестве полимерной цепи могут использоваться многоплечие молекулы PEG, такие как описанные в патенте США 5932462, полностью включенном в настоящее описание посредством ссылки. В настоящем изобретении могут использоваться многие другие полимеры. В особенности применимы в настоящем изобретении непептидные водорастворимые полимерные цепи, имеющие от 2 до 300 концов. Примеры применимых полимеров включают, но не ограничиваются, другиеи полиалкиленгликоли, такие как полипропиленгликоль ("PPG"), сополимеры этиленгликоля и пропиленгликоля и им подобные, полиоксиэтилированный полиол, полиолефиновый спирт, поливинилпирролидон, полигидроксипропилметакриламид, полигидроксикислота, поливиниловый спирт, полифосфазен, полиоксазолин, поли-N-акрилоилморфолин, такой как описан в патенте США 5629384, полностью включенном в настоящее описание посредством ссылки, а также их сополимеры, терполимеры и их смеси. Несмотря на то что молекулярный вес полимерных цепей может различаться, обычно он находится в интервале от приблизительно 100 до приблизительно 100000 Да, часто от приблизительно 6000 до приблизительно 80000 Да. При употреблении в настоящем описании в контексте введения пептидного лекарственного препарата пациенту "площадь под кривой" ("AUC") определяется как полная площадь под кривой, описывающей концентрацию лекарственного препарата в системном кровотоке пациента как функцию от времени от нуля до бесконечности. При употреблении в настоящем описании в контексте введения пептидного лекарственного препарата пациенту термин "время полужизни" или "t1/2" определяется как время, необходимое для уменьшения наполовину концентрации лекарственного препарата в плазме крови пациента. Для одного и того же пептидного лекарственного препарата может существовать несколько различных времен полужизни в зависимости от множественных механизмов клиренса, перераспределения и других механизмов, хорошо известных из уровня техники. Обычно -время полужизни и -время полужизни определяются таким образом, что -фаза оказывается связанной с перераспределением, а -фаза - с клиренсом. Однако для белковых лекарственных препаратов, которые по большей части не покидают кровотока, может существовать по меньшей мере два времени полужизни, связанных с клиренсом. Для некоторых гликозилированных пептидов быстрый клиренс во время -фазы может быть опосредован рецепторами на макрофагах или эндотелиальных клетках, распознающими терминальные галактозу, N-ацетилгалактозамин,N-ацетилглюкозамин, маннозу или фукозу. Более медленное выведение в -фазе может быть обусловлено клубочковой фильтрацией в почках молекул, имеющих эффективный радиус 2 нм (приблизительно 68 кДа) и/или специфическими или неспецифическими поглощением и метаболизмом в тканях. Гликопэгилирование может кэпировать терминальные сахара (например, галактозу или N-ацетилгалактозамин) и таким образом блокировать быстрый клиренс в -фазе посредством рецепторов, распознающих эти сахара. Также оно может увеличивать эффективный радиус молекулы и таким образом ослаблять ее распределение и поглощение тканями, что приводит к удлинению поздней -фазы. Таким образом, точный механизм влияния гликопэгилирования на время полужизни в -фазе и -фазе может варьировать в зависимости от размера, степени гликозилирования и других параметров, как хорошо известно из уровня техники. Более подробное разъяснение термина "время полужизни" см. Pharmaceutical Biotechnology (1997,ред. DFA Crommelin и RD Sindelar, Harwood Publishers, Amsterdam, p. 101-120). При использовании в настоящем описании термин "гликоконъюгирование" означает конъюгирование ферментативным путем модифицированного сахара с аминокислотным или гликозильным остатком полипептида, например пептида G-CSF согласно настоящему изобретению. Подвидом "гликоконъюгирования" является "гликопэгилирование", где модифицирующая группа модифицированного сахара представляет собой полиэтиленгликоль и его алкильные (например, m-PEG) или реактивные (например,H2N-PEG, HOOC-PEG) производные. Термины "крупномасштабный" и "в промышленных масштабах" употребляются взаимозаменяемо и означают цикл реакций, выход которого составляет по меньшей мере приблизительно 250 мг, предпочтительно по меньшей мере приблизительно 500 мг и более предпочтительно по меньшей мере приблизительно 1 г гликоконъюгата по завершении одного цикла реакций. При использовании в настоящем описании термин "гликозильная связывающая группа" означает гликозильный остаток, к которому ковалентно присоединена модифицирующая группа (например, молекула PEG, лекарственное вещество, биомолекула); гликозильная связывающая группа связывает модифицирующую группу с другой частью конъюгата. В способах согласно изобретению "гликозильная свя-7 017770 зывающая группа" ковалентно присоединяется к гликозилированному или негликозилированному пептиду, таким образом связывая агент с аминокислотным и/или гликозильным остатком в составе пептида."Гликозильную связывающую группу" обычно получают из "модифицированного сахара" путем ферментативного связывания "модифицированного сахара" с аминокислотным и/или гликозильным остатком в составе пептида. Гликозильная связывающая группа может представлять собой структуру, полученную из сахарида, распадающегося в процессе образования кассеты модифицирующая группамодифицированный сахар (например, окислениеобразование основания Шиффавосстановление),или гликозильная связывающая группа может оставаться интактной. "Интактная гликозильная связывающая группа" означает связывающую группу, полученную из гликозильной группы, где мономер сахарида, связывающий модифицирующую группу и остальную часть конъюгата, не разрушен, например,путем окисления, например, метаперйодатом натрия. "Интактные гликозильные связывающие группы" согласно изобретению могут быть получены из природного олигосахарида путем добавления гликозильной единицы (единиц) или отщепления одной или более гликозидных единиц от исходной полисахаридной структуры. При использовании в настоящем описании термин "нацеливающий фрагмент" означает фрагмент,селективно локализующийся в определенной ткани или отделе тела. Локализация опосредуется специфическим узнаванием молекулярных детерминант, размером молекулы нацеливающего агента или конъюгата, ионными взаимодействиями, гидрофобными взаимодействиями и т.д. Специалистам в уровне техники известны и другие механизмы нацеливания агента в определенную ткань или отдел тела. Типичные нацеливающие фрагменты включают антитела, фрагменты антител, трансферрин, HS-гликопротеин,факторы свертывания крови, белки сыворотки, -гликопротеин, G-CSF, GM-CSF, M-CSF, EPO и др. При использовании в настоящем описании термин "лекарственный фрагмент" означает любой фрагмент, пригодный для терапии, включая, но не ограничиваясь, антитела, противовоспалительные вещества, противоопухолевые вещества, цитотоксины и радиоактивные вещества. "Лекарственный фрагмент" включает пролекарства биоактивных веществ, конструкты, в составе которых несколько лекарственных фрагментов связано с носителем, например мультивалентные агенты. Лекарственный фрагмент также включает белки и конструкты, включающие белки. Типичные белки включают, но не ограничиваются,гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарномакрофагальный колониестимулирующий фактор (GMCSF), интерферон (например, интерфероном , , ), интерлейкин (например, интерлейкин II), белки сыворотки (например, факторы VII, VIIa, VIII, IX и X), человеческий хорионический гонадотропин (HCG), фолликулостимулирующий гормон (FSH) и лютеинизирующий гормон(LH), а также белки, слитые с антителами (например, рецептор фактора некроза опухоли (TNFR), слитый с доменом Fc). При использовании в настоящем описании термин "фармацевтически приемлемый носитель" включает любой материал, при комбинации с которым конъюгат сохраняет активность и не реагирует с иммунной системой субъекта. Примеры включают, но не ограничиваются, любые общепринятые фармацевтические носители, такие как физиологический раствор, забуференный фосфатом, вода, эмульсии, такие как водно-масляная эмульсия, и различные типы смачивающих средств. Другие носители могут также включать стерильные растворы, таблетки, включая таблетки, покрытые оболочкой, и капсулы. Обычно такие носители содержат эксципиенты, такие как крахмал, молоко, сахар, некоторые типы глин, желатин,стеаровая кислота или ее соли, стеарат магния или кальция, тальк, растительные жиры или масла, камеди, гликоли или другие известные эксципиенты. Такие носители могут также включать вкусовые добавки или красители и другие ингредиенты. Композиции, содержащие такие носители, могут быть составлены с помощью широко известных общепринятых методов. При использовании в настоящем описании термин "введение" означает пероральное введение, введение в виде суппозиториев, местный контакт, внутривенное, внутрибрюшинное, внутримышечное введение, введение внутрь пораженных тканей, интраназальное или подкожное введение или имплантация субъекту устройства медленного высвобождения, например, мини-осмотического насоса. Введение может осуществляться любым путем, включая парентеральный и трансмукозальный (т.е. пероральный, назальный, вагинальный, ректальный или трансдермальный). Парентеральное введение включает, например, внутривенное, внутримышечное, внутриартериолярное, интрадермальное, подкожное, внутрибрюшинное, внутрижелудочковое и интракраниальное введение. Далее, когда инъекция проводится с целью терапии опухоли, т.е способна вызывать апоптоз, введение может проводиться непосредственно в опухоль и/или в ткани, окружающие опухоль. Другие способы доставки включают, но не ограничиваются,использование липосомальных препаратов, внутривенной инфузии, трансдермальных пластырей и т.д. При использовании в настоящем описании термин "уменьшить интенсивность" или "уменьшение интенсивности" означает любые признаки успеха лечения патологии или заболевания, включая любые объективные или субъективные параметры, такие как ослабление, понижение или уменьшение симптомов или улучшение физического или психического здоровья пациента. Термин "терапия" означает "лечение" заболевания или состояния, включая предотвращение возникновения заболевания или состояния у животного, которое может быть предрасположено к данному заболеванию, но пока не испытывает или не демонстрирует симптомы заболевания (профилактическое лечение), подавление заболевания (замедление или остановка его развития), облегчение симптомов или побочных эффектов заболевания (включая паллиативную терапию) и излечение заболевания (регрессия заболевания). Термин "эффективное количество", или "количество, эффективное для", или "терапевтически эффективное количество", или любой грамматический эквивалент означает количество, которое при введении животному для лечения заболевания, оказывается достаточным для эффективного лечения заболевания. Термин "выделенный" относится к материалу, достаточно или полностью свободному от компонентов, используемых для производства этого материала. Для пептидных конъюгатов согласно изобретению термин "выделенный" относится к материалу, достаточно или полностью свободному от компонентов,которые обычно соседствуют с материалом в смеси, используемой для получения пептидного конъюгата."Выделенный" и "чистый" употребляются взаимозаменяемо. Обычно выделенные пептидные конъюгаты согласно изобретению имеют уровень чистоты, предпочтительно выражаемый в виде интервала. Обычно нижнее значение интервала чистоты пептидных конъюгатов равно приблизительно 60%, приблизительно 70% или приблизительно 80% и верхнее значение интервала чистоты равно приблизительно 70%, приблизительно 80% или более чем приблизительно 90%. Если чистота пептидных конъюгатов составляет более чем приблизительно 90%, их чистота также предпочтительно выражается интервалом. Обычно нижнее значение интервала равно приблизительно 90%, приблизительно 92%, приблизительно 94%, приблизительно 96% или приблизительно 98%. Верхнее значение интервала чистоты равно приблизительно 92%, приблизительно 94%, приблизительно 96%,приблизительно 98% или приблизительно 100%. Чистоту определяют с помощью аналитических методов, известных из уровня техники (например,интенсивность полосы на геле, окрашенном серебром, электрофорез в полиакриламидном геле, ВЭЖХ или сходные методы). При использовании в настоящем описании "практически каждый представитель популяции" описывает характеристику популяции пептидных конъюгатов согласно изобретению, в которой определенный процент модифицированных сахаров, присоединяемых к пептиду, присоединяется к множественным идентичным акцепторным сайтам в составе пептида. "Практически каждый представитель популяции" относится к "гомогенности" сайтов в составе пептида, конъюгированного с модифицированным сахаром,и означает конъюгаты согласно изобретению гомогенные по меньшей мере приблизительно на 80%,предпочтительно по меньшей мере приблизительно 90% и более предпочтительно по меньшей мере на приблизительно 95%. "Гомогенность" означает постоянство структуры в популяции акцепторных групп,с которыми конъюгируются модифицированные сахара. Таким образом, если в пептидном конъюгате согласно изобретению каждый модифицированный сахар конъюгирован с акцепторным сайтом, имеющим ту же структуру, что и акцепторные сайты, с которыми конъюгированы все остальные модифицированные сахара, говорят, что такой конъюгат гомогенен на 100%. Гомогенность обычно выражается в виде интервала. Нижнее значение интервала гомогенности пептидных конъюгатов равно приблизительно 60%, приблизительно 70% или приблизительно 80% и верхнее значение интервала гомогенности равно приблизительно 70%, приблизительно 80% или более чем приблизительно 90%. Если гомогенность пептидных конъюгатов составляет не менее приблизительно 90%, их чистота также предпочтительно выражается интервалом. Обычно нижнее значение интервала равно приблизительно 90%, приблизительно 92%, приблизительно 94%, приблизительно 96%, или приблизительно 98%. Верхнее значение интервала чистоты равно приблизительно 92%, приблизительно 94%, приблизительно 96%, приблизительно 98% или приблизительно 100%. Чистоту пептидных конъюгатов обычно определяют с помощью одного или более методов, известных специалистам в уровне техники (например, жидкостная хроматография-масс-спектрометрия (LC-MS) или матричная лазерная десорбционная ионизационая времяпролетная масс-спектрометрия (matrix assisted laser desorption mass time of flight"Достаточно однородная гликоформа" или "достаточно однородный паттерн гликозилирования" при описании гликопептида означает процент акцепторных групп, гликозилированных рассматриваемой гликозилтрансферазой (например, фукозилтрансферазой). Например, в случае 1,2-фукозилтрансферазы,наблюдается достаточно однородный паттерн фукозилирования, если в пептидном конъюгате согласно изобретению практически все (как определено ниже) молекулы Gal1,4-GlcNAc-R и их сиализованные аналоги фукозилированы. В фукозилированных структурах, описанных ниже, связь Fuc-GlcNAc обычно представляет собой связь 1,6 или 1,3, причем в общем случае предпочтительна связь 1,6. Специалисту в области техники следует понимать, что исходный материал может содержать гликозилированные акцепторные группы (например, фукозилированные группы Gal1,4-GlcNAc-R). Это означает, что вычисленный процент гликозилирования будет включать как акцепторные группы, гликозилированные способами согласно настоящему изобретению, так и акцепторные группы, находящиеся в гликозилированном состоянии в исходном материале. Термин "достаточно" в вышеприведенных определениях "достаточно однородного" в общем случае означает, что гликозилированы по меньшей мере приблизительно 40%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или более предпочтительно по меньшей мере приблизительно 90% и еще более предпочтительно по меньшей мере приблизительно 95% акцепторных групп данной гликозилтрансферазы. При описании замещающих групп с помощью общепринятых химических формул формулы, записанные слева направо, также распространяются на химически идентичные замещающие группы, полученные при написании формулы справа налево, т.е., например, -CH2O- может быть также записано как-OCH2-. Если не указано иначе, термин "алкил" по отдельности или в составе другой замещающей группы означает прямую или разветвленную цепь, или циклический углеводородный радикал, или их комбинацию, которая может быть полностью насыщенной, моно- или полиненасыщенной и может включать дии мультивалентные радикалы, содержащие указанное число атомов углерода (т.е. C1-C10 означает от 1 до 10 атомов углерода). Примеры насыщенных углеводородных радикалов включают, но не ограничиваются, такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, циклогексилметил, циклопропилметил, гомологи и изомеры, например, н-пентила, н-гексила,н-гептила, н-октила и т.д. Ненасыщенной алкильной группой называется группа, содержащая одну или более двойных или тройных связей. Примеры ненасыщенных алкильных групп включают, но не ограничиваются, винил, 2-пропенил, кротил, 2-изопентенил, 2-бутадиенил, 2,4-пентадиенил, 3-(1,4 пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Если не указано иначе,термин "алкил" также включает алкильные производные, более детально описанные ниже, такие как "гетероалкилы". Алкильные группы, ограничивающиеся углеводородными группами, называются "гомоалкилы". Термин "алкилен" по отдельности или в составе другой замещающей группы означает бивалентный радикал, полученный из алкана, как видно из неограничивающего примера -CH2CH2CH2CH2- и далее включает "гетероалкиленовые" группы, описанные ниже. В общем случае алкильная (или алкиленовая) группа содержит от 1 до 24 атомов углерода, при этом для настоящего изобретения предпочтительными являются группы, содержащие 10 или меньше атомов углерода. "Низший алкил" или "низший алкилен" означает алкильную или алкиленовую группу с более короткой цепью, обычно содержащую 8 или меньше атомов углерода. Термины "алкокси", "алкиламино" и "алкилтио" (или тиоалкокси) употребляются в своем общепринятом смысле и означают алкильные группы, присоединенные к остальной части молекулы через атом кислорода, аминогруппу или атом серы соответственно. Термин "гетероалкил" по отдельности или в комбинации с другим термином означает, если не указано иначе, стабильную линейную или разветвленную цепь, или циклический углеводородный радикал,или их комбинацию, содержащую указанное число атомов углерода и по меньшей мере один гетероатом,выбранный из группы, состоящей из О, N, Si и S, где атомы азота и серы могут необязательно находиться в окисленной форме, и гетероатом азота может необязательно находиться в четвертичной форме. Гетероатом (гетероатомы) О, N, S и Si могут находиться в любом внутреннем положении гетероалкильной группы или в положении, в котором алкильная группа присоединяется к остальной части молекулы. Примеры включают, но не ограничиваются, -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3,-CH2-S-CH2-CH3, -CH2-CH2-S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-О-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 и -CH=CH-N(CH3)-CH3. До двух гетероатомов могут располагаться последовательно, например,-CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Сходным образом, термин "гетероалкилен" по отдельности или в составе другой замещающей группы означает бивалентный радикал, полученный из гетероалкила, как видно из неограничивающего примера -CH2-CH2-S-CH2-CH2- и -CH2-S-CH2-CH2-CH2-. В гетероалкиленовых группах гетероатомы также могут занимать одно или оба крайних положения (например, алкиленокси,алкилендиокси, алкиленамино, алкилендиамино и т.д.). Далее, для алкиленовых и гетероалкиленовых связывающих групп направление записи формулы связывающей группы не определяет ориентации связывающей группы. Например, формула -C(O)2R'- означает как -C(O)2R'-, так и -R'C(O)2-. Термин "циклоалкил" и "гетероциклоалкил" по отдельности или в комбинации с другими терминами означают, если не указано иначе, циклические формы "алкила" и "гетероалкила" соответственно. Кроме того, в циклоалкиле гетероатом может занимать положение, в котором гетероцикл присоединен к остальной части молекулы. Примеры циклоалкилов включают, но не ограничиваются, циклопентил,циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.д. Примеры гетероциклоалкилов включают, но не ограничиваются, 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил,3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.д. Термин "гало" или "галоген" по отдельности или в составе другой замещающей группы означает,если не указано иначе, атом фтора, хлора, брома или йода. Кроме того, термины, такие как "галогенал- 10017770 кил", включают моногалогеналкил и полигалогеналкил. Например, термин "галоген(C1-C4)алкил" включает, но не ограничивается, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромопропил и т.д. Термин "арил" означает, если не указано иначе, полиненасыщенную ароматическую замещающую группу, которая может состоять из одного или нескольких колец (предпочтительно от 1 до 3 колец), конденсированных или ковалентно связанных. Термин "гетероарил" означает арильные группы (или кольца), содержащие от 1 до 4 гетероатомов, выбранных из N, О и S, где атомы азота и серы необязательно находятся в окисленном состоянии и атом (атомы) азота необязательно находятся в четвертичном состоянии. Гетероарильная группа может присоединяться к остальной части молекулы через гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил,4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил,2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил,5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил,3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил,5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил, тетразолил, бензо[b]фуранил, бензо[b]тиенил, 2,3-дигидробензо[1,4]диоксин-6-ил, бензо[1,3]диоксол-5-ил и 6-хинолил. Замещающие группы для каждой из указанных кольцевых систем выбираются из группы приемлемых замещающих групп, описанных ниже. Для краткости, при употреблении термина "арил" в комбинации с другими терминами (например,арилокси, арилтиокси, арилалкил) термин включает как арильные, так и гетероарильные кольца, как определено выше. Таким образом, термин "арилалкил" включает радикалы, где арильная группа присоединена к алкильной группе (т.е. бензил, фенэтил, пиридилметил и т.д.), включая алкильные группы, в которых атом углерода (например, метиленовая группа) замещен, например, атомом кислорода (например,феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.д.). Все термины, приведенные выше (т.е. "алкил", "гетероалкил", "арил" и "гетероарил"), включают как замещенную, так и незамещенную форму указанного радикала. Предпочтительные замещающие группы для каждого из радикалов приведены ниже. Замещающие группы для арильных и гетероарильных радикалов (включая группы, часто обозначаемые как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил,циклоалкенил и гетероциклоалкенил) имеют обобщающее название "алкильные замещающие группы" и могут представлять собой одну или более различных групп, выбранных из неограничивающего перечня:-OR', =O, =NR', =N-OR', =NR'R, -галоген, -SiR'RR, -OC(O)R', -C(O)R', -CO2R', -CONR'R,-OC(O)NR'R, -NRC(O)R', -NR'-C(O)NRR, -NRC(O)2R', -NR-C(NR'R"R)=NR, -NR-C(NR'R)=NR,-S(O)R', -S(O)2R', -S(O)2NR'R, -NRSO2R', -CN и -NO2, в количестве, варьирующем от 0 до (2m'+1),где m' - суммарное число атомов углерода в каждом радикале; R', R, R и R, каждый независимо,предпочтительно означают водород, замещенный или незамещенный гетероалкил, замещенный или незамещенный арил, например арил, замещенный 1-3 галогенами, замещенные или незамещенные алкильные, алкоксильные или тиоалкокси группы или арилалкильные группы. Когда вещество согласно изобретению включает более одной R-группы, например каждая из R-групп выбирается независимо, так же как и каждая группа из R', R, R и R, если присутствует более одной такой группы. Если R' и R связаны с одним и тем же атомом азота, они могут комбинироваться с атомом азота в 5-, 6- или 7-членное кольцо. Например, -NR'R" означает, но не ограничивается, 1-пирролидинил и 4-морфолинил. Из вышеприведенного обсуждения замещающих групп специалисту в области техники ясно, что термин "алкил" включает группы, содержащие атомы углерода, связанные с группами, отличающимися от атомов водорода, такими как галогеналкильные (например, -CF3 и -CH2CF3) и ацильные (например, -С(О)CH3,-C(O)CF3, -C(O)CH2OCH3 и т.д.). Так же как замещающие группы, описанные для алкильного радикала, замещающие группы для арильных и гетероарильных групп имеют обобщающее название "арильные замещающие группы". Замещающие группы выбираются, например, из галогена, -OR', =O, =NR', =N-OR', -NR'R, - SR', -галогена,-SiR'RR, -OC(O)R', -C(O)R', -CO2R', -CONR'R, -ОС(O)NR'R, -NRC(O)R', -NR'-C(O)NR"R,-NRC(O)2R', -NR-C (NR'RR)=NR, -NR-C(NR'R)=NR, -S(O)R', -S(O)2R', -S(O)2NR'R, -NRSO2R', -CN и -NO2, -R', -N3, -CH(Ph)2, фтор(C1-C4)алкокси и фтор(C1-C4)алкил в количестве, варьирующем от нуля до суммарного числа свободных валентностей ароматического кольца, где R', R, R и R, каждый независимо, предпочтительно означают водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Когда вещество согласно изобретению включает более одной R-группы, например, каждая изR-групп выбирается независимо, так же как и каждая группа из R', R, R и R, если присутствует более одной такой группы. В схемах, приведенных ниже, символ X означает "R", как описано выше. Две замещающие группы на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены замещающей группой вида -Т-C(О)-(CRR')u-U-, где Т и U незасисимо представляют собой -NR-, -O-, -CRR1- или одинарную связь и u представляет собой целое число от 0 до 3. В качестве альтернативы две замещающие группы на соседних атомах арильного или гетероарильного кольца могут необязательно заменяться замещающими группами вида -А-(CH2)r-B-, где А и В независимо пред- 11017770 ставляют собой -CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или одинарную связь; а r означает целое число от 1 до 4. Одна из одинарных связей вновь образованного кольца может необязательно заменяться двойной связью. В качестве альтернативы две замещающие группы на соседних атомах арильного или гетероарильного кольца могут необязательно заменяться замещающими группами вида-(CRR')z-X-(CR"R)d-, где z и d независимо означают целые числа от 0 до 3, а X означает -O-, -NR'-, -S-,-S(O)-, -S(O)2- или -S(O)2NR'-. Замещающие группы R, R', R и R предпочтительно выбираются независимо из водорода или замещенного или незамещенного (C1-C6)алкила. При использовании в настоящем описании термин "гетероатом" включает кислород (О), азот (N),серу (S) и кремний (Si). Термин "стволовые клетки" означает "мультипотентные" или недифференцированные клетки, способные к неограниченному самокопированию и дифференцировке в различные ткани тела. Стволовые клетки могут дифференцироваться в нормальные компоненты крови, включая красные кровяные клетки,белые кровяные клетки и тромбоциты. Стволовые клетки, как правило, локализуются в костном мозге и в крови и могут быть извлечены для трансплантации. Термин "кроветворная клетка" означает клетку, связанную с образованием клеток крови. Термин может употребляться взаимозаменяемо с определенным выше термином "стволовые клетки". При использовании в настоящем описании термин "стимуляция продукции стволовых клеток" включает все процессы, увеличивающие число стволовых клеток in vivo или in vitro. Большее число стволовых клеток может быть обусловлено увеличением числа клеток-предшественников. Термин также включает процессы транспорта стволовых клеток в костный мозг и из костного мозга. Сходным образом, термин "стимуляция продукции кроветворных стволовых клеток" включает все процессы, увеличивающие число кроветворных клеток in vivo или in vitro. Большее число кроветворных клеток может быть обусловлено большим количеством клеток-предшественников, ускорением созревания плюрипотентных стволовых клеток в кроветворные клетки или их комбинацией. Термин также включает процессы транспорта кроветворных клеток в костный мозг и из костного мозга. Термин "гранулоциты" означает белые кровяные клетки, для которых характерно присутствие гранул в цитоплазме. Введение. Настоящее изобретение охватывает способы введения гликопэгилированного G-CSF с целью предотвращения, облегчения симптомов или лечения заболеваний и состояний, связанных с дефицитом кроветворения, часто обусловленным химиотерапией, радиационной терапией и тромбоцитопенией. G-CSF в основном действует на костный мозг, стимулируя продукцию воспалительных лейкоцитов, и далее действует как эндокринный гормон, инициирующий замещение нейтрофилов, выработанных в ходе воспалительных функций. G-CSF также находит применение в клинике при замене костного мозга после химиотерапии. В настоящем изобретении представлен конъюгат, содержащий гранулоцитарный колониестимулирующий фактор (G-CSF). Настоящее изобретение также распространяется на конъюгаты, содержащие гликозилированные и негликозилированные пептиды, обладающие стимулирующей активностью гранулоцитарного колониестимулирующого фактора. Конъюгаты могут быть дополнительно модифицированы дальнейшей конъюгацией с различными молекулами, такими как лекарственные вещества, диагностические вещества, направляющие вещества и т.д. В конъюгатах G-CSF, описанных в настоящем изобретении, к гликозильному или аминокислотному остатку в составе пептида G-CSF может быть ковалентно присоединена полимерная модифицирующая группа предпочтительно посредством гликозильной связывающей группы. В примерном воплощении полимерная модифицирующая группа представляет собой водорастворимый полимер. В дальнейшем предпочтительном воплощении водорастворимый полимер представляет собой полиэтиленгликоль. В примерных воплощениях пептид G-CSF согласно изобретению может вводиться пациенту с целью предотвращения инфекции у онкологических больных, проходящих радиационную терапию, химиотерапию и пересадку костного мозга, с целью мобилизации клеток-предшественников для сбора при трансплантации клеток-предшественников из периферической крови, для лечения тяжелой хронической или относительной лейкопении вне зависимости от ее причины и для поддерживающей терапии пациентов с острой миелоидной лейкемией. Кроме того, полипептидные конъюгаты или композиции согласно изобретению могут использоваться для терапии СПИДа или других иммунодефицитных заболеваний, а также бактериальных инфекций, заболевания сердца и гепатитов A, B и C. В одном воплощении пептидный конъюгат G-CSF согласно изобретению может вводиться субъекту для повышения гематопоэза. Гематопоэзом называется процесс, в ходе которого клеткипредшественники развиваются в зрелые клетки крови, включая красные кровяные клетки, белые кровяные клетки и тромбоциты. Нормальный гематопоэз координируется действием различных регуляторов,включая гликопротеины, такие как колониестимулирующие факторы. Эти регуляторы модулируют выживание, пролиферацию и дифференцировку стволовых клеток и клеток-предшественников и состояние активации зрелых клеток. Нарушение гематопоэза приводит к снижению продукции клеток крови и тромбоцитов, что ведет к снижению иммунитета и невозможности заживления ран и борьбы с инфек- 12017770 циями. В настоящем изобретении представлены способы и композиции для стимуляции гематопоэза у субъекта. Способы согласно изобретению включают стадию введения субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В одном аспекте стимуляция гематопоэза включает увеличение числа кроветворных клетокпредшественников у субъекта, что приводит также к повышению зрелых кроветворных клеток (клеток крови). Кроветворные клетки-предшественники перемещаются и задерживаются в костном мозге, где они созревают и превращаются в красные и белые кровяные клетки. Способы стимулирования числа кроветворных клеток-предшественников согласно изобретению включают стадию введения субъекту эффективного количества пептида, представляющего собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В одном воплощении применение пептида увеличивает число кроветворных клеток-предшественников, представляющих собой CD34+ клетки. Миелосупрессия. Миелосупрессия представляет собой уменьшение продукции клеток крови. Нормальная кровь содержит большое количество клеток, включая красные кровяные клетки, переносящие кислород, и белые кровяные клетки, борющиеся с инфекциями. Нормальная кровь также содержит тромбоциты, крошечные фрагменты клеток, запускающие процесс свертывания крови. Эти клетки и фрагменты клеток происходят из костного мозга, вещества, находящегося внутри некоторых костей. Здоровый костный мозг каждый день продуцирует большое количество красных кровяных клеток, белых кровяных клеток и тромбоцитов. При миелосупрессии костный мозг продуцирует слишком мало таких клеток. В настоящем изобретении представлены способы и композиции для лечения, облегчения симптомов и предотвращения миелосупрессии. Одной из характерных особенностей миелосупрессии является подавление продукции белых кровяных клеток у субъекта. Это подавление продукции белых кровяных клеток может быть обусловлено некоторыми видами терапии, в особенности противоопухолевой терапии, такими как химиотерапия и радиационная терапия. Подавление продукции белых кровяных клеток также может быть обусловлено заболеваниями, такими как идиопатическая тромбоцитопеническая пурпура. В одном аспекте конъюгаты согласно изобретению используются для лечения и облегчения заболеваний, характеризующихся нарушением продукции белых кровяных клеток. Заболевания, обусловленные миелосупрессией, включают нейтропению (включая фебрильную нейтропению) и тромбоцитопению. Нейтропения представляет собой заболевание, характеризующееся ненормальным понижением числа нейтрофилов в крови (наиболее распространенного типа белых кровяных клеток). Понижение может быть относительным или абсолютным. В одном аспекте в настоящем изобретении представлены способы лечения нейтропении у млекопитающего. Эти способы включают стадии введения фармацевтически эффективного количества конъюгатов G-CSF согласно изобретению. Было показано, что G-CSF влияет на фебрильную нейтропению и смертность среди взрослых онкологических больных (Kuderer et al., J. Clin. One. (2007), 25(21):3158-67). Тромбоцитопения представляет собой заболевание, при котором число тромбоцитов в крови ненормально низкое; для этого заболевания часто характерны ненормальные кровотечения. Способы согласно изобретению включают терапии тромбоцитопении у млекопитающих. Эти способы включают стадии введения фармацевтически эффективного количества конъюгатов G-CSF согласно изобретению. При использовании в настоящем описании термин "тромбоцитопения" охватывает как заболевания известной этиологии, так и идиопатическую тромбоцитопению. Тромбоцитопения и идиопатическая тромбоцитопения также называются в настоящем описании"тромбоцитопеническая пурпура" и "идиопатическая тромбоцитопеническая пурпура". Стимуляция стволовых клеток. Один способ преодоления миелосупрессии заключается в стимуляции продукции стволовых клеток. Стимуляция продукции стволовых клеток включает увеличение числа стволовых клеток, включая число кроветворных клеток-предшественников, и числа гранулоцитов, включая нейтрофилы и эозинофилы. Стимуляция продукции стволовых клеток также включает усиленный транспорт стволовых клеток из костного мозга в периферическую кровь. Такая стимуляция облегчает забор стволовых клеток у донора,поскольку периферическая кровь более легкодоступна, чем костный мозг. В одном аспекте в настоящем изобретении представлены способы стимуляции продукции стволовых клеток у субъекта. В другом аспекте предотвращение, облегчение симптомов и лечение миелосупрессии достигаются за счет использования способов и композиций согласно изобретению путем стимуляции кроветворных клеток-предшественников у субъекта. Стимуляция кроветворных клеток-предшественников включает как увеличение числа кроветворных клеток-предшественников, так и усиленный транспорт кроветворных клеток-предшественников в костный мозг и из костного мозга. Кроветворные клетки-предшественники, такие как клетки CD34+, созревают и дифференцируются в компоненты крови, а именно в красные и белые кровяные клетки. В настоящем изобретении представлены способы стимуляции кроветворных клеток-предшественников у субъекта, включающие стадию введения субъекту: (1) первой композиции, содержащей компонент, имеющий формулу 1,1'-1,4-фенилен-бис-(метилен)-бис-1,4,8,11-тетраазациклотетрадекан (AMD3100), и (2) второй композиции, содержащей пептид, который представляет собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. В одном воплощении первую и вторую композиции вводят субъекту последовательно в любом порядке. В другом воплощении первую и вторую композицию вводят субъекту одновременно. В одном воплощении обе композиции вводят субъекту подкожно.AMD3100 представляет собой бицикламовое производное, способное мобилизовать большое число клеток CD34+ в кровоток как у здоровых субъектов, так и у онкологических больных, как было показано в работах Liles et al., Blood (2003), 102:2728-30; Devine et al., J. Clin. Oncol. (2004), 22:1095-1102. Также исследования показали, что комбинация AMD3100 и негликозилированной формы G-CSF способна мобилизовать большее число клеток CD34+ в кровоток, чем один G-CSF (Flomenberg et al., Blood (2005),106(5):1867-1874). В одном воплощении продукция стволовых клеток стимулируется у субъекта, служащего донором костного мозга или кроветворных клеток. Донор получает пептидный конъюгат, описанный выше. Количество стволовых клеток у донора повышается, и эти стволовые клетки выходят из костного мозга в периферическую кровь. Такие клетки затем легко выделяются из крови донора с помощью методов, известных из уровня техники. В таких воплощениях донор и реципиент костного мозги или кроветворных клеток могут быть одним и тем же лицом (аутологичный донор) или донором может быть субъект, не являющийся реципиентом (аллогенный донор). В другом аспекте пептидные конъюгаты согласно изобретению комбинируются по меньшей мере с одним химиотерапевтическим агентом. Трансплантаты костного мозга. В некоторых аспектах в настоящем изобретении представлены способы и композиции для стимуляции продукции стволовых клеток у реципиента трансплантата костного мозга. Эти способы включают стадию введения реципиенту некоторого количества пептида, представляющего собой конъюгат пептидаG-CSF и полимерной модифицирующей группы. В одном воплощении полимерная модифицирующая группа представляет собой водорастворимый полимер, который может быть ковалентно связан с пептидом G-CSF у гликозильного или аминокислотного остатка пептида G-CSF, предпочтительно посредством интактной гликозильной связывающей группы. Пептид может вводиться реципиенту перед трансплантацией костного мозга, после трансплантации или одновременно с трансплантацией. Успех трансплантации определяет длительное приживление трансплантата. Термин "приживление" означает процесс, в ходе которого инфузированные или пересаженные донорские стволовые клетки направляются в костный мозг реципиента и продуцируют клетки крови всех типов. Первым признаком приживления является появление в крови реципиента новых белых клеток, красных клеток и тромбоцитов после пересадки стволовых клеток. Длительное приживление трансплантата означает процесс, в ходе которого инфузированные или пересаженные донорские стволовые клетки остаются в костном мозге реципиента и продуцируют клетки крови в течение длительного периода времени без отторжения иммунной системой реципиента. При включении в трансплантат средних и поздних клетокпредшественников ускоряется продукция зрелых клеток донорского происхождения и поддерживается процесс приживления. В соответствии с вышесказанным в настоящем изобретении представлены способы и композиции,повышающие длительное приживление трансплантата костного мозга, полученного реципиентом. В одном примерном воплощении пептид согласно изобретению вводят донору до трансплантации костного мозга. Пептид стимулирует гематопоэз у донора, в частности, за счет увеличения количества клетокпредшественников, что увеличивает вероятность успешного и длительного приживления при пересадке костного мозга и/или кроветворных клеток реципиенту. Пересаженный костный мозг может принадлежать самому реципиенту (аутологичный трансплантат) или костный мозг может быть пересажен от донора того же биологического вида (аллогенный трансплантат). В другом воплощении пептид согласно изобретению вводят реципиенту костного мозга с целью повышения длительного приживления трансплантата донорского костного мозга, полученного от самого реципиента или другого субъекта. Получение пептида реципиентом может стимулировать гематопоэз у реципиента, что повышает вероятность приживления трансплантата путем стимуляции продукции кроветворных клеток-предшественников донорским костным мозгом. Трансплантаты кроветворных клеток. Трансплантация кроветворных клеток является общепринятым способом лечения различных наследственных или злокачественных заболеваний. В то время как при некоторых процедурах трансплантации используют всю популяцию клеток костного мозга, при других процедурах используют более узкие популяции, обогащенные стволовыми клетками. Кроме костного мозга, такие клетки могут быть получены из других источников, таких как периферическая кровь и пуповинная кровь новорожденных. Одно из преимуществ использования стволовых клеток из периферической крови заключается в том, что такие клетки значительно легче забрать из периферической крови, чем из костного мозга. Однако малое количество плюрипотентных клеток/клеток-предшественников в кровотоке является лимитирующим фактором для трансплантации стволовых клеток из периферической крови. Таким образом, для использования в трансплантации необходимо увеличить число стволовых клеток ex vivo. В соответствии со сказанным в настоящем изобретении представлены способы увеличения числа стволовых клеток в культуре. В примерном воплощении такие способы включают добавления эффективного количества пептида согласно изобретению в культуру кроветворных клеток. В примерном воплощении такой пептид представляет собой конъюгат пептида G-CSF и полимерной модифицирующей группы. В одном воплощении полимерная модифицирующая группа представляет собой водорастворимый полимер, который может быть ковалентно присоединен к пептиду G-CSF у гликозильного или аминокислотного остатка пептида G-CSF, предпочтительно посредством интактной гликозильной связывающей группы. В одном воплощении в настоящем изобретении представлены способы получения увеличенных популяций стволовых клеток и клеток-предшественников, которые могут использоваться для трансплантации. Эти способы включают стадию добавления к культуре стволовых клеток эффективного количества пептида согласно изобретению. Трансплантаты органов. Так же как и трансплантаты костного мозга, транспланты солидных органов, таких как печень, почка, сердце и легкое, могут вызывать различные иммунные реакции у реципиента. Такие иммунные реакции могут приводить к острому отторжению этих трансплантатов. G-CSF и другие гематопоэтические факторы роста могут использоваться для терапии таких ответов (см. патент США 5718893). Соответственно, способы и композиции согласно настоящему изобретению могут использоваться для предотвращения или уменьшения вероятности развития острого отторжения трансплантатов органов у пациента. Сердечное заболевание. В одном воплощении способы и композиции согласно настоящему изобретению могут использоваться для облегчения течения сердечного заболевания и улучшения функционирования сердца. В одном воплощении способы и композиции согласно изобретению используются для стимуляции высвобождения стволовых клеток, формирующих сосуды. Терапия G-CSF может ослаблять стенокардию у пациентов с сердечным заболеванием, включая пациентов после многочисленных операций и пациентов, принимающих максимальные дозы стандартных лекарственных препаратов (см., например, Medical NewsG-CSF способен защитить сердечные мышцы, что предотвращает их смерть, даже если мышцы были повреждены сердечным заболеванием (см., например, Sunday Telegraph News, August 5, 2007, "OurWorld-first hearts that Repair Themselves"). G-CSF по отдельности или в комбинации со зрелыми стволовыми клетками пациентов может использоваться в ходе лечения для замещения мертвых сердечных тканей и образования новых кровеносных сосудов. Неврологические заболевания. В одном воплощении способы и композиции согласно изобретению могут использоваться для лечения неврологических заболеваний, включая без ограничения болезнь Альцгеймера и другие дегенеративные заболевания мозга. Исследования болезни Альцгеймера на мышиных моделях показали, что в этих моделях G-CSF может обратить симптомы, сходные с болезнью Альцгеймера (см. Tsai et al. (2007),J. Exp. Med. 204(6):1273-80). Эти исследования показали, что инъекция G-CSF в кровоток стимулирует выход кроветворных клеток из костного мозга. Эти стволовые клетки попадают из кровотока в мозг, где они прикрепляются к местам повреждений и дифференцируются в новые клетки. Применение G-CSF приводит к росту новых клеток в местах наибольших повреждений нейронов. Конъюгаты G-CSF. В соответствии со способами, упомянутыми выше, пептид представляет собой ковалентный конъюгат пептида G-CSF и полимерной модифицирующей группы. Полимерная модифицирующая группа может ковалентно присоединяться к пептиду G-CSF у гликозильного или аминокислотного остатка пептидаG-CSF, предпочтительно посредством гликозильной связывающей группы. В одном воплощении гликозильная связывающая группа представляет собой интактную гликозильную связывающую группу. В предпочтительных воплощениях полимерная модифицирующая группа и гликозильная связывающая группа ковалентно присоединены посредством линкера. В примерном воплощении полимерная модифицирующая группа представляет собой водорастворимый полимер, такой как полиэтиленгликоль.G-CSF был клонирован и секвенирован. В примерном воплощении аминокислотная последовательность G-CSF соответствует SEQ ID NO:1. Специалисту в области техники очевидно, что настоящее изобретение не ограничивается последовательностями, приведенными в настоящем описании. Настоящее изобретение также распространяется на варианты G-CSF, известные из уровня техники. В качестве примера, никоим образом не ограничивающего настоящее изобретение, можно привести вариант G-CSF, описанный в патенте США 6166183, где описывается G-CSF, состоящий из природной совокупности лизиновых остатков, далее связанный с одной или двумя молекулами полиэтиленгликоля. Кроме того, в патентах США 6004548, 5580755, 5582823 и 5676941 описывается вариант G-CSF, в котором один или более цистеиновых остатков в положениях 17, 36, 42, 64 и 74 заменены на аланин или серин. В патенте США 5416195 описана молекула G-CSF, в которой цистеин в положении 17, аспар- 15017770 тат в положении 27 и серины в положениях 65 и 66 заменены на серин, серин, пролин и пролин соответственно. Из уровня техники известны и другие варианты, описанные, например, в патенте США 5399345. Дополнительные варианты имеют аминокислотную последовательность, выбираемую изSEQ ID NO:3-11. Экспрессия и активность модифицированной молекулы G-CSF согласно настоящему изобретению может быть определена с помощью способов, хорошо известных из уровня техники, как описано, например, в патенте США 4810643. К примеру, активность можно измерить с помощью анализа включения тимидина, помеченного радиоактивной меткой. Вкратце, костный мозг от здоровых доноров разделяют по плотности в Ficoll-Hypaque (1,077 г/мл, Pharmacia, Piscataway, NJ), и клетки с низкой плотностью суспендируют в среде Iscove (GIBCO, La Jolla, CA), содержащей 10% фетальной сыворотки теленка, глутамин и антибиотики. Приблизительно 2104 клеток костного мозга человека инкубируют в контрольной среде либо с добавлением G-CSF согласно настоящему изобретению в 96-луночном планшетах с плоским дном при приблизительно 37 С, 5% СО 2 в воздухе в течение приблизительно 2 суток. Культурам дают импульсную метку в виде 0,5 мкКюри на лунку 3 Н-тимидина в течение приблизительно 4 ч (Newal. (1983, Blood 61:781). Более сильное включение 3 Н-тимидина клетками костного мозга человека по сравнению с клетками костного мозга в присутствии контрольного вещества есть показатель активности и жизнеспособности вещества G-CSF. Конъюгаты согласно изобретению образуются путем ферментативного присоединения модифицированного сахара к гликозилированному или негликозилированному пептиду G-CSF. Модифицированный сахар, расположенный между пептидом G-CSF и модифицирующей группой на сахаре, в настоящем описании может называться, например, "интактной гликозильной связывающей группой". Используя исключительную селективность ферментов, таких как гликозилтрансферазы, настоящее изобретение позволяет получить пептиды, несущие желаемую группу в одном или более определенных положений. Таким образом, в соответствии с настоящим изобретением модифицированный сахар присоединяется напрямую к выбранному локусу на пептидной цепи G-CSF или в качестве альтернативы модифицированный сахар добавляется к углеводной группе полипептида. Пептиды, в которых модифицированные сахара присоединяются как к углеводу в составе гликопептида, так и напрямую к аминокислотному остатку,входящему в состав полипептидной цепи G-CSF, также охватываются настоящим изобретением. В отличие от известных химических и ферментативных стратегий совершенствования пептида,способы согласно изобретению возможно использовать для сборки пептидов и гликопептидов, имеющих практически гомогенный паттерн дериватизации; ферменты, используемые в соответствии с настоящим изобретением, в общем селективны в отношении определенного аминокислотного остатка или комбинации аминокислотных остатков в составе пептида G-CSF. Такие методы также могут применяться к крупномасштабному производству модифицированных пептидов и гликопептидов. Таким образом, способы согласно изобретению предоставляют практическое средство для крупномасштабного производства гликопептидов с предварительно выбранными паттернами дериватизации. Эти способы особенно хорошо применимы для модификации лекарственных пептидов, включая, но не ограничиваясь, гликопептиды,гликозилированные не полностью в ходе их продукции в клеточной системе (например, клетки млекопитающих, насекомых, растений, грибов, дрожжей или прокариотические клетки) или в трансгенных растениях или животных. В настоящем изобретении также представлены конъюгаты гликозилированных или негликозилированных пептидов G-CSF с увеличенным терапевтическим временем полужизни благодаря, например,сниженной скорости клиренса или пониженной скорости поглощения иммунной или ретикулоэндотелиальной системой (RES). Кроме того, способы согласно изобретению предоставляют возможность маскировки антигенных детерминант на пептидах, что ослабляет или отменяет иммунную реакцию хозяина на пептид. Селективное присоединение направляющих агентов также может использоваться для направления пептида в определенную ткань или к определенному рецептору на поверхности клетки, специфическому для данного направляющего агента. В одном воплощении в настоящем изобретении представлен конъюгат выбранной модифицирующей группы и пептида G-CSF. Мостик между пептидом и модифицирующей группой включает гликозильную связывающую группу, расположенную между пептидом и выбранной группой. Как обсуждается в настоящем описании, выбранная модифицирующая группа в целом представляет собой любую группу,которая может присоединяться к сахаридной единице, с образованием "модифицированного сахара",узнаваемого соответствующим ферментом-трансферазой, присоединяющей модифицированный сахар к пептиду или гликозильному остатку на пептиде. При вставке между пептидом и выбранной группой сахаридный компонент модифицированного сахара становится "гликозильной связывающей группой", например "интактной гликозильной связывающей группой". Гликозильная связывающая группа образуется из любого моно- или олигосахарида, который после модификации модифицирующей группой представляет собой субстрат для фермента, добавляющего модифицированный сахар к аминокислотному или гликозильному остатку в составе пептида. Гликозильная связывающая группа может представлять собой или включать сахаридную группу,модифицируемую с нарушением структуры до или во время добавления модифицирующей группы. Например, гликозильная связывающая группа может быть получена из сахаридного остатка, получаемого путем окислительной деградации интактного сахарида до соответствующего альдегида, например, с помощью метаперйодата и далее превращаемого в основание Шиффа с соответствующим амином, которое затем восстанавливается до соответствующего амина. Конъюгаты согласно изобретению обычно имеют следующую общую структуру: где символы а, b, с, d и s означают положительные целые числа, отличные от нуля;t означает ноль или положительное целое число;"Агент" обычно представляет собой водорастворимую группу, например PEG-группу;"Линкер" может представлять собой любую из множества связывающих групп (см. ниже). В качестве альтернативы линкер может представлять собой одинарную связь или "линкер нулевого порядка". Модифицирующие группы могут представлять собой, как обсуждается далее в настоящем описании, любую группу, присоединяемую к сахаридной единице. Такие группы включают полимеры, включая водорастворимые и водонерастворимые полимеры, а также могут включать лекарственные вещества,диагностические вещества, направляющие вещества, токсические вещества и т.д. В примерном воплощении модифицирующая группа представляет собой водорастворимый полимер, например m-PEG. Водорастворимый полимер ковалентно присоединяется к пептиду G-CSF посредством гликозильной связывающей группы, ковалентно связанной с аминокислотным или гликозильным остатком в составе пептидаG-CSF. В настоящем изобретении также представлены конъюгаты, в которых аминокислотный остаток и гликозильный остаток модифицированы гликозильной связывающей группой. Пептиды согласно настоящему изобретению содержат по меньшей мере один N- или О-связанный сайт гликозилирования. В дополнение к представлению конъюгатов, образованных с помощью ферментативного присоединения гликозильной связывающей группы, в настоящем изобретении представлены конъюгаты с высокогомогенным паттерном замен. Используя способы согласно изобретению, возможно образовывать пептидные конъюгаты, в которых практически все модифицированные сахара в популяции конъюгатов согласно изобретению присоединены ко множественным копиям аминокислотного или гликозильного остатка с идентичной структурой. Таким образом, в одном аспекте в настоящем изобретении представлен пептидный конъюгат, содержащий популяцию водорастворимых полимерных молекул, ковалентно связанных с пептидом G-CSF посредством интактной гликозильной связывающей группы. В примерном воплощении конъюгата согласно изобретению практически каждый представитель популяции водорастворимых полимерных молекул связан посредством гликозильной связывающей группы с гликозильным остатком в составе пептида G-CSF, а все гликозильные остатки в составе пептида G-CSF,к которым присоединены гликозильные связывающие группы, имеют одинаковые структуры. Также представлен пептидный конъюгат, в котором популяция водорастворимых полимерных молекул связана с ним посредством гликозидной связывающей группы. В одном воплощении практически каждый представитель популяции водорастворимых полимерных молекул связан посредством гликозильной связывающей группы с аминокислотным остатком в составе пептида G-CSF, а все аминокислотные остатки в составе пептида G-CSF, к которым присоединены гликозильные связывающие группы,имеют одинаковые структуры. В настоящем изобретении также представлены конъюгаты, аналогичные описанным выше, в который пептид G-CSF конъюгирован с лекарственным фрагментом, диагностическим фрагментом, нацеливающим фрагментом, фрагментом токсина и т.д. через интактную гликозильную связывающую группу. Каждый из вышеперечисленных фрагментов может быть малой молекулой, природным полимером (например, полипептидом) или синтетическим полимером. Модифицированные сахара. В настоящем изобретении представлены модифицированные сахара, модифицированные нуклеотидные сахара и конъюгаты модифицированных сахаров. В модифицированных сахарах согласно изобретению сахарная группа предпочтительно представляет собой сахарид, дезоксисахарид, аминосахарид или N-ацилсахарид. Термин "сахарид" и эквивалентные ему термины "сахарил", "сахар" и "гликозил" означает мономеры, димеры, олигомеры и полимеры. Сахарную группу также функционализируют модифицирующей группой. Модифицирующую группу конъюгируют с сахарной группой, обычно путем конъюгирования с амино-, сульфгидрильной или гидроксильной, например первичной гидроксильной,группой на углеводном остатке. В примерном воплощении модифицирующая группа присоединяется посредством аминогруппы в составе сахара, например, через амид, уретан или мочевину, образующиеся в результате реакции амина с реактивным производным модифицирующей группы. В качества сахарного остова конъюгатов согласно изобретению может использоваться любой сахар. Типичные сахарные остовы, применимые для получения композиций согласно изобретению, включают,но не ограничиваются, глюкозу, галактозу, маннозу, фукозу и сиаловую кислоту. Другие применимые сахара включают аминосахара, такие как глюкозамин, галактозамин, маннозамин, 5-аминный аналог сиаловой кислоты и др. Сахарный остов может представлять собой структуру, встречающуюся в природе,или он может быть модифицирован и содержать сайт для конъюгирования с модифицирующей группой. Например, в одном воплощении в настоящем изобретении представлен пептидный конъюгат, содержащий производное сиаловой кислоты, в котором 9-гидроксильная группа заменена на амин. Амин легко дериватизуется активированным аналогом выбранной модифицирующей группы. Гликозильные связывающие группы. В соответствии с пептидными конъюгатами согласно любому из вышеописанных способов некоторые воплощения пептидных конъюгатов содержат гликозильную связывающую группу, представляющую собой остаток сиаловой кислоты. Мостик между пептидом G-CSF и выбранным веществом, таким как водорастворимый полимер,включает интактную гликозильную связывающую группу, расположенную между пептидом и выбранным веществом. Как обсуждается в настоящем описании, выбранное вещество представляет собой практически любую молекулу, которая присоединяется к сахаридной единице, что приводит к получению"модифицированного сахара", который распознается соответствующим ферментом-трансферазой, присоединяющим модифицированный сахар к пептиду G-CSF. Сахаридный компонент модифицированного сахара, располагающийся между пептидом G-CSF и выбранным веществом, называется "интактной гликозильной связывающей группой". Гликозильная связывающая группа может быть образована любым моно- или олигосахаридом, который после модификации выбранным веществом представляет собой субстрат соответствующей трансферазы. В одном воплощении гликозильная связывающая группа представляет собой остаток сиаловой кислоты, структура которого приведена ниже где R означает водорастворимый полимер, и водорастворимый полимер присоединен к остатку сиаловой кислоты посредством вышеупомянутого линкера. В другом воплощении гликозильная связывающая группа представляет собой остаток сиаловой кислоты, структура которого приведена ниже где n означает целое число от 1 до 2000. Еще в одном воплощении гликозильная связывающая группа представляет собой модифицированный остаток сиаловой кислоты, структура которого приведена ниже где R2 представляет собой Н, CH2OR7, COOR7 или OR7, R7 означает Н, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил;R3 и R4 независимо выбраны из Н, замещенного или незамещенного алкила, OR8, NHC(O)R9, R8 и R9 независимо выбраны из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила или сиаловой кислоты;La означает линкер, выбранный из связи, замещенного или незамещенного алкила и замещенного или незамещенного гетероалкила;R16 и R17 означают независимо выбранные полимерные "плечи";X2 и X4 означают независимо выбранные связывающие фрагменты, соединяющие полимерные группы R16 и R17 с С; иX5 представляет собой нереактивную группу. В дальнейшем воплощении аминокислотный остаток выбирается из серина или треонина. В еще одном дальнейшем воплощении аминокислотный остаток представляет собой треонин в положении 133 В одном воплощении гликозильная связывающая группа содержит субструктуру, выбранную из где R15 означает модифицированный остаток сиаловой кислоты; р означает целое число от 1 до 10. В дальнейшем воплощении гликозильная связывающая группа имеет формулу, выбранную из где AA означает аминокислотный остаток указанного пептида;t означает целое число, равное 0 или 1; р означает целое число от 1 до 10;R15 выбирается из Н, OH, сиаловой кислоты, указанного модифицированного сиалильного остатка иSia-Siap, где Siap означает указанный сиалильный остаток; по меньшей мере один R15' выбирается из указанного модифицированного сиалильного остатка иSia-Siap. В одном воплощении аминокислотный остаток представляет собой аспарагиновый остаток. В другом воплощении указанный пептид G-CSF имеет структуру, представленную ниже где n означает целое число от 1 до 2000. В дальнейшем воплощении n означает целое число от 400 до 500. В еще одном дальнейшем воплощении пептид G-CSF имеет аминокислотную последовательность, приведенную в SEQ ID NO:1. В обсуждении, приведенном ниже, изобретение проиллюстрировано посредством ссылки к применению избранных производных сиаловой кислоты. Специалисту в области техники ясно, что целью обсуждения является ясность иллюстрации и что предлагаемые структуры и композиции в целом приме- 19017770 нимы ко всему классу сахаридных групп, модифицированных сахаридных групп, активированных модифицированных сахаридных групп и конъюгатов модифицированных сахаридных групп. В примерном воплощении в настоящем изобретении представлен пептидный конъюгат, содержащий модифицированый амин сахара, структура которого приведена нижеL означает связь или линкер;R1 означает модифицирующую группу. Типичными связями являются связи между NH2-группой гликозильной группы и группы с комплементарной реактивностью на модифицирующей группе. Таким образом, примерные связи включают, но не ограничиваются, NHR1, OR1, SR1 и т.д. Например, если R1 содержит карбоксильную группу, эта группа может быть активирована и связана с группой NH2 на гликозильном остатке, что дает связь со структурой NHC(O)R1. Сходным образом, OH- и SH-группы могут превращаться в соответствующие эфирные или тиоэфирные производные. Примерные линкеры включают алкильные и гетероалкильные группы. Линкеры включают связывающие группы, например связывающие группы на основе ацилов, например -C(O)NH-, -OC(O)NH- и т.д. Связывающие группы представляют собой связи между компонентами, принадлежащими к разным группам согласно изобретению, например между гликозильным остатком и линкером (L) или между линкером и модифицирующей группой (R1). Другие связывающие группы представляют собой эфиры,тиоэфиры и амины. Например, в одном воплощении линкер представляет собой аминокислотный остаток, такой как остаток глицина. Карбоксильная группа глицина превращается в соответствующий амид в ходе реакции с амином на гликозильном остатке, а амин глицина превращается в соответствующий амид или уретан в результате реакции с активированной карбоксикислотой или карбонатом модифицирующей группы. Еще одним примерным линкером является PEG-группа или PEG-группа, функционализированная аминокислотным остатком. PEG связывается с гликозильной группой через аминокислотный остаток на одном конце молекулы PEG и с R1 через другой конец молекулы PEG. В качестве альтернативы аминокислотный остаток может связываться с R1, а конец PEG, не связанный с аминокислотным остатком, - с гликозильной группой. Пример молекулы NH-L-R1 имеет формулу-NHC(O)(CH2)aNHsC(O)(CH2)b(OCH2CH2)cO(CH2)dNHtR1,где индексы s и t независимо равны 0 или 1; индексы a, b и d означают независимые целые числа от 0 до 20; с означает целое число от 1 до 2500. Другие сходные линкеры основаны на молекулах, в которых NH-группа заменена, например, на -S,-О и -CH2. В частности, в настоящем изобретении представлен пептидный конъюгат, содержащий соединения,в которых NH-L-R1 представляет собой:NHC(O)(CH2)aNHC(O)(CH2)b(OCH2CH2)cO(CH2)dNHR1,NHC(O)(CH2)b(OCH2CH2)cO(CH2)dNHR1,NHC(O)O(CH2)b(OCH2CH2)cO(CH2)dNHR1,NH(CH2)aNHC(O)(CH2)b(OCH2CH2)cO(CH2)dNHR1,NHC(O)(CH2)aNHR1,NH(CH2)aNHR1 и NHR1,где индексы а, b и d выбираются независимо из целых чисел от 0 до 20, предпочтительно от 1 до 5; индекс с означает целое число от 1 до 2500. В примерном воплощении G означает сиаловую кислоту, и выбранные соединения согласно изобретению имеют формулы: Специалисту в области техники очевидно, что остаток сиаловой кислоты в примерных соединениях, приведенных выше, может заменяться любым другим аминосахаридом, включая, но не ограничиваясь, глюкозамин, галактозамин, маннозамин, их N-ацетилпроизводные и т.д. В другом примерном воплощении первичная гидроксильная группа сахара функционализирована модифицирующей группой. Например, 9-гидроксил сиаловой кислоты может превращаться в соответствующий амин и функционализироваться для получения соединения согласно изобретению. Формулы согласно этому воплощению включают: В дальнейшем примерном воплощении в настоящем изобретении представлен пептидный конъюгат, включающий модифицированные сахара, где гидроксильная группа в положении 6 превращается в соответствующую аминогруппу, несущую кассету линкер-модифицирующая группа, как описанные выше. Примерные сахарильные группы, применимые в качестве основы этих модифицированных сахаров,включают Gal, GalNAc, Glc, GlcNAc, Fuc, Xyl, Man и т.д. Типичный модифицированный сахар согласно этому воплощению имеет формулу где R3-R5 и R7 независимо выбраны из Н, OH, С(О)CH3, NH и NHC(O)CH3;R6 означает OR1, NHR1 или NH-L-R1, как описано выше. Выбранные конъюгаты согласно изобретению основываются на маннозе, галактозе или глюкозе или на молекулах, имеющих стереохимию маннозы, галактозы или глюкозы. Общие формулы этих конъюгатов представлены ниже В другом примерном воплощении в настоящем изобретении представлены соединения, как описано выше, которые активируют путем их превращения в соответствующие нуклеотидные сахара. Примерные нуклеотидные сахара, использующиеся в настоящем изобретении в своей модифицированной форме,включают нуклеотидмоно-, ди- и трифосфаты или их аналоги. В одном воплощении модифицированный нуклеотидный сахар выбирают из UDP-гликозида, СМР-гликозида или GDP-гликозида. Еще более предпочтительно нуклеотидную часть модифицированного нуклеотидного сахара выбирают изUDP-галактозы, UDP-галактозамина, UDP-глюкозы, UDP-глюкозамина, GDP-маннозы, GDP-фукозы,СМР-сиаловой кислоты или CMP-NeuAc. В примерном воплощении нуклеотидфосфат связан с С-1. Таким образом, в примерном воплощении, в котором гликозильная группа представляет собой сиаловую кислоту, в настоящем изобретении представлены пептидные конъюгаты, образованные соединениями, имеющими формулы:L1-R1 означает линкер, связанный с модифицирующей группой. Как и L, примерные линкеры согласно L1 включают связь, алкильные и гетероалкильные группы. В другом примерном воплощении в настоящем изобретении представлен конъюгат, образованный модифицированным сахаром согласно изобретению и субстратом, например пептидом, липидом, агликоном и т.д., в частности модифицированным сахаром и гликозильным остатком гликопептида или гликолипида. В этом воплощении сахарная группа модифицированного сахара превращается в гликозильную связывающую группу, расположенную между субстратом и модифицирующей группой. Примерная гликозильная связывающая группа представляет собой интактную гликозильную связывающую группу, в которой гликозильная группа или группы не разрушаются в результате химических (например, воздействие метаперйодата натрия) или ферментативных процессов (например, воздействие оксидазы). Выбранные конъюгаты согласно изобретению включают модифицирующую группу, присоединенную к аминогруппе аминосахарида, например маннозамина, глюкозамина, галактозамина, сиаловой кислоты и т.д. Примерная кассета модифицирующая группа-гликозильная связывающая группа согласно этому мотиву основана на структуре сиаловой кислоты, такой как приведенной в формулах: Еще в одном примерном изобретении конъюгат образован субстратом и 1-м положением сахарильной группы, в котором модифицирующая группа присоединяется посредством линкера к 6-му атому углерода сахарильной группы. Таким образом, примерные конъюгаты согласно этому воплощению имеют формулы: где радикалы аналогичны описанным выше. Специалисту в области техники понятно, что модифицированные сахарильные группы, описанные выше, могут также быть конъюгированы с субстратом в положении 2, 3, 4 или 5 атома углерода. Примерные соединения согласно этому воплощению включают соединения, имеющие формулы: где R-группы и индексы аналогичны описанным выше. В настоящем изобретении также представлены нуклеотидны сахара, модифицированные L-R1 по углероду в положении 6. Примерные молекулы согласно этому воплощению включают: Еще один примерный нуклеотид сахара согласно изобретению основан на молекулах, имеющих стереохимию GDP-маннозы. Примерная молекула согласно этому воплощению имеет структуру Еще в одном примерном воплощении в настоящем изобретении представлен конъюгат, основанный на стереохимии UDP-галактозы. Примерное соединение согласно этому воплощению имеет структуру Еще в одном примерном воплощении нуклеотидный сахар основан на стереохимии глюкозы. Примерная молекула согласно этому воплощению имеет формулу Модифицирующая группа R1 представляет собой любое соединение, выбранное из, включая, но не ограничиваясь, водорастворимых полимеров, водонерастворимых полимеров, лекарственных веществ,диагностических веществ и др. Природа примерных модифицирующих групп ниже обсуждается более подробно. Водорастворимые полимеры. В некоторых воплощениях полимерные модифицирующие группы конъюгатов G-CSF согласно изобретению представляют собой водорастворимые полимеры. Эти водорастворимые полимеры могут быть линейными или разветвленными. В одном воплощении это водорастворимый полимер с практически гомодисперсным распределением молекулярных масс. В некоторых воплощениях конъюгаты согласно изобретению содержат водорастворимые полимеры, представляющие собой полиэтиленгликоль, например метоксиполиэтиленгликоль. Полиэтиленгликоль, используемый в настоящем изобретении, не ограничен определенной формой или определенным интервалом молекулярной массы. Для неразветвленных молекул полиэтиленгликоля молекулярная масса предпочтительно находится в интервале от 500 до 100000. Предпочтительно использовать молекулярную массу в интервале от 2000 до 60000 и более предпочтительно в интервале от приблизительно 5000 до приблизительно 30000. В другом воплощении полиэтиленгликоль представляет собой разветвленный PEG с более одной прикрепленной PEG-группой. Примеры разветвленных PEG описаны в патентах США 5932462; 5342940; 5643575; 5919455; 6113906; 5183660; в WO 02/09766 и в работах Kodera Y., Bioconjugate Chemistry 5:283-288 (1994) и Yamasaki et al., Agric. Biol. Chem., 52:2125-2127, 1998. В настоящем изобретении также раскрываются другие применимые разветвленные структуры PEG. В примерном воплощении молекулярная масса каждого полиэтиленгликоля разветвленного PEG равна или превышает 2000, 5000, 10000, 15000, 20000, 40000 или 60000 Да. Специалистам в области техники известны многие водорастворимые полимеры, применимые в настоящем изобретении. Термин "водорастворимый полимер" распространяется на молекулы, такие как сахариды (например, декстран, амилоза, гиалуроновая кислота, полисиаловая кислота, гепараны, гепарины и т.д.), полиаминокислоты, например полиаспартат и полиглутамат, нуклеиновые кислоты, синтетические полимеры (например, полиакриловая кислота, полиэфиры, например полиэтиленгликоль); пептиды, белки и т.д. Настоящее изобретение может осуществляться с участием любого водорастворимого полимера с единственным ограничением, заключающимся в том, что полимер должен содержать сайт для прикрепления остальной части конъюгата. Способы активации полимеров также можно найти в WO 94/17039, патенте США 5324844,WO 94/18247, WO 94/04193, патентах США 5219564, 5122614, WO 90/13540, патенте США 5281698 и далее в WO 93/15189, а также в работах, где рассматривается конъюгирование активированных полимеров с пептидами, например, фактором свертывания крови VIII (WO 94/15625), гемоглобином(WO 94/09027), молекулой-переносчиком кислорода (патент США 4412989), рибонуклеазой и супероксиддисмутазой (Veronese et al., App. Biochem. Biotech. 11:141-45 (1985. В одном воплощении настоящего изобретения используются водорастворимые полимеры, в которых значительная часть полимерных молекул в образце полимера имеют приблизительно одинаковую молекулярную массу; такие полимеры называются "гомодисперсными". Настоящее изобретение далее иллюстрируется ссылкой на конъюгат полиэтиленгликоля. Существует несколько обзоров и монографий на тему функционализации и конъюгирования PEG. См., например, Harris, Macronol. Chem. Phys. C25:325-373 (1985); Scouten, Methods in Enzymology. 135:30-65 (1987);Carrier Systems. 9:249-304 (1992); Zalipsky, Bioconjugate Chem. 6:150-165 (1995) и Bhadra, et al.,Pharmazie, 57:5-29 (2002). Способы получения реактивных молекул PEG и образования конъюгатов с использованием реактивных молекул известны из уровня техники. Например, в патенте США 5672662 раскрывается водорастворимый и выделяемый конъюгат активного сложного эфира полимерной кислоты, выбранной из линейных или разветвленных полиалкиленоксидов, полиоксиэтилированных полиолов,полиолефиновых спиртов и полиакрилморфолина. В патенте США 6376604 описывается способ приготовления водорастворимого сложного эфира 1-бензотриазолилкарбоната и водорастворимого непептидного полимера путем реакции конечной гидроксильной группы полимера с ди-1-бензотриазолилкарбонатом в органическом растворителе. Активный сложный эфир используется для образования конъюгатов с биологически активным агентом, таким как белок или пептид. В WO 99/45964 описывается конъюгат, состоящий из биологически активного вещества и активированного водорастворимого полимера, содержащего полимерную цепь, в которой по меньшей мере один конец связан с полимерной цепью стабильной связью, где по меньшей мере один конец содержит разветвленную молекулу, проксимальные реактивные группы которой связаны с разветвленной молекулой, в которой биологически активное вещество связано по меньшей мере с одной проксимальной реактивной группой. Другие разветвленные полиэтиленгликоли описаны в WO 96/21469, в патенте США 5932462 описывается конъюгат, образованный разветвленной молекулой PEG, включающей разветвленный конец, включающий реактивные функциональные группы. Свободные реактивные группы могут реагировать с биологически активными молекулами, такими как белок или пептид, образуя конъюгаты между полиэтиленгликолем и биологически активной молекулой. В патенте США 5446090 описывается бифункциональный PEG-линкер и его использование в образовании конъюгатов, включающих пептиды на обоих концах PEG-линкера. Конъюгаты, содержащие деградируемые PEG-связи, описаны в WO 99/34833 и WO 99/14259, а также в патенте США 6348558. Такие деградируемые связи применимы в настоящем изобретении. Вышеописанные способы активации полимера, известные из уровня техники, применимы в контексте настоящего изобретения при образовании разветвленных полимеров, описанных в настоящем изобретении, а также для конъюгирования этих разветвленных полимеров с другими молекулами, такими как сахара, нуклеотидные сахара и т.д. где R8 означает Н, OH, NH2, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный гетероалкил, например ацетал, OHC-, H2N-(CH2)q-, HS-(CH2)q или-(CH2)qC(Y)Z1; индекс е означает целое число от 1 до 2500; индексы b, d и q независимо означают целые числа от 0 до 20;Z и Z1 независимо означают OH, NH2, уходящие группы, такие как имидазол, п-нитрофенил, НОВТ,тетразол, галид, S-R9, спиртовая часть активированных сложных эфиров; -(CH2)pC(Y1)V илиX, Y, Y1, А 1 и U независимо означают группы О, S, N-R11;V означает OH, NH2, галоген, S-R12, спиртовую часть активированных сложных эфиров, аминную часть активированных амидов, нуклеотидные сахара и белки; индексы р, q, s и v независимо выбираются из целых чисел от 0 до 20;R9, R10, R11 и R12 независимо означают Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероциклоалкил и замещенный или незамещенный гетероарил. В других примерных воплощениях молекула полиэтиленгликоля выбирается из следующих вариантов: Полиэтиленгликоль, применимый для образования конъюгата согласно изобретению, может быть линейным или разветвленным. Разветвленные молекулы полиэтиленгликоля, подходящие для использования в настоящем изобретении, включают, но не ограничиваются, молекулы, описываемые следующей формулой: где R8 и R8' выбираются независимо из групп, обозначаемых выше как R8; А 1 и А 2 независимо выбираются из групп, обозначаемых выше как А 1; индексы е, f, о и q соответствуют описанным выше;X1 и X1' независимо выбираются из S, SC(O)NH, HNC(O)S, SC(O)O, O, NH, NHC(O), (O)CNH и В других примерных изобретениях разветвленный PEG базируется на цистеиновой, сериновой или дилизиновой основе. Таким образом, дальнейшие примерные молекулы PEG включают Еще в одном воплощении разветвленная молекула PEG основывается на трилизиновом пептиде. Трилизин может быть моно-, ди-, три- или тетрапэгилирован. Примерные молекулы согласно этому воплощению имеют формулы: где е, f и f' независимо выбираются из целых чисел от 1 до 2500;q, q' и q представляют собой независимо выбранные целые числа от 1 до 20. В примерных воплощениях настоящего изобретения PEG представляет собой m-PEG (5, 10 или 20 кДа). Примерная молекула разветвленного PEG представляет собой серин- или цистеин-(m-PEG)2, где Специалисту в области техники очевидно, что разветвленные полимеры, применимые в настоящем изобретении, включают вариации на вышеописанные темы. Например, конъюгат дилизина и PEG, приведенный выше, может включать три полимерные субъединицы, где третья субъединица прикрепляется к -амину, показанному на вышеприведенной структуре в неизмененном виде. Сходным образом, настоящее изобретение распространяется на использование трилизина, функционализированного тремя или четырьмя полимерными субъединицами. Конкретные воплощения согласно настоящему изобретению включают а также карбонаты и активные сложные эфиры этих молекул, такие как Другие активирующие или уходящие группы, применимые для активации линейного PEG для использования для получения соединений, описанных в настоящем описании, включают, но не ограничиваются, молекулы: Молекулы PEG, активированные этими и другими молекулами, и способы получения активированного PEG описаны в WO 04/083259. Специалисту в области техники понятно, что одно или более "плечей" разветвленного полимера,образуемых m-PEG, может заменяться молекулой PEG с отличной концевой группой, например OH,COOH, NH2, C2-C10-алкил и т.д. Далее, структуры, приведенные выше, легко модифицируются путем вставки алкильных линкеров (или удаления атомов углерода) между -атомом углерода и функциональной группой боковой цепи. Таким образом, в качестве основы для разветвленных молекул PEG для использования в настоящем изобретении рассматриваются "гомо"-производные, а также высшие и низшие гомологи. Разветвленные молекулы PEG, описанные в настоящем изобретении, легко получить с помощью способов, таких как приведенные на схеме ниже:r означает целое число от 1 до 5; индексы е и f независимо означают целые числа от 1 до 2500. Таким образом, согласно этой схеме природная или неприродная аминокислота приводится в контакт с активированным производным m-PEG, в данном случае тозилатом, образуя соединение 1 путем алкилирования гетероатома Xa боковой цепи. Монофункционалированная m-PEG аминокислота ацилируется по N-концу реактивным производным m-PEG в соответствующих условиях, что приводит к сборке разветвленного m-PEG 2. Для специалиста в области техники очевидно, что тозилатная уходящая группа может быть заменена любой применимой уходящей группой, например галогеном, мезилатом,трифлатом и т.д. Сходным образом, реактивный карбонат, используемый для ацилирования амина, может заменяться активным сложным эфиром, например N-гидроксисукцинимидом и т.д., или кислота может активироваться in situ с использованием дегидратирующего агента, такого как дициклогексилкарбодиимид, карбонилдиимидазол и т.д. В примерном воплощении модифицирующая группа представляет собой PEG-группу, однако любая модифицирующая группа, например водорастворимый полимер, водонерастворимый полимер, лекарственное вещество и др. могут включаться в гликозидную группу через подходящую связь. Модифицированный сахар образуется ферментативным путем, химическим путем или путем их комбинации, которые приводят к получению модифицированного сахара. В примерном воплощении сахара заменяются активным амином в любом положении, к которому затем может присоединиться модифицирующая молекула,однако сахар должен оставаться субстратом фермента, присоединяющего модифицированный сахар к пептиду G-CSF. В примерном воплощении, где модифицированным сахаром является галактозамин,аминогруппа присоединяется к атому углерода в положении 6. Также с помощью молекул PEG, таких как полиэтиленгликоль (PEG), можно увеличить время полужизни in vivo лекарственных гликопептидов. Например, химическая модификация белков молекулойPEG (пэгилирование) увеличивает размер их молекул и понижает доступность поверхностных и функциональных групп, зависящую от размера молекулы PEG, связанной с белком. Это приводит к увеличению времени полужизни в плазме крови и протеолитической стабильности, а также уменьшает иммуногенность вещества и скорость его усвоения печенью (Chaffee et al. J. Clin. Invest. 89:1643-1651 (1992);Pyatak et al. Res. Commun. Chem. Pathol. Pharmacol. 29:113-127 (1980. Было показано, что пэгилирование интерлейкина-2 усиливает его противоопухолевое действие in vivo (Katre et al. Proc. Natl. Acad. Sci.USA. 84:1487-1491 (1987 и что пэгилирование фрагмента F(ab')2, полученного из моноклонального антитела А 7 повышает его локализацию в опухоли (Kitamura et al. Biochem. Biophys. Res. Commun. 28:1387-1394 (1990. Таким образом, в другом воплощении время полужизни in vivo пептида, дериватизованного молекулой PEG по способу согласно изобретению, повышается по сравнению со временем жизни in vivo не дериватизованного пептида. Увеличение времени полужизни пептида in vivo лучше всего выражается с помощью процентного интервала увеличения этого показателя. Нижняя граница процентного интервала увеличения равняется приблизительно 40%, приблизительно 60%, приблизительно 80%, приблизительно 100%, приблизительно 150% или более чем приблизительно 200%. Верхняя граница интервала равняется приблизительно 60%, приблизительно 80%, приблизительно 100%, приблизительно 150% или более чем приблизительно 250%.
МПК / Метки
МПК: C07K 1/00
Метки: способы, использованием, лечения, гликопэгилированного, g-csf
Код ссылки
<a href="https://eas.patents.su/30-17770-sposoby-lecheniya-s-ispolzovaniem-glikopegilirovannogo-g-csf.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения с использованием гликопэгилированного g-csf</a>
Предыдущий патент: Замещенные пиразолохиназолиновые производные, способ их получения и их применение в качестве ингибиторов киназы
Следующий патент: Устройство для сплющивания пластмассовых бутылок
Случайный патент: Биологически активная добавка к пище