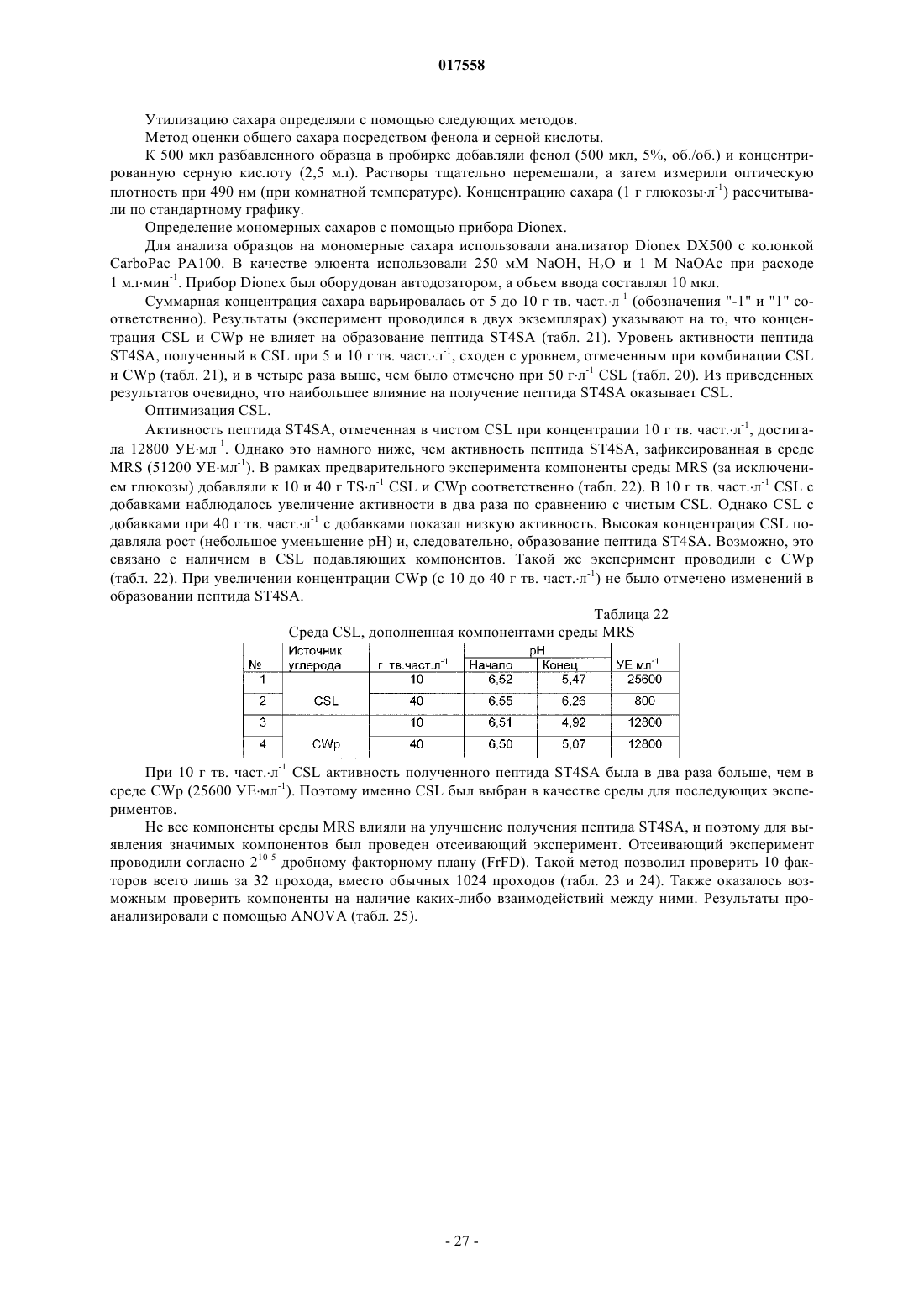
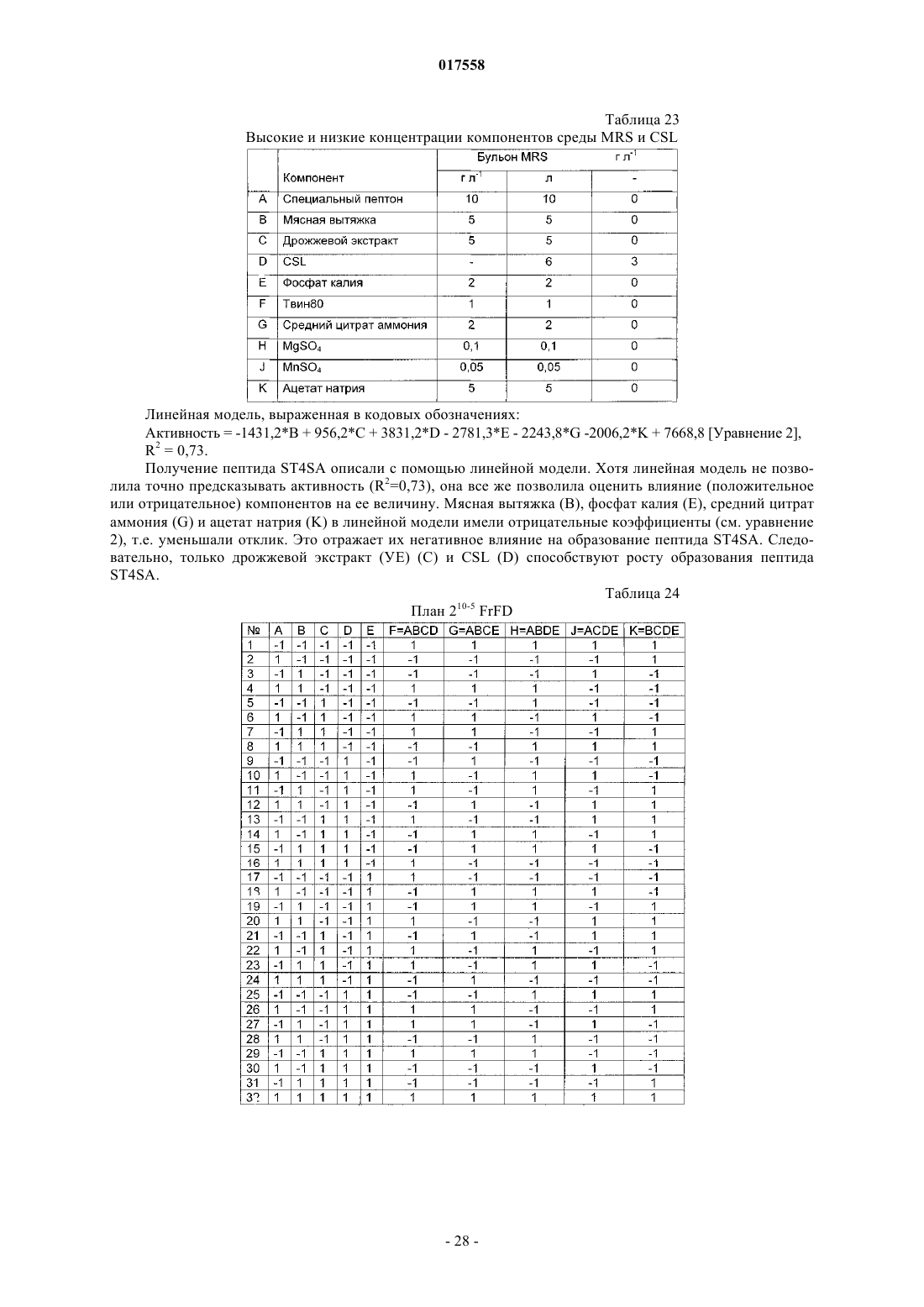
Штамм бактерий е.mundtii st4sa, способный продуцировать антибактериальный пептид st4sa, способ получения пептида st4sa и применение штамма бактерий е.mundtii st4sa и пептида
Номер патента: 17558
Опубликовано: 30.01.2013
Авторы: Кноетзе Хенриетте, Бринк Марелизе, Дикс Леон Милнер Теодоре, Тодоров Светослав Димитров
Формула / Реферат
1. Штамм бактерий E.mundtii ST4SA АТСС РТА-7278, способный при брожении в питательной среде, содержащей усвояемые источники углерода, азота и неорганические вещества, продуцировать антибактериальный пептид ST4SA, имеющий аминокислотную последовательность SEQ ID NO:12 или последовательность, которая более чем на 75% гомологична указанной, в извлекаемом количестве.
2. Способ получения изолированного антибактериального пептида ST4SA, имеющего аминокислотную последовательность SEQ ID NO:12 или последовательность, которая более чем на 75% гомологична указанной, согласно которому штамм бактерий E.mundtii ST4SA по п.1 культивируют в питательной среде при микроаэрофильных условиях и температуре от 10 до 45°C до получения извлекаемого количества упомянутого пептида, после чего пептид извлекают, при этом в качестве питательной среды используют один или несколько из перечисленных ниже вариантов: кукурузный ликер; сухая сырная сыворотка; бульон MRS (Манна-Рогоза); дрожжевой экстракт; меласса.
3. Способ по п.2, дополнительно включающий получение фрагментов указанного пептида, обладающих антибактериальной активностью.
4. Способ лечения бактериальной инфекции в организме животного или человека, на одной из стадий которого инфицированный участок организма человека или животного подвергают воздействию композиции, содержащей терапевтически эффективное количество штамма бактерий Е.mundtii ST4SA по п.1.
5. Способ по п.4, в котором указанный штамм используют в концентрации от 106 до 109 КОЕ (колониеобразующих единиц) на 1 мл композиции.
6. Способ лечения бактериальной инфекции в организме животного или человека, на одной из стадий которого инфицированный участок организма человека или животного подвергают воздействию композиции, содержащей терапевтически эффективное количество изолированного антибактериального пептида ST4SA или его фрагмента, полученных согласно способу по любому из пп.2, 3.
7. Способ по п.6, в котором указанный пептид или его фрагмент используют в концентрации от 100000 до 300000 УЕ на 1 мл композиции.
8. Способ лечения бактериальной инфекции в организме животного или человека, на одной из стадий которого инфицированный участок организма человека или животного подвергают воздействию композиции, содержащей терапевтически эффективное количество штамма бактерий Е.mundtii ST4SA по п.1 и изолированного антибактериального пептида ST4SA или его фрагмента, полученных согласно способу по любому из пп.2, 3.
9. Способ по п.8, в котором указанный штамм используют в концентрации от 106 до 109 КОЕ (колониеобразующих единиц) на 1 мл композиции.
10. Способ по п.8, в котором указанный пептид или его фрагмент используют в концентрации от 100000 до 300000 УЕ на 1 мл композиции.
11. Композиция для лечения бактериальной инфекции в организме животного или человека, содержащая штамм бактерий E.mundtii ST4SA по п.1, выполненная в виде жидкого препарата, мази, лосьона, крема, геля, жидкого спрея, лиофилизированного порошка, лиофилизированного спрея, жидкости для полоскания рта или горла.
12. Композиция для лечения бактериальной инфекции в организме животного или человека, содержащая изолированный антибактериальный пептид ST4SA или его фрагмент, полученные согласно способу по любому из пп.2, 3, выполненная в виде жидкости, мази, лосьона, крема, жидкого спрея, лиофилизированного спрея, жидкости для полоскания рта или горла.
13. Пробиотическая композиция, содержащая терапевтически эффективное количество штамма бактерий E.mundtii ST4SA по п.1 в концентрации от 105 до 109 жизнеспособных клеток (КОЕ) на 1 мл пробиотической композиции.
14. Пробиотическая композиция по п.13, выполненная в виде жидкости, таблеток, конфет, жевательной резинки или в иной съедобной форме.
15. Способ сокращения числа патогенных бактерий или вирусов в организме животного или человека, на одной из стадий которого в организм животного или человека вводят терапевтически эффективное количество пробиотической композиции по п.13.
16. Способ по п.15, в котором конечная концентрация жизнеспособных клеток бактерий (КОЕ), вводимых в организм животного или человека, составляет от 103 до 106 КОЕ/мл пробиотической композиции.
Текст
ШТАММ БАКТЕРИЙ Е.Mundtii ST4SA, СПОСОБНЫЙ ПРОДУЦИРОВАТЬ АНТИБАКТЕРИАЛЬНЫЙ ПЕПТИД ST4SA, СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА ST4SA И ПРИМЕНЕНИЕ ШТАММА БАКТЕРИЙ Е.Mundtii ST4SA И ПЕПТИДА Дикс Леон Милнер Теодоре, Тодоров Светослав Димитров, Кноетзе Хенриетте, Бринк Марелизе (ZA) Бедарева Е.П. (RU) Изобретение относится к пептиду, получаемому из штамма E.mundtii, и к пробиотической композиции штамма E.mundtii. В частности, изобретение относится к пептиду, получаемому из штамма E.mundtii, гену, который кодирует упомянутый пептид, а также к различным применениям пробиотической композиции, пептида и штамма, из которого получается пептид, в частности, для лечения бактериальной инфекции в организме животного или человека. Штамм бактерий E.mundtii ST4SA АТСС РТА-7278, способный при брожении в питательной среде,содержащей усвояемые источники углерода, азота и неорганические вещества, продуцировать антибактериальный пептид ST4SA, имеющий аминокислотную последовательность SEQ ID NO:12 или последовательность, которая более чем на 75% гомологична указанной, в извлекаемом количестве. Способ получения изолированного антибактериального пептида ST4SA, имеющего аминокислотную последовательность SEQ ID NO:12 или последовательность, которая более чем на 75% гомологична указанной, согласно которому штамм бактерий E.mundtii ST4SA по п.1 культивируют в питательной среде при микроаэрофильных условиях и температуре от 10 до 45C до получения извлекаемого количества упомянутого пептида, после чего пептид извлекают, при этом в качестве питательной среды используют один или несколько из перечисленных ниже вариантов: кукурузный ликер; сухая сырная сыворотка; бульон MRS (Манна-Рогоза); дрожжевой экстракт; меласса.(71)(73) Заявитель и патентовладелец: СИПЛА МЕДПРО РЕСЕЧ ЭНД ДЕВЕЛОПМЕНТ (ПТИ) ЛТД. (ZA) 017558 Область изобретения Изобретение относится к пептиду, получаемому из штамма Е.mundtii, и к пробиотической композиции штамма Е.mundtii. В частности, изобретение относится к пептиду, получаемому из штамма Е.mundtii, гену, который кодирует упомянутый пептид, а также к различным применениям пептида и штамма, из которого получается пептид. Предпосылки создания изобретения Молочнокислые бактерии играют важную роль в поддержании здоровой микрофлоры желудочнокишечного тракта. Диеты, стресс, микробные инфекции и желудочно-кишечные заболевания нарушают микробный баланс, что часто вызывает уменьшение количества жизнеспособных молочнокислых бактерий (особенно лактобактерий и бифидобактерий) в желудочно-кишечном тракте. Результат - бесконтрольное стремительное развитие популяций патогенных бактерий, которое может вызвать диарею и другие клинические заболевания - рак, воспаления, язвенный колит. Одним из ключевых свойств пробиотических молочнокислых бактерий является адгезия - способность клеток прикрепляться к клеткам эпителия или кишечной слизи. Для этого требуется тесное взаимодействие между рецепторными молекулами клеток эпителия и поверхностью бактерий. Адгезия клеток пробиотика предотвращает прикрепление патогенов, а также стимулирует иммунную систему. Последнее достигается за счет взаимодействия со слизистыми оболочками, в результате чего активируются лимфоциты. Другое важное свойство пробиотиков - выживание при низком значении pH и высокой концентрации солей желчных кислот. Известно, что некоторые штаммы бифидобактерий, лактобактерий и энтерококков, характерные для кишечника человека и животных, вырабатывают бактериоцины (антимикробные пептиды). Роль этих пептидов и их вклад в регулирование популяций патогенных бактерий в желудочно-кишечном тракте пока неясны. Однако последние исследования указывают на активность бактериоцинов в отношении грамотрицательных бактерий, что свидетельствует о возобновлении интереса к этим пептидам и механизму их взаимодействия с кишечными патогенами. Большинство таких бактериоцинов вырабатываются молочнокислыми бактериями, которые обычно присутствуют в желудочно-кишечном тракте, а именно бактериями группы Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus casei, LactobacillusEnterococcus faecalis. Изобретение относится к штамму E.mundtii, который устойчив к стрессовым условиям желудочнокишечного тракта (низкий уровень pH, желчные соли, соли, панкреатические ферменты и т.п.) и продуцирует антимикробный пептид широкого спектра действия (пептид ST4SA). Краткое описание изобретения Настоящее изобретение предусматривает штамм бактерий E.mundtii ST4SA АТСС РТА-7278, способный при брожении в питательной среде, содержащей усвояемые источники углерода, азота и неорганические вещества, продуцировать антибактериальный пептид ST4SA, имеющий аминокислотную последовательность SEQ ID NO:12 или последовательность, которая более чем на 75% гомологична указанной, в извлекаемом количестве. Также данное изобретение предусматривает способ получения изолированного антибактериального пептида ST4SA, имеющего аминокислотную последовательность SEQ ID NO:12 или последовательность, которая более чем на 75% гомологична указанной,согласно которому штамм бактерий E.mundtii ST4SA по п.1 культивируют в питательной среде при микроаэрофильных условиях и температуре от 10 до 45C до получения извлекаемого количества упомянутого пептида, после чего пептид извлекают, при этом в качестве питательной среды используют один или несколько из перечисленных ниже вариантов: кукурузный ликер; сухая сырная сыворотка; бульонMRS (Манна-Рогоза); дрожжевой экстракт; меласса. Способ получения изолированного антибактериального пептида ST4SA может дополнительно включать получение фрагментов указанного пептида, обладающих антибактериальной активностью. Штамм бактерий E.mundtii ST4SA используют в способе лечения бактериальной инфекции в организме животного или человека, на одной из стадий которого инфицированный участок организма человека или животного подвергают воздействию композиции, содержащей терапевтически эффективное количество вышеописанного штамма бактерий E.mundtii ST4SA. В предпочтительном варианте указанный штамм используют в концентрации от 106 до 109 КОЕ (колониеобразующих единиц) на 1 мл композиции. Изолированный антибактериальный пептид ST4SA настоящего изобретения используют в способе лечения бактериальной инфекции в организме животного или человека, на одной из стадий которого инфицированный участок организма человека или животного подвергают воздействию композиции, содержащей терапевтически эффективное количество изолированного антибактериального пептида ST4SA или его фрагмента, полученных согласно вышеописанному способу. В предпочтительном варианте указанный пептид или его фрагмент используют в концентрации от 100000 до 300000 УЕ на 1 мл композиции.-1 017558 В другом варианте изолированный антибактериальный пептид ST4SA настоящего изобретения используют в способе лечения бактериальной инфекции в организме животного или человека, на одной из стадий которого инфицированный участок организма человека или животного подвергают воздействию композиции, содержащей терапевтически эффективное количество штамма бактерий E.mundtii ST4SA и изолированного антибактериального пептида ST4SA или его фрагмента, полученных согласно вышеописанному способу. Предпочтительно использовать указанный штамм в концентрации от 106 до 109 КОЕ(колониеобразующих единиц) на 1 мл композиции или использовать указанный пептид или его фрагмент в концентрации от 100000 до 300000 УЕ на 1 мл композиции. Данное изобретение также предусматривает композицию для лечения бактериальной инфекции в организме животного или человека, содержащую штамм бактерий E.mundtii ST4SA по настоящему изобретению, выполненную в виде жидкого препарата, мази, лосьона, крема, геля, жидкого спрея, лиофилизированного порошка, лиофилизированного спрея, жидкости для полоскания рта или горла. Данное изобретение также предусматривает композицию для лечения бактериальной инфекции в организме животного или человека, содержащую изолированный антибактериальный пептид ST4SA или его фрагмент, полученные согласно способу по настоящему изобретению, выполненную в виде жидкости, мази, лосьона, крема, жидкого спрея, лиофилизированного спрея, жидкости для полоскания рта или горла. Композиция может быть использована для местного лечения таких заболеваний, как, например,ушные инфекции (например, воспаления среднего уха), горловые, глазные и кожные инфекции; жидкий препарат можно также применять в качестве жидкой пищевой добавки, растворов для промывки контактных линз либо в составе самих линз. Кроме того, пептид можно использовать в качестве антимикробного средства в составе спрея для лечения таких болезней, как носовые инфекции, синусит, тонзиллит, горловые инфекции, ринит. Также пептид может применяться в виде лиофилизированного порошка. Пептид может применяться в качестве антимикробного средства в составе упаковочного материала, например пластмассы, при производстве стерильных упаковочных материалов. Бактериальная инфекция может быть представлена любой из перечисленных ниже инфекций либо любой их комбинацией: Acinetobacter baumanii; Bacillus cereus; Clostridium tyrobutyricum; EnterobacterStreptococcus pneumoniae. Данное изобретение также предусматривает пробиотическую композицию, содержащую терапевтически эффективное количество штамма бактерий E.mundtii ST4SA по настоящему изобретению в концентрации от 105 до 109 жизнеспособных клеток (КОЕ) на 1 мл пробиотической композиции. Пробиотическая композиция может быть выполнена в виде жидкости, таблеток или капсул, конфет, жевательной резинки или в иной съедобной форме. Указанную пробиотическую композицию применяют в способе сокращения числа патогенных бактерий или вирусов в организме животного или человека, на одной из стадий которого в организм животного или человека вводят терапевтически эффективное количество вышеописанной пробиотической композиции. Предпочтительно, чтобы конечная концентрация жизнеспособных клеток бактерий (КОЕ),вводимых в организм животного или человека, составляла от 103 до 106 КОЕ/мл пробиотической композиции, желательно от 105 до 106 КОЕ/мл, наиболее предпочтительно - около 3105 КОЕ/мл. Пробиотическая композиция может применяться в виде порошка, жидкости, геля, таблеток либо в составе продуктов питания. Пробиотическая композиция в жидком виде может использоваться как жидкая пищевая добавка. Также изобретение предусматривает способ подавления роста бактерий, на одной из стадий которого бактерии подвергаются воздействию эффективного количества антимикробного пептида настоящего изобретения. Бактерии могут быть представлены любыми бактериями из перечисленных ниже:carnosus; Streptococcus caprinus; Streptococcus (Enterococcus) faecalis или Streptococcus pneumoniae. Способ может включать в себя стадию, на которой бактерии подвергаются воздействию антимикробного пептида настоящего изобретения в концентрации от 100000 до 300000 УЕ/мл, желательно около 200000 УЕ/мл.-2 017558 Краткое описание чертежей В дальнейшем приводится подробное описание изобретения и примеров его осуществления со ссылкой на приложенные чертежи и таблицы, на которых приведены: фиг. 1 - изображение клеточной морфологии штамма ST4SA E.mundtii, полученное с помощью сканирующей электронной микроскопии (СЭМ); фиг. 2 - фотография агарозного геля, показывающая результат полимеразной цепной реакции ПЦР(фрагмент ДНК), полученный с помощью родоспецифических праймеров. В результате был получен родоспецифический фрагмент ДНК длиной в 112 кб (килобаз, тысяч нуклеотидов), специфичный для энтерококков (Enterococcus); фиг. 3 - фотография агарозного геля, на которой показан результат ПЦР (фрагмент ДНК), полученный с помощью видоспецифических праймеров. В результате был получен видоспецифический фрагмент ДНК длиной в 306 п.н. (пар нуклеотидов), специфичный для Enterococcus mundtii; фиг. 4 - графическое изображение пептида ST4SA, выделенного гель-фильтрацией (хроматографAKTA-purifier); фиг. 5 - фотография полиакриламидного геля с додецилсульфатом натрия, показывающая положение пептида ST4SA; фиг. 6 А - фотография агарозного геля, на которой виден плазмидный профиль ST4SA E.mundtii; фиг. 6 Б - результат анализа Саузерн-блоттинг, на котором видно положение структурного гена в хромосоме (геноме) штамма ST4SA; фиг. 7 - схематичное изображение последовательности аминокислот пептида ST4SA E.mundtii; фиг. 8 - последовательность ДНК структурного гена (А), транспортного гена (В) и гена иммунитета(С) пептида ST4SA; фиг. 9 А и 9 Б показано влияние компонентов питательной среды на получение пептида ST4; фиг. 10 - графическое изображение образования пептида ST4SA в бульоне MRS; фиг. 11 - фотография агарозного геля, где виден фрагмент ДНК, который, возможно, содержит предполагаемый ген адгезии; фиг. 12 - график, иллюстрирующий стабильность пептида ST4SA (неочищенный экстракт, взвешенный в стерильной дистиллированной воде) при различных температурах; фиг. 13 - фотография зон подавления вида Pseudomonas в чашке с агаром; фиг. 14 - фотография Streptococcus pneumoniae, обработанных пептидом ST4SA (409600 УЕ/мл),утечка цитоплазмы показана стрелками; фиг. 15 - график, иллюстрирующий подавление роста Streptococcus pneumoniae (патоген 27); фиг. 16 - график, иллюстрирующий подавление роста Streptococcus pneumoniae (патоген 29); фиг. 17 - график, иллюстрирующий подавление роста Klebsiella pneumoniae (патоген 30); фиг. 18 - график, иллюстрирующий подавление роста изолята из среднего уха (патоген 40); фиг. 19 - график, иллюстрирующий подавление роста изолята из среднего уха (патоген BW); фиг. 20 - график, иллюстрирующий подавление роста изолята из среднего уха (патоген Е); фиг. 22 - график, иллюстрирующий подавление роста изолята из среднего уха (патоген GW); фиг. 23 - график, иллюстрирующий подавление роста изолята из среднего уха (патоген HW); фиг. 24 - график, иллюстрирующий рост штамма ST4SA в присутствии Listeria innocua LMG 13568 и образование пептида ST4SA. Обозначения:= образование пептида ST4SA; фиг. 25 - схематическое представление модели желудочно-кишечного тракта (ЖКМ), разработанной для оценки пробиотического штамма ST4SA; фиг. 26 - схема, показывающая блокирование целевого участка липида II ванкомицином и его влияние на механизм действия (антимикробную активность) пептида ST4SA. % утечки обозначает утечку цитоплазмы, отмеченную по увеличенным уровням активности ДНК и -галактозидазы; фиг. 27 - схематическое изображение встроенного в пептид дисульфидного моста, который ковалентно соединяет аминокислоты 9 (цистеин) и 14 (цистеин); фиг. 28 - кривая гидрофобности ST4SA; фиг. 29 - приведены результаты выживания L.monocytogenes при стимуляции ST4SA в искусственных условиях (модель ЖКТ); фиг. 30 - кривые роста Е.mundtii ST4SA в бульоне MRS и среде CSL (кукурузный ликер); фиг. 31 - изображены окрашенные гемолизином и эозином срезы: (А) контрольная группа, толстая кишка (Б) прием штамма ST4SA, толстая кишка (В) контрольная группа, подвздошная кишка (Г) прием штамма ST4SA, подвздошная кишка (Д) контрольная группа, печень (Е) прием штамма ST4SA, печень-3 017558 В табл. 1 приведены фенотипические характеристики штамма ST4SA (реакции брожения сахара). В табл. 2 приведены характерные признаки штамма ST4SA. В табл. 3 приведены результаты воздействия ферментов, температуры, pH и детергентов на пептидST4SA. В табл. 4 показан спектр активности пептида ST4SA. В табл. 5 иллюстрируется активность пептида ST4SA на бумажных дисках. В табл. 6 сравнивается активность пептида ST4SA и популярных антибиотиков. В табл. 7 иллюстрируется адгезия пептида ST4SA к патогенам. В табл. 8 показаны данные касательно активности внеклеточной ДНК после обработки патогенов пептидом ST4SA. В табл. 9 показаны данные касательно активности -галактозидазы после обработки патогенов пептидом ST4SA. В табл. 10 представлено функционирование ЖКМ (автоматизированное). В табл. 11 представлены данные о выживании штамма ST4SA и об образовании пептида ST4SA в ЖКМ, где в качестве целевого организма (патогена) использовали Listeria monocytogenes. Приведенные значения являются усреднением трех экспериментов. В качестве питательных веществ использовалиNAN Pelargon (компания Nestl) и MRS (среда Мана и Рогозы, компания Biolab) соответственно. В табл. 12 показана устойчивость штамма ST4SA к антибиотикам. Табл. 13 показывает рост штамма ST4SA в присутствии различных концентраций триметопримсульфаметаксозола (TMP-SMX) и метронидазола. В табл. 14 приведены оцениваемые факторы вирулентности. В табл. 15 показаны результаты определения адгезии штамма ST4SA к клеточным линиям Caco-2 методом подсчета колоний в чашках (контроль). В табл. 16 показано конкурентное исключение штамма ST4SA и L.monocytogenes. В табл. 17 приведены числовые данные, характеризующие изменения массы тела крыс, которым давали штамм ST4SA, препарат Лактовита или воду без добавок. В табл. 18 показана активность -глюкуронидазы в образцах экскрементов, взятых у самцов крыс Уистара в рамках (А) 107-дневного исследования препарата Лактовита и (Б) 50-дневного исследования штамма ST4SA. Значения обозначают количество мМ -нитрофенола, высвобождаемое за 2 ч. Значения стандартной ошибки приведены в скобках. В табл. 19 показана очистка пептида ST4SA в среде MRSf (фильтрат MRS). В табл. 20 приведены результаты проверки чистого кукурузного ликера, мелассы и сухой сырной сыворотки в качестве потенциальных сред для выращивания пептида ST4SA. В табл. 21 приведен полный факторный план (FFD) с кукурузным ликером и сухой сырной сывороткой в качестве компонентов, направленный на определение сред, оказывающих наибольшее влияние на получение пептида ST4SA. В табл. 22 показаны результаты использования кукурузного сиропа, дополненного компонентами среды MRS для оптимизации активности ST4SA. В табл. 23 показаны высокие и низкие концентрации компонентов среды MRS и CSL (кукурузный сироп). В табл. 24 приведен 210-5 дробный факторный план FrFD. В табл. 25 содержится анализ таблицы вариаций для плана 210-5 FrFD. В табл. 26 показан 22 полный факторный план FFD с 3 центральными точками для определения концентраций CSL (кукурузного ликера) и УЕ (дрожжевого экстракта). В табл. 27 приведены данные по потреблению углерода во время брожения. В табл. 28 показаны результаты проверки устойчивости E.mundtii ST4 к антибиотикам и противовоспалительным средствам. В табл. 29 приведены результаты влияния антибиотиков и противовоспалительных средств на адгезию ST4SA к клеткам Caco-2. Подробное описание изобретения Предлагается штамм бактерии Enterococcus mundtii, который устойчив к стрессовым условиям желудочно-кишечного тракта (низкий уровень pH, желчные соли, соли, панкреатические ферменты и т.п.) и вырабатывает антимикробный пептид широкого спектра действия, а именно пептид ST4SA. ШтаммEnterococcus mundtii, из которого получают пептид ST4SA, содержится в АТСС (Американской коллекции типовых культур) под номером РТА-7278. Наблюдается активность пептида в отношении большого числа грамположительных и грамотрицательных бактерий, большинство из которых выделены из инфекций среднего уха и кишечника. Примеры подавляемых бактерий: Acinetobacter baumanii, Bacillusinnocua, Pseudomonas aruginosa, Staphylococcus aureus, Staphylococcus carnosus, Streptococcus caprinus,Streptococcus (Enterococcus) faecalis, Streptococcus pneumoniae, а также некоторое количество клинических штаммов неопознанных грамположительных и грамотрицательных бактерий, изолированные из-4 017558 проб жидкости воспаленного среднего уха. Таким образом, пептид имеет обширный спектр действия,затрагивающий множество разнообразных человеческих патогенов. Уже описано несколько антимикробных пептидов широкого спектра действия, активных в отношении грамотрицательных бактерий, например пентоцин 35d, получаемый из Lactobacillus pentosus, бактериоцин ST151BR, получаемый из Lactobacilius pentosus ST151BR, бактериоцин, получаемый изAS-48, получаемый из Enterococcus faecalis, бактериоцин, получаемый из Lactococcus lactis KCA2386 и энтероцин CRL35, получаемый из Enterococcus faecium. Однако область действия этих пептидов намного уже по сравнению с пептидом ST4SA, что видно из приведенного выше списка видов, восприимчивых к пептиду ST4SA. Широкий спектр активности пептида ST4SA, особенно в отношении патогенных бактерий, делает его идеальным средством для регуляции бактериальных инфекций, в особенности воспалений среднего уха (благодаря активности пептида в отношении большого количества различных патогенов среднего уха), а также патогенов, связанных с вторичными раневыми инфекциями (пептид подавляет рост численности таких патогенов). Из жидкости инфицированного среднего уха были изолированы следующие патогенны: Acinetobacter baumanii, Escherichia coli, Klebsiella pneumoniae, Pseudomonasaruginosa, Staphylococcus aureus, Staphylococcus carnosus, Streptococcus pneumoniae, а также некоторое количество неопознанных грамположительных и грамотрицательных бактерий. Материалы и методы. Изолирование штамма ST4SA и его идентификация до уровня видов. Соевый экстракт, полученный из соевых бобов, вымоченных в стерильной дистиллированной воде в течение 4 ч, последовательно разбавляли и высевали на чашки с агаром MRS (компания Biolab, BiolabGist-brocades, B.V., г. Делфт, Нидерланды) для предотвращения развития грибков. Чашки инкубировали в течение двух дней при температуре 30 и 37C. Колонии были случайным образом отобраны из чашек с количеством колониеобразующих единиц КОЕ от 50 до 300, после чего произвели скрининг на наличие антимикробной активности путем наложения второго слоя агара MRS, дополненного препаратом Delvocid (50 мг/л). Чашки инкубировали в течение 48 ч при температуре 30 и 37C в анаэростате (компания Oxoid, Хэмпшир, Англия) в присутствии газообразующего комплекта (компания Oxoid). Колонии покрыли третьим слоем (около 10 мл) полутвердой (1,0% агар, вес./об.) среды BHI (сердечно-мозговая вытяжка, компания Merck, г. Дармштадт,Германия), дополненной 1 мл активно растущих клеток (около 106 cfu/ml) Lactobacillus casei, Enterococcus faecalis, Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Streptococcus pneumoniae и Staphylococcus aureus соответственно. Чашки инкубировали в течение 24 ч при температуре 37C. Одна из колоний подавляла наибольшее многообразие патогенов, входящих в испытательную группу (табл. 4), и была пересеяна в бульон MRS (компания Biolab), после чего штриховым методом получили чистые культуры. Изолят обозначили как штамм ST4SA. Антимикробную активность подтвердили с помощью капельного теста на агаре. Клеточную морфологию штамма ST4SA изучали посредством сканирующей электронной микроскопии (СЭМ) (см. фиг. 1). 10 мл культуры штамма ST4SA в начальной экспоненциальной фазе(ОП 600 нм=0,2) собрали центрифугированием и пять раз промыли стерильной дистиллированной водой(3000 об/мин, 10 мин, 4C). Осадок перерастворили в 500 мкл стерильной воды, очищенной с помощью системы MilliQ (Waters, Millipore), а затем подвергли микроскопии. Дальнейшую идентификацию проводили по физиологическим (табл. 2) и биохимическим признакам. Тест на образование пигмента проводили на триптическом соевом бульоне (компания Merck). Также выполнили тест на мобильность. Реакции брожения сахара (табл. 1) отмечали с помощью тестовых полосок API 50 CHL и API 20 Strep (компания Biomrieux, г. Марси-Летуаль, Франция) и сопоставляли с реакциями, указанными для энтерококков. Дальнейшую идентификацию выполняли по расположению полос фрагментов ДНК, созданных с помощью праймеров, специфических для энтерококков (фиг. 2) и Enterococcus mundtii (фиг. 3). В качестве маркера использовали фрагмент ДНК длиной в 50 п.н. (компания Amersham Bioscience, UK Limited,Великобритания). Праймеры, с помощью которых был создан фрагмент длиной в 306 п.н. (изображенный на фиг. 3), синтезировали из подходящих консервативных участков 16S рДНК. Секвенирование фрагмента ДНК показало 98% гомологии с консервативными участками 16S рДНК из базы данных GenBank. Выражение антимикробной активности. Антимикробную активность выражали в условных единицах (УЕ) на 1 мл бесклеточного супернатанта. За одну УЕ принимали обратную величину максимального разбавления, демонстрирующего четкую зону подавления роста, и рассчитывали по формулеb - последнее разбавление, образующее зону подавления диаметром не менее 2 мм. Активность на 1 мл получали умножением на 100. В качестве индикаторного штамма использовалиLactobacillus casei LHS. Определение характеристик антимикробного вещества. Штамм ST4SA культивировали в бульоне MRS (компания Biolab) в течение 24 и 48 ч при температуре 30C. После этого клетки собирали (8000 об/мин, 4C, 15 мин) и доводили бесклеточные супернатанты до pH 6,0 с помощью 6 М NaOH. 1 мл каждого супернатанта обрабатывали каталазой (компанияBoehringer Mannheim GmbH, Германия), при 1 и 0,1 мг/мл (конечная концентрация) соответственно. После инкубации ферменты инактивировали нагреванием (3 мин при 100C) и проверяли на антимикробную активность согласно вышеописанной процедуре. Результаты приведены в табл. 3. Аликвоты пептида ST4SA подвергали воздействию температур 30, 60 и 100C в течение 10, 30 и 90 мин соответственно и 121C в течение 20 мин (табл. 3). Затем образцы проверяли на антимикробную активность согласно вышеописанной процедуре.+ = зоны активности не менее 5 мм в диаметре. В рамках отдельного эксперимента образцы пептида ST4SA доводили до pH от 2 до 12, инкубировали при 37C в течение 30 мин, нейтрализовали до рН 7, а затем проверяли на антимикробную активность (табл. 3). Изолирование и очистка пептида ST4SA. Культуру штамма ST4SA суточной давности прививали (2%, об./об., ОП 600 нм=8,0) в бульон MRS(компания Biolab). Инкубацию проводили при температуре 37C, без встряхивания, в течение 20 ч. Затем клетки собрали (8000 об/мин, 10 мин, 4C) и осадили пептид из бесклеточного супернатанта сульфатом аммония с насыщенностью 80%. Осадок перерастворили в одной десятой объема 25 мМ ацетата аммония(pH 6,5), обессолили на дистиллированной воде с помощью диализной мембраны с MWCO=1000 Да(компания Spectrum Inc., штат Калифорния, США) и поместили на колонку SepPak C18 (компания WaterMillipore, штат Массачусетс, США). Колонку промыли 20% (об./об.) раствором изопропанола в 25 мМ ацетата аммония (pH 6,5) и бактериоцином, элюированным 40% раствором изопропанола в 25 мМ ацетата аммония (pH 6,5). После сушки в вакууме (прибор Speed-Vac; компания Savant) фракции объединили и растворили в 50 мМ фосфатного буфера, pH 6,5. Активные фракции подвергли дальнейшему разделению посредством гель-хроматографии (гель-фильтрации) в колонке Superdex 75 (компанияAmersham Pharmacia Biotech), связанной с хроматографом KTA-purifier (компания Amersham) (фиг. 4). Элюирование пептида из колонки производили посредством 50 мМ фосфатного буфера и 400 мМ NaCl,pH 6,5. Пептиды были обнаружены при 254 и 280 нм соответственно. Фракции, содержащие активный пептид, собрали, высушили в вакууме и хранили при температуре -20C. Проверку на активность проводили с помощью капельного теста на агаре. Определение размера. Штамм ST4SA выращивали в бульоне MRS (компания Biolab) в течение 20 ч при температуре 30C. Клетки собирали центрифугированием (8000 об/мин, 10 мин, 4C) и осаждали пептид ST4SA из бесклеточного супернатанта сульфатом аммония с насыщенностью 80%. Осадок перерастворили в одной десятой объема 25 мМ ацетата аммония (pH 6,5), обессолили на дистиллированной воде посредством диализной мембраны с MWCO=1000 Да (компания Spectrum Inc., штат Калифорния, США) и отделили с помощью трицин-SDS (додецилсульфат натрия)-ПААГ (электрофореза в полиакриламидном геле) (фиг. 5 А). Использовали низкомолекулярный маркер для размеров от 2,35 до 46 кДа (компания AmershamInternational, Великобритания). Гели зафиксировали и наполовину покрыли L.casei LHS (106 КОЕ/мл),введенными в агар с сердечно-мозговой вытяжкой (компания Biolab), чтобы определить расположение активного бактериоцина (фиг. 5 В).-8 017558 Проверка пептида ST4SA на цитотоксичность. Для поиска цитотоксических свойств у пептида ST4SA в чашках тканевых культур в течение 48 ч в тройных лунках выращивали сплошные монослои клеток Vero почек обезьян, после чего их подвергали воздействию антимикробного пептида в различной концентрации. После 48 ч инкубации проверяли жизнеспособность клеток, для чего их обрабатывали солями тетразолия (МТТ) [3-(4,5-диметилтиазол-2-ил)2,5-дифенилтетразолиум бромид] (сигма). Отметили образование синего вещества (формазан), которое получается при расщеплении МТТ сукцинатдегидрогеназой. Уровень цитотоксичности в 50% (СС 50) определили как концентрацию пептида (мк/мл), требуемую для снижения жизнеспособности клеток на 50%. Согласно результатам CC50 (уровень цитотоксичности) не было отмечено цитотоксических свойств, т.е. пептид имеет нулевую цитотоксичность, т.е. CC50=0. Изолирование плазмиды. ДНК изолировали целиком. Изолировали плазмидную ДНК, затем ДНК подвергли дальнейшему очищению с помощью центрифугирования в градиенте плотности хлорида цезия. ДНК отделяли на агарозном геле (фиг. 6). В качестве маркера молекулярных масс использовалась лямбда-ДНК, обработаннаяEcoRI и HindIII (компания Promega, г. Мэдисон, США). Излечивание плазмиды. Проводили эксперименты по излечиванию. Клетки Ent. mundtii ST4SA инкубировали в присутствии новобиоцина (1-25 мкгмл-1) в течение 72 ч при температуре 37C. Культуру, которая росла при наибольшей концентрации новобиоцина, последовательно разбавляли стерильным соляным раствором и высевали на чашки с агаром MRS. После ночной инкубации при 37C колонии были перепечатаны (методом отпечатков) на другие чашки, а исходные чашки покрыли клетками Enterococcus faecalis LMG 13566. После дополнительных 16 ч инкубации при 37C колонии проверили на утерю антимикробной активности. Эксперименты с конъюгативным переносом. Проводили эксперименты по конъюгации через фильтр. К 4,5 мл MRS добавляли выращенную за ночь культуру (0,25 мл) Ent. mundtii ST4SA и Ent. faecalis FA2-2, перемешивали и пропускали через стерильный мембранный фильтр с диаметром пор 0,45 мкм (HAWP, компания Millipore). Мембрану высевали в чашку с MRS агаром и ночью инкубировали при температуре 37C. Клетки с фильтра вымывали в 1 мл MRS, последовательно разбавляли и высевали на чашки с MRS агаром, содержащие 25 мкгмл-1 фусидовой кислоты, 25 мкгмл-1 рифампицина и 2000 УЕ мл-1 неочищенного пептида ST4SA. Эксперимент повторяли, используя в качестве реципиента Ent. faecalis OGX1. В этом случае выборку осуществляли на чашках, содержащих 1 мгмл-1 стрептомицина и 2000 УЕ мл-1 неочищенного пептида ST4SA. Колонии выбирали случайным образом и проверяли на образование пептида ST4SA, также проводился скрининг на содержание плазмиды согласно вышеописанной процедуре. Колонию конъюгированных клеток Ent.faecalis OGX1, содержащую pST4SA, культивировали и проверяли активность бесклеточного супернатанта согласно вышеописанным процедурам. Обнаружение генетических элементов, кодирующих пептид ST4SA и секвенирование ДНК. ДНК изолировали целиком. Для амплификации структурного гена, транспортного гена и гена иммунитета с помощью ПЦР использовали праймеры (см. ниже), синтезированные на основе частичных последовательностей, опубликованных для других антимикробных пептидов. Секвенирование производили с помощью комплекта для секвенирования ABI Prism BigDye Terminator Cycle SequencingReady Reaction и секвенатора ДНК ABI Prism 377 (компания РЕ Applied Biosystem, г. Фостер Сити,США). Поиск по базам данных осуществляли с помощью программ BLASTN и BLASTX Национального информационного центра биотехнологий (NCBI), г. Бетесда, штат Мэрилэнд, 20894, США. Образование пептида ST4SA в различных питательных средах и при различных начальных значениях pH. 18-часовую культуру штамма ST4SA прививали (2%, об./об.) в бульон MRS, бульон с сердечномозговой вытяжкой и бульон М 17 (компания Merck, г. Дармштадт, Германия), соответственно. Инкубацию проводили при температуре 30 и 37C соответственно, без встряхивания, в течение 28 ч. Каждый час производили забор образцов, которые исследовали на рост бактерий (ОП при 600 нм), изменения значения pH культуры и на антимикробную активность (УЕ/мл) в отношении L.casei LHS. Использовали метод капельного теста на агаре, описанный ранее. В рамках отдельного эксперимента устанавливали влияние начального значения pH среды на образование пептида ST4SA. Образцы бульона MRS каждый объемом 300 мл с помощью 6 М HCl или 6 М(фиг. 9 А). В каждую колбу прививали 2% (об./об.) 18-часовой культуры штамма ST4SA и инкубировали при температуре 30C в течение 20 ч, без встряхивания. Изменения в значении pH культуры и образовании пептида ST4SA (в УЕ/мл) определяли каждый час согласно вышеописанной процедуре. Все эксперименты проводили в трех экземплярах. Влияние состава среды на получение пептида ST4SA. Штамм ST4SA выращивали в 10 мл бульона MRS в течение 18 ч при 30C, клетки собирали центрифугированием (8000 об/мин, 10 мин, 4C), осадок перерастворяли в 10 мл стерильной пептонной воды. 4 мл полученной клеточной суспензии использовали для привития образцов следующих сред(а) бульон MRS (Ман, Рогоза, Шарп), без органических питательных веществ, дополненный триптоном (20,0 г/л), мясной вытяжкой (20,0 г/л), дрожжевым экстрактом (20,0 г/л), триптоном (12,5 г/л) и мясной вытяжкой (7,5 г/л), триптоном (12,5 г/л) и дрожжевым экстрактом (7,5 г/л), мясной вытяжкой(10,0 г/л) и дрожжевым экстрактом (10,0 г/л) либо комбинацией триптона (10,0 г/л), мясной вытяжки(г) бульон MRS с 0,1-40,0 г/л фруктозы в качестве единственного источника углерода;(е) бульон MRS (Ман, Рогоза, Шарп), дополненный 0-50,0 г/л глицерола. В рамках отдельного эксперимента в бульон MRS добавляли стерилизованные посредством фильтрации витамины при 1,0 мг/мл (конечная концентрация): цианокобаламин (компания Sigma, г. СентЛьюис, штат Миссури, США), L-аскорбиновую кислоту (компания BDH Chemicals Ltd, г. Пул, Великобритания), тиамин (компания Sigma), DL-6,8-тиоктовую кислоту (компания Sigma) и витамин K1 (компания Fluka Chemie AG, г. Букс СН-9471, Швейцария). Во всех испытаниях инкубацию производили при температуре 30C в течение 20 ч. Уровни активности пептида ST4SA определяли согласно вышеописанной процедуре. Все эксперименты проводили в трех экземплярах. Штамм ST4SA был опознан как штамм рода энтерококков на основе морфологии (см. фиг. 1), немобильности, отсутствия образования пигмента, а также ПЦР с родоспецифическими праймерами(фиг. 2) и видоспецифическими праймерами (фиг. 3). Дальнейшую идентификацию до уровня видов производили по характеру реакций брожения сахара (см. табл. 1) и по физиологическим параметрам(см. табл. 2). Пептид ST4SA инактивировали обработкой протеолитическими ферментами (протеиназа К, пепсин,проназа, папаин и трипсин), Тритоном Х-114 и нагреванием в течение 20 мин при 121C, что видно из табл. 3. Пептид оставался активным после нагревания в течение 90 мин при 100C, а также после обработки Твином 20, Твином 80, мочевиной, ЭДТА и Тритоном Х-100 (табл. 3). Не было отмечено потери активности после инкубации при значениях pH от 2,0 до 12,0 (табл. 3). Пептид ST4SA подавлял большое количество грамположительных и грамотрицательных бактерий,как видно из табл. 4. Таблица 4- 11017558 Пептид ST4SA очищали гель-фильтрацией (см. фиг. 4); как видно из фиг. 4 и 5, молекулярный вес пептида лежит в пределах 3400 Da. При проверке на Vero клетках согласно вышеописанной процедуре у пептида не было обнаружено цитотоксичных характеристик. Штамм ST4SA имеет две плазмиды (см. фиг. 6 А). При вылечивании штамма от этих плазмид потери антимикробной активности не наблюдалось. При зондировании хромосомной и плазмидной ДНК с помощью фрагмента ДНК, кодирующего структурный ген, отмечали четкое скрещивание с хромосомой(геномом) (см. фиг. 6 Б). Это доказывает, что структурный ген, кодирующий пептид ST4SA, содержится в геноме. Кроме того, конъюгация упомянутых плазмид с Е.faecalis (не показано на фигуре) не превратила штамм в источник пептида ST4SA, что подтверждает тот факт, что гены, кодирующие образование пептида ST4, располагаются в геноме штамма ST4SA. Последовательность пептида ST4SA приведена на фиг. 7 и в списке последовательностей, и в рамках данного изобретения обозначается как ПОСЛ. ИДЕНТ. НОМЕР 12. Последовательности транспортного и иммунного пептидов в рамках данного изобретения обозначаются как ПОСЛ. ИДЕНТ. НОМЕР 14 и 16 соответственно. Последовательности ДНК структурного, транспортного и иммунного генов приведены на фиг. 8 и в списке последовательностей, и в рамках данного изобретения обозначаются как ПОСЛ. ИДЕНТ. НОМЕР 11, 13 и 15 соответственно. Образование пептида ST4SA в различных питательных средах показано на фиг. 9 А и 9 Б. Влияние начального значения pH среды на образование пептида ST4SA приведено на фиг. 9 А. Из этих результатов очевидно, что оптимальной средой для получения пептида ST4SA является бульон MRS с начальным значением pH 6,0 или 6,5 и что наличие 10-20 г/л K2HPO4, 15,0-20,0 г/л фруктозы или присутствие витаминов С, В 1 и DL-6,8-тиоктовой кислоты стимулирует образование пептида. Получение пептида ST4SA показано на фиг. 10. Максимальный уровень образования зафиксировали после 14 ч культивирования. На фиг. 11 показан фрагмент ДНК, содержащий ген адгезии/иммунитета; в рамках настоящего изобретения этому фрагменту присвоен номер ПОСЛ. ИДЕНТ. НОМЕР 15.Enterococcus mundtii ST4SA вырабатывает антимикробный пептид широкого спектра действия(пептид ST4SA), активный в отношении различных патогенов. Структурный ген, кодирующий лидерный пептид и пропептид (в совокупности они известны под именем препептид), располагается в геноме штамма ST4SA (см. фиг. 6 Б). Обнаружили только одну такую генную структуру, что указывает на то, что широкий спектр антимикробной активности обеспечивается только одним пептидом. Были произведены попытки излечивания штамма ST4SA от его 50 кб и 100 кб плазмид (см. фиг. 1), однако они не увенчались успехом. Это говорит о том, что плазмида играет важную роль в обеспечении иммунитета пептидаST4SA либо содержит гены, существенные для ключевых реакций метаболизма. Дальнейшее подтверждение того, что ST4SA является штаммом Enterococcus mundtii, получили посредством видоспецифической ПЦР (полимеразной цепной реакции) с праймерами, синтезированными из консервативных участков 16S рДНК: Амплифицировали фрагмент длиной в 306 пар оснований (см. фиг. 3). Секвенирование фрагмента ДНК дало 98% гомологии с консервативными фрагментами 16S рДНК из GenBank. Структурный ген (кодирующий пропептид ST4SA), транспортные гены и ген иммунитета были секвенированы, а их последовательности аминокислот были транслированы из последовательностей ДНК(фиг. 8). Стабильность пептида ST4SA, взвешенного в стерильной дистиллированной воде, проверяли при температурах от -20 до 60C на протяжении 42 дней (фиг. 12). Пептид оставался стабильным при -20C в течение 42 дней и при 4C в течение трех недель. Уровень стабильности понизился после одной недели проверки при температуре 37C. Однако пептид ST4SA в виде порошка оставался стабильным в течение 6 месяцев при комнатной температуре (25C). Пептид ST4SA будет изготавливаться и продаваться в виде порошка. После растворения в стерильной дистиллированной воде пептид ST4SA можно хранить в течение трех недель при температуре 4C (см. фиг. 12). Активность пептида ST4SA на бумажных дисках приведена в табл. 5. Сравнение активности с антибиотиками показано в табл. 6. Активность проверялась в отношении вида Pseudomonas, изолированного из жидкости инфицированного среднего уха. Фотографии зон подавления приведены на фиг. 13. Таблица 6 Сравнение активности пептида ST4SA и популярных антибиотиков Связывание пептида ST4SA с целевыми клетками существенно для обеспечения проникновения пептида внутрь. Изучали способность пептида ST4SA прикрепляться к патогенам; результаты выражали в процентах прикрепления к патогенам (табл. 7). Согласно результатам не менее 75% пептида ST4SA прикрепляется к патогенам, использованным в эксперименте. После адгезии пептида ST4SA к целевой клетке происходит проникновение внутрь и разрушение клеточной мембраны (фиг. 14). Дальнейшее подтверждение наличия повреждений клеточных мембран и вытекания клеточных составляющих получили при проверке на активность внеклеточной ДНК и внеклеточной -галактозидазы. Результаты приведены в табл. 8 и 9 соответственно. Данные указывают на то, что ДНК и -галактозидаза вытекли из клеток, поврежденных пептидом ST4SA. Вытекание -галактозидазы отмечалось не у всех патогенов, так как не все виды имеют высокий внутриклеточный уровень этого фермента.- 14017558 Таблица 8 Данные об активности внеклеточной ДНК после обработки патогенов пептидом ST4SA На фиг. 15-23 показан лизис клеток различных патогенов после обработки пептидом ST4SA. 0,2%(об./об.) инокулят ночного патогена привили в бульон с сердечно-мозговой вытяжкой. К каждому патогену добавляли пептид ST4SA в середине экспоненциальной фазы. Из приведенных результатов (фиг. 1523) ясно, что пептид ST4SA оказывал бактерицидное воздействие на большинство патогенов. Изучали образование пептида ST4SA в присутствии Listeria innocua (фиг. 24). Согласно результатам исследования L.innocua стимулирует производство пептида ST4SA штаммом ST4SA, которое, в свою очередь, подавляет L.innocua.Enterococcus mundtii ST4SA как пробиотик. Выживание Enterococcus mundtii ST4SA оценивали с помощью компьютеризированной модели желудочно-кишечного тракта (ЖКМ, показана на фиг. 25). Первый сосуд ЖКМ изображает желудок, второй - двенадцатиперстную кишку, третий - тонкую и подвздошную кишку, а четвертый - толстую кишку. Поток питательных веществ контролировали с помощью специальной программы. Уровень pH в различных секциях ЖКМ регулировали посредством перистальтического введения стерильного 1 н. HCl или 1 н. NaOH. Каждую секцию оборудовали высокочувствительным датчиком pH, соединенным с блоком управления и компьютером. Скорость потока питательных веществ через ЖКМ регулировали в соответствии с кишечником новорожденного. Были специально выбраны условия, симулирующие короткий пищеварительный тракт, чтобы обеспечить больший размах колебаний и, соответственно, увеличить нагрузку на пробиотик. Оценивали четыре смеси для грудных детей (Lactogen 2, NAN Pelargon, ALL110 и Alfare). Дозировка пробиотических бактерий(ST4SA) производилась в соответствии с рецептурой, т.е. 108 жизнеспособных клеток (КОЕ) на 1 мл. Пробиотические клетки взвешивали в слюне. Раствор панкреатического сока и желчи содержал NaHCO3,панкреатин и медицинскую желчь, растворенные в дистиллированной воде. Использованные в ЖКМ условия описаны в табл. 10 и 11. Для проверки выживания штамма ST4SA в присутствии патогенов ЖКМ заражали Listeriamonocytogenes. Отслеживали жизнеспособность штамма ST4SA и его способность производить антимикробный пептид ST4SA в ЖКМ (см. результаты в табл. 12). Из представленных в табл. 12 результатов можно сделать вывод, что штамм ST4SA выжил во всех секциях желудочно-кишечного тракта. Образование антимикробного пептида превышало 25600 УЕ (условных единиц) на 1 мл во всех секциях желудочно-кишечного тракта. Рост в среде NAN Palargon был чуть менее благоприятным, чем в среде MRS. Однако в обоих экспериментах число клеток не уменьшилось более чем на один логарифмический цикл (см. табл. 13).- = нет зон подавления (устойчивость к антибиотику);+ = зона подавления диаметром от 1 до 11 мм;= зона подавления диаметром от 12 до 16 мм;= зона подавления с диаметром более 17 мм. Устойчивость штамма ST4SA в отношении различных антибиотиков проверяли посредством стандартных процедур (диски с антибиотиками, компания Oxoid). Согласно результатам штамм ST4SA устойчив к сульфонамидам, клоксациллину, метронидазолу, метициллину, неомицину, нистатину, оксациллину и стрептомицину (табл. 13). Для предотвращения диареи у детей с ВИЧ/СПИДом им назначают триметоприм-сульфаметаксозол(TMP-SMX) и/или метронидазол. В смесь NAN Palargon добавляли различные концентрации упомянутых антибиотиков, а затем проверяли их воздействие на штамм ST4SA после 18 ч инкубации при оптимальной температуре роста (37C). Из результатов, представленных в табл. 13, видно, что TMP-SMX и метронидазол вызвали уменьшение количества клеток штамма ST4SA на четыре логарифмических цикла. Однако увеличение концентрации антибиотиков не привело к резким изменениям в жизнеспособности клеток.- 18017558 Присутствие факторов вирулентности в ST4SA. Для получения пробиотика из штамма ST4SA важно знать, не связаны ли с ним какие-либо факторы вирулентности. Синтезировали праймеры для генов, кодирующих следующие факторы вирулентности: устойчивость к ванкомицину (VanA/VanB); образование желатиназы (Gel); субстанция агрегации (AS); адгезии к коллагену от энтерококков (Ace), поверхностный протеин энтерококков (Esp); гемолизин/бактериоцин (Cyl) и нецитолитический -гемолизин. ДНК штамма ST4SA, амплифицированная с помощью перечисленных праймеров, показала, что штамм не содержит генов, кодирующих устойчивость к ванкомицину, активность желатиназы, субстанцию агрегации и адгезию к коллагену. На основании имеющихся результатов можно сделать вывод, что штамм ST4SA не является патогенным и не должен вызывать аллергических реакций при приеме внутрь. Широкий спектр антимикробной активности пептида ST4SA, включающий грамположительные и грамотрицательные бактерии, указывает на возможное отличие механизма действия пептида ST4SA от других ранее описанных антимикробных пептидов для молочнокислых бактерий. Кроме того, участок распознавания на стенках чувствительных клеток может не совпадать с участком прикрепления липидаII, который используют другие известные заявителю пептиды (фиг. 26). Для проверки этой гипотезы целевой участок липида II Lactobacillus sakei DSM 20017 (чувствительной к пептиду ST4SA) блокировали ванкомицином (см. схематическое изображение на фиг. 26). Ванкомицин прикрепляется к боковой аминокислотной цепочке молекулы липида II, что в теории должно предотвратить присоединение пептида ST4SA к тому же участку (в случае, если липид II действует как рецептор). Однако после обработки целевых клеток (L.sakei DSM 20017) комбинацией ванкомицина и пептида ST4SA было отмечено подавление роста (вытекание цитоплазмы; см. фиг. 26), что указывает на то, что в качестве рецепторов для пептида ST4SA выступают иные целевые участки, а не липид II. Способность пептида ST4SA прикрепляться более чем к одному участку прикрепления чувствительной клетки, возможно, объясняет наличие у него такого широкого спектра антимикробной активности (подавление грамположительных и грамотрицательных бактерий). Заявитель знает, что низин (лантибиотик) связывается с липидом II, что показано на фиг. 26, где видно, что обработка L.sakei DSM 20017 ванкомицином не позволила низину прикрепиться к целевому участку липида II. Пептид ST4SA имеет два гидрофобных участка (фиг. 27), которые могут встраиваться в богатые фосфолипидами клеточные мембраны после того, как имеет место его реакция с рецепторным участком клеточной стенки. Область между двумя гидрофобными участками, а именно между аминокислотой 29(серин) и аминокислотой 30 (аланин) (фиг. 27), обладает большей гибкостью, чем другие участки структуры, и может выступать в качестве шарнира, позволяя С-концевой половине пептида сгибаться и, таким образом, проникать в богатую фосфолипидами клеточную мембрану. Для проверки этой гипотезы синтезировали два отрезка пептида ST4SA (фиг. 27), условно обозначаемые как фрагмент 1 и фрагмент 2, на основе последовательности аминокислот, установленной из последовательности ДНК структурного гена. Ниже видно, что фрагмент 1 состоит из первых 29 аминокислот (от лизина до серина) и оканчивается непосредственно перед шарнирной областью (между серином 29 и аланином 30). Ввели дисульфидный мост (см. изображенную ниже связующую линию), ковалентно связывающий аминокислоты 9 (цистеин) и 14 (цистеин), также изображенные ниже в составе полной последовательности пептида: Дисульфидный мост служит для стабилизации структуры пептида. Фрагмент 1 содержит первый гидрофобный участок, обведенный кружком (шесть аминокислот от 21 до 26, т.е. AIGIIG). Данная часть молекулы распознает рецептор на стенке клетки целевого (чувствительного) организма. Фрагмент 2 содержит последние 13 С-концевых аминокислот второй гидрофобной петли после шарнирной области, а также 11 предшествующих аминокислот непосредственно перед шарнирной областью (между серином и аланином): Фрагмент 2:. Эксперименты по обработке чувствительных клеток двумя упомянутыми фрагментами пептидаST4SA показали, что для обеспечения антимикробной активности требуются оба фрагмента (сегмента) молекулы. Поэтому разрушение клеточной мембраны представляется возможным лишь после прикрепления N-концевой области к рецептору на поверхности клетки. Прикрепление пептида ST4SA к полиэтилену (ПЭ). Проверяли прикрепление пептида ST4SA к полиэтилену (ПЭ). Полиэтиленовую пленку нарезали на фрагменты размером 55 см и в течение 1 ч замачивали в 60% растворе изопропанола и пептида ST4SA(уровень активности: 102400 УЕ/мл). Фрагменты ПЭ высушивали на воздухе (20 мин при 60C), после чего анализировали на антимикробную активность с помощью стандартного метода диффузии в агаре. Чашки с высеянными L.sakei DSM 20017 инкубировали в течение 24 ч при температуре 30C, а затем проверяли на наличие зон подавления роста.- 19017558 Пептид ST4SA был адсорбирован ПЭ за 60 с, образовав пленку с высокой антимикробной активностью (вокруг фрагмента ПЭ находились крупные зоны подавления). Для определения силы прикрепления полиэтиленовую пленку, покрытую пептидом, замачивали в буфере SDS (додецилсульфат натрия), а затем электроэлюцией извлекали пептид ST4SA из пленки током в 30 мА в течение 2 ч (при комнатной температуре, т.е. около 25C). Через определенные промежутки времени забирали образцы и проверяли их на антимикробную активность. Концентрации белков определяли по методу Бредфорд. Электроэлюированную пленку проверяли на антимикробную активность с помощью метода диффузии в агаре, как и ранее. Судя по всему, пептид ST4SA прикрепляется к ПЭ пленке очень прочно, практически неотделимо. Высвобождение пептида ST4SA с поверхности ПЭ оказалось возможным только после часового воздействия током в 30 мА. В ходе контрольного заражения, где в качестве модели использовали сырое мясо,пептид ST4SA, прикрепленный к полиэтиленовой поверхности, предотвратил рост патогенных бактерий(Listeria, Bacillus и Staphylococcus). Это указывает на возможность применения пептида ST4SA в составе раневых повязок для предотвращения или сокращения микробных инфекций, а также в других медицинских и асептических средствах, таких как, например, имплантаты, ушные трубки, катетеры, стомные трубки и мешки, стенты, шовные материалы, а также предметы гигиенического назначения, такие как предметы женской гигиены, контактные линзы, растворы для промывки контактных линз. Благодаря инкапсуляции в полимере антимикробный пептид высвобождается медленно, что увеличивает срок лечебного воздействия на микробную инфекцию. Кроме того, сила сцепления пептида ST4SA с ПЭ также указывает на то, что он действует как медленно высвобождающееся антимикробное средство. Пептид ST4SA связывается с несколькими рецепторными участками микробной клетки, чего следует ожидать от антимикробного средства широкого спектра действия. Первая часть пептида ST4SA (перед шарнирной областью) связывается с рецептором. Вторая часть (после шарнирной области) имеет гидрофобный участок большего размера и встраивается в клеточную мембрану, нарушая проницаемость клетки, что приводит к ее гибели (это выражается в утечке ДНК и ферментов). Пептид ST4SA устойчиво связывается с ПЭ и медленно высвобождается, что делает его пригодным для использования в составе раневых повязок. Превращение Enterococcus mundtii ST4SA в пробиотик. Выживаемость Enterococcus mundtii ST4SA оценивали с помощью упомянутой компьютеризированной модели желудочно-кишечного тракта. На этой стадии дополнительно оценивали штамм ST4SA в качестве пробиотика в искусственных и естественных условиях. Адгезию к слизи и клеткам эпителия изучали в искусственных условиях на клеточных линиях человека. В естественных условиях эксперимент проводили на крысах. В исследованиях использовали линии кишечных клеток человека из аденокарциномы толстой кишки, содержащие линии клеток Caco-2, HT-29 и HT29-MTX (клетки, секретирующие слизь). При культивировании в стандартных условиях клеточные линии демонстрируют морфологическую и функциональную дифференциацию, а также характеристики зрелых энтероцитов, такие как поляризация, функциональная щеточная кайма и апикальные кишечные гидролазы. На адгезию штамма ST4SA к клетке-хозяину влияют углеводы клеточной поверхности, белок А НЖК, Ace (адгезин к коллагену от энтерококков) белок и субстанция агрегации (AS), относящиеся к патогенности. AS-адгезин, который опосредует образование клеточных слипаний, обеспечивая высокоэффективный перенос плазмиды половых феромонов, кодирующей AS. В рамках данного эксперимента штамм ST4SA проверяли на наличие признаков вирулентности, активность гидролазы солей желчных кислот, а также способность к адгезии с линией человеческих энтероцитоподобных клеток Caco-2, конкурентное исключение при адгезии с клеточной линией Caco-2, а также в искусственных условиях - в модели желудочно-кишечного тракта (ЖКТ). Кроме того, определяли гидрофобность клеточной поверхности ST4SA. Факторы вирулентности. С помощью экспериментов в искусственных условиях и/или ПЦР скрининга проверяли присутствие таких факторов вирулентности,как гены устойчивости к ванкомицину(VanA/VanB/VanC1/VanC2/VanC3), образования желатиназы (Gel), субстанции агрегации (AS), адгезина к коллагену от энтерококков (Ace), поверхностного протеина энтерококков (Esp), гемолизина/бактериоцина (Cyl) и нецитолитического -гемолизина. ДНК извлекали из E.mundtii ST4 стандартными методами. Для амплификации упомянутых генов использовали ранее описанные праймеры. Результаты приведены в табл. 14. Образование субстанции агрегации (AS). Образование субстанции агрегации AS изучали в рамках анализа слипания в присутствии полового феромона. Половой феромон получали 18-часовым выращиванием производителя феромона, т.е.Enterococcus faecalis JH2-2, в бульоне MRS при температуре 37C. Супернатант производителя феромона, Е.faecalis OG1X, использовали в анализе слипания на пластине микротитратора. В 200 мкл привили(0,5%, об./об.) штамм ST4SA, а затем под микроскопом исследовали на наличие слипания клеток через 2,4, 8 и 24 ч. Слипания клеток обнаружено не было. Образование желатиназы. Образование желатиназы изучали на агаре MRS, содержащем 30 г желатина на 1 л. За положительную реакцию считали наличие чистой зоны вокруг колоний после 18 ч при температуре 37C. Образования желатиназы обнаружено не было. Образование -гемолизина. Образование -гемолизина проверяли по формированию чистых зон вокруг колоний на чашках с кровяным агаром. Для приготовления чашек с кровяным агаром использовали колумбийскую основу кровяного агара с 5% крови барана. Образования -гемолизина обнаружено не было. Очевидно, что заявитель продемонстрировал отсутствие в штамме ST4SA генов, кодирующих устойчивость к ванкомицину, образование желатиназы, образование антигена эндокардита, формирование клеточных скоплений, адгезию к коллагену и/или образование поверхностного протеина. Были обнаружены гены, кодирующие активность -гемолизина и нецитолитического -гемолизина III. Однако последние два гена не выражены (не наблюдалось гемолитической активности на чашках с кровяным агаром - см. ниже). Определение гидролитической активности солей желчных кислот. Для проверки штамма ST4SA на гидролитическую активность солей желчных кислот 10 мкл ночной культуры нанесли на чашки с MRS агаром, дополненным 0,5% (вес./об.) соли натрия тауродезоксихолевой кислоты и 0,37 г/л CaCl2. Чашки инкубировали в анаэростате в течение 72 ч при температуре 37C. Формирование зон преципитации принималось за положительный результат проверки на гидролитическую активность солей желчных кислот. Гидролитической активности солей желчных кислот у штамма ST4SA не наблюдалось. Гидролитическая активность солей желчных кислот может способствовать устойчивости молочнокислых бактерий к токсичности конъюгированных солей желчной кислоты в двенадцатиперстной кишке. Однако принято считать, что гидролитическая активность солей желчных кислот и устойчивость к желчным солям никак между собой не связаны. Определение гидрофобности поверхности клеток. Ночную культуру E.mundtii ST4SA дважды промыли раствором Рингера 1/4 крепости, а затем определили ОП 580 нм. Добавили равные объемы взвеси и н-гексадекана, перемешивая в течение 2 мин. На разделение фаз отвели 30 мин при комнатной температуре, после чего отделили 1 мл водной фазы и определили ОП 580 нм. Две оценки ОП 580 нм усреднили и полученное значение использовали для расчета гидрофобности:% гидрофобности = [(ОП 580 нм показание 1 - ОП 580 нм показание 2)/ОП 580 нм показание 1]100. Из результатов, приведенных на фиг. 28, очевидно отсутствие признаков гидрофобности у штаммаST4SA. Соответственно, клетки не приклеиваются к поверхностям ЖКТ перманентно. Они свободно передвигаются в кишечнике (как планктонные клетки), что дополнительно увеличивает полезность штамма в качестве пробиотика.- 21017558 Адгезия E.mundtii ST4SA и Listeria monocytogenes к клеточным линиям Caco-2. Для достижения слияния клетки Caco-2 (Highveld Biological Sciences) высеивали в концентрации 5105 клеток на лунку. Для определения адгезии в лунки добавляли 100 мкл бактериальной взвеси(1105 КОЕ/мл штамма ST4SA и 1103 КОЕ/мл L.monocytogenes). После 2-часовой инкубации при температуре 37C клеточные линии дважды промыли буфером ФСБ. Бактериальные клетки подвергли лизису посредством Тритона Х-100 и высеяли в чашки с агаром MRS и агаром с сердечно-мозговой вытяжкой соответственно. При расчете адгезии исходили из начального количества жизнеспособных клеток и из количества клеточных лизатов. Для определения конкурентного исключения штамма ST4SA и Listeria monocytogenes прививали 100 мкл каждого из штаммов в клеточный монослой. После 2-часовой инкубации клетки лизировали и высевали в среды, специфические для энтерококков и листерий соответственно. Монослои клеток Caco-2 подготавливали на покровных стеклах в 12-луночных чашках для тканевых культур. В лунки добавляли взвесь клеток ST4SA. После 2-часового периода адгезии клеточные линии дважды промывали буфером ФСБ, фиксировали 10% формалином и проводили окрашивание по Граму. Сцепленные клетки изучали под микроскопом. Результаты приведены в табл. 15 и 16. Таблица 15 Из результатов, приведенных в табл. 15 и 16, ясно, что клетки E.mundtii ST4SA предотвратили адгезию листерий к клеткам Caco-2 и успешно конкурировали с листериями за участки распознавания линии человеческих клеток. Таким образом, штамм ST4SA способен вытеснять листерии. Выживание в искусственных условиях (модель желудочно-кишечного тракта ЖКТ)L.Monocytogenes при стимуляции ST4SA. Оценивали антимикробную активность ST4SA в отношении L.monocytogenes в искусственной среде - желудочно-кишечной модели. ST4SA привили в изображающий желудок сосуд согласно вышеописанной процедуре. L.monocytogenes (1104) привили в сосуд ЖКТ, изображающий двенадцатиперстную кишку. Затем из каждого сосуда взяли образцы и высеяли их в среды, специфические для энтерококков и листерий соответственно. В качестве контроля в ЖКМ прививали только L.monocytogenes. Стимулирование L.monocytogenes штаммом ST4SA в искусственных условиях модели ЖКТ показало, что ST4 оказывает антимикробное воздействие на L.monocytogenes (см. графики). Темп роста в тонкой кишке снизился с 8104 до 2104, а уровень L.monocytogenes в подвздошной кишке был на 1101 КОЕ/мл ниже по сравнению с контролем (см. фиг. 29). Оценка (в естественных условиях) безопасности, бактериальной транслокации, выживаемости и иммуномодуляционных способностей E.mundtii ST4SA при пероральном приеме: сравнение с препаратом Лактовита. Материалы и процедуры. Животные. 10 самцов крыс Уистара массой тела 318-335 г поместили в пластиковые клетки группами по пять особей, при 12-часовом цикле день/ночь и контролируемых условиях окружающей среды (температура 203C). Животные получали стандартный рацион питания, а также в неограниченном количестве получали воду, обработанную в автоклаве, очищенную методом обратного осмоса и либо дополненную пробиотиком, либо нет. Бактериальные штаммы и пробиотик. Штамм ST4SA в течение 18 ч культивировали в бульоне MRS при температуре 30C; оптическую плотность доводили до 1,8 при 600 нм. Клетки собирали центрифугированием и промывали в 20 мМ фосфатного буфера (pH 7,5). Промытые клетки перерастворяли в 100 мМ сахарозы, замораживали в жидком азоте и оставляли сушиться в вакууме на ночь. Для определения значения КОЕ/мл заданную массу клеток растворяли в 1 мл фосфатного буфера и наносили полученную посевную взвесь на твердую среду MRS. Штамм ST4SA добавляли в питьевую воду в концентрации около 2108 КОЕ/мл. Вскрыли три капсулы, содержащие пробиотик с коммерческим названием "Лактовита", и добавили их содержимое в каждую бутылку с питьевой водой. Полученная таким образом концентрация составила около 3105 КОЕ/мл.- 22017558 План эксперимента. Проводили два отдельных исследования. В каждом из них 10 крыс случайным образом поделили на две группы, по пять животных в каждой. Одна группа выступала в качестве контрольной, и крысы этой группы получали воду без добавок; крысы второй группы получали воду, в которую были добавлены либо капсулы Лактовита, либо лиофилизированный штамм ST4SA. Таким образом, всего каждая крыса получила за период проведения исследований 9,891011 КОЕ штамма ST4 либо 3,1109 КОЕ препарата Лактовита. 3 а крысами велось ежедневное наблюдение, отслеживались любые отклонения в поведении или действиях, а также общее состояние здоровья, в том числе взъерошенная шерсть, сгорбленное положение тела, неустойчивые движения, дрожь, тряска, кашель, затрудненное дыхание, цвет конечностей. Активность отслеживали согласно трехступенчатой шкале: 1 = ленивые, медленные движения; 2 = средний темп; 3 = активные, рыскающие движения. Ежедневно замеряли живой вес и объем потребляемой воды. Исследования штамма ST4SA продолжались в течение 50 дней, а исследования Лактовиты - в течение 108 дней; результаты приведены в табл. 17. Таблица 17 Активность -глюкуронидазы. На ночь крыс размещали в клетках по одному согласно установленному графику забора образцов и брали 24-часовые образцы экскрементов для определения числа колоний бактерий и активности-глюкуронидазы. Образцы экскрементов гомогенизировали в 20 мМ фосфатного буфера в концентрации 100 мг экскрементов на 1 мл буфера. До анализа образцы хранили при температуре -20C. Образцы экскрементов осаждали центрифугированием и перерастворяли в 1 мл экстрагирующего буфера для-глюкуронидазы (50 мМ NaHPO4, 5 мМ DTT (дитиотреитола), 1 мМ ЭДТА, 0,1% Тритона Х-100), перемешивали и инкубировали при температуре 22C в течение 10 мин. На ночь образцы замораживали при температуре -20C, а затем размораживали перед определением активности -глюкуронидазы. Для оценки активности -глюкуронидазы 100 мкл обработанной взвеси экскрементов инкубировали в 900 мкл реакционного буфера (содержащего 1 мМ -нитрофенил глюкурониды) при температуре 37C в течение 2 ч. Для прекращения реакции добавляли 2,5 мл 1 М триса, pH 10,4. Оптическую плотность определяли при 415 нм, а затем строили калибровочную кривую, используя следующие значения концентрации-нитрофенила: 0,1, 0,2, 0,5, 1 и 10 мМ. Бактериальная транслокация, токсикологические исследования и гистология. После кормления крыс проверяемыми штаммами в течение упомянутых промежутков времени животных подвергли эвтаназии путем передозировки пентобарбитон-натрия. Забор образцов крови осуществлялся посредством пункции сердца (правого желудочка). Проверили и отметили макроскопическую анатомию внутренних органов каждой крысы. Взяли образцы тканей печени, селезенки, подвздошной,слепой и толстой кишки. Образцы тканей разместили в кассетах, поместили в 4% раствор формальдегида(ФСБ), а затем погрузили в твердый парафин для проведения гистологического анализа и исследований методом флюоресцентной гибридизации. Срезы подвздошной и толстой кишки заморозили в жидком азоте. Образцы крови нанесли на твердую среду с сердечно-мозговой вытяжкой и инкубировали ночью при температуре 37C. Иммуномодуляция. С помощью реагента тризол из замороженных образцов подвздошной и толстой кишки извлекли полную РНК. Для определения концентрации РНК измеряли оптическую плотность при 260 нм посредством спектрофотометра Nanodrop после окончания обработки ДНКазы. Каждый образец РНК разбавили до концентрации 42 нг/мкл. 5 мкг каждого образца (в сумме) в трех экземплярах перенесли на нейлоновую мембрану посредством слот-блот прибора. Затем мембрану проверяли ДНК-зондом фактора некроза опухолей (TNF), интерферона(IFN) или -актина, который амплифицировали из геномного ДНК крыс и помечали дигоксигенином. Ночью мембрану снимали на рентгеновскую пленку, которую затем проявляли. Результаты. Общее состояние здоровья и прибавка в весе. За весь период проведения исследований не было отмечено изменений в поведении или активности крыс, также отсутствовали заметные различия между экспериментальными и контрольными группами. Не было случаев заболеваний или гибели животных в связи с лечением. Активность -глюкуронидазы. Известно, что бактериальные ферменты, в том числе -глюкуронидаза, связаны с образованием мутагенов, канцерогенов и опухолевых активаторов из предшественников, имеющихся в желудочнокишечном тракте, и их присутствие может указывать на токсичность бактериальных штаммов, что позволяет использовать их для определения безопасности потенциальных пробиотиков. Взвеси штаммовST4SA и препарата Лактовита не обнаружили активности -глюкуронидазы в искусственных условиях(данные не приведены). Однако в пробах экскрементов крыс, которые потребляли взвесь препарата Лактовита, обнаружилась повышенная активность -глюкуронидазы по сравнению с крысами из контрольной группы (табл. 18 А). Кроме того, у животных из контрольной группы на 107 день исследования активность была ниже, чем на 56 день, тогда как активность экспериментальных животных на 107 день немного повысилась по сравнению с 56 днем. Крысы, получавшие добавку с ST4, показали более высокий уровень активности -глюкуронидазы по сравнению с контрольными группами (табл. 18 Б); тем не менее, активность в конце исследования была все же ниже, чем в его первый день. Животные контрольной группы также продемонстрировали снижение уровня активности в конце исследования по сравнению с его началом. Таблица 18 А Бактериальная транслокация, токсикологические исследования и гистология. Ни в одной группе животных не было отмечено бактериемии. При макроскопическом исследовании внутренних органов обнаружилось, что крысы, получавшие штамм ST4SA, имели значительно более выраженные кишечные лимфатические узлы, чем крысы из контрольной группы. У контрольных крыс обнаружить кишечные лимфатические узлы было практически невозможно. Селезенка у крыс из контрольной группы была уже, а мышечная масса и абдоминальный жир меньше, чем у крыс из экспериментальной группы. У животных, получавших препарат Лактовита, кишечные лимфатические узлы были менее выражены, а селезенка меньше, чем у животных контрольной группы. Лимфоциты попадают в селезенку и способствуют иммунным ответам в отношении антигенов крови. Увеличение селезенки может свидетельствовать о возросшей активности иммунной системы. Также есть связь с выраженными кишечными лимфатическими узлами. Они также связаны с работой иммунитета и могут увеличиваться в результате воспаления или инфекции. Такое увеличение говорит о том, что кишечные лимфатические узлы должным образом выполняют свою задачу. Следовательно, штаммST4SA может выступать в качестве стимулятора иммунитета. У крыс, получавших препарат Лактовита,селезенка была меньше, а кишечные лимфатические узлы менее выражены, чем у крыс из контрольной группы. Это указывает на то, что препарат Лактовита не стимулирует иммунный ответ. Однако у крыс из контрольной группы кишечные лимфатические узлы и селезенка были увеличены, и не было отмечено симптомов заболеваний в отсутствие иммунных стимуляторов. Иммуномодуляция. Исследования по гибридизации с нозерн-блоттингом не выявили экспрессии цитокинов (TNF илиIFN) ни в экспериментальной группе ST4SA, ни в контрольной группе. Обнаружили положительные сигналы приблизительно такой же интенсивности, как при зондировании РНК -актин ДНК-зондом, что говорит о наличии РНК. Цитокины - секретируемые протеины, которые влияют на рост клеток, воспаления, иммунитет,дифференциацию и репарации. Часто для достижения требуемых эффектов требуется всего лишь фемтомолярная концентрация цитокинов. Как правило, цитокины действуют в совокупности с рецепторами на поверхности клеток, внося изменения в паттерн РНК и синтез белка. В связи с очень низкой концентрацией цитокинов, возможно, более целесообразным будет определение экспрессии дополнительных генов, на которые влияют эти протеины. Приведенные здесь результаты показывают, что ни один из проверенных пробиотиков не оказывает отрицательного воздействия на общее состояние здоровья самцов крыс Уистара. Таким образом, штамм ST4SA не содержит генов, кодирующих устойчивость к ванкомицину. Были обнаружены гены, кодирующие активность -гемолизина и нецитолитический -гемолизин III, однако они представляют собой молчащие (невыраженные) гены. В штамме ST4SA отсутствует активность гидролазы солей желчных кислот. Это указывает на повышенную эффективность штамма в нижних отделах желудочно-кишечного тракта (подвздошная и толстая кишка). Приведенные ранее данные указывают,что штамм E.mundtii ST4SA свободно передвигается по желудочно-кишечному тракту и предотвращает адгезию листерий к клеткам Caco-2, а также успешно конкурирует с листериями за связывание с рецепторами человеческих клеток. Штамм ST4SA оказал антимикробное воздействие на L.monocytogenes при проведении исследований в модели желудочно-кишечного тракта (ЖКМ). Штамм ST4SA нетоксичен,что доказали эксперименты на крысах. Не было случаев заболеваний или смертельных исходов, связан- 24017558 ных с лечением. Штамм ST4SA также показал лучшие результаты по сравнению с препаратом Лактовита, так как у крыс, получавших препарат Лактовита, наблюдалось увеличение активности-глюкуронидазы; следовательно, штамм ST4SA стимулирует иммунный ответ у крыс. У крыс, получавших препарат Лактовита, отмечалось уменьшение селезенки и менее выраженные кишечные лимфатические узлы по сравнению с крысами из контрольной группы, что говорит о том, что Лактовита не стимулирует иммунных реакций. Выше было показано, что пептид ST4SA подавляет рост различных бактерий, а максимальное образование пептида ST4SA (51200 УЕ/мл) было зафиксировано после 20 ч выращивания в бульоне MRS(компания Biolab) и сохранялось во время брожения. 18-часовую культуру штамма ST4SA привили (2%, об./об., ОП 600 нм=2,0) в бульон MRS (компанияBiolab) и фильтрованный бульон MRS соответственно. Бульон MRS (компания Biolab) фильтровали с помощью системы Minitan (компания Millipore, BioSciences International), оборудованной нитроцеллюлозными мембранами с размером пор 6000 -8000 Да. Затем фильтрат MRS (MRSf), содержащий протеины размером менее 8000 Да, обработали в автоклаве, после чего произвели прививку согласно вышеописанной процедуре. Инкубацию в бульонах MRS и MRSf производили при температуре 30 и 37C, без встряхивания, в течение 29 ч. Активность пептида ST4SA определяли каждые 2 ч. Очистка пептида ST4SA. В 1 л MRSf прививали Enterococcus mundtii ST4SA (ОП 600 нм=1,8), а затем инкубировали в течение 24 ч при температуре 30C. Клетки собирали центрифугированием (8000 об/мин, 4C, 15 мин), бесклеточный супернатант инкубировали при температуре 80C в течение 10 мин. При температуре 4C в бесклеточный супернатант осторожно добавляли сульфат аммония до уровня насыщения в 60%. После 4 ч медленного помешивания осадок собирали центрифугированием (20000 об/мин, 1 ч, 4C). Остаток перерастворяли в одной десятой объема 25 мМ ацетата аммония (pH 6,5) и обессоливали на дистиллированной воде, очищенной на системе MilliQ, с помощью диализной мембраны с MWCO=1,0 кДа Spectra/Por(компания Spectrum Inc., штат Калифорния, США). Последующее разделение производили посредством катионообменной хроматографии в колонке 1 мл Resource S (компания Amersham Biosciences) с помощью хроматографа KTApurifier (компания Amersham) согласно вышеописанной процедуре. В табл. 19 приведены уровни активности пептида ST4SA после каждой ступени очистки. Таблица 19 Активные фракции, собранные из KTApurifier, соответствовали пику ST4SA и образовывали пептид из 42 аминокислот, что соответствует ожидаемому размеру пептида ST4SA. Изоэлектрическое фокусирование пептида ST4SA. Изоэлектрическое фокусирование пептида ST4SA проводили посредством аппарата электрофокусирования Rotofor (компания Bio-Rad, г. Геркулес, штат Калифорния, США). 1 л бесклеточного супернатанта, полученного из культивированного в MRSf штамма ST4SA и подготовленного согласно вышеописанной процедуре, подвергли лиофилизации, а затем перерастворили в 50 мл стерильной дистиллированной воды с амфолитами (диапазон pH от 3 до 10, компания Bio-Rad), следуя инструкциям производителя. В течение 5 ч применяли постоянный ток 12 Вт при температуре 8C. После разделения небольшое количество от каждой собранной фракции довели до рН 7,0 посредством 3 н. NaOH или 3 н. HCl и проверили на антимикробную активность в отношении Lactobacillus casei LHS. Фракции, давшие положительный результат, объединяли, перерастворяли в деионизированной воде до достижения общего объема в 50 мл, снова подвергали электрофокусированию, собирали фракции и проверяли их на антимикробную активность. Образцы хранили при температуре -20C.- 25017558 Снижение затрат на среду для культивации является важной частью выбора оптимальных сред. Для снижения затрат можно использовать промышленные среды в качестве источника углерода и/или азота. Часто в составе сред для роста используют кукурузный ликер (CSL), сухую сырную сыворотку (CWp) и мелассу. Кукурузный ликер - побочный продукт, получаемый при измельчении кукурузных зерен. В основном он является источником азота, но также содержит и сахар (преимущественно сахарозу), витамины и минералы. Сырная сыворотка, побочный продукт молочного производства, представляет собой наиболее распространенную среду брожения для получения молочной кислоты (LA) и в основном состоит из лактозы, белков и солей. Меласса - побочный продукт, в основном состоящий из сахарозы и примесей других минералов. Культивирование и среды. Штамм ST4SA культивировали в бульоне MRS (компания Biolab) и прививали (2% об./об.) в CSL,CWp и мелассу соответственно. Брожение. Брожение проводили в пробирках, содержащих 10 мл среды. Перед стерилизацией регулировали pH с помощью NaOH (121C в течение 15 мин). Концентрация NaOH зависела от буферной емкости сред. При прививании использовали 24-часовую культуру (2% об./об.). Периодические брожения проводили в пробирках при температуре 30C в течение 16 ч, pH 6,5-7,0. Значение pH не контролировали. Оптическую плотность (ОП) измеряли при 600 нм. Мелассу и CSL при 10, 20 и 50 гл-1 оценивали в качестве потенциальных сред для получения пептида ST4SA (табл. 20). Хотя уровень pH мелассы понизился во время брожения (что свидетельствует о росте клеток), в супернатанте не было обнаружено активности пептида ST4SA, тогда как в среде CSL образовался супернатант с активностью до 3200 УЕмл-1 при минимальной концентрации в 20 гл-1. Из этих результатов можно сделать вывод, что для образования пептида ST4SA необходим источник азота(CSL). В последующих экспериментах CWp добавили в список промышленных сред и осуществляли брожение при 10, 20 и 50 г тв. част. л-1 (табл. 20). В среде CWp отмечали активность пептида ST4SA до 1600 УЕмл-1 (табл. 20). Таблица 20 Для определения среды, имеющей наибольшее влияние на получение пептида ST4SA, использовали полный факторный (FFD) с CSL и CWp в качестве компонентов (табл. 21). FFD также мог указать 5 на наличие или отсутствие взаимодействия между питательными веществами. Таблица 21 22 FFD с CSL и CWp- 26017558 Утилизацию сахара определяли с помощью следующих методов. Метод оценки общего сахара посредством фенола и серной кислоты. К 500 мкл разбавленного образца в пробирке добавляли фенол (500 мкл, 5%, об./об.) и концентрированную серную кислоту (2,5 мл). Растворы тщательно перемешали, а затем измерили оптическую плотность при 490 нм (при комнатной температуре). Концентрацию сахара (1 г глюкозыл-1) рассчитывали по стандартному графику. Определение мономерных сахаров с помощью прибора Dionex. Для анализа образцов на мономерные сахара использовали анализатор Dionex DX500 с колонкойCarboPac PA100. В качестве элюента использовали 250 мМ NaOH, H2O и 1 М NaOAc при расходе 1 млмин-1. Прибор Dionex был оборудован автодозатором, а объем ввода составлял 10 мкл. Суммарная концентрация сахара варьировалась от 5 до 10 г тв. част.л-1 (обозначения "-1" и "1" соответственно). Результаты (эксперимент проводился в двух экземплярах) указывают на то, что концентрация CSL и CWp не влияет на образование пептида ST4SA (табл. 21). Уровень активности пептидаST4SA, полученный в CSL при 5 и 10 г тв. част.л-1, сходен с уровнем, отмеченным при комбинации CSL и CWp (табл. 21), и в четыре раза выше, чем было отмечено при 50 гл-1 CSL (табл. 20). Из приведенных результатов очевидно, что наибольшее влияние на получение пептида ST4SA оказывает CSL. Оптимизация CSL. Активность пептида ST4SA, отмеченная в чистом CSL при концентрации 10 г тв. част.л-1, достигала 12800 УЕмл-1. Однако это намного ниже, чем активность пептида ST4SA, зафиксированная в средеMRS (51200 УЕмл-1). В рамках предварительного эксперимента компоненты среды MRS (за исключением глюкозы) добавляли к 10 и 40 г TSл-1 CSL и CWp соответственно (табл. 22). В 10 г тв. част.л-1 CSL с добавками наблюдалось увеличение активности в два раза по сравнению с чистым CSL. Однако CSL с добавками при 40 г тв. част.л-1 с добавками показал низкую активность. Высокая концентрация CSL подавляла рост (небольшое уменьшение рН) и, следовательно, образование пептида ST4SA. Возможно, это связано с наличием в CSL подавляющих компонентов. Такой же эксперимент проводили с CWp(табл. 22). При увеличении концентрации CWp (с 10 до 40 г тв. част.л-1) не было отмечено изменений в образовании пептида ST4SA. Таблица 22 Среда CSL, дополненная компонентами среды MRS При 10 г тв. част.л-1 CSL активность полученного пептида ST4SA была в два раза больше, чем в среде CWp (25600 УЕмл-1). Поэтому именно CSL был выбран в качестве среды для последующих экспериментов. Не все компоненты среды MRS влияли на улучшение получения пептида ST4SA, и поэтому для выявления значимых компонентов был проведен отсеивающий эксперимент. Отсеивающий эксперимент проводили согласно 210-5 дробному факторному плану (FrFD). Такой метод позволил проверить 10 факторов всего лишь за 32 прохода, вместо обычных 1024 проходов (табл. 23 и 24). Также оказалось возможным проверить компоненты на наличие каких-либо взаимодействий между ними. Результаты проанализировали с помощью ANOVA (табл. 25).- 27017558 Таблица 23 Высокие и низкие концентрации компонентов среды MRS и CSL Линейная модель, выраженная в кодовых обозначениях: Активность = -1431,2 В + 956,2 С + 3831,2D - 2781,3 Е - 2243,8G -2006,2K + 7668,8 [Уравнение 2],R2 = 0,73. Получение пептида ST4SA описали с помощью линейной модели. Хотя линейная модель не позволила точно предсказывать активность (R2=0,73), она все же позволила оценить влияние (положительное или отрицательное) компонентов на ее величину. Мясная вытяжка (В), фосфат калия (Е), средний цитрат аммония (G) и ацетат натрия (K) в линейной модели имели отрицательные коэффициенты (см. уравнение 2), т.е. уменьшали отклик. Это отражает их негативное влияние на образование пептида ST4SA. Следовательно, только дрожжевой экстракт (УЕ) (С) и CSL (D) способствуют росту образования пептида- 28017558 Таблица 25 Анализ таблицы вариаций для плана 210-5 FrFD Концентрации CSL и УЕ установили посредством 22 FFD (табл. 26). Применение метода критических разбавлений для определения активности пептида ST4SA не дало точных результатов. Таким образом, не получилось соответствовать модели, связывающей концентрации CSL и УЕ с уровнем активности. Для установления концентраций компонентов использовали результаты экспериментов. Из табл. 26 видно, что при использовании низких или высоких концентраций CSL и УЕ не было выраженного эффекта. В качестве наилучшего варианта выбрали среднее значение - композицию из CSL 7,5 г тв. част.л-1 и УЕ 6,5 гл-1. Таблица 26 План 22 FFD с 3 центральными точками для определения концентраций CSL и УЕ На фиг. 30 показана кривая роста в оптимальной среде. Среда на основе CSL и среда MRS показали сходную динамику роста. Различия между партиями. Состав CSL может изменяться ежедневно, так как он представляет собой побочный продукт производства. Различия в составе могут в значительной степени влиять на результат. Для этого провели те же самые эксперименты на второй партии CSL. В этот раз анализ ANOVA выявил УЕ, CSL, Твин 80, MnSO4 и ацетат натрия в качестве компонентов, которые оказывают наибольшее влияние на образование бактериоцена (Р 0,1). Дальнейшая оптимизация показала, что MnSO4 не оказывал заметного влияния, а ацетат натрия уменьшал активность. Итоговая среда состояла из следующих трех компонентов: УЕ (С), CSL (D) и Твин 80 (F). Неудивительно, что дрожжевой экстракт снова оказался в числе значимых компонентов. Твин 80 обладает эмульгирующими свойствами. Окончательные концентрации, установленные согласно плану 23 FFD, составили: УЕ 7,5 гл-1, CSL 10 гл-1 и Твин 80 2 гл-1. Ограничители роста. До и после брожения измеряли сахаристость среды CSL. В начале брожения концентрация CSL составляла 7,5 г тв. част.л-1. Основными присутствующими мономерными сахарами были глюкоза и фруктоза, с суммарной концентрацией 3,883 гл-1. Следовательно, лишь 51,8% суммарного количества сахара были способны к брожению, и во время брожения был усвоен не весь сахар. В конце брожения (постоянная ОП) значение pH составляло 4,6, а процент остаточных сахаров равнялся 8,8%. Рост ограничивался низким значением pH, а не недостатком азота, минералов, витаминов или каких-либо других питатель- 29
МПК / Метки
МПК: C07K 14/315, A61K 38/16, C12N 1/20, A61K 35/74
Метки: штамма, пептида, способ, штамм, получения, st4sa, е.mundtii, антибактериальный, способный, пептид, бактерий, применение, продуцировать
Код ссылки
<a href="https://eas.patents.su/30-17558-shtamm-bakterijj-emundtii-st4sa-sposobnyjj-producirovat-antibakterialnyjj-peptid-st4sa-sposob-polucheniya-peptida-st4sa-i-primenenie-shtamma-bakterijj-emundtii-st4sa-i-peptida.html" rel="bookmark" title="База патентов Евразийского Союза">Штамм бактерий е.mundtii st4sa, способный продуцировать антибактериальный пептид st4sa, способ получения пептида st4sa и применение штамма бактерий е.mundtii st4sa и пептида</a>
Предыдущий патент: Способ защиты подлинности маркированных изделий
Следующий патент: Дверная петля для дверного элемента, установленного с возможностью поворота на стеновом элементе, в частности, для душевой перегородки
Случайный патент: Моющая композиция