Новый поверхностный белок haemophilus influenzae (белок e; pe)
Формула / Реферат
1. Поверхностный белок, который может быть обнаружен у Haemophilus infiuenzae, с аминокислотной последовательностью SEQ ID NO: 1 или его фрагмент, где фрагмент содержит аминокислотную последовательность, имеющую по меньшей мере 15 последовательных аминокислот аминокислотной последовательности SEQ ID NO: 1, где фрагмент (при необходимости связанный с носителем) способен индуцировать иммунный ответ на полипептид SEQ ID NO: 1.
2. Композиция вакцины, содержащая иммуногенный фрагмент поверхностного белка по п.1.
3. Композиция вакцины, содержащая иммуногенный фрагмент поверхностного белка по п.1, где фрагмент может быть обнаружен у Haemophilus infiuenzae.
4. Композиция вакцины, содержащая рекомбинантный иммунногенный белок на основе белка по п.1, где аминокислоты в положениях 1-21 последовательности SEQ ID NO: 1 были удалены или заменены одной или несколькими аминокислотами.
5. Композиция вакцины по п.4, имеющая аминокислотную последовательность SEQ ID NO: 2, или ее фрагмент, где фрагмент содержит аминокислотную последовательность, имеющую по меньшей мере 15 последовательных аминокислот аминокислотной последовательности SEQ ID NO: 2, где фрагмент (при необходимости связанный с носителем) способен индуцировать иммунный ответ на полипептид SEQ ID NO: 2.
6. Композиция вакцины, содержащая пептид с любой аминокислотной последовательностью SEQ ID NO: 3-10 или его фрагмент, где фрагмент содержит аминокислотную последовательность, имеющую по меньшей мере 15 последовательных аминокислот любой аминокислотной последовательности SEQ ID NO: 3-10, где фрагмент (при необходимости связанный с носителем) способен индуцировать иммунный ответ против любого полипептида с последовательностью SEQ ID NO: 3-10.
7. Композиция вакцины по любому из пп.2-6, содержащая иммуногенную часть другой молекулы, где иммуногенная часть выбрана из группы, включающей белок D H. influenzae, MID Moraxella catarrhalis, UspA1 или UspA2 Moraxella catarrhalis и белок наружной мембраны любого патогена дыхательных путей.
8. Композиция вакцины по любому из пп.2-6, дополнительно слитый продукт, в котором белок, фрагмент или пептид ковалентно или любым другим способом связаны с белком, углеводом или матрицей.
9. Выделенный полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 85% идентична аминокислотной последовательности SEQ ID NO: 1 при сравнении с полноразмерной последовательностью SEQ ID NO: 1.
10. Композиция вакцины, содержащая выделенный полипептид по п.9.
11. Композиция вакцины, содержащая выделенный полипептид по п.9, где указанный полипептид представляет собой часть более крупного слитого белка.
12. Композиция вакцины по п.11, дополнительно содержащая фармацевтически приемлемый эксципиент.
13. Композиция вакцины по п.11, где указанная композиция содержит по меньшей мере еще один другой антиген Haemophilus influenzae.
14. Композиция вакцины, содержащая эффективное количество полипептида по п.9 и фармацевтически приемлемый эксципиент.
15. Композиция вакцины по п.14, где указанная композиция содержит по меньшей мере еще один другой антиген Haemophilus influenzae.
16. Композиция вакцины по любому из пп.2-8 и 10-15, в состав которой входит белок D Haemophilus influenzae.
17. Применение поверхностного белка по п.1 для получения лекарственного средства для профилактики или лечения инфекции, где инфекция вызвана Haemophilus influenzae.
18. Применение выделенного белка по п.9 для получения лекарственного средства для профилактики или лечения инфекции, где инфекция вызвана Haemophilus influenzae.
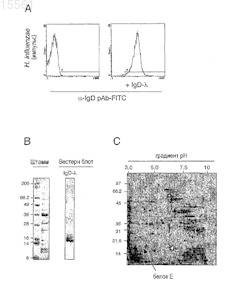
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента НОВЫЙ ПОВЕРХНОСТНЫЙ БЕЛОК HAEMOPHILUS INFLUENZAE (БЕЛОК E; pE) Настоящее изобретение относится к поверхностному белку (белку Е; рЕ), фактору вирулентности, который можно обнаружить у Haemophilus influenzae, имеющему аминокислотную последовательность SEQ ID NO: 1, иммуногенному фрагменту указанного поверхностного белка и рекомбинантному иммуногенному (рЕ(А или его процессированным вариантам на основе указанного поверхностного белка. Также описаны последовательности нуклеиновых кислот, вакцины, плазмиды и фаги, хозяева, не являющиеся человеком, последовательности рекомбинантных нуклеиновых кислот, слитые белки и продукты слияния. Также описан способ рекомбинантного получения указанного белка или его процессированных фрагментов. 015561 Область, к которой относится изобретение Настоящее изобретение относится к поверхностному белку Е, фактору вирулентности, который существует у всех инкапсулированных и атипичных Haemophilus influenzae. Предпосылки к созданию изобретения Как Haemophilus influenzae b типа (Hib), так и атипичная H. influenzae (NTHi) вызывают целый ряд заболеваний у детей и взрослых. Hib вызывает бактериальный менингит и другие инвазивные инфекции у детей младше 4 лет, тогда как NTHi была выделена в случаях среднего отита, синусита, эпиглоттита,трахеобронхита и пневмонии и может вызывать сепсис у новорожденных. В настоящее время отсутствует коммерчески доступная вакцина против NTHi, а против Hib используют ряд вакцин. Эти вакцины состоят из капсульного полисахарида Hib, полирибозилрибитолфосфата, конъюгированного с различными белковыми носителями (комплексом белков наружной мембраны менингококка, столбнячным токсоидом, нетоксичным мутантом дифтерийного токсина или дифтерийным токсоидом) для преодоления слабого иммунного ответа на капсульный полисахарид у детей младше 18 месяцев. Белки наружной мембраны H. influenzae (OMP) также рассматриваются в качестве носителей полирибозилрибитолфосфата,поскольку показано, что они являются мишенями для антител хозяина, сопровождая Hib и NTHi инфекции. Антитела к ОМР Р 1, Р 2, Р 4, Р 5 и Р 6 и белок 98-кДа были протестированы в in vivo протективных иin vitro бактерицидных исследованиях в отношении инфекций, вызванных H. influenzae, с антителами к Р 1, Р 4 и Р 6, демонстрируя биологическую активность как в отношении гомологичных, так и в отношении гетерологичных штаммов H. influenzae. Недостаточная гетерологичная защита со стороны антител в отношении других ОМР отчасти имеет место вследствие антигенной вариабельности этих белков среди различных штаммов H. influenzae. Следовательно, идеальный антиген должен быть как представленным на поверхности бактерии, так и иметь стабильные антигенные свойства. Лабораторно был выделен, клонирован, секвенирован мембранный белок 42-кДа (белок D), который широко распространен и является антигенно-стабильным среди обоих штаммов Hib и NTHi, и было показано, что он является патогенетическим фактором и возможным кандидатом для вакцины (1-5). Два десятилетия назад, было показано, что Haemophilus influenzae и М. catarrhalis демонстрируют высокую аффинность в отношении как растворимого, так и поверхностно-связанного IgD человека (6). Представляется, что IgD-связывание сравнимо с подобным взаимодействием с поверхностно-связаннымIgD на клеточном уровне, феноменом, который объясняет сильные митогенные воздействия Н. influenzae и М. catarrhalis на лимфоциты человека (7-9). Был выделен и клонирован IgD-связывающий белок наружной мембраны Н. influenzae (белок D) и было показано, что он является важным патогенетическим фактором (1-5). Однако белок D не связывается повсеместно со всеми IgD-миеломами (10). Краткое изложение сущности изобретения Принимая во внимание тот факт, что было обнаружено, что Н. influenzae является ведущей причиной инфекций верхних и нижних дыхательных путей, в настоящее время существует необходимость разработать вакцины, которые можно использовать против H. influenzae. Таким образом, задачей настоящего изобретения было выяснить, каким образом Н. influenzae взаимодействует с клетками в организме и взаимодействует с иммунной системой, и получить новый тип вакцины. В соответствии с одним аспектом настоящее изобретение относится к поверхностному белку, который можно обнаружить у Haemophilus influenzae, с аминокислотной последовательностью, соответствующей последовательности SEQ ID NO: 1, или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидрокслирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с другим аспектом настоящее изобретение относится к иммуногенному фрагменту указанного поверхностного белка, этот фрагмент может быть обнаружен у Haemophilus influenzae, или его природным или искусственно модифицированным вариантам. В соответствии с дополнительным аспектом настоящее изобретение относится к рекомбинантноиммуногенному белку на основе упомянутого выше поверхностного белка, в котором аминокислоты в положении с 1 по 21 последовательности SEQ ID NO: 1 были удалены или заменены одной или несколькими аминокислотами. В одном варианте осуществления аминокислоты в положении с 1 по 21 последовательности SEQ ID NO: 1 были заменены последовательностью от 0 до 21 необязательных аминокислот. В другом варианте осуществления рекомбинантный иммуногенный белок имеет аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 2, или его фрагмент, гомолог, функциональный эквивалент, производное, вырожденный вариант или продукт гидроксилирования, сульфонирования или гликозилирования или другой продукт вторичного процессинга. В соответствии с дополнительным аспектом настоящее изобретение относится к белку, имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 3, или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с другим дополнительным аспектом настоящее изобретение относится к пептиду,-1 015561 имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 4,или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с еще одним дополнительным аспектом настоящее изобретение относится к пептиду, имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 5, или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с дополнительным аспектом настоящее изобретение относится к пептиду, имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 6, или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с другим дополнительным аспектом настоящее изобретение относится к пептиду,имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 7,или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с еще одним дополнительным аспектом настоящее изобретение относится к белку,имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 8,или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с дополнительным аспектом настоящее изобретение относится к пептиду, имеющему аминокислотную последовательность, соответствующую пследовательности SEQ ID NO: 9, или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с другим аспектом настоящее изобретение относится к пептиду, имеющему аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 10, или его фрагменту, гомологу, функциональному эквиваленту, производному, вырожденному варианту или продукту гидроксилирования, сульфонирования или гликозилирования или другому продукту вторичного процессинга. В соответствии с другим аспектом настоящее изобретение относится к применению по меньшей мере одного белка, фрагмента или пептида, описанного выше, для производства лекарственного средства для профилактики или лечения инфекции. В одном варианте осуществления эта инфекция вызванаHaemophilias influenzae, а в другом аспекте Haemophilus influenzae является инкапсулированной или атипичной. Еще в одном варианте осуществления указанное применение служит для профилактики или лечения среднего отита, синусита или инфекций нижних дыхательных путей у детей, а также у взрослых,например, с хронической обструктивной болезнью легких (ХОБЛ). В соответствии с одним аспектом настоящее изобретение относится к лекарственному средству, содержащему по меньшей мере один белок, фрагмент или пептид, описанный выше, и один или несколько фармацевтически приемлемых адъювантов, наполнителей, эксципиентов, связующих, носителей, консервантов, буферных агентов, эмульгаторов, увлажнителей или соединений, облегчающих трансфекцию. В соответствии с другим аспектом настоящее изобретение относится к композиции вакцины, содержащей по меньшей мере один белок, фрагмент или пептид, описанный выше. В одном варианте осуществления указанная композиция вакцины содержит по меньшей мере ди-, три- или мультимер указанного белка, фрагмента или пептида. В другом варианте осуществления композиция вакцины дополнительно содержит один или несколько фармацевтически приемлемых адъювантов, наполнителей, эксципиенов, связующих, носителей, консервантов, буферных агентов, эмульгаторов, увлажнителей или соединений, облегчающих трансфекцию. Еще в одном варианте осуществления указанная композиция вакцины содержит по меньшей мере одну дополнительную вакцину, а еще в одном варианте осуществления композиция вакцины содержит иммуногенную часть другой молекулы, где эта иммуногенная часть другой молекулы может быть выбрана из группы, включающей белок D H. influenzae (ЕР 594610), MIDMoraxella catarrhalis (WO 03/004651, WO 97/41731 и WO 96/34960), UspA1 или UspA2 Moraxella catarrhalis (WO 93/03761) и белок наружной мембраны или углеводную капсулу любого патогена респираторного тракта или ДНК олигонуклеотиды, такие как мотив CpG. В одном аспекте настоящее изобретение относится к последовательности нуклеиновой кислоты,кодирующей белок, фрагмент или пептид, описанный выше, а также ее гомологам, полиморфизмам, вырожденным вариантам и вариантам сплайсинга. В одном варианте осуществления указанная последовательность нуклеиновой кислоты слита по меньшей мере с другим геном.-2 015561 В другом аспекте настоящее изобретение относится к плазмиде или фагу, содержащему последовательность нуклеиновой кислоты, описанную выше. Еще в одном варианте осуществления настоящее изобретение относится к хозяину, не являющемуся человеком, содержащему по меньшей мере одну плазмиду, описанную выше, и способному продуцировать белок, фрагмент или пептид, описанный выше, а также их гомологи, полиморфизмы, вырожденные варианты и варианты сплайсинга, этот хозяин выбран среди бактерий, дрожжей и растений. В одном варианте осуществления указанным хозяином является Е. coli. Еще в одном аспекте настоящее изобретение относится к слитому белку или полипептиду, где белок, фрагмент или пептид, описанный выше, объединен по меньшей мере с другим белком, путем использования рекомбинантной последовательности нуклеиновой кислоты, описанной выше. В одном варианте осуществления указанный слитый белок представляет собой ди-, три- или мультимер белка,фрагмента или пептида, описанного выше. В одном аспекте, настоящее изобретение относится к продукту слияния, в котором белок, фрагмент или пептид, описанный выше, ковалентно или посредством любого другого способа связан с белком,углеводом или матрицей. Еще в одном аспекте настоящее изобретение относится к способу выделения белка, фрагмента или пептида, описанного выше, указанный способ включает стадии:a) выращивания Haemophilus influenzae или Е. coli, содержащей ДНК, кодирующую указанный белок, фрагмент или пептид, сбора бактерий и выделения наружных мембран или телец включения;b) растворения телец включения сильным растворителем;c) добавления ренатурирующего агента иd) диализа полученной в результате суспензии против буфера рН от 8 до 10. В одном варианте осуществления указанного способа сильный растворитель представляет собой гуанидина гидрохлорид, а в другом варианте осуществления ренатурирующим агентом является аргинин. В другом аспекте настоящее изобретение относится к лекарственному средству или композиции вакцины, описанной выше, содержащей указанный слитый белок или полипептид, или указанный продукт слияния. В одном аспекте настоящее изобретение относится к способу профилактики или лечения инфекции у индивидуума, предусматривающему введение фармацевтически эффективного количества лекарственного средства или композиции вакцины, описанной выше. В одном варианте осуществления указанная инфекция вызывается Haemophilus influenzae как инкапсулированной, так и атипичной, а в другом варианте осуществления инфекционное заболевание выбрано из группы, состоящей из среднего отита, синусита или инфекций нижних дыхательных путей. Настоящее изобретение относится к полипептидам белка Е и полинуклеотидам белка Е, рекомбинантному материалу и способам их получения. В другом аспекте изобретение относится к способам использования таких полипептидов и полинуклеотидов, включая среди прочего профилактику и лечение микробных заболеваний. В дополнительном аспекте изобретение относится к диагностическим анализам для выявления заболеваний, связанных с микробными инфекциями, и состояний, связанных с такими инфекциями, например анализы для выявления экспрессии или активности полинуклеотидов белка Е или полипептидов. Различные изменения и модификации сущности и объема описанного изобретения будут очевидны специалистам в данной области из следующих описаний и из других частей настоящего изложения. Описание чертежей Фиг. 1. Белок Е 16,3 кДа Haemophilus influenzae выявляют с помощью миеломного белка IgD. На А показан анализ экспрессии рЕ с помощью проточной цитометрии у H. influenzae 772. Показаны SDSPAGE и Вестерн-блот (В) и 2-мерный SDS-полиакриламидный гель-электрофорез (С) белков наружной мембраны H. influenzae MinnA, обработанных Empigen. Показаны экстракты белка наружной мембраны до (В) и после разделения на Q-сефарозе (С). Стрелка на панели С указывает ожидаемую локализацию рЕ на основе данных Вестерн-блоттинга (используя IgD в качестве зонда) соответствующего геля. На А бактерии нагружали миеломным белком IgD с последующей инкубацией с кроличьими FITCконъюгированными анти-IgD pAb и анализом с помощью проточной цитометрии. На В показаны SDSгель, окрашеный Кумасси голубым (пятно), и Вестерн-блот, зондированный IgD миеломы человека с последующим инкубированием с конъюгированными с пероксидазой хрена козьими поликлональными антителами к IgD человека. Образцы кипятили в присутствии 2-меркаптоэтанола в течение 10 мин до загрузки. Фиг. 2. Профили проточной цитометрии рЕ-экспрессирующей Е. coli по сравнению с H. influenzae 3655 дикого типа и мутанта с дефицитом рЕ. Е. coli, содержащую пустой вектор pUC18 (A) сравнивают с бактерией, трансформированной pUC18, содержащей геномную ДНК из H. influenzae 772 (гены с HI0175 по HI0178) (В). Показана экспрессия рЕ у атипичной H. influenzae 3655 дикого типа (С) и у соответствующего мутанта (D). Е. coli штамм JM83 и H. influenzae выращивали в жидких культурах в течение но-3 015561 чи. Е. coli инкубировали с IgD миеломы человека на льду. Через 1 ч и после промывания добавляли конъюгированные с FITC кроличьи pAb к IgD человека в течение дополнительных 30 мин с последующими стадиями промывки и последующим анализом с помощью проточной цитометрии. Те же самые операции проводили с H. influenzae 3655 или производным мутантом рЕ, используя специфические кроличьи поликлональные антитела к рЕ и конъюгированные с FITC козьи антикроличьи pAb. Фиг. 3. Экспрессия рЕ H. influenzae и родственных видов, обнаруженная по данным проточной цитометрии и с использованием IgD миеломной сыворотки. Было проанализировано двадцать два штамма NTHi и 27 штаммов гемофильных видов или родственных бактерий. Бактерии выращивали до стационарной фазы и инкубировали с IgD миеломы человека на льду. Через 1 ч и после промываний добавляли конъюгированные с FITC кроличьи поликлональные антитела к IgD человека (pAb) дополнительно на 30 мин с последующими стадиями промывания и последующим анализом с помощью проточной цитометрии. Фиг. 4. рЕ экспрессируется у NTHi и инкапсулированных H. influenzae по данным Вестерн-блотов. Бактериальные белки указанных штаммов получали, используя Empigen, и наносили на SDS-гель с последующим проведением Вестерн-блоттинга, зондированного IgD миеломы человека и козьими поликлональными pAb к IgD человека, конъюгированными с пероксидазой хрена, в качестве детектирующих антител. Фиг. 5. Рекомбинантный рЕ 22-160, основанный на последовательности NTHi 772 по сравнению с нативным рЕ H. influenzae MinnA. На А показана аминоконцевая последовательность рЕ-производного фрагмента А в сравнении с предполагаемой аминокислотной последовательностью нативного белка рЕ. На В показана схематическая иллюстрация рЕ(А) с гистидиновой меткой. На С показан размер и чистота на PAGE, окрашенном Кумасси. На D и Е экстракт белка наружной мембраны (ОМР) H. influenzaeMinnA сравнивают с рЕ(А), полученным рекомбинантным путем, на геле, окрашенном Кумасси, и Вестерн-блоте соответственно. На А сигнальная пептидная последовательность была удалена, кроме аминокислотного остатка глутамина 21. Девять аминокислот получали на основе вектора экспрессии рЕТ 26(+),как указано. Числа представляют положения аминокислот, начиная с начала трансляции pE. Рекомбинантный рЕ(А) получали в Е. coli, очищали и подвергали разрушению по Эдману для анализа сайта расщепления сигнальной пептидазы. На D и Е два геля прогоняли одновременно, один окрашивали Кумасси бриллиантовым голубым, а другой блотировали на Иммобилон-Р мембраны, зондированные белкомIgD миеломы человека с последующим инкубированием с соответствующими вторичными антителами, конъюгированными с пероксидазой хрена. Фракцию ОМР очищали, используя Empigen, как описано в разделе "Материалы и методы". Фиг. 6. Белок Е является необычайно консервативным. Показана частота точковых мутаций в 13-31 штаммах Haemophilus influenzae (табл. 2), включая как инкапсулированные, так и атипичные изоляты. Результаты были получены секвенированием, с использованием фланкирующих праймеров. Все последовательности сравнивали с последовательностью рЕ Н. influenzae Rd, которую использовали в качестве эталонной последовательности и представили здесь. Фиг. 7. Профиль гидрофобности рЕ. Указаны гидрофобные и гидрофильные части индивидуальных аминокислотных остатков. Также отмечен предполагаемый сигнальный пептид. Данные были получены с использованием стандартного способа, как описано (21). Фиг. 8. SDS-PAGE, демонстрирующий рекомбинантный рЕ 22-160 (фрагмент А), и серии усеченных фрагментов, обозначенные с В по Н. На А показана схема различных фрагментов, а на В показан SDSPAGE. ДНК, кодирующую различные белки, лигировали в вектор экспрессии рЕТ 26(+) и рекомбинантно экспрессировали в Е. coli. Полученные в результате гиперэкспрессированные белки очищали на никелевых смолах и разделяли на SDS-PAGE с последующим окрашиванием Кумасси бриллиантовым голубым. Фиг. 9. Мутантный штамм, дефицитный по рЕ (NTHi 3655) обладает в 100-1000 раз меньшей способностью вызывать острый средний отит у крыс. Инфицирование вызывали у самцов крыс SpragueDawley вентральным срединным разрезом на шее, с последующим введением в полость среднего уха указанного числа бактерий в 0,05 мл. Данные показаны с 3 дня заражения и являются репрезентативными по 5 животным в каждой группе. Фиг. 10. Средние концентрации антител IgG и IgA, направленных против рЕ, в сыворотках различных возрастных групп. Анти-рЕ антитела анализировали с помощью сэндвич ELISA, используя рекомбинантный рЕ(А). Чистота рЕ(А) была, как показано на фиг. 5. Фиг. 11. рЕ является необычайно консервативным в пределах различных гемофильных штаммов. Ген ре был секвенирован у H. influenzae инкапсулированного типа a (n=2), b (n=2), с (n=2), d (n=l), e (n=2) и f (n=3), NTHi (n=8), H. influenzae биовар aegypticus (n=6) и H. aegypticus (n=5), используя фланкирующие праймеры. Rd обозначает Н. influenzae штамм Rd (Н 10178), а 772 NTHi штамм 772. Числа с 65 по 577 соответствуют штаммам, отмеченным в табл. 1. Описание изобретения Перед подробным объяснением настоящего изобретения важно понять, что изобретение не ограничено этой заявкой подробностями описанных здесь вариантов осуществления и стадий. Приведенные-4 015561 примеры иллюстрируют изобретение, а не ограничивают его каким-либо образом. Изобретение может иметь другие варианты осуществления, и его можно осуществить на практике и выполнить различными способами. Должно быть понятно, что используемая здесь фразеология и терминология предназначена для описания, а не для ограничения. В настоящей заявке описывается клонирование и экспрессия нового белка наружной мембраны H.influenzae, обозначенного белком Е (рЕ). Этот белок был открыт с использованием IgD сыворотки миеломы человека со специфической аффинностью в отношении рЕ. Для максимального увеличения выхода рекомбинантного рЕ был получен усеченный фрагмент рЕ,состоящий из аминокислотных остатков с лизина 22 до лизина 160. N-концевой сигнальный пептид, содержащий аминокислоту глутамин 21, был, таким образом, удален и заменен лидерным пептидом в дополнение к девяти остаткам, происходящим из вектора рЕТ 26(+). Усеченный рЕ (т.е. рЕ 22-160) обозначили рЕ(А). Настоящее изобретение включает белок наружной мембраны Haemophilus рЕ и рЕ-производные пептиды рЕ 22-60, рЕ 22-95, рЕ 22-125, рЕ 41-68, рЕ 56-125, рЕ 56-160, рЕ 86-160, рЕ 115-160, и их ди-, триили олигомеры. В частности, последовательностям рЕ или производных пептидов, которые являются поверхностными, придается более важное первостепенное значение. Таким образом, композиции вакцины по настоящему изобретению содержат в качестве иммуногенных компонентов поверхностный белок, который может быть обнаружен у всех Haemophilus influenzae,иммуногенный фрагмент указанного поверхностного белка, рекомбинантный иммуногенный белок на основе указанного поверхностного белка, рекомбинантный иммуногенный белок, имеющий аминокислотную последовательность в соответствии с последовательностью SEQ ID NO: 2, и/или пептид, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 3-10, или их фрагмент, гомолог,функциональный эквивалент, производное, вырожденный вариант или продукт гидроксилирования,сульфонирования или гликозилирования или другой продукт вторичного процессинга. Композиции вакцины также могут содержать слитый белок или полипептид или продукт слияния в соответствии с настоящим изобретением в качестве иммуногенных компонентов. Иммуногенные компоненты способны вызывать антительный или другой иммунный ответ на Haemophilus influenzae, при котором образованные антитела ингибируют патогенное действие бактерий Haemophilus influenzae на клетки индивида. Иммуногенная доза композиции вакцины в соответствии с изобретением представляет собой дозу, которая индуцирует после введения детектируемый гуморальный и/или клеточный иммунный ответ по сравнению со стандартным иммунным ответом до введения. Последовательности нуклеиновых кислот, используемые в композиции вакцины по настоящему изобретению, для получения антигенов могут быть вставлены в любой из широкого разнообразия векторов экспрессии с помощью целого ряда способов. Считается, что такие способы известны специалистам в данной области. Композиции вакцины легко получить, используя известные способы и методики, и их можно вводить различными путями, предпочтительно парентерально или интраназально. Составы, подходящие для парентерального или интраназального введения, включают водные или неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики и растворы, которые придают составу изотоничность с физиологической жидкостью конкретного пациента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты или загустители. Активный иммуногенный ингредиент зачастую смешивают с эксципиентами, которые являются фармацевтически приемлемыми, например водой, физиологическим раствором, декстрозой, глицерином, этанолом или подобными. Кроме того, композиция вакцины также может содержать незначительные количества вспомогательных веществ, таких как увлажнители или эмульгаторы, рН буферные агенты, связующие,носители или консерванты. Композиции вакцины также могут включать адъюванты для усиления иммуногенности композиции, такие как адъюванты Фрейнда или другие системы, известные в данной области. Иммуногенные компоненты композиций вакцины, т.е. белки, фрагменты, пептиды, слитые белки или полипептиды или продукты слияния в соответствии с настоящим изобретением, могут быть составлены в вакцину в виде нейтральных или солевых форм. Дозировка композиций вакцины будет зависеть от специфической активности вакцины, и ее легко определить с помощью общепринятых экспериментов. Композиции вакцины вводят в таком количестве,которое будет терапевтически эффективным и иммуногенным, и количество зависит от индивида. Изобретение относится к полипептидам белка Е и полинуклеотидам, более подробно описанным ниже. В частности, изобретение относится к полипептидам и полинуклеотидам белка Е атипичной Н.Influenzae. Полипептиды белка Е имеют сигнальную последовательность и представлены на поверхности бактерии. Сигнальный пептид расположен от остатка 1 до остатка 20 полипептида белка Е. В настоящем изобретении ссылка на белок Е является ссылкой на любой из пептидов, иммуногенных фрагментов, слияний, полипептидов или белков по изобретению, рассматриваемых здесь (таких как SEQ ID NO: 1 с сигнальной последовательностью или без нее). Полинуклеотид, кодирующий белок-5 015561 Е, относится к любой полинуклеотидной последовательности, кодирующей любой из пептидов иммуногенных фрагментов, слияний, полипептидов или белков по изобретению, рассматриваемых здесь. Термин содержащий в контексте настоящего изобретения альтернативно может быть заменен термином состоящий из. Изобретение главным образом относится к полинуклеотидам белка Е или перечисленным здесь кодируемым полипептидам. Понятно, что последовательности, изложенные в приведенном ниже списке последовательностей как ДНК, представляют иллюстрацию одного варианта осуществления изобретения, поскольку специалистам будет понятно, что такие последовательности могут быть успешно использованы, по существу,включая рибополинуклеотиды. Последовательности полинуклеотидов белка Е представлены в SEQ ID NO: 11 (из ntHi штамм 772). Последовательности кодируемых полипептидов белка Е представлены в SEQ ID NO: 1 (из ntHi штамма 772), 2, 3, 4, 5, 6, 7, 8, 9, 10. Полипептиды. В одном аспекте изобретение относится к полипептидам H. influenzae (в частности, атипичной H.influenzae), называемым здесь белок Е и полипептиды белка Е, а также к их биологически, диагностически, профилактически, клинически или терапевтически пригодным вариантам, и композициям, содержащим вышеупомянутое. Настоящее изобретение дополнительно относится к(а) выделенному полипептиду, который содержит аминокислотную последовательность, имеющую по меньшей мере 85% идентичность, предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность, наиболее предпочтительно по меньшей мере 97-99% или полную идентичность любой последовательности SEQ ID NO: 1-10;(b) полипептиду, кодируемому выделенным полинуклеотидом, содержащим полинуклеотидную последовательность, имеющую по меньшей мере 85% идентичность, предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность, еще более предпочтительно по меньшей мере 97-99% или полную идентичность любой последовательности SEQ ID NO: 11 на протяжении полной длины выбранной последовательности SEQ ID NO: 0; или(c) полипептиду, кодируемому выделенным полинуклеотидом, содержащим полинуклеотидную последовательность, кодирующую полипептид, имеющий по меньшей мере 85% идентичность, предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность,еще более предпочтительно по меньшей мере 97-99% или полную идентичность, аминокислотной последовательности любой из последовательностей SEQ ID NO: 1-10. Полипептиды белка Е, представленные в SEQ ID NO: 1-10, представляют собой полипептиды белка Е из атипичных штаммов Н. influenzae. Дополнительные последовательности белка Е были выявлены из штаммов Н. Influenzae, перечисленных в табл. 1. Изобретение также относится к иммуногенному фрагменту полипептида белка Е, то есть смежной части полипептида белка Е, который имеет такую же или, по существу, такую же иммуногенную активность, что и полипептид, содержащий соответствующую аминокислотную последовательность, выбранную из SEQ ID NO: 1-10; другими словами, этот фрагмент (при необходимости, когда соединен с носителем) способен индуцировать иммунный ответ, который распознает полипептид белка Е. Альтернативно, или дополнительно, иммуногенный фрагмент может сохранять IgD связывающую функцию полноразмерного белка (как описано в разделе примеры, например, способность связывать IgD от The Binding Site (Birmingham, England). Такой иммуногенный фрагмент может включать, например, полипептид белка Е, лишенный N-концевой лидерной последовательности и/или трансмембранного домена и/или Сконцевого якорного домена. В предпочтительном аспекте иммуногенный фрагмент белка Е в соответствии с изобретением содержит, по существу, внеклеточные домены полипептида, который имеет по меньшей мере 85% идентичность, предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность, наиболее предпочтительно по меньшей мере 97-99% идентичность последовательности, выбранной из SEQ ID NO: 1-10, по всей длине указанной последовательности. Фрагмент представляет собой полипептид, имеющий аминокислотную последовательность, которая является полностью аналогичной как часть, а не как целое, любой аминокислотной последовательности любого полипептида по изобретению. Как и в случае полипептидов белка Е, фрагменты могут быть самостоятельными или заключены в более крупный полипептид, часть или область которого они образуют, наиболее предпочтительно в виде отдельного непрерывного участка в отдельном более крупном полипептиде. Таким образом, фрагмент может быть короче нативной последовательности полной длины или, в случае заключения в более крупном полипептиде, может представлять собой полноразмерную нативную последовательность или более длинный слитый белок. Предпочтительные фрагменты включают, например, усеченные полипептиды, имеющие часть аминокислотной последовательности, выбранной из SEQ ID NO: 1-10, или их варианты, такие как непрерыв-6 015561 ные серии остатков, которые содержат амино- и/или карбоксиконцевую аминокислотную последовательность. Предпочтительными также являются расщепленные формы полипептидов по изобретению, продуцируемые клеткой-хозяином или в клетке-хозяине. Кроме того, предпочтительными являются фрагменты, характеризующиеся структурными или функциональными свойствами, например фрагменты, которые содержат -спираль и области, образующие -спираль, -складку и области, образующие -складку,изгиб и области, образующие изгиб, гидрофильные области, гидрофобные области, -амфипатические области, -амфипатические области, шарнирные области, области, формирующие поверхность, участки связывания с субстратом и области с высоким антигенным индексом. Кроме того, предпочтительные фрагменты включают выделенный полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 15, 20, 30, 40, 50 или 100 смежных аминокислот из аминокислотной последовательности, выбранной из SEQ ID NO: 1-10, или выделенный полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 15, 20, 30, 40, 50 или 100 смежных аминокислот, отсеченных или удаленных из аминокислотной последовательности, выбранной из SEQ ID NO: 1-10. Кроме того, другие предпочтительные фрагменты представляют собой фрагменты, содержащие Вклеточный эпитоп, например те фрагменты/пептиды, которые описаны в разделе Подходящие эпитопы. Фрагменты полипептидов по изобретению могут быть использованы для получения соответствующего полноразмерного полипептида с помощью пептидного синтеза; следовательно, эти фрагменты могут быть использованы в качестве промежуточных соединений для получения полноразмерных полипептидов по изобретению. Особенно предпочтительными являются варианты, в которых несколько, 5-10, 1-5, 1-3, 1-2 или 1 аминокислота заменены, удалены или добавлены в любом сочетании. Полипептиды или иммуногенные фрагменты по изобретению могут быть в форме зрелого белка или могут быть частью более крупного белка, такого как предшественник или слитый белок. Зачастую предпочтительно включать дополнительную аминокислотную последовательность, содержащую секреторные или лидерные последовательности, пропоследовательности, последовательности, которые помогают очистке, такие как многочисленные остатки гистидина, или дополнительная последовательность для стабильности при получении рекомбинантным путем. Более того, также рассматривается добавление экзогенного полипептида или липидного хвоста или полинуклеотидных последовательностей для повышения иммуногенного потенциала конечной молекулы. В одном аспекте изобретение относится к генно-инженерным растворимым слитым белкам, содержащим полипептид по настоящему изобретению или его фрагмент и различные части константных областей тяжелых или легких цепей иммуноглобулинов различных подклассов (IgG, IgM, IgA, IgE). Предпочтительной в качестве иммуноглобулина является константная область тяжелой цепи IgG человека, в частности IgG1, в которой слияние имеет место в шарнирной области. В конкретном варианте осуществления Fc-часть может быть просто удалена путем включения расщепляемой последовательности, которая может расщепляться фактором свертывания крови Ха. Более того, это изобретение относится к способам получения таких слитых белков с помощью генной инженерии и к их применению для скрининга лекарственных средств, диагностики и лечения. Дополнительный аспект изобретения также относится к полинуклеотидам, кодирующим такие слитые белки. Примеры технологии получения слитых белков можно найти в международных патентных заявкахWO 94/29458 и WO 94/22914. Белки могут быть конъюгированы химически или экспрессированы в виде рекомбинантных слитых белков, давая возможность получать повышенные уровни в экспрессионной системе по сравнению с неслитым белком. Партнер слияния может способствовать обеспечению эпитопов Т-хелперов (иммунологический партнер слияния), предпочтительно эпитопов Т-хелперов, распознаваемых людьми, или способствовать экспрессии белка (энхарсер экспрессии) с более высокими выходами, чем нативный рекомбинантный белок. Предпочтительно партнер слияния будет как иммунологическим партнером слияния,так и партнером, усиливающим экспрессию. Слитые белки включают белок D из Haemophilus influenzae (ЕР 594610) и неструктурный белок вируса гриппа, NS1 (гемагглютинин). Другим партнером слияния является белок, известный как Omp26(WO 97/01638). Другой партнер слияния представляет собой белок, известный как LytA. Предпочтительно используют С-концевую часть молекулы. LytA получают из Streptococcus pneumoniae, который синтезирует N-ацетил-L-аланинамидаза, амидаза LytA (кодируется геном lytA Gene, 43 (1986) стр. 265-272),аутолизин, который специфически разрушает определенные связи в остове пептидогликанов. С-концевой домен белка LytA отвечает за аффинность в отношении холина или некоторых аналогов холина, таких как DEAE. Это свойство было использовано для разработки экспрессирующих плазмид E.coli C-LytA,пригодных для экспрессии слитых белков. Была описана очистка гибридных белков, содержащих фрагмент С-LytA на их аминоконцах Biotechnology: 10, (1992) стр. 795-798. Возможно использовать повторяющуюся часть молекулы LytA, найденной на С-конце, начиная с остатка 178, например остатки 188-7 015561 305. Настоящее изобретение также включает варианты упомянутых выше полипептидов, то есть полипептидов, которые отличаются от эталонных полипептидов консервативными аминокислотными заменами, при которых остаток заменяется другим остатком с аналогичными свойствами. Такие характерные замены находятся среди Ala, Val, Leu и Ile; среди Ser и Thr; среди кислых остатков Asp и Glu; среди Asn и Gln и среди основных остатков Lys и Arg или ароматических остатков Phe и Tyr. Полипептиды по настоящему изобретению могут быть получены любым подходящим способом. Такие полипептиды включают выделенные природные полипептиды, полипептиды, полученные рекомбинантным путем, полипептиды, полученные синтетически, или полипептиды, полученные с помощью комбинации этих способов. Средства для получения таких полипептидов широко распространены в уровне техники. Наиболее предпочтительно, чтобы полипептид по изобретению был получен из атипичной Н. influenzae, однако предпочтительно он может быть получен из других организмов того же таксономического рода. Полипептид по изобретению также может быть получен, например, из организмов того же таксономического семейства или порядка. Полинуклеотиды. Объектом изобретения являются полинуклеотиды, которые кодируют полипептиды белка Е, в частности полинуклеотиды, которые кодируют полипептиды, обозначенные здесь белком Е. В особенно предпочтительном варианте осуществлления изобретения полинуклеотиды содержат область, кодирующую полипептиды белка Е, содержащую последовательности, представленные в SEQID NO: 11, которая включает полноразмерный ген или его вариант. Полинуклеотиды белка Е, приведенные в SEQ ID NO: 11, представляют собой полинуклеотиды белка Е из атипичной H. influenzae штамма 772. Другие последовательности были определены у генов,кодирующих белок Е из штаммов H. influenzae, перечисленных в табл. 1. В качестве дополнительного аспекта изобретения представлены выделенные молекулы нуклеиновой кислоты, кодирующие и/или экспрессирующие полипептиды белка Е, и полинуклеотиды, главным образом, полипептиды и полинуклеотиды белка Е атипичной H. influenzae, в том числе, например, непроцессированные РНК, рибозимные РНК, мРНК, кДНК, геномные ДНК, В- и Z-ДНК. Дополнительные варианты осуществления изобретения включают биологически, диагностически, профилактически, клинически или терапевтически пригодные полинуклеотиды и полипептиды и их варианты и композиции,содержащие их. Другой аспект настоящего изобретения относится к выделенным полинуклеотидам, в том числе по меньшей мере к одному полноразмерному гену, который кодирует полипептид белка Е, имеющий расшифрованную аминокислотную последовательность SEQ ID NO: 1-10, и полинуклеотидам, близкородственным ему, и их вариантам. В другом особенно предпочтительном варианте осуществления изобретение относится к полипептиду белка Е из атипичной Н. influenzae, содержащему или состоящему из SEQ ID NO: 1-10, или его варианту. Используя представленную здесь информацию, такую как полинуклеотидные последовательности,представленные в SEQ ID NO: 11, полинуклеотид по изобретению, кодирующий полипетиды белка Е,может быть получен с использованием стандартных способов клонирования и скрининга, например, для клонирования и секвенирования фрагментов хромосомной ДНК из бактерий, используя клетки атипичной H. influenzae штамма 3224 А (или 772) в качестве исходного материала, с последующим получением полноразмерного клона. Например, для получения полинуклеотидной последовательности по изобретению, например полинуклеотидной последовательности, приведенной в SEQ ID NO: 0, обычно библиотеку клонов хромосомной ДНК атипичной Н. influenzae штамма 3224 А (или 772) в E.coli или каком-то другом подходящем хозяине зондируют радиоактивно меченным олигонуклеотидом, предпочтительно 17 мер или длиннее, полученным из неполной последовательности. Клоны, несущие ДНК, идентичную к ДНК зонда, затем могут быть выделены с помощью гибридизации в строгих условиях. Путем секвенирования индивидуальные клоны, таким образом, идентифицируют гибридизацией с праймерами для секвенирования, сконструированными из исходной полипептидой или полинуклеотидной последовательности,затем возможно продолжить полинуклеотидную последовательность в обоих направлениях для определения последовательности всего гена. Такое секвенирование удобно проводить, например, используя денатурированную двухспиральную ДНК, полученную из плазмидного клона. Подходящие методики описаны у Maniatis, Т., Fritsch, E.F. и Sambrook et al., MOLECULAR CLONING, A LABORATORYMANUAL, 2nd Ed.; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989). (в частности, см. разделы Screening By Hybridization 1.90 and Sequencing Denatured Double-Stranded DNA Templates 13.70). Также можно провести прямой сиквенс геномной ДНК для получения полной длины последовательности гена. Иллюстрирующие это изобретение полинуклеотиды, представленные в SEQ ID NO: 11, были открыты в библиотеке ДНК, полученной из атипичной H. influenzae. Кроме того, каждая последовательность ДНК, представленная в SEQ ID NO: 11, содержит открытую рамку считывания, кодирующую белок, имеющий приблизительно ряд аминокислотных остатков,-8 015561 изложенных в SEQ ID NO: 1, с установленной молекулярной массой, которую можно вычислить, используя значения массы аминокислотных остатков, хорошо известных специалистам в данной области. Полинуклеотиды SEQ ID NO: 0 между стартовым кодоном и стоп-кодоном кодируют соответственно полипептид последовательности SEQ ID NO: 1. В дополнительном аспекте настоящее изобретение относится к выделенному полинуклеотиду, содержащему или состоящему из(a) полинуклеотидной последовательности, которая по меньшей мере имеет 85% идентичность,предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность, еще более предпочтительно по меньшей мере 97-99% или полную идентичность любой полинуклеотидной последовательности из SEQ ID NO: 11 по всей длине полинуклеотидной последовательности от SEQ ID NO: 0; или(b) полинуклеотидной последовательности, кодирующей полипептид, который имеет по меньшей мере 85% идентичность, предпочтительно по меньшей мере 90% идентичность, более предпочтительно по меньшей мере 95% идентичность, еще более предпочтительно по меньшей мере 97-99% или 100% полную идентичность любой аминокислотной последовательности, выбранной из SEQ ID NO: 1-10 (или ее фрагменту), по всей длине аминокислотной последовательности из SEQ ID NO: 1-10 (или ее фрагмента). Полинуклеотид, кодирующий полипептид по настоящему изобретению, включая гомологи или ортологи видов, отличных от атипичной Н. influenzae, может быть получен способом, который включает стадии скрининга соответствующей библиотеки в строгих условиях гибридизации (например, используя температуру в интервале 45-65 С и концентрацию SDS от 0,1 до 1%) с меченым или детектируемым зондом, состоящим из или содержащим любую последовательность, выбранную из SEQ ID NO: 11, или ее фрагмент; и выделения полноразмерного гена и/или геномных клонов, содержащих указанную полинуклеотидную последовательность. Изобретение относится к полинуклеотидной последовательности, идентичной по всей ее длине кодирующей последовательности (открытая рамка считывания), представленной в SEQ ID NO: 11. Кроме того, изобретение относится к кодирующей последовательности зрелого полипептида или его фрагмента,как таковой, а также кодирующей последовательности зрелого полипептида или фрагмента в рамке считывания с другой кодирующей последовательностью, такой как последовательность, кодирующая лидерную или секреторную последовательность, пре-, или про-, или препробелковую последовательность. Полинуклеотид по изобретению также может содержать по меньшей мере одну некодирующую последовательность, в том числе, например, по меньшей мере одну некодирующую 5'- и 3'-последовательность,такие как транскрибируемые, но нетранслируемые последовательности, сигналы терминации (такие какrho-зависимые и rho-независимые сигналы терминации), сайты связывания с рибосомой, последовательности Kozak, последовательности, которые стабилизируют мРНК, интроны и сигналы полиаденилирования, но не только. Полинуклеотидная последовательность также может содержать дополнительную кодирующую последовательность, кодирующую дополнительные аминокислоты. Например, может быть закодирована маркерная последовательность, которая облегчает очистку слитого полипептида. В некоторых вариантах осуществления изобретения маркерная последовательность представляет собой гексагистидиновый пептид, обеспечиваемый вектором pQE (Qiagen, Inc.) и описанный у Gentz et al., Proc. Natl.Acad. Sci., USA 86: 821-824 (1989), или пептидный таг HA (Wilson et al., Cell 37: 767 (1984), оба из которых могут быть пригодны для очистки полипептидной последовательности, слитой с ними. Полинуклеотиды по изобретению также включают, но не только, полинуклеотиды, содержащие структурный ген и последовательности, связанные с ним в природе, которые контролируют экспрессию гена. Нуклеотидная последовательность, кодирующая полипептид белка Е последовательности SEQ IDNO: 1-10, может быть идентична соответствующей полинуклеотидной кодирующей последовательностиSEQ ID NO: 11 (или содержащейся в пределах SEQ ID NO: 11). Альтернативно это может быть любая последовательность, которая в результате избыточности (вырожденности) генетического кода также кодирует полипептид последовательности SEQ ID NO: 1-10. Термин полинуклеотид, кодирующий полипептид в контексте настоящей заявки охватывает полинуклеотиды, которые включают последовательность, кодирующую полипептид по изобретению, в частности бактериальный полипептид, и более конкретно полипептид белка Е атипичной Н. influenzae,имеющий аминокислотную последовательность, представленную в любой из последовательностей SEQID NO: 1-10, или ее фрагмент. Этот термин также охватывает полинулеотиды, которые включают отдельную непрерывную область или дискретные области, кодирующие этот полипептид (например, полинуклеотиды, прерванные интегрированным фагом, интегрированной вставочной последовательностью,интегрированной векторной последовательностью, интегрированной транспозонной последовательностью или вследствие редактирования РНК или реорганизации геномной ДНК) вместе с дополнительными областями, которые также могут содержать кодирующие и/или некодирующие последовательности. Изобретение дополнительно относится к вариантам полинуклеотидов, описанных здесь, которые кодируют варианты полипептида, имеющего расшифрованную аминокислотную последовательность-9 015561 любой из последовательностей SEQ ID NO: 1-10. Фрагменты полинуклеотидов по изобретению могут быть использованы, например, для синтеза полной длины полинуклеотидов по изобретению. Предпочтительными фрагментами являются те полинуклеотиды, которые кодируют В-клеточный эпитоп, например фрагменты/пептиды, описанные в разделе Подходящие эпитопы, и рекомбинантные химерные гены, содержащие указанные полинуклеотидные фрагменты. Дополнительными особенно предпочтительными вариантами осуществления являются полинуклеотиды, кодирующие варианты белка Е, которые имеют аминокислотную последовательность полипептида белка Е любой из последовательностей SEQ ID NO: 1-10, в которых несколько, немного, 5-10, 1-5,1-3, 2, 1 или ни одного аминокислотного остатка заменено, модифицировано, удалено и/или добавлено в любой комбинации. Особенно предпочтительными среди них являются молчащие замены, добавления и делеции, которые не изменяют свойств и активности полипептида белка Е (например, свойства, описанные здесь и в экспериментальной части). Дополнительными предпочтительными вариантами осуществления изобретения являются полинуклеотиды, которые по меньшей мере на 85% идентичны по всей длине полинуклеотидам, кодирующим полипептиды белка Е, имеющие аминокислотную последовательность, представленную в любой из последовательностей SEQ ID NO: 1-10, и полинуклеотидам, которые комплементарны таким полинуклеотидам. Альтернативно, наиболее предпочтительными являются полинуклеотиды, которые содержат область, которая по меньшей мере на 90% идентична по всей длине полинуклеотидам, кодирующим полипептиды белка Е, и полинуклеотидам, комплементарным им. В этом смысле, особенно предпочтительными являются полинуклеотиды, которые по меньшей мере на 95% идентичны полноразмерной нуклеотидной последовательности. Кроме того, полинуклеотиды, которые по меньшей мере на 97% идентичны полноразмерной последовательности более предпочтительны, чем полинуклеотиды по меньшей мере с 95% идентичносью, а наиболее предпочтительны полинуклеотиды, которые по меньшей мере на 98% и по меньшей мере на 99% идентичны полноразмерной последовательности, причем самыми предпочтительными являются последовательности, которые по меньшей мере на 99% идентичны полноразмерной последовательности. Предпочтительными вариантами осуществления являются полинуклеотиды, кодирующие полипептиды, которые сохраняют, по существу, ту же биологическую функцию или активность, что и зрелый полипептид, кодируемый последовательностью ДНК, выбранной из SEQ ID NO: 11 (например, те активности, которые описаны в настоящей заявке в экспериментальной части). В соответствии с некоторыми предпочтительными вариантами осуществления, изобретение относится к полинуклеотидам, которые гибридизируются, в частности в строгих условиях, с полинуклеотидными последовательностями белка Е, такими как полинуклеотиды SEQ ID NO: 11. Изобретение дополнительно относится к полинуклеотидам, которые гибридизуются с представленными здесь полинуклеотидными последовательностями. В этом смысле изобретение относится к полинуклеотидам, которые гибридизируются в строгих условиях с описанными здесь полинуклеотидами. В контексте настоящей заявки термины строгие условия и гибридизации в строгих условиях означает гибридизацию, происходящую только в том случае, если существует по меньшей мере 95% и предпочтительно по меньшей мере 97% идентичность между последовательностями. Конкретным примером гибридизации в строгих условиях является инкубация в течение ночи при 42 С в растворе, содержащем 50% формамида, 5 SSC (150 мМ NaCl, 15 мМ тринатрия цитрат), 50 мМ фосфата натрия (рН 7,6), 5 раствора Денхардта, 10% сульфата декстрана и 20 мкг/мл денатурированной, расщепленной ДНК спермы лосося с последующим промыванием гибридизационной подложки в 0,1 SSC примерно при 65 С. Условия гибридизации и промывки хорошо известны и пояснены на примерах у Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), в частности в части 11. Раствор для гибридизации также может быть использован с полинуклеотидными последовательностями по настоящему изобретению. Изобретение также относится к полинуклеотиду, состоящему из или содержащему полинуклеотидную последовательность, полученную скринингом соответствующей библиотеки, содержащей полный ген для полинуклеотидной последовательности, изложенной в любой из последовательностей SEQ IDNO: 11, в строгих условиях гибридизации с зондом, имеющим последовательность указанной полинуклеотидной последовательности, изложенной в соответствующей последовательности SEQ ID NO: 11, или ее фрагменту; и выделение указанной полипептидной последовательности. Фрагменты, подходящие для получения такого полинуклеотида, включают, например, зонды и праймеры, описанные в этой заявке в других местах. Рассматриваемые в других местах настоящего описания полинуклеотидные анализы в соответствии с изобретением, например полинуклеотиды по изобретению, могут быть использованы в качестве гибридизационного зонда для РНК, кДНК и геномной ДНК для выделения полноразмерных кДНК и геномных клонов, кодирующих белок Е, и для выделения кДНК и геномных клонов других генов, которые имеют высокую идентичность, в частности высокую идентичность последовательностей, с генами белка Е. Такие зонды, в основном, будут содержать по меньшей мере 15 нуклеотидных остатков или пар оснований.- 10015561 Предпочтительно такие зонды будут иметь по меньшей мере 30 нуклеотидных остатков или пар оснований и могут иметь по меньшей мере 50 нуклеотидных остатков или пар оснований. Особенно предпочтительные зонды будут иметь по меньшей мере 20 нуклеотидных остатков или пар оснований и будут иметь менее 30 нуклеотидных остатков или пар оснований. Кодирующая область генов белка Е может быть выделена скринингом с использованием ДНК последовательности, приведенной в SEQ ID NO: 11 для синтеза олигонуклеотидного зонда. Меченый олигонуклеотид, имеющий последовательность, комплементарную последовательности гена по изобретению, затем используют для скрининга библиотеки кДНК, геномной ДНК или мРНК для определения, с какими членами библиотеки гибридизируется этот зонд. Существует несколько доступных и хорошо известных специалисту в уровне техники способов получения полноразмерных ДНК или удлинения коротких ДНК, например те, которые основаны на методе быстрой амплификации концов кДНК (RACE) (см., например, Frohman, et al., PNAS USA 85: 8998-9002,1988). Недавние модификации этого метода, примером которых является технологический процесс Marathon (Clontech Laboratories Inc.), значительно упростили поиск длинномерных кДНК. В методе Marathon, кДНК получают из мРНК, выделенной из выбранной ткани, и адапторную последовательность лигируют к каждому концу. Затем проводят амплификацию нуклеиновой кислоты (ПЦР) для амплифицирования пропущенного 5'-конца данной ДНК, с использованием комбинации ген-специфичных и адаптор-специфичных олигонуклеотидных праймеров. Затем ПЦР-реакцию повторяют с использованием гнездовых праймеров, то есть праймеров, сконструированных для отжига внутри амплифицированного продукта (обычно, адаптор-специфичный праймер, который отжигается после 3' в адапторной последовательности, и ген-специфичный праймер, который отжигается после 5' в выбранной последовательности гена). Затем анализ продуктов этой реакции можно провести с помощью секвенирования ДНК, и полноразмерная ДНК может быть сконструирована путем присоединения этого продукта непосредственно к существующей ДНК для образования полной последовательности, или проведения отдельной ПЦР протяженных участков ДНК с использованием информации о новой последовательности для конструкции 5'праймера. Полинуклеотиды и полипептиды по изобретению могут быть использованы, например, в качестве реактивов для исследований и материалов для поиска способов лечения и диагностики заболеваний, в частности заболеваний людей, как рассмотрено далее в этой заявке в отношении полинуклеотидных анализов. Полинуклеотиды по изобретению, которые представляют собой олигонуклеотиды, происходящие из последовательности SEQ ID NO: 11, могут быть использованы в описанных здесь способах, но предпочтительно для ПЦР, для определения, транскрибируются ли идентифицированные здесь полинуклеотиды полностью или частично в бактерии в инфицированной ткани или нет. Понятно, что такие последовательности также будут применимы в диагностике стадий инфекционного процесса и получении типа инфекционного патогена. Изобретение также относится к полинуклеотидам, которые кодируют полипептид, который представляет собой зрелый белок плюс дополнительные амино- или карбоксиконцевые аминокислоты или аминокислоты внутри зрелого полипептида (когда зрелая форма имеет более одной полипептидной цепи,например). Такие последовательности могут играть роль в процессинге белка из предшественника в зрелую форму, могут обеспечивать транспорт белка, могут удлинять или укорачивать период полужизни белка или могут облегчать обработку белка для анализа или получения, помимо всего прочего. Как правило, это случай in vivo, дополнительные аминокислоты могут быть процессированы вдали от зрелого белка клеточными ферментами. Для каждого и всех полинуклеотидов по изобретению здесь представлен полинуклеотид, комплементарный ему. Предпочтительно, чтобы эти комплементарные полинуклеотиды были полностью комплементарными каждому полинуклеотиду, которому они комплементарны. Белок-предшественник, имеющий зрелую форму полипептида, слитого с одной или несколькими пропоследовательностями, может представлять собой неактивную форму полипептида. Когда пропоследовательности удалены, такие неактивные предшественники, как правило, активируются. Некоторые или все пропоследовательности могут быть удалены до активации. В основном, такие предшественники называются пробелками. Помимо стандартных A, G, С, T/U обозначений нуклеотидов также может использоваться терминN при описании некоторых полинуклеотидов по изобретению. N означает, что любой из четырех ДНК или РНК нуклеотидов может присутствовать в этом обозначенном положении в ДНК или РНК последовательности, за исключением того, что предпочтительно, чтобы N не представлял собой нуклеиновую кислоту, которая в комбинации со смежными положениями нуклеотидов при считывании в правильной рамке считывания не приводила бы к появлению кодона преждевременной терминации в такой рамке считывания. В целом, полинуклеотид по изобретению может кодировать зрелый белок, зрелый белок плюс лидерную последовательность (который можно назвать пребелком), предшественника зрелого белка,- 11015561 имеющего одну или несколько пропоследовательностей, которые не являются лидерными последовательностями пребелка, или препробелок, который является предшественником пробелка, имеющего лидерную последовательность и одну или несколько пропоследовательностей, которые, как правило, удаляются во время стадий процессинга, которые дают активные и зрелые формы полипептида. В соответствии с одним аспектом изобретение относится к применению полинуклеотида по изобретению для терапевтических или профилактических целей, в частности генетической иммунизации. Применение полинуклеотида по изобретению в генетической иммунизации будет предпочтительно использоваться в подходящем способе доставке, таком как прямое внесение плазмидной ДНК в мышцы(Wolff et al., Hum Mol Genet (1992) 1: 363, Manthorpe et al., Hum. Gene Ther. (1983) 4: 419), доставка ДНК в комплексе со специфическими белками-переносчиками (Wu et al., J Biol Chem. (1989) 264: 16985), совместная преципитация ДНК с фосфатом кальция (BenvenistyReshef, PNAS USA, (1986) 83: 9551), инкапсуляция ДНК в различные формы липосом (Kaneda et al., Science (1989) 243: 375), бомбардировка частиц (Tang et al., Nature (1992) 356:152, Eisenbraun et al., DNA Cell Biol (1993) 12: 791) и in vivo инфицирование с использованием клонированных ретровирусных векторов (Seeger et al., PNAS USA (1984) 81: 5849). Векторы, клетки-хозяева, системы экспрессии. Изобретение также относится к векторам, которые содержат полинуклеотид или полинуклеотиды по изобретению, клеткам-хозяевам, которые созданы методами генной инженерии с векторами по изобретению, и получению полипептидов по изобретению с помощью рекомбинантных технологий. Бесклеточные системы трансляции также могут быть использованы для получения таких белков с использованием РНК, полученных из конструкций ДНК в соответствии с изобретением. Рекомбинантные полипептиды по настоящему изобретению могут быть получены способами, хорошо известными специалистам в данной области, из генетически сконструированных клеток-хозяев,содержащих экспрессионные системы. В соответствии с этим в дополнительном аспекте настоящее изобретение относится к экспрессионным системам, которые содержат полинуклеотид или полинуклеотиды по настоящему изобретению, к клеткам-хозяевам, которые генетически сконструированы с такими экспрессионными системами, и к получению полипептидов по изобретению с помощью рекомбинантных технологий. Для рекомбинантного получения полипептидов по изобретению клетки-хозяева могут быть генетически сконструированы для включения экспрессионных систем или их частей или полинуклеотидов по изобретению. Включение полинуклеотида в клетку-хозяин может осуществляться способами, описанными во многих типовых лабораторных руководствах, таких как Davis, et al., BASIC METHODS IN MOLECULAR BIOLOGY, (1986) и Sambrook, et al., MOLECULAR CLONING: A LABORATORY MANUAL,2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989), такими как трансфекция с фосфатом кальция, DEAE-декстран-опосредованная трансфекция, трансвекция, микроинъекция, катионная липид-опосредованная трансфекция, электропорация, конъюгация, трансдукция, введение при соскабливании, введение баллистическим методом и инфицирование. Характерные примеры соответствующих хозяев включают бактериальные клетки, такие как клетки стрептококков, стафилококков, энтерококков, Е. coli, стрептомицетов, цианобактерий, Bacillus subtilis,Neisseria meningitidis, Haemophilus influenzae и Moraxella catarrhalis; клетки грибов, например клетки дрожжей, Kluveromyces, Saccharomyces, Plchia, бизидомицетов, Candida albicans и Aspergillus; клетки насекомых, таких как Drosophila S2 и Spodoptera Sf9; клетки животных, такие как СНО, COS, HeLa,C127, 3 Т 3, BHK, 293, CV-1 и клетки меланомы Bowes; и клетки растений, такие как клетки голосеменных или покрытосеменных. Огромное разнообразие экспрессионных систем может быть использовано для получения полипептидов по изобретению. Такие векторы включают, среди прочего, векторы хромосомного, эписомального или вирусного происхождения, например векторы, полученные из бактериальных плазмид, из бактериофага, из транспозонов, из дрожжевых эписом, из вставочных элементов, из хромосомных элементов дрожжей, из вирусов, таких как бакуловирусы, папиломавирусы, такие как SV40, вирусы коровьей оспы,аденовирусы, вирусы оспы птиц, вирусы псевдобешенства, пикорнавирусы, ретровирусы и альфавирусы,и векторы, полученные из их комбинаций, например те, которые получены из генетических элементов плазмиды и бактериофага, например космиды и фагемиды. Конструкции экспрессионных систем могут содержать контрольные области, которые регулируют, а также вызывают экспрессию. В основном, любая система или вектор, подходящий для содержания, репродукции или экспрессии полинуклеотидов и/или для экспрессии полипептида в хозяине могут быть использованы для экспрессии в этом смысле. Соответствующая последовательность ДНК может быть вставлена в экспрессионную систему любым из различных хорошо известных и обычно используемых способов, например такими, которые описаны уSambrook et al., MOLECULAR CLONING, A LABORATORY MANUAL (выше). В рекомбинантных системах экспрессии эукариот, для секреции транслируемого белка в просвет эндоплазматического ретикулума, в периплазматическое пространство или во внеклеточное окружение,соответствующие секреторные сигналы могут быть включены в экспрессируемый полипептид. Эти сигналы могут быть эндогенными в отношении полипептида или они могут быть гетерологичными сигна- 12015561 лами. Полипептиды по настоящему изобретению могут быть восстановлены и очищены из рекомбинантных клеточных культур хорошо известными способами, в том числе преципитацией сульфатом аммония или этанолом, кислой экстракцией, анион- или катион-обменной хроматографией, фосфоцеллюлозной хроматографией, хроматографией гидрофобных взаимодействий, аффинной хроматографией, гидроксилапатитной хроматографией и лектиновой хроматографией. Наиболее предпочтительно для очистки используют аффинную хроматографию иона металла (IMAC). Хорошо известные способы переукладки белка могут быть использованы для регенерации активной конформации, когда полипептид денатурируют при внутриклеточном синтезе, выделении и/или очистке. Экспрессионная система также может представлять собой рекомбинантный живой организм, такой как вирус или бактерия. Представляющий интерес ген может быть вставлен в геном живого рекомбинантного вируса или бактерии. Инокуляция и in vivo инфицирование этим живым вектором приведет к invivo экспрессии антигена и индукции иммунных реакций. Вирусы и бактерии, используемые для этой цели, представляют собой, например, поксвирусы (например, коровьей оспы, оспы птиц, оспы канареек),альфавирусы (вирус Синдбис, вирус Semliki Forest, вирус венесуэльского энцефалита лошадей), аденовирусы, адено-ассоциированные вирусы, пикорнавирусы (полиовирус, риновирус), вирусы герпеса (вирус ветряной оспы и т.п.), Листерия, Сальмонелла, Шигелла, BCG, стрептококки. Эти вирусы и бактерии могут быть вирулентными или аттенуированы различными путями для получения живых вакцин. Такие живые вакцины также составляют часть изобретения. Диагностические, прогностические анализы, серотипирование и исследование мутаций. Это изобретение также относится к применению полинуклеотидов белка Е и полипептидов по изобретению для использования в качестве диагностических реактивов. Выявление полинуклеотидов и/или полипептидов белка Е у эукариот, в частности млекопитающих и особенно у людей, обеспечит диагностический способ для диагностики заболевания, стадии заболевания или реакции возбудителя инфекции на лекарственные средства. Эукариоты, в частности млекопитающие, и особенно люди, в частности инфицированные организмом или у которых подозревают инфекцию, содержащим гены белка Е или белки,можно выявить на уровне нуклеиновых кислот или аминокислот целым рядом известных методик, а также способами, описанными здесь. Полипептиды и полинуклеотиды для прогнозирования, диагностики или другого анализа могут быть получены из предположительно инфицированных и/или инфицированных материалов организма индивидуума. Полинуклеотиды из любых этих источников, в особенности ДНК или РНК, могут быть использованы для детекции непосредственно или могут быть ферментативно амплифицированы с помощью ПЦР или любых других способов амплификации перед анализом. РНК, в частности мРНК, кДНК и геномная ДНК, также могут быть использованы таким же образом. Используя амплификацию, характеристика видов и штаммов возбудителя инфекции или резидентного организма, находящегося у индивидуума, может быть осуществлена с помощью анализа генотипа выбранного полинуклеотида организма. Делеции и вставки можно обнаружить путем изменения размера амплифицированного продукта по сравнению с генотипом эталонной последовательности, выбранной из родственного организма, предпочтительно различных видов того же рода или различных штаммов одних и тех же видов. Точковые мутации могут быть идентифицированы путем гибридизации амплифицированной ДНК с меченными полинуклеотидными последовательностями белка Е. Точно спаренные или спаренные в значительной степени последовательности можно отличить от неполностью или значительно в большей степени неправильно спаренных дуплексов с помощью расщепления ДНазой или РНазой, для ДНК или РНК соответственно,или путем выявления различий в температурах плавления или кинетики ренатурации. Различия полинуклеотидных последовательностей также можно выявить с помощью изменений электрофоретической подвижности полинуклеотидных фрагментов в гелях по сравнению с эталонной последовательностью. Это можно проводить с денатурирующими агентами или без них. Различия полинуклеотидов также можно выявлять непосредственным сиквенированием ДНК или РНК. См., например, Myers et al., Science, 230: 1242 (1985). Изменения последовательности в определенных локализациях также могут быть обнаружены с помощью методов защиты от нуклеазы, например методом защиты от РНазы, V1 и S1 или способом химического расщепления. См., например, Cotton et al., Proc. Natl. Acad. Sci., USA, 85: 4397-4401 (1985). В другом варианте осуществления может быть сконструирована матрица олигонуклеотидных зондов, содержащих нуклеотидные последовательности белка Е или их фрагменты, для проведения эффективного скрининга, например генетических мутаций, серотипа, таксономической классификации или идентификации. Способы матричных технологий хорошо известны и имеют повсеместное применение и могут быть использованы для решения целого ряда вопросов в молекулярной генетике, включая генную экспрессию, сцепленное наследование и генетическую вариабельность (см., например, Chee et al.,Science, 274: 610 (1996. Таким образом, в другом аспекте настоящее изобретение относится к диагностическому набору, который содержит:(a) полинуклеотид по настоящему изобретению, предпочтительно любую из нуклеотидных последовательностей SEQ ID NO: 11 или их фрагмент;(c) полипептид по настоящему изобретению, предпочтительно любой из полипептидов SEQ ID NO: 1-10 или его фрагмент; или(d) антитело к пептиду по настоящему изобретению, предпочтительно к любому из полипептидовSEQ ID NO: 1-10. Будет понятно, что в любом таком наборе (а), (b), (с) или (d) может содержать основной компонент. Такой набор будет применяться в диагностике заболевания или подозрения на заболевание, среди прочего. Это изобретение также относится к применению полинуклеотидов по настоящему изобретению в качестве диагностических реактивов. Выявление мутантной формы полинуклеотида по изобретению,предпочтительно любой последовательности SEQ ID NO: 11, связанной с заболеванием или патогенностью, будет обеспечивать диагностический инструмент, который может дополнить или установить диагноз заболевания, прогноз течения заболевания, определение стадии заболевания или подверженности заболеванию, которое является результатом недостаточной экспрессии, гиперэкспресии или измененной экспрессии этого полинуклеотида. Организмы, в частности возбудители инфекции, несущие мутации в таком полинуклеотиде, могут быть обнаружены на полинуклеотидном уровне с помощью целого ряда методик, например, описанных в любом месте этой заявки. Клетки организма, несущего мутации или полиморфизмы (аллельные варианты) в полинуклеотиде и/или полипептиде по изобретению, также можно выявить на полинуклеотидном или полипептидном уровне с помощью целого ряда методик, например, для возможности осуществления серотипирования. Например, может быть использована ОТ-ПЦР для выявления мутаций в РНК. Особенно предпочтительно использовать ОТ-ПЦР совместно с автоматизированными системами детекции, например, такими какGeneScan. РНК, кДНК или геномная ДНК также могут быть использованы для той же цели ПЦР. В качестве примера ПЦР-праймеры, комплементарные полинуклеотиду, кодирующему полипептиды белка Е,могут быть использованы для идентификации и анализа мутаций. Изобретение дополнительно относится к праймерам с 1, 2, 3 или 4 нуклеотидами, удаленными с 5'и/или 3'-конца. Эти праймеры могут быть использованы, среди прочего, для амплификации ДНК белка Е и/или РНК, выделенной из образца, полученного от индивидуума, такого как биологический материал. Праймеры могут быть использованы для амплификации полинуклеотида, выделенного от инфицированного индивидуума, таким образом, чтобы этот полинуклеотид затем можно было подвергнуть различным методикам для выяснения полинуклеотидной последовательности. Следовательно, мутации в полинуклеотидной последовательности могут быть детектированы и использованы для диагностики и/или прогноза инфекции или ее стадии, или течения или для серотипирования и/или классификации инфекционного агента. Изобретение дополнительно относится к способу диагностики заболевания, предпочтительно бактериальных инфекций, более предпочтительно инфекций, вызываемых атипичной Н. influenzae, включающему выявление из образца, полученного от индивидуума, такого как биоматериал, повышенного уровня экспрессии полинуклеотида, имеющего последовательность любую из последовательностей SEQID NO: 11. Повышенная или сниженная экспрессия полинуклеотида белка Е может быть измерена с помощью любого из хорошо известных в этой области способов для количественной оценки полинуклеотидов, например, таких как амплификация, ПЦР, ОТ-ПЦР, защита от РНазы, Нозерн-блоттинг, спектрометрия и других способов гибридизации. Кроме того, диагностическое исследование в соответствии с изобретением для выявления гиперэкспрессии полипептидов белка Е по сравнению с образцами нормальных контрольных тканей может быть использовано, например, для выявления наличия инфекции. Методики исследования, которые могут быть использованы для определения уровней полипептидов белка Е, в образце, полученном от хозяина, таком как биоматериал, хорошо известны специалистам в этой области. Такие способы исследования включают радиоиммуноанализы, анализы конкурентного связывания, Вестерн-блот анализ, сэндвичанализы с использованием антител, детекция антитела и ELISA. Полинуклеотиды по изобретению могут быть использованы в качестве компонентов полинуклеотидных матриц, предпочтительно матриц высокой плотности, или гридов. Эти матрицы высокой плотности главным образом используют с диагностическими и прогностическими целями. Например, набор пятен, каждое, содержащее различный ген и дополнительно содержащее полинуклеотид или полинуклеотиды по изобретению, может быть использован для зондирования, например, с использованием гибридизации или амплификации нуклеиновой кислоты, с использованием зондов, полученных из биологического образца или происходящих из него, для определения наличия у индивидуума конкретной полинуклеотидной последовательности или родственной последовательности. Такое наличие может указывать на присутствие патогена, в частности атипичной Н. influenzae, и может быть использовано в диагностике и/или прогнозировании заболевания или течения заболевания. Предпочтительным является грид,содержащий ряд вариантов любой полинуклеотидной последовательности SEQ ID NO: 11. Также предпочтительным является ряд вариантов полинуклеотидной последовательности, кодирующей любую полипептидную последовательность SEQ ID NO: 1-10.- 14015561 Антитела. Полипептиды и полинуклеотиды по изобретению, или их варианты, или клетки, экспрессирующие их, могут быть использованы в качестве иммуногенов для получения антител, иммунологически специфичных в отношении таких полипептидов или полинуклеотидов соответственно. Альтернативно, мимотопы, в частности пептидные мимотопы, эпитопов в пределах полипептидной последовательности также могут быть использованы в качестве иммуногенов для получения антител, иммунологически специфичных в отношении полипептида по изобретению. Термин иммунологически специфичные означает, что эти антитела имеют, по существу, более высокую аффинность в отношении полипептидов по изобретению, чем их аффинность в отношении других родственных полипептидов, известных из уровня техники. В некоторых предпочтительных вариантах осуществления изобретение относится к антителам против полипептидов или полинуклеотидов белка Е. Антитела, вырабатываемые против полипептидов или полинуклеотидов по изобретению, могут быть получены путем введения полипептидов и/или полинуклеотидов по изобретению или фрагментов,несущих эпитоп, одного из них или обоих, аналогов одного или обоих или клеток, экспрессирующих любой или оба вместе, животному, предпочтительно не человеку, используя обычные протоколы. Для получения моноклональных антител может быть использована любая методика, известная в уровне техники, которая обеспечивает получение антител, продуцируемых культурами стабильных клеточных линий. Примеры включают различные методики, такие как у Kohler, G. и Milstein, С, Nature 256: 495-497AND CANCER THERAPY, Alan R. Liss, Inc. (1985). Методики получения одноцепочечных антител (патент США 4946778) могут быть приспособлены для получения одноцепочечных антител к полипептидам или полинуклеотидам по изобретению. Также трансгенные мыши или другие организмы или животные, такие как другие млекопитающие, могут быть использованы для экспрессии гуманизированных антител, иммунологически специфичных в отношении полипетидов или полинуклеотидов по изобретению. Альтернативно, технология фагового дисплея может быть использована для отбора генов антител со связывающими активностями в отношении полипептида по изобретению либо из репертуара амплифицированных с помощью ПЦР v-генов лимфоцитов людей, подвергнутых скринингу на наличие антибелка Е, либо из природных библиотек (McCafferty, et al., (1990), Nature 348, 552-554; Marks, et al., (1992)Biotechnology 10, 779-783). Аффинность этих антител также может быть улучшена, например, цепьевым шаффлингом (Clackson et al., (1991) Nature 352: 628). Описанные выше антитела могут быть использованы для выделения или для идентификации клонов, экспрессирующих полипептиды или полинуклеотиды по изобретению, для очистки полипептидов или полинуклеотидов, например, с помощью аффинной хроматографии. Таким образом, среди прочего, антитела против полипептидов белка Е или полинуклеотидов белка Е могут быть использованы для лечения инфекций, в частности бактериальных инфекций. Полипептидные варианты, включающие антигенно, эпитопно или иммунологически эквивалентные варианты, составляют особый аспект изобретения. Предпочтительно антитело или его вариант модифицируют для уменьшения его иммуногенности у индивидуума. Например, если индивидуумом является человек, наиболее предпочтительно антитело может быть гуманизировано, где область или области, определяющие комплементарность, гибридомного антитела были трансплантированы в моноклональное антитело человека, например, как описано у Joneset al. (1986), Nature 321, 522-525 или Tempest et al., (1991) Biotechnology 9, 266-273. Антагонисты и агонисты - исследования и молекулы. Полипептиды и полинуклеотиды по изобретению также могут быть использованы для оценки связывания мелкомолекулярных субстратов и лигандов, например, в клетках, бесклеточных препаратах,химических библиотеках и смесях природных продуктов. Эти субстраты и лиганды могут быть природными субстратами и лигандами или могут быть структурными или функциональными миметиками. См.,например, Coligan et al., Current Protocols in Immunology 1(2): Chapter 5 (1991). Способами скрининга можно просто измерять связывание кандидатного соединения с полипептидом или полинуклеотидом или с клетками или мембранами, несущими полипептид, или полинуклеотид,или слитый белок полипептида, посредством метки, непосредственно прямо или опосредованно связанной с кандидатным соединением. Альтернативно, способ скрининга может включать конкуренцию с меченым конкурентным веществом. Кроме того, этими способами скрининга можно протестировать, приводит ли кандидатное соединение в результате к сигналу, генерированному активацией или ингибированием полипептида или полинуклеотида, используя системы детекции, соответствующие клеткам, содержащим этот полипептид или полинуклеотид. Ингибиторы активации в основном исследуют в присутствии известного агониста и наблюдают за влиянием присутствующего кандидатного соединения на активацию под действием агониста. Конститутивно активный полипептид и/или конститутивно экспрессируемые полипептиды и полинуклеотиды могут быть использованы в способах скрининга на инверсию- 15015561 агонистов или ингибиторов, в отсутствие агониста или ингибитора, путем тестирования, приведет ли кандидатное соединение к ингибированию или активации полипептида или полинуклеотида в зависимости от конкретного случая. Кроме того, способы скрининга могут просто включать стадии смешивания кандидатного соединения с раствором, содержащим полипептид или полинуклеотид по настоящему изобретению, с получением смеси, измерения активности полипептидов и/или полинуклеотидов белка Е в смеси, и сравнения активности полипептидов и/или полинуклеотидов белка Е в смеси со стандартом. Слитые белки, такие как белки, полученные из Fc-части и полипептидов белка Е, описанные здесь ранее,также могут быть использованы для скрининговых исследований с высокой пропускной способностью для идентификации антагонистов полипептидов по настоящему изобретению, а также филогенетически и/или функционально родственных полипептидов (см. D. Bennett et al., J. Mol. Recognition, 8:52-58 (1995) и K. Johanson et al., J. Biol. Chem., 270(16):9459-9471 (1995. Полинуклеотиды, полипептиды и антитела, которые связываются и/или взаимодействуют с полипептидом по настоящему изобретению, также могут быть использованы для создания способов скрининга для определения действия дополнительных компонентов на продукцию мРНК и/или полипептида в клетках. Например, ELISA можно проводить для измерения секретируемых или клеточносвязанных уровней полипептида, используя моноклональные и поликлональные антитела, с помощью стандартных способов, известных в уровне техники. Этот анализ может быть использован для выявления агентов, которые могут ингибировать или усиливать продукцию полипептида (также называемых антагонистом или агонистом соответственно) из обработанных соответствующим образом клеток или тканей. Изобретение также относится к способу скрининга соединений для идентификации тех, которые усиливают (агонист) или блокируют (антагонист) действие полипептидов или полинуклеотидов белка Е,особенно тех соединений, которые являются бактериостатическими и/или бактерицидными. Способ скрининга может включать методики с высокой пропускной способностью. Например, для скрининга агонистов или антагонистов, синтетическую реакционную смесь, клеточный компартмент, такой как мембрана, клеточная оболочка, или клеточная стенка, или препарат любого из них, содержащих полипептиды белка Е и меченый субстрат или лиганд такого полипептида, инкубируют в отсутствии или присутствии кандидатной молекулы, которая может быть агонистом или антагонистом белка Е. Способность кандидатной молекулы вызывать агонизм или антагонизм в отношении полипептида белка Е отражается в снижении связывания меченого лиганда или снижении образования продукта из этого субстрата. Молекулы, которые связываются необоснованно, т.е. не оказывая воздействия на полипептид белка Е, наиболее вероятно являются хорошими антагонистами. Молекулы, которые связываются хорошо, и, соответственно, увеличивают скорость образования продукта из субстрата, усиливают передачу сигнала, или повышают активность химического канала, являются агонистами. Определение скорости или уровня, в зависимости от каждого конкретного случая, образования продукта из субстрата, передачи сигнала или активности химического канала можно улучшить использованием репортерной системы. Репортерные системы, которые могут быть использованы в этом отношении, включают, но не только, колориметрические, превращение меченого субстрата в продукт, репортерный ген, который отвечает за изменения активности полинуклеотидов или полипептидов белка Е, и анализы связывания, известны в уровне техники. Другим примером исследования в отношении агонистов белка Е является конкурентный анализ, который объединяет белок Е и потенцильнаый агонист с молекулами, связывающимися с белком Е, рекомбинантными молекулами, связывающимися с белком Е, природными субстратами или лигандами или миметиками субстрата или лиганда, в соответствующих условиях для анализа конкурентного ингибирования. Белок Е можно пометить, например, радиоактивным или колориметрическим соединением таким образом, чтобы можно было точно определить количество молекул белка Е, связавшихся со связывающей молекулой или преобразовавшихся в продукт, для оценки эффективности потенциального антагониста. Потенциальные антагонисты включают, среди прочего, низкомолекулярные органические молекулы, пептиды, полипептиды и антитела, которые связываются с полинуклеотидом и/или полипептидом по изобретению и, тем самым, ингибируют или подавляют их активность или экспрессию. Потенциальные антагонисты также могут представлять собой низкомолекулярные органические молекулы, пептид, полипептид, например близкородственный белок или антитело, который связывается с теми же сайтами на связывающей молекуле, такой как связывающая молекула, не индуцируя активность, индуцируемую белком Е, тем самым предотвращая действие или экспрессию полипептидов белка Е и/или полинуклеотидов, исключая полипептиды и/или полинуклеотиды белка Е из связывания. Потенциальные антагонисты включают малую молекулу, которая связывается и занимает сайт связывания полипептида, тем самым предотвращая связывание с клеточными молекулами связывания так,чтобы не допустить нормальную биологическую активность. Примеры низкомолекулярных молекул включают, но не только, низкомолекулярные органические молекулы, пептиды или пептидоподобные молекулы. Другие потенциальные антагонисты включают антисмысловые молекулы (описание этих молекул см. у Okano, J. Neurochem. 56: 560 (1991); OLIGODEOXYNUCLEOTIDES AS ANTISENSE INHIBITORS OF GENE EXPRESSION, CRC Press, Boca Raton, FL (1988. Предпочтительные антагонисты- 16015561 включают соединения, родственные белку Е, или варианты белка Е. В дополнительном аспекте настоящее изобретение относится к генно-инженерным растворимым слитым белкам, содержащим полипептид по настоящему изобретению или его фрагмент и различные части константных областей тяжелых или легких цепей иммуноглобулинов различных подклассов (IgG,IgM, IgA, IgE). В качестве иммуноглобулина предпочтительной является константная область тяжелой цепи IgG человека, в частности IgG1, где слияние имеет место в шарнирной области. В отдельном варианте осуществления Fc-часть может быть удалена простым включением расщепляемой последовательности, которая может расщепляться под действием фактора свертывания крови Ха. Кроме того, это изобретение относится к способам получения этих слитых белков с помощью генной инженерии, и к их применению для скрининга лекарственных средств, диагностики и лечения. Дополнительный аспект изобретения также относится к полинуклеотидам, кодирующим такие слитые белки. Примеры технологии слитых белков можно найти в международных патентных заявках WO 94/29458 и WO 94/22914. Каждая из представленных здесь полинуклеотидных последовательностей может быть использована для обнаружения и разработки антибактериальных соединений. Кодируемый белок после экспрессии может быть использован в качестве мишени для скрининга антибактериальных лекарственных средств. Дополнительно полинуклеотидные последовательности, кодирующие аминоконцевые области кодируемого белка или последовательность Шайна-Дальгарно или другие последовательности, облегчающие трансляцию соответствующей мРНК, могут быть использованы для конструирования антисмысловых последовательностей для контроля экспрессии интересующей кодирующей последовательности. Изобретение также относится к применению полипептида, полинуклеотида, агониста или антагониста по изобретению для оказания противодействия исходному физическому взаимодействию между патогеном или патогенами и эукариотическим хозяином, предпочтительно млекопитающим, отвечающим на последствия инфицирования. В частности, молекулы по изобретению могут быть использованы для предотвращения адгезии бактерий, в частности грамположительных и/или грамотрицательных бактерий,к белкам внеклеточного матрикса эукариот, предпочтительно млекопитающих, на имплантированных устройствах или к белкам внеклеточного матрикса в ранах; для блокирования бактериальной адгезии между белками внеклеточного матрикса эукариот, предпочтительно млекопитающих, и белка Е бактерий, которые опосредуют повреждение тканей, и/или для блокирования нормального развития патогенеза при инфекциях, вызванных иными причинами, помимо имплантации постоянных устройств или другой хирургической техники. В соответствии с еще одним аспектом изобретение относится к агонистам и антагонистам белка Е,предпочтительно бактеристатическим или бактерицидным агонистам и антагонистам. Антагонисты и агонисты по изобретению могут быть использованы, например, для профилактики,ингибирования и/или лечения заболеваний. В дополнительном аспекте настоящее изобретение относится к мимотопам полипептида по изобретению. Мимотоп представляет собой пептидную последовательность, в достаточной степени сходую с нативным пептидом (по последовательности и структурно), которая может распознаваться антителами,распознающими нативный пептид; или способный индуцировать образование антител, которые распознают нативный пептид при соединении с подходящим носителем. Пептидные мимотопы могут создаваться для конкретной цели путем добавления, делеции или замены выбранных аминокислот. Следовательно, пептиды могут быть модифицированы с целью облегчения конъюгации с белком-переносчиком. Например, может быть желательным для некоторых химических способов конъюгации включать концевой цистеин. Дополнительно может быть желательным для пептидов, конъюгированных с белком-переносчиком, включать гидрофобный конец в отдалении от конъюгированного конца пептида таким образом, чтобы свободный неконъюгированный конец пептида оставался связанным с поверхностью белка-переносчика. Тем самым, представляя пептид в конформации, которая наиболее близко напоминает конформацию пептида, находящегося в окружении целостной природной молекулы. Например, пептиды могут быть изменены для приобретения N-концевого цистеина и С-концевого гидрофобного амидированного хвоста. Альтернативно, добавление или замена Dстереоизомерной формы одной или нескольких аминокислот (инвертированные последовательности) можно проводить для создания благоприятного производного, например, для усиления стабильности пептида. Мимотопы также могут быть ретропоследовательностями природных пептидных последовательностей, которые имеют обратную ориентацию последовательнсти. Мимотопы также могут быть по характеру ретро-инвертированными. Ретро, инвертированные и ретро-инвертированные пептиды описаны в WO 95/24916 и WO 94/05311. Альтернативно, пептидные мимотопы могут быть идентифицированы с использованием антител,которые сами способны связываться с полипептидами по настоящему изобретению, с помощью таких методик, как технология фагового дисплея (ЕР 0552267 В 1). В этой технологии генерируется огромное число пептидных последовательностей, которые имитируют структуру нативных пептидов и, следовательно, способны связываться с антителами к нативным пептидам, но сами не обязательно могут иметь существенную гомологию последовательности с нативным полипептидом.- 17015561 Вакцины. Другой аспект изобретения относится к способу индукции иммунологического ответа у индивидуума, в частности у млекопитающего, предпочтительно у людей, включающему инфицирование индивидуума полинуклеотидом и/или полипептидом белка Е или его фрагментом или вариантом, подходящим для продукции антитела и/или Т-клеточного иммунного ответа для защиты указанного индивидуума от инфекции, в частности бактериальной инфекции и наиболее предпочтительно инфекции, вызванной атипичной Н. influenzae. Также предусматриваются способы, посредством которых такой иммунологический ответ замедляет репликацию бактерий. Еще один аспект изобретения относится к способу индукции иммунологического ответа у индивидуума, который включает введение этому индивидууму нуклеотидного вектора, последовательности или рибозима для направления экспрессии полинуклеотидов и/или полипептидов белка Е или их фрагмента или вариантов, для экспрессии полинуклеотидов и/или полипептидов белка Е или их фрагмента или варианта in vivo для индукции иммунологического ответа, в том числе, например, цитокин-продуцирующих Т-клеток или цитотоксических Т-клеток, для защиты указанного индивидуума, предпочтительно человека, от заболевания независимо от того, развилось ли уже у индивидуума это заболевание или нет. Одним примером введения гена является введение путем запуска их в желаемые клетки в виде нанесения на частицы или иным путем. Такой нуклеотидный вектор может содержать ДНК, РНК, рибозим, модифицированную нуклеиновую кислоту, гибрид ДНК/РНК,комплекс ДНК-белок или комплекс РНК-белок. Дополнительный аспект изобретения относится к иммунологической композиции, которая при введении индивидууму, предпочтительно человеку, способному иметь индуцированный иммунологический ответ, индуцирует иммунологический ответ у этого индивидуума на полинуклеотид и/или полипептид белка Е, кодируемого им, где эта композиция содержит рекомбинантный полинуклеотид белка Е и/или полипептид, кодируемый им и/или содержит ДНК и/или РНК, которая кодирует и экспрессирует антиген указанного полинуклеотида белка Е, полипептида, кодируемого им, или другого полипептида по изобретению. Иммунологический ответ может быть использован терапевтически или профилактически и может принимать форму антительного иммунитета и/или клеточного иммунитета, например, клеточного иммунитета, обусловленного CTL или CD4+ Т-клетками. Полипептиды белка Е или их фрагменты могут быть слиты с ко-белком или химической частью,которая сама может или не может продуцировать антитела, но которая способна стабилизировать первый белок и продуцировать слитый или модифицированный белок, который будет обладать антигенными и/или иммуногенными свойствами и предпочтительно протективными свойствами. Следовательно, слитый рекомбинантный белок предпочтительно дополнительно содержит антигенный ко-белок, такой как липопротеин или белок D Haemophilus influenzae (ЕР 594610), глутатион-S-трансферазу (GST) или галактозидазу, или любой другой относительно крупный ко-белок, который солюбилизирует белок и облегчает его продукцию и очистку. Кроме того, ко-белок может действовать в качестве адъюванта в смысле обеспечения генерализированой стимуляции иммунной системы организма, получающего этот белок. Ко-белок может быть присоединен либо к амино-, либо к карбоксиконцу первого белка. В композиции вакцины по изобретению полипептиды и/или полинуклеотиды белка Е, или их фрагмент, или мимотоп, или вариант могут находиться в векторе, например живых рекомбинантных векторах, описанных выше, например живых бактериальных векторах. Также подходят неживые векторы для полипептидов белка Е, например везикулы наружной мембраны бактерий или пузырьки. Пузырьки наружной мембраны образуются из наружной мембраны двухслойной мембраны грамотрицательных бактерий и были документально зафиксированы у многих грамотрицательных бактерий (Zhou, L. et al., 1998. FEMS Microbiol. Lett. 163:223-228), в том числе С.trachomatis и С. psittaci. Неполный перечень бактериальных патогенов, которые, как сообщается, образуют пузырьки, также включает Bordetella pertussis, Borrelia burgdorferi, Brucella melitensis, Brucella ovis,Esherichia coli, Haemophilus influenzae, Legionella pneumophila, Moraxella catarrhalis, Neisseria gonorrhoeae,Neisseria meningitidis, Pseudomonas aeruginosa и Yersinia enterocolitica. Преимущество пузырьков состоит в том, что белки наружной мембраны представлены в их нативной конформации и, следовательно, особенно подходят для вакцин. Пузырьки также можно усовершенствовать для использования в вакцинах путем создания бактерии, таким образом, чтобы модифицировать экспрессию одной или нескольких молекул на наружной мембране. Таким образом, например, экспрессия желаемого иммуногенного белка на наружной мембране, например полипептидов белка Е, может быть интродуцирована или активирована (например, путем изменения промотора). Вместо этого или в дополнение к этому, экспрессия молекул наружной мембраны, которые либо не релевантны (например,непротективные антигены или иммунодоминантные, но вариабельные белки), либо являются вредными(например, токсические молекулы, такие как LPS, или потенциальные индукторы аутоиммунной реакции) может быть подавлена. Эти подходы более подробно рассматриваются ниже. Некодирующие фланкирующие области генов белка Е содержат регуляторные элементы, важные для экспрессии этого гена. Эта регуляция имеет место как на уровне транскрипции, так и на уровне трансляции. Последовательность этих областей либо выше, либо ниже открытой рамки считывания этого- 18015561 гена может быть получена путем секвенирования ДНК. Эта информация о последовательности дает возможность определить потенциальные регуляторные мотивы, такие как различные промоторные элементы, терминаторные последовательности, индуцибельные элементы последовательностей, репрессоры,элементы, ответственные за фазовую вариацию, последовательность Шайна-Дальгарно, области с потенциальной вторичной структурой, вовлеченной в регуляцию, а также другие типы регуляторных мотивов или последовательностей. Эта последовательность представляет собой дополнительный аспект изобретения. Эта информация о последовательности позволяет модулировать природную экспрессию генов белка Е. Активация генной экспрессии может осуществляться путем изменения промотора, последовательности Шайна-Дальгарно, потенциальных репрессорных или операторных элементов или любых других,вовлеченных в этот процесс, элементов. Подобным образом, подавление экспрессии может достигаться аналогичными типами модификации. Альтернативно, путем изменения последовательностей вариации фаз, экспрессия гена может быть поставлена под контроль вариации фаз, или может быть не связана с этой регуляцией. В другом подходе экспрессия гена может быть поставлена под контроль одного или нескольких индуцибельных элементов,позволяющих осуществлять регулируемую экспрессию. Примеры такой регуляции включают, но не только, индукцию температурным сдвигом, добавление субстрата-индуктора наподобие выбранных углеводов или их производных, микроэлементов, витаминов, кофакторов, ионов металла и т.п. Такие модификации, как описано выше, могут быть введены несколькими различными способами. Модификацию последовательностей, вовлеченных в генную экспрессию, можно осуществлять in vivo путем случайного мутагенеза с последующей селекцией желаемого фенотипа. Другой подход состоит в выделении области, представляющей интерес, и модификации этой области посредством случайного мутагенеза или сайт-направленным мутагенезом замены, вставочным или делеционным мутагенезом. Модифицированную область затем можно снова ввести в бактериальный геном посредством гомологичной рекомбинации и можно оценить воздействие на генную экспрессию. В другом подходе знание о последовательности в представляющей интерес области может быть использовано для замены или делеции всех природных регуляторных последовательностей или части из них. В этом случае намеченную регуляторную область выделяют и модифицируют таким образом, чтобы она содержала регуляторные элементы другого гена, сочетание регуляторных элементов различных генов, синтетическую регуляторную область или любую другую регуляторную область, или для делеции выбранных частей регуляторных последовательностей дикого типа. Эти модифицированные последовательности затем могут быть повторно введены в бактерию посредством гомологичной рекомбинации в геном. Неполный перечень предпочтительных промоторов, которые могли быть использованы для активации генной экспрессии,включает промоторы porA, porB, lbpB, tbpB, p110, 1st, hpuAB из N. meningitidis или N. gonorroheae;ompCD, copB, lbpB, ompE, UspA1; UspA2; TbpB из M. Catarrhalis; p1, p2, p4, p5, p6, lpD, tbpB, D15, Hia,Hmw1, Hmw2 из Н. influenzae. В одном примере экспрессию гена можно модулировать путем замены его промотора более сильным промотором (посредством выделения последовательности гена перед сайтом инициации транскрипции, in vitro модификации этой последовательности и повторного введения в геном путем гомологичной рекомбинации). Активированную регуляцию экспрессии можно получить и у бактерий, а также и в везикулах наружной мембраны, сбрасываемых с бактерий (или вырабатываемых). В других примерах описанные подходы могут быть использованы для получения рекомбинантных бактериальных штаммов с улучшенными характеристиками для применений в вакцинах. Это могут быть,но не только, аттенуированные штаммы, штаммы с повышенной экспрессией выбранных антигенов,штаммы с нокаутом (или сниженной экспрессией) генов, препятствующих иммунной реакции, штаммы с модулированной экспрессией иммунодоминатных белков, штаммы с модулированным шеддингом везикул наружной мембраны. Таким образом, изобретение также относится к модифицированной 3'-5'-области генов белка Е, которая содержит гетерологичный регуляторный элемент, который изменяет уровень экспрессии белков белка Е, расположенных на наружной мембране. 3'-5'-Область в соответствии с этим аспектом изобретения включает последовательность, расположенную перед сайтом инициации транскрипции генов белка Е. 3'-5'-Область начинается непосредственно выше генов белка Е и продолжается обычно до положения примерно не более 1000 п.н. выше гена от стартового кодона ATG. В случае расположения гена в полицистонной последовательности (оперон) 3'-5'-область может начинаться непосредственно перед интересующим геном или перед первым геном в опероне. Предпочтительно модифицированный участок, расположенный в направлении 3'-5', в соответствии с этим аспектом изобретения содержит гетерологичный промотор в положении между 500 и 700 п.н. выше ATG. Применение описанных 3'-5'-областей для активации экспрессии генов белка Е, способ осуществления этого посредством гомологичной рекомбинации (например, как описано в WO 01/09350, включено здесь в качестве ссылки), вектор, содержащий 3'-5'-последовательность, подходящую для этой цели, и клетка-хозяин, измененная таким образом, составляют дополнительные аспекты этого изобретения.- 19015561 Таким образом, изобретение относится к полипептидам белка Е в модифицированном бактериальном пузырьке. Изобретение дополнительно относится к модифицированным клеткам-хозяевам, способным продуцировать неживые мембраносвязанные пузырьковые векторы. Изобретение дополнительно относится к нуклеотидным векторам, содержащим гены белка Е, с модифицированной 3'-5'-областью,содержащей гетерологичный регуляторный элемент. Дополнительно изобретение относится к способам получения клеток-хозяев и бактериальных пузырьков в соответствии с изобретением. Изобретение также относится к композициям, в частности к композициям вакцины, и способам,включающим полипептиды и/или полинуклеотиды по изобретению и иммуностимулирующие ДНК последовательности такие, которые описаны у Sato, Y. et al. Science 273: 352 (1996). Изобретение также относится к способам применения описанного полинуклеотида или его отдельных фрагментов, который, как было покзано, кодирует невариабельные области белков клеточной поверхности бактерий, в полинуклеотидных конструкциях, используемых в таких экспериментах по генной иммунизации на животных моделях инфекции, вызванной атипичной Н. influenzae. Такие эксперименты будут особенно полезны для идентификации белковых эпитопов, способных вызывать профилактический или терапевтический иммунный ответ. Считается, что этот подход позволит в дальнейшем получить моноклональные антитела особой важности, происходящие из нужного органа животного, с успехом сопротивляющегося или освобождающегося от инфекции, для разработки профилактических средств или терапевтического лечения бактериальной инфекции, в частности инфекции, вызванной атипичной Н. influenzae, у млекопитающих, главным образом, у людей. Изобретение также включает композицию вакцины, которая содержит иммуногенный рекомбинантный полипептид и/или полинуклеотид по изобретению вместе с подходящим носителем, таким как фармацевтически приемлемый носитель. Поскольку полипептиды и полинуклеотиды могут разрушаться в желудке, каждый из них предпочтительно вводить парентерально, в том числе, например, введением,которое является подкожным, внутримышечным, внутривенным или внутрикожным. Композиции, подходящие для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические соединения и растворы,которые сохраняют изотоничность состава с жидкостью организма, предпочтительно с кровью, индивидуума; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты или загустители. Композиции могут быть представлены в контейнерах с однократной дозой или множественными дозами, например в герметично закрытых ампулах и флаконах, и могут храниться в лиофилизированном виде, требуя только добавления стерильного жидкого носителя непосредственно перед применением. Композиция вакцины по изобретению также может включать адъювантные системы для усиления иммуногенности композиции. Желательно, чтобы адъювантная система индуцировала предпочтительноTH1-тип ответа. Иммунный ответ ориентировочно можно разделить на две различные категории, гуморальные или клеточно-опосредованные иммунные реакции (традиционно характеризуемые антительным и клеточноэффекторными механизмами защиты соответственно). Эти категории ответа были названы ответамиTH1-типа (клеточно-опосредованный ответ), и иммунными реакциями ТН 2-типа (гуморальный ответ). Выраженные иммунные реакции THl-типа могут быть охарактеризованы выработкой антигенспецифичных, ограниченных гаплотипом, цитотоксических Т-лимфоцитов и реакциями естественных клеток-киллеров. У мышей реакции THl-типа зачастую характеризуются выработкой антител IgG2a подтипа, тогда как у людей это соответствует антителам типа IgG1. Иммунные реакции ТН 2-типа характеризуются выработкой широкого спектра изотипов иммуноглобулинов, включающих у мышей IgGl, IgA,и IgM. Можно предположить, что движущей силой этих двух типов иммунных реакций, являются цитокины. Высокие уровни цитокинов TH1-типа направлены на поддержание индукции клеточноопосредованных иммунных реакций на заданный антиген, тогда как высокие уровни цитокинов ТН 2 типа направлены на поддержание индукции гуморальных иммунных реакций на этот антиген. Различие между иммунными реакциями ТН 1 и ТН 2-типа не является абсолютным. В действительности, у индивидуума будет обеспечиваться иммунная реакция, которую описывают как преимуществено ТН 1 или преимущественно ТН 2. Однако зачастую удобно рассматривать семейства цитокинов в выражениях, описанных в CD4+ Т-клеточных клонах мышей или крыс авторами Mosmann и Coffmanto different functional properties. Annual Review of Immunology, 7, p. 145-173). Традиционно, реакции TH1 типа связаны с продукцией INF- и IL-2 цитокинов Т-лимфоцитами. Другие цитокины, зачастую непосредственно связанные с индукцией иммунных реакций TH1-типа, не продуцируются Т-клетками, например IL-12. Напротив, реакции ТН 2-типа связаны с секрецией IL-4, IL-5, IL-6 и IL-13. Известно, что определенные вакцинные адъюванты особенно подходят для стимуляции цитокиновых реакций либо ТН 1, либо ТН 2-типа. Традиционно, самые лучшие показатели ТН 1:ТН 2 баланса иммунной реакции после вакцинации или инфекции включают непосредственное измерение продукции- 20015561 ТН 1 или ТН 2 цитокинов Т-лимфоцитами in vitro после повторной стимуляции антигеном, и/или измерение IgGl:IgG2a соотношения антиген-специфичных реакций антител. Таким образом, адъювантом TH1-типа является адъювант, который предпочтительно стимулирует выделенные популяции Т-клеток к выработке высоких уровней цитокинов TH1-типа при повторной стимуляции антигеном in vitro и способствует развитию как CD8+ цитотоксических Т-лимфоцитарных, так и антиген-специфичных иммуноглобулиновых реакций, связанных с изотипов TH1-типа. Адъюванты, способные предпочтительно стимулировать ТН 1-клеточный ответ, описаны в международной патентной заявкеWO 94/00153 и WO 95/17209. 3-Дез-O-ацилированный монофосфориллипид A (3D-MPL) представляет собой один из таких адъювантов. Он известен из GB 2220211 (Ribi). Химически этот адъювант представляет собой смесь 3-дез-Оацилированного монофосфорил липида А с 4, 5 или 6 ацилированными цепями и производится компанией Ribi Immunochem, Montana. Предпочтительная форма 3-дез-O-ацилированного монофосфориллипида А описана в европейском патенте 0689454 B1 (SmithKline Beecham Biologicals SA). Предпочтительно частицы 3D-MPL являются достаточно мелкими для того, чтобы их можно было стерильно профильтровать через мембрану 0,22 мкм (европейский патент 0689454). 3D-MPL будет находиться в диапазоне 10-100 мкг, предпочтительно 25-50 мкг на дозу, где антиген обычно будет присуствовать в диапазоне 2-50 мкг на дозу. Другой предпочтительный адъювант содержит QS21, Hplc-очищенную нетоксичную фракцию, полученную из коры Quillaja Saponaria Molina. Необязательно этот адъювант можно смешать с 3-дез-Oацилированным монофосфориллипидом A (3D-MPL), необязательно вместе с носителем. Способ получения QS21 описан в патенте США 5057540. Нереактогенные адъювантные композиции, содержащие QS21, были описаны ранее (WO 96/33739). Было показано, что такие композиции, содержащие QS21 и холестерин, являются адъювантами, успешно стимулирующими ТН 1 при составлении в композицию вместе с антигеном. Дополнительные адъюванты, которые являются селективными стимуляторами TH1-клеточного ответа, включают иммуномодулирующие олигонуклеотиды, например неметилированные последовательности CpG, описанные в WO 96/02555. Комбинации различных TH1-стимулирующих адъювантов, например упомянутых выше, также рассматриваются обеспечивающими адъювант, который является селективным стимулятором TH1 клеточного ответа. Например, QS21 может быть составлен в композицию вместе с 3D-MPL. Соотношение QS21:3D-MPL обычно будет порядка от 1:10 до 10:1; предпочтительно от 1:5 до 5:1 и зачастую в основном 1:1. Предпочтительным диапазоном для оптимального синергизма является диапазон от 2,5:1 до 1:1 3D-MPL:QS21. Предпочтительно носитель также присутствует в композиции вакцины по изобретению. Носитель может представлять собой эмульсию масло-в-воде или соль алюминия, например фосфат алюминия или гидроксид алюминия. Предпочтительная эмульсия масло-в-воде содержит метаболизируемое масло, такое как сквален, токоферол и Твин 80. В особенно предпочтительном аспекте антигены в композиции вакцины по изобретению объединяют с QS21 и 3D-MPL в такую эмульсию. Дополнительно эмульсия масло-в-воде может содержать спан 85, и/или лецитин, и/или трикаприлин. Обычно для введения людям QS21 и 3D-MPL будет присутствовать в вакцине в диапазоне 1-200 мкг, например 10-100 мкг, предпочтительно 10-50 мкг на дозу. Обычно масло в воде будет содержать от 2 до 10% сквалена, от 2 до 10% -токоферола и от 0,3 до 3% Твина 80. Предпочтительно соотношение сквален: -токоферол равно или менее 1, поскольку такое соотношение обеспечивает более стабильную эмульсию. Спан 85 также может присутствовать на уровне 1%. В некоторых случаях может быть полезным, чтобы вакцины по настоящему изобретению дополнительно содержали стабилизатор. Нетоксичные эмульсии масло-в-воде предпочтительно содержат нетоксичное масло, например сквалан или сквален, эмульгатор, например Твин 80, в водном носителе. Водным носителем, например,может быть фосфатно-буферный солевой раствор. Особенно сильная адъювантная композиция, содержащая QS21, 3D-MPL и токоферол в эмульсии масло-в-воде, описана в WO 95/17210. Хотя изобретение было описано со ссылкой на определенные полипептиды и полинуклеотиды белка Е, должно быть понятно, что оно также распространяется на фрагменты природных полипептидов и полинуклеотидов, и аналогичные полипептиды и полинуклеотиды с добавлениями, делециями или заменами, которые, по существу, не влияют на иммуногенные свойства рекомбинантных полипептидов или полинуклеотидов. Предпочтительные фрагменты/пептиды описаны в разделе Подходящие эпитопы. Настоящее изобретение также относится к поливалентной композиции вакцины, содержащей композицию вакцины по изобретению в сочетании с другими антигенами, в частности антигенами, пригодными для лечения среднего отита. Такая поливалентная композиция вакцины может включать TH1 индуцирующий адъювант, как описано выше в этой заявке. В предпочтительном варианте осуществления полипептиды, фрагменты и иммуногены по изобре- 21015561 тению составляют в композицию с одним или несколькими из следующих групп антигенами: а) одним или несколькими капсульными полисахаридами пневмококка (либо в чистом виде, либо конъюгированным с белком-переносчиком); b) одним или несколькими антигенами, которые могут защищать хозяина от инфекции М. catarrhalis; с) одним или несколькими белковыми антигенами, которые могут защищать хозяина от инфекции Streptococcus pneumoniae; d) одним или несколькими дополнительными белковыми антигенами атипичной Haemophilus influenzae; e) одним или несколькими антигенами, которые могут защищать хозяина от RSV; и f) одним или несколькими антигенами, которые могут защищать хозяина от вируса гриппа. Предпочтительными являются комбинации с группами а) и b); b) и с); b) , d) и а) и/или с);b), d), e), f) и а) и/или с). Такие вакцины могут быть преимущественно использованы в качестве универсальных вакцин против среднего отита. Антигены полисахаридной капсулы пневмококка предпочтительно выбирают из серотипов 1, 2, 3,4, 5, 6 В, 7F, 8, 9N, 9V, 10 А, НА, 12F, 14, 15 В, 17F, 18 С, 19 А, 19F, 20, 22F, 23F и 33F (наиболее предпочтительно из серотипов 1, 3, 4, 5, 6 В, 7F, 9V, 14, 18 С, 19F и 23F). Предпочтительными белковыми антигенами пневмококка являются те антигены, которые представлены на наружной поверхности пневмококка (способные распознаваться иммунной системой хозяина в течение по меньшей мере части жизненного цикла пневмококка), или белки, которые секретируются или высвобождаются пневмококком. Наиболее предпочтительно белок представляет собой токсин, адгезии,2-компонентный трансдуктор сигнала или липопротеин Streptococcus pneumoniae или их фрагменты. Особенно предпочтительные белки включают, но не только, пневмолизин (предпочтительно детоксицированный химической обработкой или мутацией) [Mitchell et al. Nucleic Acids Res. 1990 Jul 11; 18(13): 4010 Comparison of pneumolysin genes and proteins from Streptococcus pneumoniae types 1 and 2 , Mitchellcoli: rapid purification and biological properties , WO 96/05859 (A. Cyanamid), WO 90/06951 (Paton et al.),WO 99/03884 (NAVA)]; PspA и его трансмембранные делеционные варианты (WO 92/14488; WO 99/53940; US 5804193 - Briles et al.); PspC и его трансмембранные делеционные варианты (WO 99/53940;WO 97/09994 Briles et al.); PsaA и его трансмембранные делеционные варианты (BerryPaton, Infectfor virulence of Streptococcus pneumoniae); хлорин-связывающие белки пневмококка и их трансмембранные делеционные варианты; CbpA и его тансмембранные делеционные варианты (WO 97/41151; WO 99/51266); глицеральдегид-3-фосфатдегидрогеназа (Infect. Immun. 1996 64:3544); HSP70 (WO 96/40928); РсрА (Sanchez-Beato et al. FEMS Microbiol. Lett. 1998, 164:207-14); М-подобный белок, патентная заявкаSB EP 0837130; и адгезии 18627 (патентная заявка SmithKline Beecham EP 0834568). Дополнительные предпочтительные белковые антигены пневмококка представляют собой антигены, описанные в WO 98/18931, предпочтительно выбранные в W0 98/18930 и PCT/US 99/30390. Предпочтительными белковыми антигенами Moraxella catarrhalis, которые могут быть включены в комбинированную вакцину (главным образом для профилактики среднего отита) являются ОМР 106 [WO 97/41731 (Antex) и WO 96/34960 (РМС)]; ОМР 21; LbpA и/или LbpB [WO 98/55606 (PMC)]; TbpA и/или(PCT/EP 99/03823); OMP85 (PCT/EP 00/01468); lipo06 (GB 9917977.2); lipo10 (GB 9918208.1); lipo11 (GB 9918302.2); Iipo18 (GB 9918038.2); P6 (PCT/EP 99/03038); D15 (PCT/EP 99/03822); OmplA1 (PCT/EP 99/06781); Hly3 (PCT/EP 99/03257) и OmpE. Предпочтительные дополнительные белковые антигены атипичной Haemophilus influenzae, которые могут быть включены в комбинированную вакцину (главным образом для профилактики среднего отита) включают белок фимбрин [(US 5766608 - Ohio State Research Foundation)] и слитые конструкции, содержащие пептиды, на его основе [например, LBl(f) пептидные слитые конструкции; US 5843464 (OSU) илиiOMP1681 (BASB210) [WO 02/34772]. Предпочтительные антигены вируса гриппа включают вирус целиком, живой или инактивированный вирус, расщепленный вирус гриппа, выращенный в яйцах или клетках MDCK, или клетки Vero или целые виросомы гриппа (описанные авторами R. Gluck, Vaccine, 1992, 10, 915-920) или их очищенные или рекомбинантные белки, такие как НА, NP, NA, или М-белки, или их сочетания. Предпочтительные антигены RSV (респираторно-синцитиального вируса) включают Fгликопротеин, G-гликопротеин, HN-белок или их производные. Композиции, наборы и введение. В дополнительном аспекте изобретение относится к композициям, содержащим полинуклеотиды белка Е и/или полипептиды белка Е для введения в клетку или в многоклеточный организм. Изобретение также относится к композициям, содержащим полинуклеотид и/или полипептиды,рассматриваемые здесь, или их агонисты или антагонисты. Полипептиды и полинуклеотиды по изобре- 22015561 тению могут быть использованы в комбинации с нестерильным или стерильным носителем или носителями для использования с клетками, тканями или организмами, например фармацевтическим носителем,подходящим для введения индивидууму. Такие композиции содержат, например, вспомогательные средства или терапевтически эффективное количество полипептида и/или полинуклеотида по изобретению и фармацевтически приемлемый носитель или эксципиент. Такие носители могут включать, но не только,солевой раствор, буферный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации. Композиция должна соответствовать способу введения. Изобретение дополнительно относится к диагностическим и фармацевтическим упаковкам и наборам, содержащим один или несколько контейнеров, наполненных одним или несколькими ингредиентами упомянутых выше композиций по изобретению. Полипептиды, полинуклеотиды и другие соединения по изобретению могут быть использованы отдельно или совместно с другими соединениями, например терапевтическими соединениями. Фармацевтические композиции можно вводить любым эффективным, удобным способом, в том числе, например, введением местным, пероральным, анальным, вагинальным, внутривенным, внутрибрющинным, внутримышечным, подкожным, интраназальным или внутрикожным путем, среди прочего. При лечении или в качестве профилактики активный агент можно вводить индивидууму в виде инъекционной композиции, например в виде стерильной водной дисперсии, предпочтительно изотонической. В дополнительном аспекте настоящее изобретение относится к фармацевтическим композициям,содержащим терапевтически эффективное количество полипептида и/или полинуклеотида, например растворимую форму полипептида и/или полинуклеотида по настоящему изобретению, пептидного агониста или антагониста или мелкомолекулярного соединения в сочетании с фармацевтически приемлемым носителем или эксципиентом. Такие носители включают, но не только, солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации. Изобретение дополнительно относится к фармацевтическим упаковкам и наборам, содержащим один или несколько контейнеров,заполненных одним или несколькими ингредиентами упомянутых выше композиций по изобретению. Полипептиды, полинуклеотиды и другие соединения по изобретению могут быть использованы по отдельности или совместно с другими соединениями, например терапевтическими соединениями. Композиции будут адаптированы к пути введения, например системному или пероральному пути. Предпочтительные формы системного введения включают инъекцию, обычно посредством внутривенной инъекции. Могут быть использованы другие инъекционные пути введения, например подкожный,внутримышечный или внутрибрюшинный. Альтернативные средства системного введения включают введение через слизистую и через кожу, используя проникающие вещества, например соли желчных кислот или фусидовые кислоты или другие детергенты. Кроме того, если полипептид или другие соединения по настоящему изобретению могут быть составлены в энтеральную или инкапсулированную композицию, также может быть возможным пероральное введение. Введение этих соединений также может быть местным и/или локализованным, в форме мазей, паст, гелей, растворов, порошков и подобного. Для введения млекопитающим, и, в частности, людям, ожидается, что уровень ежедневной дозы активного вещества составит от 0,01 до 10 мг/кг, обычно около 1 мг/кг. Лечащий врач в любом случае определит конкретную дозу, которая будет наиболее подходящей для индивидуума, и она будет зависеть от возраста,массы тела и реакции конкретного индивидуума. Указанные выше дозы иллюстрируют случай в среднем. Конечно, могут существовать индивидуальные примеры, которые заслуживают более высоких или более низких интервалов доз, и они находятся в объеме этого изобретения. Необходимый интервал доз зависит от выбора пептида, пути введения, характера композиции, характера состояния пациента и решения лечащего врача. Подходящие дозы, однако, находятся в диапазоне 0,1-100 мкг/кг массы тела пациента. Удобно, когда композиция вакцины находится в инъекционной форме. Могут быть использованы обычные адъюванты для усиления иммунного ответа. Подходящая однократная доза для вакцинации составляет 0,5-5 мкг антигена на 1 кг, и такую дозу предпочтительно вводят 1-3 раза и с интервалом 1-3 недели. С указанным интервалом дозы не будет наблюдаться неблагоприятных токсикологических эффектов соединений по изобретению, которые могли бы прервать их введение соответствующим индивидуумам. Однако ожидается широкое разнообразие необходимых доз, принимая во внимание разнообразие доступных соединений и различную эффективность различных путей введения. Например, можно было бы ожидать, что для перорального введения потребуются более высокие дозы, чем для введения путем внутривенной инъекции. Колебания этих уровней доз могут быть скорректированы с помощью стандартных эмпирических методик оптимизации, которые широко распространены в этой области. Базы данных последовательностей, последовательности на материальном носителе и алгоритмы. Полинуклеотидные и полипептидные последовательности образуют ценный информацинный ресурс, с помощью которого определяют их 2- и 3-мерные структуры, а также идентифицируют дополнительные последовательности аналогичной гомологии. Эти подходы в наибольшей степени облегчают хранение последовательности на машиночитаемом носителе и последующее использование сохраненных данных в известной программе для макромолекулярной структуры или для поиска в базе данных после- 23015561 довательностей, используя хорошо известные инструменты поиска, такие как программный пакет GCG. Изобретение также относится к способам анализа характера последовательностей или цепочек, в частности генетических последовательностей или кодированных белковых последовательностей. Предпочтительные способы анализа последовательностей включают, например, способы анализа гомологии последовательностей, например анализ идентичности и подобия, анализ структуры ДНК, РНК и белка,сборки последовательности, кладистический анализ, анализ мотивов последовательности, определение открытой рамки считывания, обращение к нуклеотидным основаниям, анализ использования кодонов,выравнивание нуклеотидных оснований и пошаговый анализ хроматографического пика. Автоматизированный способ предоставляется для проведения идентификации гомологии. Этот способ включает стадии предоставления первой полинуклеотидной последовательности, содержащей последовательность полинуклеотида по изобретению на машиночитаемом носителе; и сравнения указанной первой полинуклеотидной последовательности по меньшей мере с одной другой полинуклеотидной или полипептидной последовательностью для идентификации гомологии. Автоматизированный способ также предусмотрен для проведения идентификации гомологии, указанный способ включает стадии предоставления последовательности первого полипептида, содержащей последовательность полипептида по изобретению на машиночитаемом носителе; и сравнения указанной первой полипептидной последовательности по меньшей мере с одной другой полинуклеотидной или полипептидной последовательностью для идентификации гомологии. Все публикации и ссылки, включая, но не только, патенты и патентные заявки, цитируемые в этом описании, включены здесь в качестве ссылки в полном объеме, как если бы каждая отдельная публикация или ссылка была особо и отдельно указана как включенная здесь в качестве ссылки в полном объеме. Любая патентная заявка, по которой испрашивается приоритет, также включена здесь в качестве ссылки в полном объеме, описанным выше образом для публикаций и ссылок. Определения. Идентичность, как известно в уровне техники, представляет собой сходство между двумя или несколькими полипептидными последовательностями или двумя или несколькими полинуклеотидными последовательностями, в зависимости от конкретного случая, определенное путем сравнения последовательностей. В уровне техники идентичность также означает степень родства последовательностей между полипептидными или полинуклеотидными последовательностями в зависимости от конкретного случая, определенную комплементарностью цепей таких последовательностей. Идентичность можно легко вычислить с помощью известных способов, в том числе, но не только, описанными в (Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of SequenceData, Part I, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heine, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; и Carillo, H., and Lipman, D., SIAM J. Applied Math., 48: 1073 (1988). Способы для определения идентичности разработаны для предоставления наибольшего совпадения тестируемых последовательностей. Кроме того, способы для определения идентичности систематизированы в общедоступных компьютерных программах. Компьютерные программы для определения идентичности между двумя последовательностями включают, но не только, программу GAP в программном пакете GCG (Devereux, J., et al., Nucleic Acids Research 12(1): 387 (1984, BLASTP, BLASTN(BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, MD 20894; Altschul, S., et al., J. Mol. Biol. 215: 403-410 (1990) . Для определения идентичности также может быть использован хорошо известный алгоритм Смита Ватермана. Параметры для сравнения полипептидной последовательности включают следующее. Алгоритм: Needleman и Wunsch, J. Mol. Biol. 48: 443-453 (1970). Матрица сравнения: BLOSSUM62 от Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA. 89:1091510919 (1992). Штраф за разрыв: 8. Штраф за длину разрыва: 2. Программа, используемая с этими параметрами, является общедоступной как программа gap отGenetics Computer Group, Madison WI. Вышеупомянутые параметры представляют собой параметры по умолчанию для сравнений пептидов (наряду с отсутствием штрафа за концевые разрывы). Параметры для сравнения полинуклеотидов включают следующее. Алгоритм: Needleman и Wunsch, J. Mol. Biol. 48: 443-453 (1970). Матрица сравнения: соответствия = +10, несоответствия = 0. Штраф за разрыв: 50. Штраф за длину разрыва: 3. Доступен как программа gap от Genetics Computer Group, Madison WI. Это параметры по умолча- 24015561 нию для сравнений нуклеиновых кислот. Предпочтительные значения идентичности для полинуклеотидов и полипептидов в зависимости от конкретного случая представлены ниже в пп. (1) и (2).(1) Полинуклеотидные варианты осуществления дополнительно включают выделенный полинуклеотид, содержащий полинуклеотидную последовательность, имеющую по меньшей мере 50, 60, 70, 80,85, 90, 95, 97 или 100% идентичность с эталонной последовательностью SEQ ID NO: 11, где указанная полинуклеотидная последовательность может быть идентичной эталонной последовательности SEQ IDNO: 11 или может включать нуклеотидные изменения вплоть до определенного целого числа по сравнению с эталонной последовательностью, где указанные изменения выбраны из группы, состоящей по меньшей мере из одной нуклеотидной делеции, замены, включая транзицию и трансверсию, или вставки,и где указанные изменения могут встречаться в 5'- или 3'-концевых положениях эталонной нуклеотидной последовательности или в любом месте между этими концевыми положениями, рассеянные либо по отдельности среди нуклеотидов в эталонной последовательности, либо в одной или нескольких смежных группах в пределах эталонной последовательности, и где указанное число нуклеотидных изменений определяется умножением общего количества нуклеотидов в SEQ ID NO: 11 на целое число, определяющее процент идентичности, разделенное на 100, а затем вычитанием этого результата из указанного общего числа нуклеотидов в SEQ ID NO: 11, илиnnXn - (Xny),где nn представляет собой число нуклеотидных изменений, xn представляет собой общее количество нуклеотидов в SEQ ID NO: 11, у составляет 0,50 для 50%, 0,60 для 60%, 0,70 для 70%, 0,80 для 80%, 0,85 для 85%, 0,90 для 90%, 0,95 для 95%, 0,97 для 97% или 1,00 для 100%, ипредставляет собой символ оператора умножения, и где любое не целое число результата xn и y округляют в меньшую сторону до наиболее близкого целого числа до вычитания его из xn. Изменения полинуклеотидных последовательностей,кодирующих полипептиды SEQ ID NO:1-10, могут создавать нонсенс, миссенс мутации или мутации со сдвигом рамки считывания в этой кодирующей последовательности и, тем самым, изменять полипептид,кодируемый полинуклеотидом после таких изменений. В качестве примера полинуклеотидная последовательность по настоящему изобретению может быть идентична эталонным последовательностям SEQ ID NO: 11, то есть она может быть 100% идентичной, или она может содержать изменения нуклеиновой кислоты вплоть до определенного целого числа по сравнению с эталонной последовательностью так, что процент идентичности составляет менее 100%. Такие изменения выбраны из группы, состоящей по меньшей мере из одной нуклеотидной делеции, замены, включая транзицию и трансверсию, или вставки, и где указанные изменения могут встречаться в 5'- или 3'-концевых положениях эталонной нуклеотидной последовательности или в любом месте между этими концевыми положениями, рассеянные либо по отдельности среди нуклеотидов в эталонной последовательности, либо в одной или нескольких смежных группах в пределах эталонной последовательности. Число изменений в нуклеиновой кислоте для заданного процента идентичности определяется умножением общего числа нуклеиновых кислот в SEQ ID NO: 11 на целое число, определяющее процент идентичности, разделенное на 100, а затем вычитанием этого результата из указанного общего числа нуклеиновых кислот в SEQ ID NO: 11, илиnn xn - (xny),где nn представляет собой число изменений в нуклеиновой кислоте, xn представляет собой общее число нуклеиновых кислот в SEQ ID NO: 11, у составляет, например, 0,70 для 70%, 0,80 для 80%, 0,85 для 85% и т.д.,представляет собой символ оператора умножения, и любое не целое число результата xn и y округляют в меньшую сторону до наиболее близкого целого числа до вычитания его из xn.(2) Полипептидные варианты осуществления дополнительно включают выделенный полипептид,содержащий полипептид, имеющий по меньшей мере 50, 60, 70, 80, 85, 90, 95, 97 или 100% идентичность с полипептидной эталонной последовательностью SEQ ID NO: 1-10, где указанная полипептидная последовательность может быть идентичной эталонной последовательности SEQ ID NO: 1-10 или может содержать аминокислотные изменения, вплоть до определенного числа, по сравнению с эталонной последовательностью, где указанные изменения выбраны из группы, состоящей по меньшей мере из одной аминокислотной делеции, замены, включая консервативную и неконсервативную замену, или вставки, и где указанные изменения могут встречаться в амино- или карбоксиконцевых положениях эталонной полипептидной последовательности или в любом месте между этими концевыми положениями, разбросанные либо по отдельности среди аминокислот в эталонной последовательности, либо в одной или нескольких смежных группах в пределах эталонной последовательности, и где указанное число аминокислотных изменений определяется умножением общего числа аминокислот в SEQ ID NO: 1-10 на целое число, определяющее процент идентичности, разделенное на 100, а затем вычитанием этого результата из указанного общего числа аминокислот в SEQ ID NO: 1-10 соответственно, илиna Xa - (Xay),где na представляет собой число аминокислотных изменений, Xa представляет собой общее число аминокислот в SEQ ID NO: 1-10, y составляет 0,50 для 50%, 0,60 для 60%, 0,70 для 70%, 0,80 для 80%, 0,85 для- 25015561 85%, 0,90 для 90%, 0,95 для 95%, 0,97 для 97% или 1,00 для 100%, ипредставляет собой символ оператора умножения, и любое не целое число результата Xa и y округляют в меньшую сторону до наиболее близкого целого числа до вычитания его из Xa. В качестве примера полипептидная последовательность по настоящему изобретению может быть идентична эталонной последовательности SEQ ID NO: 1-10, то есть она может быть 100% идентичной,или она может содержать аминокислотные изменения, вплоть до определенного числа, по сравнению с эталонной последовательностью так, что процент идентичности составляет менее 100% идентичности. Такие изменения выбраны из группы, состоящей по меньшей мере из одной аминокислотной делеции,замены, включая консервативную и неконсервативную замену, или вставки, и где указанные изменения могут встречаться в амино- или карбоксиконцевых положениях эталонной полипептидной последовательности или в любом месте между этими концевыми положениями, разбросанные либо по отдельности среди аминокислот в эталонной последовательности, либо в одной или нескольких смежных группах в пределах эталонной последовательности. Число аминокислотных изменений для заданного % идентичности определяется умножением общего числа аминокислот в SEQ ID NO: 1-10 на целое число, определяющее процент идентичности разделенное на 100, а затем вычитанием этого результата из указанного общего числа аминокислот в SEQ ID NO: 1-10, илиna Xa - (Xay),где na представляет собой число аминокислотных изменений, Xa представляет собой общее число аминокислот в SEQ ID NO: 1-10, у составляет, например, 0,70 для 70%, 0,80 для 80%, 0,85 для 85% и т.д., апредставляет собой символ оператора умножения, и любое не целое число результата Xa и у округляют в меньшую сторону до наиболее близкого целого числа до вычитания его из Xa. Индивидуум(ы) в контексте настоящего изобретения со ссылкой на организм означает многоклеточный эукариот, в том числе, но не только, многоклеточное животное, млекопитающее, овцы и крупный рогатый скот, обезьяну, примата и человека. Выделенный означает преобразованный руками человека из его природного состояния, т.е. если встречается в природе, его изменили или удалили из исходного окружения, или и то, и другое. Например,природный полинуклеотид или полипептид живого организма не является выделенным, но тот же полинуклеотид или полипептид, отделенный от сосуществующих с ним веществ его природного окружения, является выделенным, как этот термин используется в контексте данного изобретения. Кроме того, полинуклеотид или полипептид, который введен в организм путем трансформации, генетического воздействия или любым другим рекомбинантным способом, является выделенным, даже если он всетаки присуствует в указанном организме, который может быть живым или неживым. Полинуклеотид(ы) в основном относится к любому полирибонуклеотиду или полидезоксирибонуклеотиду, который может представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК, включая односпиральные и двухспиральные участки. Вариант относится к полинуклеотиду или полипептиду, который отличается от эталонного полинуклеотида или полипептида, но сохраняет необходимые свойства. Обычный вариант полинуклеотида отличается по нуклеотидной последовательности от другого, эталонного полипептида. Изменения в нуклеотидной последовательности варианта могут изменять или могут не изменять аминокислотную последовательность полипептида, кодируемого эталонным полипептидом. Нуклеотидные изменения могут приводить к аминокислотным заменам, добавлениям, делециям, слияниям и усечениям в полипептиде,кодируемом эталонной последовательностью, как рассмотрено ниже. Обычный вариант полипептида отличается по аминокислотной последовательности от другого, эталонного полипептида. В основном,различия ограничены таким образом, что последовательности эталонного полипептида и варианта в целом очень сходны и во многих областях идентичны. Вариант и эталонная последовательность могут отличаться по аминокислотной последовательности одной или несколькими заменами, добавлениями, делециями в любом сочетании. Замененный или вставленный аминокислотный остаток может кодироваться или может не кодироваться генетическим кодом. Вариант полинуклеотида или полипептида может быть природным, например аллельным вариантом, или может быть вариантом, который не известен в природе. Неприродные варианты полинуклеотидов и полипептидов могут быть получены методиками мутагенеза или прямым синтезом. Заболевание(я) означает любое заболевание, вызванное или относящееся к бактериальной инфекции, в том числе, например, средний отит у новорожденных и детей, пневмония у пожилых, синусит,внутрибольничные инфекции и инвазивные заболевания, хронический средний отит с потерей слуха,накопление жидкости в среднем ухе, повреждение слухового нерва, замедленное изучение речи, инфекция верхних дыхательных путей и воспаление среднего уха. Экспериментальная часть Приведенные ниже примеры выполняются с использованием стандартных методик, которые хорошо известны и являются общепринятыми у специалистов в данной области, за исключением того, что описано подробно. Примеры являются иллюстрирующими, а не ограничивающими изобретение. Настоящее исследование описывает выделение, очистку, характеристику, клонирование и экспрес- 26015561 сию нового белка наружной мембраны H. influenzae, названного белком Е (рЕ), и нового усеченного рекомбинантного рЕ(А), который был обнаружен с использованием IgD сыворотки при миеломе человека. Материалы и методы. Реактивы. Штаммы MinnA и NTHi3 655 H. Influenzae, тип b, были любезно предоставлены Robert S. MunsonJr. (Washington University School of Medicine (St. Louis, Mo. Штамм NTHi772 атипичной H. influenzae был выделен клинически из культуры носоглоточного мазка в департаменте (2). Ряд различных видовHaemophilus также был проанализирован и описан в табл. 1. IgD цельной сыворотки IgD-миеломы человека покупали у The Binding Site (Birmingham, England). Для получения специфической анти-рЕ антисыворотки кроликов иммунизировали внутримышечно 200 мкг рекомбинантного рЕ 22-160 [рЕ(А)],эмульгированного в полном адъюванте Фрейнда (Difco, Becton Dickinson, Heidelberg, Germany), или пептидом рЕ 41-68, конъюгированным с гемоцианином лимфы улитки (KLH), и ревакцинировали на 18 и 36 день такой же дозой белка в неполном адъюванте Фрейнда. Кровь брали спустя 2-3 недели. Полученные в результате поликлональные антитела выделяли с помощью аффинной хроматографии, используя рЕ(А) или специфический пептид рЕ (рЕ 41-68), конъюгированный с CnBr-сефарозой (11). Козьи антитела к IgD человека, конъюгированные с пероксидазой хрена (HRP), были из Biosource (Camarillo, CA). КроличьиpAb к IgD человека были из Dakopatts (Gentofte, Denmark). Мышиные поликлональные иммуноглобулины к IgD человека, конъюгированные с флуоресцеинизотиоцианатом (FITC), кроличьи поликлональные иммуноглобулины к легким цепям ( и ) человека,конъюгированные с HRP, FITC-конъюгированные антикроличьи поликлональные иммуноглобулины свиньи покупали у Dakopatts. Экстракция и очистка белка Е. Н. influenzae тип b (MinnA) выращивали в течение ночи в бульоне с сердечно-мозговым экстрактом(BHI) (Difco Laboratories, Detroit, Mich.), дополненным NAD и гемином (Sigma, St. Louis, МО), каждого по 10 мкг/мл. После двух промываний бактерии экстрагировали в 0,05 М Трис-HCl-буфере (рН 8,8), содержащем 0,5% Empigen (Calbiochem Novabiochem, Bedford, MA). Бактериальную суспензию перемешивали магнитной мешалкой в течение 2 ч при 37 С. После центрифугирования при 8000g в течение 20 мин при 4 С, супернатант фильровали с использованием стерильного фильтра (0,45 мкм; Sterivex-HV,Millipore). Экстракт Н. influenzae в 0,5% Empigen наносили на колонку с Q-сефарозой (Amersham Pharmacia Biotech), уравновешенной 0,05 М Трис-HCl (рН 8,8), содержащим 6 М мочевины. Колонку элюировали с использованием линейного градиента NaCl от 0 до 1M в том же буфере. Фракции, которые были выявлены с помощью IgD миеломной сыворотки, объединяли, диализировали в мембранных трубкахSpectraphor (исключение молекулярной массы 6-8000; Spectrum, Laguna hills, CA) против 0,05 М ТрисHCl, рН 8,8, и концентрировали на дисковых мембранах YM100 (исключение молекулярной массы 10000; Amicon, Beverly, MA).SDS-PAGE и выявление белков на мембранах (Вестерн-блот).SDS-PAGE проводили при постоянном напряжении 150, используя 10% бис-трис-гели с подвижным буфером (MES), буфером для образца (LDS) и буфером для блоттинга, а также средства для блоттинга от Novex (San Diego, CA). Образцы равномерно нагревали при 100 С в течение 10 мин. Гели окрашивали Кумасси бриллиантовым голубым R-250 (13; Bio-Rad, Sundbyberg, Sweden). Электрофоретический перенос белковых полос с геля на мембрану иммунобилон-Р (Millipore, Bedford, MA) осуществляли при 30 В в течение 2-3 ч. После переноса мембрану иммунобилон-Р блокировали в PBS с 0,05% Твином 20 (PBS-Tween), содержащим 5% сухого молока. После нескольких промываний в PBS-Tween, мембрану инкубировали с очищенным белком IgD-миеломы (0,5 мкг/мл, IgD миеломы человека; The Bindingsite) в PBS-Tween, включающем 2% сухого молока, в течение 1 ч при комнатной температуре. HRPконъюгированные козьи антитела к IgD человека, разбавленные 1/1000 добавляли после нескольких промываний в PBS-Tween. После инкубации в течение 40 мин при комнатной температуре и нескольких дополнительных промываний в PBS-Tween, проводили выявление с использованием проявляющих реактивов ECL для Вестерн-блоттинга (Amersham Pharmacia Biotech, Uppsala, Sweden). Двумерный электрофорез в SDS-полиакриламидном геле 2-D PAGE) и Вестерн-блоттинг. После ионообменной хроматографии Empigen экстракты H. influenzae (MinnA) подвергали изоэлектрическому фокусированию (IEF), используя систему IPGphor IEF System (Amersham Pharmacia Biotech) (5, 12). Для калибровки геля использовали стандарт (номер в каталоге 161-0320; Bio-Rad). 2-D полиакриламидные гели подвергали электроблоттингу на фильтры Immobilon-PVDF (0,45 мм; Millipore,Bedford, US) при 120 мА в течение ночи. После насыщения стадии инкубации, блокирования и промывки проводили, как описано выше. Анализ аминокислотной последовательности. Автоматизированный анализ аминокислотной последовательности проводили с помощью AppliedBiosystems (Foster City, CA) 470A газожидкостного твердофазного секвенатора. Конструирование геномной библиотеки Н. influenzae.- 27015561 Хромосомную ДНК получали из штамма 772, используя модификацию способа Berns и Thomas (2,13). Коротко, геномную библиотеку Н, influenzae 772 конструировали из 40 мкг ДНК, которая была частично расщеплена Sau3A в течение 1 ч. Расщепленную ДНК фракционировали на градиенте сахарозы(14). Фракции, содержащие фрагменты ДНК соответствующих размеров (от 2 до 7 т.н.п.), объединяли и ДНК лигировали в pUC18, расщепленную BamHI, с последующей трансформацией в Escherichia coliJM83 путем электропорации, используя Gene pulser (Bio-Rad, Richmond CA). Бактерии помещали на агарLB, дополненный ампициллином и X-Gal (5-бром-4-хлор-3-индолилD-галактопиранозид). Иммуноанализ колоний, выделение и секвенирование ДНК. Трансформанты Е. coli, культивированные в течение ночи на агаре LB, переносили на нитроцеллюлозные фильтры (Sartorius, Gottingen, Germany) путем покрытия поверхностей агара сухими фильтрами. Чашки оставляли на 15 мин и клетки лизировали, подвергая воздействию насыщенных паров хлороформа в течение 20 мин. Оставшиеся на фильтрах белок-связывающие участки блокировали инкубированием фильтров в сбалансированном Трис-солевом растворе, содержащем овальбумин (50 мМ Трисгидрохлорид, 154 мМ NaCl, 1,5% овальбумин [рН 7,4]) в течение 30 мин. После блокировки фильтры инкубировали с IgD человека в течение 30 мин. Поликлональные антитела к IgD человека, конъюгированные с HRP, добавляли после промываний и фильтры инкубировали в течение 30 мин. Все инкубации проводили при комнатной температуре. В конце фильтры проявляли, используя 4-хлор-1-нафтол иH2O2. Положительные клоны собирали и ДНК плазмиды pUC18, содержащую геномную ДНК NTHi772,очищали. Полученную в результате вставку ДНК NTH1772 секвенировали, используя фланкирующие праймеры М 13+ и М 13- и набор для сиквенсовой реакции BigDye Terminator Cycle Sequencing v. 2.0Ready (Perkin-Elmer, Foster City, Ca). Полученная вставочная последовательность (3,55 т.н.п.) соответствовала участку, содержащему ДНК, кодирующую белки HI0175, HI0176, HI0177 и, наконец, HI0178 (15). Клонирование ДНК и экспрессия белка. Все конструкции были разработаны с использованием фрагментов, амплифицированных в результате ПЦР. В качестве матрицы использовали pUC18, содержащую геномную ДНК NTHi 772 (с HI0175 поHI0178). Taq ДНК-полимераза была производства Roche (Mannheim, Germany), условия проведения ПЦР соответствовали рекомендованным фирмой-изготовителем. Были клонированы открытые рамки считывания четырех предсказанных белков с HI0175 по HI0178, но сюда включена только методика, описывающая процесс клонирования HID (HIQ178). рЕ 22-160 [обозначенный рЕ(А)] лишали эндогенного сигнального пептида, в том числе аминокислотного остатка глутамина 21, и амплифицировали посредством ПЦР с использованием праймеров 5'-ctcaggatccaaaggctgaacaaaatgatgtg-3' и 5'-ggtgcagattaagcttttttttatcaactg3', вводящих сайты для ферментов рестрикции BamHI и HindIII. Для слияния 6 остатков гистидина, кодируемых этим экспрессирующим вектором, стоп-кодон pE22-160 был видоизменен. Полученную открытую рамку считывания гена ре размером 417 н.п. лигировали в рЕТ 26(+) (Novagen, Darmstadt, Germany). Во избежание возможной токсичности полученные в результате плазмиды сначала трансформировали в хозяине Е. coli DH5. Затем плазмиды, кодирующие рЕ и рЕ(А), трансформировали в экспрессирующем хозяине BL21(DE3). В дополнение к полноразмерным рЕ и рЕ(А) были получены последовательности процессированных вариантов рЕ. Схема представлена на фиг. 8. Для всех конструкций использовали праймеры, содержащие в себе сайты рестрикции для BamHI и HindIII. Процедуры для процессированных вариантов были описаны выше. Все конструкции были секвенированы с использованием набора для сиквенсовой реакции BigDye Terminator Cycle Sequencing v. 2.0 Ready (Perkin-Elmer, Foster City, Ca). Для получения рекомбинантных белков бактерии выращивали до середины фазы логарифмического роста (OD600 от 0,6 до 0,8) с последующей индукцией с использованием 1 мл изопропил-1-тиоDгалактозида (IPTG), что приводило к гиперэкспрессии рЕ(А). Когда OD600 достигала 1,5-1,7, бактерии собирали и выделяли тельца включения, используя стандартный протокол. Рекомбинантные белки могут быть дополнительно очищены с помощью аффинной хроматографии с использованием никелиевых колонок. Затем проводили анализ очищенных рекомбинантных белков вSDS-PAGE. Очистка ДНК Н.influenzae, условия ПЦР и секвенирование. Геномную ДНК из клинических штаммов Н. influenzae выделяли с использованием набора DNeasyTissue (Qiagen, Hilden, Germany). Taq ДНК-полимераза была производства Roche (Mannheim, Germany), а условия проведения ПЦР соответствовали рекомендованным фирмой-изготовителем. Для выделения гена ре использовали пару праймеров 5'-gcatttattaggtcagtttattg-3' и 5'-gaaggattatttctgatgcag-3', которые отжигаются с фланкирующими генами HI0177 и HI0179 соответственно. Последовательности полученных продуктов ПЦР (948 п.н.) определяли посредством шаговой полимеразной цепной реакции целевого гена с использованием вышеуказанных праймеров в дополнение к праймерам 5'-cttgggttacttaccgcttg-3' и 5'gtgttaaacttaacgtatg-3'. Капиллярный электрофорез проводили на приборе Beckman CEQ 2000 с использованием набораDye-terminator cycle sequencing (CEQ DTCS kit, Beckman Coulter, Stockholm, Sweden). Обработку и выравнивание полученных последовательностей ДНК осуществляли с использованием PHRED (CodonCode,Deadham, USA) и SEQUENCHER (MedProbe, Oslo, Norway).- 28015561 Получение H. influenzae с дефицитом рЕ (NTHi 3655 pe). В качестве матрицы использовали геномную ДНК, выделенную из NTHi 772. 5'- и 3'-Концы гена ре,содержащие части генов HI0177 и HI0179, были амплифицированы как две кассеты (815 н.п. и 836 н.п. соответственно) с использованием ДНК-полимеразы DyNAzyme II (Finnzymes, Espoo, Finland), вводя сайты для ферментов рестрикции XhoI и EcoRI соответственно, EcoRI и SpEI в дополнение к специфическим захватывающим последовательностям в этих двух кассетах (18). Полученные фрагменты ПЦР были расщеплены и клонированы в pBluescript SK (+/-). Кассета гена устойчивости к канамицину (1282 н.п.) была получена из pUC4K с использованием сайта фермента рестрикции EcoRI. После расщепления продукт ПЦР лигировали в процессированный фрагмент гена ре, включающий части генов HI0177 и HI0179. Штаммы H. influenzae Eagan и RM804 были трансформированы в соответствии с методом M-IV, описанным Heriott et al. (19). Полученных мутантов проверяли с помощью ПЦР и экспрессию рЕ анализировали с помощью Вестерн-блоттинга и проточной цитометрии. Программное обеспечение для молекулярной биологии. Полученные последовательности сравнивали с имеющимся геномом H. influenzae KW20(http://www.tigr.org) (15). Сигнальный пептид был установлен с помощью SignalP VI. 1 World Wide WebPrediction Server Center for Biological Sequence Analysis (http://www.cbs.dtu.dk/services/SignalP/) (16). Профиль гидрофобности рЕ анализировали способом по Kyte и Doolittle (17). Животные, хирургиеские процедуры и крысиная модель среднего отита. Использовали здоровых самцов крыс Sprague-Dawley, массой 200-250 г. До операции у всех животных отсутствовали инфекционные заболевания среднего уха по данным отомикроскопии. При вмешательствах крыс анастезировали метогекситалом (Brietal, Elli Lilly and Company, Indianapolis, IN) внутривенно или хлоралгидратом (apoteksbolaget, Lund, Sweden) внутрибрюшинно. Бактерии для экспериментов с животными выращивали, как описано выше. После сбора центрифугированием бактерии ресуспендировали в свежей культуральной среде до концентрации 21010 колониеобразующих единиц (КОЕ) как для NTHi 3655, так и для соответствующего мутанта рЕ. До использования препараты держали на льду. Для индукции острого среднего отита (АОМ) среднего уха достигали вентральным срединным разрезом на шее и приблизительно 0,05 мл бактериальной суспензии вводили по каплям в полость среднего уха. Отомикроскопию проводили на 3 и 5 день после операции. Средний отит с гнойным экссудатом, т.е. непрозрачным экссудатом и зачастую резко выраженным расширением сосудов на 3 день, называли АОМ. Результаты. Экстракция и разделение белка Н. influenzae (рЕ), выявленного с помощью IgD сыворотки при миеломе. Ранее считалось, что атипичная H. influenzae (NTHi) не связывается с IgD (19), тогда как инкапсулированная H. influenzae прочно связывается с IgD. Авторы изобретения установили, что IgD сыворотки при миеломе специфически связывается также с NTHi. Характерный профиль NTHi772 по данным проточной цитометрии представлен на фиг. 1. Сильный сдвиг и повышенная флуоресценция были обнаружены в присутствии миеломного белка IgD по сравнению с контролем без IgD. Для тщательного анализа белка наружной мембраны H. Influenzae, который был обнаружен с помощью IgD миеломы, фракцию наружной мембраны солюбилизировали в детергенте Empigen. На фиг. 1B показано, что очень сильная IgD-связывающая активность была получена на Вестерн-блотах для белка со средней молекулярной массой приблизительно 16 кДа. Однако различимой полосы белка, соответствующей IgD-связывающей активности, не могло быть обнаружено при окрашивании SDS-PAGE Кумасси бриллиантовым голубым. После разделения на колонке с Q-сефарозой, тот же экстракт наружной мембраны наносили на 2-мерный гель-электрофорез и окрашивали серебром (фиг. 1 С). Одновременно проводили соответствующий Вестерн-блоттинг, зондированный IgD человека. Область, где находился рЕ, могла, следовательно, быть охвачена. Однако видимого белка не наблюдалось (фиг. 1 С). Клонирование белка Е и получение мутанта атипичной Н. influenzae, лишенного рЕ. Поскольку авторы изобретения не могли выявить какого-либо белка в 2-D анализе после разделения, была сконструирована ДНК библиотека H. Influenzae с использованием атипичной H. influenzaepUC18 с последующей трансформацией в Е. coli JM83. Трансформанты анализировали на связывание сIgD, используя иммуноанализ колоний, состоящий из IgD человека и поликлональных антител к IgD человека, конъюгированных с HRP. Было выявлено три положительные колонии из 20000 тестируемых колоний и их подвергали второму раунду скрининга с IgD. Авторы изобретения секвенировали один из положительных клонов и обнаружили 3,55 т.н. вставку, содержащую ДНК, кодирующую четыре белка с HI0175 по HI0178 в соответствии с физической картой H. influenzae KW20 (15). Для дальнейшего подтверждения специфического взаимодействия с IgD, выбранный трансформант также анализировали с помощью проточной цитометрии. Как видно на фиг. 2B, Е. coli JM83, содержащая геномную ДНК H.influenzae 772, соответствующую последовательности, кодирующей HI0175 HI0178, была обнаружена с помощью IgD по сравнению с отрицательной контрольной Е. coli, трансформированной только пустым вектором (фиг. 2 А).
МПК / Метки
МПК: C07K 16/12, C07K 14/285, A61K 39/012
Метки: поверхностный, новый, influenzae, белок, haemophilus
Код ссылки
<a href="https://eas.patents.su/30-15561-novyjj-poverhnostnyjj-belok-haemophilus-influenzae-belok-e-pe.html" rel="bookmark" title="База патентов Евразийского Союза">Новый поверхностный белок haemophilus influenzae (белок e; pe)</a>
Предыдущий патент: Способ лечения вирусного гепатита
Следующий патент: Применение пептидных соединений тро и фармацевтических композиций для лечения анемии
Случайный патент: Устройство для реакции синтеза углеводородов, реакционная система для синтеза углеводородов и способ извлечения жидких углеводородов


































