Лекарственные средства, применяемые при аритмии и сердечной недостаточности
Номер патента: 15010
Опубликовано: 29.04.2011
Авторы: Дэн Шисянь, Лэндри Дональд В., Маркс Эндрю Р., Чэн Чжэн Чжуан
Формула / Реферат
1. Производные 1,4-бензотиазепина общей формулы (a)
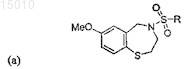
где R = арил, алкенил, алкил, -(CH2)nNR'2 или -(CH2)nSR' и n = 0, 1, 2 или 3, и R' = алкил или циклоалкил; или их окисленные производные.
2. Производные 1,4-бензотиазепина общей формулы (b)

где R = арил, алкенил, алкил, -(CH2)nNR'2 или -(CH2)nSR' и n = 0, 1, 2 или 3, и R' = алкил или циклоалкил; или их окисленные производные.
3. Производные 1,4-бензотиазепина общей формулы (c)
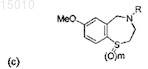
где R = CO(CH2)nNR'2, SO2(CH2)nNR'2, SO2NH(CH2)nNR'2, CO(CH2)nSR', SO2(CH2)nSR' или SO2NH(CH2)nSR' и n = 1, 2 или 3, и R' = алкил или циклоалкил; и где m = 1 или 2; или их окисленные производные.
4. Производные 1,4-бензотиазепина общей формулы (d)
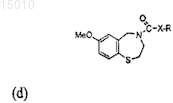
где R = арил, алкил, -(CH2)nNR'2, -(CH2)nSR' и n = 0, 1, 2 или 3, и R' = алкил или циклоалкил; и где X = NH или O; или их окисленные производные.
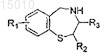
5. Производные 1,4-бензотиазепина общей формулы (e)
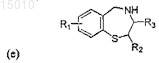
где R1 = OR', SR', N(R')2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил или H; где R2= алкил или арил; и где R3= Н или арил; или их окисленные производные.
6. Производные 1,4-бензотиазепина общей формулы (f)
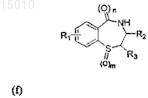
где R1= H, OR', SR', N(R')2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил или ацил; где R2 = алкенил или арил; где R3= алкил, алкенил или арил; где m = 0, 1 или 2; и где n = 0 или 1; или их окисленные производные.
7. Производные 1,4-бензотиазепина общей формулы (g)
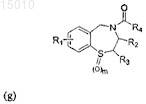
где R1= H, OR', SR', N(R')2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил или ацил; где R2 = H, алкил, алкенил или арил; где R3 = H, алкил, алкенил или арил; где R4 = галоид, карбоновая кислота или алкил, содержащий O, S или I; и где m = 0, 1 или 2; или их окисленные производные.
8. Производные 1,4-бензотиазепина, выбранные из группы
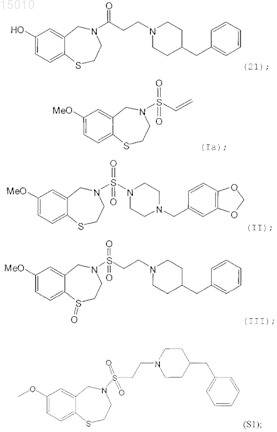
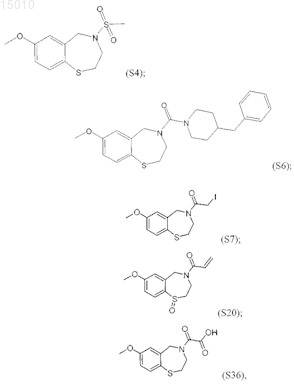
и их окисленные производные.
9. Соединение по п.7, представляющее собой соединение формулы
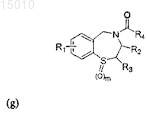
где R1= OR', SR', N(R')2, алкил или галоид, в положении 6, 7, 8 или 9 бензотиазепинового кольца;
R' = алкил, арил или ацил;
R2 = H, алкил, алкенил или арил;
R3 = H, алкил, алкенил или арил;
R4 = галоид, карбоновая кислота или алкил, содержащий O, S или I; и
m = 0, 1 или 2;
или его окисленное производное.
10. Соединение по п.2, где R1 = OR' в положении 7 бензотиазепинового кольца, m = 0 или 1, и R' = алкил.
11. Соединение по п.9 или 10, где R2 = H и R3 = H.
12. Соединение по любому из пп.9, 10 или 11, где R4 = карбоновая кислота или алкил, содержащий I, и R' = метил.
13. Соединение по п.8, представляющее собой S36 или его окисленное производное.
14. Фармацевтическая композиция, включающая соединение по любому из пп.1-13 и фармацевтически приемлемый носитель, добавку или разбавитель.
15. Фармацевтическая композиция по п.14, дополнительно содержащая один или более компонентов, представляющих собой антиоксидант, краситель, ароматизатор, консервант, подсластитель, связывающий агент или смазывающий агент, и где носитель представляет собой карбоксиметилцеллюлозу, кристаллическую целлюлозу, глицерин, гуммиарабик, лактозу, стеарат магния, метилцеллюлозу, солевой раствор, альгинат натрия, сахарозу, крахмал, тальк или воду, и фармацевтическая композиция находится в форме капсулы, таблетки, порошка, гранулы или суспензии.
16. Способ ограничения или предотвращения снижения уровня RyR2-связанного FKBP 12.6 у субъекта, который страдает заболеванием сердца, включающий введение субъекту эффективного количества соединения по любому из пп.1-13 или соединения, выбранного из группы, состоящей из S24, S25, S26, S27, или его окисленного производного.
17. Способ лечения или предотвращения заболевания сердца у субъекта, включающий введение субъекту эффективного количества соединения по любому из пп.1-13, или соединения, выбранного из группы, состоящей из S24, S25, S26, S27, или его окисленного производного.
18. Способ по п.16 или 17, где заболевание сердца представляет собой сердечную аритмию, тахикардию, предсердную аритмию, предсердную тахиаритмию, фибрилляцию предсердий, постоянную фибрилляцию предсердий, непостоянную фибрилляцию предсердий, желудочковую аритмию, фибрилляцию желудочков, вентрикулярную тахикардию, постоянную вентрикулярную тахикардию, непостоянную вентрикулярную тахикардию, катехоламинергическую полиморфную желудочковую тахикардию (CPVT), сердечную недостаточность, внезапную кардиальную смерть или кардиальную смерть, индуцированную физической нагрузкой.
19. Способ по любому из пп.16-19, где соединение выбирают из группы, состоящей из соединений 21, Ia, II, III, S1, S4, S6, S7, S20, S36 или его окисленного производного.
20. Способ предупреждения сердечной аритмии у субъекта, включающий введение субъекту эффективного количества средства, представляющего собой соединение формулы
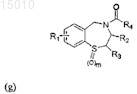
где R1 = H, OR', SR', N(R')2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил или ацил; где R2 = H, алкил, алкенил, или арил; R3 = H, алкил, алкенил или арил; R4 = H, галоид, карбоновая кислота или алкил, содержащий O, S или I; и m = 0, 1 или 2; или соединение, выбранное из группы, содержащей соединения 21, Ia, II, III, S1, S4, S6, S7, S20, S24, S25, S26, S27, S36, или его окисленные производные.
21. Способ по любому из пп.16-20, где субъект является человеком и эффективное количество соединения определяется как одно или более нижеследующих условий:
(a) от примерно 5 до примерно 20 мг/кг/день,
(b) количество, обеспечивающее концентрацию в плазме субъекта от примерно 0,02 до примерно 1,0 мкМ,
(c) количество, обеспечивающее концентрацию в плазме субъекта от примерно 300 до примерно 1000 нг/мл,
(d) количество, достаточное для повышения связывания FKBP 12.6 с RyR2 у субъекта, или
(e) количество, эффективное для лечения или предотвращения заболевания сердца у субъекта.
22. Способ по п.20 или 21, где соединение выбирают из группы, содержащей соединения 21, Ia, II, III, S1, S4, S6, S7, S20 и S36, или их окисленного производного.
23. Способ по любому из пп.20-22, где соединение представляет собой соединение S36.
24. Применение соединения по любому из пп.1-13 или соединения, выбранного из группы, содержащей соединения S24, S25, S26, S27, и их окисленного производного для ограничения или предотвращения снижения уровня RyR2-связанного FKBP 12.6 у пациента, страдающего заболеванием сердца.
25. Применение соединения по любому из пп.1-13 или соединения, выбранного из группы, содержащей соединения S24, S25, S26, S27, и их окисленного производного для лечения или предотвращения заболевания сердца у субъекта.
26. Применение соединения по любому из пп.1-13 или соединения, выбранного из группы, содержащей соединения S24, S25, S26, S27 и их окисленного производного для приготовления лекарственного средства для ограничения или предотвращения снижения уровня RyR2-связанного FKBP 12.6 у пациента, страдающего заболеванием сердца, или для лечения или предотвращения заболевания сердца у субъекта.
27. Применение по любому из пп.24-26, где заболевание сердца представляет собой сердечную аритмию, тахикардию, предсердную аритмию, предсердную тахикардию, фибрилляцию предсердий, постоянную фибрилляцию предсердий, непостоянную фибрилляцию предсердий, вентрикулярную фибрилляцию, вентрикулярную тахикардию, постоянную вентрикулярную тахикардию, непостоянную вентрикулярную тахикардию, катехоламинергическую полиморфную желудочковую тахикардию (CPVT), сердечную недостаточность, внезапную кардиальную смерть или кардиальную смерть, индуцированную физической нагрузкой.
28. Применение по любому из пп.24-27, где субъектом является человек и соединение выбирают из группы, содержащей соединения 21, Ia, II, III, S1, S4, S6, S7, S20 и S36, или их окисленного производного.
29. Применение соединения формулы (g) или соединения, выбранного из группы, состоящей из соединений 21, Ia, II, III, S1, S4, S6, S7, S20, S24, S25, S26, S27, S36, или их окисленных производных для предотвращения сердечной аритмии у субъекта
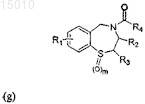
где R1 = H, OR', SR', N(R')2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил или ацил; где R2 = H, алкил, алкенил или арил; R3 = H, алкил, алкенил или арил; R4 = H, галоид, карбоновая кислота или алкил, содержащий O, S или I; и m = 0, 1 или 2.
30. Применение соединения формулы (g) или соединения, выбранного из группы, состоящей из соединений 21, Ia, II, III, S1, S4, S6, S7, S20, S24, S25, S26, S27, S36, или их окисленных производных для приготовления лекарственного средства для предотвращения сердечной аритмии у субъекта
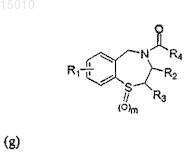
где R1 = H, OR', SR', N(R')2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил, или ацил; где R2 = H, алкил, алкенил или арил; R3 = H, алкил, алкенил или арил; R4 = H, галоид, карбоновая кислота или алкил, содержащий O, S или I; и m = 0, 1 или 2.
31. Применение по п.29 или 30, где субъектом является человек и соединение выбирают из группы, содержащей соединения 21, Ia, II, III, S1, S4, S6, S7, S20 и S36, или их окисленного производного.
32. Применение по любому из пп.24-31, где соединение представляет собой соединение S36.
33. Способ получения соединения формулы
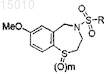
где R = арил, алкенил, алкил, -(CH2)nNR'2 или -(CH2)nSR' и n = 0, 1, 2 или 3, m = 0, 1 или 2, и R' = алкил или циклоалкил, включающий стадии:
(a) обработки соединения формулы
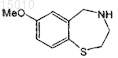
производным сульфонилхлорида и основанием для получения соединения формулы

(b) в случае необходимости, окисления соединения, полученного на стадии (a), для получения соединения формулы
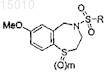
где m = 1 или 2.
34. Способ по п.33, где соединение, полученное на стадии (a), представляет собой

дополнительно включающий стадию (a-1) между стадией (a) и стадией (b), которая представляет собой обработку соединения, полученного на стадии (a), первичным или вторичным амином с образованием соединения формулы
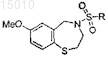
где R = -(CH2)nN(R')2; n = 2 и R' определен в п.1.
35. Способ получения соединения формулы
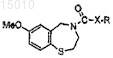
где R = арил, алкил, -(CH2)nNR'2 или -(CH2)nSR' и n = 0, 1, 2 или 3, и R' = алкил или циклоалкил, X = NH или O, включающий стадию обработки соединения формулы
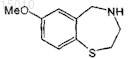
карбонилхлоридом в присутствии основания и первичным или вторичным амином или спиртом, для получения соединения формулы

36. Способ получения производного 2,3,4,5-тетрагидро-1,4-бензотиазепина, имеющего формулу
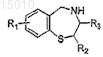
где R1 = OR', SR', NR'2, алкил или галоид в положении 6, 7, 8 или 9 бензотиазепинового цикла, и
R' = алкил, арил или H; где R2 = H, алкил или арил; и где R3 = H, алкил или арил, включающий стадии:
(a) обработки соединения формулы
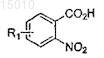
восстанавливающим агентом, необязательно в присутствии катализатора, для получения соединения формулы
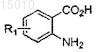
(b) обработки соединения, полученного на стадии (a), диазотирующим агентом и дисульфидом для получения соединения формулы
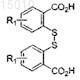
(c) обработки соединения, полученного на стадии (b), активирующим агентом и хлорэтиламином для получения соединения формулы
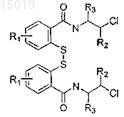
(d) обработки соединения, полученного на стадии (c), восстанавливающим агентом и основанием для получения соединения формулы
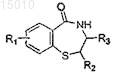
и
(e) обработки соединения, полученного на стадии (d), восстанавливающим агентом для получения соединения формулы
Текст
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ АРИТМИИ И СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Медведев В.Н., Павловский А.Н. (RU) Настоящее изобретение относится к производным 1,4-бензодиазепина, способу их получения и фармацевтической композиции на их основе. Кроме того, настоящее изобретение относится к способу ограничения или предотвращения снижения уровня RyR2-связанного FKBP 12.6 у пациента, к способу лечения и предотвращения заболевания сердца у субъекта, способу предупреждения сердечной аритмии у субъекта. Кроме того, настоящее изобретение относится к применению производных 1,4-бензодиазепина для ограничения или предотвращения снижения уровня RyR2-связанногоFKBP 12.6 у пациента, для лечения или предотвращения заболевания сердца у субъекта и для приготовления соответствующего лекарственного средства. Соединения согласно настоящему изобретению представляют собой Маркс Эндрю Р., Лэндри Дональд В., Дэн Шисянь, Чэн Чжэн Чжуан (US)(71)(73) Заявитель и патентовладелец: ДЗЕ ТРАСТИЗ ОФ КОЛАМБИЯ ЮНИВЕРСИТИ ИН ДЗЕ СИТИ ОФ НЬЮ ЙОРК (US) 015010 Перекрестные ссылки на связанные заявки Притязания согласно настоящей заявке являются частичным продолжением патентной заявки США Серийный 10/809089, поданной 25 марта 2004; которая является частичным продолжением патентной заявки серийный 10/763498 поданной 22 января 2004; которая является частичным продолжением патентной заявки серийный 10/680988, поданной 7 октября 2003; которая является частичным продолжением патентной заявки серийный 10/608723, поданной 26 июня 2003; которая является частичным продолжением патентной заявки серийный 10/288606, поданной 5 ноября 2002; которая является частичным продолжением патентной заявки серийный 09/568474, поданной 10 мая 2000, по которой выдан Патент США 648 9125 B1 3 декабря 2002; содержание которых таким образом включено в настоящее описание в виде ссылки. Установление государственного интереса Настоящее исследование проводили с государственной поддержкой NIH грантомPO1 HL 6784901. Следовательно, правительство Соединенных Штатов имеет определенные права в этом изобретении. Предшествующий уровень техники настоящего изобретения Несмотря на успехи в лечении, застойная сердечная недостаточность остается важной причиной смертности в Западных странах. Сердечная недостаточность поражает 5 миллионов людей только в Соединенных Штатах, и характеризуется уровнем смертности в течение 5 лет 50% (Levy et al., Long-termtrends in the incidence of and survival with heart failure. N. Engl. J. Med., 347:1397-402, 2002). Важным признаком сердечной недостаточности является сниженная сократимость миокардаfailure. Circ. Res., 61:70-76, 1987). В здоровой сердечной мышце и в других поперечно-полосатых мышцах каналы, высвобождающие кальций на саркоплазматической сети (SR), включая рецепторы рианодина (RyRs), облегчают связь потенциала действия с сокращением мышечных клеток (т.е. связь возбуждение-сокращение (EC. Сокращение начинается, когда кальций (Ca2+) высвобождается из SR в окружающую цитоплазму. При сердечной недостаточности нарушения сократимости приводят, отчасти, к нарушениям сигнального каскада, который позволяет сердечному потенциалу действия (ПД (AP запускать сокращение. В частности, при сердечной недостаточности, амплитуда общеклеточного перехода Ca2+ снижена (Beuckelmann et al., Intracellular calcium handling in isolated ventricular myocytes from patients withheart failure. Circ, 85:1046-55, 1992). Известно, что сердечная аритмия, обычная характеристика сердечной недостаточности, ассоциирована с утечкой Ca2+ SR в структурно нормальных сердцах. В таких случаях, наиболее обычным механизмом индукции и поддержания желудочковой тахикардии является нарушенный автоматизм. Одна форма нарушенного автоматизма, известная как вызванная аритмия, ассоциирована с нарушенным высвобождением Ca2+ SR, который запускает отложенные пост-деполяризации, или DAD (Fozzard, H.A., Afterdepolarizations and triggered activity. Basic Res. Cardiol., 87:105-13, 1992; Wit and Rosen, Pathophysiologicmechanisms of cardiac arrhythmias. Am. Heart J., 106:798-811, 1983). DAD представляют собой нарушенные деполяризации в кардиомиоцитах, которые возникают после реполяризации потенциала действия сердца. Молекулярная основа нарушенного высвобождения Ca2+ SR, которое приводит к DAD, полностью не ясна. Однако, известно, что DAD блокируются рианодином, обеспечивая доказательство того,что RyR2 может играть ключевую роль в патогенезе такого нарушенного высвобождения Ca2+ (Marban etInvest., 78:1185-92, 1986; Song and Belardinelli, ATP promotes development of afterdepolarizations and triggered activity in cardiac myocytes. Am. J. Physiol., 267:H2005-114, 1994). Наиболее частой сердечной аритмией у людей является фибрилляция предсердий (ФП (AF. Она представляет собой главную причину заболеваемости и смертности (Chugh et al., Epidemiology and naturalhistory of atrial fibrillation: clinical implications. J. Am. Coll. Cardiol., 37:371-78, 2001; Falk, R.H., Atrial fibrillation. N. Engl. J. Med., 344:1067-78, 2001). Несмотря на ее клиническую значимость, однако возможности лечения ФП ограничены отчасти из-за факта, что лежащие в ее основе молекулярные механизмы плохо известны. Приблизительно 50% всех пациентов с заболеваниями сердца умирают из-за смертельных сердечных аритмий. Такие смертельные сердечные аритмии часто являются желудочковыми по природе. В некоторых случаях, желудочковая аритмия в сердце может быстро стать смертельной, феномен, называемый как "внезапная кардиальная смерть" (ВКС (SCD. Смертельные желудочковые аритмии (и ВКС) также могут возникать в молодом возрасте, у в остальном здоровых людей, про которых известно, что они не имеют структурных заболеваний сердца. Действительно, желудочковая аритмия является наиболее частой причиной внезапной смерти у здоровых в остальном людей. Катехоламинергическая полиморфная желудочковая тахикардия (КПЖТ (CPVT является наследственным расстройством у пациентов со структурно нормальным сердцем. Она характеризуется стрессиндуцированной желудочковой тахикардией - смертельной аритмией, которая может вызвать ВКС. У-1 015010 пациентов с КПЖТ, физическая нагрузка и/или стресс индуцируют двунаправленные и/или полиморфные желудочковые тахикардии, которые приводят к ВКС в отсутствие определяемых структурных заболеваний сердца (Laitinen et al., Mutations of the cardiac ryanodine receptor (RyR2) gene in familial polymorphic ventricular tachycardia. Circulation, 103:485-90, 2001; Leenhardt et al., Catecholaminergic polymorphicnormal hearts. J. Am. Coll. Cardiol, 34:2035-42,1999). КПЖТ является преимущественно наследуемой по аутосомно-доминантному типу. Пациенты с КПЖТ имеют желудочковые аритмии при воздействии физической нагрузки, но не имеют аритмий в покое. Анализ групп сцепления и прямое секвенирование определили мутации в человеческом генеcauses malignant polymorphic ventricular tachycardia in structurally normal hearts. J. Am. Coll. Cardiol.,34:2035-42,1999). Существует три типа рецепторов рианодина, все из которых являются высоко связанными с Ca2+ каналами. RyR1 обнаруживают в скелетных мышцах, RyR2 обнаруживают в сердце и RyR3 располагается в головном мозге. Рецептор рианодина 2 типа (RyR2) является главным каналом, высвобождающимCa2+, необходимый для EC связывания и мышечного сокращения в поперечно-полосатой мышце сердца. Каналы RyR2 упакованы в плотные массивы в специализированных участках SR, которые высвобождают внутриклеточные запасы Ca2+, и таким образом запускают мышечное сокращение (Marx et al.,Coupled gating between individual skeletal muscle Ca2+ release channels (ryanodine receptors). Science,281:818-21, 1998). Во время EC соединения, деполяризация мембран клеток сердечной мускулатуры, в нулевой фазе ПД, активирует потенциалзависимые Ca2+ каналы. Напротив, приток Ca2+ через эти каналы вызывает высвобождение Ca2+ из SR посредством RyR2, в процессе, известном как Ca2+-индуцированное высвобождение Ca2+ (Fabiato, A., Calcium-induced release of calcium from the cardiac sarcoplasmic reticulum.Am. J. Physiol, 245.-C1-C14, 1983; Nabauer et al., Regulation of calcium release is gated by calcium current,not gating charge, in cardiac myocytes. Science, 244:800-03, 1989). Опосредованное RyR2, Ca2+индуцированное высвобождение Ca2+ затем активирует сократительные белки, которые ответственны за сокращение сердечной мышцы.RyR2 является комплексом белков, включающим четыре полипептида RyR2 по 565000-дальтон в связи с четырьмя белками, связывающими FK506, из 12000-дальтон (FKBP), особенно FKBP12.6 (кальстабин). FKBP являются цис-транс пептидилпролилизомеразами, которые широко экспрессируются, и обеспечивают множество клеточных функций (Marks, A.R., Cellular functions of immunophilins. Physiol.Rev., 76:631-49, 1996). Белки FKBP12 тесно связаны и регулируют функцию скелетного рецептора рианодина, RyR1 (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function byFK506-binding protein. Cell, 77:513-23, 1994; Jayaraman et al., FK506 binding protein associated with the calcium release channel (ryanodine receptor). J. Biol. Chem., 267:9474-77, 1992); сердечного рецептора рианодина RyR2 (Kaftan et al., Effects of rapamycin on ryanodine receptor/(Ca2+)-release channels from cardiacmuscle. Circ. Res., 78:990-97, 1996); связанного внутриклеточного высвобождающего Ca2+ канала, известного как рецептор инозитол 1,4,5-трифосфата 1 типа (IP3R1) (Cameron et al., FKBP12 binds the inositol 1,4,5-trisphosphate receptor at leucine-proline (1400-1401) and anchors calcineurin to this FK506-like domain.J. Biol Chem., 272:27582-88, 1997); и рецептора трансформирующего фактора роста(TGF) I типаFKBP12.6 связывается с каналом RyR2 (одна молекула на субъединицу RyR2), стабилизирует функцию канала RyR2 (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function by FK506binding protein. Cell, 77:513-23, 1994), и облегчает сочетанное открытие между соседними каналами RyR2Science, 281:818-21, 1998), таким образом предотвращая нарушенную активацию канала в течение фазы покоя сердечного цикла. Очевидно, что утечка в каналах RyR2 ассоциирована с рядом патологических состояний как в больных, так и в структурно-нормальных сердцах. Соответственно, способы для восстановления утечки вRyR2 могут лечить или предотвращать сердечную недостаточность, сердечные аритмии и внезапную кардиальную смерть у миллионов пациентов. Производное 1,4-бензотиазепина JTV-519, или моногидрохлорид 4-[3-(4-бензилпиперидин-1 ил)пропионил]-7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина (также известный как k201 или ICPCalstan 100), является новым модулятором кальциевых каналов. Кроме того, для регуляции уровня Ca2+ в-2 015010 клетках миокарда, JTV-519 также модулирует ток Na+ и внутринаправленный вентильный ток K+ в желудочковых клетках морских свинок, и ингибирует отложенный вентильный ток K+ в клетках предсердий морских свинок. Исследования показали, что JTV-519 обладает сильным кардиопротективным эффектом в отношении катехоламин-индуцированного повреждения миокарда, чрезмерного сокращения миофибрилл, индуцированного повреждением миокарда, и ишемически/реперфузионного повреждения. В экспериментальной модели чрезмерного сокращения миофибрилл JTV-519 продемонстрировал большие кардиопротективные эффекты, чем пропранолол, верапамил и дилтиазем. Экспериментальные данные также предполагают, что JTV-519 эффективно предотвращает ишемию/реперфузию желудочков посредством снижения уровня нагрузки внутриклеточным Ca2+ в моделях на животных. Краткое изложение сущности изобретения Настоящее изобретение основано на удивительном открытии, что RyR2 является мишенью для разработки способов лечения и предотвращения сердечной недостаточности и сердечных аритмий, включая фибрилляцию предсердий, желудочковые аритмии и сердечные аритмии, индуцированные физической нагрузкой. Как описано в настоящем описании, авторы изобретения создали мутантные каналы RyR2 с 7 различными мутациями КПЖТ, и изучали их функции. Все 7 мутантов имели функциональные дефекты,которые приводили к тому, что каналы становились протекающими (утечка кальция) при стимуляции во время физической нагрузки. Исследование авторов является первым для определения механизма, посредством которого утечка кальция SR вызывает DAD. Замечательно, что дефект в мутантных каналах КПЖТ приводит к тому, что каналы выглядят как протекающие каналы в сердцах у пациентов с конечной стадией сердечной недостаточности расстройством, характеризующимся высокой частотой фатальных сердечных аритмий. Следовательно, авторы изобретения показали, что механизм для ЖТ при КПЖТ является таким же, как механизм для ЖТ при сердечной недостаточности. Авторы также показывают в настоящем описании, что JTV-519 (k201 или ICP-Calstan 100), и другие новые производные 1,4-бензотиазепина восстанавливают утечку в каналах RyR2. Как показали авторы изобретения, JTV-519 и связанные производные усиливают связывание FKBP12.6 с PKAфосфорилированным RyR2, и с мутантным RyR2s, который иным образом имеет сниженное сродство к или не связывается с FKBP12.6. Такое действие определяет утечку в RyR2, что в свою очередь запускает смертельные сердечные аритмии (внезапную кардиальную смерть (ВКС и вносит вклад в фибрилляцию предсердий/желудочков и дисфункцию сердечной мышцы при сердечной недостаточности. Соответственно, в одном аспекте настоящее изобретение относится к новым производным 1,4 бензотиазепина общей формулы (a) где R = арил, алкенил, алкил, -(CH2)nNR'2, или -(CH2)nSR', и n = 0, 1, 2 или 3, и R1 = алкил или циклоалкил; или их окисленным производным. В другом аспекте настоящее изобретение относится к производным 1,4-бензотиазепина общей формулы (b) где R = арил, алкенил, алкил, -(CH2)nNR'2 или -(CH2)nSR', и n = 0, 1, 2 или 3, и R' = алкил или циклоалкил; или их окисленным производным. В следующем аспекте настоящее изобретение относится к производным 1,4-бензотиазепина общей формулы (c)SO2NH(CH2)nSR', и n = 1, 2 или 3, и R'= алкил или циклоалкил; и где m = 1 или 2; или их окисленным производным. В следующем аспекте настоящее изобретение относится к производным 1,4-бензотиазепина общей формулы (d)X = NH или 0; или их окисленным производным. В следующем аспекте настоящее изобретение относится к производным 1,4-бензотиазепина общей формулы (e)R' = алкил, арил, или H; где R2 = алкил, или арил; и где R3 = H или арил; или их окисленным производным. В следующем аспекте настоящее изобретение относится к производным 1,4-бензотиазепина общей формулы (f) где R1 = H, OR', SR', N(R')2, алкил, или галоид, в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил, или ацил; где R2 = алкенил, или арил; где R3 = алкил, алкенил, или арил; где m = 0,1, или 2; и где n = 0 или 1; или их окисленным производным. В следующем аспекте настоящее изобретение относится к производным 1,4-бензотиазепина общей формулы (g)O, S, или I; и где m =0, 1, или 2; или их окисленным производным. В следующем аспекте настоящее изобретение относится к производным 1,4-бензотиазепина, выбранным из группы: и их окисленным производным. В предпочтительном варианте предложенное изобретение относится к соединению формулыm = 0, 1, или 2; или его окисленному производному. В предпочтительном варианте предложенное изобретение относится к соединению формулы (g),где R1 = OR' в положении 7 бензотиазепинового кольца, m = 0 или 1, и R' = алкил. Наиболее предпочтительны соединения формулы (g), в которых R2 = H, и R3 = H. Еще более предпочительны соединения формулы (g), в которых R4 = карбоновая кислота, или алкил, содержащий I, иR' = метил. В предпочтительном варианте предложенное изобретение относится к соединению формулы S36 или его окисленному производному. В другом аспекте предложенное изобретение относится к фармацевтической композиции, включающей одно из соединений настоящего изобретения, перечисленных выше, и фармацевтически приемлемый носитель, добавку или разбавитель. В предпочтительном варианте фармацевтическая композиция дополнительно содержит один или более компонентов, представляющих собой антиоксидант, краситель, ароматизатор, консервант, подсластитель, связывающий агент или смазывающий агент, при этом носитель представляет собой карбоксиметилцеллюлозу, кристаллическую целлюлозу, глицерин, гуммиарабик, лактозу, стеарат магния, метилцеллюлозу, солевой раствор, альгинат натрия, сахарозу, крахмал, тальк или воду, и фармацевтическая композиция находится в форме капсулы, таблетки, порошка, гранулы или суспензии. В другом аспекте предложенное изобретение относится к способу ограничения или предотвращения снижения уровня RyR2-связанного FKBP 12.6 у субъекта, который страдает заболеванием сердца,где указанный способ включает введение субъекту эффективного количества соединения настоящего изобетения или его окисленного производного. В другом аспекте предложенное изобретение относится к способу лечения или предотвращения заболевания сердца у субъекта, включающему введение субъекту эффективного количества соединения настоящего изобретения или его окисленного производного. В предпочтительном варианте заболевание сердца представляет собой сердечную аритмию, тахикардию, предсердную аритмию, предсердную тахиаритмию, фибрилляцию предсердий, постоянную фибрилляцию предсердий, непостоянную фибрилляцию предсердий, желудочковую аритмию, фибрилляцию желудочков, вентрикулярную тахикардию, постоянную вентрикулярную тахикардию, непостоянную вентрикулярную тахикардию, катехоламинергическую полиморфную желудочковую тахикардию (CPVT),сердечную недостаточность, внезапную кардиальную смерть или кардиальную смерть, индуцированную физической нагрузкой. Предпочтительно соединение выбирают из группы, состоящей из соединений 21, Ia, II, III, SI, S4,S6, S7, S20, S36 или его окисленного производного. В другом аспекте предложенное изобретение относится к способу предупреждения сердечной аритмии у субъекта, включающий введение субъекту эффективного количества средства, представляющего собой соединение формулы:R4 = галоид, карбоновая кислота, или алкил, содержащий O, S, или I; и m = 0, 1, или 2; или соединение, выбранное из группы, содержащей соединения: 21, Ia, II, III, SI, S4, S6, S7, S20, S24,S25, S26, S27, S36 или его окисленные производные. Предпочтительно, когда в перечисленных выше способах лечения субъект является человеком и эффективное количество соединения определяется как одно или более нижеследующих условий:(a) от примерно 5 до примерно 20 мг/кг/день,(b) количество, обеспечивающее концентрацию в плазме субъекта от примерно 0,02 до примерно-6 015010 1,0 мкМ,(c) количество, обеспечивающее концентрацию в плазме субъекта от примерно 300 нг/мл до примерно 1000 нг/мл у субъекта,(d) количество, достаточное для повышения связывания FKBP 12.6 с RyR2 у субъекта, или(e) количество, эффективное для лечения или предотвращения заболевания сердца у субъекта. Предпочтительно соединение выбирают из группы, содержащей соединения 21, Ia, II, III, SI, S4, S6,S7, S20 и S36 или их окисленного производного. При этом наиболее предпочтительно соединение представляет собой соединение S36. В следующем аспекте предложенное изобретение относится к соединению, выбранному из группы,содержащей соединения S24, S25, S26, S27, и их окисленному производному, предназначенному для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациента, страдающего заболеванием сердца. В следующем аспекте предложенное изобретение относится к применению соединений согласно настоящему избретению и их окисленных производных для лечения или предотвращения заболевания сердца у субъекта. В следующем аспекте предложенное изобретение относится к применению соединений согласно настоящему избретению и их окисленных производных для приготовления лекарственного средства для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациента, страдающего заболеванием сердца, или для лечения или предотвращения заболевания сердца у субъекта. Предпочтительно заболевание сердца представляет собой сердечную аритмию, тахикардию, предсердную аритмию, предсердную тахикардию, фибрилляцию предсердий, постоянную фибрилляцию предсердий, непостоянную фибрилляцию предсердий, вентрикулярную фибрилляцию, вентрикулярную тахикардию, постоянную вентрикулярную тахикардию, непостоянную вентрикулярную тахикардию,катехоламинергическую полиморфную желудочковую тахикардию (CPVT), сердечную недостаточность,внезапную кардиальную смерть или кардиальную смерть, индуцированную физической нагрузкой. Предпочтительно субъектом является человек и соединение выбирают из группы, содержащей соединения 21, Ia, II, III, S1, S4, S6, S7, S20 и S36, или их окисленного производного. В следующем аспекте предложенное изобретение относится к применению соединений формулы (g)R4 = галоид, карбоновая кислота, или алкил, содержащий O, S, или I; и m = 0, 1, или 2; или соединений, выбранных из группы, состоящей из соединений: 21, Ia, II, III, SI, S4, S6, S7,S20,S24, S25, S26, S27, S36, или их окисленных производных, для предотвращения сердечной аритмии у субъекта. В следующем аспекте предложенное изобретение относится к применению формулы (g), где R1 = H, OR1, SR1, N(R')2, алкил, или галоид, в положении 6, 7, 8 или 9 бензотиазепинового кольца, и R' = алкил, арил, или ацил; где R2 = H, алкил, алкенил, или арил; R3 = H, алкил, алкенил, или арил;R4 = H, галоид, карбоновая кислота, или алкил, содержащий О, S, или I; и m = 0, 1, или 2; или соединений, выбранных из группы, состоящей из соединений: 21, Ia, II, III, SI, S4, S6, S7, S20,S24, S25, S26, S27,S36, или их окисленных производных, для приготовления лекарственного средства для предотвращения сердечной аритмии у субъекта. Предпочтительно субъектом является человек и соединение выбирают из группы, содержащей соединения 21, Ia, II, III, S1, S4, S6, S7, S20 и S36, или их окисленного производного. Наиболее предпочтительно соединение представляет собой соединение S36. В следующем аспекте предложенное изобретение относится к способу получения соединения формулы где R = арил, алкенил, алкил, - (CH2) nNR'2, или -(CH2)nSR', и n = 0, 1, 2, или 3, m = 0, 1 или 2, и R' = алкил или циклоалкил, где указанный способ включает стадии: производным сульфонилхлорида и основанием для получения соединения формулы(b) в случае необходимости, окисления соединения, полученного на стадии (a) для получения соединения формулы где m = 1 или 2. Предпочтительно соединение, полученное на стадии (a), представляет собой при этом способ дополнительно включает стадию (a-1) между стадией (a) и стадией (b), которая представляет собой обработку соединения, полученного на стадии (a) первичным или вторичным амином с образованием соединения формулы где R = -(CH2)nN (R')2; n = 2; и R' определен в п.1. В следующем аспекте предложенное изобретение относится к способу получения соединения формулы где R = арил, алкил, -(CH2)nNR'2,или -(CH2)nSR', и n = 0, 1, 2, или 3, и R' = алкил или циклоалкил X =NH или O, где указанный способ включает стадии обработки соединения формулы карбонилхлоридом в присутствии основания, и первичным или вторичным амином или спиртом,для получения соединения формулы В следующем аспекте предложенное изобретение относится к способу получения производного 2,3,4,5-тетрагидро-1,4-бензотиазепина, имеющего формулуR1 = алкил, арил, или H; где R2 = H, алкил, или арил; и где R3 =H, алкил, или арил, где указанный способ включает стадии: восстанавливающим агентом, необязательно в присутствии катализатора, для получения соединения формулы(b) обработки соединения, полученного на стадии (a) диазотирующим агентом и дисульфидом для получения соединения формулы(c) обработки соединения, полученного на стадии (b) активирующим агентом и хлорэтиламином для получения соединения формулы(d) обработки соединения, полученного на стадии (c) восстанавливающим агентом и основанием для получения соединения формулы(e) обработки соединения, полученного на стадии (d) восстанавливающим агентом для получения соединения формулы Дополнительные аспекты настоящего изобретения будут очевидны в свете следующего описания. Краткое описание чертежей Фиг. 1 демонстрирует, что JTV-519 предотвращает желудочковые аритмии, индуцированные физической нагрузкой, у мышей FKBP12.6+/-. (A) Характерные амбулаторные электрокардиограммы нелеченной мыши FKBP12.6+/-, мыши FKBP12. 6+/-, леченной JTV-519, и мыши FKBP12.6-/-, леченной JTV-519. Не было значительных различий в частоте сердечных сокращений или в любом из измеряемых параметров ЭКГ. (B) верхняя метка: пример постоянной полиморфной желудочковой тахикардии, записанной у нелеченной мыши FKBP12.6+/-, подвергнутой физической нагрузке и введению 1,0 мг/кг эпинефрина. Средняя метка: Электрокардиограмма мыши FKBPl2.6+/-, леченной JTV-519, после такого же протокола; не определяли аритмий. Нижняя метка: Желудочковая тахикардия (ЖТ), индуцированная физической нагрузкой, у мыши FKBPl2.6-/-, леченной JTV-519. Пунктирная линия представляет собой 16,31 с ЖТ,которые не показаны на чертеже. 'P' показывает P-волну, которая является показателем синусового ритма после желудочковой тахикардии. (C) Столбчатая диаграмма показывает количественное определение внезапной кардиальной смерти (слева), постоянных желудочковых тахикардии (10 ударов, середина), и непостоянных желудочковых тахикардии (3-10 неправильных ударов, справа) у мышей FKBP12.6+/- иFKBP12. 6-/-, или леченных или нелеченных JTV-519, соответственно. Должно быть отмечено, что лечение JTV-519 полностью предотвращает аритмии, индуцированные физической нагрузкой и эпинефрином, у мышей FKBP12. 6+/-, леченных JTV-519 (n = 9), по сравнению с нелеченными мышами FKBP12.6+/(n = 10) или JTV-519-леченными мышами FKBP12.6-/- (n = 5), предполагая, что JTV-519 предотвращает аритмии и внезапную смерть у мышей FKBP12.6+/- посредством повторного связывания FKBP12.6 сRyR2. Фиг. 2 показывает, что JTV-519 предотвращает внезапную кардиальную смерть, индуцированную физической нагрузкой (ВКС), увеличением сродства FKBP12.6 к RyR2 у мышей FKBP12. 6+/-. (A-B) Сердечные рецепторы рианодина (RyR2) метили иммунопреципитацией с использованием антитела RyR2-9 015010 5029. Показаны иммуноблоты (A) и столбчатые диаграммы (B) , представляющие собой выраженные количества RyR2, PKA-фосфорилированный RyR2 (антитело RyR2-pSer2809) , и FKBP12.6 у мышей дикого типа (FKBP12.6+/+), мышей FKBP12.6+/-, и FKBP12.6-/- в условиях отдыха, и после физической нагрузки, и в отсутствии и в присутствии JTV-519, соответственно. В условиях отдыха, 70% FKBP12.6 ассоциировано с RyR2 у мышей FKBP12. 6+/-. После тестирования физической нагрузки, количествоFKBP12.6, ассоциированное с комплексом RyR2, было значительно снижено у мышей FKBP12.6+/-, но это можно предотвратить лечением JTV-519. (C) Одиночные каналы RyR2 выделяли из сердец, полученных после физической нагрузки и инъекции эпинефрина. Показаны каналы от мышей FKBP12.6+/-, с и без предварительного лечения JTV-519, и каналы от мышей FKBP12.6-/- после предварительного леченияJTV-519. Необходимо отметить, что функция RyR2-канала нормализовывалась у мышей FKBP12.6+/- после физической нагрузки, леченных JTV-519. Характерный одиночный канал от мышей FKBP12.6-/- с физической нагрузкой после лечения JTV-519 показал, что FKBP12.6 в сердце требуется для действияJTV-519. Пунктирные линии представляют собой неполные отверстия канала или 'расщепленные' отверстия и являются показательными для каналов RyR2, лишенных FKBP12.6. Метки слева представляют собой 5,0 с, тогда как метки справа представляют собой 500 мс. На чертеже, Po = вероятность открытия;To = среднее время открытия; Tc = среднее время закрытия; и c = закрытое состояние канала. (D) Суммарная столбчатая диаграмма, показывающая вероятности открытия отдельных RyR2 каналов (см. выше). JTV-519 значительно снижает вероятность открытия RyR2 от мышей FKBPl2.6+/- после тестов с физической нагрузкой при диастолических концентрациях кальция (150 нМ). Фиг. 3 иллюстрирует, что JTV-519 нормализует открытие RyR2-канала путем увеличения связывающей аффинности FKBP12.6 к PKA-фосфорилированным RyR2 каналам. (A, B) Мембраны SR сердца собак (A) и рекомбинантно-экспрессируемые RyR2 каналы (B) получали, как описано ранее (Kaftan et al.,Effects of rapamycin on ryanodine receptor/Ca(2+)-release channels from cardiac muscle. Circ. Res., 78:990-97,1996). (A) Рецепторы рианодина (RyR2) фосфорилировали с помощью каталитической субъединицыPKA (40 ед; Sigma Chemical Co., St. Louis, MO), в присутствии или отсутствии ингибитора PKA, PKI5-24,в фосфорилирующем буфере (8 мМ MgCl2, 10 мМ EGTA, и 50 мМ Tris/PIPES; pH 6,8). Образцы центрифугировали при 100000g в течение 10 мин и промывали три раза в имидазольном буфере (10 мМ имидазола; pH 7). Рекомбинантно-экспрессируемый FKBP12.6 (конечная концентрация = 250 нМ) добавляли к образцам в отсутствии или присутствии различных концентраций JTV-519. После 60 мин инкубации образцы центрифугировали при 100000g в течение 10 мин и промывали дважды в имидазольном буфере. Образцы нагревали до 95C и фракционировали по размеру с использованием SDS-PAGE. Проводили иммуноблоттинг микросом SR, как описано ранее (Jayaraman et al., FK506 binding protein associated withFKBP12.6 связываться с: (A) PKA-фосфорилированным RyR2 (частичное связывание при 100 нМ; полное связывание при 1000 нМ) или (B) RyR2-S2809D мутантными каналами, которые являются по существу PKA-фосфорилированными RyR2 каналами. (C-E) Исследования отдельных каналов показали повышенную вероятность открытия RyR2 после фосфорилирования PKA (D), при сравнении с PKAфосфорилированием в присутствие специфического ингибитора PKA, PKI5-24 (C) . Функцию отдельного канала нормализовали в PKA-фосфорилированных RyR2, инкубированных с FKBP12.6 в присутствииJTV-519 (E). Отверстия каналов направлены вверх, штрих указывает на уровень полного открытия (4pA), и буква 'c' показывает закрытое состояние. Каналы показаны в сжатой (5 с, верхняя метка) и расширенной (500 мс, нижняя метка) временных шкалах, и записи проводили при 0 мВ. Гистограммы амплитуды (справа) выявили повышенную активность и расщепленные отверстия в PKA-фосфорилированныхRyR2, но не после лечения JTV-519 и FKBP12.6. (F) нормализованный график вероятности открытия, как функции цитозольного [Ca2+]. Инкубация PKA-фосфорилированного RyR2 с FKBP12.6 в присутствииJTV-519 сдвигала Ca2+-зависимую активацию RyR2 направо, делая ее подобной Ca2+-зависимости нефосфорилированных каналов. Фиг. 4 показывает, что JTV-519 улучшает сократимость сердца в модели сердечной недостаточности у крыс. (A) Площадь поперечного сечения миокарда в диастоле определяли на срединнопапиллярном уровне с использованием эхокардиографии до и после 4 недель лечения JTV-519 или растворителем (контроль). Относительное увеличение диастолической дисфункции ингибировали JTV-519.(B) Хотя систолическая функция ухудшена у нелеченных животных, JTV-519 существенно увеличивал систолическую функцию у крыс с постинфарктной (пост-ИМ) сердечной недостаточностью. Фиг. 5 демонстрирует, что JTV-519 увеличивает сродство кальстабина 2 (FKBP 12.6) к RyR2 у крыс с сердечной недостаточностью. Эквивалентные количества RyR2 подвергали иммунопреципитации с использованием анти-RyR2 антитела (A). Характерные иммуноблоты (A) и столбчатые диаграммы (B) показывают количество PKA фосфорилирование RyR2 в Ser2809 (В, слева) и количество кальстабина 2(FKBP12.6) (B, справа), связанного с RyR2 в различных экспериментальных группах. При сердечной недостаточности, RyR2 является существенно гиперфосфорилированным PKA (B, слева), что приводит к диссоциации кальстабина 2 (FKBP12.6) из комплекса канала (B, справа). Лечение JTV-519 приводило к- 10015010 нормализации и состоянию PKA-фосфорилирования RyR2, а также связыванию FKBP12.6 с RyR2. Количество экспериментов указано в столбиках. P0,05, CH vs. ложные; P0,05, CH+JTV-519 vs. CH. Фиг. 6 иллюстрирует, что JTV-519 нормализует открытие RyR2-канала при сердечной недостаточности. RyR2 каналы выделяли у крыс с симуляцией операции (ложные) или сердечной недостаточностью(CH). Характерные метки отдельных каналов показывают, что вероятность открытия RyR2-канала (Po) была существенно увеличена при сердечной недостаточности (среднее), по сравнению с ложнооперированными крысами (вверху). Лечение крыс с сердечной недостаточностью с помощью JTV-519 в течение 4 недель нормализовало вероятность открытия до уровня, подобного таковому у ложнооперированных животных. Для каждого состояния верхняя метка представляет собой 5000 мс и нижняя метка представляет собой 200 мс. Отверстия каналов направлены кверху, штрих показывает полный уровень открытия канала (4 pA), и 'c' указывает закрытое состояние каналов. Гистограммы амплитуды(справа) выявляют повышенную Po и расщепленные отверстия в RyR2 каналах при сердечной недостаточности. Фиг. 7 демонстрирует, что JTV-519 нормализует открытие RyR2 канала посредством увеличения связывания FKBP12.6 (кальстабина 2) с RyR2 каналами. (A) Каналы RyR2 дикого типа (RyR2-WT) былиPKA фосфорилированы в отсутствии или присутствии специфического ингибитора PKA PKI5-24, затем инкубированы с кальстабином 2 (FKBP12.6) в присутствии JTV-519 в указанных концентрациях. Иммуноблот RyR2 показывает равные количества RyR2 в образцах; иммуноблот кальстабина 2 показывает, чтоJTV-519 облегчает частичное (100 нМ) или полное (1000 нМ) повторное связывание кальстабина 2 сPKA-фосфорилированным RyR2. (B) RyR2-S2809D, который имитирует по существу PKAфосфорилированный RyR2, инкубировали с кальстабином 2 в присутствии указанных концентраций JTV519. Иммуноблот RyR2 показывает равные количества RyR2 в образцах; иммуноблоты кальстабина 2 показали, что JTV-519 облегчает частичное (100 нМ) или полное (1000 нМ) повторное связывание кальстабина 2 с RyR2-S2809D. (C) Кривые связывания [35S]-меченого кальстабина 2 показали, что JTV-519 увеличивает связывающее сродство кальстабина 2 с PKA-фосфорилированным RyR2 и мутантным RyR2S2809D каналами, до уровня, сравнимого с нефосфорилированным RyR2-WT. (D-F) исследования отдельных каналов показали, что JTV-519 (1 мкМ) снижает вероятность открытия (Po) PKA-фосфорилированного RyR2WT посредством повторного связывания кальстабина 2 при 150 нМ [Ca2+] (n = 11 для D; n = 12 для E; n = 13 для F). Отверстия каналов направлены вверх, штрих указывает уровень полного открытия канала (4 pA), и 'c' показывает закрытое состояние каналов. Гистограммы амплитуды (справа) выявили повышенную Po и расщепленные отверстия в PKA-фосфорилированных RyR2; это не наблюдали после лечения JTV-519(1 мкМ) и кальстабином 2 (FKBP 12.6). Фиг. 8 иллюстрирует макромолекулярный комплекс RyR2 в ткани предсердия. (A) RyR2 получали иммунопреципитацией из саркоплазматической сети (SR) предсердия и фосфорилировали PKA или циклическим аденозинмонофосфатом (цАМФ). Добавление ингибитора PKA (PKI) полностью блокировало реакцию фосфорилирования. (B) Компоненты макромолекулярного комплекса RyR2 совместно иммунопреципитировали с RyR2 из SR предсердий. Положительным контролем был SR предсердий (с 50% мощностью иммунопреципитации (IP. Отрицательный контроль представляет собой образцы, иммунопреципитированные с антителами, блокированными антигенным пептидом. (C) Кальстабин 2 (FKBP12.6) совместно иммунопреципитировали с RyR2 из SR предсердий. Перед фракционированием по размеру посредством SDS PAGE, образцы фосфорилировали PKA в присутствии и отсутствии PKI. Фосфорилирование PKA вызывало диссоциацию кальстабина 2 (FKBP12.6) из комплекса канала, таким образом, ингибируемым PKI. +Конт. (CSR) = SR предсердий; +Конт. (FKBP) рекомбинантный FKBP; -Конт. = IP,проводимая с антителом, с предварительным поглощением антигенного пептида. Фиг. 9 показывает PKA-гиперфосфорилирование RyR2 при фибрилляции предсердий (ФП) . (A) иммунопреципитированные (IP) RyR2 от контрольных животных (Контроль; n = 6) и собак с фибрилляцией предсердий (A Fib; n = 6) фосфорилировали PKA. Для экспериментов обратного фосфорилирования, параллельно проводили иммуноблоттинг RyR2, с целью определения количества белка RyR2, которое было иммунопреципитировано в каждом образце. Столбчатая диаграмма слева представляет собой количественное определение исследований обратного фосфорилирования. Значения представляют собой относительную степень PKA-фосфорилирования RyR2, приведенную для количества иммунопреципитированного белка. У собак с ФП было показано увеличение на 130% PKA фосфорилирования, по сравнению с контролем (n = 6 для ФП; n = 6 для контроля; P = 0,001). Кальстабин 2 (FKBP12.6) совместно иммунопреципитировали с RyR2. Для экспериментов совместной иммунопреципитации иммуноблот дляRyR2 проводили параллельно с целью определить количество белка RyR2, которое было иммунопреципитировано из каждого образца. Столбчатая диаграмма справа представляет собой количественное определение экспериментов совместной иммунопреципитации. Значения представляют собой количество кальстабина 2 (FKBP12.6), совместно иммунопреципитированное с RyR2, скорректированное с количеством иммунопреципитированного белка. Связывание кальстабина 2 (FKBP12.6) с RyR2 показало снижение ФП у собак на 72%, по сравнению с контролем (n = 6 для контрольной группы; n = 7 для ФП; P0,0005).(B) Такую же серию экспериментов проводили с использованием человеческой ткани предсердий от па- 11015010 циентов с фибрилляцией предсердий в условиях сердечной недостаточности (A Fib; n = 5) и ткани предсердий от пациентов со здоровыми сердцами (Контроль; n = 3). Столбчатая диаграмма слева представляет собой количественное определение исследования обратного фосфорилирования. У людей с ФП показано увеличение на 112% PKA фосфорилирования, по сравнению с контролем (n = 5 для A Fib; n = 3 для контроля; P = 0,002). Столбчатая диаграмма справа представляет собой результаты экспериментов совместной иммунопреципитации кальстабина 2 (FKBP12.6). У людей с ФП показано снижение на 70% количества кальстабина 2 (FKBP12.6), связанного с RyR2 (n = 5 для A Fib; n = 3 для контроля; P0,0001). Фиг. 10 иллюстрирует нарушенную функцию RyR2-канала при ФП. (A) Верхние метки показывают характерные RyR2 каналы из левого предсердия контрольной группы; нижние метки являются каналами ФП. Справа от меток находятся соответствующие гистограммы существующей амплитуды. (B) Столбчатые диаграммы показывают количественное определение вероятности открытия (Po) и частоты открытия(Fo) для контрольных собак (Конт.) и собак с хронической фибрилляцией предсердий (A Fib) . Исследовали 17 каналов от 5 собак A Fib, и 11 каналов от 5 контрольных собак. Каналы от контрольных собак не продемонстрировали повышенной активности. Наоборот, 15 из 17 каналов (88%) от собак A Fib показали значительно увеличенную вероятность открытия (ФП: 0,3 90,07; контроль: 0,0090,002; P0,001) и частоту пропускания (ФП: 21,94,6 c-1; контроль: 1,6 + 0,6 c-1; P0,002). Фиг. 11 демонстрирует, что лечение JTV-519 восстанавливает нормальную функцию RyR2 при ФП.(A) Характерные метки отдельных RyR2 каналов из сердец собак, при концентрации цитозольного Ca2+ 150 нМ (что имеется во время диастолы) и в присутствии 0,25 мМ кальстабина 2 (FKBP12.6), демонстрируют значительно повышенную вероятность открытия (Po) и частоту пропускания после PKA фосфорилирования (контроль: Po = 0,30,2%, n = 6; PKA: Po = 14,83,2%, n = 7; Р 0,001). Как видно при более высоком разрешении во времени в нижней метке и во всеточечных гистограммах PKA фосфорилирование RyR2 приводит к частичным открытиям (расщепленные состояния), которые наблюдаются, когда кальстабин 2 (FKBP12.6) диссоциирует из RyR2. JTV-519 (1,0 мМ) восстанавливает активность каналаRyR2; JTV-519 также приводил к прерывистому распределению существующих амплитуд в гистограмме,как видно в нефосфорилированных контрольных каналах. Верхние и нижние метки представляют собой 5000 и 200 мс, соответственно; закрытое состояние указано как 'c'; полное открытие каналов показано как направленные вверх изгибы до уровня 4 pA, что указано столбиками; пунктирные линии в нижних метках указывают 1 pA стадии частичных открытий. (B) Рекомбинантный кальстабин 2 (FKBP12.6) инкубировали с PKA-фосфорилированными RyR2, в присутствии или отсутствии производного 1,4 бензотиазепина, JTV-519. Иммуноблоттинг с антикальстабин 2 антителом выявил, что JTV-519 позволяет рекомбинантному кальстабину 2 (FKBP12.6) связываться с PKA-фосфорилированным RyR2. В отсутствие JTV-519, связывание кальстабина 2 не возникало. Фиг. 12 показывает, что новые производные 1,4-бензотиазепина индуцируют связывание кальстабина 2 (FKBP12.6) с PKA-фосфорилированным рецептором рианодина в сердце (RyR2) при 0,5 нМ. Верхняя панель = 2,0 нМ каждого соединения; нижняя панель = 0,5 нМ каждого соединения. Фиг. 13 показывает, что производное 1,4-бензотиазепина, S36 (изображенное на фиг. 15) предотвращает сердечные аритмии у мышей при 200 нМ. Столбчатые диаграммы иллюстрируют аритмические эпизоды или внезапную кардиальную смерть в течение исследования физической нагрузки у мышейFKBPl2.6+/- - с или без лечения лекарственным средством, как указано. Левый график иллюстрирует внезапную кардиальную смерть; средний график иллюстрирует постоянную ЖТ; и правый график иллюстрирует непостоянную ЖТ. Числа относятся к общему количеству животных, используемых в каждой группе. Фиг. 14 демонстрирует, что JTV-519 улучшает сократимость сердца в модели сердечной недостаточности у крыс. Фиг. 15 показывает структуры производных. Подробное описание изобретения Фосфорилирование сердечного RyR2 протеинкиназой (PKA) является важной частью ответа "борьбы или полета"; оно увеличивает прирост EC-связывания в сердце, облегчая высвобождение количестваCa2+ для данного запуска (Marks, A.R., Cardiac intracellular calcium release channels: role in heart failure.Circ. Res., 87:8-11, 2000). Такой сигнальный путь обеспечивает механизм, посредством которого активация симпатической нервной системы в ответ на стресс приводит к повышенному сердечному выбросу,требуемому для соответствия метаболическим потребностям ответа на стресс. При связывании катехоламинов, 1- и 2-адренергические рецепторы активируют аденилилциклазу посредством стимулирующего G-белка, Gs. Аденилилциклаза увеличивает уровень внутриклеточного циклического аденозинмонофосфата (цАМФ), который активирует цАМФ-зависимую PKA. PKA-фосфорилирование RyR2 увеличивает вероятность открытия канала посредством диссоциации кальстабина 2 (FKBP12.6) из комплекса канала. Это, в свою очередь, увеличивает чувствительность RyR2 к Ca2+-зависимой активации (Hain etCell, 101:365-76, 2000). Сердечная недостаточность (например, у пациентов с сердечной недостаточностью и в моделях сердечной недостаточности у животных) характеризуется неадекватным ответом, который включает хроническую гиперадренергическую стимуляцию (Bristow et al., Decreased catecholamine sensitivity andbeta-adrenergic-receptor density in failing human hearts. N. Engl. J. Med., 307:205-11, 1982). Патогенетическая значимость такой стимуляции при сердечной недостаточности поддерживается терапевтическими стратегиями, которые снижают бета-адренергическую стимуляцию и сокращение стенки левого желудочка, и эффективно обращает ремоделирование желудочка (Barbone et al., Comparison of right and leftof heart failure. Circulation, 94:2285-96, 1996). При сердечной недостаточности хроническая бетаадренергическая стимуляция ассоциирована с активацией бета-адренергических рецепторов в сердце,которая, посредством связывания с G-белками, активирует аденилилциклазу и таким образом увеличивает внутриклеточную концентрацию цАМФ. ЦАМФ активирует цАМФ-зависимую PKA, про которую показано, что она индуцирует гиперфосфорилирование RyR2. Следовательно, хроническая сердечная недостаточность является хроническим гиперадренергическим состоянием (Chidsey et al., AugmentationPKA-гиперфосфорилирование RyR2 было предложено как фактор, участвующий в снижении сократительной функции и развитии аритмий при сердечной недостаточности (Marks et al., Progression of heart(ryanodine receptor): defective regulation in failing hearts. Cell, 101:365-76, 2000). Согласуясь с этой гипотезой, PKA-гиперфосфорилирование RyR2 при сердечной недостаточности было продемонстрировано invivo, и в моделях на животных и у пациентов с сердечной недостаточностью, подвергнувшихся трансплантации сердца (Antos et al., Dilated cardiomyopathy and sudden death resulting from constitutive activationa mouse model. J. Clin. Invest., 109:1013-20, 2002; Yano et al., Altered stoichiometry of FKBP12.6 versus ryanodine receptor as a cause of abnormal Ca2+ leak through ryanodine receptor in heart failure. Circulation,102:2131-36, 2000). При сердечной недостаточности гиперфосфорилирование RyR2 PKA индуцирует диссоциацию регуляторной субъединицы FKBP12.6 из канала RyR2 (Marx et al., PKA phosphorylation dissociatesFKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation in failing hearts. Cell,101:365-76, 2000). Это вызывает заметные изменения в биофизических свойствах RyR2 канала. Такие изменения подтверждаются увеличенной вероятностью открытия (Po) из-за повышенной чувствительности к Ca2+-зависимой активации (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor)function by FK506-binding protein. Cell, 77:513-23, 1994; Kaftan et al., Effects of rapamycin on ryanodine receptor/Ca2+-release channels from cardiac muscle. Circ. Res, 78:990-97, 1996); дестабилизации канала, приводящей к расщепленному состоянию; и нарушенного связанного пропускания каналов, приводящего к нарушенному EC связыванию и кардиальной дисфункции (Marx et al., Coupled gating between individualskeletal muscle Ca2+ release channels (ryanodine receptors). Science, 281:818-21, 1998). Следовательно, PKAгиперфосфорилированные RyR2 являются очень чувствительными к стимуляции низким уровнем Ca2+, и это проявляется само по себе как утечка Ca2+ SR через гиперфосфорилированный канал. Неадекватный ответ на стресс при сердечной недостаточности приводит к истощению FKBP12.6 из макромолекулярного комплекса канала. Это приводит к сдвигу влево в чувствительности RyR2 к Ca2+индуцированному высвобождению Ca2+, приводя к каналам, которые являются более активными при низком-среднем [Ca2+] (Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium releaseabnormal Ca2+ leak through ryanodine receptor in heart failure. Circulation, 102:2131-36, 2000). В течение времени повышенная "утечка" через RyR2 приводит к переустановке содержания Ca2+ SR на более низ- 13015010 ком уровне, который в свою очередь снижает прирост EC связывания и участвует в нарушенной систолической сократимости (Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium releasechannel (ryanodine receptor): defective regulation in failing hearts. Cell, 101:365-76, 2000). Субпопуляция каналов RyR2, которая является особенно "протекающей", может высвобождать Ca2+SR в течение фазы отдыха сердечного цикла, диастолы. Это приводит к деполяризации мембран кардиомиоцитов, известной как отложенные постдеполяризации (DAD), о которых известно, что они запускают смертельные сердечные аритмии (Wehrens et al., FKBP12.6 deficiency and defective calcium release channel(ryanodine receptor) function linked to exercise-induced sudden cardiac death. Cell, 113:829-40, 2003). В нормальных по структуре сердцах, подобный феномен может быть в действии. В особенности известно, что физическая нагрузка и стресс индуцируют высвобождение катехоламинов, которые активируют бета-адренергические рецепторы в сердце. Активация бета-адренергических рецепторов приводит к гиперфосфорилированию RyR2 каналов. Доказательства также предполагают, что гиперфосфорилирование RyR2, возникающее в результате активации бета-адренергических рецепторов, делает мутированныеRyR2 каналы более способными к открытию в фазе расслабления сердечного цикла, увеличивая вероятность аритмий. Авторы изобретения показали в данном описании, что JTV-519 предотвращает сердечную недостаточность в модели пост-ИМ сердечной недостаточности у крыс. В такой модели на животных JTV-519 улучшает функцию сердца в отношении сниженной диастолической дисфункции и улучшенной систолической функции. Более того, авторы изобретения продемонстрировали, что скелетно-мышечная формаRyR канала, RyR1, также является неисправной (или протекающей) в скелетных мышцах при сердечной недостаточности, из-за PKA-гиперфосфорилирования (Reiken et al., PKA phosphorylation dissociatesfailure. J. Cell Biol, 160:919-28, 2003). Следовательно, ожидают, что JTV-519 также будет улучшать скелетно-мышечную функцию у пациентов с сердечной недостаточностью. Как таковой, JTV-519 обеспечивает новый терапевтический подход к лечению двух основных симптомов сердечной недостаточности ранней утомляемости и одышки, которые вызваны скелетно-мышечной слабостью в конечностях и диафрагме, соответственно. Как обсуждалось выше, катехоламинергическая полиморфная желудочковая тахикардия (КПЖТ) представляет собой наследственное заболевание у людей со структурно нормальными сердцами. Она характеризуется желудочковой тахикардией, индуцированной стрессом, смертельной аритмией, которая может вызвать внезапную кардиальную смерть (ВКС). Мутации в RyR2 каналах, расположенных на саркоплазматической сети (SR), были связаны с КПЖТ. Все пациенты с КПЖТ имеют сердечные аритмии, индуцированные физической нагрузкой. Авторы изобретения ранее показали, что аритмии, индуцированные физической нагрузкой, и внезапная смерть (у пациентов с КПЖТ) возникает в результате сниженной афинности FKBP12.6 к RyR2. Далее авторы изобретения продемонстрировали, что физическая нагрузка активирует RyR2 в результате фосфорилирования аденозин-3',5'-монофосфатзависимой протеинкиназы (PKA). Для определения молекулярных механизмов, лежащих в основе смертельных сердечных аритмий при КПЖТ, авторы изобретения изучали КПЖТ-ассоциированные мутантные RyR2 каналы (например,S2246L, R2474S, N4104K, R4497C). Мутантные RyR2 каналы, которые имели нормальную функцию в плоских липидных слоях в основных условиях, были более чувствительными к активации посредствомPKA фосфорилирования, проявляя повышенную активность (вероятность открытия) и удлиненное состояние открытия, по сравнению с каналами дикого типа. Кроме того, PKA-фосфорилированные мутантные RyR2 каналы были устойчивыми к ингибированию Mg2+, физиологическим ингибитором RyR2 каналов и проявляли сниженное связывание с FKBP12.6 (который стабилизирует канал в закрытом состоянии). Такие открытия указывают, что во время физической нагрузки, когда RyR2 каналы являются PKAфосфорилированными, мутантные КПЖТ каналы более вероятно открываются в фазе расслабления сердечного цикла (диастоле), увеличивая вероятность возникновения аритмий, запускаемых утечкой Ca2+SR. Так как сердечная недостаточность является основной причиной смерти во всем мире, способы для борьбы с утечкой RyR2 смогут предотвратить смертельные аритмии у миллионов пациентов. Авторы изобретения, кроме того, продемонстрировали, что экспериментальное лекарственное средство, JTV-519, производное 1,4-бензотиазепина, предотвращает смертельные желудочковые аритмии у мышей, гетерозиготных по гену FKBP12.6. Недавно было показано, что JTV-519 снижает диастолическую утечку Ca2+ SR в модели сердечной недостаточности у животных (Yano et al., FKBP12.6-mediatedgating of ryanodine receptor in heart failure. Am. J. Physiol. Heart Circ. Physiol, 14:14, 2002). В настоящем исследовании, авторы изучали эффективность и механизм действия JTV-519 в модели сердечной аритмии. Для своих экспериментов in vivo авторам исследования требовались граммовые количества JTV-519(4-[3-(4-бензилпиперидин-1-ил)пропионил]-7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепинмоногидрохлорида). Для изучения сердечных аритмий мышей FKBP12.6+/- и FKBP12.6-/- подвергали ранее описанному- 14015010 протоколу физической нагрузки (Wehrens et al., FKBP12.6 deficiency and defective calcium release channelet al., Ankyrin-B mutation causes type 4 long-QT cardiac arrhythmia and sudden cardiac death. Nature, 421:63439, 2003). Тогда как у 88% мышей FKBP12. 6+/- (7 из 8) проявились желудочковые тахиаритмии (ЖТ) или синкопальные события во время протокола, ни у одной из мышей FKBP12.6+/- (0 из 6), предварительно пролеченных JTV-519 не развились аритмии или синкопальные события (фиг. 1). Более того, 90% мышейFKBP12.6+/-(9 из 10) умерли во время или после физической нагрузки, тогда как ни одна из мышейFKBP12.6+/-, леченных JTV-519 (0 из 9) не умерла (фиг. 1C) . В противоположность предварительно леченным мышам FKBP12.6+/- у 100% мышей FKBP12.6-/- (5 из 5), леченных JTV-519, развились ЖТ во время протокола стресса и они умерли, несмотря на лечение JTV-519 (фиг. 1C). Вместе эти данные предполагают, что FKBP12.6 требуется для антиаритмического действия JTV-519. С целью дальнейших характеристик антиаритмических свойств JTV-519 авторы изобретения подвергали мышей FKBP12.6+/+, FKBP12.6+/- и FKBP12.6-/- протоколам программируемой электрической стимуляции. ЖТ индуцировали быстрым искусственным ускорением сердечного ритма у 71% мышейFKBP12.6+/- (5 из 7), но не у мышей дикого типа FKBP12.6+/+ (P0,05, n = 5), после инъекции 0,5 мг/кг изопротеренола. Мыши FKBP12.6+/-, предварительно леченные JTV-519 (0,5 мг/кг/ч), были достоверно менее подвержены ЖТ, индуцированным искусственным ускорением сердечного ритма, по сравнению с нелеченными мышами FKBP12.6+/- (1 из 7 vs. 5 из 7; P0,05). Наоборот, у 67% мышей FKBP12.6-/- (4 из 6), предварительно леченных JTV-519, развились ЖТ во время искусственного ускорения сердечного ритма. ЖТ могли быть индуцированы одиночной ранней экстрасистолой у 71% мышей FKBP12.6+/- (5 из 7). ЖТ не наблюдали у 7 мышей FKBP12.6+/-, предварительно леченных JTV-519. С использованием протокола двойной ранней экстрасистолы (S1-S2-S3), ЖТ воспроизводимо индуцировали у 100% нелеченных мышей FKBP12.6+/- (7 из 7). Лечение JTV-519 полностью устраняло индуцируемые ЖТ у мышейFKBP12.6+/- (7 из 7). Лечение JTV-519 не предотвращало ЖТ у мышей FKBP12.6-/-, поддерживая концепцию, что FKBP12.6 требуется для антиаритмического действия JTV-519. Ранее авторы изобретения продемонстрировали, что PKA фосфорилирование RyR2 на Ser2809 вызывает диссоциацию FKBP12.6 из RyR2 канала (Marx et at, PKA phosphorylation dissociates FKBP12.6from the calcium release channel (ryanodine receptor): defective regulation in failing hearts. Cell, 101:365-76,2000). В настоящем исследовании предварительное лечение JTV-519 (0,5 мг/кг/ч) не влияло на степеньFKBP12.6+/+, комплексы RyR2 от мышей FKBP12.6+/- были достоверно более обеднены FKBP12.6 после физической нагрузки (P0,05). Предварительное лечение JTV-519 однако предотвращало потерюFKBP12.6 из макромолекулярного комплекса RyR2 у мышей FKBP12.6+/- во время физической нагрузки( + /-: 0,470,12, n= 11; +/+: 0,040,01, n= 13; P0,05). Лечение мышей FKBP12.6+/- с физической нагрузкой JTV-519 (0,5 мг/кг/ч) достоверно снижало Po каналов (0,020,01, n = 13) по сравнению с нелеченными мышами с физической нагрузкой (фиг. 2). Такое наблюдение согласуется с повышенным количеством FKBP12.6 в комплексе RyR2 (фиг. 2). Наоборот, лечение JTV-519 мышей FKBP12.6-/- с физической нагрузкой не приводило к каналам с низкой Po. Одиночные RyR2 каналы исследовали с низким цис (цитозольным) [Ca2+] 150 нМ, с использованием Ca2+ в качестве носителя заряда. Такие условия симулируют таковые в сердце во время диастолы, когда RyR2 каналы должны иметь низкую вероятность открытия с целью предотвращения диастолического протекания Ca2+ SR, которое может запускать сердечные аритмии. Следовательно, значительное снижение RyR2 Po, что наблюдается у мышей FKBP12.6+/- с физической нагрузкой, леченных JTV-519, предполагает, что RyR2 каналы не будут "протекающими" во время диастолы d, что согласуется с отсутствием наблюдаемых аритмий. Для дальнейшего изучения механизма, посредством которого JTV-519 предотвращает ЖТ, авторы изобретения симулировали условия физической нагрузки с использованием PKA-фосфорилирования дикого типа RyR2 (RyR2-WT) каналов. PKA-фосфорилированные RyR2 каналы затем инкубировали сFKBP12.6 (250 нМ), в присутствии увеличивающихся концентраций JTV-519. Инкубация с 100 нМ или 1000 нМ JTV-519 индуцировала связывание FKBP12.6 с PKA-фосфорилированными RyR2 (фиг. 3). JTV519 также индуцировал связывание FKBP12.6 с мутантными RyR2-S2809D каналами, которые имитируют постоянно-PKA-фосфорилированные RyR2 каналы (фиг. 3). Афинность FKBP12.6 к PKA-фосфорилированным RyR2 каналам достоверно увеличивалась добавлением JTV-519. Константы диссоциации (Kds) для связывания FKBP12.6 с каналами были: 14859,0 нМ для RyR2-WT + PKA + PK5-24 (ингибитор PKA); 197239,9 нМ для RyR2-WT + PKA; 15856,4 нМ для RyR2 + PKA + JTV-519 (P0,05, n = 2 для PKA-фосфорилированных каналов vs. PKAфосфорилированными каналами с JTV-519) (фиг. 3). Подобные результаты были получены с использова- 15015010 нием мутантных RyR2-S2809D каналов (которые имитируют постоянно-PKA-фосфорилированные каналы). KdS для связывания FKBP12.6 были: 2123104 нМ для RyR2-S2809D; и 42839 нМ для RyR2S2809D + JTV-519. PKA фосфорилирование RyR2 активировало каналы (Po = 0,010,002 (PKA + PKI;n = 11) vs. Po = 0,4 00,02 (PKA; n = 12; P0,05). Добавление FKBP12.6 (250 нМ) к PKAфосфорилированным RyR2-WT каналам не снижало Po. Однако добавление 1 мкМ JTV-519 плюсFKBP12.6 снижало Po до уровня, сравнимого с не-PKA-фосфорилированными каналами (Po = 0,0020,001; n = 13; P0,05). В целом, результаты, полученные авторами изобретения, показали, что обеднение FKBP12.6 из макромолекулярного комплекса RyR2, которое ассоциировано с повышенной вероятностью открытияRyR2, желудочковыми тахикардиями, и внезапной кардиальной смертью у мышей FKBPl2.6+/-, обращалось лечением производным 1,4-бензодиазепина, JTV-519. Следовательно, авторы изобретения идентифицировали новый молекулярный механизм для лечения желудочковых аритмий: увеличение афинности RyR2 к FKBP12.6 предотвращает диастолическую утечку кальция SR, которая запускает аритмии. Так как дефицит FKBP12.6 в макромолекулярном комплексе RyR2 является обычным свойством при сердечной недостаточности (Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation in failinghearts. Cell, 101:365-76, 2000) и наследственных желудочковых аритмиях, индуцированных физической нагрузкой (Wehrens et al., FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor)function linked to exercise-induced sudden cardiac death. Cell, 113:829-40, 2003), ожидают, что JTV-519 обеспечит новый и специфический путь для лечения молекулярного дефекта RyR2, который запускает внезапную кардиальную смерть. Как обсуждается выше, фибрилляция предсердий является наиболее частой формой сердечной аритмии у людей. На сегодняшний день было установлено, что структурное ремоделирование и электрическое ремоделированиевключая укорочение рефрактерности предсердий, потерю связанной с частотой адаптации рефрактерности (Wijffels et al., Atrial fibrillation begets atrial fibrillation: a study in awakedogs: electrophysiological remodeling. Circulation, 94:2953-60, 1996; Gaspo et al., Functional mechanisms underlying tachycardia-induced sustained atrial fibrillation in a chronic dog model. Circulation, 96:4027-35, 1997),и укорочение длины волны входящих импульсов - сопровождающих постоянную тахикардию (Rensma etRes., 62:395-410, 1988). Такое ремоделирование является, вероятно, важным в развитии, поддержании и прогрессировании фибрилляции предсердий. Также предполагают, что манипулирование кальцием может играть роль в электрическом ремоделировании при фибрилляции предсердий (Sun et al., CellularK8644. Circulation, 93:1747-54, 1996; Tieleman et al., Verapamil reduces tachycardia-induced electrical remodeling of the atria. Circulation, 95:1945-53, 1997). Множество механизмов, на основании нарушенной функции ионных каналов, было предложено для ФП. Например, исследования показали снижение тока Ca2+ L-типа (ICa,L) и переходного наружного тока(Ito)f в условиях длительной предсердной тахикардии (Yue et al., Ionic remodeling underlying action potential changes in a canine model of atrial fibrillation. Circ. Res., 81:512-25, 1997). Наблюдаемое подавлениеICa,L, вероятно, объясняет, по меньшей мере, частично, укорочение AERP и потерю связанной с частотой адаптации рефрактерности, оба из которых являются признаками процесса электрического ремоделирования, которое сопровождает ФП (Yue et al., Ionic remodeling underlying action potential changes in a caninemodel of atrial fibrillation. Circ. Res., 81:512-25, 1997). В экспериментальных моделях быстрой стимуляции предсердий на животных и в клинических исследованиях людей с ФП было показано, что верапамил ингибирует электрическое ремоделирование, таким образом предполагая, что вовлечена перегрузка Ca2+(Daoud et al., Effect of verapamil and procainamide on atrial fibrillation-induced electrical remodeling in humans. Circulation, 96:1542-50, 1997; Leistad et al., Atrial contractile dysfunction after short-term atrial fibrillation is reduced by verapamil but increased by BAYK8644. Circulation, 93:1747-54, 1996). Тогда как ионные каналы сарколеммы несомненно играют важную роль в ремоделировании, которое сопровождает предсердную тахикардию и ФП, вклад внутриклеточной поставки Ca2+ тщательно не изучен. Существуют доказательства, однако, предполагающие, что нарушенная поставка внутриклеточного Ca2+ играет роль в процессе ремоделирования. В предшествующих исследованиях было продемонстрировано, например, что потеря адаптации к частоте не может быть полностью объяснена нарушенны- 16015010 ми токами ионов в сарколемме, таких как ICa,L и Ito (Ramirez et al., Mathematical analysis of canine atrialloss of rate-adaptation. Cardiovasc. Res., 54:416-26, 2002). Исследования также показали, что изменения, индуцированные тахикардией в внутриклеточном потоке кальция, также вносят значительный вклад в потерю адаптации к скорости, что считается критическим в патогенезе ФП (Sun et al., Cellular mechanisms of atrial contractile dysfunction caused by sustainedmechanisms. Cardiovasc. Res., 42:455-69, 1999). В предыдущих исследованиях предсердия из модели стимулированного ФП на собаках продемонстрировали потерю адаптации ПД-длительности-скорости и изменения характеристики ПД, что может быть обращено присутствием рианодина. Такие наблюдения предполагают, что изменения возникают в результате, по меньшей мере, частично, процесса, зависимого от внутриклеточного Ca2+ (Hara et al.,Steady-state and nonsteady-state action potentials in fibrillating canine atrium: abnormal rate adaptation and itspossible mechanisms. Cardiovasc. Res., 42:455-69, 1999). Более того, в предсердиях собак с постоянной индуцированной импульсами предсердной тахикардией существует значительное снижение переходного состояния Ca2+ (Sun et al., Cellular mechanisms of atrial contractile dysfunction caused by sustained atrialtachycardia. Circulation, 98:719-27, 1998). Так как переходное состояние Ca2+ возникает в результате входа Ca2+ сарколеммы, который запускает Ca2+-индуцированное высвобождение Ca2+ из SR посредством RyR2, результаты предшествующих исследований предполагают, что изменения обмена внутриклеточного кальция сопровождают процесс ремоделирования, индуцированный тахикардией. Такие ненормально сниженные переходные состоянияCa2+ были ассоциированы с подавленным укорочением выделенных миоцитов предсердий, показывая,что обмен кальция вносит вклад в сократительную дисфункцию предсердий, сопровождающую ФП (Sunet al., Cellular mechanisms of atrial contractile dysfunction caused by sustained atrial tachycardia. Circulation,98:719-27, 1998). Как показано в настоящем описании, исследования авторов обеспечивают убедительные доказательства, что гомеостаз кальция играет важную роль в электрическом и сократительном ремоделировании, которое сопровождает постоянную предсердную тахикардию и ФП. Высвобождение запасов Ca2+SR RyR2 стоит как интегральный компонент гомеостаза миокардиального Ca2+. Регуляция RyR2 хорошо характеризована в ткани желудочков собак и людей, и RyR2 вовлечены в заболевания миокарда желудочков, включая сердечную недостаточность и внезапную коронарную смерть (Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation inhuman heart failure. Circulation, 107:2459-66, 2003). Несмотря на свидетельства того, что обмен Ca2+ играет роль в предсердных аритмиях, регуляция и функция предсердного рецептора рианодина плохо охарактеризована в этих условиях. В частности, перед настоящим изобретением, роль такого канала в ФП не была известна. Авторы изобретения подтвердили в настоящем описании, что в миокарде желудочков предсердные каналы, высвобождающие внутриклеточный кальций, существуют в виде макромолекулярных комплексов. Результаты экспериментов авторов по совместной иммунопреципитации показывают, что предсердный RyR2 является физически ассоциированным с главной регуляторной субъединицей, кальстабином 2(FKBP12.6); с фосфатазами, PP1 и PP2A; и с регуляторной и каталитической субъединицами PKA. Более того, авторы изобретения продемонстрировали, что эндогенная PKA специфически фосфорилирует RyR2 в предсердной саркоплазматической сети, приводя к обеднению кальстабином 2 (FKBP12.6) комплекса каналов. Такие открытия предполагают, что регуляция в предсердии может моделироваться PKA фосфорилированием предсердных RyR2, образом, подобным, наблюдаемому в миокарде желудочков(Brillantes, et al. , Stabilization of calcium release channel (ryanodine receptor) function by FK-506 binding protein, Cell, 77:513-523, 1994). В настоящем исследовании авторы изобретения наблюдали, что PKA-гиперфосфорилированиеRyR2 было ассоциировано с обеднением кальстабином 2 (FKBP12.6) в предсердиях собак с ФП. Подобным образом, авторы изобретения наблюдали PKA-гиперфосфорилирование с ассоциированным обеднением кальстабина (FKBP12.6), в ткани предсердий у людей с ФП в условиях сердечной недостаточности. Функциональными последствиями такого нарушенного PKA гиперфосфорилирования RyR2 была увеличенная вероятность открытия в условиях, которые симулируют диастолу в сердце (низкий цитозольныйCa2+) . Такие функциональные нарушения являются характерными для каналов, которые обеднены кальстабином 2 (FKBP12.6) (Brillantes, et al., Stabilization of calcium release channel (ryanodine receptor) functionby FK-506 binding protein, Cell, 77:513-523, 1994). Такая нарушенная функция каналов при ФП согласует- 17015010 ся с предшествующими исследованиями, демонстрируя, что потеря кальстабина 2 (FKBP12.6) из RyR2, в условиях PKA гиперфосфорилирования, приводит к "протекающим каналам", которые предрасположены к диастолическому протеканию Ca2+, которое является вторичным к повышенной чувствительности к индуцированному Ca2+ высвобождению Ca2+ (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function by FK506-binding protein. Cell, 77:513-23, 1994; Kaftan et al., Effects of rapamycinon ryanodine receptor/Ca2+-release channels from cardiac muscle. Ore. Res., 78:990-97, 1996). В отсутствие кальстабина 2 (FKBP12.6), также известно, что каналы открываются и закрываются (пропускают) случайно, скорее чем одновременно (связанное открытие) (Marx et al., Coupled gating between individual skeletalmuscle Ca2+ release channels (ryanodine receptors). Science, 281:818-21, 1998). Свидетельства предполагают, что ФП обычно индуцируется преждевременными предсердными экстрасистолами (Bennett and Pentecost, The pattern of onset and spontaneous cessation of atrial fibrillation in(Cranefield, P.F., Action potentials, afterpotentials, and arrhythmias. Circ. Res., 41:415-23, 1977). Наблюдали повторное инициирование ФП предсердными экстрасистолами, непосредственно после завершения аритмий (Timmermans et al., Immediate reinitiation of atrial fibrillation following internal atrial defibrillation.J. Cardiovasc. Electrophysiol, 9:122-28, 1998; Wellens et al., Atrioverter: an implantable device for the treatment of atrial fibrillation. Circulation, 98:1651-56, 1998), и специфически связано с ранними постдеполяризациями (Burashnikov and Antzelevitch, Reinduction of atrial fibrillation immediately after termination of the arrhythmia is mediated by late phase 3 early afterdepolarization-induced triggered activity. Circulation, 107:2355-60, 2003). Экстрасистолы, особенно вероятно повышают ФП в условиях укороченного эффективного рефрактерного периода предсердий (Wang et al., Regional and functional factors determining induction and maintenance of atrial fibrillation in dogs. Am. J. Physiol., 271 :H 148-58, 1996), подобно тому, что сопровождает электрическое ремоделирование предсердий. Как обсуждается выше, существуют доказательства, что нарушенное диастолическое высвобождение Ca2+ из "протекающих" PKA-гиперфосфорилированных RyR2 приводит к отложенным постдеполяризациям (DAD), достаточным, чтобы запустить смертельные желудочковые аритмии (Wehrens et al.,FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor) function linked to exerciseinduced sudden cardiac death. Cell, 113:829-40, 2003). Считают, что дисфункциональный обмен кальцияRyR2 также может служить инициатором ФП подобным образом. Нарушенная функция каналов, наблюдаемая авторами изобретения, может вносить вклад в патогенез ФП, обеспечивая источник DAD, необходимых для запуска ФП, в добавление ко вкладу в дисфункциональный обмен кальция, она является составной частью процесса ремоделирования, ассоциированного с аритмией. Данное свидетельство,представленное в настоящем описании, что миокард предсердия от людей с ФП, в условиях сердечной недостаточности, является PKA-гиперфосфорилированным и обедненным кальстабином 2 (FKBP12.6),нарушенная функция RyR2 может объяснить, частично, частоту предсердных аритмий у пациентов с ФП. Способность JTV-519 восстанавливать специфический дефект на молекулярном уровне в обмене кальция RyR2 делает его интересным кандидатом для нового терапевтического агента. ЭффективностьJTV-519 подчеркивается увеличивающимся количеством серьезных заболеваний сердца, включая сердечную недостаточность и смертельные желудочковые аритмии, которые включают дисфункциональную регуляцию RyR2 (т.е. PKA-гиперфосфорилирование и потеря кальстабина 2 (FKBP12.6) из комплекса каналов могут быть важными участниками их патогенеза). Начальные исследования JTV-519 фокусировались на его антиишемических свойствах (PersonalCommunication, Aetas). Позднее, однако, было показано, что JTV-519 ингибирует индукцию ФП в модели фибрилляции предсердий при стерильном перикардите у собак (Kumagai et al., Antiarrhythmic effects ofJTV-519, a novel cardioprotective drug, on atrial fibrillation/flutter in a canine sterile pericarditis model. J. Cardiovasc. Electrophysiol., 14:880-84, 2003). Это исследование, однако, не определяет механизм, посредством которого JTV-519 влияет на индукцию и поддержание ФП. Как продемонстрировано в настоящем описании, авторы определили, что лечение JTV-519 (1 мкМ) позволяет рекомбинантному кальстабину 2 (FKBP12.6) связываться с PKA-фосфорилированным RyR2,который выделяли из нормального миокарда собак in vitro. Ассоциация кальстабина 2 (FKBP12.6) с PKAфосфорилированным RyR2 не возникает в нелеченных каналах. Ре-ассоциация кальстабина 2 (FKBP12.6) с комплексом каналов восстанавливает нормальную функцию PKA-гиперфосфорилированных каналов. Следовательно, восстановление функции каналов RyR2 может играть роль в способности JTV-519 ингибировать индукцию и поддержание ФП, что наблюдали Kumagai et al. (Antiarrhythmic effects of JTV-519,a novel cardioprotective drug, on atrial fibrillation/flutter in a canine sterile pericarditis model. J. Cardiovasc.Electrophysiol, 14:880-84, 2003). Фибрилляция предсердий является комплексным электрофизиологическим процессом; его молекулярный патогенез, вероятно является многофакторным. Нарушенный обмен Ca2+ в миокарде, вероятно вносит существенный вклад в процесс заболевания. Исследования авторов изобретения предполагают,что нарушенная функция каналов высвобождения внутриклеточного Ca2+, что возникает в результатеPKA гиперфосфорилирования RyR2, может вносить вклад в процесс ремоделирования при ФП и может- 18015010 потенциально служить как пусковой фактор для аритмии. Новые способы лечения и профилактики с использованием JTV-519 В соответствии с вышеуказанным, настоящее изобретение обеспечивает способ ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациента. Как используется в настоящем описании, "FKBP12.6" включает "белок FKBP12.6" и "аналог FKBP12.6". Если не указано иначе в описании, "белок" должен включать белок, белковый домен, полипептид или пептид и их любой фрагмент. "Аналог FKBP12.6" является функциональным вариантом белка FKBP12.6, имеющим биологическую активность FKBP12.6, который имеет 60% или больше гомологии аминокислотной последовательности с белком FKBP12.6. Как используется дальше в настоящем описании, термин "биологическая активность FKBP12.6" относится к активности белка или пептида, который демонстрирует способность ассоциироваться физически или связываться с нефосфорилированным или негиперфосфорилированнымRyR2 (т.е., связывание приблизительно в два раза, или более предпочтительно, приблизительно в пять раз, выше базового связывания отрицательного контроля), в условиях анализа, описанных в настоящем описании, хотя афинность может отличаться от таковой FKBP12.6. Кроме того, как используется в настоящем описании, "RyR2" включает и "белок RyR2" (например,предсердный белок RyR2 или желудочковый белок RyR2) и "аналог RyR2". "Аналог RyR2" является функциональным вариантом белка RyR2, имеющего биологическую активность RyR2, который имеет 60% или больше гомологию аминокислотной последовательности с белком RyR2. Как используется в настоящем описании, термин "аналог RyR2" включает RyR1 - скелетно-мышечную изоформу RyR2 - иRyR3. RyR2 по настоящему изобретению может быть нефосфорилированным, фосфорилированным (например, PKA), или гиперфосфорилированным (например, PKA); предпочтительно, RyR2 является фосфорилированным или гиперфосфорилированным. Как используется далее в настоящем описании, термин"биологическая активность RyR2" относится к активности белка или пептида, который демонстрирует способность физически ассоциироваться с или связываться с, FKBP12.6 (т.е. связывание приблизительно в два раза или, более предпочтительно, в пять раз, выше основного связывания отрицательного контроля), в условиях анализов, описанных в настоящем описании, хотя афинность может отличаться от таковой RyR2. Как описано выше, рецептор рианодина в сердце, RyR2, является комплексом белков, включающим четыре белка RyR2 по 565000-дальтон в ассоциации с четырьмя белками FKBP12.6 по 12000-дальтон. Белки, связывающие FK506, (FKBP) являются цис-транс пептидилпролилизомеразами, которые широко экспрессируются и участвуют во множестве клеточных функций. Белок FKBP12.6 тесно связывается с и регулирует функцию RyR2. FKBP12.6 связывается с RyR2 каналом, одна молекула на субъединицу RyR2 стабилизирует функцию RyR2-канала и облегчает связанное открытие между соседними RyR2 каналами,таким образом, предотвращая нарушенную активацию канала во время фазы отдыха сердечного цикла. Соответственно, как используется в настоящем описании, термин "RyR2-связанный FKBP12.6" включает молекулу белка FKBP12.6, которая связана с субъединицей белка RyR2 или тетрамером FKBP12.6, который ассоциирован с тетрамером RyR2. Термин "RyR2-связанный FKBP12.6" также включает субъединицу белка RyR2, которая связана с молекулой белка FKBP12.6, или тетрамер RyR2, который находится в ассоциации с тетрамером FKBP12.6. Следовательно, "снижение уровня RyR2-связанного FKBP12.6 у пациента" включает снижение уровня FKBP12.6-связанного RyR2 у пациента и снижение уровня комплекса FKBP12.6-RyR2 у пациента. В соответствии со способом по настоящему изобретению "снижение" уровня RyR2-связанногоFKBP12.6 у пациента относится к определяемому снижению, уменьшению или подавлению уровняRyR2-связанного FKBP12.6 у пациента. Такое снижение ограничивается или предотвращается у пациента, когда снижение является каким-либо образом остановленным, замедленным, воспрепятствованным,блокированным или сниженным введением JTV-519 (как описано ниже), так что уровень RyR2 связанного FKBP12.6 у пациента выше, чем должен иным образом быть в отсутствии JTV-519. "Уровень" RyR2-связанного FKBP12.6 у пациента относится к общему уровню у пациента, включая уровниRyR2-связанного FKBP12.6 в крови (циркуляции), тканях, и клетках (например, цитоплазме или ядре) пациента. В качестве примера, затем снижение общего уровня RyR2-связанного FKBP12.6 у пациента может быть достигнуто снижением уровня RyR2-связанного FKBP12.6 в крови, в ткани, и/или в клетках пациентов. Уровень RyR2-связанного FKBP12.6 у пациента может быть определен стандартными анализами и методиками, включая таковые, легко определяемые в известной области техники (например, иммунологические методики, анализ гибридизации, иммунопреципитация, вестерн-блоттинг анализ, методики флуоресцентной визуализации, и/или рентгенологическое определение и др.), а также любыми анализами и методами определения, описанными в настоящем описании. Например, белок может быть выделен и очищен из клеток пациента с использованием стандартных методов, известных в области техники,включая, без ограничения, экстракцию из клеток (например, детергентом, который растворяет белок),когда необходимо, с последующей афинной очисткой на колонке, хроматографией (например, ЖТЖХ и ВЭЖХ), иммунопреципитацией (с антителом) и осаждением (например, изопропанолом и реагентом,таким как Тризол).- 19015010 Выделение и очистка белка может продолжаться электрофорезом (например, на SDSполиакриламидном геле). Снижение уровня RyR2-связанного FKBP12.6 у пациента, или его ограничение или предотвращение, может быть определено сравнением количества RyR2-связанного FKBP12.6, определяемого перед введением терапевтического/профилактического агента (например, JTV-519 или другого производного 1,4-бензотиазепина в соответствии со способами, описанными ниже) с количеством,определяемым через подходящее время после введения терапевтического/профилактического агента. В способе по настоящему изобретению снижение уровня RyR2-связанного FKBP12.6 у пациента(например, в клетках пациента) может быть ограничено или предотвращено, например, ингибированием диссоциации FKBP12.6 и RyR2 у пациента; увеличением связывания между FKBP12.6 и RyR2 у пациента; или стабилизацией комплекса RyR2-FKBPl2.6 у пациента. Как используется в настоящем описании,термин "ингибирование диссоциации" включает блокирование, снижение, ингибирование, ограничение или предотвращение физической диссоциации или разделения субъединицы FKBP12.6 из молекулыRyR2 у пациента, и блокирование, снижение, ингибирование, ограничение, или предотвращение физической диссоциации или отделение молекулы RyR2 из от субъединицы FKBP12.6 у пациента. Как дальше используется в настоящем описании, термин "увеличенное связывание" включает усиление, увеличение,или улучшение способности фосфорилированного RyR2 ассоциироваться физически с FKBP12.6 (например, связывание приблизительно в два раза или более предпочтительно, приблизительно в пять раз,выше базального связывания отрицательного контроля) у пациента, и усиление, увеличение или улучшение способности FKBP12.6 связываться физически с фосфорилированным RyR2 (например, связывание приблизительно в два раза или более предпочтительно приблизительно в пять раз выше базального связывания отрицательного контроля) у пациента. Кроме того, в способе по настоящему изобретению, снижение уровня RyR2-связанного FKBP12.6 у пациента (например, в клетках пациентов) может быть ограничено или предотвращено непосредственным снижением уровня фосфорилирования RyR2 у пациента, или непрямым снижением уровня фосфорилированного RyR2 у пациента (например, нацеливанием на фермент (такой как PKA) или другую эндогенную молекулу, которая регулирует или модулирует функции или уровни фосфорилированногоRyR2 в клетках). Предпочтительно, уровень фосфорилированного RyR2 у пациента снижен по меньшей мере на 10% в способе по настоящему изобретению. Более предпочтительно, уровень фосфорилированного RyR2 снижен на по меньшей мере 20%. В соответствии со способом по настоящему изобретению снижение уровня RyR2-связанногоFKBP12.6 ограничивается или предотвращается у пациента (например, в клетках пациента). Пациентом по настоящему изобретению может быть любое животное, включая амфибий, птиц, рыб, млекопитающих и сумчатых, но предпочтительно является млекопитающее (например, человек; домашнее животное,такое как кошка, собака, обезьяна, мышь или крыса; или сельскохозяйственное животное, такое как корова или свинья). В определенных вариантах осуществления настоящего изобретения пациент имеет или является кандидатом для развития заболевания сердца. Примеры "заболеваний сердца" включают, без ограничения, сердечные аритмии (например, тахикардию; предсердную аритмию, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковую аритмию,включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой),сердечную недостаточность, и внезапную кардиальную смерть, индуцированную физической нагрузкой. Сердечная аритмия является расстройством электрической активности сердца, которая проявляется как нарушение частоты сердечных сокращений или сердечного ритма. Тахикардия (например, предсердная, атриовентрикулярная (узловая), вентрикулярная и пароксизмальная тахикардия) является состоянием, ассоциированным с избыточной скоростью действия в сердце, особенно, когда частота сердечных сокращений составляет выше 100 в мин. Тахиаритмия является тахикардией, ассоциированной с нерегулярностью нормального ритма сердца. Сердечная аритмия, индицированная физической нагрузкой, является состоянием сердца (например, фибрилляция желудочков или желудочковая тахикардия, включая таковые, приводящие к внезапной кардиальной смерти), которое развивается в течение/после физической нагрузки пациента. Фибрилляция предсердий является примером тахиаритмии. В частности, фибрилляция предсердий является состоянием, ассоциированным с нарушенным и нерегулярным ритмом сердца, где электрические сигналы образуются хаотично на всем протяжении верхних камер, или предсердий, сердца. Обычные симптомы фибрилляции предсердий включают, без ограничения, сердцебиения (неприятное ощущение быстрых и нерегулярных ударов сердца). Фибрилляция предсердий также может приводить к образованию сгустков крови, которые попадают из сердца в головной мозг, вызывая инсульт. Существующее лечение фибрилляции предсердий включает контроль факторов риска, введение лекарственных препаратов для замедления сердечного ритма и/или преобразования сердца к нормальному ритму, и предотвращение осложнений, ассоциированных с тромбообразованием. Сердечная недостаточность является состоянием, проявляющимся сниженной сократительной функцией (сократимостью) сердца. Симптомы сердечной недостаточности включают одышку, сниженную толерантность к физической нагрузке и раннюю мышечную слабость."Кандидатом" в заболевания сердца (например, сердечные аритмии или сердечную недостаточ- 20015010 ность) является пациент, о котором известно, что он является, или считают, что является или ожидается,что имеет риск развития заболевания сердца. Примеры кандидатов на заболевания сердца включают, без ограничения, животное/человека, у которого ожидается развитие сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечной аритмии, индуцированной физической нагрузкой; и животное/человека, о котором известно, или о котором считается, или которое ожидается, что будет иметь риск развития сердечной аритмии (например,тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечной аритмии, индуцированной физической нагрузкой), сердечной недостаточности, и/или внезапной кардиальной смерти, индуцированной физической нагрузкой."Кандидатом" для сердечной аритмии, индуцированной физической нагрузкой является пациент, о котором известно, или считается или ожидается, что он имеет риск развития сердечной аритмии во время/после физических упражнений. Примеры кандидатов для сердечной аритмии, индуцированной физической нагрузкой, включают, без ограничения, животное/человека, известного как имеющее катехоламинергическую полиморфную желудочковую тахикардию (КПЖТ); животное/человека, ожидаемого как имеющее КПЖТ; и животное/человека, о котором известно, или считается, или ожидается, что он имеет риск развития сердечной аритмии во время/после физических упражнений, и который собирается заниматься физической нагрузкой, в настоящее время занимается физической нагрузкой или только что завершил физическую нагрузку. Как обсуждается выше, КПЖТ является наследственным расстройством у пациентов со структурно нормальными сердцами. Она характеризуется желудочковой тахикардией, индуцированной стрессом - смертельной аритмией, которая может вызывать внезапную кардиальную смерть. У пациентов с КПЖТ физическое усилие и/или стресс индуцируют двунаправленные и/или полиморфные желудочковые тахикардии, которые приводят к внезапной кардиальной смерти (ВКС) в отсутствие определяемых структурных заболеваний сердца. Пациенты с КПЖТ имеют желудочковые аритмии при воздействии физической нагрузки, но у них не развиваются аритмии в покое. В способе по настоящему изобретению интересующими клетками являются предпочтительно поперечно-полосатые мышечные клетки. Поперечно-полосатые мышцы являются мышцами, в которых повторяющиеся части (саркомеры) сократительных миофибрилл расположены регулярно на всем протяжении клетки, приводя к поперечным и наклонным полосам, которые можно увидеть на уровне светового микроскопа. Примеры клеток поперечно-полосатых мышц включают, без ограничения, клетки произвольных (скелетных) мышц и клетки сердечной мышцы. В предпочтительном варианте воплощения изобретения, клетки, используемые в способе по настоящему изобретению, являются клетки сердечной мышцы человека. Как используется, "клетки сердечной мышцы" включают волокна сердечной мышцы,такие как обнаруживаемые в миокарде сердца. Волокна сердечной мышцы состоят из цепей непрерывных клеток сердечной мышцы или кардиомиоцитов, объединенных конец в конец на вставочных дисках. Такие диски обладают двумя видами соединений клеток: расширенные десмосомы, простирающиеся вдоль их поперечных частей, и слияние отверстий, наибольшие из которых лежат вдоль продольных частей. В способе по настоящему изобретению снижение уровня RyR2-связанного FKBP12.6 ограничивается или предотвращается у пациента (например, в клетках пациента) введением JTV-519 пациенту; затем это разрешает контакт между клетками пациента и JTV-519. JTV-519 (моногидрохлорид 4- [3-(4 бензилпиперидин-1-ил)пропионил]-7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина), также известный как k201, является производным 1,4-бензотиазепина, и модулятором кальциевых ионных каналов. В добавление к регуляции уровня Ca+ в клетках миокарда JTV-519 модулирует ток Na+ и направленный внутрь ток K+ в клетках желудочков морских свинок, и ингибирует поздний направленный ток K+ в клетках предсердий морских свинок. FK506 и рапамицин являются лекарственными средствами, которые могут быть использованы для создания других соединений, которые стабилизируют комплекс RyR2FKBP12.6 у пациента по настоящему изобретению. FK506 и рапамицин оба диссоциируют FKBP12.6 изRyR2. Возможно создавать и/или искать соединения, которые являются структурно связанными с такими лекарственными средствами, но имеют противоположные эффекты. В способе по настоящему изобретению, JTV-519 можно вводить пациенту посредством терапевтической композиции, включающей JTV-519 и фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель должен быть приемлемым в смысле быть совместимым с другими ингредиентами композиции и не вредным для их потребителя. Фармацевтически приемлемый носитель, используемый в настоящем описании, выбирают из различных органических или неорганических веществ, которые используют как материалы для фармацевтических композиций и которые могут быть включены в качестве обезболивающих агентов, буферов, вяжущих веществ, дезинтегрирующих агентов, разбавителей, эмульгаторов, вспомогательных веществ, наполнителей, глидантов, растворителей, стабилизаторов,суспендирующих агентов, агентов, регулирующих тонус, основ и агентов, увеличивающих вязкость. Если необходимо, также могут быть добавлены фармацевтические добавки, такие как антиоксиданты, ароматизаторы, красители, агенты, улучшающие вкус, консерванты и подсластители. Примеры приемлемых- 21015010 фармацевтических носителей включают карбоксиметилцеллюлозу, кристаллическую целлюлозу, глицерин, гуммиарабик, лактозу, стеарат магния, метилцеллюлозу, порошки, солевой раствор, альгинат натрия, сахарозу, крахмал, тальк и воду, среди остальных. Фармацевтические композиции по настоящему изобретению могут быть получены способами, хорошо известными в фармацевтической области техники. Например, JTV-519 можно совместить с носителем или разбавителем, в виде суспензии или раствора. Необязательно также может быть добавлен один или более дополнительных ингредиентов (например, буферы, ароматизирующие агенты, поверхностноактивные вещества и подобные). Выбор носителя будет зависеть от пути введения.JTV-519 может вводиться пациенту посредством контакта с целевыми клетками (например, клетками мышцы сердца) in vivo у пациента с JTV-519. JTV-519 может контактировать с (например, вводиться в) клетками пациента с использованием методик, используемых для внесения и введения белков, нуклеиновых кислот и других лекарственных средств. Примеры способов для контакта клеток с (т.е. лечения клеток) JTV-519 включают, без ограничения, всасывание, электропорирование, иммерсию, инъекцию,введение, доставку липосомами, трансфекцию, трансфузию, векторы, и другие носители и способы доставки лекарственных средств. Когда целевые клетки расположены в определенной части пациента, может быть желательно вносить JTV-519 непосредственно в клетки, инъекцией или каким-либо другими средствами (например, введением JTV-519 в кровь или другую жидкость тела). Целевые клетки могут,например, содержаться в ткани сердца пациента и могут определяться в ткани сердца пациента стандартными методами определения, легко доступными в известной области техники, примеры которых включают, без ограничения, иммунологические методики (например, иммуногистохимическое окрашивание),методики флуоресцентной визуализации и микроскопические методики. Кроме того, JTV-519 по настоящему изобретению можно вводить пациенту человеку или животному известными методиками, включая, без ограничения, пероральное введение, парентеральное введение и трансдермальное введение. Предпочтительно JTV-519 вводят парентерально, посредством эпифасциальной, интракапсулярной, интракраниальной, внутрикожной, интратекальной, внутримышечной, интраорбитальной, интраперитонеальной, интраспинальной, интрастернальной, внутрисосудистой, внутривенной, паренхиматозной, подкожной или сублингвальной инъекции, или посредством катетера. В одном варианте осуществления изобретения агент вводят пациенту посредством нацеленной доставки в клетки сердечной мышцы посредством катетера, вставленного с сердце пациента. Для перорального введения композиция JTV-519 может быть представлена в виде капсул, таблеток,порошков, гранул или в виде суспензии. Композиция может иметь обычные добавки, такие как лактоза,маннит, кукурузный крахмал или картофельный крахмал. Композиция также может быть представлена с вяжущими веществами, такими как кристаллическая целлюлоза, производные целлюлозы, акация, кукурузный крахмал или желатин. Кроме того, композиция может быть представлена с дезинтегрирующими агентами, такими как кукурузный крахмал, картофельный крахмал или карбоксиметилцеллюлоза натрия. Композиция также может быть представлена с безводным двухосновным фосфатом кальция или гликолатом крахмала натрия. Наконец, композиция может быть представлена со смазывающими агентами,такими как тальк или стеарат магния. Для парентерального введения (т.е. введения посредством инъекции путем, иным чем пищеварительный канал) JTV-519 может быть смешан со стерильным водным раствором, который является предпочтительно изотоническим с кровью пациента. Такая композиция может быть получена растворением твердого активного ингредиента в воде, содержащей физиологически совместимые вещества, такие как хлорид натрия, глицин и подобные, и имеющая буферизованный рН, совместимый с физиологическими условиями так, чтобы получился водный раствор, затем переводя указанный раствор в стерильный. Композиция может быть представлена в одно- или многодозовых контейнерах, таких как герметичные ампулы или флаконы. Композиция может быть доставлена любым типом инъекции, включая, без ограничения, эпифасциальную внутрикапсулярную, интракраниальную, внутрикожную, интратекальную, внутримышечную, интраорбитальную, интраперитонеальную, интраспинальную, интрастернальную, внутрисосудистую, внутривенную, паренхиматозную, подкожную или сублингвальную, или посредством катетера в сердце пациента. Для трансдермального введения JTV-519 может быть смешан с усилителями проницаемости кожи,такими как пропиленгликоль, полиэтиленгликоль, изопропанол, этанол, олеиновая кислота, Nметилпирролидон и подобные, которые увеличивают проницаемость кожи для JTV-519, и позволяютJTV-519 проходить через кожу и в кровоток. Композиция JTV-519/усилителя также может далее быть комбинирована с полимерным веществом, таким как этилцеллюлоза, гидроксипропилцеллюлоза, этилен/винилацетат, поливинилпирролидон, и подобные, для получения композиции в форме геля, которая может быть растворена в растворителе, таком как метиленхлорид, выпарена до желаемой вязкости и затем нанесена на материал основы для получения пластыря. В соответствии со способом по настоящему изобретению JTV-519 может быть введен пациенту (иJTV-519 может прийти в контакт с клетками пациента) в количестве, эффективном для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациента, особенно в клетках пациента. Такое количество может быть легко определено опытным специалистом в области техники, на основании- 22015010 известных методик, включая анализ кривых титрования, полученных in vivo, и способов и анализов, описанных в настоящем описании. Подходящее количество JTV-519, эффективное для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациентов может варьироваться от около 5 до около 20 мг/кг/день, и/или может быть количеством, достаточным для достижения уровней в плазме,варьирующихся от около 300 до около 1000 нг/мл. Предпочтительно количество JTV-519 варьируется от около 10 до около 20 мг/кг/день. В одном варианте осуществления настоящего изобретения, у пациента еще не развилось заболевание сердца, такое как сердечные аритмии (например, тахикардия; предсердная аритмия, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковая тахикардия, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой), сердечная недостаточность или внезапная кардиальная смерть, индуцированная физической нагрузкой. В таком случае количество JTV-519, эффективное для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациента, может быть количеством JTV-519, эффективным для предотвращения заболевания сердца (например, сердечной аритмии, сердечной недостаточности или внезапной кардиальной смерти, индуцированной физической нагрузкой) у пациента. Как используется в настоящем описании количество лекарственного средства (например, JTV-519)"эффективное для предотвращения заболевания сердца" включает количество лекарственного средства(например, JTV-519), эффективное для предотвращения развития клинических нарушений или симптомов заболевания сердца. Например, когда заболеванием сердца является фибрилляция предсердий, количеством JTV-519, эффективным для предотвращения фибрилляции предсердий, может быть количествоJTV-519, эффективное для предотвращения сердцебиений и/или образования сгустков крови у пациента. Подобным образом, когда заболеванием сердца является сердечная аритмия, индуцированная физической нагрузкой, количеством JTV-519, эффективным для предотвращения сердечной аритмии, индуцированной физической нагрузкой, может быть количество JTV-519, эффективное для предотвращения индуцированных физической нагрузкой сердцебиений, обмороков, фибрилляции желудочков, желудочковой тахикардии и внезапной кардиальной смерти у пациента. Кроме того, когда заболеванием сердца является сердечная недостаточность, количеством JTV-519, эффективным для предотвращения сердечной недостаточности, может быть количество JTV-519, эффективное для предотвращения одышки, сниженной толерантности к физической нагрузке и ранней мышечной слабости у пациента. Количество лекарственного средства (например, JTV-519), эффективное для предотвращения заболеваний сердца у пациента, может варьироваться в зависимости от определенных факторов каждого случая, включая тип заболевания сердца, массу тела пациента, тяжесть состояния пациента и тип введения лекарственного средства (например, JTV-519). Такое количество может быть легко определено опытным специалистом в области техники на основании известных методик, включая клинические исследования и способы, описанные в настоящем описании. В одном варианте осуществления настоящего изобретения,количество лекарственного средства (например, JTV-519), эффективное для предотвращения сердечной аритмии, индуцированной физической нагрузкой, является количество лекарственного средства (например, JTV-519), эффективное для предотвращения внезапной кардиальной смерти, индуцированной физической нагрузкой у пациента. В другом варианте осуществления изобретения лекарственное средство(например, JTV-519) предотвращает по меньшей мере одно заболевание сердца (например, сердечную аритмию (например, тахикардию; предсердную аритмию, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковую аритмию, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой), сердечную недостаточность, или внезапную кардиальную смерть, индуцированную физической нагрузкой) у пациента. Из-за его способности стабилизировать RyR2-связанный FKBP12.6, поддерживать и восстанавливать баланс в контексте динамического PKA фосфорилирования и дефосфорилирования RyR2, JTV-519 также может быть применимым в лечении пациента, у которого уже начались клинические симптомы заболевания сердца. Если симптомы заболевания сердца наблюдаются у пациента достаточно рано, JTV519 может быть эффективным в ограничении или предотвращении дальнейшего снижения RyR2 связанного FKBP12.6 у пациента. Соответственно, в другом варианте осуществления настоящего изобретения у пациента развилось заболевание сердца. Например, пациент занимался физической нагрузкой или в настоящее время занимается физической нагрузкой, и уже развилась сердечная аритмия, индуцированная физической нагрузкой. В таком случае, количеством JTV-519, эффективным для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 у пациента, может быть количество JTV-519, эффективное для лечения заболевания сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии,включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой или сердечную недостаточность у пациента. Как используется в настоящем описании, количество лекарственного средства (например, JTV-519)"эффективное для лечения заболевания сердца" включает количество лекарственного средства (например, JTV-519), эффективное для облегчения или улучшения клинических нарушений или симптомов за- 23015010 болевания сердца. Например, когда заболеванием сердца является фибрилляция предсердий, количеством JTV-519, эффективным для лечения фибрилляции предсердий, может быть количество JTV-519, эффективное для облегчения или улучшения сердцебиений и/или образования сгустков крови у пациента. Подобным образом, когда заболеванием сердца является сердечная аритмия, индуцированная физической нагрузкой, количеством JTV-519, эффективным для лечения сердечной аритмии, индуцированной физической нагрузкой, может быть количество JTV-519, эффективное для облегчения или улучшения сердцебиений, индуцированных физической нагрузкой, слабости, фибрилляции желудочков и желудочковой тахикардии у пациента. Кроме того, когда заболеванием сердца является сердечная недостаточность, количеством JTV-519, эффективным для лечения сердечной недостаточности, может быть количество JTV-519, эффективное для облегчения или улучшения одышки, сниженной толерантности к физической нагрузке и ранней мышечной слабости у пациента. Количество лекарственного средства (например, JTV-519), эффективное для лечения заболевания сердца у пациента, будет варьироваться в зависимости от определенных факторов каждого случая, включая тип заболевания сердца, массу тела пациента, тяжесть состояния пациента, и тип введения лекарственного средства (например, JTV-519). Такое количество может быть легко определено специалистом в области техники на основании известных методик, включая клинические исследования и способы, описанные в настоящем описании. В предпочтительном варианте осуществления изобретения, лекарственное средство (например, JTV-519) лечит по меньшей мере одно заболевание сердца у пациента. Настоящее изобретение кроме того обеспечивает способ для лечения по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность) у пациента. Способ включает введение JTV-519 пациенту в количестве, эффективном для лечения по меньшей мере одного заболевания сердца у пациента. Подходящее количество JTV-519, эффективное для лечения заболевания сердца (например, сердечной аритмии(например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков/ и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность) у пациента может варьироваться от около 5 до около 20 мг/кг/день, и/или может быть количеством, эффективным для достижения уровня в плазме, варьирующегося от около 300 до около 1000 нг/мл. Настоящее изобретение также обеспечивает способ для предотвращения по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии/предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков/ и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность), или внезапной кардиальной смерти, индуцированной физической нагрузкой) у пациента. Способ включает введение JTV-519 пациенту в количестве, эффективном для предотвращения по меньшей мере одного заболевания сердца у пациента. Подходящее количествоJTV-519, эффективное для предотвращения по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии/предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность), или внезапной кардиальной смерти, индуцированной физической нагрузкой) у пациента может варьироваться от около 5 до около 20 мг/кг/день, и/или может быть количеством, достаточным для достижения уровня в плазме, варьирующегося от около 300 до около 1000 нг/мл. В различных вариантах осуществления вышеописанных способов сердечная аритмия, индуцированная физической нагрузкой, у пациента ассоциирована с ЖТ. В предпочтительных вариантах осуществления ЖТ является КПЖТ. В других вариантах осуществления таких способов, пациент является кандидатом к развитию сердечной аритмии, индуцированной физической нагрузкой, включая кандидата для развития внезапной кардиальной смерти, индуцированной физической нагрузкой. Кроме того, в свете вышеуказанных способов, настоящее изобретение также обеспечивает применение JTV-519 в способе для ограничения или предотвращения снижения уровня RyR2-связанногоFKBP12.6 у пациента, который имеет или является кандидатом к развитию по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность). Настоящее изобретение также обеспечивает применение JTV519 в способе для лечения или предотвращения по меньшей мере одного заболевания сердца (например,сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность) у пациента.- 24015010 Новые способы скрининга Как обсуждается выше и представлено в настоящем описании, данные, полученные авторами изобретения, показывают, что фосфорилирование протеинкиназой A (PKA) рецептора рианодина сердца,RyR2, по серину 2809 активирует канал высвобождением белка, связывающего FK506, FKBP12.6. При сердечной недостаточности (включая сердца людей и модели сердечной недостаточности на животных),RyR2 является PKA-гиперфосфорилированным, приводя к дефектным каналам, которые имеют сниженное количество связанного FKBP12.6, и имеют повышенную чувствительность к активации, индуцированной кальцием. Конечным результатом таких изменений является то, что RyR2 каналы являются "протекающими". Такие утечки в каналах могут приводить к обеднению внутриклеточных запасов кальция настолько, что больше не существует достаточно кальция в саркоплазматической сети (SR) для обеспечения сильного стимула для сокращения мышц. Это приводит к слабому сокращению сердечной мышцы. Как второе последствие протекания каналов, RyR2 каналы высвобождают кальций во время фазы отдыха сердечного цикла, известной как "диастола". Такое высвобождение кальция во время диастолы может запустить смертельные аритмии сердца (например, желудочковую тахикардию и фибрилляцию желудочков), которые вызывают внезапную кардиальную смерть (ВКС). Авторы изобретения также показали, что лечение сердечной недостаточности механическими насосными устройствами, называемыми левожелудочковыми аппаратами вспомогательного кровообращения (LVAD), которые приводят сердце в состояние отдыха и восстанавливают нормализованную функцию, ассоциировано с снижением PKA гиперфосфорилирования RyR2, и нормализованной функцией канала. Более того, авторы изобретения показали, что лечение собак (у которых была сердечная недостаточность, индуцированная импульсами) -адреноблокаторами (-блокаторами) обращает PKA гиперфосфорилирование RyR2. Бета-блокаторы ингибируют путь, который активирует PKA. Выводы, которые могут быть получены на основании результатов работы авторов изобретения, состоят в том, что PKA гиперфосфорилирование RyR2 увеличивает активность канала, приводя к большему высвобождению кальция в клетку для заданного сигнала запуска (активатора) канала. Как описано далее в настоящем описании, авторы изобретения установили, что заболевания сердца(например, сердечная аритмия (например, тахикардия; предсердная аритмия, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковая аритмия, включая фибрилляцию желудочков; и сердечная аритмия, индуцированная физической нагрузкой) или сердечная недостаточность) ассоциированы с увеличением фосфорилирования белков RyR2 (особенно КПЖТ-ассоциированных RyR2 мутантных белков) и снижением уровня RyR2-связанного FKBP12.6. Такой механизм можно использовать для создания эффективных лекарственных средств для лечения и предотвращения таких заболеваний сердца. Агент-кандидат, имеющий способность ограничивать или предотвращать заболевание на уровне RyR2-связанного FKBP12.6, может, как последствие такой ограничивающей или предотвращающей активности, оказывать влияние на биологические события, ассоциированные с RyR2, таким образом лечить или предотвращать такие заболевания сердца. Соответственно, настоящее изобретение кроме того обеспечивает способ для идентификации агента, предназначенного для лечения или предотвращения по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность), или внезапной кардиальной смерти, индуцированной физической нагрузкой). Способ включает стадии: (a) получения или создания культуры клеток, содержащих RyR2; (b) контакта клеток с агентом-кандидатом; (c) воздействия на клетки одного или более условий, известных как увеличивающие фосфорилирование RyR2 в клетках; и (d) определения, ограничивает или предотвращает агент снижение уровня RyR2-связанного FKBP12.6 в клетках. Как используется в настоящем описании, "агент" будет включать белок, полипептид, пептид, нуклеиновую кислоту (включая ДНК или РНК), антитело, Fab фрагмент, F(ab')2 фрагмент, молекулу, соединение, антибиотик, лекарственное средство и их любую комбинацию(и). Агент, который ограничивает или предотвращает снижение уровня RyR2-связанного FKBP12.6, может быть естественным или синтетическим и может быть агентом, реакционно-способным с (т.е., агентом, который имеет афинность к,связывается с или направлен против) RyR2 и/или FKBP12.6. Как дальше используется в настоящем описании клетка "содержащая RyR2" является клеткой (предпочтительно клеткой мышцы сердца), в которойRyR2, или его производное или гомолог, естественно экспрессируется или естественно возникает. Состояния, известные как увеличивающие фосфорилирование RyR2 в клетках, включают, без ограничения,PKA. В способе по настоящему изобретению клетки могут контактировать с агентом-кандидатом любым из стандартных способов возможности контакта между лекарственными средствами/агентами и клетками, включая любые типы введения и внесения, описанные в настоящем описании. Уровень RyR2 связанного FKBP12.6 в клетке может быть измерен или определен известными методиками, включая любые способы, молекулярные методики и анализы, известные специалисту в области техники или описанные в настоящем описании. В одном варианте осуществления настоящего изобретения, агент ограни- 25015010 чивает или предотвращает снижение уровня RyR2-связанного FKBP12.6 в клетках. Как описано в настоящем описании, RyR2 вовлечен в ряд биологических событий в поперечнополосатых мышечных клетках. Например, было показано, что RyR2 каналы играют важную роль в EC связывании и сокращении клеток мышцы сердца. Следовательно, очевидно, что терапевтические или профилактические лекарственные средства, созданные для ограничения или предотвращения снижения уровня RyR2-связанного FKBP12.6 в клетках, особенно клетках мышцы сердца, могут быть применимы в регуляции ряда биологических событий, ассоциированных с RyR2, включая EC связывание и сократимость. Следовательно, так как агент-кандидат по настоящему изобретению был скринирован и было определено, что он имеет подходящий ограничивающий или предотвращающий эффект на снижение уровня RyR2-связанного FKBP12.6, его можно оценивать в отношении его эффекта на EC связывание и сократимость в клетках, особенно клетках сердечной мышцы. Ожидают, что терапевтический/профилактический агент по настоящему изобретению будет применимым для лечения или предотвращения заболеваний сердца, включая сердечную аритмию (например, тахикардию; предсердную аритмию, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковую аритмию, включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой) или сердечную недостаточность), или внезапную кардиальную смерти, индуцированную физической нагрузкой). Соответственно способ по настоящему изобретению может кроме того включать стадии: (e) контакта агента-кандидата с культурой клеток, содержащих RyR2; и (f) определения, обладает ли агент эффектом на биологические события, ассоциированные с RyR2 в клетках. Как используется в настоящем описании, "RyR2-ассоциированное биологическое событие" включает биохимический или физиологический процесс, в который вовлечены уровень или активность RyR2. Как описано в настоящем описании, примеры RyR2-ассоциированных биологических событий включают, без ограничения, EC связывание и сократимость в клетках мышцы сердца. В соответствии с таким способом по настоящему изобретению,агент-кандидат может контактировать с одной или более клетками (предпочтительно клетками сердечной мышцы) in vitro. Например, культуру клеток можно инкубировать с препаратом, содержащим агенткандидат. Затем эффект агента-кандидата на RyR2-ассоциированное биологическое событие может быть оценен любыми биологическими анализами или способами, известными в области техники, включая иммуноблоттинг, одноканальные записи и любые другие, описанные в настоящем описании. Настоящее изобретение далее направлено на агент, идентифицированный вышеописанным способом идентификации, а также фармацевтическую композицию, включающую агент и фармацевтически приемлемый носитель. Агент может быть применимым для предотвращения внезапной кардиальной смерти, индуцированной физической нагрузкой у пациента, и для лечения или предотвращения другихRyR2-ассоциированных заболеваний. Как используется в настоящем описании "RyR2-ассоциированное состояние" является состоянием, заболеванием или расстройством, при котором вовлечены уровень или активность RyR2, и включает RyR2-ассоциированное биологическое событие и заболевание сердца (например, сердечную аритмию (например, тахикардию; предсердную аритмию, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковую аритмию,включая фибрилляцию желудочков; и сердечную аритмию, индуцированную физической нагрузкой или сердечную недостаточность), или внезапную кардиальную смерть, индуцированную физической нагрузкой.RyR2-ассоциированное состояние можно лечить или предотвращать у пациента введением пациенту количества агента, эффективного для лечения или предотвращения RyR2-ассоциированного состояния у пациента. Такое количество может быть легко определено специалистом в области техники. В одном варианте осуществления, настоящее изобретение обеспечивает способ для лечения или предотвращения по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечной аритмии, индуцированной физической нагрузкой) или сердечной недостаточности, или внезапной кардиальной смерти, индуцированной физической нагрузкой) у пациента, введением агента пациенту в количестве, эффективном для лечения или предотвращения по меньшей мере одного заболевания сердца у пациента. Настоящее изобретение также обеспечивает способ in vivo для идентификации агента для применения в лечении или предотвращении заболевания (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечной аритмии, индуцированной физической нагрузкой) или сердечной недостаточности, или внезапной кардиальной смерти, индуцированной физической нагрузкой). Способ включает стадии: (a) обеспечения или создания животного, содержащего RyR2; (b) введение агента-кандидата животному; (c) воздействия на животное одного или более состояний, известных как увеличивающие фосфорилирование RyR2 в клетках; и (d) определения, ограничивает или предотвращает агент снижение уровня RyR2-связанного FKBP12.6 у животного. Способ может кроме того включать стадии: (e) введения агента животному, содержащему RyR2; и (f) определения, имеет ли агент воздействие на RyR2-ассоциированные биологические события у жи- 26015010 вотного. Также настоящее изобретение обеспечивает агент, идентифицируемый таким способом; фармацевтическую композицию, включающую такой агент; и способ для лечения или предотвращения по меньшей мере одного заболевания сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечной аритмии, индуцированной физической нагрузкой) или сердечной недостаточности, или внезапной кардиальной смерти,индуцированной физической нагрузкой) у пациента, введением такого агента пациенту в количестве,эффективном для лечения или предотвращения по меньшей мере одного заболевания сердца у пациента. Проведенные авторами изобретения исследования продемонстрировали, что соединения, которые блокируют активацию PKA, ожидаемо будут снижать активацию RyR2 канала, приводя к меньшему высвобождению кальция в клетку. Соединения, которые связываются с RyR2 каналом в месте связыванияFKBP12.6, но не проходят через канал, когда канал фосфорилирован PKA, также будут ожидаемо, снижать активность канала в ответ на активацию PKA или другие запускающие импульсы, которые активируют RyR2 канал. Такие соединения также будут приводить к меньшему высвобождению кальция в клетку. В свете таких открытий, настоящее изобретение кроме того обеспечивает дополнительные анализы для идентификации агентов, которые могут быть применимыми в лечении или предотвращении заболеваний сердца (например, сердечной аритмии (например, тахикардии; предсердной аритмии, включая предсердную тахиаритмию и фибрилляцию предсердий (и постоянную и непостоянную); желудочковой аритмии, включая фибрилляцию желудочков; и сердечной аритмии, индуцированной физической нагрузкой) или сердечной недостаточности), или внезапной кардиальной смерти, индуцированной физической нагрузкой), при которых они блокируют или ингибируют активацию RyR2. В качестве примера, диагностические анализы по настоящему изобретению могут скринировать в отношении высвобождения кальция в клетки посредством RyR2 канала, с использованием кальцийчувствительных флуоресцентных красителей (например, Fluo-3, Fura-2, и подобных). Клетки могут быть нагружены выбранным флуоресцентным красителем, затем стимулированы активаторами RyR2 для определения уменьшают ли или нет соединения, добавленные к клетке, кальций-зависимый флуоресцентный сигнал (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function by FK506binding protein. Cell, 77:513-23, 1994; Gillo et al., Calcium entry during induced differentiation in murinereceptor by tyrosine phosphorylation. Science, 272:1492-94, 1996). Кальций-зависимые флуоресцентные сигналы могут отслеживаться с помощью фотоэлектронного умножителя и анализироваться с помощью соответствующего программного обеспечения, как описано ранее (Brillantes et al., Stabilization of calciumet al., Regulation of the inositol 1,4,5-trisphosphate receptor by tyrosine phosphorylation. Science, 272:1492-94,1996). Этот анализ может легко быть автоматизирован для скрининга большого количества соединений с использованием многолуночных чашек. Для определения соединений, которые ингибируют PKA-зависимую активацию RyR2 опосредованного внутриклеточного высвобождения кальция, анализ может включать экспрессию рекомбинантных RyR2 каналов в гетерологичной системе экспрессии, такой как клетки Sf9, HEK293, или CHO(Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function by FK506-binding protein. Cell, 77:513-23, 1994). RyR2 также могут совместно экспрессироваться с -адренергическими рецепторами. Это позволит оценить эффект соединений на активацию RyR2 в ответ на добавление агонистов-адренергических рецепторов. Уровень PKA фосфорилирования RyR2, который коррелирует со степенью сердечной недостаточности, также может быть оценен и затем использован для определения эффективности соединений, созданных для блокады PKA фосфорилирования RyR2 канала. Такой анализ может быть основан на применении антител, которые являются специфичными для белка RyR2. Например, белок RyR2-канала может быть иммунопреципитирован и затем обратно фосфорилирован PKA и [гамма 32P]-АТФ. Количество радиоактивной метки [32P], которая переносится на белок RyR2, затем может быть измерено с использованием фосфор-визуализатора (Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation in failing hearts. Cell, 101:365-76, 2000). Другой анализ по настоящему изобретению включает применение фосфоэпитоп-специфического антитела, которое определяет RyR2, которые являются PKA-фосфорилированными по Ser 2809. Иммуноблоттинг с таким антителом может быть использован для оценки эффективности терапии сердечной недостаточности и сердечных аритмий. Кроме того, мыши, нокированные RyR2 S2809A и RyR2 S2809D,могут быть использованы для оценки эффективности терапии сердечной недостаточности и сердечных аритмий. Такие мыши, кроме того, обеспечивают доказательства, что PKA гиперфосфорилированиеRyR2 является способствующим фактором в сердечной недостаточности и сердечных аритмиях, показывая, что S2809A мутация RyR2 ингибирует сердечную недостаточность и аритмии и что S2809D мутацияRyR2 ухудшает сердечную недостаточность и аритмии.- 27015010 Новые производные 1,4-Бензотиазепина и способы синтеза таковых Производные 1,4-бензотиазепина, особенно производные 2,3,4,5-тетрагидро-1,4-бензотиазепина,являются важными строительными блоками в получении биологически-активных молекул, включая JTV519. Авторы изобретения разработали новый способ для получения промежуточных соединений 1,4 бензотиазепина, таких как 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепин. Предложенный способ использует легко доступные и недорогие исходные вещества, и обеспечивает высокие выходы ключевых промежуточных продуктов 1,4-бензотиазепина. В ранние 1990-е, Kaneko et al. (Патент США 5416066; WO 92/12148; JP4230681) описывает, чтоJTV-519 может быть получен реакцией 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина (промежуточного продукта 1,4-бензотиазепина) с акрилоилхлоридом и затем реакцией полученного продукта с 4 бензилпиперидином. Ранее в литературе сообщали о двух способах получения 7-метокси-2,3,4,5-тетрагидро-1,4 бензотиазепина и сходных соединений. Первый способ, описанный Kaneko et al. (патент США . 5416066), вовлеченный в путь синтеза из шести стадий, который начинается с 2,5-дигидроксибензойной кислоты. В этом способе 2,5-дигидроксибензойную кислоту селективно метилировали диметилсульфатом. Затем полученное соединение реагировало с диметилтиокарбамоилхлоридом в течение 20 ч, и затем его подвергали воздействию высокой температуры (270C) в течение 9 ч. Продукт этой стадии нагревали в колбе с обратным холодильником с метоксидом натрия в метаноле в течение 20 ч. Продукт стадии рефлюкса затем реагировал с 2-хлорэтиламином, в основных условиях и при высокой температуре, для получения циклизованного амида. Циклизованный амид восстанавливали LiAlH4 для получения 7-метокси 2,3,4,5-тетрагидро-1,4-бензотиазепин (промежуточный продукт 1,4-бензотиазепина). Второй способ для получения 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина описан Hitoshi в Японском патенте (JP 10045706). Этот способ начинается с 2-бром-5-метоксибензальдегида. Бромид замещали NaSMe, и полученный продукт окисляли хлором с последующим нагреванием в колбе с обратным холодильником в воде для получения диальдегида дисульфида. Диальдегид обрабатывали 2 хлорэтиламином, и полученный продукт восстанавливали восстанавливающим агентом, таким какNaBH4. Полученное соединение циклизовали для получения 7-метокси-2,3,4,5-тетрагидро-1,4 бензотиазепина. Вначале авторы изобретения попробовали получить промежуточный продукт 1,4-бензотиазепина,7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепин, с использованием способов, описанных выше. Однако они обнаружили, что первый способ, описанный Kaneko et al. (патент США 5416066), включает высокотемпературные синтетические стадии и продолжительные реакции. Кроме того, авторы изобретения обнаружили, что тиогруппу в третьем тиолированном промежуточном продукте легко окислялась воздухом до дисульфидного соединения, делая возможным синтез последующего циклизованного продукта. Авторы изобретения также определили, что способ, описанный Hitoshi (JP 10045706), включает Cl2 и что другой запатентованный способ для получения первого промежуточного продукта, кроме замещения бромида NaSMe, должен использоваться. Для решения вышеуказанных проблем авторы изобретения разработали новый способ для получения 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина из легкодоступных и недорогих исходных веществ. Способ авторов изобретения упрощает стадии выделения и очистки и может быть использован для получения различных промежуточных продуктов 1,4-бензотиазепина, включая 7-метокси-2,3,4,5-тетрагидро 1,4-бензотиазепин и другие соединения, имеющие общую структуру, показанную в формуле Этот процесс также может быть использован для получения JTV-519. Соответственно, в свете вышеуказанного, настоящее изобретение обеспечивает способ для синтеза соединения, имеющего формулу где R = OR', SR', NR', алкил, или галоид и R' = алкил, арил или H и где R может быть в положении 2, 3, 4 или 5, указанный способ включает стадии:(b) обработки соединения, полученного на стадии (a) диазотирующим агентом и дисульфидом для получения соединения, имеющего формулу:(c) обработки соединения, полученного на стадии (b) активирующим агентом и хлорэтиламином,для получения соединения, имеющего формулу:(d) обработки соединения, полученного на стадии (c) восстанавливающим агентом и основанием,для получения соединения, имеющего формулу:(e) обработки соединения, полученного на стадии (d) восстанавливающим агентом для получения соединения, имеющего формулу: где R является, как определено выше. В соответствии со способом по настоящему изобретению восстанавливающим агентом на стадии(a) может быть H2. Кроме того, диазотирующим агентом на стадии (b) может быть NaNO2, и дисульфидом на стадии (b) может быть Na2S2. Более того, хлоридом на стадии (c) может быть SOCl2. Восстанавливающим агентом на стадии (d) может быть триметилфосфин (PMe3), тогда как основанием на стадии (d) является триэтиламин. В другом варианте осуществления изобретения восстанавливающим агентом на стадии (e) является LiAlH4. Настоящее изобретение кроме того обеспечивает способ синтеза соединения, имеющего формулу: где R = OR', SR' , NR', алкил, или галоид и R' = алкил, арил, или H и где R может быть в положении 2, 3, 4 или 5, указанный способ включает стадию:
МПК / Метки
МПК: A61K 31/554, A61K 31/553
Метки: средства, аритмии, применяемые, недостаточности, лекарственные, сердечной
Код ссылки
<a href="https://eas.patents.su/30-15010-lekarstvennye-sredstva-primenyaemye-pri-aritmii-i-serdechnojj-nedostatochnosti.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственные средства, применяемые при аритмии и сердечной недостаточности</a>


































