Способы лечения неврологического расстройства у животного, способы стимуляции и активации роста поврежденных периферических нервов, способ активации регенерации и роста нейронов и способ предотвращения нейродегенерации у животного
Номер патента: 1379
Опубликовано: 26.02.2001
Авторы: Стайнер Джозеф П., Хэмилтон Грегори С, Досон Тед, Снайдер Соломон
Формула / Реферат
1. Способ лечения неврологического расстройства у животного путем введения животному эффективного количества неиммуносупрессорного производного пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для стимуляции роста поврежденных периферических нервов или для активации регенерации нейронов, причем иммунофилины FKBP-типа проявляют ротамазную активность, а производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу:
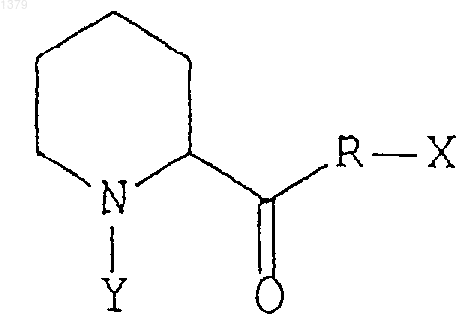
где R может быть кислородом или азотом,
Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца.
2. Способ по п.1, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из периферических невропатий, вызванных физической травмой или болезненным состоянием, физическим повреждением головного мозга, физическим повреждением спинного мозга, сосудистым ударом, сопровождающимся повреждением мозга, и неврологических расстройств, связанных с нейродегенерацией.
3. Способ по п.2, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона и амиотрофического латерального склероза.
4. Способ по п.1, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way-124,666.
5. Способ по п.1, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506.
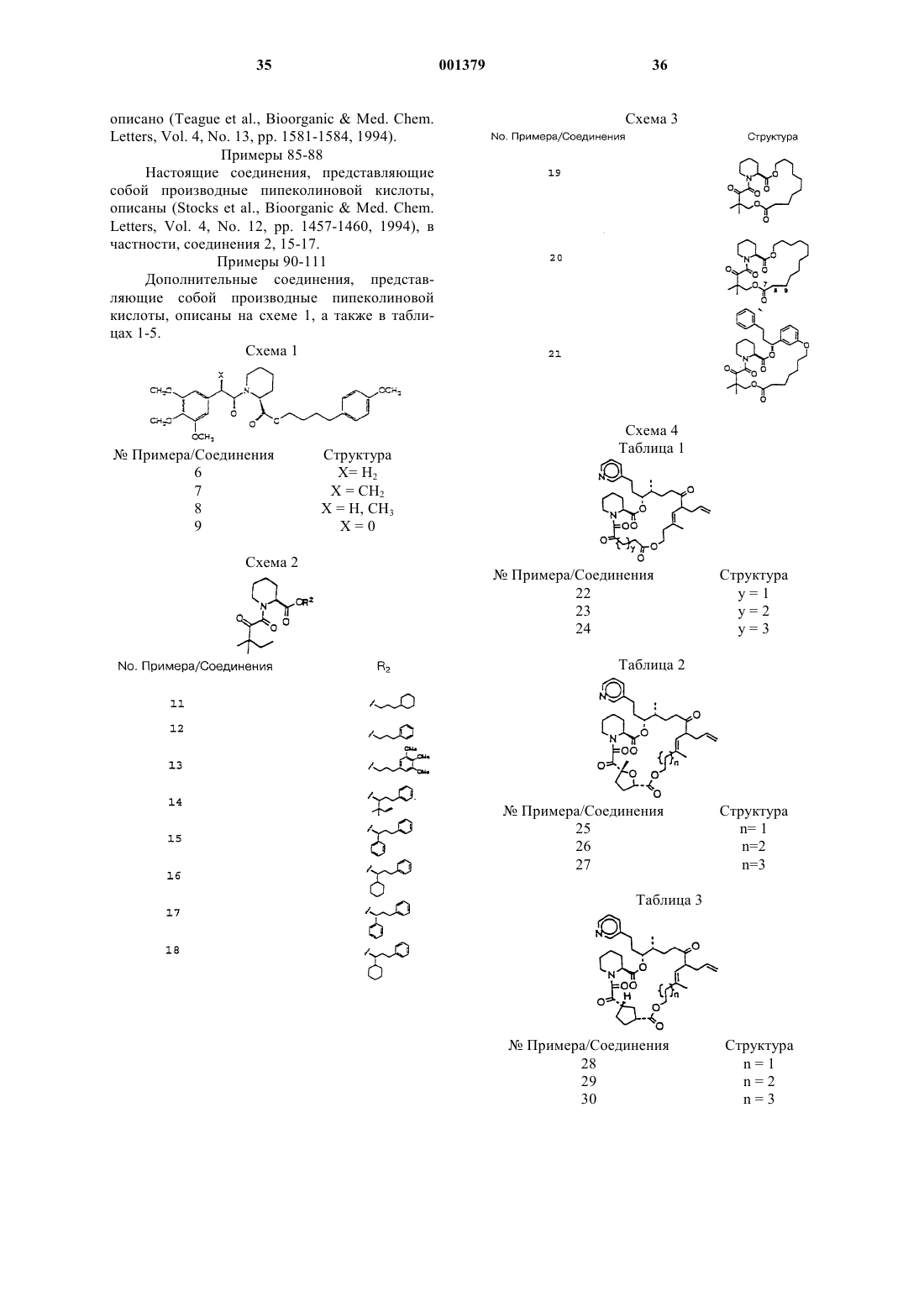
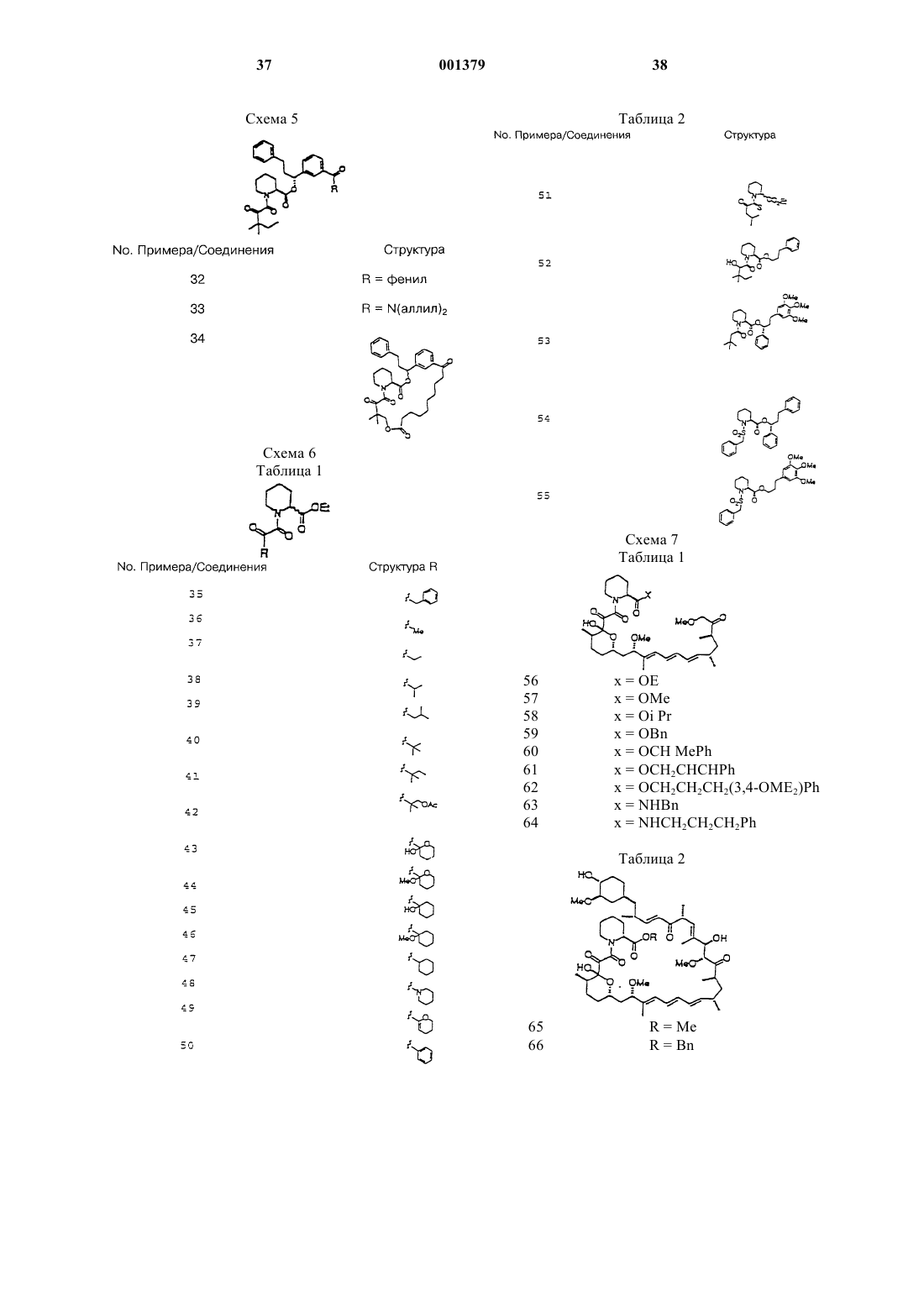
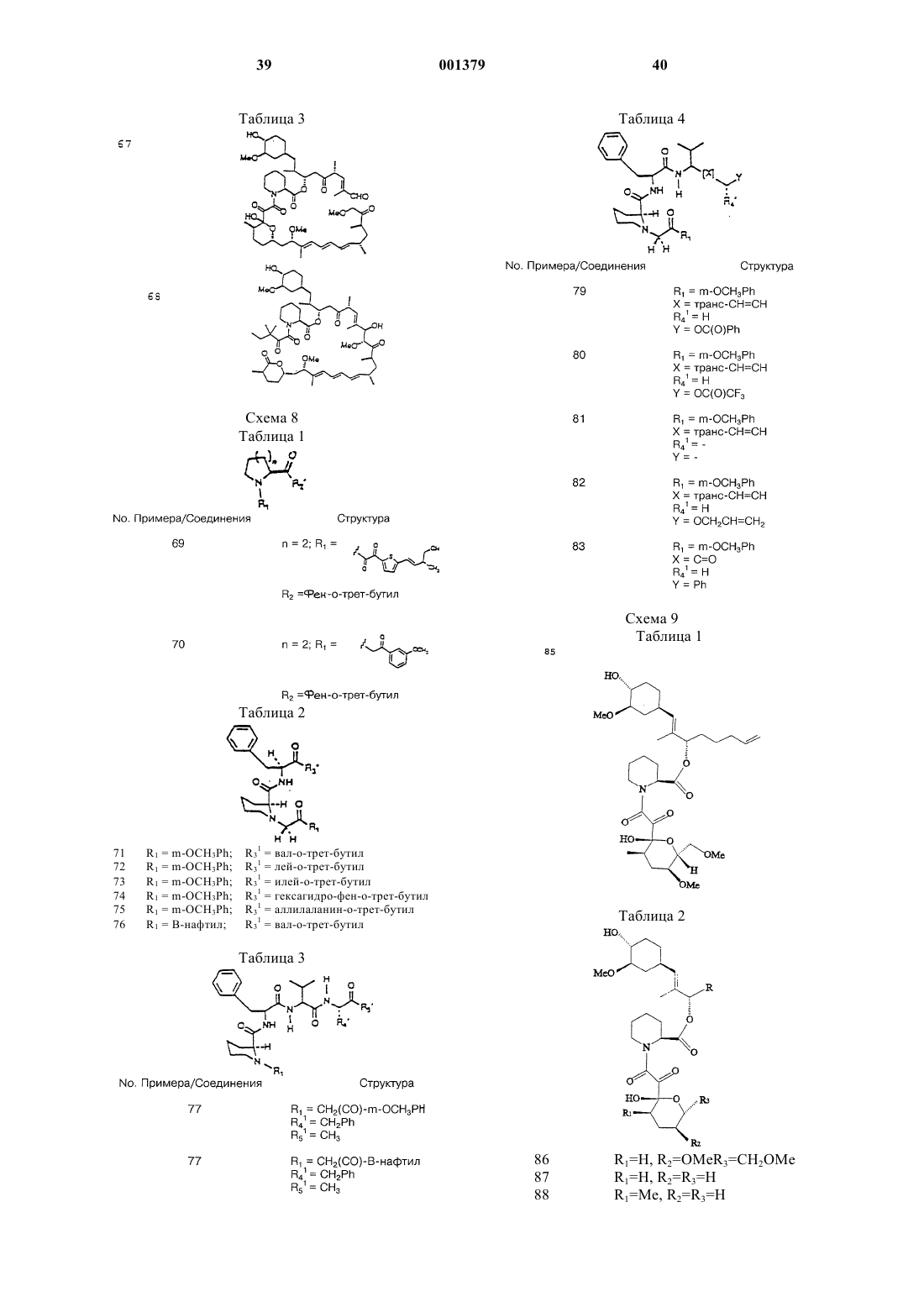
6. Способ по п.1, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 86-88 и 90-111.
7. Способ по п.1, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации.
8. Способ по п.1, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации.
9. Способ по п.1, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ.
10. Способ по п.1, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ.
11. Способ по п.1, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ.
12. Способ по п.1, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 200 нМ.
13. Способ по п.1, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 35 нМ.
14. Способ по п.1, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 1 нМ.
15. Способ лечения неврологического расстройства у животного путем введения животному эффективного количества неиммуносупрессорного производного пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, в комбинации с эффективным количеством нейротрофного фактора, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3, для стимуляции роста поврежденных периферических нервов или для активации регенерации нейронов, причем иммунофилины FKBP-типа проявляют ротамазную активность, а производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу:
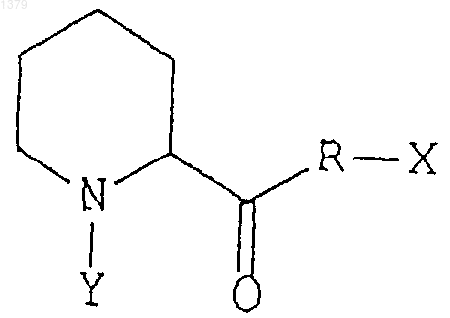
где R может быть кислородом или азотом,
Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца.
16. Способ по п.15, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из периферических невропатий, вызванных физической травмой или болезненным состоянием, физическим повреждением головного мозга, физическим повреждение спинного мозга, сосудистым ударом, сопровождающимся повреждением мозга, и неврологических расстройств, связанных с нейродегенерацией.
17. Способ по п.15, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона и амиотрофического латерального склероза.
18. Способ по п.15, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way-124,666.
19. Способ по п.15, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506.
20. Способ по п.15, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 86-88 и 90-111.
21. Способ стимуляции или активации роста поврежденных периферических нервов, при котором на поврежденные периферические нервы воздействуют эффективным количеством соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для стимуляции или активации роста поврежденных периферических нервов, причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу:
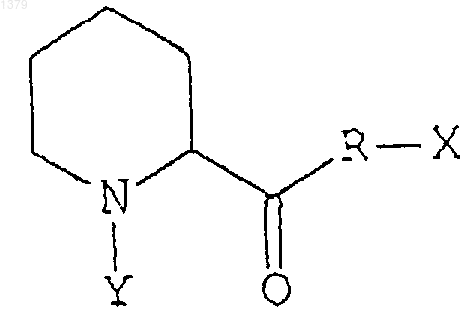
где R может быть кислородом или азотом,
Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца.
22. Способ по п.21, отличающийся тем, что дополнительно воздействуют нейротрофным фактором для стимуляции или активации роста поврежденных периферических нервов, выбранным из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3.
23. Способ по п.21, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way-124,666.
24. Способ по п.21, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506.
25. Способ по п.21, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 86-88 и 90-111.
26. Способ по п.21, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации.
27. Способ по п.21, отличающийся тем, что обеспечивают, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации.
28. Способ по п.21, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ.
29. Способ по п.21, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ.
30. Способ по п.21, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ.
31. Способ по п.21, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 200 нМ.
32. Способ по п.21, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 35 нМ.
33. Способ по п.21, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 1 нМ.
34. Способ стимуляции роста поврежденэых периферических нервов, при котором на поврежденные периферические нервы воздействуют эффективным количеством соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для стимуляции роста поврежденных периферических нервов, причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу:
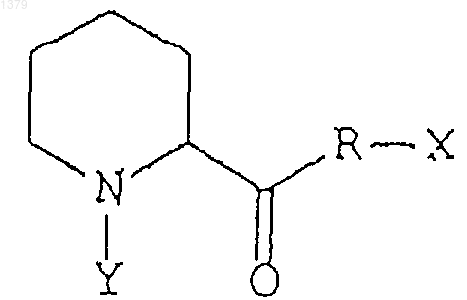
где R может быть кислородом или азотом,
Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца.
35. Способ по п.34, отличающийся тем, что дополнительно воздействуют эффективным количеством нейротрофного фактора, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3.
36. Способ по п.34, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way-124,666.
37. Способ по п.34, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506.
38. Способ по п.34, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 86-88 и 90-111.
39. Способ активации регенерации и роста нейронов у животных путем введения животному эффективного количества соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для активации регенерации нейронов, причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу:
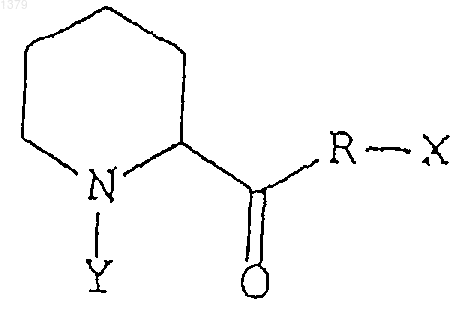
где R может быть кислородом или азотом,
Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца.
40. Способ по п.39, отличающийся тем, что дополнительно воздействуют эффективным количеством нейротрофного фактора для активации регенерации нейронов, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3.
41. Способ по п.39, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way-124,666.
42. Способ по п.39, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506.
43. Способ по п.39, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 86-88 и 90-111.
44. Способ по п.39, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации.
45. Способ по п.39, отличающийся тем, что обеспечивают, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации.
46. Способ по п.39, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ.
47. Способ по п.39, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ.
48. Способ по п.39, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ.
49. Способ по п.39, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 200 нМ.
50. Способ по п.39, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 35 нМ.
51. Способ по п.39, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 1 нМ.
52. Способ предотвращения нейродеградации у животного путем введения животному эффективного количества сoединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа для предотвращения нейродегенерации, причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу:

где R может быть кислородом или азотом,
Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца.
53. Способ по п.52, отличающийся тем, что дополнительно воздействуют эффективным количеством нейротрофного фактора для предотвращения нейродегенерации, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3.
54. Способ по п.52, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way-124,666.
55. Способ по п.52, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506.
56. Способ по п.52, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 86-88 и 90-111.
57. Способ по п.52, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации.
58. Способ по п.52, отличающийся тем, что обеспечивают, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации.
59. Способ по п.52, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ.
60. Способ по п.52, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ.
61. Способ по п.52, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ.
62. Способ по п.52, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 200 нМ.
63. Способ по п.52, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 35 нМ.
64. Способ по п.52, отличающийся тем, что нейротрофной ЭД50 достигают при применении соединения в концентрации не выше 1 нМ.
Текст
1 Родственные заявки Настоящая заявка является частичным продолжением заявки на патент США 08/474,072, поданной 7 июня 1995 г. Обоснование изобретения 1. Область изобретения. Настоящее изобретение касается способа применения нейротрофных соединений, представляющих собой производные пипеколиновой кислоты, а также обладающих сродством к иммунофилинам FKBP-типа, в качестве ингибиторов ферментативной активности, ассоциированной с иммунофилиновыми белками, в частности, в качестве ингибиторов ферментативной активности пептидил-пролил-изомеразы или ротамазы. 2. Описание предшествующих достижений в данной области. Понятие "иммунофилин" относится к ряду белков, служащих рецепторами основных иммуносупрессорных агентов, таких как циклоспорин A (CsA), FK506 и рапамицин. Известными классами иммунофилинов являются циклофилины и FК 506-связывающие белки, такие какFKBP. В то время как циклоспорин А связывается с циклофилином, FK506 и рапамицин имеют сродство к FKBP. Указанные комплексы,образованные иммунофилином и лекарственным средством, задействованы в целом ряде внутриклеточных систем сигнальной трансдукции, в особенности в иммунной и нервной системах. Известно, что иммунофилины обладают пептидил-пролил-изомеразной (PPIase), или ротамазной ферментативной активностью. Показано, что ротамазная активность задействована в катализе взаимного превращения цис- и транс-изомеров иммунофилиновых белков. Иммунофилины были впервые описаны и изучены в иммунной ткани. Исходно специалисты предполагали, что ингибирование ротамазной активности иммунофилинов приводит к подавлению пролиферации Т-лимфоцитов, что,в свою очередь, обусловливает иммуносупрессорное действие, свойственное иммуносупрессорным лекарственным средствам, таким как циклоспорин А, FKBP и рапамицин. Как показали дальнейшие исследования, само по себе ингибирование ротамазной активности недостаточно для иммуносупрессорной активности(Schreiber et al., Science, 1990, 250, 556-559). Но оказалось, что иммуносупрессия происходит вследствие образования комплекса иммуносупрессорных лекарственных средств и иммунофилинов. Было продемонстрировано, что способ действия вышеупомянутых комплексов иммунофилин-лекарственное средство обусловлен их взаимодействием с тройными белковыми мишенями (Schreiber et al., Cell 1991, 66, 807-815). Комплексы, образованные лекарственным средством и иммунофилином (такие как FKBPFK506 и FKBP-CsA), связываются с ферментом 2 кальцинейрином, ингибируя передачу сигналов рецептора Т-клеток, что приводит к пролиферации Т-клеток. Комплекс, образованный рапамицином и FKBP, взаимодействует аналогичным образом с белком RAFT1/FRAP и ингибирует передачу сигнала от рецептора IL-2. Обнаружено, что иммунофилины присутствуют в высоких концентрациях в центральной нервной системе, где их количество в 10-50 раз больше, нежели в иммунной системе. Как оказалось, в нервных тканях иммунофилины оказывают влияние на процесс роста нейронов,синтез оксида азота, а также выделение нейротрансмиттеров. Способствуя фосфорилированию синтетазы оксида азота, FK506 может функционально ингибировать образование оксида азота и таким образом блокировать нейротоксичный эффект глутамата. Действительно, низкие концентрации как FK506, так и циклоспорина А подавляют обусловленную N-метил-О-аспартатом нейротоксичность в корковых культурах. Судя по тому, что рапамицин способен обращать терапевтический эффект FK506, молекулы FKBP играют в этом процессе опосредующую роль. Считается, что FK506, имеющийся в продаже как иммуносупрессор, может клинически применяться при лечении больных, страдающих непроходимостью сосудов.FK-506 способствует также фосфорилированию белка 43 (GAP43), ассоциированного с ростом. GAP43 вовлечен в процессы удлинения нейронов, и оказывается, что фосфорилирование данного белка усиливает его активность. В соответствии с этим, на клетках РС 12 было исследовано влияние FK-506, рапамицина и циклоспорина А на процессы удлинения нейронов. Клетки РС 12 представляют собой поддерживаемую линию нейроноподобных клеток, у которых под действием фактора роста нервов(NGF) происходит удлинение аксонов. Удивительным оказался тот факт, что пикомолярные концентрации иммуносупрессоров,таких как FK-506 и рапамицин, стимулируют внешний рост аксона у клеток РС 12 и чувствительных нервов, в частности, у клеток спинномозговых узлов (DRGs) (Lyons et al., proc. Natl.Acad. Sci. USA, 1994, 91, 3191-3195). В экспериментах, проводимых на целых животных, дляFK506 продемонстрированы его способность стимулировать регенерацию нервов после лицевой нервной хирургии, а также позитивные результаты в функциональном восстановлении у животных с повреждениями седалищного нерва. Более конкретно, было обнаружено, что лекарственные препараты, обладающие высоким сродством к FKBP, являются мощными ингибиторами ротамазы и оказывают превосходное нейротрофное действие (Snyder et al., "Immunophilins and the Nervous System", NatureMedicine, Volume 1, No. 1, January 1995, 32-37). На основании этих открытий было предложено 3 применение иммуносупрессоров при лечении различных периферических невропатий, а также для усиления процесса восстановления нервов в центральной нервной системе (ЦНС). Как показали проведенные исследования, причиной нейродегенеративных расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз (ALS) может служить потеря или снижение биологической доступности нейротрофного вещества, специфичного для конкретной популяции нейронов,пораженных указанным заболеванием. Выявлено несколько нейротрофных факторов, оказывающих влияния на определенные популяции нейронов в центральной нервной системе. В частности, было высказано предположение о том, что болезнь Альцгеймера возникает в результате уменьшения содержания или исчезновения фактора роста нервов (NGF). В связи с этим, было высказано предположение,что пациентов с болезнью Альцгеймера можно лечить экзогенным фактором роста нервов или другими нейротрофными белками, такими как ростовой фактор, полученный из мозга, фактор роста глиального происхождения, цилиарный нейротрофный фактор, а также нейротропин-3,в результате чего будет наблюдаться повышение выживаемости дегенерирующих популяций нейронов. Клиническое применение указанных белков для лечения различных болезненных неврологических состояний затруднено сложностями введения и биологической доступности крупных белков по отношению к мишеням нервной системы. Напротив, лекарственным препаратам,обладающим иммунодепрессантным действием и нейротрофной активностью, свойственны относительно небольшие размеры, а также великолепные биологическая доступность и специфичность. Вместе с тем, при хроническом применении иммунодепрессантов наблюдается ряд потенциально опасных побочных эффектов, в том числе нейротоксичность (например, нарушение гломерулярной фильтрации и необратимый интерстициальный фиброз (Корр et al.,1991, J. Am. Soc. Nephrol. 1: 162; неврологические дефициты (например, непроизвольные треморы) или неспецифическая церебральная стенокардия (например, не локализуемые головные боли (De Groen et al., 1987, N. Engl. J.Med. 317:861; а также васкулярная гипертензия с проистекающими от нее осложнениями(Kahan et al., 1989, N. Engl. J. Med. 321:1725). Согласно настоящему изобретению предложены имеющие небольшие молекулы ингибиторы ротамазы FKBP, содержащие соединения,представляющие собой неиммуносупрессорные,также как и иммуносупрессорные производные пипеколиновой кислоты, которые чрезвычайно эффективны в удлинении аксонов, стимуляции роста и регенерации нейронов при различных невропатологических ситуациях, когда может 4 быть облегчено восстановление нервов, в частности при повреждении периферических нервов в результате физической.травмы или болезненного состояния, такого как диабет, физического повреждения центральной нервной системы(спинного или головного мозга), повреждения мозга при ударе, а также для лечения неврологических расстройств, связанных с нейродегенерацией, в том числе болезни Паркинсона, болезни Альцгеймера и бокового амиотрофического склероза. Краткое описание изобретения Настоящее изобретение касается способа применения нейротрофных соединений, представляющих собой производные пипеколиновой кислоты, а также обладающих сродством к иммунофилинам FKBP-типа, в качестве ингибиторов ферментативной активности, ассоциированной с иммунофилиновыми белками, в частности, в качестве ингибиторов ферментативной активности пептидил-пролил-изомеразы или ротамазы. Предпочтительный вариант воплощения настоящего изобретения предусматривает способ лечения неврологического расстройства у животного путем введения животному эффективного количества неиммуносупрессорного производного пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBPтипа, для стимуляции роста поврежденных периферических нервов или для активации регенерации нейронов, причем иммунофилиныFKBP-типа проявляют ротамазную активность,а производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. Еще один предпочтительный вариант воплощения настоящего изобретения предусматривает способ лечения неврологического расстройства у животного путем введения животному эффективного количества неиммуносупрессорного производного пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, в комбинации с эффективным количеством нейротрофного фактора, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3, для стимуляции роста поврежденных периферических нервов или для активации регенерации нейронов,причем иммунофилины FKBP-типа проявляют 5 ротамазную активность, а производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. Еще один предпочтительный вариант воплощения настоящего изобретения предусматривает способ стимуляции или активации роста поврежденных периферических нервов, при котором на поврежденные периферические нервы воздействуют эффективным количеством соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для стимуляции или активации роста поврежденных периферических нервов,причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. Еще один предпочтительный вариант воплощения настоящего изобретения предусматривает способ стимуляции роста поврежденных периферических нервов, при котором на поврежденные периферические нервы воздействуют эффективным количеством соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBPтипа, для стимуляции роста поврежденных периферических нервов, причем иммунофилиныFKBP-типа проявляют ротамазную активность,а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х 6 и Y могут быть связаны друг с другом с образованием кольца. Еще один предпочтительный вариант воплощения настоящего изобретения предусматривает способ активации регенерации и роста нейронов у животных путем введения животному эффективного количества соединения, представляющего собой производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для активации регенерации нейронов, причем иммунофилины FKBPтипа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. Еще один предпочтительный вариант воплощения настоящего изобретения предусматривает способ предотвращения нейродегенерации у животного путем введения животному эффективного количества соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBPтипа, для предотвращения нейродегенерации,причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. Краткое описание иллюстраций Фиг. 1 - фиг. 1 А: экспрессия FKBP-12 иGAP-43 в фасциальном ядре после нарушения целостности нерва. Сравнение временных параметров экспрессии мРНК, специфичной дляFKBP-12 (слева) и GAP-43 (справа), с помощью гибридизации in situ. Фиг. 1 В: справа - фасциальное ядро, расположенное ипсилатерально по отношению к месту повреждения, слева неповрежденный контроль. Гибридизация in situ с пробой на FKBP-12 в неповрежденном контроле (слева), а также с пробой на кальцинейрин 7 Аа,b через 7 дней после нарушения целостности фасциального нерва (справа). Эксперименты были воспроизведены по меньшей мере в трех повторностях со сходными результатами. Фиг. 2 - локализация FKBP-12 в пределах фасциальных моторных нейронов после нарушения целостности нерва. Микрофотографии с освещенным полем гибридизации in situ с пробой на FKBP-12 в моторных нейронах фасциального ядра через 7 дней после указанного повреждения (фиг. 2 А), а также в моторных нейронах контрольного фасциального ядра (фиг. 2 В). Фиг. 3 - увеличение количества мРНКFKBP-12 в моторных нейронах поясничного отдела спинного мозга после нарушения целостности седалищного нерва. Гибридизация insitu с пробой на FKBP-12 через 7 дней после повреждения правого седалищного нерва. На верхней панели (фиг. 3 А) представлен ответ моторных нейронов переднего рога нижнего поясничного отдела спинного мозга (показаны стрелкой). На нижних панелях представлены микрофотографии с освещенным полем соответствующих пулов моторных нейронов: слева контралатерального по отношению к указанному повреждению нерва (фиг. 3 В), справа - ипсилатерального по отношению к указанному повреждению нерва (фиг. 3 С). Данный эксперимент был воспроизведен трижды со сходными результатами. Фиг. 4 - индукция мРНК FKBP и FKBP-12 в спинномозговом узле через 1 и 6 недель после нарушения целостности седалищного нерва. Микрофотографии с темным полем срезов через спинномозговой узел L4, расположенный ипсилатерально по отношению к указанному повреждению седалищного нерва: левые панели гибридизация in situ с пробой на FKBP, правые панели - авторадиография с [3 Н] FK506. Для каждой временной точки эти результаты были воспроизведены трижды. Фиг. 5 - повреждение правого фасциального нерва рицином. Окрашивание по Нисслу(Nissl), проведенное через 7 дней после инъекции рицина в фасциальный нерв, выявляет существенную дегенерацию моторных нейронов правого фасциального ядра, а также сопровождающую ее пролиферацию узла (нижняя панель,фиг. 5 А). На верхней панели (фиг. 5 В) представлена гибридизация in situ с пробой на мРНКFKBP, проведенная через 7 дней после инъекции рицина в фасциальный нерв или фасциальное ядро. Данный эксперимент был воспроизведен трижды со сходными результатами. Фиг. 6 - связывание [3 Н] FK506 в сегментах седалищного нерва через 7 дней после повреждения. На диаграмме представлены результаты, полученные на 3-миллиметровых сегментах указанного нерва: сужения обозначают положения лигатур, наложенных на 7-й день на 6 001379 8 часовой период сбора, как это описано в приводимых методах. Дистальная лигатура расположена на 10 мм проксимальнее участка исходного повреждения. Антероградный транспортFKBP составляет 124 мм в день. Представленные данные соответствуют средним значениям+/-С.О.И. (n = 3). Фиг. 7 - транспорт FKBP в седалищном нерве. Микрофотографии с темным полем срезов через контрольный (неповрежденный) седалищный нерв и через поврежденный участок седалищного нерва через 7 дней после нанесения повреждения; представлены результаты гибридизации in situ с пробами на FKBP-12(фиг. 7 А и фиг. 7 В, соответственно), а также авторадиографии с [3H] FK506 (фиг. 7 С и фиг. 7D, соответственно). Стрелкой показан участок повреждения исследуемого нерва. Данный эксперимент был воспроизведен трижды со сходными результатами. Фиг. 8 - интенсивность связывания [3 Н]FK506 в клетках PC-12 в присутствии или в отсутствие NGF (50 нг/мл). n = 3 для каждой временной точки. Приведенные ошибки соответствуют С.О.И. Фиг. 9 - влияние иммуносупрессорного соединения на удлинение аксонов у клеток PC-12. Микрофотографии культур, выращенных в течение 48 ч в присутствии NGF в присутствии или в отсутствие добавленного FK506 или рапамицина; фотографии получены с использованием контраста Hoffman (64). Представлены клетки PC-12, выращенные в присутствии 1,0 нг/мл NGF (фиг. 9 А); 50 нг/мл NGF (фиг. 9 В); 1,0 нг/мл NGF и 100 нМ FK506 (фиг. 9 С); 1,0 нг/мл NGF и 100 нМ рапамицина (фиг. 9D). Увеличение 200 х. Фиг. 10 - влияние FK506 на удлинение аксонов у клеток PC-12. Клеточные культуры обрабатывали различными концентрациями NGF в присутствии или в отсутствие 100 нМ FK506,измерение длины аксонов проводили через 48 ч. Степень удлинения аксонов оценивали таким же образом, как это описано в Методах, подсчитывая клетки, у которых размер аксонов превышал 5 мкм. Для каждой точки проведено 4 независимых повтора, приведенные интервалы соответствуют СОИ (среднеквадратичная ошибка измерения). Фиг. 11 - зависимость концентрация-ответ для вызванного FK506 удлинения аксонов у клеток PC-12. В течение 48 ч клетки обрабатывали 1 нг/мл NGF, а также различными концентрациями FK506. Оценку удлинения аксонов проводили таким же образом, как это описано в пояснениях к фиг. 10 и методах. Для каждой точки проведено 4 независимых эксперимента,р 0.001 по t-критерию Стъюдента. Фиг. 12 - авторадиография с [3 Н] FK506 на культурах спинномозгового узла. Экстенсивное воздействие, заключавшееся в 26-дневном куль 9 тивировании клеток в присутствии 100 нг/млNGF, приводило к появлению многочисленных зерен серебра, ассоциированных с молекуламиFKBP. Возникновение указанных авторадиографических зерен подавляется при добавлении 1 мнМ не меченного FK506. Фиг. 13 - фазово-контрастные микрофотографии спинномозговых узлов, выращиваемых в присутствии различных веществ: 100 нг/млNGF (фиг. 13 А); 1 мкМ FK506 (фиг. 13 В); 1 мкМ FK506 и aнти-NGF-антитело (фиг. 13 С); в отсутствие ростового фактора (Фиг. 13D); 1 пМFK506 (фиг. 13 Е); 1 мкМ FK506 и 1 мкМ рапамицина (фиг. 13F). Масштабный отрезок составляет 205 мкм. NGF обуславливает мощное удлинение аксонов (фиг. 13 А), аналогичный эффект свойственен 1 мкМ FK506 (фиг. 13 В). Действие FK506 существенно ослабляется при уменьшении его концентрации до 1 пМ (фиг. 13 Е). Тем не менее, интенсивность удлинения аксонов в присутствии 1 пМ FK506 превышает аналогичный показатель в отсутствие указанного соединения (фиг. 13D). Кроме того, эффективность FK506 снижается при добавлении специфичных к NGF антител, что необходимо для предотвращения эффектов, которые обусловлены NGF, вырабатываемым присутствующими в культуре клетками не нейронной природы. Многочисленные аксоны, образующиеся в виде крупных пучков в ответ на 100 нг/мл NGF (фиг. 13 А) или 1 мкМ FK506 (фиг. 13 В), выглядят белыми, в то время как небольшие пучки и отдельные аксоны выглядят черными. Наличие клеток не нейронной природы (Шванновских клеток и некоторых фибробластов) более очевидно при действии 1 пМ FK506 (фиг. 13 Е),либо антител, специфичных к NGF (фиг. 13 С),нежели при действии 1 мкМ FK506 (фиг. 13 В).NGF, который вырабатывается присутствующими в указанных культурах клетками не нейронной природы, ограничивает удлинение аксонов, наблюдаемое в культурах, выращиваемых в отсутствие экзогенных ростовых факторов (фиг. 13D). Большое количество клеток не нейронной природы, которые вследствие свой преломляющей способности выглядят белыми, приводит к затенению отдельных аксонов (фиг. 13D). Рапамицин полностью подавляет удлинение аксонов в присутствии FK506 (фиг. 13F). На микрофотографиях представлены 12-30 узлов из одинаковых вариантов эксперимента. Различия между всеми экспериментальными группами были высоковоспроизводимыми. Фиг. 14 - влияние FK506 и рапамицина на обусловленное NGF удлинение аксонов у клеток PC-12. Клетки PC-12 (60-й пассаж), обрабатывали различными концентрациями либо только NGF, либо NGF в присутствии 100 нМFK506, 100 нМ рапамицина или 100 нМ WAY124,466. Оценку удлинения аксонов проводили через 96 ч; в качестве позитивных рассматривали клетки, у которых длина аксонов превышала 10 диаметр самой клетки. Для каждой точки проведено 3 независимых эксперимента, ошибки определения представлены как С.О.И. Фиг. 15 - пикомолярные концентрации(В) усиливают удлинение аксонов, обусловленное NGF (0,5 нг/мл) у клеток PC-12. Непродолжительно пассированные клетки PC-12 в течение 4 дней обрабатывали 0,5 нг/мл NGF в присутствии различных концентраций FK506 ( ),рапамицинаили WAY-124,466 (о). Оценку реакции аксонов проводили таким же образом,как в случае фиг. 14. Интенсивность образования аксонов в присутствии NGF в концентрации 0,5 нг/мл (обозначено L) и 50 нг/мл (обозначено Н) приведена для сравнительных целей. Фиг. 16 - микрофотографии клеток PC-12,обработанных иммунофилиновым лигандом+0,5 нг/мл NGF или 50 нг/мл NGF. Фиг. 17 - иммунофилиновые лиганды снижают количество NGF, необходимое для достижения максимального удлинения аксонов в чувствительных ганглиях цыпленка. Экспланты целых спинномозговых узлов, выделенные у 910-дневных зародышей цыпленка, культивировали при температуре 37 С в атмосфере с 5%-м содержанием СO2; культивирование проводили в 12-луночных платах, покрытых тонким слоемMatrigel, на среде L15 с высоким содержанием глюкозы, добавкой 10%-й фетальной сыворотки теленка, а также 10 мкМ пенициллина и стрептомицина Аrа С. В течение 48 ч чувствительные ганглии обрабатывали 1 нг/мл NGF, 1 нг/млNGF + 100 нМ FK506, либо 100 нг/мл NGF, после чего проводили подсчет и фотографирование нейронного ответа. Фиг. 18 - FK506, рапамицин и WAY124,466 усиливают обусловленное NGF образование аксонов в чувствительных ганглиях. Культивирование эксплантов DRG проводили таким же образом, как это описано выше в пояснениях к фиг. 17. К указанным культурам эксплантов DRG добавляли FK506, рапамицин или WAY-124,466 (каждый в концентрации 100 нМ), в присутствии или в отсутствие 0,1 нг/млNGF. Через 48 ч проводили оценку удлинения аксонов и фотографирование исследуемых культур. Фиг. 19 - микрофотография удлинения аксонов, обусловленного соединением из примера 111 на культурах узлов цыпленка. На трех представленных панелях показано удлинение аксонов, вызываемое соединением из примера 111 в концентрации 1 пМ (левая панель), 100 пМ(центральная панель) и 100 нМ (правая панель). Фиг. 20 - микрофотография удлинения аксонов, обусловленного соединением из примера 17 на культурах спинномозговых узлов цыпленка. На трех представленных панелях показано удлинение аксонов, вызываемое соединением из примера 17 в концентрации 1 пМ (левая па 11 нель), 100 пМ (центральная панель) и 100 нМ(правая панель). Фиг. 21 - микрофотография удлинения аксонов, обусловленного соединением из примера 102 на культурах спинномозговых узлов цыпленка. На трех представленных панелях показано удлинение аксонов, вызываемое соединением из примера 102 в концентрации 1 пМ (левая панель), 100 пМ (центральная панель) и 100 нМ(правая панель). Детальное описание изобретения Предусмотренные настоящим изобретением новые нейротрофные соединения, представляющие собой производные пипеколиновой кислоты, обладают сродством к белкам, связывающим FK506, в частности, к FKBP-12. Оказалось, что при своем связывании с FKBP предусмотренные настоящим изобретением нейротрофные соединения ингибируют пролилпептидил-цис-транс-изомеразную или ротамазную активности связывающего белка, в результате чего происходит неожиданная стимуляция удлинения аксонов. Предусмотренные настоящим изобретением соединения могут быть использованы в форме солей, образованных неорганическими или органическими кислотами и основаниями. К числу указанных солей, образованных кислотами, принадлежат следующие: ацетат, адипат,альгинат, аспартат, бензоат, бензолсульфонат,бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат,додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид,гидроиодид, 2-гидроксиэтансульфонат, лактат,малеат, метансульфонат, 2-нафталенсульфонат,никотинат, оксалат, памоат, пектинат, пропионат, сукцинат, тартрат, тиоционат, тозилат, а также ундеканоат. К числу солей, образованных основаниями, относятся: соли аммония, соли щелочных металлов (такие как натриевые и калиевые соли), соли щелочно-земельных металлов (такие как кальциевые и магниевые соли),соли, образованные органическими основаниями (такие как соли дициклогексиламина и Nметил-D-глюкамин), а также соли, образованные аминокислотами (такими как аргинин, лизин и т.п.). Кроме того, основные азотсодержащие группы могут быть переведены в состояние четвертичных солей с помощью таких агентов,как низшие алкилгалогениды (например, метил, этил-, пропил- и пентилхлориды, -бромиды или -иодиды), диалкилсульфаты (например, диметил-, диэтил-, дибутил- и диамилсульфаты),галогениды длинноцепочечных углеводородов(например, децил-, лаурил-, миристил- и стеарилхлориды, -бромиды или -иодиды), аралкилгалогениды (например, бензил- и фенетилбромиды), а также другие соединения. При этом получают продукты, растворимые или диспергируемые в воде или масле. 12 Предусмотренные настоящим изобретением нейротрофные соединения можно периодически вводить пациенту, проходящему лечение от неврологических расстройств, либо в других целях, при необходимости стимулировать нейронную регенерацию и рост, например, при различных периферических невропатических и неврологических расстройствах, сопровождающихся нейродегенерацией. Кроме того, предусмотренные настоящим изобретением соединения можно применять для млекопитающих, отличных от человека, при лечении разнообразных неврологических расстройств млекопитающих. Предусмотренные настоящим изобретением новые соединения являются мощными ингибиторами ротамазной активности и проявляют высокую степень нейротрофной активности. Указанный эффект может быть использован для стимуляции поврежденных нейронов, активации регенерации нейронов, предотвращения нейродеградации, а также при лечении некоторых неврологических расстройств, которые, как известно, сопровождаются деградацией нейронов и периферическими невропатиями. К числу указанных неврологических расстройств, лечение которых можно проводить вышеописанным способом, относятся в частности: невралгия тройничного нерва, языкоглоточная невралгия,паралич Белла (Bell's), тяжелая псевдопаралитическая миастения, мускульная дистрофия, боковой амиотрофический склероз, прогрессирующая мускульная атрофия, прогрессирующая бульбарная наследственная мускульная атрофия, синдромы, обусловленные грыжами, переломами или выпадениями межпозвонковых дисков, шейный спондилез, заболевания нервных сплетений, синдромы сквозных повреждений грудной клетки, периферическая невропатия(вызываемая, в частности, отравлениями свинцом, дапсоном, укусами клещей, порфирия, либо синдром Гийена-Барре-Штроля (GuiilianBarre), болезнь Альцгеймера, болезнь Паркинсона. В указанных целях предусмотренные настоящим изобретением соединения можно вводить перорально, парентерально, посредством ингаляции, местно, ректально, назально, буккально, вагинально, либо с помощью имплантируемой емкости, с использованием дозированных составов, содержащих традиционные нетоксичные фармацевтически приемлемые наполнители, адъюванты и наполнители. В настоящей заявке понятие '"парентеральное введение" включает в себя подкожное, внутривенное,внутримышечное,внутрибрюшинное,внутриоболочковое, внутрижелудочковое, внутригрудинное или внутричерепное введение с помощью инъекции или вливания. Для того, чтобы комплекс, образованный иммунофилином и лекарственным средством,оказался терапевтически эффективным по от 13 ношению к мишеням центральной нервной системы, он должен успешно преодолевать гематоэнцефалический барьер в случае периферического введения. Предусмотренные настоящим изобретением соединения, не способные преодолевать гематоэнцефалический барьер, могут успешно применяться путем внутрижелудочкового введения. Рассматриваемые фармацевтические составы могут находиться в форме стерильного препарата, предназначенного для инъекции,например, в виде стерильной водной или масляной суспензии, предназначенной для инъекции. Указанная суспензия может быть получена в соответствии со способами, известными из уровня техники, с использованием приемлемых диспергирующих или смачивающих агентов, а также суспендирующих агентов. Кроме того,инъецируемый стерильный препарат может представлять собой предназначенный для инъекции стерильный раствор или суспензию в нетоксичном разбавителе или растворителе, пригодном для парентерального введения (например, раствор в 1,3-бутандиоле). К числу приемлемых носителей и растворителей, пригодных к такого рода использованию, относятся вода,раствор Рингера, а также изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспензионной среды традиционно используют стерильные стабильные масла. Для этих целей может быть использовано любое стабильное мягкое масло, в том числе искусственные моно- или диглицериды. Жирные кислоты, такие как масляная кислота и ее глицеридные производные, а также оливковое и касторовое масла (особенно в своих полиоксиэтилированных формах), находят применение при производстве инъецируемых препаратов. Кроме того, указанные масляные растворы или суспензии могут содержать в качестве разбавителей или диспергирующих агентов спирты с длинными углеводородными цепями. Указанные соединения можно вводить перорально, например в форме капсул или таблеток, либо в виде водной суспензии или раствора. При изготовлении таблеток, предназначенных для перорального введения, традиционно используемыми носителями являются лактоза и кукурузный крахмал. Кроме того, обычно добавляют смягчающие вещества, такие как стеарат магния. К числу удобных разбавителей, используемых при получении капсул для перорального введения, относятся лактоза и сухой кукурузный крахмал. В том случае, если для перорального введения используются водные суспензии, активный ингредиент комбинируют с эмульгирующими и суспендирующими агентами. При желании можно добавлять определенные подсластители, ароматизаторы и/или красители. Предусмотренные настоящим изобретением соединения также можно применять в форме 14 суппозиториев, предназначенных для ректального введения соответствующего лекарственного средства. Подобные составы могут быть получены при смешивании указанного лекарственного средства с приемлемым не раздражающим наполнителем, для которого характерно твердое состояние при комнатной температуре,но жидкое состояние при температуре, свойственной прямой кишке, в результате чего рассматриваемый наполнитель должен таять в прямой кишке и высвобождать указанное лекарственное средство. К числу такого рода веществ относятся масло какао, пчелиный воск, а также полиэтиленгликоли. Предусмотренные настоящим изобретением соединения также можно вводить локально,особенно в том случае, если требующие лечения симптомы затрагивают участки или органы,полностью доступные для местной обработки; к числу подобных заболеваний относятся неврологические заболевания глаз, кожи, либо нижние отделы кишечного тракта. Соответствующие составы, предназначенные для местного применения, могут быть приготовлены для каждой из указанных частей тела. В случае введения через слизистую глаза указанные соединения могут быть использованы в форме микронизированных суспензий в изотоническом стерильном солевом растворе с доведенным рН, либо в предпочтительном случае - в виде растворов в изотонических стерильных солевых растворах с доведенным рН, возможно содержащих консерванты, такие как хлорид бензилалкония, либо не содержащих их. В альтернативном случае введения через слизистую глаза рассматриваемые соединения могут применяться в составе мази, например, на основе вазелина. При местном нанесении на кожу указанные соединения могут быть изготовлены в форме приемлемой мази, включающей в себя соответствующее соединение, суспендированное или растворенное в смеси, содержащей, например, по меньшей мере одно или большее число следующих веществ: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль,соединение полиоксиэтилена полиоксипропилена, эмульгирующий воск, а также воду. В альтернативном случае рассматриваемое соединение можно использовать в форме приемлемого лосьона или крема, включающего в себя соответствующее активное соединение, суспендированное или растворенное в смеси, содержащей,например, одно или несколько следующих веществ: минеральное масло, моностеарат сорбитана, полисорбат 60, цетил-эфирный воск, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт, а также воду. Местное введение через нижние отделы кишечного тракта может быть достигнуто с использованием состава, представляющего собой ректальный суппозиторий (см. выше), либо с 15 помощью приемлемого состава, вводимого посредством клизмы. Для лечения вышеупомянутых состояний указанные соединения, представляющие собой активный ингредиент, можно использовать в дозах в пределах от 0,1 мг до 10 000 мг; предпочтительные дозы находятся в пределах от 0,1 мг до 1 000 мг. Конкретное количество активного ингредиента, смешиваемого с соответствующими веществами-носителями для получения разовой дозы, зависит от особенностей конкретного пациента, а также способа введения. Вместе с тем, хорошо известно, что конкретный уровень дозы для каждого конкретного пациента зависит от целого ряда факторов,включая активность используемого специфического соединения, возраст, вес тела, общее состояние здоровья, пол, тип диеты, длительность применения, интенсивность выведения, комбинация лекарственных средств, степень тяжести конкретного заболевания, лечение которого проводят указанным соединением, а также способ введения. Рассматриваемые соединения могут быть введены совместно с другими нейротрофными агентами, такими как нейротрофный ростовый фактор (NGF), ростовый фактор глиального происхождения, ростовый фактор, полученный из мозга, цилиарный нейротрофный фактор, а также нейротропин-3. Дозовое количество подобных лекарственных средств, обладающих нейротрофной активностью, должно зависеть от вышеописанных параметров, а также от нейротрофной эффективности используемой комбинации лекарственных средств. Материалы и методы Сдавливание седалищного нерва Настоящий пример показывает наличие высоких концентраций FKBP в нормальном периферическом нерве, еще более увеличивающихся после сдавливания нерва. Если FKBP физиологически вовлечены в процесс удлинения нейронов под действиемGAP-43, можно предполагать наличие высоких концентраций FKBP в периферическом нерве. В соответствии с этим, мы измерили интенсивность связывания [3 Н] FK-506 в седалищном нерве крысы, а также в конусах роста, выделенных из 2-дневных детенышей крысы, а полученные данные сравнили с аналогичными значениями для коры головного мозга, а также некоторых периферических тканей. Авторадиографию с [3 Н] FK-506 проводили в соответствии с описанными методами на нефиксированных срезах, которые после оттаивания и воздушного высушивания подвергали преинкубации в течение 1 ч в буфере, содержащем 50 мМ Hepes, 2 мг/мл альбумина сыворотки быка, 5% этанола, а также 0.02% Tween 20 рН 7,4. Затем указанные срезы в течение 1 ч обрабатывали 1 нМ [3 Н] FK-506 (86,5 Ки/мМ; 16 буфере при комнатной температуре. Для выявления неспецифического связывания добавляли 1 мкМ FK-506. По окончании инкубации обработанные препараты промывали ледяным преинкубационным буфером (4 х 5 мин) и подвергали воздушному высушиванию. После этого полученные радиоактивно меченные срезы совмещали с чувствительной к тритию пленкой или покровными стеклами, покрытыми эмульсией Kodak NTB-2. Таблица 1 Связывание [3 Н] FK-506 с седалищным нервом и конусами роста А. Связывание [3 Н] FK-506 с седалищным нервом Вmax Ткань(пМоль/мг белка) Взрослые крысы: седалищный нерв 22,1 кора головного мозга 38,0 тимус 9,5 селезенка 8,0 Новорожденные крысы: передний мозг 25,5 конусы роста 10,2 Б. Связывание [3 Н] FK-506 после раздавливания седалищного нерваBmах Белок фМоль/сегмент пМоль/мг длиной 5 мм Без сдавливания 31,82,1 21,21,4 Через 7 дней после сдавливания 136,515,7 40,12,0 Связывание [3 Н] FK-506 в соответствии с описанием в разделе Методы. Данные, представленные в таблице 1 А, были воспроизведены трижды с менее чем 10%-м варьированием. Данные, представленные в таблице 1 Б, соответствуют средним значениям .+/- С.О.И. (n = 3).По t-критерию Стьюдента р 0,05 для независимых событий. Среди всех исследованных тканей седалищный нерв характеризуется наиболее высокими значениями связывания, указанные значения несколько выше соответствующих показателей в случае коры головного мозга и приблизительно на порядок превышают интенсивность связывания в тимусе и селезенке, которые содержат FKBP, ассоциированные с лимфоцитами(таблица 1 А). Участие FKBP в процессах регенерации нервов становится очевидным из результатов экспериментов по сдавливанию седалищного нерва у взрослых крыс, в ходе которых через 7 дней после указанного повреждения нерва проводили измерение интенсивности связывания[3 Н] FK-506 в сегментах длиной 5 мм, расположенных в непосредственной близости по отношению к участку повреждения. 17 Крыс линии Sprague-Dawley весом 175-200 г анестезировали смесью ромпуна (12 мг/кг) и кетамина (30 мг/кг). У анестезированных крыс в асептических условиях сдавливали лицевой нерв, дважды пережимая его ювелирным пинцетом на 30 с на расстоянии 2 мм от выхода указанного нерва из шилососцевидного отверстия. Аналогичную процедуру проводили для сдавливания седалищного нерва на уровне среднего бедра. Общая интенсивность связывания в сегменте, расположенном в непосредственной близости по отношению к участку повреждения, в 4 раза превышала контрольные показатели. Учитывая повышенное общее содержание белка в указанном близлежащем сегменте, интенсивность связывания [3 Н] FK-506 в пересчете на мг белка превышала контрольные показатели только в 2 раза. Сдавливание лицевого нерва Настоящий пример свидетельствует о том,что повреждения лицевого нерва повышают уровень экспрессии FKBP и GAP-43. После сдавливания лицевого нерва в ядре лицевого нерва происходит повышение количества мРНК, кодирующей GAP-43. Используя метод гибридизации in situ, мы исследовали количество мРНК, специфичных для FKBP,GAP-43 и кальцинейрина, после повреждения лицевого нерва. Крысам внутрисердечно вливали 150-200 мл ледяного забуференного фосфатом солевого раствора (PBS: 0,1 М; рН 7,4). Выделенные ткани сразу же замораживали в изопентане (-80 С). Получали криостатные срезы толщиной 18 мкм,позволяли им оттаять и помещали на покрытые желатином предметные стекла. Гибридизацию in situ проводили таким же образом, как это описано выше, используя в качестве зондов концы антисмысловых олигонуклеотидов, меченных [35S] dАТФ. В случаеFKBP были использовали 3 различные олигонуклеотидные последовательности, комплементарные следующим районам соответствующей клонированной кДНК (Maki, et al., (1990) Proc.Natl. Acad.-Sci. USA 87, 5440-5443, and Standaert, R.F., et al. (1990) Nature 346, 671-674): 70114, 214-258 и 441-485; указанные фрагменты кДНК включены в настоящую заявку в виде ссылок. В случае GAP-43 использовали 3 различные антисмысловые олигонуклеотидные последовательности, комплементарные следующим нуклеотидам соответствующей клонированной кДНК: 961-1008, 1081-1128 и 12011248; указанные фрагменты кДНК включены в настоящую заявку в виде ссылок (Rosental, A., etal. (187) EMBO J. 6, 3641-3646). В случае кальцинейрина Аа использованные антисмысловые олигонуклеотиды были комплементарны нуклеотидам 1363-1410 и 1711-1758 (Ito et al. (1989)(1989) Biochem. Biophys. Res. Commun. 165,1352-1358); приведенные фрагменты включены в настоящую заявку в виде ссылок. Полученным срезам позволяли оттаять и высохнуть, а затем фиксировали их в течение 5 мин в 4%-ном свежедеполимеризированном параформальдегиде вPBS. Дважды промыв полученные срезы PBS,подвергали их ацетилированию 0,25%-ным уксусным ангидридом в 0,1 М триэтаноламине и 0,5%-ном NaCl (pH 8,0), после чего дегидратировали в серии спиртов, в течение 5 мин обезжиривали в хлороформе, регидратировали 95%ным этанолом и позволяли высохнуть на воздухе. Гибридизацию проводили в течение ночи при температуре 37 С в буфере, состоящем из 50% деионизированного формамида, 10% сульфата декстрана, 4 объемов SSC, 1 объема раствора Денхарда, 20 мМ фосфатного буфера, 0,1 мг/мл ДНК из спермы лосося, 0,1 мг/мл транспортной РНК дрожжей, 10 мМ дитиотрейтола,2% бета-меркаптоэтанола (BMD), 1,0 мМ ЭДТА и меченного зонда (2 000 000 импульсов в мин на срез). По окончании гибридизации полученные срезы в течение 15 мин ополаскивали 1 объемом SSC и 1,0%-ным ВМЕ при комнатной температуре, затем в течение 10 мин проводили воздушную сушку при температуре 55 С и либо помещали на пленку, либо погружали в эмульсию Kodak NTB-2. Выявляется резкое усиление экспрессииFKBP и GAP-43, в то время как в экспрессии кальцинейрина не происходит никаких изменений. Усиление экспрессии FKBP происходит уже через 24 ч после сдавливания лицевого нерва и достигает наивысших значений в течение 12 недель, через 3 недели концентрация соответствующей мРНК начинает постепенно снижаться. Как показывает исследование при более сильном увеличении, высокое содержание зерен серебра,выявляющихFKBP-специфичную мРНК, приходится на тела нервных клеток (фиг. 2). Результаты Northern-гибридизации на срезах лицевого ядра подтверждают данные о повышенном количестве FKBP-специфичной мРНК. Временные закономерности изменения количества мРНК, специфичной для GAP-43, очень похожи на соответствующие параметры дляFKBP. Напротив, ни в одной из исследованных временных точек не обнаружено никаких изменений в экспрессии кальцинейрина. Из изолированного лицевого ядра выделяли тотальную клеточную РНК. Образцы по 10 или 20 мкг тотальной РНК подвергали электрофорезу в геле, состоящем из 1% агарозы и 2,0% формальдегида, после чего переносили их на нейлоновую мембрану в 10 нМ NaOH. Гибридизацию с зондами, представляющими собой специфичную для FKBP кДНК, случайным образом меченную [35S] dCTP до специфической активности 1 х 109 импульсов в минуту на мкг, проводили в течение ночи при температуре 42 С в 19 буфере, состоящем из 50% формамида, 2xSSPE,7% SDS, 0,5% Blotto и 100 мкг/мл ДНК из спермы лосося. Полученные фильтры промывали в течение 20 мин при комнатной температуре, а затем - два раза по 15 мин при температуре 65 С; промывочный раствор состоял из 0,15xSSC и 0,15% SDS; затем указанными фильтрами в течение 48-96 ч экспонировали соответствующую пленку. На неповрежденной стороне наблюдается менее выраженное увеличение количества зерен серебра по сравнению с контролем. Этот результат вполне согласуется с данными, свидетельствующими о том, что контралатеральные нейроны также реагируют на аксотомию. У крыс, перенесших сдавливание лицевого нерва, развивается паралич лицевого нерва,проявляющийся в отсутствии подвижности усов, функциональное восстановление которой происходит через 3 недели одновременно с завершением регенерации нерва. У наших крыс после повреждения указанного нерва мы также обнаружили потерю подвижности усов с восстановлением функции через 3 недели. Таким образом, период усиленной экспрессии FKBP иGAP-43 коррелирует с процессом регенерации нерва. Регенерация седалищного нерва Настоящий пример показывает изменения в экспрессии FKBP и GAP-43, сопровождающие регенерацию седалищного нерва. После повреждения седалищного нерва количество мРНК, специфичной для GAP-43,увеличивается как в моторных нейронах спинного мозга, так и в нейронных клетках спинномозговых узлов. У крыс, перенесших повреждение седалищного нерва, мы наблюдали резкое увеличение количества указанной мРНК: специфичной для FKBP, в моторных нейронах L-4 и L-5 (фиг. 3), а также в нейронных клетках спинномозговых узлов, что согласуется с описанным усилением экспрессии GAP-43 (фиг. 4). Судя по результатам визуальных исследований при сильном увеличении, зерна серебра, выявляющие FKBP-специфичную мРНК, локализуются в телах нервных клеток (фиг. 3). Проводя авторадиографию с использованием [3 Н] FK-506 при условиях, обеспечивающих его селективное связывание с FKBP, мы следили за количеством белковых молекул FKBP (фиг. 4). Увеличение количества FKBP отмечено в первичных чувствительных нейронах спинномозговых узлов,таким образом, повреждение седалищного нерва не сопровождается видимым увеличением количества FKBP в моторных нервных клетках. Четкое совпадение повышенной экспрессии FKBP и регенерационной селективности получило дополнительное подтверждение в экспериментах с рицином. При инъекции в периферические нервы рицин транспортируется в клеточное тело и вызывает его разрушение без последующей регенерации нерва. В тот же уча 001379 20 сток лицевого нерва, который в других наших экспериментах подвергался повреждению, мы проводили инъекцию 0,5 г рицина (RCA 60,Sigma, St. Louis, МО) в 0,5 ул PBS и 0,1% FastGreen (Streit et al., (1988) J.Comp. Neurol. 268,248-263). Через 2, 4 и 7 дней после введения рицина мы проводили локализацию FKBP-специфичной мРНК с использованием гибридизации in situ(фиг. 5). Мы не обнаружили никакого увеличения количества указанной мРНК после обработки рицином. Как после введения рицина, так и после механического повреждения нерва возникает глиоз. Неспособность рицина индуцировать повышение количества FKBP-специфичной мРНК согласуется с избирательной локализацией указанной мРНК в лицевом ядре. Транспорт FKBP в седалищном нерве Настоящий пример свидетельствует о том,что FKBP способен быстро транспортироваться по седалищному нерву. Судя по тому, что в моторных нейронах после механического сдавливания седалищного нерва не происходит увеличения количества белковых молекул FKBP, несмотря на увеличение количества FKBP-специфичной мРНК, соответствующий белок быстро транспортируется из клеточного тела в нервные отростки. Этот вывод согласуется с нашими более ранними наблюдениями, касающимися того, что FKBPспецифичная мРНК сконцентрирована в гранулярных клетках мозжечка, содержащих небольшие количества белковых молекул FKBP, в то время как высокие концентрации белковых молекул FKBP выявляются в виде молекулярного слоя мозжечка, ассоциированного с параллельными тяжами, идущими от гранулярных клеток. Для того, чтобы изучить возможный транспортFKBP, мы проводили механическое сдавливание седалищного нерва, а через 7 дней накладывали лигатуры на расстоянии 10 и 20 мм по отношению к участку повреждения. Через 6 ч после наложения лигатур мы анализировали интенсивность связывания [3 Н] FK-506 в сегменте длиной 3 мм, находящимся между лигатурами(фиг. 6). Для экспериментов по аксонному транспорту использовали классический метод лигатур (Tetzlaff et al.). Через неделю после механического сдавливания седалищного нерва на указанный нерв накладывали две собирающие лигатуры (510 швов) на расстоянии приблизительно 10 мм друг от друга, причем более дистальную лигатуру располагали в 10 мм проксимальнее по отношению к участку исходного повреждения. Через 6 ч из участков указанного нерва,расположенных проксимальнее или дистальнее собирающих лигатур, либо между лигатурами,выделяли сегменты длиной 3-5 мм (см. фиг. 5). Выделенные сегменты готовили к тесту на связывание [3 Н] FK-506, гомогенизируя их в 10 объемах 50 мМ Tris-HCl (pH 7,4). Полученные 21 гомогенаты в течение 20 мин центрифугировали при 15000 g и температуре 4 С, а отобранные супернатанты тестировали на общее содержание белка с использованием теста на связывание с красителем Coomassie blue (Pearce). Эксперименты по связыванию [3 Н] FK-506 проводили в соответствии с приведенными выше описаниями (4) на аликвотах, содержащих 2 уг тотального растворимого белка, в конечном объеме 0,4 мл буфера для анализа, содержащего 50 мМTris-HCl (pH 7,4); 2 мг/мл альбумина сыворотки быка; 250 пМ [3 Н] FK-506, а также различные концентрации не меченного FK-506. Полученную смесь инкубировали в течение 60 мин при температуре 25 С, аликвоту в 0,35 мл наслаивали на колонку Sephadex LH-20 (Pharmacia LKB) емкостью 0,8 мл и промывали 0,4 мл буфера для анализа. Собирали образующийся при этом элюат и анализировали его в сцинтилляционном счетчике. Полученные результаты представлены на фиг. 5. Наивысшая интенсивность связывания[3 Н] FK-506 наблюдается в сегменте, расположенном непосредственно проксимальнее по отношению к лигатуре, наложенной в 20 мм от участка исходного повреждения; при этом количественные показатели связывания почти в 4 раза превосходят соответствующие значения для других сегментов. Исходя из интенсивности связывания [3 Н] FK-506 в сегментах А-Г, мы рассчитали скорость направленного вперед транспорта FKBP. Эта скорость составила 240 мм в день, что точно совпадает со скоростью транспорта GAP-43 и является одной из наивысших скоростей транспорта нейронных белков. Для того, чтобы визуализировать накопление FKBP после раздавливания нерва, мы использовали пропускающую лигатуру, маркирующую участок повреждения седалищного нерва, и осуществляли гибридизацию in situ по отношению к FKBP-специфичной мРНК, а также авторадиографию в плане связывания [3 Н]FK-506 (фиг. 7). Большая часть FKBPспецифичной мРНК и связанного [3 Н] FK-506 локализовалась в участке, расположенном непосредственно проксимально по отношению к исходному повреждению. Соответствующие количественные значения были значительно выше, нежели в случае контрольного неповрежденного седалищного нерва. Судя по исследованию результатов гибридизации in situ, а также авторадиографии при большом увеличении,зерна серебра ассоциированы с нервными тяжами. Кроме того, зерна серебра локализуется в клетках, не поддающихся однозначной идентификации, это могут быть Шванновские клетки,макрофаги или фибробласты.FKBP в клетках PC-12 Настоящий пример свидетельствует о том,что клетки PC-12 содержат FKBP, причем его 22 количество увеличивается при действии фактора роста нервов. Для того, чтобы определить наличие FKBP в клетках PC-12, мы исследовали интенсивность связывания [3 Н] FK-506 с указанными клетками при нормальных условиях, а также после обработки фактором роста нервов (NGF). Количество FKBP в клетках PC-12 определяли, проводя анализ кривых связывания [3 Н]FK-506 методом Скатчарда. Клеточные культуры собирали из культивационных лунок, гомогенизировали в 10 объемах 50 мМ Tris-HCl (рН 7,4), 1 мМ EDTA, 100 мкг/мл фенилметилсульфонилфторида и в течение 20 мин центрифугировали при 40 000 g и температуре 4 С. Выявление белка проводили с помощью теста на связывание красителя Coomassie blue при использовании альбумина из сыворотки быка в качестве стандарта. Связывание 250 пМ [3 Н] дигидроFК-506 (86,5 Ки/мМ; DuPont/Nen) осуществляли в образцах, содержащих 5 мкг растворимого белка в конечном объеме 0,4 мл буфера для анализа, состоящего из 50 мМ Tris-HCl (рН 7,4), 2 мг/мл BSA, а также различных концентраций не меченного FK-506. Полученную смесь инкубировали в течение 60 мин при температуре 25 С,а аликвоту в 0,35 мл наслаивали на колонкуSephadex LH-20 (Pharmacia LKB; емкость 0,8 мл), предварительно уравновешенную буфером для анализа. Затем указанную колонку промывали 0,4 мл буфера для анализа, собирали образующиеся при этом элюаты, смешивали их сFormula 963 (DuPont/Nen) и анализировали с помощью сцинтилляционного счетчика Beckman. Величину специфического связывания получали, вычитая величину связывания в присутствии 1 мкМ не меченного FK-506 из показателя общего связывания [3 Н] FK-506. Полученные результаты представлены на фиг. 8. [3 Н] FK-506 характеризуется насыщенным связыванием с гомогенатами необработанных клеток PC-12. В типичных экспериментах показатель связывания соответствует приблизительно 1000 импульсов в мин, в то время как величина неспецифического связывания в присутствии 1 мкМ не меченного FK-506 равна приблизительно 150 импульсов в мин. Судя по тому, что при использовании 1-2 нМ FK-506 наблюдается 50%-ное подавление связывания[3 Н] FK-506, сайты связывания действительно соответствуют FKBP. Обработка NGF приводит к существенному увеличению связывания [3 Н]FK-506. Указанное увеличение становится достоверным через 10-15 ч. Через 20 ч величина связывания возрастает в 3 раза, дальнейшее незначительное увеличение выявляется через 100 ч. Усиленное удлинение аксонов у клеток PC-12 Настоящий пример свидетельствует о том,что FK-506 и рапамицин усиливают удлинение аксонов у клеток PC-12. Клетки PC-12 поддерживали при температуре 37 С в атмосфере с 5%-ным содержаниемCO2; культивирование проводили на модифицированной по Дульбекко среде Игла (DMEM) с добавкой 10% инактивированной нагреванием сыворотки лошади и 5% инактивированной нагреванием фетальной сыворотки быка. Для индукции дифференцировки под действием NGF указанные клетки высевали в концентрации 1 х 105 в 35-миллиметровые культивационные лунки, покрытые коллагеном из хвоста крысы(плотность 5 мкг/см 2), позволяли клеткам прикрепиться к субстрату, после чего заменяли указанную среду на DMEM с добавкой 2% фетальной сыворотки лошади, NGF, а также/либо FK506 или рапамицина. Для количественного определения удлинения аксонов проводили случайное фотографирование (3-4 фотографии на лунку), после чего подсчитывали количество нейронов, несущих отростки длиной более 5 мкм. Экспериментальные условия были неизвестны как фотографу, так и счетчику клеток. Для каждого варианта было проведено 4 эксперимента 2 раза каждый. Качественный и количественный учет аксонов проводили у приблизительно 100 клеток на фотографии. Таким образом, в случае каждого варианта было просчитано от 1200 до 1600 клеток. Судя по полученным данным, NGF стимулирует удлинение аксонов с эффективностью,равной половине максимальной, при использовании в концентрации 1 нг/мл, максимальный эффект наблюдается при концентрации 50-100 нг/мл (фиг. 9, 10). FK-506 (10 нМ) заметно усиливает указанный эффект, повышая чувствительность клеток к NGF. Таким образом, использование FK-506 позволяет в 20-50 раз снизить концентрацию NGF, необходимую для достижения максимального удлинения аксонов. Полумаксимальное удлинение в отсутствие FK506 наблюдается при использовании 5 нг/млNGF, в то время как в присутствии FK-506 - при 0,1 нг/мл NGF. При наивысших концентрацияхNGF (10-100 нг/мл) FK-506 не оказывает дополнительного эффекта на удлинение аксонов.FK-506 свойственны чрезвычайно мощные нейротрофные эффекты. В присутствии субмаксимальной концентрации NGF (1 нг/мл) 1 нМ FK-506 обуславливает такой же максимальный прирост аксонов, какой вызывается 50 нг/мл NGF (фиг. 11). Полумаксимальные эффекты FK-506 достигаются при его концентрации приблизительно равной 100 пМ. FK-506 не способен усиливать удлинение аксонов в отсутствие NGF (фиг. 10). Рапамицин является мощным иммуносупрессором, который оказывает свое действие предположительно не через кальцинейрин, а возможно за счет других путей фосфорилирования. Рапамицин мощно подавляет эффекты, оказываемые FK-506 на FKBP и кальцинейрин,преимущественно за счет своего взаимодействия с FKBP в качестве антагониста FK-506. В концентрации 1 мкМ рапамицин не способен 24 подавлять нейротрофные эффекты FK-506. Действительно, рапамицин при использовании в концентрации 1 нМ сам вызывает существенное удлинение аксонов. Механизм действия рапамицина и FK-506, по-видимому, различен. Так,рапамицин вызывает увеличение как количества нервных отростков, так и их длины, в то время как FK-506 в основном усиливает лишь удлинение аксонов. Кроме того, эффекты, оказываемые рапамицином и FK-506, являются аддитивными. Спинномозговые узлы Настоящий пример свидетельствует о том,что FK-506 оказывает нейротрофный эффект на чувствительные ганглии. Мы исследовали действие FK-506 на первичные культуры спинномозговых узлов крыс, выделенных на 16-ый день эмбрионального развития. У зародышей (стадия Е 16), выделенных из беременных крыс линии Sprague-Dawley, проводили вычленение спинномозговых узлов. Целые экспланты ганглиев культивировали в покрытых коллагеном 35-миллиметровых чашках(Falcon) на среде N2 (смесь модифицированной по Дульбекко среды Игла и среды Хэма F12 в соотношении 1:1 с добавкой прогестерона, селена, инсулина, путресцина, глюкозы и пенициллина-стрептомицина) при температуре 37 С в атмосфере, содержащей 15% СO2. Чувствительные ганглии обрабатывали различными концентрациями NGF, а также/либо FK-506,рапамицином или антителами, специфичными кNGF. Каждые 2-3 дня проводили визуальное обследование ганглиев под инвертированным микроскопом Olympus IMT-2 с использованием фазового контраста, а также измеряли длину аксонов. Аксонное поле каждого ганглия подразделяли на четыре четверти, в каждой четверти с помощью глазного микрометра измеряли длину самого длинного аксона (в мкм). На основании четырех полученных величин рассчитывали среднее значение, которое служило показателем длины аксонов у данного ганглия. Для того, чтобы осуществить авторадиографию с [3 Н] FK-506, культуры спинномозговых узлов на пластинах, покрытых коллагеном(плотность 5 мкг/см 2). Выращенные культуры в течение 1 ч фиксировали на пластине ледяным 4%-ным свежедеполимеризованным параформальдегидом в 0,1 М натрий-фосфатном буфере(рН 7,4), затем дважды промывали солевым раствором, забуференным фосфатом. Для того,чтобы осуществить мечение фиксированных культур [3 Н] FK-506, указанные пластины предварительно инкубировали в буфере, состоящем из 50 мМ Hepes, 2 мг/мл альбумина из сыворотки быка и 0,02%-ного Tween-20 (рН 7,4). После этого пластины инкубировали в том же буфере с добавкой 1 нМ [3 Н] FK-506. Для определения неспецифического связывания использовали добавку 1 мкМ не меченного FK-506. Затем указанные пластины ополаскивали (4 раза по 5 25 мин), высушивали и в течение 10 дней экспонировали ими чувствительную к тритию пленку. В результате авторадиографии сайтов, связывающих [3 Н] FK-506, в указанных ганглиях выявляется значительное количество зерен серебра, ассоциированных с FKBP (фиг. 12). Отсутствие авторадиографических зерен при использовании 1 мкМ не меченного FK-506 свидетельствует о специфичности связывания. Как уже было отмечено выше, NGF в концентрации 100 нг/мл заметно повышает количество и длину нервных отростков (фиг. 13). Сам FK-506 (1 мкМ) вызывает сходный нейротрофный эффект,причем даже при использовании всего лишь 1 нМ FK-506 имеет место ощутимое усиление роста аксонов. Рапамицин (1 мкМ), являющийся антагонистом FK-506, полностью подавляет обусловленные им эффекты, таким образом,действие FK-506 характеризуется специфичностью по отношению к FK-506. В то время как FK-506 не способен стимулировать удлинение аксонов у клеток PC-12 в отсутствие экзогенного NGF, по отношению к чувствительным ганглиям FK-506 сам оказывает нейротрофный эффект. Присутствующие в ганглиях Шванновские клетки способны продуцировать NGF, причем указанная продукция регулируется процессом фосфорилирования белка. Для того, чтобы выяснить, связаны ли эффекты, вызываемые добавкой только FK-506,с усилением действия эндогенного NGF, мы исследовали влияние антител, специфичных кNGF (фиг. 13). Специфичные к NGF антитела приводят к заметному ослаблению нейротрофных эффектов, обусловленных FK-506 в концентрации 1 мкМ. Эти антитела не оказывают токсичного действия, поскольку мы не обнаружили никаких морфологических свидетельств токсичного действия на клетки, подверженные действию специфических к NGF антител в присутствии или в отсутствие экзогенного NGF.FK-506 чрезвычайно эффективно стимулирует удлинение аксонов. Даже при использовании всего лишь 1 пМ FK-506 наблюдается ощутимый эффект. Прогрессивно увеличивающиеся приросты аксонов обнаруживаются при использовании 0,1 и 10 нМ FK-506 (данные не представлены), при этом максимальные показатели удлинения наблюдаются при 1 мкМ FK-506. Временные характеристики удлинения аксонов оказываются сходными при любых концентрациях NGF и FK-506. Определенное удлинение становится очевидным через 1 день, а приблизительно через 5-6 дней показатели роста выходят на плато. Нейротрофные эффекты, оказываемые FK506 на чувствительные ганглии, опосредованы молекулами FKBP (белка, связывающего FK506), поскольку указанные эффекты FK-506 могут быть обращены низкими концентрациями рапамицина, который представляет собой анта 001379 26 гониста FK-506 по отношению к FKBP. Неспособность рапамицина подавлять эффекты, вызываемые FK-506 у клеток PC-12, по-видимому,свидетельствует о дополнительном стимулирующем действии рапамицина. Механизмы стимуляции удлинения аксонов у клеток PC-12 под действием рапамицина пока остаются неизвестными. Предполагают, что иммуносупрессорные свойства рапамицина обеспечиваются иными механизмами, нежели в случае FK-506. Рапамицин способен ингибировать киназу S6,осуществляющую фосфорилирование белка S6,входящего в состав субъединиц рибосом. Кроме того, рапамицин ингибирует фосфатидилинозитол-3-киназу. В процессы удлинения аксонов в ходе регенерации нервов вовлечено фосфорилирование, осуществляемое протеинкиназой С (РКС). Другие данные свидетельствуют о ингибиторных эффектах РКС в ходе удлинения нервных отростков.GAP-43 является очевидным субстратом кальцинейрина, накапливающимся в аксонах в высоких концентрациях, его фосфорилирование регулируется FKBP. Судя. по тому, что низкие концентрации GAP-43 обеспечивают нормальное удлинение аксонов, GAP-43 вполне может не принимать непосредственного участия в процессе удлинения аксонов. Вместе с тем, GAP-43 и его фосфорилированная форма могут быть задействованы в ориентации аксонов, поскольку интенсивность фосфорилирования GAP-43 повышается при приближении аксона к своей цели. Кроме того, фосфорилирование GAP-43 может оказывать влияние на мобилизацию ионов Са 2+, регулирующую удлинение аксонов. Фосфорилированная форма GAP-43 ингибирует образование фосфатидилинозитол-бис-фосфата,что должно приводить к уменьшению количества инозитол-1,4,5-трифосфата и сопровождаться высвобождением ионов Са 2+. Иммунофилины могут быть задействованы в сайтах помимо кальцинейрина, когда за счет изменения концентрации ионов Ca2+ происходит регуляция удлинения аксонов. FKBP связываются с рианодиновым рецептором, представляющим собой канал, служащий для высвобождения ионов Са 2+. В саркоплазматическом ретикулюме скелетных мышц FK-506 вытесняетFKBP из комплекса с рианодиновым рецептором с запуском Са 2+-зависимого процесса высвобождения ионов Са 2+. Кроме того, FK-506 оказывает воздействие и на другие сайты, в том числе на стероидные рецепторы FKBP25, а также на другие не выявленные мишени, например сходные с FKBP13. Таким образом, в процессе удлинения аксонов могут быть задействованы и другие механизмы. 27 Неиммуносупрессорные и иммуносупрессорные лиганды иммунофилинов стимулируют удлинение аксонов у клеток PC-12 В данном исследовании мы детально изучали влияние целого ряда лигандов иммунофилинов на удлинение аксонов у, клеток PC-12, а также в интактных чувствительных ганглиях цыпленка. Мы показали, что и неиммуносупрессорные, и иммуноcупрессорные лиганды чрезвычайно эффективно стимулируют удлинение аксонов как у клеток PC-12, так и в чувствительных ганглиях. Как мы показали в нашем предыдущем исследовании, иммуносупрессорные агенты стимулируют удлинение аксонов у клеток PC-12,увеличивая активность фактора роста нервов(NGF) приблизительно в 10 раз (Lyons et al.,1994). При этом никакие нейротрофные эффекты не обнаруживаются в отсутствие экзогенногоNGF. В настоящем исследовании мы оценивали эффекты, оказываемые иммуносупрессорными агентами (FK-506 и рапамицином) на удлинение аксонов как у клеток PC-12 в присутствии 0,1100 нг/мл NGF. В отсутствие экзогенного NGF ни один из указанных агентов не был способен стимулировать удлинение аксонов. При использовании только NGF в концентрации 0,1 нг/мл возникает небольшое усиление роста аксонов, приблизительно составляющее всего лишь 15% по сравнению с максимальными эффектами, наблюдающимися при концентрации NGF, равной 50 нг/мл (фиг. 14). Рапамицин в большей степени стимулирует удлинение аксонов, нежели другие агенты, при этом в случае использования 0,1-0,5 нг/мл NGF имеет место 3-4-кратная стимуляция. Степень вызываемого рапамицином эффекта уменьшается с ростом концентрации NGF и становится статистически недостоверной при 550 нг/мл NGF. FK-506 также оказывает нейротрофное действие, эффективность которого наиболее значительна при низких концентрациях NGF; максимальное (2,5-кратное) усиление роста аксонов достигается при использовании 0,5 нг/мл NGF. Известно три основных структурных класса иммуносупрессорных агентов, родственных по своей структуре циклоспорину А, FK-506 и рапамицину. Так как FK-506 и циклоспорин А связываются с разными иммунофилиновыми белками, оба указанных агента оказывают свои иммуносупрессорные эффекты за счет ингибирования кальцинейрина. Рапамицин обладает очень высоким сродством к FKBP-12, причем комплекс, образованный указанными агентом и иммунофилином, в свою очередь, не способен к связыванию с кальцинейрином. Действительно,рассматриваемые иммуносупрессорные эффекты обусловлены тем, что комплекс, образованный рапамицином и FKBP-12, связывается с недавно идентифицированным белком, обозначаемым RAFT-1 (рапамицин и FK-506 мишень)Chen et al., 1994). Так как рапамицин эффективно связывается с FKBP-12, но не ингибирует кальцинейрин, он может служить антагонистомFK-506. Известны неиммуносупрессивные производные рапамицина. Один из них (WAY124,466) представляет собой триеновое производное рапамицина, с высокой эффективностью связывающееся с FKBP-12 и подавляющее ротамазную активность, однако, лишенное иммуносупрессорных свойств. Циклоспорин А является крупным циклическим ундекапептидом. Простое добавление метильной группы к остатку аланина, находящемуся в 6 положении, приводит к образованию агента (Me CsA), не способного ингибировать кальцинейрин и не проявляющего иммуносупрессорные свойства, но вместе с тем подавляющего ротамазную активность иммунофилина аналогично циклоспорину А. Для того, чтобы выяснить, является ли иммуносупрессорная активность необходимой для проявления нейротрофных эффектов, мы сравнили нейротрофное действие FK-506, рапамицина и циклоспорина А с действием неиммуносупрессорного WAY-124,466 при использовании широкого спектра концентраций указанных агентов по отношению к клеткам PC-12(фиг. 15, 16). Все исследования проводили в присутствии 0,5 нг/мл NGF. Как уже было отмечено выше, FK-506 очень эффективно стимулирует удлинение аксонов, при этом стимуляция, составляющая половину максимальной,наблюдается при использовании 0,5 нМ FK-506,а максимальные эффекты - при 5-100 нМ. Рапамицин является наиболее мощным из исследованных агентов, он обуславливает наивысшие максимальные показатели удлинения аксонов. В воспроизводящихся экспериментах удлинение, соответствующее половине максимального, наблюдаются при использовании 0,20,4 нМ указанного агента, в то время как максимальные эффекты - при приблизительно 10100 нМ. Максимальное удлинение аксонов под действием рапамицина сопоставимо с максимальными эффектами, обусловленными 50 нг/мл NGF. WAY-124,466 также оказывает нейротрофное действие, однако, оно менее эффективно и приводит к менее высоким значениям максимального удлинения, нежели в случае рапамицина. Стимуляция, составляющая половину максимальной, обусловленная WAY-124,466,наблюдается при использовании приблизительно 10 нМ указанного агента, а максимальные эффекты - при 100-1000 нМ. Таким образом,рапамицин является приблизительно в 100 раз более мощным агентом по сравнению с WAY124,466, проявляющим в 40 раз более высокое сродство к FKBP-12 (таблица II). Циклоспорин А характеризуется существенно меньшей активностью в плане стимуляции удлинения аксонов по сравнению с FK-506 29 и рапамицином, что хорошо согласуется с его существенно меньшей способностью ингибировать ротамазную активность. Стимуляция, составляющая половину максимальной, обусловленная циклоспорином А, выявляется при использовании 50 нМ указанного агента, а максимальные эффекты - при 100 нМ, причем с дальнейшим увеличением концентрации циклоспорина А происходит ослабление роста аксонов. Максимальная стимуляция, вызываемая циклоспорином А, составляет приблизительно 60% от соответствующих эффектов, обусловленных 50 нг/мл NGF. Основные особенности удлинения нервных отростков при использовании различных иммунофилиновых лигандов, а также NGF достаточно сходны. При использовании NGF в концентрации, вызывающей эффект, составляющий половину максимального, (1-5 нг/мл), у 40-50% клеток длина отростков, по меньшей мере, равна размерам тела клетки, при этом у 15% клеток образуются еще более длинные отростки, в 3-5 раз превышающие размер тела клетки. Эта особенность очень характерна и для различных других исследованных агентов. Рапамицин и WAY-124,466 имеют тенденцию вызывать образование большего количества отростков в пересчете на клетку, нежели FK-506. Циклоспорин А характеризуется промежуточными показателями в плане количества образующихся отростков. Удлинение нервов в спинномозговых узлах цыпленка под действием неиммуносупрессорных и имуносупрессорных лигандов иммунофилинов В нашем предыдущем исследовании мы продемонстрировали нейротрофные эффекты,оказываемые иммуносупрессорными агентами на экспланты спинномозговых узлов крысы и проявляющиеся в существенном усилении роста нерва при использовании FK-506 в всего лишь пикомолярной концентрации (Lyons et al., 1994). В ганглиях крысы указанных нейротрофные эффекты наблюдались при воздействии FK-506 даже в отсутствие NGF. В настоящей работе мы использовали экспланты спинномозговых узлов цыпленка, которые более удобны в исследованиях удлинения нервов. В отсутствие экзогенного NGF мы наблюдали минимальные эффекты агентов, представляющих собой иммунофилиновые лиганды. Клетки цыпленка более чувствительны к NGF, нежели клетки PC-12, поэтому для получения минимального удлинения аксонов и демонстрации нейротрофной активности иммунофилиновых лигандов мы использовали NGF в концентрации 0,1 нг/мл (фиг. 17,18). Выделение спинномозговых узлов (DRG's) проводили из зародышей цыпленка на 10 день после оплодотворения. Целые экспланты ганглиев культивировали при температуре 37 С в атмосфере с 5%-ым содержанием СO2; культи 001379 30 вирование проводили в 12-луночных платах,покрытых тонким слоем Matrigel, на среде Либовица (L15 с высоким содержанием глюкозы) с добавками 2 мМ глутамина и 10% фетальной сыворотки теленка, а также 10 мкМ цитозин-bD арабинофуранозида (Аrа С). Через 24 ч указанные DRG's обрабатывали различными концентрациями фактора роста нервов (NGF), иммунофилиновыми лигандами, либо комбинациями NGF + исследуемые активные соединения. Через 48 ч после вышеописанной обработки активными соединениями проводили визуальное исследование тестируемых ганглиев под инвертированным микроскопом Zeiss Axiovert с использованием фазового контраста, либо контраста Hoffman Modulation. Получали микрофотографии исследуемых эксплантов и измеряли удлинение аксонов. Аксоны, длина которых превышала диаметр DRG, рассматривали в качестве позитивных, кроме того, проводили учет общего количества аксонов в каждом из вариантов эксперимента. В одном гнезде культивировали от 3 до 4 DRG, каждый вариант обработки проводили два раза. Относительные способности использованных иммунофилиновых лигандов стимулировать удлинение нерва в указанных ганглиях оказались практически такими же, что и в случае клеток PC-12. Так, рапамицин является наиболее мощным агентом, в 10 раз превышающим по своей эффективности WAY-124,466; при этом значение, соответствующее ЭК 50, достигается в случае рапамицина при концентрации 1 нМ, а в случае FK-506 - при 1-2 нМ. Максимально эффективные концентрации иммунофилиновых лигандов, а также NGF (100 нг/мл) обуславливают достаточно сходное максимальное увеличение количества образующихся отростков, их длины и интенсивности ветвления. При прогрессивном увеличении концентраций указанных агентов наблюдается возрастание количества отростков, более интенсивное ветвление, а также большая длина отдельных отростков. Исследуя подавление связывания [3 Н] FK506 с рекомбинантными молекулами FKBP-12,мы провели оценку способности различных агентов связываться с FKBP-12. Мы обнаружили четкий параллелизм между сродством указанных агентов с FKBP-12 и эффективностью стимуляции удлинения аксонов, а также подавления ротамазной активности. Действительно,стимуляция удлинения аксонов не связана с ингибированием кальцинейрина. Четкое ингибирование кальцинейрина хорошо согласуется с иммуносупрессорным действием, не проявляющий иммуносупрессорных свойств WAY124,466 не способен ингибировать кальцинейрин. Рапамицин является мощным иммуносупрессором, однако комплекс, образованный рапамицином и FKBP-12, связывается с RAFT-1 с индукцией иммуносупрессорных реакций (Sa 31batini and Snyder, 1994; Snyder and Sabatini,1995). Полученные результаты представлены в таблице 2. Таблица 2. Нейротрофизм лигандов иммунофилина сопровождается ингибированием ротамазы, но не кальцинейрина Лекарство Ингибирование кальцинейрина Да Нет Нет Да Мы сравнили способность неиммуносупрессорных иммунофилиновых лигандов вызывать удлинение аксонов в культурах эксплантов спинномозговых узлов цыпленка (таблица 3). Каждое из исследованных соединений не способно ингибировать кальцинейрин, но при этом взаимодействует с иммунофилином FKBP-12,ингибируя его ротамазную активность с различными константами ингибирования, приведенными в таблице 3. Способность указанных соединений вызывать удлинение аксонов в DRG's хорошо коррелирует с их способностью подавлять ротамазную активность FKBP-12. Таблица 3. Нейротрофизм иммунофилиновых лигандов сопровождается ингибированием ротамазы, но не кальцинейрина Лекарство Соед. из примера 12 Соед.из примера 13 Столь четкая корреляция между эффективностью указанных соединений в плане связывания иммунофилинов, ингибирования их ротамазной активности и стимуляции удлинения аксонов свидетельствует о том, что подавление ротамазной активности является ключевым моментом, определяющим нейротрофные эффекты рассматриваемых соединений. Судя по чрезвычайно высокой эффективности указанных соединений в плане стимуляции удлинения аксонов и связывания с иммунофилинами, участие других мишеней в определении данных нейротрофных эффектов представляется весьма маловероятным. Можно предполагать, что лекарственные средства воздействуют на биологическую активность иммунофилинов, отличную от ротамазной, опосредуя нейротрофное действие. Однако до сих пор никакие подобные активности не выявлены. Учитывая чрезвычайно высокую эффективность указанных лекарственных средств, а также четкую корреляцию между ингибированием ротамазной активности и проявлением нейротрофных эффектов, мы предполагаем, что 32 ротамазная активность, по-видимому, вовлечена в процесс реализации нейротрофных эффектов. Описан целый ряд белков, представляющих собой субстраты для свойственной иммунофилинам ротамазной активности, включая коллагенand King, 1991). Недавно было показано, что высокоочищенные препараты рианодинового рецептора, а также рецептора IP-3, вероятно представляющие собой внутриклеточные кальциевые каналы, способны существовать в виде комплекса с FKBP-12. Удаление FKBP-12 из этих комплексов приводит к "протеканию" указанных кальциевых каналов (Cameron et al.,1995). Известно, что кальциевые потоки вовлечены в процессы удлинения аксонов, таким образом, рецепторы IP-3, а также рианодиновые рецепторы могут принимать участие в проявлении нейротрофных эффектов, обусловленных рассматриваемыми лекарственными средствами. Так как указанные лекарственные средства связываются с тем же сайтом в молекуле FKBP12, что и рецептор IP-3 или рианодиновый рецептор, можно сделать вывод о том, что данные лекарства замещают FKBP-12 в вышеупомянутых каналах. Судя по тому, что не обнаружено какого-либо взаимодействия между указанными кальциевыми каналами в циклофилине, эта модель не может объяснить нейротрофное действие циклоспорина А. Учитывая способность лекарственных средств, исследованных в настоящей работе,проявлять нейротрофные эффекты даже при чрезвычайно низкой концентрации, эффективность указанных соединений сопоставима с эффективностью таких нейротрофных белков, как мозговой фактор роста, нейротропин-3, а также нейротрофный ростовой фактор. Приведенные ниже примеры призваны проиллюстрировать предпочтительные варианты воплощения настоящего изобретения и не должны рассматриваться как ограничивающие настоящее изобретение. Под молекулярной массой всех полимеров подразумевается средняя молекулярная масса. Во всех случаях, кроме особо оговоренных, процентные содержания рассчитаны как массовые процентные содержания по отношению к массе заключительной вводимой системы или приготовленного состава; общая масса во всех случаях составляет 100%. К числу соединений, представляющих собой производные пипеколиновой кислоты, пригодных к применению в целях настоящего изобретения, относятся соединения следующих примеров: Этo соединение, представляющее собой производное пипеколиновой кислоты, описано(Ocain et al., Biochemical and Biophysical Research Communications, Vol. 192, No. 3, 1993). Указанное соединение синтезировано др. Филом Хьюзом (Dr. Phil Hughes, Wyeth-Ayerst) в результате реакции между 4-фенил-1,2,4 триазолин-3,5-дионом и рапамицином. Пример 2 Настоящее соединение, представляющее собой производное пипеколиновой кислоты,описано (Chakraborty et al., Chemistry and Biology, March 1995, 2: 157-161). Примеры 3-5 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Ikeda et al., J. Am. Chem. Soc. 1994,116, 4143-4144). Примеры 6-9 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Wang et al., Bioorganic and Medicinal Настоящее соединение, представляющее собой производное пипеколиновой кислоты, 001379 34 описано (Birkenshaw et al., BioorganicMedicinal Chemistry Letters, Vol. 4, No. 21, pp. 25012506, 1994). Примеры 11-21 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Holt et al., J. Am. Chem. Soc., 1993,115, 9925-9938), в частности, соединения 4-14. Пример 22-30 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Caffery et al., BioorganicMedicinal Настоящее соединение, представляющее собой производное пипеколиновой кислоты,описано (Teague et al., BioorganicMedicinalChemistry Letters, Vol. 3, No. 10, pp. 1947-1950). Пример 32-34 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Yamashita et al., BioorganicMedicinal Chemistry Letters, Vol. 4., No. 2, pp. 325-328,1994), в частности, соединения 11, 12 и 19. Пример 35-55 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Holt et al., BioorganicMedicinalChemistry Letters, Vol. 4, No. 2, pp. 315-320,1994). Пример 56-68 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны в (Holt et al., BioorganicMedicinalChemistry Letters, Vol. 3, No. 10, pp. 1977-1980). Пример 69-83 Соединения согласно настоящему изобретению описаны (Hauske et al., J. Med. Chem. 1992, 35, 4284-4296), в частности, соединения 6,9-10, 21-24, 26, 28, 31-32 и 52-55. Пример 84 Настоящее соединение, представляющее собой производное пипеколиновой кислоты, 35Letters, Vol. 4, No. 13, pp. 1581-1584, 1994). Примеры 85-88 Настоящие соединения, представляющие собой производные пипеколиновой кислоты,описаны (Stocks et al., BioorganicMed. Chem.Letters, Vol. 4, No. 12, pp. 1457-1460, 1994), в частности, соединения 2, 15-17. Примеры 90-111 Дополнительные соединения, представляющие собой производные пипеколиновой кислоты, описаны на схеме 1, а также в таблицах 1-5. Схема 1 42 Нейротрофные эффекты, оказываемые ингибиторами ротамазы В таблице 1 представлены соединения,включенные в формулу настоящего изобретения, с указанием их эффективности в плане индукции нейротрофных эффектов по отношению к культивируемым чувствительным нейронам(см. выше). Фиг. 19 и 20 представляют собой микрофотографии, отражающие влияние соединений из примеров 111 и 17 на удлинение аксонов в культурах спинномозговых узлов. Таблица 1. Эффективность исследованных соединений in vitro Ингибирование Нейротрофная ЭД 50 Примера ротамазыDRG's, нМ Кi, нМ 6 140 25 9 13 0,030 11 170 1 12 250 300 13 25 80 15 17 0,30 19 12 0,017 36 10 000 10000 41 1300 5000 50 10000 10000 90 1800 2500 91 28 200 92 39 90 93 75 35 94 70 8 95 165 5-10 96 740 10-20 97 725 150 98 130 75 99 30 5 100 60 43 101 15 0,17 102 12 2,5 103 120 3 104 20 0,016 105 103 6 106 760 1 107 210 0,82 108 32 0,29 109 2 0,08 110 24 0,002 111 5 0,08 Активность соединений из примеров на модели регенерации нервов in vitro Аксотомия седалищного нерва У анестезированных шестинедельных самцов крыс линии Sprague-Dawley на уровне бедра обнажали седалищный нерв и сдавливали его с помощью пинцета. Непосредственно перед нанесением указанного повреждения крысам подкожно вводили исследуемые соединения или носитель, после чего ежедневно повторяли данное введение в течение еще 18 дней. Получали срезы поврежденного седалищного нерва, окрашивали их с помощью серебряного красителя Хольмса (Holmes) (для определения количества аксонов), а также Luxol быстрым синим (для количественного определения интенсивности миелинизации). У животных, обработанных носителем, через 18 дней после нанесения исходного повреждения наблюдали достоверное снижение количества аксонов (50%-е снижение по отношению к неповрежденному контролю), а также интенсивности миелинизации (90%-е снижение по отношению к неповрежденному контролю). По сравнению с животными, обработанными носителем, у подопытных крыс, которым непосредственно перед нанесением повреждения, а также ежедневно в течение 18 дней после нанесения указанного повреждения осуществляли подкожное введение соединения из примера 12 (30 мг/кг) или примера 13 (мг/кг), наблюдали достоверную регенерацию как количества аксонов (соответственно, 25%-е или 5%-е снижение по отношению к неповрежденному контролю), так и интенсивности миелинизации (соответственно, 65%-е или 50%-е снижение по отношению к контролю). Значительная эффективность соединений из примеров 12 и 13 хорошо согласуется с их мощной способностью ингибировать ротамазную активность и стимулировать удлинение аксонов в DRG's цыпленка; следует отметить параллелизм между относительной активностью указанных соединений inI). Полученные результаты представлены на фиг. 21. Обозначение "имитация" соответствует контрольным животным, получавшим носитель в отсутствие повреждения. Обозначение "носитель" соответствует животным, которым наносили повреждение и вводили лишь веществоноситель без активного ингредиента. Животные,обработанные соединениями из примеров 12 и 13, оказались очень сходными по исследованным параметрам с контрольными животными,претерпевшими имитацию повреждения, что свидетельствует о мощных нейрорегенерационных эффектах, оказываемых данными соединениями in vivo. Полученные численные значения представлены в таблице II. Таблица II Вид обработки Имитация Повреждение Очевидно, что описанные в настоящем изобретении способы могут быть осуществлены с большим количеством разнообразных вариаций. Все подобные вариации не должны восприниматься в отрыве от настоящего изобретения, а, напротив, должны рассматриваться в 44 качестве составной части приведенной ниже формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения неврологического расстройства у животного путем введения животному эффективного количества неиммуносупрессорного производного пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для стимуляции роста поврежденных периферических нервов или для активации регенерации нейронов, причем иммунофилины FKBP-типа проявляют ротамазную активность, а производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. 2. Способ по п.1, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из периферических невропатий, вызванных физической травмой или болезненным состоянием, физическим повреждением головного мозга, физическим повреждением спинного мозга, сосудистым ударом, сопровождающимся повреждением мозга, и неврологических расстройств, связанных с нейродегенерацией. 3. Способ по п.2, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из болезни Альцгеймера,болезни Паркинсона и амиотрофического латерального склероза. 4. Способ по п.1, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой Way124,666. 5. Способ по п.1, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой SLB-506. 6. Способ по п.1, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 8688 и 90-111. 7. Способ по п.1, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации. 8. Способ по п.1, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации. 45 9. Способ по п.1, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ. 10. Способ по п.1, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ. 11. Способ по п.1, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ. 12. Способ по п.1, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 200 нМ. 13. Способ по п.1, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 35 нМ. 14. Способ по п.1, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 1 нМ. 15. Способ лечения неврологического расстройства у животного путем введения животному эффективного количества неиммуносупрессорного производного пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, в комбинации с эффективным количеством нейротрофного фактора, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3, для стимуляции роста поврежденных периферических нервов или для активации регенерации нейронов,причем иммунофилины FKBP-типа проявляют ротамазную активность, а производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. 16. Способ по п.15, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из периферических невропатий, вызванных физической травмой или болезненным состоянием, физическим повреждением головного мозга, физическим повреждение спинного мозга, сосудистым ударом, сопровождающимся повреждением мозга, и неврологических расстройств, связанных с нейродегенерацией. 17. Способ по п.15, отличающийся тем, что неврологическое расстройство выбрано из группы, состоящей из болезни Альцгеймера, 001379 46 болезни Паркинсона и амиотрофического латерального склероза. 18. Способ по п.15, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойWay-124,666. 19. Способ по п.15, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойSLB-506.Способ по п.15, отличающийся тем, что 20. неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 8688 и 90-111. 21. Способ стимуляции или активации роста поврежденных периферических нервов,при котором на поврежденные периферические нервы воздействуют эффективным количеством соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBP-типа, для стимуляции или активации роста поврежденных периферических нервов,причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. 22. Способ по п.21, отличающийся тем, что дополнительно воздействуют нейротрофным фактором для стимуляции или активации роста поврежденных периферических нервов, выбранным из группы, состоящей из нейротрофного ростового фактора, ростового фактора,полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3. 23. Способ по п.21, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойWay-124,666. 24. Способ по п.21, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойSLB-506.Способ по п.21, отличающийся тем, что 25. неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 8688 и 90-111. 26. Способ по п.21, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации. 47 27. Способ по п.21, отличающийся тем, что обеспечивают, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации. 28. Способ по п.21, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ. 29. Способ по п.21, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ. 30. Способ по п.21, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ. 31. Способ по п.21, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 200 нМ. 32. Способ по п.21, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 35 нМ. 33. Способ по п.21, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 1 нМ. 34. Способ стимуляции роста поврежденных периферических нервов, при котором на поврежденные периферические нервы воздействуют эффективным количеством соединения,представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBPтипа, для стимуляции роста поврежденных периферических нервов, причем иммунофилиныFKBP-типа проявляют ротамазную активность,а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. 35. Способ по п.34, отличающийся тем, что дополнительно воздействуют эффективным количеством нейротрофного фактора, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора,а также нейротропина-3. 36. Способ по п.34, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собой 48 37. Способ по п.34, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойSLB-506.Способ по п.34, отличающийся тем, что 38. неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 8688 и 90-111. 39. Способ активации регенерации и роста нейронов у животных путем введения животному эффективного количества соединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBPтипа, для активации регенерации нейронов,причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. 40. Способ по п.39, отличающийся тем, что дополнительно воздействуют эффективным количеством нейротрофного фактора для активации регенерации нейронов, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3. 41. Способ по п.39, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойWay-124,666. 42. Способ по п.39, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойSLB-506.Способ по п.39, отличающийся тем, что 43. неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 8688 и 90-111. 44. Способ по п.39, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации. 45. Способ по п.39, отличающийся тем, что обеспечивают, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации. 46. Способ по п.39, отличающийся тем, что ингибирования ротамазной активности дости 49 гают при применении соединения в концентрации не выше 1800 нМ. 47. Способ по п.39, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ. 48. Способ по п.39, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ. 49. Способ по п.39, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 200 нМ. 50. Способ по п.39, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 35 нМ. 51. Способ по п.39, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 1 нМ. 52. Способ предотвращения нейродеградации у животного путем введения животному эффективного количества сoединения, представляющего собой неиммуносупрессорное производное пипеколиновой кислоты, обладающего сродством к иммунофилинам FKBPтипа для предотвращения нейродегенерации,причем иммунофилины FKBP-типа проявляют ротамазную активность, а неиммуносупрессорное производное пипеколиновой кислоты ингибирует указанную ротамазную активность данного иммунофилина, и производное пипеколиновой кислоты имеет следующую формулу: где R может быть кислородом или азотом, Х и Y могут быть любыми заместителями, при этом Х и Y могут быть связаны друг с другом с образованием кольца. 53. Способ по п.52, отличающийся тем, что дополнительно воздействуют эффективным количеством нейротрофного фактора для предотвращения нейродегенерации, выбранного из группы, состоящей из нейротрофного ростового фактора, ростового фактора, полученного из 50 мозга, ростового фактора глиального происхождения, цилиарного нейротрофного фактора, а также нейротропина-3. 54. Способ по п.52, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойWay-124,666. 55. Способ по п.52, отличающийся тем, что неиммуносупрессорное производное пипеколиновой кислоты представляет собойSLB-506.Способ по п.52, отличающийся тем, что 56. неиммуносупрессорное производное пипеколиновой кислоты выбрано из группы, состоящей из соединений, описанных в примерах 3-84, 8688 и 90-111. 57. Способ по п.52, отличающийся тем, что обеспечивает, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 35%-ное восстановление миелинизации. 58. Способ по п.52, отличающийся тем, что обеспечивают, по крайней мере, 75%-ную регенерацию количества аксонов и, по крайней мере, 50%-ное восстановление миелинизации. 59. Способ по п.52, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 1800 нМ. 60. Способ по п.52, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 210 нМ. 61. Способ по п.52, отличающийся тем, что ингибирования ротамазной активности достигают при применении соединения в концентрации не выше 103 нМ. 62. Способ по п.52, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 200 нМ. 63. Способ по п.52, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 35 нМ. 64. Способ по п.52, отличающийся тем, что нейротрофной ЭД 50 достигают при применении соединения в концентрации не выше 1 нМ.
МПК / Метки
МПК: A61K 31/495, A61P 25/02
Метки: роста, нервов, предотвращения, поврежденных, активации, нейродегенерации, лечения, животного, неврологического, регенерации, нейронов, способы, стимуляции, периферических, расстройства, способ
Код ссылки
<a href="https://eas.patents.su/30-1379-sposoby-lecheniya-nevrologicheskogo-rasstrojjstva-u-zhivotnogo-sposoby-stimulyacii-i-aktivacii-rosta-povrezhdennyh-perifericheskih-nervov-sposob-aktivacii-regeneracii-i-rosta-nejjr.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения неврологического расстройства у животного, способы стимуляции и активации роста поврежденных периферических нервов, способ активации регенерации и роста нейронов и способ предотвращения нейродегенерации у животного</a>
Предыдущий патент: Плавильный агрегат с дуговой печью
Следующий патент: Производные фенилуксусной кислоты
Случайный патент: Способ очистки водного экстракта растений