Композиции для иммунизации против микобактерий
Номер патента: 12436
Опубликовано: 30.10.2009
Авторы: Хилл Эдриан, Гилберт Сара К., Патан Ансар А., Макшейн Хелен
Формула / Реферат
1. Способ индукции иммунного ответа центральных Т-клеток памяти против по меньшей мере одного антигена у пациента-человека, включающий стадию введения указанному пациенту иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4 и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА.
2. Способ по п.1, где иммуногенная композиция представляет собой векторную вакцину.
3. Способ по п.1 или 2, где Т-клеточный иммунный ответ представляет собой CCR7+ ответ.
4. Способ по любому из пп.1-3, где нереплицирующийся поксвирусный вектор представляет собой MVA (модифицированный вирус осповакцины Анкара).
5. Способ по любому из пп.1-4, где поксвирусный вектор экспрессирует продукт трансляции SEQ ID NO:5.
6. Способ по любому из пп.1-5, где поксвирусный вектор дополнительно экспрессирует продукт трансляции по меньшей мере одного дополнительного гена(ов) антигена из микобактериального вида.
7. Способ по любому из пп.1-6, где иммуногенную композицию вводят по меньшей мере с одним дополнительным антигеном и/или противомикробным средством.
8. Способ по п.7, где по меньшей мере один дополнительный антиген и/или противомикробное средство вводят одновременно, раздельно или последовательно.
9. Способ по любому из пп.1-8, где ответ представляет собой антигенспецифический иммунный ответ.
10. Способ по любому из пп.1-9, где ответ является терапевтическим или профилактическим.
11. Способ по любому из пп.1-10, где Т-клеточный ответ является защитным против заболевания, выбранного из группы, состоящей из туберкулеза, лепры, инфекции, вызванной Mycobacterium avium, нетуберкулезной микобактериальной инфекции, язвы Бурули, инфекции или заболевания, вызванных Mycobacterium bovis, натуральной оспы, обезьяньей оспы, инфекции, вызванной Mycobacterium paratuberculosis, воспалительного заболевания кишечника, болезни Крона, аутоиммунного заболевания, рака и рака мочевого пузыря.
12. Способ по любому из пп.1-10, где пациент выбран из группы, состоящей из детей, пациентов, которые имеют ВИЧ-инфекцию или СПИД, имеют ослабленный иммунитет или были подвергнуты пересадке органов.
13. Способ по любому из пп.1-10, где пациент ранее подвергался воздействию микобактерий.
14. Способ по п.13, где пациент ранее подвергался воздействию М. tuberculosis.
15. Способ по п.13 или 14, где пациент является латентно инфицированным микобактериями.
16. Способ по любому из пп.1-10, где пациента ранее подвергали воздействию BCG (бацилла Кальметта-Герена).
17. Применение иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4 и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА, в изготовлении лекарственного средства для лечения или предупреждения микобактериального заболевания у пациента путем индукции иммунного ответа центральных Т-клеток памяти у указанного пациента.
18. Применение по п.17, где Т-клеточный иммунный ответ представляет собой CCR7+ ответ.
19. Применение по п.17 или 18, где поксвирусный вектор дополнительно экспрессирует продукт трансляции по меньшей мере одного дополнительного гена антигена и где указанное лекарственное средство предназначено для лечения или предупреждения как микобактериального заболевания, так и по меньшей мере одного дополнительного заболевания у указанного пациента.
20. Применение по любому из пп.17-19, где иммуногенная композиция дополнительно индуцирует Т-клеточный иммунный ответ против вируса, из которого происходит поксвирусный вектор.
21. Применение иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4, и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА, в изготовлении лекарственного средства для лечения или предупреждения по меньшей мере одного заболевания у пациента путем индукции иммунного ответа центральных Т-клеток памяти, где указанное лекарственное средство вводят по меньшей мере с одним дополнительным антигеном.
22. Применение по п.21, где Т-клеточный иммунный ответ представляет собой CCR7+ ответ.
23. Векторная вакцина, содержащая нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4 и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА.
24. Векторная вакцина по п.23, где вирусный вектор экспрессирует продукт трансляции нуклеотидной последовательности SEQ ID NO: 5.
25. Векторная вакцина по п.23 или 24, где нереплицирующийся вирусный вектор представляет собой MVA.
26. Векторная вакцина по любому из пп.23-25, где вирусный вектор дополнительно экспрессирует продукт трансляции по меньшей мере одного дополнительного гена(ов) антигена из микобактериального вида.
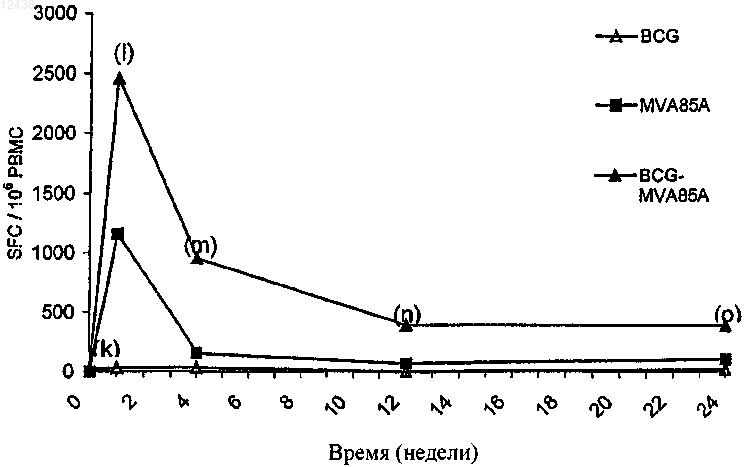
Текст
012436 Настоящее изобретение относится к способу формирования Т-клеточного иммунного ответа у хозяина. Данный способ включает стадию введения векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена антигена 85 А (также именуемого здесь как ген "Ag85A"). Все публикации, патенты и заявки на патент, процитированные здесь, полностью включены в данное описание изобретения посредством ссылки. Предшествующий уровень техники Туберкулез вызывается респираторным патогеном Mycobacterium tuberculosis и каждый год убивает 2 миллиона человек,преимущественно в развивающихся странах(http://www.who.int/gtb/publications/globrep01/index.html). Единственная лицензионная вакцина против М.tuberculosis, бацилла Кальметта-Герена (BCG) (Calmette, A., Gurin. (1924) Ann. Inst. Pasteur. 38:371),представляет собой аттенуированный штамм Mycobacterium bovis, который в развивающихся странах обычно вводят интрадермально в виде однократной дозы новорожденным младенцам. Обзор многочисленных исследований свидетельствует о том, что вакцинация BCG является защитной против детского менингеального туберкулеза и системных форм данного заболевания. Однако защитная эффективность является вариабельной (варьирует от 0 до 80%) (Colditz, G.A. et al. (1994). JAMA 271:698) в отношении легочного заболевания взрослых, основной глобальной причины смертности от туберкулеза, и уменьшается со временем (Sterne, J. A. et al. (1998) Int. J. Tuberc. Lung Dis. 2:200). Причина такой вариабельности не известна. Даже при этих условиях 80% младенцев во всем мире каждый год получают BCGMycobacterium tuberculosis представляет собой внутриклеточный патоген, защитная эффективность против которого ассоциирована с поддержанием сильного, клеточно-опосредованного ответа на инфекцию, вовлекающего как CD4+, так и CD8+ Т-клетки, и со способностью отвечать цитокинами Thl-типа, в частности IFN- (Flynn, J. L., J. Chan. (2001) Annu. Rev. Immunol. 19:93). Вакцинация BCG индуцирует Тклетки, секретирующие IFN-, преимущественно Т-клетки фенотипа CD4+, которые перекрестно реагируют с белками М. tuberculosis (Launois R et al, (1994) Infection and Immunity 62(9):3679-87). Недавние исследования демонстрируют, что BCG, введенная парентерально, не способна индуцировать Тклеточные иммунные ответы в слизистой оболочке легких, которые могут быть решающими для защиты против легочного заболевания. Следовательно, существует потребность в разработке других вакцин против микобактериального заболевания. Краткое описание сущности изобретения В данной работе неожиданно обнаружили, что вирусные векторы, экспрессирующие микобактериальный антиген 85 А (Ag85A), могут индуцировать Т-клеточный иммунный ответ у пациента-человека при введении в виде иммуногенной композиции. Поэтому в изобретении предложен способ индукции Тклеточного иммунного ответа против микобактериального антигена у пациента-человека, включающий стадию введения указанному пациенту иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A. Предпочтительно, данная иммуногенная композиция представляет собой векторную вакцину. Этот подход с новой вакциной значительно улучшает силу и продолжительность Тклеточного иммунного ответа. Предпочтительно, Т-клеточный ответ представляет собой ответ Т-клеток памяти. Антиген 85 А (Ag85A) (регистрационныеСАА 17868 и ВХ 842584) является членом комплексаAg85. Он представляет собой семейство белков, включающее антигены 85 А, 85 В и 85 С, секретируемые М. tuberculosis, BCG и многими другими видами микобактерий (Harth, G. et al., (1996) Infect. Immun. 64:3038-3047). Антиген 85 А (Ag85A) является высококонсервативным у всех видов микобактерий и является иммунодоминантным в исследованиях животных и человека. Ag 85A (Ag85A) кодируется геномfbpA, Антиген 85A (Ag85A) из Mycobacterium tuberculosis приведен в SEQ ID NO: 1 и 2 в данном описании. В современных стратегиях индукции усиленных Т-клеточных ответов в исследовании туберкулезных вакцин использовали технологию рекомбинантных ДНК с использованием плазмидных, бактериальных или вирусных векторов и рекомбинантного белка для экспрессии антигенов М. tuberculosis. Было показано, что вакцинация мышей ДНК Ag85A, повторно иммунизируемых вектором MVA, экспрессирующим Ag85A, дает степень защиты, эквивалентную BCG, после контрольного заражения М. tuberculosis (McShane, Н. et al, (2002). Infect. Immun. 70:1623-1626). Однако иммунные ответы, формируемые однократной или повторной иммунизацией одним рекомбинантным вектором MVA, были слабыми. Для долговременной защиты против микобактериального заболевания, такого как туберкулез, считается важным поддерживать "Т-клетки памяти", которые могут продолжать стимулировать защитный иммунитет в течение десятилетий. Вторичные иммунные ответы (memory immune responses) классически приписывают повторной активации долгоживущих антигенспецифических Т-лимфоцитов, которые происходят непосредственно из-1 012436 дифференцированных эффекторных Т-клеток и продолжают существовать равномерно в состоянии покоя. Полагают, что эффекторные Т-клетки и Т-клетки памяти распределяются по всем тканям в организме, в частности, по эпителиальным поверхностям (таким как кожа и кишечник), где вероятной является повторная встреча с патогенами. Было показано, что Т-клетки памяти являются гетерогенными и включают в себя по меньшей мере две субпопуляции, наделенные разной способностью к миграции и эффекторной функции (Reinhardt,R.L. et ah, (2001) Nature. 410, 101-105). Клетки из первой субпопуляции имеют сходство с эффекторными клетками, образующимися при первичном ответе, в том, что они не имеют L-селектина и CCR7, представляющих собой хоминг-рецепторы лимфатических узлов, и экспрессируют рецепторы для миграции в воспаленные ткани. При повторной встрече с антигеном эти "эффекторные Т-клетки памяти" (ТЕМ) могут быстро продуцировать IFN- или IL-4, или высвобождать предварительно запасенный перфорин. Клетки из второй субпопуляции экспрессируют L-селектин и CCR7 и не имеют немедленной эффекторной функции. Эти "центральные Т-клетки памяти" (ТСМ) имеют низкий порог активации и, при повторной стимуляции во вторичных лимфоидных органах, пролиферируют и дифференцируются в эффекторы(Iezzi, G. et ah, (2001). J. Exp. Med. 193, 987-994). Авторы настоящего изобретения обнаружили, что дефектный по репликации вирусный вектор, экспрессирующий Ag 85A (Ag85A) (в данном случае проиллюстрированный примером "MVA85A"), может индуцировать высокие уровни антигенспецифических Т-клеток памяти, секретирующих интерферон-: как эффекторных Т-клеток памяти, так и центральных Т-клеток памяти, при использовании его одного у здоровых добровольцев, не подвергавшихся воздействию BCG. На протяжении последних 10 лет были разработаны новые иммунологические анализы для измерения и количественной оценки Т-клеточных ответов. Авторы настоящего изобретения использовалиELISPOT (иммуноферментный спот-анализ от англ. Enzyme-linked immunosorbent spot) анализ интерферона-гамма (IFN-) в качестве основных иммунологических данных для клинических испытаний сMVA85A, поскольку секреция IFN-y из антигенспецифических Т-клеток является самым лучшим доступным кореллятом защиты против М. tuberculosis. Кроме того, ELISPOT анализ является хорошо воспроизводимым и чувствительным методом количественной оценки числа антигенспецифических Тклеток, секретирующих IFN-. Авторы настоящего изобретения использовали два ELISPOT анализа: ex-vivo (свежий) ELISPOT анализ, где мононуклеарные клетки периферической крови (РВМС) инкубируют с антигеном в течение 18 часов для определения уровней CCR7-циркулирующих эффекторных Т-клеток, и ELISPOT анализ в культуре, где РВМС инкубируют с антигеном в течение 10-14 суток для измерения уровней CCR7+ центральных Т-клеток памяти (Godkin et al, JI, 2002). Авторы настоящего изобретения открыли, что вакцинация MVA85A индуцирует сильный ответ центральных Т-клеток памяти, специфичный в отношении антигена 85 А (Ag85A), который все еще определяется через 3 недели после вакцинации, когда ответ циркулирующих эффекторных Т-клеток является практически неопределимым. Это является первой демонстрацией того, что долговременная популяция центральных Т-клеток памяти может быть значительно усилена у пациента путем введения иммуногенной композиции, экспрессирующей микобактериальный антиген. Подразумевается, что используемый в данном описании термин "Т-клетка памяти" включает какCCR7- (эффекторные Т-клетки памяти), так и CCR7+ (центральные Т-клетки памяти) субпопуляции Тклеток. Это определение также включает как CD4 Т-клетки памяти, ограниченные классом II, так и CD8 Т-клетки памяти, ограниченные классом I. Предпочтительно, Т-клетки памяти, индуцированные векторными вакцинами по изобретению, характеризуются экспрессией CCR7+ на поверхности клеток. Они упоминаются в данном описании как центральные Т-клетки памяти. Предпочтительно, ответ Т-клеток памяти, индуцированный иммуногенными композициями по изобретению, представляет собой защитный Т-клеточный ответ. Защитный иммунный ответ можно измерить с помощью иммуноанализа секреции IFN-у, предпочтительно из антигенспецифических Т-клеток. Предпочтительно, ответ Т-клеток памяти является долговременным и сохраняется в течение по меньшей мере 1, 2, 5, 10, 15, 20, 25 или более лет. Наиболее предпочтительно, защитный иммунный ответ является пожизненным. Предпочтительно, ген Ag85A экспрессируется в вирусном векторе. Предпочтительно ген Ag85A экспрессируется в нереплицирующемся или дефектном по репликации вирусном векторе. Термин "векторные вакцины" хорошо известен в данной области. Вектор, используемый в способе по изобретению, представляет собой нереплицирующийся или дефектный по репликации вирусный вектор. Используемый в данном описании термин "нереплицирующийся" или "дефектный по репликации" означает не способный к репликации в значительной степени в большинстве нормальных клеток человека. Вирусы, которые являются нереплицирующимися или дефектными по репликации, могут становиться таковыми естественным путем (например, они могут быть выделены в таком виде из природной среды) или искусственно, например путем селекции in vitro или пугем генетической манипуляции, например-2 012436 делеции гена, который является критическим для репликации. Обычно существует один или несколько типов клеток, в которых можно выращивать вирусы, такие как клетки CEF для модифицированного вируса Анкара (MVA). В общем, вирусный вектор должен иметь способность стимулировать Т-клеточный ответ. Примерами вирусных векторов, которые являются полезными в этом контексте, являются векторы на основе вируса осповакцины, такие как MVA или NYVAC. Предпочтительным вирусным вектором является штамм вируса осповакцины MVA или штамм, происходящий из MVA. Альтернативы векторам на основе вируса осповакцины включают в себя векторы на основе других поксвирусов, включая векторы на основе вирусов оспы птиц, такие как векторы на основе вирусов оспы кур или оспы канареек. Особенно подходящим в качестве вектора на основе вируса оспы птиц является штамм вируса оспы канареек, известный как ALVAC (имеющийся в продаже под названием Капарох), и штаммы, происходящие изALVAC, а также штамм вируса оспы кур, известный как FP9. Другими альтернативами являются альфавирусные векторы, аденовирусные векторы, векторы на основе вируса герпеса, флавивирусные векторы,ретровирусные векторы и векторы на основе вирусов гриппа. Например, вектор может представлять собой вектор на основе аденовируса, не являющегося человеческим. Неожиданно обнаружили, что применение аденовирусного вектора индуцирует очень сильный ответ CD8 Т-клеток памяти, помимо очень сильного ответа CD4 Т-клеток памяти. Индукция ответа какCD8, так и CD4 Т-клеток памяти одной и той же вакциной, по-видимому, является полезной как в профилактике, так и в лечении микобактериального заболевания. Способ индукции ответа CD8 и CD4 Тклеток памяти в отношении антигена с использованием аденовирусного вектора, экспрессирующего антиген или его иммунногенный фрагмент, следовательно, также включен в объем данной заявки. Антиген,экспрессирующийся аденовирусным вектором, предпочтительно представляет собой микобактериальный антиген, как описано выше, наиболее предпочтительно Ag85A, но, в качестве альтернативы, может представлять собой любой другой подходящий антиген. Объем данного изобретения охватывает также применение аденовирусного вектора, экспрессирующего антиген или его иммуногенный фрагмент, в изготовлении лекарственного средства для индукции ответа CD8 и CD4 Т-клеток памяти в отношении данного антигена. Предпочтительно, согласно данному изобретению предложено применение аденовирусного вектора, экспрессирующего микобактериальный антиген или его иммунногенный фрагмент, в изготовлении лекарственного средства для лечения или профилактики микобактериального заболевания. Данный антиген предпочтительно представляет собой микобактериальный антиген, как описано выше, наиболее предпочтительно Ag85A, но, в качестве альтернативы, может представлять собой любой другой подходящий антиген Предпочтительно, чтобы вирусный вектор не мог вызывать серьезную инфекцию у пациента-человека. Репликацию вируса обычно измеряют двумя путями: 1) синтез ДНК и 2) вирусный титр. Более точно, термин "нереплицирующийся или дефектный по репликации", как он используется в данном описании и как он используется в отношении поксвирусов, означает вирусы, которые удовлетворяют одному из двух или обоим следующим критериям: 1) демонстрируют 1 log (10-кратное) снижение синтеза ДНК по сравнению с копенгагенским штаммом вируса осповакцины в клетках MRC-5 (линия человеческих клеток); 2) демонстрируют 2 log снижение вирусного титра в клетках HELA (линия человеческих клеток) по сравнению с копенгагенским штаммом вируса осповакцины. Примеры поксвирусов, которые подпадают под это определение, представляют собой MVA, NYVAC и вирусы оспы птиц, тогда как вирус, который не подпадает под это определение, представляет собой аттенуированный штамм вируса осповакцины М 7. Согласно данному изобретению также предложено применение иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A, в изготовлении лекарственного средства для лечения или предупреждения микобактериального заболевания у пациента-человека. Предпочтительно, иммуногенная композиция представляет собой векторную вакцину. Данная иммуногенная композиция и векторная вакцина действуют путем индукции у пациента Т-клеточного иммунного ответа. Вакцины по изобретению могут быть либо профилактическими (т.е. для предупреждения инфекции), либо вакцинами для применения после контакта с источником инфекции (т.е. для лечения после инфекции, но до начала заболевания), либо терапевтическими (т.е. для лечения заболевания), но типично будут представлять собой профилактические вакцины или вакцины для применения после контакта с источником инфекции. Микобактериальные заболевания, которые можно лечить или предупреждать с помощью векторной вакцины по настоящему изобретению, включают в себя туберкулез, лепру, инфекцию Mycobacteriumavium, нетуберкулезную микобактериальную инфекцию, язву Бурули, инфекцию или заболевание, вызванное Mycobacterium bovis, инфекцию, вызванную Mycobacterium paratuberculosis, или родственное заболевание. Другие заболевания (т.е. немикобактериальные заболевания) включают в себя воспалительное заболевание кишечника, болезнь Крона, аутоиммунное заболевание, рак, рак мочевого пузыря, натуральную оспу и обезьянью оспу.-3 012436 Можно использовать специализированные конструкции вирусных векторов для облегчения получения и применения векторной вакцины. Все векторные конструкции, раскрытые в данном описании, образуют аспекты данного изобретения. Векторные вакцины, содержащие эти вирусные конструкции, также включены в качестве аспектов данного изобретения. Например, один или более генов антигена могут быть укорочены по С-концу или N-концу данного гена. Это может оказывать влияние на облегчение клонирования и конструирования векторной вакцины и, альтернативно или дополнительно, может приводить к повышенной эффективности. Способы укорочения обычно известны специалисту в данной области. Простейшим способом осуществления укорочений этого типа является применение различных хорошо известных методик генной инженерии для избирательного удаления кодирующей последовательности нуклеиновой кислоты на любом конце гена антигена, а затем вставка желательной кодирующей последовательности в вирусный вектор. Например, укорочения кандидатного белка создают, избирательно используя 3'- и/или 5'-экзонуклеазные стратегии для разрушения, соответственно, 3'- и/или 5'-концов кодирующей нуклеиновой кислоты. Предпочтительно,последовательность гена дикого типа укорачивают таким образом, что экспрессируемый антиген укорачивается на 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот относительно родительского антигена. Наиболее предпочтительно, ген антигена представляет собой Ag85A,который укорочен на 15 аминокислот по С-концу относительно антигена Ag85A дикого типа (SEQ IDNO:3, продукт экспрессии SEQ ID NO:4). Антигены, подходящие для применения в данном изобретении, также включают фрагменты родительского антигена, при условии, что эти фрагменты имеют антигенную детерминанту или эпитоп, общий с родительским антигеном или иммунологически идентифицируемый с родительским антигеном. Полинуклеотиды, кодирующие эти фрагменты, также подходят для применения в иммуногенных композициях и векторных вакцинах по изобретению. Используемый в данном описании термин "фрагмент" относится к полипептиду, имеющему аминокислотную последовательность, которая является такой же, как часть, но не вся, аминокислотной последовательности родительского антигена, из которого он происходит, или одним из его функциональных эквивалентов. Данные фрагменты должны содержать по меньшей мере n последовательных аминокислот из данной последовательности и, в зависимости от конкретной последовательности, n предпочтительно равно 7 или более (например 8, 10, 12, 14, 16, 18, 20 или более). Маленькие фрагменты могут образовывать антигенную детерминанту. Гены антигенов по изобретению также могут кодировать варианты или функциональные эквиваленты родительского антигена. Такая молекула нуклеиновой кислоты может представлять собой природный вариант, такой как встречающийся в природе аллельный вариант, или данная молекула может представлять собой вариант, для которого не известно, что он встречается в природе. Такие не встречающиеся в природе варианты молекулы нуклеиновой кислоты могут быть получены с помощью методик мутагенеза, включая методики, используемые в отношении молекул нуклеиновых кислот, клеток или организмов. Среди вариантов в этом отношении есть варианты, которые отличаются от вышеупомянутых последовательностей гена антигена нуклеотидными заменами, делениями или вставками. Данные замены,делеции или вставки могут включать один или более нуклеотидов. Данные варианты могут быть изменены в кодирующих или в некодирующих участках, или и в тех и других. Изменения в кодирующих участках могут давать консервативные или неконсервативные аминокислотные замены, делеции или вставки. Альтернативно или в дополнение к использованию генного укорочения, ген, кодирующий антиген,может содержать нуклеиновую кислоту, кодирующую полипептидную метку, так, чтобы она была ковалентно связана с антигеном при трансляции. Предпочтительно, полипептидная метка выбрана из группы,состоящей из РК метки, FLAG метки, MYC метки, полигистидиновой метки или любой метки, которую можно определить с помощью моноклонального антитела. Другие примеры будут очевидны квалифицированному специалисту в данной области. В случае использования, РК метка предпочтительно имеет последовательность Pro-Asn-Pro-Leu-Gly-Leu-Asp. Метка этого типа может облегчать определение экспрессии антигена и клонов, экспрессирующих данный антиген, и альтернативно или дополнительно может приводить к увеличению эффективности. Нуклеиновая кислота, кодирующая полипептидную метку, может быть расположена таким образом,что после трансляции данная метка находится на С-конце или N-конце экспрессируемого антигена, или она может быть расположена внутри экспрессируемого антигена. Предпочтительно метка расположена на С-конце экспрессируемого антигена. Нуклеотиды, кодирующие линкерную последовательность, могут быть встроены между нуклеиновой кислотой, кодирующей полипептидную метку, и нуклеиновой кислотой, кодирующей экспрессируемый антиген. Предпочтительно, линкерная последовательность,когда она экспрессируется, содержит аминокислоты Gly-Ser-Ile. Более предпочтительно аминокислотыGly-Ser-Ile встроены между N-концевой последовательностью антигена и меткой экспрессируемого антигена. Наиболее предпочтительно экспрессируемый антиген представляет собой Ag85a (Ag85A), и РК метка расположена на С-конце гена Ag85a (Ag85A). Ген, кодирующий антиген, также может включать лидерную последовательность. Лидерная после-4 012436 довательность может влиять на процессинг первичного транскрипта в мРНК, на стабильность мРНК или на эффективность трансляции. Предпочтительно, лидерная последовательность усиливает экспрессию и/или иммуногенность антигена. Повышенная иммуногенность может быть определена, например, с помощью ELISPOT анализа в культуре и ex vivo. Повышенный уровень экспрессии может быть определен,например, с использованием моноклонального антитела для определения количества продуцируемого белка. Предпочтительно, экспрессия и/или иммуногенность увеличиваются в 2, 3 раза или более раз по сравнению с антигеном, экспрессируемым без лидерной последовательности. Примером подходящей лидерной последовательности является t-РА (тканевой активатор плазминогена) (Malin A.S. et al. (2000)Microbes Infect. 2000 Nov; 2(14): 1677-85). Предпочтительно, конструкция вирусного вектора включает укороченную по С-концу последовательность Ag85A, слитую с лидерной последовательностью ТРА. В еще одном другом предпочтительном воплощении вирусный вектор по изобретению экспрессирует укороченную по С-концу последовательность Ag85A, слитую с лидерной последовательностью ТРА и с последовательностью РК метки. Предпочтительно, лидерная последовательность слита с N-концом антигена, а последовательность метки слита либо внутри, либо с С-концом белка. В особенно предпочтительном воплощении конструкция вирусного вектора содержит полинуклеотид, кодирующий Ag85a (Ag85A), укороченный по С-концу на 15 аминокислот, слитый с последовательностью ТРА и с С-концевой РК меткой последовательности ProAsn-Pro-Leu-Leu-Gly-Leu-Asp, где аминокислотные остатки Gly-Ser-Ile присутствуют между последовательностью Ag85A и РК меткой (SEQ ID NO:5). Предпочтительно, продукт экспрессии вирусного вектора имеет аминокислотную последовательность SEQ ID NO:6. Было обнаружено, что защитный эффект Т-клеток, отмеченный авторами данного изобретения, является особенно сильным у пациентов-людей, которые ранее подвергались воздействию микобактериального антигена. Стратегии гетерологичной первичной-повторной иммунизации индуцируют более высокие уровни ответов эффекторных Т-клеток у животных и людей, чем гомологичная повторная иммунизация той же самой вакциной (Schneider, J. et. al. (1998) Nat. Med. 4, 397-402, McShane, H. et al (2001) Infect. Immun. 69, 681-686). Механизм, лежащий в основе постепенной потери эффективности BCG (прививаемой новорожденным), когда индивидуум достигает возраста 10-15 лет, плохо понятен. Одним из возможных предположений является то, что иммунитет, формируемый BCG, исчезает, и индивидуум становится эквивалентным хозяину, не подвергавшемуся вакцинации, который может быть вакцинирован новой кандидатной вакциной, разработанной для индукции первичного иммунитета. Хотя повторная вакцинация BCG, повидимому, дополнительно не увеличивает защиту против ТВ (ссылка Rodrigues L et al, Lancet 2005),включение BCG в гетерологичный режим первичной-повторной иммунизации сохраняло бы защитные эффекты BCG. Ранее была подтверждена иммуногенность и защитная эффективность повторной BCG иммунизации с использованием вирусных векторов, экспрессирующих антиген 85 А (Ag85A) в нескольких животных моделях (Goonetilleke, N.P. et. al. (2003) J. Immunol. 171, 1602-1609; Williams A et. al, Infection and Immunity (73(6):3814-6), но индукция защитного ответа Т-клеток памяти не была подтверждена. Поэтому согласно данному изобретению также предложен способ усиления Т-клеточного иммунного ответа у пациента-человека, включающий стадию введения указанному пациенту по меньшей мере одного микобактериального антигена в комбинации с векторной вакциной, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена 85 а (Ag85A). Предпочтительно Т-клеточный иммунный ответ представляет собой иммунный ответ Т-клеток памяти. Согласно данному изобретению также предложено применение: (а) по меньшей мере одного микобактериального антигена; и (б) векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена 85 а(Ag85A), в изготовлении лекарственного средства для введения пациенту для индукции Т-клеточного иммунного ответа. Векторную вакцину, содержащую нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена 85 а (Ag85A), и микобактериальный(е) антиген(ы) можно вводить одновременно, последовательно или раздельно. Например, микобактериальный(е) антиген(ы) можно вводить для примирования пациента до или после введения векторной вакцины для усиления иммунного ответа пациента на векторную вакцину. Кроме того, согласно данному изобретению также предложен способ индукции Т-клеточного иммунного ответа у пациента-человека, включающий стадию введения указанному пациенту-человеку иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A, где данный пациент был подвергнут предварительному воздействию по меньшей мере одного микобактериального антигена. Предпочтительно Т-клеточный иммунный ответ представляет собой иммунный ответ Т-клеток памяти. Согласно данному изобретению также предложено применение иммуногенной композиции, содержащей векторную вакцину, содержащую нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена 85 а (Ag85A), в изготовлении-5 012436 лекарственного средства для лечения или предупреждения микобактериального заболевания у пациентачеловека, который был подвергнут предварительному воздействию микобактериального антигена. Микобактериальный антиген может происходить из М. tuberculosis и/или может происходить из одной или более других микобактерий, таких как М. avium-intracellulare, M. kansasii, M. marinum и/или из М. ulcerans. Когда пациент был предварительно подвергнут воздействию только одного антигена, тогда данный антиген может представлять собой антиген, который дает защитный иммунный ответ против микобактериальной инфекции. В одном из воплощений данного изобретения антиген, воздействию которого был предварительно подвергнут пациент, не является Ag85A. Альтернативно или дополнительно, пациент возможно был предварительно подвергнут воздействию одной или более самих микобактерий. Например, предварительное воздействие на пациента по меньшей мере одного микобактериального антигена может иметь место до воздействия М. tuberculosis. Альтернативно или дополнительно, предварительное воздействие на пациента по меньшей мере одного микобактериального антигена может иметь место до воздействия микобактерий из окружающей среды,таких как М. avium-intracellulare, M. kansasii, M. marinum и/или из М. ulcerams. Предпочтительно, пациент является латентно инфицированным микобактериями. Например, данный пациент возможно был предварительно подвергнут воздействию М. tuberculosis и может быть латентно инфицирован туберкулезом. Когда лекарственное средство предназначено для лечения пациента, который латентно инфицирован микобактерией, данное лечение предпочтительно уничтожает микобактериальную инфекцию. Альтернативно или дополнительно, предварительное воздействие может включать неонатальную или предварительную вакцинацию BCG. Авторы настоящего изобретения обнаружили, что у добровольцев, которых ранее вакцинировали BCG и которые затем получили повторную иммунизирующую дозу векторной вакцины по настоящему изобретению, были индуцированы значительно более высокие уровни антигенспецифических Т-клеток, секретирующих интерферон-, и через 24 недели после вакцинации эти уровни были в 5-30 раз выше, чем у вакцинированных, которым проводили однократную вакцинацию BCG. Соответственно, согласно этому аспекту изобретения предложен способ индукции Т-клеточного иммунного ответа у пациента-человека, включающий стадии воздействия на пациента по меньшей мере одним микобактериальным антигеном и усиления иммунного ответа путем введения композиции для повторной иммунизации, включающей иммуногенную композицию, содержащую нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена 85 а (Ag85A). Этот аспект данного изобретения также относится к способу формирования Т-клеточного иммунного ответа у пациента-человека, включающему стадии: 1) воздействия на пациента по меньшей мере одним микобактериальным антигеном; 2) введения указанному пациенту по меньшей мере одной дозы композиции для повторной иммунизации, включающей векторную вакцину, содержащую нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена 85 а (Ag85A). В одном из воплощений данного изобретения, когда пациент подвергается воздействию только одного микобактериального антигена на стадии 1), данный антиген представляет собой антиген, который дает защитный иммунный ответ, но не Ag85A. Стадию 1) можно осуществить с пациентом любого возраста, например, в период новорожденности,в раннем детстве, во время пубертатного периода или во взрослом состоянии. Предпочтительно пациента подвергают воздействию по меньшей мере одного микобактериального антигена в период новорожденности. Введение иммуногенной композиции может происходить по меньшей мере через 1, 2, 3, 4, 5, 6, 7, 8,9 или 10 или более недель, или через 0,25, 0,5, 0,75, 1, 5, 10, 15, 20, 25, 30, 35 или 40 или более лет после предварительного воздействия по меньшей мере одного микобактериального антигена. Предпочтительно, когда стадию 1) осуществляют, когда пациент находится в раннем детстве, тогда стадию 2) осуществляют в раннем детстве или пубертатном возрасте. Когда стадия 2) включает введение пациенту более чем одной дозы композиции для повторной иммунизации, тогда более чем одну дозу можно вводить в течение короткого периода времени или в течение длительного периода времени. Например, дозы композиции для повторной иммунизации можно вводить в течение периода, длящегося часы, сутки, недели, месяцы или годы. Например, вторую дозу повторной иммунизации можно вводить от 0,5 до 24 ч после первой дозы повторной иммунизации, от 1 до 7 суток после первой дозы повторной иммунизации, от 1 недели до 1 месяца после первой дозы повторной иммунизации, от 1 месяца до 6 месяцев после первой дозы повторной иммунизации, от 6 месяцев до 1 года после первой дозы повторной иммунизации, или от 1 до 2, от 2 до 5, от 6 до 10 или более чем через 10 лет после первой дозы повторной иммунизации. Эти временные интервалы с соответствующими изменениями предпочтительно также применяются к периоду между любыми последовательными дозами. Во втором аспекте данного изобретения помимо иммунного ответа, индуцированного против антигена 85 а (Ag85A), вирусный вектор стимулирует векторспецифичный Т-клеточный ответ. Согласно это-6 012436 му аспекту изобретения введение векторной вакцины по изобретению стимулирует Т-клеточный иммунный ответ против вируса, из которого происходит вирусный вектор. Например, применение вектораMVA в векторной вакцине по изобретению стимулирует Т-клеточный иммунный ответ против вируса осповакцины. Предпочтительно, этот Т-клеточный ответ является защитным Т-клеточным ответом. Об эффекте этого типа ранее не сообщалось, и он является явно полезным в том, что векторная вакцина играет двойную роль во-первых, в защите против микобактериальных заболеваний и, во-вторых, в защите против заболевания, опосредованного вирусами, родственными данному вектору. В случае вектора MVA таким заболеванием является натуральная оспа. Заболевания вирусного происхождения, которые можно лечить или предупреждать с помощью векторной вакцины по настоящему изобретению, будут очевидны специалистам в данной области; их примеры включают в себя натуральную оспу, обезьянью оспу и диссеминированную инфекцию осповакциной. Соответственно, согласно этому аспекту данного изобретения предложен способ индукции Тклеточного иммунного ответа против микобактериального антигена и вируса у пациента-человека,включающий стадию введения иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A, пациенту-человеку. Предпочтительно Т-клеточный иммунный ответ представляет собой ответ Т-клеток памяти. Согласно этому аспекту данного изобретения также предложено применение иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A, в изготовлении лекарственного средства для индукции у пациента-человека Т-клеточного иммунного ответа против микобактериального антигена и вируса. Вакцины по изобретению доставляют пациенту иммунологически эффективное количество по меньшей мере одного антигена. Под "иммунологически эффективным количеством" подразумевают, что введение этого количества индивидууму либо в однократной дозе, либо как часть серии, является эффективным для лечения или предупреждения. Это количество варьирует в зависимости от здоровья и физического состояния индивидуума, которого лечат, возраста, активности иммунной системы индивидуума,степени желательной защиты, препарата вакцины, оценки медицинской ситуации лечащим врачом и других релевантных факторов. Ожидается, что данное количество будет попадать в относительно широкий интервал, который может быть определен обычными исследованиями. В третьем аспекте данного изобретения вирусный вектор может дополнительно экспрессировать продукт трансляции одного или более дополнительных генов антигена, которые могут быть использованы для индукции антигенспецифического иммунного ответа против таких дополнительных антигенов. Данный иммунный ответ может представлять собой CD8+, CD4+ и/или антительный ответ. Предпочтительно один или более дополнительных генов антигена происходят из М. tuberculosis, Plasmodium sp,вируса гриппа, ВИЧ, вируса гепатита С, цитомегаловируса, вируса папилломы человека, паразитов, вызывающих малярию, лейшманию, или, предпочтительно, из любого вида микобактерий. Предпочтительно, один или более дополнительных генов антигена кодируют антиген, выбранный из группы, состоящей из антигена из семейства антигена 85 из любой микобактерий или любого антигена, экспрессируемого видами микобактерий; более предпочтительно, из одного или более антигенов латентного периода, таких как 16 кДа антиген или гепарин-связывающий гемагглютинин (НВНА), или ESAT7, или слитый белок,известный как 72F. Также предусматривается, что дополнительный антиген может иметь эндогенное происхождение,чтобы индуцированный иммунный ответ был направлен против опухоли. Антигены эндогенного происхождения, которые подходят для применения в настоящем изобретении, представляют собой: белки теплового шока человека и опухолеассоциированные антигены, такие как СЕА, PSA, Muc-1, Her2neu. Вирусный вектор может быть сконструирован для экспрессии гена Ag85A и одного или более дополнительных генов антигена в виде последовательности эпитопов. Преимущественно эпитопы в последовательности многочисленных эпитопов связаны друг с другом без промежуточных последовательностей так, что исключается вещество нуклеиновых кислот и/или аминокислот, которое не является необходимым. Создания последовательности эпитопов предпочтительно можно достичь с использованием конструкции рекомбинантной ДНК, которая кодирует аминокислотную последовательность последовательности эпитопов, с ДНК, кодирующей Ag85A в той же рамке считывания, что и ДНК, кодирующая дополнительный(е) антиген(ы). В качестве альтернативы, Ag85A и дополнительный(е) антиген(ы) можно экспрессировать как отдельные полипептиды. Согласно этому аспекту изобретения также предложено применение векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A и продукт трансляции по меньшей мере одного дополнительного гена антигена или эпитопа в изготовлении лекарственного средства для лечения или предупреждения как микобактериального заболевания, так и по меньшей мере одного дополнительного заболевания у пациента-человека путем индукции Т-клеточного ответа у данного пациента.-7 012436 Согласно этому аспекту изобретения векторную вакцину можно использовать для защиты как против микобактериального заболевания, так и против одного или более заболеваний, выбранных из группы,состоящей из ВИЧ, малярии и натуральной оспы, путем индукции у пациента-человека Т-клеточного иммунного ответа, предпочтительно иммунного ответа Т-клеток памяти. Хотя векторную вакцину по настоящему изобретению можно использовать отдельно, ее можно также объединять с другими режимами вакцинации или терапевтическими режимами для лечения или предупреждения дополнительного заболевания. Следовательно, также как и предложение векторных вакцин, как описано выше, согласно данному изобретению предложена композиция, содержащая векторную вакцину по изобретению и один или более других антигенов или эпитопов, происходящих из агента,вызывающего заболевание. Антигены и эпитопы, подходящие для применения в композициях по изобретению, могут иметь бактериальное или вирусное происхождение. Подходящие антигены можно дополнительно классифицировать как белковые антигены, углеводные антигены или гликоконъюгированные антигены. Композиции по изобретению могут включать один или более дополнительных антигенов или эпитопов. Примеры представляют собой другой микобактериальный антиген или эпитоп; антиген или эпитоп ВИЧ; антиген или эпитоп плазмодия; малярийный антиген или эпитоп; сахаридный антиген из Streptococcus pneumoniae; белковый антиген из S. pneumoniae (например, из PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA,Spl25, Sp101, Sp128, Sp130 и Sp133); антиген или эпитоп из вируса гепатита А, такого как инактивированный вирус; антиген или эпитоп из вируса гепатита В, такие как поверхностные и/или коровые антигены; антиген или эпитоп из вируса гепатита С; сахаридный антиген из Haemophilus influenzae типа b; полиомиелитные антиген(ы) или эпитопы, такие как в IPV (инактивированная полиовакцина); дифтерийная вакцина или составляющие ее эпитопы, или антигены, или токсоид; столбнячная вакцина или составляющие ее эпитопы, или антигены, или токсоид; антигены или эпитопы из вирусов кори, свинки и/или краснухи; антиген(ы) или эпитопы из вируса гриппа, такие как поверхностные белки гемагглютинин и/или нейраминидаза. Антиген из вируса гриппа может быть выбран из пандемического штамма, например, из вируса птичьего гриппа, например, штамма H5N1; антиген или эпитоп из Staphylococcus aureus; раковый антиген или эпитоп. Когда используют сахаридный антиген, тогда он предпочтительно конъюгирован с носителем для усиления иммуногенности. Антигены токсичных белков могут быть детоксифицированы, при необходимости, например, химическими и/или генетическими способами. Сахаридные антигены предпочтительно находятся в форме конъюгатов. Предпочтительные белкиносители для конъюгатов представляют собой бактериальные токсины или токсоиды, такие как дифтерийный токсоид или столбнячный токсоид. Особенно предпочтительным носителем является мутантCRM197 дифтерийного токсина, а также дифтерийный токсоид. Другие подходящие белки-носители включают белок наружной мембраны N. meningitidis, синтетические пептиды, белки теплового шока,коклюшные белки, цитокины, лимфокины, гормоны, факторы роста, искусственные белки, содержащие множество эпитопов человеческих CD4+ Т-клеток из разных патогенов-происходящих антигенов, таких как белок N19, белок D из Н. Influenyae, пневмококковый поверхностный белок PspA, пневмолизин, белки поглощения железа, токсин А или В из С, difficile и пр. Каждый дополнительный антиген в данной композиции обычно будет присутствовать в концентрации по меньшей мере 1 мкг/мл. В общем, концентрация любого данного антигена будет достаточной для индукции иммунного ответа против этого антигена. В качестве альтернативы использованию дополнительных белковых антигенов в смеси можно использовать нуклеиновую кислоту, кодирующую данный антиген. Белковые компоненты смеси, таким образом, можно заменить нуклеиновой кислотой (предпочтительно ДНК, например, в форме плазмиды),которая кодирует данный белок. Аналогично, композиции по изобретению могут содержать белки, которые имитируют сахаридные антигены, например, мимеотопы или антиидиотипические антитела. Кроме того, согласно данному изобретению также предложена композиция, содержащая векторную вакцину по изобретению и одно или более чем одно противомикробное соединение. Примерами противомикробных соединений для применения в композициях по изобретению являются противотуберкулезные, химиотерапевтические соединения, такие как рифампицин, изониазид, этамбутол, пиризинамид и т.д. Соответственно, согласно данному изобретению предложен способ усиления Т-клеточного иммунного ответа у пациента-человека против по меньшей мере одного антигена, включающий стадию введе-8 012436 ния указанному пациенту векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag 85A(Ag85A) в комбинации с по меньшей мере одним дополнительным антигеном и/или противомикробным агентом. Согласно данному изобретению также предложено применение: (а) векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A (Ag85A); и (б) по меньшей мере один дополнительный антиген и/или микробный агент, в изготовлении лекарственного средства для введения пациенту-человеку для индукции Т-клеточного иммунного ответа. Векторную вакцину, содержащую нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A (Ag85A), и дополнительный антиген(ы) и/или противомикробный(ые) агент(ы), можно вводить одновременно, последовательно или раздельно. Например, векторную вакцину можно вводить для примирования пациента до введения антигена(ов)/противомикробного(ых) средств(а) или после введения антигена(ов) для усиления иммунного ответа пациента на этот антиген. Векторную вакцину и антиген(ы)/противомикробное(ые) средство(а) предпочтительно вводят в смеси. Согласно данному изобретению также предложено применение по меньшей мере одного антигена и/или противомикробного средства в изготовлении лекарственного средства для индукции у пациента Тклеточного иммунного ответа, где данное лекарственное средство вводят вместе с векторной вакциной,содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A (Ag85A). Аналогично, согласно данному изобретению предложено применение векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A(Ag85A), в изготовлении лекарственного средства для индукции у пациента Т-клеточного иммунного ответа, где данное лекарственное средство вводят по меньшей мере с одним дополнительным антигеном и/или противомикробным средством. Согласно данному изобретению также предложено применение по меньшей мере одного антигена и/или противомикробного средства в изготовлении лекарственного средства для индукции у пациента Тклеточного иммунного ответа, где указанный пациент был предварительно обработан векторной вакциной, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A. Согласно данному изобретению также предложено применение векторной вакцины, содержащей нереплицирующийся или дефектный по репликации вирусный вектор, экспрессирующий продукт трансляции микобактериального гена Ag85A, в изготовлении лекарственного средства для индукции у пациента Т-клеточного иммунного ответа, где указанный пациент был предварительно обработан по меньшей мере одним антигеном и/или противомикробным средством. Настоящее изобретение можно использовать для индукции или усиления целого ряда иммунных ответов, как описано выше. Конкретно, целью этого изобретения является именно идентификация эффективных способов иммунизации против заболеваний, в которые вовлечены микобактерии. Такие заболевания включают болезнь Гансена, туберкулез, остеомиелит, болезнь Крона, лепру, лимфаденит, болезнь Джона. Вышеописанные аспекты данного изобретения применимы к целому ряду различных пациентов,включая, например, детей, пациентов, которые имеют ВИЧ, СПИД, имеют ослабленный/подавленный иммунитет, или которые были подвергнуты трансплантациям органов, трансплантациям костного мозга,или которые страдают от генетических иммунонодефицитов. Когда вакцина предназначена для профилактического примения, тогда пациентом может быть ребенок (например младенец или ребенок в возрасте 1-5 лет), ребенок более старшего возраста или подросток; когда вакцина предназначена для терапевтического применения, пациентом предпочтительно является взрослый. Вакцину, предназначенную для детей, также можно вводить и взрослым, например, для оценки безопасности, дозировки, иммуногенности и т.д. Согласно данному изобретению также предложена фармацевтическая композиция, содержащая (1) иммуногенную композицию по изобретению и (2) фармацевтически приемлемый носитель. Согласно данному изобретению предложен способ получения фармацевтического препарата, включающий стадии: (1) получения векторной вакцины по изобретению; (2) смешивания указанной иммуногенной композиции с одним или более чем одним фармацевтически приемлемым носителем. Носитель (2) может представлять собой любое вещество, которое само не индуцирует продукцию антител, вредных для пациента, получающего данную композицию, и которое можно вводить без чрезмерной токсичности. Подходящие носители могут представлять собой большие, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Такие носители хорошо известны специалистам в данной области. Фармацевтически приемлемые носители могут включать жидкости, такие как вода, физиологический раствор, глицерин и этанол. В таких носите-9 012436 лях также могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, соединения, забуферивающие рН, и тому подобное. Также могут присутствовать стабилизирующие агенты, такие как трегалоза или вещества, которые обеспечивают образование водорастворимой стекловидной сахарной массы при температурах окружающей среды. Последнее включает применение смешанной технологии стабилизации растворимой стекловидной массы в формате микросфер, суспендированных в перфторуглеродных жидкостях. Липосомы также являются подходящими носителями. Детальное обсуждение фармацевтических носителей доступно в Gennaro (2000) Remington: The Science andPractice of Pharmacy. 20th ed., ISBN: 0683306472. Фармацевтические композиции по изобретению также можно использовать профилактически, например, в ситуации, когда ожидается контакт с микробами и когда следует предотвратить инфицирование. Например, данную композицию можно вводить перед хирургическим вмешательством. Фармацевтическая композиция является предпочтительно стерильной. Она является предпочтительно апирогенной. Она является предпочтительно забуференной, например, от рН 6 до рН 8, обычно около рН 7. Предпочтительно данная композиция является, по существу, изотоничной жидкостям из организма человека. Композиции по изобретению можно вводить множеством разных путей. Некоторые пути могут быть предпочтительными для определенных композиций, как приводящие к формированию более эффективного ответа, или за счет меньшей вероятности индукции побочных эффектов, или в результате более легкого введения. Например, композиции, используемые в этом изобретении, можно вводить многими путями, включая, но не ограничиваясь этим, пероральное, внутривенное, внутримышечное, внутриартериальное, интрамедуллярное, интратекальное, интравентрикулярное, трансдермальное или чрескожное применения,подкожный, интраперитонеальный, интраназальный, энтеральный, местный, сублингвальный, интравагинальный или ректальный способы. Композиции могут быть приготовлены для интраназального введения в виде назального спрея, назальных капель, геля или порошка, или в виде инъецируемых препаратов в виде либо жидких растворов, либо суспензий; также могут быть получены твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. Прямая доставка композиций обычно будет осуществляться путем инъекции, подкожно, интраперитонеально, внутривенно или внутримышечно, интраназально, или доставка будет осуществляться в интерстициальное пространство ткани. Дозировка при лечении может представлять собой схему с однократной дозой или со многими дозами. Различные аспекты и воплощения настоящего изобретения теперь будут описаны более подробно с помощью примера со ссылкой на следующие графические материалы. Краткое описание графических материалов фиг. 1: Медиана IFN- ответов, определенных с помощью ELISPOT, после вакцинации в каждой группе вакцинации: только BCG; только MVA85A; первичная иммунизация BCG - повторная иммунизация MVA85A. (а) временная шкала для вакцинаций (недели) в каждой группе; (б) ответы на очищенное белковое производное туберкулина (PPD); (в) ответы на очищенный белок антиген 85 (Ag85A); (г) ответы на суммарные объединенные пептиды; (д) для каждого из трех измеренных антигенов ответы между каждой группой вакцинации в каждый момент времени сравнивали с использованием статистики МаннаУитни. Указаны статистически достоверные сравнения; (е) обнаружение Т-клеточных эпитопов после повторной MVA иммунизации у индивидуумов, вакцинированных BCG. Все ответы на индивидуальные пептиды были полностью отменены CD4+ Т-клеточным истощением; фиг. 2: Скрининг ответов крови, определенных с помощью ELISPOT в культуре, на PPD M.tb; PPDM.avium и рекомбинантный антиген 85A (Ag85A); от 4 добровольцев в исследовании только MVA85A,до вакцинации; каждый доброволец идентифицирован кодом ТХХХХХХ, где первые три X соответствуют номеру испытания, а последние три X соответствуют номеру добровольца, например, Т 002022 означает, что Т 002 представляет собой номер испытания, а 022 представляет собой номер добровольца; фиг. 3: Ответы ELISPOT в культуре (меченая "культура") и ex vivo на пулы пептидов Ag85A (обозначенных прописными буквами) у пяти добровольцев (каждый идентифицирован кодом ТХХХХ, где ХХХХ представляет собой номер из четырех цифр, причем первая цифра соответствует номеру испытания, и вторая, третья и четвертая цифры соответствуют номеру волонтера, например, Т 2003 означает, что Т 2 представляет собой номер испытания, а 003 представляет собой номер волонтера (Т 2 является тем же самым, что и Т 002 на фиг. 2, приведенной выше), через три недели после проведения однократной иммунизации MVA85A. Ответы после вакцинации являются очень сильными и более сильными, чем ответы до вакцинации. Добровольцы ранее не были вакцинированы BCG; фиг. 4: Последующее наблюдение Т-клеточных ответов на MVA-Lac-z, который используют в качестве антигена в ELISPOT анализе ex vivo у здоровых добровольцев, иммунизированных MVA-85A, иммунизированных один раз в неделю 1. Добровольцев ранее вакцинировали BCG; фиг. 5(а): Медиана ответов в ELISPOT на PPD, рекомбинантный антиген 85 А (Ag85A) и на суммарные пептидные пулы антигена 85 А (Ag85A) после однократной вакцинации MVA85A у субъектов, латентно инфицированных M.tb;- 10012436 фиг. 5(б): Сравнение MVA85A-индуцированных ответов на суммарные объединенные пептиды антигена 85 А (Ag85A) у субъектов, примированных BCG (Т 005, т.е. испытание 5; смотри пример 1), и субъектов, латентно инфицированных M.tb (Т 007, т.е. испытание 7); фиг. 5(в): Сравнение MVA85A-индуцированных ответов на рекомбинантный антиген 85 А (Ag85A) у субъектов, примированных BCG (T005), и субъектов, латентно инфицированных M.tb (T007); фиг. 6(а): Постоянство MVA85A-индуцированных иммунных ответов в течение по меньшей мере 1 года после вакцинации в группе субъектов с длительным (более 10 лет) интервалом между первичной(BCG) и повторной (MVA85A) иммунизациями; фиг. 6(6): Постоянство MVA85A-индуцированных иммунных ответов в течение по меньшей мере 1 года после вакцинации в группе субъектов с коротким (1 месяц) интервалом между первичной (BCG) и повторной (MVA85A) иммунизациями; фиг. 7(а): Отсутствие корелляции между интервалом между BCG и MVA85A вакцинациями и Тклеточными ответами на суммарные пептидные пулы антигена 85 А (Ag85A) через 1 неделю после введения MVA85 А; фиг. 7(б): Отсутствие корелляции между интервалом между BCG и MVA85A вакцинациями и Тклеточными ответами на суммарные пептидные пулы антигена 85 А (Ag85A) через 24 недели после введения MVA85A; на фиг. 8(а) показаны средние уровни IFN- после вакцинации; на фиг. 8(б) показаны средние уровни IFN-y после стимула; на фиг. 9(а) показаны IFN- ответы, определенные в ELISPOT ex-vivo, на MVA85A у добровольцев из Великобритании, не подвергавшихся воздействию BCG; и на фиг. 9(б) показаны IFN- ответы, определенные в ELISPOT ex-vivo, на MVA85A у добровольцев из Гамбии, не подвергавшихся воздействию BCG. Примеры Пример 1. Вакцина MVA85A Конструкция MVA85A была описана ранее (McShane, H. et al. (2002) Infect. Immun. 70, 1623-1626).MVA85A клинического качества была получена Impfstoffwerke Dessau-Tornau в соответствии с хорошим стандартом производственной практики. Свидетельство об освобождении от уплаты налогов для врачей и стоматологов было выдано Регулирующим агентством по медицинским продуктам и продуктам для заботы о здоровье (Medicines and Healthcare products Regulatory Agency), Лондон, для примененияMVA85A в клинических испытаниях. Клинические испытания Добровольцев для исследований иммунизации набирали в соответствии с протоколами, одобренными Комитетом по этике научных исследований Оксфордшира (Oxfordshire Research Ethics Committee),и регистрировали только после получения письменного информированного согласия. Возрастной диапазон для включения в испытание составлял 18-55 лет, и все исследованные добровольцы были серонегативными на ВИЧ, HBV (вирус гепатита В) и HCV (вирус гепатита С) при скрининге. До вакцинации выполняли обычные лабораторные исследования по гематологии и биохимии, и все значения находились в пределах нормы. Всех добровольцев наблюдали в течение 6 месяцев, причем образцы крови отбирали в определенные моменты времени. Пациенты, которые получали иммунизации MVA85A, заполняли ежедневные карты, фиксирующие местные и системные побочные эффекты и температуру тела в течение 7 суток после вакцинации. Вакцинации Первые два испытания были проведены на здоровых добровольцах, не подвергавшихся воздействию BCG, что было установлено с использованием пробы Гифа (Heaf test). Проба Гифа включает помещение очищенного белкового производного туберкулина (PPD) на кожу и затем использование пистолета для производства множества проколов. Положительным ответом является более чем 4 папулы в местах проколов через 72 ч. Положительная кожная проба указывает на активную туберкулезную инфекцию или предварительную вакцинацию BCG. Добровольцев с отрицательной (балл 0) пробой Гифа (эквивалентной туберкулиновому кожному тесту 0 мм) вакцинировали либо BCG (однократная иммунизация штаммом BCG Glaxo, 100 мкл вводили внутрикожно, n=11), либо MVA85A (5107 БОЕ (бляшкообразующих единиц), введенных интрадермально, 2 иммунизации проводили с интервалом 3 недели, n=14). В третьем испытании набирали добровольцев, которые ранее были вакцинированы BCG (n=17). Медиана времени между вакцинацией BCG и иммунизацией MVA85A составляла 18 лет (интервал от 0,5 до 38 лет). Добровольцев с пробой Гифа, не превышающей уровень II (эквивалентный туберкулиновой кожной пробе 15 мм), регистрировали для испытания и иммунизировали однократной дозой 5 х 10 БОЕMVA85A интрадермально в кожу, находящуюся над дельтовидной мышцей руки, противоположной по отношению к руке, в которую осуществляли вакцинацию BCG. В целом, 31 здорового добровольца вакцинировали MVA85A. 11 из 14 добровольцев, не подвергавшихся обработке BCG, получали 2 иммунизации с интервалом 3 недели. Остальные 3 получали однократную иммунизацию. Все 17 добровольцев,примированных BCG, получали однократную иммунизацию MVA85A. Все добровольцы завершили 6- 11012436 месячный период наблюдения, и ни в одном из этих испытаний не было серьезных или тяжелых неблагоприятных событий. Показатели иммуногенности Главным иммунологическим показателем, используемым для определения иммуногенности вакцины, был анализ IFN- с помощью ELISPOT ex vivo. Его осуществляли на крови, взятой в следующие моменты времени: в момент скрининга до туберкулиновой кожной пробы и затем через 1,4, 12 и 24 недели после вакцинации. Эти измерения осуществляли на свежих РВМС, используя PPD туберкулина (20 мкг/мл, SSI), комплекс очищенного антигена 85 (Ag85A) (10 мкг/мл) и 7 пулов 9-10 15-мерных пептидов,имеющих перекрытие в 10 аминокислот (конечная концентрация каждого пептида в лунке для ELISPOT 10 мкг/мл). Вкратце, 300000 РВМС на лунку в 100 мкл R10 (RPMI плюс 10% фетальной телячьей сыворотки) непосредственно высевали на планшет для ELISPOT (MAIP S4510, Millipore) в присутствии антигена и инкубировали в течение 18 ч. Во всех анализах в качестве положительных контролей использовали стрептокиназу (250 ед./мл)/стрептодорназу (12,5 ед./мл) и фитогемагглютинин (10 мкг/мл). Анализы осуществляли в двойной повторности и результаты усредняли. Картирование эпитопов Ответы на индивидуальные пептиды тестировали на первом или последующем образце после вакцинации. Истощение с использованием магнитных шариков (Dynal) осуществляли на индивидуальных пептидных ответах. Истощения CD4+ и CD8+ Т-клеток осуществляли посредством 30-минутной инкубации с моноклональными антителами на CD4 и CD8, коньюгированными с железными шариками, в соотношении 5 шариков на 1 клетку, используя М-450 (Dynal, Oslo, Norway) в 200 мкл R10 на льду. Клетки,покрытые антителами, удаляли с использованием магнита (Dynal). Образцы анализировали в отношении групп с неистощенными, истощенными CD4+ и истощенными CD8+ Т-клетками. Истощения клеток подтверждали с помощью FACS сканирования, и они всегда составляли 90% для CD8+ Т-клеток и 97% для CD4+ Т-клеток (данные не показаны). Анализ иммуногенности Данные ELISPOT анализировали путем вычитания среднего количества пятен в контрольных лунках, содержащих только среду и клетки, из среднего количества пятен в лунках с антигенами или пептидными пулами и клетками. Количества менее 5 пятен/лунку не учитывали. Лунка считалась положительной, если количество было по меньшей мере в два раза выше, чем в лунках с отрицательным контролем, и по меньшей мере на 5 пятен больше, чем в лунках с отрицательным контролем. Для лунок с пептидными пулами результаты суммировали по всем пептидным пулам для каждого добровольца в каждый момент времени. Например, там, где присутствуют 7 пептидных пулов, каждый из которых содержит 910 пептидов, каждый пул тестируют в двойной повторности. Для получения результата для этого пула рассчитывают среднее этой двойной повторности для каждого пула и вычитают среднее для лунки с отрицательным контролем. Результаты для 7 индивидуальных пулов затем складывают вместе. При этом потенциально будут дважды учитывать Т-клетку, которая отвечает на любой из 10-мерных перекрывающихся участков, которые встречаются в двух пулах со смежными пептидами. Статистический анализ Анализ дисперсии повторных измерений с использованием исходного результата при скрининге в качестве ковариации осуществляли на логарифмически преобразованных данных для сравнения групп. Затем для всех сравнений между группами использовали критерий Манна-Уитни, а для попарного сравнения скрининговых и 24-недельных образцов в группе с первичной иммунизацией BCG -повторной иммунизацией MVA85A использовали критерий Уилкоксона (Wilcoxon). Метод ELISPOT в культуре Для ELISPOT в культуре, 1106 хранившихся при криогенной температуре РВМС стимулировали 20 мкг/мл M.tb PPD ("PPD-T"), M.avium PPD ("PPD-A") или 10 мкг/мл рекомбинантного антигена 85 А(Ag85A) в 24-луночном планшете. После 3-суточного периода инкубации при +37 С в атмосфере 5% СО 2 удаляли 500 мкл клеточного культурального супернатанта и заменяли 5 МЕ/мл Lymphocult-T (Biotest,Dreieich, Germany) в R10. Эту процедуру повторяли на 7-е сутки. На 9-е сутки клетки промывали три раза и оставляли в покое на ночь при +37 С в атмосфере 5% СО 2 в R10. На 10-е сутки клетки промывали и ресуспендировали в 2 мл R10, 50 мкл культивируемых клеток (2,5104 первоначально посеянных клеток) переносили в дублированные лунки на планшете для ELISPOT и стимулировали в течение 18 ч с помощью PPD-T 20 мкг/мл, PPD-A 20 мкг/мл и Ag85A 10 мкг/мл. Планшет для ELISPOT затем проявляли, как описано ранее. Результаты Иммунизация MVA85A была безопасной и хорошо переносимой (табл. 1). Сравнивали кинетику и амплитуду антигенспецифического Т-клеточного ответа, индуцированного вакцинацией только BCG,только MVA85A и первичной иммунизацией BCG - повторной иммунизацией MVA85A. В анализах все три схемы вакцинации индуцируют значительные иммунные ответы с использованием в качестве антигена любого из PPD-T, белка антигена 85 (Ag85A) или перекрывающихся пептидов из антигена 85A(Ag85A) (табл. 2, фиг. 1). Имел место статистически достоверный основной эффект вакцины в группеPPD-T (F = 3,624; Р = 0,037), антигена 85 (Ag85A) (F = 16,605; Р 0,001) и суммарных объединенных пептидов антигена 85 А (Ag85A) (F 39,982; Р 0,001). Иммунизация BCG индуцировала умеренные уровни антигенспецифических Т-клеток, секретирующих IFN-, которые имели пик через 4 недели после иммунизации (табл. 2, фиг. 1 б-г). Ответы на объединенные пептиды антигена 85A (Ag85A) после вакцинации BCG были удивительно слабыми (фиг. 1 г). Только 4 из 11 добровольцев отвечали на любой из 7 пептидных пулов в анализе ELISPOT ex-vivo. Все эти ответы на пептидные пулы относились к пептидам 12, 13, 27 и 28 и полностью отменялись истощением CD4+ Т-клеток. Таблица 1. Сопутствующие неблагоприятые события после иммунизации MVA85A. Не было различий ни в частоте, ни в тяжести описанных нежелательных событий между группами добровольцев, не подвергавшихся воздействию BCG и подвергавшихся первичной иммунизации BCG Все системные симптомы проходили в течение 7 суток Интервал 37,7-38,1 С; все спонтанно проходило в течение 24 ч У добровольцев, не подвергавшихся воздействию BCG, однократная иммунизация MVA85A индуцировала высокие уровни антигенспецифических Т-клеток, секретирующих IFN-, которые достигали пика через 7 суток после вакцинации у 13/14 добровольцев (табл. 2, фиг. 1 б-в). К 4 неделям этот ответ падал до уровня, лишь слегка превышающего исходный. Не наблюдалось усиливающего эффекта второй вакцинации MVA85A, проведенной на 3-ей неделе. У одного добровольца после иммунизации MVA85A не обнаруживались специфические к вставке Т-клетки, однако у этого добровольца обнаруживались специфические Т-клеточные ответы на вектор MVA, несмотря на то, что он не имел предыдущей истории иммунизации вирусом осповакцины (данные не показаны). Затем исследовали ответы на MVA-lac-Z у добровольцев, вакцинированных MVA85A, путем проведения анализов ELISPOT ех-vivo с использованием антигена MVA-lac-Z. Методология анализа является такой же, как обсуждалось выше в "Показателях иммуногенности". Здоровые добровольцы, вакцинированные MVA85A, демонстрировали сильные анти-MVA Т-клеточные ответы, которые длились в течение вплоть до 24 недель после вакцинации. В отличие от BCG вакцинации вакцинация MVA85A индуцировала сильные ответы на некоторые пептидные пулы у всех 13/14 отвечающих добровольцев (табл. 2, фиг. 1 г). Были зарегистрированы ответы на широкий спектр пептидов по всей длине антигена 85 А (Ag85A). Все эти ответы на индивидуальные пептиды полностью отменялись истощением CD4+ Т-клеток (данные не показаны). У 16/17 добровольцев в группе с первичной иммунизацией BCG - повторной иммунизациейMVA85A наблюдали значительное увеличение числа антигенспецифических Т-клеток через 1 неделю после вакцинации (табл. 2, фиг. 1). Максимальный ответ через 1 неделю после иммунизации был значительно выше в группе с первичной иммунизацией BCG - повторной иммунизацией MVA85A, чем в любой из групп с иммунизацией только BCG или только MVA85A (фиг. 1 б-д). Эти ответы поддерживались на значительно более высоком уровне, чем после вакцинации только BCG или только MVA85A, в течение по меньшей мере 24 недель (фиг. 1 д). Исходные ответы при скрининге были более сильными у добровольцев, ранее вакцинированных BCG, чем в группе добровольцев, не подвергавшихся воздействиюBCG, как ожидалось. Тем не менее, ответы через 24 недели после вакцинации MVA85A в группе с первичной иммунизацией BCG - повторной иммунизацией MVA85A были значительно более сильными, чем исходные показатели в этой группе для PPD (Уилкоксон z = -3,010, Р = 0,003), антиген 85 (Ag85A) (Уилкоксон z = -3,516, Р 0,001) и суммарные объединенные пептиды (Уилкоксон z = -3,408, Р = 0,001). Широта пептидных ответов, наблюдаемых в группе, иммунизированной только MVA85A (не пока- 13012436 зано), и в группе с первичной иммунизацией BCG - повторной иммунизацией MVA85A (фиг. 1 е) была очень сходной. Однако амплитуда ответов была значительной выше в группе с первичной иммунизациейBCG - повторной иммунизацией MVA85A (фиг. 1 д). РВМС от 12 добровольцев в группе с первичной иммунизацией BCG - повторной иммунизацией MVA85A анализировали со всеми 66 пептидами из антигена 85 А (Ag85A). Некоторые из этих пептидов распознавались более чем у 50% субъектов (фиг. 1 е),иллюстрируя различное распознавание этих пептидов разными молекулами HLA Класса II, как сообщалось ранее (Launois, P. et al. (1994) Infect. Immun. 62, 3679-3687. Таблица 2. Среднее арифметическое (SE) и медиана (IQR) ответов в ELISPOT на PPD, антиген 85(Ag85A) и суммарные объединенные пептиды в каждой группе вакцинации в каждый момент времени. Амплитуда Т-клеточных ответов, наблюдаемых в группе, иммунизированной только MVA85A, является примерно в 10 раз более сильной, чем амплитуда, которую наблюдали с другими рекомбинантными MVA, используемыми до настоящего времени (McConkey, S.J. et al., "Enhanced T-cell immunogenicity of plasmid DNA vaccines boosted by recombinant modified vaccinia virus Ankara in humans", Nat. Med., 9,729-735 (2003; Mwau, M. et al., "A human immunodeficiency virus 1 (HIV-1) clade A vaccine in clinical trials: stimulation of HIV-specific T-cell responses by DNA and recombinant modified vaccinia virus Ankara(MVA) in humans", J. Gen. Virol., 85, 911-919 (2004. Рекомбинантный MVA, экспрессирующий антиген из Р. falciparum, индуцировал средний суммарный пептидный ответ 90SFC/106 РВМС через 7 суток после вакцинации (McConkey, S.J. et al. (2003) Nat. Med. 9, 729-735). В отличие от этого, авторы данного изобретения наблюдают средний ответ на суммарные пептиды 1365 SFC/106 РВМС через 7 суток после вакцинации MVA85A (табл. 2). Одним из объяснений этого является то, что эти добровольцы имеют некоторый предсуществующий антимикобактериальный иммунитет, который усиливается иммунизациейMVA85A. Чтобы дополнительно исследовать это, авторы данного изобретения использовали ELISPOT анализ в культуре, а не ELISPOT анализ ex-vivo. Ранее было показано, что ELISPOT анализ в культуре определяет центральные Т-клетки памяти, а не активированные эффекторные Т-клетки, которые определяются в ELISPOT ex-vivo (Reece,W.H. et al. (2004) Nat. Med. 10, 406-410, Godkin, A.J. et al. (2002) J. Immunol. 169, 2210-2214). Анализ IFN- с помощью ELISPOT в культуре осуществляли на скрининированных РВМС до вакцинации от 4 добровольцев в группе, иммунизированной только MVA85A. Клетки культивировали сPPD M.tb, PPD M.avium и рекомбинантным антигеном 85 А (Ag85A). Все 4 добровольца отвечали на PPDM.avium, 2/4 отвечали на PPD M.tb и 2/4 отвечали на рекомбинантный антиген 85 А (Ag85A) (фиг. 2). Ни один из этих добровольцев не имел каких-либо исходных ответов ни на PPD M.tb, ни на очищенный антиген 85 (Ag85A) при скрининге с помощью ELISPOT ex-vivo. Для дальнейшего исследования индукции ответа Т-клеток памяти после вакцинации MVA85A осуществляли ELISPOT анализ ex-vivo и в культуре на 3-ей неделе после вакцинации РВМС. Клетки культивировали с PPD M.tb, PPD M.avium и рекомбинантным антигеном 85 А (Ag85A). На 3-ей неделе ответex-vivo является очень слабым или недетектируемым, однако у всех 5 исследованных добровольцев наблюдались сильные ответы в ELISPOT в культуре, что указывает на индукцию вакцинацией центральных Т-клеток памяти, специфических в отношении антигена 85 А (Ag85A) (фиг. 3). Пример 2. Данные по безопасности и иммуногенности у субъектов, которые являются латентно инфицированными М.tb 9 здоровых взрослых, которые были латентно инфицированы Mycobacterium tuberculosis (M.tb),вакцинировали MVA85A. Сывороточные маркеры воспаления определяли у каждого субъекта после вакцинации с регулярными интервалами в течение двенадцати месяцев. У каждого субъекта до вакцинации и через 10 недель после вакцинации осуществляли КТ (компьютерная томография) сканирование- 14012436 легких высокого разрешения. Эти анализы проводили для того, чтобы определить любые субклинические признаки воспаления легких. Результаты ELISPOT ex vivo от 9 латентно инфицированных добровольцев показаны на фиг. 5 а. Безопасность MVA85A в этой группе идентична безопасности, наблюдавшейся в предыдущих испытаниях, описанных в примере 1. Не обнаружили увеличения ни местных, ни системных побочных эффектов и не обнаружили никаких признаков какого-либо воспаления легких. После вакцинации не было изменений в маркерах воспаления, и после вакцинации не было воспаления легких, регистрируемого КТ сканированием. Для сравнения, 17 здоровых взрослых, которые ранее получали инъекцию BCG от 0,5 до 37 лет назад, подвергали повторной иммунизации вакциной MVA85A. Результаты описаны в примере 1. Иммунные ответы после вакцининации, наблюдаемые в латентно инфицированной группе (испытание 7,"Т 007"), имеют амплитуду, аналогичную амплитуде ответов, наблюдаемой в группе, получившей первичную иммунизацию BCG (испытание 5, "Т 005"). Результаты показаны на фиг. 5 б и 5 в. Эти данные являются значимыми, так как важно, что любая новая ТВ вакцина является безопасной у латентно инфицированных субъектов, при условии преобладания латентной инфекции во всем развивающемся мире. Кроме того, обнадеживающая иммуногенность поддерживает применение этой вакцины в качестве вакцины для применения после контакта с источником инфекции, вводимой латентно инфицированному человеку с целью уничтожения такой латентной инфекции. Продолжительность иммунного ответа Ответы, регистрируемые в ELISPOT ex-vivo у добровольцев, примированных BCG, после повторной иммунизации MVA85A длятся в течение по меньшей мере 1 года после вакцинации как при коротком (1 месяц), так и при длительном (более 10 лет) интервале между первичной (BCG) и повторной(MVA85A) иммунизациями. Данные долгосрочного наблюдения за 12 добровольцами, вакцинированными MVA85A более чем через 10 лет после BCG, и за 10 добровольцами, вакцинированными MVA85A через 1 месяц после BCG,показаны на фиг. 6. Данные из обеих групп добровольцев показывают, что постоянство иммунных ответов через 1 год после вакцинации имеет ту же амплитуду, которая наблюдается через 6 месяцев после вакцинации. Постоянство иммунных ответов, индуцированных вакциной, демонстрирует индукцию вторичного иммунного ответа (memory response). Нельзя было бы ожидать наблюдения постоянных ответов, индуцированных вакциной, через 1 год после вакцинации нереплицирующейся вакциной, если бы не был индуцирован вторичный иммунный ответ. Корреляция между интервалом первичной иммунизации - повторной иммунизации и уровнем иммунного ответа Данные, представленные на фиг. 3, показывают, что усиление иммунных ответов, индуцированныхBCG, наблюдаемое после повторной вакцинации MVA85A, не зависит от интервала между первичной иммунизацией BCG и повторной иммунизацией MVA85A. Равное усиление наблюдали при коротком (1 месяц) и длительном (более 10 лет) интервале повторной иммунизации. Не существует корреляции между интервалом между первичной (BCG) и повторной (MVA85A) вакцинациями, и пиком (1 неделя), и плато (6 месяцев) иммунных ответов, индуцированных MVA85A(фиг. 7). Таким образом, одинаково возможным является усиление иммунитета против микобактерий как вскоре после вакцинации BCG (например в раннем детстве в развивающихся странах), так и в более поздние моменты времени (например в пубертатном возрасте). Как повторная иммунизация в раннем детстве, так и повторная иммунизация в пубертатном возрасте являются возможными вариантами для исследований эффективности и потенциальных показаний для бустерной ТВ вакцины. Иммуногенность и защитная эффективность первичной иммунизации BCG -повторной иммунизации MVA85A у макак-резусов В эксперименте по иммуногенности и контрольному заражению макак-резусов (6/группу) вакцинировали либо 1) только BCG, 2) BCG и затем через 9 недель подвергали повторной иммунизацииMVA85A, либо 3) физиологическим раствором (контрольная группа). Всех животных подвергали контрольному заражению интратекально через 18 недель после вакцинации BCG (или вакцинации физиологическим раствором для контрольной группы) и затем наблюдали за ними в течение 16 недель перед тем,как умертвить их. Результаты по иммуногенности показаны на фиг. 8. На фиг. 8 а показаны средние уровни IFN- после вакцинации (измеренные к 3 суткам теста по стимуляции лимфоцитов) во всех трех группах в пределах этого эксперимента по контрольному заражению. В то время как уровни IFN-y в ответ на PPD в группе BCG и в группе с первичной иммунизацией BCG повторной иммунизацией MVA85A кажутся сравнимыми, ответы на Ag85A являются явно более сильными в группе с первичной иммунизацией BCG - повторной иммунизацией MVA85A. Таким образом,имеет место значительное увеличение Ag85A-специфической секреции IFN- после вакцинацииMVA85A (группа 2), которое не заметно в группе, иммунизированной только BCG (группа 1) (фиг. 8 а). На фиг. 8 б показаны средние уровни IFN- после контрольного заражения (измеренные к 3 суткам- 15012436 теста по стимуляции лимфоцитов) во всех трех группах в пределах этого эксперимента по контрольному заражению. После контрольного заражения M.tb, группа BCG-MVA85A (группа 2) имела значительно более высокие Ag85A-специфические ответы, чем группа, иммунизированная только BCG (группа 1). Также и ответы ESAT6/CFP10 (рано секретируемый антигенный белок-мишень/белок 10 из культурального фильтрата), которые являются М.tb-специфическими иммунными ответами (амплитуда относится к бактериальной нагрузке), являются более слабыми в группах BCG и BCG-MVA85A по сравнению с группой, иммунизированной физиологическим раствором. Ответы на PPD сравнимы между этими двумя группами. Результаты в отношении ESAT6/CFP10 являются важными (самая нижняя панель), поскольку эти антигены являются ТВ-специфическими, и уровни иммунных ответов на эти антигены коррелируют с бактериальной нагрузкой (т.е. чем выше бактериальная нагрузка (группа, иммунизированная физиологическим раствором), тем сильнее иммунный ответ на ESAT6 и CFP10). Защитная эффективность вакцины определяется относительно более низким уровнем ответа ESAT6/CFP10 в группах BCG и BCGMVA85A по сравнению с группой, иммунизированной физиологическим раствором. При аутопсии, в группе BCG-MVA85A наблюдалась значительно меньшая патология, чем в группе,иммунизированной только BCG. Снижение бактериальной нагрузки в этих 2 группах составляло 0,97 для группы BCG-MVA85A и 0,42 для группы, иммунизированной только BCG. Макак-резус является хорошей моделью заболевания человека, и это многообещающее улучшение защитной эффективности, несмотря на небольшое количество животных, говорит о том, что у человека ожидаются похожие результаты в отношении эффективности. Данные по безопасности и иммуногенности из Фазы II испытаний на взрослых в Южной Африке Фаза II исследования безопасности и иммуногенности была начата в Western Саре, Южная Африка. Это испытание проводят на взрослых, и его объектом являются 24 субъекта. Субъекты, которые являются латентно инфицированными, исключены из этого испытания. К настоящему моменту было вакцинировано 12 субъектов. Все 12 субъектов имели значительные иммунные ответы, индуцированныеMVA85A, в первую неделю после их вакцинации в анализе ELISPOT. Профиль безопасности к настоящему моменту является таким же, как и профиль безопаслоти, наблюдавшийся в испытаниях в Великобритании и в Гамбии. Результаты испытаний в Великобритании показаны на фиг. 1 и фиг. 9 а, а результаты испытания в Гамбии показаны на фиг. 9 б. В целом, в Гамбии были вакцинированы 11 добровольцев, не подвергавшихся воздействию BCG, и 10 добровольцев, примированных BCG. Результаты по иммуногенности в группе, не подвергавшейся иммунизации BCG (фиг. 96), имели сходство с результатами по иммуногенности в группе, примированной BCG, в Великобритании (фиг. 1 б, в, г) в том, что она сохранялась на уровне, превышающем исходный, на протяжении периода последующего наблюдения. Вероятно, это отражает большую степень примирования микобактериями из окружающей среды в исходный момент времени, а также продолжающееся воздействие микробактерий из окружающей среды, которое поддерживает этот ответ. В Гамбии нет достоверного различия между группой, не подвергавшейся иммунизации BCG, и группой, примированной BCG, что, как и выше, объясняется более высоким уровнем примирования из окружающей среды в этой группе. В отличие от этого, в Великобритании результаты по иммуногенности в группе, не подвергавшейся иммунизации BCG, возвращались к исходному уровню на протяжении последующего наблюдения (фиг. 9 а и фиг. 1 б, в и г), тогда как иммуногенность в группе, примированнойBCG, оставалась выше исходного уровня на протяжении последующего наблюдения (фиг. 1 б, в и г). В литературе, касающейся BCG, существует много примеров широкой вариабельности защитной эффективности в разных странах и на разных континентах. Согласующийся профиль безопасности и иммуногенности MVA85A в Великобритании, Западной Африке и Восточной Африке является очень важным. Иммуногенность аденовируса, экспрессирующего антиген 85 А (Ag85A), у мышей Было показано, что рекомбинантный аденовирус (человеческий штамм 5, с делецией El и Е 2), экспрессирующий антиген 85 А (Ag85A), индуцирует сильные иммунные ответы у мышей при введении его одного (CD4 ответ около 800 пятен/миллион спленоцитов; CD8 ответ около 1200 пятен/миллион спленоцитов). При введении мышам, которые ранее получили BCG, этот аденовирус, экспрессирующий антиген 85 А (Ag85A), стимулирует еще более сильный ответ (CD4 ответ около 1400 пятен/миллион спленоцитов; CD8 ответ около 2500 пятен/миллион спленоцитов). Таким образом, удивительно, что этот аденовирусный вектор, как здесь показано, помимо очень сильного CD4 ответа, индуцирует очень сильныеCD8 Т-клеточные ответы, и их индукция одной и той же вакциной, по-видимому, полезна как в профилактике, так и в лечении микобактериального заболевания. Раньше аденовирусные векторы рассматривали как хорошие средства для индукции CD8 Т-клеточных ответов, но в данном описании авторы данного изобретения демонстрируют сильную индукцию как CD4, так и CD8 ответов. Эти данные свидетельствуют о том, что аденовирусные векторы могут быть мощным усилителем Т-клеточных ответов, примированных BCG. Данное изобретение было описано выше только с помощью примера. Понятно, что можно осуществить модификацию деталей без отклонения от объема изобретения.SEQ ID NO: 5. Последовательность вставки из 1176 нуклеотидов является следующей (экспрессируемая последовательность показана прописными буквами, кодирующая последовательность Ag85A подчеркнута): ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ индукции иммунного ответа центральных Т-клеток памяти против по меньшей мере одного антигена у пациента-человека, включающий стадию введения указанному пациенту иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации поксвирусный вектор,экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4 и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА. 2. Способ по п.1, где иммуногенная композиция представляет собой векторную вакцину. 3. Способ по п.1 или 2, где Т-клеточный иммунный ответ представляет собой CCR7+ ответ. 4. Способ по любому из пп.1-3, где нереплицирующийся поксвирусный вектор представляет собойMVA (модифицированный вирус осповакцины Анкара). 5. Способ по любому из пп.1-4, где поксвирусный вектор экспрессирует продукт трансляции SEQID NO:5. 6. Способ по любому из пп.1-5, где поксвирусный вектор дополнительно экспрессирует продукт трансляции по меньшей мере одного дополнительного гена(ов) антигена из микобактериального вида. 7. Способ по любому из пп.1-6, где иммуногенную композицию вводят по меньшей мере с одним дополнительным антигеном и/или противомикробным средством. 8. Способ по п.7, где по меньшей мере один дополнительный антиген и/или противомикробное средство вводят одновременно, раздельно или последовательно. 9. Способ по любому из пп.1-8, где ответ представляет собой антигенспецифический иммунный ответ. 10. Способ по любому из пп.1-9, где ответ является терапевтическим или профилактическим. 11. Способ по любому из пп.1-10, где Т-клеточный ответ является защитным против заболевания,выбранного из группы, состоящей из туберкулеза, лепры, инфекции, вызванной Mycobacterium avium,нетуберкулезной микобактериальной инфекции, язвы Бурули, инфекции или заболевания, вызванныхMycobacterium bovis, натуральной оспы, обезьяньей оспы, инфекции, вызванной Mycobacterium paratuberculosis, воспалительного заболевания кишечника, болезни Крона, аутоиммунного заболевания, рака и рака мочевого пузыря. 12. Способ по любому из пп.1-10, где пациент выбран из группы, состоящей из детей, пациентов,которые имеют ВИЧ-инфекцию или СПИД, имеют ослабленный иммунитет или были подвергнуты пересадке органов.- 18012436 13. Способ по любому из пп.1-10, где пациент ранее подвергался воздействию микобактерий. 14. Способ по п.13, где пациент ранее подвергался воздействию М. tuberculosis. 15. Способ по п.13 или 14, где пациент является латентно инфицированным микобактериями. 16. Способ по любому из пп.1-10, где пациента ранее подвергали воздействию BCG (бацилла Кальметта-Герена). 17. Применение иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4 и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА, в изготовлении лекарственного средства для лечения или предупреждения микобактериального заболевания у пациента путем индукции иммунного ответа центральных Т-клеток памяти у указанного пациента. 18. Применение по п.17, где Т-клеточный иммунный ответ представляет собой CCR7+ ответ. 19. Применение по п.17 или 18, где поксвирусный вектор дополнительно экспрессирует продукт трансляции по меньшей мере одного дополнительного гена антигена и где указанное лекарственное средство предназначено для лечения или предупреждения как микобактериального заболевания, так и по меньшей мере одного дополнительного заболевания у указанного пациента. 20. Применение по любому из пп.17-19, где иммуногенная композиция дополнительно индуцирует Т-клеточный иммунный ответ против вируса, из которого происходит поксвирусный вектор. 21. Применение иммуногенной композиции, содержащей нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4, и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА, в изготовлении лекарственного средства для лечения или предупреждения по меньшей мере одного заболевания у пациента путем индукции иммунного ответа центральных Т-клеток памяти, где указанное лекарственное средство вводят по меньшей мере с одним дополнительным антигеном. 22. Применение по п.21, где Т-клеточный иммунный ответ представляет собой CCR7+ ответ. 23. Векторная вакцина, содержащая нереплицирующийся или дефектный по репликации поксвирусный вектор, экспрессирующий продукт трансляции нуклеотидной последовательности SEQ ID NO: 4 и дополнительно включающий С-концевую РК метку и лидерную последовательность ТРА. 24. Векторная вакцина по п.23, где вирусный вектор экспрессирует продукт трансляции нуклеотидной последовательности SEQ ID NO: 5. 25. Векторная вакцина по п.23 или 24, где нереплицирующийся вирусный вектор представляет собой MVA. 26. Векторная вакцина по любому из пп.23-25, где вирусный вектор дополнительно экспрессирует продукт трансляции по меньшей мере одного дополнительного гена(ов) антигена из микобактериального вида.IFN ответ после вакцинации Средние уровни антигенспецифической секреции IFN в 3-х суточном тесте по стимуляции лимфоцитовIFN ответ после инфекции Средние уровни антигенспецифической секреции IFN- в 3-х суточном тесте по стимуляции лимфоцитов
МПК / Метки
МПК: A61K 39/04, C07K 14/35
Метки: микобактерий, иммунизации, против, композиции
Код ссылки
<a href="https://eas.patents.su/30-12436-kompozicii-dlya-immunizacii-protiv-mikobakterijj.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции для иммунизации против микобактерий</a>












