Стимуляция тимозином генетической иммунизации
Формула / Реферат
1. Способ иммунизации индивидуума, чувствительного к инфекции, которая вызывается вирусом гепатита С, против указанной инфекции, отличающийся тем, что индивидууму вводят полинуклеотид, который кодирует один или несколько пептидов вируса гепатита С, в сочетании с одним или несколькими a-тимозинами.
2. Способ по п.1, отличающийся тем, что полинуклеотид кодирует один или несколько протеинов оболочки вируса гепатита С.
3. Способ по п.1, отличающийся тем, что полинуклеотид кодирует один или несколько протеинов вируса гепатита С, выбранных из группы, включающей протеин NS3, протеин NS4A, протеин NS4B, протеин NS5A и протеин NS5B.
4. Способ по п.3, отличающийся тем, что полинуклеотид кодирует один или несколько протеинов NS5.
5. Способ по одному из пп.1-4, отличающийся тем, что a-тимозин представляет собой тимозин a1.
6. Способ по одному из пп.1-4, отличающийся тем, что тимозин вводят в дозе от 0,001 до 10 мг/кг веса тела/день.
7. Способ по п.6, отличающийся тем, что тимозин вводят в дозе примерно 0,02 мг/кг веса тела/день.
8. Применение полинуклеотида, кодирующего один или несколько пептидов вируса гепатита С, в сочетании с одним или более a-тимозинами для приготовления фармацевтической комбинации для иммунизации субъекта, восприимчивого к вирусу гепатита С, против этой инфекции.
9. Применение по п.8, где полинуклеотид кодирует один или несколько протеинов оболочки вируса гепатита С.
10. Применение по п.8, где полинуклеотид кодирует один или несколько протеинов вируса гепатита С, выбранных из группы, включающей протеин NS3, протеин NS4A, протеин NS4B, протеин NS5A и протеин NS5B.
11. Применение по п.10, где полинуклеотид кодирует один или несколько протеинов NS5.
12. Применение по одному из пп.8-11, где a-тимозин представляет собой тимозин a1.
13. Применение по одному из пп.8-11, где тимозин вводят в дозе от 0,001 до 10 мг/кг веса тела/день.
14. Применение по п.13, где тимозин вводят в дозе примерно 0,02 мг/кг веса тела /день.
15. Фармацевтическая комбинация, включающая полинуклеотид, который кодирует один или несколько пептидов вируса гепатита С, в сочетании с одним или несколькими a-тимозинами.
16. Фармацевтическая комбинация по п.15, отличающаяся тем, что полинуклеотид кодирует один или несколько протеинов оболочки вируса гепатита С.
17. Фармацевтическая комбинация по п.15, отличающаяся тем, что полинуклеотид кодирует один или несколько протеинов вируса гепатита С, выбранных из группы, включающей протеин NS3, протеин NS4A, протеин NS4B, протеин NS5A и протеин NS5B.
18. Фармацевтическая комбинация по п.17, отличающаяся тем, что полинуклеотид кодирует один или несколько протеинов NS5.
19. Фармацевтическая комбинация по одному из пп.15-18, отличающаяся тем, что a-тимозин представляет собой тимозин a1.
20. Фармацевтическая комбинация по одному из пп.15-18, отличающаяся тем, что тимозин вводят в дозе от 0,001 до 10 мг/кг веса тела/день.
21. Фармацевтическая комбинация по п.20, отличающаяся тем, что тимозин вводят в дозе примерно 0,02 мг/кг веса тела /день.
Текст
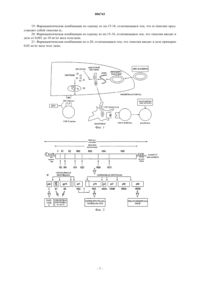
006743 Ссылка на родственные заявки По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент 60/330638, поданной 26 октября 2001 г. Предпосылки создания изобретения Хронический гепатит, который вызывается вирусом гепатита С (HCV), представляет собой очень серьезную медицинскую проблему и приводит к хроническому заболеванию печени, циррозу и печеночно-клеточному раку. Предполагается, что в большинстве случаев вирус гепатита С является возбудителем приобретенного после перфузии гепатита. Несмотря на улучшение качества депо донорской крови и проведение тестирования крови доноров, после перфузии все еще часто встречаются случаи острой инфекции у людей. Хронический гепатит развивается, по меньшей мере, у половины пациентов, страдающих острой формой гепатита, вызываемого HCV (примерно у 90% пациентов, страдающих гепатитом ни А, ни В (ВГНАНБ, а цирроз развивается по меньшей мере у 20% представителей этой группы. Для приостановления или замедления развития заболеваний, связанных с HCV, был изучен целый ряд лекарственных средств. Современное стандартное лечение предусматривает применение интерферона альфа и рибавирина. Однако значительное количество пациентов нечувствительны к такому лечению. Было установлено, что генетическая иммунизация стимулирует широкий спектр клеточных иммунных ответов на структурные и неструктурные протеины HCV. Однако с помощью нескольких моделей с использованием животных было установлено, что различные несущие HCV конструкции обладают невысокой биологической активностью (Tokushige и др. (1996. Генетическая иммунизация является новой альтернативой применению традиционных основанных на использовании антигенов вакцин, таких как вакцины, включающие ослабленный вирус или субъединицы протеинов. При генетической иммунизации для иммунизации реципиента применяют оголенную ДНК. ДНК называют оголенной потому, что она не содержит никакого носителя для введения возбудителя инфекции, который может облегчать проникновение в клетку, такого как вирусные частицы. Когда вводят оголенную ДНК, организм реципиента может экспрессировать кодируемые плазмидной ДНК протеины, которые затем могут стимулировать специфический иммунный ответ, в котором принимают участие цитотоксические Т-клетки, Т-клетки-хелперы и антитела. Применение вакцин на основе ДНК устраняет необходимость в очистке патогена или иммунозащитного антигена для вакцинации и устраняет возможность реверсии вирулентности, поскольку ДНК кодирует индивидуальный вирусный протеин. Применение для иммунизации полинуклеотидов имеет многочисленные преимущества. Например,иммунизацию клеток можно осуществлять с использованием любого антигена, кодируемого полинуклеотидом. Кроме того, колируемые полинуклеотидами антигены экспрессируются как чистые антигены в их нативном состоянии и подвержены обычным модификациям в клетке-хозяине. Полинуклеотиды также легко подвергать не дорогостоящим манипуляциям, и они стабильны в составе безводного продукта или в растворе в широком диапазоне температур. Таким образом, эта технология имеет большое значение для разработки высокоэффективных субъединичных вакцин. Вызванный гуморальный и/или клеточно-опосредованный (клеточный) иммунный ответ может обеспечивать защиту или защитный иммунитет против инфекции, вызываемой патогенными агентами,такими как бактерии, вирусы и эукариотические организмы (например, паразиты). Затем защитные гуморальные и/или клеточные иммунные ответы оказывают воздействие на инфективность или активность патогена или ограничивают его распространение или рост, что приводит к защите от последующего заражения патогеном. Иммунный ответ может также обеспечивать защиту от заболеваний или нарушений,которые связаны с клетками, продуцирующими специфические протеины. При оценке в опытах на различных животных установлено, что генетическая иммунизация посредством внутримышечной инъекции является эффективной в отношении многих вирусов (например, иммунизация морских свинок против инфекции, вызываемой вирусом герпеса простого (HSV) типа 2(Boume и др. (1996; иммунизация мышей против вируса гриппа (Fu и др. (1997; вакцинация цыплят против вирусов гриппа (Kodihalli и др. (1997; и млекопитающих и птиц против ротавирусов (Herrmann и др. U.S. 5620896. Daheshia с соавторами (1997) описали, что одна обработка роговицы животных, пораженной герпетическим стромальным кератитом, оголенной ДНК, кодирующей IL-1, приводила к уменьшению повреждений у животных, вызывая ремиссию повреждений. Обсуждение генетической иммунизации в целом и ее применение см., например, в US 5830876 (Weiner и др.). Было установлено, что представители класса полипептидов-иммуномодуляторов тимусного происхождения, т.е. тимозины, запускают процессы, связанные с созреванием лимфоцитов, стимулируют Тклеточную функцию и усиливают восстановление иммунных дефектов. Тимозин 1 (THN1) представляет собой состоящий из 28 аминокислот кислотный полипептид с молекулярной массой 3100, который обладает выраженной иммунологической активностью, такой как стимуляция производства - и интерферонов, повышение производства фактора, ингибирующего миграцию макрофагов, индукция экспрессии Т-клеточных маркеров, рецепторов IL-2 и повышение активности Т-клеток-хелперов. Выделение, характеристики и применение THN1 описаны, например, в US 4079127.-1 006743 Для лечения хронического гепатита, вызываемого HCV, в качестве монотерапии применяют различные антивирусные агенты, такие как ацикловир, видарабин и аденинарабинозид. Монотерапия с использованием указанных антивирусных агентов, как правило, является неэффективной либо из-за высокой токсичности агента, либо из-за того, что агент сначала вызывает некоторое ингибирование репликации вируса, но не может поддерживать ингибирование репликации вируса в течение длительного времени (см., например, Alexander и др. (1988. Таким образом, сохраняется необходимость в разработке лечения опосредуемых HCV заболеваний,которое сочетало бы эффективность в отношении вируса с меньшими побочными действиями, вызывало модуляцию ответов иммунной системы и приводило к снижению частоты рецидивов. Краткое изложение сущности изобретения В изобретении описано применение -тимозина для стимуляции CD4+ - и СD8+-клетками иммунных ответов на иммуногенные пептиды HCV, предпочтительно на протеин NS5 HCV. Стимуляция клеточных иммунных ответов на вирусные и клеточные протеины представляет собой трудную задачу. В изобретении описано применение in vivo -тимозина для резкого усиления цитотоксического и пролиферативного Т-клеточных ответов на эпитопы протеинов HCV. В предпочтительном варианте осуществления изобретения тимозин представляет собой тимозин 1. Сами по себе вакцины, основой которых является ДНК, представляют собой новую технологию и поэтому отличаются от ранее известных типов вакцинации (так, все вакцины, основой которых являются протеины, пептиды или убитые вирусы, вызывают гуморальный или опосредуемый антителом иммунитет, в то время как вакцины на основе ДНК обусловливают клеточный иммунитет), а тот факт, что -тимозин повышает эффективность вакцины, обеспечивает новое и неожиданное преимущество при применении вакцин на основе ДНК для лечения и профилактики связанных с HCV заболеваний. Краткое описание чертежей На фиг. 1 показано схематическое изображение механизма иммунизации с использованием вакцины на основе ДНК; на фиг. 2 - схематическое изображение генома вируса гепатита С (HCV); на фиг. 3 - воздействие совместного введения 5 мкг тимозина 1 (i.p.) и кодирующего NS5 полинуклеотида на Тклеточную пролиферацию при использовании трех концентраций для контрольного заражения (0,1, 0,5 и 1 мкг); на фиг. 4 - воздействие совместного введения 5 мкг тимозина 1 (i.p.) и кодирующего NS5 полинуклеотида на цитотоксическую реакцию при двух соотношениях лимфоцит-эффектор/мишень (L/T). Подробное описание изобретения В изобретении описано применение -тимозина в сочетании с основанной на использовании ДНК или генетической иммунизацией для резкого усиления клеточных иммунных ответов на HCV. Предпочтительным вариантом осуществления изобретения является стимуляция вакцин на основе ДНК с помощью тимозина 1 (тималфасин). Изобретение может найти широкое применение для разработки профилактических и терапевтических вакцин и для значительного усиления клеточных иммунных ответов на вирусные и клеточные протеины после основанной на применении ДНК иммунизации. Полинуклеотид, кодирующий иммуногенный пептид, полипептид или протеин HCV вводят непосредственно животному in vivo в сочетании с одним или несколькими -тимозинами. Полинуклеотид кодирует полипептид,несущий по меньшей мере один эпитоп иммуногенного протеина HCV, который является мишенью. Полинуклеотид экспрессируют с использованием клеток индивидуума для получения иммуногенных протеинов-мишеней, которые вызывают иммунный ответ широкого спектра против HCV. Геном HCV кодирует два протеина оболочки (Е 1 и Е 2) и шесть структурных протеинов (NS2, NS3, NS4A, NS4B, NS5A иNS5B) (фиг. 2). Согласно настоящему изобретению можно использовать полинуклеотиды, которые кодируют любой из этих вирусных протеинов или их комбинации или фрагменты. Под объем изобретения подпадают нативный (т.е. встречающийся в естественных условиях) -тимозин, а также синтетический-тимозин и рекомбинантный -тимозин, которые имеют аминокислотную последовательность нативных -тимозинов, аминокислотные последовательности, практически аналогичные ей, или полученные из нее укороченные последовательности и их биологически активные аналоги, имеющие последовательности, которые несут замены, делеции, удлинения, замещения или другие модификации, и активность которых практически аналогична активности нативного -тимозина. Предпочтительный тимозин представляет собой тимозин 1. Выделение, характеристики и применение -тимозина описаны, например, в US 4079127, US 4353821, US 4148788 и US 4116951. Количество -тимозина, необходимое для того, чтобы вызывать требуемую степень стимуляции действия вакцины на основе ДНК, можно определять с помощью стандартных экспериментов по типу доза-титрование. Было установлено, что -тимозин безопасен для людей при введении в дозах до 16 мг/кг веса тела/день. Предпочтительная доза -тимозина составляет от 0,001 до 10 мг/кг веса тела/день, причем наиболее предпочтительной является доза примерно 0,02 мг/кг веса тела/день. Полинуклеотидные последовательности, предлагаемые в изобретении, представляют собой последовательности ДНК или РНК, которые кодируют антигенные/иммуногенные полипептиды HCV, функ-2 006743 ционально связанные с регулирующими транскрипцию последовательностями. Эти последовательности можно применять в сочетании с другими полинуклеотидными последовательностями, которые кодируют регуляторные протеины, контролирующие экспрессию этих полипептидов. Регуляторный протеин может действовать путем связывания с геномной ДНК таким образом, чтобы регулировать ее транскрипцию; в другом варианте он может действовать путем связывания с матричной РНК, повышая или понижая ее стабильность или эффективность трансляции. Понятие функционально связаны с регулирующими транскрипцию и трансляцию последовательностями обозначает, что кодирующая полипептид последовательность и минимальные контролирующие транскрипцию и трансляцию последовательности связаны таким образом, чтобы обеспечивать экспрессию полипептида, когда соответствующие молекулы (например, протеины-активаторы транскрипции) связаны с регуляторной(ыми) последовательностью(ями). Полинуклеотид функционально кодирует полипептид, когда он несет всю генетическую информацию, необходимую для экспрессии в клеткемишени, такую как промоторы и т.п. Понятия промотор или промоторная последовательность в контексте настоящего описания относится к минимальной последовательности, достаточной для контроля транскрипции. Полинуклеотидная последовательность ДНК, как правило, ограничена сайтом инициации и сайтом терминации, т.е. представляет собой единицу транскрипции ДНК, и транскрибируется с образованием первичного транскрипта. Полинуклеотидный продукт, введенный в клетки in vivo, может иметь любое количество форм, и настоящее изобретение не ограничено каким-либо конкретным полинуклеотидом, кодирующим какойлибо конкретный полипептид HCV, хотя полинуклеотиды, кодирующие протеин NS5 или его фрагмент,являются предпочтительными. Плазмиды, содержащие гены, которые кодируют антигены или иммуногены HCV, описаны в литературе и специалисты в данной области легко могут их получать (см., например, Tokushige и др., 1996). Полинуклеотид может кодировать один или несколько антигенов, таких как антигены из двух или большего количества различных вирусных протеинов. В альтернативном варианте полинуклеотид может содержать две или большее количество различных последовательностей ДНК, при этом одна последовательность кодирует антиген, а другая(ие) кодирует(ют) полипептиды, которые могут обладать или могут не обладать антигенными свойствами. Например, вектор может кодировать два (или большее количество) антигена HCV. Согласно другому варианту осуществления изобретения другой(ие) полипептид(ы) может(гут) способствовать усилению иммунного ответа против HCV (например, эпитопы-хелперы, цитокины, полипептиды-носители, субъединицы холерного токсина или другие иммуностимуляторы). Полинуклеотид дополнительно может быть встроен в вектор, который несет последовательности для экспрессии полинуклеотида. Когда в одном векторе присутствуют две или большее количество кодирующих полипептиды последовательностей ДНК, то транскрипция каждой кодирующей антиген последовательности ДНК может находиться под контролем ее собственного промотора для экспрессии двух или большего количества не слитых полипептидов. В другом варианте один промотор может контролировать экспрессию двух или большего количества кодирующих антиген последовательностей ДНК,слитых в рамке считывания друг с другом, для экспрессии слитого протеина. Применяемые в этих методах полинуклеотиды могут представлять собой последовательности, не интегрированные в геном клеткихозяина. Они могут представлять собой нереплицирующиеся последовательности ДНК или специфические реплицирующиеся последовательности, сконструированные с помощью методов генной инженерии таким образом, чтобы у них отсутствовала способность к интеграции в геном. Полинуклеотид можно вводить пациенту в присутствии адъювантов или других субстанций, которые могут повышать способность нуклеиновой кислоты к проникновению или повышать рекрутмент клеток иммунной системы в области инокуляции. Следует отметить, что сам полинуклеотид экспрессируется в клетке-хозяине с помощью факторов транскрипции, присущими клетке-хозяину или единице транскрипции ДНК. Согласно способам, предлагаемым в изобретении, в клетки для получения в них продукта трансляции в виде полипептида можно вводить как экспрессируемую ДНК, так и мРНК. Если нуклеиновые кислоты содержат соответствующие контролирующие последовательности, то они должны обеспечивать синтез относительно больших количеств кодируемого протеина. Дозу иммуногенного полипептида легко может определить практикующий врач или ветеринар с использованием в качестве моделей животных или других систем для тестирования, которые хорошо известны в данной области. Композиции должны содержать эффективное количество ДНК в водном растворе. Подлежащее введению количество ДНК зависит от таких факторов, как возраст, вес и физиологическое состояние индивидуума, подлежащего вакцинации. Количество ДНК зависит также от способности иммунной системы индивидуума синтезировать антитела и от уровня требуемой защиты. Эффективные дозы может легко определить специалист в данной области с помощью обычных опытов, необходимых для построения графиков зависимости ответа от дозы. Предпочтительная доза составляет от 1 мкг/кг веса тела до 1 мг/кг веса тела индивидуума. Индивидуума можно иммунизировать путем однократного введения ДНК или с помощью нескольких введений. Несколько введений может потребоваться для поддержания состояния иммунитета индивидуума к конкретному патогену. Композиции гетерологичных полинуклеотидов и метод их конструирования для успешной транс-3 006743 формации хорошо известны специалисту в данной области, и такие композиции и методы можно применять для получения полинуклеотидов, предлагаемых в изобретении. Конкретная композиция полинуклеотидов не имеет решающего значения для настоящего изобретения, и изобретение не зависит от композиции конкретных применяемых для трансформации полинуклеотидов. Приемлемые компоненты полинуклеотида, такие как промоторы, последовательности для полиаденилирования, сигналы терминации,сигналы сплайсинга, селектируемые маркеры, репортерные гены, энхансеры, вирусные репликоны, интроны и бактериальные плазмидные последовательности, хорошо известны в данной области. У Sambrook с соавторами (1989) описаны приемлемые методы конструирования гетерологичных полинуклеотидов. Полинуклеотиды можно получать с помощью целого ряда известных методов. Например, ДНК, кодирующую предварительно отобранный антиген, можно встраивать в экспрессионный вектор (см., например, Sambrook и др. (1989. При наличии оборудования для автоматического синтеза нуклеиновых кислот ДНК можно синтезировать непосредственно, если нуклеотидная последовательность является известной, или с помощью сочетания методов ПЦР, клонирования и ферментации. Кроме того, если последовательность предварительно отобранного полипептида является известной, то можно предсказать приемлемую кодирующую последовательность полинуклеотида. Когда полинуклеотид представляет собой мРНК, то ее легко можно получать in vitro из соответствующей ДНК. Например, согласно общепринятым методикам фаговые РНК-полимеразы SP6, Т 3 или Т 7 применяют для получения мРНК на ДНК-матрице в присутствии индивидуальных рибонуклеозидтрифосфатов. Соответствующий промотор фага, такой как сайт инициации репликации фага Т 7, помещают в ДНК-матрице непосредственно против хода транскрипции подлежащего транскрибированию гена. Системы, основанные на таком применении фага Т 7, хорошо известны и описаны в литературе. Еще одним объектом изобретения является иммунологическая композиция, которая после ее интродукции в организм индивидуума, который обладает способностью или должен индуцировать иммунный ответ, индуцирует иммунный ответ у такого индивидуума на кодируемый этой композицией протеин HCV, причем композиция содержит полинуклеотид, который кодирует и экспрессирует один или несколько антигенов/иммуногенов HCV, в сочетании с одним или несколькими -тимозинами. Иммунный ответ можно применять в терапевтических или профилактических целях и можно применять для формирования связанного с антителами иммунитета или клеточного иммунитета, обусловленного, например,ЦТЛ (цитотоксическими Т-лимфоциты) или CD4+-Т-клетками. Пример 1. Конструирование плазмид. В качестве источника вирусных генов плазмиду, обозначенную как pBRTM/HCV1-3011, несущую полноразмерную открытую рамку считывания (ОРС) HCV, применяли для клонирования в экспрессионных векторах (Grakoui и др., 1993). Конструкцию pAp031-Ns5 клонировали с помощью ПЦР после встраивания созданных стартового и стоп-кодонов, а также сайтов, распознаваемых рестриктазами, с использованием следующих праймеров для NS5: 5'-Т CAG TCT AGA ATG ТСС GGC ТСС TGG СТА[SEQ ID No. 2]. После ПЦР-амплификации с использованием обеспечивающей высокую точность ПЦРсистемы (фирма Boehringer Mannheim, Индианаполис, шт. Индиана), фрагменты кДНК встраивали в плазмидный экспрессионный вектор рАр 031, содержащий энхансерный элемент вируса саркомы Рауса и промотор CMV. Конструкциями трансформировали клетки линии DH5 и плазмидную ДНК затем очищали либо двукратным центрифугированием в хлориде цезия, либо с помощью набора Qiagen Giga с использованием буферной системы Эндофри (Endofree) (Санта Клара, шт. Калифорния). Правильность инсерции кДНК, кодирующих неструктурные протеины, подтверждали секвенированием с использованием стандартных методов. Для создания линий клеток, стабильно экспрессирующих NS5, которые использовали в качестве клеток-мишеней для анализов ЦТЛ, генные фрагменты, кодирующие неструктурные протеины, клонировали также в экспрессионных векторах pcDNA3 и pcDNA3.1/Zeo(-) (фирма Invitrogen,Сан-Диего, шт. Калифорния) с использованием неомицина в качестве селектируемого маркера. ХbaI- иMluI-фрагмент NS5 субклонировали в сайте NheI/MluI вектора Litmus-38 (фирма New England Biolabs,Беверли, шт. Массачусетс), расщепляли с помощью EcoRI и SalI и встраивали путем лигирования в множественный сайт клонирования векторов EcoRI/XhoI pcDNA3 и pcDNA3,I/Zeo(-) соответственно. HbaI- и ВатHI-фрагмент, содержащий NS4, встраивали путем лигирования в вектор Litmus-29 (фирма New England Biolabs), повторно расщепляли с помощью KpnI и EcoRI, и затем встраивали путем лигирования в вектор рс DNA3. Плазмиды были обозначены как pcDNA3.1/Zeo(-)-NS5. Экспрессирующую ДНК плазмиду, кодирующую мышиный IL-2 (pcD/3-Il2), клонировали и очищали с помощью описанных ранее методов (Geissler и др., 1997 а, 1997 б, 1997 в). Генетическая иммунизация. Для повышения проникновения в клетку плазмидной ДНК в несколько областей на четырехглавой мышце мышей линии Balb/c инъецировали всего 100 мкл 0,25% гупивакаина (hupivacaine). Через 4 дня плазмидные конструкции инъецировали в эту же область в 5 различных мест в конечном объеме 100 мкл 0,9% NaCl. Через 2 недели мышей подвергали бустер-инъекции, вводя в противоположную ногу плаз-4 006743 мидную ДНК. Через 10 дней после последней иммунизации мышей умерщвляли. Для опыта использовали три группы мышей по 5 особей в каждой. Группа 1 - мыши, которых иммунизировали 100 мкг ДНКимитатора; группа 2 - мыши, которых иммунизировали 50 мкг pAp031NS5 и 50 мкг ДНК-имитатора; группа 3 - мыши, которых иммунизировали 50 мкг рАр 031 NS5 и 50 мкг ДНК-имитатора и которым вводили 5 мкг тимозина 1 (i.p.) дважды в неделю. Животных иммунизировали три раза через 2 недели и исследования проводили через 10 дней после последней иммунизации. Анализ Т-клеточной пролиферации. Мышей анестезировали изофлураном (фирма Aerrane, Анаквест, шт. Нью-Джерси), брали кровь с помощью ретробульбарной пункции и собирали клетки селезенки. Эритроциты удаляли инкубацией в 8,3% NH4Cl/0,17 моля/л Трис (рН 7,4) в течение 10 мин при 37 С. Клетки селезенки культивировали в трех повторностях с использованием 96-луночных плоскодонных планшетов с плотностью 5x105 клеток на лунку в 100 мкл полной среды (модифицированной по способу Дульбекко среды Игла, фирма Mediatech, Вашингтон, федеральный округ Колумбия), содержащей 10% ФТС. Клетки селезенки стимулировали рекомбинантным NS5 в различных концентрациях (1; 5; 10 мкг/мл). И, наконец, добавляли 2 меркаптоэтанол до конечной концентрации 50 мкмолей/л. В качестве контроля антигенной специфичности эффекторные клетки стимулировали 10 мкг/мл рекомбинантной -субъединицы человеческого хорионического гонадотропина, который секретируется из клетки и, как было установлено, является сильным Т-клеточным иммуногеном (Geissler, и др., 1997 г). Клетки селезенки стимулировали в течение 3 дней. После добавления [3 Н]-тимидина (1 мкКи /лунку) клетки инкубировали в течение 18 ч. Включение[3 Н]-тимидина в ДНК оценивали после сбора (фиг. 3). Включение радиоактивности корректировали с учетом фоновой активности ( срm (число импульсов в мин. Анализ цитотоксичности. Клетки селезенки из организма иммунизированных мышей суспендировали в полной среде DMEM,содержащей 10% ФТС и 50 мкмолей/л 2-меркаптоэтанола; затем через 5 дней после стимуляции in vitro клетки анализировали в отношении цитотоксической активности. Добавляли рекомбинантный мышиныйIL-2 в виде одной порции в концентрации 5 ед./мл и клетки-респондеры (4x107 ) совместно культивировали с 6,25 х 106 сингенных клеток, стабильно экспрессирующих NS5 после обработки 20000 рад. Популяции цитотоксических эффекторных лимфоцитов собирали после 5-дневной инкубации. В течение 4 ч в 96-луночных круглодонных планшетах осуществляли анализ высвобождения 51 Сr, используя в качестве клеток-мишеней меченную с помощью 51 Сr линию SP2-NS. ЦТЛ-анализы осуществляли при соотношениях лимфоцитов-эффекторов:клеток-мишеней (L/T) 1:10 и 1:100. Цитотоксичность (в процентах) оценивали следующим образом: Высвобождение в эксперименте - спонтанное высвобождение Максимальное высвобождение - спонтанное высвобождение Высвобождение в эксперименте обозначает среднее количество импульсов в минуту, которые высвобождаются клетками-мишенями в присутствии клеток-эффекторов. Общее высвобождение обозначает радиоактивность, которая высвобождается после общего лизиса клеток-мишеней 5% TritonX-100 (фиг. 4). Спонтанное высвобождение обозначает присутствующую в среде радиоактивность, полученную только из клеток-мишеней. Статистический анализ. Для сравнения результатов, полученных для различных групп, применяли непараметрический Uкритерий Манна-Уитни. Значение Р 0,05 рассматривали как статистически значимое. Значения Р дляCD4+- и CD8+- Т-клеточных ответов выводили из результатов, полученных при использовании всех концентраций рекомбинантного NS5, которые применяли для стимуляции, и соотношений L:T соответственно. Результаты, представленные на фиг. 3 и 4, демонстрируют очень резкое усиление иммунного ответа, которое можно достигать при введении -тимозина одновременно с иммунизацией вакциной на основе ДНК. Одновременное введение -тимозина увеличивало пролиферацию СD4-клеток примерно на 100% по сравнению с результатами, полученными при использовании трех концентраций, применяемых для контрольного заражения (фиг. 3). При одновременном введении -тимозина процент цитотоксичности также увеличивался на 100% или более (фиг. 4). СсылкиTokushige и др. Expression and immune response to hepatitis С virus core DNA-based vaccine, Hepatology 24, 1996, cc. 14-20. Патент US4079127 (на имя Goldstein и др.). Патент US4116951 (на имя Wang). Патент US4148788 (на имя Wang). Патент US4353821 (на имя Birr и др.). Патент US5620896 (на имя Herrmann и др.). Патент US5830876 (на имя Weiner и др.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ иммунизации индивидуума, чувствительного к инфекции, которая вызывается вирусом гепатита С, против указанной инфекции, отличающийся тем, что индивидууму вводят полинуклеотид,который кодирует один или несколько пептидов вируса гепатита С, в сочетании с одним или несколькими -тимозинами. 2. Способ по п.1, отличающийся тем, что полинуклеотид кодирует один или несколько протеинов оболочки вируса гепатита С. 3. Способ по п.1, отличающийся тем, что полинуклеотид кодирует один или несколько протеинов вируса гепатита С, выбранных из группы, включающей протеин NS3, протеин NS4A, протеин NS4B,протеин NS5A и протеин NS5B. 4. Способ по п.3, отличающийся тем, что полинуклеотид кодирует один или несколько протеиновNS5. 5. Способ по одному из пп.1-4, отличающийся тем, что -тимозин представляет собой тимозин 1. 6. Способ по одному из пп.1-4, отличающийся тем, что тимозин вводят в дозе от 0,001 до 10 мг/кг веса тела/день. 7. Способ по п.6, отличающийся тем, что тимозин вводят в дозе примерно 0,02 мг/кг веса тела/день. 8. Применение полинуклеотида, кодирующего один или несколько пептидов вируса гепатита С, в сочетании с одним или более -тимозинами для приготовления фармацевтической комбинации для иммунизации субъекта, восприимчивого к вирусу гепатита С, против этой инфекции. 9. Применение по п.8, где полинуклеотид кодирует один или несколько протеинов оболочки вируса гепатита С. 10. Применение по п.8, где полинуклеотид кодирует один или несколько протеинов вируса гепатита С, выбранных из группы, включающей протеин NS3, протеин NS4A, протеин NS4B, протеин NS5A и протеин NS5B. 11. Применение по п.10, где полинуклеотид кодирует один или несколько протеинов NS5. 12. Применение по одному из пп.8-11, где -тимозин представляет собой тимозин 1. 13. Применение по одному из пп.8-11, где тимозин вводят в дозе от 0,001 до 10 мг/кг веса тела/день. 14. Применение по п.13, где тимозин вводят в дозе примерно 0,02 мг/кг веса тела /день. 15. Фармацевтическая комбинация, включающая полинуклеотид, который кодирует один или несколько пептидов вируса гепатита С, в сочетании с одним или несколькими -тимозинами. 16. Фармацевтическая комбинация по п.15, отличающаяся тем, что полинуклеотид кодирует один или несколько протеинов оболочки вируса гепатита С. 17. Фармацевтическая комбинация по п.15, отличающаяся тем, что полинуклеотид кодирует один или несколько протеинов вируса гепатита С, выбранных из группы, включающей протеин NS3, протеинNS4A, протеин NS4B, протеин NS5A и протеин NS5B. 18. Фармацевтическая комбинация по п.17, отличающаяся тем, что полинуклеотид кодирует один или несколько протеинов NS5.-6 006743 19. Фармацевтическая комбинация по одному из пп.15-18, отличающаяся тем, что -тимозин представляет собой тимозин 1. 20. Фармацевтическая комбинация по одному из пп.15-18, отличающаяся тем, что тимозин вводят в дозе от 0,001 до 10 мг/кг веса тела/день. 21. Фармацевтическая комбинация по п.20, отличающаяся тем, что тимозин вводят в дозе примерно 0,02 мг/кг веса тела /день.
МПК / Метки
МПК: A61K 38/16, A61K 45/00, A61K 39/29
Метки: тимозином, иммунизации, генетической, стимуляция
Код ссылки
<a href="https://eas.patents.su/9-6743-stimulyaciya-timozinom-geneticheskojj-immunizacii.html" rel="bookmark" title="База патентов Евразийского Союза">Стимуляция тимозином генетической иммунизации</a>
Предыдущий патент: Композиции для ингаляции, содержащие трициклические 5,6-дигидро-9н-пиразоло (3,4-с)-1,2,4-триазоло (4,3-α) пиридины
Следующий патент: Применение ингибиторов il-18 для лечения и предотвращения повреждений цнс
Случайный патент: Окисленный авидин с большим временем удержания в обработанной им ткани