Pyy – агонисты и их применение
Номер патента: 11882
Опубликовано: 30.06.2009
Авторы: Финн Рори Фрэнсис, Саммерз Нина Линн, Сигель Нед Роджер, Нардон Нэнси Энн
Формула / Реферат
1. Полипептид (Е10С)hPYY3-36, имеющий аминокислотную последовательность
![]()
или его фармацевтически приемлемая соль.
2. Полипептид (D11C)hPYY3-36, имеющий аминокислотную последовательность
![]()
или его фармацевтически приемлемая соль.
3. Конъюгат, содержащий полиэтиленгликоль (ПЭГ) и полипептид (E10C)hPYY3-36 или (D11C)hPYY3-36.
4. Конъюгат по п.3, имеющий формулу 3
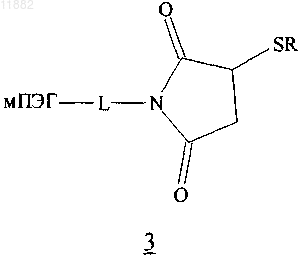
где ПЭГ представляет собой метокси-ПЭГ (мПЭГ) и является линейным или разветвленным и имеет среднюю молекулярную массу в диапазоне от приблизительно 1 до 50 кДа,
L представляет собой группу формулы
![]()
в которой каждый p и r независимо равен целому числу от 1 до 6,
или L представляет собой группу формулы
![]()
в которой s равен целому числу от 1 до 6 и
-SR представляет собой полипептид (Е10С)hPYY3-36 или (D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина.
5. Конъюгат по п.4, где мПЭГ является линейным.
6. Конъюгат по п.5, имеющий формулу 4
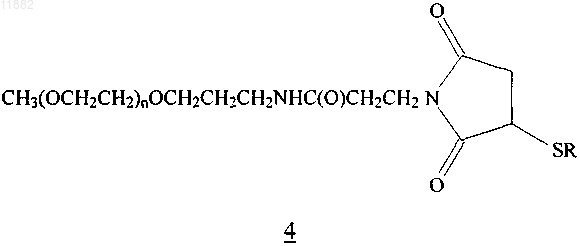
где n равен целому числу в диапазоне от приблизительно 600 до 750 и -SR представляет собой полипептид (Е10С)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина.
7. Конъюгат по п.6, где группировка (ОСН2СН2)n имеет среднюю молекулярную массу приблизительно 30 кДа.
8. Конъюгат по п.5, имеющий формулу 4
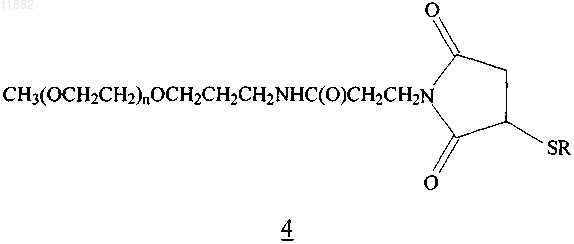
где n равен целому числу в диапазоне от приблизительно 375 до 525 и -SR представляет собой полипептид (Е10С)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина.
9. Конъюгат по п.8, где группировка (ОСН2СН2)n имеет среднюю молекулярную массу приблизительно 20 кДа.
10. Конъюгат по п.5, имеющий формулу 4

где n равен целому числу в диапазоне от приблизительно 600 до 750 и -SR представляет собой полипептид (D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина.
11. Конъюгат по п.10, где группировка (OCH2CH2)n имеет среднюю молекулярную массу приблизительно 30 кДа.
12. Конъюгат по п.4, где мПЭГ является разветвленным.
13. Конъюгат по п.12, где мПЭГ является глицерин-разветвленным.
14. Конъюгат по п.13, имеющий формулу 5
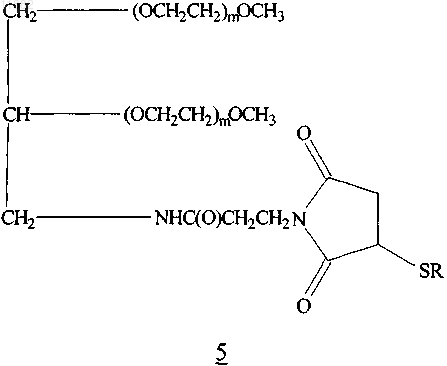
где каждый m является приблизительно одинаковым и равен целому числу в диапазоне от приблизительно 450 до 500 и -SR представляет собой полипептид (E10C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина.
15. Конъюгат по п.14, где каждая группировка (ОСН2СН2)m имеет среднюю молекулярную массу в диапазоне от приблизительно 20 до 22 кДа.
16. Конъюгат по п.13, имеющий формулу 5

где каждый m является одинаковым и равен целому числу в диапазоне от приблизительно 450 до 500 и
-SR представляет собой полипептид (D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина.
17. Конъюгат по п.16, где каждая группировка (ОСН2СН2)m имеет среднюю молекулярную массу в диапазоне от приблизительно 20 до 22 кДа.
18. Глицерин-разветвленный конъюгат 43K мПЭГ-малеимид-(E10C)hPYY3-36, имеющий формулу 5
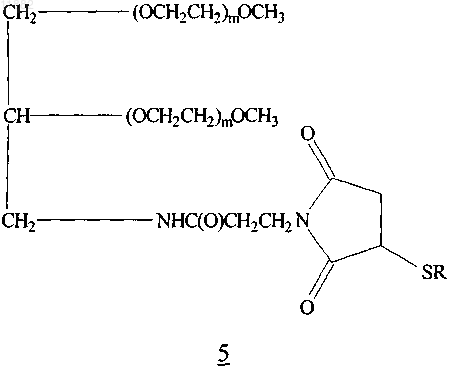
где каждый m является приблизительно одинаковым и -SR представляет собой полипептид (E10C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина, или его фармацевтически приемлемая соль.
19. Глицерин-разветвленный конъюгат 43K мПЭГ-малеимид-(D11C)hPYY3-36 формулы 5
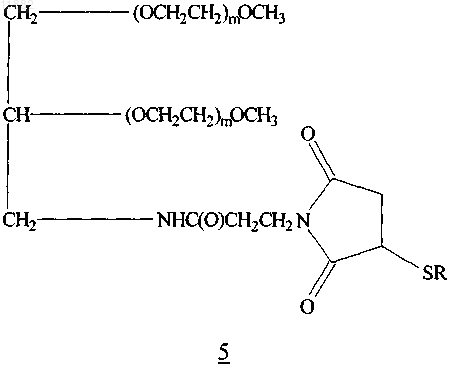
где каждый m является приблизительно одинаковым и -SR представляет собой полипептид (D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина, или его фармацевтически приемлемая соль.
20. Фармацевтическая композиция, содержащая полипептид по п.1 или 2 или конъюгат по любому из пп.3-19 либо их фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
21. Фармацевтическая композиция по п.20, дополнительно содержащая второй агент, представляющий собой средство против ожирения.
22. Способ лечения ожирения или состояния избыточного веса у млекопитающего, нуждающегося в таком лечении, включающий периферическое введение млекопитающему терапевтически эффективного количества полипептида по п.1 или 2 или конъюгата по любому из пп.3-19 либо их фармацевтически приемлемой соли.
23. Способ замедления прироста массы, уменьшения потребления пищи или уменьшения потребления калорий у млекопитающего, включающий периферическое введение млекопитающему терапевтически эффективного количества полипептида по п.1 или 2 или конъюгата по любому из пп.3-19 либо их фармацевтически приемлемой соли.
24. Способ по п.22 или 23, при котором полипептид, конъюгат или соль вводят в комбинации со вторым агентом, представляющим собой средство против ожирения.
25. Применение полипептида по п.1 или 2 или конъюгата по любому из пп.3-19 либо их фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения ожирения или состояния избыточного веса у млекопитающих или для замедления прироста массы, уменьшения потребления пищи или уменьшения потребления калорий у млекопитающего.
26. Полинуклеотид, кодирующий полипептид по п.1 или 2.
27. Моноклональное антитело, специфически связывающееся с полипептидом, содержащим аминокислотную последовательность, как она показана на SEQ ID NO: 3 или SEQ ID NO: 4.
28. Моноклональное антитело по п.27, где указанный полипептид пэгилирован по остатку цистеина.
Текст
011882 Область изобретения Настоящее изобретение относится к PYY-агонистам, более конкретно к вариантам PYY3-36 и к пэгилированным производным PYY3-36 и вариантов PYY3-36, к композициям, содержащим такие агонисты,выделенным нуклеиновым кислотам, кодирующим такие PYY-агонисты, и к применению таких агонистов или композиций в лечении ожирения и сопутствующих заболеваний или для снижения аппетита,потребления пищи или потребления калорий у млекопитающего. Предшествующий уровень техники Ожирение вызывает большую озабоченность здравоохранения из-за его широкой распространенности и связанным с ним риском для здоровья. Более того, ожирение может влиять на качество жизни субъекта ввиду ограничения подвижности и снижения физической выносливости, а также в результате общественной, академической и связанной с работой дискриминации. Как правило, ожирение и избыточный вес определяют по индексу массы тела (BMI), который коррелирует с общей тучностью организма и служит в качестве меры риска возникновения некоторых заболеваний. BMI рассчитывают как массу в килограммах, деленную на рост в метрах в квадрате (кг/м 2). Избыточный вес обычно определяют, когда BMI составляет 25-29,9 кг/м 2, а ожирение обычно определяют,когда BMI составляет 30 кг/м 2 или выше. См., например, National Heart, Lung, and Blood Institute, ClinicalGuidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults (Национальный институт сердца, легких и крови, Клиническое руководство по идентификации, оценке и лечению избыточного веса и ожирения у взрослых), The Evidence Report, Washington, DC: U.S. Department ofHealth and Human Services, NIH publication no. 98-4083 (1998). Недавними исследованиями обнаружено, что ожирение и связанный с ним риск для здоровья не ограничивается взрослыми, но также в пугающей степени оказывает воздействие на детей и подростков. Согласно данным Центра по контролю заболеваемости (США) (Center for Disease Control) процент детей и подростков, которым поставлен диагноз избыточный вес, увеличился более чем в два раза с начала 1970-х гг. и приблизительно 15% детей и подростков в настоящее время имеют избыточный вес. Возрастает частота факторов риска для болезни сердца, таких как высокий уровень холестерина и высокое кровяное давление, у детей и подростков с избыточным весом по сравнению с субъектами подобного возраста, имеющими нормальный вес. Кроме того, у детей и подростков драматически возросло число случаев диабета 2 типа, ранее считавшегося болезнью взрослых. Состояния избыточного веса и ожирение тесно связаны с диабетом 2 типа. Недавно было установлено, что для подростков с избыточным весом шанс стать взрослыми людьми с избыточным весом или тучными людьми составляет 70%. Такая вероятность увеличивается приблизительно до 80%, если по меньшей мере один из родителей имеет избыточный вес или является тучным. Самым прямым последствием избыточного веса, которое ощущается самими детьми, является дискриминация в обществе. Люди с избыточным весом или тучные люди имеют повышенный риск таких болезненных состояний, как гипертензия, дислипидемия, диабет 2 типа (инсулинонезависимый), резистентность к инсулину,нетолерантность к глюкозе, гиперинсулинемия, ишемическая болезнь сердца, стенокардия, застойная сердечная недостаточность, инсульт, желчные конкременты, холецистит, желчнокаменная болезнь, подагра, остеоартрит, обструктивные приступы апноэ во сне и проблемы с дыханием, заболевание желчного пузыря, некоторые формы рака (например рака эндометрия, молочной железы, предстательной железы и толстой кишки) и психологические расстройства (такие как депрессия, расстройства приема пищи, деформированное представление о фигуре и низкая самооценка). Негативные в отношении здоровья последствия ожирения делают его второй лидирующей причиной предотвратимой смерти в Соединенных Штатах и оказывают значительное экономическое и психосоциальное воздействие на общество. См.McGinnis M, Foege WH., "Actual Causes of Death in the United States," JAMA, 270, 2207-12, 1993. В настоящее время ожирение признано хроническим заболеванием, которое требует лечения с целью снижения связанного с ним риска для здоровья. Несмотря на то, что уменьшение массы представляет собой важный результат лечения, одна из главных задач лечения ожирения заключается в улучшении сердечно-сосудистых и метаболических показателей с целью снижения связанных с ожирением заболеваемости и смертности. Было показано, что уменьшение массы тела на 5-10% может значительно улучшить метаболические показатели, такие как содержание глюкозы в крови, кровяное давление и концентрация липидов. Поэтому считается, что уменьшение массы тела на 5-10% может понизить заболеваемость и смертность. Доступные в настоящее время отпускаемые по рецепту лекарственные средства для лечения ожирения, как правило, снижают массу путем уменьшения всасывания пищевых жиров, как при применении орлистата, или путем создания дефицита энергии в результате уменьшения потребления пищи и/или в результате увеличения расхода энергии, что наблюдается в случае с сибутрамином. Поиск альтернатив доступным в настоящее время средствам против ожирения проведен несколькими путями, один из которых сфокусирован на некоторых пептидах кишечника, которые вовлечены в модулирование насыщения,как например пептид YY (PYY).PYY является членом семейства панкреатических полипептидных (РР) гормонов (вместе с РР и нейропептидом Y (NPY. Как и другие члены этого семейства, PYY представляет собой амидированный-1 011882 по С-концу, состоящий из 36 аминокислот пептид. Он является эндокринным пептидом кишечника, первоначально выделенным из кишечника свиньи (Tatemoto and Mutt, Nature 285: 417-418, 1980), и впоследствии было показано, что он уменьшает потребление пищи с повышенным содержанием жира после периферического введения у крыс (Okada et al., Endocrinology Supplement 180, 1993) и вызывает уменьшение массы у мышей после периферического введения (Morley and Flood, Life Sciences 41:2157-2165,1987). Известно о существовании множественных депонированных и циркулирующих в крови молекулярных форм PYY (Chen et al., Gastroenterology 87: 1332-1338, 1984; и Roddy, et al., Regul. Pept. 18: 201212, 1987). Одна из таких форм, PYY3-36, была выделена из экстрактов слизистой оболочки ободочной кишки человека (Eberlein et al., Peptides 10: 797-803, 1989), и было обнаружено, что она является преобладающей формой PYY в плазме крови человека после приема пищи (Grandt et al., Regul. Pept. 51: 151159, 1994). Сообщалось, что PYY3-36 является высоко аффинным селективным агонистом Y2-рецептора(Y2R) NPY (Keire et al., Am. J. Physiol. Gasrointest. Liver Physiol. 279: G126-G131, 2000). Сообщалось, что периферическое введение PYY3-36 значительно уменьшало потребление пищи и прирост массы у крыс,снижало аппетит и потребление пищи у людей и уменьшало потребление пищи у мышей, но не у лишенных Y2R мышей, что являлось подтверждением того, что для воздействия на потребление пищи требуется Y2R. В исследованиях на людях обнаружено, что инфузия PYY3-36 значительно снижает аппетит и уменьшает потребление пищи на 33% в течение 24 ч. Иифузия PYY3-36 для достижения нормальных, возникающих после приема пищи, концентраций пептида в циркулирующей крови приводила к достижению максимальных уровней PYY3-36 в сыворотке крови через 15 мин с последующим быстрым падением до базальных уровней в течение 30 мин. Сообщалось о существенном ингибировании потребления пищи в течение 12-часового периода после инфузии PYY3-36, но не было по существу никакого влияния на потребление пищи в течение периода времени от 12 до 24 ч. В исследовании на крысах повторное внутрибрюшинное (IP) введение PYY3-36 (инъекции дважды в сутки в течение 7 суток) уменьшало кумулятивное потребление пищи (Batterham, et al., Nature 418: 650-654, 2002). Лекарственные средства на основе полипептидов зачастую ковалентно присоединяют к таким полимерам, как полиэтиленгликоли (ПЭГ), для пролонгирования периода их полувыведения in vivo. Однако это зачастую приводит к значительной потере биологической или фармакологической активностиSyst. 9: 249-304, 1992; Fung et al., Polym. Preprints 38: 565-566, 1997; Reddy, Ann. Pharmacother. 34: 915923, 2000; Veronese, Biomaterials 22: 405-417, 2001). Например, Shechter и др., выше, сообщали, что присоединение полиэтиленгликоля 40 кДа к PYY3-36 методами обычной химии через образование стабильной связи (40 кДа ПЭГ-PYY3-36) приводило к его полной инактивации в исследованиях по потреблению пищи на мышах (подкожная (SC) инъекция). Тем не менее, они также сообщали, что обратимое присоединение полиэтиленгликоля к PYY3-36 (40 кДа ПЭГ-FMS-PYY3-36) приводило к восьмикратному увеличению в значении функционального периода полувыведения (24 ч против 3 ч). См. также заявки на патент РСТWO 2004/089279 и WO 03/026591. Краткое изложение сущности изобретения Настоящее изобретение относится к PYY-агонистам, представляющим собой варианты PYY3-36. В одном аспекте настоящего изобретения PYY-агонист представляет собой вариант PYY3-36 млекопитающих, в котором остаток 10 (глутаминовая кислота) или остаток 11 (аспарагиновая кислота) заменен аминокислотой X, выбранной из группы, состоящей из цистеина, лизина, серина, треонина, тирозина и неприродных аминокислот, имеющих функциональную группу, способную к образованию конъюгатов с гидрофильным полимером, таким как полиэтиленгликоль (ПЭГ), например функциональную группу кето, тиол, гидроксил, карбоксил или свободную аминогруппу, при этом такой вариант обозначают как(E10X)PYY3-36 или (D11X)PYY3-36, соответственно. Остатком X предпочтительно является цистеин, а соответствующими вариантами, следовательно,(E10C)PYY3-36 и (D11C)PYY3-36. В предпочтительном воплощении настоящего изобретения PYY-агонист представляет собой вариант PYY3-36 человека (hPYY3-36), PYY3-36 собаки, PYY3-36 кошки или PYY3-36 лошади, более предпочтительно hPYY3-36. В предпочтительном воплощении изобретения PYY-агонист представляет собой полипептид(E10C)hPYY3-36, имеющий аминокислотную последовательность или его фармацевтически приемлемую соль. В следующем предпочтительном воплощении PYY-агонист представляет собой полипептид(D11C)hPYY3-36, который имеет аминокислотную последовательность или его фармацевтически приемлемую соль. Наиболее предпочтительно, когда агонист представляет собой (E10C)hPYY3-36. PYY-агонисты по-2 011882 изобретению предпочтительно конъюгируют с гидрофильным полимером, предпочтительно ПЭГ. Агонист предпочтительно является монопэгилированным, то есть, отношение агониста к ПЭГ составляет приблизительно 1:1, и он присоединен по способной к образованию конъюгатов функциональной группе,такой как функциональная группа кето, тиол, гидроксил, карбоксил или свободная аминогруппа, в остатке X в (E10X)PYY3-36 и (D11X)PYY3-36 ПЭГ может быть линейным, разветвленным или имеющим боковые цепи; более предпочтительно, линейным или разветвленным; наиболее предпочтительно, линейным. В линейных ПЭГ один конец ПЭГ блокирован группой, являющейся инертной в условиях сочетания ПЭГ с агонистом, например, группой простого эфира, предпочтительно группой метокси. ПЭГ, терминированные таким образом (с использованием группы метокси), обычно обозначают как мПЭГ. Другой конец активирован для сочетания с PYY-агонистом. Аналогично, в случае с разветвленными ПЭГ,полезными в настоящем изобретении, все концы, кроме одного, блокированы группой простого эфира, а конец, не блокированный группой простого эфира, активируют для сочетания. В одном воплощении не блокированный группой простого эфира конец ПЭГ блокирован линкерной группировкой (L), связывающей ПЭГ с функциональной группой, которая является реакционноспособной в отношении способной к образованию конъюгатов функциональной группы аминокислоты X в (E10X)PYY3-36 или(D11X)PYY3-36, с получением конъюгата, представляющего собой ПЭГ, ковалентно присоединенный к способной к образованию конъюгатов функциональной группе в X. В дополнительном воплощении ПЭГ присоединен непосредственно к реакционноспособной группе без включения линкерной группировки. Такие ПЭГ часто называют безлинкерными ПЭГ. Для полипептидов (E10C)PYY3-36 и (D11C)PYY3-36, не блокированный группой простого эфира конец ПЭГ предпочтительно присоединен к линкеру, связывающему ПЭГ с малеимидом или другой группой, которая будет взаимодействовать с тиолом остатка цистеина с получением конъюгата, представляющего собой ПЭГ, ковалентно присоединенный к тиоловой группе цистеина. Подходящие реакционноспособные ПЭГ для использования с (E10C)hPYY3-36 или (D11 С)PYY3-36 включают ПЭГ формул Предпочтительно, чтобы ПЭГ представлял собой мПЭГ-малеимид, изображенный выше, включающий линкерную группировку -L-. Безлинкерные ПЭГ-малеимиды также подходят для применения в настоящем изобретении, в особенности с (E10C)hPYY3-36 или (D11C)PYY3-36 Такие безлинкерные ПЭГмалеимиды можно получить, как описано в Goodson and Katre, Bio/Technology 8: 343-346, 1990. Конъюгаты, полученные в результате сочетания полипептидов (E10C)hPYY3-36 или (D11C)PYY3-36 с мПЭГ, показанными выше, изображены на следующих далее формулах, где -SR представляет собой полипептид (E10C)hPYY3-36 или (D11C)PYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина: Линкер -L- служит просто для связывания ПЭГ с реакционноспособной функциональной группой и поэтому не ограничен конкретной группировкой, а предпочтительно включает алкиленовую группу, содержащую сложноэфирую связь, уретановую связь, амидную связь, простую эфирную связь, карбонатную связь или группу вторичного амина. В предпочтительном воплощении, в частности для линейных ПЭГ, линкер представляет собой группу формулы где р равен целому числу от 1 до 6, предпочтительно от 1 до 3, более предпочтительно 2 или 3, наиболее предпочтительно 3, и r равен целому числу от 1 до 6, предпочтительно от 1 до 3, более предпочтительно 2 или 3, наиболее предпочтительно 2. Предпочтительный линкер представляет собой группу В другом предпочтительном воплощении, в частности для разветвленных ПЭГ, линкер представляет собой группу формулы где s равен целому числу от 1 до 6, предпочтительно от 1 до 3, более предпочтительно 2 или 3, наиболее предпочтительно 2. Предпочтительный линкер представляет собой группу -NHC(O)CH2CH2-. ПЭГ может быть линейным или нелинейным, например, разветвленным или имеющим боковые цепи. Предпочтительно, чтобы ПЭГ являлся линейным или разветвленным, предпочтительно, линейным или разветвленным мПЭГ-малеимидом. Глицерин-разветвленный мПЭГ-малеимид является предпочтительным разветвленным ПЭГ. Предпочтительно, чтобы ПЭГ являлся линейным мПЭГ-малеимидом. Средняя молекулярная масса ПЭГ должна находиться в диапазоне от приблизительно 1 кДа до приблизительно 50 кДа. Предпочтительно, чтобы средняя молекулярная масса находилась в диапазоне от приблизительно 5 кДа до приблизительно 45 кДа; более предпочтительно, от приблизительно 10-12 кДа до приблизительно 40-45 кДа или от приблизительно 20 кДа до приблизительно 40-45 кДа. Особый интерес представляет линейный мПЭГ, такой как показано в формуле 1, со средней молекулярной массой, равной приблизительно 20 или приблизительно 30 кДа. Также представляет интерес глицерин-разветвленный мПЭГ формулы 2, предпочтительно со средней молекулярной массой, равной приблизительно 20 кДа или приблизительно 43 кДа. Предпочтительные ПЭГ, соответственно активированные для конъюгирования с тиоловой группой цистеина в (Е 10C)hPYY3-36 или (D11C)PYY3-36, представляют собой соединения формул 1 и 2. В линейном мПЭГ формулы 1 n равен целому числу в диапазоне приблизительно 175-800; предпочтительно,приблизительно 375-525 или приблизительно 600-750, или приблизительно 425-475 или приблизительно 650-700, или приблизительно 437-463 или 675-700. В глицерин-разветвленных мПЭГ формулы 2 каждыйm является предпочтительно одинаковым и равен целому числу в диапазоне приблизительно 150-500; предпочтительно, приблизительно 160-285 или приблизительно 400-525, или приблизительно 200-250 или 450-500. Разнообразные ПЭГ, соответственно активированые для конъюгирования с целевыми функциональными группами в боковой цепи аминокислот пептидов, например, группами кето, тиол, гидроксил,карбоксил или свободными аминогруппами, могут быть приобретены у ряда поставщиков, например уNOF Corporation (Tokyo, Japan) или Nektar Therapeutics Corporation (Huntsville, AL). Другой аспект настоящего изобретения относится к конъюгатам представленных вариантов PYY3-36 и полиэтиленгликоля. В одном воплощении конъюгат представляет собой соединение формулы 3 где группировка мПЭГ является линейной или разветвленной и имеет среднюю молекулярную массу в диапазоне от приблизительно 1 до 50 кДа, предпочтительно от 5 до приблизительно 45 кДа, более предпочтительно от приблизительно 10 или 12 кДа до приблизительно 40 или 45 кДа, или от приблизительно 20 кДа до приблизительно 40 кДа или 45 кДа,L представляет собой группу формулы в которой р равен целому числу от 1 до 6; предпочтительно от 1 до 3; более предпочтительно 2 или 3; наиболее предпочтительно 3; (как представлено ниже в формуле 4); и r равен целому числу от 1 до 6; предпочтительно от 1 до 3; более предпочтительно 2 или 3, наиболее предпочтительно 2; или L представляет собой группу формулы в которой s равен целому числу от 1 до 6; предпочтительно от 1 до 3; более предпочтительно 2 или 3; наиболее предпочтительно 2; и-SR представляет собой полипептид (E10C)hPYY3-36 или (D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина. Предпочтительным воплощением по изобретению является конъюгат линейного мПЭГ и варианта где n равен целому числу в диапазоне приблизительно 175-800; предпочтительно приблизительно 375-525 или приблизительно 600-750, или приблизительно 437-463 или приблизительно 675-700; и -SR представляет собой полипептид (E10C)hPYY3-36 или (D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина; или его фармацевтически приемлемая соль. Предпочтительно,чтобы средняя молекулярная масса группировки (СН 2 СН 2 О)n составляла приблизительно 20 кДа или 30 кДа. Особенный интерес представляет конъюгат, в котором -SR представляет собой полипептид(E10C)hPYY3-36. Дополнительный аспект изобретения относится к конъюгатам, в которых группировка ПЭГ является разветвленной. Предпочтительные конъюгаты этой категории содержат глицерин-разветвленную группировку ПЭГ. Особый интерес представляет конъюгат формулы 5 где каждый m приблизительно одинаковый и равен целому числу в диапазоне приблизительно 150550; предпочтительно приблизительно 160-285 или приблизительно 400-525, или приблизительно 200250 или приблизительно 450-500, и -SR представляет собой полипептид (E10C)hPYY3-36 или(D11C)hPYY3-36, в котором S представляет собой атом серы тиоловой группы цистеина; или его фармацевтически приемлемая соль. Предпочтительно, чтобы каждая группировка (СН 2 СН 2 О)m, имела среднюю-5 011882 молекулярную массу в диапазоне приблизительно 9-11 кДа или приблизительно 20-22 кДа. Предпочтительно, чтобы объединенная средняя молекулярная масса группировок (СН 2 СН 2 О)m составляла приблизительно 20 кДа или приблизительно 43 кДа. Конъюгат, в котором -SR является полипептидом(E10C)hPYY3-36, представляет особенный интерес. В настоящем изобретении также предложено моноклональное антитело, специфически связывающееся с полипептидом, имеющим аминокислотную последовательность, которая показана в SEQ IDNO:3 или SEQ ID NO:4. В одном воплощении этого аспекта изобретения полипептид пэгилирован по остатку цистеина. В дополнение, в настоящем изобретении предложены полинуклеотидные последовательности, кодирующие полипептидные последовательности по изобретению, предпочтительно они кодируют SEQ IDNO:3 и SEQ ID NO:4. В другом воплощении изобретения предложена фармацевтическая композиция, содержащая PYYагонист по настоящему изобретению и фармацевтически приемлемый носитель. В дополнительном воплощении композиция также содержит по меньшей мере один дополнительный фармацевтический агент,который может представлять собой агент, полезный в лечении основного для этой композиции показания или заболеваний, сопутствующих основному показанию. Дополнительный фармацевтический агент предпочтительно является средством против ожирения. Композиция предпочтительно содержит терапевтически эффективное количество PYY-агониста по изобретению или терапевтически эффективное количество комбинации PYY-агониста по изобретению и дополнительного фармацевтического агента. Кроме того, предложен способ лечения заболевания, состояния или расстройства, модулируемогоY2R-агонистом у млекопитающих, включающий периферическое введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества PYY-агониста по изобретению. PYYагонист по изобретению может быть использован сам по себе или в комбинации по меньшей мере с одним дополнительным фармацевтическим агентом, полезным в лечении заболевания, состояния или расстройства либо заболеваний, сопутствующих этому заболеванию, состоянию или расстройству. Заболевания, состояния или расстройства, модулируемые Y2R-агонистом у млекопитающих, включают ожирение и избыточный вес. Лечение таких заболеваний, состояний или расстройств вероятно будет приводить к улучшению заболеваний, сопутствующих таким заболеваниям, состояниям или расстройствам. Дополнительно предложен способ лечения ожирения у млекопитающего, нуждающегося в таком лечении,включающий периферическое введение млекопитающему терапевтически эффективного количестваPYY-агониста по настоящему изобретению. Кроме того, предложен способ снижения массы или стимулирования уменьшения массы (включая предупреждение или замедление прироста массы) у млекопитающего, включающий периферическое введение млекопитающему регулирующего массу или уменьшающего массу количества PYY-агониста по настоящему изобретению. Кроме того, предложен способ уменьшения потребления пищи у млекопитающего, включающий периферическое введение млекопитающему уменьшающего потребление пищи количества PYYагониста по настоящему изобретению. Кроме того, предложен способ стимулирования насыщения у млекопитающего, включающий периферическое введение млекопитающему стимулирующего насыщение количества PYY-агониста по изобретению. Кроме того, предложен способ уменьшения потребления калорий у млекопитающего, включающий периферическое введение млекопитающему уменьшающего потребление калорий количества PYYагониста по изобретению. PYY-агонист может быть введен сам по себе или в комбинации по меньшей мере с одним дополнительным фармацевтическим агентом, предпочтительно средством против ожирения. В каждом из способов, изложенных в данном описании и в прилагаемой формуле изобретения,PYY-агонист может быть введен сам по себе или в комбинации по меньшей мере с одним дополнительным фармацевтическим агентом, предпочтительно средством против ожирения. Представленные PYY-агонисты и композиции, содержащие их, также полезны в изготовлении лекарственного средства для терапевтических применений, упомянутых в данном описании. Определения и сокращения Фраза фармацевтически приемлемый означает, что данные вещество или композиция должны быть совместимы с точки зрения химии и/или токсикологии с другими ингредиентами, входящими в состав препарата, и/или млекопитающим, которого лечат им. Термин PYY-агонист означает любое соединение, вызывающее один или более эффектов, вызываемых действием PYY, предпочтительно PYY3-36, in vivo или in vitro. Фраза терапевтически эффективное количество означает количество PYY-агониста по настоящему изобретению, которое уменьшает потребление калорий, уменьшает массу тела и/или уменьшает тучность организма по сравнению с соответствующими контрольными величинами, определяемыми до лечения или в обработанной растворителем группе. Термин млекопитающее означает людей, а также всех других теплокровных членов царства жи-6 011882 вотных, обладающих механизмом гомеостаза в классе Млекопитающие, например, домашних млекопитающих, млекопитающих зоопарков и млекопитающих-источников пищи. Некоторыми из примеров домашних млекопитающих являются представители семейств псовых (например, собаки), кошачих (например, кошки) и лошадей; некоторыми из примеров млекопитающих-источников пищи являются свиньи, крупный рогатый скот, овцы и тому подобное. Предпочтительным млекопитающим является человек или домашнее млекопитающее. Наиболее предпочтительным млекопитающим является человек мужского или женского пола. Термины лечащий, лечить или лечение включают как превентивное, то есть профилактическое, так и паллиативное лечение. Термин периферическое введение означает введение за пределами центральной нервной системы. Периферическое введение не включает непосредственного введения в головной мозг. Периферическое введение включает внутрисосудистое, внутримышечное, подкожное, ингаляционное, пероральное, сублингвальное, энтеральное, ректальное, трансдермальное или интраназальное введение, но этим не ограничивается. Неприродной аминокислотой, подходящей для использования в настоящем изобретении, обычно является любая аминокислота приведенной ниже формулы, отличающаяся от 20 природных аминокислот(Cantor and Shimmel, Biophysical Chemistry, Part 1, WH FreemanSons, San Fransisco, 42-43, 1980), где R1 представляет собой любой заместитель, включающий функциональную группу кето, тиол, карбоксил,гидроксил или свободную аминогруппу, как например описанные в публикации заявки на патент США 2005/0208536, включенной в данное описание во всей своей полноте посредством ссылки. Такие неприродные аминокислоты, например, включают тиотирозин, орнитин, 3 меркаптофенилаланин, 3- или 4-аминофенилаланин, 3- или 4-ацетилфенилаланин, 2-или 3 гидроксифенилаланин (орто- или метатирозин), гидроксиметилглицин, аминоэтилглицин, 1-метил-1 меркаптоэтилглицин, аминоэтилтиоэтилглицин и меркаптоэтилглицин. Большинство неприродных аминокислот, полезных в настоящем изобретении, имеется в продаже. Другие могут быть получены способами, известными в данной области техники. Например, тиотирозин можно получить способом, описанным в работе Lu et al., J. Am. Chem. Soc. 119: 7173-7180, 1997, включенной в данное описание посредством ссылки. Термин PYY человека или hPYY означает амидированный по С-концу, состоящий из 36 аминокислот полипептид, имеющий следующую аминокислотную последовательность: Термин hPYY3-36 означает С-концевой 34-мерный hPYY, имеющий следующую аминокислотную последовательность: Термин (E10C)hPYY3-36 означает С-концевой 34-мерный hPYY, в котором остаток глутаминовой кислоты 10 в hPYY заменен на остаток цистеина и который имеет следующую аминокислотную последовательность: Термин (D11C)hPYY3-36 означает С-концевой 34-мерный hPYY, в котором остаток аспарагиновой кислоты 11 в hPYY заменен на остаток цистеина и который имеет следующую аминокислотную последовательность: Краткое описание графических материалов Фиг. 1 представляет собой запись обращенно-фазовой ВЭЖХ очищенного пептида (E10C)hPYY3-36 на колонке Zorbax Eclipse XDB-C8. Фиг. 2 представляет собой запись эксклюзионной ВЭЖХ (SEC-ВЭЖХ) реакционной смеси линейного 30 К мПЭГ-малеимида плюс (E10C)hPYY3-36 на SEC-колонке Shodex 804. Фиг. 3 представляет собой фотографию SDS PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия) фракций, полученных после очистки на SP Hitrap конъюгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36. MW представляет собой стандарты молекулярной массы; L представляет собой наносимую в колонку пробу; FT представляет собой проходящий поток; 4-23 представляют собой элюированные фракции. Фиг. 4 представляет собой запись обращенно-фазовой ВЭЖХ очищенного пептида (D11C)hPYY3-36 на колонке Zorbax Eclipse XDB-C8. Фиг. 5 представляет собой запись эксклюзионной ВЭЖХ реакционной смеси линейного 30 К мПЭГмалеимида плюс (D11C)hPYY3-36 на SEC-колонке Shodex 804. Фиг. 6 представляет собой запись эксклюзионной ВЭЖХ, показывающую профиль элюции очи-7 011882 щенного продукта конъюгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36 на SEC-колонке Shodex 804. Фиг. 7 представляет собой запись эксклюзионной ВЭЖХ, показывающую профиль элюции очищенного продукта конъюгата линейный 30 К мПЭГ-малеимид-(D11C)hPYY3-36, на SEC-колонке Shodex 804. Фиг. 8 представляет собой запись эксклюзионной ВЭЖХ реакционной смеси глицеринразветвленного 43 К мПЭГ-малеимида плюс (E10C)hPYY3-36 на SEC-колонке Shodex 804. Фиг. 9 представляет собой запись эксклюзионной ВЭЖХ, показывающую профиль элюции очищенного продукта конъюгата глицерин-разветвленный 43 К мПЭГ-малеимид-(E10C)hPYY3-36 на SECколонке Shodex 804. Фиг. 10 представляет собой график ингибирования кумулятивного потребления пищи после периода голодания у мышей после внутрибрюшинной (IP) инъекции. На фиг. 10 А показана кривая доза-эффект для нативного PYY3-36 по сравнению с группой, получавшей растворитель. На фиг. 10 В показана кривая доза-эффект для конъюгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36. На фиг. 11 показано влияние на потребление пищи после периода голодания IP инъекции мышам конъюгата глицерин-разветвленный 43 К мПЭГ-малеимид-(E10C)PYY3-36 по сравнению с растворителем и конъюгатом линейный 30 К мПЭГ-малеимид-(E10C)PYY3-36. Фиг. 11 А является графическим представлением, показывающим ответ в течение 6 ч после инъекции. Фиг. 11 В представляет собой диаграмму сравнения эффектов в течение 24 ч после инъекции. На фиг. 12 показано влияние IP инъекций растворителя, PYY3-36 и конъюгата линейный 30 К мПЭГмалеимид-(E10C)PYY3-36 на спонтанно кормящихся мышей. На фиг. 12 А показано влияние на потребление пищи, а на фиг. 12 В показано влияние на массу тела. На фиг. 13 показано влияние подкожной (SC) инъекции растворителя, PYY3-36 и конъюгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36 на спонтанно кормящихся мышей. На фиг. 13 А показано влияние на потребление пищи, а на фиг. 13 В показано влияние на массу тела. На фиг. 14 показана экспозиция PYY в плазме у мышей после IP инъекции в дозе 0,1 мг/кг. На фиг. 14 А продемонстрированы уровни PYY в плазме после инъекции hPYY3-36, а на фиг. 14 В продемонстрированы уровни PYY в плазме после инъекции конъюгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36. Фиг. 15 представляет собой график кривых концентрация-ответ для PYY3-36 или конъюгата линейный 30 К мПЭГ-малеимид-(E10C)PYY3-36, полученных с использованием анализа с использованием аналит-связывающих сцинтилляционных гранул (scintillation proximity assay; SPA), в котором лиганды конкурируют с 125I-PYY1-36 за связывание с Y2R, экспрессируемым KAN-TS-клетками. Фиг. 16 представляет собой график кривых концентрация-ответ для PYY3-36 или конъюгата линейный 30 К мПЭГ-малеимид-(E10C)PYY3-36, полученных с использованием анализа по связыванию ГТФ(гуанозинтрифосфат)гамма[35S] с Y2R, экспрессируемым на мембранах KAN-TS-клеток. Подробное описание изобретения Настоящее изобретение относится к PYY-агонистам, представляющим собой варианты PYY3-36 и их пэгилированные конъюгаты, которые могут обладать по меньшей мере одним улучшенным химическим или физиологическим свойством, выбранным из пониженной скорости клиренса, повышенной продолжительности нахождения в плазме, пролонгированной активности in vivo, повышенной эффективности,повышенной стабильности, улучшенной растворимости и пониженной антигенности, но этим не ограничиваются. Предпочтительным вариантом PYY3-36 по изобретению является (E10C)hPYY3-36. Другим предпочтительным вариантом является (D11C)hPYY3-36. Эти и другие варианты по изобретению могут быть получены путем синтеза, с помощью технологии рекомбинантной ДНК и другими способами, как описано ниже и в примерах в данном описании, или аналогичными способами. В дополнение к перечисленным выше заменам (например, Е 10 С и D11C), PYY-агонисты по изобретению также могут включать одну или более чем одну консервативную аминокислотную замену в других аминокислотных положениях. Консервативные замены могут быть произведены, например, в соответствии с приведенной ниже таблицей. Алифатическая неполярная, полярная-незаряженная и полярнаязаряженная аминокислоты могут быть заменены другой алифатической аминокислотой, которая является неполярной, полярной-незаряженной или полярной-заряженной аминокислотой, соответственно. Предпочтительно, чтобы такие замены осуществлялись между аминокислотами одной и той же линии третьей колонки приведенной ниже таблицы. Консервативные аминокислотные замены также могут быть осуществлены между ароматическими аминокислотами, которые показаны в приведенной ниже таблице. Получение путем синтеза Варианты PYY3-36 по этому изобретению, например (E10C)hPYY3-36 и (D11C)hPYY3-36, могут быть получены с использованием стандартных методик пептидного синтеза, известных в данной области техники, например посредством твердофазного пептидного синтеза, проводимого с использованием автоматического пептидного синтезатора (например, модели 433 А; Applied Biosystems, Foster City, CA) с использованием tBoc- (трет-бутоксикарбонил) или Fmoc-химии (9-флуоренилметиленоксикарбонил). Обзор многих доступных методик пептидного синтеза можно найти в работе Solid Phase Peptide Synthesis 2nd ed. (Stewart, J.M. and Young, J.D., Pierce Chemical Company, Rockford, IL, 1984). См. также книгу Solidphase Organic Synthesis (Burgess, K., John WileySons, New York, NY, 2000) и статью Engels et al.,Angew. Chem. Intl. Ed. 28:716- 34, 1989. Все перечисленные выше работы включены в данное описание посредством ссылки. Варианты PYY3-36 по изобретению предпочтительно конъюгируют с ПЭГ. Реакции конъюгирования, называемые реакциями пэгилирования, исторически проводили в растворе с молярным избытком полимера и без учета места присоединения полимера к белку. Однако обычно получали подтверждение тому, что такие общие методики не являются адекватными для сохранения достаточной биологической активности при конъюгировании биологически активных белков с неантигенными полимерами. Одним из путей сохранения биологической активности варианта агониста PYY3-36 после пэгилирования является по существу возможность избежать, в процессе сочетания, конъюгации любых реакционноспособных групп этого варианта, которые участвуют в связывании агониста с рецептором-мишенью. С целью сохранения высоких уровней активности, в одном аспекте настоящего изобретения предложен способ конъюгирования полиэтиленгликоля с вариантом агониста PYY3-36 по изобретению по специфическим реакционноспособным сайтам, которые по существу не перекрываются с сайтом(ами) связывания рецептора. Другой аспект этого изобретения представляет собой введение реакционноспособных остатков вPYY3-36 с целью получения вариантов этого агониста для конъюгирования с полиэтиленгликолем с минимальным изменением активности. Химическая модификация посредством образования ковалентной связи может быть осуществлена в любых подходящих условиях, в общем случае адаптированных для реакции конъюгирования биологически активного вещества с активированным ПЭГ. Реакцию конъюгирования осуществляют в относительно мягких условиях для того, чтобы избежать инактивации варианта агониста PYY3-36. Мягкие условия включают поддержание рН реакционного раствора в диапазоне приблизительно 3-10 и температуры реакции в диапазоне приблизительно 0-40 С. Нецелевые функциональные группы в вариантах PYY3-36, которые являются реакционноспособными по отношению к активированному ПЭГ в условиях пэгилирования, предпочтительно защищают соответствующей защитной группой, которую можно удалить после пэгилирования по целевой функциональной группе. При пэгилировании свободных аминогрупп такими реагентами, как ПЭГ-альдегиды или ПЭГ-сукцинимиды, рН обычно поддерживают в диапазоне приблизительно 3-10, предпочтительно приблизительно 4-7,5. Реакцию сочетания предпочтительно проводят в подходящем буфере (рН 3-10), например фосфате, MES (2-(N-морфолино)этансульфоновая кислота),цитрате, ацетате, сукцинате или HEPES (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота), в течение приблизительно 1-48 ч при температуре в диапазоне приблизительно 4-40 С. При пэгилировании тиоловых групп с использованием таких реагентов, как ПЭГ-малеимиды, ПЭГ-винилсульфоны или ПЭГортопиридилдисульфиды, рН предпочтительно поддерживают в диапазоне приблизительно 4-8. ПЭГамины полезны при пэгилировании кетогрупп, например, в параацетилфенилаланине, и их можно получить, как описано в Pillai et al., J. Org. Chem. 45:5364-5370, 1980. При осуществлении реакций конъюгирования по настоящему изобретению обычно получают реакционную смесь или пул, содержащую(ий) желаемый монопэгилированный вариант PYY3-36, а также непрореагировавший вариант пептида PYY3-36, непрореагировавший ПЭГ и обычно менее чем приблизительно 20% высокомолекулярных структур, которые могут включать конъюгаты, содержащие более одной цепи ПЭГ и/или агрегированные структуры. После удаления непрореагировавших структур и высокомолекулярных структур производят извлечение композиций, содержащих преимущественно монопэгилированные варианты PYY3-36. Принимая во внимание, что такие конъюгаты часто включают одну полимерную цепь, они являются по существу гомогенными. Желаемый конъюгат ПЭГ и варианта PYY3-36 может быть очищен из реакционной смеси традици-9 011882 онными способами, обычно используемыми для очистки белков, такими как диализ, высаливание, ультрафильтрация, ионообменная хроматография, хроматография гидрофобного взаимодействия (HIC), гельхроматография и электрофорез. Для удаления любого непрореагировавшего ПЭГ или непрореагировавшего варианта PYY3-36 особенно эффективна ионообменная хроматография. Отделение желаемого конъюгата ПЭГ-вариант можно осуществить посредством помещения реакционной смеси, содержащей смешанные структуры, в буферный раствор, имеющий рН от приблизительно 4 до приблизительно 10, предпочтительно ниже 8, чтобы избежать деамидирования. Буферный раствор предпочтительно содержит одну или более буферных солей, выбранных из KCl, NaCl, К 2 НРО 4, КН 2 РО 4, Na2HPO4, NaH2PO4,NaHCO3, NaBO4 и CH3CO2Na, но этим не ограничивается. Если буферная система, используемая в реакции пэгилирования, отличается от таковой в процессе разделения, реакционную смесь для пэгилирования подвергают буферному обмену/диафильтрации или разбавляют достаточным количеством изначального буфера для разделения. Фракционирование конъюгатов в пуле, содержащем желаемые структуры, предпочтительно осуществляют с использованием среды для ионообменной хроматографии. Такая среда способна к селективному связыванию конъюгатов ПЭГ и вариантов PYY3-36 за счет различий в заряде, который варьирует до некоторой степени предсказуемым образом. Например, поверхностный заряд варианта PYY3-36 определяется количеством доступных заряженных групп на поверхности пептида, которые доступны для взаимодействия с носителем колонки, устойчивым в присутствии ПЭГ. Эти заряженные группы обычно служат в качестве точки возможного присоединения полимеров ПЭГ. Следовательно, конъюгаты ПЭГ и вариантов PYY3-36 будут иметь заряд, отличный от заряда других присутствующих структур, что дает возможность избирательного выделения. Для очистки представленных конъюгатов ПЭГ и вариантов PYY3-36 особенно предпочтительны ионообменные смолы. В способе очистки по настоящему изобретению используют катионообменные смолы, такие как сульфопропил-смолы. Неограничивающий перечень катионообменных смол, подходящих для использования по настоящему изобретению, включает SP-hitrap, SP Sepharose HP и SP Sepharose fast flow. Также можно использовать другие подходящие катионообменные смолы, например S- и СМ(карбоксиметил)содержащие смолы. Катионообменную смолу предпочтительно упаковывают в колонку и уравновешивают традиционным образом. Используют буфер, имеющий те же значения рН и осмоляльности, что и раствор ПЭГконъюгированного варианта PYY3-36. Элюирующий буфер предпочтительно содержит одну или более солей, выбранных из CH3CO2Na, HEPES, KCl, NaCl, K2HPO4, KH2PO4, Na2HPO4, NaH2PO4, NaHCO3,NaBO4; и (NH4)2CO3, но этим не ограничивается. Раствор, содержащий конъюгат, затем адсорбируют на колонке, при этом непрореагировавший ПЭГ и некоторые высокомолекулярные структуры не удерживаются. По окончании загрузки для элюирования желаемой фракции ПЭГ-конъюгированного вариантаPYY3-36 к колонке прикладывают градиентный поток элюирующего буфера с увеличивающейся концентрацией соли. Объединенные элюированные фракции после стадии катионообменного разделения предпочтительно ограничиваются однородными полимерными конъюгатами. Любые структуры неконъюгированных вариантов PYY3-36 затем можно вымывать из колонки с использованием традиционных методик. При желании, моно- и мультипэгилированные структуры вариантов PYY3-36 и высокомолекулярные структуры можно потом отделить друг от друга путем проведения дополнительной ионообменной хроматографии или эксклюзионной хроматографии. Вместо линейного градиента можно применять методики, в которых используются множественные стадии изократического элюирования с повышающейся концентрацией. Множественные стадии изократического элюирования с повышающейся концентрацией будут приводить к последовательному элюированию сначала конъюгатов мультипэгилированных/агрегированных и затем монопэгилированных вариантов PYY3-36. Также можно использовать методики элюирования, основанные на градиентах рН. В общем случае температурный диапазон для элюирования составляет от приблизительно 4 С до приблизительно 25 С. Элюирование конъюгата ПЭГ и варианта PYY3-36 регистрируют по УФ-поглощению при 280 нм. Сбор фракций можно осуществлять, исходя непосредственно из профилей элюирования во времени. Рекомбинантная экспрессия Молекулы нуклеиновых кислот Молекулы нуклеиновых кислот, кодирующие полипептид (E10C)hPYY3-36, могут содержать одну из следующих последовательностей нуклеиновых кислот (мутация в кодоне для замены Е 10 С подчеркнута): Молекулы нуклеиновых кислот, кодирующие полипептид (D11C)hPYY3-36, могут содержать одну из следующих последовательностей нуклеиновых кислот (мутация в кодоне для замены D11 С подчеркнута): Эти последовательности также могут включать стоп-кодон (например tga, taa, tag) на С-конце, и их легко получить рядом способов, включая химический синтез, генетическую мутацию полинуклеотидных последовательностей hPYY дикого типа, полученных из кДНК или скринингом геномной библиотеки,скринингом библиотеки по экспрессии и/или амплификацией кДНК с использованием полимеразной цепной реакции (ПЦР), но этим не ограничиваясь. Молекулы нуклеиновых кислот, кодирующие варианты (E10C)hPYY3-36 и (D11C)hPYY3-36, можно создавать с использованием сайт-специфического мутагенеза, ПЦР-амплификации или других подходящих способов, в случае, если праймер(ы) имеет(ют) желаемые точечные мутации. Способы рекомбинантной ДНК и способы мутагенеза, рассмотренные в данном описании, в целом приведены в Sambrook et al., Molecular Cloning: Laboratory Manual (Cold Spring Harborand Wiley and Sons 1994). Если желательно, чтобы ЕЮ или D11 была заменена другой, не существующей в природе аминокислотой, такой пептид может быть рекомбинантно экспрессирован с использованием способов, которые описаны, например, в публикации заявки на патент США 2005/0208536, включенной в данное описание посредством ссылки. Полинуклеотиды нуклеиновых кислот, кодирующие аминокислотную последовательность hPYY,могут быть идентифицированы посредством экспрессирующего клонирования, в котором применяется детектирование позитивных клонов на основании свойства экспрессируемого белка. Обычно библиотеки нуклеиновых кислот подвергают скринингу в отношении связывания антитела или другого партнера по связыванию (например, рецептора или лиганда) с клонированными белками, которые экспрессируются и располагаются на поверхности клеток-хозяев. Антитело или партнер по связыванию модифицируют детектируемой меткой с целью идентификации таких клеток, экспрессирующих желаемый клон. Методики рекомбинантной экспрессии, осуществляемые в соответствии с приведенными ниже описаниями, могут быть использованы для получения кодирующих (E10C)hPYY3-36 и (D11C)hPYY3-36 полинуклеотидов и для экспрессии кодируемых полипептидов. Например, вставкой последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность варианта (E10C)hPYY3-36 или(D11C)hPYY3-36, в соответствующий вектор, специалист в данной области может без труда получить большие количества желаемой нуклеотидной последовательности. Данные последовательности могут быть затем использованы для получения детектирующих зондов или амплификационных праймеров. Альтернативно, полинуклеотид, кодирующий аминокислотную последовательность полипептида(E10C)hPYY3-36 или (D11C)hPYY3-36, можно легко вставить в экспрессирующий вектор. Введением экспрессирующего вектора в соответствующего хозяина можно получить кодируемый вариант(E10C)hPYY3-36 или (D11C)hPYY3-36 в больших количествах. Другим способом получения подходящей последовательности нуклеиновой кислоты является полимеразная цепная реакция (ПЦР). В этом способе кДНК получают из поли(А)+РНК или суммарной РНК, используя фермент обратную транскриптазу. Два праймера, обычно комплементарные двум отдельным участкам кДНК, кодирующим аминокислотную последовательность варианта (E10C)hPYY3-36 или (D11C)hPYY3-36, затем добавляют к кДНК вместе с полимеразой, такой как Taq-полимераза, и полимераза амплифицирует участок кДНК между этими двумя праймерами. Другим способом получения молекулы нуклеиновой кислоты, кодирующей аминокислотную последовательность варианта (E10C)hPYY3-36 или (D11C)hPYY3-36, является химический синтез с использованием способов, хорошо известных специалисту в данной области техники, как например описанные вEngels et al., Angew. Chem. Intl. Ed. 28: 716-34, 1989. Эти способы включают способы синтеза нуклеиновых кислот с использованием фосфотриэфиров, фосфорамидитов и Н-фосфонатов. Предпочтительным способом такого химического синтеза является синтез на полимерной подложке с использованием стандартной химии фосфорамидитов. Обычно длина ДНК, кодирующей аминокислотную последовательность (E10C)hPYY3-36, будет составлять приблизительно одну сотню нуклеотидов. Нуклеиновые кислоты, превышающие приблизительно 100 нуклеотидов, можно синтезировать в виде нескольких фрагментов с использованием этих способов. Фрагменты затем можно лигировать вместе с образованием полноразмерной нуклеотидной последовательности гена (E10C)hPYY3-36. Фрагмент ДНК, кодирующий амино-конец полипептида, может иметь ATG, который кодирует остаток метионина. Этот метионин может быть представлен или не представлен в зрелой форме(E10C)hPYY3-36 или (D11C)hPYY3-36, в зависимости от того, предназначен ли полипептид, продуцируемый в клетке-хозяине, для секретирования из клетки. В качестве стартового сайта также можно использовать кодон, кодирующий изолейцин. Кроме этого можно использовать другие способы, известные специалисту в данной области техники. В некоторых воплощениях варианты нуклеиновых кислот содержат кодоны, которые были изменены для оптимальной экспрессии (E10C)hPYY3-36 или (D11C)hPYY3-36 в- 11011882 данной клетке-хозяине. Конкретные изменения кодонов будут зависеть от (E10C)hPYY3-36 или(D11C)hPYY3-36 и клетки-хозяина, выбранной для экспрессии. Такую оптимизацию кодонов можно осуществить рядом способов, например, путем выбора кодонов, предпочтительных для использования в высоко экспрессируемых генах в данной клетке-хозяине. Можно использовать компьютерные алгоритмы, которые включают таблицы частот кодонов, такие как "Ecohigh.Cod" для частот кодонов высоко экспрессируемых бактериальных генов, и они представлены в пакете (программ), версия 9.0 Университета в Висконсине (University of Wisconsin Package Version 9.0; Gentics Computer Group, Madison, Wis.). Другие полезные таблицы частот кодонов включают "Celeganshigh.cod", "Celeganslow.cod","Drosophilahigh.cod", "Humanhigh.cod", "Maizehigh.cod" и "Yeasthigh.cod." Векторы и клетки-хозяева Молекулу нуклеиновой кислоты, кодирующую аминокислотную последовательность (E10C)hPYY3-36 или (D11C)hPYY3-36, вставляют в соответствующий экспрессирующий вектор, используя стандартные методики лигирования. Обычно вектор выбирают таким образом, чтобы он был функциональным в конкретной применяемой клетке-хозяине (то есть, вектор является совместимым с системой клетки-хозяина с тем, чтобы могла идти амплификация гена и/или экспрессия гена). Молекулу нуклеиновой кислоты,кодирующую аминокислотную последовательность (E10C)hPYY3-36 или (D11C)hPYY3-36, можно амплифицировать/экспрессировать в клетке-хозяине прокариот, дрожжей, насекомых (бакуловирусные системы) и/или эукариот. Для обзора по экспрессирующим векторам, смотри Meth. Enz., vol. 185 (D. V. Goeddel, ed., Academic Press, 1990). Обычно экспрессирующие векторы, используемые в любой из клеток-хозяев, будут содержать последовательности для поддержания плазмид и для клонирования и экспрессии экзогенных нуклеотидных последовательностей. Такие последовательности, вместе называемые как фланкирующие последовательности, в некоторых воплощениях обычно будут включать одну или более чем одну из следующих нуклеотидных последовательностей: промоторную, одну или более энхансерных последовательностей,ориджин репликации, последовательность терминации транскрипции, полную интронную последовательность, содержащую донорный и акцепторный сайт сплайсинга, последовательность, кодирующую лидерную последовательность для секреции полипептида, сайт связывания с рибосомой, последовательность полиаденилирования, полилинкерный участок для вставки нуклеиновой кислоты, кодирующей экспрессируемый полипептид, и селектируемый маркерный элемент. Каждая из этих последовательностей обсуждается ниже. Возможно, вектор может содержать метка-кодирующую последовательность, то есть, олигонуклеотидную молекулу, расположенную на 5'- или З'-конце последовательности, кодирующей(E10C)hPYY3-36 или (D11C)hPYY3-36; при этом данная олигонуклеотидная последовательность кодирует пoлиHis (такой как гексаHis), или другую метку, такую как FLAG, НА (гемаглютинин вируса гриппа) или myc, для которой существуют антитела, имеющиеся в продаже. Эту метку обычно подвергают слиянию с полипептидом по мере его экспрессии, и она может служить в качестве средства для аффинной очистки (E10C)hPYY3-36 или (D11C)hPYY3-36 из клетки-хозяина. Аффинную очистку можно осуществить,например, с помощью колоночной хроматографии с использованием антител против метки в качестве аффинной матрицы. Возможно, затем метку можно удалить из очищенных (E10C)hPYY3-36 или(D11C)hPYY3-36 различными способами, такими как использование конкретных пептидаз для расщепления, например, энтерокиназного расщепления по 3'-концу последовательности метки FLAG, расположенной слева от одной из аминокислотных последовательностей, которые показаны на SEQ ID NO: 3-4. Фланкирующие последовательности могут быть гомологичными (то есть, из того же вида и/или штамма, что и клетка-хозяин), гетерологичными (то есть, из вида, отличного от вида или штамма клеткихозяина), гибридными (то есть, представлять собой комбинацию фланкирующих последовательностей более чем из одного источника) или синтетическими, либо фланкирующие последовательности могут представлять собой нативные последовательности, которые обычно участвуют в регуляции экспрессииhPYY3-36. Источником фланкирующей последовательности может быть любой прокариотический или эукариотический организм, любой организм позвоночного или беспозвоночного или любое растение,при условии, что фланкирующая последовательность функциональна в клетке-хозяине и может быть активирована системой клетки-хозяина. Полезные фланкирующие последовательности можно получить любым из нескольких способов,хорошо известных в данной области техники. Обычно, фланкирующие последовательности, полезные в данном изобретении, отличные от последовательностей, фланкирующих ген PYY, должны быть предварительно идентифицированы посредством картирования и/или анализа с помощью рестрикционных эндонуклеаз и могут, таким образом, быть выделены из ткани подходящего источника с использованием соответствующих рестрикционных эндонуклеаз. В некоторых случаях может быть известна полная нуклеотидная последовательность фланкирующей последовательности. В этих случаях фланкирующая последовательность может быть синтезирована с использованием способов синтеза или клонирования нуклеиновых кислот, изложенных в данном описании. Когда вся или только часть фланкирующей последовательности известна, она может быть получена с использованием ПЦР и/или скрининга геномной библиотеки с использованием подходящего олигонук- 12011882 леотида и/или фрагмента фланкирующей последовательности из того же самого или другого вида. Когда фланкирующая последовательность не известна, фрагмент ДНК, содержащий фланкирующую последовательность, может быть выделен из большего по размерам участка ДНК, который может содержать,например, кодирующую последовательность или даже другой ген или гены. Выделение может быть осущестлено посредством обработки рестрикционной эндонуклеазой с получением подходящего фрагмента ДНК с последующим выделением с использованием очистки в агарозном геле, хроматографии на колонке Qiagen (Chatsworth, CA) или других способов, известных специалисту в данной области. Выбор подходящих для этой цели ферментов будет очевиден специалисту в данной области техники. Ориджин репликации обычно представляет собой часть тех прокариотических экспрессирующих векторов, которые имеются в продаже, и ориджин способствует амплификации вектора в клетке-хозяине. Амплификация вектора до определенного числа копий может, в некоторых случаях, быть важна для оптимальной экспрессии (E10C)hPYY3-36 или (D11C)hPYY3-36. Если выбранный вектор не содержит сайт ориджина репликации, его можно химически синтезировать на основе известной последовательности и лигировать в вектор. Например, ориджин репликации из плазмиды pBR322 (New England Bioiabs,Beverly, MA) подходит для большинства грам-отрицательных бактерий, а для клонирования векторов в клетках млекопитающих полезны многие ориджины (например, вируса 40 (SV40) обезьяны, вируса полиомы, аденовируса, вируса везикулярного стоматита (VSV) или вирусов папилломы, таких как HPV(вирус папилломы человека) или BPV (папилломавирус крупного рогатого скота. В общем случае ориджин репликации не является необходимым компонентом для экспрессирующих векторов млекопитающих (например, ориджин SV40 часто используется только потому, что он содержит ранний промотор). Последовательность терминации транскрипции обычно локализована на 3'-конце кодирующего полипептид участка и служит для терминации транскрипции. Обычно последовательность терминации транскрипции в прокариотических клетках представляет собой богатый G-C фрагмент, за которым следует поли-Т-последовательность. Хотя данную последовательность легко клонировать из библиотеки либо даже приобрести как часть вектора, ее также легко можно синтезировать с использованием способов синтеза нуклеиновых кислот, таких как представленные в данном описании. Селектируемый маркерный генный элемент кодирует белок, необходимый для выживания и роста клетки-хозяина на селективной культуральной среде. Обычно селектируемые маркерные гены кодируют белки, которые (а) придают прокариотическим клеткам-хозяевам устойчивость к антибиотикам или другим токсинам, например, ампициллину, тетрациклину или канамицину; (б) дополняют ауксотрофную недостаточность клетки; или (в) поставляют крайне необходимые питательные вещества, которые невозможно получить из комплексных сред. Предпочтительными селектируемыми маркерами являются ген устойчивости к канамицину, ген устойчивости к ампициллину и ген устойчивости к тетрациклину. Для селекции в прокариотических и эукариотических клетках-хозяевах также можно использовать ген устойчивости к неомицину. Для амплификации гена, который будет экспрессирован, можно использовать другие гены селекции. Амплификация представляет собой процесс, когда гены, в которых существует наибольшая потребность для продуцирования критического для роста белка, повторяются в тандеме внутри хромосом при последовательных генерациях рекомбинантных клеток. Примеры подходящих селектируемых маркеров для клеток млекопитающих включают дигидрофолат-редуктазу (DHFR) и тимидинкиназу. Трансформантов клеток млекопитающих помещают в условия селекционного давления, в которых только трансформанты уникально адаптируются для выживания благодаря наличию в векторе гена селекции. Селекционное давление создают посредством культивирования трансформированных клеток в условиях, при которых концентрация селекционного агента в среде последовательно изменяется, приводя в результате этого к амплификации как гена селекции, так и ДНК, кодирующей (E10C)hPYY3-36 или (D11C)hPYY3-36. В результате с амплифицированной ДНК синтезируются повышенные количества (E10C)hPYY3-36 или(D11C)hPYY3-36. Сайт связывания с рибосомой обычно необходим для инициации трансляции мРНК и характеризуется последовательностью Шайна-Далгарно (прокариоты) или последовательностью Козака (эукариоты). Этот элемент обычно локализован в положении 3' по отношению к промотору и 5' по отношению к кодирующей последовательности (E10C)hPYY3-36 или (D11C)hPYY3-36, которая должна быть экспрессирована. Последовательность Шайна-Далгарно варьирует, но обычно представляет собой полипурин (то есть,имеет высокое содержание A-G). Идентифицировано много последовательностей Шайна-Далгарно, каждую из которых можно легко синтезировать способами, приведенными в данном описании, и использовать в прокариотическом векторе. Для того чтобы направить (E10C)hPYY3-36 или (D11C)hPYY3-36 из клетки-хозяина, можно использовать лидерную или сигнальную последовательность. Обычно нуклеотидная последовательность, кодирующая эту сигнальную последовательность, расположена в кодирующем участке молекулы нуклеиновой кислоты (Е 10C)hPYY3-36 или (D11C)hPYY3-36 или непосредственно у 5'-конца кодирующего участка(E10C)hPYY3-36 или (D11C)hPYY3-36. Идентифицированы многие сигнальные последовательности и лю- 13011882 бые из них, которые функциональны в выбранной клетке-хозяине, можно использовать вместе с молекулой нуклеиновой кислоты (E10C)hPYY3-36 или (D11C)hPYY3-36. Следовательно, сигнальная последовательность может быть гомологичной (естественного происхождения) или гетерологичной по отношению к молекуле нуклеиновой кислоты (E10C)hPYY3-36 или (D11C)hPYY3-36. К тому же сигнальную последовательность можно синтезировать химически с использованием способов, изложенных в данном описании. В большинстве случаев секретирование (E10C)hPYY3-36 или (D11C)hPYY3-36 из клетки-хозяина благодаря наличию сигнального пептида будет приводить к удалению сигнального пептида из секретируемых(E10C)hPYY3-36 или (D11C)hPYY3-36. Сигнальная последовательность может быть компонентом вектора,или она может быть частью вставленной в вектор молекулы нуклеиновой кислоты (E10C)hPYY3-36 или(D11C)hPYY3-36. Нуклеотидная последовательность, кодирующая нативную сигнальную последовательность hPYY3-36, может быть присоединена к кодирующему участку (E10C)hPYY3-36 или (D11C)hPYY3-36, либо нуклеотидная последовательность, кодирующая гетерологичную сигнальную последовательность, может быть присоединена к кодирующему участку (E10C)hPYY3-36 или (D11C)hPYY3-36. Выбранная гетерологичная сигнальная последовательность должна распознаваться и процессироваться, то есть отщепляться сигнальной пептидазой клетки-хозяина. Для прокариотических клеток-хозяев, которые не распознают и не процессируют нативную сигнальную последовательность hPYY, сигнальную последовательность заменяют на прокариотическую сигнальную последовательность, выбранную, например, из группы лидерных последовательностей щелочной фосфатазы, пенициллиназы или термостабильного энтеротоксина II. Для секретирования в дрожжах нативная сигнальная последовательность hPYY может быть заменена на лидерную последовательность дрожжевой инвертазы, альфа-фактора или кислой фосфатазы. Для экспрессии в клетках млекопитающих нативная сигнальная последовательность является достаточной, хотя могут подходить другие сигнальные последовательности млекопитающих. Во многих случаях транскрипция молекулы нуклеиновой кислоты усиливается благодаря присутствию в векторе одного или более интронов; это особенно справедливо, когда полипептид продуцируется в эукариотических клетках-хозяевах, в особенности в клетках-хозяевах млекопитающих. Используемые интроны могут естественным образом присутствовать внутри гена hPYY, в особенности, когда используемый ген является полноразмерной геномной последовательностью или ее фрагментом. Когда интрон не присутствует естественным образом внутри гена (как для большинства кДНК), его можно получить из другого источника. Расположение интрона по отношению к фланкирующим последовательностям и генуhPYY обычно является важным, поскольку чтобы быть эффективным, интрон должен транскрибироваться. Таким образом, когда транскрибируется молекула кДНК, кодирующая (Е 10C)hPYY3-36 или(D11C)hPYY3-36., предпочтительным положением для интрона является положение 3' по отношению к сайту начала транскрипции и 5' по отношению к поли-А последовательности терминации транскрипции. Предпочтительно, чтобы интрон или интроны были локализованы либо с одной стороны кДНК, либо с другой (то есть, 5' или 3'), так чтобы это не прерывало кодирующую последовательность. Можно использовать любой интрон из любого источника, включая вирусы, прокариотические и эукариотические (растение или животное) организмы, при условии совместимости с клеткой-хозяином, в которую его вводят. Кроме того, в данное описание включены синтетические интроны. Возможно, в векторе можно использовать более одного интрона. Экспрессирующие и клонирующие векторы обычно будут содержать промотор, который распознается организмом хозяина и оперативно связывается с молекулой, кодирующей (E10C)hPYY3-36 или(D11C)hPYY3-36. Промоторы представляют собой нетранскрибируемые последовательности, локализованные выше (то есть, 5') по отношению к стартовому кодону структурного гена (в общем случае в пределах приблизительно 100-1000 пар оснований (п.о., которые регулируют транскрипцию данного структурного гена. Промоторы традиционно группируют в один из двух классов: индуцибельные промоторы и конститутивные промоторы. Индуцибельные промоторы инициируют повышенные уровни транскрипции ДНК, находящейся под их контролем, в ответ на некоторое изменение в условиях культивирования, как например присутствие или отсутствие питательного вещества, или изменение в температуре. Конститутивные промоторы, с другой стороны, инициируют постоянное продуцирование продукта гена; то есть имеется незначительная регуляция или не имеется никакой регуляции генной экспрессии. Хорошо известно большое количество промоторов, распознаваемых разнообразными потенциальными клетками-хозяевами. Подходящий промотор функциональным образом связан с ДНК, кодирующей(E10C)hPYY3-36 или (D11C)hPYY3-36, путем удаления промотора из источника ДНК с использованием обработки рестрикционными ферментами и вставки желаемой промоторной последовательности в вектор. Чтобы направить амплификацию и/или экспрессию молекулы нуклеиновой кислоты (E10C)hPYY3-36 или (D11C)hPYY3-36, можно использовать нативную промоторную последовательность hPYY3-36. Тем не менее, предпочтителен гетерологичный промотор, если он позволяет осуществлять более сильную транскрипцию и давать более высокие выходы экспрессируемого белка по сравнению с нативным промотором, и если он совместим с системой клетки-хозяина, которая выбрана для использования. Промоторы, подходящие для использования с прокариотическими хозяевами, включают беталактамазные и лактозные промоторные системы; промотор индуцибельной РНК-полимеразы E.coli T7;- 14011882 промотор щелочной фосфатазы; триптофановую (trp) промоторную систему; и гибридные промоторы,такие как tac-промотор. Также подходят другие известные бактериальные промоторы. Их последовательности опубликованы, что позволяет специалисту в данной области лигировать их с желаемой последовательностью ДНК, используя при необходимости линкеры или адаптеры для создания любых полезных сайтов рестрикции. Промоторы, подходящие для использования с дрожжевыми клетками-хозяевами, также хорошо известны в данной области техники. С дрожжевыми промоторами преимущественно используют дрожжевые энхансеры. Промоторы, подходящие для использования с клетками-хозяевами млекопитающих, хорошо известны и включают промоторы, полученные из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы, аденовирус (такой как Аденовирус 2), папилломавирус крупного рогатого скота, вирус птичьей саркомы, цитомегаловирус (CMV), ретровирусы, вирус гепатита В и, наиболее предпочтительно,вирус 40 (SV40) обезьяны, но этим не ограничиваются. Другие подходящие промоторы млекопитающих включают гетерологичные промоторы млекопитающих, например, промоторы белков теплового шока и актиновый промотор. Дополнительные промоторы, которые могут представлять интерес в отношении регуляции экспрессии (E10C)hPYY3-36 или (D11C)hPYY3-36, включают: участок раннего промотора SV40 (Bemoist andChambon, Nature 290: 304-10, 1981); CMV-промотор; промотор, содержащийся в длинных 3'терминальных повторах вируса саркомы Рауса (Yamamoto et al, Cell 22: 787-97, 1980); промотор тимидинкиназы вируса герпеса (Wagner et al., Proc. Natl. Acad. Sci. U.S.A. 78: 1444-45, 1981); регуляторные последовательности гена металлотионина (Brinster et al., Nature 296: 39-42, 1982); прокариотические экспрессирующие векторы, такие как промотор бета-лактамазы (Villa-Kamaroff et al., Proc. Natl. Acad. Sci.U.S.A. 75: 3727-31, 1978); или tac-промотор (DeBoer et al., Proc. Natl. Acad. Sci. U.S.A. 80: 21-25, 1983), но этим не ограничиваются. Для усиления транскрипции в высших эукариотах ДНК, кодирующей (E10C)hPYY3-36 или(D11C)hPYY3-36, в вектор можно вставить энхансерную последовательность. Энхансеры представляют собой цис-действующие элементы ДНК, обычно приблизительно 10-300 п.о. по длине, которые действуют на промотор, усиливая транскрипцию. Энхансеры относительно независимы от ориентации и расположения. Они были обнаружены в положениях 5' и 3' по отношению к транскрибируемой единице. Известно несколько энхансерных последовательностей, доступных из генов млекопитающих (например,генов глобина, эластазы, альбумина, альфа-фетопротеина и инсулина). Однако обычно будет использован энхансер из вируса. Энхансер SV40, энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы и энхансеры аденовирусов являются типичными энхансерными элементами для активации эукариотических промоторов. Несмотря на то, что энхансер может быть встроен в вектор в положении 5' или 3' по отношению к молекуле нуклеиновой кислоты, кодирующей (E10C)hPYY3-36 или (D11C)hPYY3-36, обычно он расположен в положении 5' по отношению к промотору. Экспрессирующие векторы можно конструировать из исходного вектора, как например вектора,имеющегося в продаже. Такие векторы могут содержать или могут не содержать все желаемые фланкирующие последовательности. Когда одна или более фланкирующих последовательностей, приведенных в данном описании, не присутствуют изначально в векторе, их можно получить в индивидуальном порядке и лигировать в вектор. Способы, используемые для получения каждой из фланкирующих последовательностей, хорошо известны специалисту в данной области техники. Предпочтительными векторами являются такие, которые совместимы с клеткой-хозяином бактерий,насекомых и млекопитающих. Такие векторы включают, среди прочего, pCRII, pCR3 и pcDNA3.1 (Invitrogen, Carlsbad, CA), pBSII (Stratagene, La Jolla, CA), pET15 (Novagen, Madison, WI), pGEX (Pharmacia(публикация заявки РСТWO 90/14363) и pFastBacDual (Gibco-BRL, Grand Island, NY). Дополнительные подходящие векторы включают космиды, плазмиды или модифицированные вирусы, но этим не ограничиваются, однако очевидно, что векторная система должна быть совместима с выбранной клеткой-хозяином. Такие векторы включают плазмиды, такие как плазмидные производныеBluescript (высококопийная фагмида на основе ColEl, Stratagene), ПЦР-клонированные плазмиды, разработанные для клонирования Taq-амплифицированных ПЦР-продуктов (например, ТОРО ТАCloning Kit, PCR2.1 плазмидные производные, Invitrogen), и векторы млекопитающих, дрожжей или вирусов, такие как бакуловирусная экспрессирующая система (рВасРАК плазмидные производные, Clontech), но этим не ограничиваются. После того как вектор сконструирован и молекула нуклеиновой кислоты, кодирующая полипептид(E10C)hPYY3-36 или (D11C)hPYY3-36, встроена в подходящий сайт этого вектора, скомплектованный вектор можно ввести в подходящую клетку-хозяин для амплификации и/или экспрессии полипептида. Трансформация выбранных клеток-хозяев экспрессирующим вектором для полипептида (E10C)hPYY3-36 или (D11C)hPYY3-36 может быть осуществлена хорошо известными способами, включая такие способы как трансфекция, инфекция, электропорация, микроинъекция, липофекция, диэтиламиноэтил(DEAE)декстрановый способ или другие известные методики. Выбранный способ отчасти должен соответство- 15011882 вать функции того типа клетки-хозяина, который будет использован. Эти способы и другие подходящие способы хорошо известны специалисту в данной области и изложены, например, в Sambrook et al., выше. Клетки-хозяева могут быть прокариотическими клетками-хозяевами (такими как Е. coli) или эукариотическими клетками-хозяевами (такими как дрожжевые клетки, клетки насекомых или позвоночных). Клетка-хозяин, когда ее культивируют в соответствующих условиях, синтезирует полипептид(E10C)hPYY3-36 или (D11C)hPYY3-36, который потом может быть собран из культуральной среды (если клетка-хозяин секретирует его в среду) или непосредственно из клетки-хозяина, продуцирующей его(если он не секретируется). Выбор соответствующей клетки-хозяина будет зависеть от различных факторов, таких как желаемые уровни экспрессии, полипептидные модификации, которые желательны или необходимы для активности (как например гликозилирование или фосфорилирование), и легкость сворачивания в биологически активную молекулу. В данной области техники известен ряд подходящих клеток-хозяев, и многие из них могут быть получены из Американской коллекции типовых культур (АТСС), Manassas, Va. Примеры включают клетки млекопитающих, такие как клетки яичников китайского хомячка (СНО), СНО DHFR(-)-клетки (Urlaub etal., Proc. Natl. Acad. Sci. U.S.A. 97: 4216-20, 1980), клетки почки эмбриона человека (НЕК) 293 или 293 Тклетки, или 3 Т 3-клетки, но этим не ограничиваются. Выбор подходящих клеток-хозяев млекопитающего и способов трансформации, культивирования, амплификации, скрининга, получения и очистки продукта известны в данной области техники. Другими подходящими клеточными линиями млекопитающих являются клеточные линии COS-1 и COS-7 обезьяны и клеточная линия CV-1. Дополнительные типичные примеры клеток-хозяев млекопитающих включают клеточные линии приматов и клеточные линии грызунов, включая трансформированные клеточные линии. Также подходят обычные диплоидные клетки,клеточные штаммы, происходящие из in vitro культуры первичной ткани, а также первичных эксплантатов. Клетки-кандидаты могут быть генотипически дефицитными по селектируемому гену или могут содержать доминантно действующий селектируемый ген. Другие подходящие клеточные линии млекопитающих включают N2A клетки нейробластомы мыши, HeLa, L-929 клетки мыши, линии 3 Т 3, происходящие из мышей Swiss, Balb-c или NIH, клеточных линий хомячка ВНК или НаК, но этим не ограничиваются. Каждая из этих клеточных линий известна и доступна специалисту в области экспрессии белков. Аналогично, в качестве подходящих клеток-хозяев полезны бактериальные клетки. Например, в области биотехнологии в качестве клеток-хозяев хорошо известны различные штаммы Е. coli (например,НВ 101, DH5, DH10 и МС 1061). Различные штаммы В. subtilis, Psendomonas, другие виды Bacillus и виды Streptomyces также могут быть использованы в этом способе. Многие штаммы дрожжевых клеток, известные специалистам в данной области, также доступны в качестве клеток-хозяев для экспрессии полипептидов (E10C)hPYY3-36 и (D11C)hPYY3-36. Предпочтительные дрожжевые клетки включают, например, Saccharomyces cerivisae и Pichia pastoris. В дополнение, где это желательно, для экспрессии (E10C)hPYY3-36 и (D11C)hPYY3-36 можно использовать клеточные системы насекомых. Такие системы описаны, например, в Kitts et al., 1993, Biotechniques 14: 810-17; Lucklow, Сип. Opin. Biotechnol. 4: 564-72, 1993; и Lucklow et al., J. Virol., 67: 4566-79,1993. Предпочтительными клетками насекомых являются Sf-9 и Hi5 (Invitrogen). Получение полипептида (E10C)hPYY3-36 и (D11C)hPYY3-36 Линию клеток-хозяев, содержащую вектор, экспрессирующий (E10C)hPYY3-36 или (D11C)hPYY3-36,можно культивировать, используя стандартную среду, хорошо известную специалисту в данной области. Обычно среда будет содержать все питательные вещества, необходимые для роста и выживания этих клеток. Подходящие среды для культивирования клеток Е. coli включают, например, бульон Луриа (LB) и/или Terrific Broth (ТВ). Подходящие среды для культивирования эукариотических клеток включают среду 1640 от Roswell Park Memorial Institute (RPMI 1640), минимальную незаменимую среду (MEM) и/или модифицированную Дульбекко среду Игла (DMEM), каждая из которых может быть дополнена сывороткой и/или ростовыми факторами, если это необходимо для конкретной культивируемой клеточной линии. Подходящей средой для культур клеток насекомых является среда Грейса (Grace), дополненная при необходимости дрожжевым экстрактом (yeastolate), гидролизатом лактальбумина и/или фетальной телячьей сывороткой. Обычно в качестве дополнения к среде добавляют антибиотик или другое соединение, полезное для селективного роста трансфицированных или трансформированных клеток. Предназначенное для использования соединение будет определяться селектируемым маркерным элементом, присутствующим в плазмиде, которой трансформировали клетку-хозяина. Например, когда селектируемый маркерный элемент определяет устойчивость к канамицину, соединением, добавляемым в культуральную среду, будет канамицин. Другие соединения для селективного роста включают ампициллин, тетрациклин и неомицин. Количество продуцируемого клеткой-хозяином полипептида (E10C)hPYY3-36 или (D11C)hPYY3-36 можно оценить, используя стандартные способы, известные в данной области техники. Такие способы включают вестерн-блоттинг, SDS-полиакриламидный гель-электрофорез, гель-электрофорез в неденатурирующих условиях, разделение с использованием высокоэффективной жидкостной хроматографии(ВЭЖХ), иммунопреципитацию и/или такие анализы активности, как анализы по связыванию ДНК со смещением в геле, но этим не ограничиваются.- 16011882 Если (E10C)hPYY3-36 или (D11C)hPYY3-36 разработаны для их секретирования из линии клетокхозяев, большая часть полипептида может быть обнаружена в культуральной клеточной среде. Если, однако, полипептид не секретируется из клеток-хозяев, он будет присутствовать в цитоплазме и/или в ядре(для эукариотических клеток-хозяев) или в цитозоле (для грам-отрицательных бактериальных клетокхозяев). Что касается (E10C)hPYY3-36 или (D11C)hPYY3-36, находящихся в цитоплазме и/или ядре клеткихозяина (для эукариотической клетки-хозяина) или в цитозоле (для бактериальной клетки-хозяина), то внутриклеточный материал (включая тельца включения для грам-отрицательных бактерий) можно экстрагировать из клетки-хозяина с использованием любой стандартной методики, известной специалисту в данной области. Например, клетки-хозяева можно лизировать для высвобождения содержимого периплазмы/цитоплазмы с использованием пресса Френча, гомогенизации и/или обработки ультразвуком с последующим центрифугированием. Если (E10C)hPYY3-36 или (D11C)hPYY3-36 образует тельца включения в цитозоле, то эти тела зачастую могут связываться с внутренней и/или внешней клеточной мебранами, и ввиду этого будут преимущественно обнаружены в материале осадка после центрифугирования. Затем материал осадка можно обработать при экстремальных значениях рН или с использованием хаотропного агента, такого как детергент, гуанидин, производные гуанидина, мочевина или производные мочевины, в присутствии восстанавливающего агента, такого как дитиотрейтол при щелочных значениях рН или трискарбоксиэтилфосфин при кислых значениях рН, чтобы произвести высвобождение, разрушение на части и солюбилизацию телец включения. Солюбилизированные (E10C)hPYY3-36 или (D11C)hPYY3-36 далее можно анализировать, используя гель-электрофорез, иммунопреципитацию или тому подобное. Если желательно выделить данный полипептид, то выделение может быть осуществлено с использованием стандартных способов, как например изложенные в данном описании и в Marston et al., Meth. Em. 182: 264-75, 1990. Если тельца включения не образуются в значительной степени по мере экспрессии (E10C)hPYY3-36 или (D11C)hPYY3-36, то данный полипептид будет находиться преимущественно в супернатанте после центрифугирования клеточного гомогената. Затем полипептид можно выделить из супернатанта с использованием таких способов, как способы, изложенные в данном описании. Очистку (E10C)hPYY3-36 или (D11C)hPYY3-36 из раствора можно осуществить с использованием разнообразных методик. Если полипептид синтезирован таким образом, что он содержит метку, такую как гексагистидин 9 или другой небольшой пептид, такой как FLAG (Eastman Kodak Co., New Haven, CT) или myc (Invitrogen), либо на его карбоксильном, либо аминоконце, его можно очистить в одностадийном процессе путем пропускания раствора через аффинную колонку, где матрица колонки обладает высокой аффинностью к данной метке. Например, полигистидин связывается с высокой аффинностью и специфичностью с никелем. Таким образом, для очистки можно использовать аффинную колонку с никелем (такую как никелевые колонкиQiagen). См., например, Current Protocols in Molecular Biology10.11.8 (Ausubel et al., eds., Green Publishers Inc. and Wiley and Sons, 1993). В дополнение, полипептид (E10C)hPYY3-36 или (D11C)hPYY3-36 можно очистить посредством применения моноклонального антитела, способного к специфическому распознаванию полипептида(E10C)hPYY3-36 или (D11C)hPYY3-36 и связыванию с ним. В ситуациях, когда предпочтительна частичная или полная очистка полипептида (E10C)hPYY3-36 или (D11C)hPYY3-36, то есть чтобы он был частично или по существу полностью очищен от примесей,можно использовать стандартные способы, известные специалистам в данной области техники. Такие способы включают разделение с использованием электрофореза с последующим электроэлюированием,различные типы хроматографии (аффинную, иммуноаффинную, гель-фильтрацию и ионообменную),ВЭЖХ и препаративное изоэлектрическое фокусирование (прибор/методика "Isoprime", Hoefer Scientific,San Francisco, CA), но этим не ограничиваются. В некоторых случаях для достижения повышенной степени чистоты можно объединять две или более методик очистки. В данной области техники известен ряд дополнительных способов получения полипептидов, и эти способы можно использовать для получения полипептидов (E10C)hPYY3-36 и (D11C)hPYY3-36. См., например, работу Roberts et al., Proc. Natl. Acad. Sci. U.S.A. 94: 12297-303, 1997, в которой описано получение белков слияния между мРНК и кодируемым ею пептидом. См. также Roberts, Curr. Opin. Chem. Biol. 3: 268-73, 1999. Способы получения пептидов или полипептидов также описаны в патентах США 5763192,5814476, 5723323 и 5817483. Способ включает получение случайных генов или их фрагментов и затем введение этих генов в клетки-хозяева, которые продуцируют один или более белков, кодируемых этими случайными генами. Клетки-хозяева далее подвергают скринингу с целью идентификации тех клонов,которые продуцируют пептиды или полипептиды, обладающие желаемой активностью. Другие способы экспрессии рекомбинантных пептидов изложены в патентах США 6103495, 6210925, 6627438 и 6737250. В способе используют Е. coli и общий секреторный путь Е. coli. Пептид подвергают слиянию с сигнальной последовательностью; таким образом, пептид помечен для секретирования. Другой способ получения пептидов или полипептидов описан в РСТ публикации заявки на патентWO 99/15650. Опубликованный способ, названный случайной активацией генной экспрессии для открытия гена, включает активацию эндогенной генной экспрессии или сверхэкспрессии гена посредством способов рекомбинации in situ. Например, экспрессия эндогенного гена активируется или усиливается в результате интегрирования регуляторной последовательности в клетку-мишень, которая способна к активации экспрессии гена посредством негомологичной или неправильной рекомбинации. ДНК-мишень сначала подвергают облучению и в нее вставляют генетический промотор. В конечном счете, промотор располагается в разрыве перед геном, что инициирует транскрипцию этого гена. Это приводит к экспрессии желаемого пептида или полипептида. Амидирование Амидирование пептида, полученного либо синтетически, либо рекомбинантно, осуществляют под действием фермента, называемого пептидил-глицин-альфа-амидирующая монооксигеназа (РАМ). При рекомбинантном получении пептидов (E10C)hPYY3-36 или (D11C)hPYY3-36 с использованием бактериальной экспрессирующей системы пептиды могут быть амидированы по С-концу в результате реакции invitro с использованием рекомбинантного фермента РАМ. Источник фермента РАМ, способы его продуцирования и очистки и способы, которые можно использовать для амидирования пептидов (E10C)hPYY3-36 или(D11C)hPYY3-36, описаны, например, в патентах США 4708934, 5789234 и 6319685. Селективные по отношению к (E10 С)hPYY3-36 и (D11C)hPYY3-36 антитела Антитела и фрагменты антител, которые специфически связывают полипептиды (E10C)hPYY3-36 или (D11C)hPYY3-36, с пэгилированием или без него по сайту цистеинового замещения (как изложено в данном описании), но селективно не связывают нативный hPYY3-36, входят в объем настоящего изобретения. Антитела могут быть поликлональными, в том числе моноспецифическими поликлональными; моноклональными; рекомбинантными; химерными; гуманизированными, такими как CDR-привитыми(complementarity-determining region; гипервариабельный участок); человеческими; состоящими из одной цепи; и/или биспецифическими; а также их фрагментами; вариантами или производными. Фрагменты антител включают те части антитела, которые связываются с эпитопом на полипептиде (E10C)hPYY3-36 или (D11C)hPYY3-36. Примеры таких фрагментов включают Fab- и Р(ab')-фрагменты, образованные в результате ферментативного расщепления полноразмерных антител. Другие связывающие фрагменты включают фрагменты, полученные с использованием методик рекомбинантной ДНК, таких как экспрессия рекомбинантных плазмид, содержащих последовательности нуклеиновой кислоты, кодирующие вариабельные участки антител. Поликлональные антитела к полипептиду (E10C)hPY3-36 или (D11C)hPYY3-36 в общем случае получают с использованием животных (например, кроликов или мышей) посредством многократных SC илиIP инъекций полипептида (E10C)hPYY3-36 или (D11C)hPYY3-36 и адъюванта. Полезным может быть конъюгирование полипептида (E10C)hPYY3-36 или (D11C)hPYY3-36 с белковым носителем, который является иммуногенным в иммунизируемых видах, таким как гемоцианин морского моллюска, сывороточный альбумин, бычий тироглобулин или ингибитор трипсина из сои. Кроме этого для усиления иммунного ответа используют вызывающие агрегацию агенты, такие как квасцы. После иммунизации у животных отбирают кровь и сыворотку анализируют на титр анти-(E10C)hPYY3-36 или анти-(D11C)hPYY3-36 антител. Моноклональные антитела к полипептидам (E10C)hPYY3-36 или (D11C)hPYY3-36 получают, используя любой способ, обеспечивающий продуцирование молекул антител непрерывными клеточными линиями в культуре. Примеры подходящих способов получения моноклональных антител включают гибридомные способы Кохлера и др. (Kohler et al., Nature 256: 495-97, 1975) и способ с использованием Вклеточных гибридом человека (Kozbor, J. Immunol. 133: 3001, 1984; Brodeur et al., Monoclonal AntibodyProduction Techniques and Applications, 51-63 (Marcel Dekker, Inc., 1987. Кроме того, согласно изобретению предложены гибридомные клеточные линии, продуцирующие моноклональные антитела, реакционноспособные по отношению к полипептидам (E10C)hPYY3-36 или (D11C)hPYY3-36. Предпочтительные способы определения специфичности и аффинности моноклональных антител посредством конкурентного ингибирования могут быть найдены в Harlow and Lane, Antibodies: Laboratory Manual (Cold Spring Harbor Laboratories, 1989); Current Protocols in Immunology (Colligan et al., eds.,Greene Publishing Assoc. and Wiley Interscience, 1993); и Muller, Meth. Enzymol. 92: 589-601, 1988. Химерные антитела по настоящему изобретению могут содержать индивидуальные Н- и/или L-цепи иммуноглобулинов. Предпочтительная химерная Н-цепь содержит антиген-связывающий участок, происходящий из Н-цепи антитела, не являющегося человеческим, специфичного к полипептиду(E10C)hPYY3-36 или (D11C)hPYY3-36, который соединен по меньшей мере с частью С-участка человеческой Н-цепи (Сн), такой как CH1 или СН 2. Предпочтительная химерная L-цепь содержит антигенсвязывающий участок, происходящий из L-цепи антитела, не являющегося человеческим, специфичного к полипептиду (E10C)hPYY3-36 или (D11C)hPYY3-36, который соединен по меньшей мере с частью С-участка человеческой L-цепи (CL). Химерные антитела и способы их получения известны в данной области техники. См. Cabilly et al., Proc. Natl. Acad. Sci. U.S.A. 81: 3273-77, 1984; Morrison et al., Proc. Natl.- 18011882 Селективно связывающие агенты, имеющие химерные Н-цепи и L-цепи с одинаковой или различной специфичностью по связыванию вариабельных участков, также можно получить, объединяя соответствующим образом индивидуальные полипептидные цепи способами, известными в данной области техники. См., например, Current Protocols in Molecular Biology (Ausubel et al., eds., Green Publishers Inc. andWiley и Sons, 1994) и Harlow and Lane, выше. Используя этот подход, клетки-хозяева, экспрессирующие химерные Н-цепи (или их производные), культивируют отдельно от клеток-хозяев, экспрессирующих химерные L-цепи (или их производные), и иммуноглобулиновые цепи извлекают по отдельности, а затем объединяют. Альтернативно, клетки-хозяева можно культивировать совместно и предоставлять цепям возможность для спонтанной ассоциации в культуральной среде с последующим извлечением собранного иммуноглобулина. В другом воплощении моноклональное антитело по изобретению является гуманизированным антителом. Способы гуманизации антител, не являющихся человеческими, хорошо известны в данной области техники. См. патенты США 5585089 и 5693762. В общем случае гуманизированное антитело содержит один или более аминокислотных остатков, введенных в него из источника, не являющегося человеком. Гуманизацию можно осуществить, например, используя способы, описанные в данной области техники (Jones et al., 1986, Nature 321: 522-25; Riechmann et al., 1998, Nature 332: 323-27; Verhoeyen etal., 1988, Science 239: 1534-36), посредством замещения соответствующих участков антитела человека по меньшей мере частью гипервариабельного участка (CDR) антитела грызунов. Методики создания рекомбинантных ДНК-версий антиген-связывающих участков молекул антител(то есть, Fab-фрагментов или фрагментов вариабельных участков), которые заменяют генерацию моноклональных антител, находятся в пределах объема настоящего изобретения. Согласно этой методике молекулы информационной РНК, кодирующие антитело, экстрагируют из клеток иммунной системы, взятых у иммунизированного животного, и транскрибируют в кДНК. Эту кДНК затем клонируют в бактериальную экспрессирующую систему. В одном из примеров такой методики, подходящей для практического применения по этому изобретению, используют векторную систему бактериофага лямбда, имеющую лидерную последовательность, которая заставляет экспрессируемый Fab-белок мигрировать в периплазматическое пространство (между бактериальной клеточной мембраной и клеточной стенкой) или секретироваться. Можно быстро производить и подвергать скринингу большое количество функциональных(D11C)hPYY3-36) конкретно охватываются термином антитело, как он использован в данном описании. Кроме того, в объем изобретения включены методики, разработанные для получения химерных антител посредством сплайсинга генов молекулы мышиных антител соответствующей антигенной специфичности с генами молекулы человеческих антител соответствующей биологической активности (такой как способность активировать систему комплемента человека и опосредовать антитело-зависимую клеточную цитотоксичность (ADCC. Morrison et al., Proc. Natl. Acad. Sci. U.S.A. 81: 6851-55, 1984; Neuberger et al., Nature 312: 604-08, 1984. Селективно связывающие агенты, такие как антитела, получаемые в соответствии с этой методикой, входят в объем данного изобретения. Очевидно, что данное изобретение не ограничено мышиными или крысиными моноклональными антителами; в действительности можно использовать человеческие антитела. Такие антитела можно получить с использованием человеческих гибридом. Таким образом, полностью человеческие антитела, которые связывают полипептиды (E10C)hPYY3 или (D11C)hPYY3-36, включены в данное изобретение. Такие антитела получают посредством иммуни 36 зации (E10C)hPYY3-36- или (D11C)hPYY3-36-антигеном (возможно конъюгированным с носителем) трансгенных животных (например мышей), способных продуцировать репертуар человеческих антител в отсутствие продуцирования эндогенных иммуноглобулинов. См., например, Jakobovits et al., Proc. Natl.Immuno. 7: 33-40, 1993. Кроме того, в данное изобретение включены человеческие антитела, которые связывают полипептиды (E10C)hPYY3-36 или (D11C)hPYY3-36. Используя трансгенных животных (например мышей), способных продуцировать репертуар человеческих антител в отсутствие продуцирования эндогенных иммуноглобулинов, такие антитела получают посредством иммунизации антигеном полипептида(E10C)hPYY3-36 или (D11C)hPYY3-36 (то есть, антигеном, имеющим по меньшей мере 6 соседних аминокислот), возможно конъюгированным с носителем. См., например, Jakobovits et al., 1993 выше; Jakobovitset al., Nature 362: 255-58, 1993; Bruggermann et al., 1993, выше. В одном из способов таких трансгенных животных получают, выводя в них из строя эндогенные локусы, кодирующие тяжелую и легкую иммуноглобулиновые цепи, и вводя в их геном локусы, кодирующие белки тяжелой и легкой цепи человека. Частично модифицированных животных, то есть, имеющих не полный комплект модификаций, далее скрещивают для получения животного, имеющего все желаемые модификации иммунной системы. При введении иммуногена эти трансгенные животные продуцируют антитела с аминокислотными последовательностями человека (в большей мере, чем например мыши), включая вариабельные участки, которые являются иммуноспецифичными для этих антигенов. См. публикации заявок на патент РСТWO- 19011882 96/33735 и WO 94/02602. Дополнительные способы описаны в патенте США 5545807, публикациях заявок на патент РСТWO 91/10741 и WO 90/04036, в патенте ЕР 0546073 В 1 и публикации заявки на патент РСТWO 92/03918. Человеческие антитела также можно получить путем экспрессии рекомбинантной ДНК в клетках-хозяевах или путем экспрессии в гибридомных клетках, как изложено в данном описании. В альтернативном воплощении человеческие антитела также могут быть получены из библиотек фагового дисплея (Hoogenboom et al., J. Mol. Biol. 227: 381, 1991; Marks et al., J. Mol. Biol. 222: 581, 1991). Эти процессы имитируют иммунную селекцию посредством проявления репертуаров антител на поверхности нитчатого бактериофага с последующей селекцией фага на основе их связывания с выбранным антигеном. Одна из таких методик описана в публикации заявки на патент РСТWO 99/10494, в которой описано выделение высокоаффинных и функциональных агонистических антител к MPL- и mskрецепторам с использованием такого подхода. Химерные, CDR-привитые и гуманизированные антитела обычно получают рекомбинантными способами. Нуклеиновые кислоты, кодирующие эти антитела, вводят в клетки-хозяева и экспрессируют,используя материалы и методики, изложенные в данном описании и известные в данной области техники. В предпочтительном воплощении антитела получают в клетках-хозяевах млекопитающего, таких как СНО-клетки. Моноклональные (например, человеческие) антитела можно получить путем экспрессии рекомбинантной ДНК в клетках-хозяевах или путем экспрессии в гибридомных клетках, как изложено в данном описании.Aнти-(E10C)hPYY3-36 и анти-(D11C)hPYY3-36 антитела по изобретению можно использовать в любом известном способе анализа, таком как анализы на конкурентное связывание, прямой и непрямой сэндвич-анализы и иммунопреципитационные анализы (Sola, Monoclonal antibodies: Manual ofTechniques, 147-158 (CRC Press, Inc., 1987, для детектирования и количественного определения полипептидов (E10C)hPYY3-36 и (D11C)hPYY3-36, а также для очистки полипептидов. Антитела будут связывать полипептиды (Е 10C)hPYY3-36 или (D11C)hPYY3-36 с аффинностью, соответствующей используемому способу анализа.PYY-агонисты по изобретению могут быть представлены в форме фармацевтически приемлемых солей присоединения кислоты для применения в относящемся к способу аспекте изобретения. Репрезентативные фармацевтически приемлемые соли присоединения кислоты настоящих соединений включают соли: гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат,сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, паратолуолсульфонат, памоат, пальмитат, малонат,стеарат, лаурат, малат, борат, гексафторфосфат, нафтилат, глюкогептаноат, лактобионат и лаурилсульфонат и тому подобное. Соли не-пэгилированных вариантов не обязательно должны быть фармацевтически приемлемыми, если данный вариант предполагают использовать в качестве промежуточного соединения при получении конъюгата ПЭГ и варианта PYY3-36.PYY-агонисты по настоящему изобретению в общем случае будут вводить в форме фармацевтической композиции. Фармацевтическая композиция может, например, быть в форме, подходящей для перорального введения (например, в форме таблетки, капсулы, пилюли, порошка, раствора, суспензии), для парентеральной инъекции (например, в форме стерильного раствора, суспензии или эмульсии), для интраназального введения (например, в форме аэрозольных капель и так далее), для ректального введения(например, в форме суппозитория) или для трансдермального введения (например, в форме пластыря). Фармацевтическая композиция может быть в стандартных лекарственных формах, подходящих для разового введения точных дозировок. Фармацевтическая композиция будет включать в себя традиционный фармацевтический носитель и PYY-агонист по изобретению в качестве активного ингредиента. В дополнение, она может включать другие фармацевтические агенты, адъюванты и так далее. Способы приготовления различных фармацевтических композиций биологически активных пептидов хорошо известны в фармацевтических областях науки. Например, см. публикацию заявки на патент США 2005/0009748 (для перорального введения) и 2004/0157777, 2005/0002927 и 2005/0215475 (для введения через слизистые оболочки, например, интраназального или трансбуккального введения). См. также Remington: The Practice of Pharmacy, Lippincott Williams and Wilkins, Baltimore, MD, 20th ed. 2000.PYY-агонисты по данному изобретению можно применять вместе с другими фармацевтическими агентами для лечения болезненных статусов или состояний, рассмотренных в данном описании. Следовательно, способы лечения, включающие введение соединений по настоящему изобретению в комбинации с другими фармацевтическими агентами, также предложены согласно настоящему изобретению. Подходящие фармацевтические агенты, которые можно применять в комбинации с PYYагонистами по настоящему изобретению, включают другие средства против ожирения, такие как антагонисты каннабиноидных рецепторов-1 (СВ-1) (такие как римонабант), ингибиторы 11-гидроксистероиддегидрогеназы-1 (11-HSD, тип 1), агонисты MCR-4 (рецептор-4 меланокортина), агонисты холецистокинина-А (ССК-А), ингибиторы обратного захвата моноаминов (такие как сибутрамин), симпатомимети- 20011882 ческие агенты, агонисты 3-адренергических рецепторов, агонисты дофаминовых рецепторов (такие как бромкриптин), аналоги рецепторов меланоцит-стимулирующего гормона, агонисты 5 НТ 2 с-рецептора,антагонисты меланин-концентрирующего гормона, лептин, аналоги лептина, агонисты лептинового рецептора, антагонисты галанина, ингибиторы липазы (такие как тетрагидролипстатин, то есть орлистат),аноректические агенты (такие как агонист бомбезина), антагонисты рецептора нейропептида-Y (например, антагонисты рецептора NPY Y5), тиреомиметические агенты, дегидроэпиандростерон или его аналог, агонисты или антагонисты глюкокортикоидного рецептора, антагонисты орексинового рецептора,агонисты рецепторов глюкагоноподобного пептида-1, цилиарные нейротрофические факторы (такие какAxokine, поставляемый Regeneron Pharmaceuticals, Inc., Tarrytown, NY и ProcterGamble Company,Cincinnati, ОН), ингибиторы агути(agouti)-связанного белка (AGRP) человека, антагонисты грелинового рецептора, антагонисты или обратные агонисты рецепторов гистамина 3, агонисты рецепторов нейромедина U, ингибиторы МТР/АроВ (микросомальный белок-переносчик триглицеридов /аполипопротеин В)(например, интестинально действующие ингибиторы МТР, такие как дирлотапид) и тому подобное. Предпочтительные средства против ожирения для применения в комбинации с PYY-агонистами по настоящему изобретению включают антагонисты СВ-1-рецептора, интестинально действующие ингибиторы МТР, агонисты ССК-А, агонисты 5 НТ 2 с-рецептора, антагонисты рецептора NPY Y5, орлистат и сибутрамин. Предпочтительные антагонисты СВ-1-рецептора для применения в способах по настоящему изобретению включают: римонабант (SR141716A, также известный под торговой маркой Acomplia),его можно приобрести у Sanofi-Synthelabo или можно получить, как описано в патенте США 5624941;[5-(4-бромфенил)-1-(2,4-дихлор-фенил)-4-этил-N-(1 пиперидинил)-1 Н-пиразол-3-карбоксамид] (SR147778), который можно получить, как описано в патенте США 6645985; N-(пиперидин-1-ил)-4,5-дифенил-1-метилимидазол-2-карбоксамид, N-(пиперидин-1 ил)-4-(2,4-дихлорфенил)-5-(4-хлорфенил)-1-метилимидазол-2-карбоксамид, N-(пиперидин-1-ил)-4,5-ди(4-метилфенил)-1-метилимидазол-2-карбоксамид,N-циклогексил-4,5-ди-(4-метилфенил)-1-метилимидазол-2-карбоксамид, N-(циклогексил)-4-(2,4-дихлорфенил)-5-(4-хлорфенил)-1-метилимидазол-2-карбоксамид и N-(фенил)-4-(2,4-дихлорфенил)-5-(4-хлорфенил)-1-метилимидазол-2-карбоксамид, который можно получить, как описано в публикации заявки на патент РСТWO 03/075660; соль гидрохлорид,мезилат и безилат амида 1-[9-(4-хлорфенил)-8-(2-хлор-фенил)-9 Н-пурин-6-ил]-4-этиламинопиперидин-4 карбоновой кислоты, которую можно получить, как описано в публикации заявки на патент США 2004/0092520; амид 1-[7-(2-хлорфенил)-8-(4-хлор-фенил)-2-метилпиразоло[1,5-а][1,3,5]триазин-4-ил]3-этиламино-азетидин-3-карбоновой кислоты и амид 1-[7-(2-хлорфенил)-8-(4-хлорфенил)-2 метилпиразоло[1,5-а][1,3,5]триазин-4-ил]-3-метиламиноазетидин-3-карбоновой кислоты, которые можно получить, как описано в публикации заявки на патент США 2004/0157839; 3-(4-хлорфенил)-2-(2 хлорфенил)-6-(2,2-дифторпропил)-2,4,5,6-тетрагидропиразоло[3,4-с]пиридин-7-он, который можно получить, как описано в публикации заявки на патент США 2004/0214855; 3-(4-хлорфенил)-2-(2 хлорфенил)-7-(2,2-дифторпропил)-6,7-дигидро-2 Н,5 Н-4-окса-1,2,7-триазаазулен-8-он, который можно получить, как описано в публикации заявки на патент США 2005/0101592; 2-(2-хлорфенил)-6-(2,2,2 трифторэтил)-3-(4-трифторметилфенил)-2,6-дигидропиразоло[4,3-d]пиримидин-7-он, который можно получить, как описано в публикации заявки на патент США 2004/0214838; (S)-4-хлор-N-[3-(4 хлорфенил)-4-фенил-4,5-дигидро-пиразол-1-ил]метиламино-метилен-бензолсульфонамид (SLV-319) и(S)-N-[3-(4-хлорфенил)-4-фенил-4,5-дигидропиразол-1-ил]-метиламинометилен-4-трифторметилбензолсульфонамид (SLV-326), которые можно получить, как описано в публикации заявки на патент РСТWO 02/076949; N-пиперидино-5-(4-бромфенил)-1-(2,4-дихлорфенил)-4-этилпиразол-3 карбоксамид, который можно получить, как описано в патенте США 6432984; 1-[бис-(4 хлорфенил)метил]-3-[(3,5-дифторфенил)метансульфонилметилен]азетидин, который можно получить,как описано в патенте США 6518264; 2-(5-(трифторметил)пиридин-2-илокси)-N[-(4-(4-хлорфенил)-3(3-цианофенил)бутан-2-ил)-2-метилпропанамид, который можно получить, как описано в публикации заявки на патент РСТWO 04/048317; 4-[6-метокси-2-(4-метоксифенил)-1-бензофуран-3 ил]карбонилбензнитрил (LY-320135), который можно получить, как описано в патенте США 5747524; 1-[2-(2,4-дихлорфенил)-2-(4-фторфенил)бензо[1,3]диоксол-5-сульфонил]пиперидин, который можно получить, как описано в WO 04/013120; и [3-амино-5-(4-хлорфенил)-6-(2,4-дихлорфенил)фуро[2,3-b]пиридин-2-ил]фенилметанон, который можно получить, как описано в публикации заявки на патент РСТWO 04/012671. Предпочтительные интестинально действующие ингибиторы МТР для применения в комбинациях,фармацевтических композициях и способах по изобретению включают дирлотапид S)-N-2[бензил(метил)амино]-2-оксо-1-фенилэтил-1-метил-5-[4'-(трифторметил)[1,1-бифенил]-2-карбоксамидо]1H-индол-2-карбоксамид) и (карбамоилфенилметил)амид 1-метил-5-[(4'-трифторметил-бифенил-2 карбонил)амино]-1 Н-индол-2-карбоновой кислоты, оба они могут быть получены с использованием способов, описанных в патенте США 6720351; (пентилкарбамоилфенилметил)амид (S)-2-[(4'трифторметилбифенил-2-карбонил)амино]хинолин-6-карбоновой кислоты,[(4-фторбензил)метил- 21011882 карбамоил]фенилметиламид(S)-2-[(4'-трет-бутил-бифенил-2-карбонил)амино]хинолин-6-карбоновой кислоты и [(4-фторбензилкарбамоил)фенилметил]амид (S)-2-[(4'-трет-бутил-бифенип-2-карбонил)амино]хинолин-6-карбоновой кислоты, все они могут быть получены, как описано в публикации заявки на патент США 2005/0234099 А 1, (-)-4-[4-[4-[4-(2S,4R)-2-(4-хлорфенил)-2-(4-метил-4H-1,2,4 триазол-3-ил)сульфанил]метил-1,3-диоксолан-4-ил]метокси]фенил]пиперазин-1-ил]фенил]-2-(1R)-1 метилпропил]-2,4-дигидро-3H-1,2,4-триазол-3-он (также известный как Mitratapide или R103757), который можно получить, как описано в патентах США 5521186 и 5929075; и имплитапид (BAY 139952), который можно получить, как описано в патенте США 6265431. Наиболее предпочтительным является дирлотапид, митратапид, (пентилкарбамоил-фенилметил)амид (S)-2-[(4'-трифторметилбифенил-2-карбонил)амино]хинолин-6-карбоновой кислоты, [(4-фторбензил)метилкарбамоил]фенилметиламид (S)-2-[(4'-трет-бутилбифенил-2-карбонил)амино]хинолин-6-карбоновой кислоты или [(4 фторбензилкарбамоил)фенилметил]амидY5-рецептора включают 2-оксо-N-(5 фенилпиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид, который можно получить,как описано в публикации заявки на патент США 2002/0151456; и 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид; 3-оксо-N-(7-трифторметилпиридо[3,2b]пиридин-2-ил)спиро-[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид;N-[5-(3-фторфенил)-2 пиримидинил]-3-оксоспиро-[изобензофуран-1(3 Н),[4'-пиперидин]-1'-карбоксамид; транс-3'-оксо-N-(5 фенил-2-пиримидинил)]спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4-карбоксамид; транс-3'-оксо-N-[1(3-хинолил)-4-имидазолил]спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4-карбоксамид; транс-3-оксо-N(5-фенил-2-пиразинил)спиро[4-азаизо-бензофуран-1(3 Н), 1'-циклогексан]-4'-карбоксамид; транс-N-[5-(3 фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоксамид; транс-N[-[5-(2-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3 Н), 1'-циклогексан]-4'карбоксамид; транс-N-[1-(3,5-дифторфенил)-4-имидазолил]-3-оксоспиро[7-азаизобензофуран-1(3 Н), 1'циклогексан]-4'-карбоксамид; транс-3-оксо-N-(1-фенил-4-пиразолил)спиро[4-азаизобензофуран-1(3 Н), 1'циклогексан]-4'-карбоксамид; транс-N-[1-(2-фторфенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран 1(3 Н), 1'-циклогексан]-4'-карбоксамид; транс-3-оксо-N-(1-фенил-3-пиразолил)спиро[6-азаизобензофуран 1(3 Н),1'-циклогексан]-4'-карбоксамид и транс-3-оксо-N-(2-фенил-1,2,3-триазол-4-ил)спиро[6 азаизобензофуран-1(3 Н), 1'-циклогексан]-4'-карбоксамид, все они могут быть получены, как описано в публикации заявки на патент РСТWO 03/082190; а также их фармацевтически приемлемые соли и сложные эфиры. Все перечисленные выше патенты США и публикации включены в данное описание посредством ссылки. В аспекте изобретения, относящемся к способам, PYY-агонист по изобретению, сам по себе или в комбинации с одним или более чем одним другим фармацевтическим агентом, периферически вводят субъекту по отдельности или вместе с любым из традиционных способов периферического введения,известных в данной области техники. Соответственно, PYY-агонист или комбинацию можно вводить субъекту парентерально (например, внутривенно, внутрибрюшинно, внутримышечно или подкожно),интраназально, перорально, сублингвально, трансбуккально, посредством ингаляции (например, в виде аэрозоля), ректально (например, в виде суппозитория) или трансдермально. Парентеральное введение является предпочтительным способом введения, а подкожное введение является предпочтительным способом парентерального введения. Композиции, подходящие для парентеральной инъекции, в общем случае включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для восстановления в стерильных инъекционных растворах или дисперсиях. Примеры подходящих водных и неводных носителей или разбавителей (включая растворители и наполнители) включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и тому подобное), их подходящие смеси, триглицериды, включая растительные масла, такие как оливковое масло, и сложные органические эфиры для инъекций, такие как этилолеат. Эти композиции для парентеральной инъекции также могут содержать такие эксципиенты, как консерванты, увлажняющие, солюбилизирующие, эмульгирующие и диспергирующие агенты. Предотвращение композиций от микробного заражения может быть достигнуто с использованием различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты и тому подобного. Также бывает желательно включать агенты, придающие изотоничность, например, сахара, хлорид натрия и тому подобное. Пролонгированное всасывание фармацевтических композиций для инъекции может быть вызвано посредством применения агентов, обладающих способностью к замедлению всасывания, например, моностеарата алюминия и желатина.PYY-агонисты по настоящему изобретению будут введены субъекту в дозировке, изменяющейся в зависимости от ряда факторов, включая способ введения, возраст и массу субъекта, тяжесть подвергаемого лечению заболевания, состояния или расстройства и фармакологическую активность вводимогоPYY-агониста. Определение диапазона дозировок и оптимальных дозировок для конкретного пациента определяется специалистом обычной квалификации в данной области техники.PYY-агонисты по настоящему изобретению для парентерального введения можно вводить субъекту-человеку с уровнями дозировок в диапазоне от приблизительно 0,01 мкг/кг до приблизительно 10 мг/кг/доза в режиме дозирования из расчета на не-пэгилированный вариант. Например, для 30 К мПЭГмалеимид-(E10C)hPYY3-36 парентеральный уровень дозирования будет находиться в диапазоне от приблизительно 0,01 мкг/кг до приблизительно 10 мг/кг/доза в режиме дозирования из расчета на(E10C)hPYY3-36, предпочтительно в диапазоне от приблизительно 0,05 мг/кг до приблизительно 1,0 мг/кг/доза, или приблизительно от 0,05 или 0,1 мг/кг до приблизительно 1,0 мг/кг/доза, или приблизительно от 0,05 или 0,1 мг/кг до приблизительно 0,3 или 0,5 мг/кг/доза. Например, доза 85 мг 30 К мПЭГмалеимид-(E10C)hPYY3-36, который имеет молекулярную массу приблизительно 34024 Да (30 кДа ПЭГ плюс 4024, молекулярная масса не-пэгилированного пептида), эквивалентна 10 мг из расчета на непэгилированный (E10C)hPYY3-36. Режим дозирования может составлять одну или более доз в сутки,предпочтительно перед приемом пищи, или, в особенности для 30 К мПЭГ-малеимид-(E10C)hPYY3-36 или 20 К мПЭГ-малеимид-(E10C)hPYY3-36, предпочтительным режимом дозирования будет 2 или 3 раза в неделю, или один раз в неделю, или один раз каждые 10-14 суток. Воплощения настоящего изобретения проиллюстрированы следующими далее примерами. Следует понимать, однако, что воплощения по изобретению не ограничиваются конкретными подробностями этих примеров, поскольку специалисту в данной области техники будут известны или очевидны в свете настоящего описания и прилагаемой формулы изобретения и другие их варианты. Все цитируемые в данном описании ссылки включены таким образом посредством ссылки. Примеры Пример 1. Линейный 30 К и 20 К мПЭГ-малеимид-(E10C)hpPYY3-36 В этом примере представлено получение, по существу, гомогенного монопэгилированного(E10C)PYY3-36 синтезировали твердофазным способом, используя Fmoc-стратегию с активацией гексафторфосфатом 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU) (Fastmoc; циклы по 0,15 ммоль), используя автоматический пептидный синтезатор (модель 433 А; Applied Biosystems, Foster City,CA). В качестве защитных групп боковых цепей использовали Trt (тритил, или триметилфенил) для Asn,Gln, Cys и His; tBu (трет-бутил) для Ser, Thr и Tyr; Boc для Lys; OtBu (трет-бутокси) для Asp и Glu; и Pbf для Arg. Отщепление пептида от смолы завершали с использованием смеси 9 мл трифторуксусной кислоты (TFA), 0,5 г фенола, 0,5 мл Н 2 О, 0,5 мл тиоанизола и 0,25 мл 1,2-этандитиола при комнатной температуре в течение 4 ч. Пептид осаждали в охлажденном во льду этиловом эфире и промывали этиловым эфиром, растворяли в DMSO и очищали обращенно-фазовой ВЭЖХ на колонке Waters Deltapak C18, 15 мкм, 100, 50300 мм (внутренний диаметр (ID ( по каталогу WAT011801, Waters, Milford, MA), используя линейный градиент от смеси 100% растворителя А: 0% растворителя В до смеси 70% растворителя А:30% растворителя В в течение 30 мин при скорости потока 80 мл/мин. Растворитель А представляет собой водный 0,1%-ный раствор TFA (трифторуксусная кислота). Растворитель В представляет собой 0,1%-ный раствор TFA в ацетонитриле. Молекулярную массу очищенного пептида подтверждали с использованием ESI-MS (MAvg=4024), а чистоту оценивали по обращенно-фазовой ВЭЖХ (фиг. 1).(б) Получение конюъгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36 Линейный мПЭГ-малеимидный реагент с молекулярной массой (MW) приблизительно 30000 (Sunbright ME-300MA, NOF Corporation, Tokyo, Japan) подвергали избирательному сочетанию с(E10C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 10. Линейный 30 К мПЭГ-малеимид, растворенный в 20 мМ HEPES (Sigma Chemical, St. Louis, MO) pH 7,0 или, альтернативно, в 20 мМ ацетате натрия (Sigma Chemical, St. Louis, MO) pH 4,5, немедленно приводили во взаимодействие с пептидом(Е 10 С)hPYY3-36 путем непосредственного добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(E10C)hPYY3-36 приблизительно 1:1. Реакции проводили в темноте при комнатной температуре в течение 0,5-24 ч. Реакции в HEPES рН 7,0 останавливали разбавлением в 20 мМ ацетате натрия, рН 4,5, для последующей очистки катионообменной хроматографией. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5, наносили непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивали по SEC-ВЭЖХ (фиг. 2).(в) Очистка конъюгата линейный 30 К мПЭГ-малеимид-(E10C)hPYY3-36 Пэгилированные структуры (E10C)hPYY3-36 очищали из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (E10C)hPYY3-36 очищали от немодифицированного (E10C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь линейного 30 К мПЭГ-малеимида и(Е 10C)hPYY3-36 (10 мг белка), которая описана выше, фракционировали на колонке SP-Sepharose Hitrap(5 мл) (Amersham Pharmacia Biotech, GE Healthcare, Piscataway, NJ), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь разбавляли (7 Х) буфером А и наносили на колонку при скорости потока 2,5 мл/мин. Колонку промывали буфером А в объеме, равном 5-10 объемам колонки. После этого из колонки элюировали различные структуры (E10C)hPYY3-36 в объеме, равном 20 объемам- 23011882 колонки, с использованием линейного 0-100 мМ градиента NaCl. Элюат регистрировали по поглощению на 280 нм (А 280) и собирали фракции соответствующего размера. Фракции объединяли по степени пэгилирования, как оценивали по SDS-PAGE (фиг. 3). Очищенный пул затем концентрировали до 0,5-5 мг/мл в концентраторе Centriprep 3 (Amicon Technology Corporation, Northborough, MA) или, альтернативно, используя концентратор Vivaspin 10K (Vivascience Sartorius Group, Hannover, Germany). Концентрацию белка в очищенном пуле определяли путем сравнения площади пика обращенно-фазовой (ОФ) ВЭЖХ со стандартной кривой для PYY3-36 (не показано) или, альтернативно, концентрацию в очищенном пуле определяли по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. С использованием SEC-ВЭЖХ получали профиль очищенного пула пэгилированного(E10C)hPYY3-36, который показан на фиг. 6.(г) Получение конъюгата линейный 20 К мПЭГ-малеимид-(E10C)hPYY3-36 Линейный мПЭГ-малеимидный реагент с MW приблизительно 20000 (Sunbright МЕ-200 МА, NOFCorporation) подвергали избирательному сочетанию с (E10C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 10. Линейный 20 К мПЭГ-малеимид, растворенный в 20 мМ ацетате натрия (SigmaChemical, St. Louis, МО) рН 4,5, непосредственно приводили во взаимодействие с пептидом(E10C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(E10C)hPYY3-36 приблизительно 1,3:1. Реакции проводили в темноте при комнатной температуре в течение 60 мин, затем 16 ч при 4 С. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5, наносили непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивали по SEC-ВЭЖХ.(д) Очистка конъюгата линейный 20 К мПЭГ-малеимид-(E10C)hPYY3-36 Пэгилированные структуры (E10C)hPYY3-36 очищали из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (E10C)hPYY3-36 отделяли от свободного ПЭГ, немодифицированного (E10C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь линейного 20 К мПЭГмалеимида и (E10C)hPYY3-36 (20 мг белка), которая описана выше, фракционировали на колонке SPSepharose Hitrap (5 мл) (Amersham Pharmacia Biotech, GE Healthcare), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь наносили на колонку при скорости потока 1,0 мл/мин. Колонку промывали буфером А в объеме, равном 4 объемам колонки, при скорости потока 2,5 мл/мин. После этого из колонки элюировали различные структуры (E10C)hPYY3-36 в объеме, равном 25 объемам колонки, с использованием линейного 0-200 мМ градиента NaCl при скорости потока 2,5 мл/мин. Элюат регистрировали по поглощению на 280 нм (А 280) и собирали фракции соответствующего размера. Фракции объединяли по степени пэгилирования, как оценивали по SEC-ВЭЖХ. Очищенный пул затем концентрировали до 0,5-5 мг/мл, используя концентратор Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяли по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. Суммарный выход очищенного конъюгата моно-20 К мПЭГмалеимид-(E10C)hPYY3-36 составил 38%. Чистоту конъюгата моно-20 К мПЭГ-малеимид-(E10C)hPYY3-36 в очищенном пуле определили как 96%, используя SEC-ВЭЖХ. Пример 2. Линейный 30 К мПЭГ-малеимид-(D11C)hPYY3-36 Этот пример демонстрирует получение, по существу, гомогенного монопэгилированного(D11C)hPYY3-36 синтезировали твердофазным способом, применяя Fmoc-стратегию с активацией гексафторфосфатом 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU) (Fastmoc; циклы по 0,15 ммоль), используя автоматический пептидный синтезатор (модель 433 А; Applied Biosystems, Foster City,CA). В качестве защитных групп боковых цепей использовали Trt для Asn, Gln, Cys и His; tBu для Ser,Thr и Tyr; Boc для Lys; OtBu для Asp и Glu; и Pbf для Arg. Отщепление пептида от смолы завершали с использованием смеси 9 мл трифторуксусной кислоты (TFA), 0,5 г фенола, 0,5 мл Н 2 О, 0,5 мл тиоанизола и 0,25 мл 1,2-этандитиола при комнатной температуре в течение 4 ч. Пептид осаждали в охлажденном во льду этиловом эфире и промывали этиловым эфиром, растворяли в DMSO и очищали обращеннофазовой ВЭЖХ на колонке Waters Deltapak С 18, 15 мкм, 100, 50300 мм (внутренний диаметр) ( по каталогу WAT011801, Waters, Milford, MA), используя линейный градиент от смеси 100% растворителя А:0% растворителя В до смеси 70% растворителя А:30% растворителя В в течение 30 минут при скорости потока 80 мл/мин. Растворитель А представляет собой водный 0,1%-ный раствор TFA (трифторуксусная кислота). Растворитель В представляет собой 0,1%-ный раствор TFA в ацетонитриле. Молекулярную массу очищенного пептида подтверждали с использованием ESI-MS (MAvg=4038), а чистоту оценивали по обращенно-фазовой ВЭЖХ (фиг. 4).(б) Получение конъюгата линейный 30 К мПЭГ-малеимид-(D11C)hPYY3-36 Линейный мПЭГ-малеимидный реагент с MW приблизительно 30000 (Sunbright МЕ-300 МА, NOFCorporation, Tokyo, Japan) подвергали избирательному сочетанию с (D11C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 11. Линейный 30 К мПЭГ-малеимид, растворенный в 20 мМ HEPES (SigmaChemical, St. Louis, МО) рН 7,0, непосредственно приводили во взаимодействие с пептидом(D11C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(D11C)hPYY3-36 приблизительно 1:1. Реакции проводили в темноте при комнатной температуре в течение 0,5-24 ч. Реакции останавливали разбавлением в 20 мМ ацетате натрия, рН 4,5, для непосредственной очистки катионообменной хроматографией. Продукты реакции оценивали по SEC-ВЭЖХ (фиг. 5). Альтернативно, вместо растворения линейного 30 К мПЭГ-малеимида в HEPES, как описано выше,его растворяют в 20 мМ ацетате натрия (Sigma Chemical, St. Louis, МО), рН 4,5, и непосредственно приводят во взаимодействие с пептидом (D11C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:D11C)hPYY3-36 приблизительно 1:1. Реакции проводят в темноте при комнатной температуре в течение 0,5-24 ч. Реакционные смеси наносят непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивают по SEC-ВЭЖХ.(в) Очистка конъюгата линейный 30 К мПЭГ-малеимид-(D11C)hPYY3-36 Пэгилированные структуры (D11C)hPYY3-36 очищали из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (D11C)hPYY3-36 очищали от немодифицированного (D11C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь линейного 30 К мПЭГ-малеимида и(D11C)hPYY3-36 (10 мг белка), которая описана выше, фракционировали на колонке SP-Sepharose Hitrap(5 мл) (Amersham Pharmacia Biotech, GE Healthcare, Piscataway, NJ), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционные смеси при рН 7,0 разбавляли (7 Х) буфером А и наносили на колонку при скорости потока 2,5 мл/мин. Колонку промывали буфером А в объеме, равном 5-10 объемам колонки. После этого из колонки элюировали различные структуры (D11C)hPYY3-36 в объеме, равном 20 объемам колонки, с использованием линейного 0-100 мМ градиента NaCl. Элюат регистрировали по поглощению на 280 нм (А 280) и собирали фракции соответствующего размера. Фракции объединяли по степени пэгилирования, что оценивали по SEC-ВЭЖХ. Очищенный пул затем концентрировали до 0,5-5 мг/мл в концентраторе Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяли путем сравнения площади пика ОФ-ВЭЖХ со стандартной кривой для PYY3-36 (не показано). С использованием SEC-ВЭЖХ получали профиль очищенного пула пэгилированного(D11C)hPYY3-36, который показан на фиг. 7. Альтернативно, реакционные смеси при рН 4,5 из вышеприведенной стадии (б), наносят непосредственно на колонку при скорости потока 2,5 мл/мин и концентрацию в очищенном пуле определяют по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. Пример 3. Разветвленный 43 К мПЭГ-малеимид-(E10C)hPYY3-36 Этот пример демонстрирует получение по существу гомогенного монопэгилированного(а) Получение конъюгата разветвленный 43 К мПЭГ-малеимид-(E10C)hPYY3-36 Разветвленный мПЭГ-малеимидный реагент с MW приблизительно 43000 (Sunbright GL2-400MA,NOF Corporation, Tokyo, Japan) подвергали избирательному сочетанию с (E10C)hPYY3-36, полученным,как описано в примере 1(а), по сульфгидрильной группе цистеина в остатке 10. Разветвленный 43 К мПЭГ-малеимид, растворенный в 20 мМ HEPES (Sigma Chemical, St. Louis,МО), рН 7,0, непосредственно приводили во взаимодействие с пептидом (E10C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(E10C)hPYY3-36 приблизительно 1:1. Реакции проводили в темноте при комнатной температуре в течение 0,5-24 часов. Реакции в HEPES, рН 7,0, останавливали разбавлением в 20 мМ ацетате натрия, рН 4,5, для немедленной очистки катионообменной хроматографией. Продукты реакции оценивали по SEC-ВЭЖХ (фиг. 8). Альтернативно, разветвленный 43 К мПЭГ-малеимид, растворяют в 20 мМ ацетате натрия (SigmaChemical, St. Louis, МО), рН 4,5, и немедленно приводят во взаимодействие с пептидом (E10C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(E10C)hPYY3-36 приблизительно 1:1. Реакционные смеси наносят непосредственно на колонку для катионообменной хроматографии.(б) Очистка монопэгилированного конъюгата разветвленный 43 К мПЭГ-малеимид-(Е 10C)hP YY3-36 Монопэгилированные структуры разветвленный 43 К мПЭГ-малеимид-(E10C)hPYY3-36 отделяли от немодифицированного (E10C)hPYY3-36 и структур большей молекулярной массы, используя одну стадию катионообменной хроматографии. Типичную реакционную смесь разветвленного 43 К мПЭГ-малеимида и (E10C)hPYY3-36 (10 мг белка), которая описана выше, фракционировали на колонке SP-Sepharose Hitrap(буфер А). Реакционные смеси при рН 7,0 разбавляли (10 Х) буфером А и наносили на колонку при скорости потока 2,5 мл/мин. Колонку промывали буфером А в объеме, равном 5-10 объемам колонки. После этого из колонки элюировали различные структуры (E10C)hPYY3-36 в объеме, равном 20 объемам колонки, с использованием линейного 0-100 мМ градиента NaCl. Элюат регистрировали по поглощению на- 25011882 280 нм (А 280) и собирали фракции соответствующего размера. Фракции объединяли по степени пэгилирования, как оценивали по SEC-ВЭЖХ. Очищенный пул затем концентрировали до 0,5-5 мг/мл в концентраторе Centriprep 3 (Amicon Technology Corporation) или, альтернативно, используя концентраторVivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле рассчитывали количественно по результатам аминокислотного анализа. С использованием SEC-ВЭЖХ получали профиль очищенного пула монопэгилированного конъюгата разветвленный 43 К мПЭГ-малеимид-(E10C)hPYY3-36,который показан на фиг. 9. Альтернативно, концентрацию белка определяют путем сравнения площади пика ОФ-ВЭЖХ со стандартной кривой для PYY3-36 (не показано) или по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. Пример 4. В этом примере рассматривается получение по существу гомогенного монопэгилированного(E10C)hPYY3-36 с использованием линейного мПЭГ (12 кДа) или разветвленного мПЭГ (20 кДа), присоединенного к остатку 10, и получение по существу гомогенного монопэгилированного (D11C)hPYY3-36 с использованием линейного мПЭГ (20 кДа), линейного мПЭГ (12 кДа) или разветвленного мПЭГ (20 кДа), присоединенного к остатку 11.(а) Получение конъюгата линейный 12 К мПЭГ-малеимид-(E10C)hPYY3-36 Линейный мПЭГ-малеимидный реагент с MW приблизительно 12000 (Sunbright МЕ-120 МА, NOFCorporation) подвергают избирательному сочетанию с (E10C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 10. Линейный 12 К мПЭГ-малеимид, растворенный в 20 мМ ацетате натрия (SigmaChemical) pH 4,5, непосредственно приводят во взаимодействие с пептидом (E10C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(E10C)hPYY3-36 приблизительно 1:1. Реакции проводят в темноте при комнатной температуре в течение 0,5-24 ч. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5, наносят непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивают по SEC-ВЭЖХ или(б) Очистка конъюгата линейный 12 К мПЭГ-малеимид-(E10C)hPYY3-36 Пэгилированные структуры (E10 С)hYY3-36 очищают из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (E10C)hPYY3-36 отделяют от свободного ПЭГ, немодифицированного (E10C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь линейного 12 К мПЭГмалеимида и (E10C)hPYY3-36 (10 мг белка), которая описана выше, фракционируют на колонке SPSepharose Hitrap (5 мл) (Amersham Pharmacia Biotech, GE Healthcare), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь наносят на колонку при скорости потока 1,0 мл/мин. Колонку промывают буфером А в объеме, равном 4 объемам колонки, при скорости потока 2,5 мл/мин. После этого из колонки элюируют различные структуры (E10C)hPYY3-36 в объеме, равном 25 объемам колонки, с использованием линейного 0-200 мМ градиента NaCl при скорости потока 2,5 мл/мин. Элюат регистрируют по поглощению на 280 нм (А 280) и собирают фракции соответствующего размера. Фракции объединяют по степени пэгилирования, что оценивают по SEC-ВЭЖХ. Очищенный пул затем концентрируют до 0,5-5 мг/мл, используя концентратор Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяют по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. С использованием SEC-ВЭЖХ или SDS-PAGE получают профиль очищенного пула 12 К мПЭГ-малеимид-(E10C)hPYY3-36.(в) Получение конъюгата разветвленный 20 К мПЭГ-малеимид-(E10C)hPYY3-36 Разветвленный мПЭГ-малеимидный реагент с MW приблизительно 20000 (Sunbright GL2-200MA,NOF Corporation) подвергают избирательному сочетанию с (E10C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 10. Разветвленный 20 К мПЭГ-малеимид, растворенный в 20 мМ ацетате натрия(Sigma Chemical, St. Louis, МО) рН 4,5, непосредственно приводят во взаимодействие с пептидом(E10C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(E10C)hPYY3-36 приблизительно 1:1. Реакции проводят в темноте при комнатной температуре в течение 0,5-24 ч. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5,наносят непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивают по SEC-ВЭЖХ или SDS-PAGE.(г) Очистка конъюгата разветвленный 20 К мПЭГ-малеимид-(E10C)hPYY3-36 Пэгилированные структуры (E10C)hPYY3-36 очищают из реакционной смеси до чистоты 95%,используя одну стадию ионообменной хроматографии. Монопэгилированный (E10C)hPYY3-36 отделяют от свободного ПЭГ, немодифицированного (E10C)hPYY3-36 и структур большей молекулярной массы,используя катионообменную хроматографию. Типичную реакционную смесь разветвленного 20 К мПЭГмалеимида и (E10C)hPYY3-36 (10 мг белка), которая описана выше, фракционируют на колонке SPSepharose Hitrap (5 мл) (Amersham Pharmacia Biotech, GE Healthcare), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь наносят на колонку при скорости потока 1,0 мл/мин. Ко- 26011882 лонку промывают буфером А в объеме, равном 4 объемам колонки, при скорости потока 2,5 мл/мин. После этого из колонки элюируют различные структуры (E10C)hPYY3-36 в объеме, равном 25 объемам колонки, с использованием линейного 0-200 мМ градиента NaCl при скорости потока 2,5 мл/мин. Элюат регистрируют по поглощению на 280 нм (А 280) и собирают фракции соответствующего размера. Фракции объединяют по степени пэгилирования, что оценивают по SEC-ВЭЖХ. Очищенный пул затем концентрируют до 0,5-5 мг/мл, используя концентратор Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяют по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. С использованием SEC-ВЭЖХ или SDS-PAGE получают профиль очищенного пула конъюгата разветвленный 20 К мПЭГ-малеимид-(E10C)hPYY3-36.(д) Получение конъюгата линейный 20 К мПЭГ-малеимид-(D11C)hPYY3-36 Линейный мПЭГ-малеимидный реагент с MW приблизительно 20000 (Sunbright МЕ-200 МА, NOFCorporation) подвергают избирательному сочетанию с (D11C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 11. Линейный 20 К мПЭГ-малеимид, растворенный в 20 мМ ацетате натрия (SigmaChemical) pH 4,5, непосредственно приводят во взаимодействие с пептидом (D11C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(D11C)hPYY3-36 приблизительно 1:1. Реакции проводят в темноте при комнатной температуре в течение 0,5-24 ч. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5, наносят непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивали по SEC-ВЭЖХ или(е) Очистка конъюгата линейный 20 К мПЭГ-малеимид-(D11 С)hPYY3-36 Пэгилированные структуры (D11C)hPYY3-36 очищают из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (D11C)hPYY3-36 отделяют от свободного ПЭГ, немодифицированного (D11C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь линейного 20 К мПЭГмалеимида и (D11C)hPYY3-36 (10 мг белка), которая описана выше, фракционируют на колонке SPSepharose Hitrap (5 мл) (Amersham Pharmacia Biotech, GE Healthcare), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь наносят на колонку при скорости потока 1,0 мл/мин. Колонку промывают буфером А в объеме, равном 4 объемам колонки, при скорости потока 2,5 мл/мин. После этого из колонки элюируют различные структуры (D11C)hPYY3-36 в объеме, равном 25 объемам колонки, с использованием линейного 0-200 мМ градиента NaCl при скорости потока 2,5 мл/мин. Элюат регистрируют по поглощению на 280 нм (A280) и собирают фракции соответствующего размера. Фракции объединяют по степени пэгилирования, что оценивают по SEC-ВЭЖХ. Очищенный пул затем концентрируют до 0,5-5 мг/мл, используя концентратор Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяют по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. С использованием SEC-ВЭЖХ или SDS-PAGE получают профиль очищенного пула 20 К мПЭГ-малеимид-(D11C)hPYY3-36.(ж) Получение конъюгата линейный 12 К мПЭГ-малеимид-(D11C)hPYY3-36 Линейный мПЭГ-малеимидный реагент с MW приблизительно 12000 (Sunbright МЕ-120 МА, NOFCorporation) подвергают избирательному сочетанию с (D11C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 10. Линейный 12 К мПЭГ-малеимид, растворенный в 20 мМ ацетате натрия (SigmaChemical, St. Louis, МО) рН 4,5, непосредственно приводят во взаимодействие с пептидом (D11C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(D11C)hPYY3-36 приблизительно 1:1. Реакции проводят в темноте при комнатной температуре в течение 0,5-24 ч. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5, наносят непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивают по SECВЭЖХ или SDS-PAGE.(з) Очистка конъюгата линейный 12 К мПЭГ-малеимид-(D11C)hPYY3-36 Пэгилированные структуры (D11C)hPYY3-36 очищают из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (D11C)hPYY3-36 отделяют от свободного ПЭГ, немодифицированного (D11C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь линейного 12 К мПЭГ-малеимида и(D11C)hPYY3-36 (10 мг белка), которая описана выше, фракционируют на колонке SP-Sepharose Hitrap (5 мл) (Amersham Pharmacia Biotech, GE Healthcare), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь наносят на колонку при скорости потока 1,0 мл/мин. Колонку промывают буфером А в объеме, равном 4 объемам колонки, при скорости потока 2,5 мл/мин. После этого из колонки элюируют различные структуры (D11C)hPYY3-36 в объеме, равном 25 объемам колонки, с использованием линейного 0-200 мМ градиента NaCl при скорости потока 2,5 мл/мин. Элюат регистрируют по поглощению на 280 нм(А 280) и собирают фракции соответствующего размера. Фракции объединяют по степени пэгилирования,что оценивают по SEC-ВЭЖХ. Очищенный пул затем концентрируют до 0,5-5 мг/мл, используя концентратор Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяют по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. С использованием SEC-ВЭЖХ или SDS-PAGE получают профиль очищенного пула 12 К мПЭГ-малеимид-(D11C)hPYY3-36.(и) Получение конъюгата разветвленный 20 К мПЭГ-малеимид-(D11C)hPYY3-36 Разветвленный мПЭГ-малеимидный реагент с MW приблизительно 20000 (Sunbright GL2-200MA,NOF Corporation) подвергают избирательному сочетанию с (D11C)hPYY3-36 по сульфгидрильной группе цистеина в остатке 10. Разветвленный 20 К мПЭГ-малеимид, растворенный в 20 мМ ацетате натрия(Sigma Chemical, St. Louis, МО) рН 4,5, непосредственно приводят во взаимодействие с пептидом(D11C)hPYY3-36 путем прямого добавления пептида с получением концентрации пептида 1 мг/мл и относительного молярного соотношения мПЭГ:(D11C)hPYY3-36 приблизительно 1:1. Реакции проводят в темноте при комнатной температуре в течение 0,5-24 ч. Реакционные смеси в 20 мМ ацетате натрия, рН 4,5,наносят непосредственно на колонку для катионообменной хроматографии. Продукты реакции оценивают по SEC-ВЭЖХ или SDS-PAGE.(к) Очистка конъюгата разветвленный 20 К мПЭГ-малеимид-(D11C)hPYY3-36 Пэгилированные структуры (D11C)hPYY3-36 очищают из реакционной смеси до чистоты 95%, используя одну стадию ионообменной хроматографии. Монопэгилированный (D11C)hPYY3-36 отделяют от свободного ПЭГ, немодифицированного (D11C)hPYY3-36 и структур большей молекулярной массы, используя катионообменную хроматографию. Типичную реакционную смесь разветвленного 20 К мПЭГмалеимида и (D11C)hPYY3-36 (10 мг белка), которая описана выше, фракционируют на колонке SPSepharose Hitrap (5 мл) (Amersham Pharmacia Biotech. GE Healthcare), уравновешенной 20 мМ ацетатом натрия, рН 4,5 (буфер А). Реакционную смесь наносят на колонку при скорости потока 1,0 мл/мин. Колонку промывают буфером А в объеме, равном 4 объемам колонки, при скорости потока 2,5 мл/мин. После этого из колонки элюируют различные структуры (D11C)hPYY3-36 в объеме, равном 25 объемам колонки, с использованием линейного 0-200 мМ градиента NaCl при скорости потока 2,5 мл/мин. Элюат регистрируют по поглощению на 280 нм (А 280) и собирают фракции соответствующего размера. Фракции объединяют по степени пэгилирования, как оценивают по SEC-ВЭЖХ. Очищенный пул затем концентрируют до 0,5-5 мг/мл, используя концентратор Vivaspin 10K (Vivascience Sartorius Group). Концентрацию белка в очищенном пуле определяют по поглощению на 280 нм, используя экспериментально полученный коэффициент экстинкции. С использованием SEC-ВЭЖХ или SDS-PAGE получают профиль очищенного пула конъюгата разветвленный 20 К мПЭГ-малеимид-(D11C)hPYY3-36. Пример 5. Определение биохимических характеристик(E10C)hPYY3-36, (D11C)hPYY3-36 и пэгилированные формы (E10C)hPYY3-36 и (D11C)hPYY3-36 охарактеризовывали различными биохимическими методами, включая масс-спектрометрию с ионизацией электрораспылением (ESI-MS), SDS-PAGE и SEC-ВЭЖХ и ОФ-ВЭЖХ, соответственно.(А) Масс-спектрометрию с ионизацией электрораспылением (ESI-MS) осуществляли на LC/MSD электрораспылительном масс-спектрометре серии 1100 (Agilent Technologies, Palo Alto, CA) в режиме положительно заряженных ионов (пример 1(а), 2(а.(Б) Для анализа пептида (E10C)hPYY3-36 (фиг. 1 и 4) проводили обращенно-фазовую хроматографию на колонке ZORBAX Eclipse XDB-C8, 4,6 х 150 мм, 5 мм ( по каталогу 993967-906, Agilent Technologies, Palo Alto, CA), используя линейный градиент от смеси 100% растворителя А и 0% растворителя В до смеси 95% растворителя А и 5% растворителя В в течение 3 мин, затем от смеси 95% растворителя А и 5% растворителя В до смеси 50% растворителя А и 50% растворителя В в течение 12 мин при скорости 1,5 мл/мин (пример 1(а. Растворителем А является водный 0,1%-ный раствор TFA. Растворителем В является 0,1%-ный раствор TFA в ацетонитриле. Обращенно-фазовую хроматографию для количественного определения пэгилированных(E10C)hPYY3-36 и (D11C)PYY3-36 (не показано) проводили на колонке Vydac C18 (2,1250 мм) ( по каталогу 218MS552, Vydac, Hesperia, CA), используя линейный градиент от смеси 80% растворителя А и 20% растворителя В до смеси 40% растворителя А и 60% растворителя В в течение 48 мин при скорости потока 0,2 мл/мин (пример 1(в), 2(в. Растворителем А является водный 0,1%-ный раствор TFA. Растворителем В является 0,085%-ный раствор TFA в ацетонитриле.(В) Эксклюзионная высокоэффективная жидкостная хроматография (SEC-ВЭЖХ) Реакционные смеси линейного 30 К или разветвленного 43 К мПЭГ либо с (E10C)hPYY3-36; либо с(D11C)hPYY3-36, пулы после их катионообменной очистки и конечные очищенные продукты оценивали,используя SEC-ВЭЖХ в неденатурирующих условиях (пример 1(6) и (в), 2(6) и (в. Аналитическую(Tosohaas) в 20 мМ фосфате рН 7,4, 150 мМ NaCl, при скорости потока 1,0 мл/мин (возможно Superdex 200, 7,8 мм 30 см, Amersham Bioscience, Piscataway, NJ). Пэгилирование значительно увеличивает гидродинамический объем белка, приводя к сдвигу в сторону более раннего времени удерживания. В реакционных смесях 30 К мПЭГ-малеимид плюс (E10C)hPYY3-36 наблюдали небольшой пик, соответствующий оставшемуся немодифицированным (E10C)hPYY3-36, а также новые пики, соответствующие пэгилированным структурам пептида (фиг. 2). Новые структуры наблюдали в реакционных смесях 30 К мПЭГ и(D11C)hPYY3-36 и разветвленный 43 К мПЭГ и (E10C)hPYY3-36 с очень небольшим количеством оставшегося немодифицированым (D11C)hPYY3-36 или (E10C)hPYY3-36 (фиг. 5 и 8). Эти пэгилированные и непэгилированные структуры фракционировали хроматографией на SP-Sepharose, и после этого было пока- 28011882 зано, что полученные очищенные структуры моно-мПЭГ-(E10C)hPYY3-36 и моно-мПЭГ-(D11C)hPYY3-36 элюировались в виде одного пика с чистотой 95% при проведении SEC в неденатурирующих условиях(фиг. 6, 7 и 9). Стадией хроматографии на SP-Sepharose эффективно отделяли свободные мПЭГ,(E10C)hPYY3-36 или (D11C)hPYY3-36 и структуры большей молекулярной массы от монопэгилированных конъюгатов линейный 30 К и разветвленный 43 К мПЭГ-(E10C)hPYY3-36 или мПЭГ-(D11C)hPYY3-36.SDS-PAGE (пример 1(в также использовали для оценки реакции фракций после катионообменной очистки (фиг. 3) и конечных очищенных продуктов. SDS-PAGE проводили на гелях 10-NuPAGE толщиной 1 мм (Invitrogen, Carlsbad, CA) в восстанавливающих и не восстанавливающих условиях и окрашивали, используя окрашивающий набор Novex Colloidal Coomassie G-250 (Invitrogen, Carlsbad, CA). Биологические анализы Полезность PYY-агонистов по настоящему изобретению в качестве фармацевтически активных агентов в уменьшении прироста массы и лечении ожирения у млекопитающих (в особенности, людей) можно продемонстрировать по активности агонистов в традиционных анализах и в анализах in vitro и invivo, описанных ниже. Кроме того, в таких анализах предложены средства, с помощью которых активности настоящих PYY-агонистов можно сравнивать с активностями известных соединений. Исследования потребления пищи (FI) Анализ в условиях возобновления питания после голодания: самцов мышей C57BL/6J (The JacksonLaboratory, Bar Harbor, ME) размещали по 2 на клетку. Их содержали в условиях 12:12-часового цикла чередования света и темноты (включение освещения в 5:00 утра, выключение освещения в 5:00 вечера),кормили гранулированным кормом для грызунов RMH3000 Purina (Research Diets, Inc., New Brunswick,NJ), а воду предоставляли без ограничений. Мышей получали в возрасте 7-8 недель и давали возможность акклиматизироваться как минимум в течение 10 суток до проведения исследования. На день проведения исследования возраст мышей составлял 9-12 недель. За сутки до начала исследования мышей помещали в клетки со свежей подстилкой, не давая никакой пищи, но с предоставлением свободного доступа к воде. Их не кормили в течение вечера и ночи (20-24 ч). В день исследования мышам посредством IP инъекции вводили дозу (объем дозы составляет 5 мл/кг), возвращали в свою клетку и в клетку незамедлительно помещали предварительно взвешенный корм. В качестве растворителя для дозирования использовали 20 мМ Na-ацетат, рН 4,5, 50 мМ NaCl, и дозу брали из расчета на активную PYYсоставляющую без учета пэгилирования. Растворитель в качестве контроля, нативный PYY, 30 К мПЭГмалеимид-(E10C)hPYY3-36 и 43 К мПЭГ-малеимид-(E10C)hPYY3-36 тестировали в трех дозах (0,1 мг/кг; 0,3 мг/кг и 1,0 мг/кг). Корм повторно взвешивали через 2, 4, 6 и 24 ч после дозирования. Подстилку проверяли на проливание, ее взвешивали и включали в расчеты. Кумулятивное потребление пищи рассчитывали,вычитая вес корма для каждого момента времени из исходного веса корма. Процент (%) ингибирования рассчитывали как (FIобраб-FIраств)/FIраств 100. На фиг. 10 показано 6-часовое кумулятивное потребление после IP инъекции трех доз нативногоPYY3-36 (фиг. 10 А) и 30 К мПЭГ-малеимид-(Е 10C)hPYY3-36 (фиг. 10 В). Как нативный PYY3-36, так и 30 К мПЭГ-малеимид-(E10C)hPYY3-36 демонстрировали дозозависимое уменьшение кумулятивного потребления пищи в течение 6-часового курса. 43 К мПЭГ-малеимид-(E10C)hPYY3-36 также вызывал дозозависимое уменьшение кумулятивного потребления пищи в течение 6 часов (фиг. 11 А) и 24 ч (фиг. 11 В). Однако влияние 43 К мПЭГ-малеимид(E10C)hPYY3-36 на снижение кумулятивного потребления пищи не было столь велико, как было продемонстрировано с использованием 30 К мПЭГ-малеимид-(E10C)hPYY3-36 в той же дозе (0,1 мг/кг) как после 6 ч, так и после 24 ч. Кроме того, сравнивали эффекты 30 К мПЭГ-малеимид-(Е 10C)hPYY3-36 на возобновление кормления после голодания вслед за инъекцией 0,1 мг/кг (SC) с эффектами 30 К мПЭГ-малеимид-(D11C)hPYY3-36. Несмотря на то,что конъюгат 30 К мПЭГ-малеимида с полипептидом (D11C)hPYY3-36 вызывал снижение кумулятивного потребления пищи (FI) в течение периода времени 24 ч, как показано ниже в таблице, этот эффект не был столь значительным по сравнению с наблюдаемым для 30 К мПЭГ-малеимид-(E10C)11PYY3-36.- 29011882 Эффекты конъюгата линейный 20 К мПЭГ-малеимид-(Е 10C)hPYY3-36 сравнивали с эффектами 30 К мПЭГ-малеимид-(E10C)hPYY3-36 (оба из примера 1). Результаты одного исследования, в котором самцов мышей инъецировали дозой 0,1 мг/кг (IP), показаны ниже в таблице.% изменения в кумулятивном потреблении пищи по сравнению с обработкой растворителем Аналогично, результаты второго исследования, в котором сравниваются эффекты на прием пищи конъюгатов линейный 20 К мПЭГ-малеимид-(Е 10C)hPYY3-36 и 30 К мПЭГ-малеимид-(E10C)hPYY3-36 после дозы 0,1 мг/кг (SC), показаны ниже в таблице.% изменения в кумулятивном потреблении пищи по сравнению с обработкой растворителем Анализ на спонтанное потребление пищи: самцов мышей C57BL/6J (The Jackson Laboratory) размещали индивидуально и оставляли в течение 2 недель для акклиматизации перед проведением исследования. Их содержали в условиях 12:12-часового цикла чередования света и темноты, кормили порошкообразным кормом для грызунов без ограничений и предоставляли свободный доступ к воде. За день до дозирования мышей помещали в камеры для (тестирования) потребления пищи и оставляли в течение 1 суток для акклиматизации. На следующие сутки мышам вводили дозу IP или подкожной (SC) инъекцией непосредственно перед выключением света (4:00 вечера). Потребление пищи непрерывно регистрировали с 10-минутными интервалами в течение всего периода времени и ежедневно осуществляли измерение массы тела. Показаны результаты для IP инъекции нативного PYY3-36 и конъюгата 30 К мПЭГ-малеимид(E10C)hPYY3-36 (фиг. 12) и для SC инъекции нативного PYY3-36 и конъюгата 30 К ПЭГ-малеимид(E10C)hPYY3-36 (фиг. 13). Несмотря на то, что как нативный PYY3-36, так и конъюгат 30 К мПЭГмалеимид-(Е 10C)hPYY3-36 сразу же давали уменьшение в кумулятивном потреблении пищи по сравнению с обработанными растворителем мышами, эффект уменьшения потребления пищи, вызванный конъюгатом 30 К мПЭГ-малеимид-(E10C)hPYY3-36, был намного более продолжительным, чем эффект,вызванный нативным PYY3-36. В сочетании с более продолжительным эффектом на потребление пищи конъюгат 30 К мПЭГ-малеимид-(E10C)hPYY3-36 также демонстрировал пролонгированную экспозицию в плазме после разовой инъекции (0,1 мг/кг, IP) (фиг. 14). В то время как для нативного PYY3-36 скорость клиренса составляла 16 мл/мин/кг и Cmax 38 нМ, для конъюгата 30 К мПЭГ-малеимид-(E10C)hPYY3-36 скорость клиренса составляла 0,2 мл/мин/кг и Cmax 267 нМ. Величины PYY в плазме мышей измеряли с использованием набора для радиоиммуноанализа hPYY (Linco Research, Inc., St. Louis, MO). Анализ с использованием мини-насосов на мышах ob/ob (линия с генетическим ожирением): самцов мышей ob/ob (The Jackson Laboratory) возрастом 8-9 недель (n=26) кормили нормальным кормом для грызунов и им имплантировали на срок 14 суток осмотические мини-насосы (Alza Corp., Mountain View,CA), с помощью которых вводили либо растворитель (физиологический раствор), либо PYY3-36 (0,1 мг/кг/сутки), либо конъюгат 30 К мПЭГ-малеимид-(E10C)hPYY3-36 (0,03 мг/кг/сутки). Взвешивание корма и определение массы тела проводили каждые сутки. Состав жировой массы тела определяли на сутки 0 и сутки 13. В конце исследования отбирали образцы крови. Не было обнаружено никаких значительных различий в потреблении пищи, массе тела или составе жировой массы тела для этих групп. По окончании исследования определяли PYY в плазме с использованием радиоиммуноанализа, как описано ранее. В группе, обработанной нативным PYY3-36, уровни PYY в плазме составляли 152 нг/мл; в группе, обработанной конъюгатом 30 К мПЭГ-малеимид-(E10C)hPYY3-36, уровни PYY в плазме составляли 13222 нг/мл. Исследования по связыванию in vitro SPA для связывания лигандов В SPA для связывания лигандов измеряют конкурентное вытеснение меченого радиоактивной меткой PYY из Y2-рецепторов и используют микросферы, содержащие сцинтилляционное вещество (SPAгранулы), покрытое лектиновым агглютинином пшеничного зародыша (WGA), полученным от Amersham Biosciences ( по каталогу RPNQ 0085). Суспензии клеток нейробластомы человека KAN-TS, экспрессирующих Y2-рецепторы на своей поверхности (Fuhlendorf et al., Proc. Natl. Acad. Sci. USA, 87: 182186, 1990), готовили, используя буфер для сбора клеток, составленный из 50 мМ HEPES-буфера (рН 7,4),145 мМ NaCl, 2,5 мМ СаС 12, 1 мМ MgCl2, 10 мМ глюкозы, 0,1% BSA, 5% DMSO и протеазных ингиби- 30
МПК / Метки
МПК: C07K 14/575, A61K 47/48, A61K 38/22
Метки: применение, агонисты
Код ссылки
<a href="https://eas.patents.su/30-11882-pyy-agonisty-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Pyy – агонисты и их применение</a>
Предыдущий патент: Лиофилизация виросом
Следующий патент: Комбинированная терапия для лечения диабета и родственных ему состояний и для лечения состояний, улучшаемых увеличением уровня glp-1 крови
Случайный патент: Система очистки воды и способ очистки воды












