Протеиновые гидролизаты, снижающие давление крови
Номер патента: 11865
Опубликовано: 30.06.2009
Авторы: Рос Де Андре Леонардус, Эденс Люппо, Хувен Ван Дер Робертус Антониус Мийндерт, Ден Филиппус Антониус
Формула / Реферат
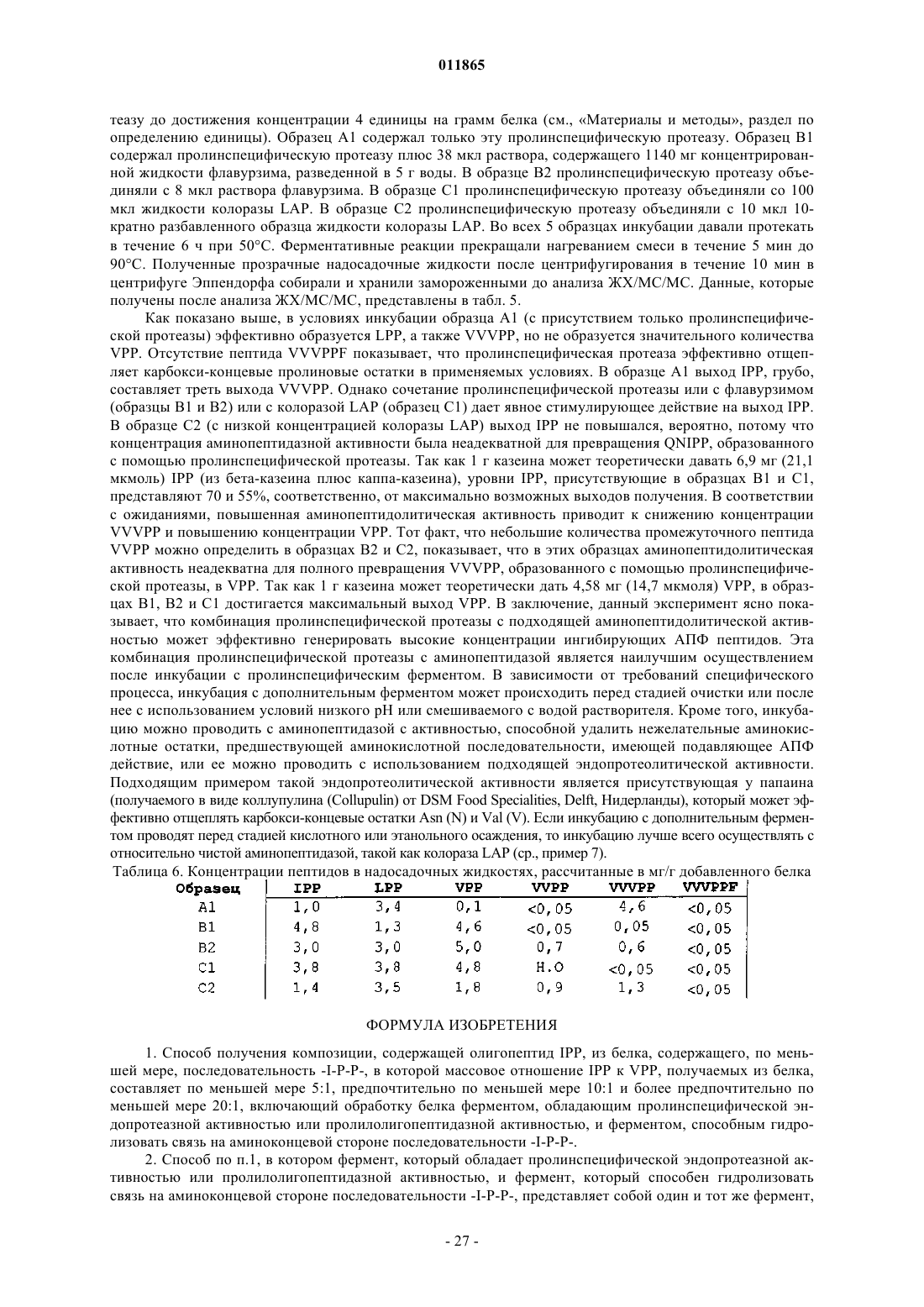
1. Способ получения композиции, содержащей олигопептид IPP, из белка, содержащего, по меньшей мере, последовательность -I-P-P-, в которой массовое отношение IPP к VPP, получаемых из белка, составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1 и более предпочтительно по меньшей мере 20:1, включающий обработку белка ферментом, обладающим пролинспецифической эндопротеазной активностью или пролилолигопептидазной активностью, и ферментом, способным гидролизовать связь на аминоконцевой стороне последовательности -I-P-P-.
2. Способ по п.1, в котором фермент, который обладает пролинспецифической эндопротеазной активностью или пролилолигопептидазной активностью, и фермент, который способен гидролизовать связь на аминоконцевой стороне последовательности -I-Р-Р-, представляет собой один и тот же фермент, и предпочтительно этот фермент является пролинспецифической эндопротеазой или пролилолигопептидазой, более предпочтительно этот фермент является пролинспецифической эндопротеазой.
3. Способ по любому из пп.1-2, где пролинспецифическая эндопротеаза не обладает аминопептидазной активностью и/или карбоксипептидазной активностью.
4. Способ по пп.1 и 2, где время инкубации составляет менее 24 ч, предпочтительно менее 10 и более предпочтительно менее 4 ч.
5. Способ по любому из предшествующих пунктов, где температура инкубации составляет выше 30шС, предпочтительно выше 40шС и более предпочтительно выше 50шС.
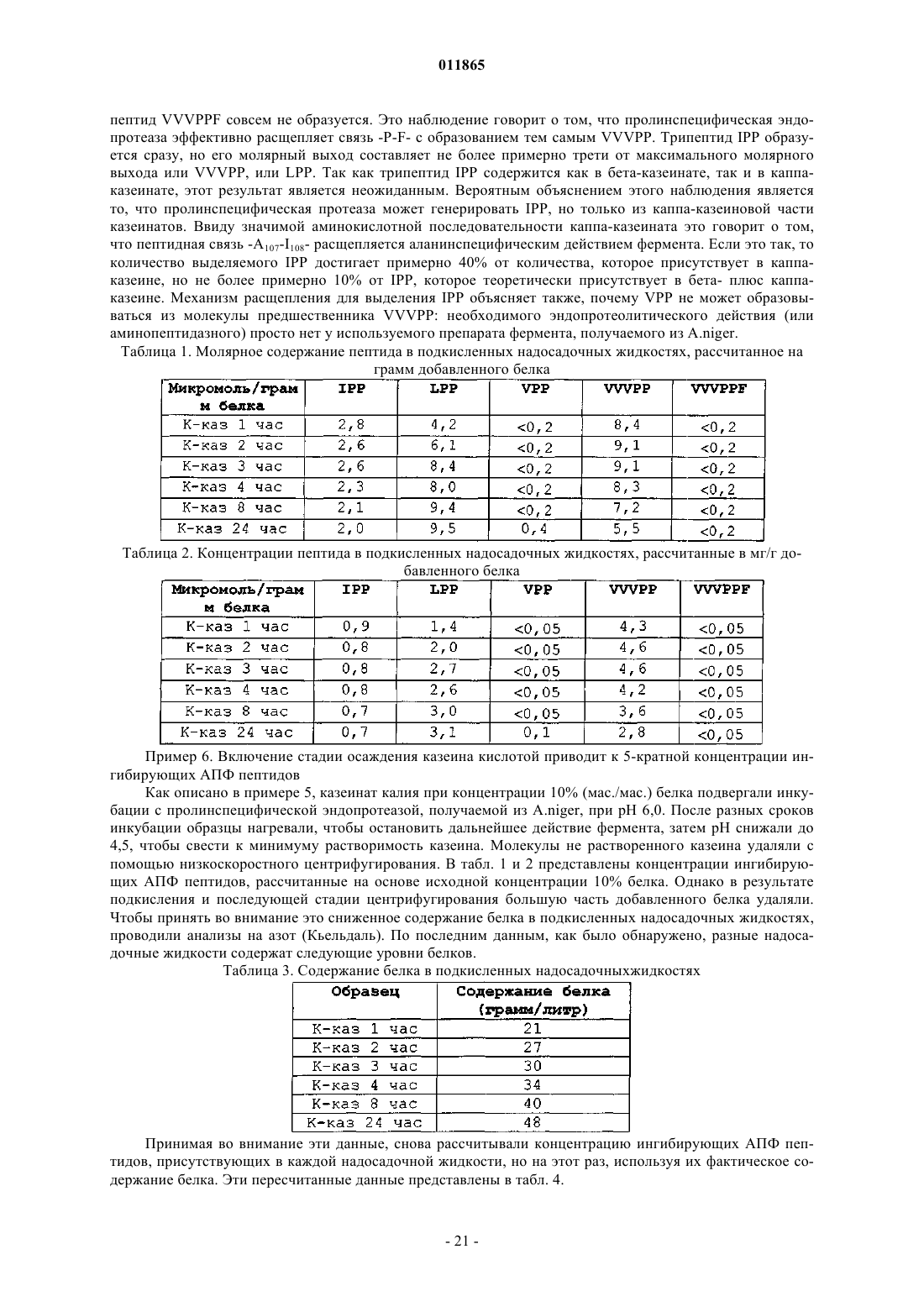
6. Способ по любому из предшествующих пунктов, где продуцируется также и LPP.
7. Способ по любому из предшествующих пунктов, где используют белок молока, предпочтительно казеин.
8. Способ по п.7, где последовательность -A-I-P-P- и/или -P-I-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 30% в пептид IPP.
9. Способ по п.6, где последовательность -P-L-P-P- и/или -A-L-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 40% в пептид LPP.
10. Способ по п.1, дополнительно включающий отделение нерастворимой части гидролизованного белка от растворимой части в условиях кислого рН, предпочтительно при рН от 3,5 до 6 с получением в результате композиции, содержащей растворимые пептиды, включая IPP, и в которой массовое отношение IPP к VPP составляет по меньшей мере 5:1.
11. Способ получения композиции, которая содержит растворимые пептиды, предпочтительно IPP, где способ включает изменение рН композиции, которая продуцируется при гидролизе подходящего источника белка и предпочтительно продуцируется способом по любому из пп.1-9, до рН, при котором часть гидролизованного белка становится нерастворимой, и отделение нерастворенной части от растворенных пептидов с получением в результате композиции, содержащей растворимые пептиды.
12. Композиция, содержащая растворимые пептиды, включая IPP, и в которой массовое отношение IPP к VPP составляет по меньшей мере 5:1, где по меньшей мере 70 мас.%, предпочтительно по меньшей мере 80 мас.% и наиболее предпочтительно по меньшей мере 90 мас.% пептидов растворимо при рН от 3,5 до 6, предпочтительно при рН от 4 до 5, причем ни один пептид из растворимых пептидов не присутствует в количестве более 40 мас.% от растворимых пептидов, предпочтительно ни один пептид из растворимых пептидов не присутствует в количестве более 30 мас.% от растворимых пептидов и наиболее предпочтительно ни один пептид из растворимых пептидов не присутствует в количестве более 20 мас.% от растворимых пептидов, и где композиция получена способом по п.1.
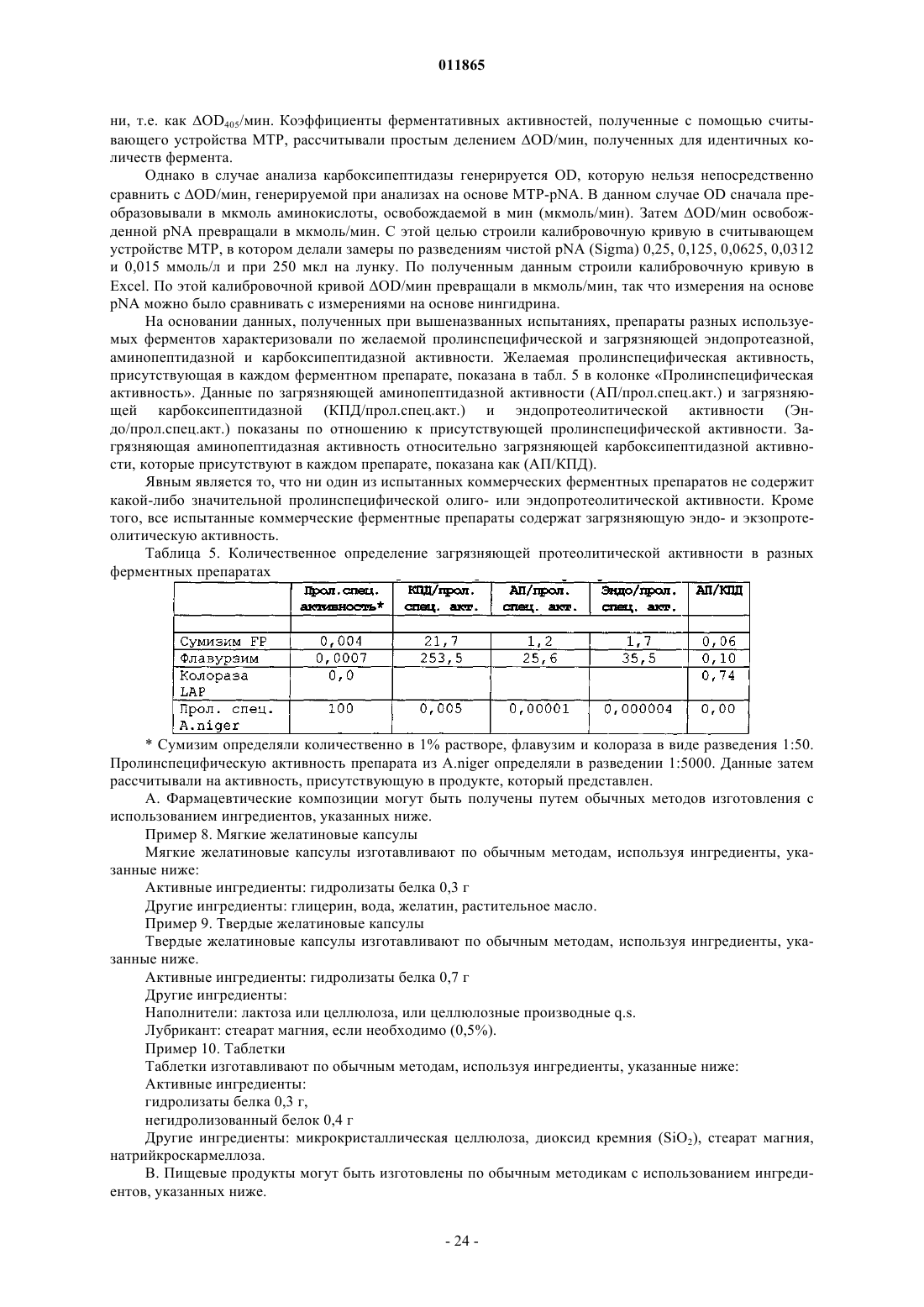
13. Применение пролинспецифической эндопротеазы для получения IPP из белка, где продуцируется по меньшей мере в 5 раз (мас.) больше IPP, чем VPP.
14. Композиция, продуцируемая путем гидролиза белка, содержащая IPP, где массовое отношение IPP к VPP в данной композиции составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1 и более предпочтительно по меньшей мере 20:1.
15. Композиция по п.14, которая дополнительно содержит LPP.
16. Композиция по п.14 или 15 в качестве нутрицевтика предпочтительно лекарственного средства.
17. Композиция по любому из пп.12-16, которую получают способом по любому из пп.1-11.
18. Применение композиции по любому из пп.12 и 14-17 или композиции, получаемой по любому из пп.1-11 в качестве нутрицевтика предпочтительно лекарственного средства, для производства нутрицевтика предпочтительно лекарственного средства, для улучшения здоровья или профилактики и/или лечения заболеваний, или для производства нутрицевтика предпочтительно лекарственного средства для лечения или профилактики таких заболеваний, как высокое давление крови (гипертензия), сердечная недостаточность, преддиабет или диабет, ожирение, сниженная толерантность к глюкозе или стресс.
19. Применение по п.18, где композиция находится в форме диетической добавки, в форме средств для индивидуального применения, включая местное применение в форме лосьона, геля или эмульсии, или в виде пищевого продукта, корма или ингредиента корма.
20. Применение композиции по любому из пп.12 и 14-17 для производства функционального пищевого продукта для профилактики ожирения или для контроля массы тела.
21. Применение композиции по любому из пп.12 и 14-17 для производства функционального пищевого продукта для поддержания здоровья сердечно-сосудистой системы.
22. Применение по п.21, где поддержание здоровья сердечно-сосудистой системы включает ингибирование ангиотензинпревращающего фермента.
23. Применение по п.21, где поддержание здоровья сердечно-сосудистой системы включает регуляцию уровня холестерина крови.
24. Функциональный пищевой продукт, способный оказывать полезное действие на здоровье потребителя, где указанное полезное действие выбрано из профилактики ожирения, контроля массы тела и поддержания здоровья сердечно-сосудистой системы, и включающий композицию по любому из пп.12 и 14-17.
25. Функциональный пищевой продукт по п.24, где полезное действие на поддержание здоровья сердечно-сосудистой системы включает ингибирование ангиотензинпревращающего фермента и/или регуляцию уровней холестерина в крови.
26. Функциональный пищевой продукт по любому из пп.24 или 25, содержащий 50-200 ммоль/кг K+, и/или 15-60 ммоль/кг Са2+, и/или 6-25 ммоль/кг Mg2+.
27. Функциональный пищевой продукт по п.26, содержащий 110-135 ммоль/кг K+, и/или 35-45 ммоль/кг Са2+, и/или 13-20 ммоль/кг Mg2+.
28. Функциональный пищевой продукт по любому из пп.24-27, содержащий один или несколько В-витаминов.
29. Функциональный пищевой продукт по п.26, содержащий фолиевую кислоту, витамин В6 и витамин В12.
30. Функциональный пищевой продукт по любому из пп.24-29, содержащий от 3 до 25 мас.% стерина, более предпочтительно от 7 до 15 мас.% стерина.
31. Способ получения пищевого продукта, напитка или диетической добавки, включающий:
(а) получение композиции, которая содержит IPP, по любому из пп.1-9 и
(b) включение указанной композиции, содержащей IPP, в пищевой продукт, напиток или диетическую добавку.
32. Способ по п.31, где на стадии а) используют белок молока, предпочтительно казеин.
33. Способ по п.32, где на стадии а) последовательность -A-I-P-P- или -P-I-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 10%, более предпочтительно по меньшей мере на 30% в пептид IPP.
34. Способ по п.32, где на стадии а) последовательность -P-L-P-P- или -A-L-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 10%, более предпочтительно по меньшей мере на 40% в пептид LPP.
35. Способ по п.31, включающий также стадию с) очистки пептидов от гидролизованного белка, предпочтительно гидролизованного не аспартиловой протеазой, более предпочтительно сериновой протеазой, где гидролизованный белок способен осаждаться в условиях выбранного рН, которая включает изменение рН до рН, при котором гидролизованный белок осаждается, ш отделения осажденных белков от гидролизованного белка.
36. Способ по п.35, где стадия с) имеет место после стадии а) и перед стадией b).
37. Способ по п.31, где пищевой продукт, напиток или диетическую добавку выбирают из группы маргаринов, паст, масла, молочных продуктов или содержащих сыворотку напитков, предпочтительно продуктов на основе йогурта или молока, таких как йогурт или молоко.
38. Пищевой продукт, напиток или диетическая добавка, получаемые способом по одному или нескольким из пп.31-37.
39. Пищевой продукт, напиток или диетическая добавка по п.38, содержащие от 0,05 до 10 мас.%, более предпочтительно от 0,1 до 5 мас.%, наиболее предпочтительно от 0,2 до 4 мас.% указанной композиции, содержащей IPP.
40. Пищевой продукт, напиток или диетическая добавка по п.38 или 39, содержащие на 100 г продукта от 0,05 до 50 мг IPP, более предпочтительно от 0,1 до 40 мг, наиболее предпочтительно от 0,2 до 30 мг.
41. Пищевой продукт, напиток или диетическая добавка по одному или нескольким из пп.38-40, где массовое отношение IPP к VPP составляет от 5:1 до 100:1, более предпочтительно от 5:1 до 48:1.
42. Пищевой продукт, напиток или диетическая добавка по одному или нескольким из пп.38-41, где массовое отношение IPP к LPP составляет от 1:10 до 1:1, более предпочтительно от 1,5:7,1 до 4,8:7,1.
43. Пищевой продукт, напиток или диетическая добавка по одному или нескольким из пп.38-42 для применения для облегчения гипертензии у людей.
Текст
011865 Область техники, к которой относится изобретение Данное изобретение относится к продукции IPP. Предпосылки создания изобретения Гипертензия является относительно распространенным болезненным состоянием у людей и представляет преобладающий фактор риска в отношении сердечно-сосудистых заболеваний, почечной недостаточности и инсульта. Наличие большого набора фармацевтических продуктов, таких как блокаторы кальциевых каналов, бета-блокаторы, диуретики, альфа-блокаторы, центральные альфа-антагонисты,антагонисты ангиотензина II и ингибиторы АПФ, показывает, что физиологические механизмы, лежащие в основе гипертензии, многогранны. Из физиологических механизмов гипертензии особенно много внимания в научных исследованиях получил ренин-ангиотензивный механизм. По этому механизму ангиотензин секретируется печенью и расщепляется пептидазой ренина с получением биологически неактивного декапептида ангиотензина I. Когда ангиотензин I проходит через капилляры легких, другая пептидаза, называемая ангиотензин превращающим ферментом (здесь и далее называемая АПФ) действует на ангиотензин I путем удаления двух последних остатков ангиотензина I (His-Leu) с образованием октапептида ангиотензина II. Октапептид ангиотензин II проявляет сильное сосудосуживающее действие, и поэтому повышает кровяное давление. Ингибирование АПФ, приводящее к низким уровням ангиотензина II, предотвращает сужение сосудов и, таким образом, высокое давление крови. Кроме расщепления ангиотензина I, АПФ может также гидролизовать брадикинин, нонапептид,также участвующий в регуляции давления крови. По последнему механизму ингибирование АПФ приводит к повышенным уровням брадикинина, которые способствуют расширению кровеносных сосудов, а также снижают давление крови. Ингибирование АПФ, таким образом, приводит к снижающим давление крови эффектам путем по меньшей мере двух отдельных механизмов. Известно также, что октапептид ангиотензин II стимулирует выделение альдостерона корой надпочечников. Органом-мишенью для альдостерона являются почки, где альдостерон способствует обратному всасыванию натрия в почечных канальцах. К тому же по этому третьему механизму ингибирование АПФ снижает давление крови, но в этом случае путем снижения обратного всасывания натрия. Благодаря его многочисленным эффектам ингибирование протеолитической активности АПФ является эффективным путем снижения давления крови. Это наблюдение привело к получению ряда эффективных фармацевтических продуктов, снижающих давление крови, таких как каптоприл и эналаприл(Ondetti, M.A. et al., 1977, Science, Washington DC, 196, 441-444). Так как гипертензия является относительно распространенным болезненным состоянием, было бы полезно противодействовать этому нежелательному результату современного образа жизни с помощью мягко действующих природных ингредиентов. В частности, мягко действующие природные ингредиенты, которые могут быть включены в пищевые продукты и напитки, так как в основе потребления таких продуктов лежит регулярность. Альтернативно, такие мягко действующие природные ингредиенты могли бы включаться в диетические добавки. На протяжении последних десятилетий было открыто, что специфические пептиды, присутствующие в ферментированном молоке, обладают ингибирующим АПФ действием и могут вызывать снижение давления крови у лиц с гипертензией. В настоящее время многочисленными испытаниями in vitro и несколькими испытаниями на животных показано подавляющее действие на АПФ разных пептидов, полученных из ряда источников белков. Хотя исследования ингибирования АПФ in vitro выявили много разных пептидных последовательностей, нужно подчеркнуть, что для проявления действия in vivo необходимо, чтобы пептиды, ингибирующие АПФ, циркулировали в крови. Результатом является то, что ингибирующие АПФ пептиды должны быть устойчивы к разрушению в системе желудочно-кишечного протеолитического расщепления и оставаться невредимыми во время последующего переноса через стенку кишечника. Изучение зависимости функции от строения разных ингибирующих АПФ пептидов навело на мысль о том, что они часто имеют последовательность Pro-Pro, Ala-Pro или Ala-Hyp в их С-концевой последовательности (Maruyama, S. and Suzuki, H., 1982; Agric. Biol. Chem., 46(5): 1393-1394). Эти данные частично объясняются тем фактом, что АПФ является пептидилдипептидазой (ЕС 3.4.15.1), неспособной расщеплять пептидные связи с участием пролина. Таким образом, из трипептидов, имеющих строение Хаа-Pro-Pro, дипептид Pro-Pro не может быть выделен, так как связь Хаа-Pro не может быть расщеплена. Поэтому, возможно, что трипептиды, имеющие строение Хаа-Pro-Pro, присутствуют в относительно высоких концентрациях, они будут ингибировать активность АПФ. Так как не только АПФ, но и почти все протеолитические ферменты сталкиваются с трудностями при расщеплении Хаа-Pro или Pro-Pro связей,идея о том, что наличие (множественных) пролиновых остатков на карбокси-конце пептидов дает в результате относительно устойчивые к протеазам молекулы, является почти не требующим доказательств. Подобно этому, пептиды, содержащие гидроксипролин (Hyp) вместо пролина, являются относительно устойчивыми к протеазам. Из этого можно сделать вывод, что пептиды, несущие один или более (гидрокси)пролиновых остатков на их карбоксиконце, вероятно, уходят от протеолитического разложения в желудочно-кишечном тракте. Эти выводы помогут понять эффект заметного снижения давления крови invivo специфическими подавляющими АПФ пептидами: они не только соответствуют требованиям к-1 011865 строению для ингибирования АПФ, они также устойчивы к разложению желудочно-кишечной системой протеолитического расщепления и остаются нетронутыми во время последующего транспорта через кишечную стенку. О сильной ингибирующей АПФ активности сообщалось в отношении трипептидов Leu-Pro-Pro(JP02036127), Val-Pro-Pro (EP 0583074) и Ile-Pro-Pro (J. Dairy Sci., 78: 777-783, 1995. Первоначально все ингибирующие АПФ пептиды были охарактеризованы на основе их действия на активность АПФ in vitro, и трипептиды Ile-Pro-Pro (здесь и далее называемый IPP), Val-Pro-Pro (здесь и далее, называемыйVPP) и Leu-Pro-Pro (здесь и далее называемый LPP) выделялись по их сильному ингибирующему АПФ действию, дающему в результате относительно низкие значения IC50. Впоследствии предполагаемое антигипертензивное действие трипептидов VPP, а также IPP могло быть подтверждено на крысах со спонтанной гипертензией (Nakamura et al., J. Dairy Sci., 78: 1253-1257 (1995. В этих экспериментах ингибирующие трипептиды получали из молока, ферментированного кисломолочными бактериями. Во время ферментации молока желательные пептиды продуцируются с помощью протеиназ, вырабатываемых растущими кисломолочными бактериями. Недостатком этого ферментативного подхода является то, что кисломолочные бактерии являются живыми микроорганизмами, для которых тип и количество экскретируемых ферментов трудно регулировать. Продукция ингибирующих АПФ пептидов поэтому является трудновоспроизводимой, и также маловероятно, что оптимальный набор ферментов может продуцироваться для обеспечения выхода необходимых пептидов. А также необходимое время ферментации относительно велико, что в сочетании с низким выходом означает неблагоприятную стоимостную структуру в отношении биологически активных пептидов. Кроме того, ферментированный продукт менее подходит для прямого включения в твердую пищу и создает строгие органолептические ограничения. Плохая вкусовая привлекательность таких ферментированных молочных продуктов и многие трудности, с которыми сталкиваются при технологическом процессе во время выделения ингибирующих АПФ пептидов из таких ферментированных жидких питательных сред, описаны в США 6428812. Несмотря на эти недостатки, продукты ферментированного молока нашли практическое применение в качестве перорально вводимого сосудорасширяющего средства. Ингибирующие АПФ пептиды выделяли и концентрировали из продуктов ферментированного молока после электродиализа, диализа через мембрану из полых волокон или хроматографическими методами, чтобы сделать возможным появление их на рынке в форме концентрированных пищевых добавок, таких как таблетки или пастилки. Названные выше недостатки получения путем ферментирования были представлены, в том числе, в патентных заявках WO 01/68115 и ЕР 1231279. В последней заявке описан чисто ферментативный процесс при получении трипептидов Val-Pro-Pro и Ile-Pro-Pro из молочного казеина. В данной заявке заявлен способ получения данных трипептидов путем расщепления материала, содержащего казеин молока,протеиназой и пептидазой через промежуточный пептид. Каждая из этих инкубаций с ферментом может продолжаться так долго, как до 12 ч, и происходит в условиях, которые способствуют росту загрязняющих микроорганизмов. Перед инкубацией с пептидазой промежуточный пептид предпочтительно очищают, и высокие конечные концентрации ингибирующих АПФ пептидов могут быть получены только после стадии дополнительной хроматографической очистки промежуточного пептида. В виду этих разнообразных недостатков существует потребность в более простом и микробиологически более надежном ферментативном пути, при котором образуется продукт, дающий слабое вкусовое ощущение, с высоким и воспроизводимым выходом антигипертензивных пептидов. Краткое описание изобретения Данное изобретение относится к способу получения композиции, которая содержит IPP из протеинового источника, причем отношение IPP к VPP, получаемых из протеина, составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1, и более предпочтительно по меньшей мере 20:1 (масс/масс),который предпочтительно включает использование пролинспецифической эндопротеазы или пролилолигопептидазы. Данный способ, кроме того, относится к применению пролинспецифической эндопротеазы или пролилолигопептидазы, которая не обладает аминопептидазной активностью. Пролинспецифическая эндопротеаза предпочтительно способна к гидролизу больших белковых молекул, подобных полипептидам, или самого белка. По способу данного изобретения время инкубации в основном составляет менее 24 ч, предпочтительно время инкубации составляет менее 10 ч и более предпочтительно менее 4 ч. Температура инкубации в основном выше 30 С, предпочтительно выше 40 С и более предпочтительно выше 50 С. Предпочтительно протеаза, которая расщепляет на конце со стороны пролина, такая как пролинспецифическая эндопротеаза, не обладает какой-либо другой примешивающейся эндопротеазной активностью. Предпочтительно протеаза, которая расщепляет на конце со стороны пролина, такая как пролинспецифическая эндопротеаза, не обладает какой-либо примешивающейся карбоксипептидазной активностью. Предпочтительно протеаза, которая расщепляет на конце со стороны пролина, такая как пролинспецифическая эндопротеаза, не обладает какой-либо примешивающейся аминопептидазной активностью. Пролинспецифическая эндопротеаза или пролилолигопептидаза, которая не обладает какой-либо-2 011865 другой примешивающейся эндопротеазной активностью, является ферментным препаратом, предпочтительно имеющим отношение специфичной активности эндо/прол.спец.акт. менее 1, более предпочтительно менее 0,01. Пролинспецифическая эндопротеаза или пролилолигопептидаза, которая не обладает какой-либо примешивающейся карбоксипротеазной активностью, является ферментным препаратом, предпочтительно имеющим отношение специфической активности КПД/прол.спец.акт. менее 10, более предпочтительно менее 1. Пролинспецифическая эндопротеаза или пролилолигопептидаза, которая не обладает какой-либо примешивающейся аминопротеазной активностью, является ферментным препаратом, предпочтительно имеющим отношение специфической активности АП/прол.спец.акт менее 1, более предпочтительно менее 0,1. Во время продукции IPP преимущественно образуется и LPP. Другим аспектом данного изобретения является способ очистки или выделения пептидов из гидролизата белка, предпочтительно, гидролизованного протеазой не по аспарагиновой кислоте, более предпочтительно, серинпротеазой. Этот гидролизованный протеин способен осаждаться в выбранных условиях рН. Очистка или процесс выделения включает изменение рН до рН, при котором гидролизованный белок выпадает в осадок, и отделение осажденных белков от пептидов в растворе. Поэтому данное изобретение относится к способу получения композиции, которая содержит растворимые пептиды, предпочтительно IPP, который включает изменение рН композиции, которая продуцируется при гидролизе подходящего источника белка, до рН, при котором часть гидролизованного белка становится нерастворимой, и отделение нарастворенной части от растворимых пептидов с получением композиции, содержащей растворимые пептиды. Данное изобретение относится также к пептидной композиции, продуцируемой гидролизом белка,имеющего отношение IPP к VPP, равное по меньшей мере 5:1, предпочтительно по меньшей мере 10:1, и более предпочтительно по меньшей мере 20:1, которая предпочтительно содержит LPP, или к композиции, содержащей растворимые пептиды по данному изобретению, для применения в качестве нутрицевтика, предпочтительно в качестве лекарственного средства. Данное изобретение, кроме того, относится к применению указанных пептидных композиций для производства нутрицевтика, предпочтительно лекарственного средства, для улучшения здоровья или профилактики и/или лечения заболеваний, или для производства нутрицевтика, предпочтительно лекарственного средства, для лечения или профилактики высокого давления крови (гипертензии), сердечной недостаточности, преддиабета или диабета, ожирения, сниженной толерантности к глюкозе или стресса. Предпочтительно данные пептидные композиции используют в виде диетической добавки или в виде средств индивидуального применения, включая местное применение в виде лосьона, геля или эмульсии, или в виде ингредиента пищи, напитка, корма или консервов для животных. Подробное описание изобретения В соответствии с предшествующим уровнем техники эффективные ингибирующие АПФ пептиды,вероятно, включают один остаток или два остатка пролина на карбоксиконце пептида. То же самое требование к структуре придает пептидам также и повышенную устойчивость к протеолитическому разложению, повышая тем самым возможность неповрежденному пептиду достигать кровяного русла. Для получения пептидов по меньшей мере с одним, но предпочтительно многими пролиновыми остатками на их карбоксиконце представляющую интерес альтернативу представляет использование протеазы, которая может производить расщепление на карбоксиконце со стороны пролиновых остатков. Так называемые пролилолигопептидазы (ЕС 3.4.21.26) обладают способностью преобладающего расщепления пептидов на карбоксильной стороне пролиновых остатков. У всех адекватно охарактеризованных пролинспецифических протеаз, выделенных от млекопитающих, а также их микробных источников, был идентифицирован уникальный пептидазный домен, который не допускает большие пептиды к активному сайту фермента. Фактически эти ферменты неспособны разлагать пептиды, содержащие более примерно 30 аминокислотных остатков, так что эти ферменты теперь называют пролилолигопептидазами (Fulop etal: Cell, Vol. 94, 161-170, July 24, 1998). В результате для этих пролилолигопептидаз необходим интенсивный предварительный гидролиз другими эндопротеазами перед тем, как они могут оказать свое гидролитическое действие. Однако, как описано в WO 02/45523, даже комбинация пролилолигопептидаз с такой другой эндопептидазой дает в результате гидролизаты, характеризующиеся значительно повышенной пропорцией пептидов с карбоксиконцевым пролиновым остатком. Из-за этого такие гидролизаты образуют превосходный исходный источник для выделения пептидов с ингибирующим АПФ действиемin vitro, а также с улучшенной устойчивостью к желудочно-кишечному протеолитическому разложению. Несмотря на эти потенциальные преимущества авторам не известны заявки, описывающие применение пролинспецифических протеаз для выделения ингибирующих АПФ пептидов, не говоря уже о селективной продукции IPP. Данное изобретение относится к способу получения композиции, которая включает IPP из протеинового источника, при котором массовое отношение IPP к VPP, получаемых из белка, составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1 и более предпочтительно по меньшей мере-3 011865 20:1, который включает использование фермента, который обладает активностью пролинспецифической эндопротеазы или активностью пролилолигопептидазы, и фермента, который делает возможным гидролиз связи на аминоконцевой стороне последовательности -I-P-Р-. Преимущественно, ферментативная активность, которая представляет активность пролинспецифической эндопротеазы или активность пролилолигопептидазы, и активность, которая делает возможным гидролиз связи на аминоконцевой стороне последовательности -I-P-P-, присутствуют в одном ферменте, предпочтительно этот фермент является пролинспецифической эндопротеазой или пролилолигопептидазой, более предпочтительно этот фермент является пролинспецифической эндопротеазой. Кроме того, данное изобретение относится к способу получения композиции, которая включает растворимые пептиды, предпочтительно IPP, причем способ включает изменение рН в условиях гидролиза до рН, при котором часть гидролизованного белка становится нерастворимой, и отделение нерастворимой части от растворимых пептидов, что дает в результате композицию, содержащую растворимые пептиды. Температура на стадии разделения предпочтительно находится от 0 до 20 С, более предпочтительно от 1 до 10 С. Данное изобретение относится также к изготовлению пищевого продукта, продукта в виде напитка или диетической добавки, включающему получение композиции, которая содержит IPP, как описано выше, и включение композиции, содержащей IPP, в пищевой продукт, продукт в виде напитка или диетический продукт для здорового образа жизни. Кроме того, данное изобретение относится к способу получения композиции, содержащей растворимые пептиды, которая продуцируется путем первого гидролиза белка с помощью пролинспецифических эндопротеаз до DH 5-30%, второй необязательной обработки ферментом, предпочтительно протеазой, и последующего отделения нерастворимой части гидролизованного белка от растворимой части в выбранных условиях рН, предпочтительно в условиях кислых рН, более предпочтительно, при рН от 3,5 до 6, и наиболее предпочтительно, при рН от 4 до 5 с получением в результате композиции, содержащей растворимые пептиды. Поэтому данное изобретение представляет композицию, которая может быть получена по последнему способу, и указанная композиция содержит растворимые пептиды, посредством чего по меньшей мере 70 мас.%, предпочтительно по меньшей мере 80 мас.% и наиболее предпочтительно по меньшей мере 90% пептидов являются растворимыми (определено при 4 С) при рН от 3,5 до 6, предпочтительно при рН от 4 до 5 и наиболее предпочтительно при рН=4,5, и ни один пептид из растворимых пептидов не присутствует в количестве более 40 мас.% от растворимых пептидов, предпочтительно ни один пептид из растворимых пептидов не присутствует в количестве более 30 мас.% от растворимых пептидов, и наиболее предпочтительно ни один пептид из растворимых пептидов не присутствует в количестве более 20 мас.% от растворимых пептидов. Последний способ и последняя композиция являются результатом понимания того, что может быть получена композиция с высоким количеством пептидов, которая в результате использования пролинспецифической эндопротеазы содержит также высокие количества пептидов, имеющих карбоксиконцевой пролин. Как описано выше, белок сначала нужно гидролизовать пролинспецифической эндопротеазой. Если этот гидролизованный белок затем гидролизуют дополнительной (второй) протеазой, пептиды с карбокси-концевым пролином далее будут гидролизованы вторым ферментом. Предпочтительно, обработку вторым ферментом проводят чистым и селективным ферментом. Этот второй фермент предпочтительно является аминопептидазой (например, королазой LAP, примеры 12 и 13) или эндопротеазой, наиболее предпочтительно использование аминопептидазы. В примерах 12 и 13 показано, что наилучший IPP, селективно дополненный IPP и VPP, образуется из казеина. Выбор этого второго фермента производится всегда в отношении используемого белка. Таким путем можно изготовить адаптированную композицию, содержащую растворимые пептиды из данного белка. Эта вторая обработка ферментом может быть выполнена предпочтительно после гидролиза пролинспецифической эндопротеазой, а другой вариант состоит в том, что вторую обработку ферментом производят в то же самое время, что и гидролиз пролинспецифической эндопротеазой. В соответствии с дополнительным воплощением данного изобретения эта вторая обработка ферментом может происходить после стадии кислотного осаждения. В этом случае твердую пептидную композицию дополнительно гидролизуют вторым ферментом с получением в результате композиции, содержащей растворимые пептиды. Предпочтительно по меньшей мере 10 мол.%, более предпочтительно по меньшей мере 20 мол.% и еще предпочтительнее по меньшей мере 30 мол.% растворимых пептидов представляют собой карбоксиконцевой пролин. В патентной заявке WO 02/45523 описано, как можно определить эти мол.%. Данное изобретение относится к представленной композиции, содержащей пептиды, в качестве нутрицевтика предпочтительно лекарственного средства. Данное изобретение относится также к применению данной композиции, содержащей пептиды, в качестве нутрицевтика предпочтительно лекарственного средства; к применению представленной композиции, содержащей пептиды, для производства-4 011865 нутрицевтика предпочтительно лекарственного средства; к применению представленной композиции,содержащей пептиды, для улучшения здоровья или профилактики и/или лечения заболеваний; к применению представленной композиции, содержащей пептиды, для производства нутрицевтика предпочтительно лекарственного средства; к применению представленной композиции, содержащей пептиды, для лечения сердечно-сосудистых заболеваний, таких как гипертензия и сердечная недостаточность; к применению представленной композиции, содержащей пептиды, для лечения преддиабета или диабета; к применению представленной композиции, содержащей пептиды, для лечения или профилактики ожирения; к применению представленной композиции, содержащей пептиды, для повышения уровня инсулина в плазме или для повышения чувствительности к инсулину, находящемуся в плазме; к применению представленной композиции, содержащей пептиды, для повышения уровня инсулина в плазме или для повышения чувствительности к инсулину, находящемуся в плазме при диабете типа 2 или преддиабете; к применению представленной композиции, содержащей пептиды, для понижения послеобеденных концентраций глюкозы в крови при диабете 2 типа или преддиабете; к применению представленной композиции, содержащей пептиды, для повышения послеобеденной секреции инсулина в кровь при диабете 2 типа или преддиабете; к применению представленной композиции, содержащей пептиды, где данная композиция, содержащая пептиды, находится в форме диетической добавки; к применению представленной композиции, содержащей пептиды, для производства функционального пищевого продукта для терапевтического лечения эффектов стресса; к применению представленной композиции, содержащей пептиды, при местном применении, предпочтительно при индивидуальном применении, и к применению представленной композиции, содержащей пептиды, в пище и корме для животных. Кроме того, данное изобретение относится к способу лечения диабета 1 и 2 типа и профилактики диабета типа 2 у лиц с преддиабетом или сниженной толерантностью к глюкозе (IGT; СТГ), который включает введение пациенту, нуждающемуся в таком лечении, данной композиции, содержащей пептиды, и к способу лечения людей, которые страдают гипертензией или сердечной недостаточностью, или их профилактики, который включает введение пациенту, нуждающемуся в таком лечении, данной композиции, содержащей пептиды, и таким образом проявляются снижающие давление крови эффекты. Ингибирование АПФ приводит к сниженному сужению сосудов, повышенному расширению сосудов,улучшенному выведению натрия и воды, что, в свою очередь, приводит к сниженному периферическому сопротивлению сосудов и сниженному давлению крови и улучшенному местному кровотоку. Таким образом, данные гидролизаты, содержащие пептид, особенно эффективны в отношении профилактики и лечения заболеваний, на которые может влиять ингибирование АПФ, которые включают, но не ограничиваются ими, гипертензию, сердечную недостаточность, стенокардию, инфаркт миокарда, инсульт, периферическое артериальное обструктивное заболевание, атеросклероз, нефропатию, почечную недостаточность, эректильную дисфункцию, эндотелиальную дисфункцию, гипертрофию левого желудочка,диабетическую васкулопатию, задержку жидкости и гиперальдостеронизм. Композиции могут быть также полезны для профилактики и лечения желудочно-кишечных заболеваний (диареи, синдрома раздраженной кишки), воспаления, сахарного диабета, ожирения, слабоумия,эпилепсии, старческого помрачения сознания, болезни Меньера. Кроме того, композиции могут улучшать познавательную функцию и память (включая болезнь Альцгеймера), усиливать чувство насыщения,ограничивают ишемическое повреждение и предотвращать повторную окклюзию артерий после хирургической операции шунтирования или ангиопластики. Сахарный диабет является широко распространенным хроническим заболеванием, которое до сих пор не излечивается. Коэффициент заболеваемости и распространенность сахарного диабета растут экспоненциально, и он находится среди наиболее обычных метаболических расстройств в развитых и развивающихся странах. Сахарный диабет является сложным заболеванием, происходящим от многих причинных факторов, и характеризуется нарушенным метаболизмом углеводов, белков и жиров, связанным с дефицитом секреции инсулина и/или резистентностью к инсулину. Это приводит к повышенным концентрациям глюкозы натощак и после еды, что приводит к осложнениям, если не применять лечение. Существуют две главных категории заболевания, инсулинзависимый сахарный диабет (ИЗСД, СД 1 Т) и инсулиннезависимый сахарный диабет (ИНСД, СД 2 Т). СД 1 Т = сахарный диабет 1 типа. СД 2 Т = сахарный диабет 2 типа. СД 1 Т и СД 2 Т диабеты связаны с гипергликемией, гиперхолестеринемией и гиперлипидемией. Абсолютный дефицит инсулина и нечувствительность к инсулину при СД 1 Т и СД 2 Т, соответственно, приводят к снижению утилизации глюкозы печенью, мышцами и жировой тканью и к повышению уровней глюкозы в крови. Нерегулируемая гипергликемия связана с повышенной и преждевременной смертностью из-за повышенного риска в отношении микрососудистых и макрососудистых заболеваний, включая нефропатию, нейропатию, ретинопатию, инсульт и сердечные заболевания. Последние данные показали,что умелая регуляция гликемии является главным фактором предотвращения этих осложнений как при СД 1 Т, так и СД 2 Т. Поэтому оптимальная регуляция гликемии лекарственными средствами или терапевтическими режимами является важным подходом в лечении диабета. Терапия СД 2 Т первоначально включает изменения диеты и образа жизни, когда эти меры не способны поддерживать адекватную регуляцию гликемии, пациентов лечат пероральными гипогликемиче-5 011865 скими средствами и/или экзогенным инсулином. Современные пероральные фармакологические средства для лечения СД 2 Т включают средства, которые потенцируют секрецию инсулина (производные сульфонилмочевины), средства, которые улучшают действие инсулина в печени (бигуанидиновые средства),повышающие чувствительность к инсулину средства (тиазолидиндионы), и средства, которые действуют с ингибированием усвоения глюкозы (ингибиторы -глюкозидазы). Однако доступные в настоящее время средства обычно неспособны длительно поддерживать адекватную регуляцию гликемии из-за прогрессивного ухудшения гипергликемии, происходящего в результате прогрессивной потери функции клетками поджелудочной железы. Доля пациентов, способных поддерживать целевые уровни гликемии заметно снижается с течением времени, требуя введения дополнительных/альтернативных фармакологических средств. Кроме того, лекарственные средства могут иметь нежелательные побочные действия и связаны с высокой степенью первичной или вторичной несостоятельности. И, наконец, использование гипогликемических лекарственных средств может быть эффективно в отношении регуляции уровней глюкозы в крови, но может не предотвращать осложнений диабета. Таким образом, современные методы лечения всех типов сахарного диабета не способны обеспечить достижение идеала нормогликемии и предотвращения осложнений диабета. Поэтому, хотя предпочтительная терапия при лечении СД 1 Т и СД 2 Т основана, по существу, на введении инсулина и пероральных гипогликемических лекарственных средств, существует потребность в безопасной и эффективной диетической добавке с минимальными побочными эффектами при лечении и профилактике диабета. Многие пациенты заинтересованы в альтернативной терапии, которая сводит к минимуму побочные эффекты, связанные с высокой дозировкой лекарственных средств, и дает дополнительные клинические преимущества. Пациенты с сахарным диабетом особенно заинтересованы в лечении, рассматриваемом как натуральное с мягким противодиабетическим действием и без больших побочных эффектов, которое можно применять в качестве вспомогательного лечения. СД 2 Т является прогрессирующим и хроническим заболеванием, которое обычно не распознается до тех пор, пока не происходит значительного нарушения в клетках поджелудочной железы, ответственных за продукцию инсулина (-клетки островков Лангерганса). Поэтому существует повышенная заинтересованность в разработке диетической добавки, которую можно использовать для предотвращения повреждения -клеток и,таким образом, прогрессирования до явного СД 2 Т у людей с риском его возникновения, особенно у пожилых, у которых риск развития СД 2 Т высок. Защита -клеток поджелудочной железы может быть достигнута путем снижения уровней глюкозы в крови и/или уровней липидов, так как глюкоза и липиды оказывают повреждающее действие на -клетки. Снижение уровней глюкозы в крови может быть достигнуто путем разных механизмов, например путем повышения чувствительности к инсулину и/или путем снижения продукции глюкозы в печени. Снижение уровней липидов в крови может быть достигнуто также путем разных механизмов, например путем повышения окисления липидов и/или хранения липидов. Другой возможной стратегией защиты -клеток поджелудочной железы является снижение окислительного давления. Окислительное давление также вызывает повреждение -клеток с последующей потерей секреции инсулина и прогрессирования до явного СД 2 Т. Поэтому СД 2 Т является осложненным заболеванием, происходящим от одновременно существующих дефектов во многих органах: резистентности к действию инсулина в мышечной и жировой тканях,недостаточной секреции инсулина в поджелудочной железе, неограничиваемой продукции глюкозы в печени. Эти дефекты часто связаны с липидной патологией и эндотелиальной дисфункцией. При условии многочисленных нарушений при СД 2 Т, комбинированная терапия является привлекательным подходом к его лечению. Данное изобретение относится к новым нутрицевтическим композициям, включающим композицию, содержащую пептиды, данного изобретения. Нутрицевтические композиции, включающие композицию, содержащую пептиды, данного изобретения могут также включать негидролизованные протеины и углеводы в качестве активных ингредиентов для лечения или профилактики сахарного диабета или других патологических состояний, связанных со сниженной толерантностью к глюкозе, таких как синдром X. В другом аспекте данное изобретение относится к применению таких композиций в качестве диетической добавки для указанного лечения или профилактики, например, в качестве добавки к поливитаминным препаратам, содержащим витамины и минералы, которые являются существенными для поддержания нормальной метаболической функции, но не синтезируются в организме. В еще одном аспекте данное изобретение относится к способу лечения сахарного диабета как 1 типа, так и 2 типа, и профилактики СД 2 Т у таких лиц с преддиабетом или сниженной толерантностью к глюкозе (СТГ) или ожирением, который включает введение субъекту, нуждающемуся в таком лечении, композиции, содержащей пептиды, данного изобретения и гидролизаты белков или негидролизованные белки и/или углеводы. Композиции данного изобретения, в частности, предназначены для лечения как СД 1 Т, так и СД 2 Т,и для профилактики СД 2 Т у лиц с преддиабетом или сниженной толерантностью к глюкозе (СТГ). Обнаружено, что данные композиции, содержащие пептиды, можно использовать при диабете 2 типа или преддиабете, предпочтительно для снижения концентраций глюкозы после приема пищи или для-6 011865 повышения секреции инсулина в кровоток после приема пищи. Композиции, содержащие пептид и необязательно углеводы, стимулируют секрецию инсулина и повышают утилизацию глюкозы в чувствительных к инсулину целевых тканях, таких как жировая ткань,скелетная мускулатура и печень, и таким образом обеспечивают синергетический эффект при лечении сахарного диабета. В основном признано, что связанные со стрессом заболевания и отрицательные эффекты стресса на организм обладают значительным воздействием на многих людей. В последние годы эффекты стресса и его участие в развитии различных заболеваний и патологических состояний получили более широкое признание у медицинского и научного сообщества. Потребители в настоящее время становятся все более обеспокоенными этими потенциальными проблемами и становятся повышенно заинтересованными в снижении или профилактике возможного отрицательного влияния стресса на их здоровье. Дополнительная цель данного изобретения состоит в получении пищевого продукта или ингредиента, который может быть включен в него, который пригоден для использования в качестве помощи организму, чтобы справиться с эффектами стресса. Еще одна цель состоит в получении пищевого продукта, включающего данную содержащую пептид композицию, который обеспечивает благоприятное воздействие на здоровье таким образом, что помогает организму справиться с отрицательными эффектами стресса. Термин нуртицевтический, как использовано в данном описании, означает полезный как в пищевой, так и в фармацевтической области применения. Таким образом, новые нутрицевтические композиции могут найти применение в качестве добавки к пище и в виде напитков, и в качестве фармацевтических препаратов или лекарственных средств для энтерального или парентерального применения, которые могут быть твердыми препаратами, такими как капсулы или таблетки, или жидкими препаратами,такими как растворы или суспензии. Как явствует из предшествующего, термин нутрицевтическая композиция также включает пищевые продукты и напитки, включающие данную композицию, содержащую пептиды, и необязательно углеводы, а также композиции добавок, например диетические добавки,включающие названные выше активные ингредиенты. Термин диетическая добавка, как использовано в данном описании, означает продукт, принимаемый через рот, который содержит пищевой ингредиент, предназначенный для пополнения диеты. Пищевые ингредиенты в этих продуктах могут включать: витамины, минералы, травы и другие растительные составляющие, аминокислоты и такие вещества, как ферменты, ткани органов, желез и метаболиты. Диетические добавки также могут представлять собой экстракты или концентраты, и могут находиться во многих формах, таких как таблетки, капсулы, мягкие гели, желатиновые капсулы, жидкости или порошки. Они могут быть также в других формах, таких как батончик, но если они в таком виде,информация на этикетке диетической добавки будет в основном представлять данный продукт не как обычный пищевой продукт или единственный продукт питания или диеты. Поливитаминную и минеральную добавку можно добавлять к нутрицевтическим композициям данного изобретения с получением адекватного количества незаменимого питательного вещества, отсутствующего в некоторых диетах. Поливитаминная и минеральная добавка также может быть полезна при профилактике заболевания и для защиты от пищевых потерь и дефицита из-за особенностей образа жизни и обычно неадекватного характера питания, иногда наблюдаемого при диабете. Кроме того, окислительный стресс может быть связан с инсулиновой резистентностью. Кислород в реактивном состоянии может ухудшать стимулированное инсулином усвоение глюкозы путем нарушения каскада активации инсулиновых рецепторов. Противодействие окислительному стрессу с помощью антиоксидантов, таких как -токоферол (витамин Е), аскорбиновая кислота (витамин С), может быть ценным при лечении диабета. Поэтому, прием поливитаминной добавки может быть добавлен к названным выше активным веществам для поддержания хорошо сбалансированного питания. Кроме того, комбинацию данной композиции, содержащей пептиды, с минералами, такими как магний (Mg2+), кальций (Са 2+) и/или калий (K+) можно использовать для улучшения здоровья и профилактики и/или лечения заболеваний, включая, но не ограничиваясь ими, сердечно-сосудистые заболевания и диабет. В предпочтительном аспекте данного изобретения нутрицевтическая композиция настоящего изобретения включает представленные композиции, содержащие пептиды. IPP, соответственно, присутствует в композиции по данному изобретению в количестве для получения суточной дозы примерно от 0,001 г на кг массы тела до примерно 1 г на кг массы тела пациента, которому нужно ее вводить. Пищевой продукт или напиток, соответственно, включает примерно от 0,05 г на порцию до примерно 50 г на порциюIPP. Если нутрицевтическая композиция является фармацевтическим препаратом, такой препарат может включать IPP в количестве примерно от 0,001 до примерно 1 г на единицу дозировки, например на капсулу или таблетку, или примерно от 0,035 г на суточную дозу до примерно 70 г на суточную дозу жидкого препарата. Данные композиции, содержащие пептиды, соответственно присутствуют в композиции по данному изобретению в количестве для получения суточной дозы примерно от 0,01 г на кг массы тела до примерно 3 г на кг массы тела пациента, которому нужно ее вводить. Пищевой продукт или напиток,соответственно, содержит примерно от 0,1 г на порцию до примерно 100 г на порцию протеиновых гид-7 011865 ролизатов. Если нутрицевтическая композиция является фармацевтическим препаратом, такой препарат может включать данные композиции, содержащие пептиды, в количестве примерно от 0,01 до примерно 5 г на единицу дозировки, например на капсулу или таблетку, или примерно от 0,7 г на суточную дозу до примерно 210 г на суточную дозу жидкого препарата. В еще одном предпочтительном аспекте данного изобретения композиция содержит данный пептид, который описан выше, и необязательно углеводы. Углеводы, соответственно, присутствуют в композиции по данному изобретению в количестве для получения суточной дозы примерно от 0,01 г на кг массы тела до примерно 7 г на кг массы тела пациента, которому нужно ее вводить. Пищевой продукт или напиток, соответственно, содержит примерно от 0,5 г на порцию до примерно 200 г углеводов на порцию. Если нутрицевтическая композиция является фармацевтическим препаратом, такой препарат может включать углеводы в количестве примерно от 0,05 до примерно 10 г на единицу дозировки, например на капсулу или таблетку, или примерно от 0,7 г на суточную дозу до примерно 490 г на суточную дозу жидкого препарата. Интервалы дозировки (для человека массой 70 кг) IPP: 0,005-70 г/сутки Протеиновые гидролизаты: 0,07-210 г/сутки Негидролизованные белки: 0,07-210 г/сутки Углеводы: 0,1-490 г/сутки Один из объектов данного изобретения представляет собой пищевой материал, который можно использовать для получения благоприятного воздействия на здоровье пациента, потребляющего его. Еще один дополнительный объект состоит в получении такого пищевого материала, который можно просто проглотить или в изолированной форме или во включенной в пищевой продукт форме. Дополнительным объектом данного изобретения является получение пищевого продукта или ингредиента, который может быть в него включен, который пригоден для использования в программах по контролю массы тела. Еще одним объектом данного изобретения является получение пищевого продукта или ингредиента, который может быть в него включен, который пригоден для помощи в поддержании здоровья сердечно-сосудистой системы, например, посредством ингибирования АПФ. Дополнительным объектом данного изобретения является получение пищевого продукта или ингредиента, который может быть в него включен, который имеет приемлемые стабильность и/или органолептические свойства, в частности, хороший вкус, такой как отсутствие или приемлемый уровень горечи. Еще одним объектом данного изобретения является получение пищевого продукта, имеющего высокую концентрацию ингредиента, который оказывает благоприятное действие на здоровье, такое как помощь в профилактике ожирения или контроле массы тела и/или помощь в сохранении здоровья сердечно-сосудистой системы. Неожиданно, что один или более из этих объектов достигаются по настоящему изобретению путем использования данной композиции, содержащей пептиды, для получения пищевого продукта, который обеспечивает благоприятное действие на здоровье при потреблении. По первому аспекту настоящее изобретение представляет применение данной композиции, содержащей пептиды, для производства функционального пищевого продукта для профилактики ожирения или контроля массы тела. По второму аспекту настоящее изобретение представляет применение данной композиции, содержащей пептиды, для производства функционального пищевого продукта для сохранения здоровья сердечно-сосудистой системы. Особенно предпочтительным по данному изобретению является сохранение здоровья сердечнососудистой системы, включающее ингибирование ангиотензин превращающего фермента (АПФ) и/или регуляцию уровней глюкозы в крови. По третьему аспекту настоящее изобретение представляет функциональный пищевой продукт, полезный для здоровья его потребителя, где указанное благоприятное действие на здоровье выбрано из действия на ожирение, контроль массы тела и сохранения сердечно-сосудистой системы, и включающий данную композицию, содержащую пептиды. Дополнительным преимуществом композиции, содержащей пептиды, по данному изобретению является то, что эта композиция, содержащая пептиды, может быть легко включена в пищевые продукты с получением функциональных пищевых продуктов без неприемлемого влияния на его стабильность и/или органолептические свойства. Полезным для здоровья средством по данному изобретению являются материалы, которые приносят пользу здоровью, то есть которые обладают положительным действием на один из аспектов здоровья, или которые помогают сохранить один из аспектов хорошего здоровья при употреблении, причем этими аспектами хорошего здоровья являются профилактика ожирения, контроль массы тела и сохранение здоровья сердечно-сосудистой системы. Функциональные пищевые продукты по данному изобретению определяют как пищевые продукты (включая, без сомнения, напитки), пригодные для потребления людьми, в которых композицию, содержащую пептиды, данного изобретения используют в качестве ингредиента в эффективном количест-8 011865 ве, таком, что потребитель этого пищевого продукта получает заметную пользу для здоровья. Термин содержащий, когда его используют в данном описании, означает не являющийся ограниченным указанными затем элементами, а скорее охватывает неспецифические элементы большего или меньшего функционального значения. Другими словами, нет требования, что перечисленные стадии,элементы или варианты выбора являются исчерпывающими. Когда же использованы слова включающий или имеющий, эти термины, как подразумевается, являются эквивалентными термину содержащий, которому дано определение выше. Пептид или олигопептид определяется в данном описании как цепь из по меньшей мере двух аминокислот, которые связаны пептидными связями. Термины пептид и олигопептид рассматриваются как синонимы (что, как правило, общепризнано), и каждый термин можно использовать как взаимозаменяемые, когда требуется по контексту. Полипептид определяется как цепь, содержащая более 30 аминокислотных остатков. Все формулы и последовательности (олиго)пептидов и пептидов записаны слева направо в направлении от аминоконца к карбоксиконцу в соответствии с обычной практикой. Однобуквенный код аминокислот, используемый в данном описании, как правило, известен специалистам в данной области, и его можно найти в Sambrook, et al. (Molecular Cloning: A Laboratory Manual, 2nd. ed.Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989). Признанные на международном уровне схемы классификации и номенклатуры ферментов от IUMB включают и протеазы. Уточненный текст IUMB в отношении номеров протеазы ЕС можно найти на интернет-сайте: http://www.chem.qmw/ac.uk/iubmb/enzyme/EC3/4/11/. В этой системе ферменты определены по тому факту, что они катализируют единственную реакцию. Это имеет важное значение в том, что несколько разных белков, все описаны как один и тот же фермент и белок, который катализирует более чем одну реакцию, трактуется как более, чем один фермент. По этой системе протеазы разделяют на эндо- и экзопротеазы. Эндопротеазы представляют собой такие ферменты, которые гидролизуют внутренние пептидные связи, экзопротеазы гидролизуют пептидные связи, соседние с концевой а-аминогруппой(аминопептидазы) или пептидную связь между концевой карбоксильной группой и предпоследней аминокислотой (карбоксипептидазы). Эндопротеазы разделены на подподгруппы на основе каталитического механизма. Существуют подподгруппы серинэндопротеаз (ЕС 3.4.21), цистеинэндопротеаз (ЕС 3.4.22), аспарагинэндопротеаз (ЕС 3.4.23), металлоэндопротеаз (ЕС 3,4.24) и треонинэндопротеаз (ЕС 3.4.25). Аминопептидазы относятся к группе 3.4.11. Подклассификиция происходит на основе относительной эффективности, с которой отщепляются 20 разных аминокислот. Можно провести различие аминопептидаз с узкой и широкой специфичностью. Аминопептидазы могут последовательно отщеплять одиночные амино-концевые аминокислоты из протеинового или пептидного субстратов. Аминопептидазы с узкой специфичностью проявляют сильное предпочтение в отношении вида аминокислотного остатка в положении Р 1, который выделяется в свободном состоянии из субстратного пептида. Аминопептидазы с широкой специфичностью способны к выделению ряда разных аминокислот в N-концевом или Р 1 положениях (по номенклатуре Шехтера: Schechter, I. and Berger, А. 1967. Biochem. Biophys. Res. Commun. 27: 157-162). Карбоксипептидазы могут последовательно отщеплять одиночные аминоконцевые аминокислоты из протеинового и пептидного субстратов. Сопоставимо с ситуацией в отношении эндопротеаз,карбоксипептидазы делят на подподгруппы на основе каталитического механизма. Карбоксипептидазы серинового типа относятся к группе ЕС 3.4.16, металлкарбоксипептидазы к группе ЕС 3.4.17 и карбоксипептидазы цистеинового типа к группе ЕС 3.4.18. Значение ЕС перечня протеаз состоит в обеспечении стандартной терминологии для разных видов протеазной активности и, в частности, в назначении уникального идентификационного номера и рекомендуемого названия каждой протеазы. В ЕР 1231279 описан чисто ферментативный способ выделения трипептидов VPP и IPP из молочного казеина. В последней заявке заявлен способ получения трипептидов путем расщепления материала,содержащего молочный казеин, протеиназой и пептидазой через так называемый промежуточный пептид, выбранный из группы, состоящей из пептидов, содержащих последовательность -V-Р-Р-, но не содержащих пролин, кроме тех остатков, которые находятся в этой последовательности, а также пептида,содержащего последовательность -I-P-P-, но не содержащего пролин, кроме тех остатков, которые находятся в этой последовательности. Как описано в примерах ЕР 1231279, этот способ включает двухстадийный процесс. Сначала получают промежуточные пептиды, охватывающие любой из VPP и IPP. Это осуществляют путем инкубации казеина с подходящей протеиназой по одному из примеров, при 37 С в течение 12-часового периода. Затем используемую протеиназу инактивируют нагреванием первого гидролизата до 100 С в течение 3 мин и после охлаждения добавляют препарат другого фермента (фактически препарат с экзопротеолитической активностью). После еще 12 ч инкубации при 37 С с другим препаратом фермента может быть продемонстрировано присутствие трипептидов VPP и IPP. Чтобы получить более высокие выходы ингибирующих АПФ пептидов в ЕР 1231279, кроме того, предлагается очистить концентрат промежуточного пептида перед воздействием экзопротеолитической активности. В ЕР 1231279 также предложено, после получения промежуточного пептида и перед тем, как промежуточный пептид приводят в контакт с пептидазой, при необходимости могут быть выполнены различные опера-9 011865 ции, такие как удаление непрореагировавшего белка, например, центрифугированием при 5000-20000 об/мин в течение 3-10 мин. Так желаемые трипептиды получают промышленным довольно громоздким двухстадийным способом. Так как каждая инкубация с ферментом может занимать такой долгий срок,как 12 ч при рН 4,5-7 и при температуре 25-50 С, очевидно, что такая методика также неприемлема с микробиологической точки зрения. Это большое время инкубации в сочетании с низкой температурой 25-50 С может легко приводить к инфицированию содержащих белок растворов. В WO 02/45524 описана пролинспецифическая протеаза, получаемая из Aspergillus niger. Фермент,получаемый из A.niger, расщепляет преимущественно на карбокси-конце пролина, но может также расщеплять на карбокси-конце гидроксипролина, и причем это происходит с низкой эффективностью, на карбокси-конце аланина. В WO 02/45524 указано также, что не существует чистой гомологии между ферментом, получаемым из A.niger, и известными олигопептидазами из других микробных источников или источников от млекопитающих. В отличие от известных пролилолигопептидаз фермент из A.niger имеет кислый оптимум рН. Хотя известные пролилолигопептидазы, а также фермент, получаемый из A.niger,являются так называемыми серинпротеазами, авторами в настоящем описании показано (пример 1), что фермент A.niger принадлежит совсем к другому подсемейству. Секретируемый A.niger фермент, по видимому, является представителем семейства S28 сериновых пептидаз, а не семейства S9, в которое сгруппировано большинство цитозольных пролилолигопептидаз (Rawling, N.D. and Barrett, A.J.: Biochim.Biophys. Acta 1298 (1996) 1-3). В примере 2 настоящего описания показаны оптимумы рН и температуры пролинспецифической протеазы, получаемой из A.niger. В примере 3 показано, что препарат фермента,получаемого из A.niger, который используют в способе данного изобретения, является, по существу, чистым, означая, что не присутствует значительной эндопротеолитической активности, помимо эндопротеолитической активности, присущей чистой пролинспецифической эндопротеазе. Как также показано в данном описании, используемый в соответствии с настоящим изобретением препарат фермента, получаемого из A.niger, не содержит какой-либо экзопротеолитической, более конкретно, аминопептидолитической побочной активности. Все положительно идентифицированные образцы протеиназы, приведенные в ЕР 1231279, являются сложными смесями разных ферментов, проявляющих разную протеолитическую активность. Специалисту в данной области будет понятно, что способ, описанный в ЕР 1231279, тесно связан с комбинацией эндопротеолитической активности с активностью одного или нескольких экзопротеолитических ферментов. Такая экзопротеолитическая активность отсутствует в используемом в способе данного изобретения препарате фермента, получаемого из A.niger. И наоборот,фермент, используемый при способе по данному изобретению, не присутствует в сложных протеиназных образцах, описанных в ЕР 1231279. Экспериментальное доказательство в отношении представления о том, что этот фермент, по существу, отсутствует в нерекомбинантных штаммах Aspergillus, можно найти в WO 02/45524. Так как способ данного изобретения возможен только с пролинспецифической эндопротеазой, оптимальные условия инкубации, подобные температуре, рН и т.д., можно легко выбрать, и они не должны устанавливаться на субоптимальные условия, как в случае, если применять два или несколько ферментов. Имея больше степеней свободы при выборе условий реакции, легче сделать выбор в отношении других возможных критериев. Например, теперь намного легче выбрать условия, которые менее чувствительны к инфицированию микробами, и оптимизировать условия рН относительно последующих стадий осаждения белка. В примере 4 показано, что фермент Aspergillus является не олигопептидазой, а настоящей эндопептидазой, делающей возможным гидролиз неповрежденных белков, больших пептидов, а также малых пептидных молекул без необходимости вспомогательной эндопротеазы. Эти новые и неожиданные данные открывают возможность использования фермента A.nicer для получения гидролизатов с беспрецедентно высоким содержанием пептидов с карбоксиконцевым пролиновым остатком, так как нет необходимости во вспомогательной эндопротеазе. Такие новые гидролизаты можно получить из разных белковых исходных материалов, являются ли они растительного или животного происхождения. Примерами таких исходных материалов являются сывороточные белки, сывороточный беталактоглобулин, сывороточный альфа-лактоглобулин, казеины, желатин, белки из рыбы или яичные белки, белок картофеля, глютен пшеницы и кукурузы, белок сои и гороха, белок риса, а также белок люпина. Несомненно, исходный белок должен иметь, по меньшей мере, последовательность -I-P-P- в его последовательности. Предпочтительно белок содержит также последовательность -L-P-P-в его протеиновой последовательности. Как объяснено выше, данный белок может иметь последовательность -V-P-P- в его протеиновой последовательности. Из субстрата, подобного желатину, с высоким содержанием пролина, а также гидропролина, можно производить гидролизаты с беспрецедентно высоким содержанием пептидов или с карбокси-концевым пролином, или с гидроксипролиновым остатком. Так как фермент A.niger (подобно известным пролилолигопептидазам) не способен расщеплять Pro-Pro или Pro-Hyp, или Нур-Нур связи,данный подход будет также давать выход гидролизатов, содержащих беспрецедентно высокое содержание пептидов, имеющих два, три или даже больше карбоксиконцевых пролиновых или гидроксипролиновых остатков. Очевидно, природа и содержание пролина в исходном белковом материале определяет возможность производства таких пептидов. Предпочтительными субстратами являются субстраты, со- 10011865 держащие более 6% пролина (т.е. более 6 г этой аминокислоты на 100 г белка), такого как казеин, желатин, глютены пшеницы и кукурузы. Ввиду того факта, что пептиды, несущие такие карбокси-концевые последовательности аминокислот, как можно ожидать, имеют большие шансы сохраниться при протеолитическом воздействии в желудочно-кишечном тракте, гидролизаты, создаваемые при инкубации с пролилэндопротеазой, получаемой из A.niger, дают превосходный исходный материал для выделения биологически активных пептидов, а также для идентификации новых биологически активных пептидов. Так как натрий, как известно, играет важную роль в гипертензии, предпочтительными субстратами для продукции ингибирующих АПФ пептидов являются кальциевые и калиевые, а не натриевые соли указанных белков. Оптимум рН эндопротеазы, получаемой из A.niger, составляет примерно 4,3 (см. фиг. 1). Из-за этого низкого оптимального рН инкубация казеината коровьего молока с эндопротеазой, получаемой изA.niger, не является само собой очевидным. Казеинат коровьего молока будет осаждаться, если рН падает ниже 6,0, и при этом значении рН фермент из A.niger обладает только ограниченной активностью. Однако в примере 5 показано, что даже эти довольно неблагоприятные условия инкубации с пролилэндопротеазой, получаемой из A.niger, могут давать выход нескольких ингибирующих АПФ пептидов. По данному изобретению ингибирующие АПФ трипептиды IPP и LPP продуцируются с выходом, который соответствует 10% и почти 60%, соответственно, от количества, теоретически присутствующего в казеине. В соответствии с объяснением, представленным в примере 5, данный выход IPP является результатом того факта, что IPP может быть выделен только из каппа-казеина. Если принять это во внимание, получают выход примерно 40%. Предпочтительно, в качестве субстрата в способе данного изобретения использовать осаждаемый кислотой казеин. Совершенно неожиданно, что VPP не продуцируется, несмотря на тот факт, что предшественник VPP, VWPP продуцируется с выходом, сходным с выходом LPP, т.е. почти 60% от теоретически присутствующего. Предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, или еще более предпочтительно по меньшей мере 40%, и наиболее предпочтительно по меньшей мере 60%, -L-PP-последовательностей, присутствующих в протеиновой последовательности, превращается в пептидLPP. Предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, или еще более предпочтительно по меньшей мере 40%, и наиболее предпочтительно по меньшей мере 60%, -I-PP-последовательностей, присутствующих в протеиновой последовательности, превращается в пептидIPP. Пролинспецифическая протеаза предпочтительно способна к гидролизу больших молекул белка,подобных самому субстратному белку. Эти результаты получены при инкубации казеината с эндопротеазой, получаемой из A.niger, в простом одностадийном ферментационном процессе. Водные растворы, содержащие протеин, высоко чувствительны к микробному заражению, особенно если выдержка происходит в течение многих часов при значениях рН выше 5,0 и при температуре 50 С или ниже. В частности, микробные токсины, которые могут продуцироваться во время продолжительных стадий инкубации и, вероятно, сохраняются после стадий нагревания и создают потенциальную угрозу процессам пищевого ранга. В отличие от условий,описанных в ЕР 1231279, в способе по данному изобретению предпочтительно использовать температуру инкубации выше 50 С. В сочетании с одностадийным ферментационным способом, при котором инкубация с ферментом осуществляется в течение периода менее 24 ч, предпочтительно менее 8 ч, более предпочтительно менее 4 ч, способ по данному изобретению представляет преимущество улучшенной устойчивости к микробному заражению. Казеин коровьего молока заключает в себе ряд разных белков, включая бета-казеин и каппа-казеин. В соответствии с известными аминокислотными последовательностями бета-казеин заключает в себе ингибирующие АПФ трипептиды IPP (Ile-Pro-Pro), VPP (Val-Pro-Pro) и LPP (Leu-Pro-Pro). Каппа-казеин включает только IPP. В примере 5 показано, что инкубация казеинатов калия с пролилэндопротеазой,получаемой из A.niger, генерирует известные ингибирующие АПФ пептиды IPP, а также LPP с высоким выходом. Используя данное соотношение фермент-субстрат в сочетании с условиями высокой температуры вырезание IPP и LPP завершается в пределах 3-часового периода инкубации. Совершенно неожиданно может быть продемонстрирована сопутствующая продукция значительного количества трипептида VPP. Тот факт, что фермент, получаемый из A.niger, не содержит какой-либо измеряемой аминопептидазной активности, решительно говорит о том, что образованный IPP выделяется из последовательности -A107-I108-Р 109-Р 110-, присутствующей в каппа-казеине. По-видимому, пептидная связь карбоксиконца IPP расщепляется с помощью главного действия активной пролилэндопротеазы, получаемой изA.niger, тогда как расщепление предшествующей связи Ala-Ile осуществляется с помощью Alaспецифической побочной активности. Поэтому данное изобретение представляет способ получения IPP из протеинового источника, причем отношение продуцируемых IPP к VPP составляет по меньшей мере 5, предпочтительно по меньшей мере 10 и более предпочтительно по меньшей мере 20, который включает использование фермента, который обладает пролинспецифической эндопротеазной активностью, и- 11011865 фермента, который способен к гидролизу связи с аминоконцевой стороны IPP. Предпочтительно фермент, который способен к гидролизу аминоконцевой связи -I-P-P-, в то же время не способен к гидролизу или обладает низкой активностью гидролиза аминоконцевой связи -V-PP-. Хотя были приведены две ферментативные активности в отношении способа данного изобретения, а также фермент, который обладает обеими активностями в одно и то же время, пролинспецифическая эндопротеазная активность и гидролизующее действие на аминоконцевую связь -I-P-P-, соответственно,могут использоваться в данном изобретении, примером этого является пролинспецифическая эндопротеаза, как описано в данном описании, которая предпочтительно происходит из A.niger. Вследствие выбранного способа гидролиза по данному изобретению будет образовываться меньшее число водорастворимых пептидов, чем в способах предшествующего уровня техники. Среди этих водорастворимых пептидов IPP и, необязательно, LPP присутствуют в основном количестве. Это особенно важно в случае, когда необходимы высокие концентрации соединений IPP и необязательно LPP, без многих других, часто менее активных соединений. В соответствии со способом настоящего изобретения предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, наиболее предпочтительно по меньшей мере 40% последовательности -A-I-P-P- или -A-L-P-P-, присутствующей в протеине, превращается в IPP или LPP, соответственно. Кроме того, в соответствии с данным способом предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, еще предпочтительнее по меньшей мере 40% и наиболее предпочтительно по меньшей мере 50% последовательности -P-L-P-Р- или -P-I-P-P-, присутствующей в белке,превращается в LPP или IPP, соответственно. В примере 6 проиллюстрирован эффект 5-кратной очистки IPP на стадии новой и неожиданной очистки. В этом способе гидролизат образуется во время краткого периода инкубации с ферментом при 55 С, рН 6,0 и затем его нагревают до температуры выше 80 С, чтобы убить все загрязняющие микроорганизмы и инактивировать пролилэндопептидазу, получаемую из A.niger. Затем гидролизат подкисляют,для того, чтобы снизить рН до 4,5 или по меньшей мере ниже 5,0. При этом значении рН, которое нельзя использовать для инактивации пролилэндопептидазы, получаемой из A.niger, так как он представляет оптимальное условие для фермента, все большие пептиды из казеината осаждаются, так что только небольшие пептиды остаются в растворе. Так как осажденные казеинаты можно легко удалить с помощью стадий декантации или фильтрования, или низкоскоростного (т.е. ниже 5000 об./мин) центрифугирования, водная фаза содержит биологически активные пептиды в высокой пропорции по отношению к количеству присутствующего протеина. По данным Kjeldahl 80-70% казеинатного белка удаляется на стадии низкоскоростного центрифугирования, что подразумевает четырех-пятикратную очистку ингибирующих АПФ пептидов. Авторы обнаружили, что этот принцип очистки также может применяться с получением преимуществ при производстве биологически активных пептидов, получаемых из другого белкового материала, помимо казеина. А также не только ферментативно продуцируемые гидролизаты, но и белки,которые ферментируются подходящими микроорганизмами, могут быть выделены и очищены по данному способу. Инкубации фермента и субстрата при значении рН, близком к тому, при котором субстрат будет осаждаться, и при котором фермент все еще активен, сделает возможной такую стадию очистки. Благодаря низкому оптимуму рН пролилэндопротеазы, получаемой из A.niger, можно рассматривать осаждение субстрата в интервале от 1,5 до 6,5. Ввиду их специфического поведения в отношении осаждения, осадки глютена при рН выше 3,5, осадки сывороточных белков при рН выше 3,5 и ниже 6,0, белые осадки яичного белка при рН выше 3,5 и ниже 5,0 представляют примеры условий, в которых осаждается гидролизованный белок, и осажденные белки могут быть отделены от гидролизованного белка или пептидов. Эта растворимая фракция гидролизата также содержится в составе гидролизата. Этот растворимый в кислоте гидролизат образуется путем гидролиза белка по данному изобретению с последующим изменением условий кислотности так, что растворимые гидролизованные части можно отделить от растворимых пептидов. Такое разделение может быть выполнено, например, путем осаждения нерастворимых частей или центрифугирования. Что касается гидролизата глютена, условия кислотности для разделения составляют предпочтительно рН=4, для гидролизата сывороточных белков условия кислотности составляют предпочтительно рН 4,5, для гидролизата казеина условия кислотности составляют предпочтительно рН 4,5 и для гидролизата яичного белка условия кислотности составляют предпочтительно рН 5,0. В основном, предпочтительные условия кислотности для разделения составляют рН=4,5. Под гидролизатом подразумевается продукт, который образуется при гидролизе белка (или кратко,протеиновый гидролизат или гидролизованный белок), причем растворимый в кислой среде гидролизат является растворимой фракцией протеинового гидролизата, которая также описана как растворимая пептидная композиция или композиция, содержащая растворимые пептиды) или смесью протеинового гидролизата и растворимого в кислой среде гидролизата. Гидролизаты данного изобретения преимущественно используются при применении в виде нутрицевтиков и в виде пищевых продуктов и напитков. Протеиновый гидролизат, растворимый в кислой среде гидролизат, а также их смесь можно использовать при применении в виде нутрицевтика, применении в виде пищи или напитка. Предпочтительно, растворимый в кислой среде гидролизат используют при применении в качестве нутрицевтика, применении в качестве пищевого продукта или напитка из-за вы- 12011865 сокого содержания данных активных пептидов. Хотя похожий принцип используют в способе изготовления сыра для отделения казеинового творога от белков сыворотки, в процессе изготовления сыра используют только аспарагиноэндопротеазы (ЕС 3.4.23). Эта группа ферментов (ЕС 3.4.23) включает хорошо известные ферменты для изготовления сыра, подобные химозину и разным пепсинам, подобным пепсинам млекопитающих, а также разных микробных пепсинов, подобных аспергиллопепсинам и мукопепсинам. В данном изобретении створоженное молоко или сыворотка в способе изготовления сыра определяется как материал, не являющийся гидролизатом. Кроме того, в способе гидролиза данного изобретения предпочтительно не используют аспарагиноэндопротеазы (ЕС 3.4.23). Кроме того, как обсуждено выше, способ очистки по данному изобретению не испытан в отношении гидролизатов, получаемых с помощью фермента, не относящегося к аспарагинопротеазе. Способ изготовления сыра или способ разделения створоженной массы/сыворотки исключен из способа очистки данного изобретения, поэтому данный способ очистки нацелен на получение растворимых пептидов при условии, что указанный способ не является частью способа изготовления сыра или способа разделения створоженной массы/сыворотки. Несмотря на внешнее сходство стадии очистки со способом изготовления сыра, она полностью является другой. При изготовлении сыра образование створоженной массы начинается или на ферментной стадии (сычужное свертывание), или на стадии подкисления. Однако процесс сычужного свертывания продолжается независимо от подкисления, тогда как коагуляция сырной створоженной массы путем подкисления развивается независимо от фермента. При альтернативном способе очистки пептиды легко и эффективно отделяют от гидролизованного протеина по способу данного изобретения, используя смешиваемый с водой растворитель, такой как этанол, ацетон, пропанол-1, пропанол-2, метанол или их смесь. При таком подходе протеиновый гидролизат предпочтительно осторожно смешивают с 30-60% (об./об.) смешиваемого с водой растворителя в выбранных условиях рН так, что большие белки осаждаются, а малые пептиды, такие как IPP, остаются в растворе. После разделения, например, декантации, фильтрования или низкоскоростного центрифугирования,супернатанты, содержащие биологически активные пептиды могут быть выделены в чистом виде. Полученную композицию, содержащую пептид (или содержащую растворимый пептид), при необходимости обрабатывают дополнительным ферментом, например, чтобы повысить уровень активных ингибирующих АПФ пептидов (примеры 12 и 13), или пептидную композицию можно приводить в контакт с селективно связывающими веществами, такими как активированный уголь, хроматографические смолы из ряда Amberlite XAD (Rohm) или бутилсефарозные смолы, которые поставляет Pharmacia. Последующее выпаривание и необязательно стадия распылительной сушки дадут экономичный путь получения пасты или порошка пищевой марки с высокой биологической активностью. При расщеплении казеинатов получают белый без запаха порошок с высокой концентрацией ингибирующих АПФ пептидов, который богатIPP и LPP. При соответствующем разбавлении до правильной концентрации трипептида получают многоцелевой исходный материал с превосходной вкусовой привлекательностью, пригодный для добавления во все виды пищевых продуктов и напитков со свойствами ингибирования АПФ. Если необходимо, концентрацию биологически активных ингредиентов можно дополнительно повысить последующей очисткой, при которой используется гидрофобный характер пептидов IPP и LPP. Предпочтительные методы очистки включают нанофильтрование, экстрагирование, например, гексаном или бутанолом, с последующим выпариванием/осаждением, или контактирование подкисленного гидролизата, который получен, со связывающими веществами, подобными активированному углю или хроматографическим смолам из ряда Amberlite XAD (Roehm). А также можно использовать бутилсефарозные смолы, которые поставляет Pharmacia. Десорбцию ингибирующих АПФ пептидов с таких веществ можно выполнять органическими растворителями, подобными смесям метанола/этанола, или пропанолом. Пептиды, которые получены или перед, или после дополнительной (например, хроматографией) стадии очистки, можно использовать для включения в пищевые продукты или напитки, которые широко потребляются на основе регулярности. Примеры таких продуктов являются маргарины, пасты, различные молочные продукты, такие как сливочное масло или йогурты, или молоко, или содержащие сыворотку напитки, предпочтительно, продукты на основе йогурта или молока, такие как йогурт и молоко. Гидролизаты данного изобретения можно также использовать и в других напитках, таких как фруктовые напитки или соевые напитки. Другой альтернативой является использование гидролизата в продуктах лечебного питания, таких как фруктовые батончики, белковые батончики, энергетические батончики, продукты на основе зерна,например зерновые завтраки. Другой аспект данного изобретения относится к пищевым продуктам, напиткам или диетическим добавкам, которые получают по описываемому способу или способом, описанным ранее, причем указанный способ получения пищевого продукта или напитка включает стадии (а) получения композиции, содержащей IPP, из белкового источника, причем массовое отношение IPP к VPP, получаемых из белка,составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1 и более предпочтительно по меньшей мере 20:1, который включает использование пролинспецифической эндопротеазы; и (b) вклю- 13011865 чения указанной композиции, содержащей IPP, в пищевой продукт, напиток или диетическую добавку. Предпочтительно указанный пищевой продукт, напиток или диетическая добавка по данному изобретению содержит от 0,05 до 10 мас.%, более предпочтительно от 0,1 до 5 мас.%, наиболее предпочтительно от 0,2 до 4 мас.% указанной композиции, содержащей IPP, или гидролизата белка. Также предпочтительно, когда пищевой продукт или напиток или диетическая добавка по данному изобретению содержит на 100 г продукта от 0,05 до 50 мг IPP, более предпочтительно от 0,1 до 40 мг, наиболее предпочтительно от 0,2 до 30 мг. Также предпочтительно, когда в пищевом продукте или диетической добавке данного изобретения массовое отношение IPP к VPP составляет от 5:1 до 100:1, более предпочтительно от 5:1 до 48:1. Также предпочтительно, когда пищевой продукт или напиток или диетическая добавка по данному изобретению включает как IPP, так и LPP, причем массовое отношение IPP к LPP составляет от 1:10 до 1:1, более предпочтительно от 1,5:7,1 до 4,8:7,1. Предпочтительно пищевой продукт или напиток, или диетическая добавка выбраны из маргарина разных видов, пасты разных видов, молочных продуктов или содержащих сыворотку напитков, предпочтительно йогурта или продуктов на основе молока, таких как йогурт или молоко, причем указанные пищевой продукт или напиток, или диетическая добавка содержит количество гидролизата белка или количество IPP, которые указаны выше. Особенно предпочтительными являются пищевой продукт или напиток, или диетические добавки, которые описаны выше для применения для облегчения гипертензии у людей. Предпочтительные размеры порции для пищевого продукта, напитка или диетических добавок представляют, например, 5-350 г на порцию, например от 5 до 150 г. Предпочтительно число порций на сутки составляет 1-10, например 2-5. Хотя такие композиции обычно вводятся людям, их можно также вводить животным, предпочтительно млекопитающим, для облегчения гипертензии. Кроме того, высокая концентрация ингибиторов АПФ или других биологически активных пептидов в полученных продуктах делает эти продукты очень полезными для включения в диетические добавки в виде пилюль, таблеток или высоко концентрированных растворов, или паст, или порошков. Диетические добавки с замедленным высвобождением, которые будут обеспечивать непрерывное высвобождение ингибирующих АПФ пептидов или других биологически активных пептидов, представляют особый интерес. Ингибирующие АПФ пептиды или другие биологически активные пептиды по данному изобретению могут быть переработаны в виде сухого порошка,например, в пилюли, таблетки, гранулы, пакетики или капсулы. Альтернативно, ферменты по данному изобретению могут быть переработаны в жидкость, например сироп или капсулы. Композиции, используемые в разных препаратах и содержащие ферменты по данному изобретению, могут также включать по меньшей мере одно соединение из группы, состоящей из физиологически приемлемого носителя, вспомогательного вещества, эксципиента, стабилизатора, буфера и разбавителя, эти термины использованы в их обычном смысле, чтобы представить вещества, которые помогают упаковке, доставке, всасыванию,стабилизации или, в случае вспомогательного вещества, повышению физиологического эффекта ферментов. Существенную исходную информацию по разным соединениям, которые можно использовать в сочетании с ферментами по данному изобретению в порошковой форме, можно найти в PharmaceuticakDosage Forms, second edition, Volumes 1, 2 and 3, ISBN 0-8247-8044-2 Marcel Dekker, Inc. Хотя ингибирующие АПФ пептиды по данному изобретению, полученные в виде сухого порошка, можно хранить в течение довольно длительных сроков, контакт с влагой или влажным воздухом должен быть исключен путем выбора подходящей упаковки, такой, например, как алюминиевые штампованные упаковки (блистеры). Относительно новая форма для перорального применения представляет использование разных типов желатиновых капсул или таблеток на основе желатина. Ввиду значимости природных ингибирующих АПФ пептидов для борьбы с гипертензией данный новый и рентабельный путь предлагает привлекательный исходный пункт для мягко действующих гипотензивных пищевых или даже ветеринарных продуктов. Так как данный путь включает также неожиданно простую стадию очистки, возможности снижения давления крови концентрированными диетическими добавками также расширяются. Способ по данному изобретению можно осуществлять, используя любую пролинспецифическую олиго- или эндопротеазу. Под пролинспецифическими олигопептидазами по данному изобретению или применяемыми по данному изобретению подразумевают ферменты, принадлежащие к ЕС 3.4.21.26. Под пролинспецифической эндопротеазой по данному изобретению или применяемой по данному изобретению предпочтительно подразумевают полипептид, который приведен в пп.1-5, 11 и 13 в WO 02/45524. Поэтому пролинспецифическая эндопротеаза является полипептидом, который обладает пролинспецифической эндопротеолитической активностью, выбранной из группы, состоящей из: (а) полипептида, который имеет аминокислотную последовательность, которая имеет по меньшей мере 40% идентичность аминокислотной последовательности с аминокислотами 1-526 SEQ ID NO:2 или ее фрагментом; (b) полипептида, который кодируется полинуклеотидом, который гибридизируется в слабо жестких условиях с (i) последовательностью нуклеиновой кислоты SEQ ID NO:1 или ее фрагментом, которая является по меньшей мере на 80 или 90% идентичной свыше 60, предпочтительно свыше 100 нуклеотидам, более предпочтительно по меньшей мере на 90% идентична свыше 200 нуклеотидам, или (ii) последовательностью нуклеиновой кислоты, комплементарной последовательности нуклеиновой кислотыSEQ ID NO:1. SEQ ID NO:1 и SEQ ID NO:2, как показано в WO 02/45524. Предпочтительно полипептид находится в изолированной форме. Предпочтительный полипептид, используемый по данному изобретению, имеет аминокислотную последовательность, которая имеет по меньшей мере 50%, предпочтительно по меньшей мере 60%,предпочтительно по меньшей мере 65%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 97% идентичность с аминокислотами 1-526 SEQ ID NO:2 или включающей аминокислотную последовательность SEQ ID NO:2. Предпочтительно, данный полипептид кодируется полинуклеотидом, который гибридизуется в слабо жестких условиях, более предпочтительно, в условиях средней жесткости, и наиболее предпочтительно, в условиях высокой жесткости, с (i) последовательностью нуклеиновой кислоты SEQ ID NO:1 или ее фрагментом, или (ii) последовательностью нуклеиновой кислоты, комплементарной последовательности нуклеиновой кислоты SEQ ID NO:1. Термин способный к гибридизации означает, что целевой полинуклеотид данного изобретения может гибридизоваться с нуклеиновой кислотой, используемой в качестве пробы (например, нуклеотидной последовательностью, представляемой SEQ ID NO:1 или ее фрагментом, или комплементарной SEQID NO:1) на уровне значительно выше фонового. Данное изобретение включает также полинуклеотиды,которые кодируют пролинспецифическую эндопротеазу данного изобретения, а также нуклеотидные последовательности, которые являются комплементарными им. Нуклеотидная последовательность может быть РНК или ДНК, включая геномную ДНК, синтетическую ДНК или кДНК. Предпочтительно нуклеотидная последовательность является ДНК, и наиболее предпочтительно последовательностью геномной ДНК. Обычно полинуклеотид данного изобретения включает соседнюю последовательность нуклеотидов, которая способна к гибридизации в выбранных условиях с кодирующей последовательностью или последовательностью, комплементарной кодирующей последовательности SEQ ID NO:1. Такие нуклеотиды могут быть синтезированы способами, хорошо известными специалистам в данной области. Полинуклеотид данного изобретения может гибридизоваться с кодирующей последовательностью или комлементарной кодирующей последовательности SEQ ID NO:1 на уровне значительно выше фонового. Фон гибридизации может происходить, например, из-за других ДНК, присутствующих в библиотеке кДНК. Уровень сигнала, генерируемого взаимодействием между полинуклеотидом данного изобретения и кодирующей последовательностью или комплементарной кодирующей последовательности SEQID NO:1 обычно по меньшей мере в 10 раз, более предпочтительно по меньшей мере в 50 раз и еще предпочтительнее по меньшей мере в 100 раз интенсивнее взаимодействий между другими полинуклеотидами и кодирующей последовательностью SEQ ID NO:1. Интенсивность взаимодействия может быть измерена, например, с помощью радиоактивно меченой пробы, например 32 Р. Селективной гибридизации можно обычно достичь при использовании условий низкой жесткости (0,3 М хлорида натрия и 0,03 М цитрат натрия при примерно 40 С), средней жесткости (например, 0,3 М хлорида натрия и 0,03 М цитрат натрия при примерно 50 С) или высокой жесткости (например, 0,3 М хлорида натрия и 0,03 М цитрат натрия при примерно 60 С). Блок UWGCG обеспечивает программу BESTFIT, которую можно использовать для расчета идентичности (например, с использованием его стандартных настроек). Алгоритмы PILEUP и BLAST N также можно использовать для расчета идентичности последовательности или для выстраивания последовательностей (таких как идентифицирующая эквивалентная или соответствующая последовательности, например, по их стандартным настройкам). Программное обеспечение для выполнения BLAST анализов свободно доступно через Национальный центр биотехнологической информации (National Center for Biotechnology Information;http://www.ncbi.nlm.nih.gov/). Этот алгоритм включает первую идентификацию пары последовательностей с высокими количественными показателями (HSP) путем идентификации коротких групп с длинойW в запрашиваемой последовательности, которая или соответствует, или удовлетворяет некоторой пороговой оценке с положительной величиной Т, когда совмещается с группой той же длины в последовательности из базы данных. Эти первоначальные совпадения соседних групп действуют как затравки для инициирующих поисков, чтобы найти HSP, содержащие их. Совпадения групп распространяются в обоих направлениях по каждой последовательности, поскольку кумулятивная оценка сравнительного анализа структуры может повышаться. Расширение совпадений групп в каждом направлении может прекращаться, когда кумулятивная оценка сравнительного анализа структуры падает на количество X от ее максимально достигнутого значения; кумулятивная оценка доходит до нуля или ниже из-за накопления одного или нескольких отрицательно оцененных сравнений остатков; или когда достигнут конец одной из последовательностей. Параметры алгоритма BLAST, W, Т и X, определяют чувствительность и скорость сравнения. В программе BLAST используются в качестве значений по умолчанию длина группы (W),равная 11, оценивающие матричные сравнения BLOSUM62 (В) равные 50, математическое ожидание (Е),равное 10, М=5, N=4 и сравнение обоих цепей. Алгоритм BLAST выполняет статистический анализ подобия между двумя последовательностями.- 15011865 Одной из мер подобия, обеспечиваемой алгоритмом BLAST, является наименьшая сумма вероятности(P(N, которая дает показание вероятности, по которому совпадение между двумя нуклеотидами или аминокислотными последовательностями должны происходить случайно. Например, последовательность рассматривают как подобную другой последовательности, если наименьшая суммарная вероятность при сравнении первой последовательности со второй последовательностью составляет меньше примерно 1,предпочтительно меньше примерно 0,1, более предпочтительно менее примерно 0,01, и наиболее предпочтительно менее примерно 0,001. Штаммы рода Aspergillus имеют статус пищевой марки, и ферменты, получаемые из этих микроорганизмов, как известно, происходят из не вызывающего подозрений источника пищевой марки. В соответствии с другим предпочтительным воплощением фермент является секретируемым продуцирующими его клетками, а не несекретируемым, так называемым цитозольным ферментом. Таким образом, ферменты могут быть выделены из бульона для роста клеток в, по существу, чистом состоянии без дорогих стадий очистки. Предпочтительно, фермент имеет высокое сродство к его субстрату в превалирующих условиях рН и температуры. Описание фигур Фиг. 1 - графическое представление оптимума рН для пролилэндопротеазы, получаемой из A.niger; фиг. 2 - Специфические характеристики пролилэндопротеазы, получаемой из A.niger; фиг. 3 - ПААГ-ДСН (SDS-PAGE) неповрежденного овальбумина и синтетического 27-мерного пептида после инкубации с хроматографически очищенной пролинспецифической эндопротеазой, полученной из A.niger; фиг. 4 - Относительная активность трех коммерчески доступных препаратов ферментов, содержащих аминопептидазу, испытанных при рН 6,0 на синтетических субстратах F-pNA, Q-pNA и V-pNA. Пищевой распыляемый материал казеината калия (88%) получали от DMV International, Нидерланды. Синтетические хромогенные пептиды получали или от Pepscan Systems B.V., Нидерланды или от(Япония) и колоразу LAP Ch.: 4123 от АВ Enzymes (UK). Пролинспецифическая эндопротеаза из A.niger. Сверхпродукцию пролинспецифической эндопротеазы из A.niger осуществляли, как описано в WO 02/45524. Активность фермента оценивали на синтетическом пептиде Z-Gly-Pro-hNA при 37 С в цитрат/динатрийфосфатном буфере с рН 4,6. Продукт реакции контролировали спектрофотометрически при 405 нМ. Единицу измерения определяли как количество фермента, которое освобождает 1 мкмоль пнитроанилида в минуту в этих условиях испытания. Хроматографическая очистка эндопротеазы, полученной из A.niger Культуральный бульон, полученный от сверхпродуцирующего штамма A.niger, использовали для хроматографической очистки протеазы для удаления какой-либо загрязняющей эндо- и экзопротеолитической активности. С этой целью ферментационный бульон сначала центрифугировали, чтобы удалить основную часть массы гриба, и надосадочную жидкость затем пропускали через ряд фильтров со снижающимися размерами пор для удаления фрагментов клеток. И, наконец, полученный ультрафильтрат разводили в десять раз 20 миллимоль/литр раствором ацетата натрия при рН 5,1 и наносили на колонкуQ-сефарозы FF. Протеины элюировали градиентом от 0 до 0,4 моль/л NaCl в 20 миллимоль/л растворе ацетата натрия при рН 5,1. Фракции пика концентрации, проявляющие активность в отношении расщепления Z-Gly-Pro-pNA, собирали и объединяли по методике, описанной в World Journal of MicrobiologyBiotechnology 11, 209-212 (1995), но в слегка модифицированных условиях исследования. Принимая во внимание кислый оптимум рН пролинспецифической эндопротеазы, полученной из A.niger, анализ фермента проводили при рН 4,6 в цитрат/дифосфатном буфере при 37 С. Объединение активных фракций с последующим концентрированием в конце давали препарат, который демонстрировал только одну полосу при ПААГ-ДСН и один пик на HP-SEC. Дополнительный анализ хроматографией гидрофобного взаимодействия подтвердил чистоту полученного ферментного препарата. Анализ ЖХ/МС/МС ВЭЖХ с использованием масс-спектрометра с ионной ловушкой (Thermo Electron, Breda, Нидерланды), соединенного с насосом Р 4000 (Thermo Electron, Breda, Нидерланды) использовали для количественного определения представляющих интерес пептидов, среди указанных пептидов находятся IPP(M=325,2), LPP (М=325,2), VPP (M=311,2), VVVPP (М=509,3) и VVVPPF (М=656,4) в ферментативных гидролизатах белка, получаемых по способу данного изобретения. Образовавшиеся пептиды выделяли,используя колонку Inertsil 3 ODS 3, 3 мкм, 1502.1 mm (Varian Belgium, Бельгия) в сочетании с градиентом 0,1% муравьиной кислоты в воде Milli Q (Millipore, Bedford, MA, USA; раствор А) и 0,1% муравьиной кислоты в ацетонитриле (раствор В) для элюирования. Исходный градиент, представлявший собой 100% раствор А, выдерживали в таком значении в течение 5 мин, линейно повышая до 5% раствора В в течение 10 мин, с последующим линейным повышением до 45% раствора В в течение 30 мин, и сразу переходя к исходным условиям, которые выдерживали 15 мин для стабилизации. Используемый объем- 16011865 инъекции составлял 50 мкл, скорость потока составляла 200 мкл в минуту, и температуру колонки сохраняли на уровне 55 С. Концентрация белка во вводимом образце составляла примерно 50 мкг/мл. Подробную информацию по конкретным пептидам получали путем использования специальной МС/МС для представляющих интерес пептидов, используя оптимальную энергию столкновения, равную примерно 30%. Количественное определение конкретных пептидов выполняли, используя внутреннюю калибровку, применяя полностью меченный по изолейцину N15, С 13 IPP (М=332,2) путем использования наибольших по количеству ионов, наблюдаемых при МС/МС фрагментов для всех значимых анализируемых пептидов. Все используемые пептиды синтезировали с помощью Pepscan (Lelystad,Нидерланды). Трипептид LPP (М=325,2) использовали для настройки на оптимальную чувствительность в МС методе и на оптимальную фрагментацию при МС/МС методе, осуществляя постоянную инфузию 5 мкг/мл, дающую в результате протонированную молекулу при МС методе и оптимальную энергию столкновения, равную примерно 30% при МС/МС методе, с генерацией серий В- и Y-ионов. Перед ЖХ/МС/МС ферментативные гидролизаты белка центрифугировали при комнатной температуре и 13000 об./мин в течение 10 мин, фильтровали через 0,22 мкм фильтр и надосадочную жидкость разводили 1:100 деминерализованной водой, профильтрованной через оборудование для фильтрации воды Millipore (MilliQ водой). Степень гидролиза Степень гидролиза (СГ), которую получали во время инкубации с разными протолитическими смесями, контролировали, используя быстрый тест ОРА (Nielsen, P.M./ Petersen, D.; Dambmann, С. Improvedmethod for determinating food protein degree of hydrolysis. Journal of Food Science 2001, 66, 642-646). Азот по Кьельдалю Общий азот по Кьельдалю определяли анализом струйного впрыскивания. Используя систему для струйного впрыскивания Tecator FIASTAR 5000 с кассетой 5000-040 для метода TKN, компьютером Pentium 4 с программным обеспечением SOFIA и автоматическим пробоотборником Tecator 5027, аммиак,выделяющийся из содержащих белок растворов определяли количественно при 590 нм. Количество образца, соответствующего динамическому интервалу метода (0,5-20 мг N/I) помещали в трубку для расщепления вместе с 95-97% серной кислоты и Kjeltab подвергали расщеплению по программе 30 мин при 200 С с последующими 90 мин при 360 С. После впрыскивания в систему FIASTAR 5000 измеряли пик азота, по которому может быть выведено определяемое количество белка. Нутрицевтические продукты Нутрицевтические продукты по данному изобретению могут представлять собой любой вид пищи. Они могут содержать обычные пищевые ингредиенты в дополнение к пищевому продукту, такие как вкусовая добавка, сахар, фрукты, минералы, витамины, стабилизаторы, загустители и т.д. в подходящем количестве. Предпочтительно, нутрицевтический продукт содержит 50-200 ммоль/кг K+ и/или 15-60 ммоль/кг 2+ Са , и/или 6-25 ммоль/кг Mg2+, более предпочтительно 100-150 ммоль/кг K+, и/или 30-50 ммоль/кг Са 2+,и/или 10-25 ммоль/кг Mg2+ и наиболее предпочтительно 110-135 ммоль/кг K+, и/или 35-45 ммоль/кг Са 2+,и/или 13-20 ммоль/кг Mg2+. Эти катионы обладают благоприятным действием дополнительного снижения давления крови, когда их включают в нутрицевтические продукты по данному изобретению. Преимущественно нутрицевтический продукт содержит В-витамины. В-витамин, фолиевая кислота, как известно, участвует в метаболизме гомоцистеина, аминокислоты питания человека. В течение ряда лет высокие уровни гомоцистеина соотносили с высоким процентом сердечно-сосудистых заболеваний. Полагают, что снижение уровней гомоцистеина может снижать риск сердечно-сосудистых заболеваний. Витамины В 6 и В 12, как известно, вмешиваются в биосинтез пурина и тиамина, участвуют в синтезе метильной группы в процессе метилирования гомоцистеина для получения метионина и в нескольких процессах роста. Витамин В 6 (пиридоксина гидрохлорид) является известной витаминной добавкой. Витамин В 12 (цианокоболамин) способствует здоровью нервной системы и участвует в продукции красных клеток крови. Он также известен как витамин в пищевых добавках. Из-за их сочетанного положительного действия по снижению риска сердечно-сосудистых заболеваний предпочтительно, чтобы продукты по данному изобретению включали витамин В 6, витамин В 12 и фолиевую кислоту. Количество В-витаминов в нутрицевтическом продукте может быть рассчитано специалистом в данной области на основе суточных количеств этих В-витаминов, представленных здесь: фолиевая кислота: 200-800 мкг/сутки, предпочтительно 200-400 мкг/сутки; витамин В 6: 0,2-2 мг/сутки, предпочтительно 0,5-1 мг/сутки и витамин В 12: 0,5-4 мкг/сутки, предпочтительно 1-2 мкг/сутки. Предпочтительно нутрицевтический продукт содержит от 3 до 25 мас.% стерина, более предпочтительно от 7 до 15 мас.% стерина. Преимущество включения стерина состоит в том, что он будет вызывать снижение уровня ЛНП-холестерина в человеческой крови, что будет давать в результате снижение риска сердечно-сосудистых заболеваний.- 17011865 Где дается ссылка на стерин, это включает насыщенные станолы и этерифицированные производные стерина/станола или смесей любых из них. В данном описании, где дается ссылка на сложный эфир стерина, это также включает его насыщенные производные, сложные эфиры станолов и комбинации сложных эфиров стеринов и станолов. Стерины и фитостерины, известные также как растительные стерины или овощные стерины, могут быть разделены на три группы, 4-дезметилстерины, 4-монометилстерины и 4,4'-диметилстерины. В маслах они, главным образом, существуют в виде свободных стеринов и сложных эфиров стеринов и жирных кислот, хстя также присутствуют стериновые глюкозиды и ацилированные стериновые глюкозиды. Существуют три главных фитостерина, а именно бета-ситостерин, стигмастерин и кампестерин. Схематические изображения средних величин компонентов являются такими, как представлено в "Influence ofProcessing on Sterols of Edible Vegetable Oils", S.P. Kochhar; Prog. Lipid Res. 22: pp. 161-188. Соответствующие 5-альфа-насыщенные производные, такие как ситостанол, кампестанол и эргостанол и их производные в данном описании называются станолами. Предпочтительно, (необязательно этерифицированные) стерин и станол выбирают из группы, включающей сложный эфир жирной кислоты и-ситостанола, кампестерина, кампестанола, стигмастерина, брассикастерина, брассикастанола или их смеси. Стерины или станолы являются необязательно, по меньшей мере, частично этерифицированными жирной кислотой. Предпочтительно, стерины или станолы этерифицированы одной или несколькими С 222 жирными кислотами. Для целей данного изобретения термин С 2-22 жирная кислота относится к любой молекуле, содержащей С 2-22 главную цепь и по меньшей мере одну кислотную группу. Хотя в данном контексте и не предпочтительно, С 2-22 главная цепь может быть частично замещенной, или могут присутствовать боковые цепи. Предпочтительно, однако, когда С 2-22 жирные кислоты имеют линейные молекулы, содержащие одну или две кислотных групп в виде концевых(ой) групп(ы). Наиболее предпочтительными являются линейные С 8-22 жирные кислоты, такие как встречающиеся в природных маслах. Подходящими примерами любых таких жирных кислот являются уксусная кислота, пропионовая кислота, масляная кислота, капроновая кислота, каприловая кислота, каприновая кислота. Другими подходящими кислотами являются, например, лимонная кислота, молочная кислота, щавелевая кислота и малеиновая кислота. Наиболее предпочтительными являются миристиновая кислота, лауриновая кислота, пальмитиновая кислота, стеариновая кислота, арахидоновая кислота, бегеновая кислота, олеиновая кислота, цетолеиновая кислота, эруковая кислота, линолевая кислота и линоленовая кислота. При необходимости можно использовать смесь жирных кислот для этерификации стеринов или станолов. Например, можно использовать существующие в природе жир или масло в качестве источника жирной кислоты и осуществлять этерификацию путем переэтерификации. Описанные выше нутрицевтические ингредиенты, способствующие улучшению здоровья сердечнососудистой системы, K+, Са 2+ и Mg2+, В-витамины (фолиевая кислота, В 6, В 12) и стерины все вместе называются ингредиентами здоровья сердца. Пример 1. Фермент, который получен из A.niger, представляет новую группу пролинспецифических ферментов В полной кодирующей последовательности пролинспецифической эндопротеазы, получаемой изA.niger, которая представлена в WO 02/45524, может быть определена последовательность для протеина из 526 аминокислот. Новизна данного фермента подтверждена исследованиями BLAST баз данных, таких как SwissProt, PIR и trEMBL. Неожиданно было обнаружено, что нельзя определить четкой гомологии между ферментом из A.niger и известными пролилолигопептидазами. Более подробное исследование аминокислотной последовательности, однако, выявило низкую, но значительную гомологию к Pro-Х карбоксипептидазам (ЕС 3.4.16.2), дипептидиламинопептидазам I (ЕС 3.4.14.2) и тимусспецифическим серинопротеазам. Все из указанных ферментов были выделены в семейство S28 клана SC серинпептидаз(Handbook of Proteolitic Enzymes; Barrett F.J.; Rawlings N.D.; Woessner J.F., Eds.; Academic Press, London,UK, 1998, 369-415). Конфигурация GSY G вокруг активного сайта серина сохраняется среди этих ферментов и эндопротеазы, получаемой из A.niger. Кроме того, представители семейства S28 имеют кислый оптимум рН, обладают специфичностью в отношении расщепления на карбокси-концевой стороне пролиновых остатков и синтезируются с помощью сигнальной последовательности и пропептида таких как у эндопротеазы, получаемой из A.niger. A также размер фермента A.niger подобен размерам представителей семейства S28. Поэтому пролинспецифическая эндопротеаза A.niger, по-видимому, является представителем семейства S28 серинпротеаз, а не семейства S9, в которое сгруппировано большинство цитозольных пролилолигопептидаз, включая фермент, полученный из Flavobacterium meningosepticum. На основе этих структурных и физиологических особенностей авторы заключили, что фермент A.niger принадлежит к семейству S28, а не к семейству S9 клана SC серинпротеаз. Дополнительной особенностью,которая отличает фермент, получаемый из A.niger, от пролилолигопептидаз, принадлежащих к семействуS9, является фактом того, что в отличие от цитозольных пролилэндопротеаз, принадлежащих к последнему семейству, недавно идентифицированный фермент A.niger секретируется в ростовую среду.- 18011865 Пример 2. Оптимумы рН и температуры для пролинспецифической эндопротеазы, которая получена из A.niger Чтобы установить оптимум рН для пролинспецифической эндопротеазы, получаемой из A.niger, готовили буферы с разными значениями рН. Буферы с рН 4,0-4,5-4,8-5,0-5,5 и 6,0, используя 0,05 моль/лNa-ацетат и 0,02 М CaCl2; буферы с рН 7,0 и 8,0 готовили, используя 0,05 М буферы Трис/HCl, содержащие 0,02 М CaCl2. Показатель рН доводили до данных значений, применяя уксусную кислоту и HCl, соответственно. Хромогенный синтетический пептид Z-Gly-Pro-pNA использовали в качестве субстрата. Субстраты pNA (п-нитроанилид) дают изменение цвета, если расщепляется X-pNA пептидная связь. Буферный раствор, раствор субстрата и пролилэндопротеазы (с активностью 0,1 Ед/мл) нагревали точно до 37 С на водяной бане. После смешивания реакцию отслеживали спектрофотометрически при 405 нм при 37,0 С в течение 3,5 мин, проводя измерения каждые 0,5 мин. По результатам, представленным на фиг. 1, ясно, что пролинспецифическая эндопротеаза, получаемая из A.niger, имеет оптимум рН около 4. Устанавливали оптимум температуры для пролилэндопептидазы. С этой целью очищенный препарат фермента инкубировали в 0,1 моль/л растворе ацетата Na, содержащего 0,02 моль/л CaCl2 при рН 5,0 в течение 2 ч при разной температуре, используя казеинат резофурина (Roche Diagnostics, Almere, Нидерланды) в качестве субстрата, и активность фермента количественно определяли путем измерения поглощения при 574 нм. По полученным результатам, пролинспецифическая эндопротеаза из A.niger имеет оптимум температуры около 50 С. Пример 3. Специфичность пролинспецифической эндопротеазы, которая получена из A.niger Образцы неочищенного, а также хроматографически очищенного фермента, которые получены из штамма A.niger, содержащего множественные копии кассеты экспрессии (сравните, WO C2/45524) испытывали в отношении коллекции хромогенных пептидных субстратов, чтобы установить специфичность кодируемой эндопротеазы. Эндопротеолитическую активность фермента испытывали на субстратахAAXpNA, в которых X представляет разные природные аминокислотные остатки. Стандартные растворы субстратов AAX-pNA (150 ммоль/л) разводили 100 Х 0,1 М ацетатным буфером с рН 4,0, содержащим 20 мМ CaCl2. При 10-минутных кинетических измерениях при 40 С в считывающем устройстве TECAN Genios MTP (Salzburg, Vienna) при 405 нм регистрировали повышение оптической плотности. Получаемые данные дополнительно обрабатывали в Excel с получением картины, показанной на фиг. 2. По результату ясно, что эндопротеаза, получаемая из A.niger, является высоко специфической в отношении пролильных пептидных связей с побочной активностью в отношении аланильных связей. Неочищенные и хроматографически очищенные препараты продемонстрировали сходные характеристики активности. Пример 4. Пролинспецифическая эндопротеаза, получаемая из A.niger, может гидролизовать крупные протеины, а также малые пептиды и, таким образом, является настоящей эндопротеазой. Из-за специфической структурной особенности пролилолигопептидазы, принадлежащие к семейству S9 клана SC сериновых протеаз, не могут расщеплять пептиды крупнее, чем из 30 аминокислот. Это ограничение является явным недостатком для фермента, который должен гидролизовать настолько быстро и так эффективно, как возможно, разные пептиды. Чтобы увидеть, проявляются ли у пролинспецифической эндопротеазы, получаемой из A.niger, такие же ограничения в отношении размера молекулы субстрата, хроматографически очищенную пролилэндопептидазу из A.niger инкубировали с небольшим синтетическим пептидом и с овальбумином с большой молекулой, чтобы изучить кинетику деградации этих субстратных молекул. Используемый синтетический пептид был 27-мером с последовательностью NH2FRASDNDRVIDPGKVETLTIRRLHIPR-COOH и был подарком компании Pepscan (Lelystad, Нидерланды). Как показано по его аминокислотной последовательности, этот пептид содержит 2 пролиновых остатка, один в середине и один на самом конце пептида. Используемый овальбумин с неповрежденной молекулой (Pierce Imject, флаконы, содержащие 20 мг лиофилизированного материала) состоит из 385 аминокислот и имеет молекулярную массу 42750 Да. Эта молекула содержит 14 пролиновых остатков, один из которых расположен на самом С-конце молекулы и не может быть отщеплен пролинспецифической эндопротеазой. Овальбумин и олигопептид отдельно инкубировали при 50 С с очищенной пролинспецифической эндопротеазой, получаемой из A.niger. Через несколько временных интервалов отбирали образцы, которые анализировали, используя ПААГ-ДСН. Хроматографически очищенную пролинспецифическую эндопротеазу, получаемую из A.niger, с активностью 4,5 ед/мл разводили в 100 раз 0,1 М ацетатным буфером с рН 4, содержащим 20 мМ CaCl2. Овальбумин растворяли в ацетатном буфере с рН 4 до концентрации 1 мг/мл (22 мкМ). 27-мер растворяли в том же буфере до достижения концентрации 0,48 мг/мл (152 мкМ). Молярность овальбумина и раствора 27-мера выбирали таким образом, чтобы оба раствора содержали одинаковую молярность при расщепляемых пролиновых остатках. Овальбумин содержит 13 потенциальных сайтов пролинового расщепления, тогда как 27-мерный пептид имеет только два. Из обоих растворов субстратов инкубировали- 19011865 0,5 мл с 10 мкл (0,45 миллиЕд) раствора фермента в термосмесителе Eppendorf при 50 С. Через несколько временных интервалов отбирали 10 мкл образцы из инкубируемой смеси и выдерживали при 20 С до ПААГ-ДСН. Вещества, используемые для ПААГ-ДСН и окрашивания, закупали у Invitrogen (Breda, Нидерланды). Образцы готовили, используя LDS буфер по инструкциям производителей и разделяли на 12% бис-Трис гелях с использованием MES-SDS буферной системы по инструкциям производителей. Окрашивание выполняли, используя простую синюю безопасную краску (Simply Blue Safe Stain; Colloidal Coomassie G250). Как можно видеть на фиг. 3 овальбумин расщепляется ферментом, получаемым из Aspergillus, на отдельные отрезки из примерно 35-36 кДа в первые 4,75 ч инкубации (полоса 3). Продолжительные периоды инкубации дают в результате дополнительное расщепление на продукты меньшего размера с разной молекулярной массой (полоса 7). Инкубация с 27-мерным пептидом и ферментом также дает в результате быстрое разложение, о котором можно будет судить по относительно слабым и более размытым полосам 4, 6 и 8. Так как 27 мерный пептид разрывается с той же длиной шага, что и молекула овальбумина со значительно большими размерами, можно заключить, что в отличие от известных пролилолигопептидаз, принадлежащих к семейству S9, пролинспецифическая эндопротеаза, получаемая из A.niger, не обладает преимуществом расщепления пептидов малого размера по отношению к белкам большего размера. Это наблюдение показывает, что фермент, получаемый из A.niger, представляет настоящую эндопротеазу и предпочтительный фермент для гидролиза разных видов белков. Эти данные привели к неожиданному использованию фермента, которое проиллюстрировано в следующем примере. Пример 5. Инкубация казеината калия с пролинспецифической эндопротеиназой из A.niger быстро производит IPP и LPP, но не VPP В этом эксперименте сверхпродуцированную и, по существу, чистую пролинспецифическую эндопротеиназу из A.niger инкубировали с казеинатом калия, чтобы провести испытание на выход ингибирующих АПФ пептидов IPP, VPP, а также LPP. Используемая эндопротеаза была, по существу, чистой,что означает, что отсутствовала значительная протеолитическая активность, кроме эндопротеолитического действия, присущего чистой пролинспецифической эндопротеазе (т.е. карбоксиконцевого расщепления остатков пролина и аланина) (ср. пример 7). Чтобы ограничить потребление натрия в результате расщепления ингибирующих АПФ пептидов насколько возможно, использовали казеинат калия в качестве субстрата для этой инкубации. Казеинат суспендировали в воде при 65 С в концентрации 10% (мас./мас.) протеина, после чего рН доводили до 6,0, используя фосфорную кислоту. Затем суспензию охлаждали до 55 С и добавляли пролинспецифическую эндопротеазу, получаемую из A.niger, в концентрации 4 единицы/г протеина (см.,раздел Материалы и методы в отношении определения единицы). При непрерывном перемешивании полученную смесь инкубировали в течение 24 ч. В дальнейшем во время этого периода корректировку рН не проводили. Образцы отбирали через 1, 2, 3, 4, 8 и 24 ч после инкубации. Активность фермента в каждом образце прекращали немедленным нагреванием образца до 90 С в течение 5 мин. После охлаждения рН каждого образца быстро снижали до 4,5, используя фосфорную кислоту, затем суспензию центрифугировали в течение 5 мин при 3000 об./мин в настольной центрифуге Hereaus. Полностью прозрачную надосадочную жидкость использовали для анализа ЖХ/МС/МС для количественного определения пептидов VPP, IPP, LPP, VVVPP и VVVPPF в надосадочной жидкости (см., раздел Материалы и методы). Казеин коровьего молока включает ряд разных белков, включающих бета-казеин и каппа-казеин. В соответствии с известными аминокислотными последовательностями бета-казеин заключает в себе ингибирующие АПФ трипептиды IPP, VPP и LPP. В бета-казеине IPP содержится в последовательности -P71Q72-N73-I74-P75-P76-, VPP содержится в последовательности -P81-V82-V83-V84-P85-Р 86- и LPP содержится в последовательности -P150-L151-P152-P153-. Каппа-казеин, который присутствует в осажденных кислотой препаратах казеината в молярной концентрации, равной почти 50% концентрации бета-казеина, содержит только IPP. В каппа-казеине IPP содержится в последовательности -A107-I108-P109-P110-. Другие белковые составляющие казеина не содержат ни одного из IPF, VPP или LPP. В табл. 1 и 2 представлены концентрации пептидов, присутствующих в подкисленных и центрифугированных надосадочных жидкостях и количество которых определено по ЖХ/МС/МС. В этих таблицах концентрации разных пептидов представлены в расчете на грамм казеината калия, добавленного в инкубационную смесь. Как показано в табл. 1, максимальная концентрация IPP достигается через 1 ч после инкубации. После этого концентрация IPP больше не повышается. При образовании пентапептидаVVVPP показана та же самая кинетика, что и при образовании IPP. Как теоретически ожидается, молярный выход VVVPP подобен молярному выходу пептида LPP. Выход как LPP, так и VVVPP достигает почти 60% от теоретически возможного. Тот факт, что максимальная концентрация LPP достигается только через 3 ч после инкубации, свидетельствует о том, что расщепление этой конкретной части молекулы бета-казеина возможно является несколько более трудным. В противоположность VVVPP гекса- 20011865 пептид VVVPPF совсем не образуется. Это наблюдение говорит о том, что пролинспецифическая эндопротеаза эффективно расщепляет связь -P-F- с образованием тем самым VVVPP. Трипептид IPP образуется сразу, но его молярный выход составляет не более примерно трети от максимального молярного выхода или VVVPP, или LPP. Так как трипептид IPP содержится как в бета-казеинате, так и в каппаказеинате, этот результат является неожиданным. Вероятным объяснением этого наблюдения является то, что пролинспецифическая протеаза может генерировать IPP, но только из каппа-казеиновой части казеинатов. Ввиду значимой аминокислотной последовательности каппа-казеината это говорит о том,что пептидная связь -A107-I108- расщепляется аланинспецифическим действием фермента. Если это так, то количество выделяемого IPP достигает примерно 40% от количества, которое присутствует в каппаказеине, но не более примерно 10% от IPP, которое теоретически присутствует в бета- плюс каппаказеине. Механизм расщепления для выделения IPP объясняет также, почему VPP не может образовываться из молекулы предшественника VVVPP: необходимого эндопротеолитического действия (или аминопептидазного) просто нет у используемого препарата фермента, получаемого из A.niger. Таблица 1. Молярное содержание пептида в подкисленных надосадочных жидкостях, рассчитанное на грамм добавленного белка Пример 6. Включение стадии осаждения казеина кислотой приводит к 5-кратной концентрации ингибирующих АПФ пептидов Как описано в примере 5, казеинат калия при концентрации 10% (мас./мас.) белка подвергали инкубации с пролинспецифической эндопротеазой, получаемой из A.niger, при рН 6,0. После разных сроков инкубации образцы нагревали, чтобы остановить дальнейшее действие фермента, затем рН снижали до 4,5, чтобы свести к минимуму растворимость казеина. Молекулы не растворенного казеина удаляли с помощью низкоскоростного центрифугирования. В табл. 1 и 2 представлены концентрации ингибирующих АПФ пептидов, рассчитанные на основе исходной концентрации 10% белка. Однако в результате подкисления и последующей стадии центрифугирования большую часть добавленного белка удаляли. Чтобы принять во внимание это сниженное содержание белка в подкисленных надосадочных жидкостях,проводили анализы на азот (Кьельдаль). По последним данным, как было обнаружено, разные надосадочные жидкости содержат следующие уровни белков. Таблица 3. Содержание белка в подкисленных надосадочныхжидкостях Принимая во внимание эти данные, снова рассчитывали концентрацию ингибирующих АПФ пептидов, присутствующих в каждой надосадочной жидкости, но на этот раз, используя их фактическое содержание белка. Эти пересчитанные данные представлены в табл. 4.- 21011865 Таблица 4. Концентрации пептидов в подкисленных надосадочных жидкостях, рассчитанные на грамм присутствующего белка Сравнение данных, представленных в табл. 2 и 4, четко показывает, что стадия простого подкисления с последующими промышленно осуществимой стадией декантации, фильтрования или низкоскоростного центрифугирования дает в результате 5-кратное повышение концентрации специфических ингибирующих АПФ пептидов. В более поздних экспериментах можно было показать, что эффективность стадии осаждения кислотой дополнительно улучшалась при хранении в течение ночи подкисленной суспензии перед декантацией, фильтрованием или низкоскоростным центрифугированием. Пример 7. Количественное определение загрязняющей ферментативной активности при получении ингибирующих АПФ пептидов В соответствии с данным изобретением ингибирующие АПФ пептиды могут быть получены простым одностадийным способом путем инкубации подходящего белкового субстрата с пролинспецифической эндопротеазой. Последующее обогащение водорастворимых ингибирующих АПФ пептидов выполняют осаждением белковых фрагментов с большим молекулярной массой путем подкисления. Эффективность последнего кислотного процесса обогащения зависит от очень селективного расщепления субстратной молекулы. Чем больше присутствующая протеолитическая активность, тем больше образуется водорастворимых пептидов со снижением, таким образом, фактора обогащения ингибирующих АПФ пептидов. Например, присутствие дополнительных, непролиновых и неаланиновых специфических эндопротеаз во время инкубации с субстратом приводит к солюбилизации большего числа биологически неактивных пептидов, снижая тем самым относительные концентрации IFP и LPP в окончательном концентрате. Кроме того, наличие загрязняющих экзопротеаз, таких как, например, карбоксипептидазы или аминопептидазы, приводит к выделению свободных аминокислот. Эти дополнительные свободные аминокислоты также снижают относительные концентрации ингибирующих АПФ пептидов и, кроме того,придают бульонные привкусы в результате усиленных реакций Мейлларда. Чтобы свести к минимуму эти нежелательные побочные реакции, предпочтительно использовать, по существу, чистую пролинспецифическую протеазу. Термин по существу чистый означает, что активность загрязняющих эндопротеаз, а также загрязняющих экзопротеаз в используемых условиях инкубации является минимальной или,предпочтительно, отсутствует. Следующая методика испытания рекомендована для количественного определения такой загрязняющей активности. Основу для методики испытания составляет коллекция разных селективных хромогенных пептидов. Во всех хромогенных пептидах Z представляет бензилоксикарбонил, и pNA - хромофорный параанилид. Так как только пролинспецифические олиго- и эндопротеазы могут высвобождать окрашенныйpNA из пептида, блокированного на его N-конце Z группой, пептид Z-AAAP-pNA, использовали для того, чтобы количественно определить желаемую пролинспецифическую эндопротеолитическую активность. Так как много эндопротеаз могут высвобождать pNA из пептидов Z-AAAF-pNA и Z-AAAR-pNA,эти два пептида использовали для количественного определения загрязняющей не пролинспецифической эндопротеолитической активности. Так как для превращения пептидов QNIPP и VVVPP в IPP и VPP,соответственно, необходимы аминопептидазы, которые могут эффективно удалять Gin(Q) и Val(V) остатки, пептиды Q-pNA и V-pNA использовали для количественного определения такой загрязняющей аминопептидазной активности. Так как много карбоксипептидаз могут выделять остатки Phe(F) и Arg(R) из пептидов, пептиды, содержащие эти остатки, были отобраны для количественного анализа загрязняющей карбоксипептидазной активности. Поскольку нет доступных подходящих хромогенных групп для количественного определения карбоксипептидазной активности, был разработан альтернативный метод с использованием синтетических пептидов Z-AF и Z-AR. Этот альтернативный метод представлен ниже. Все хромогенные пептиды были получены от Pepscan (Lelystad, Нидерланды). Пептиды Z-AF и ZAR были закуплены у Bachem (Швейцария). Все инкубации проводили при 40 С. Чтобы проиллюстрировать данный способ, коммерчески доступные ферментные препараты флавурзим 1000L (Flavourzyme 1000L), партия HPN00218, который получен от Novozymes (Дания), сумизим (Sumizyme) FP от Shin Ninon (Япония) и колораза (Colorase) LAP (Ch.: 4123) от АВ Enzymes (UK) сравнивали с пролинспецифической эндопротеазой из A.niger. Испытуемые коммерческие ферментные препараты разводили, чтобы создать оптимальные условия инкубации, но повторно пересчитывали на концентрацию коммерческого продукта при представлении окончательных данных (ср. табл. 5).- 22011865 Количественное определение загрязняющей аминопептидазной активности Базовые растворы 150 ммоль/л V-pNA и Q-pNA в 100% ДМСО разводили в 80 раз 0,1 М бис-Трис буфером рН 6, чтобы изготовить раствор V-pNA+Q-pNA субстрата 3,75 ммоль/л, содержащего V-pNA иQ-pNA в соотношении 1:1. Аликвоту 200 мкл аминопептидазного субстратного раствора пипеткой вносили в отдельные лунки микротитровального планшета (МТП). МТП предварительно инкубировали при 40 С в Tecan Genios MTP (Salzburg, Vienna), работающем под управлением программного обеспеченияMagellan4. Реакцию начинали добавлением 50 мкл соответствующего ферментного раствора, так что инкубации происходили при концентрации субстрата, равной 3 мМ. Обычно использовали разведение 1:50 жидких образов флавурзима, колоразы LAP и пролинспецифической эндопротеазы. Использовали 1% раствор сухого продукта сумизима FP. Желтое окрашивание, которое количественно оценивали при 405 нм с помощью Tecan Genios MTP,развивающееся в результате расщепления связи аминокислоты-pNa, являлось следствием по меньшей мере 20 кинетических циклов (примерно 10 мин). Программное обеспечение выдавало данные, получаемые как OD405/мин. Количественное определение активности пролинспецифической эндопротеазы Это количественное определение осуществляли, по существу, так же, как и анализ аминопептидазы,но в этом случае использовали Z-AAAP-pNA в качестве единственного субстрата в конечной концентрации 3 ммоль/л. Этот субстрат солюбилизировали нагреванием суспензии в буфере рН 6 до 50-55 С, получая в результате прозрачный раствор при комнатной температуре. Измерения осуществляли при 40 С. Обычно использовали разведение 1:50 жидких образцов фермента флавурзима и колоразы LAP. СимузимFP использовали в виде 1% раствора. Пролинспецифическую эндопротеазу обычно использовали в разведении 1:5000. Программное обеспечение выдавало данные в виде OD405/мин. Количественное определение загрязняющей не пролинспецифической эндопротеазной активности Количественное определение осуществляли по существу так же, как описано в отношении анализа аминопептидазы, но при этом испытании использовали Z-AAAF-pNA и Z-AAAR-pNA в соотношении 1:1 в конечной концентрации 3 ммоль/л в качестве субстрата. Субстрат Z-AAAF-pNA изменялся так, что становился плохо растворимым в применяемых условиях испытания с рН 6,0, но инкубация при испытании с субтилизином приводила к быстрой солюбилизации субстрата с сопровождающим выделениемpNA. Измерения проводили при 40 С. Однако, чтобы компенсировать его плохую растворимость, считывающее устройство МТР программировали на встряхивание между кинетическими циклами. Программное обеспечение выдавало данные в виде OD405/мин. Количественное определение загрязняющей карбоксипептидазной активности Так как нет доступных чувствительных хромогенных пептидов для количественного определения активности карбоксипептидазы, использовали метод на основе методики Берингера для количественного определения карбоксипептидазы С. Два базовых раствора Z-A-F и Z-A-R в этаноле 150 ммоль/л разводили в 80 раз 0,1 моль/л бис-Трис буфером с рН 6 для получения раствора субстрата Z-A-F + Z-A-R 3,75 ммоль/л, содержащего Z-A-F и ZA-R в соотношении 1:1. Затем 200 мкл субстратного раствора пипеткой вносили в пробирку Эппендорфа и предварительно инкубировали при 40 С. Реакцию начинали добавлением 50 мкл соответствующего разведения фермента. Обычно использовали разведение 1:50 флавурзима и колоразы LAP и пролинспецифической эндопротеазы. Использовали 1% раствор для сумизима FP. Через 5 мин реакцию останавливали добавлением 250 мкл реагента нингидрина. Нингидриновый реагент изготавливали из 400 мг нингидрина (Merck) и 60 мг гидриндантина, растворенных в 15 мл ДМСО, к которым добавляли 5 мл литийацетатного буфера 4,0 моль/л с рН 5,2. Литий-ацетатный буфер 4,0 моль/л изготавливали растворениемLiOH (Sigma), затем рН раствора доводили до рН 5,2, используя ледяную уксусную кислоту (Merck). После остановки реакции каждый образец нагревали в течение 15 мин при 95 С для облегчения образования окрашивания и затем разводили в 10 раз чистым этанолом. Получаемое окрашивание измеряли при 578 нм на спектрофотометре Uvikon. Чистые контроли готовили таким же образом, как и образцы на определение активности, но добавление нингидринового реагента и фермента проводили в обратном порядке. Чтобы определить количество свободных аминокислот, генерированных действием карбоксипептидазы, использовали аминокислоту L-фенилаланин для получения калибровочной кривой. Растворы в буфере с рН 6, содержащие 0,1875, 0,375, 0,75, 1,5 и 3,0 ммоль/л L-фенилаланина (Sigma), обрабатывали таким же образом, что и образцы, т.е. по 250 мкл на пробирку. Значения получали по OD578, кривую строили в Excel. Концентрации свободных аминокислот, присутствующих в образцах, содержащих субстраты Z-A-F и Z-A-R, рассчитывали, используя эту кривую. По полученным значениям рассчитывали карбоксипептидазную активность в микромолях в минуту на количество испытуемого фермента. Расчет соотношения активности Чтобы установить пригодность разных ферментных препаратов для способа по данному изобретению рассчитывали коэффициенты активности соответствующих ферментов. При исследованиях на считывающем устройстве МТР активность ферментов характеризовали по выделению pNA в течение време- 23011865 ни, т.е. как OD405/мин. Коэффициенты ферментативных активностей, полученные с помощью считывающего устройства МТР, рассчитывали простым делением OD/мин, полученных для идентичных количеств фермента. Однако в случае анализа карбоксипептидазы генерируется OD, которую нельзя непосредственно сравнить с OD/мин, генерируемой при анализах на основе MTP-pNA. В данном случае OD сначала преобразовывали в мкмоль аминокислоты, освобождаемой в мин (мкмоль/мин). Затем OD/мин освобожденной pNA превращали в мкмоль/мин. С этой целью строили калибровочную кривую в считывающем устройстве МТР, в котором делали замеры по разведениям чистой pNA (Sigma) 0,25, 0,125, 0,0625, 0,0312 и 0,015 ммоль/л и при 250 мкл на лунку. По полученным данным строили калибровочную кривую вExcel. По этой калибровочной кривой OD/мин превращали в мкмоль/мин, так что измерения на основеpNA можно было сравнивать с измерениями на основе нингидрина. На основании данных, полученных при вышеназванных испытаниях, препараты разных используемых ферментов характеризовали по желаемой пролинспецифической и загрязняющей эндопротеазной,аминопептидазной и карбоксипептидазной активности. Желаемая пролинспецифическая активность,присутствующая в каждом ферментном препарате, показана в табл. 5 в колонке Пролинспецифическая активность. Данные по загрязняющей аминопептидазной активности (АП/прол.спец.акт.) и загрязняющей карбоксипептидазной (КПД/прол.спец.акт.) и эндопротеолитической активности (Эндо/прол.спец.акт.) показаны по отношению к присутствующей пролинспецифической активности. Загрязняющая аминопептидазная активность относительно загрязняющей карбоксипептидазной активности, которые присутствуют в каждом препарате, показана как (АП/КПД). Явным является то, что ни один из испытанных коммерческих ферментных препаратов не содержит какой-либо значительной пролинспецифической олиго- или эндопротеолитической активности. Кроме того, все испытанные коммерческие ферментные препараты содержат загрязняющую эндо- и экзопротеолитическую активность. Таблица 5. Количественное определение загрязняющей протеолитической активности в разных ферментных препаратах Сумизим определяли количественно в 1% растворе, флавузим и колораза в виде разведения 1:50. Пролинспецифическую активность препарата из A.niger определяли в разведении 1:5000. Данные затем рассчитывали на активность, присутствующую в продукте, который представлен. А. Фармацевтические композиции могут быть получены путем обычных методов изготовления с использованием ингредиентов, указанных ниже. Пример 8. Мягкие желатиновые капсулы Мягкие желатиновые капсулы изготавливают по обычным методам, используя ингредиенты, указанные ниже: Активные ингредиенты: гидролизаты белка 0,3 г Другие ингредиенты: глицерин, вода, желатин, растительное масло. Пример 9. Твердые желатиновые капсулы Твердые желатиновые капсулы изготавливают по обычным методам, используя ингредиенты, указанные ниже. Активные ингредиенты: гидролизаты белка 0,7 г Другие ингредиенты: Наполнители: лактоза или целлюлоза, или целлюлозные производные q.s. Лубрикант: стеарат магния, если необходимо (0,5%). Пример 10. Таблетки Таблетки изготавливают по обычным методам, используя ингредиенты, указанные ниже: Активные ингредиенты: гидролизаты белка 0,3 г,негидролизованный белок 0,4 г Другие ингредиенты: микрокристаллическая целлюлоза, диоксид кремния (SiO2), стеарат магния,натрийкроскармеллоза. В. Пищевые продукты могут быть изготовлены по обычным методикам с использованием ингредиентов, указанных ниже.- 24011865 Пример 11. Безалкогольный напиток с 30% сока Обычная порция: 240 мл Активные ингредиенты: В этот пищевой продукт включают гидролизаты белка и мальтодекстрин в качестве источника углеводов: гидролизаты белка: 1,5-15 г/на порцию мальтодекстрин: 3-30 г/на порцию Смесь безалкогольного напитка готовят из следующих ингредиентов: Термин активные ингредиенты означает активный ингредиент, названный выше: протеиновый гидролизат и мальтодекстрин в концентрациях, названных выше. Концентраты фруктовых соков и водорастворимые вкусовые добавки-ароматизаторы смешивают без включения воздуха. Краситель растворяют в деионизированной воде. Аскорбиновую кислоту и лимонную кислоту растворяют в воде. Бензоат натрия растворяют в воде. При перемешивании добавляют пектин и растворяют при кипячении. Раствор охлаждают. Апельсиновое масло и жирорастворимые вкусовые добавки предварительно смешивают. Активные ингредиенты, которые названы в 1.6, смешивают в сухом виде и затем примешивают, предпочтительно в смесь концентрата фруктового сока (1.1). Чтобы приготовить смесь безалкогольного напитка, все части с 3.1.1 по 3.1.6 смешивают вместе перед гомогенизацией с применением Turrax, и затем гомогенизатора высокого давления (p1=200 бар, р 2=50 бар).II. Разлитый в бутылки сироп готовят из следующих ингредиентов: Ингредиенты разливаемого в бутылки сиропа смешивают вместе. Разливаемый в бутылки сироп разбавляют водой до 1 л готового порционного напитка. Варианты: Вместо использования бензоата натрия напиток можно пастеризовать. Напиток может быть также газирован углекислым газом. Пример 12. Аминопептидолитическая активность разных коммерческих ферментных препаратов В бета-казеине IPP содержится в последовательности -P71-Q72-N73-I74-P75-P76-, VPP содержится в последовательности -P81-V82-V83-V84-P85-P86- и LPP содержится в последовательности -P150-L151-P152-P153-. Из других белковых составляющих казеина только каппа-казеин включает содержащую IPP последовательность. По специфичности пролинспецифической эндопротеазы можно заключить, что при инкубации бета-казеина с ферментом, получаемым из A.niger, будут образовываться пептиды -Q72-N73-I74-P75-P76-, -V82V83-V84-P85-P86- и -L151-P152-P153-. В отличие от LPP два образовавшиеся пентапептида проявляют только низкую подавляющую АПФ активность. Например, в ЕР 0583074 сообщается значение IC50 для VVVPP, равное 873 мкмоль/л, тогда как усеченная молекула VPP имеет значение IC50, равное 9 мкмоль/л. Таким образом,очевидно, что для получения полного подавляющего АПФ потенциала казеинового гидролизата пентапептиды VVVPP и QNIPP, которые образуются при инкубации с пролинспецифической эндопротеазой, должны быть преобразованы в трипептиды VPP и IPP, соответственно. Аминопептидазы могут затем отделять аминокислоты с N-концевой стороны пептидов, и аминопептидолитическая ферментативная активность необходима, чтобы можно было эффективно удалить два валиновых (V) остатка, предшествующих последовательности VPP, и глютаминовый (Q) и аспарагиновый (N) остатки, которые предшествуют последовательности IPP. Так как пептидные связи Х-Р и Р-Р, присутствующие в трипептидах ХРР, как известно, устойчивы к ферментативному расщеплению, вероятно, что такая аминопептидолитическая активность будет трансформировать два пентапептида в желаемые трипептиды VPP и IPP. Три коммерчески доступных ферментных препарата были испытаны на их аминопептидолитическую активность, т.е. флавурзим 1000L, партия HPN00218 (Novozymes, Дания), сумизим FP (Shin Nihon,Япония) и колораза LAP Ch.: 4123 (АВ Enzymes, UK). Как флавурзим, так и сумизим FP, как известно,являются сложными ферментными препаратами, которые включают несколько аминопептидолитических ферментативных действий, помимо неспецифической эндопротеолитической и карбоксипептидолитической активности. Колораза LAP представляет активность относительно чистой, клонированной и сверхэкспрессированной аминопептидазы из Aspergillus. Эти три коммерческих препарата испытывали на присутствующую аминопептидолитическую активность, используя хромогенные субстраты F-pNA (эталонный), Q-pNA и V-pNA. С этой целью базовый раствор 150 мМ X-pNA в ДМСО разводили 100 бис-Трис буфером с рН 6. Микротитровальный планшет заполняли по 200 мкл буферного раствора субстрата на лунку и предварительно инкубировали при 40 С в считывающем устройстве Tecan Genios MTP, работающем под управлением программного обеспеченияMagellan4. Реакцию начинали добавлением 50 мкл соответствующего ферментного раствора (порошок сумизима FP растворяли в бис-Трис буфере рН 6 до концентрации 100 мг/мл перед использованием). За выделением желтого pNA отслеживали при 405 нм в течение 10 мин. Программное обеспечение вычисляло OD/мин. Активность каждого ферментного препарата в отношении разных субстратов стандартизовали по их активности в отношении F-pNA. Полученные данные показаны на фиг. 4. Очевидно, что все три ферментных препарата проявляют наивысшую активность в отношении F-pNA, но Q-pNA и V-pNA также представляют субстраты для этих ферментов. Эти результаты показывают, что при сочетании с пролинспецифической протеазой каждый из коммерческих препаратов должен быть способен к образованию желаемых ингибирующих АПФ трипептидов IPP, VPP, а также LPP, так как действие аминопептидазы будет превращать пептиды QNIPP и VVVPP, образуемые действием пролинспецифической протеазы, в IPP и VPP, соответственно. Эту гипотезу проверяли в эксперименте, описанном в примере 13. Пример 13. Инкубация казеината с пролинспецифической эндопротеазой из A.niger вместе с разными препаратами аминопептидолитических ферментов дает высокие выходы IPP, LPP и VPP. В данном примере исследован эффект сочетания пролинспецифической протеазы из A.niger с аминопептидолитическим действием при единственной стадии инкубации на образование разных ингибирующих АПФ пептидов. С этой целью раствор казеината, приготовленный путем растворения 50 г казеината натрия в 506 г воды при 70 С с получением раствора, содержащего 81 г белка/л. Полученный раствор охлаждали до 50 С,после чего рН снижали до 6,0 (определено при 20 С), используя фосфорную кислоту, затем добавляли разные комбинации ферментов. Ко всем образцам (10 мл каждый) добавляли пролинспецифическую про- 26011865 теазу до достижения концентрации 4 единицы на грамм белка (см., Материалы и методы, раздел по определению единицы). Образец А 1 содержал только эту пролинспецифическую протеазу. Образец В 1 содержал пролинспецифическую протеазу плюс 38 мкл раствора, содержащего 1140 мг концентрированной жидкости флавурзима, разведенной в 5 г воды. В образце В 2 пролинспецифическую протеазу объединяли с 8 мкл раствора флавурзима. В образце С 1 пролинспецифическую протеазу объединяли со 100 мкл жидкости колоразы LAP. В образце С 2 пролинспецифическую протеазу объединяли с 10 мкл 10 кратно разбавленного образца жидкости колоразы LAP. Во всех 5 образцах инкубации давали протекать в течение 6 ч при 50 С. Ферментативные реакции прекращали нагреванием смеси в течение 5 мин до 90 С. Полученные прозрачные надосадочные жидкости после центрифугирования в течение 10 мин в центрифуге Эппендорфа собирали и хранили замороженными до анализа ЖХ/МС/МС. Данные, которые получены после анализа ЖХ/МС/МС, представлены в табл. 5. Как показано выше, в условиях инкубации образца А 1 (с присутствием только пролинспецифической протеазы) эффективно образуется LPP, а также VVVPP, но не образуется значительного количестваVPP. Отсутствие пептида VVVPPF показывает, что пролинспецифическая протеаза эффективно отщепляет карбокси-концевые пролиновые остатки в применяемых условиях. В образце А 1 выход IPP, грубо,составляет треть выхода VVVPP. Однако сочетание пролинспецифической протеазы или с флавурзимом(образцы В 1 и В 2) или с колоразой LAP (образец С 1) дает явное стимулирующее действие на выход IPP. В образце С 2 (с низкой концентрацией колоразы LAP) выход IPP не повышался, вероятно, потому что концентрация аминопептидазной активности была неадекватной для превращения QNIPP, образованного с помощью пролинспецифической протеазы. Так как 1 г казеина может теоретически давать 6,9 мг (21,1 мкмоль) IPP (из бета-казеина плюс каппа-казеина), уровни IPP, присутствующие в образцах В 1 и С 1,представляют 70 и 55%, соответственно, от максимально возможных выходов получения. В соответствии с ожиданиями, повышенная аминопептидолитическая активность приводит к снижению концентрацииVVVPP и повышению концентрации VPP. Тот факт, что небольшие количества промежуточного пептидаVVPP можно определить в образцах В 2 и С 2, показывает, что в этих образцах аминопептидолитическая активность неадекватна для полного превращения VVVPP, образованного с помощью пролинспецифической протеазы, в VPP. Так как 1 г казеина может теоретически дать 4,58 мг (14,7 мкмоля) VPP, в образцах В 1, В 2 и С 1 достигается максимальный выход VPP. В заключение, данный эксперимент ясно показывает, что комбинация пролинспецифической протеазы с подходящей аминопептидолитической активностью может эффективно генерировать высокие концентрации ингибирующих АПФ пептидов. Эта комбинация пролинспецифической протеазы с аминопептидазой является наилучшим осуществлением после инкубации с пролинспецифическим ферментом. В зависимости от требований специфического процесса, инкубация с дополнительным ферментом может происходить перед стадией очистки или после нее с использованием условий низкого рН или смешиваемого с водой растворителя. Кроме того, инкубацию можно проводить с аминопептидазой с активностью, способной удалить нежелательные аминокислотные остатки, предшествующей аминокислотной последовательности, имеющей подавляющее АПФ действие, или ее можно проводить с использованием подходящей эндопротеолитической активности. Подходящим примером такой эндопротеолитической активности является присутствующая у папаина(получаемого в виде коллупулина (Collupulin) от DSM Food Specialities, Delft, Нидерланды), который может эффективно отщеплять карбокси-концевые остатки Asn (N) и Val (V). Если инкубацию с дополнительным ферментом проводят перед стадией кислотного или этанольного осаждения, то инкубацию лучше всего осуществлять с относительно чистой аминопептидазой, такой как колораза LAP (ср., пример 7). Таблица 6. Концентрации пептидов в надосадочных жидкостях, рассчитанные в мг/г добавленного белка ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения композиции, содержащей олигопептид IPP, из белка, содержащего, по меньшей мере, последовательность -I-P-P-, в которой массовое отношение IPP к VPP, получаемых из белка,составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1 и более предпочтительно по меньшей мере 20:1, включающий обработку белка ферментом, обладающим пролинспецифической эндопротеазной активностью или пролилолигопептидазной активностью, и ферментом, способным гидролизовать связь на аминоконцевой стороне последовательности -I-P-P-. 2. Способ по п.1, в котором фермент, который обладает пролинспецифической эндопротеазной активностью или пролилолигопептидазной активностью, и фермент, который способен гидролизовать связь на аминоконцевой стороне последовательности -I-Р-Р-, представляет собой один и тот же фермент,- 27011865 и предпочтительно этот фермент является пролинспецифической эндопротеазой или пролилолигопептидазой, более предпочтительно этот фермент является пролинспецифической эндопротеазой. 3. Способ по любому из пп.1-2, где пролинспецифическая эндопротеаза не обладает аминопептидазной активностью и/или карбоксипептидазной активностью. 4. Способ по пп.1 и 2, где время инкубации составляет менее 24 ч, предпочтительно менее 10 и более предпочтительно менее 4 ч. 5. Способ по любому из предшествующих пунктов, где температура инкубации составляет выше 30 С, предпочтительно выше 40 С и более предпочтительно выше 50 С. 6. Способ по любому из предшествующих пунктов, где продуцируется также и LPP. 7. Способ по любому из предшествующих пунктов, где используют белок молока, предпочтительно казеин. 8. Способ по п.7, где последовательность -A-I-P-P- и/или -P-I-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 30% в пептид IPP. 9. Способ по п.6, где последовательность -P-L-P-P- и/или -A-L-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 40% в пептид LPP. 10. Способ по п.1, дополнительно включающий отделение нерастворимой части гидролизованного белка от растворимой части в условиях кислого рН, предпочтительно при рН от 3,5 до 6 с получением в результате композиции, содержащей растворимые пептиды, включая IPP, и в которой массовое отношение IPP к VPP составляет по меньшей мере 5:1. 11. Способ получения композиции, которая содержит растворимые пептиды, предпочтительно IPP,где способ включает изменение рН композиции, которая продуцируется при гидролизе подходящего источника белка и предпочтительно продуцируется способом по любому из пп.1-9, до рН, при котором часть гидролизованного белка становится нерастворимой, и отделение нерастворенной части от растворенных пептидов с получением в результате композиции, содержащей растворимые пептиды. 12. Композиция, содержащая растворимые пептиды, включая IPP, и в которой массовое отношениеIPP к VPP составляет по меньшей мере 5:1, где по меньшей мере 70 мас.%, предпочтительно по меньшей мере 80 мас.% и наиболее предпочтительно по меньшей мере 90 мас.% пептидов растворимо при рН от 3,5 до 6, предпочтительно при рН от 4 до 5, причем ни один пептид из растворимых пептидов не присутствует в количестве более 40 мас.% от растворимых пептидов, предпочтительно ни один пептид из растворимых пептидов не присутствует в количестве более 30 мас.% от растворимых пептидов и наиболее предпочтительно ни один пептид из растворимых пептидов не присутствует в количестве более 20 мас.% от растворимых пептидов, и где композиция получена способом по п.1. 13. Применение пролинспецифической эндопротеазы для получения IPP из белка, где продуцируется по меньшей мере в 5 раз (мас.) больше IPP, чем VPP. 14. Композиция, продуцируемая путем гидролиза белка, содержащая IPP, где массовое отношениеIPP к VPP в данной композиции составляет по меньшей мере 5:1, предпочтительно по меньшей мере 10:1 и более предпочтительно по меньшей мере 20:1. 15. Композиция по п.14, которая дополнительно содержит LPP. 16. Композиция по п.14 или 15 в качестве нутрицевтика предпочтительно лекарственного средства. 17. Композиция по любому из пп.12-16, которую получают способом по любому из пп.1-11. 18. Применение композиции по любому из пп.12 и 14-17 или композиции, получаемой по любому из пп.1-11 в качестве нутрицевтика предпочтительно лекарственного средства, для производства нутрицевтика предпочтительно лекарственного средства, для улучшения здоровья или профилактики и/или лечения заболеваний, или для производства нутрицевтика предпочтительно лекарственного средства для лечения или профилактики таких заболеваний, как высокое давление крови (гипертензия), сердечная недостаточность, преддиабет или диабет, ожирение, сниженная толерантность к глюкозе или стресс. 19. Применение по п.18, где композиция находится в форме диетической добавки, в форме средств для индивидуального применения, включая местное применение в форме лосьона, геля или эмульсии,или в виде пищевого продукта, корма или ингредиента корма. 20. Применение композиции по любому из пп.12 и 14-17 для производства функционального пищевого продукта для профилактики ожирения или для контроля массы тела. 21. Применение композиции по любому из пп.12 и 14-17 для производства функционального пищевого продукта для поддержания здоровья сердечно-сосудистой системы. 22. Применение по п.21, где поддержание здоровья сердечно-сосудистой системы включает ингибирование ангиотензинпревращающего фермента. 23. Применение по п.21, где поддержание здоровья сердечно-сосудистой системы включает регуляцию уровня холестерина крови. 24. Функциональный пищевой продукт, способный оказывать полезное действие на здоровье потребителя, где указанное полезное действие выбрано из профилактики ожирения, контроля массы тела и поддержания здоровья сердечно-сосудистой системы, и включающий композицию по любому из пп.12 и 14-17. 25. Функциональный пищевой продукт по п.24, где полезное действие на поддержание здоровья- 28011865 сердечно-сосудистой системы включает ингибирование ангиотензинпревращающего фермента и/или регуляцию уровней холестерина в крови. 26. Функциональный пищевой продукт по любому из пп.24 или 25, содержащий 50-200 ммоль/кгK+, и/или 15-60 ммоль/кг Са 2+, и/или 6-25 ммоль/кг Mg2+. 27. Функциональный пищевой продукт по п.26, содержащий 110-135 ммоль/кг K+, и/или 35-45 ммоль/кг Са 2+, и/или 13-20 ммоль/кг Mg2+. 28. Функциональный пищевой продукт по любому из пп.24-27, содержащий один или несколько Ввитаминов. 29. Функциональный пищевой продукт по п.26, содержащий фолиевую кислоту, витамин В 6 и витамин В 12. 30. Функциональный пищевой продукт по любому из пп.24-29, содержащий от 3 до 25 мас.% стерина, более предпочтительно от 7 до 15 мас.% стерина. 31. Способ получения пищевого продукта, напитка или диетической добавки, включающий:(а) получение композиции, которая содержит IPP, по любому из пп.1-9 и(b) включение указанной композиции, содержащей IPP, в пищевой продукт, напиток или диетическую добавку. 32. Способ по п.31, где на стадии а) используют белок молока, предпочтительно казеин. 33. Способ по п.32, где на стадии а) последовательность -A-I-P-P- или -P-I-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 10%, более предпочтительно по меньшей мере на 30% в пептид IPP. 34. Способ по п.32, где на стадии а) последовательность -P-L-P-P- или -A-L-P-P-, присутствующая в белковой последовательности, превращается по меньшей мере на 10%, более предпочтительно по меньшей мере на 40% в пептид LPP. 35. Способ по п.31, включающий также стадию с) очистки пептидов от гидролизованного белка,предпочтительно гидролизованного не аспартиловой протеазой, более предпочтительно сериновой протеазой, где гидролизованный белок способен осаждаться в условиях выбранного рН, которая включает изменение рН до рН, при котором гидролизованный белок осаждается, и отделения осажденных белков от гидролизованного белка. 36. Способ по п.35, где стадия с) имеет место после стадии а) и перед стадией b). 37. Способ по п.31, где пищевой продукт, напиток или диетическую добавку выбирают из группы маргаринов, паст, масла, молочных продуктов или содержащих сыворотку напитков, предпочтительно продуктов на основе йогурта или молока, таких как йогурт или молоко. 38. Пищевой продукт, напиток или диетическая добавка, получаемые способом по одному или нескольким из пп.31-37. 39. Пищевой продукт, напиток или диетическая добавка по п.38, содержащие от 0,05 до 10 мас.%,более предпочтительно от 0,1 до 5 мас.%, наиболее предпочтительно от 0,2 до 4 мас.% указанной композиции, содержащей IPP. 40. Пищевой продукт, напиток или диетическая добавка по п.38 или 39, содержащие на 100 г продукта от 0,05 до 50 мг IPP, более предпочтительно от 0,1 до 40 мг, наиболее предпочтительно от 0,2 до 30 мг. 41. Пищевой продукт, напиток или диетическая добавка по одному или нескольким из пп.38-40, где массовое отношение IPP к VPP составляет от 5:1 до 100:1, более предпочтительно от 5:1 до 48:1. 42. Пищевой продукт, напиток или диетическая добавка по одному или нескольким из пп.38-41, где массовое отношение IPP к LPP составляет от 1:10 до 1:1, более предпочтительно от 1,5:7,1 до 4,8:7,1. 43. Пищевой продукт, напиток или диетическая добавка по одному или нескольким из пп.38-42 для применения для облегчения гипертензии у людей.
МПК / Метки
МПК: A61P 9/02, C12P 21/06, A61K 38/06
Метки: снижающие, протеиновые, крови, гидролизаты, давление
Код ссылки
<a href="https://eas.patents.su/30-11865-proteinovye-gidrolizaty-snizhayushhie-davlenie-krovi.html" rel="bookmark" title="База патентов Евразийского Союза">Протеиновые гидролизаты, снижающие давление крови</a>
Предыдущий патент: Применение 4-гидроксифенилретинамида и 4-метоксифенилретинамида для лечения офтальмологических состояний
Следующий патент: Агенты, специфически связывающие ангиопоэтин-2