Способы, реагенты, материалы и наборы для исследования образца на наличие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений
Номер патента: 24233
Опубликовано: 31.08.2016
Авторы: Ван Ден Бюльке Марк Анри Жермен, Мбонголо Мбелла Этондо Гийом, Ливан Антон Пит Нелли Рауль, Лёнда Амая, Снейер Мириям Жаклин Сильвьян, Барбо-Пьенуар Элоди
Формула / Реферат
1. Способ анализа образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений, включающий стадии:
(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих
одну, более чем одну или все из нуклеиновых кислот, выбранных из:
a) "Zm": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Zea mays, предпочтительно Zea mays ssp. mays,
b) "Bn": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Brassica napus,
c) "Gm": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Glycine max,
o) "Or": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Orysa sativa,
p) "Bv": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Beta vulgaris,
q) "Gs": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Gossipium, и
t) "St": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Solanum tuberosum; и
всех нуклеиновых кислот, указанных в d)-i):
d) "p35S": нуклеиновой кислоты, происходящей из промотора 35S вируса мозаичной болезни цветной капусты,
e) "tNOS": нуклеиновой кислоты, происходящей из 3'-терминатора гена нопалинсинтетазы Agrobacterium tumefaciens,
f) "Cry 1Ab": нуклеиновой кислоты, происходящей из гена Cry1Ab кристаллического белка Bacillus thuringiensis,
g) "PAT/bar": нуклеиновой кислоты, происходящей из гена bar фосфинотрицинацетилтрансферазы (PAT) Streptomyces hygroscopicus,
h) "PAT/pat": нуклеиновой кислоты, происходящей из гена pat фосфинотрицинацетилтрансферазы (PAT) Streptomyces viridochromogenes и
i) "CP4-EPSPS": нуклеиновой кислоты, происходящей из гена EPSPS 5-енолпирувилшикимат-3-фосфатсинтазы из Agrobacterium sp. CP4;
где на стадии (1) присутствие или отсутствие нуклеиновых кислот в образце детектируют при помощи ПЦР-амплификации, где ПЦР-амплификацию нуклеиновых кислот проводят одновременно в одинаковых температурных условиях цикла, с использованием соответствующих пар праймеров из следующей таблицы, или их вариантов, последовательность которых по меньшей мере на 85% идентична последовательности указанных пар праймеров, и где праймеры или пары праймеров при необходимости могут быть помечены для возможности их детекции:

и (2) заключения о присутствии или отсутствии в образце материала, происходящего от одного или нескольких независимых трансформантов растений, выбранных из группы, включающей независимые трансформанты Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, MIR604, LY038, MON88017, их гибриды и родственные им независимые трансформанты; независимые трансформанты Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т45, Liberator pHoe6/Ac, GS40/90pHoe6/Ac, OXY235, их гибриды, включая MS1/RF1, MS1/RF2, MS8/RF3 и родственные им независимые трансформанты; независимые трансформанты MON 40-3-2, MON89788, A2704-12, A5547-127, их гибриды и родственные им независимые трансформанты, независимые трансформанты LL62, LL06 и LL601, их гибриды и родственные им независимые трансформанты; независимые трансформанты T120-7, H7-1 и A5-15, их гибриды и родственные им независимые трансформанты; независимые трансформанты LL cotton 25, MON 1445, MON 531, MON15985, их гибриды и родственные им независимые трансформанты; и независимый трансформант EH92-527-1 и родственные ему независимые трансформанты, где указанные родственные независимые трансформанты являются растениями того же таксона, что и независимые трансформанты, и которые трансформированы теми же конструкциями, как и соответствующие независимые трансформанты, которым они родственны, где стадия (2) включает в себя этапы:
(i) присвоения набору нуклеиновых кислот, состоящего из нуклеиновых кислот, детектированных на стадии (1) как присутствующих в образце, обозначения "GSAM";
(ii) присвоения одному или нескольким наборам нуклеиновых кислот, соответствующих одному или нескольким представляющим интерес независимым трансформантам растений ("X"), выбранным из группы, включающей или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, A21, DAS-59122, MIR604, LY038, MON88017, Topas 19/2, MS1, RF1, RF2, MS1/RF1, MS81/RF2, MS8, RF3, MS8/RF3, GT73, T45, Liberator pHoe6/Ac, GS40/90pHoe6/Ac, OXY235, MON 40-3-2, MON89788, A2704-12, A5547-127, LL62, LL06, LL601, T120-7, H7-1, A5-15, LL cotton 25, MON1445, MON531, MON15985 и ТН92-527-1, обозначения "GX", выбранного из группы, включающей



(iii) выполнения для каждого набора GX следующих логических операций:
если GX равен GSAM (GX = GSAM), то материал, происходящий из независимого трансформанта растения X или из его гибрида, или из родственного ему независимого трансформанта, потенциально присутствует в образце;
если GX является истинным подмножеством GSAM (GX Ì GSAM), то материал, происходящий из независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта потенциально присутствует в образце;
если GX не равен GSAM и GX не является истинным подмножеством GSAM, (GX ¹ GSAM и GX Ë GSAM), то материал, происходящий из независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта, отсутствует в образце.
2. Способ по п.1, где стадия (1) включает детектирование присутствия или отсутствия в образце нуклеиновых кислот, включающих все нуклеиновые кислоты, перечисленные под пунктами a)-c) и d)-i).
3. Способ по любому из пп.1, 2, где на стадии (1) наличие или отсутствие нуклеиновой кислоты в образце детектируется с помощью ПЦР-амплификации в режиме реального времени.
4. Способ по любому из пп.1-3, где осуществляют множественную ПЦР-амплификацию двух или большего числа нуклеиновых кислот.
5. Способ по любому из пп.1-4,
где стадия (1) дополнительно включает
детектирование присутствия или отсутствия в образце нуклеиновой кислоты j) "mCry3A": нуклеиновой кислоты, происходящей из модифицированного гена Cry3A кристаллического белка Bacillus thuringiensis; и/или
детектирование присутствия или отсутствия в образце одной или обеих нуклеиновых кислот k) "cordapA": нуклеиновой кислоты, происходящей из гена cordapA не чувствительной к лизину дигидродипиколинатсинтазы (cDHDPS) Corynebacterium glutamicum, и/или i) "Glb1": нуклеиновой кислоты, происходящей из промотора Glb1 кукурузы; и/или
детектирование присутствия или отсутствия в образце нуклеиновой кислоты m) "Cry3Bb1": нуклеиновой кислоты, происходящей из гена Cry3Bb1 кристаллического белка Bacillus thuringiensis; и/или
детектирование присутствия или отсутствия в образце нуклеиновой кислоты n) "Bxn": нуклеиновой кислоты, происходящей из гена Bxn нитрилазы Klebsiella pneumoniae ssp. ozaenae; и/или
детектирование присутствия или отсутствия в образце одной или обеих из нуклеиновых кислот r) "Cry1Ac": нуклеиновой кислоты, происходящей из гена Cry1Ac кристаллического белка Bacillus thuringiensis, и/или s) "Cry2Ab2": нуклеиновой кислоты, происходящей из гена Cry2Ab2 кристаллического белка Bacillus thuringiensis; и/или
детектирование присутствия или отсутствия в образце нуклеиновой кислоты u) "GBSS": нуклеиновой кислоты, происходящей из гена Gbss связанной с гранулами крахмалсинтазы Solanum tuberosum, где
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты j), то - GMIR604 Î {Zm; tNOS; mCry3A};
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты k) и l), то - GLYO38 Î {Zm; p35S; tNOS; cordapA; Glb1};
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты m), то - GMON88017 Î {Zm; p35S; tNOS; CP4-EPSPS; Cry3Bb1};
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты n), то - GOXY235 Î {Bn; p35S; Bxn};
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты r), то - GMON531 Î {Gs; p35S; tNOS; Cry1Ac};
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты r) и s), то - GMON15985 Î {Gs; p35S; tNOS; Cry1Ac; Cry2Ab2};
если стадия (1) включает определение присутствия или отсутствия в образце нуклеиновой кислоты u), то - GEH92-527-1 Î {St; tNOS; Gbss};
где дополнительная детекция одной или нескольких указанных нуклеиновых кислот на стадии (1) способа позволяет более точно определить наличие или отсутствие материала, полученного из одного или нескольких независимых трансформантов растений MIR604, LY038, MON88017, OXY235, MON531, MON15985 и/или EH92-527-1/
6. Способ по любому из пп.1-5, где стадия (1) дополнительно включает детектирование присутствия или отсутствия в образце характерной для растений нуклеиновой кислоты, предпочтительно происходящей из гена малой субъединицы Rubisco (рибулозобисфосфаткарбоксилазы хлоропластов) или из гена CHL-tRNA-синтазы.
7. Способ по п.6, где присутствие или отсутствие указанной характерной для растений нуклеиновой кислоты детектируют при помощи ПЦР-амплификации, предпочтительно ПЦР-амплификации в реальном времени, с использованием пары праймеров 5' AGGTCTAADGGRTAAGCTAC 3' (SEQ ID NO: 26) и 5' AGYCTTGATCGTTACAAAGG 3' (SEQ ID NO: 27) или их вариантов, последовательность которых по меньшей мере на 85% идентична последовательности указанных пар праймеров, и где праймеры или пары праймеров, при необходимости, могут быть помечены для возможности их детекции.
8. Способ по любому из пп.1-7, где используют ДНК-связывающий реагент, который, по существу, неспецифично связывается с последовательностью продукта ПЦР-амплификации, полученного из соответствующих нуклеиновых кислот с использованием пар праймеров, указанных в п.1, для детекции накопления продуктов амплификации предпочтительно используют ДНК-связывающий флуоресцентный краситель, более предпочтительно используют SYBR Green или PicoGreen.
9. Способ по любому из пп.1-8, где специфичность продуктов амплификации дополнительно подтверждают предпочтительно с использованием анализа кривой плавления (Тm) и/или определения размера при помощи гель-электрофореза.
10. Способ по любому из пп.1-7, где продукты амплификации детектируют посредством флуорофорной метки, присутствующей по меньшей мере в одном праймере из пары праймеров, например, с использованием технологии Light Upon Extension (LUXÔ).
11. Способ по любому из пп.1-10, где образец включает растения или их части, в том числе цветки, листочки околоцветника, лепестки, чашелистики, пыльники, пыльцу, семена, плод, околоплодник (перикарпий), коробочки, листья, черешки, стебли, корни, корневища, столоны, клубни или побеги, или их части, клетки растений, протопласты растений и/или ткани растений и/или происходящий из растений материал, предпочтительно пищевой или кормовой материал.
12. Способ по любому из пп.1-11, где на стадии (1) присутствие или отсутствие нуклеиновых кислот в образце детектируют при помощи ПЦР-амплификации, дополнительно используя соответствующие пары праймеров из приведенной ниже таблицы, или их варианты, последовательность которых по меньшей мере на 85% идентична последовательности указанных пар праймеров, и где праймеры или пары праймеров при необходимости могут быть помечены для возможности их детекции

13. Способ по любому из пп.1-12, в котором, если GX равен GSAM и если ни один набор или ни одна сумма двух или более наборов, выбранных из группы, включающей или состоящей из

иная, чем GX, не равна GSAM, то материал, происходящий из независимого трансформанта растения X или из его гибрида, или из родственного ему независимого трансформанта, присутствует в образце.
14. Способ по любому из пп.1-12, в котором нуклеиновым кислотам, выбранным из группы, включающей "Zm", "Bn", "Gm", "p35S", "tNOS", "Cry1Ab", "PAT/bar", "PAT/pat", "CP4-EPSPS", "mCry3A", "cordap A", "Glb1", "Cry3Bb1", "Bxn", "Or", "Bv", "Gs", "Cry1Ac", "Cry2ab2", "St" и "Gbss" присвоены соответствующие уникальные числовые значения

каждому набору GX присвоено числовое значение "VGX", выбранное из группы,
включающей числовые значения
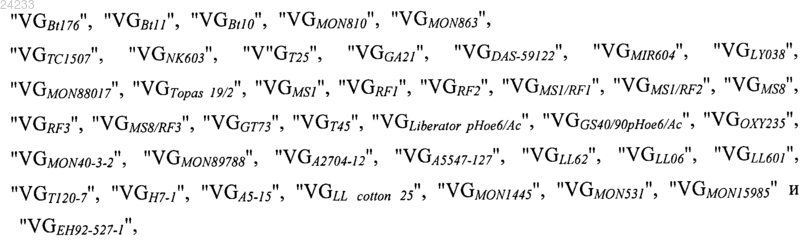
в которых


и где набору GSAM присвоено числовое значение "VGSAM", которое является произведением уникальных числовых значений, присвоенных нуклеиновым кислотам, детектированным на стадии (1) в качестве присутствующих в образце;
и где этап (iii) включает выполнение для каждого набора GX следующих логических операций:
если VGSAM/VGX равно 1, то материал, происходящий из независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта, потенциально присутствует в образце;
если VGSAM/VGX равно одному числовому значению или произведению двух или более числовых значений, выбранных из группы, включающей или состоящей из числовых значений VZm, VBn, VGm, Vp35S, VtNOS, VCry1Ab, VPAT/bar, VPAT/pat, VCP4-EPSPS, VmCry3A, VcordapA, VGlb1, VCry3Bb1, VBxn, VOr, VBv, VGs, VCry1Ac, VCry2ab2, VSt и VGbss, то материал, происходящий из независимого трансформанта растения X, из его гибрида, или из родственного ему независимого трансформанта, потенциально присутствует в образце;
если VGSAM/VGX не равно 1 и не равно одному числовому значению или произведению двух или более числовых значений, выбранных из группы, включающей или состоящей из числовых значений VZm, VBn, VGm, Vp35S, VtNOS, VCry1Ab, VPAT/bar, VPAT/pat, VCP4-EPSPS, VmCry3A, VcordapA, VGlb1, VCry3Bb1, VBxn, VOr, VBv, VGs, VCry1Ac, VCry2ab2, VSt и VGbss, то материал, происходящий из независимого трансформанта растения X, из его гибрида, или из родственного ему независимого трансформанта, отсутствует в образце.
15. Способ по п.14, в котором, если VGSAM/VGX равно 1 и если ни одно числовое значение или произведение двух или более числовых значений, выбранных из группы, включающей или состоящей из числовых значений
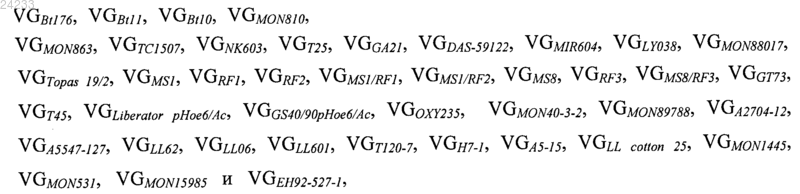
иное, чем VGX, не равно VGX, то материал, происходящий из независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта, присутствует в образце.
16. Способ по любому из пп.14 или 15, в котором числовое значения VZm, VBn, VGm, Vp35S, VtNOS, VCry1Ab, VPAT/bar, VPAT/pat, VCP4-EPSPS, VmCry3A, VcordapA, VGlb1, VCry3Bb1, VBxn, VOr, VBv, VGs, VCry1Ac, VCry2ab2, VSt и VGbss, являются уникальными простыми числами и где этап (iii) включает выполнение для каждого представляющего интерес набора GX следующих логических операций:
если VGSAM/VGX равно 1, то материал, происходящий из независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта, потенциально присутствует в образце;
если VGSAM/VGX является целым числом, большим чем 1, то материал, происходящий из независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта, потенциально присутствует в образце;
если VGSAM/VGX не является целым числом, то материал, происходящий независимого трансформанта растения X, или из его гибрида, или из родственного ему независимого трансформанта, отсутствует в образце.
17. Способ по любому из пп.1-16, где стадию (2) проводят при помощи вычислительного устройства.
18. Компьютер или калькулятор, запрограммированные для осуществления стадии (2) способа по любому из пп.1-16, или носитель данных, содержащий инструкции для вычислительного устройства, запрограммированного для осуществления стадии (2) способа по любому из пп.1-16.
19. Комбинация пар праймеров, включающая
пары праймеров для амплификации одной или более чем одной нуклеиновых кислот, выбранных из а), b), c), o), р), q) и t), указанных в п.1, и
пары праймеров для амплификации всех нуклеиновых кислот d)-i), указанных в п.1, где структуры праймеров определены в п.1.
20. Комбинация пар праймеров по п.19, дополнительно содержащая одну или несколько пар праймеров, определенных в п.12.
21. Комбинация пар праймеров по п.19 или 20, дополнительно содержащая пару праймеров для амплификации, характерной для растений нуклеиновой кислоты, определенной в п.7
22. Комбинация продуктов амплификации, используемая в качестве положительного контроля и/или калибратора в способе по любому из пп.1-17, содержащая
продукты амплификации одной или более чем одной нуклеиновых кислот, выбранных из а), b), c), o), р), q) и t), указанных в п.1, и продукты амплификации всех нуклеиновых кислот d)-i), указанных в п.1, где указанные продукты амплификации получены с использованием пар праймеров, определенных в п.1, где указанные продукты амплификации выбраны из группы, состоящей из SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:52, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:73, SEQ ID NO:74 и SEQ ID NO:75.
23. Комбинация продуктов амплификации по п.22, дополнительно содержащая продукты амплификации, полученные с использованием пар праймеров, определенных в п.12, где указанные продукты амплификации выбраны из группы, состоящей из SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:32 и SEQ ID NO:33.
24. Комбинация продуктов амплификации по любому из пп.22 или 23, дополнительно содержащая продукт амиплификации, характерной для растений нуклеиновой кислоты, полученный с использованием пары праймеров, определенной в п.7, где указанные продукты амплификации выбраны из группы, состоящей из SEQ ID NO:41 из SEQ ID NO:42.
25. Комбинация рекомбинантных векторов и плазмид, содержащих комбинацию продуктов амплификации по п.20, используемая в качестве положительного контроля и/или калибратора в способе по любому из пп.1-17.
26. Комбинация рекомбинантных микроорганизмов, трансформированных комбинацией векторов и/или плазмид по п.25, используемая в качестве положительного контроля и/или калибратора в способе по любому из пп.1-17.
27. Комбинация рекомбинантных микроорганизмов по п.26, включающая рекомбинантные E. coli, выбранные из группы, включающей BCCM/LMBP 5452, BCCM/LMBP 5453, BCCM/LMBP 5454, BCCM/LMBP 5455, BCCM/LMBP 5456, BCCM/LMBP 5457, BCCM/LMBP 5458, BCCM/LMBP 5459, BCCM/LMBP 5460, BCCM/LMBP 5451, BCCM/LMBP 5587, BCCM/LMBP 5588, BCCM/LMBP 5589 и BCCM/LMBP 5590.
28. Комбинация рекомбинантных плазмид по п.25, включающая выделенные рекомбинантные плазмиды, полученные из рекомбинантных бактерий E. coli по п.27.
29. Набор для осуществления способа по п.1, содержащий комбинацию пар праймеров согласно п.19 и носитель данных, содержащий инструкции для вычислительного устройства, запрограммированного для осуществления стадии (2) способа по п.1.
30. Набор по п.29, дополнительно содержащий
одну или несколько пар праймеров или их вариантов, определенных в п.12; или
пару праймеров или их вариант для амплификации, характерной для растений нуклеиновой кислоты, как определено в п.7; или
одну или более нуклеиновых кислот, подходящих в качестве положительного контроля для амплификации нуклеиновых кислот в соответствии с п.1; или
комбинацию рекомбинантных бактерий E. coli, определенную в п.27, комбинацию рекомбинантных микроорганизмов, определенную в п.26, комбинацию выделенных рекомбинантных плазмид по п.28 или их комбинацию.
31. Набор для осуществления способа по п.1, содержащий комбинацию пар праймеров согласно п.19 и одну или более нуклеиновых кислот, подходящих в качестве положительного контроля для амплификации нуклеиновых кислот в соответствии с п.1.
Текст
СПОСОБЫ, РЕАГЕНТЫ, МАТЕРИАЛЫ И НАБОРЫ ДЛЯ ИССЛЕДОВАНИЯ ОБРАЗЦА НА НАЛИЧИЕ ИЛИ ОТСУТСТВИЕ МАТЕРИАЛА, ПРОИСХОДЯЩЕГО ОТ ОДНОГО ИЛИ НЕСКОЛЬКИХ НЕЗАВИСИМЫХ ТРАНСФОРМАНТОВ РАСТЕНИЙ Данное изобретение относится к детектированию в образце материала, происходящего от независимых трансформантов растений. В частности, в настоящем изобретении предложены способы, реагенты, наборы и эталонные материалы для детектирования присутствия или отсутствия в образце генетического материала, происходящего от одного или нескольких независимых трансформантов растений.(71)(73) Заявитель и патентовладелец: САЙНТИФИК ИНСТИТЬЮТ ОФ ПАБЛИК ХЕЛТ (ИПХ) (BE)(72) Изобретатель: Ван Ден Бюльке Марк Анри Жермен,Ливан Антон Пит Нелли Рауль, Лнда Амая, Мбонголо Мбелла Этондо Гийом(BE), Барбо-Пьенуар Элоди (FR), Снейер Мириям Жаклин Сильвьян (BE) Область техники, к которой относится изобретение Данное изобретение относится к детектированию материалов, происходящих от независимых трансформантов растений (transgenic plant event). В частности, это изобретение обеспечивает способы,реагенты, наборы и ссылочные материалы для детектирования присутствия или отсутствия в образце генетического материала, происходящего от или могущего быть отнесенным к избранным независимым трансформантам растений. Сведения о предшествующем уровне техники Генетически модифицированные организмы (ГМО), в частности, генетически модифицированные растения, приобретают важность в сельском хозяйстве, а также в получении и маркетинге пищевых и кормовых продуктов. Однако вследствие обеспокоенности в отношении действия ГМО на окружающую среду и здоровье потребителей введение новых ГМО требует обычно регламентирующего санкционирования и, во многих странах, в том числе Европейском Союзе, пищевые и кормовые продукты, содержащие ГМО, подвергаются сами получению разрешения и обязательному маркированию (см., например, Regulation (EC) по. 1829/2003. Off J Eur Communities: Legis. 2003, L268: 1-23; Regulation (EC) no. 1830/2003. Off J Eur Communities: Legis. 2003, L268: 24-28). Таким образом, отслеживание ГМО в среде и на протяжении процесса культивирования и производственной цепи пищевых и кормовых продуктов является фундаментальным для оценки опасности для окружающей среды, а также необходимым для сохранения доверия потребителей и для удовлетворения или подтверждения соблюдения обязательных предписаний, в том числе маркировки продуктов ГМО. Это требует наличия способов, которые могут определять присутствие, идентичность и/или количество ГМО или материалов, происходящих или полученных из них, например, в пищевых и кормовых источниках, ингредиентах и/или обработанных потребительских товарах. В этом отношении очень применимы способы на основе ДНК, не в последнюю очередь потому, что ДНК часто выдерживает физические и химические технологические обработки лучше, чем другие молекулы, такие как белки. Например,полимеразная цепная реакция в реальном времени (ПЦР) оказалась специфическим и чувствительным способом для количественного определения нуклеиновых кислот, являющихся показателями присутствия ДНК, происходящей из ГМО. Доступны анализы для недвусмысленного заключения о присутствии или отсутствии генетического материала, происходящего от независимого трансформанта растения, в образце. Обычно такие анализы могут детектировать присутствие уникальной, специфической для данной трансформации, нуклеотидной последовательности, обнаруживаемой в представляющем интерес независимом трансформанте растения,но отсутствующей в других независимых трансформантах. Например, такие отличительные нуклеотидные последовательности могут присутствовать в местах соединений между эндогенной геномной последовательностью ГМО и последовательностью трансформирующей конструкции гена в геномном сайте инсерции последнего; детектирование может, например, включать в себя ПЦР-амплификацию сквозь указанное место соединения с использованием специфических праймеров, фланкирующих это место соединения (см., например, Hernandez et al. 2003. Transgenic Res 12: 179-189; Hernandez et al. 2004. J CerealTechnol 219: 421-427; или Ronning et al. 2003. Eur Food Res Technol 216: 347-354). Однако эти специфические для трансформантов анализы часто осуществляются с использованием дорогостоящих наборов, позволяющих лишь ограниченное количество тестов, которые ограничены детектированием материала от одного независимого трансформанта, и часто используют очень конкретные условия реакций. Однако, количество создаваемых, разрешенных и продаваемых на рынке ГМО продолжает увеличиваться. Таким образом, недвусмысленное определение состава ГМО образца может, в принципе, требовать применения неуклонно растущей совокупности отдельных специфических для этих независимых трансформантов анализов детектирования на каждом образце, что является как трудоемким, так и дорогостоящим. Таким образом, хотя все еще является желательным использование специфических для трансформации анализов вследствие недвусмысленного характера их результата, существует потребность в использовании этих анализов более эффективным и нацеленным образом, для улучшения детектирования ГМО, например, в отношении затраты времени, стоимости и трудоемкости. Сущность изобретения В разных аспектах данное изобретение обеспечивает способы, реагенты, наборы и ссылочные материалы, которые направлены на одну или несколько из обсуждаемых выше потребностей в данной области. В общем, это изобретение обеспечивает улучшенные способы, реагенты, наборы и ссылочные материалы для детектирования материала, происходящего из ГМО, и предпочтительно из генетически модифицированных растений, в образцах. Более конкретно, авторы изобретения выяснили, что посредством тщательного выбора признаков определенных последовательностей, которые должны быть анализированы в этом образце - где эти указанные признаки последовательности не должны быть обязательно специфическими для конкретного независимого трансформанта и могут быть фактически общими между двумя или более независимыми трансформантами - можно сделать вывод, содержит ли этот образец потенциально материал, происходящий от одного или нескольких незавимимых трансформантов, или, напротив, что этот образец не содержит материала, происходящего от одного или нескольких таких независимых трансформантов. Анализы этого изобретения могут, следовательно, обеспечивать важное указание на потенциальное содержание ГМО в образце и посредством этого уменьшать количество последующих тестов (таких как специфические для трансформантов анализы), необходимых для подтверждения присутствия материала, происходящего от одного или нескольких конкретных независимых трансформантов, в этом образце; это может,в свою очередь, улучшать эффективность способов детектирования ГМО путем уменьшения стоимости,затрат времени и труда. Например, анализы этого изобретения могут позволить уменьшение количества специфических для независимых трансформантов анализов, необходимых для характеристики состава ГМО этого образца. Авторы этого изобретения оценили скрупулезно известные, коммерчески значимые и/или разрешенные независимые трансформанты для выбора признаков, подлежащих анализу в образце, для уменьшения количества индивидуальных тест-реакций, требуемых на один образец, но все еще гарантирования достаточной информативности анализа профиля ГМО в соответствии с этим исследованием. Данное изобретение объединяет вышеописанное соответствующее понимание в его различных аспектах. Таким образом, в одном особенно предпочтительном аспекте (здесь аспекте "A1") это изобретение относится к способу для испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений, предусматривающему стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, содержащих или состоящих из:a) "Zm": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Zea mays,предпочтительно Zea mays ssp. mays;b) "Bn": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Brassica napus;c) "Gm": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Glycinemax,и одной, более чем одной или всех нуклеиновых кислот, выбранных из:d) "p35S": нуклеиновой кислоты, происходящей из промотора 35S вируса мозаичной болезни цветной капусты,e) "tNOS": нуклеиновой кислоты, происходящей из 3'-терминатора гена нопалинсинтетазы Agrobacterium tumefaciens,f) "Cry1Ab": нуклеиновой кислоты, происходящей из гена Cry1Ab кристаллического белка Bacillusthuringiensis,g) "PAT/bar": нуклеиновой кислоты, происходящей из гена bar фосфинотрицинацетилтрансферазы(PAT) Streptomyces hygroscopicus,h) "PAT/pat": нуклеиновой кислоты, происходящей из гена pat фосфинотрицинацетилтрансферазыi) "CP4-EPSPS": нуклеиновой кислоты, происходящей из гена EPSPS 5-енолпирувилшикимат-3 фосфатсинтазы из Agrobacterium sp. CP4 и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или более независимых трансформантов растений, таких как независимые трансформанты, выбранные из группы, включающей или состоящей из независимых трансформантов, выбранных из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, их гибридов и родственных им независимых трансформантов; независимых трансформантов Topas 19/2, MS1,RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac, GS40/90pHoe6/Ac, их гибридов, включающих в себяMS1/RF1, MS1/RF2, MS8/RF3, и родственных им независимых трансформантов; независимых трансформантов MON 40-3-2, MON89788, А 2704-12, А 5547-127, их гибридов и родственных им независимых трансформантов. Аспект A1 позволяет исследовать потенциальное присутствие или отсутствие в образце материала от многочисленных независимых трансформантов растений, принадлежащих к нескольким отдельным таксонам растений, с проведением относительно ограниченного количества стадий детектирования. Предпочтительно независимые трансформанты растений, детектируемые по способу аспекта A1, включают в себя большую часть или даже, по существу, наибольшее количество независимых трансформантов растений, разрешенных и/или коммерциализованных в настоящее время, например, в Европе, т.е. независимые трансформанты растений, которые должны встречаться особенно вероятно например, в окружающей среде или коммерческих образцах. Таким образом, в этом аспекте это изобретение обеспечивает не предъявляющий особенно больших требований анализ для испытания значительного спектра релевантных независимых трансформантов растений. Предпочтительно стадия (1) аспекта A1 может включать в себя детектирование присутствия или от-2 024233 сутствия в образце нуклеиновых кислот, содержащих все из нуклеиновых кислот или состоящих из всех нуклеиновых кислот, перечисленных под пунктами а)-i), определенными выше. Это выгодным образом улучшает информацию, получаемую тестированием этого образца, и позволяет сделать вывод о потенциальном присутствии или отсутствии материала, происходящего, по существу, от большого числа независимых трансформантов растений. Поскольку на стадии (2) аспекта A1 предусматривается детектирование специально для конкретно существующих независимых трансформантов растений, должно быть понятно, что другие независимые трансформанты, в том числе любые будущие независимые трансформанты, которые будут генерироваться, могут также детектироваться в той степени, в какой они принадлежат к таксонам, определенным под пунктами а)-c), и содержат одну или несколько из нуклеиновых кислот, определенных под пунктами d)i). Это наблюдение относится mutatis mutandis к детектированию независимых трансформантов в любых аспектах этого изобретения, как описано в дальнейшем. Хотя способ аспекта A1 позволяет одновременно испытывать присутствие или отсутствие в образце независимых трансформантов растений, принадлежащих по меньшей мере к трем различным таксонам,авторы изобретения рассматривают также адаптирование этого способа к индивидуальным таксонам. Это может выгодным образом уменьшать количество стадий детектирования нуклеиновых кислот, если требуется информация только для конкретного таксона. Таким образом, в следующем аспекте ("A2") это изобретение обеспечивает способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктом a), определенным выше, и одной, более чем одной или всех нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы, таких как независимые трансформанты, выбранные из группы, включающей или состоящей из Bt176, Bt11, Bt10, MON810, MON863, TC1507,NK603, T25, GA21, DAS-59122, их гибридов и родственных им независимых трансформантов. Предпочтительно стадия (1) аспекта A2 может включать в себя детектирование присутствия или отсутствия в образце нуклеиновых кислот, содержащих все из нуклеиновых кислот или состоящих из всех нуклеиновых кислот, перечисленных под пунктами a)-i), определенными выше. Это увеличивает информацию, получаемую тестированием этого образца, и позволяет сделать вывод о потенциальном присутствии или отсутствии материала, происходящего из сравнительно большего числа независимых трансформантов растений кукурузы. В следующем аспекте ("A3") это изобретение представляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений масличного рапса, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктом b), определенным выше, и одной более чем одной или всех нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений масличного рапса, таких как независимые трансформанты, выбранные из группы, включающей или состоящей из независимых трансформантовTopas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac, GS40/90pHoe6/Ac, их гибридов,включающих в себя MS1/RF1, MS1/RF2, MS8/RF3, и родственных им независимых трансформантов. Предпочтительно стадия (1) аспекта A3 может включать в себя детектирование присутствия или отсутствия в образце нуклеиновых кислот, содержащих все из нуклеиновых кислот или состоящих из всех нуклеиновых кислот, перечисленных под пунктами b) и d)-i), определенными выше. Это увеличивает информацию, получаемую тестированием этого образца, и позволяет сделать вывод о потенциальном присутствии или отсутствии материала, происходящего из сравнительно большего числа независимых трансформантов растений масличного рапса. В другом предпочтительном варианте осуществления стадия (1) аспекта A3 включает в себя детектирование присутствия или отсутствия в образце нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами b) и d), e) и g)-i), определенными выше. Отмечается, что многие независимые трансформанты масличного рапса, например независимые трансформанты, особо указанные в стадии (2) аспекта 3, могут не включать в себя нуклеиновую кислоту, указанную под пунктом f), определенным выше. Таким образом, исключение указанной нуклеиновой кислоты, указанной в перечне под пунктом f) из стадии (1) аспекта A3, может уменьшать число тестов без потери информации. В следующем аспекте ("A4") это изобретение предоставляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктом c), определенным выше, и одну, более чем одну или все нуклеиновые кислоты, выбранные из нуклеиновых кислот,перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений сои, таких как независимые трансформанты, выбранные из группы, состоящей из MON 40-3-2, MON89788, А 2704-12, А 5547-127, их гибридов и родственных им независимых трансформантов. Предпочтительно стадия (1) аспекта A4 может включать в себя детектирование присутствия или отсутствия в образце нуклеиновых кислот, включающих из нуклеиновых кислот или состоящих из всех нуклеиновых кислот, перечисленных под пунктами c) и d)-i), определенными выше. Это увеличивает информацию, получаемую тестированием этого образца, и позволяет сделать вывод о потенциальном присутствии или отсутствии материала, происходящего из сравнительно большего числа независимых трансформантов растений сои. В другом предпочтительном варианте осуществления стадия (1) аспекта A4 включает в себя детектирование присутствия или отсутствия в образце нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами c) и d), e), h) и i), определенными выше. Отмечается, что многие независимые трансформанты сои, например независимые трансформанты, особо указанные в стадии (2) аспекта 4, могут не включать в себя нуклеиновых кислот, указанных под пунктами f) и g), определенными выше. Таким образом, исключение указанных нуклеиновых кислот,указанных в перечне под пунктами f) и g), из стадии (1) аспекта A4 может уменьшать число тестов без потери информации. Должно быть также понятно, что дополнительные аспекты могут описывать комбинации любых двух из приведенных выше аспектов A2-A4. Например, это может выгодным образом уменьшать количество проведений тестирования в случаях, когда предполагается детектирование независимых трансформантов из выбранных таксонов. Таким образом, в следующем аспекте ("A5") это изобретение предоставляет способ для испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a) и b), определенными выше, и одной, более чем одной или всех из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов, выбранных из Bt176, Bt11, Bt10, MON810, MON863, TC1507,NK603, T25, GA21, DAS-59122, их гибридов и родственных им независимых трансформантов; и независимых трансформантов Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac,GS40/90pHoe6/Ac, их гибридов, включающих в себя MS1/RF1, MS1/RF2, MS8/RF3, и родственных им независимых трансформантов. По разъясненным выше причинам стадия (1) аспекта A5 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами a), b) и d)i), определенными выше. Еще в одном аспекте ("A6") это изобретение представляет способ для испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или сои, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a) и c), определенными выше, и одной, более чем одной или всех из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или сои, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, их гибридов и родственных им независимых трансформантов и независимых трансформантов MON 40-3-2,MON89788, А 2704-12, A5547-127, их гибридов и родственных им независимых трансформантов. По разъясненным выше причинам стадия (1) аспекта A6 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами a), c) и d)-4 024233i), определенными выше. Еще в одном аспекте ("A7") это изобретение предоставляет способ для испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов масличного рапса и/или сои, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a) и b), определенными выше, и одной, более чем одной или всех из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений масличного рапса и/или сои, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac,GS40/90pHoe6/Ac, их гибридов, включающих в себя MS1/RF1, MS1/RF2, MS8/RF3, и родственных им независимых трансформантов; и независимых трансформантов MON 40-3-2, MON89788, А 2704-12,A5547-127, их гибридов и родственных им независимых трансформантов. По разъясненным выше причинам, стадия (1) аспекта A7 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами b), c) и d)i), определенными выше. В другом предпочтительном варианте осуществления, стадия (1) аспекта A7 включает в себя детектирование присутствия или отсутствия в образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящей из всех нуклеиновых кислот, перечисленных под пунктами b), c) и d), e) и g)-i),определенными выше, т.е. без детектирования нуклеиновой кислоты, указанной в перечне под пунктомf). Таким образом, в одном аспекте ("A8") это изобретение предоставляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса и/или сои, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из таких нуклеиновых кислот, как одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами a), b) и c), определенными выше; и одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, их гибридов, и родственных им независимых трансформантов; независимых трансформантов Topas 19/2, MS1, RF1,RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac, GS40/90pHoe6/Ac, их гибридов, включающих в себяMS1/RF1, MS1/RF2, MS8/RF3 и родственных им независимых трансформантов; и независимых трансформантов MON 40-3-2, MON89788, А 2704-12, A5547-127, их гибридов и родственных им независимых трансформантов. По разъясненным выше причинам стадия (1) аспекта A8 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше. Как объяснялось, способы описанных выше аспектов A1-A8 хорошо подходят для детектирования потенциального присутствия или отсутствия в образце материала, происходящего из независимых трансформантов растений, таких как независимые трансформанты, которые были разрешены и/или обычно использовались. Однако должно быть понятно, что указанные способы являются также выгодно гибкими и в вариантах осуществления позволяют лучшим образом оценивать присутствие или отсутствие материала, происходящего из дополнительных независимых трансформантов, таких как независимые трансформанты, не описанные особо в стадии 2 описанных выше аспектов A1-A9. Таким образом, это позволяет собирать даже больше информации в отношении состава этого образца. Таким образом, в вариантах стадия (1) любого из аспектов A1, А 2, A5, A6 или A8 может дополнительно содержать детектирование присутствия или отсутствия в образце нуклеиновой кислоты j)"mCry3A": нуклеиновой кислоты, происходящей из модифицированного гена Cry3A кристаллического белка Bacillus thuringiensis; и группа независимых трансформантов, определенная на стадии (23) любого из соответствующих аспектов, дополнительно содержит независимый трансформант кукурузы MIR604,его гибриды с другими независимыми трансформантами кукурузы и независимые трансформанты, родственными MIR604. В дополнительных вариантах осуществления стадия (1) любого из вышеописанных аспектов A1,-5 024233 А 2, A5, A6 или A8 может дополнительно включать в себя детектирование присутствия или отсутствия в образце одной или обеих нуклеиновых кислот k) "cordapA": нуклеиновой кислоты, происходящей из генаglutamicum, и/или l) "Glb1": нуклеиновой кислоты, происходящей из промотора Glb1 кукурузы; и группа независимых трансформантов, определенных в стадии (2) любого из соответствующих аспектов, дополнительно содержит незавимимый трансформант кукурузы LY038, его гибриды с другими независимыми трансформантами кукурузы, и независимые трансформанты, родственные LY038. В дополнительных вариантах осуществления стадия (1) любого из вышеописанных аспектов A1,А 2, A5, A6 или A8 может дополнительно включать в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты m) "Cry3Bb1": нуклеиновой кислоты, происходящей из гена Cry3Bb1 кристаллического белка Bacillus thuringiensis; и группа независимых трансформантов, определенная в стадии(2) любого из соответствующих аспектов, дополнительно содержит незавимимый трансформант кукурузы MON88017, его гибриды с другими независимыми трансформантами кукурузы и независимые трансформанты, родственные MON88017. Соответственно, стадия (1) любого из вышеописанных аспектов A1, А 2, A5, A6 или A8 может дополнительно включать в себя детектирование присутствия или отсутствия в образце одной, более чем одной или всех нуклеиновых кислот, перечисленных под пунктами j)-m), определенными выше; и группа независимых трансформантов, определенных в стадии (2) любого из соответствующих аспектов, может дополнительно содержать одно, более чем одно или все из независимых трансформантов кукурузыMIR604, LY038 и MON88017, их гибриды с другими независимыми трансформантами кукурузы и независимые трансформанты, родственные им. Однако, поскольку детектирование соответствующих нуклеиновых кислот, перечисленных под пунктами j)-m), определенными выше, может обеспечивать улучшенное детектирование присутствия материала из независимых трансформантов кукурузы MIR604,LY038 и/или MON88017 в этом образце, детектирование нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше, позволяет уже сделать выводы относительно потенциального присутствия материала из указанных независимых трансформантов MIR604, LY038 и/или MON88017 в образце(см. также табл. 3). В вариантах осуществления стадия (1) любого из вышеописанных аспектов A1, А 2, A5, A6 или A8 может дополнительно включать в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты n) "Bxn": нуклеиновой кислоты, происходящей из гена Bxn нитрилазы Klebsiella pneumoniaessp. ozaenae; и группа независимых трансформантов, определенных в стадии (2) любого из соответствующих аспектов, дополнительно содержит независимый трансформант масличного рапса OXY235, его гибриды с другими независимыми трансформантами в масличном рапсе и независимые трансформанты,родственные OXY235. Однако, поскольку детектирование нуклеиновой кислоты, указанной под пунктом(n), определенным выше, может обеспечивать улучшенное детектирование присутствия материала из независимых трансформантов масличного рапса OXY235 в этом образце, детектирование нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше, позволяет уже сделать выводы относительно потенциального присутствия материала из указанного независимого трансформанта OXY235 в образце (см. табл. 3). Таким образом, в одном аспекте ("A9") это изобретение предоставляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса и/или сои, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из таких нуклеиновых кислот, как одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами a), b) и c), определенными выше, и одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и необязательно, одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами j)-n), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, MIR604,LY038 и MON88017, их гибридов и родственных им независимых трансформантов; независимых трансформантов Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac, GS40/90pHoe6/Ac,OXY235, их гибридов, включающих в себя MS1/RF1, MS1/RF2, MS8/RF3, и родственных им независимых трансформантов; и независимых трансформантов MON 40-3-2, MON89788, А 2704-12, A5547-127, их гибридов и родственных им независимых трансформантов. По разъясненным выше причинам, стадия (1) аспекта A9 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами d)-i), опре-6 024233 деленными выше. Таким образом, в следующих предпочтительных вариантах осуществления способы вышеописанных аспектов A1-A8 могут дополнительно оценивать также потенциальное присутствие или отсутствие в образцах материала, происходящего из независимых трансформантов, которые относятся к другим таксонам. Таким образом, в вариантах осуществления стадия (1) любого из вышеописанных аспектов A1-A8(или вышеописанных вариантов осуществления указанных аспектов) может дополнительно включать в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты o) "Or": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Oryza sativa; и группа независимых трансформантов, определенная в стадии (2) любого из соответствующих аспектов, дополнительно включает один, более одного или всех независимых трансформантов риса LL62, LL06 и LL601, их гибридов и родственных им независимых трансформантов. В дополнительных вариантах осуществления стадия (1) любого из вышеописанных аспектов A1-A8(или вышеописанных вариантах осуществления указанных аспектов) дополнительно включает в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты p) "Bv": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Beta vulgaris; и группа независимых трансформантов, определенная в стадии (2) любого из соответствующих аспектов, дополнительно включает один, более одного или все независимые трансформанты в сахарной свекле T120-7, H7-1 и A5-15, их гибриды и родственные им независимые трансформанты. В дополнительных вариантах осуществления стадия (1) любого из вышеописанных аспектов A1-A8(или вышеописанных вариантов осуществления указанных аспектов) может дополнительно включать в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты q) "Gs": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Gossypium; и группа независимых трансформантов, определенная в стадии (2) любого из соответствующих аспектов, дополнительно включает один, более одного или все независимые трансформанты хлопчатника LL cotton 25, MON 1445,MON 531, MON15985, их гибриды и родственные им независимые трансформанты. В дополнительном развитии стадия (1) любого из вариантов осуществления предыдущего абзаца может дополнительно включать в себя детектирование присутствия или отсутствия в образце одной или обеих из нуклеиновых кислот r) "Cry1Ac": нуклеиновой кислоты, происходящей из гена Cry1Ac кристаллического белка Bacillus thuringiensis, и/или s) "Cry2Ab2": нуклеиновой кислоты, происходящей из генаCry2Ab2 кристаллического белка Bacillus thuringiensis; и группа независимых трансформантов, определенная в стадии (2), может особенно хорошо детектировать одно или оба из независимых трансформантов в хлопчатнике MON 531, MON15985, их гибриды с другими независимыми трансформантами в хлопчатнике и родственные им независимые трансформанты. В других дополнительных вариантах осуществления стадия (1) любого из вышеописанных аспектовA1-A8 (или вышеописанных вариантов осуществления указанных аспектов) может дополнительно включать в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты t) "St": нуклеиновой кислоты, происходящей из таксона и специфической для таксона Solarium tuberosum; и группа независимых трансформантов, определенная в стадии (2) любого из соответствующих аспектов, дополнительно включает незавимимую трансформацию в картофеле EH92-527-1 и родственные ему независимые трансформанты. В дополнительном развитии стадия (1) любого из вариантов осуществления предыдущего абзаца может дополнительно включать в себя детектирование присутствия или отсутствия в образце нуклеиновой кислоты u) "GBSS": нуклеиновой кислоты, происходящей из гена Gbss связанной с гранулами крахмалсинтазы Solarium tuberosum, что дополнительно улучшает достоверность детектирования материала из указанного независимого трансформанта EH92-527-1. Должно быть понятно, что предыдущие способы могут выполняться в различных подходящих комбинациях, позволяющих детектировать желаемые независимые трансформанты растений и уменьшающих прилагаемые усилия. Таким образом, в одном аспекте ("A10") это изобретение представляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса, и/или сои, и/или риса, и/или сахарной свеклы, и/или хлопчатника, и/или картофеля, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из таких нуклеиновых кислот, как одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами a), b), c), o), p), q), и t), определенными выше; и одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)- i), определенными выше; и необязательно одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами j)-n), r), s) и u) определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, MIR604,LY038 и MON88017, их гибридов, и родственных им независимых трансформантов; независимых трансформантов Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac, GS40/90pHoe6/Ac,OXY235, их гибридов, включающих в себя MS1/RF1, MS1/RF2, MS8/RF3 и родственных им независимых трансформантов; и независимых трансформантов MON 40-3-2, MON89788, А 2704-12, A5547-127, их гибридов и родственных им независимых трансформантов; независимых трансформантов LL62, LL06 иLL601, их гибридов и родственных им независимых трансформантов; независимых трансформантовT120-7, H7-1 и A5-15, их гибридов и родственных им независимых трансформантов; независимых трансформантов LL cotton 25, MON 1445, MON 531, MON15985, их гибридов и родственных им независимых трансформантов. По разъясненным выше причинам стадия (1) аспекта A10 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше. В одном родственном предпочтительном аспекте ("A11") это изобретение предоставляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса, и/или сои, и/или риса, и/или сахарной свеклы, и/или хлопчатника, и/или картофеля, предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из таких нуклеиновых кислот, как одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами a), b), c), o), p), q) и t), определенными выше, и одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, необязательноMIR604, LY038 и MON88017, их гибридов и родственных им независимых трансформантов; независимых трансформантов Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac,GS40/90pHoe6/Ac, необязательно OXY235, их гибридов, включающих в себя MS1/RF1, MS1/RF2,MS8/RF3, и родственных им независимых трансформантов; независимых трансформантов MON 40-3-2,MON89788, А 2704-12, A5547-127, их гибридов и родственных им независимых трансформантов; независимых трансформантов LL62, LL06 и LL601, их гибридов и родственных им независимых трансформантов; независимых трансформантов T120-7, H7-1 и A5-15, их гибридов и родственных им независимых трансформантов; независимых трансформантов LL cotton 25, MON 1445, MON 531, MON15985, их гибридов и родственных им независимых трансформантов. По разъясненным выше причинам стадия (1) аспекта A11 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами d)-i). Предпочтительно в любом из вышеописанных аспектов A1-A11 или любом варианте осуществления указанных аспектов присутствие или отсутствие нуклеиновых кислот в образце детектируют с использованием амплификации ампликонов, содержащихся в соответствующих нуклеиновых кислотах,например, предпочтительно с использованием ПЦР и более предпочтительно с использованием ПЦР в реальном времени. Для возможности эффективного применения ПЦР-амплификации в вышеописанных способах авторы данного изобретения проводили скрупулезный поиск на праймеры и пары праймеров и тестировали праймеры и пары праймеров таким образом, чтобы выбрать праймеры, особенно предпочтительные в указанных способах. Идентифицированные предпочтительные пары праймеров приведены в списке в табл. 1. Они влекут за собой inter alia следующие существенные преимущества. Эти праймеры проявляют, по существу, одну и ту же или достаточно сходную температуру отжига, позволяя посредством этого выполнять ПЦРамплификацию на различных нуклеиновых кислотах при одних и тех же температурных условиях циклов и, следовательно, в одном и том же устройстве. Это в значительной степени облегчает достижение высокой производительности этих способов и уменьшает количество прилагаемого труда, расходных материалов и устройств. Эти пары праймеров продуцируют ампликоны приблизительно 100 п.н. и посредством этого позволяют амплифицировать нуклеиновые кислоты-мишени даже из образцов, в которых генетический материал в значительной степени фрагментирован, как это может иметь место в случае обработанных пищевых или кормовых продуктов. Эти праймеры и пары праймеров обнаруживают достаточную специфичность амплификации, а также чувствительность, подходящую для амплификации в реальном времени. Кроме того, для гарантии чувствительности и однородности способов и наборов,обеспечиваемых этим изобретением, эти праймеры и пары праймеров были сконструированы таким образом, что они генерируют, при 40 циклах и с использованием 10000 копий матрицы, флуоресценцию по меньшей мере 2500 относительных единиц флуоресценции (RFU), причем генерированные таким образом величины флуоресценции для различных наборов праймеров лежат приблизительно в 3-кратном пределе. Кроме того, каждая пара праймеров была сконструирована таким образом, что она выполняет амплификацию на соответствующих нуклеиновых кислотах, по существу, из всех представляющих интерес независимых трансформантов, несмотря на существование потенциальных несоответствий последовательности (например, вследствие оптимизированной частоты использования кодонов) в указанных нуклеиновых кислотах между такими независимыми трансформантами. Таблица 1. Предпочтительные пары праймеров для детектирования нуклеиновых кислот, перечисленных под пунктами a)-i), o), p), q) и t), определенными выше, при помощи ПЦР Таким образом, это изобретение обеспечивает способы, определенные в любом из вышеописанных аспектов A1-A11 или в любом варианте осуществления указанных аспектов, в которых присутствие или отсутствие нуклеиновых кислот из нуклеиновых кислот, перечисленных под пунктами a)-i), o), p), q) и t),определенными выше, в образце детектируют при помощи ПЦР-амплификации с использованием соответствующих пар праймеров, показанных в табл. 1. Когда табл. 1 приводит более чем один прямой и/или обратный праймер для амплификации на определенной нуклеиновой кислоте (например, для "CP4-EPSPS"), любой один или любая комбинация указанных прямых праймеров могут быть использованы с любым одним или с любой комбинацией указанных обратных праймеров для получения амплификации. Следует понимать, что, хотя последовательности праймеров, перечисленных в табл. 1, были усовершенствованы для обеспечения оптимальной амплификации, данные способы могут работать адекватно при использовании вариантных праймеров, которые проявляют определенную ограниченную степень вариации последовательности относительно праймеров в табл. 1. Таким образом, вышеописанные аспекты и варианты осуществления включают в себя также способы, в которых представляющие интерес нуклеиновые кислоты детектируют ПЦР-амплификацией с использованием вариантных праймеров, которые включают в себя одну или несколько вариаций последовательности относительно соответствующих праймеров, перечисленных в табл. 1, такие как, например,одна или несколько делеций, инсерций и/или замен, пока такие вариантные праймеры/пары праймеров все еще могут приводить к адекватной амплификации их соответствующих ампликонов. Предпочтительно такие вариантные праймеры могут обнаруживать по меньшей мере 85%, более предпочтительно по меньшей мере 90%, даже более предпочтительно по меньшей мере 95% и даже еще более предпочтительно по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с праймерами, перечисленными в табл. 1. Сопоставления последовательностей и определение идентичности последовательностей может выполняться, например, с использованием Basic Local Alignment Search Tool (BLAST) первоначально описанного Altschul et al. 1990 (J(FEMS Microbiol Lett 174: 247-250). Кроме того, должно быть понятно, что праймеры, перечисленные в табл. 1, или их варианты могут быть выгодным образом дериватизованы. Например, указанные праймеры или их варианты могут быть помечены для возможности детектирования амплифицированных продуктов, например, в применениях ПЦР в реальном времени. Таким образом, подобная дериватизация может, например, приводить к введению одной или нескольких меченых частей и одной или нескольких вспомогательных частей молекулы(например, гасящую часть, часть FRET и т.д.), и необязательно, если требуется, модификации последовательности праймера для создания возможности введения и/или правильной работы указанной части или частей молекулы. Квалифицированный в данной области специалист обычно знаком со способами модификации праймеров и пар праймеров для целей мечения. Применение дериватизованных таким образом праймеров и пар праймеров может быть особенно полезным в ПЦР в реальном времени и, в частности, когда в мультиплексных реакциях амплификации должны прослеживаться два или более меченых продукта амплификации. Таким образом, вышеописанные аспекты и варианты осуществления включают в себя также способы, в которых представляющие интерес нуклеиновые кислоты детектируют при помощи ПЦРамплификации с использованием производных праймеров и пар праймеров, перечисленных в табл. 1, или их вариантов. В качестве примера в одном предпочтительном аспекте ("A12") это изобретение представляет способ испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений (в частности, одного или нескольких независимых трансформантов растений кукурузы и/или масличного рапса, и/или сои, и/или риса, и/или сахарной свеклы, и/или хлопчатника, и/или картофеля), предусматривающий стадии:(1) детектирования присутствия или отсутствия в этом образце нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из таких нуклеиновых кислот, как одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами a), b), c), o), p), q) и t), определенными выше, и одна, более чем одна или все из нуклеиновых кислот, выбранных из нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше; и(2) заключения о присутствии или отсутствии в этом образце материала, происходящего от одного или нескольких независимых трансформантов растений, таких как независимые трансформанты, выбранные из группы, включающей независимые трансформанты или состоящей из независимых трансформантов Bt176, Bt11, Bt10, MON810, MON863, TC1507, NK603, T25, GA21, DAS-59122, необязательноMIR604, LY038 и MON88017, их гибридов и родственных им независимых трансформантов; независимых трансформантов Topas 19/2, MS1, RF1, RF2, RF3, MS8, GT73, Т 45, Liberator pHeo6/Ac,GS40/90pHoe6/Ac, необязательно OXY235, их гибридов, включающих в себя MS1/RF1, MS1/RF2,MS8/RF3 и родственных им независимых трансформантов; независимых трансформантов MON 40-3-2,MON89788, А 2704-12, A5547-127, их гибридов и родственных им независимых трансформантов; независимых трансформантов LL62, LL06 и LL601, их гибридов и родственных им независимых трансформантов; независимых трансформантов T120-7, H7-1 и A5-15, их гибридов и родственных им независимых трансформантов; независимых трансформантов LL cotton 25, MON 1445, MON 531, MON15985, их гибридов и родственных им независимых трансформантов, где на стадии (1) присутствие или отсутствие нуклеиновых кислот в образце детектируют при помощи ПЦР-амплификации с использованием соответствующих праймеров и пар праймеров, показанных в табл. 1, или их вариантов или производных. По разъясненным выше причинам стадия (1) аспекта A12 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами d)-i), определенными выше. В одном предпочтительном варианте осуществления стадия (1) аспекта A12 может предпочтительно включать в себя детектирование присутствия или отсутствия в этом образце нуклеиновых кислот, включающих все нуклеиновые кислоты или состоящих из всех нуклеиновых кислот, перечисленных под пунктами a)-i), определенными выше. В одном аспекте это изобретение дополнительно обеспечивает праймеры и пары праймеров и их варианты или производные, подходящие для амплификации ампликонов из нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a) u), определенными выше. В частности, ввиду значительных усилий, вложенных авторами этого изобретения в идентификацию пар праймеров, перечисленных в табл. 1, это изобретение обеспечивает праймеры и пары праймеров, перечисленные в табл. 1, а также их варианты и производные, необязательно в любой подходящей комбинации указанных праймеров и/или пар праймеров или их вариантов или производных. Кроме того, это изобретение обеспечивает также продукты амплификации, получаемые с использованием предпочтительных праймеров и пар праймеров, векторы и плазмиды, содержащие указанные продукты амплификации, и рекомбинантые микроорганизмы, трансформированные указанными векторами и плазмидами и несущие указанные векторы и плазмиды. Таким образом, в предпочтительных вариантах осуществления, это изобретение относится также к рекомбинантной E. coli, депонированной согласно Будапештскому договору Belgian Coordinated Collections of Microorganisms (BCCM), Laboratorium voor Moleculaire Biologie - Plasmidencollectie(BCCM/LMBP) (Universiteit Gent, Technologiepark 927, B-9052 Gent-Zwijnaarde, Belgium) 10 января 2007 г. под номерами доступа LMBP: LMBP 5452, LMBP 5453, LMBP 5454, LMBP 5455, LMBP 5456, LMBP 5457, LMBP 5458, LMBP 5459 и LMBP 5460, 6 марта 2007 года под номером доступа 5451 и 19 апреля 2007 года под номерами доступа LMBP: LMBP 5587, LMBP 5588, LMBP 5589 и LMBP 5590, a также к выделенным рекомбинантным плазмидам, получаемым из указанной рекомбинантной E. coli, а также к выделенным вставкам из указанных плазмид, предпочтительно выделенным вставкам EcoRI-EcoRI. Такие плазмиды или векторы или их вставки и их комбинации особенно применимы в качестве положительных контролей, эталонов и/или калибраторов для соответствующих ампликонов в реакциях амплификации вышеописанных способов. Кроме того, это изобретение относится также к наборам, содержащим один или несколько реагентов, применимых в способах одного или нескольких вышеописанных аспектов и вариантов. Например,такие наборы могут содержать один или несколько из вышеописанных праймеров и/или пар праймеров,в частности, перечисленных в табл. 1, или вариантов или производных указанных праймеров, и/или один или несколько вышеописанных продуктов амплификации, векторов или плазмид, содержащих их, или вставки из указанных векторов или плазмид и/или носитель данных, содержащий инструкции для программируемого устройства для проведения стадии (2) способов этого изобретения (см. ниже). Такие наборы могут предпочтительно дополнительно содержать инструкции для пользователя в отношении выполнения способов этого изобретения и для интерпретации получаемых таким образом данных. Это изобретение описывает также несложный и прямой способ выполнения стадии (2) вышеописанных аспектов и вариантов, т.е. для заключения о потенциальном присутствии или отсутствии в образце материала, происходящего из различных представляющих интерес независимых трансформантов растений. В частности, результаты, получаемые для образца в стадии (1) вышеописанных аспектов и вариантов, представлены в виде набора "GSAM", состоящего из нуклеиновых кислот, т.е. представляющего коллекцию нуклеиновых кислот, выбранных из нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a) - u) выше, которые были детектированы в указанной стадии (1) как присутствующие в этом образце (стадии i. Кроме того, любой представляющее интерес независимый трансформант растения может быть представлено в виде набора "GX" (где X обозначает представляющее интерес незавимимую трансформацию), состоящего из нуклеиновых кислот, т.е. представляющего коллекцию нуклеиновых кислот, выбранных из нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a)-u) выше, которые были обнаружены в указанном независимом трансформанте, следовательно, могут быть детектированы в стадии (1), если этот образец содержал материал, происходящий из указанного независимого трансформанта, или гибрид, включающий в себя такой или родственный независимый трансформант (стадии (ii. В конкретном примерном варианте осуществления, набор GX может предпочтительно быть выбран из наборов, представляющих независимые трансформанты, конкретно описанные выше, например, содержащих наборы: наборы независимых трансформантов в кукурузе GBt176Zm; p35S; Cry1Ab;Zm; p35S; tNOS; CP4-EPSPS; Cry3Bb1, наборы независимых трансформантов в масличном рапсе GTopas 19/2Bn; p35S; PAT/pat, GMS1Bn; tNOS; PAT/bar, GRF1Bn; tNOS; PAT/bar, GRF2Bn; tNOS;Bn; p35S; Bxn; наборы независимых трансформантов в сое GMON40-3-2Gm; p35S; tNOS; CP4-EPSPS,GMON89788Gm; CP4-EPSPS, GA2704-12Gm; p35S; PAT/pat и GA5547-127p35S; PART/pat, наборы независимых трансформантов в рисе GLL62Or; p35S; PAT/bar, GLL06Or; p35S; PAT/bar и GLL601Or; p35S; tNOS; PAT/bar, наборы независимых трансформантов в сахарной свекле GT120-7Bv; p35S;PAT/pat, GH7-1Bv; p35S; CP4-EPSPS и GA5-15Bv; p35S; tNOS; CP4-EPSPS, наборы независимых трансформантов в хлопчатнике GLL cotton 25Gs; p35S; tNOS; PAT/bar, GMON1445Gs; p35S; tNOS;CP4-EPSPS, GMON531Gs; p35S; tNOS; Cry1Ac и GMON15985Gs; p35S; tNOS; Cry1Ac; Cry2Ab2 и набор независимых трансформантов в картофеле GEH92-527-1St; tNOS; Gbss; где обозначения между скобкамиотносятся к нуклеиновым кислотам, перечисленным под пунктами a)-u) выше, которые обнаружены в таких независимых трансформантах и могут быть, следовательно, детектированы в материалах, происходящих из них. Должно быть понятно, что, если стадия детектирования (1) включает в себя дополнительные нуклеиновые кислоты, другие, чем нуклеиновые кислоты, перечисленные под пунктамиa)-u) выше, такие нуклеиновые кислоты могут быть предпочтительно включены в вышеописанные наборы. Должно быть понятно, что, когда вышеописанные способы не тестируют присутствие всех нуклеиновых кислот под пунктами a) - u) выше, этот набор образцов, а также наборы независимых трансформантов могут быть определены на основе нуклеиновых кислот, присутствие которых эффективно тестируется. В качестве примера, но не ограничения, если присутствие нуклеиновых кислот, перечисленных под пунктами j) - n), r) s) и u), определенными выше, которые соответствуют специфическим признакам,наряду с нуклеиновыми кислотами, определенными под пунктами d) - i), не тестируется, то наборы, соответствующие нескольким независимым трансформантам, могут быть определены в более узких рамках, в частности, наборы независимых трансформантов в кукурузе GMIR604Zm; tNOS, GLY038Zm;p35S; tNOS, GMON88017Zm; p35S; tNOS; CP4-EPSPS; наборы независимых трансформантов в масличном рапсе GOXY235Bn; p35S; наборы независимых трансформантов в хлопчатнике GMON531Gs; p35S; tNOS, GMON15985Gs; p35S; tNOS и наборы независимых трансформантов в картофелеGEH92-527-1 St; tNOS. Таким образом, присутствие материала, происходящего из представляющего интерес независимого трансформанта X в этом образце, может быть затем определено проведением логических операций для соответствующего представляющего интерес набора GX следующим образом (стадии iii): если GX равен GSAM (GX = GSAM), то материал, происходящий из независимого трансформанта X или из его гибрида, или из родственного ему независимого трансформанта, потенциально присутствует в этом образце; если GX является истинным подмножеством GSAM (GXGSAM), то материал, происходящий из независимого трансформанта X, или из его гибрида, или из родственного ему независимого трансформанта,потенциально присутствует в этом образце; если GX не равен GSAM и GX не является истинным подмножеством GSAM, (GXGSAM и GXGSAM),то материал, происходящий из независимого трансформанта X, или из его гибрида, или из родственного ему независимого трансформанта, отсутствует в этом образце. В предпочтительных вариантах осуществления эти логические операции могут предпочтительно проводиться вычислительным устройством. Должно быть понятно, что поскольку вышеописанный алгоритм для применения на стадии (2) этих способов объяснен здесь в связи с заключением о присутствии материала из определенных независимых трансформантов с использованием детектирования конкретных нуклеиновых кислот, указанный алгоритм в принципе легко применим к способам, которые нацелены на заключение о присутствии любых независимых трансформантов, таких как независимые трансформанты, иные, чем независимые трансформанты, конкретно упомянутые выше, или дополнительные к независимым трансформантам, конкретно упомянутым выше, с использованием детектирования любых нуклеиновых кислот, таких как нуклеиновые кислоты, другие, чем нуклеиновые кислоты, перечисленные под пунктами a)-u), или дополнительные к нуклеиновым кислотам, перечисленным под пунктами a)-u) выше. Эти и дополнительные аспекты, и предпочтительные варианты осуществления этого изобретения описаны в следующих разделах и в прилагаемой формуле изобретения. Краткое описание фигур Фиг. 1 (A-F) иллюстрирует выбранные последовательности ампликонов, амплифицированных с использованием праймеров, перечисленных в табл. 4, и присутствующих в клонирующих векторах, в частности, в pUC18, таких как плазмиды, перечисленные в табл. 5. Как можно видеть, эти последовательности могут включать в себя частичные последовательности из множественных сайтов клонирования,фланкирующих инсертированные ампликоны. Фиг. 2 (A) показывает результаты мультиплексного ПЦР-теста на p35S/tNOS, (В) кривая диссоциации p35S/tNOS-специфического мультиплексного теста. Фиг. 3 обеспечивает графическое представление данных с использованием +/-8300 копий матриц,перечисленных в табл. 8. Сведения, подтверждающие возможность осуществления изобретения В данном контексте единственные формы "a", "an" и "the" включают в себя как единственные, так и множественные понятия, если контекст не диктует явно другого понимания. Термины "содержащий", "содержит" и "состоит из" являются в данном контексте синонимами терминов "включающий в себя", "включает в себя" или "содержащий в себе", "содержит в себе", и являются включающими в себя или не окончательными и не исключают дополнительных, не указанных здесь членов, элементов или стадий способов. Предполагается, что термин "приблизительно", когда он относится к измеряемой величине, такой как параметр, количество, продолжительность времени и т.п., включает в себя вариации +/- 20% или менее, предпочтительно +/-10% или менее, более предпочтительно +/-5% или менее, даже более предпочтительно +/-1% или менее и еще более предпочтительно +/-0,1% или менее указанной величины, пока такие вариации являются пригодными для выполнения в описанном изобретении. Должно быть понятно,что величина, к которой относится определение "приблизительно", сама также раскрывается конкретно и предпочтительно. Перечисления числовых диапазонов посредством конечных точек включает в себя все числа и части, находящиеся в пределах такого диапазона, а также указанные конечные точки. Все документы, цитируемые в данном описании, включены в настоящее описание посредством отсылки в их полном виде. В частности, описания всех документов, на которые даются ссылки здесь,включены посредством отсылки. Таким образом, в некоторых аспектах, более конкретно аспектах A1-A12, как описано в разделе Выводы, это изобретение относится к способам для испытания образца на присутствие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений, предусматривающим стадии (1) детектирования присутствия или отсутствия в образце нуклеиновых кислот,включающих одну, более чем одну или все (причем конкретный выбор зависит от цели конкретного анализа) из нуклеиновых кислот, перечисленных под пунктами a)-u), в разделе Выводы, и (2) заключения о присутствии или отсутствии в образце материала, происходящего от одного или нескольких независимых трансформантов растений, выбранных из группы, включающей один или несколько независимых трансформантов растений или состоящей из одного или нескольких независимых трансформантов растений, выбранных из группы, включающей некоторые или все из независимых трансформантов или состоящей из некоторых или всех независимых трансформантов, подробно описанных в разделе Выводы."Незавимимая трансформация растения" происходит путем независимой трансформации клеток растений гетерологичной нуклеиновой кислотой, обычно конструкцией нуклеиновой кислоты, содержащей один или более представляющих интерес трансгенов; регенерацией популяции растений, полученных в результате инсерции этой конструкции или ее части, включающей в себя указанный (указанные) представляющий интерес (представляющие интерес) трансген (трансгены), в геном этих растений; и отбором конкретного растения, характеризующегося указанной инсерцией, в одном или нескольких, предпочтительно одном конкретном местоположении генома. Таким образом, термин "независимый трансформант растения" включает в себя исходное отобранное таким образом растение-трансформант, а также его любого последующего потомка, содержащего инсертированную нуклеиновую кислоту, включающую в себя представляющий интерес трансген (представляющие интерес трансгены); например, указанный потомок может быть гемизиготным или гомозиготным в отношении указанной инсерции; указанный потомок может быть получен, например, вегетативным размножением или половым скрещиванием. Термин "растение" включает в себя в данном контексте клетки растений; протопласты растений; культуру клеток или ткани растений, из которых может быть регенерирован растительный организм; каллусы или скопления растения; растительные организмы и их части, например, без ограничения, цветки, листочки околоцветника, лепестки, чашелистики, пыльники, пыльцу, семена, плоды, околоплодник(перикарпий), коробочки, листья, черешки, стебли, корни, корневища (ризомы), столоны, клубни, побеги и т.п. Этот термин обычно включает в себя в этом контексте растения любых таксонов, классифицированных в этой области в пределах царства растений (Plantae). Кроме того, в данном контексте растение может предпочтительно принадлежать к наземным растениям (эмбриофитам), в том числе, без ограничения, бессосудистым растениям (бриофитам) и сосудистым растениям (трахеофитам); более предпочтительно к сосудистым растениям (трахеофитам), включающим в себя, без ограничения, lycopodiophyta(плауны), equisetophyta, pteridophyta (папоротникообразные), psilotophyta, ophioglossophyta, и семенные растения (spermatophyta); даже более предпочтительно к семенным растениям (spermatophyta), включающим в себя, без ограничения, семеноносные растения (голосемянные растения), такие как, например,pinophyta, cycadophyta, ginkgophyta и gnetophyta и цветущие растения (покрытосемянные растения), такие как magnoliophyta, в том числе однодольные (liliopsida) и двудольные (Magnoliopsida). Предпочтительными растениями могут быть растения, обычно применяемые в земледелии и садоводстве. В качестве примера, но не ограничения, предпочтительные сельскохозяйственные культуры могут включать в себя кукурузу, пшеницу, рис, ячмень, сорго, табак, томат, картофель, масличный рапс, сою, сахарную свеклу, горох, подсолнечник, хлопчатник, арахис, цветочные растения (например, гвоздику) и т.д. Термин "материал" относится обычно к физическому веществу. Термин "материал, происходящий от независимого трансформанта растения", включает в себя независимый трансформант растения как таковой, в том числе, в качестве примера, но не ограничения, организм независимого трансформанта растения; любые части организма независимого трансформанта растения, такие как, например, цветки,листочки околоцветника, лепестки, чашелистики, пыльники, пыльцу, семена, плоды, околоплодник (перикарпий), коробочки, листья, черешки, стебли, корни, корневища (ризомы), столоны, клубни или побеги, или их части; клетки, протопласты, ткани, каллусы или скопления независимых трансформантов растения; или материал, полученный подверганием любых из вышеописанных частей одной или нескольким дальнейшим стадиям обработки. Эти дальнейшие стадии обработки могут включать в себя любые дейст- 13024233 вия, используемые для обработки конкретных растительных материалов в сельском хозяйстве, садоводстве или в любых последующих отраслях промышленности, например, в пищевой промышленности,включающей в себя производство напитков, комбикормовую промышленность, в текстильной промышленности (например, хлопчатника, льна, бамбука и т.д.), топливной промышленности (например, масличного рапса), производстве смазочных веществ (например, касторового масла), производстве красок(например, льняного масла, тунгового масла), косметической и фармацевтической промышленности, и т.д. В качестве примера, но не ограничения, такая дальнейшая обработка может включать в себя сбор; удаление нежелательных наружных слоев, например очистку от кожуры или кожицы, обдирание и т.д.; сушку, например атмосферную сушку, воздушно-солнечную сушку, распылительную сушку, лиофилизацию, концентрирование сока и т.д.; измельчение, например дробление, размалывание, рубку, нарезание и т.д.; разжижение, например сбор сока; консервирование, например вакуумный розлив в бутылки, консервирование в жестяных банках, баночное консервирование в герметичной таре, пастеризацию, добавление консервантов и т.д.; прессование, например сбор масла; гидрогенизацию, например сатурацию растительного масла; мацерацию; эмульгирование; тепловую обработку, например, варку, варку под давлением, обработку паром, обработку в печи, копчение, обжаривание, обработку на гриле и т.д.; ферментацию, например, с использованием дрожжей, бактерий и/или грибов; замораживание, и т.п. Термин "образец" относится в данном контексте в широком смысле к репрезентативной части или фракции большего материала, представленного в целом для инспекции, например, для контроля качества. Предпочтительно в образце, подлежащем испытанию при помощи способов этого изобретения, может предполагаться потенциальное содержание материала, происходящего от одного или нескольких представляющих интерес независимых трансформантов растений. В качестве примера, такое подозрение может существовать в отношении любого образца, являющегося репрезентативным образцом материала, о котором известно, что он содержит, или предполагается, что он, возможно или вероятно, содержит, растения или их части или материал, происходящий из них, причем указанные растения или их части принадлежат к тому же самому таксону, что и представляющий интерес независимый трансформант, присутствие которого в этом образце подлежит испытанию. Например, образец может быть репрезентативным образцом растений или их частей, например, собранных или убранных растений или их частей (таких как, без ограничения, плодов, семян, коробочек, цветков и т.д.) или репрезентативным образцом промежуточного или конечного материала, полученного с применением к нему одной или нескольких дальнейших стадий обработки, или продуктов, содержащих такой материал, например, обработанных пищевых или кормовых продуктов. Таким образом, в одном варианте осуществления этот образец содержит растения или их части,включающие в себя цветки, листочки околоцветника, лепестки, чашелистики, пыльники, пыльцу, семена,плоды, околоплодник (перикарпий), коробочки, листья, черешки, стебли, корни, корневища (ризомы),столоны, клубни или побеги, или их части; клетки растений, протопласты растений и/или ткани растений, и/или полученный из растений материал, предпочтительно пищевой или кормовой материал, в том числе обработанный пищевой или кормовой материал. Способы этого изобретения детектируют присутствие или отсутствие в образце нуклеиновых кислот, т.е. генетического материала и предпочтительно геномной ДНК, происходящих или произведенных из представляющих интерес независимых трансформантов растений. Присутствие или отсутствие таких нуклеиновых кислот является показателем, соответственно, присутствия или отсутствия в этом образце этого и потенциально дополнительного материала, происходящего от соответствующих независимых трансформантов растений; такого как, например, материалы, соочищающиеся или совместно выделяющиеся с указанными нуклеиновыми кислотами во время различных стадий обработки, примененной к этим независимым трансформантам растений. Известно, что нуклеиновые кислоты и, в частности, геномная ДНК, являются сравнительно стойкими и могут выдерживать различные стадии обработки, применяемые к растительным материалам в сельском хозяйстве и промышленности, например в пищевой и кормовой промышленности, так что молекулы ДНК с длиной, которая позволяет последовательность-специфическое определение их, могут быть обнаружены после таких стадий и даже в конечных продуктах. Таким образом, предпочтительный образец этого изобретения содержит нуклеиновые кислоты, более предпочтительно геномную ДНК, даже более предпочтительно геномную ДНК, имеющую, по меньшей мере, размеры, которые позволяют их последовательность-специфическое детектирование, такие как, в среднем, по меньшей мере приблизительно 20 п.н., например, по меньшей мере приблизительно 30 п.н., предпочтительно по меньшей мере приблизительно 50 п.н., по меньшей мере приблизительно 75 п.н., более предпочтительно по меньшей мере приблизительно 100 п.н., например, приблизительно 150 п.н., или даже более предпочтительно приблизительно 200 п.н., или по меньшей мере приблизительно 300 п.н., или по меньшей мере приблизительно 500 п.н., или по меньшей мере приблизительно 1 т.п.н.,или более. Хотя можно предположить, что большинство стадий обработки, которым незавиcимый трансформант растения может быть подвергнут на практике, могло бы сохранять детектируемые нуклеиновые кислоты в конечном продукте, и, следовательно, в его подлежащем испытанию образце, авторы этого изобретения предполагают выполнение положительного контроля, нацеленного на проверку, содержит ли указанный образец детектируемые происходящие из растения нуклеиновые кислоты. В частности, способ данного изобретения может дополнительно предусматривать детектирование присутствия или отсутствия в этом образце характерной для растений нуклеиновой кислоты. В предпочтительном варианте осуществления такая характерная для растений нуклеиновая кислота происходит из гена, присутствующего в различных таксонах растений и предпочтительно высоко консервативного (например, с 80%, предпочтительно 90%, более предпочтительно 95%, даже более предпочтительно 96%,97%,98% или 99% идентичностью последовательности) между различными таксонами растений; предпочтительно, по меньшей мере, в пределах семенных растений; или, по меньшей мере, в пределах покрытосемянных растений, например, между однодольными и двудольными растениями и/или в пределах однодольных и двудольных растений; или предпочтительно, по меньшей мере, между таксонами растений, обычно используемыми в сельском хозяйстве и промышленности, например, без ограничения, между кукурузой, пшеницей, рисом, ячменем, сорго, табаком, томатом, масличным рапсом, соей,сахарной свеклой, горохом, подсолнечником, хлопчатником, арахисом и цветковыми растениями (например, гвоздикой); или предпочтительно по меньшей мере между таксонами растений, содержащими независимые трансформанты получения трансгенных растений или состоящими из независимых трансформантов растений, испытуемых в этом образце. В предпочтительных вариантах осуществления указанная характерная для растений нуклеиновая кислота получена из хлоропластного гена малой субъединицы Rubisco (рибулозобисфосфаткарбоксилазы) или из гена CHL-tRNA-синтетазы. Как упоминалось, способы этого изобретения включают в себя в стадии (1) детектирование присутствия или отсутствия в образце нуклеиновых кислот, включающих одну, более чем одну или все из нуклеиновых кислот или состоящих из одной, более чем одной или всех нуклеиновых кислот, перечисленных под пунктами a)-u) в разделе Выводы. Термин "детектирование" или "детекция" включает в себя в данном контексте любой способ определения присутствия или отсутствия указанной нуклеиновой кислоты в этом образце. Предпочтительно присутствие конкретной молекулы нуклеиновой кислоты в образце может быть детектировано с использованием одного или нескольких реагентов, специфически гибридизующихся с соответствующей нуклеотидной последовательностью (соответствующими нуклеотидными последовательностями), содержащимися в указанной молекуле нуклеиновой кислоты. Термины "гибридизация" и "гибридизоваться" относятся к процессу, посредством которого одна цепь нуклеиновой кислоты отжигается (гибридизуется) с комплементарной или по существу комплементарной последовательностью (последовательностями), содержащимися в одной и той же или другой полинуклеотидной цепи спариванием оснований, предпочтительно спариванием оснований Уотсона-Крика. Термины "комплементарное" и "комплементарность" относятся к нормальному связыванию полинуклеотидов при пермиссивных солевых (ионной силе) и температурных условиях спариванием оснований, предпочтительно спариванием оснований Уотсона-Крика. В качестве примера, комплементарное спаривание оснований Уотсона-Крика происходит между основаниями A и T, A или G и C. Например,последовательность A-G-T (т.е., 5'-A-G-T-3') является, следовательно, комплементарной последовательности A-C-T (т.е., 5'-A-C-T-3')."Степень комплементарности" цепи (T) нуклеиновой кислоты цепи (B) нуклеиновой кислоты может быть выражена в виде доли (процента) нуклеотидов цепи (A), которая, как ожидается, будет соответствовать, т.е. образовывать спаривание Уотсона-Крика, с нуклеотидами цепи (B) нуклеиновой кислоты,при отжиге указанных цепей (A) и (B) нуклеиновых кислот, предпочтительно в условиях высокой строгости. Таким образом, "комплементарные" обозначает в данном контексте полную комплементарность,так что все соответствующие нуклеотиды этих цепей нуклеиновых кислот могут связываться при отжиге этих цепей. В качестве примера, относительно более короткая цепь может обнаруживать полную комплементарность относительно более длинной цепи нуклеиновой кислоты, если эта последняя цепь содержала последовательность, полностью комплементарную последовательности первой цепи. Термин"по существу комплементарная" относится к комплементарной в значительной степени, но не полностью комплементарной, в частности, по меньшей мере комплементарной на 85%, например, комплементарной по меньшей мере на 90%, предпочтительно комплементарной по меньшей мере на 96, 97, 98 или по меньшей мере на 99% нуклеиновой кислоте. Термины "специфически гибридизоваться" и "специфическая гибридизация" отражают ситуацию,когда реагент гибридизуется с конкретной последовательностью более легко, чем он гибридизовался бы со случайной, неродственной последовательностью. Например, реагент специфически гибридизующийся с конкретной нуклеотидной последовательностью (A), предпочтительно обнаруживает малую гибридизацию или отсутствие гибридизации с другими полинуклеотидами и предпочтительно с гомологами или ортологами последовательности нуклеиновой кислоты (A), в условиях, в которых он мог бы специфиче- 15024233 ски гибридизоваться с указанным полинуклеотидом (A). Предпочтительно реагентами, которые могут специфически гибридизоваться с соответствующей нуклеотидной последовательностью (соответствующими нуклеотидными последовательностями), содержащимися в молекулах нуклеиновых кислот, перечисленных под пунктами a)-u) выше, могут быть зонды или праймеры."Зонд" является выделенной нуклеиновой кислотой, к которой предпочтительно присоединена детектируемая метка или репортерная часть молекулы, например, радиоактивный изотоп (например, 32P,33P), лиганд, хемилюминесцентный агент, флуорофор (например, флуоресцеин, тетрахлорфлуоресцеин,TAMRA, ROX, Cy3, Cy3.5, Cy5, Cy5.5, Texas Red, и т.д.), витамин (например, биотин), стероид (например, дигоксин), фермент (например, HRP, AP, и т.д.), и т.д. Такой зонд является комплементарным или по существу комплементарным последовательности, содержащейся в цепи нуклеиновой кислотымишени, в случае данного изобретения, нуклеиновой кислоты, предпочтительно геномной ДНК, находящейся в списке под пунктами a)-u) выше. Зондами в соответствии с данным изобретением могут быть дезоксирибонуклеиновые кислоты, рибонуклеиновые кислоты или нуклеиновые кислоты, содержащие как дезоксирибо-, так и рибонуклеотиды; они могут содержать стандартные пуриновые и/или пиримидиновые основания (A, G, T, C, U и/или I), но также другие природные, химически или биохимически модифицированные (например, метилированные), неприродные или дериватизованные нуклеотидные основания; могут включать в себя скелет макромолекулы, содержащий сахара и фосфатные группы, которые могут обычно обнаруживаться в РНК или ДНК, а также один или несколько раз модифицированные или замещенные (например, 2'-O-алкилированные, например, 2'-O-метилированные или 2'-O-этилированные; или 2'-O,4'-C-алкинилированные, например, 2'-О,4'-C-этилированные) сахара или один или несколько раз модифицированные или замещенные фосфатные группы - например, скелетные аналоги в нуклеиновых кислотах могут включать в себя фосфородиэфирные, фосфоротиоатные, фосфородитиоатные, метилфосфонатные, фосфороамидатные, алкилфосфотриэфирные, сульфаматные, 3'-тиоацетатные, метиленовые(метиламино), 3'-N-карбаматные, морфолинокарбаматные и пептиднуклеиновые кислоты (ПНА). Зонды могут иметь длину по меньшей мере 10 нуклеотидов, например, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13 или по меньшей мере 14 нуклеотидов, предпочтительно по меньшей мере 15 нуклеотидов, например, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 нуклеотидов, более предпочтительно по меньшей мере 20 нуклеотидов, например,по меньшей мере 21 нуклеотид, по меньшей мере 22 нуклеотида, по меньшей мере 23 или по меньшей мере 24 нуклеотида, даже более предпочтительно по меньшей мере 25 нуклеотидов, например, по меньшей мере 30, по меньшей мере 35, по меньшей мере 40, по меньшей мере 45, по меньшей мере 50, по меньшей мере, по меньшей мере 100 или по меньшей мере 200 нуклеотидов."Праймеры" являются выделенными нуклеиновыми кислотами, предпочтительно дезоксирибонуклеиновыми кислотами, или в других предпочтительных примерах, рибонуклеиновыми кислотами или ПНА, комплементарными или по существу комплементарными последовательности, содержащейся в нуклеиновой кислоте-мишени (в случае данного изобретения, последовательности, содержащейся в нуклеиновой кислоте, предпочтительно геномной ДНК, включающей нуклеиновые кислоты или состоящей из нуклеиновых кислот, перечисленных под пунктами a)-u) выше), которые могут быть подвергнуты отжигу с указанной нуклеиновой кислотой-мишенью и могут действовать в качестве точки инициации синтеза продукта удлинения праймера в присутствии нуклеотидов и агента для полимеризации нуклеиновых кислот, такого как ДНК-зависимая или РНК-зависимая полимераза. Праймер должен быть достаточно длинным для праймирования синтеза продуктов удлинения в присутствии агента для полимеризации. Таким образом, типичный праймер имеет длину по меньшей мере 10 нуклеотидов, например, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13 или по меньшей мере 14 нуклеотидов, предпочтительно по меньшей мере 15 нуклеотидов, например, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18 или по меньшей мере 19 нуклеотидов, более предпочтительно по меньшей мере 20 нуклеотидов. Дополнительные предпочтительные праймеры имеют длину между приблизительно 10 и приблизительно 40 нуклеотидами, более предпочтительно между приблизительно 15 и приблизительно 30 нуклеотидами, наиболее предпочтительно между приблизительно 20 и приблизительно 25 нуклеотидами."Парами праймеров" называют комбинации праймеров, которые пригодны для амплификации ампликонов из внутренней части нуклеиновых кислот-мишеней (в случае данного изобретения, из внутренней части нуклеиновых кислот, предпочтительно геномной ДНК, включающей нуклеиновые кислоты или состоящей из нуклеиновых кислот, перечисленных под пунктами a)-u) выше), при помощи подходящих способов амплификации нуклеиновых кислот. Таким образом, способность амплификации ампликона из внутренней части конкретной нуклеиновой кислоты-мишени с использованием пары праймеров,сконструированных для специфической гибридизации внутри указанной нуклеиновой кислоты-мишени указывает на присутствие (и необязательно количество) указанной нуклеиновой кислоты-мишени в этом образце. Примерные, но не ограничивающие способы приготовления и применения зондов и праймеров описаны, например, в Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, ed. Sambrook et al., ColdApplications, Academic Press: San Diego, 1990. Пары праймеров ПЦР могут быть произведены из известной последовательности, например, с использованием компьютерных программ, предназначенных для этой цели, таких как Primer3 (Rozen and Skaletsky. 2000. Primer3 on the WWW for general users and for biologist programmers. In: Krawetz S, Misener S (eds) Bioinformatics Methods and Protocols: Methods in Molecular Biology. Humana Press, Totowa, NJ, pp 365-386) или пакета программ GCG v. 11.1.2 от Accelrys. Специфическая гибридизация этих зондов, праймеров или пар праймеров этого изобретения с их соответствующими комплементарными последовательностями внутри нуклеиновых кислот-мишеней,например нуклеиновых кислот, содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a)-u) выше), может быть предпочтительно достигнута в условиях высокой строгости."Условия высокой строгости" включают в себя условия, эквивалентные следующим примерным условиям для связывания или гибридизации при 65C в растворе, состоящем из 5SSPE (43,8 г/л NaCl, 6,9 г/л NaH2PO4.H2O и 1,85 г/л ЭДТА, с pH, доведенным до 7,4 при помощи NaOH), 0,1% ДСН, 5 х реагента Денхардта (50 х раствор Денхардта содержит на 500 мл: 5 г Фиколла (Type 400, Pharmacia), 5 г БСА(Фракции V; Sigma) и 100 мкл/мл денатурированной ДНК спермы лосося), с последующим промыванием в растворе, содержащем 5SSPE, 0,1% ДСН, при 65C при использовании зонда с длиной приблизительно 500 нуклеотидов. Другие примерные условия для гибридизации при "высокой строгости" для последовательностей нуклеиновых кислот с длиной более приблизительно 20-100 нуклеотидов, предпочтительно с длиной приблизительно 30-100 нуклеотидов, например, с длиной между 30 и 50 нуклеотидами,включают в себя условия, эквивалентные гибридизации в 6SSC при 45C, с последующими одной или несколькими промывками в 0,2SSC, 0,1% ДСН или даже 0,1SSC, 0,1% ДСН при 65C. Многочисленные эквивалентные условия могут быть использованы для варьирования условий строгости; рассматриваются такие факторы, как длина и природа (ДНК, РНК, состав оснований) зонда и природа мишени(ДНК, РНК, состав оснований, присутствующие в растворе или иммобилизованные и т.д.), и концентрация солей и других компонентов (например, присутствие или отсутствие формамида, декстран-сульфата,полиэтиленгликоля), и раствор для гибридизации может варьироваться для генерирования условий гибридизации низкой или высокой строгости, отличающейся от перечисленных выше условий, но эквивалентных им. Кроме того, в данной области известны условия, которые стимулируют гибридизацию при условиях высокой строгости (например, увеличение температуры гибридизации и/или стадий промывок,применение формамида в гибридизационном растворе, и т.д.). Руководство для выполнения реакций гибридизации может быть найдено, например, в Current Protocols in Molecular Biology, John WileySons,N.Y., 6.3.1-6.3.6, 1989, и более недавних обновленных изданиях, все из которых включены в качестве ссылки. Что касается амплификации ампликонов из внутренней части нуклеиновых кислот-мишеней с использованием пар праймеров, "строгие условия" или "условия высокой строгости" являются условиями,которые позволяют паре праймеров гибридизоваться только с ее соответствующей последовательностью нуклеиновой кислоты-мишени и получать уникальный продукт амплификации, т.е. ампликон, по существу, без получения непредусмотренных, т.е. неспецифических продуктов амплификации. Например,предпочтительно менее 20%, более предпочтительно менее 10%, даже более предпочтительно менее 5%,например, менее 4%, менее 3% или менее 2%, еще более предпочтительно менее 1%, например менее 0,1% или менее 0,01% общего количества (например, массы) продукта амплификации в одной реакции амплификации могли бы быть неспецифическими при проведении такой реакции при строгих условиях(например, при анализе с использованием количественного гель-электрофореза или посредством определения Tm или т.п.). Любые общепринятые способы могут быть использованы для детектирования гибридизации зонда с нуклеиновой кислотой-мишенью в этом образце. Например, нуклеиновые кислоты, предпочтительно ДНК, из образца могут быть иммобилизованы и денатурированы на твердом носителе и таким образом гибридизованы с соответствующими зондами (например, блоттингом по Саузерну, слот-блоттингом, дотблоттингом и т.д.). Если зонд - и, следовательно, его детектируемая метка - удерживаются на этом твердом носителе, это свидетельствует о том, что нуклеиновая кислота-мишень, в отношении которой является специфическим этот зонд, присутствует в данном образце. Подобным образом, любой существующий способ амплификации нуклеиновых кислот может быть использован для амплификации ампликонов из внутренней части представляющих интерес последовательностей-мишеней, указывая на присутствие соответствующих последовательностей-мишеней в этом образце: в том числе, но не только полимеразная цепная реакция (ПЦР) (US 4683202; US 4965188), амплификация с вытеснением цепи (SDA) (US 5455166; EP 0684315), LCR, TAS, 3SR, NASBA (US 5409818;EP 0329822), RCA и Q-бета-амплификация. В одном особенно предпочтительном варианте осуществления способы этого изобретения используют полимеразную цепную реакцию (ПЦР) для амплификации ампликонов из внутренней части нук- 17024233 леиновых кислот-мишеней, выбранных из нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a)-u) выше. Термины "полимеразная цепная реакция" и "ПЦР" в широком смысле включают в себя любой способ, называемый так в данной области, и, в частности, способы для амплификации последовательностей нуклеиновых кислот-мишеней,особенно ДНК-последовательностей-мишеней, с использованием термостабильных ДНК-полимераз и двух праймеров, в частности, олигонуклеотидных праймеров, одного, комплементарного (+)-цепи на одном конце амплифицируемой последовательности, и другого, комплементарного (-)-цепи на другом конце. Этот термин включает в себя модификации прототипных ПЦР, таких как, например, ПЦР высокой точности, ПЦР с горячим стартом, touch-down PCR, гнездовая ПЦР, мультиплексная ПЦР, количественная ПЦР, количественная ПЦР в реальном времени, ПЦР длинных фрагментов, ОТ-ПЦР, и т.д. (см., например, PCR Protocols: A Guide to Methods and Applications, eds. Innis et al., Academic Press, San Diego,1990). Продукты амплификации, полученные с использованием вышеописанных способов амплификации,и, в частности, с использованием ПЦР, могут оцениваться, например, на их присутствие или отсутствие,на их специфичность и/или количество, любым из способов, обычных в данной области. Например, размер (как показатель специфичности амплификации) и/или количество продукта амплификации могут оцениваться с использованием гель-электрофореза, такого как, например, электрофорез в агарозном или полиакриламидном геле, где продукты амплификации визуализируют при помощи подходящих ДНКсвязывающих красителей, таких как, например, бромид этидия. Альтернативно, продукты амплификации могут оцениваться способами, которые используют зонды, гибридизующиеся со специфическими последовательностями внутри продуктов амплификации. Например, продукт амплификации может быть иммобилизован и денатурирован на твердом носителе и затем гибридизован с меченым зондом. В другом случае, продукт амплификации может быть сам меченым, например, включением детектируемой метки (например, флуорофора) в один или оба праймера и/или посредством субстратных нуклеотидов, включенных в продукт амплификации во время амплификации, и полученный таким образом продукт ПЦР может быть затем денатурирован и гибридизован со специфическими (олигонуклеотидными) зондами, прикрепленными к твердому носителю. Таким образом, присутствие и количество детектируемой метки в выбранных положениях на твердом носителе показывает специфичность и количество,соответственно, продукта амплификации. Например, такая схема пригодна для использования с массивами зондов, например микрочипами. В дополнительных примерных способах продукты амплификации могут оцениваться с использованием клонирования и секвенирования; прямого секвенирования; опосредованного олигонуклеотидом пиросеквенирования (Ahmadian et al. 2000. Anal Biochem 280: 103-110); хроматографии, например,DHPLC, анализов лигирования олигонуклеотидов (Landegren et al. 1988. Science 241: 1077; Eggerding etal. 1995. Hum Mutat 5: 153-165; Nickerson et al. 1990. PNAS 87: 8923-8927); RNAse Protection Assay; и т.д. Особенно предпочтительным способом оценки продукта амплификации является амплификация в реальном времени, особенно ПЦР в реальном времени. Термин "амплификация в реальном времени" обозначает любой способ амплификации, предпочтительно ПЦР ("ПЦР в реальном времени"), который позволяет проводить мониторинг развития протекающей реакции амплификации (см., например, RealTime PCR: An Essential Guide, eds. Edwards et al., Horizon Scientific Press, 2004; Marras SAE et al. 2006.Acta 363: 48-60; в отношении обсуждения см. различные платформы ПЦР в реальном времени). В качестве примера, но не ограничения, амплификация в реальном времени, в частности, ПЦР в реальном времени, включает в себя в данном контексте полностью стандартные системы, такие как, например, система TaqMan, разработанная Applied Biosystems, которая основана на высвобождении и детектировании флуоресцентного зонда во время каждого раунда амплификации ДНК (Holland et al. 1991. Detection of specific polymerase chain reaction product by utilizing the 5'-3' exonuclease activity ofThermus aquaticus DNA polymerase. PNAS 88: 7276-80). Этот способ использует 5'-экзонуклеазную активность полимеразы Taq во время удлинения праймера для расщепления дважды меченого, флуорогенного зонда, гибридизованного с ДНК-мишенью, между праймерами ПЦР. Перед расщеплением, репортерный флуорофор, такой как 6-карбоксифлуоресцеин (6-FAM), на 5-конце этого зонда тушат 6 карбокситетраметилроданином с использованием резонансного переноса энергии флуоресценции(FRET). После расщепления высвобождается FAM. Полученная флуоресценция, измеренная в реальном времени при приблизительно 518 нм, во время лог-фазы накопления продукта, пропорциональна количеству копий последовательности-мишени. Дополнительные системы детектирования амплификации в реальном времени, в частности, ПЦР в реальном времени, могут также использовать FRET, например, системы на основе молекулярных маяков. Молекулярные маяки являются одноцепочечными полинуклеотидными зондами, которые имеют структуру "шпильки" со стеблем и петлей. Петля является последовательностью зонда, комплементарной последовательности внутри подлежащего оценке ампликона, а стебель образован короткими комплементарными последовательностями, расположенными на противоположных концах этого молекулярного маяка. Молекулярный маяк метят флуорофором (например, 6-FAM) на одном конце и гасителем (например, TAMRA) на другом конце. Будучи свободным в растворе, этот стебель сохраняет флуорофор и тушитель в тесной близости, вызывая тушение флуоресценции этого флуорофора посредством FRET. Однако, при связывании с его комплементарной мишенью этот гибрид зонд-мишень заставляет стебель разворачиваться, отделяя флуорофор от тушителя и восстанавливая флуоресценцию. Таким образом, при увеличении количества ампликона во время амплификации это увеличение может быть подвергнуто мониторингу в виде увеличения флуоресценции соответствующего маяка (см., например, Manganelli et al. 2001. Real-time PCR using molecular beacons. Methods Mol Med 54: 295-310; Marras SAE. 2006. Selection ofMarras SAE et al. 2006. Real-time assays with molecular beacons and other fluorescent nucleic acid hybridization probes. Clin Chim Acta 363: 48-60 в отношении дополнительного обсуждения детектирования молекулярных маяков). Особенно предпочтительной системой ПЦР-амплификации в реальном времени и детектирования для применения в данном изобретении является система Light Upon Extension (LUX), продаваемая Invitrogen (Carlsbad, CA) и описанная подробно в Nazarenko et al. 2002 (Nucleic Acids Research 30: e37) и Nazarenko et al. 2002 (Nucleic Acids Research 30: 2089-2095). Эта система использует пары праймеров, в которых обычно один из этих праймеров указанной пары праймеров помечен флуорофором (таким как, например, FAM или JOE или Alexa Fluor 546). Эта конкретная структура этого "свободного" праймера гасит сигнал связанного с ним флуорофора, в то время как интенсивность сигнала флуорофора увеличивается, когда этот праймер принимает удлиненную конформацию после включения в амплифицированный продукт. Последовательность этих праймеров данного изобретения, таких как особенно предпочтительные праймеры, перечисленные в табл. 1 и 4, может быть специально приспособлена для выполнения способа LUX в соответствии с инструкциями приведенных выше публикаций Nazarenko et al. 2002 или с использованием инструментов программ, обеспеченных Invitrogen на www.invitrogen.com/lux. Этот способ LUX особенно пригоден для достижения мультиплексности (множественности) (т.е., выполнения в единой реакции) двух или более амплификации с использованием различных наборов праймеров, так как каждый из этих наборов праймеров может быть маркирован с использованием отличающегося флуорофора. В отношении описания дополнительных путей для детектирования и оценки продуктов амплификации (например, с использованием смежных зондов; 5'-нуклеазных зондов, таких как зонды Taqman;Light-up; праймеров Duplex scorpion; праймеров Amplifluor; и других альтернативных флуоресцентных форматов гибридизационных зондов, см., например, Marras SAE et al. 2006. Real-time assays with molecular beacons and other fluorescent nucleic acid hybridization probes. Clin Chim Acta 363: 48-60, в частности,раздел 6 и ссылки в нем). В предпочтительных вариантах осуществления амплификация в реальном времени, предпочтительно ПЦР в реальном времени, данного изобретения использует (в основном) не специфические в отношении последовательности реагенты для детектирования и оценки накапливания продуктов амплификации. Эти системы обычно используют флуорохромы (флуоресцентные красители), которые связываются с ДНК (т.е. являются ДНК-связывающими), предпочтительно с двухцепочечной ДНК, по существу, не специфическим в отношении последовательности образом, и после такого связывания достигается или усиливается их флуоресценция. Таким образом, наблюдаемое увеличение флуоресценции указывает на появление и количество накопленного (двухцепочечного) продукта амплификации. Если указанные флуорохромы связываются преимущественно или исключительно с двухцепочечной ДНК и/или если их флуоресценция усиливается преимущественно или исключительно при связывании с двухцепочечной ДНК, то специфичность этого продукта амплификации может быть определена получением его "кривой плавления", т.е. графика зависимости флуоресценции от температуры, и определением Tm этого продукта, т.е. температуры, при которой 50% этого продукта расплавлены и, следовательно, потеряли его усиленную флуоресценцию. Наблюдение единственной ожидаемой Tm для продукта амплификации (или множественных ожидаемых Tm во множественной амплификации) подтверждает специфичность амплификации. Примерные флуорохромы для применения в вышеописанных способах не специфического в отношении последовательности детектирования включают в себя, без ограничения, связывающиеся с большой бороздкой агенты, связывающиеся с малой бороздкой агенты, интеркалирующиеся красители или т.п.; такие как, например, SYBR Green I (2-[N-(3-диметиламинопропил)-N-пропиламино]-4-[2,3-дигидро 3-метил-(бензо-1,3-тиазол-2-ил)-метилиден]-1-фенилхинолиний; Zipper et al. 2004. Nucleic Acid Res 32:PicoGreen. В дополнительном предпочтительном варианте осуществления реакции амплификации в реальном времени в данных способах могут быть множественными, т.е. два или более разных ампликонов могут быть амплифицированы с использованием двух или более соответствующих пар праймеров на одном и том же образце (образцах) в одной и той же реакции. Праймеры, предполагаемые авторами данного изо- 19024233 бретения, в частности праймеры, перечисленные в любой из табл. 1 или табл. 4, или их варианты или производные, могут быть особенно пригодными для мультиплексирования применений, inter alia потому,что они работают адекватно, по существу, при одних и тех же или сходных условиях реакции (например,условиях состава реакционной смеси и температурных циклов), а также потому, что они продуцируют продукты сходного размера. Хорошо понятно, что мультиплексность обычно требует, чтобы различные продукты амплификации, возникающие в этой реакции, могли быть различены. В данном контексте при использовании не специфических в отношении последовательности способов (например, с использованием SYBR Green или другого ДНК-связывающего красителя) для детектирования продуктов амплификации, мультиплексность, в частности, может ожидаться, когда продукты амплификации имеют достаточно разные Tm,для различения построением кривой плавления (например, когда Tm различаются на приблизительно 5C или более). Однако при использовании ампликон-специфических способов детектирования (например,различно меченых праймеров или различно меченых зондов для различных ампликонов), в принципе возможным является далеко идущая мультиплексность этих тестов. Таким образом, мишенью для вышеописанного детектирования с применением зондов и/или матрицы для амплификации с использованием пар праймеров, должна быть нуклеиновая кислота, происходящая из соответствующих независимых трансформантов растений, содержащаяся в этом образце. Предпочтительно эта мишень и/или нуклеиновая кислота-матрица должны быть геномной ДНК, происходящей из указанных трансгенных независимых трансформантов, которая, как ожидается, вследствие ее более высокой стабильности является лучше сохраняемой в этом образце, чем другие типы нуклеиновых кислот, такие как, например, гетерогенная ядерная РНК (гяРНК) или мРНК. Тем не менее, это изобретение рассматривает также детектирование мРНК или кДНК (например, при помощи соответствующих ОТ-ПЦР-анализов), или происходящей из плазмид ДНК, в подходящих случаях. Таким образом, данный способ предпочтительно использует амплификацию с применением пар праймеров, сконструированных для специфической гибридизации внутри и амплификации соответствующих ампликонов из внутренней части нуклеиновых кислот, присутствие или отсутствие которых в этом образце должно быть детектировано, таких как предпочтительно нуклеиновые кислоты, включающие нуклеиновые кислоты или состоящие из нуклеиновых кислот, перечисленных под пунктами a)-u) выше, в качестве средства детектирования присутствия или отсутствия указанных нуклеиновых кислот в этом образце. В этом отношении авторы данного изобретения выяснили, что, если материал независимого трансформанта растения был подвергнут одной или нескольким дальнейшим стадиям обработки, например,как описано выше, нуклеиновые кислоты, такие как их геномная ДНК, могут быть фрагментированы. Таким образом, для увеличения шансов репрезентативной амплификации соответствующих ампликонов из фрагментированной таким образом ДНК это изобретение описывает также выгодное уменьшение размера этих ампликонов. Таким образом, в предпочтительных вариантах осуществления эти ампликоны меньше приблизительно 300 п.н., меньше приблизительно 280 п.н., меньше приблизительно 260 п.н., меньше приблизительно 240 п.н. или меньше приблизительно 220 п.н., более предпочтительно меньше приблизительно 200 п.н., например, меньше приблизительно 190 п.н., меньше приблизительно 180 п.н., меньше приблизительно 170 п.н. или меньше приблизительно 160 п.н., даже более предпочтительно менее приблизительно 150 п.н., меньше приблизительно 140 п.н., меньше приблизительно 130 п.н., меньше приблизительно 120 п.н. или меньше приблизительно 110 п.н., еще более предпочтительно меньше приблизительно 100 п.н. и еще более предпочтительно меньше приблизительно 90 п.н., например, приблизительно 85 п.н., приблизительно 80 п.н., приблизительно 75 п.н., приблизительно 70 п.н., приблизительно 65 п.н.,приблизительно 60 п.н., приблизительно 55 п.н. или приблизительно 50 п.н В следующих предпочтительных вариантах осуществления эти ампликоны находятся в диапазонах приблизительно 50 п.н. - приблизительно 150 п.н., приблизительно 50 п.н. - приблизительно 100 п.н.,предпочтительно в диапазонах приблизительно 50 п.н. - приблизительно 90 п.н., более предпочтительно в диапазонах приблизительно 60 п.н. - приблизительно 80 п.н. и еще более предпочтительно в диапазоне приблизительно 65 п.н. - приблизительно 75 п.н. Как объяснялось, приведенные выше способы детектируют конкретные нуклеиновые кислоты,предпочтительно геномную ДНК, в образце. Может быть понятно, что некоторые надежные протоколы детектирования, например некоторые протоколы ПЦР, могут выполняться на образцах без предварительной очистки или обогащения составляющих их нуклеиновых кислот. С другой стороны, детектирования по этому изобретению могут выполняться более надежно, если нуклеиновые кислоты, такие как предпочтительно геномная кислота, сначала обогащают или выделяют из этого образца. Способы выделения нуклеиновых кислот, например, геномной ДНК, из образцов, в частности, из образцов, содержащих растительный материал, являются давно установленными в данной области и включают в себя способы, основанные, например, без ограничения, на экстракции органическим растворителем (например,экстракции смесью фенол-хлороформ) и осаждении этанолом или изопропиловым спиртом; связывании с ионообменными смолами; разделении в градиенте плотности хлорида цезия; хроматографии на колон- 20024233 ке при центрифугировании, магнитном разделении и т.д. (см., например, Milligan 1992. Plant DNA isolation, pp 59-88 in Hoelzel, ed. Molecular genetic analysis of populations: a practical approach. IRL Press,Oxford, UK). Качество выделенной таким образом ДНК может оцениваться, например, гель-электрофорезом и/или измерением отношения оптической плотности A260/A280. Предпочтительно это отношение A260/A280 для нуклеиновых кислот, используемых в способах детектирования этого изобретения, может находиться между 1,6 и 2,3, более предпочтительно между 1,6 и 2,0, даже более предпочтительно между 1,7 и 1,9,еще более предпочтительно между 1,75 и 1,85 и наиболее предпочтительно равно приблизительно 1,8. Количество выделенной таким образом ДНК может оцениваться, например, измерением оптической плотности A260 (Sambrook 1989) или предпочтительно с использованием флуорохромов PicoGreen илиSYBR Green I (Ahn et al. 1996. Nucleic Acids Res 24: 2623-5; Schneeberger et al. 1995. PCR Methods Appl 4: 234-8). В предпочтительном варианте осуществления получение материала нуклеиновых кислот, в частности геномной ДНК, для применения в способах этого изобретения может также вызывать фрагментацию с получением более низких средних размеров фрагментов нуклеиновых кислот, например, с использованием ферментативного расщепления или обработки ультразвуком, известных в данной области. Предпочтительная средняя длина фрагментированных таким образом нуклеиновых кислот может находиться между 200 и 2000 п.н., более предпочтительно между 300 и 1500 п.н., даже более предпочтительно между 500 и 1000 п.н., например, приблизительно 500, приблизительно 600, приблизительно 700, приблизительно 800, приблизительно 900 или приблизительно 1000 п.н. Таким образом, вышеописанные способы детектируют присутствие или отсутствие выбранных нуклеиновых кислот в образце, предпочтительно с использованием систем и протоколов детектирования,описанных здесь ранее. В данном контексте, заключение о "присутствии" конкретной нуклеиновой кислоты в образце делают, когда величина интенсивности сигнала (количество сигнала), полученная для этой нуклеиновой кислоты при помощи подходящего способа анализа (например, флуоресцентного сигнала, хемилюминесцентного сигнала, сигнала ферментной реакции и т.д.) в образце является большей,предпочтительно статистически значимо большей, чем величина этого сигнала в отрицательном контроле. Отрицательный контроль не содержит анализируемой нуклеиновой кислоты, но может быть предпочтительно сравнимым с этим образцом в других отношениях, предпочтительно в большинстве других отношений, например в типе и количестве содержащегося в нем растительного материала, в дальнейших стадиях обработки, которым был подвергнут этот материал, и т.д. Предпочтительно способы детектирования этого изобретения могут выполняться на нуклеиновых кислотах, более предпочтительно на геномной ДНК, выделенных из этого образца (см. выше). В таком случае отрицательный контроль может состоять в основном из выделенных нуклеиновых кислот, не содержащих детектируемых нуклеиновых кислот. Предпочтительно этот способ детектирования мог бы тогда использовать одно и то же или приблизительно одно и то же количество выделенных нуклеиновых кислот как из этого образца, так и для ссылки, отрицательного контроля. Предпочтительно также чистота и/или количество нуклеиновых кислот, выделенных из этого образца и из отрицательного контроля, может быть также одинаковым или приблизительно одинаковым; предпочтительно также, чтобы мог быть использован один и тот же способ выделения для выделения нуклеиновых кислот как из образца, так и из отрицательного контроля. В вышеописанных ситуациях заключение о присутствии конкретной нуклеиновой кислоты в образце может быть предпочтительно сделано, когда величина интенсивности сигнала (количество сигнала),полученного для этой нуклеиновой кислоты в образце, является по меньшей мере в 2 раза большей, чем величина интенсивности сигнала в отрицательном контроле, например, по меньшей мере в 3 раза или по меньшей мере в 4 раза большей, более предпочтительно по меньшей мере в 5 раз большей, например, по меньшей мере в 6 раз, по меньшей мере в 7 раз большей, по меньшей мере в 8 раз или по меньшей мере в 9 раз большей, даже более предпочтительно по меньшей мере в 10 раз большей, например, по меньшей мере в 15 раз большей, еще более предпочтительно по меньшей мере в 20 раз большей, например, по меньшей мере в 30 раз большей или по меньшей мере в 40 раз большей, еще более предпочтительно по меньшей мере в 50 раз большей, например, по меньшей мере в 100 раз большей по меньшей мере в 200 раз большей, по меньшей мере в 300 раз большей, по меньшей мере в 400 раз большей, по меньшей мере в 500 раз большей, по меньшей мере в 1000 раз или даже в большее число раз большей, чем сигнал в отрицательном контроле. Таким образом, когда величина сигнала (количество сигнала), полученного для анализируемой нуклеиновой кислоты в образце, является не большей (например, одинаковой, приблизительно одинаковой или меньшей), чем величина сигнала, полученного для анализируемой нуклеиновой кислоты в отрицательном контроле, или предпочтительно не большей в указанное предпочтительное число раз, обычно можно сделать заключение об "отсутствии" указанной нуклеиновой кислоты в этом образце. В предпочтительных вариантах осуществления присутствие или отсутствие в этом образце представляющей интерес нуклеиновой кислоты оценивают амплификацией в реальном времени, предпочти- 21024233 тельно ПЦР в реальном времени. В этих системах общей мерой, используемой для выражения количества матрицы для конкретной нуклеиновой кислоты в образце, является величина Ct. Вкратце, величина Ct обозначает количество циклов, при котором флуоресценция, приписываемая накапливающемуся продукту амплификации (Rn), переходит через условную (произвольно выбранную) величину флуоресценции,установленную выше фоновой флуоресценции, но в пределах экспоненциальной фазы амплификации(т.е. в пределах части, которая казалась бы линейной на log 2-графике зависимости флуоресценции от числа циклов). Таким образом, в амплификации в реальном времени обычно можно сделать заключение о присутствии конкретной нуклеиновой кислоты в образце, когда Ct этого образца ("SAM Ct") является более низким, чем Ct отрицательного контроля ("NC Ct"); и можно сделать предпочтительно, когда SAM CtCt(NC Ct - 20), например SAM Ct(NC Ct - 25), SAM Ct(NC Ct - 30) или SAM Ct(NC Ct - 35). Таким образом, в амплификации в реальном времени, когда SAM Ct является не меньшей (например одинаковой, почти одинаковой или большей), чем NC Ct, или предпочтительно является не меньшей на предпочтительные перепады, указанные выше, обычно может быть сделано заключение об "отсутствии" указанной нуклеиновой кислоты в этом образце. Как отмечалось выше, в системах амплификации в реальном времени, которые не используют последовательно-специфические зонды (например, когда продукт амплификации детектируют с использованием не специфических в отношении последовательности красителей ДНК, таких как, например,SYBR Green I), специфичность продукта амплификации может быть подтверждена выполнением анализа кривой плавления и определением Tm. О присутствии специфического продукта амплификации можно заключить, когда наблюдаемая Tm является идентичной или, по существу, идентичной (предпочтительно в интервале 3C, более предпочтительно 2C, еще более предпочтительно 1C, даже более предпочтительно 0,5C, и еще более предпочтительно 0,2C или 0,1C) рассчитанной и/или экспериментально определенной температуре плавления ожидаемого ампликона. Кроме того, заключение о специфической амплификации может быть предпочтительно сделано, когда анализ кривой плавления обнаруживает единственную Tm. Альтернативно или дополнительно, заключение о специфической амплификации может быть предпочтительно сделано, когда продукт амплификации обнаруживает единственный, ожидаемый размер после гель-электрофореза. Однако, появление продукта (продуктов) неспецифической амплификации может быть до некоторой степени переносимым на практике, предпочтительно, если такой продукт (такие продукты) неспецифической амплификации составляют менее 50%, более предпочтительно менее 40%, даже более предпочтительно менее 30%, еще более предпочтительно менее 20%, даже еще более предпочтительно менее 10%, более предпочтительно менее 5%, даже более предпочтительно менее 2% и наиболее предпочтительно менее 1%, например, менее 0,5% или менее 0,1%, общего количества (масса/масса) продукта амплификации. Такие продукт(продукты) неспецифической амплификации могут наблюдаться, например, в виде одного или нескольких дополнительных размеров продуктов после гель-электрофореза. В дополнительном развитии этого изобретения отмечается, что ампликоны, амплифицированные с использованием одного и того же набора праймеров на нуклеиновых кислотах, происходящих из различных независимых трансформантов, могут обнаруживать различающиеся величины Tm, предположительно вследствие некоторых различий в последовательности между этими ампликонами. В качестве примера, но не ограничения ампликоны, амплифицированные с использованием набора праймеров SEQ ID NO: 11 и 12 (табл. 4) на Bt11 и Bt176, обнаруживают такое различие в их Tm. Таким образом, наблюдаемая величина Tm может служить в качестве дополнительной отличающей информации для использования в способе этого изобретения, так что получают даже более детальное указание на присутствие или отсутствие нуклеиновых кислот из таких конкретных независимых трансформантов. Альтернативно или дополнительно, в следующей вариации конкретная нуклеиновая кислота может быть амплифицирована с использованием конкретного набора праймеров для одного или более независимых трансформантов, хотя тот же самый праймер не мог бы амплифицировать соответствующую нуклеиновую кислоту в одном или нескольких других независимых трансформантах, предположительно вследствие некоторых различий последовательности в сайтах связывания праймера. Хотя такая ситуация может делать необходимым применение двух или более наборов праймеров для амплификации соответствующей нуклеиновой кислоты из различных независимых трансформантов (и может в этом отношении быть менее выгодной, чем выбор набора праймеров, который амплифицирует эту нуклеиновую кислоту из всех представляющих интерес независимых трансформантов в растении), это может давать преимущество обеспечения дополнительной информации о присутствии или отсутствии нуклеиновых кислот из конкретных независимых трансформантов в данном образце. Например, нуклеиновая кислота Cry1Ab может быть преимущественно детектирована из MON810 с использованием набора праймеров SEQ IDNO: 30 и 31 и из Bt11 и Bt176 с использованием набора праймеров SEQ ID NO: 11 и 12 (табл. 4). Квалифицированному в данной области специалисту будет понятно, что реакции амплификации,например ПЦР, могут вызывать появление неспецифического, побочного продукта - "димера праймера". Такие продукты, "димеры праймера", могут обычно быть легко отличимыми от продукта (продуктов) специфической амплификации по их отличающемуся, наиболее часто меньшему размеру и/или Tm. Таким образом, квалифицированный в данной области специалист был бы способен распознать и минимизировать влияние таких артефактов на анализ реакции амплификации. Предпочтительные праймеры этого изобретения, такие как перечисленные в табл. 1 и 4, были сконструированы для минимизации действия димера праймера. Следующим предметом обсуждения является чувствительность способов детектирования, используемых в данном изобретении, которая может быть выражена как их "предел детектирования" (LOD),обозначающий здесь самое низкое количество или самую низкую концентрацию аналита (здесь конкретной подлежащей детектированию нуклеиновой кислоты) в образце, которые могут быть достоверно детектированы, хотя и необязательно в количественном выражении. Выражение "достоверно детектированы", обозначает здесь, что образцы, содержащие количество или концентрацию LOD анализируемого вещества, будут давать положительный результат в 50% повторных детектирований, предпочтительно в 60%, более предпочтительно в 70%, даже более предпочтительно в 80%, еще более предпочтительно в 90% и наиболее предпочтительно в 95% или даже в 99% повторных детектирований. Предпочтительно LOD способов детектирования, подходящих для применения в этом изобретении,выражаемый в виде копийности LOD конкретной представляющей интерес нуклеиновой кислоты в образце, подвергаемой детектированию, может быть равен 10000 или менее, например, 9000 или менее,8000 или менее, 7000 или менее или 6000 или менее, более предпочтительно 1000 или менее, например,900 или менее, 800 или менее, 700 или менее или 600 или менее, еще более предпочтительно 500 или менее, например, 400 или менее, 300 или менее или 200 или менее, еще более предпочтительно 100 или менее, например, 90 или менее, 80 или менее, 70 или менее или 60 или менее, и наиболее предпочтительно 50 или менее, с примерными предпочтительными вариантами, включающими в себя 40 или менее, 30 или менее, 20 или менее или даже 10 или менее, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9. Предпочтительные праймеры этого изобретения, такие как праймеры, перечисленные в табл. 1 и 4, были сконструированы для достижения особенно высокой чувствительности (низкого LOD). В данном контексте, термин "кукуруза" относится к Zea mays, предпочтительно Zea mays ssp. mays,и включает в себя все сорта растения, которые были выведены с кукурузой, в том числе дикие виды кукурузы; термины "рапс", "масличный рапс" или "канола" относятся взаимозаменяемо к Brassica napus и включают в себя все сорта, которые были выведены с рапсом, в том числе дикие виды рапса; термины"соя" ("soy", "soya bean" или "soybean") относятся взаимозаменяемо к Glycine max и включают в себя все сорта растения, которые могут быть выведены с соей, в том числе дикие виды сои; термин "рис" относится к Oryza sativa, в том числе, без ограничения, ssp. indica и japonica, и включает в себя все сорта растения, которые могут быть выведены с рисом, в том числе дикие виды риса; термин "сахарная свекла" относится к Beta vulgaris и включает в себя все сорта растения, которые могут быть выведены с сахарной свеклой, в том числе дикие виды сахарной свеклы; термин "хлопчатник" относится к Gossypium species,предпочтительно Gossypium hirsutum, и включает в себя все сорта растения, которые могут быть выведены с хлопчатником, в том числе дикие виды хлопчатника; термин "картофель" относится к Solarium tuberosum и включает в себя все сорта растения, которые могут быть выведены с картофелем, в том числе дикие виды картофеля. Независимые трансформанты растений называются здесь их обозначениями, обычно используемыми в данной области и известными квалифицированному в данной области специалисту. Тем не менее, в качестве дополнительной помощи, табл. 2 ниже суммирует дополнительную информацию, достаточную для специфической идентификации указанных независимых трансформантов. Перечисленные выше уникальные идентификаторы (UI) представляют систему уникальной классификации независимых трансформантов растений, установленную вместо прежней классификации Organisation for Economic Co-operation and Development (OECD) и описанную в ее публикацияхOctober 20, 2004, и ENV/JM/MONO(2002)7/REV1 of November 7, 2006. Эти указанные уникальные идентификаторы используются, признаются и приписываются в международном масштабе, в том числе в Европе (см., например, Commission Regulation (EC) No 65/2004 of January 14, 2004, где устанавливается система для развития и приписывания уникальных идентификаторов генетически модифицированным организмам). Подробная информация в отношении вышеописанных и последующих представляющих интерес независимых трансформантов растений, такая как, например, информация о таксонах хозяев, трансформирующих конструкциях, инсертированных последовательностях, и т.д., может быть доступна через публично доступные порталы различных регламентирующих органов власти, в том числе, например,OECD(http://ec.europa.eu/food/dyna/gmregister/indexen.cfm), Agbios database (www.agbios.com), или the EC ГМО Compass database (http://www.gmo-compass.org/), а также в научной литературе, и т.д. Квалифицированный в данной области специалист хорошо знает об этом и может использовать такие источники баз данных. Кроме того, специфические в отношении независимых трансформантов способы детектирования и специфические в отношении конструкций способы детектирования (например, см. Codex Alimentarium) являются доступными и позволяют недвусмысленно различать приведенные выше и последующие независимые трансформанты. Например, European Community Reference Laboratory (CRL) (http://gmocrl.jrc.it/; http://gmo-crl.jrc.it/statusofdoss.htm) предоставляет список надежных способов для специфического в отношении независимых трансформантов детектирования, обеспечиваемых изготовителями,описанных в научной литературе или разработанных самой CRL. Как отмечалось выше, это изобретение позволяет делать вывод о присутствии или отсутствии в образце материала, происходящего из выбранных независимых трансформантов, их гибридов, или родственных им независимых трансформантов. Термин "их гибриды" в этом контексте относится к потомству, полученному одним или несколькими скрещиваниями двух или более совместимых независимых трансформантов (т.е. независимых трансформантов, способных скрещиваться, в частности, независимых трансформантов, принадлежащих к одному и тому же таксону), так что указанное полученное потомство содержит трансгенные вставки из двух или более родительских скрещиваемых независимых трансформантов. Термин "родственные им независимые трансформанты" в этом контексте относится к независимым трансформантам, которые были получены введением в одни и те же таксоны тех же самых трансформирующих конструкций, что и в соответствующих указанных независимых трансформантов, но, несмотря на это отличаются от указанных независимых трансформантов, например, могут обычно отличаться в количестве и/или сайте геномных интеграции этой трансформирующей конструкции. Часто такие независимые трансформанты могут сами быть предметом для получения разрешения. В других случаях такие родственные независимые трансформанты могут присутствовать в виде нежелательных примесей. Таким образом, посредством детектирования генетических элементов из внутренней части трансформирующих конструкций способ данного изобретения позволит выгодным образом детектировать такие независимые трансформанты. Как отмечалось выше, способы этого изобретения включают в себя детектирование присутствия или отсутствия в образцах одной или нескольких нуклеиновых кислот, включающих нуклеиновых кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a)-u), определенными выше. В этом отношении, выражение "нуклеиновая кислота, происходящая из конкретного таксона или специфическая для конкретного таксона", такая как нуклеиновые кислоты, перечисленные под пунктомa) "Zm", b) "Bn", c) "Gm", o) "Or", p) "Bv", q) "Gs" и t) "St", означает, что указанная нуклеиновая кислота в этом образце происходит из генетического материала, предпочтительно геномной ДНК, указанного конкретного таксона и не присутствует - и, следовательно, не могла бы быть детектирована с использованием выбранного способа детектирования - в генетическом материале, происходящем из других таксонов,таких как остальные таксоны, перечисленные выше. В качестве примера, но не для ограничения указанная нуклеиновая кислота, происходящая из этого конкретного таксона, может либо не иметь гомологов в других таксонах, либо ее гомологи в других таксонах могут иметь достаточно отличающиеся последовательности, так что они не могли бы быть детектированы выбранным способом детектирования. Например, в одном сайте детектирования, например в сайте детектировании, с которым мог бы гибридизоваться зонд или один или несколько праймеров амплификации, внутри этой конкретной нуклеиновой кислоты, такие гомологи могут обнаруживать меньшую чем 100% идентичность последовательности, предпочтительно меньшую чем 95%, даже более предпочтительно меньшую чем 90%, еще более предпочтительно меньшую чем 85%, еще более предпочтительно меньшую чем 80% и наиболее предпочтительно меньшую чем 75%, в предпочтительных примерных вариантах меньшую чем 70%, меньшую чем 65%,меньшую чем 60%, меньшую чем 55% или меньшую чем 50% идентичность последовательности с рассматриваемой нуклеиновой кислотой. Кроме того, термин нуклеиновая кислота, "происходящая из", используемый, в частности, в a)-u),означает, что указанные нуклеиновые кислоты происходят из их соответствующих таксонов, генетических элементов, генов, открытой рамки считывания и т.д., хотя они, как обнаружено в этом образце, могут структурно отчасти отличаться от них. Например, последующая обработка растительного материала может вызывать изменения в структуре нуклеиновой кислоты (например, ДНК), и, возможно, что наиболее важно, может вызывать ее фрагментацию. Кроме того, иногда функциональные фрагменты или варианты полноразмерных элементов могут быть использованы в трансгенных растениях. Таким образом, нуклеиновые кислоты, "происходящие из" нуклеиновых кислот, указанных под пунктами a)-u) выше, могут быть, например, их фрагментами, пока такие фрагменты позволяют их специфическое отнесение к исходным нуклеиновым кислотам. Например, такие фрагменты могут включать в себя по меньшей мере 15 непрерывных п.н. последова- 25024233 тельности, из которой они произведены, предпочтительно по меньшей мере 20 непрерывных п.н., например по меньшей мере 30 или по меньшей мере 40 непрерывных п.н., более предпочтительно по меньшей мере 50 непрерывных п.н., например, по меньшей мере 60 или по меньшей мере 70 непрерывных п.н.,даже более предпочтительно по меньшей мере 80 непрерывных п.н., например по меньшей мере 90 непрерывных п.н., еще более предпочтительно по меньшей мере 200 непрерывных п.н., например, по меньшей мере 300 непрерывных п.н., по меньшей мере 400 непрерывных п.н. или по меньшей мере 500 непрерывных п.н. или более, и могут даже включать в себя полноразмерные элементы. Другие модификации нуклеиновых кислот, ожидаемые из последующей обработки растительного материала, например, частичное дезаминирование и т.д., также обсуждаются под термином "происходящие из". В предпочтительном варианте осуществления, нуклеиновая кислота a) "Zm" происходит из эндогенного гена (adh-1) алкогольдегидрогеназы Zea mays. Примерная, но не ограничивающая последовательность гена adh-1 Zea mays найдена под номером доступа AF123535.1 в базе данных GenBank(http://www.ncbi.nlm.nih.gov/). В следующем предпочтительном варианте осуществления, нуклеиновая кислота b) "Bn" происходит из эндогенного гена (acc) ацетил-CoA-карбоксилазы или эндогенного гена круциферина Brassica napus. Примерная, но не ограничивающая последовательность гена acc Brassica napus найдена под номером доступа Х 77576.1 в базе данных GenBank; примерная последовательность гена круциферина найдена под номером доступа XI4555.1 в базе данных GenBank. В следующем предпочтительном варианте осуществления нуклеиновая кислота c) "Gm" происходит из эндогенного гена (lec) лектина Glycine max. Примерная, но не ограничивающая последовательность гена lec Glycine max найдена под номером доступа К 00821.1 в базе данных GenBank. В следующем предпочтительном варианте осуществления нуклеиновая кислота о) "Or" происходит из эндогенного гена (pld) фосфолипазы D Oryza sativa. Примерная, но не ограничивающая последовательность гена pld Oryza sativa. найдена под номером доступа AB001919. В предпочтительном варианте осуществления нуклеиновая кислота р) "Bv" происходит из эндогенного гена глутаминсинтазы (GluA3) Beta vulgaris. Примерная, но не ограничивающая последовательность гена GluA3 Beta vulgaris найдена под номером доступа AY026353.1 в базе данных GenBank. В предпочтительном варианте осуществления нуклеиновая кислота q) "Gs" происходит из эндогенного гена (sah-7) гомолога 7 sinopsis arabidopsis Gossypium. Примерная, но не ограничивающая последовательность гена sah-7 Gossypium найдена под номером доступа AY117067 (авторы: Senchina et al. 2003.Mol Biol Evol 20 (4): 633-643) в базе данных GenBank. В предпочтительном варианте осуществления нуклеиновая кислота t) "St" происходит из эндогенного гена УДФ-глюкозофосфорилазы (UGPase) Solarium tuberosum. Примерная, но не ограничивающая последовательность гена UGPase Solarium tuberosum найдена под номером доступа U20345 в базе данныхGenBank. В следующем предпочтительном варианте осуществления характерная для растений нуклеиновая кислота происходит из эндогенного хлоропластного гена RBCL (rbcl) Zea mays. Примерная, но не ограничивающая последовательность гена rbcl Zea mays найдена под номером доступа Z11973.1 в базе данных GenBank. Квалифицированный в данной области специалист способен конструировать и подтверждать специфические зонды или пары праймеров из вышеописанных последовательностей для использования в стадиях детектирования данного способа. Ссылки на элементы последовательностей и гены, упоминаемые в этом описании для нуклеиновых кислот, перечисленных под пунктами d)-n), r), s) и u), известны квалифицированному специалисту в области генетической модификации растений. Таким образом, квалифицированный специалист понимает, к каким последовательностям относятся эти обозначения, и может вполне понять уровень изменений в отношении этих последовательностей, который является общим в генерировании трансгенных растений. В одном варианте осуществления, нуклеиновая кислота, присутствующая в независимом трансформанте, может включать в себя открытую рамку считывания или ее функциональную часть (т.е. часть,успешно выполняющую желаемое действие в трансгенном растении) упоминаемых здесь генов, в частности генов, перечисленных под пунктами f)-n), r), s) и u), выше. Тем не менее, посредством дополнительного объяснения, но не ограничения, авторы данного изобретения приводят здесь список примерных последовательностей для конкретных генов и элементов,упоминаемых под пунктами d)-n), r), s) и u), и примерную происходящую из исходного растения нуклеиновую кислоту: Должно быть понятно, что нуклеиновые кислоты, фактически присутствующие в независимых трансформантах растений, могут содержать последовательности, которые могут отличаться до некоторой степени от приведенных выше примерных последовательностей. Например, такие различия могут включать в себя делеции, добавления и/или замены оснований, укорочения (например, включение функциональных фрагментов), слияния с другими элементами (например, слияние с сигналами мембранного транспорта или сортинга органелл) и т.д. Фактические последовательности приведенных выше и других элементов, обнаруживаемые в независимых трансформантах, были во многих случаях определены и доступны через GenBank и другие базы данных последовательностей. Таким образом, должны выполняться сопоставления последовательностей для идентификации районов в вышеуказанных нуклеиновых кислотах, наиболее подходящих для получения из них зондов или ампликонов. Таким образом, может быть выгодным образом произведен зонд или ампликон (и соответствующий набор праймеров) из частей каждой из вышеупомянутых нуклеиновых кислот, который обнаруживается в большинстве независимых трансформантов и/или который обнаруживает наивысшую идентичность между различными независимыми трансформантами. Такие зонды или пара праймеров будут увеличивать шанс детектирования этой конкретной нуклеиновой кислоты из различных независимых трансформантов. Квалифицированный специалист может следовать этой инструкции для выполнения необходимых сопоставлений последовательностей. Как указано в разделе Выводы, это изобретение обеспечивает также предпочтительный способ заключения в отношении потенциального присутствия или отсутствия материала от одного или нескольких представляющих интерес независимых трансформантов растений для использования в стадии (2) вышеописанных способов. В частности, результаты, полученные для образца в стадии (1) представлены в виде набора GSAM, символизирующего коллекцию нуклеиновых кислот, выбранных из нуклеиновых кислот,содержащих нуклеиновые кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктамиa)-u) выше, которые были детектированы как присутствующие в этом образце; и сравнении указанного набора GSAM с одним или несколькими наборами представляющих интерес GX, представляющих подлежащие оценке индивидуальные независимые трансформанты. Эти наборы представляющих интерес GX состоят из нуклеиновых кислот, т.е. представляют коллекцию нуклеиновых кислот, выбранных из нуклеиновых кислот, включающих нуклеиновой кислоты или состоящих из нуклеиновых кислот, перечисленных под пунктами a)-u) выше, которые обнаруживаются в соответствующих независимых трансформантах и, следовательно, могут быть детектированы в стадии (1) (в той степени, до которой указанная стадия (1) детектирует присутствие указанных нуклеиновых кислот), если этот образец содержал материал, происходящий из соответствующих независимых трансформантов, или гибрида, включающего в себя этот материал, или родственного независимого трансформанта. Следующая табл. 3 перечисляет, какие нуклеиновые кислоты из нуклеиновых кислот, перечисленных под пунктами a)-u) выше, присутствуют в конкретных представляющих интерес независимых трансформантах. Как уже объяснялось: если GX равен GSAM (Gx = GSAM), то материал, происходящий из независимого трансформанта растения X, или его гибрида, или родственного ему независимого трансформанта, потенциально присутствует в этом образце; если GX является истинным подмножеством GSAM (GXGSAM), то материал, происходящий из независимого трансформанта растения X, или его гибрида, или родственного ему независимого трансформанта, потенциально присутствует в этом образце; если GX не равен GSAM и GX не является истинным подмножеством GSAM, (GXGSAM и GXGSAM),то материал, происходящий из независимого трансформанта растения X, или его гибрида, или родственного ему независимого трансформанта, отсутствует в этом образце. В следующем предпочтительном варианте осуществления, если GX равен GSAM и если ни один набор или ни одна сумма двух или нескольких наборов, представляющих независимые трансформанты (в частности, наборов, представляющих независимые трансформанты, выбранные из группы, содержащей или состоящей из: другие, чем GX, не равны GX, то материал, произведенный из независимого трансформанта растения X или из его гибрида, или из родственного им независимого трансформанта, присутствует в этом образце. В дополнительном развитии этого способа оценки нуклеиновым кислотам, включающим нуклеиновые кислоты или состоящим из нуклеиновых кислот, перечисленных под пунктами a)-u) выше, приписываются соответствующие уникальные значения. Таким образом, набору GSAM приписано в этом случае значение "VGSAM", являющееся множеством уникальных значений, приписанных нуклеиновым кислотам, детектированным на стадии (1) в качестве присутствующих в этом образце; и набору представляющих интерес GX приписано значение "VGX", являющееся множеством уникальных значений, приписанных нуклеиновым кислотам, выбранным из нуклеиновых кислот, включающих нуклеиновые кислоты или состоящих их нуклеиновых кислот, перечисленных под пунктами a)-u) выше, которые обнаруживаются в указанной событии и, следовательно, могут быть детектированы на стадии (1). Таким образом, в предпочтительном примере, нуклеиновым кислотам приписаны соответствующие уникальные значения и каждому набору представляющих интерес GX приписано соответствующее значение "VGX", выбранное из значений из группы, содержащей значения или состоящей из значений
МПК / Метки
МПК: C12Q 1/68
Метки: нескольких, одного, трансформантов, образца, отсутствие, наличие, реагенты, растений, наборы, независимых, материалы, материала, способы, происходящего, исследования
Код ссылки
<a href="https://eas.patents.su/30-24233-sposoby-reagenty-materialy-i-nabory-dlya-issledovaniya-obrazca-na-nalichie-ili-otsutstvie-materiala-proishodyashhego-ot-odnogo-ili-neskolkih-nezavisimyh-transformantov-rastenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы, реагенты, материалы и наборы для исследования образца на наличие или отсутствие материала, происходящего от одного или нескольких независимых трансформантов растений</a>
Предыдущий патент: Новые легкоразрушающиеся ингибиторы rock
Следующий патент: Унифицированная упаковка и способ ее изготовления
Случайный патент: Способ нанесения термопластических красок на печатную форму и контейнеры для красок, используемые в этом способе












