Новая соль сукцинат о-десметилвенлафаксина
Номер патента: 11451
Опубликовано: 28.04.2009
Авторы: Шах Сайед Музафар, Провост Джеймс Эндрю, Уинкли Майкл Уилльям, Парк Аэри, Хэдфилд Энтони Фрэнсис, Расселл Брентон Уилльям, Шипплетт Рекс Элвин, Сатерлэнд Карен Уиггинс, Вебер Бит Теодор
Формула / Реферат
1. Соединение, представляющее собой сукцинат O-десметилвенлафаксина или его смешанную соль.
2. Соединение по п.1, где отношение О-десметилвенлафаксина к янтарной кислоте составляет 1:1.
3. Соединение по п.1, где отношение О-десметилвенлафаксина к янтарной кислоте составляет 2:1.
4. Соединение по любому из пп.1-3, представляющее собой гидрат сукцината О-десметилвенлафаксина.
5. Соединение по п.1, представляющее собой моногидрат сукцината О-десметилвенлафаксина.
6. Соединение по любому из пп.1-5, где соль является кристаллическим веществом.
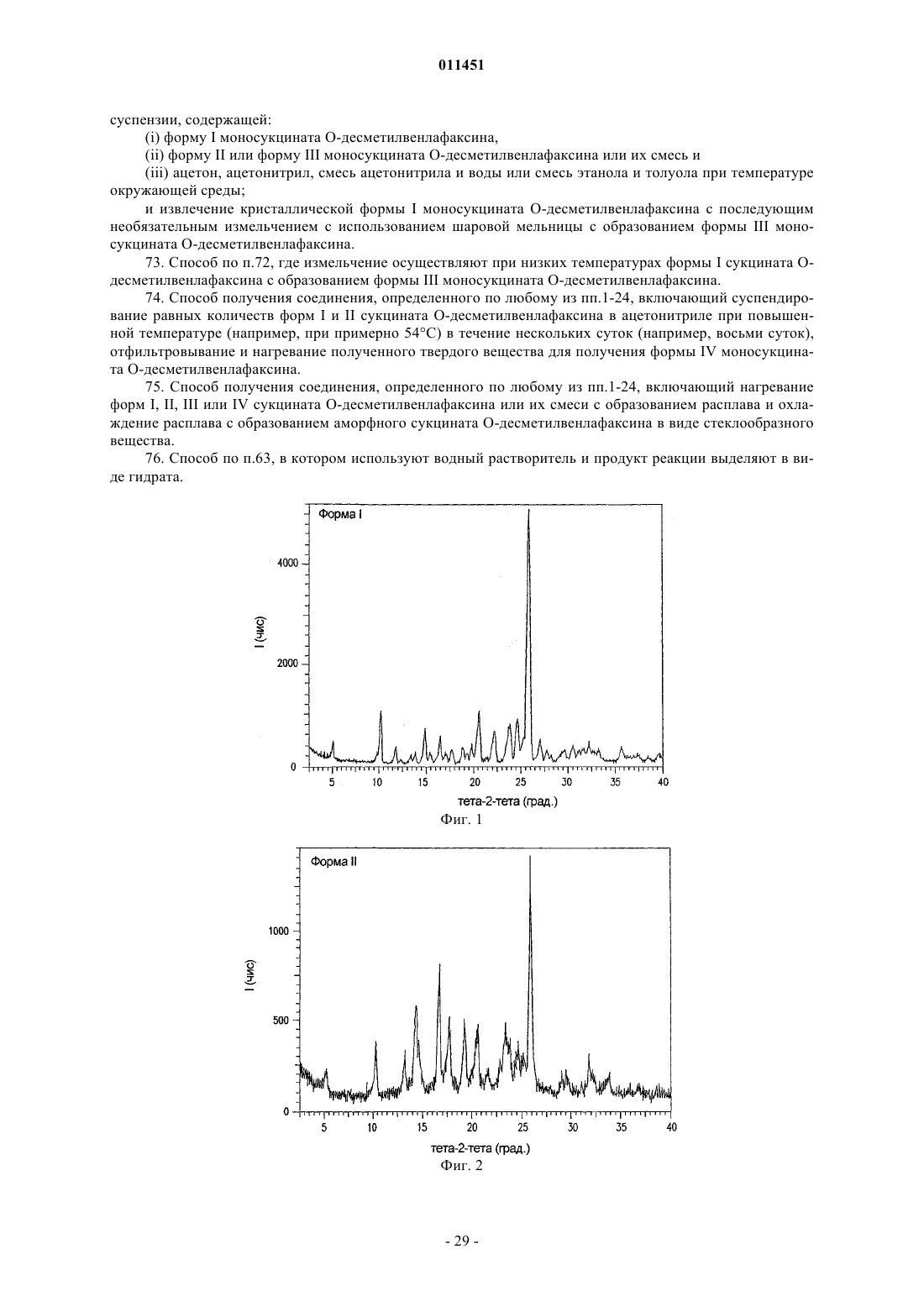
7. Соединение по п.6, демонстрирующее рентгеновскую порошковую дифрактограмму для формы I сукцината ODV с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 10,20, 14,91, 20,56, 22,13, 23,71, 24,60 и 25,79.
8. Соединение по п.6, где соединение представляет собой форму I сукцината ODV с эндотермическим пиком при примерно 131шС.
9. Соединение по п.6, где соединение представляет собой форму I сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, какая показана на фиг. 1.
10. Соединение по п.6, где соединение представляет собой форму II сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 13,18, 14,04, 14,35, 14,66, 16,68, 17,67, 19,24, 25,13 и 31,78.
11. Соединение по п.8, где соединение представляет собой форму II сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 10,25, 13,18, 14,04, 14,35, 14,66, 16,68, 17,67, 19,24, 20,38, 20,56, 23,41, 23,78, 24,57, 25,13, 25,80 и 31,78.
12. Соединение по п.6, где соединение представляет собой форму II сукцината ODV с эндотермическим пиком при примерно 127шС.
13. Соединение по п.6, где соединение представляет собой форму II сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, как показана на фиг. 2.
14. Соединение по п.6, где соединение представляет собой форму III сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 13,74, 22,55 и 32,42.
15. Соединение по п.14, где соединение представляет собой форму III сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 10,36, 13,74, 14,40, 14,68, 14,96, 16,75, 17,48, 17,76, 19,26, 20,42, 20,74, 22,55, 23,58, 23,82, 24,92, 26,00, 31,86 и 32,42.
16. Соединение по п.6, где соединение представляет собой форму III сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, какая показана на фиг. 3.
17. Соединение по п.6, где соединение представляет собой форму IV сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 11,29, 17,22, 19,64, 20,91, 21,61, 28,86, 29,80, 30,60, 36,85 и 37,70.
18. Соединение по п.17, где соединение представляет собой форму IV сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2q (+0,2ш 2q), при 10,46, 11,29, 13,69, 14,48, 15,17, 16,62, 17,22, 17,61, 19,22, 19,64, 20,91, 21,61, 22,55, 23,84, 24,77, 25,34, 25,92, 26,40, 28,86, 29,80, 30,60, 33,17, 36,85 и 37,70.
19. Соединение по п.6, где соединение представляет собой форму IV сукцината ODV с эндотермическим пиком при 145шС.
20. Соединение по п.6, где соединение представляет собой форму IV сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, как показана на фиг. 4.
21. Соединение по п.1, представляющее собой аморфное вещество.
22. Соединение по п.21 с начальной Tg при 18шС.
23. Соединение по п.1, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, какая показана на фиг. 5.
24. Соединение по п.1, имеющее растворимость в воде по меньшей мере 30 мг/мл при 25шС.
25. Фармацевтическая композиция, содержащая сукцинат O-десметилвенлафаксина или его смешанную соль, определенный по любому из пп.1-24, и фармацевтически приемлемый носитель или эксципиент.
26. Фармацевтическая композиция по п.25, кроме того содержащая венлафаксин или его фармацевтически приемлемую соль.
27. Фармацевтическая лекарственная форма, содержащая терапевтически эффективное количество сукцината O-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24, и фармацевтически приемлемый носитель или эксципиент.
28. Пероральная лекарственная форма, содержащая терапевтически эффективное количество сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24, и фармацевтически приемлемый носитель или эксципиент.
29. Пероральная лекарственная форма по п.28, представляющая собой таблетку или капсулу.
30. Пероральная лекарственная форма по п.28 или 29, представляющая собой композицию с замедленным высвобождением.
31. Пероральная лекарственная форма по п.28, кроме того содержащая полимерный материал, регулирующий скорость высвобождения.
32. Пероральная лекарственная форма по п.31, где регулирующий скорость высвобождения полимерный материал выбирают из гидроксиалкилцеллюлозы, полиэтиленоксидов, алкилцеллюлозы, карбоксиметилцеллюлозы гидрофильных производных целлюлозы и полиэтиленгликоля.
33. Пероральная лекарственная форма по п.31 или 32, содержащая примерно от 30 до примерно 50 мас.% сукцината O-десметилвенлафаксина и примерно от 40 до примерно 70 мас.% полимерного материала, регулирующего скорость высвобождения, относительно 100% общей массы пероральной лекарственной формы.
34. Пероральная лекарственная форма по п.31 или 32, содержащая примерно от 32 до примерно 44 мас.% сукцината O-десметилвенлафаксина и примерно от 45 до примерно 66 мас.% полимерного материала, регулирующего скорость высвобождения, относительно 100% общей массы пероральной лекарственной формы.
35. Пероральная лекарственная форма по любому из пп.28-34, также содержащая связующее вещество.
36. Пероральная лекарственная форма по п.35, где связующее вещество представляет собой микрокристаллическую целлюлозу.
37. Способ лечения пациента, страдающего от депрессии, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
38. Способ лечения пациента, страдающего от тревоги, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли по любому из пп.1-24.
39. Способ лечения пациента, страдающего от панического расстройства, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
40. Способ лечения пациента, страдающего от расстройства генерализованной тревоги, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината O-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
41. Способ лечения пациента, страдающего от посттравматического стрессового расстройсттр, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
42. Способ лечения пациента, страдающего от предменструального дисфорического расстройства, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
43. Способ лечения пациента, страдающего от расстройства, выбранного из числа фибромиалгии, агорофобии, дефицита внимания, обсессивно-компульсивного расстройства, социальной тревоги, аутизма, шизофрении, ожирения, нервно-психической анорексии, нервно-психической булемии, синдрома Жиль де ла Туретта, вазомоторного прилива крови, кокаиновой и алкогольной зависимости, половой дисфункции, пограничного личностного расстройства, синдрома хронической усталости, недержания мочи, боли, синдрома Шая-Дрейджера, синдрома Рейно, болезни Паркинсона и эпилепсии, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
44. Способ усиления познавательной способности или лечения ухудшения познавательной способности у пациента, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
45. Способ отказа от курения или других применений табака у пациента, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
46. Способ лечения гипоталамической аменореи у женщины в состоянии депрессии или вне такого состояния, включающий предоставление женщине, нуждающейся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24.
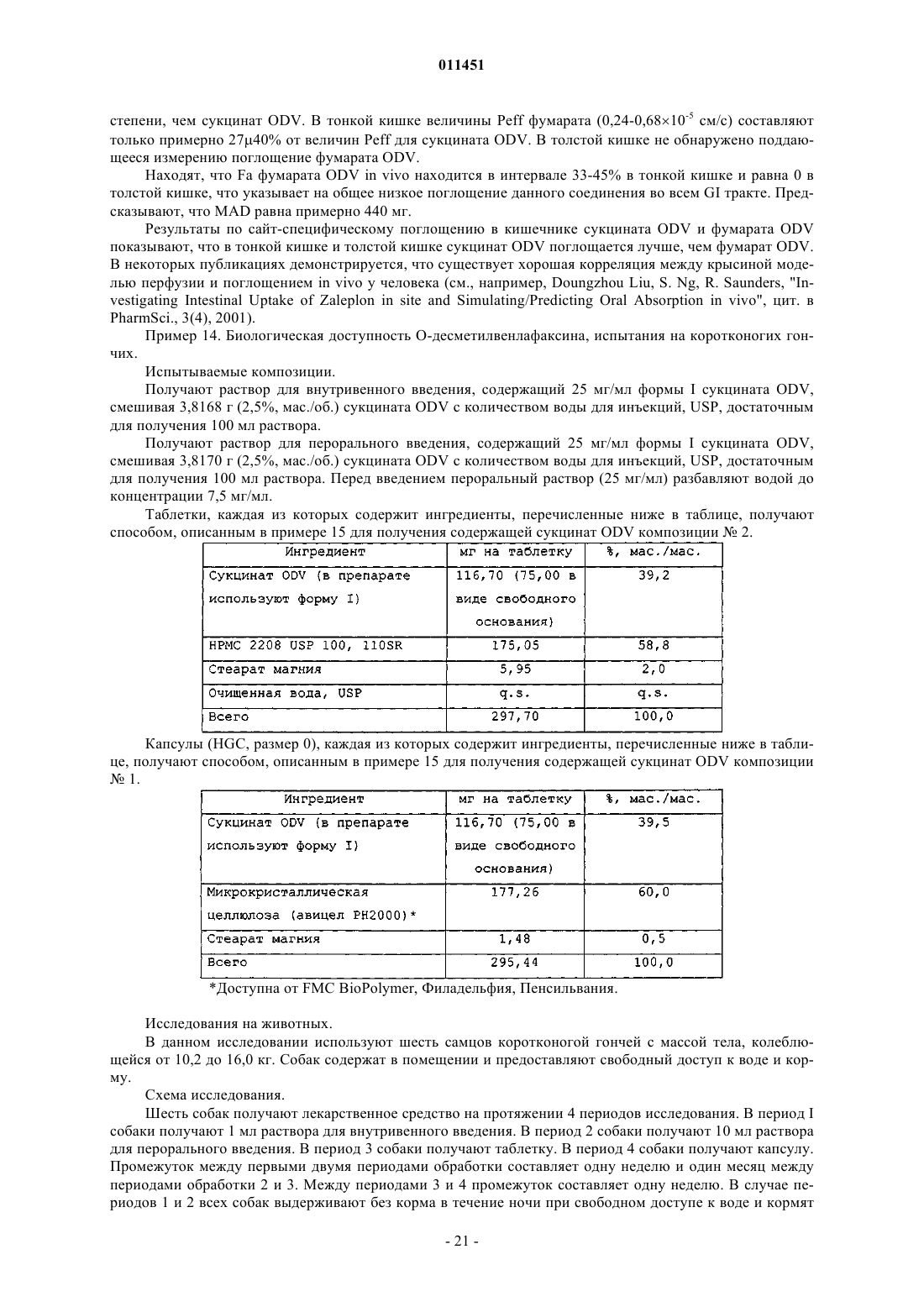
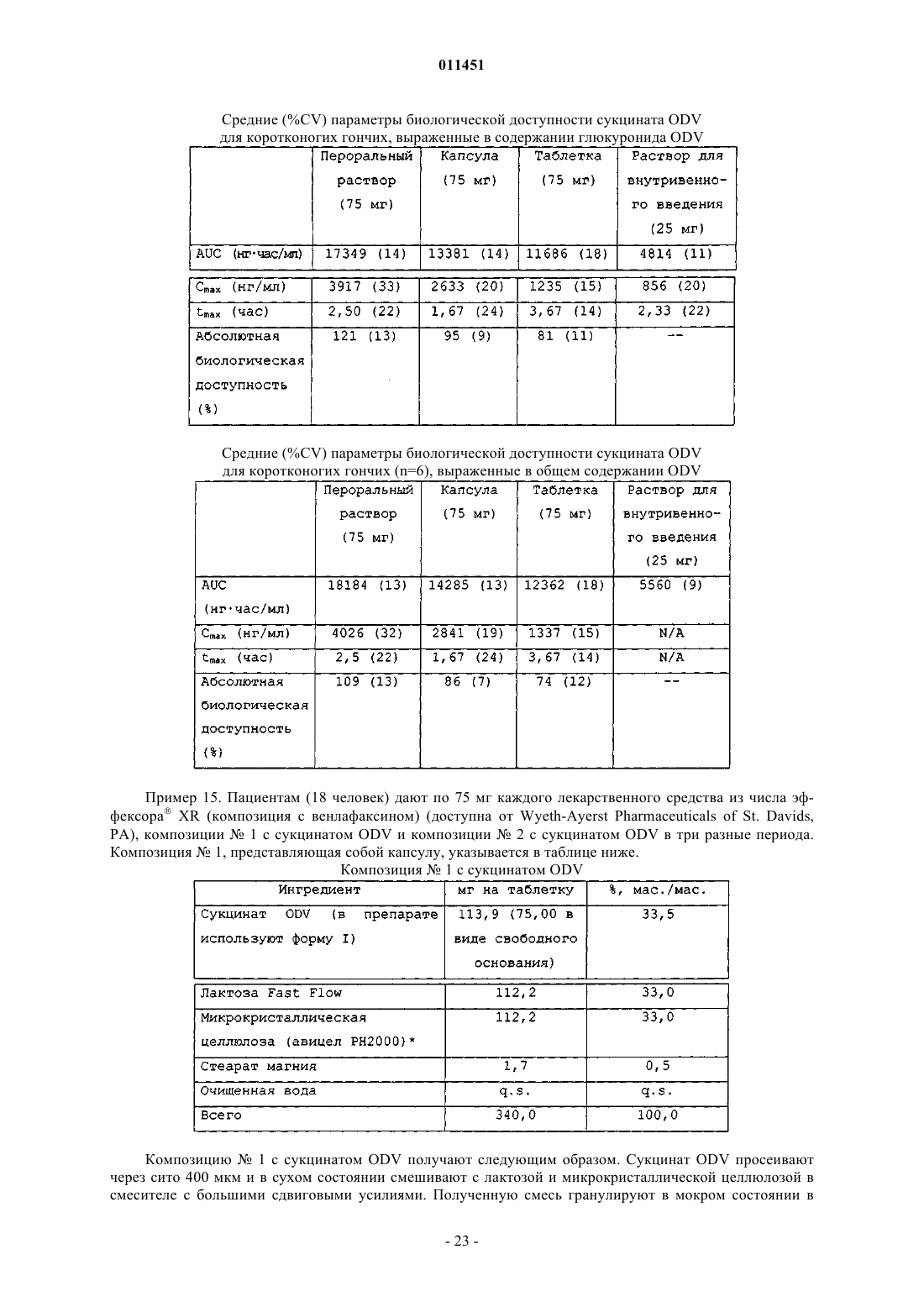
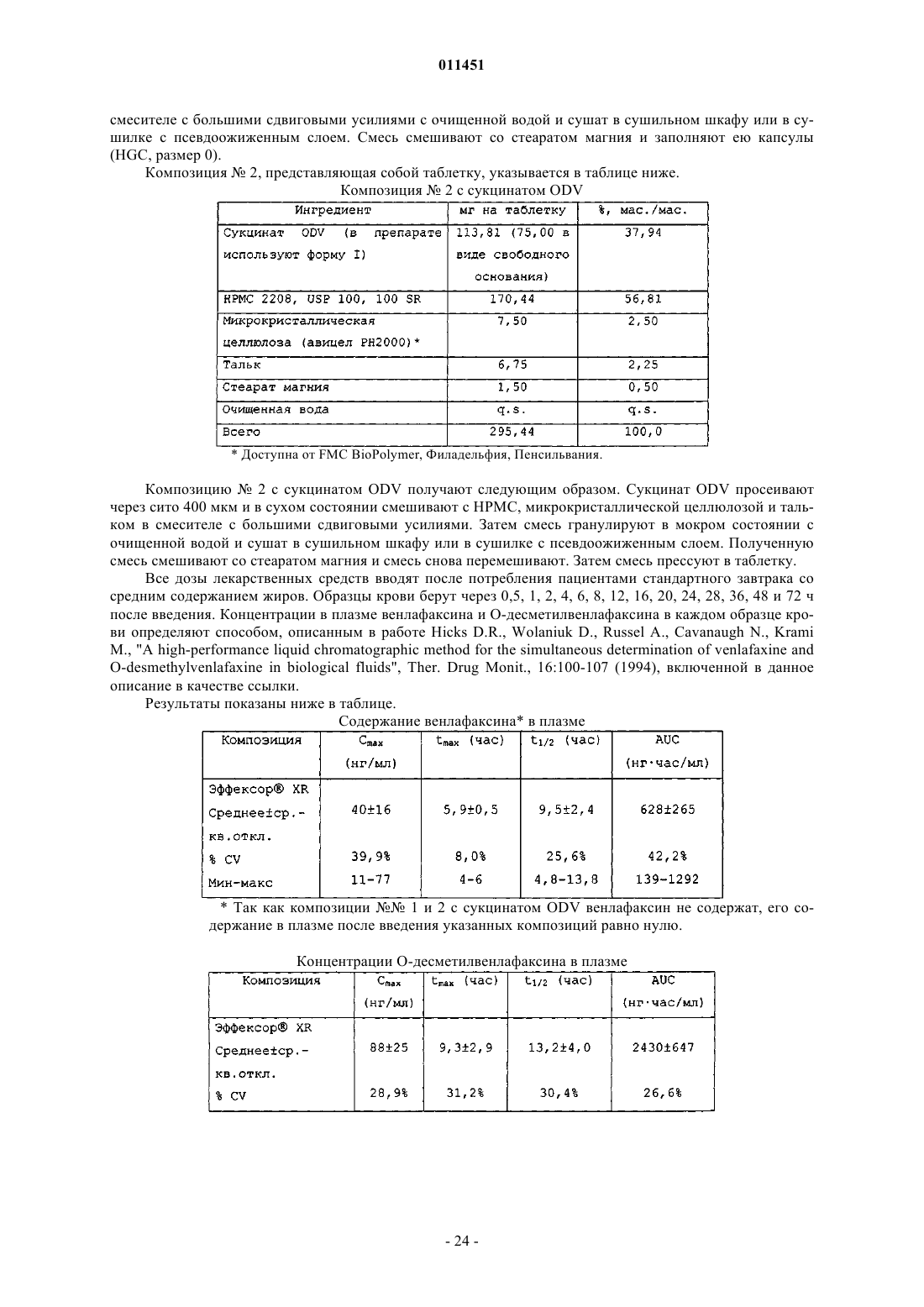
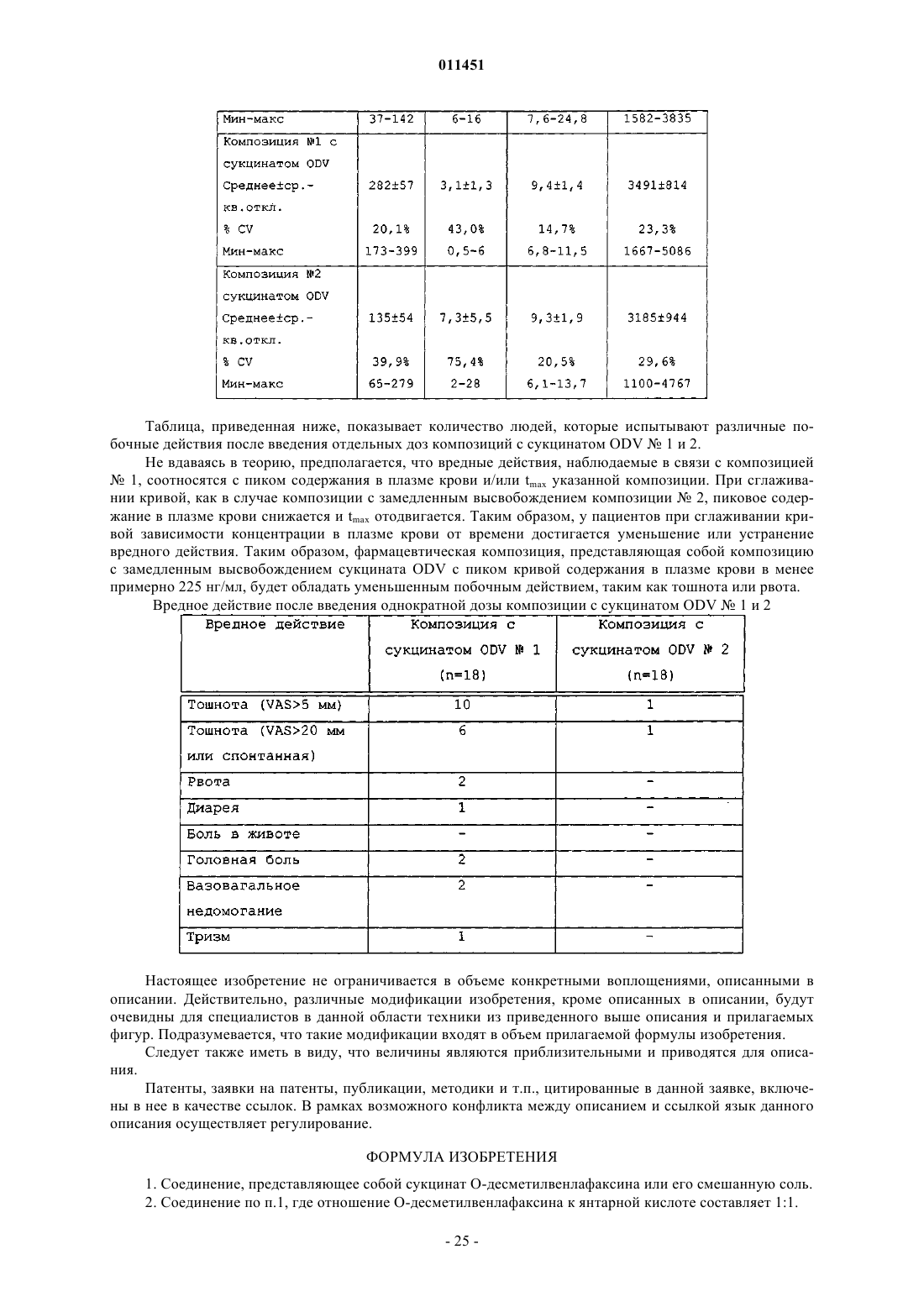
47. Способ снижения частоты появления тошноты, рвоты, диареи, боли в животе, головной боли, вазовагального недомогания или тризма, появляющихся в результате перорального введения пациенту сукцината О-десметилвенлафаксина, включающий пероральное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества пероральной лекарственной формы с замедленным высвобождением, содержащей сукцинат O-десметилвенлафаксина или его смешанную соль, определенный по любому из пп.1-24, обеспечивающей содержание O-десметилвенлафаксина или его смешанной соли в плазме крови не более 225 нг/мл.
48. Способ получения О-десметилвенлафаксина, включающий стадию деметилирования венлафаксина или его соли триалкилборогидридом щелочного металла.
49. Способ по п.48, где каждая алкильная группа в триалкилборогидриде представляет собой, независимо, (C1-C6)-алкил.
50. Способ по п.49, где триалкилборогидрид щелочного металла выбирают из L-селектрида, K-селектрида, триэтилборогидрида лития, триэтилборогидрида калия и их смесей.
51. Способ по п.48, где триалкилборогидрид щелочного металла представляет собой L-селектрид.
52. Способ по любому из пп.48-51, где стадию деметилирования (b) осуществляют при температуре от примерно 60 до примерно 140шС.
53. Способ по любому из пп.48-52, дополнительно включающий стадию превращения О-десметилвенлафаксина в сукцинат O-десметилвенлафаксина.
54. Способ по любому из пп.48-53, включающий стадию дезактивирования любых боросодержащих побочных продуктов, образовавшихся при реакции деметилирования.
55. Способ по п.54, где стадия дезактивирования включает окисление боросодержащих побочных продуктов.
56. Способ по п.55, где стадия окисления включает взаимодействие боросодержащих побочных продуктов с окислителем, выбранным из пероксида водорода, пербората натрия и их смесей.
57. Способ по п.55, где стадия окисления включает добавление боросодержащих побочных продуктов к окислителю или раствору, содержащему окислитель.
58. Способ получения О-десметилвенлафаксина, включающий стадии:
(a) деметилирования венлафаксина или его соли триалкилборогидридом щелочного металла с образованием соли щелочного металла О-десметилвенлафаксина и
(b) превращение соли щелочного металла O-десметилвенлафаксина в свободное основание O-десметилвенлафаксина.
59. Способ по п.58, где стадия (b) включает нейтрализацию соли щелочного металла О-десметилвенлафаксина кислотой.
60. Способ по п.58 или 59, также включающий стадию (с) превращения свободного основания О-десметилвенлафаксина в сукцинат О-десметилвенлафаксина.
61. Способ по любому из пп.58-60, где венлафаксин на стадии (а) представляет собой свободное основание.
62. Фармацевтический состав с замедленным высвобождением, содержащий сукцинат О-десметилвенлафаксина и фармацевтически приемлемый носитель или эксципиент, обеспечивающий максимальное содержание лекарственного средства в сыворотке крови до 225 нг/мл.
63. Способ получения соединения, определенного по любому из пп.1-24, включающий взаимодействие янтарной кислоты или ее фармацевтически приемлемой соли моносукцината со свободным основанием О-десметилвенлафаксином, причем по меньшей мере один реагент из указанных кислоты и основания находится в растворе, и, при необходимости, превращение образовавшейся соли моносукцината в смешанную фармацевтически приемлемую соль.
64. Способ по п.63, включающий дополнительную стадию добавления антирастворителя в случае получения раствора моногидрата моносукцината О-десметилвенлафаксина с осаждением формы II моносукцината О-десметилвенлафаксина.
65. Способ по п.63, дополнительно включающий стадию охлаждения водного или в смеси вода/ацетон раствора моносукцината О-десметилвенлафаксина с применением вакуума, и/или ледяной бани, и/или бани со смесью лед/вода с образованием формы II моносукцината О-десметилвенлафаксина.
66. Способ по п.63, дополнительно включающий стадию выдержки аморфной формы сукцината О-десметилвенлафаксина в атмосфере с относительной влажностью 75% или выше с образованием формы II моносукцината О-десметилвенлафаксина.
67. Способ получения соединения, определенного по любому из пп.1-24, включающий растворение свободного основания O-десметилвенлафаксина и янтарной кислоты в смеси воды и ацетона и охлаждение полученного раствора в течение примерно 3 ч или более с образованием формы I моносукцината O-десметилвенлафаксина.
68. Способ по п.67, дополнительно включающий стадию выпариванивания раствора формы I моносукцината O-десметилвенлафаксина, растворенного в ацетоне, с образованием формы II моносукцината О-десметилвенлафаксина.
69. Способ по п.67, дополнительно включающий стадию охлаждения либо насыщенного раствора в ацетоне, либо раствора в смеси этанол:вода, 95:5, об./об., формы I моносукцината O-десметилвенлафаксина с образованием формы II моносукцината O-десметилвенлафаксина.
70. Способ по п.67, дополнительно включающий стадию выпаривания раствора формы I моносукцината O-десметилвенлафаксина в воде с образованием формы II моносукцината О-десметилвенлафаксина.
71. Способ по п.67, дополнительно включающий стадию выпаривания раствора формы I моносукцината O-десметилвенлафаксина в ацетонитриле, или смеси этанол/гексан, или смеси этанол/хлороформ с образованием формы II моносукцината O-десметилвенлафаксина.
72. Способ получения соединения, определенного по любому из пп.1-24, включающий получение суспензии, содержащей:
(i) форму I моносукцината О-десметилвенлафаксина,
(ii) форму II или форму III моносукцината O-десметилвенлафаксина или их смесь и
(iii) ацетон, ацетонитрил, смесь ацетонитрила и воды или смесь этанола и толуола при температуре окружающей среды;
и извлечение кристаллической формы I моносукцината O-десметилвенлафаксина с последующим необязательным измельчением с использованием шаровой мельницы с образованием формы III моносукцината О-десметилвенлафаксина.
73. Способ по п.72, где измельчение осуществляют при низких температурах формы I сукцината О-десметилвенлафаксина с образованшхь формы III моносукцината О-десметилвенлафаксина.
74. Способ получения соединения, определенного по любому из пп.1-24, включающий суспендирование равных количеств форм I и II сукцината О-десметилвенлафаксина в ацетонитриле при повышенной температуре (например, при примерно 54шС) в течение нескольких суток (например, восьми суток), отфильтровывание и нагревание полученного твердого вещества для получения формы IV моносукцината О-десметилвенлафаксина.
75. Способ получения соединения, определенного по любому из пп.1-24, включающий нагревание форм I, II, III или IV сукцината О-десметилвенлафаксина или их смеси с образованием расплава и охлаждение расплава с образованием аморфного сукцината O-десметилвенлафаксина в виде стеклообразного вещества.
76. Способ по п.63, в котором используют водный растворитель и продукт реакции выделяют в виде гидрата.
Текст
011451 Настоящее изобретение относится к новой соли O-десметилвенлафаксина, сукцинату Одесметилвенлафаксина, а также к полиморфам, фармацевтическим композициям, лекарственным формам и способам их применения. О-Десметилвенлафаксин является основным метаболитом венлафаксина, и показано, что он ингибирует поглощение норэпинефрина и серотонина. Klamerus K.J. et al., "Introduction of the Composite Parameter to the Pharmacokinetics of Venlafaxine and its Active O-Desmethyl Metabolite", J. Clin. Pharmacol.,32:716-724 (1992). Пример О-десметилвенлафаксина, химическое название 1-[2-(диметиламино)-1-(4 фенол)этил]циклогексанол, в виде его соли фумаратовой кислоты приводится в патенте США 4535186. Однако соль фумарат O-десметилвенлафаксина имеет неподходящие физико-химические характеристики и проникающую способность. Также пример O-десметилвенлафаксина в виде свободного основания описывается в публикации международного патентаWO 00/32555. Образование соли является способом изменения физико-химических и итоговых биологических характеристик лекарственного средства без изменения химической структуры. Форма соли может оказывать существенное влияние на свойства лекарственного средства. Выбор подходящей соли частично диктуется выходом, степенью чистоты и количеством кристаллической структуры. Кроме того, важными моментами являются гигроскопичность, устойчивость, растворимость и способ получения соли. Может быть затруднительной идентификация солевой формы, проявляющей подходящее сочетание свойств. Растворимость является одной из основных характеристик соли, которая может повлиять на пригодность ее применения в качестве лекарственного средства. Когда растворимость в воде слабая, т.е. менее 10 мг/мл, скорость растворения при введении in vivo может являться скоростью, ограничивающей процесс поглощения, что приводит к плохой биологической доступности. Гигроскопичность также является важным свойством. Соединения с низкой гигроскопичностью имеют склонность проявлять более хорошую устойчивость и легче перерабатываться. Настоящее изобретение относится к новой соли O-десметилвенлафаксина - сукцинату О-десметилвенлафаксина (далее в описании называемому "сукцинат ODV"). Новая соль настоящего изобретения имеет свойства, которые особенно подходят для применения в качестве лекарственного средства, в том числе хорошую растворимость, проникающую способность и биологическую доступность. Например,сукцинат ODV хорошо абсорбируется в желудочно-кишечном тракте. Кроме того, пероральное введение сукцината ODV реже вызывает тошноту, рвоту, диарею, боли в животе, головную боль, вазовагальное недомогание и/или тризм, чем пероральное введение венлафаксина, О-десметилвенлафаксина и иных,чем сукцинат ODV, солей О-десметилвенлафаксина. Кроме того, замедленное высвобождение сукцинатаODV из пероральных композиций реже вызывает тошноту, рвоту, диарею, боли в животе, головную боль, вазовагальное недомогание и/или тризм, чем пероральное введение венлафаксина, Одесметилвенлафаксина и солей О-десметилвенлафаксина (в иных композициях, чем композиции сукцината ODV с замедленным высвобождением). Также изобретение относится к фармацевтическим композициям, содержащим сукцинат ODV и фармацевтически приемлемые носители или эксципиенты. Предпочтительно фармацевтические композиции содержат количество сукцината ODV, эффективное для лечения нужного симптома у животного, такого как человек. В других своих воплощениях настоящее изобретение относится к способам лечения пациентов,страдающих от депрессии (в том числе обширного депрессивного расстройства, биполярного расстройства и дистемии и других расстройств), тревоги, панического расстройства, расстройства генерализованной тревоги, посттравматического стрессового расстройства, предменструального дисфорического расстройства, фибромиалгии, агорафобии, дефицита внимания (с гиперактивностью или без нее), обсессивно-компульсивного расстройства (включая трихотиломанию), социальной тревоги, аутизма, шизофрении, ожирения, нервно-психической анорексии, нервно-психической булемии, синдрома Жиль де ла Туретта, вазомоторного прилива крови, кокаиновой и алкогольной зависимости, половой дисфункции(включая ускоренную эякуляцию и другие расстройства), пограничного личностного расстройства, синдрома хронической усталости, недержания мочи, боли (в том числе мигрени, хронической боли в спине,фантомной боли, боли, связанной с центральной нервной системой, невропатической боли, такой как при диабетической невропатии и постгерпетической невропатии и другой боли), синдрома Шая-Дрейджера,синдрома Рейно, болезни Паркинсона и эпилепсии, включающим предоставление пациенту эффективного количества сукцината ODV. Сукцинат ODV также можно вводить для предупреждения рецидива или возвратности депрессии, с целью вызвать усиление познавательной способности, для лечения ухудшения познавательной способности и в режимах отказа от курения или другого употребления табака. Кроме того, сукцинат ODV можно вводить для лечения гипоталамической аменории у женщин в состоянии депрессии и вне такого состояния. Указанные способы включают введение пациенту, нуждающемуся в таком лечении, эффективного количества сукцината ODV или, по существу, чистой полиморфной формы сукцината ODV или их смесей. Настоящее изобретение также относится к кристаллическим полиморфным формам сукцината ODV(называемым далее в данном описании формами I, II, III и IV соответственно) и аморфной форме сукцината ODV. Согласно предпочтительному воплощению изобретения фармацевтическая композиция настоящего изобретения содержит по меньшей мере примерно 20, 30, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99,-1 011451 99,1, 99,2, 99,3, 99,4, 99,5, 99,6, 99,7, 99,8 или 99,9 мас.% формы I, II, III или IV или аморфной формы сукцината ODV относительно 100% общей массы сукцината ODV в фармацевтической композиции (или общей массы кристаллического сукцината ODV в фармацевтической композиции). Другим воплощением изобретения является способ получения свободного основания О-десместилвенлафаксина деметилированием венлафаксина или его соли солью щелочного металла триалкилборогидрида. Фиг. 1 представляет собой рентгеновскую порошковую дифрактограмму (XRPD) формы I сукцината ODV, полученного в примере 7; фиг. 2 - XRPD формы II сукцината ODV, полученного в примере 8; фиг. 3 - XRPD формы III сукцината ODV, полученного в примере 9; фиг. 4 - XRPD формы IV сукцината ODV, полученного в примере 10; фиг. 5 - XRPD аморфной формы сукцината ODV, полученного в примере 11; фиг. 6 - результаты анализа, полученные методом сканирующей калориметрии (DSC) форм I, II, III и IV и аморфной формы сукцината ODV от 25 до 250 С в герметично закрытой кювете при скорости сканирования 10 С/мин при продувке азотом; фиг. 7 - XRPD формы I сукцината ODV, полученного в примере 1; фиг. 8 - результаты термогравиметрического анализа (ТГА) форм I, II, III и IV и аморфной формы сукцината ODV при нагревании от 25 до 300 С при скорости сканирования 10 С/мин при продувке азотом; фиг. 9 - графическое отображение коэффициента проникающей способности в кишечнике (Peff) крысы, определенного экспериментально в примере 14, и предсказанной для человека части дозы, поглощенной in vivo (Fa(%, для сукцината ODV, метопролола, глюкозы и маннита; фиг. 10 - графическое отображение полученного в примере 14 Peff, определенного экспериментально, и вычисленной Fa для сукцината ODV, поглощенного в двенадцатиперстной-тонкой кишке, подвздошной кишке и толстой кишке; фиг. 11 - графическое отображение полученного в примере 14 Peff, определенного экспериментально, и вычисленной Fa для фумарата ODV, метопролола, глюкозы и маннита; фиг. 12 - графическое отображение полученного в примере 14 Peff, определенного экспериментально, и вычисленной Fa для фумарата ODV, поглощенного в двенадцатиперстной-тонкой кишке, подвздошной кишке и толстой кишке; фиг. 13 - сравнение в примере 14 специфического поглощения фумарата ODV и сукцината ODV в двенадцатиперстной-тонкой кишке, подвздошной кишке и толстой кишке; фиг. 14 - схемы реакций получения свободного основания О-десместилвенлафаксина из венлафаксина и L-селектрида. Определения Термин "примерно", как правило, соответствует пределу в 10%, предпочтительно - 5%, более предпочтительно - 1% от данной величины или интервала. С другой стороны, при рассмотрении специалистом в данной области техники "примерно" обозначает предел в среднеквадратическую ошибку от среднего. Термин "моногидрат", используемый в данном описании, относится к гидрату, в котором одна молекула воды связана с каждой молекулой сукцината ODV. Термин "полугидрат", используемый в данном описании, относится к гидрату, в котором одна молекула воды связана с каждыми двумя молекулами сукцината ODV. Термин "лечение", используемый в данном описании, относится к предупреждению, облегчению,борьбе или излечению от требуемых симптомов или расстройств. Термин "по существу, одинаковые", когда используется для описания рентгеновских порошковых дифрактограмм, предназначен для описания дифрактограмм, в которых пики находятся в пределах среднеквадратичного отклонения 0,22. Настоящее изобретение относится к новой соли O-десметилвенлафаксина - сукцинату Одесметилвенлафаксина (далее в описании называемому "сукцинат ODV"). Сукцинат ODV придает оптимальные свойства композиции из-за своей высокой растворимости, проникающей способности и биологической доступности и имеет структурную формулу Янтарно-кислые соли О-десметилвенлафаксина существуют в виде энантиомеров, и данное изобре-2 011451 тение включает рацемические смеси, а также стереоизомерически чистые формы указанных соединений. Термин "сукцинат ODV", используемый в данном описании, включает рацемические смеси и стереоизомерически чистые формы сукцината ODV, если не указано иное. Термин "стереоизомерически чистые" относится к соединениям, которые большей частью состоят из нужного изомера, а не из оптического антипода. Стереоизомерически чистые соединения, как правило, состоят по меньшей мере на 90% из нужного изомера относительно 100% общей массы сукцинатаODV. Янтарная кислота представляет собой двухосновную карбоновую кислоту, и, следовательно, изобретение включает как соли, в которых отношение О-десметилвенлафаксина к кислоте (мольное) составляет 1:1 (т.е. моносукцинат), так и соли, в которых отношение О-десметилвенлафаксина к кислоте(мольное) составляет 2:1 (т.е. биссукцинат), а также смешанные соли, например, катиона щелочного металла или аммония. Изобретение также включает смеси сукцината ODV и О-десметилвенлафаксина в форме свободного основания. Кристаллические полиморфы (т.е. формы I, II, III и IV) и аморфная форма сукцината ODV, описываемые ниже, являются моносукцинатами, т.е. молярное отношение Одесметилвенлафаксина к кислоте составляет 1:1. Соли настоящего изобретения могут представлять собой кристаллическое вещество и могут существовать в виде нескольких полиморфов. Каждый полиморф составляет другой аспект изобретения. Гидраты, как и безводные формы солей, также охватываются изобретением. В частности, предпочтительна моногидратная форма сукцината O-десметилвенлафаксина. Сукцинат ODV, как правило, имеет растворимость в воде свыше 30 мг/мл. Предпочтительно водорастворимость сукцината ODV составляет по меньшей мере 25, 30, 32, 35, 40 или 45 мг/мл при 25 С. Соли янтарной кислоты можно получить взаимодействием стехиометрических количеств кислоты и свободного основания O-десметилвенлафаксина. С другой стороны, кислоту можно использовать в избытке, как правило, не превышающем 1,5 экв. Предпочтительно основание и/или кислота находятся в растворе, более предпочтительно оба реагента находятся в растворе. Кристаллическую соль можно получить непосредственной кристаллизацией из растворителя. Улучшенный выход можно получить путем выпаривания некоторой части или всего растворителя или кристаллизацией при повышенной температуре с последующим регулируемым охлаждением предпочтительно поэтапно. Тщательный контроль за температурой осаждения и внесение затравки можно использовать для улучшения воспроизводимости процесса получения и распределения частиц по размеру и формы продукта. Соответственно, данное изобретение относится к способу получения сукцината О-десметилвенлафаксина или его полиморфной формы, включающему:a) взаимодействие янтарной кислоты или ее фармацевтически приемлемой соли моносукцината со свободным основанием O-десметилвенлафаксином, причем по меньшей мере один реагент из указанных кислоты и основания находится в растворе и, при необходимости, превращение образовавшейся соли моносукцината в смешанную фармацевтически приемлемую соль; илиb) растворение свободного основания О-десметилвенлафаксина и янтарной кислоты в смеси воды и ацетона, охлаждение полученного раствора в течение примерно 3 ч или более с образованием формы I моносукцината О-десметилвенлафаксина; или с) получение суспензии, содержащей(iii) ацетон, ацетонитрил, смесь ацетонитрила и воды или смесь этанола и толуола при температуре окружающей среды; и извлечение кристаллической формы I моносукцината O-десметилвенлафаксина; или(d) выпаривание раствора формы I сукцината O-десметилвенлафаксина, растворенного в ацетоне, с образованием формы II моносукцината О-десметилвенлафаксина; или(e) охлаждение или насыщенного раствора в ацетоне, или раствора в смеси этанол:вода, 95:5 об./об. формы I моносукцината О-десметилвенлафаксина с образованием формы II моносукцината Одесметилвенлафаксина; или(g) выпаривание раствора формы I моносукцината O-десметилвенлафаксина в воде с образованием формы II моносукцината О-десметилвенлафаксина; или(h) выпаривание раствора формы I моносукцината O-десметилвенлафаксина в ацетонитриле или смеси этанол/гексан, или смеси этанол/хлороформ с образованием формы II моносукцината Oдесметилвенлафаксина; или(i) охлаждение водного или в смеси вода/ацетон раствора моносукцината О-десметилвенлафаксина с применением вакуума, и/или ледяной бани, и/или бани со смесью лед/вода с образованием формы II моносукцината О-десметилвенлафаксина; или(j) выдержка аморфной формы сукцината O-десметилвенлафаксина в атмосфере с относительной влажностью 75% или выше с образованием моногидрата формы II моносукцината O-десметилвенла-3 011451 факсина; или(k) измельчение с использованием шаровой мельницы или измельчение при низких температурах формы I сукцината O-десметилвенлафаксина с образованием формы III моносукцината O-десметилвенлафаксина; илиl) суспендирование равных количеств форм I и II сукцината О-десметилвенлафаксина в ацетонитриле при повышенной температуре (например, при примерно 54 С) в течение нескольких суток (например, 8 суток), отфильтровывание и нагревание полученного твердого вещества в течение времени, достаточного для получения формы IV моносукцината О-десметилвенлафаксина; или нагревание форм I, II, III или IV сукцината O-десметилвенлафаксина или их смеси с образованием расплава и охлаждение расплава с образованием аморфного сукцината O-десметилвенлафаксина в виде стеклообразного вещества. Форма I. Кристаллический полиморф форма I сукцината ODV представляет собой моногидрат и устойчив при комнатной температуре. Форма I физически устойчива по меньшей мере до примерно 105 С и при 595% относительной влажности. Согласно данным дифференциальной сканирующей калориметрии (DSC) форма I имеет эндотермический пик при примерно 131 С (см. фиг. 6). Форма I сукцината ODV имеет картину XRPD, по существу, идентичную картине, показанной на фиг. 1 (измельченная форма I) и 7 (неизмельченная форма I). Расположение пиков и интенсивности для картины XRPD на фиг. 1 приводятся ниже в табл.1. Таблица 1 Характеристические пики XRPD (выраженные в градусах 20,22) и относительные интенсивности дифракционных линий для формы I сукцината ODV В частности, пики (выраженные в градусах 20,22) при 10,20, 14,91, 20,56, 22,13, 23,71, 24,60 и 25,79 являются характерными для формы I. Форму I можно получить из свободного основания O-десметилвенлафаксина следующим образом. Свободное основание O-десметилвенлафаксин и янтарную кислоту растворяют в смеси воды и ацетона. Полученный раствор можно, необязательно, профильтровать для удаления каких-либо побочных продуктов, таких как продукты, образовавшиеся во время получения свободного основания Одесметилвенлафаксина. Затем раствор медленно охлаждают (например, в течение 3 ч или долее), и получают форму I ODV-сукцината. Кристаллы формы I можно извлечь любым способом, известным в технике. Форму I также можно получить, получая суспензию, содержащую (а) форму I и (b) форму II, формуIII или их смесь в (с) ацетоне, ацетонитриле, смеси ацетонитрила и воды (например, смеси 9:1) или смеси этанола и толуола (например, смеси 1:1) при температуре окружающей среды. Любое кристаллическое вещество, полученное вышеуказанными способами, можно извлечь любым методом, известным специалистам в данной области техники, такими как, например, фильтрация. Форма II. Кристаллический полиморф форма II сукцината O-десметилвенлафаксина представляет собой моногидрат и является более термоустойчивой, чем форма III. Согласно данным (DSC) форма II имеет эндотермический пик при примерно 127 С (см. фиг. 6). Форма II сукцината ODV имеет картину XRPD, по существу, идентичную картине, показанной на фиг. 2. Расположение пиков и интенсивности для картины-4 011451 Таблица 2 Характеристические пики XRPD (выраженные в градусах 20,22) и относительные интенсивности дифракционных линий для формы II сукцината ODV В частности, пики (выраженные в градусах 20,22) при 13,18, 14,04, 14,35, 14,66, 16,68, 17,67,19,24, 25,13 и 31,78 являются характерными для формы II. Форму II можно получить выпариванием в роторном испарителе раствора формы I в ацетоне. Форму II также можно получить медленным охлаждением насыщенного раствора формы I сукцината ODV или в ацетоне, или в смеси этанол:вода (95:5). Согласно одному из воплощений медленное охлаждение осуществляют следующим образом. Получают смесь растворителя и формы I сукцината ODV и нагревают при перемешивании на нагревательной плитке (предпочтительно установленной на 60-75 С). Растворитель добавляют до тех пор, пока не растворится почти весь сукцинат ODV. Полученную смесь,необязательно, фильтруют (например, через нейлоновый фильтр 0,2 мкм) в чистый предварительно нагретый сосуд, предпочтительно, на той же плитке. Источник тепла отключают и плитку и сосуд оставляют охлаждаться до температуры окружающей среды. Затем сосуд оставляют при температуре окружающей среды на ночь. Если твердое вещество не образуется, сосуд помещают в холодильник по меньшей мере на сутки. Снова, если твердое вещество не образуется, сосуд помещают в морозильник по меньшей мере на сутки. Любое твердое вещество извлекают фильтрацией под вакуумом и сушат на воздухе. В случаях, когда твердое вещество не получают, часть растворителя выпаривают и повторяют процедуру нагревания и охлаждения. Еще одним способом получения формы II является осаждение формы I сукцината ODV из смеси растворитель/антирастворитель этанол/гексан. Подходящими растворителями являются растворители, в которых растворимость сукцината ODV составляет более 1 мг/мл. Подходящими антирастворителями являются антирастворители, в которых сукцинат ODV имеет низкую растворимость, например растворимость менее 1 мг/мл. Согласно одному из вариантов воплощения растворитель насыщают сукцинатомODV. Смесь фильтруют (например, через нейлоновый фильтр 0,2 мкм) в сосуд с охлажденным антирастворителем (например, растворителем, в котором сукцинат ODV имеет растворимость менее 0,1%). Полученную смесь можно поместить в морозильник для повышения выхода. Форму II можно получить постепенным выпариванием воды из раствора формы I сукцината ODV. Например, форму I сукцината ODV можно растворить в воде и затем оставить в емкости с отверстиями при температуре окружающей среды для образования кристаллического полиморфа формы II. Форму II можно получить быстрым выпариванием маточных растворов формы I сукцината ODV в ацетонитриле или смеси этанол/гексан или этанол/хлороформ. Например, форму I сукцината ODV можно растворить в растворителе и затем оставить в открытой емкости при температуре окружающей среды для образования кристаллического полиморфа формы II. Форму II можно получить быстрым охлаждением водного или водноацетонового раствора сукцината ODV. Быстрое охлаждение можно осуществить любым способом, известным в технике, таким как,например, применение вакуума, и/или ледяной бани, или бани смеси лед/вода. Форму II также можно получить, подвергая аморфную форму сукцината ODV воздействию атмо-5 011451 сферы с относительной влажности 75% или выше (например, при комнатной температуре). Любое кристаллическое вещество, полученное вышеуказанными способами, можно извлечь любыми методами, известными в технике. Форма III. Кристаллический полиморф форма III сукцината ODV представляет собой гидрат. Молярное отношение воды к сукцинату ODV составляет менее 1, но более 1/2 (т.е. форма III сукцината ODV располагается между полугидратом и моногидратом). Форма III ODV-сукцината имеет картину XRPD, по существу, идентичную картине, показанной на фиг. 3. Расположение пиков и интенсивности для картины XRPD на фиг. 3 приводятся ниже в табл.3. Таблица 3 Характеристические пики XRPD (выраженные в градусах 20,22) и относительные интенсивности дифракционных линий для формы III сукцината ODV В частности, пики (выраженные в градусах 20,22) при примерно 13,74, 22,55 и 32,42 являются характерными для формы III. Форму III можно получить измельчением с использованием шаровой мельницы или измельчением при низких температурах формы I сукцината ODV. Измельчение с использованием шаровой мельницы осуществляют, помещая шар в цилиндр с сукцинатом ODV и затем встряхивая цилиндр. Измельчение при низких температурах осуществляют, помещая ODV-сукцинат в цилиндр, и встряхивая цилиндр, поддерживая температуру цилиндра на уровне криогенных температур (например, при -90 С). Любое кристаллическое вещество, полученное вышеуказанными способами, можно извлечь известными методами. Форма IV. Кристаллический полиморф форма IV сукцината ODV является безводным. В соответствии с DSC форма IV имеет эндотермический пик при примерно 145 С (см. фиг. 6). Форма IV сукцината ODV имеет картину XRPD, по существу, идентичную картине, показанной на фиг. 4. Расположение пиков и интенсивности для картины XRPD на фиг. 4 приводятся ниже в табл.4.-6 011451 Таблица 4 Характеристические пики XRPD (выраженные в градусах 20,22) и относительные интенсивности дифракционных линий для формы IV сукцината ODV В частности, пики (выраженные в градусах 20,22) при примерно 11,29, 17,22, 19,64, 20,91,21,61, 28,86, 29,80, 30,60, 36,85 и 37,70 являются характерными для формы IV. Форму IV можно получить путем суспендирования равных количеств формы I и формы II при примерно 54 С в течение нескольких суток (например, 8 суток), отфильтровывая и нагревая полученное твердое вещество в течение 18 ч при примерно 120 С. Кристаллическое вещество можно извлечь известными методами. Аморфная форма. Аморфная форма сукцината ODV имеет картину XRPD, по существу, идентичную картине, показанной на фиг. 5. Фиг. 5 показывает аморфную форму сукцината ODV. Точка стеклования (Tg) аморфной формы составляет 18 С. Согласно DSC аморфная форма имеет основной эндотермический пик при примерно 120 С (см. фиг. 6). Не вдаваясь в теорию, авторы изобретения полагают, что аморфная форма превращается в кристаллическую форму до достижения 120 С, так как аморфные формы обычно не показывают эндотермических пиков, в то время как кристаллические формы показывают. Аморфную форму можно получить, получая расплав нагреванием форм I, II, III или IV или их смеси и охлаждая расплав с образованием стеклообразного вещества. Например, аморфную форму можно получить, выдерживая формы I, II, III или IV или их смесь при примерно 150 С в течение от примерно 6 до примерно 18 мин для образования расплава и затем охлаждая расплав с образованием стеклообразного вещества. Охлаждение можно осуществить медленно или быстро (например, путем резкого охлаждения). Аморфную форму можно превратить в форму II, помещая аморфное вещество в окружающую среду с относительно высокой влажностью (например, с относительной влажностью свыше примерно 50 или примерно 75%). Получение свободного основания ОРУ. Свободное основание О-десметилвенлафаксин (ODV) можно получить согласно общим процедурам, описанным в патенте США 4535186. Другим способом получения свободного основания ODV является деметилирование соединения формулы I (венлафаксина) с образованием соединения формулы II, как описывается ниже на схеме I. Как показано выше на схеме I, исходное вещество венлафаксин (формула I) деметилируют. Венлафаксин можно получить согласно процедурам, известным в технике, таким как процедуры, описанные в патенте США 4535186, включенном в данное описание в качестве ссылки. Деметилирование осуществляют с использованием высокомолекулярного алкан-, арен- или арилалкилтиолат-аниона, например линейных или разветвленных алкантиолат-анионов с 8-20 атомами углерода, моно- или бициклических арентиолат-анионов с 6-10 атомами углерода или моно- или бициклических арилалкилтиолат-анионов с 7-12 атомами углерода, в присутствии протонного или апротонного растворителя. Необязательно, для генерации тиолат-аниона может присутствовать основание, такое как алкоксид, содержащий линейную или разветвленную алкильную группу с 1-6 атомами углерода. Предпочтительно алифатический тиол содержит 10-20 атомов углерода и наиболее предпочтительно алифатический тиол представляет собой додекантиол. Ароматический тиол предпочтительно представляет собой бензолтиол. Арилалкилтиолат-анион предпочтительно представляет собой толуолтиол или нафтилметантиол. Алкоксид, когда он присутствует, представляет собой предпочтительно низший алкоксид (метоксид, этоксид и т.п.), такой как метоксид натрия (метилат натрия, метанолат натрия). Растворитель предпочтительно представляет собой гидроксилсодержащий или содержащий простую эфирную группу растворитель и более предпочтительно - спирт, этиленгликоль или простой эфир этиленгликоля. К простым эфирам этиленгликоля относятся, но не ограничиваются ими, моноэтиловый эфир этиленгликоля, диметиловый эфир триэтиленгликоля и полиэтиленгликоль. Предпочтительно растворитель представляет собой инертный, полярный простой эфир этиленгликоля с высокой температурой кипения, такой как полиэтиленгликоль, и наиболее предпочтительно - PEG 400 (полиэтиленгликоль с молекулярной массой в интервале примерно 380-420). Взаимодействие предпочтительно осуществляют при температуре от примерно 150 С до примерно 220 С, более предпочтительно от примерно 170 до примерно 220 С и наиболее предпочтительно от примерно 180 до примерно 200 С. Взаимодействие, как правило, продолжают до тех пор, пока, в идеале, останется не более примерно 1% венлафаксина. В некоторых аспектах изобретения взаимодействие завершают за время от примерно 2 до примерно 5 ч и более предпочтительно от примерно 2 до примерно 3,5 ч. В предпочтительных воплощениях данного способа основание венлафаксина растворяют в полиэтиленгликоле 400, содержащем додекантиол и метилат натрия в виде раствора в метаноле, в то время как температуру повышают до температуры от примерно 180 до примерно 200 С при перемешивании в течение примерно 2-3,5 ч. Затем реакционную смесь охлаждают до температуры от примерно 65 до примерно 75 С и можно добавить спирт как разбавитель перед нейтрализацией до изоэлектрической точки (от примерно рН 9,5 до примерно рН 10,0) соответствующим агентом нейтрализации, таким как хлороводородная кислота. Спиртовая среда также может способствовать кристаллизации продукта реакции, когда инициируется кристаллизация. Предпочтительно спирт содержит линейную или разветвленную алкильную группу с 1-6 атомами углерода, как, например, метанол, этанол, изопропанол, бутанол и т.п., и их смеси. В некоторых предпочтительных воплощениях такого способа спирт представляет собой изопропанол. Выход в данном способе превышает примерно 75% и, как правило, составляет от примерно 85 до величины более 90%. Еще одним способом получения свободного основания ODV является деметилирование венлафаксина или его соли (например, невосстанавливаемой соли венлафаксина, такой как гидрохлорид) солью щелочного металла триалкилборогидрида. Алкильные группы в триалкилборогидриде могут представлять собой, независимо, (C1-С 6)-алкил, и предпочтительно представляют собой, независимо, (C1-C4)алкил. Алкильные заместители в триалкилборогидриде могут быть одинаковыми или разными. Подходящими щелочными металлами являются, но не ограничиваются ими литий, натрий и калий. Подходящими триалкилборогидридами являются, но не ограничиваются ими, селектрид (три-вторбутилборогидрид) или триэтилборогидрид. Примеры солей, не являющиеся ограничительными, включают L-селектрид, K-селектрид, триэтилборогидрид лития и триэтилборогидрид калия.-8 011451 Предпочтительными солями являются L-селектрид и триэтилборогидрид лития и другие соли. Более предпочтительной солью является L-селектрид. Как правило, процесс деметилирования осуществляют в одном или нескольких из следующих растворителей: 1,2-диметоксиэтане, тетрагидрофуране (ТГФ), 1,2-диэтоксиэтане и диглиме (бис-(2 метоксиэтиловый) эфир). Взаимодействие типично осуществляют при температуре кипения растворителя или несколько меньшей температуре. Предпочтительно взаимодействие осуществляют при температуре от примерно 60 до примерно 140 С, более предпочтительно от примерно 80 до примерно 100 С и даже более предпочтительно от примерно 85 до примерно 95 С. Взаимодействие, как правило, осуществляют до тех пор, пока основное количество венлафаксина не будет деметилировано, и предпочтительно до тех пор, пока не будет деметилировано 80, 90, 95 или 99% венлафаксина. Вообще говоря, взаимодействие осуществляют в течение от примерно 8 до примерно 48 ч. Согласно одному из воплощений реакцию осуществляют в течение от примерно 12 до примерно 36 ч и предпочтительно в течение примерно 24 ч. В результате реакции образуется соль щелочного металла O-десметилвенлафаксина. Соль щелочного металла можно превратить в свободное основание способами, известными в технике, такими как нейтрализация кислотой (например, до изоэлектрической точки). Способ деметилирования венлафаксина не изменяет оптической активности исходного вещества венлафаксина. Иными словами, если исходное вещество является рацемической смесью венлафаксина,продукт такого процесса деметилирования также будет представлять собой рацемическую смесь. Если исходное вещество является оптически чистым энантиомером, продукт такого процесса деметилирования также будет представлять собой такой же оптически чистый энантиомер. Пример такой реакционной схемы получения свободного основания О-десметилвенлафаксина показан на фиг. 14. Данный способ деметилирования венлафаксина может дать свободное основание ODV, по существу, в чистой форме (например, с 0,5, 0,4, 0,3, 0,2, 0,1, 0,09, 0,08, 0,07, 0,06 или 0,05% примесей(мас./мас.) (исключая неорганические примеси) при измерении методом ВЭЖХ). Деметилирование с помощью триалкилборогидрида дает различные вредные боросодержащие побочные продукты. Например, использование L-селектрида приводит к образованию трис(1 метилпропил)борана и трис(1-метилпропил)бороксина как побочных продуктов. Такие побочные продукты реакции можно дезактивировать (или стабилизировать) окислением и, необязательно, гидролизом(промежуточных сложных эфиров боратов). Окисление можно осуществить взаимодействием боросодержащих побочных продуктов с окислителем, таким как пероксид водорода, пербораты (например, перборат натрия) или их смесь. Предпочтительным окислителем является щелочной раствор пербората (например, водный раствор, содержащий гидроксид натрия и тетрагидрат пербората натрия). Предпочтительно боросодержащие побочные продукты добавляют к окислителю или раствору, содержащему окислитель. Как описывается в работе Rewiews in Contemporary Pharmacology, Volume 9(5), page 293-302 (1998),включенном в данное описание в качестве ссылки, О-десметилвенлафаксин имеет фармакологический профиль, показанный ниже в табл.5. Таблица 5-9 011451 Таким образом, соединения, композиции и способы настоящего изобретения можно использовать для лечения или предупреждения расстройств центральной нервной системы, включая, но не ограничиваясь перечисленным, депрессию (включая, но не ограничиваясь перечисленным, обширное депрессивное расстройство, биполярное расстройство и дистемию), фибромиалгию, тревогу, паническое расстройство, агорафобию, посттравматическое стрессовое расстройство, предменструальное дисфорическое расстройство (также известное как предменструальный синдром), дефицит внимания (с гиперактивностью или без нее), обсессивно-компульсивное расстройство (включая трихотиломанию), социальную тревогу,аутизм, шизофрению, ожирение, нервно-психическую анорексию, нервно-психическую булемию, синдром Жиль де ла Туретта, вазомоторный прилив крови, кокаиновую и алкогольную зависимость, половую дисфункцию (включая ускоренную эякуляцию), пограничное личностное расстройство, синдром хронической усталости, недержание (включая недержание кала, недержание мочи вследствие переполнения мочевого пузыря, пассивное недержание, недержание рефлексов, недержание мочи при напряжении, неудержание, недержание мочи вопреки усилиям и недержание мочи), боль (в том числе, мигрень,хроническую боль в спине, фантомную боль, боль, связанную с центральной нервной системой, невропатическую боль, такую как при диабетической невропатии и постгерпетической невропатии, и другую боль), синдром Шая-Дрейджера, синдром Рейно, болезнь Паркинсона, эпилепсию и другие заболевания. Соединения и композиции настоящего изобретения также можно использовать для предупреждения рецидива или возвратности депрессии; для лечения ухудшения познавательной способности у пациента,страдающего от сенильной деменции, болезни Альцгеймера, потери памяти, амнезии и амнезийного синдрома; и в режимах отказа от курения или другого употребления табака. Кроме того, соединения и композиции настоящего изобретения можно использовать для лечения гипоталамической аменории у женщин в состоянии депрессии и вне такого состояния. В некоторых предпочтительных воплощениях изобретения сукцинат О-десметилвенлафаксина полезен для лечения депрессии, тревоги, панического расстройства, расстройства генерализованной тревоги, посттравматического стресса и предменструального дисфорического расстройства. Данное изобретение относится к способам лечения, предупреждения, подавления или облегчения каждого из перечисленных выше заболеваний у млекопитающего, предпочтительно человека, причем способы включают введение эффективного количества соединения изобретения млекопитающему, нуждающемуся в этом. Эффективное количество представляет собой количество, достаточное для предупреждения, подавления или облегчения одного или нескольких симптомов перечисленных выше состояний. Дозировочное количество, полезное для лечения, предупреждения, подавления или облегчения каждого из перечисленных выше состояний у млекопитающего, будет изменяться в зависимости от тяжести состояния, от которого лечат, и способа введения. Доза и частота введения дозы также будут изменяться в зависимости от возраста, массы тела, реакции и медицинского анамнеза данного больного человека. Вообще, интервал суточных доз, рекомендуемый в случае состояний, описанных в данном описании, лежит в пределах от 10 до примерно 1000 мг О-десметилвенлафаксина в сутки, более предпочтительно в пределах от примерно 15 до примерно 350 мг/сутки и еще более предпочтительно от примерно 15 до примерно 140 мг/сутки. В других воплощениях изобретения дозировка будет колебаться от примерно 30 до примерно 90 мг/сутки. Дозировка приводится в расчете на свободное основание и соответственно регулируется в случае сукцината. При лечении больного, как правило, предпочтительно, чтобы лечение начиналось с более низкой дозы с повышением ее при необходимости. Дозировки для пациентов, не относящихся к людям, специалист в данной области техники может соответственно отрегулировать. Другим воплощением изобретения является способ снижения тошноты, рвоты, диареи, боли в животе, головной боли, вазовагального недомогания и/или тризма, появляющихся в результате перорального введения пациенту венлафаксина, O-десметилвенлафаксина или иной, чем сукцинат Oдесметилвенлафаксина, соли О-десметилвенлафаксина. Способ включает пероральное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества сукцината O-десметилвенлафаксина. Еще одним воплощением изобретения является способ снижения тошноты, рвоты, диареи, боли в животе, головной боли, вазовагального недомогания и/или тризма, появляющихся в результате перорального введения пациенту сукцината O-десметилвенлафаксина. Способ включает пероральное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества пероральной лекарственной формы с замедленным высвобождением, содержащей сукцинат О-десметилвенлафаксина, имеющей пик содержания в плазме менее примерно 225 нг/мл. Сукцинат О-десметилвенлафаксина также можно предоставить в сочетании с венлафаксином. Дозировка венлафаксина предпочтительно составляет от примерно 75 до примерно 350 мг/сутки и более предпочтительно от примерно 75 до примерно 225 мг/сутки. Еще более предпочтительно дозировка венлафаксина составляет от примерно 75 до примерно 150 мг/сутки. Отношение О-десметилвенлафаксина к венлафаксину будет изменяться от пациента к пациенту в зависимости от интенсивности реакции пациента, но, как правило, будет составлять по меньшей мере 6:1 (О-десметилвенлафаксин к венлафаксину).- 10011451 Любой подходящий способ введения можно использовать для введения пациенту эффективного количества сукцината O-десметилвенлафаксина. Например, можно использовать пероральный способ введения, способ введения через слизистые оболочки (например, назальный, подъязычный, буккальный,ректальный или вагинальный), парентеральный способ (например, внутривенный или внутримышечный), трансдермальный и подкожный способы введения. Предпочтительными способами введения являются пероральный, трансдермальный и через слизистые оболочки. Сукцинат О-десметилвенлафаксина можно объединять с фармацевтическим носителем или эксципиентом (например, фармацевтически приемлемыми носителями и эксципиентами) согласно обычному методу получения фармацевтических композиций с образованием фармацевтической композиции или лекарственной формы. Подходящими фармацевтически приемлемыми носителями являются носители,описанные в издании Remington's, The Science and Pratice of Pharmacy (Gennaro, A.R., ed., 19th edition,1995, Mack Pub. Co.), включенном в настоящее описание в качестве ссылки, и другие носители. Выражение "фармацевтически приемлемые" относится к добавкам или композициям, которые являются физиологически переносимыми и, как правило, не дают аллергической или подобной неблагоприятной реакции, такой как желудочное расстройство, головокружение и т.п., при введении животному, например млекопитающему (например, человеку). В случае пероральных жидких фармацевтических композиций фармацевтическими носителями и эксципиентами могут являться вода, гликоли, масла, спирты, корригенты, консерванты, красители и т.п. Пероральные твердые фармацевтические композиции могут включать крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, вещества, способствующие образованию гранул, смазывающие вещества, связующие вещества и вещества, способствующие рассыпанию. Фармацевтическая композиция или лекарственная форма также могут включать велафаксин или его соль, как указывалось выше. Согласно одному из воплощений изобретения большая часть частиц сукцината ODV в фармацевтической композиции или лекарственной форме настоящего изобретения имеет размер от 45 до 400 мкм. Предпочтительно более 60 или 65% частиц имеют размер от 45 до 400 мкм. Лекарственными формами являются таблетки, капсулы, пастилки, лепешки, дисперсии, суспензии,суппозитории, мази, согревающие компрессы, пасты, порошки, кремы, растворы, капсулы (включая инкапсулированные стероиды) и пэтчи, и другие. Лекарственные формы также могут включать композиции немедленного высвобождения, а также композиции, приспособленные для регулируемого, постепенного,длительного или замедленного высвобождения. Наиболее предпочтительными лекарственными формами являются таблетки и капсулы. На таблетки и сфероиды можно нанести покрытие стандартными методами из водных и неводных составов, по необходимости. Каждая лекарственная форма, как правило, содержит от примерно 15 до примерно 350 мг ODV сукцината ODV (в расчете на эквивалент свободного основания). Более предпочтительно каждая лекарственная форма содержит от примерно 30 до примерно 200 мг сукцината ODV (в расчете на эквивалент свободного основания) и даже более предпочтительно от примерно 75 до примерно 150 мг сукцинатаODV (в расчете на эквивалент свободного основания). Согласно одному из предпочтительных воплощений фармацевтическая композиция является композицией с пролонгированным высвобождением, такой, какая описывается в патенте США 6274171,включенном в данное описание в качестве ссылки. Например, композиция с пролонгированным высвобождением может содержать сфероиды, состоящие из сукцината ODV, микрокристаллической целлюлозы и, необязательно, гидроксипропилметилцеллюлозы. На сфероиды предпочтительно наносят покрытие из состава для получения пленки, содержащего этилцеллюлозу и гидроксипропилметилцеллюлозу. Согласно другому предпочтительному воплощению фармацевтическая композиция является композицией с замедленным высвобождением (например, в форме таблетки). Композиция с замедленным высвобождением может содержать сукцинат ODV, полимерный материал, регулирующий скорость (т.е. материал, регулирующий скорость, с которой высвобождается сукцинат ODV), и, необязательно, другие адъюванты. Подходящими, регулирующими скорость полимерными материалами являются гидроксиалкилцеллюлоза, такая как гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза (НРМС); полиэтиленоксид; алкилцеллюлоза, такая как этилцеллюлоза и метилцеллюлоза; карбоксиметилцеллюлоза; гидрофильные производные целлюлозы и полиэтиленгликоля, и другие полимеры. Композиция с замедленным высвобождением содержит от примерно 30 до примерно 50% (мас./мас.) сукцината ODV и от примерно 25 до примерно 70% (мас./мас.) регулирующего скорость полимерного материала. Необязательно, композиция с замедленным высвобождением также может содержать от примерно 0,5 до примерно 10% (мас./мас.) и предпочтительно от примерно 2 до примерно 10% (мас./мас.), микрокристаллической целлюлозы. Предпочтительная композиция с замедленным высвобождением содержит от примерно 32 до примерно 44% (мас./мас.) сукцината ODV и от примерно 45 до примерно 66% (мас./мас.) гидроксипропилметилцеллюлозы. Как правило, композиция с замедленным высвобождением обеспечивает продолжительное терапевтически эффективное действие в плазме на протяжении по меньшей мере 16 или 20 ч. Пик содержания в сыворотке во время 16-20-часового периода, как правило, достигает 150 нг/мл. Композиция с замедленным высвобождением уменьшает уровень тошноты, рвоты, диареи, боли в животе, головной боли, вазовагального недомогания и/или тризма.- 11011451 Примеры, приведенные далее, являются пояснительными, но не предназначены для ограничения настоящего изобретения. Пример 1. Получение формы I сукцината ODV. Ацетон (2111 мл), воду (667 мл) и О-десметилвенлафаксин (250,0 г, 0,949 моль) смешивают с образованием густой белой суспензии, которую перемешивают при 23 С в течение 0,5 ч. Добавляют янтарную кислоту (115,5 г, 0,978 моль) с ацетоном (236 мл) и водой (75 мл). Суспензию нагревают до 58 С и перемешивают при указанной температуре в течение 30 мин. Реакционную смесь фильтруют и охлаждают до 30-34 С. Суспензию перемешивают при 30-31 С в течение 3 ч, затем охлаждают до 0-5 С и перемешивают при такой температуре еще в течение часа. Твердые вещества отделяют фильтрацией и влажный остаток на фильтре сушат при 30 С в течение 12 ч (50 мм рт.ст.), затем при 40 С в течение 24 ч (50 мм рт.ст.) и получают моногидрат сукцината О-десметилвенлафаксина в виде белого кристаллического вещества (325,5 г, 85,7%). Т.пл. 122,3 С и 139,6 С. 1(ушс, 1 Н), 3,12 (дд, J=7,0, 12,2 Гц, 1 Н), 2,74 (т, J=8,7 Гц, 1 Н), 2,7-2,58 (м, 1 Н), 2,50 (с, 3 Н), 2,36 (с, 3 Н),2,28 (с, 4 Н), 1,50-1,25 (м, 6 Н), 1,20-0,80 (4 Н). Чистота 99,40% (по методу ВЭЖХ). Картина XRPD для полученного (неизмельченного) кристаллического вещества показана на фиг. 7. Характеристические пики XRPD показаны ниже в табл. 6. Таблица 6 Рентгеновская порошковая дифрактограмма (CuK2) Кристаллы формы I, результаты для которых приводятся на фиг. 7, не измельчались, в то время как на фиг. 1 приводятся результаты для кристаллов, измельченных перед проверкой. Не вдаваясь в теорию,авторы изобретения теоретически предполагают, что XRPD для неизмельченного кристаллического вещества отличается от XRPD для измельченного кристаллического вещества из-за предпочтительной ориентации неизмельченных кристаллов. Объемный вес 0,369 г/мл. Растворимость в воде 32,2 мг/мл при 25 С. Растворимость в воде (приведенную выше) формы I сукцината ODV определяют согласно процедуре, описанной далее. Материалы. Спектрофотометр - способный выделять полосу шириной 2 нм или менее при длине волны максимального поглощения и измерять поглощение в интервале 0,0-1,0 с точностью 0,01. Подходящим является спектрофотометр Cary, модель 219 или равноценный. Кюветы - кварц, 1 см. Фильтры - нейлоновые фильтры 0,45 мкм, являющиеся химически устойчивыми, или равноценные. Склянки - склянки с завинчивающейся пробкой емкостью 15 мл или более. Качалка - подходят горизонтальная качалка, шарнирная качалка или вибратор, не выделяющие тепла. Приготовление образцов.A. В случае растворителей, не поглощающих УФ. 1. В склянке взвешивают образец в количестве, эквивалентном приблизительно 1,5-кратному от растворимого количества. 2. В склянку отмеривают пипеткой 10,0 мл воды, и склянку плотно закрывают. 3. Склянки встряхивают при комнатной температуре в течение по меньшей мере 16 ч. 4. Получают прозрачный слой фильтрата или центрифугированием, или фильтрацией, причем аккуратной во избежание испарения. 5. Количественно переносят раствор в мерную колбу и разбавляют водой до соответствующего объема. 6. Градуируют прибор по воде.- 12011451 7. Осуществляют количественные разбавления для достижения концентрации, подходящей для измерения.B. В случае растворителей, поглощающих УФ. 1. В склянке взвешивают образец в количестве, эквивалентном приблизительно 1,5-кратному от растворимого количества. 2. В склянку отмеривают пипеткой 10,0 мл воды, и склянку плотно закрывают. 3. Встряхивают склянки при комнатной температуре в течение по меньшей мере 16 ч. 4. Получают прозрачный слой фильтрата или центрифугированием, или фильтрацией, причем аккуратной во избежание испарения. 5. Выпаривают точное количество растворителя на паровой бане и остаток снова растворяют в растворителе, используемом для получения эталона. Количественно переносят в мерную колбу с помощью того же растворителя, который используют для получения эталонного раствора. 6. Осуществляют необходимые разбавления для получения концентрации, подходящей для количественного измерения. Процедура. 1. Получают спектры препаратов образца и эталона от 350 до 200 нм с использованием воды в качестве фона. Интервал длин волн может изменяться в зависимости от отсекания УФ-излучения водой. 2. Вычисляют водорастворимость с помощью следующего уравнения: где As - оптическая плотность препарата образца;Ds - показатель разбавления препарата образца, мл;Wg - общая масса эталона и емкости, мг;Ar - оптическая плотность препарата эталона;Dr - показатель разбавления препарата эталона, мл;V - количество выпаренного растворителя, мл. Пример 2. Лекарственная форма твердая желатиновая капсула. Активный ингредиент просеивают и смешивают с перечисленными эксципиентами. Твердые желатиновые капсулы подходящего размера заполняют с использованием подходящего оборудования и способов, известных в технике. Можно получить другие дозы, изменяя заполняющую массу и, при необходимости, изменяя размер капсулы на подходящий. Пример 3. Получение свободного основания О-десметилвенлафаксина. Додекантиол (122 г), венлафаксин (111 г) и раствор метанолата натрия в метаноле (30%, 90 г) и PEG 400 нагревают до 190 С. Отгоняют метанол и раствор перемешивают в течение 2 ч при 190 С. Затем температуру снижают, добавляют 2-пропанол (450 г) и доводят рН до 9,5 соляной кислотой. Выпавший осадок собирают фильтрацией с разрежением и остаток на фильтре промывают 2-пропанолом, толуолом,2-пропанолом и водой. Влажный О-десметилвенлафаксин сушат в вакууме. Выход 87 г. 1 Н ЯМР (Gemini 200, Varian, 200 МГц) (ДМСО-d6)= 9,11 (с, уш, 1H; ОН), 6,98 (д, уш, J=8,4, 2H,аром.), 6,65 (д, уш, J=8,4, 2 Н; аром.), 5,32 (с, уш, 1 Н; ОН), 3,00 (дд, J=12,3 и 8,5, 1 Н), 2,73 (дд, J=8,5 и 6,3,1 Н), 2,36 (дд, J=12,3 и 6,3, 1 Н), 2,15 (с, 6 Н, 2Me), 1,7-0,8 (м, 10 Н, ц-гекс). Пример 4. Получение свободного основания О-десметилвенлафаксина. Венлафаксин (5,6 г) и натриевую соль бензолтиола (6,9 г) добавляют к PEG 400 (25 г). Реакционную смесь греют при 160 С в течение 5 ч. Затем температуру снижают и добавляют воду (60 г). Доводят рН до 3,5 с помощью Н 3 РО 4. Органические побочные продукты реакции удаляют экстракцией гептаном (25 г). Затем рН водного слоя доводят до 9,5 водным раствором аммиака. Выпавший осадок собирают фильтрацией с разрежением, ресуспендируют в воде (100 г), выделяют фильтрацией с разрежением и сушат в вакууме. Выход 1 г. 1 Н ЯМР (Gemini 200, Varian, 200 МГц) (ДМСО-d6)= 9,11 (с, уш, 1 Н; ОН), 6,98 (д, уш, J=8,4, 2H,- 13011451 аром.), 6,65 (д, уш, J=8,4, 2 Н, аром.), 5,32 (с, уш, 1 Н; ОН), 3,00 (дд, J=12,3 и 8,5, 1 Н), 2,73 (дд, J=8,5 и 6,3,1 Н), 2,36 (дд, J=12,3 и 6,3, 1 Н), 2,15 (с, 6 Н, 2Me), 1,7-0,8 (м, 10 Н, ц-гекс). Пример 5. Получение свободного основания О-десметилвенлафаксина. Додекантиол (69 г), венлафаксин (55 г) и раствор этанолата натрия в этаноле (21%, 82 г) загружают в автоклав. Температуру поднимают до 150 С и реакционную смесь перемешивают в течение 2 суток. Затем температуру снижают и раствор фильтруют. Доводят рН фильтрата до 9,5 соляной кислотой. Кристаллическое вещество собирают фильтрацией с разрежением. Остаток на фильтре промывают этанолом и сушат в вакууме. Выход 42 г. 1H ЯМР (Gemini 200, Varian, 200 МГц) (ДМСО-d6)= 9,11 (с, уш, 1 Н; ОН), 6,98 (д, уш, J=8,4, 2H,аром.), 6,65 (д, уш, J=8,4, 2 Н, аром.), 5,32 (с, уш, 1 Н; ОН), 3,00 (дд, J=12,3 и 8,5, 1 Н), 2,73 (дд, J=8,5 и 6,3,1 Н) , 2,36 (дд, J=12,3 и 6,3, 1 Н), 2,15 (с, 6 Н, 2Me), 1,7-0,8 (м, 10 Н, ц-гекс). Пример 6. Получение свободного основания О-десметилвенлафаксина. В нагревательный кожух помещают 12-л многогорловую колбу, снабженную механической мешалкой, термометром, 1-л капельной воронкой с уравновешенным давлением и дистилляционной насадкой Кляйзена, снабженной прямым холодильником, соединенным с 5-л приемником с вакуумным отводом. Систему продувают азотом и атмосферу азота сохраняют. В перегонную колбу загружают 4,00 л (4,00 моль, 5,55-кратный молярный избыток) 1 М раствора L-селектрида. В капельную воронку загружают раствор 200,00 г (0,720 моль) венлафаксина основания в 0,6936 кг (800 мл) безводного 1,2 диметоксиэтана, сохраняя атмосферу азота. Раствор основания венлафаксина при перемешивании добавляют к раствору L-селектрида в течение 15 мин с использованием смывания 1,2-диметоксиэтаном (2400 мл, 20,3468 кг). Водород выпускают и барботируют через рассекатель в воду. Во время добавления существенного изменения температуры не происходит. Капельную воронку заменяют подобной 4-л воронкой, содержащей 2,4276 кг (2800 мл) безводного 1,2-диметоксиэтана. Систему снова продувают азотом и атмосферу азота сохраняют. Раствор нагревают и перегоняют при атмосферном давлении до тех пор, пока уровень жидкости в колбе не достигнет отметки 4 л и температура реакционной смеси составит 84-85 С. Во время перегонки добавляют по каплям 2,4276 кг (2800 мл) 1,2-диметоксиэтана со скоростью, при которой уровень жидкости сохраняется на отметке 4,00 л до тех пор, пока температура в реакционной колбе не достигнет 9394 С. Наблюдают образование осадка кристаллического вещества. Дистиллят отбрасывают. Суспензию кристаллического вещества при перемешивании охлаждают до 90 С, останавливают мешалку и удаляют капельную воронку и оборудование для перегонки. Затем колбу снабжают обратным холодильником, снабженным вводом для азота. Систему продувают азотом и атмосферу азота сохраняют. Суспензию перемешивают и кипятят с обратным холодильником в атмосфере азота в течение примерно 19 ч. Начальная температура суспензии при образовании флегмы составляет 94-96 С, а конечная температура составляет 97 С. Происходит обильная кристаллизация. Суспензию охлаждают до комнатной температуры. В 20-л колбе Дюрана 12 л дистиллированной воды продувают азотом для удаления кислорода и диоксида углерода. Продувку, при необходимости, повторяют. Такая вода далее в описании называется"дистиллированной водой, очищенной азотом". Нагревательный кожух удаляют и заменяют баней со смесью лед/вода для того, чтобы привести температуру реакционной смеси почти к комнатной температуре. Колбу снабжают 1000-мл капельной воронкой с уравновешенным давлением. Реакционную смесь при перемешивании охлаждают на бане со смесью лед/вода, чтобы получить температуру смеси 15-20 С. Сохраняя атмосферу азота, реакцию гасят,добавляя по каплям 0,296 кг (296 мл) дистиллированной воды, очищенной азотом. Добавление регулируют так, чтобы температура оставалась ниже 25 С. Температура поднимается до 15-24 С в результате выделения тепла. Смесь перемешивают при температуре окружающей среды в течение примерно 1 ч. Густой желеобразный осадок, образовавшийся сначала, в указанный период превращается в кристаллический осадок. Сохраняя атмосферу азота, колбу снабжают дистилляционной насадкой Кляйзена, прямым холодильником с вакуумным отводом и 5-л колбой-приемником, охлаждаемой на бане со смесью лед/вода. Реакционную смесь при перемешивании отгоняют под вакуумом (109-134 мм рт.ст.) до отметки в перегонной колбе 2,80 л при температуре 25-38 С. Дистиллят отбрасывают. Добавляют 3,00 кг (3000 мл) дистиллированной воды, очищенной азотом. Смесь при перемешивании отгоняют под вакуумом (113-187 мм рт.ст.) до отметки в перегонной колбе 2,80 л при температуре 35-50 С с образованием двухфазной смеси. Дистиллят (дистиллят А) отбрасывают согласно процедуре обработки отходов, описанной ниже. Теплую двухфазную смесь (3540 С) переносят в 4-л делительную воронку с использованием смывания 600 мл дистиллированной воды,очищенной азотом, и 0,5296 кг (600 мл) толуола. Твердое вещество, присутствующее в небольшом количестве на границе раздела фаз, отбрасывают. Водный слой последовательно экстрагируют толуолом (20,5196 кг, 2600 мл) и гептаном (0,5472 кг, 800 мл). Органические фазы (экстракт А) отбрасывают согласно процедуре обработки отходов, описанной ниже. К водному слою добавляют дистиллированную воду, очищенную азотом, в количестве, достаточном для достижения объема 3,60 л.- 14011451 Многогорловую 12-л колбу снабжают механической мешалкой, термометром и холодильником с вводом для азота. Колбу продувают азотом, и поддерживают в колбе атмосферу азота. Водный 3,60-л слой переносят в пустую 12-л колбу. Раствор при перемешивании в атмосфере азота охлаждают до 10-15 С на бане со смесью лед/вода. К раствору при перемешивании из 1000-мл капельной воронки с уравновешенным давлением добавляют по каплям 400 мл 12 N соляной кислоты, поддерживая температуру на уровне 10-15 С с помощью бани со смесью лед/вода, до достижения рН 3,50,2. Образуется небольшое количество осадка. Полученную суспензию фильтруют через слой целита на полипропиленовой ткани на 19-см воронке Бюхнера в 5-л многогорловую колбу, снабженную механической мешалкой, термометром, холодильником с вводом для азота и 1000-мл капельной воронкой с уравновешенным давлением. Фильтровальный слой промывают 300 мл дистиллированной воды, очищенной азотом. Фильтровальную воронку удаляют. Систему продувают азотом и снова сохраняют атмосферу азота. К раствору при перемешивании из капельной воронки добавляют 76 мл 10N раствора гидроксида натрия до достижения рН 9,60,2. Полученную суспензию кристаллического вещества охлаждают до 5-10 С и суспензию кристаллического вещества выдерживают при 0-5 С в течение примерно 1 ч. Твердое вещество собирают на полипропиленовой ткани на 19-см воронке Бюхнера. Остаток на фильтре промывают 3200 мл дистиллированной воды, очищенной азотом. Фильтрат отбрасывают. Многогорловую 12-л колбу снабжают механической мешалкой, термометром и холодильником с вводом для азота. Колбу продувают азотом и поддерживают в колбе атмосферу азота. В колбу загружают 3000 мл дистиллированной воды, очищенной азотом, и охлаждают до 15-20 С на бане со смесью лед/вода. Твердое вещество, собранное на полипропиленовой ткани, при перемешивании добавляют к воде в колбе и смесь перемешивают при 15-20 С до тех пор, пока не получат однородную суспензию(примерно 30 мин). Твердое вещество собирают на полипропиленовой ткани на 19-см воронке Бюхнера с использованием для полного переноса 600 мл дистиллированной воды, очищенной азотом. Остаток на фильтре промывают водой (3200 мл) и фильтруют. Поверх фильтра формируют перегородку из листа латексного каучука и включают вакуумный отсос из фильтровальной колбы примерно на 5 ч. Белое твердое вещество сушат в вакуумном сушильном шкафу при откачке масляным насосом при 80 С в течение примерно 18 ч. Твердое вещество измельчают и снова сушат, при необходимости, до постоянной массы. Выход составляет 90,7% (172,3 г) (анализ методом ВЭЖХ: степень чистоты (мас./мас.) 98,8%, примесей (за исключением неорганических) (мас./мас.) 0,046%, золы (неорганические вещества) (мас./мас.) 0,14%). Обработка отходов. Отходы, которые отбрасывают, содержат побочные продукты реакции, такие как трис(1 метилпропил)боран и трис(1-метилпропил)бороксин. Многогорловую 22-л или 50-л колбу снабжают механической мешалкой, термометром и холодильником с вводом для азота. Колбу продувают азотом с использованием клапана Файрестона (Firestone) и атмосферу азота в колбе сохраняют. Дистиллят А и экстракт А в атмосфере азота объединяют в колбе и получают двухфазную смесь(4,00 л с 400 мл нижней водной фазой). Включают мешалку и добавляют 600 мл 10N раствора гидроксида натрия и 600 мл воды. Добавляют по частям в течение примерно 20 мин суспензию тетрагидрата пербората натрия (1,848 кг, 12,01 моль, 3 экв. на моль трис(1-метилпропил)борана) в 12 л воды при охлаждении смесью лед/вода для поддержания температуры на уровне 28-38 С. После прекращения выделения тепла смесь перемешивают при 22-23 С в атмосфере азота в течение примерно 18 ч. Твердое вещество растворяется, и остаются две жидкие фазы. Мешалку останавливают и позволяют фазам разделиться. Верхнюю фазу проверяют методом газовой хроматографии/масс-спектрометрии для того, чтобы определить, можно ли еще обнаружить трис(1 метилпропил)боран или трис(1-метилпропил)бороксин. Если вещества детектируются, добавляют 80 г(0,52 моль) пербората натрия в виде суспензии в 400 мл воды и раствор перемешивают при 22-23 С в течение примерно 18 ч. Как только трис(1-метилпропил)боран и трис(1-метилпропил)бороксин в верхней фазе более не детектируются, водную фазу контролируют на ее окисляющую способность (например, изза присутствия пероксидов и избытка пербората натрия) с помощью иод-крахмальной бумаги. Затем фазы раствора разделяют. Верхний органический слой объединяют с другими органическими отходами синтеза, которые отбрасываются. Водный слой объединяют с другими водными отходами синтеза, которые отбрасываются. В приведенных ниже примерах 7-11 используют процедуры, описанные далее. Порошковая рентгенография. Анализы методом XRPD осуществляют на рентгеновском дифрактометре для порошков ShimadzuXRD-6000 с использованием Cu K излучения. Прибор снабжают рентгеновской трубкой с тонкой фокусировкой. Расхождение и рассеивающие диафрагмы находятся под углом 1, и приемную диафрагму устанавливают на 0,15 мм. Дифрагированное излучение детектируют сцинтилляционным детектором с NaI. Используют непрерывное сканирование -2 при 3/мин (0,4 с/шаг 0,02) для 2 от 2,5 до 40. Силиконовый эталон анализируют каждый день для проверки настройки прибора.- 15011451 В случаях, когда в ходе определения методом рентгеновской порошковой дифракции имеет место предпочтительная ориентация (см. ниже), сукцинат ODV иногда помещают между сложенными листами бумаги для взвешивания, затем его измельчают агатовым пестиком и снова анализируют методом XRPD. Термогравиметрический анализ (ТГА). Термогравиметрический анализ проводят на термогравиметрическом анализаторе ТА Instruments. Калибровочными стандартами являются никель и алюмель. Образец приблизительно в 8-20 мг помещают в лодочку, тщательно взвешивают и ставят в ТГ-печь. Образцы нагревают в атмосфере азота со скоростью 10 С/мин до конечной температуры 300 С. Производную массы (%/С) используют для определения общей потери массы при температурах от 40 С до температуры, при которой производная равна нулю (как правило, 150 С). Результаты ТГА для соединений примеров 8-12, приведенных ниже,показаны на фиг. 8. Дифференциальная сканирующая калориметрия. Анализы методом DSC осуществляют с использованием сканирующего калориметра 2920, ТА Instruments. Образец приблизительно в 3-5 мг помещают в кювету для DSC и точно взвешивают. Кювету закрывают герметично. Каждый образец нагревают в атмосфере азота со скоростью 10 С/мин до конечной температуры 250 С. В качестве калибровочного стандарта используют металлический индий. Приведенные температуры DSC находятся в максимумах перехода. Результаты DSC для соединений примеров 8, 9, 11 и 12, приведенных ниже, показаны на фиг. 6. Стеклование по DSC. Для исследования температуры стеклования (Tg) аморфного материала образец нагревают в атмосфере азота со скоростью 10 С/мин до конечной температуры 250 С. Кювету с образцом закрывают герметично. Пример 7. Получение формы I сукцината ODV. Многогорловую 5-л колбу, снабженную мешалкой, термометром и холодильником с вводом для азота, присоединенным к клапану Файрестона, помещают в нагревательный кожух. Систему продувают азотом и атмосферу азота сохраняют. В колбу загружают 1,668 кг (2111 мл) ацетона и 0,667 кг (667 мл) воды. Включают мешалку и добавляют 0,250 кг (0,949 моль) свободного основания O-десметилвенлафаксина (полученного так, как описывается в примере 6). Суспензию перемешивают в течение 30 мин. Добавляют 0,1155 кг (0,978 моль) янтарной кислоты и перенос завершают смыванием ацетоном(0,186 кг, 236 мл) и водой (0,075 кг, 75 мл). Суспензию перемешивают, нагревают до 60 С (3 С) и выдерживают при 60 С (3 С) при перемешивании в течение 30-60 мин. Получают прозрачный или мутный раствор. Затем смесь через фильтр, состоящий из полипропиленовой ткани с подслоем из фильтровальной бумаги, фильтруют в 5-л многогорловую колбу, снабженную механической мешалкой, термометром и холодильником с вакуумным патрубком. Фильтровальную воронку омывают теплой (50-60 С) смесью воды и ацетона (24:76, об./об., 427 мл). Систему продувают азотом и раствор охлаждают до 30-35 С, чтобы вызвать кристаллизацию. Суспензию кристаллического вещества при перемешивании выдерживают при указанной температуре в течение примерно 4 ч. Суспензию кристаллического вещества при перемешивании охлаждают до 0-5 С и выдерживают при указанной температуре в течение примерно 1 ч. Кристаллическое вещество собирают на фильтре из полипропиленовой ткани с подслоем из фильтровальной бумаги на 15-см воронке. Остаток на фильтре промывают холодной (0-5 С) смесью воды и ацетона(24:76, об./об., 2300 мл) и фильтруют в течение 5 мин. Поверх фильтра формируют перегородку из листа латексного каучука. Применяют отсос к остатку на фильтре в течение 1 ч. Масса остатка на фильтре составляет примерно 0,351 кг. Продукт реакции сушат в вакууме (50 мм рт.ст.) при 305 С в течение 12 ч. Затем продукт сушат в вакууме (50 мм рт.ст.) при 455 С в течение 24 ч.XRPD сукцината ODV показана на фиг. 1. Альтернативный способ получения формы I сукцината ODV. Многогорловую 5-л колбу, снабженную мешалкой, термометром и холодильником с вводом для азота, присоединенным к клапану Файрестона, помещают в нагревательный кожух. Систему продувают азотом и атмосферу азота сохраняют. В колбу загружают 1,651 кг (2090 мл) ацетона и 0,660 кг (660 мл) воды. Включают мешалку и добавляют 0,250 кг (0,949 моль) свободного основания O-десметилвенлафаксина (полученного так, как описывается в примере 6). Суспензию перемешивают в течение 30 мин. Добавляют 0,1155 кг (0,978 моль) янтарной кислоты. Суспензию перемешивают, нагревают до 60 С(3 С) и выдерживают при 60 С (3 С) при перемешивании в течение 30-60 мин. Затем смесь через фильтр, состоящий из целита на полипропиленовой ткани с подслоем из фильтровальной бумаги, фильтруют в 5-л многогорловую колбу, снабженную механической мешалкой, термометром и холодильником с вакуумным патрубком. Фильтровальную воронку омывают теплой (50-60 С) смесью воды и ацетона(24:76, об./об., 427 мл). Систему продувают азотом и раствор охлаждают до 30-35 С, чтобы вызвать кристаллизацию. Суспензию кристаллического вещества при перемешивании выдерживают при указанной температуре в течение примерно 4 ч. Суспензию кристаллического вещества охлаждают до 0-5 С и выдерживают при указанной температуре в течение примерно 1 ч. Кристаллическое вещество собирают на фильтре из полипропиленовой ткани с подслоем из фильтровальной бумаги на 15-см воронке. Остаток на- 16011451 фильтре промывают холодной (0-5 С) смесью воды и ацетона (24:76, об./об., 2300 мл) и фильтруют. Поверх фильтра формируют перегородку из листа латексного каучука. Применяют отсос к остатку на фильтре в течение 1 ч. Масса остатка на фильтре составляет примерно 0,351 кг. Продукт реакции сушат в вакууме (50 мм рт.ст.) при 305 С в течение 12 ч. Затем продукт сушат в вакууме (50 мм рт.ст.) при 455 С в течение 24 ч. Выход составляет 85,8% (325,2 г) (анализ методом ВЭЖХ: примеси (за исключением неорганических веществ (мас./мас.) 0,0%, зола (неорганические вещества) (мас./мас.) 0,0%, количество какой-либо отдельной примеси (мас./мас.) 0,01%). Пример 8. Получение формы II сукцината ODV. Форму II получают, растворяя 306,1 мг формы I в 200 мл ацетона, фильтруя раствор через нейлоновый круглый фильтр 0,2 мкм с последующим выпариванием фильтрата в вакууме на роторном испарителе при температуре окружающей среды.XRPD сукцината ODV показана на фиг. 2. Пример 9. Получение формы III сукцината ODV. Форму III получают с использованием двух разных способов измельчения. При первом способе измельчении с использованием шаровой мельницы - в цилиндр из нержавеющей стали с шаром отмеряют 290,2 мг формы I, закрытый контейнер помещают на Retsch Mixer и осуществляют измельчение в течение 5 мин при частоте перемещения 30/с. По окончании цикла используют шпатель для отделения материала от стенок. Процедуру повторяют три раза для достижения общего времени измельчения 20 мин. В другом методе - измельчение при низких температурах - 40,5 мг формы I загружают в цилиндр из нержавеющей стали со стержнем, затем закрытый контейнер помещают в дробилку SPEX Freezer, в которой с помощью жидкого азота поддерживают температуру -96 С. Материал измельчают в течение 2 мин при частоте перемещения 10/с (20 ударов с секунду), затем охлаждают в течение 2 мин. Процедуру повторяют два раза для достижения общего времени измельчения 6 мин.XRPD сукцината ODV показана на фиг. 3. Пример 10. Получение формы IV сукцината ODV. Форму IV получают следующим образом. Смесь равных количеств формы I и формы II загружают в насыщенный раствор сукцината ODV в ацетонитриле, профильтрованный через фильтр 0,2 мкм, при 54 С. Смесь энергично перемешивают в течение 8 суток. Суспензию фильтруют и извлеченное твердое вещество сушат на воздухе. Затем твердое вещество загружают в 2-драхмовый сцинтилляционный флакон и греют в течение 18 ч при 120 С.XRPD сукцината ODV показана на фиг. 4. Пример 11. Получение аморфной формы сукцината ODV. Аморфную форму сукцината OPV получают, загружая смесь 854,1 мг форм I и II в открытый 20-мл сцинтилляционный флакон и помещая затем флакон на масляную баню при 150 С примерно на 18 мин.XRPP сукцината ODV показана на фиг. 5. Согласно DSC начальная Tg имеет место при 18 С. Пример 12. Получение формы II сукцината ODV. В контейнер загружают 56 г О-десметилвенлафаксина, 26 г янтарной кислоты, 112 г ацетона и 112 г очищенной воды. Полученную суспензию греют при температуре образования флегмы (примерно 62 С) до тех пор, пока не образуется раствор. Раствор слегка охлаждают и загружают 1,2 г угля 2S. Раствор кипятят с обратным холодильником в течение примерно 15 мин. Раствор фильтруют через фильтр Seitz и остаток на фильтре промывают 5 г ацетона. Затем горячий раствор загружают в колбу, снабженную обратным холодильником. В верхней части холодильника создают вакуум. Раствор начинает кипеть и кристаллизуется. Раствор перемешивают. Вакуум применяют до тех пор, пока температура суспензии не достигнет 20 С. Раствор охлаждают до 5 С, помещая колбу на ледяную баню. Кристаллическое вещество извлекают фильтрацией с разрежением. Остаток на фильтре промывают смесью 11 г очищенной воды и 45 г ацетона. Через остаток на фильтре просасывают воздух в течение примерно 2 ч. Получают примерно 70 г сукцината ODV. Другой способ получения формы II сукцината ODV путем быстрой кристаллизации. В 2-л 4-горловую колбу загружают О-десметилвенлафаксин (75,0 г, 0,285 моль), ацетон (627 мл),янтарную кислоту (34,50 г, 0,29 моль) и воду (197,5 мл). Суспензию нагревают до 60 С и фильтруют через слой целита. Фильтровальный слой промывают теплой смесью ацетона (97 мл) и воды (30,6 мл). Фильтрат переносят в чистую 2-л колбу, смывая ацетоном (50 мл). Температура раствора 28 С. Раствор охлаждают, и при 23 С начинается кристаллизация. Затем смесь быстро охлаждают до 0-5 С на бане со смесью лед/вода. Смесь перемешивают при 0-5 С в течение 2 ч. Твердое вещество отделяют фильтрацией и промывают холодной смесью воды и ацетона (2200 мл, вода/ацетон 25:75, об./об.). Влажный остаток на фильтре сушат в вакуумном шкафу при 355 С (50 мм рт.ст.) в течение 48 ч и получают моногидрат сукцината ODV в виде белого кристаллического вещества (89,5 г, 78,7%). 1 Н ЯМР (300 МГц, ДМСО-d6) 10-9 (ушс, 2 Н), 7,00 (д, J=8,2 Гц, 2 Н), 6,65 (д, J=8,2 Гц, 2 Н), 3,4-3,2- 17011451 Пример 13. Испытание в тонкой кишке крысы. Метод перфузии кишечника крысы является прямым способом измерения свойств региональной абсорбции испытываемого соединения в желудочно-кишечном тракте. Коэффициент проникающей способности в кишечнике крысы (Peff) можно использовать для предсказания пероральной абсорбции пассивно поглощаемых соединений in vivo у человека. В работе Fagerholm, M. Johansson and Lennernas,"Comparision between permeability coefficients in rat and human jejunum", Pharm. Res., 13, 1996, 1336-1342,показана хорошая корреляция между Peff крысы и частью поглощенной дозы (Fa) человека для ряда соединений. Между тем, также можно оценить некоторые другие характеристики, например вводимую в композицию максимальную поглощаемую дозу (MAD), FDA Biopharmaceutical Classification, и т.п. Материалы. Буфер для перфузии содержит KCl (5,4 мМ), NaCl (48 мМ), Na2HPO4 (28 мМ), NaH2PO4 (43 мМ),маннит (35 мМ), полиэтиленгликоль (PEG) 4000 (0,1%, мас./об.), глюкозу (10 мМ). Величину рН доводят до 6,8 с помощью NaOH и доводят осмолярность до 290+10 мОсм/л 1,0 М раствором NaCl. Перед экспериментом добавляют 14C-PEG-4000 (0,02 мкКи/мл), 3 Н-маннит (0,025 мкКи/мл), метопролол (20 мкг/мл) и сукцинат или фумарат ODV (50 мкг/мл). Крысы, используемые в данном исследовании, являются самцами Charles River CD массой приблизительно 300-350 г. Эталонные соединения. Метопролол (хорошо адсорбируемое и пассивно транспортируемое соединение) используют в качестве стандарта и испытывают одновременно с соединениями ODV. Глюкозу (хорошо адсорбируемое и активно транспортируемое соединение) используют для контроля за физиологической функциональностью интестинальных барьеров. Меченный 14 С PEG-4000 используют в качестве непоглощаемого маркера для описания потока воды через интестинальную стенку. Меченый 3 Н маннит используют в качестве парацеллюлярно транспортируемого маркера как показатель целостности интестинальных плотных контактов. Аналитические методы. Все химикаты являются чистыми для анализа. После каждого эксперимента все анализы осуществляют незамедлительно. Для определения изотопов 0,5 мл образца перфузата, содержащего 14 С-PEG-4000 и 3 Н-маннит, смешивают с 5 мл сцинтилляционной смеси. Радиоактивность подсчитывают в жидкостном сцинтилляционном счетчике (Wallac 1409). Концентрацию глюкозы определяют глюкозооксидазным способом (Biochemistry Analyzer). Метопролол и соединения ODV анализируют методом ВЭЖХ/спектрометрии в УФ- и видимой области (НР-1100 с детектором с диодной матрицей) с использованием колонки 1504,6 мм с YMC AQ 120 мкм, 5 мкм, и подвижной фазы со ступенчатым градиентом,содержащей воду/0,1% ТФК и ацетонитрил. Соединения ODV и метопролол детектируют в УФ-области при длине волны 22 6 и 272 нм соответственно. Бесцветный перфузат анализируют для оценки интерференции в указанных условиях хроматографии. Перфузия тонкой кишки крысы in situ. Перфузию осуществляют в трех участках кишечника крыс, получивших наркоз: двенадцатиперстной кишке - тонкой кишке, подвздошной кишке и толстой кишке. Длина сегментов составляет приблизительно 10-12 см для сегментов тонкой кишки и 5-6 см для сегментов толстой кишки. В проксимальный конец вставляют подающую канюлю, а в дистальный конец вставляют отводящую канюлю. Перфузат прокачивают через сегмент со скоростью 0,19 мл/мин и собирают на 20, 40, 55, 70, 85 и 100 мин. Сукцинат или фумарат ODV добавляют в рабочий буфер для перфузии в концентрации 50 мкг/мл,что приблизительно эквивалентно 200 мг для человека. Скорости исчезновения соединения ODV, метопролола и глюкозы определяют для каждого интервала отбора путем сравнения с начальным раствором соединения, остающимся в шприце по истечении 100 мин. Это справедливо в случае любых потерь из-за соединения со шприцом или трубками. Между тем, концентрацию лекарственного средства в образцах перфузата корректируют на приток/отток воды, которые вычисляют на основании изменений концентрации 14C-PEG-4000. Анализ результатов. а. Извлечение и отделение воды. Извлечение 14C-PEG-4000 определяют для получения информации о целостности перфузированного сегмента кишечника.% PEGrec = (PEGout/PEGin)100 Вычисляют общее извлечение 14C-PEG-4000, и любые данные, для которых извлечение выходит за рамки интервала 96-103%, исключают из набора результатов. Величины ниже указанного интервала могут указывать на повреждение ткани, допускающей выход PEG-4000 из перфузированного сегмента, в то время как величины выше указанного интервала могут указывать на выход воды из сегмента. Движение воды сквозь стенку кишечника определяют, вычисляя чистую водную среду Чистая вода (NWF) = [(1-PEGout/PEGin)Q]/L,где PEGout и PEGin являются количеством радиоактивности (чрм, dpm) 14C-PEG-4000 со стороны входа и- 18011451 выхода перфузированного сегмента кишечника соответственно;Q представляет собой скорость потока перфузата;L представляет собой длину перфузированного сегмента, см.b. Вычисление Peff. Присутствие соединения ODV в перфузате определяют методом ВЭЖХ. Количество лекарственного средства, присутствующего в каждый момент времени, исправляют на движение воды через стенку кишечникаCout,испр = Cout (PEGin/PEGout),где Cout представляет собой концентрацию лекарственного средства на выходе перфузата;Cout,испр представляет собой концентрацию лекарственного средства на выходе перфузата, исправленную на движение воды в или из сегмента, определяемое по извлечению 14C-PEG-4000. Эффективную проникающую способность в кишечнике Peff (см/с) определяют с помощью уравненияPeff = [Q(Cin-Cout,испр)/Cin]2rL,где Q представляет собой скорость потока;Cin представляет собой концентрацию лекарственного средства на входе перфузата; 2rL представляет собой площадь внутренней поверхности перфузированного сегмента, где у крысы r принимают равным 0,18 см (см. G. Amidon, H. Lennernas, V. Shah, J. Crison, "A theoretical basis for aL представляет собой длину перфузированного сегмента, см.c. Поглощаемая часть (Fa). Поглощаемую часть дозы Fa для человека на сегодняшний день предсказывают по (Fagerholm M.,цит. выше)Fa = 100(1-e -(2 (Peff,крыса+)(tres/r,гдеиявляются поправочными коэффициентами,tres представляет собой время пребывания в тонкой кишке человека иr представляет собой радиус тонкой кишки человека.d. Максимальная поглощаемая доза (MAD). Максимальную поглощаемую дозу MAD у людей можно вычислить как где ka представляет собой константу скорости поглощения первого порядка,tres представляет собой время пребывания в тонкой кишке человека;r представляет собой радиус тонкой кишки человека иV0 представляет собой оцененный объем жидкости, присутствующей в желудочно-кишечном тракте. См. Johnson K.С., Swindell А.С., "Guidance in setting of drug particle size specifications to minimize variability in absorption", Pharm. Res., 13(2), 1996, 1795-1798). Результаты. Устойчивость в жидкости тонкой кишки. Устойчивость сукцината или фумарата ODV в растворах чистого буфера для перфузии (Р) и жидкостях тонкой кишки (буфер для перфузии, собранный промыванием выделенного сегмента тонкой кишки, рН 6,8) определяют при 37 С за время до 6 ч. Результаты показывают, что видимые разрушение/метаболизм двух таких форм солей в указанных условиях испытания не очевидны. Результаты для сукцината ODV приводятся ниже в табл.7. Подобные результаты получают и для фумарата ODV. Таблица 7- Данные являются относительным сохранением, в процентах (%), площади пика ВЭЖХ в различные моменты времени по сравнению со временем ноль 2- Общая концентрация белка приблизительно 0,2 мг/мл.- 19011451 Результаты перфузии тонкой кишки крысы. Сайт-специфическое поглощение сукцината ODV. Величины Peff для сукцината ODV в тонкой кишке (0,9120,06710-5 см/с в двенадцатиперстнойтонкой кишке, 1,730,2210-5 см/с в подвздошной кишке) ниже величин Peff для метопролола. Найдено,что величина Peff для сукцината ODV в толстой кишке составляет 0,0620,03110-5 см/с, что соответствует примерно 10% от величины Peff для метопролола в толстой кишке. Оказывается, что сегмент подвздошной кишки является наилучшим местом для поглощения сукцината ODV. Найдено, что отношениеPeff в двенадцатиперстной-тонкой кишке к Peff в подвздошной кишке к Peff в толстой кишке составляет 1,00:1,90:0,07, что указывает, что участки тонкой кишки двенадцатиперстная кишка, тонкая кишка и подвздошная кишка являются преимущественными для перорального поглощения данного соединения(90%) в случае лекарственной формы IR (Dongzhou Liu, S. Ng, R. Saunders, "Effect of Polysorbate 80 onin vivo", цит. по PharmSci., 3(4), 2001). На основании полученного экспериментального Peff предсказывается, что Fa сукцината ODV invivo для человека находится в интервале 60-77% в тонкой кишке и составляет 20% в толстой кишке, как видно на фиг. 9 и 10 и в табл. 8, приведенной ниже. Носителем для доставки является буфер для перфузии (рН 6,8). Испытание поглощения в каждом участке повторяют на 3 крысах, и величины Peff усредняют. Таблица 8 Данные перфузии сукцината ODV (50 мкг/мл) для крыс Оцениваемую максимальную поглощаемую дозу (MAD) получают на основе данных для крыс.MAD сукцината ODV во всем желудочно-кишечном (GI) тракте (человек) оценивают как равную примерно 8,6 г, что представляет собой сумму 2236 мг, поглощаемых в двенадциатиперстной-тонкой кишке,5629 мг, поглощаемых в подвздошной кишке, и 683 мг, поглощаемых в толстой кишке. Сайт-специфическое поглощение фумарата ODV. Сайт-специфическое поглощение фумарата ODV исследуют в тех же условиях, в каких исследуют поглощение сукцината ODV (50 мкг/мл в буфере для перфузии, рН 6,8). Испытание на поглощение в каждом участке повторяют на 3 крысах (за исключением тонкой кишки, где испытания проводят только на 2 крысах) и величины Peff усредняют. Результаты показаны ниже в табл.9 и на фиг. 11, 12 и 13. Таблица 9 Данные перфузии фумарата ODV (50 мкг/мл) для крыс В целом, результаты показывают, что в GI тракте крысы фумарат ODV абсорбируется в меньшей- 20011451 степени, чем сукцинат ODV. В тонкой кишке величины Peff фумарата (0,24-0,6810-5 см/с) составляют только примерно 2740% от величин Peff для сукцината ODV. В толстой кишке не обнаружено поддающееся измерению поглощение фумарата ODV. Находят, что Fa фумарата ODV in vivo находится в интервале 33-45% в тонкой кишке и равна 0 в толстой кишке, что указывает на общее низкое поглощение данного соединения во всем GI тракте. Предсказывают, что MAD равна примерно 440 мг. Результаты по сайт-специфическому поглощению в кишечнике сукцината ODV и фумарата ODV показывают, что в тонкой кишке и толстой кишке сукцинат ODV поглощается лучше, чем фумарат ODV. В некоторых публикациях демонстрируется, что существует хорошая корреляция между крысиной моделью перфузии и поглощением in vivo у человека (см., например, Doungzhou Liu, S. Ng, R. Saunders, "Investigating Intestinal Uptake of Zaleplon in site and Simulating/Predicting Oral Absorption in vivo", цит. вPharmSci., 3(4), 2001). Пример 14. Биологическая доступность О-десметилвенлафаксина, испытания на коротконогих гончих. Испытываемые композиции. Получают раствор для внутривенного введения, содержащий 25 мг/мл формы I сукцината ODV,смешивая 3,8168 г (2,5%, мас./об.) сукцината ODV с количеством воды для инъекций, USP, достаточным для получения 100 мл раствора. Получают раствор для перорального введения, содержащий 25 мг/мл формы I сукцината ODV,смешивая 3,8170 г (2,5%, мас./об.) сукцината ODV с количеством воды для инъекций, USP, достаточным для получения 100 мл раствора. Перед введением пероральный раствор (25 мг/мл) разбавляют водой до концентрации 7,5 мг/мл. Таблетки, каждая из которых содержит ингредиенты, перечисленные ниже в таблице, получают способом, описанным в примере 15 для получения содержащей сукцинат ODV композиции 2. Капсулы (HGC, размер 0), каждая из которых содержит ингредиенты, перечисленные ниже в таблице, получают способом, описанным в примере 15 для получения содержащей сукцинат ODV композиции 1. Доступна от FMC BioPolymer, Филадельфия, Пенсильвания. Исследования на животных. В данном исследовании используют шесть самцов коротконогой гончей с массой тела, колеблющейся от 10,2 до 16,0 кг. Собак содержат в помещении и предоставляют свободный доступ к воде и корму. Схема исследования. Шесть собак получают лекарственное средство на протяжении 4 периодов исследования. В период I собаки получают 1 мл раствора для внутривенного введения. В период 2 собаки получают 10 мл раствора для перорального введения. В период 3 собаки получают таблетку. В период 4 собаки получают капсулу. Промежуток между первыми двумя периодами обработки составляет одну неделю и один месяц между периодами обработки 2 и 3. Между периодами 3 и 4 промежуток составляет одну неделю. В случае периодов 1 и 2 всех собак выдерживают без корма в течение ночи при свободном доступе к воде и кормят- 21011451 через 4 ч после взятия крови. В случае периодов 3 и 4 всех собак кормят за 30 мин до введения лекарственного средства при свободном доступе к воде. Образцы крови. В периоды 1 и 2 образцы крови берут из яремной вены в точках 0 (перед введением лекарственного средства), 0,05 (только в случае внутривенного введения) и 0,13 (только в случае внутривенного введения), 0,25, 0,5, 1, 1,5, 2, 3, 4, 8, 12, 24, 32 и 48 ч после введения лекарственного средства в 5 мл гепаринизированные откаченные емкости и сразу же помещают на лед. В периоды 3 и 4 образцы крови берут из яремной вены в точках 0 (перед введением лекарственного средства), 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 12, 16,24 и 32 ч после введения лекарственного средства в 5 мл гепаринизированные откаченные емкости и сразу же помещают на лед. Плазму отделяют на центрифуге с охлаждением и хранят при -70 С. Затем образцы плазмы анализируют. Анализ образцов. Концентрации О-десметилвенлафаксина в плазме определяют методом ВЭЖХ с использованием масс-спектрометрической детекции, описанным в работе Hicks D.R., Wolaniuk D., Russel A., Cavanaughvenlafaxine and O-desmethylvenlafaxine in biological fluids", Ther. Drug Monit., 16:100-107 (1994), включенной в данное описание в качестве ссылки. Основанный на объеме образца 0,2 мл, метод имеет предел определения количества O-десметилвенлафаксина в 5,05 нг/мл. Общее содержание Oдесметилвенлафаксина определяют после инкубации 0,2 мл образцов плазмы в -глюкуронидазе в течение 18 ч. Содержание O-десметилвенлафаксинглюкуронида определяют, вычитая концентрации Одесметилвенлафаксина (процедура разделения экстракцией без применения -глюкуронидазы и анализ методом ВЭЖХ-M.-с.) из общих концентраций О-десметилвенлафаксина. Анализ результатов. Некомпартментальные фармакокинетические параметры вычисляют из кривых зависимости концентрации O-десметилвенлафаксина и О-десметилвенлафаксинглюкуронида в плазме от времени для каждой собаки. Площадь под кривыми зависимости концентрации в плазме от времени (AUC0-) вычисляют, складывая AUCLast (AUCLast = линейная формула трапеций от времени 0 до последней поддающейся измерению концентрации в плазме CPLast) и CPLast/лямбда. Величины лямбда определяют из протяженного линейного участка заключительного наклона кривой зависимости концентрации Одесметилвенлафаксина и O-десметилвенлафаксинглюкуронида в плазме от времени после внутривенного введения лекарственного средства. Период полувыведения (thalf) вычисляют как thalf = 0,693/лямбда. Пик концентрации в плазме (Cmax) и время достижения Cmax (tmax) отмечают непосредственно из кривых зависимости концентрации в плазме от времени. Абсолютную биологическую доступность определяют, сравнивая нормализованные по дозе величины AUC0- после внутривенного введения. Результаты. Все концентрации, сообщенные как нижний предел количества (BLQ), при вычислениях принимают за нули. Результаты биологических анализов показывают, что содержание Oдесметилвенлафаксинглюкуронида ответственно за основную часть общего количества О-десметилвенлафаксина в кровотоке после введения сукцината ODV. На основании общего содержания О-десметилвенлафаксина поглощение О-десметилвенлафаксина и сукцината ODV из пероральной композиции завершается, по существу, с абсолютной биологической доступностью в 121, 103 и 76% из композиции в виде перорального раствора, капсулы и таблетки соответственно. Средние (%CV) параметры биологической доступности сукцината ODV- 22011451 Средние (%CV) параметры биологической доступности сукцината ODV для коротконогих гончих, выраженные в содержании глюкуронида ODV Средние (%CV) параметры биологической доступности сукцината ODV для коротконогих гончих (n=6), выраженные в общем содержании ODV Пример 15. Пациентам (18 человек) дают по 75 мг каждого лекарственного средства из числа эффексора XR (композиция с венлафаксином) (доступна от Wyeth-Ayerst Pharmaceuticals of St. Davids,PA), композиции 1 с сукцинатом ODV и композиции 2 с сукцинатом ODV в три разные периода. Композиция 1, представляющая собой капсулу, указывается в таблице ниже. Композиция 1 с сукцинатом ODV Композицию 1 с сукцинатом ODV получают следующим образом. Сукцинат ODV просеивают через сито 400 мкм и в сухом состоянии смешивают с лактозой и микрокристаллической целлюлозой в смесителе с большими сдвиговыми усилиями. Полученную смесь гранулируют в мокром состоянии в- 23011451 смесителе с большими сдвиговыми усилиями с очищенной водой и сушат в сушильном шкафу или в сушилке с псевдоожиженным слоем. Смесь смешивают со стеаратом магния и заполняют ею капсулы Композицию 2 с сукцинатом ODV получают следующим образом. Сукцинат ODV просеивают через сито 400 мкм и в сухом состоянии смешивают с НРМС, микрокристаллической целлюлозой и тальком в смесителе с большими сдвиговыми усилиями. Затем смесь гранулируют в мокром состоянии с очищенной водой и сушат в сушильном шкафу или в сушилке с псевдоожиженным слоем. Полученную смесь смешивают со стеаратом магния и смесь снова перемешивают. Затем смесь прессуют в таблетку. Все дозы лекарственных средств вводят после потребления пациентами стандартного завтрака со средним содержанием жиров. Образцы крови берут через 0,5, 1, 2, 4, 6, 8, 12, 16, 20, 24, 28, 36, 48 и 72 ч после введения. Концентрации в плазме венлафаксина и О-десметилвенлафаксина в каждом образце крови определяют способом, описанным в работе Hicks D.R., Wolaniuk D., Russel A., Cavanaugh N., KramiO-desmethylvenlafaxine in biological fluids", Ther. Drug Monit., 16:100-107 (1994), включенной в данное описание в качестве ссылки. Результаты показаны ниже в таблице. Содержание венлафаксина в плазме Так как композиции 1 и 2 с сукцинатом ODV венлафаксин не содержат, его содержание в плазме после введения указанных композиций равно нулю. Концентрации О-десметилвенлафаксина в плазме Таблица, приведенная ниже, показывает количество людей, которые испытывают различные побочные действия после введения отдельных доз композиций с сукцинатом ODV1 и 2. Не вдаваясь в теорию, предполагается, что вредные действия, наблюдаемые в связи с композицией 1, соотносятся с пиком содержания в плазме крови и/или tmax указанной композиции. При сглаживании кривой, как в случае композиции с замедленным высвобождением композиции 2, пиковое содержание в плазме крови снижается и tmax отодвигается. Таким образом, у пациентов при сглаживании кривой зависимости концентрации в плазме крови от времени достигается уменьшение или устранение вредного действия. Таким образом, фармацевтическая композиция, представляющая собой композицию с замедленным высвобождением сукцината ODV с пиком кривой содержания в плазме крови в менее примерно 225 нг/мл, будет обладать уменьшенным побочным действием, таким как тошнота или рвота. Вредное действие после введения однократной дозы композиции с сукцинатом ODV1 и 2 Настоящее изобретение не ограничивается в объеме конкретными воплощениями, описанными в описании. Действительно, различные модификации изобретения, кроме описанных в описании, будут очевидны для специалистов в данной области техники из приведенного выше описания и прилагаемых фигур. Подразумевается, что такие модификации входят в объем прилагаемой формулы изобретения. Следует также иметь в виду, что величины являются приблизительными и приводятся для описания. Патенты, заявки на патенты, публикации, методики и т.п., цитированные в данной заявке, включены в нее в качестве ссылок. В рамках возможного конфликта между описанием и ссылкой язык данного описания осуществляет регулирование. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой сукцинат O-десметилвенлафаксина или его смешанную соль. 2. Соединение по п.1, где отношение О-десметилвенлафаксина к янтарной кислоте составляет 1:1.- 25011451 3. Соединение по п.1, где отношение О-десметилвенлафаксина к янтарной кислоте составляет 2:1. 4. Соединение по любому из пп.1-3, представляющее собой гидрат сукцината Одесметилвенлафаксина. 5. Соединение по п.1, представляющее собой моногидрат сукцината О-десметилвенлафаксина. 6. Соединение по любому из пп.1-5, где соль является кристаллическим веществом. 7. Соединение по п.6, демонстрирующее рентгеновскую порошковую дифрактограмму для формы I сукцината ODV с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 10,20, 14,91,20,56, 22,13, 23,71, 24,60 и 25,79. 8. Соединение по п.6, где соединение представляет собой форму I сукцината ODV с эндотермическим пиком при примерно 131 С. 9. Соединение по п.6, где соединение представляет собой форму I сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, какая показана на фиг. 1. 10. Соединение по п.6, где соединение представляет собой форму II сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 13,18, 14,04, 14,35, 14,66, 16,68, 17,67, 19,24, 25,13 и 31,78. 11. Соединение по п.8, где соединение представляет собой форму II сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 10,25, 13,18, 14,04, 14,35, 14,66, 16,68, 17,67, 19,24, 20,38, 20,56, 23,41, 23,78,24,57, 25,13, 25,80 и 31,78. 12. Соединение по п.6, где соединение представляет собой форму II сукцината ODV с эндотермическим пиком при примерно 127 С. 13. Соединение по п.6, где соединение представляет собой форму II сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, как показана на фиг. 2. 14. Соединение по п.6, где соединение представляет собой форму III сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 13,74, 22,55 и 32,42. 15. Соединение по п.14, где соединение представляет собой форму III сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 10,36, 13,74, 14,40, 14,68, 14,96, 16,75, 17,48, 17,76, 19,26, 20,42, 20,74, 22,55,23,58, 23,82, 24,92, 26,00, 31,86 и 32,42. 16. Соединение по п.6, где соединение представляет собой форму III сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, какая показана на фиг. 3. 17. Соединение по п.6, где соединение представляет собой форму IV сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 11,29, 17,22, 19,64, 20,91, 21,61, 28,86, 29,80, 30,60, 36,85 и 37,70. 18. Соединение по п.17, где соединение представляет собой форму IV сукцината ODV, демонстрирующее рентгеновскую порошковую дифрактограмму с характеристическими пиками, выраженными в градусах 2 (0,2 2), при 10,46, 11,29, 13,69, 14,48, 15,17, 16,62, 17,22, 17,61, 19,22, 19,64, 20,91, 21,61,22,55, 23,84, 24,77, 25,34, 25,92, 26,40, 28,86, 29,80, 30,60, 33,17, 36,85 и 37,70. 19. Соединение по п.6, где соединение представляет собой форму IV сукцината ODV с эндотермическим пиком при 145 С. 20. Соединение по п.6, где соединение представляет собой форму IV сукцината ODV, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, как показана на фиг. 4. 21. Соединение по п.1, представляющее собой аморфное вещество. 22. Соединение по п.21 с начальной Tg при 18 С. 23. Соединение по п.1, имеющее рентгеновскую порошковую дифрактограмму, по существу, такую же, какая показана на фиг. 5. 24. Соединение по п.1, имеющее растворимость в воде по меньшей мере 30 мг/мл при 25 С. 25. Фармацевтическая композиция, содержащая сукцинат O-десметилвенлафаксина или его смешанную соль, определенный по любому из пп.1-24, и фармацевтически приемлемый носитель или эксципиент. 26. Фармацевтическая композиция по п.25, кроме того содержащая венлафаксин или его фармацевтически приемлемую соль. 27. Фармацевтическая лекарственная форма, содержащая терапевтически эффективное количество сукцината O-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24, и фармацевтически приемлемый носитель или эксципиент. 28. Пероральная лекарственная форма, содержащая терапевтически эффективное количество сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24, и фармацевтически приемлемый носитель или эксципиент. 29. Пероральная лекарственная форма по п.28, представляющая собой таблетку или капсулу. 30. Пероральная лекарственная форма по п.28 или 29, представляющая собой композицию с замед- 26011451 ленным высвобождением. 31. Пероральная лекарственная форма по п.28, кроме того содержащая полимерный материал, регулирующий скорость высвобождения.32. Пероральная лекарственная форма по п.31, где регулирующий скорость высвобождения полимерный материал выбирают из гидроксиалкилцеллюлозы, полиэтиленоксидов, алкилцеллюлозы, карбоксиметилцеллюлозы гидрофильных производных целлюлозы и полиэтиленгликоля. 33. Пероральная лекарственная форма по п.31 или 32, содержащая примерно от 30 до примерно 50 мас.% сукцината O-десметилвенлафаксина и примерно от 40 до примерно 70 мас.% полимерного материала, регулирующего скорость высвобождения, относительно 100% общей массы пероральной лекарственной формы. 34. Пероральная лекарственная форма по п.31 или 32, содержащая примерно от 32 до примерно 44 мас.% сукцината O-десметилвенлафаксина и примерно от 45 до примерно 66 мас.% полимерного материала, регулирующего скорость высвобождения, относительно 100% общей массы пероральной лекарственной формы. 35. Пероральная лекарственная форма по любому из пп.28-34, также содержащая связующее вещество. 36. Пероральная лекарственная форма по п.35, где связующее вещество представляет собой микрокристаллическую целлюлозу. 37. Способ лечения пациента, страдающего от депрессии, включающий предоставление пациенту,нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 38. Способ лечения пациента, страдающего от тревоги, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли по любому из пп.1-24. 39. Способ лечения пациента, страдающего от панического расстройства, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 40. Способ лечения пациента, страдающего от расстройства генерализованной тревоги, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината Oдесметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 41. Способ лечения пациента, страдающего от посттравматического стрессового расстройства,включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината Одесметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 42. Способ лечения пациента, страдающего от предменструального дисфорического расстройства,включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината Одесметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 43. Способ лечения пациента, страдающего от расстройства, выбранного из числа фибромиалгии,агорофобии, дефицита внимания, обсессивно-компульсивного расстройства, социальной тревоги, аутизма, шизофрении, ожирения, нервно-психической анорексии, нервно-психической булемии, синдрома Жиль де ла Туретта, вазомоторного прилива крови, кокаиновой и алкогольной зависимости, половой дисфункции, пограничного личностного расстройства, синдрома хронической усталости, недержания мочи, боли, синдрома Шая-Дрейджера, синдрома Рейно, болезни Паркинсона и эпилепсии, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината Одесметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 44. Способ усиления познавательной способности или лечения ухудшения познавательной способности у пациента, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 45. Способ отказа от курения или других применений табака у пациента, включающий предоставление пациенту, нуждающемуся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 46. Способ лечения гипоталамической аменореи у женщины в состоянии депрессии или вне такого состояния, включающий предоставление женщине, нуждающейся в этом, эффективного количества сукцината О-десметилвенлафаксина или его смешанной соли, определенного по любому из пп.1-24. 47. Способ снижения частоты появления тошноты, рвоты, диареи, боли в животе, головной боли,вазовагального недомогания или тризма, появляющихся в результате перорального введения пациенту сукцината О-десметилвенлафаксина, включающий пероральное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества пероральной лекарственной формы с замедленным высвобождением, содержащей сукцинат O-десметилвенлафаксина или его смешанную соль, определенный по любому из пп.1-24, обеспечивающей содержание O-десметилвенлафаксина или его смешанной соли в плазме крови не более 225 нг/мл. 48. Способ получения О-десметилвенлафаксина, включающий стадию деметилирования венлафаксина или его соли триалкилборогидридом щелочного металла.- 27011451 49. Способ по п.48, где каждая алкильная группа в триалкилборогидриде представляет собой, независимо, (C1-C6)-алкил. 50. Способ по п.49, где триалкилборогидрид щелочного металла выбирают из L-селектрида, Kселектрида, триэтилборогидрида лития, триэтилборогидрида калия и их смесей. 51. Способ по п.48, где триалкилборогидрид щелочного металла представляет собой L-селектрид. 52. Способ по любому из пп.48-51, где стадию деметилирования (b) осуществляют при температуре от примерно 60 до примерно 140 С. 53. Способ по любому из пп.48-52, дополнительно включающий стадию превращения Одесметилвенлафаксина в сукцинат O-десметилвенлафаксина. 54. Способ по любому из пп.48-53, включающий стадию дезактивирования любых боросодержащих побочных продуктов, образовавшихся при реакции деметилирования. 55. Способ по п.54, где стадия дезактивирования включает окисление боросодержащих побочных продуктов. 56. Способ по п.55, где стадия окисления включает взаимодействие боросодержащих побочных продуктов с окислителем, выбранным из пероксида водорода, пербората натрия и их смесей. 57. Способ по п.55, где стадия окисления включает добавление боросодержащих побочных продуктов к окислителю или раствору, содержащему окислитель. 58. Способ получения О-десметилвенлафаксина, включающий стадии:(a) деметилирования венлафаксина или его соли триалкилборогидридом щелочного металла с образованием соли щелочного металла О-десметилвенлафаксина и(b) превращение соли щелочного металла O-десметилвенлафаксина в свободное основание Oдесметилвенлафаксина. 59. Способ по п.58, где стадия (b) включает нейтрализацию соли щелочного металла Одесметилвенлафаксина кислотой. 60. Способ по п.58 или 59, также включающий стадию (с) превращения свободного основания Одесметилвенлафаксина в сукцинат О-десметилвенлафаксина. 61. Способ по любому из пп.58-60, где венлафаксин на стадии (а) представляет собой свободное основание. 62. Фармацевтический состав с замедленным высвобождением, содержащий сукцинат Одесметилвенлафаксина и фармацевтически приемлемый носитель или эксципиент, обеспечивающий максимальное содержание лекарственного средства в сыворотке крови до 225 нг/мл. 63. Способ получения соединения, определенного по любому из пп.1-24, включающий взаимодействие янтарной кислоты или ее фармацевтически приемлемой соли моносукцината со свободным основанием О-десметилвенлафаксином, причем по меньшей мере один реагент из указанных кислоты и основания находится в растворе, и, при необходимости, превращение образовавшейся соли моносукцината в смешанную фармацевтически приемлемую соль. 64. Способ по п.63, включающий дополнительную стадию добавления антирастворителя в случае получения раствора моногидрата моносукцината О-десметилвенлафаксина с осаждением формы II моносукцината О-десметилвенлафаксина. 65. Способ по п.63, дополнительно включающий стадию охлаждения водного или в смеси вода/ацетон раствора моносукцината О-десметилвенлафаксина с применением вакуума, и/или ледяной бани, и/или бани со смесью лед/вода с образованием формы II моносукцината О-десметилвенлафаксина. 66. Способ по п.63, дополнительно включающий стадию выдержки аморфной формы сукцината Одесметилвенлафаксина в атмосфере с относительной влажностью 75% или выше с образованием формыII моносукцината О-десметилвенлафаксина. 67. Способ получения соединения, определенного по любому из пп.1-24, включающий растворение свободного основания O-десметилвенлафаксина и янтарной кислоты в смеси воды и ацетона и охлаждение полученного раствора в течение примерно 3 ч или более с образованием формы I моносукцината Oдесметилвенлафаксина. 68. Способ по п.67, дополнительно включающий стадию выпариванивания раствора формы I моносукцината O-десметилвенлафаксина, растворенного в ацетоне, с образованием формы II моносукцината О-десметилвенлафаксина. 69. Способ по п.67, дополнительно включающий стадию охлаждения либо насыщенного раствора в ацетоне, либо раствора в смеси этанол:вода, 95:5, об./об., формы I моносукцината Oдесметилвенлафаксина с образованием формы II моносукцината O-десметилвенлафаксина. 70. Способ по п.67, дополнительно включающий стадию выпаривания раствора формы I моносукцината O-десметилвенлафаксина в воде с образованием формы II моносукцината Одесметилвенлафаксина. 71. Способ по п.67, дополнительно включающий стадию выпаривания раствора формы I моносукцината O-десметилвенлафаксина в ацетонитриле, или смеси этанол/гексан, или смеси этанол/хлороформ с образованием формы II моносукцината O-десметилвенлафаксина. 72. Способ получения соединения, определенного по любому из пп.1-24, включающий получение(i) форму I моносукцината О-десметилвенлафаксина,(ii) форму II или форму III моносукцината O-десметилвенлафаксина или их смесь и(iii) ацетон, ацетонитрил, смесь ацетонитрила и воды или смесь этанола и толуола при температуре окружающей среды; и извлечение кристаллической формы I моносукцината O-десметилвенлафаксина с последующим необязательным измельчением с использованием шаровой мельницы с образованием формы III моносукцината О-десметилвенлафаксина. 73. Способ по п.72, где измельчение осуществляют при низких температурах формы I сукцината Одесметилвенлафаксина с образованием формы III моносукцината О-десметилвенлафаксина. 74. Способ получения соединения, определенного по любому из пп.1-24, включающий суспендирование равных количеств форм I и II сукцината О-десметилвенлафаксина в ацетонитриле при повышенной температуре (например, при примерно 54 С) в течение нескольких суток (например, восьми суток),отфильтровывание и нагревание полученного твердого вещества для получения формы IV моносукцината О-десметилвенлафаксина. 75. Способ получения соединения, определенного по любому из пп.1-24, включающий нагревание форм I, II, III или IV сукцината О-десметилвенлафаксина или их смеси с образованием расплава и охлаждение расплава с образованием аморфного сукцината O-десметилвенлафаксина в виде стеклообразного вещества. 76. Способ по п.63, в котором используют водный растворитель и продукт реакции выделяют в виде гидрата.
МПК / Метки
МПК: A61P 25/00, A61P 13/00, C07C 215/64, A61K 31/137
Метки: о-десметилвенлафаксина, сукцинат, соль, новая
Код ссылки
<a href="https://eas.patents.su/30-11451-novaya-sol-sukcinat-o-desmetilvenlafaksina.html" rel="bookmark" title="База патентов Евразийского Союза">Новая соль сукцинат о-десметилвенлафаксина</a>
Предыдущий патент: Гуманизированный иммуноглобулин, который специфически связывается с бета-амилоидным пептидом, и способы его применения
Следующий патент: Способы приготовления выпечного продукта, используемые для этого композиции и выпечной продукт
Случайный патент: Тетрагидропиразоло[1,5-a]пиридопиримидины - антагонисты серотониновых 5-нт6 рецепторов, способы их получения и применения