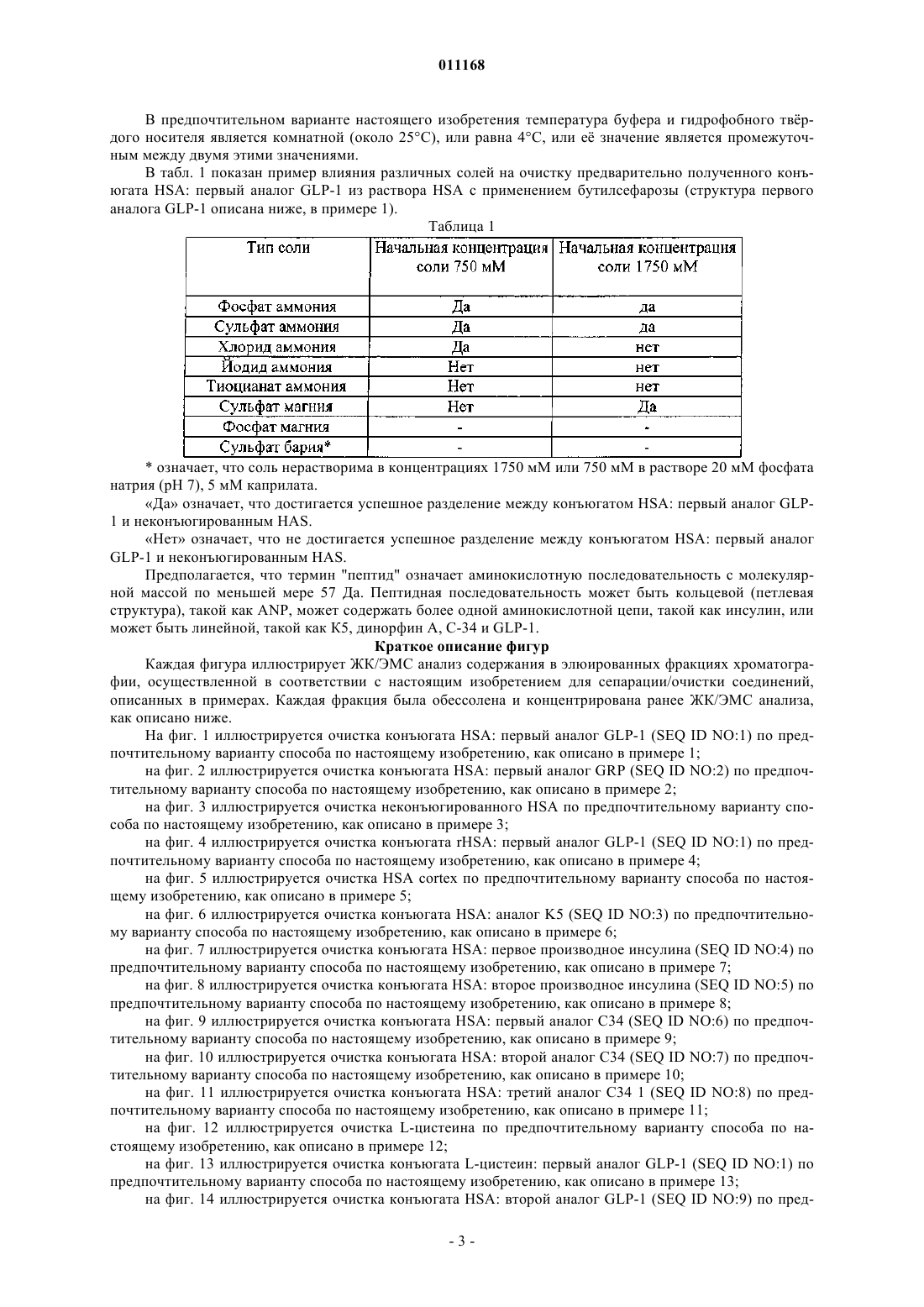
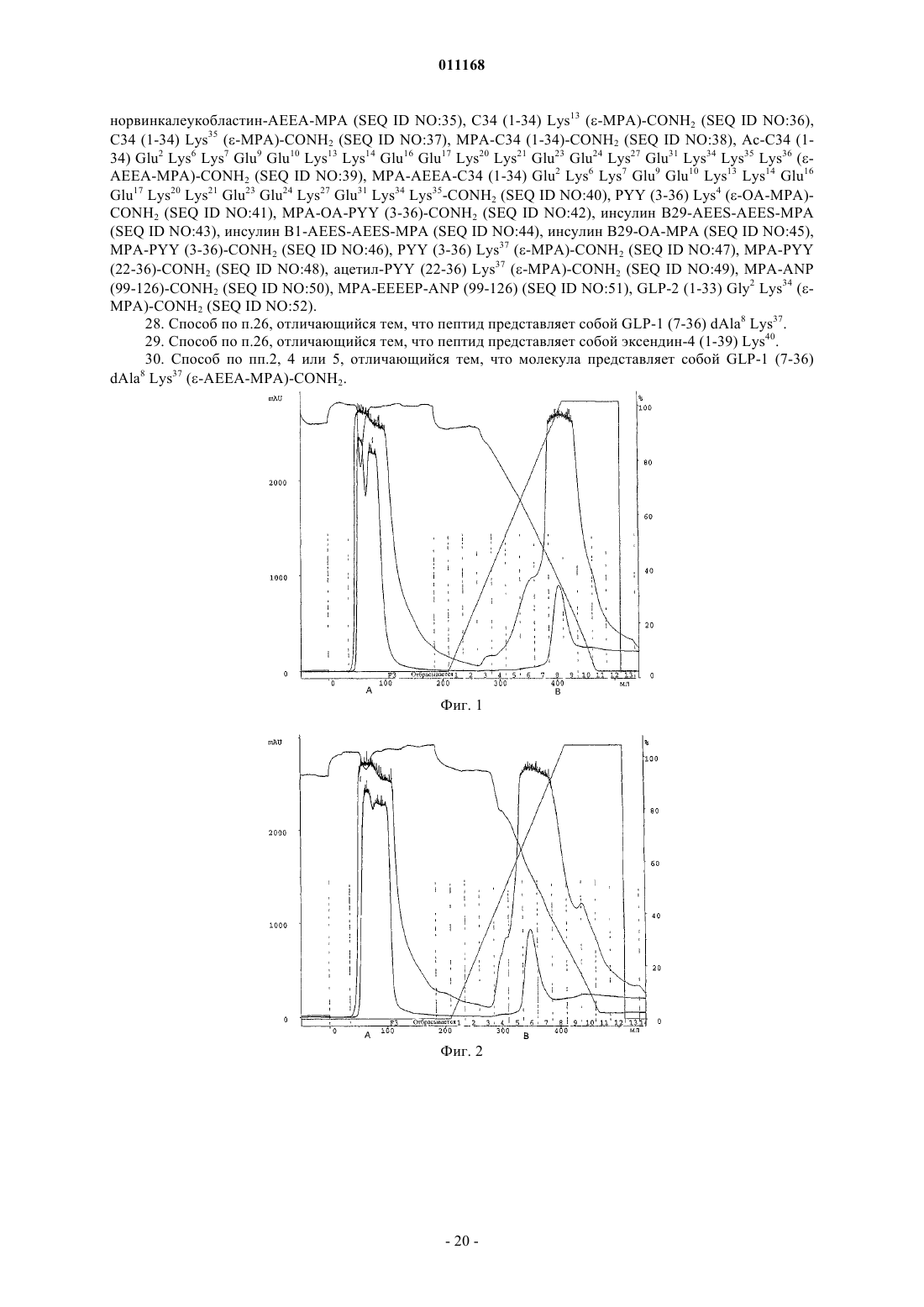
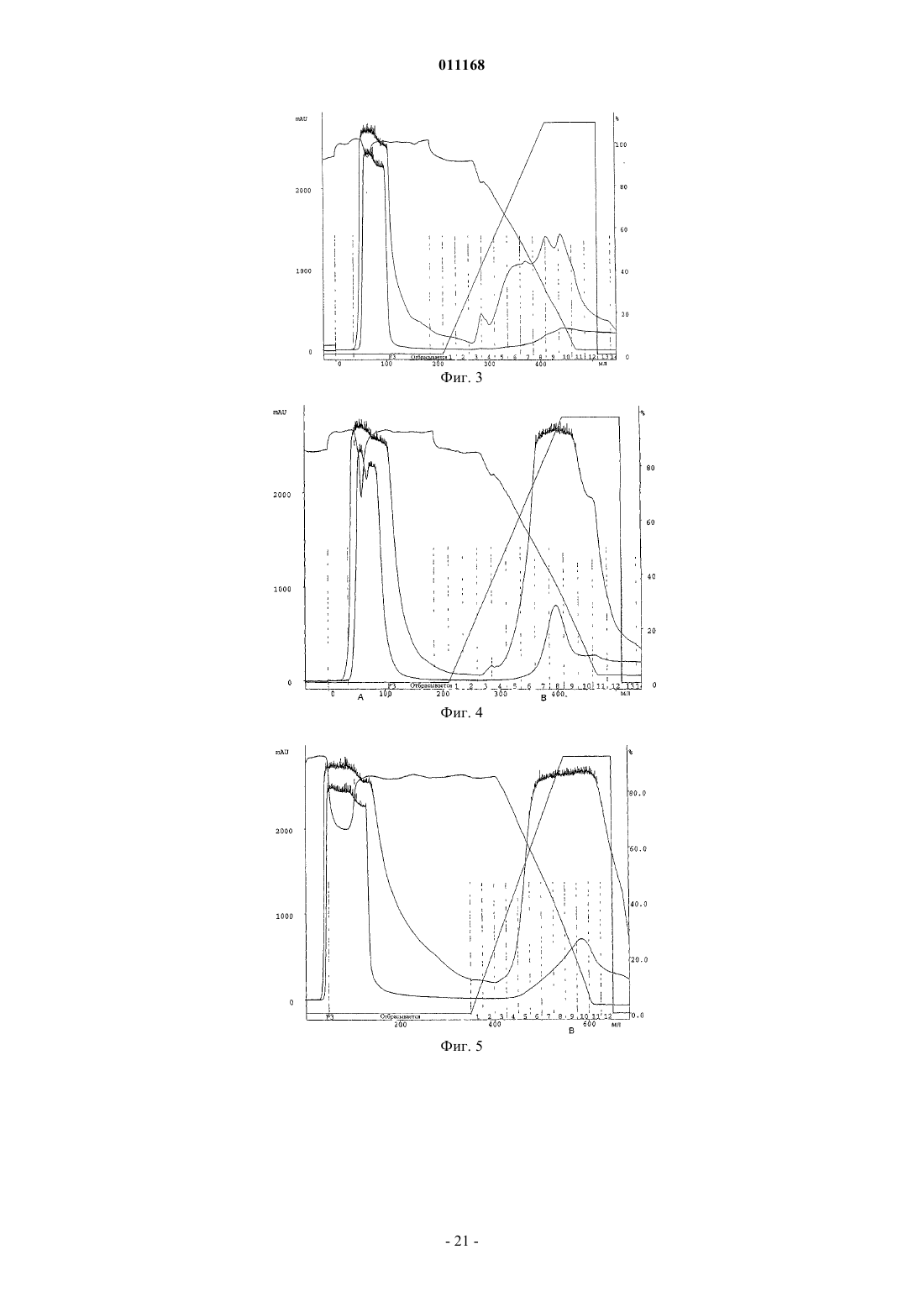
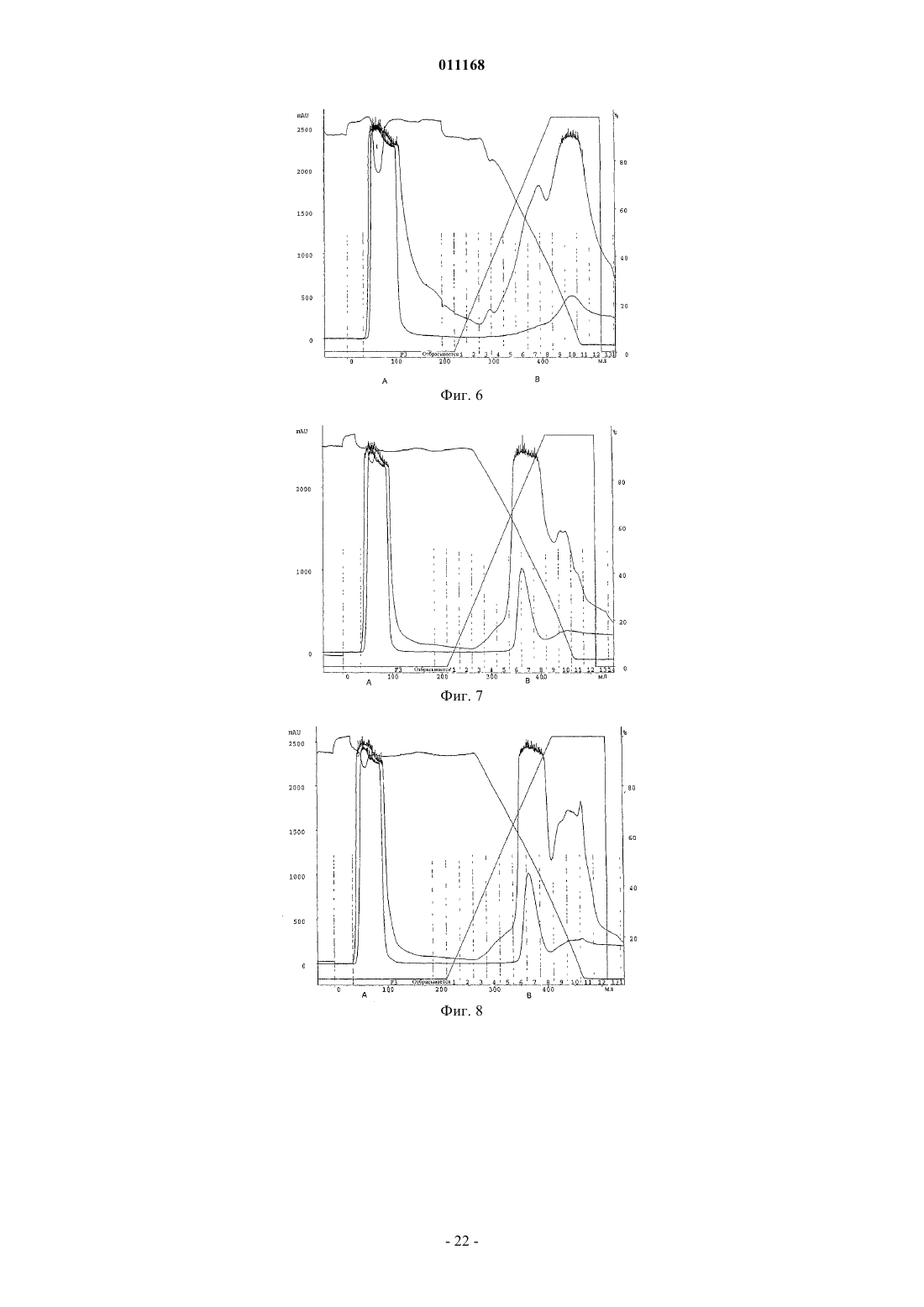
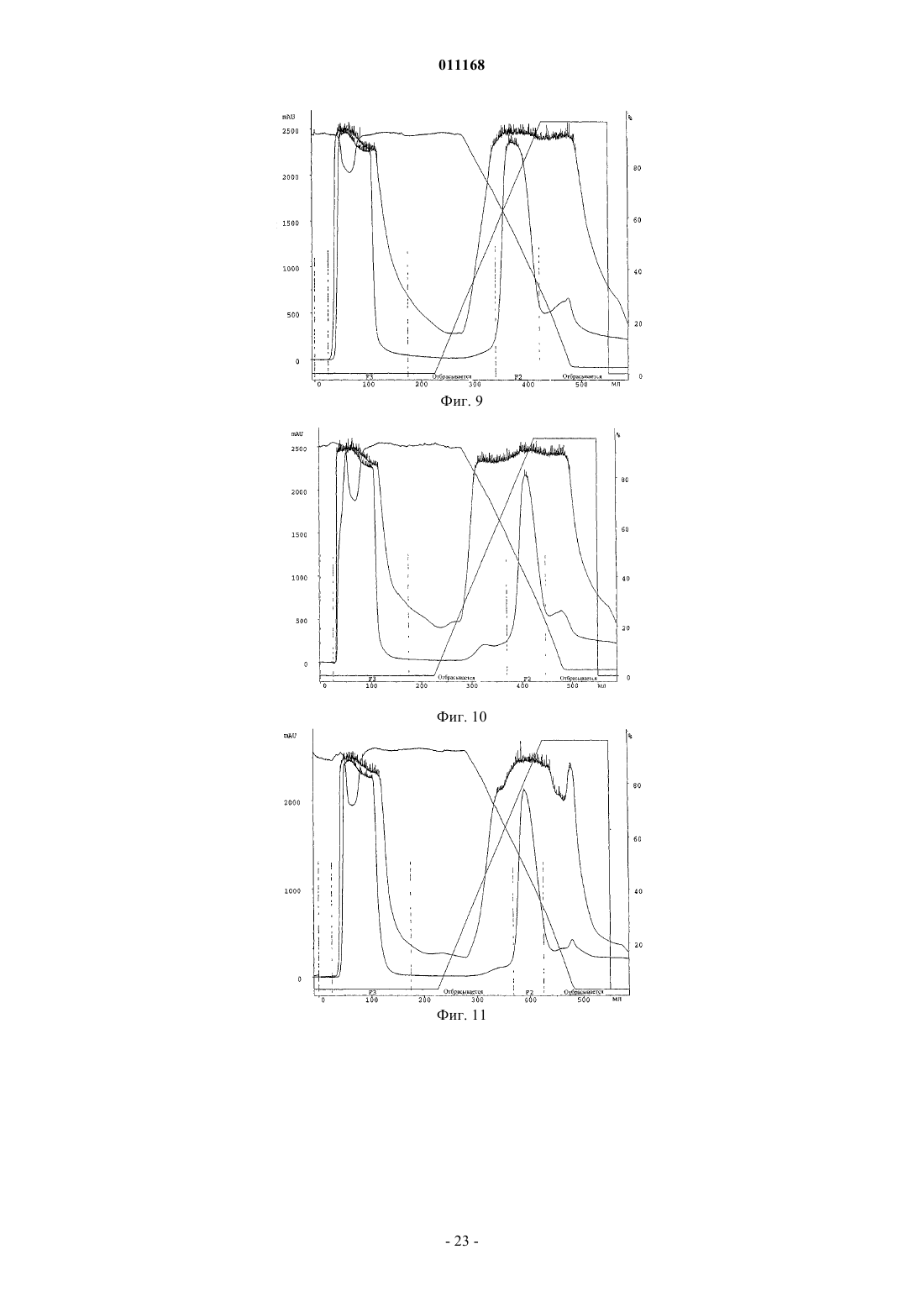
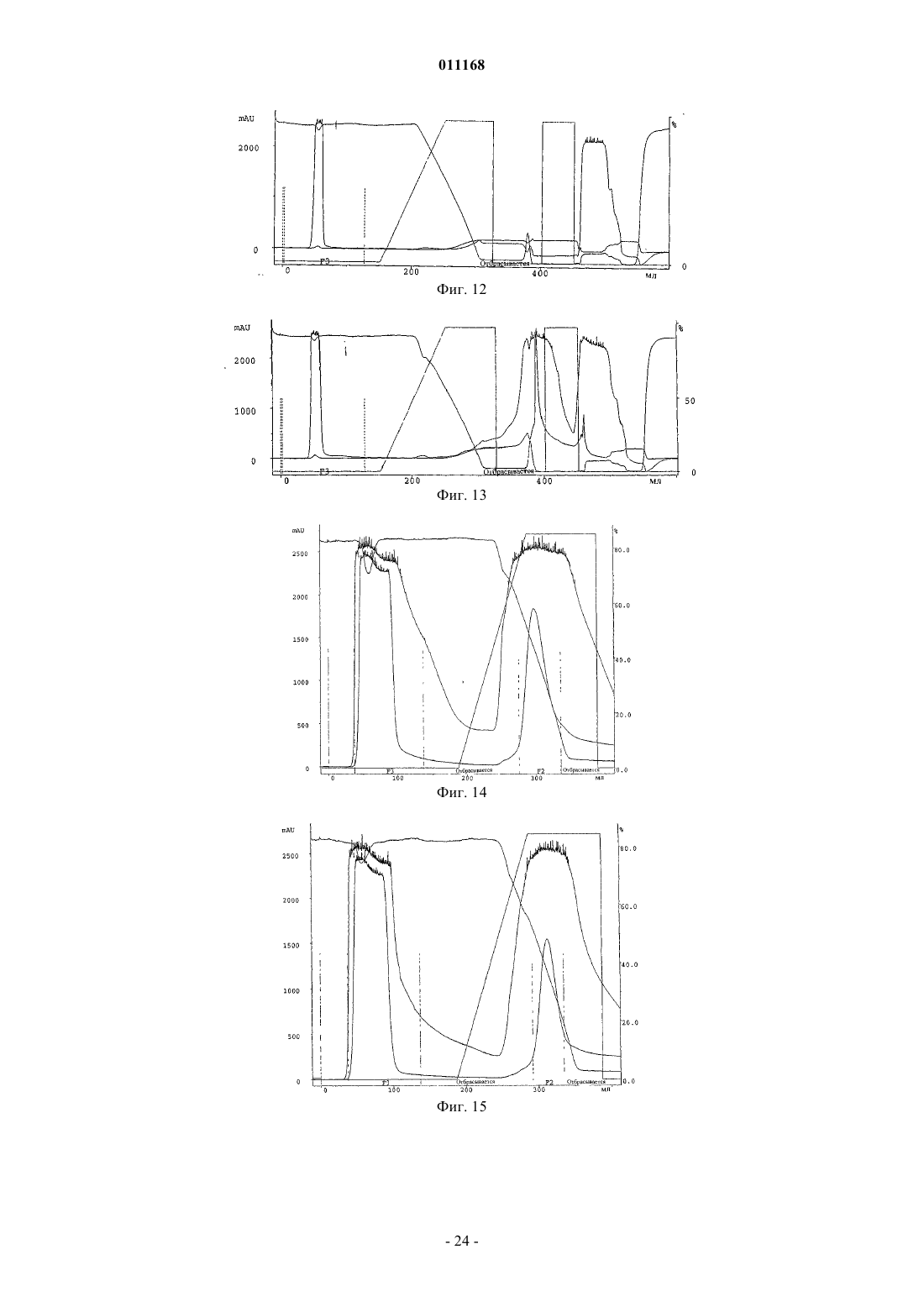
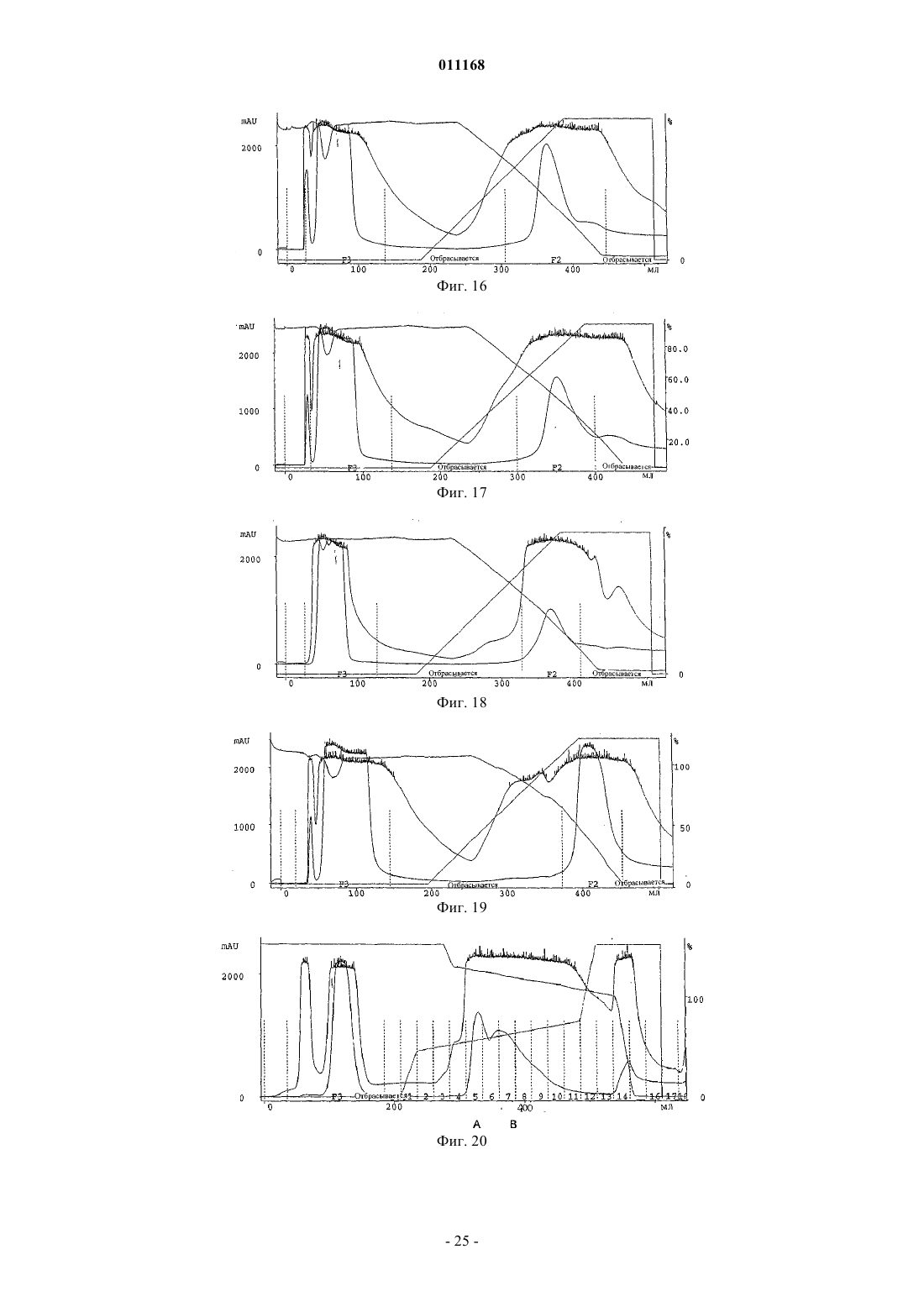
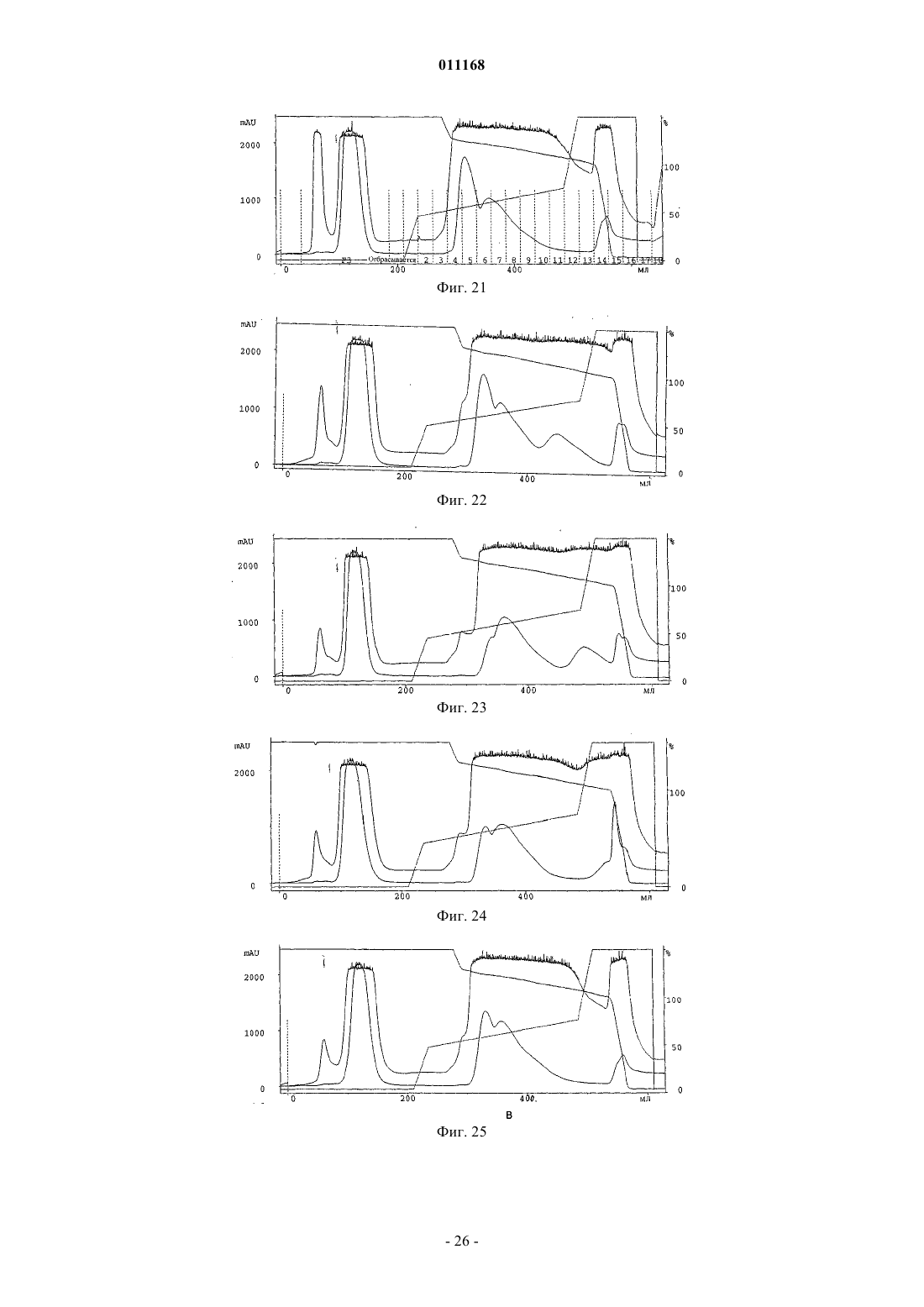
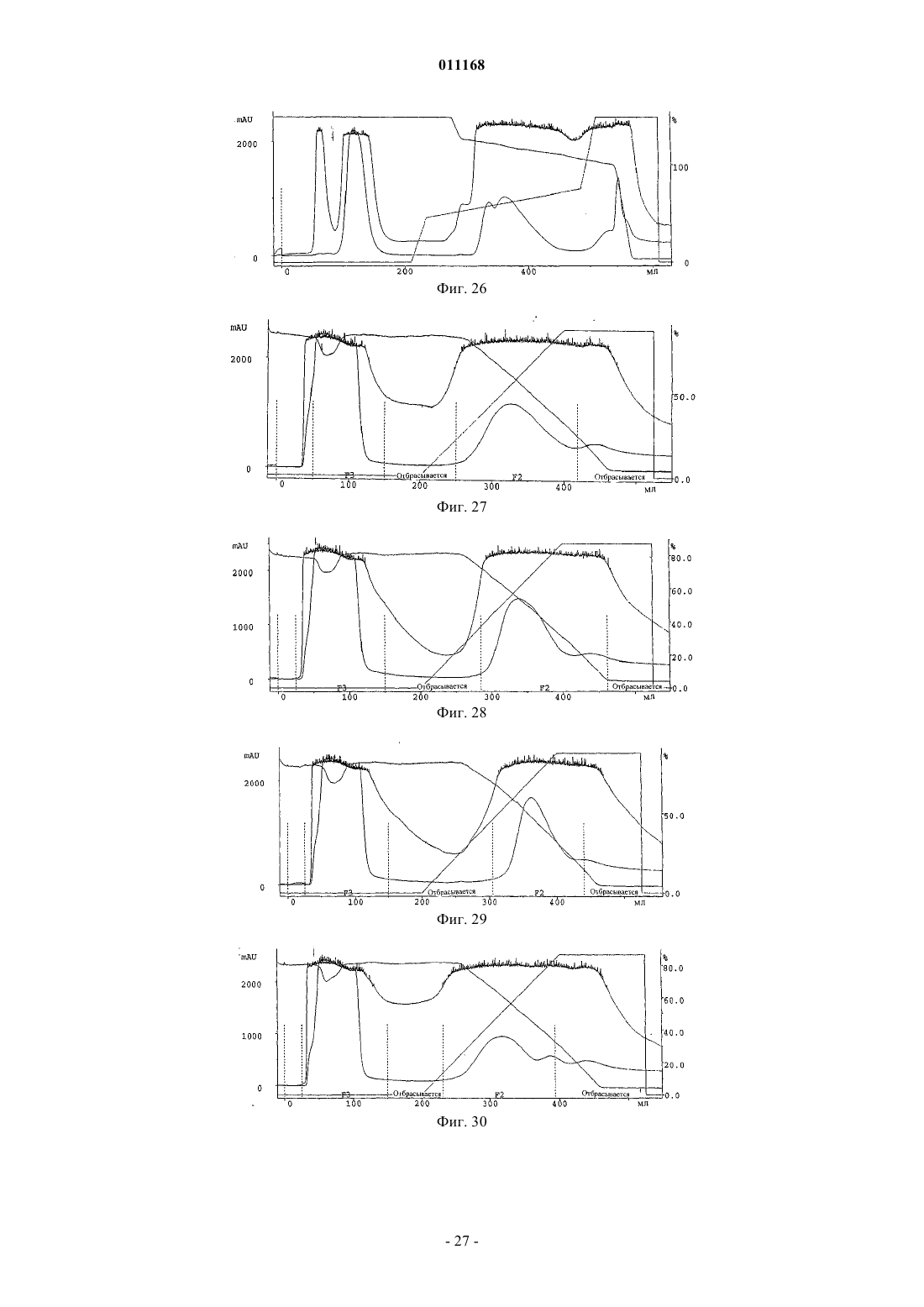
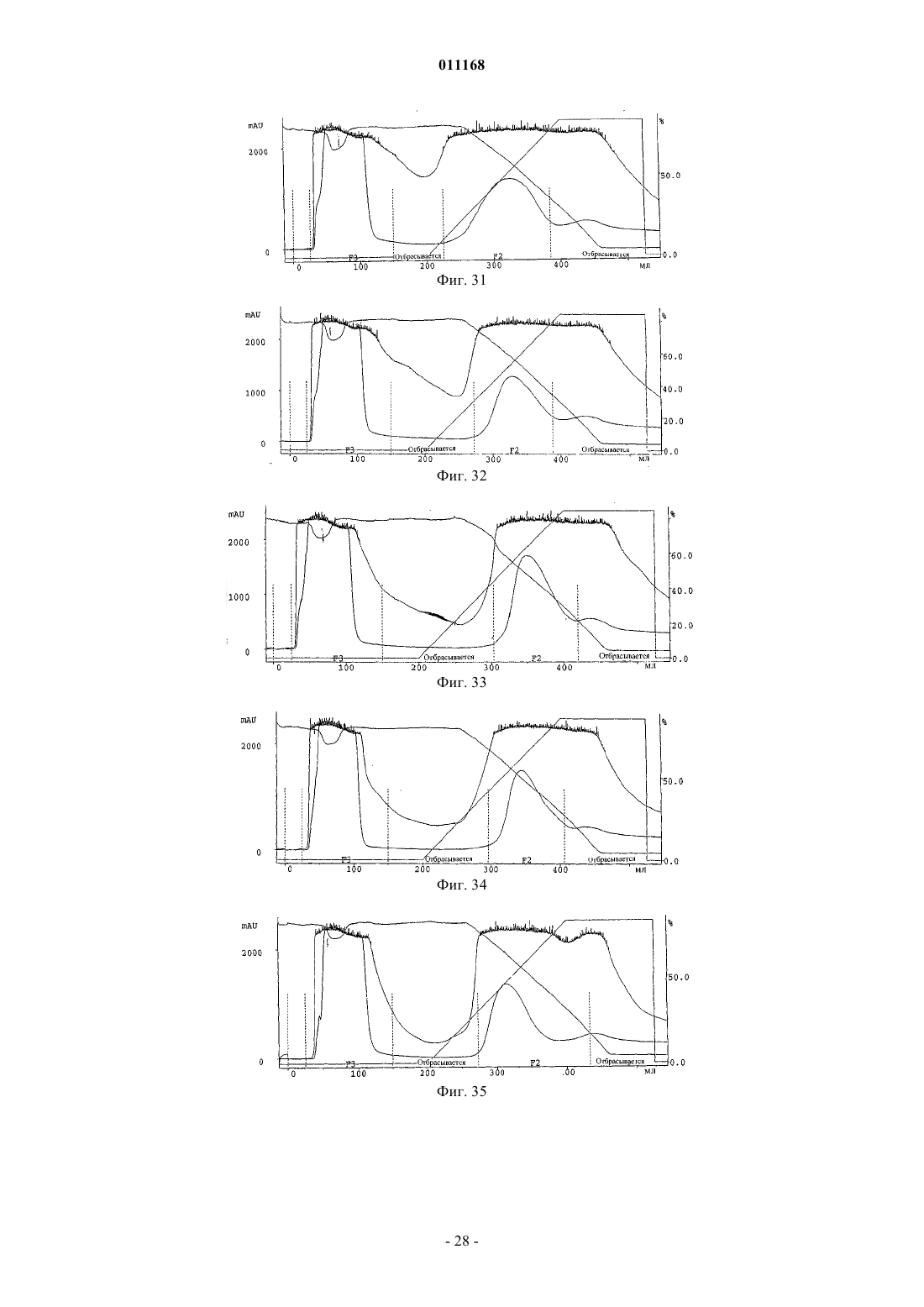
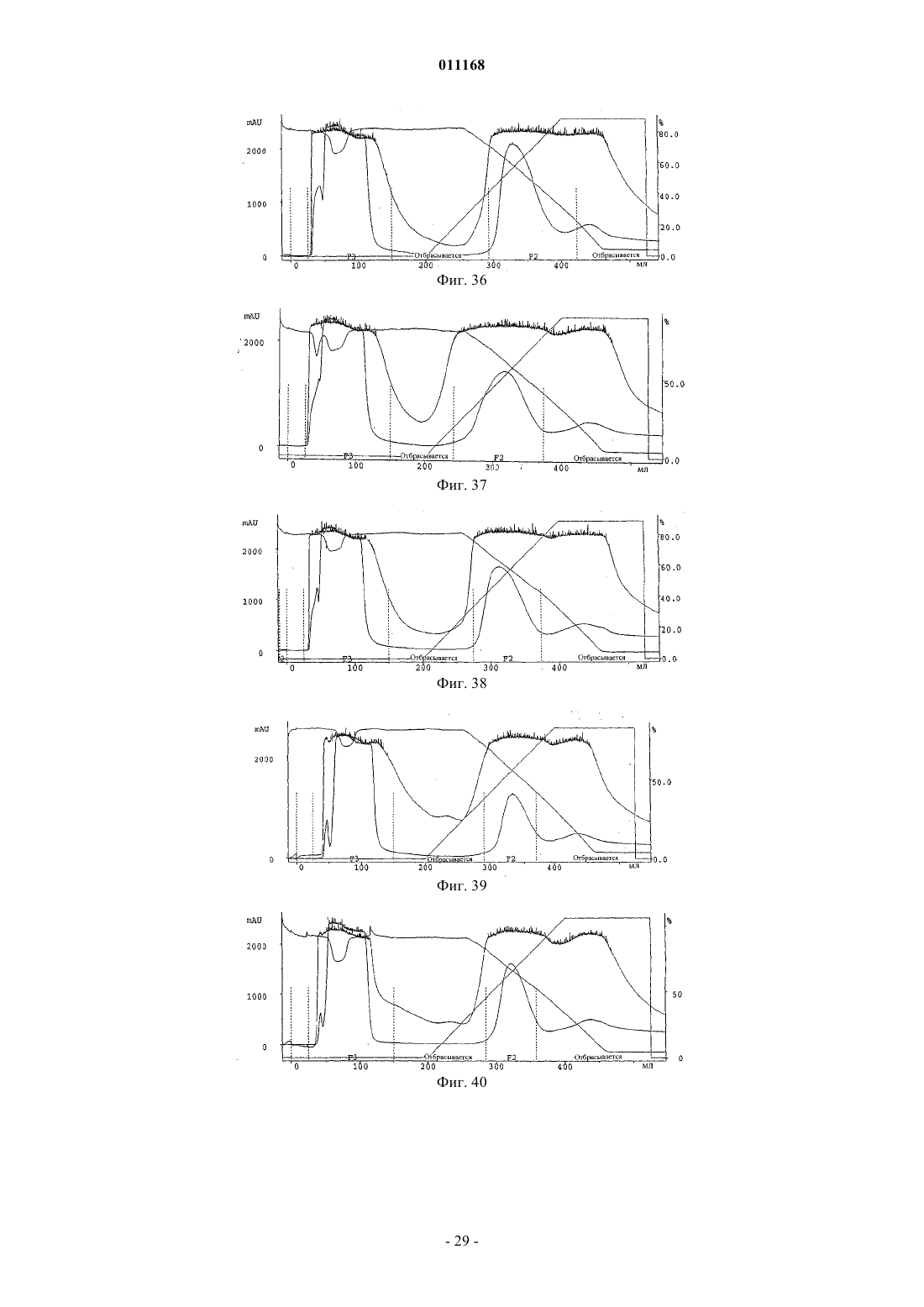
Способ очистки конъюгатов альбумина
Номер патента: 11168
Опубликовано: 27.02.2009
Авторы: Буске-Ганьон Натали, Бридон Доминик П., Курэши Омар
Формула / Реферат
1. Способ отделения конъюгата альбумина от неконъюгированного альбумина в растворе, содержащем конъюгат альбумина и неконъюгированный альбумин, включающий:
а) нанесение раствора на гидрофобную твердую подложку, уравновешенную водным буфером с высоким содержанием соли;
б) подачу на подложку градиента, понижающего содержание соли и
в) сбор конъюгата альбумина.
2. Способ по п.1, отличающийся тем, что конъюгат альбумина состоит из молекулы, содержащей ковалентно присоединённый к ней акцептор Михаэля.
3. Способ по п.2, отличающийся тем, что присоединение осуществляется между акцептором Михаэля и цистеином 34 альбумина.
4. Способ по п.2, отличающийся тем, что акцептор Михаэля представляет собой малеинимидную группу.
5. Способ по п.4, отличающийся тем, что малеинимидная группа представляет собой малеинимидпропионовую кислоту (МРА).
6. Способ по п.1, отличающийся тем, что альбумин выбирают из группы, состоящей из сывороточного альбумина и рекомбинантного альбумина.
7. Способ по п.1, отличающийся тем, что альбумин выбирают из группы, состоящей из человеческого альбумина, альбумина крысы, альбумина мыши, альбумина свиньи, бычьего альбумина, альбумина собаки и кроличьего альбумина.
8. Способ по п.1, отличающийся тем, что альбумин представляет собой человеческий сывороточный альбумин.
9. Способ по п.1, отличающийся тем, что альбумин модифицирован с помощью по меньшей мере одного агента, выбранного из группы, состоящей из жирных кислот, ионов металлов и сахаров.
10. Способ по п.9, отличающийся тем, что сахара выбирают из группы, состоящей из глюкозы, лактозы и маннозы.
11. Способ по п.1, отличающийся тем, что молекулу выбирают из группы, состоящей из пептида, ДНК, РНК и их комбинаций, к которым ковалентно присоединён акцептор Михаэля, возможно через линкер.
12. Способ по п.11, отличающийся тем, что молекула представляет собой пептид с молекулярной массой по меньшей мере 57 Да.
13. Способ по п.11, отличающийся тем, что пептид выбран из группы, состоящей из глюкагоноподобного пептида 1 (GLP-1), эксендин-4, предсердного натрийуретического пептида (ANP), крингл 5 (K5), динорфина, фактора высвобождения гормона роста (GRF), инсулина, натрийуретических пептидов, энфувиртида (Т-20), Т-1249, С-34, растворимого С-35 пептида EF (SC-35), пептида YY (PYY) и их аналогов.
14. Способ по п.2, отличающийся тем, что молекула выбрана из группы, состоящей из винорельбина, гемцитабина и паклитаксела.
15. Способ по п.11, отличающийся тем, что молекула ковалентно присоединена к альбумину чувствительной к кислоте ковалентной связью или пептидной последовательностью, чувствительной к протеолитическому расщеплению, что способствует отделению молекулы от альбумина и входу молекулы в клетку.
16. Способ по п.1, отличающийся тем, что гидрофобная твердая подложка представляет собой колонку, содержащую гидрофобный полимер.
17. Способ по п.16, отличающийся тем, что гидрофобный полимер выбирают из группы, состоящей из октилсефарозы, фенилсефарозы и бутилсефарозы.
18. Способ по п.16, отличающийся тем, что гидрофобный полимер представляет собой бутилсефарозу.
19. Способ по п.1, отличающийся тем, что соль оказывает эффект высаливания, достаточный для промотирования взаимодействий лиганд-протеин.
20. Способ по п.1, отличающийся тем, что соль выбирают из группы, состоящей из фосфата аммония, сульфата аммония и фосфата магния.
21. Способ по п.1, отличающийся тем, что соль представляет собой фосфат аммония или сульфат аммония.
22. Способ по п.1, отличающийся тем, что соль представляет собой сульфат аммония.
23. Способ по п.1, отличающийся тем, что градиент, понижающий содержание соли, имеет начальную концентрацию соли менее 3000 мМ.
24. Способ по п.1, отличающийся тем, что градиент, понижающий содержание соли, имеет начальную концентрацию соли от 500 до 1000 мМ.
25. Способ по пп.2, 4 или 5, отличающийся тем, что молекула представляет собой пептид, к которому ковалентно присоединён акцептор Михаэля, возможно через линкер.
26. Способ по п.25, отличающийся тем, что пептид выбран из группы, состоящей из глюкагоноподобного пептида 1 (GLP-1), глюкагоноподобного пептида 2 (GLP-2), эксендин-4, предсердного натрийуретического пептида (ANP), крингл 5 (K5), динорфина, фактора высвобождения гормона роста (GRF), инсулина, натрийуретических пептидов, энфувиртида (Т-20), Т-1249, С-34, растворимого С-35 пептида EF (SC-35), пептида YY (PYY).
27. Способ по пп.2, 4 или 5, отличающийся тем, что молекула выбрана из группы, состоящей из GLP-1 (7-36) dAla8 Lys37 (e-AEEA-MPA)-CONH2 (SEQ ID NO:1), GRF (1-29) dAla2 Gln8 Ala15 Leu27 Lys30 (e-MPA)-CONH2 (SEQ ID NO:2), Ac-K5 Lys8(e-MPA)-NH2 (SEQ ID NO:3), инсулин B1-MPA (SEQ ID NO:4), инсулин A1-MPA (SEQ ID NO:5), MPA-AEEA-C34-CONH2 (SEQ ID NO:6), C34 (1-34) Lys35(e-AEEA-MPA)-CONH2 (SEQ ID NO:7), C34 (1-34) Lys13(e-AEEA-MPA)-CONH2 (SEQ ID NO:8), GLP-1 (7-36) Lys37(e-MPA)-NH2 (SEQ ID NO:9), GLP-1 (7-36) dAla8 Lys37 (e-MPA)-NH2 (SEQ ID NO: 10), GLP-1 (7-36) Lys26(e-AEEA-AEEA-MPA) (SEQ ID NO:11), GLP-1 (7-36) Lys34(e-AEEA-AEEA-MPA) (SEQ ID NO:12), эксендин-4 (1-39) Lys40 (e-MPA)-NH2 (SEQ ID NO:13), эксендин-4 (9-39) Lys40 (e-AEEA-MPA)-CONH2 (SEQ ID NO:14), Dyn A (1-13) (MPA)-NH2 (SEQ ID NO:15), MPA-AEEA-ANP (99-126)-CONH2 (SEQ ID NO:16), Dyn A (7-13) Lys13(MPA)-CONH2 (SEQ ID NO:17), ацетил-Phe-His-циклогексилстатил-Ile-Lys (e-AEEA-MPA)-CONH2 (SEQ ID NO:18), GLP-1 (7-36) Lys23 (e-AEEA-MPA)-CONH2 (SEQ ID NO:19), GLP-1 (7-36) Lys18(e-AEEA-MPA)-CONH2 (SEQ ID NO:20), GLP-1 (7-36) Lys26 (e-AEEA-MPA)-CONH2 (SEQ ID NO:21), GLP-1 (7-36) Lys27(e-AEEA-MPA)-CONH2 (SEQ ID NO:22), GLP-1 (7-36) Lys37 (e-AEEA-AEEA-MPA)-CONH2 (SEQ ID NO:23), GLP-1 (7-36) Lys37(e-AEEA-MPA)-CONH2 (SEQ ID NO:24), эксендин-4 (1-39) Lys40(e-AEEA-MPA)-CONH2 (SEQ ID NO:25), GLP-1 (7-36) Lys34(e-AEEA-MPA)-CONH2 (SEQ ID NO:26), инсулин B1-OA-MPA (SEQ ID NO:27), инсулин В29-МРА (SEQ ID NO:28), GRF (1-29) Lys30(e-MPA)-CONH2 (SEQ ID NO:29), GRF (1-29) dAla2 Gln8 dArg11 Ala15 Leu27 Lys30 (e-MPA)-CONH2 (SEQ ID NO:30), GRF (1-29) dAla2 Lys30 (e-MPA)-CONH2 (SEQ ID NO:31), GLP-1 (9-36) Lys37 (e-AEEA-MPA)-CONH2 (SEQ ID NO:32), Ac-T20 (1-36) Lys37(e-AEEA-MPA)-CONH2 (SEQ ID NO:33), Ac-T1249 (1-39) Lys40 (e-AEEA-MPA)-CONH2 (SEQ ID NO:34), 3'4'-дидегидро-4'-деокси-С'-норвинкалеукобластин-АЕЕА-МРА (SEQ ID NO:35), C34 (1-34) Lys13 (e-MPA)-CONH2 (SEQ ID NO:36), C34 (1-34) Lys35 (e-МРА)-CONH2 (SEQ ID NO:37), MPA-C34 (1-34)-CONH2 (SEQ ID NO:38), Ac-C34 (1-34) Glu2 Lys6 Lys7 Glu9 Glu10 Lys13 Lys14 Glu16 Glu17 Lys20 Lys21 Glu23 Glu24 Lys27 Glu31 Lys34 Lys35 Lys36 (e-AEEA-MPA)-CONH2 (SEQ ID NO:39), MPA-AEEA-C34 (1-34) Glu2 Lys6 Lys7 Glu9 Glu10 Lys13 Lys14 Glu16 Glu17 Lys20 Lys21 Glu23 Glu24 Lys27 Glu31 Lys34 Lys35-CONH2 (SEQ ID NO:40), PYY (3-36) Lys4 (e-OA-MPA)-CONH2 (SEQ ID NO:41), MPA-OA-PYY (3-36)-CONH2 (SEQ ID NO:42), инсулин B29-AEES-AEES-MPA (SEQ ID NO:43), инсулин B1-AEES-AEES-MPA (SEQ ID NO:44), инсулин В29-ОА-МРА (SEQ ID NO:45), MPA-PYY (3-36)-CONH2 (SEQ ID NO:46), PYY (3-36) Lys37 (e-MPA)-CONH2 (SEQ ID NO:47), MPA-PYY (22-36)-CONH2 (SEQ ID NO:48), ацетил-PYY (22-36) Lys37 (e-MPA)-CONH2 (SEQ ID NO:49), MPA-ANP (99-126)-CONH2 (SEQ ID NO:50), MPA-EEEEP-ANP (99-126) (SEQ ID NO:51), GLP-2 (1-33) Gly2 Lys34 (e-MPA)-CONH2 (SEQ ID NO:52).
28. Способ по п.26, отличающийся тем, что пептид представляет собой GLP-1 (7-36) dAla8 Lys37.
29. Способ по п.26, отличающийся тем, что пептид представляет собой эксендин-4 (1-39) Lys40.
30. Способ по пп.2, 4 или 5, отличающийся тем, что молекула представляет собой GLP-1 (7-36) dAla8 Lys37 (e-AEEA-MPA)-CONH2.
Текст
(а) Область, к которой относится изобретение. Настоящее изобретение относится к способу очистки при выделении конъюгатов альбумина из раствора, содержащего как конъюгаты альбумина, так и неконъюгированный альбумин.(б) Уровень техники. В международных заявках WO 95/10302 и WO 99/24074 описано образование конъюгатов альбумина, в которых представляющая интерес молекула имеет связанную с ней реакционноспособную (реактивную) функциональность, которая способна ковалентно связываться с альбумином, образуя при этом конъюгат. Эти конъюгаты могут образовываться in vivo, но они могут также образовываться in vitro. Образование конъюгатов in vitro включает присоединение молекулы, связанной с реактивной функциональностью, к альбумину в растворе. Основные конечные продукты этой реакции представляют собой неконъюгированный альбумин, конъюгат альбумина и непрореагировавшую молекулу, связанную с реактивной функциональностью. Было бы в высшей степени желательно иметь способ очистки конъюгата альбумина из раствора,содержащего конъюгат альбумина и неконъюгированный альбумин. Сущность изобретенеия Согласно настоящему изобретению предлагается способ отделения конъюгата альбумина от неконъюгированного альбумина в растворе, содержащем конъюгат альбумина и неконъюгированный альбумин, включающий: а) нанесение раствора на гидрофобный тврдый носитель, уравновешенный водным буфером с высоким содержанием соли; б) подачу на носитель водного буфера с понижающимся с градиентом содержанием соли и в) сбор элюированного конъюгата альбумина. В предпочтительном варианте настоящего изобретения конъюгат альбумина состоит из молекулы,содержащей акцептор Михаэля, ковалентно связанный с ней, который связывается с альбумином, и более предпочтительно имеется связь между акцептором Михаэля и цистеином 34 альбумина. В более предпочтительном варианте настоящего изобретения акцептором Михаэля является малеинимидная группа, и более предпочтительно малеинимидная группа представляет собой малеинимидпропионовую кислоту (МРА). Акцептор Михаэля необязательно связан с молекулой с помощью линкера. Линкер предпочтительно выбирают в группе, состоящей из гидроксиэтильных мотивов, таких как (2 амино)этоксиуксусная кислота (АЕА), этилендиамин (EDA), 2-[2-(2-амино)этокси]этоксиуксусная кислота (АЕЕА), аминоэтоксиэтиламиноянтарная кислота (AEEAS); один или более мотивов с алкильной цепью (С 1-С 10), таких как глицин, 3-аминопропионовая кислота (АРА), 8-аминооктановая кислота (АОА),октановая кислота (ОА), 4-аминобензойная кислота (APhA). Предпочтительными линкерами являются ОА, ADE, АЕА, АЕЕА и AEEAS. Можно также применять комбинацию двух линкеров, например, такую как AEEA-EDA, AEEA-AEEA, AEEAS-AEEAS и АЕА-АЕЕА. В предпочтительном варианте настоящего изобретения альбумин выбирают из группы, состоящей из сывороточного альбумина, рекомбинантного альбумина и альбумина из геномного источника. В предпочтительном варианте настоящего изобретения альбумин выбирают из группы, состоящей из человеческого альбумина, альбумина крысы, альбумина мыши, альбумина свиньи, бычьего альбумина, альбумина собаки и кроличьего альбумина, более предпочтителен бычий сывороточный альбумин. В предпочтительном варианте изобретения альбумин модифицирован с помощью по меньшей мере одного реагента, выбранного из группы, состоящей из жирных кислот, ионов металла, малых молекул с высоким сродством к альбумину, и сахаров, таких, но без ограничения, как глюкоза, лактоза и манноза. В предпочтительном варианте настоящего изобретения молекулу выбирают из группы, состоящей из пептида, ДНК, РНК, малой органической молекулы и их комбинации. Молекулярная масса пептида составляет предпочтительно по меньшей мере 57 Да. Предполагается, что пептид включает, но без ограничения, GLP-1, GLP-2, ANP, K5, динорфин, GRF, инсулин, натрийуретический пептид, Т-20, Т-1249, С 34 и PYY. Предполагается, что малая молекула включает, но без ограничения, винорелбин, гемцитабин и паклитаксел. В более предпочтительном варианте настоящего изобретения, когда молекула представляет собой ДНК, РНК или малую органическую молекулу, она ковалентно связана с альбумином за счт чувствительной к кислоте ковалентной связи или за счт пептидной последовательности, чувствительной к протеолитическому расщеплению, тем самым обеспечивается отделение (отщепление) молекулы от альбумина и вход молекулы в клетку. В предпочтительном варианте настоящего изобретения гидрофобная тврдая подложка (носитель) представляет собой колонку, содержащую гидрофобный полимер, такой как, но без ограничения, октилсефароза, фенилсефароза и бутилсефароза, причм более предпочтительной является бутилсефароза. В другом варианте настоящего изобретения гидрофобный тврдый носитель содержит гидрофобный лиганд, такой как Cibacron Blue F3G-A, либо изопропильные группы, ассоциированные с носителем,таким как матрица полистирол/изопропилбензол. Вещества разделяют за счт их различной интенсивности гидрофобного взаимодействия с гидрофобными лигандами, иммобилизованными на незаряженной матрице. Этот способ обычно осуществляют-1 011168 при умеренно высоких концентрациях солей (1 М) в начальном буфере (адсорбция, промотируемая солью). Элюцию проводят при линейном или постадийном снижении концентрации соли. Тип лиганда, степень замещения, значение рН и тип и концентрация соли, применяемой на стадии адсорбции, оказывают значительное влияние на общую эффективность (например, селективность и (адсорбционную) способность) HIC матрицы (носителя (матрицы) для хроматографии гидрофобных взаимодействий). Растворимость является одной из наиболее важных характеристик, которая влияет на производительность и селективность HIC (хроматографии гидрофобных взаимодействий). В целом, процесс адсорбции является более селективным, чем процесс десорбции. Следовательно, важно оптимизировать начальный буфер по рН, типу растворителя, типу соли и концентрации соли. Добавление к образцу различных "высаливающих" солей вызывает взаимодействия лиганд-белок в процессе HIC. По мере повышения концентрации соли количество связанного белка повышается до точки преципитации белка. Каждый тип соли отличается по своей способности промотировать гидрофобные взаимодействия. Влияние различных солей на гидрофобное взаимодействие подчиняется общеизвестному ряду Гофмейстера,представленному ниже: Ряд Гофмейстера Эффект высаливания Анионы: Хаотропный эффект Катионы: Возрастание эффекта высаливания усиливает гидрофобные взаимодействия, тогда как возрастание хаотропного эффекта ослабляет их. Следовательно, сульфат аммония вызывает более сильный эффект высаливания, чем хлорид натрия. Наиболее часто для HIC применяют соли: сульфат аммония(KCl) и ацетат аммония (CH3COONH4). Связывание белка с HIC адсорбентами промотируется концентрациями "высаливающих" солей от умеренных до высоких, большинство из этих солей также оказывают стабилизирующее действие на структуру белка благодаря предпочтительному исключению их из нативных глобулярных белков, т.е. взаимодействие между солью и поверхностью белка термодинамически невыгодно. Концентрация соли должна быть достаточно высокой (например, 500-1000 мМ) для того, чтобы вызывать взаимодействие лиганд-белок, но ниже концентрации, которая вызывает преципитации белка в образце. В случае альбумина концентрацию соли следует выдерживать ниже 3 М (молей на литр). Основной механизм высаливания заключается в вызываемом солью повышении поверхностного натяжения воды (Melander andHorvath, 1977). Таким образом, компактная структура становится энергетически более выгодной, так как она соответствует меньшей площади пограничной (межфазной) поверхности белок - раствор. Авторы обнаружили, что в одних и тех же условиях (т.е. буфер, содержащий SO42-, PO43- или СН 3 СОО- с любым противоионом) то, как эти соли проявляют эффект высаливания в отношении практически всего конъюгированного альбумина по данному описанию, отличается от их поведения в отношении неконъюгированного альбумина (т.е. меркаптальбумина и альбумина, кэпированного цистеином),что делает возможным непрерывное хроматографическое разделение конъюгированного альбумина и неконъюгированного альбумина. То есть, для того, чтобы инициировать взаимодействие между лигандом и конъюгированным альбумином, требуются более низкие концентрации соли, чем для инициирования взаимодействия между лигандом и неконъюгированным альбумином. Это хроматографическое разделение практически не зависит от (а) последовательности альбумина (например, человеческого, мыши,крысы и т.д.), (б) источника альбумина (т.е. из плазмы или рекомбинантного), (в) молекулярной массы конъюгированной молекулы, (г) положения акцептора Михаэля (или малеинимидной группы) в структуре молекулы, (д) пептидной последовательности или химической структуры молекулы и (е) трхмерной структуры конъюгированной молекулы, например линейной структуры по сравнению с петлевой структурой. В предпочтительном варианте настоящего изобретения соль в водном буфере проявляет достаточный эффект высаливания. Для того, чтобы обеспечить достаточный эффект высаливания, соль, предпочтительно, но без ограничения, представляет собой фосфат, сульфат и ацетат. Более предпочтительно,соль является фосфатом или сульфатом. Выбор катиона в буфере менее важен и, следовательно, такой катион можно выбирать, без ограничения, из группы, состоящей из NH4+, Rb+, K+, Na+, Cs+, Li+, Mg2+ иBa2+. Водный буфер предпочтительно представляет собой фосфат аммония, сульфат аммония и фосфат магния и более предпочтительно сульфат аммония. В предпочтительном варианте настоящего изобретения рН буфера имеет значение 3,0-9,0; более предпочтительно 6,0-8,0 и ещ более предпочтительно рН 7,0.-2 011168 В предпочтительном варианте настоящего изобретения температура буфера и гидрофобного тврдого носителя является комнатной (около 25 С), или равна 4 С, или е значение является промежуточным между двумя этими значениями. В табл. 1 показан пример влияния различных солей на очистку предварительно полученного конъюгата HSA: первый аналог GLP-1 из раствора HSA с применением бутилсефарозы (структура первого аналога GLP-1 описана ниже, в примере 1). Таблица 1 означает, что соль нерастворима в концентрациях 1750 мМ или 750 мМ в растворе 20 мМ фосфата натрия (рН 7), 5 мМ каприлата. Да означает, что достигается успешное разделение между конъюгатом HSA: первый аналог GLP1 и неконъюгированным HAS. Нет означает, что не достигается успешное разделение между конъюгатом HSA: первый аналогGLP-1 и неконъюгированным HAS. Предполагается, что термин "пептид" означает аминокислотную последовательность с молекулярной массой по меньшей мере 57 Да. Пептидная последовательность может быть кольцевой (петлевая структура), такой как ANP, может содержать более одной аминокислотной цепи, такой как инсулин, или может быть линейной, такой как К 5, динорфин А, С-34 и GLP-1. Краткое описание фигур Каждая фигура иллюстрирует ЖК/ЭМС анализ содержания в элюированных фракциях хроматографии, осуществленной в соответствии с настоящим изобретением для сепарации/очистки соединений,описанных в примерах. Каждая фракция была обессолена и концентрирована ранее ЖК/ЭМС анализа,как описано ниже. На фиг. 1 иллюстрируется очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 1; на фиг. 2 иллюстрируется очистка конъюгата HSA: первый аналог GRP (SEQ ID NO:2) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 2; на фиг. 3 иллюстрируется очистка неконъюгированного HSA по предпочтительному варианту способа по настоящему изобретению, как описано в примере 3; на фиг. 4 иллюстрируется очистка конъюгата rHSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 4; на фиг. 5 иллюстрируется очистка HSA cortex по предпочтительному варианту способа по настоящему изобретению, как описано в примере 5; на фиг. 6 иллюстрируется очистка конъюгата HSA: аналог K5 (SEQ ID NO:3) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 6; на фиг. 7 иллюстрируется очистка конъюгата HSA: первое производное инсулина (SEQ ID NO:4) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 7; на фиг. 8 иллюстрируется очистка конъюгата HSA: второе производное инсулина (SEQ ID NO:5) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 8; на фиг. 9 иллюстрируется очистка конъюгата HSA: первый аналог С 34 (SEQ ID NO:6) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 9; на фиг. 10 иллюстрируется очистка конъюгата HSA: второй аналог С 34 (SEQ ID NO:7) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 10; на фиг. 11 иллюстрируется очистка конъюгата HSA: третий аналог С 34 1 (SEQ ID NO:8) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 11; на фиг. 12 иллюстрируется очистка L-цистеина по предпочтительному варианту способа по настоящему изобретению, как описано в примере 12; на фиг. 13 иллюстрируется очистка конъюгата L-цистеин: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 13; на фиг. 14 иллюстрируется очистка конъюгата HSA: второй аналог GLP-1 (SEQ ID NO:9) по пред-3 011168 почтительному варианту способа по настоящему изобретению, как описано в примере 14; на фиг. 15 иллюстрируется очистка конъюгата HSA: третий аналог GLP-1 (SEQ ID NO:10) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 15; на фиг. 16 иллюстрируется очистка конъюгата HSA: четвртый аналог GLP-1 (SEQ ID NO:11) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 16; на фиг. 17 иллюстрируется очистка конъюгата HSA: пятый аналог GLP-1 (SEQ ГО NO:12) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 17; на фиг. 18 иллюстрируется очистка конъюгата HSA: первый аналог эксендина-4 (SEQ ID NO:13) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 18; на фиг. 19 иллюстрируется очистка конъюгата HSA: второй аналог эксендина-4 (SEQ ID NO:14) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 19; на фиг. 20 иллюстрируется очистка конъюгата HSA: MPA по предпочтительному варианту способа по настоящему изобретению, как описано в примере 20; на фиг. 21 иллюстрируется очистка HSA по предпочтительному варианту способа по настоящему изобретению, как описано в примере 21; на фиг. 22 иллюстрируется очистка конъюгата HSA: второй аналог с 34 (SEQ ID NO:3) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 22; на фиг. 23 иллюстрируется очистка конъюгата HSA: первый аналог динорфина-А (SEQ ID NO:15) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 23; на фиг. 24 иллюстрируется очистка конъюгата HSA: первый аналог ANP (SEQ ID NO:16) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 24; на фиг. 25 иллюстрируется очистка конъюгата HSA: второй аналог динорфина А (SEQ ID NO:17) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 25; на фиг. 26 иллюстрируется очистка конъюгата HSA: ингибитор АСЕ (SEQ ID NO:18) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 26; на фиг. 27 иллюстрируется очистка конъюгата HSA: шестой аналог GLP-1 (SEQ ID NO:19) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 27; на фиг. 28 иллюстрируется очистка конъюгата HSA: седьмой аналог GLP-1 (SEQ ID NO:20) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 28; на фиг. 29 иллюстрируется очистка конъюгата HSA: восьмой аналог GLP-1 (SEQ ID NO:21) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 29; на фиг. 30 иллюстрируется очистка конъюгата HSA: девятый аналог GLP-1 (SEQ ID NO:22) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 30; на фиг. 31 иллюстрируется очистка конъюгата HSA: десятый аналог GLP-1 (SEQ ID NO:23) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 31; на фиг. 32 иллюстрируется очистка конъюгата HSA: одиннадцатый аналог GLP-1 (SEQ ID NO:24) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 32; на фиг. 33 иллюстрируется очистка конъюгата HSA: третий аналог эксендина-4 (SEQ ID NO:25) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 33; на фиг. 34 иллюстрируется очистка конъюгата HSA: двенадцатый аналог GLP-1 (SEQ ID NO:26) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 34; на фиг. 35 иллюстрируется очистка конъюгата HSA: первое производное инсулина с модификацией в цепи В (SEQ ID NO:4) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 35; на фиг. 36 иллюстрируется очистка конъюгата HSA: третье производное инсулина с модификацией в цепи В (SEQ ID NO:27) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 36; на фиг. 37 иллюстрируется очистка конъюгата HSA: второе производное инсулина с модификацией в цепи A (SEQ ID NO:5) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 37; на фиг. 38 иллюстрируется очистка конъюгата HSA: четвртое производное инсулина с модификацией в цепи В (SEQ ID NO:28) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 38; на фиг. 39 иллюстрируется очистка конъюгата HSA: первый аналог GRF (SEQ ID NO:2) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 39; на фиг. 40 иллюстрируется очистка конъюгата HSA: второй аналог GRP (SEQ ID NO:29) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 40; на фиг. 41 иллюстрируется очистка конъюгата HSA: третий аналог GRF (SEQ ID NO:30) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 41; на фиг. 42 иллюстрируется очистка конъюгата HSA: четвртый аналог GRF (SEQ ID NO:31) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 42; на фиг. 43 иллюстрируется очистка конъюгата HSA: тринадцатый аналог GLP-1 CJC 1365 (SEQ IDNO:32) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 43; на фиг. 44 иллюстрируется очистка конъюгата HSA лактоза: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 44; на фиг. 45 иллюстрируется очистка конъюгата HSA: первый аналог Т 20 (SEQ ID NO:33) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 45; на фиг. 46 иллюстрируется очистка конъюгата HSA: первый аналог Т 1249 (SEQ ID NO:34) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 46; на фиг. 47 иллюстрируется очистка соединения HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 47; на фиг. 48 иллюстрируется очистка соединения HSA: первый аналог С 34 (SEQ ID NO:6) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 48; на фиг. 49 иллюстрируется очистка соединения HSA: второй аналог GRF (SEQ ID NO:29) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 49; на фиг. 50 иллюстрируется очистка конъюгата HSA: аналог винорельбина (SEQ ID NO:35) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 50; на фиг. 51 иллюстрируется очистка L-цистеина по предпочтительному варианту способа по настоящему изобретению, как описано в примере 51; на фиг. 52 иллюстрируется очистка конъюгата L- цистеин: аналог винорельбина (SEQ ID NO:35) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 52; на фиг. 53 иллюстрируется очистка конъюгата RSA: третий аналог эксендина-4 (SEQ ID NO:25) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 53; на фиг. 54 иллюстрируется очистка конъюгата HSA: четвртый аналог С 34 (SEQ ID NO:36) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 54; на фиг. 55 иллюстрируется очистка конъюгата HSA: пятый аналог С 34 (SEQ ID NO:37) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 55; на фиг. 56 иллюстрируется очистка конъюгата HSA: шестой аналог С 34 (SEQ ID NO:38) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 56; на фиг. 57 иллюстрируется очистка конъюгата HSA: седьмой аналог С 34 (SEQ ID NO:39) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 57; на фиг. 58 иллюстрируется очистка конъюгата HSA: восьмой аналог С 34 (SEQ ID NO:40) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 58; на фиг. 59 иллюстрируется очистка конъюгата HSA: первый аналог PYY (SEQ ID NO:41) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 59; на фиг. 60 иллюстрируется очистка конъюгата HSA: второй аналог PYY (SEQ ID NO:42) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 60; на фиг. 61 иллюстрируется очистка конъюгата HSA: пятое производное инсулина с модификацией в цепи В (SEQ ID NO:43) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 61; на фиг. 62 иллюстрируется очистка конъюгата HSA: шестое производное инсулина с модификацией в цепи В (SEQ ID NO:44) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 62; на фиг. 63 иллюстрируется очистка конъюгата HSA: седьмое производное инсулина с модификацией в цепи В (SEQ ID NO:45) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 63; на фиг. 64 иллюстрируется очистка конъюгата HSA: третий аналог PYY (SEQ ID NO:46) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 64; на фиг. 65 иллюстрируется очистка конъюгата HSA: четвртый аналог PYY (SEQ ID NO:47) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 65; на фиг. 66 иллюстрируется очистка конъюгата HSA: пятый аналог PYY (SEQ ID NO:48) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 66; на фиг. 67 иллюстрируется очистка конъюгата HSA: шестой аналог PYY (SEQ ID NO:49) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 67; на фиг. 68 иллюстрируется очистка конъюгата HSA: второй аналог ANP (SEQ ID NO:50) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 68; на фиг. 69 А-В иллюстрируется очистка конъюгата HSA: третий аналог ANP CJC 1681 (SEQ IDNO:51) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 69; на фиг. 70 иллюстрируется очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 70; на фиг. 71 иллюстрируется очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 71; на фиг. 72 иллюстрируется очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 72;-5 011168 на фиг. 73 иллюстрируется очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 73; на фиг. 74 иллюстрируется очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 74; на фиг. 75 иллюстрируется очистка конъюгата HSA: первый аналог GLP-2 (SEQ ID NO:52) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 75; и на фиг. 76 иллюстрируется очистка конъюгата RSA: первый аналог GLP-2 (SEQ ID NO:52) по предпочтительному варианту способа по настоящему изобретению, как описано в примере 76. Подробное описание предпочтительного варианта настоящего изобретения Согласно настоящему изобретению охватывается способ очистки конъюгатов альбумина из раствора, содержащего конъюгаты альбумина и неконъюгированный альбумин. Способы Получение контрольного (неконъюгированного) человеческого сывороточного альбумина (HAS) и преформированных конъюгатов альбумина. Каждое соединение с акцетором Михаэля солюбилизируют в "наночистой" воде (или, если соединение трудно солюбилизируется, в ДМСО) с концентрацией 10 мМ, затем разводят до концентрации 1 мМ в растворе HAS (25%, 250 мг/мл, Cortex-Biochem, San Leandro, CA). Затем образцы инкубируют при 37 С в течение 30 мин. Перед очисткой каждый конъюгат разводят до концентрации 5% 50 мг/мл HSA в 20 мМ натрий-фосфатном буфере (рН 7), содержащем 5 мМ октаноата натрия. Начальную концентрацию соли, применяемой в градиентной элюции, можно добавить к буферу для разведения раствора смеси. Предпочтительно начальная концентрация соли составляет около 750-1700 мМ (NH4)2SO4. Методика очистки по предпочтительному варианту изобретения Применяя хроматографическую систему очистки АКТА (Amersham Biosciences, Uppsala, Sweden),каждый конъюгат при скорости потока 2,5 мл/мин наносят на колонку 50 мл с бутилсефарозой 4 Fast(рН 7), содержащим 5 мМ октаноата натрия и 750 мМ-1,7 М (NH4)2SO4. В этих условиях увеличение молекулярной массы конъюгатов HAS составляет более 2 кДа относительно неконъюгированного HAS,нанеснного на гидрофобный полимер, тогда как практически весь неконъюгированный HAS элюируется из свободного объма колонки. Для увеличения молекулярной массы менее 2 кДа можно использовать более высокое начальное содержание соли с последующим постадийным градиентом уменьшения содержания соли. Каждый конъюгат можно очищать далее от любого свободного неконъюгированного соединения с применением постоянного или постадийного (непостоянного) градиента понижения концентрации соли (от 750 до 0 мМ (NH4)2SO4) в объме, равном 4 объмам колонки. В предпочтительном варианте изобретения каждый очищенный конъюгат затем обессоливают и концентрируют диафильтрацией, например, используя ультрафильтры (30 кДа) Amicon (Millipore Corporation, Bedford, MA). Наконец, для продолжительного хранения каждый раствор конъюгата предпочтительно помещают в жидкий азот и лиофилизируют, используя систему для лиофилизации Labconco (FreeZone4.5), и хранят при 20 С. Примеры ЖХ/ЭМС (LC/EMS) анализа После очистки 1 мкл каждого образца конъюгата предпочтительно инъецируют в систему LC/EMS. Конъюгат HSA: первый аналог GLP-1 (SEQ ID NO:1) подтверждают, обнаруживая наиболее распространнную частицу с общей молекулярной массой 70160 Да, что соответствует массе меркаптальбумина(66448 Да), в котором цистеин 34 находится в виде свободного тиола, плюс масса только одной молекулы аналога GLP-1 (3719.9 Да). Структура первого аналога GLP-1 (SEQ ID NO:1) описана ниже, в примере 1. Она иллюстрируется табл. 2. Таблица 2 Структуру конъюгата HSA: первый аналог GRF (SEQ ID NO:2) подтверждают, обнаруживая наиболее распространнную частицу с общей молекулярной массой 70086 Да, что соответствует массе меркаптальбумина (66448 Да), в котором цистеин 34 находится в виде свободного тиола, плюс масса только-6 011168 одной молекулы первого аналога GRF (3648.2 Да). Структура первого аналога GRF (SEQ ID NO:2) описана ниже в примере 2. Она иллюстрируется табл. 3. Таблица 3 Нижеприведнные примеры иллюстрируют некоторые соединения, содержащие малеинимидную группу в качестве акцептора Михаэля, которые были конъюгированы с альбумином и очищены в соответствии со способом по настоящему изобретению. Нижеприведнные примеры даются с целью иллюстрации настоящего изобретения, но не с целью ограничения его объма. В нижеприведнных примерах номера градиента относятся к следующим особенностям (характеристикам) градиента, где CV означает объм колонки 50 мл. Градиент 1. Линейный 750-0 мМ (NH4)2SO4, 4CV, скорость потока 2,5 мл/мин. Градиент 2. Ступенчатый градиент 1,75 М-1,2 М (NH4)2SO4, 0,5CV, затем 1,2 М-875 мМ(NH4)2SO4, 5CV, и наконец, 875 мМ-0 мМ (NH4)2SO4, 0,5CV, скорость потока 2,5 мл/мин. Градиент 3. Линейный 900-0 мМ (NH4)2SO4, 4CV, скорость потока 2.5 мл/мин. Градиент 4. Ступенчатый градиент 1,5 М-1,1 М (NH4)2SO4, 0,5CV, затем 1.1 М-375 мМ (NH4)2SO4,6CV, и наконец, 375 мМ-0 мМ (NH4)2SO4, 0,5CV, скорость потока 2.5 мл/мин. Градиент 5. Линейный 750-0 мМ (NH4)2SO4, 2CV, скорость потока 2,5 мл/мин. Градиент 6. Ступенчатый градиент 1,75 М-0 М (NH4)2SO4, 6CV, скорость потока 2.5 мл/мин. Градиент 7. Линейный 750-0 мМ (NH4)2SO4,6CV, скорость потока 2,5 мл/мин. Пример 1. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37 (-AEEA-MPA)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GLP-1, разведнным в 9 мл буфера, полученного из 20 мМ натрийфосфатного буфера рН 7,0, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 1 фракцию очищенного конъюгата элюирует в градиенте понижения концентрации (NH4)2SO4 как фракцию В (F8-F9), тогда как неконъюгированный альбумин элюируется из свободного объма колонки (фракция А). Фракцию конъюгата концентрируют на фильтре Ultrafree 30 кДа и анализируют с помощью LC-EMS. Пример 2. Очистка конъюгата HSA: первый аналог GRF (SEQ ID NO:2). Первый аналог GRF представляет собой GRF (1-29) dAla2 Gln8 Ala15 Leu27 Lys30(-MPA)CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GRP, разведнным в 9 мл буфера 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 2 фракция очищенного конъюгата наблюдается во фракции В (F6-F7), тогда как неконъюгированный альбумин элюируется из свободного объма колонки (фракция А). Фракцию конъюгата концентрируют на фильтре Ultrafree 30 кДа и анализируют с помощью LC- EMS. Пример 3. Очистка 1 мл неконъюгированного HAS. Очистку 1 мл 25% 250 мг/мл неконъюгированного HSA (Cortex- Biochem, San Leandro, CA), разведнного в 9 мл буфера (рН 7,0), полученного из 20 мМ натрий-фосфатного буфера, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. Практически все молекулы альбумина элюируются из свободного объма и никаких частиц белка не наблюдается при 280 нм в градиенте (NH4)2SO4. На фиг. 3 датся кривая разделения. Пример 4. Очистка конъюгата rHSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla Lys (-АЕЕА-МРА)-CONH2 и его последовательность представлена в примере 1. Очистку конъюгата, полученного по реакции 5 мл 5% rHSA (культура рекомбинантного HAS сте-7 011168 пени чистоты, доступной самыми современными методами), с 200 мкМ первого аналога GLP-1, разведнными в 5 мл буфера, приготовленного из 20 мМ натрий-фосфатного буфера, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 4 фракция очищенного конъюгата наблюдается во фракции В (F7-F8-F9). Пример 5. Очистка 10 мл HAS. Очистку 10 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, СА), разведнного в 40 мл буфера, полученного из 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ(NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. Практически все молекулы альбумина элюируются из свободного объма и никаких частиц белка не наблюдается при 280 нм в градиенте (NH4)2SO4. На фиг. 5 датся полученная кривая разделения. Пример 6. Очистка конъюгата HSA: аналог K-5 (SEQ ID NO:3). Аналог K5 представляет собой Ас-K5 Lys8 (- MPA)-NH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 4 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, СА) с 1 мМ аналога K-5, разведнным в 16 мл буфера, приготовленного из 20 мМ натрийфосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 6 фракция очищенного конъюгата наблюдается во фракции А с альбумином и во фракции В (F6-F7-F8). Пример 7. Очистка конъюгата HSA: первое производное инсулина (SEQ ID NO:4). Первое производное инсулина представляет собой человеческий инсулин с МРА в положении В 1 В цепи (SEQ ID NO:4) и нативной А цепью (SEQ ID NO: 35). Формула 1 представляет первое производное инсулина, описанное в настоящем примере, а также другие производные инсулина, описанные в последующих примерах. Формула 1 дает представление о дисульфидном мостике в цепи А и двух дисульфидных мостиках между цепями А и В для всех производных инсулина. Формула 1 Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого производного инсулина, разведнным в 9 мл буфера, приготовленного из 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 7 фракция очищенного конъюгата наблюдается во фракции В (F6-F7-F8). Пример 8. Очистка конъюгата HSA: второе производное инсулина (SEQ ID NO:5). Второе производное инсулина представляет собой человеческий инсулин с МРА в положении Al цепи A (SEQ ID NO:5) и нативной цепью В (SEQ ID NO: 53) и изображено как формула 1, пример 7. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Lean-8 011168dro, CA) с 1 мМ второго производного инсулина, разведнным в 9 мл 20 мМ натрийфосфатного буфера(рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 8 фракция очищенного конъюгата наблюдается во фракции В (F6-F7-F8). Пример 9. Очистка конъюгата HSA: первый аналог С 34 (SEQ ID NO:6). Первый аналог С 34 представляет собой MPA-AEEA-C34-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога С 34, разведнным в 20 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 9 фракция очищенного конъюгата наблюдается во фракции F2. Пример 10. Очистка конъюгата HSA: второй аналог С 34 (SEQ ID NO:7). Второй аналог С 34 представляет собой С 34 (1-34) Lys35 (- АЕЕА- МРА)-CONH2 и имеет следующую структуру: Очистку конъюгата, полученного по реакции 5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога С 34, разведнным в 20 мл 20 мМ натрий-фосфатного буфера, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 10 фракция очищенного конъюгата наблюдается во фракции F2. Пример 11. Очистка конъюгата HSA: третий аналог С 34 (SEQ ID NO:8). Второй аналог С 34 представляет собой С 34 (1-34) Lys13(- АЕЕА- МРА)-CONH2 и имеет следующую структуру: Очистку конъюгата, полученного по реакции 5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ третьего аналога С 34, разведнным в 20 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 11 фракция очищенного конъюгата наблюдается во фракции F2. Пример 12. Очистка L-цистеина. Очистку 121 мг L-цистеина в 2 мл буфера, полученного из 20 мМ фосфата натрия, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 5, описанном выше. На фиг. 12 показана полученная кривая разделения, на которой L-цистеин элюируется из свободного объма колонки (F3). Пример 13. Очистка конъюгата L-цистеин: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys (-АЕЕА-МРА)-CONH2 и его последовательность представлена в примере 1. Очистку конъюгата, полученного по реакции 121 мг L-цистеина с 36.36 мг первого аналога GLP-1,разведнными в 2 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ(NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 5, описанном выше. На фиг. 13 показана полученная кривая разделения, на которой избыток L-цистеина элюируется во фракции F3 (свободный объм колонки), а конъюгат L-цистеин: первый аналог GLP-1 элюируется при 0 мМ (NH4)2SO4. Пример 14. Очистка конъюгата HSA: второй аналог GLP-1 (SEQ ID NO:9). Второй аналог GLP-1 представляет собой GLP-1 (7-36) Lys37(- МРА)-NH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2.5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога GLP-1, разведнным в 10 мл 20 мМ натрий-фосфатного буфера (рН 7,0),5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 5,описанном выше. На фиг. 14 очищенный конъюгат выходит во фракции F2. Пример 15. Очистка конъюгата HSA: третий аналог GLP-1 (SEQ ID NO:10). Третий аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37 (-MPA)-NH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2.5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога GLP-1, разведнным в 10 мл 20 мМ натрий-фосфатного буфера (рН 7,0),-9 011168 5 мМ каприлата натрия и 750 мМ (NB4)2SO4, проводят на колонке с бутилсефарозой в градиенте 5,описанном выше. На фиг. 15 очищенный конъюгат выходит во фракции F2. Пример 16. Очистка конъюгата HSA: четвртый аналог GLP-1 (SEQ ID NO:11). Четвртый аналог GLP-1 представляет собой GLP-1 (7-36) Lys26(-АЕЕА- АЕЕА-МРА) и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ четвртого аналога GLP-1, разведнным в 10 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 16 очищенный конъюгат выходит во фракции F2. Пример 17. Очистка конъюгата HSA: пятый аналог GLP-1 (SEQ ID NO:12). Пятый аналог GLP-1 представляет собой GLP-1 (7-36) Lys34(-АЕЕА-АЕЕА-МРА) и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ пятого аналога GLP-1, разведнным в 10 мл 20 мМ натрий-фосфатного буфера (рН 7.0),5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1,описанном выше. На фиг. 17 очищенный конъюгат выходит во фракции F2. Пример 18. Очистка конъюгата HSA: первый аналог эксендина-4 (SEQ ID NO:13). Первый аналог эксендина-4 представляет собой эксендин-4 (1-39) Lys40(-МРА)-NH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога эксендина-4, разведнным в 9 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 18 очищенный конъюгат выходит во фракции F2. Пример 19. Очистка конъюгата HSA: второй аналог эксендина-4 (SEQ ID NO:14). Второй аналог эксендина-4 представляет собой эксендин-4 (9-39) Lys40(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 3,5 мл 25% HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога эксендина-4, разведнным в 21,5 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 19 очищенный конъюгат выходит во фракции F2. Пример 20. Очистка HSA: МРА. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 2 мМ МРА, разведнными в 9 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2, описанном выше. На фиг. 20 меркаптальбумин элюируется с фракцией A (F5), а кэпированный альбумин выходит с фракцией В (F7-F8). Фракцию конъюгата концентрируют с помощью фильтра Amicon 30 кДа. Пример 21. Очистка HAS. Очистку 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, СА), разведнного в 9 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2, описанном выше. При использовании градиента 2, в отличие от градиентов 1 и 5, как конъюгированный альбумин, так и неконъюгированный альбумин адсорбируются на гидрофобном полимере в процессе нанесения образца. На фиг. 21 показана полученная кривая разделения, на которой видно, что F4 и F5 обогащены меркаптальбумином, a F6, F7 и F8 обогащены кэпированным альбумином. Пример 22. Очистка конъюгата HSA: второй аналог С 34 (SEQ ID NO:3). Второй аналог С 34 представляет собой С 34 (1-34) Lys35(-AEEA- МРА)-CONH2 и его структура изображена в примере 10. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога С 34, разведнным в 9 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2,описанном выше. На фиг. 22 меркаптальбумин элюируется с фракцией A (F5), а кэпированный альбумин и очищенный конъюгат выходит с фракцией В (F7- F8). Пример 23. Очистка конъюгата HSA: первый аналог динорфина A (SEQ ID NO: 15). Первый аналог динорфина А представляет собой Dyn A (1-13) (МРА)-NH2 и имеет следующую структуру: YGGFLRRIRPKLK(MPA)-CONH2. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Lean- 10011168dro, CA) с 1 мМ первого аналога динорфина А, разведнным в 9 мл 20 мМ натрий-фосфатного буфера(рН 7.0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2, описанном выше. На фиг. 23 фракция очищенного конъюгата выходит с фракцией A (F11-F12). Пример 24. Очистка конъюгата HSA: первый аналог ANP (SEQ ID NO:16). Первый аналог ANP представляет собой МРА-АЕЕА-ANP(99-126)-CONH2 и имеет следующую структуру: Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога ANP, разведнным в 9 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2,описанном выше. На фиг. 24 фракция очищенного конъюгата выходит с фракцией A (F14). Пример 25. Очистка конъюгата HSA: второй аналог динорфина A (SEQ ID NO:17). Второй аналог динорфина А представляет собой Dyn A (7-13) Lys13(MPA)-CJNH2 и имеет следующую последовательность: RIRPKLK(MPA)-CONH2. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога динорфина А, разведнным в 9 мл 20 мМ натрий-фосфатного буфера(рН 7.0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2, описанном выше. На фиг. 25 фракция очищенного конъюгата выходит с фракцией A (F9). Пример 26. Очистка конъюгата HSA: ингибитор АСЕ (SEQ ID NO:18). В данном примере ингибитор АСЕ представляет собой ацетил-Phe-His-циклогексилстатил- Ie-Lys(АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ ингибитора АСЕ, разведнным в 9 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 2, описанном выше. На фиг. 26 фракция очищенного конъюгата выходит с фракцией A (F11-F12). Пример 27. Очистка конъюгата HSA: шестой аналог GLP-1 (SEQ ID NO:19). Шестой аналог GLP-1 представляет собой GLP-1 (7-36) Lys23(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 3 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, СА) с 1 мМ шестого аналога GLP-1, разведнным в 22 мл 20 мМ натрий-фосфатного буфера (рН 7,0),5 мМ каприлата натрия и 1750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1,описанном выше. На фиг. 27 очищенный конъюгат выходит во фракции F2. Пример 28. Очистка конъюгата HSA: седьмой аналог GLP-1 (SEQ ID NO:20). Седьмой аналог GLP-1 представляет собой GLP-1 (7-36) Lys (-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 3 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ седьмого аналога GLP-1, разведнным в 22 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 28 очищенный конъюгат выходит во фракции F2. Пример 29. Очистка конъюгата HSA: восьмой аналог GLP-1 (SEQ ID NO:21). Восьмой аналог GLP-1 представляет собой GLP-1 (7-36) Lys26(-АЕЕА- МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ восьмого аналога GLP-1, разведнным в 22,5 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 29 очищенный конъюгат выходит во фракции F2. Пример 30. Очистка конъюгата HSA: девятый аналог GLP-1 (SEQ ID NO:22). Девятый аналог GLP-1 представляет собой GLP-1 (7-36) Lys27(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 3 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ девятого аналога GLP-1, разведнным в 22 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 30 очищенный конъюгат выходит во фракции F2. Пример 31. Очистка конъюгата HSA: десятый аналог GLP-1 (SEQ ID NO:23). Десятый аналог GLP-1 представляет собой GLP-1 (7-36) Lys37(-АЕЕА-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ десятого аналога GLP-1, разведнным в 22,5 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 31 очищенный конъюгат выходит во фракции F2. Пример 32. Очистка конъюгата HSA: одиннадцатый аналог GLP-1 (SEQ ID NO:24). Одиннадцатый аналог GLP-1 представляет собой GLP-1 (7-36) Lys37(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ одиннадцатого аналога GLP-1, разведнным в 22,5 мл 20 мМ натрий-фосфатного буфера(рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 32 очищенный конъюгат выходит во фракции F2. Пример 33. Очистка конъюгата HSA: третий аналог эксендина-4 (SEQ ID NO:25). Третий аналог эксендина-4 представляет собой эксендин-4-(1-39) Lys40(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ третьего аналога эксендина- 4, разведнным в 22.5 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 33 очищенный конъюгат выходит во фракции F2. Пример 34. Очистка конъюгата HSA: двенадцатый аналог GLP-1 (SEQ ID NO:26). Двенадцатый аналог GLP-1 представляет собой GLP-1 (7-36) Lys34(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ двенадцатого аналога GLP-1, разведнным в 22,5 мл 20 мМ натрий-фосфатного буфера(рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 34 очищенный конъюгат выходит во фракции F2. Пример 35. Очистка конъюгата HSA: первое производное инсулина (SEQ ID NO:4). Первое производное инсулина представляет собой человеческий инсулин с МРА в положении В 1 цепи В (SEQ ID NO: 4) и нативной А цепью (SEQ ID NO: 35), и его структура подробно представлена в примере 7. Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого производного инсулина, разведнным в 22,5 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 35 очищенный конъюгат выходит во фракции F2. Пример 36. Очистка конъюгата HSA: третье производное инсулина (SEQ ID NO:27). Первое производное инсулина представляет собой человеческий инсулин с ОА-МРА в положении В 1 цепи В (SEQ ID NO: 27) и нативной А цепью (SEQ ID NO: 35), и его структура показана на формуле 1 в примере 7. Очистку конъюгата, полученного по реакции 4 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, СА) с 1 мМ третьего производного инсулина, разведнным в 21 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 36 очищенный конъюгат выходит во фракции F2. Пример 37. Очистка конъюгата HSA: второе производное инсулина (SEQ ID NO:5). Второе производное инсулина представляет собой человеческий инсулин с МРА в положении А 1 цепи A (SEQ ID NO: 5) и нативной цепью В (SEQ ID NO: 53), и его структура представлена на формуле 1 в примере 7. Очистку конъюгата, полученного по реакции 3 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Lean- 12011168dro, CA) с 1 мМ второго производного инсулина, разведнным в 22 мл 20 мМ натрий-фосфатного буфера(рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 37 очищенный конъюгат выходит во фракции F2. Пример 38. Очистка конъюгата HSA: четвртое производное инсулина (SEQ ID NO:28). Четвртое производное инсулина представляет собой человеческий инсулин с МРА в положении В 29 цепи В (SEQ ID NO: 28) и нативной цепью A (SEQ ID NO: 35), и его структура представлена на формуле 1 в примере 7. Очистку конъюгата, полученного по реакции 3 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ четвртого производного инсулина, разведнным в 22 мл 20 мМ натрийфосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 38 очищенный конъюгат выходит во фракции F2. Пример 39. Очистка конъюгата HSA: первый аналог GRF (SEQ ID NO:2). Первый аналог GRF представляет собой GRF (1-29) dAla2 Gln8 Ala15 Leu27 Lys30 (-MPA)CONH2, и его последовательность представлена в примере 2. Очистку конъюгата, полученного по реакции 3,7 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GRF, разведнным в 22 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 39 очищенный конъюгат выходит во фракции F2. Пример 40. Очистка конъюгата HSA: второй аналог GRF (SEQ ID NO:29). Второй аналог GRF представляет собой GRF (1-29) Lys30(-МРА)CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ второго аналога GRF, разведнным в 22,5 мл 20 мМ натрий- фосфатного буфера (рН 7,0),5 мМ каприлата натрия и 900 мМ (NH4)2SO4, проводят на колонке с бутил- сефарозой в градиенте 3,описанном выше. На фиг. 40 очищенный конъюгат выходит во фракции F2. Пример 41. Очистка конъюгата HSA: третий аналог GRF (SEQ ID NO:30). Третий аналог GRF представляет собой GRF (1-29) dAla2 Gln8 dArg11 Ala15 Leu27 Lys30(-MPA)CONH2, и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ третьего аналога GRF, разведнным в 22,5 мл 20 мМ натрий- фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил- сефарозой в градиенте 3, описанном выше. На фиг. 41 очищенный конъюгат выходит во фракции F2. Пример 42. Очистка конъюгата HSA: четвртый аналог GRF (SEQ ID NO:31). Четвртый аналог GRF представляет собой GRF (1-29) dAla Lys (-MPA)-CONH2, и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ третьего аналога GRF, разведнным в 22,5 мл 20 мМ натрийфосфатного буфера (рН 7,0),5 мМ каприлата натрия и 900 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 3,описанном выше. На фиг. 42 очищенный конъюгат выходит во фракции F2. Пример 43. Очистка конъюгата HSA: тринадцатый аналог GLP-1 CJC 1365 (SEQ ID NO:32). Тринадцатый аналог GLP-1 представляет собой GLP-1 (9-36) Lys37(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 3,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ тринадцатого аналога GLP- 1, разведнным в 21,5 мл 20 мМ натрий-фосфатного буфера(рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 43 очищенный конъюгат выходит во фракции F2. Пример 44. Очистка конъюгата HSA лактоза: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37(-АЕЕА-MPA)-CONH2 и имеет последовательность, показанную выше, в примере 1. Очистку конъюгата, полученного по реакции 4 мл 25% 250 мг/мл лактозаминированного альбумина(HSA, преинкубированного с избытком лактозы при 37 С, рН 7,0) с 200 мкМ первого аналога GLP- 1 в 4 мл буфера, приготовленного из 20 мМ фосфата натрия, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, (рН 7,0), проводят на колонке с бутил- сефарозой в градиенте 1, описанном выше. На фиг. 44 очищенный конъюгат выходит во фракции F2. Пример 45. Очистка конъюгата HSA: первый аналог Т 20 (SEQ ID NO:33). Первый аналог Т 20 представляет собой Ас-Т 20 (1-36) Lys37 (-АЕЕА- МРА)-CONH2 и имеет сле- 13011168 дующую последовательность: Очистку конъюгата, полученного по реакции 2,5 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога Т 20, разведнным в 10 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 45 очищенный конъюгат выходит во фракции F2. Пример 46. Очистка конъюгата HSA: первый аналог Т 1249 (SEQ ID NO:34). Первый аналог Т 1249 представляет собой Ас-Т 1249 (1-39) Lys40(-АЕЕА-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2 мл 25% 250 мг/мл HSA с 1 мМ первого аналога Т 1249 в 10,5 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4,проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 49 очищенный конъюгат выходит во фракции F4. Пример 47. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37(-AEEA-МРА)-CONH2 и его последовательность представлена в примере 1. Очистку 114,45 мг преформированного конъюгата первого аналога GLP-1 в 12.5 мл 20 мМ натрийфосфатного буфера (рН 7), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 5, описанном выше. На фиг. 47 показана кривая разделения, полученная для конъюгата, обнаруженного во фракции F2. Пример 48. Очистка конъюгата HSA: первый аналог С 34 (SEQ ID NO:6). Первый аналог C34 представляет собой МРА-АЕЕА-C34-CONH2 и имеет последовательность,представленную выше, в примере 9. Очистку 114,45 мг преформированного конъюгата первого аналога С-34 в 12.5 мл 20 мМ натрийфосфатного буфера (рН 7), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4 проводят на колонке с бутилсефарозой в градиенте 5, описанном выше. На фиг. 48 показана кривая разделения, полученная для конъюгата, обнаруженного во фракции F2. Пример 49. Очистка конъюгата HSA: второй аналог GRF (SEQ ID NO:29). Второй аналог GRF представляет собой GRF (1-29) Lys30(-МРА)-CONH2, и его последовательность показана выше в примере 40. Очистку 125,53 мг преформированного конъюгата второго аналога GRF в 12,5 мл 20 мМ натрийфосфатного буфера (рН 7), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, рН 7,0, проводят на колонке с бутилсефарозой в градиенте 5, описанном выше. На фиг. 49 показана кривая разделения, полученная для конъюгата, обнаруженного во фракции F2. Пример 50. Очистка конъюгата HSA: аналог винорельбина (SEQ ID NO:35). Первый аналог винорельбина представляет собой молекулу винорельбина с присоединнным к ней фрагментом АЕЕА- МРА и имеет следующую структуру: Очистку конъюгата, полученного из 2,5 мл 25% HSA и 1 мМ аналога винорельбина в 22.5 мл буфера, приготовленного из 20 мМ натрий-фосфатного буфера, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4,рН 7,0, проводят на колонке с бутил-сефарозой в градиенте 4, описанном выше. На фиг. 50 очищенный конъюгат выходит во фракции F2. Фракцию конъюгата концентрируют на ультрафильтре Amicon 30 кДа. Пример 51. Очистка L-цистеина. Очистку 2,5 мл 40 мМ L-цистеина в 22,5 мл 20 мМ натрий-фосфатного буфера (рН 7), 5 мМ каприлата натрия и 1500 мМ (NH4)2SO4, рН 7,0, проводят на колонке с бутил-сефарозой в градиенте 4, описанном выше. На фиг. 51 показана кривая разделения, полученная для L-цистеина, элюированного из свободного объма колонки (фракция F3). Пример 52. Очистка конъюгата L-цистеин: аналог винорельбина (SEQ ID NO:35). Аналог винорельбина представляет собой молекулу винорельбина с присоединнным к ней фрагментом АЕЕА-МРА, как иллюстрируется в примере 50.- 14011168 Очистку конъюгата, полученного по реакции 2,5 мл 40 мМ L-цистеина с 1 мМ аналога винорельбина в 22,5 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4,проводят на колонке с бутилсефарозой в градиенте 4, описанном выше. На фиг. 52 иллюстрируется кривая разделения, полученная для конъюгата L-цистеина, элюирующегося с фракциями F8, F9 и F10. Пример 53. Очистка конъюгата RSA: третий аналог эксендина-4 (SEQ ID NO:25). Третий аналог эксендина-4 представляет собой эксендин-4-(1-39) Lys40(-AEEA-МРА)-CONH2 и имеет последовательность, показанную в примере 33. Очистку конъюгата, полученного по реакции 11 мл 5% RSA (сывороточный альбумин крысы) с 200 мкМ третьего аналога эксендина-4 в 11 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 53 очищенный конъюгат выходит во фракции F2. Пример 54. Очистка конъюгата HSA: четвртый аналог С 34 (SEQ ID NO:36). Четвртый аналог С 34 представляет собой С 34 (1-34) Lys13(-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ четвртого аналога С 34 в 13 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 54 очищенный конъюгат выходит во фракции F2. Пример 55. Очистка конъюгата HSA: пятый аналог С 34 (SEQ ID NO:37). Пятый аналог С 34 представляет собой С 34 (1-34) Lys35(-МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ пятого аналога С 34 в 13 мл буфера, приготовленного из 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ(NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 55 очищенный конъюгат выходит во фракции F2. Пример 56. Очистка конъюгата HSA: шестой аналог С 34 (SEQ ID NO:38). Шестой аналог С 34 представляет собой МРА-С 34 (1-34)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ шестого аналога С 34 в 13 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 56 очищенный конъюгат выходит во фракции F2. Пример 57. Очистка конъюгата HSA: седьмой аналог С 34 (SEQ ID NO:39). Седьмой аналог С 34 представляет собой Ac- C34 (1-34) Glu2 Lys6 Lys7 Glu9 Glu10 Lys13 Lys14 Glu16 17Glu Lys20 Lys21 Glu23 Glu24 Lys27 Glu31 Lys34 Lys35 Lys36 (-AEEA-MPA)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ седьмого аналога С 34 в 13 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 57 очищенный конъюгат выходит во фракции F2. Пример 58. Очистка конъюгата HSA: восьмой аналог С 34 (SEQ ID NO:40). Восьмой аналог С 34 представляет собой MPA-АЕЕА-С 34 (1-34) Glu2 Lys6 Lys7 Glu9 Glu10 Lys13 Lys14Glu16 Glu17 Lys20 Lys21 Glu23 Glu24 Lys27 Glu31 Lys34 Lys35-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ восьмого аналога C34 в 13 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 58 очищенный конъюгат выходит во фракции F2. Пример 59. Очистка конъюгата HSA: первый аналог PYY (SEQ ID NO:41). Первый аналог PYY представляет собой PYY (3-36) Lys4 (-ОА- МРА)-CONH2 и имеет следующую структуру:- 15011168 Очистку конъюгата, полученного по реакции 1.5 мл 25% HSA с 1 мМ первого аналога PYY в 6 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 59 очищенный конъюгат выходит во фракции F2. Пример 60. Очистка конъюгата HSA: второй аналог PYY (SEQ ID NO:42). Первый аналог PYY представляет собой МРА-OA-PYY (3-36)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 1,5 мл 25% HSA с 1 мМ второго аналога PYY в 6 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 60 очищенный конъюгат выходит во фракции F2. Пример 61. Очистка конъюгата HSA: пятое производное инсулина (SEQ ID NO:43). Пятое производное инсулина представляет собой человеческий инсулин с AEEAS-AEEAS-MPA в положении В 29 цепи В (SEQ ID NO: 43) и нативной цепью A (SEQ ID NO: 35) и изображено на формуле 1, пример 7. Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ пятого производного инсулина в 15 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 61 очищенный конъюгат выходит во фракции F2. Пример 62. Очистка конъюгата HSA: шестое производное инсулина (SEQ ID NO:44). Шестое производное инсулина представляет собой человеческий инсулин с AEEAS-AEEAS-MPA в положении В 1 цепи В (SEQ ID NO: 44) и нативной цепью A (SEQ ID NO: 35) и изображено на формуле 1,пример 7. Очистку конъюгата, полученного по реакции 2.5 мл 25% HSA с 1 мМ шестого производного инсулина в 15 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4,проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 62 очищенный конъюгат выходит во фракции F2. Пример 63. Очистка конъюгата HSA: седьмое производное инсулина (SEQ ID NO:45). Седьмое производное инсулина представляет собой человеческий инсулин с ОА-МРА в положении В 29 цепи В (SEQ ID NO: 45) и нативной А цепью (SEQ ID NO: 35) и изображено на формуле 1, пример 7. Очистку конъюгата, полученного по реакции 2 мл 25% HSA с 1 мМ седьмого производного инсулина в 15 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4,проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 63 очищенный конъюгат выходит во фракции F2. Пример 64. Очистка конъюгата HSA: второй аналог PYY (SEQ ID NO:46). Третий аналог PYY представляет собой MPA-PYY (3-36)-CONH2 и имеет следующую последовательность: МРА-NH-IKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY- CONH2 Очистку конъюгата, полученного по реакции 3 мл 25% HSA с 1 мМ третьего аналога PYY в 18 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 64 очищенный конъюгат выходит во фракции F2. Пример 65. Очистка конъюгата HSA: четвртый аналог PYY (SEQ ID NO:47). Четвртый аналог PYY представляет собой PYY (3-36) Lys37(-МРА)-CONH2 и имеет следующую последовательность:IKPEAPGEDASPEELNRYYASLRHYLNLVTRQRYK(MPA)-CONH2 Очистку конъюгата, полученного по реакции 3 мл 25% HSA с 1 мМ четвртого аналога PYY в 18 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 65 очищенный конъюгат выходит во фракции F2. Пример 66. Очистка конъюгата HSA: пятый аналог PYY (SEQ ID NO:48). Пятый аналог PYY представляет собой MPA- PYY (22-36)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 6 мл 25% HSA с 1 мМ пятого аналога PYY в 36 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 900 мМ (NH4)2SO4, проводят на ко- 16011168 лонке с бутил-сефарозой в градиенте 3, описанном выше. На фиг. 66 очищенный конъюгат выходит во фракции F2. Пример 67. Очистка конъюгата HSA: шестой аналог PYY (SEQ ID NO:49). Шестой аналог PYY представляет собой Ацетил-PYY (22- 36) Lys37(- МРА)-CONH2 и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 6 мл 25% HSA с 1 мМ шестого аналога PYY в 36 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 900 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 3, описанном выше. На фиг. 67 очищенный конъюгат выходит во фракции F2. Пример 68. Очистка конъюгата HSA: второй аналог ANP (SEQ ID NO:50). Второй аналог ANP представляет собой МРА-ANP (99-126)- CONH2 и имеет следующую структуру: Очистку конъюгата, полученного по реакции 1 мл 25% HSA с 1 мМ шестого аналога ANP в 14 мл 20 мМ натрий-фосфатного буфера (рН 7.0), 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 3, описанном выше. На фиг. 68 очищенный конъюгат выходит во фракции F2. Пример 69. Очистка конъюгата HSA: третий аналог ANP (SEQ ID NO:51). Третий аналог ANP представляет собой ANP (99-126), прореагировавший с MAL-dPEG4 (QuantaBiodesign, Powell, OH, USA), связанным с Ser". Полученный в результате аналог ANP представляет собой МРА-ЕЕЕЕР-ANP (99- 126), где ЕЕЕЕР обозначает этокси- этокси- этокси- этоксипропионовую кислоту; и имеет следующую последовательность: Очистку конъюгата, полученного по реакции 1 мл 25% HSA с 1 мМ шестого аналога CJC 1681 в 14 мл 20 мМ натрий-фосфатного буфера (рН 7,0), 5 мМ каприлата натрия и 900 мМ (NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 3, описанном выше. На фиг. 69 А и 69 В очищенный конъюгат выходит во фракции F2. Пример 70. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37(-AEEA-MPA)-CONH2 и его последовательность представлена выше, в примере 1. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GLP- 1, разведнным в 9 мл буфера, приготовленного из 20 мМ натрийфосфатного буфера рН 7.0, 5 мМ каприлата натрия и 1.75 М (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 6, описанном выше. На фиг. 70 фракция очищенного конъюгата выходит во фракции В. Пример 71. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37 (-AEEA-MPA)-CONH2 и его последовательность представлена выше, в примере 1. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GLP-1, разведнным в 9 мл буфера, приготовленного из 20 мМ натрийфосфатного буфера рН 7,0, 5 мМ каприлата натрия и 1,75 М (сульфата магния, проводят на колонке с бутил-сефарозой в градиенте 6, описанном выше. На фиг. 71 фракция очищенного конъюгата выходит во фракции F2. Пример 72. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37(-АЕЕА-МРА)-CONH2, и его последовательность представлена выше, в примере 1. Пример с 750 мМ сульфата аммония. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GLP-1, разведнным в 9 мл буфера, приготовленного из 20 мМ натрий-фосфатного буфера рН 7,0, 5 мМ каприлата натрия и 750 мМ(NH4)2SO4, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 72 фракция очищенного конъюгата выходит во фракции F2. Пример 73. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37(-АЕЕА-MPA)-CONH2 и его последовательность представлена выше, в примере 1. Пример с 1,75 М фосфата аммония. Очистку конъюгата, полученного по реакции 1 мл 25% 250- 17011168 мг/мл HSA (Cortex- Biochem, San Leandro, CA) с 1 мМ первого аналога GLP- 1, разведнным в 9 мл буфера, приготовленного из 20 мМ натрийфосфатного буфера рН 7,0, 5 мМ каприлата натрия и 1,75 М фосфата аммония, проводят на колонке с бутил- сефарозой в градиенте 6, описанном выше. На фиг. 73 фракция очищенного конъюгата выходит во фракции В. Пример 74. Очистка конъюгата HSA: первый аналог GLP-1 (SEQ ID NO:1). Первый аналог GLP-1 представляет собой GLP-1 (7-36) dAla8 Lys37(-AEEA-MPA)-CONH2, и его последовательность представлена выше, в примере 1. Пример с 750 мМ фосфата аммония. Очистку конъюгата, полученного по реакции 1 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, CA) с 1 мМ первого аналога GLP-1, разведнным в 9 мл буфера, приготовленного из 20 мМ натрий-фосфатного буфера рН 7.0, 5 мМ каприлата натрия и 750 мМ фосфата аммония, проводят на колонке с бутил-сефарозой в градиенте 1, описанном выше. На фиг. 74 фракция очищенного конъюгата выходит во фракции F2. Пример 75. Очистка конъюгата HSA: первый аналог GLP-2 (SEQ ID NO:52). Первый аналог GLP-2 представляет собой GLP-2 (1-33) Gly2 Lys34(-МРА)-CONH2 и имеет следующую последовательность:HGDGSFSDEMNTILDNLAARDFINWLIQTKITDK(MPA)-CONH2 Очистку конъюгата, полученного по реакции 2 мл 25% 250 мг/мл HSA (Cortex-Biochem, San Leandro, СА) с 1 мМ первого аналога GLP-2, разведнным в 14 мл буфера, приготовленного из 20 мМ натрийфосфатного буфера рН 7,0, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 75 фракция очищенного конъюгата выходит во фракции F2. Пример 76. Очистка конъюгата RSA: первый аналог GLP-2 (SEQ ID NO:52). Первый аналог GLP-2 представляет собой GLP-2 (1-33) Gly2 Lys34(-МРА)-CONH2, и его последовательность представлена в примере 75. Очистку конъюгата, полученного по реакции 9 мл 25% 250 мг/мл RSA (сывороточный альбумин крысы) с 1 мМ первого аналога GLP- 2, разведнным в 14 мл буфера, приготовленного из 20 мМ натрийфосфатного буфера рН 7,0, 5 мМ каприлата натрия и 750 мМ (NH4)2SO4, проводят на колонке с бутилсефарозой в градиенте 1, описанном выше. На фиг. 76 фракция очищенного конъюгата выходит во фракции F2. Хотя изобретение описывается на его конкретных вариантах, понятно, что возможны его дальнейшие модификации, и предполагается, что данная заявка охватывает любые варианты, применения или улучшения изобретения, следующие, в целом, принципам изобретения и включающие такие отступления от настоящего описания, которые подпадают под известную или обычную практику в уровне техники, к которой относится изобретение, и которые могут быть применены к основным признакам, представленным выше в данном описании, и которые соответствуют объму прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ отделения конъюгата альбумина от неконъюгированного альбумина в растворе, содержащем конъюгат альбумина и неконъюгированный альбумин, включающий: а) нанесение раствора на гидрофобную твердую подложку, уравновешенную водным буфером с высоким содержанием соли; б) подачу на подложку градиента, понижающего содержание соли и в) сбор конъюгата альбумина. 2. Способ по п.1, отличающийся тем, что конъюгат альбумина состоит из молекулы, содержащей ковалентно присоединнный к ней акцептор Михаэля. 3. Способ по п.2, отличающийся тем, что присоединение осуществляется между акцептором Михаэля и цистеином 34 альбумина. 4. Способ по п.2, отличающийся тем, что акцептор Михаэля представляет собой малеинимидную группу. 5. Способ по п.4, отличающийся тем, что малеинимидная группа представляет собой малеинимидпропионовую кислоту (МРА). 6. Способ по п.1, отличающийся тем, что альбумин выбирают из группы, состоящей из сывороточного альбумина и рекомбинантного альбумина. 7. Способ по п.1, отличающийся тем, что альбумин выбирают из группы, состоящей из человеческого альбумина, альбумина крысы, альбумина мыши, альбумина свиньи, бычьего альбумина, альбумина собаки и кроличьего альбумина. 8. Способ по п.1, отличающийся тем, что альбумин представляет собой человеческий сывороточный альбумин. 9. Способ по п.1, отличающийся тем, что альбумин модифицирован с помощью по меньшей мере одного агента, выбранного из группы, состоящей из жирных кислот, ионов металлов и сахаров. 10. Способ по п.9, отличающийся тем, что сахара выбирают из группы, состоящей из глюкозы, лак- 18011168 тозы и маннозы. 11. Способ по п.1, отличающийся тем, что молекулу выбирают из группы, состоящей из пептида,ДНК, РНК и их комбинаций, к которым ковалентно присоединн акцептор Михаэля, возможно через линкер. 12. Способ по п.11, отличающийся тем, что молекула представляет собой пептид с молекулярной массой по меньшей мере 57 Да. 13. Способ по п.11, отличающийся тем, что пептид выбран из группы, состоящей из глюкагоноподобного пептида 1 (GLP-1), эксендин-4, предсердного натрийуретического пептида (ANP), крингл 5 (K5),динорфина, фактора высвобождения гормона роста (GRF), инсулина, натрийуретических пептидов, энфувиртида (Т-20), Т-1249, С-34, растворимого С-35 пептида EF (SC-35), пептида YY (PYY) и их аналогов. 14. Способ по п.2, отличающийся тем, что молекула выбрана из группы, состоящей из винорельбина, гемцитабина и паклитаксела. 15. Способ по п.11, отличающийся тем, что молекула ковалентно присоединена к альбумину чувствительной к кислоте ковалентной связью или пептидной последовательностью, чувствительной к протеолитическому расщеплению, что способствует отделению молекулы от альбумина и входу молекулы в клетку. 16. Способ по п.1, отличающийся тем, что гидрофобная твердая подложка представляет собой колонку, содержащую гидрофобный полимер. 17. Способ по п.16, отличающийся тем, что гидрофобный полимер выбирают из группы, состоящей из октилсефарозы, фенилсефарозы и бутилсефарозы. 18. Способ по п.16, отличающийся тем, что гидрофобный полимер представляет собой бутилсефарозу. 19. Способ по п.1, отличающийся тем, что соль оказывает эффект высаливания, достаточный для промотирования взаимодействий лиганд-протеин. 20. Способ по п.1, отличающийся тем, что соль выбирают из группы, состоящей из фосфата аммония, сульфата аммония и фосфата магния. 21. Способ по п.1, отличающийся тем, что соль представляет собой фосфат аммония или сульфат аммония. 22. Способ по п.1, отличающийся тем, что соль представляет собой сульфат аммония. 23. Способ по п.1, отличающийся тем, что градиент, понижающий содержание соли, имеет начальную концентрацию соли менее 3000 мМ. 24. Способ по п.1, отличающийся тем, что градиент, понижающий содержание соли, имеет начальную концентрацию соли от 500 до 1000 мМ. 25. Способ по пп.2, 4 или 5, отличающийся тем, что молекула представляет собой пептид, к которому ковалентно присоединн акцептор Михаэля, возможно через линкер. 26. Способ по п.25, отличающийся тем, что пептид выбран из группы, состоящей из глюкагоноподобного пептида 1 (GLP-1), глюкагоноподобного пептида 2 (GLP-2), эксендин-4, предсердного натрийуретического пептида (ANP), крингл 5 (K5), динорфина, фактора высвобождения гормона роста (GRF),инсулина, натрийуретических пептидов, энфувиртида (Т-20), Т-1249, С-34, растворимого С-35 пептидаEF (SC-35), пептида YY (PYY). 27. Способ по пп.2, 4 или 5, отличающийся тем, что молекула выбрана из группы, состоящей из(99-126)-CONH2 (SEQ ID NO:50), MPA-EEEEP-ANP (99-126) (SEQ ID NO:51), GLP-2 (1-33) Gly2 Lys34 (MPA)-CONH2 (SEQ ID NO:52). 28. Способ по п.26, отличающийся тем, что пептид представляет собой GLP-1 (7-36) dAla8 Lys37. 29. Способ по п.26, отличающийся тем, что пептид представляет собой эксендин-4 (1-39) Lys40. 30. Способ по пп.2, 4 или 5, отличающийся тем, что молекула представляет собой GLP-1 (7-36)
МПК / Метки
МПК: B01D 15/08, A61K 47/48, A61K 47/42, C07K 14/76, C07K 1/20
Метки: способ, альбумина, конюгатов, очистки
Код ссылки
<a href="https://eas.patents.su/30-11168-sposob-ochistki-konyugatov-albumina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ очистки конъюгатов альбумина</a>
Предыдущий патент: Производные сульфонамида для лечения заболеваний
Следующий патент: Система подкожной доставки, способ ее получения и ее применение для лечения холинергических дефицитных расстройств
Случайный патент: Композиция самоукладывающегося бетона и самоукладывающийся бетон, содержащий такую композицию