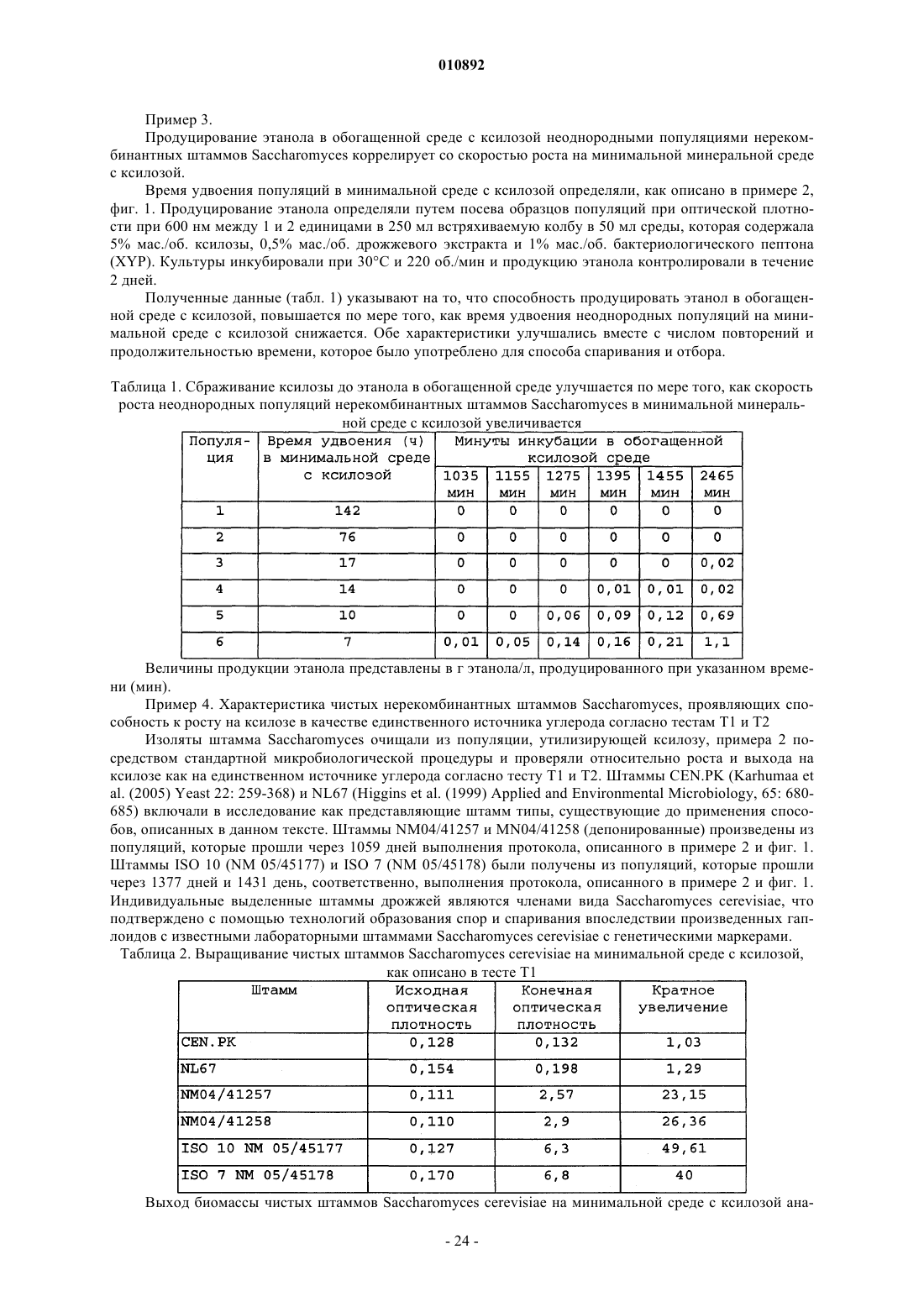
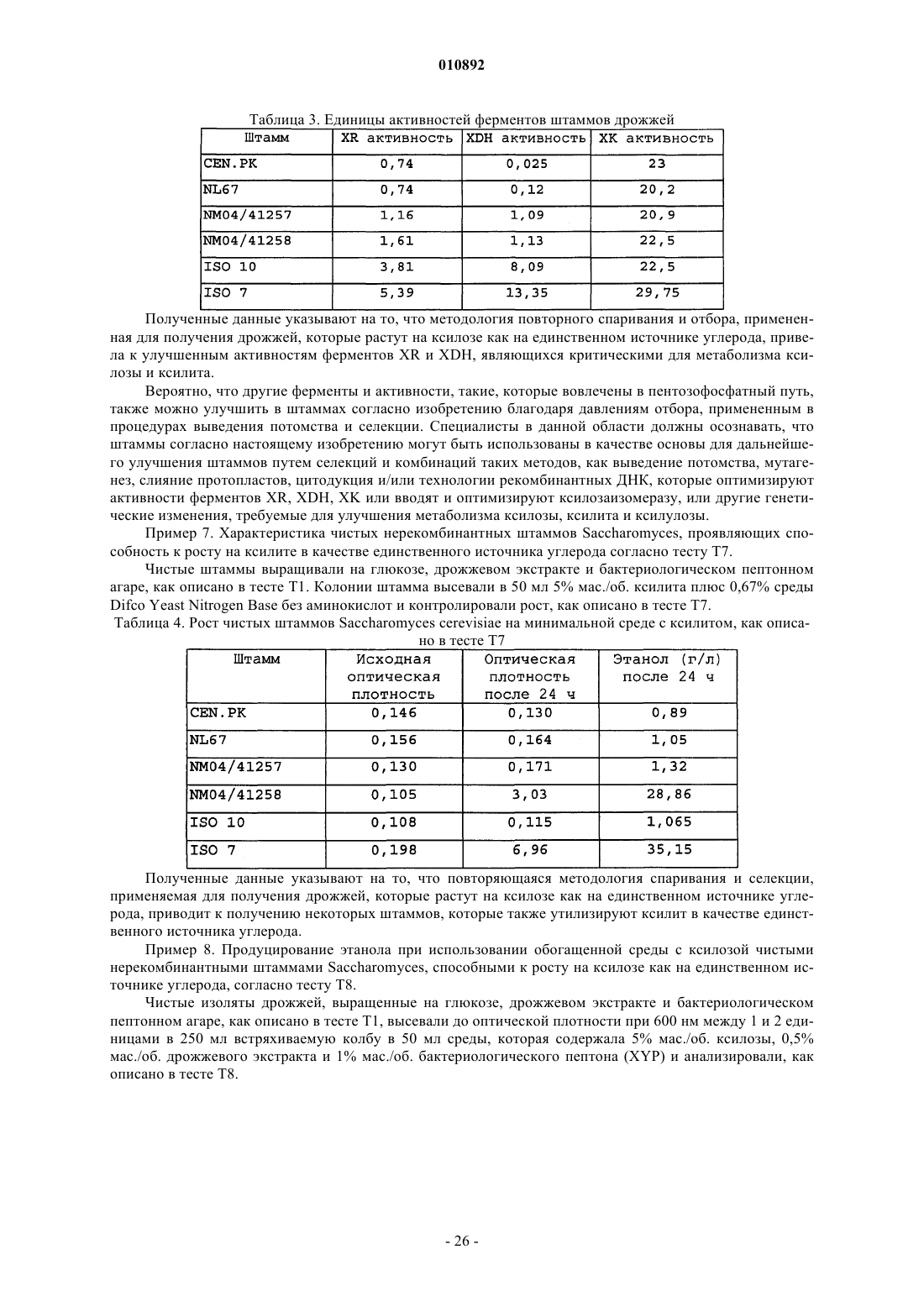
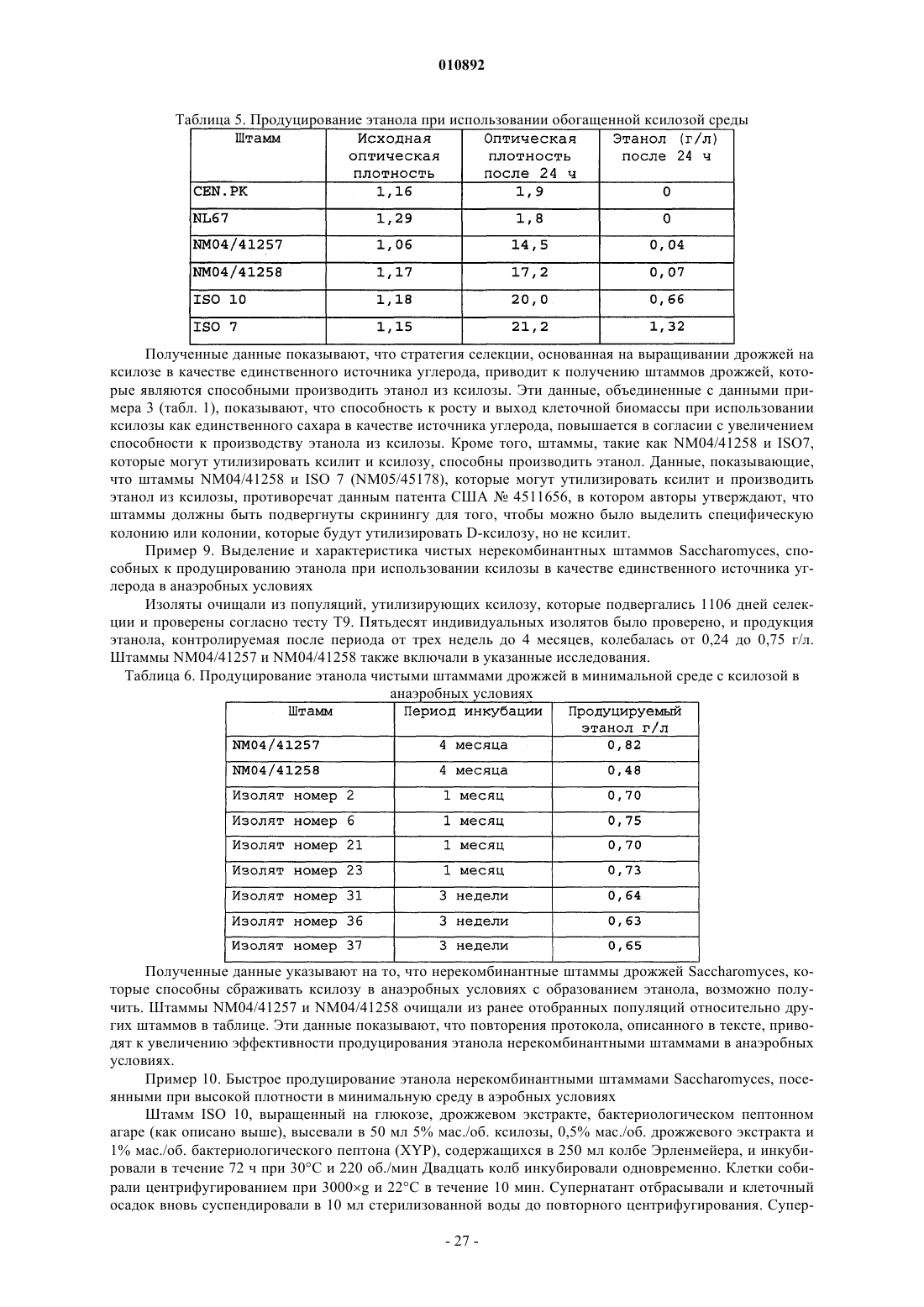
Нерекомбинантные штаммы saccharomyces, которые растут на ксилозе
Номер патента: 10892
Опубликовано: 30.12.2008
Формула / Реферат
1. Способ получения штамма Saccharomyces, который способен расти при желательной скорости роста, используя ксилозу в качестве единственного источника углерода для роста, где способ включает стадии:
(a) обеспечения популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces;
(b) культивирования клеток дрожжей в условиях, допускающих комбинирование ДНК между дрожжевыми клетками;
(c) проведения скрининга или селекции дрожжевых клеток в пользу клеток дрожжей, которые проявляют повышенную скорость роста, используя ксилозу в качестве единственного источника углерода для роста;
(d) выделения одной или более клеток дрожжей, проявляющих желательную скорость роста.
2. Способ по п.1, где прошедшие скрининг клетки или отобранные клетки образуют популяцию генетически различных нерекомбинантных клеток дрожжей, и стадии (b) и (с) повторяют до тех пор, пока не будет достигнута желательная скорость роста.
3. Способ получения штамма Saccharomyces в культуре, который способен расти со скоростью роста, составляющей по крайней мере одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста, где способ включает стадии:
(a) обеспечения популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces;
(b) культивирования клеток дрожжей в условиях, допускающих комбинирование ДНК между дрожжевыми клетками;
(c) проведения скрининга или селекции дрожжевых клеток путем инкубации клеток дрожжей на среде или в среде, содержащей ксилозу;
(d) повторения стадий (b) и (с) с прошедшими скрининг клетками или отобранными клетками, образующими популяцию генетически различных нерекомбинантных клеток дрожжей Saccharomyces, до тех пор, пока одна или более дрожжевых клеток не приобретут способность расти со скоростью роста, составляющей по крайней мере одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста.
4. Способ по любому из пп.1-3, где дрожжевые клетки на стадии (с) подвергают отбору путем инкубации клеток дрожжей на среде, содержащей ксилозу.
5. Способ по любому из пп.1-4, где содержащая ксилозу среда содержит ксилозу в качестве единственного источника углерода.
6. Способ по любому из пп.1-5, где содержащая ксилозу среда является минимальной средой, содержащей ксилозу.
7. Способ по любому из пп.1-4, где содержащая ксилозу среда содержит ксилозу в качестве одного из множества источников углерода.
8. Способ по любому из пп.1-7, где дрожжевые клетки инкубируют на среде или в среде, содержащей ксилозу, в течение периода времени, достаточного для того, чтобы клетки дрожжей, которые не имеют повышенной скорости роста, используя ксилозу в качестве единственного источника углерода, могли расти на ксилозе.
9. Способ по любому из пп.1-8, где комбинирование ДНК между дрожжевыми клетками осуществляют путем спаривания.
10. Способ по п.9, где спаривание осуществляют посредством образования спор дрожжевых клеток и гибридизации компетентного по половому признаку потомства.
11. Способ по любому из пп.1-10, где популяция генетически различных клеток дрожжей включает по крайней мере два генетически различных штамма дрожжей.
12. Способ по любому из пп.1-11, где популяция дрожжевых клеток включает природные штаммы Saccharomyces.
13. Способ по любому из пп.1-10, где популяция генетически различных нерекомбинантных клеток дрожжей включает штаммы Saccharomyces, произведенные путем какого-либо одного или более химического или физического мутагенеза, слияния протопластов, спорообразования и гибридизации, цитодукции.
14. Способ по любому из пп.1-13, где популяция генетически различных клеток дрожжей включает вид Saccharomyces cerevisiae.
15. Штамм, полученный способом по любому из пп.1-14.
16. Производное штамма по п.15.
17. Выделенный штамм Saccharomyces, который способен расти со скоростью роста, составляющей одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста, где штамм производит:
(i) 5-кратное увеличение биомассы при выращивании в условиях, установленных в тесте T1; и
(ii) по крайней мере 10 мг сухого веса биомассы при выращивании в условиях, установленных в тесте Т2, и где штамм получен способом по любому из пп.1-14.
18. Выделенный штамм Saccharomyces, который способен расти со скоростью роста, составляющей одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста, где:
(i) штамм производит 10-кратное увеличение биомассы при выращивании в условиях, установленных в тесте T1; и
(ii)штамм производит по крайней мере 50 мг сухого веса биомассы при выращивании в условиях, установленных в тесте Т2; и
(iii) по крайней мере 0,1 г/л этанола определяется в тесте Т3; и
(iv) по крайней мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30шC при определении в тесте Т4; и
(v) по крайней мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30шC при определении в тесте Т5; и
где штамм получен способом по любому из пп.1-14.
19. Выделенный штамм Saccharomyces, который способен расти со скоростью роста, составляющей одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста, где
(i) штамм производит по крайней мере 5-кратное увеличение биомассы при выращивании в условиях, установленных в тесте T1; и
(ii) штамм производит по крайней мере 40 мг сухого веса биомассы при выращивании в условиях, установленных в тесте Т2; и
(iii) по крайней мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30шC при определении в тесте Т4; и
(iv) по крайней мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30шC при определении в тесте Т5; и
(v) штамм производит по крайней мере 5-кратное увеличение биомассы при использовании ксилита в качестве единственного источника углерода в условиях, установленных в тесте Т7;
(vi) концентрация по крайней мере 0,04 г/л этанола определяется, когда штамм подвергается испытанию Т8;
и где штамм получен способом по любому из пп.1-14.
20. Выделенный штамм Saccharomyces, который способен расти со скоростью, составляющей по крайней мере одну генерацию за 48 ч при использовании ксилозы в качестве единственного источника углерода для роста, где штамм приобретает способность утилизировать ксилозу как единственный источник углерода с помощью нерекомбинантных методов.
21. Штамм по п.20, где скорость роста является выше, чем одна генерация за 24 ч.
22. Штамм по п.20, где скорость роста является выше, чем одна генерация за 8 ч.
23. Штамм по п.20, где скорость роста является выше, чем одна генерация за 4 ч.
24. Штамм по п.20, где скорость роста является выше, чем одна генерация за 2 ч.
25. Штамм по любому из пп.20-24, где штамм производит по крайней мере 2-кратное увеличение биомассы при выращивании в условиях, установленных в тесте T1.
26. Штамм по любому из пп.20-25, где штамм производит по крайней мере 5-кратное увеличение биомассы при выращивании в условиях, установленных в тесте T1.
27. Штамм по любому из пп.20-26, где штамм производит по крайней мере 0,01 г сухого веса биомассы на 50 мл культуры при выращивании в условиях, установленных в тесте Т2.
28. Штамм по любому из пп.20-27, где штамм экспрессирует нерекомбинантный фермент, имеющий активность ксилозаредуктазы по крайней мере 1 единицу при определении тестом Т4.
29. Штамм по любому из пп.20-28, где штамм экспрессирует нерекомбинантный фермент, имеющий активность ксилитдегидрогеназы по крайней мере 1 единицу при определении тестом Т5.
30. Штамм по любому из пп.20-29, где штамм экспрессирует нерекомбинантный фермент, имеющий активность ксилулозакиназы по крайней мере 10 единиц при определении тестом Т6.
31. Штамм по любому из пп.20-30, где штамм экспрессирует нерекомбинантный фермеэт, имеющий активность ксилозаредуктазы по крайней мере 1 единицу при определении тестом Т4, и нерекомбинантный фермент, имеющий активность ксилитдегидрогеназы по крайней мере 1 единицу при определении тестом Т5.
32. Выделенный штамм Saccharomyces, который проявляет способность расти на ксилозе как на единственном источнике углерода со скоростью, составляющей по крайней мере одну генерацию за 48 ч, и который способен экспрессировать нерекомбинантный фермент, имеющий активность, выбранную из группы, состоящей из активности ксилозаредуктазы и активности ксилитдегидрогеназы, где активность ксилозаредуктазы составляет по крайней мере 1 единицу при определении тестом Т4, и активность ксилитдегидрогеназы составляет по крайней мере 1 единицу при определении тестом Т5.
33. Штамм по п.32, где штамм проявляет способность экспрессировать нерекомбинантный фермент, обладающий активностью ксилозаредуктазы, и нерекомбинантный фермент, обладающий активностью ксилитдегидрогеназы.
34. Штамм по п.32 или 33, где штамм проявляет способность экспрессировать нерекомбинантный фермент, обладающий активностью ксилулозакиназы, в добавление к одному или более нерекомбинантных ферментов, обладающих активностью, выбранной из группы, состоящей из активности ксилозаредуктазы и активности ксилитдегидрогеназы.
35. Штамм по п.34, где активность ксилулозакиназы составляет по крайней мере 10 единиц при определении тестом Т6.
36. Штамм по любому из пп.32-35, где штамм растет со скоростью выше, чем одна генерация за 24 ч, используя ксилозу в качестве единственного источника углерода для роста.
37. Штамм по любому из пп.32-36, где биомасса штамма увеличивается по крайней мере в 2 раза при определении в тесте T1.
38. Штамм по любому из пп.32-37, где биомасса штамма увеличивается по крайней мере в 5 раз при определении в тесте T1.
39. Штамм по любому из пп.32-38, где биомасса штамма увеличивается по крайней мере в 10 раз при определении в тесте T1.
40. Штамм по любому из пп.20-39, где биомасса штамма увеличивается по крайней мере в 5 раз при определении в тесте Т7.
41. Штамм по любому из пп.20-39, где по крайней мере 10 мг сухого веса биомассы производится при определении в тесте Т2.
42. Штамм по любому из пп.20-39, где по крайней мере 30 мг сухого веса биомассы производится при определении в тесте Т2.
43. Штамм по любому из пп.20-39, где по крайней мере 40 мг сухого веса биомассы производится при определении в тесте Т2.
44. Штамм по любому из пп.20-39, где по крайней мере 50 мг сухого веса биомассы производится при определении в тесте Т2.
45. Штамм по любому из пп.20-44, где штамм проявляет способность продуцировать этанол при выращивании на ксилозе.
46. Штамм по любому из пп.20-44, где штамм подвергает брожению ксилозу с образованием этанола.
47. Штамм по любому из пп.20-46, где штамм проявляет способность продуцировать этанол при концентрации по крайней мере 0,1 г/л при определении в тесте Т3.
48. Штамм по любому из пп.20-46, где штамм проявляет способность продуцировать этанол при концентрации по крайней мере 0,4 г/л при определении в тесте Т8.
49. Выделенный нерекомбинантный штамм Saccharomyces, который производит увеличение биомассы по крайней мере в 2 раза в условиях, установленных в тесте T1.
50. Выделенный нерекомбинантный штамм Saccharomyces, который имеет следующие характеристики:
(a) увеличение биомассы по крайней мере в 5 раз в условиях, установленных в тесте T1;
(b) произведение 10 мг сухого веса биомассы в условиях, установленных в тесте Т2.
51. Выделенный нерекомбинантный штамм Saccharomyces, который имеет следующие характеристики:
(a) биомасса штамма увеличивается по крайней мере в 10 раз при определении в тесте T1;
(b) по крайней мере 50 мг сухого веса биомассы производится при определении в тесте Т2;
(c) концентрация по крайней мере 0,1 г/л этанола определяется в тесте Т3;
(d) по крайней мере 1 единица активности ксилозаредуктазы определяется в условиях, установленных в тесте Т4;
(e) по крайней мере 1 единица активности ксилитдегидрогеназы определяется в условиях, установленных в тесте Т5.
52. Выделенный нерекомбинантный штамм Saccharomyces, который имеет следующие характеристики:
(а) биомасса штамма увеличивается по крайней мере в 5 раз при определении в тесте T1;
(b) по крайней мере 40 мг сухого веса биомассы производится при определении в тесте Т2;
(c) биомасса штамма увеличивается по крайней мере в 5 раз при определении в тесте Т7;
(d) концентрация по крайней мере 0,04 г/л этанола определяется в условиях, установленных в тесте Т8;
(e) по крайней мере 1 единица активности ксилозаредуктазы определяется в условиях, установленных в тесте Т4;
(f) по крайней мере 1 единица активности ксилитдегидрогеназы определяется в условиях, установленных в тесте Т5.
53. Штамм по любому из пп.20-52, где штамм продуцирует по крайней мере 0,2 г этанола на литр в течение периода 4 месяцев в условиях, установленных в тесте Т9.
54. Штамм по любому из пп.20-52, где штамм продуцирует по крайней мере 0,5 г этанола на литр в условиях посева клеток при плотности, составляющей, по крайней мере, 5_108 клеток на мл, в минимальную минеральную среду, содержащую ксилозу.
55. Штамм по любому из пп.15, 17-54, где штамм является штаммом Saccharomyces cerevisiae.
56. Нерекомбинантный штамм Saccharomyces, депонированный под депозитным инвентарным номером NM04/41257 при AGAL (правительственные аналитические лаборатории Австралии).
57. Нерекомбинантный штамм Saccharomyces, депонированный под депозитным инвентарным номером NM04/41258 при AGAL.
58. Нерекомбинантный штамм Saccharomyces, депонированный под депозитным инвентарным номером NM05/45177 при AGAL.
59. Нерекомбинантный штамм Saccharomyces, депонированный под депозитным инвентарным номером NM05/45178 при AGAL.
60. Производное штамма по любому из пп.17-59.
61. Производное по п.16 или 60, которое является рекомбинантным производным.
62. Популяция клеток дрожжей Saccharomyces, полученная способом по любому из пп.1-14.
63. Применение штамма Saccharomyces по любому из пп.15, 17-59, производного по п.16 или 60 или популяции по п.62 в производстве дрожжевой биомассы.
64. Применение штамма Saccharomyces по любому из пп.15, 17-59, производного по п.16 или 60 или популяции по п.62 в производстве этанола.
65. Способ превращения ксилозы в дрожжевую биомассу, включающий культивирование штамма Saccharomyces по любому из пп.15, 17-56, производного по п.16 или 60 или популяции по п.62 со средой, содержащей ксилозу, в условиях, которые позволяют штамму расти, используя ксилозу в качестве источника углерода для роста.
66. Способ производства дрожжевой биомассы, включающий выращивание штамма Saccharomyces по любому из пп.15, 17-59, производного по п.16 или 60 или популяции по п.62, на среде или в среде, содержащей ксилозу, где по крайней мере часть дрожжевой биомассы производится при использовании ксилозы в качестве источника углерода для роста.
67. Способ продуцирования соединения из штамма Saccharomyces, где способ включает культивирование штамма Saccharomyces по любому из пп.15, 17-59, производного по п.16 или 60 или популяции по п.62, на среде или в среде, содержащей ксилозу, в условиях, которые допускают продуцирование соединения, где соединение продуцируется штаммом в течение роста, используя ксилозу как источник углерода.
68. Способ продуцирования этанола, включающий стадии:
(a) инкубации штамма по любому из пп.15, 17-59, производного по п.16 или 60 или популяции по п.62, в среде в условиях, которые позволяют продуцирование этанола;
(b) извлечения продуцированного этанола.
69. Способ по п.68, где среда является средой, содержащей ксилозу.
70. Способ по п.69, где среда, содержащая ксилозу, содержит кроме ксилозы один или более сахаров, выбранных из группы, состоящей из глюкозы, фруктозы, маннозы, галактозы, мальтотриозы, мальтозы, сахарочы, мелибиозы, раффинозы, ксилозы, мелизитозы, альфа-метилглюкозида, трегалозы, изомальтозы, двуокиси углерода.
71. Способ по любому из пп.68-70, где штамм инкубируют при анаэробных условиях.
72. Способ продуцирования этанола, включающий:
(a) засевание среды, содержащей ксилозу, штаммом по любому из пп.15, 17-59, производным по п.16 или 60 или популяцией по п.62, до плотности, составляющей по крайней мере 1_108 клеток дрожжей на мл;
(b) инкубацию засеянной среды в течение времени, достаточного для того, чтобы достичь продуцирования этанола;
(c) извлечения этанола.
73. Способ по п.72, где плотность составляет по крайней мере 5_108 клеток на мл.
74. Способ мечения желательного штамма Saccharomyces, включающий:
(a) культивирование желательного штамма со штаммом по любому из пп.15, 17-59, с производным по п.16 или 60 или с популяцией по п.62, в условиях, которые позволяют комбинировать ДНК штаммов;
(b) проведение скрининга или селекции дрожжевых клеток для получения модифицированных желательных штаммов, которые обладают повышенной скоростью роста, используя ксилозу в качестве единственного источника углерода;
(c) выделение модифицированного желательного штамма Saccharomyces с повышенной скоростью роста при использовании ксилозы в качестве единственного источника углерода.
Текст
010892 Область изобретения Изобретение относится к способам получения нерекомбинантных штаммов Saccharomyces, к штаммам Saccharomyces и к их использованию. Предыдущий уровень техники Все ссылки, включая любые патенты или заявки на патенты, цитированные в данном описании,включены в текст посредством ссылки. Никакого признания не делается относительно того, что любая ссылка составляет предыдущий уровень техники. Обсуждение ссылок точно определяет, что их авторы утверждают, и заявители оставляют за собой право оспаривать точность и применимость цитированных документов. Следует признать, что, хотя ряд публикаций предыдущего уровня техники рассматривается в данном описании, эта ссылка не должна истолковываться как признание того, что любой из рассматриваемых документов образует часть общего знания в данной области в Австралии или любой другой стране. Одной из самых экономически важных групп дрожжей является род Saccharomyces, штаммы которого используют в пивоварении, хлебопечении, виноделии, винокурении и различных других отраслях промышленности, связанных с дрожжами. Виды Saccharomyces, определены филогенетически исследователем Kurtzman (2003) FEMS Yeast Research 3:417-432 и включают в себя S.cerevisiae, S.paradoxus,S.mikatae, S.cariocanus, S.kudriavzevii, S.pastorianus и S.bayanus. Виды Saccharomyces являются одними из самых эффективных микроорганизмов, способствующих превращению сахаров, таких как глюкоза, фруктоза, сахароза и мальтоза, в биомассу, и брожению указанных сахаров до этанола. В результате виды Saccharomyces и, в частности, Saccharomyces cerevisiae,являются одними из самых широко используемых микроорганизмов в промышленных способах. Например, в пивоварении, винокурении и виноделии Saccharomyces используют для сбраживания сахаров, таких как глюкоза, фруктоза, сахароза и/или мальтоза, с образованием этанола. В производстве топливного этанола штаммы Saccharomyces cerevisiae выбирают из-за их способности быстро превращать высокие концентрации сахаров, таких как глюкоза, фруктоза, сахароза и мальтоза, в большие количества этанола. В хлебопекарной промышленности штаммы Saccharomyces cerevisiae используют, главным образом, изза их способности образовывать двуокись углерода из сахаров, таких как глюкоза, фруктоза, сахароза и/или мальтоза, для выпечки хлеба из дрожжевого теста. Другие области применения Saccharomyces cerevisiae включают в себя производство дрожжевых экстрактов и других вкусовых и ароматизирующих продуктов, источников ферментов, таких как инвертаза, производство различных биохимических препаратов, промежуточных продуктов, белков, аминокислот рибонуклеиновых кислот и нуклеотидов, кофакторов и витаминов. Миллионы тонн дрожжей выращивают каждый год в производственных процессах. Поэтому способность Saccharomyces расти на общеупотребительных и возобновляемых источниках углерода представляется важной с точки зрения рентабельности производства дрожжевой биомассы для промышленных целей и для получения экономически выгодных побочных продуктов метаболизма дрожжей. В частности, способность Saccharomyces к росту на отходах от других промышленных процессов имеет значение для окружающей среды и для экономики. Таким образом, например, биомассу хлебопекарных дрожжей часто получают путем выращивания дрожжей на мелассе, которая является отходом производства сахара, или на сиропах, богатых глюкозой и мальтозой, образующихся при промышленном гидролизе крахмала. Сущность изобретения Изобретение относится к способу производства штамма Saccharomyces, который способен расти при желаемой скорости роста (такой как по меньшей мере одна генерация за 48 ч), используя ксилозу в качестве единственного источника углерода, и к штаммам Saccharomyces, которые растут на ксилозе с указанными скоростями роста, и к их использованию. Ксилоза служит примером природного, общеупотребительного и возобновляемого сахара, доступного из растительной биомассы, который, как было показано ранее, микроорганизм Saccharomyces не способен утилизировать. См., например, публикацию Barnett et al. "Yeast Characteristics and Identification" 2nd edition (1990), Cambridge University Press, в которой авторы утверждают, что дрожжи вида Saccharomyces cerevisiae не способны утилизировать ксилозу в качестве единственного источника углерода для роста. Ксилоза является главным возможным источником для выращивания дрожжей и для промышленных продуктов, включающих этанол, из дрожжей. Использование ксилозы в качестве источника сахара для дрожжей создаст большие преимущества в области экономики и экологии. Например, производство топливного этанола из богатых ксилозой материалов должно быть основным источником возобновляемой энергии. В первом аспекте изобретение относится к способу получения штамма Saccharomyces, который способен расти с желаемой скоростью роста, используя ксилозу в качестве единственного источника углерода для роста, включающему:(a) обеспечение популяции генетически различных нерекомбинантных дрожжевых клеток Saccharomyces;(b) культивирование дрожжевых клеток при условиях, которые допускают комбинирование ДНК(c) проведение скринирования или селекции дрожжевых клеток в пользу дрожжевых клеток, которые имеют повышенную скорость роста при использовании ксилозы в качестве единственного источника углерода для роста;(d) выделение одной или более дрожжевых клеток, которые проявляют желательную скорость роста. Обычно дрожжевые клетки культивируют в условиях, которые допускают комбинирование ДНК между парами дрожжевых клеток. Обычно желательной скоростью роста является увеличение скорости роста относительно скорости роста дрожжевых клеток штаммов Saccharomyces, к которым способ не был применен. Например, штаммы Saccharomyces, такие как штамм NL67. Более характерно, желательной скоростью роста является по меньшей мере одна генерация за 48 ч, более характерно по меньшей мере одна генерация за 24 ч. Обычно дрожжевые клетки подвергают скринированию или селекции в пользу дрожжевых клеток,которые имеют желательную скорость роста, путем инкубации дрожжевых клеток в среде или на среде,содержащей ксилозу. Обычно содержащей ксилозу средой является культуральная среда, содержащая ксилозу. Культуральная среда может содержать ксилозу в качестве единственного источника углерода,или ксилоза может быть одним из многих источников углерода. Обычно ксилоза является единственным источником углерода в среде, содержащей ксилозу. Обычно культуральная среда, содержащая ксилозу,является минимальной минеральной средой, содержащей ксилозу. Обычно дрожжевые клетки инкубируют на среде или в среде, содержащей ксилозу, в течение достаточного периода времени, чтобы клетки приобрели желательную скорость роста, используя ксилозу в качестве источника углерода для роста. В одном воплощении изобретения прошедшие скринирование или отобранные дрожжевые клетки образуют популяцию генетически различных нерекомбинантных дрожжевых клеток, и стадии (b) и (с) повторяют до тех пор, пока не получат дрожжевые клетки с желательной скоростью роста. В одном варианте осуществления изобретения стадию (b) выполняют до стадии (с). В другом варианте осуществления изобретения стадию (с) выполняют до стадии (b) . B еще другом варианте осуществления изобретения стадии (b) и (с) выполняют одновременно. Во втором аспекте изобретение относится к способу получения штамма Saccharomyces в культуре,который способен расти при желательной скорости, используя ксилозу в качестве единственного источника углерода для роста, включающему:(a) обеспечение популяции генетически различных нерекомбинантных дрожжевых клеток Saccharomyces;(b) культивирование дрожжевых клеток при условиях, которые допускают комбинирование ДНК между дрожжевыми клетками;(c) проведение скрининга или селекции дрожжевых клеток путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу;(d) повторение стадий (b) и (с) с прошедшими скринирование или отобранными клетками, образующими популяцию генетически различных нерекомбинантных дрожжевых клеток Saccharomyces, до тех пор, пока одна или более дрожжевых клеток не приобретут способность расти при желаемой скорости роста, используя ксилозу в качестве единственного источника углерода для роста. Обычно способ включает в себя дополнительную стадию (е) выделения одной или более дрожжевых клеток, растущих при желательной скорости роста. В одном воплощении изобретения одна или более дрожжевых клеток, которые выделяют, представляют один штамм Saccharomyces. B другом воплощении изобретения одна или более дрожжевых клеток, которые выделяют, представляют популяцию генетически различных клеток дрожжей. В одном варианте осуществления изобретения дрожжевые клетки подвергают отбору на стадии (с). Дрожжевые клетки могут быть отобраны на стадии (с) путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу, в течение достаточного периода времени, чтобы дрожжевые клетки проявили способность к росту на ксилозе как на единственном источнике углерода, чтобы расти, используя ксилозу в качестве источника углерода, и, впоследствии, путем сбора выращенных дрожжевых клеток. Дрожжевые клетки могут быть подвергнуты селекции на стадии (с) путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу, в течение периода времени, достаточного для того, чтобы дрожжевые клетки достигли повышенной скорости роста, используя ксилозу в качестве единственного источника углерода, чтобы расти при использовании ксилозы как источника углерода, и, после этого,путем сбора выращенных дрожжевых клеток. В другом варианте осуществления изобретения дрожжевые клетки подвергают скринированию на стадии (с). Дрожжевые клетки могут быть подвергнуты скринированию на стадии (с) путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу, в течение достаточного периода времени,чтобы дрожжевые клетки достигли повышенной скорости роста при использовании ксилозы в качестве единственного источника углерода для того, чтобы расти, используя ксилозу как источник углерода, и потом путем сбора дрожжевых клеток, которые имеют повышенную скорость роста, используя для роста-2 010892 ксилозу как источник углерода. Также предполагают, что в части повторений стадий (b) и (с) дрожжевые клетки должны быть отобраны, и в части повторений стадий (b) и (с) дрожжевые клетки должны быть скринированы. Стадии (b) и (с) могут быть повторены любое число раз, достаточное для того, чтобы получить дрожжевой штамм, который окажется способным к росту при желательной скорости, используя ксилозу в качестве единственного источника углерода для роста. Специалисты в данной области должны признать, что число раз повторяемых стадий (b) и (с) будет зависеть от среды, которая используется, исходных штаммов дрожжей, условий культивирования и т.д. В одном воплощении изобретения стадии (b) и(с) повторяют по меньшей мере один раз, обычно по меньшей мере 2 раза, более предпочтительно по меньшей мере 5 раз, даже более предпочтительно по меньшей мере 10 раз, еще более предпочтительно по меньшей мере 20 раз, подходяще по меньшей мере 30 раз. Дрожжевые клетки могут быть подвергнуты скринированию или селекции на твердой среде или в жидкой среде, содержащей в обоих случаях ксилозу. В одном воплощении изобретения клетки подвергают скринированию или селекции на твердой среде, содержащей ксилозу. В другом воплощении изобретения клетки подвергают скринированию или селекции в жидкой среде, содержащей ксилозу. В еще другом варианте осуществления изобретения клетки подвергают скринированию или селекции на твердой среде, содержащей ксилозу, с последующим скринированием или отбором в жидкой среде, содержащей ксилозу. Например, дрожжевые клетки могут быть подвергнуты скринированию или селекции множество раз путем повторения стадий (b) и (с), используя твердую среду, содержащую ксилозу, с последующим скринированием или отбором множество раз путем повторения стадий (b) и (с), используя жидкую среду, содержащую ксилозу. Твердая среда, содержащая ксилозу, может быть любой твердой средой, которая содержит ксилозу в качестве источника углерода и которая обеспечивает избирательное предпочтение по отношению к штамму, способному утилизировать ксилозу как единственный источник углерода. Например, содержащая ксилозу твердая среда может быть сложной твердой средой, в которой ксилоза является одним из множества источников углерода, или содержащая ксилозу твердая среда может быть минимальной твердой средой, в которой ксилоза является единственным источником углерода. Обычно содержащая ксилозу твердая среда будет твердой минимальной средой, содержащей ксилозу в качестве единственного источника углерода. Жидкая среда, содержащая ксилозу, может быть любой жидкой средой, которая содержит ксилозу в качестве источника углерода. Например, жидкая, содержащая ксилозу среда может быть сложной жидкой средой, в которой ксилоза является одним из множества источников углерода, или жидкая, содержащая ксилозу среда может быть минимальной жидкой средой, в которой ксилоза является единственным источником углерода. Обычно жидкая, содержащая ксилозу среда будет жидкой минимальной средой, содержащей ксилозу в качестве единственного источника углерода. Обычно жидкая минимальная среда является минимальной минеральной средой, содержащей ксилозу в качестве единственного источника углерода. Желательная скорость роста обычно составляет, по меньшей мере, одну генерацию за 48 ч. Желательная скорость роста может быть выше, чем одна генерация за 24 ч. Желательная скорость роста может быть выше, чем одна генерация за 12 ч. Желательная скорость роста может быть выше, чем одна генерация за 10 ч. Желательная скорость роста может быть выше, чем одна генерация за 8 ч. Желательная скорость роста может быть выше, чем одна генерация за 4 ч. Желательная скорость роста может быть выше,чем одна генерация за 2 ч. Получаемый штамм Saccharomyces может быть штаммом из любого вида рода Saccharomyces, который способен расти при желательной скорости роста, используя ксилозу в качестве единственного источника углерода. Квалифицированные специалисты в данной области должны признать, что получаемый штамм будет зависеть от видов, которые образуют генетически различную популяцию нерекомбинантных дрожжевых клеток Saccharomyces. Примеры соответствующих видов дрожжей включаютS.cerevisiae, S.paradoxus, S.mikatae, S.cariocanus, S.kudriavzevii, S.pastorianus и S.bayanus. Обычно штамм является штаммом вида Saccharomyces cerevisiae. Обычно штамм должен проявлять способность к спариванию с Saccharomyces такого же вида. Обычно штамм должен быть способен спариваться с Saccharomyces cerevisiae. Дрожжи могут быть культивированы при любых условиях, которые допускают комбинацию ДНК между дрожжевыми клетками, при условии, что комбинирование ДНК не осуществляется методами рекомбинации. Дрожжевые клетки могут быть культивированы при условиях, которые позволяют комбинацию ДНК между дрожжевыми клетками, например, посредством спаривания или цитодукции или любыми другими методами, известными в данной области для комбинации ДНК дрожжевых клеток, отличными от рекомбинантных методов. В одном варианте осуществления изобретения дрожжевые клетки культивируют при условиях, которые позволяют спаривать дрожжевые клетки. Обычно спаривание дрожжей включает в себя процесс спорообразования, проращивания спор и спаривание проросших спор. Способы спаривания дрожжей известны специалистам в данной области и описаны в публикациях, например, Fowell (1969) "Sporulation and hybridization of yeast", in The Yeasts (A.H. Rose and J.S. Harrison,-3 010892genetic manipulations of industrial yeasts" in, Topics in Current Genetics, Vol. 2. Functional Genetics of Industrial Yeasts (J.H. de Winde, ed.), Springer-Verlag Berlin Heidelberg, или способы могут быть комбинированы. Популяция генетически различных нерекомбинантных клеток дрожжей может представлять собой природные изоляты Saccharomyces из любого источника, изоляты Saccharomyces, подвергшиеся спонтанной мутации, или могут быть получены путем воздействия мутагена на один или более штаммы Saccharomyces. Популяцию генетически различных нерекомбинантных клеток дрожжей могут представлять собой штаммы из одного вида или штаммы из множества видов. Виды, подходящие для использования в качестве генетически различной популяции нерекомбинантных клеток дрожжей, включают в себя S. cerevisiae, S. paradoxus, S. mikatae, S. cariocanus, S. kudriavzevii, S. pastorianus и S. bayanus. Обычно штаммы представлены видом Saccharomyces cerevisiae. Обычно штаммы проявляют способность спариваться сSaccharomyces такого же вида. Обычно штаммы проявляют способность спариваться с Saccharomycescerevisiae. Специалистам в данной области будет очевидно, что кроме популяции генетически различных нерекомбинантных клеток дрожжей, рекомбинантные дрожжевые клетки могут быть включены на стадии(b) и (с) как отдельная популяция. В третьем аспекте изобретение относится к способу генерации производного штамма Saccharomyces с повышенной скоростью роста, использующего ксилозу в качестве единственного источника углерода для роста, включающему:(a) получение дрожжевых клеток штамма как части популяции генетически различных клеток дрожжей Saccharomyces;(b) культивирование популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces при условиях, которые допускают комбинирование ДНК между клетками дрожжей в популяции;(c) проведение скринирования или отбора дрожжевых клеток в пользу производных штамма, которые обладают повышенной скоростью роста на ксилозе;(d) выделение одного или более производных штамма, которые обладают повышенной скоростью роста при использовании ксилозы в качестве единственного источника углерода относительно скорости роста штамма, использующего ксилозу как единственного источника углерода. Обычно клетки дрожжей подвергают скринингу или селекции путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу. В одном воплощении изобретения клетки дрожжей подвергают отбору на стадии (с). Клетки дрожжей могут быть отобраны на стадии (с) путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу, в течение достаточного периода времени, чтобы клетки дрожжей смогли приобрести способность к росту на ксилозе как на единственном источнике углерода для роста, используя ксилозу в качестве источника углерода. Клетки дрожжей могут быть отобраны на стадии (с) путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу, в течение достаточного периода времени,чтобы клетки дрожжей имели повышенную скорость роста при использовании ксилозы как единственного источника углерода для роста, используя ксилозу в качестве источника углерода. В другом воплощении изобретения клетки дрожжей подвергают скринированию на стадии (с). Дрожжевые клетки могут быть скринированы на стадии (с) путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу, в течение достаточного периода времени, чтобы клетки дрожжей достигли повышенной скорости роста при использовании ксилозы как единственного источника углерода для того, чтобы расти, используя ксилозу в качестве источника углерода, и после этого путем сбора клеток дрожжей, которые растут с наибольшей скоростью, используя ксилозу в качестве источника углерода. Стадии (b) и (с) могут быть повторены, благодаря чему производные штамма образуют, по меньшей мере, часть популяции генетически различных штаммов Saccharomyces до тех пор, пока одно или более производных не приобретут способность к повышенной скорости роста на ксилозе как на единственном источнике углерода для роста. В прошлом для того, чтобы обратиться к проблеме неспособности Saccharomyces cerevisiae использовать ксилозу, другие исследователи использовали технологии рекомбинантных ДНК для введения генов, полученных из дрожжей, которые могли утилизировать ксилозу в качестве источника углерода, чтобы Saccharomyces приобрели способность утилизировать ксилозу (например, Sonderegger and Sauer(2003) Applied and Environmental Microbiology 69: 1990-1998). В этих подходах гены для утилизации ксилозы были клонированы из организмов, которые были способны утилизировать ксилозу для роста, и потом внесены в Saccharomyces cerevisiae. Например, ксилозаизомераза грибов из вида Piromyces была интегрирована в геном Saccharomyces cerevisiae, чтобы производить штаммы, которые растут медленно на ксилозе как на единственном источнике углерода (Kuyper et al. 2003). Ксилозаредуктаза из Pichia stipitis также была клонирована в Saccharomyces cerevisiae, чтобы производить дрожжи, которые могли бы утилизировать ксилозу как единственный источник углерода для роста (Wahlbom et al. 2003).(GRAS), и если рекомбинантные технологии используют, чтобы получить штаммы Saccharomyces cerevisiae, которые утилизируют ксилозу, то они теряют статус GRAS. Поэтому с точки зрения промышленной и экономической выгоды необязательно использовать штаммы Saccharomyces cerevisiae, которые содержат гены из других родов или видов, или которые получают с помощью технологий рекомбинантных ДНК. Действительно, штаммы, которые получены посредством технологий рекомбинантных ДНК,не применяются в промышленности, где существуют социально-политические или экологические или другие барьеры к использованию таких штаммов. Использование технологий рекомбинантных ДНК уменьшает перспективы и желательность для использования дрожжей в пищевых продуктах для человека и т.д., в то время как нерекомбинантные штаммы могли бы быть использованы преимущественно в пищевых продуктах для человека. Возможность использования нерекомбинантных дрожжей одновременно для получения этанола и пищевых продуктов для человека создает благоприятные условия для повышения экономической эффективности способов, основанных на дрожжах. Например, можно использовать нерекомбинантные дрожжи, чтобы превратить ксилозу в этанол и дрожжевую биомассу. Этанол можно использовать для топлива и других целей, тогда как получаемые дрожжи могут найти свое применение в других ценных приложениях, таких как производство экстрактов или других побочных продуктов. Авторы изобретения обнаружили, что при инкубации нерекомбинантных штаммов Saccharomyces дикого типа на среде, содержащей ксилозу в качестве единственного источника углерода, наблюдается очень медленный рост на ксилозе. Это наблюдение не соответствует данным предыдущего уровня техники, которые четко указывают на то, что микроорганизм Saccharomyces не способен расти на ксилозе. Изобретатели полагают, что рост Saccharomyces на ксилозе был настолько медленным, что он не мог быть определен. Как описано в тексте, изобретатели обнаружили, что когда твердую минимальную минеральную среду, содержащую ксилозу в качестве единственного источника углерода, засевали штаммами Saccharomyces cerevisiae дикого типа, рост определяли посредством микроскопических исследований колоний после инкубации в течение 2 месяцев при 30C. Хотя обнаруживаемый рост клеток дрожжей позволяет применять нерекомбинантные стратегии для производства дрожжей с повышенными скоростями роста, наблюдаемая замедленная скорость роста не имеет промышленного приложения. Изобретатели расширили полученные ими сведения о том, что клетки дрожжей Saccharomyces способны очень медленно расти на ксилозе как на единственном источнике углерода, с целью разработки штаммов Saccharomyces, которые могли бы расти на ксилозе как на единственном источнике углерода при скоростях, намного превышающих скорости роста штаммов Saccharomyces, к которым способ согласно настоящему изобретению не относится. До открытия, сделанного авторами изобретения, невозможно было представить, что инкубация клеток дрожжей Saccharomyces в среде или на среде, содержащей ксилозу в качестве единственного источника углерода, может привести к какому-либо отбору или обогащению дрожжевых клеток, способных к росту на ксилозе, поскольку полагали, что дрожжи не могут расти в среде из-за ксилозы, которую рассматривали как непригодный источник углерода для Saccharomyces. Однако, используя свои открытия и комбинацию стратегий отбора и способов, таких как спаривание популяций генетически различных штаммов Saccharomyces, соответственно штаммов Saccharomyces cerevisiae, изобретатели обнаружили, что могут быть получены штаммы Saccharomyces, которые проявляют способность к росту на твердой среде и/или в жидкой среде, содержащей ксилозу в качестве единственного источника углерода, при скоростях, превышающих скорости роста штаммовSaccharomyces, к которым способы согласно настоящему изобретению не были применены. Кроме того,авторы изобретения обнаружили, что при использовании стратегий отбора и способов, таких как спаривание генетически различных штаммов Saccharomyces, могут быть получены штаммы Saccharomyces,скорость роста которых при использовании ксилозы в качестве единственного источника углерода составляет по меньшей мере одну генерацию за 48 ч, и в некоторых предпочтительных вариантах осуществления изобретения скорость роста может быть выше, чем одна генерация за 4 ч. Таким образом, используя нерекомбинантные способы, изобретатели смогли получить штаммы Saccharomyces, которые проявляли способность к росту в жидкой среде и на твердой среде, содержащей ксилозу как единственный источник углерода, при скоростях, применяемых в промышленных целях. В четвертом аспекте изобретение относится к штамму Saccharomyces, полученному способом первого-третьего аспектов изобретения. В пятом аспекте изобретение относится к выделенному штамму Saccharomyces, который проявляет способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при использовании ксилозы в качестве единственного источника углерода для роста, где штамм производит:(ii) по меньшей мере 10 мг сухого веса биомассы в условиях роста, установленных в тесте Т 2, и где штамм получен способом первого-третьего аспектов. В шестом аспекте изобретение относится к выделенному штамму Saccharomyces, который проявляет способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя для роста ксилозу в качестве единственного источника углерода, где:T1; и (ii) штамм производит по меньшей мере 50 мг сухого веса биомассы в условиях роста, установленных в тесте Т 2; и(iii) по меньшей мере 0,1 г/л этанола определяется в условиях, заданных в тесте Т 3; и(iv) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 4; и(v) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 5; и где штамм получен способом первоготретьего аспектов. В седьмом аспекте изобретение относится к выделенному штамму Saccharomyces, который проявляет способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя для роста ксилозу в качестве единственного источника углерода, где(i) штамм производит по меньшей мере 5-кратное увеличение биомассы в условиях роста, установленных в тесте Tl; и(ii) штамм производит по меньшей мере 40 мг сухого веса биомассы в условиях роста, установленных в тесте Т 2; и(iii) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 4; и(iv) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 5; и(v) штамм производит по меньшей мере 5-кратное увеличение биомассы в условиях, заданных в тесте Т 7;(vi) концентрация по меньшей мере 0,04 г/л этанола определяется в условиях, заданных в тесте Т 8; и где штамм получен способом первого-третьего аспектов. В одном варианте четвертого-седьмого аспектов штамм продуцирует по меньшей мере 0,2 г этанола на литр в течение 4 месяцев в условиях, установленных в тесте Т 9. В восьмом аспекте изобретение относится к выделенному штамму Saccharomyces, который проявляет способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя для роста ксилозу в качестве единственного источника углерода, где способность штамма утилизировать ксилозу как единственный источник углерода приобретается с помощью нерекомбинантных методов. Скорость роста штамма может быть любой скоростью, которая составляет по меньшей мере одну генерацию за 48 ч. Скорость роста может составлять по меньшей мере одну генерацию за 36 ч. Скорость роста может быть выше, чем одна генерация за 24 ч. Скорость роста может быть выше, чем одна генерация за 12 ч. Скорость роста может быть выше, чем одна генерация за 10 ч. Скорость роста может быть выше, чем одна генерация за 8 ч. Скорость роста может быть выше, чем одна генерация за 6 ч. Скорость роста может быть выше, чем одна генерация за 4 ч. Скорость роста может быть выше, чем одна генерация за 2 часа. Скорость роста может быть выше, чем одна генерация за 80 мин. В одном воплощении изобретения штамм проявляет способность к росту, используя ксилозу в качестве единственного источника углерода, со скоростью, которая, в основном, такая же, как скорость роста штамма, использующего глюкозу в качестве единственного источника углерода для роста. В одном воплощении изобретения скорость роста штамма составляет по меньшей мере одну генерацию за 48 ч на минимальной минеральной среде, содержащей ксилозу. В одном воплощении изобретения штамм производит 2-кратное увеличение биомассы в условиях роста, установленных в тесте T1. Обычно штамм производит по меньшей мере 5-кратное увеличение биомассы в условиях роста, установленных в тесте T1. Подходяще, штамм производит по меньшей мере 10-кратное увеличение биомассы в условиях роста, установленных в тесте T1. В одном воплощении изобретения штамм производит по меньшей мере 0,01 сухого веса биомассы на 50 мл культуры в условиях роста, установленных в тесте Т 2. В различных воплощениях изобретения:(i) штамм экспрессирует нерекомбинантный фермент, проявляющий по меньшей мере 1 единицу активности ксилозаредуктазы в условиях, установленных в тесте Т 4;(ii) штамм экспрессирует нерекомбинантный фермент, проявляющий по меньшей мере 1 единицу активности ксилитдегидрогеназы в условиях, установленных в тесте Т 5;iii) штамм экспрессирует нерекомбинантный фермент, проявляющий по меньшей мере 1 единицу активности ксилозаредуктазы в условиях, установленных в тесте Т 4, нерекомбинантный фермент, проявляющий по меньшей мере 1 единицу активности ксилитдегидрогеназы в условиях, установленных в тесте Т 5. В девятом аспекте изобретение относится к выделенному штамму Saccharomyces, который проявляет способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя для роста ксилозу в качестве единственного источника углерода, и который способен экспрессировать нерекомбинантный фермент, обладающий активностью, выбранной из группы, состоящей из ксилозаре-6 010892 дуктазной активности и ксилитдегидрогеназной активности, где ксилозаредуктазная активность составляет по меньшей мере 1 единицу при определении по тесту Т 4, и ксилитдегидрогеназная активность составляет по меньшей мере 1 единицу при определении в условиях, установленных в тесте Т 5. Штамм может проявлять способность к экспрессии нерекомбинантного фермента, имеющего ксилозаредуктазную активность, и нерекомбинантного фермента, имеющего ксилитдегидрогеназную активность. В одном варианте осуществления изобретения штамм проявляет способность к экспрессии нерекомбинантного фермента, имеющего ксилулозакиназную активность, в добавление к одному или более нерекомбинантных ферментов, имеющих активность, выбранную из группы, состоящей из ксилозаредуктазной активности и ксилитдегидрогеназной активности. Обычно ксилулозакиназная активность составляет по меньшей мере 5 единиц при определении тестом Т 6. Обычно штамм девятого аспекта имеет скорость роста, составляющую по меньшей мере одну генерацию за 48 ч, при использовании ксилозы в качестве единственного источника углерода. В одном воплощении изобретения штамм производит по меньшей мере 2-кратное увеличение биомассы в условиях роста, установленных в тесте T1. Обычно штамм производит по меньшей мере 5 кратное увеличение биомассы в условиях роста, установленных в тесте T1. Более характерно, штамм производит по меньшей мере 5-кратное увеличение биомассы в условиях роста, установленных в тестеT1. Штамм может производить по меньшей мере 10 мг сухого веса биомассы в условиях, установленных в тесте Т 2. Штамм может производить по меньшей мере 30 мг сухого веса биомассы в условиях,установленных в тесте Т 2. Штамм может производить по меньшей мере 40 мг сухого веса биомассы в условиях, установленных в тесте Т 2. Обычно штамм производит по меньшей мере 50 мг сухого веса биомассы в условиях, установленных в тесте Т 2. Штамм может производить по меньшей мере 0,01 г сухого веса биомассы на 50 мл культуры в условиях роста, установленных в тесте Т 2. Штамм Saccharomyces также может проявлять способность к утилизации ксилита в качестве единственного источника углерода для роста. Обычно способность штамма утилизировать ксилит как единственный источник углерода приобретается посредством нерекомбинантных методов. В одном варианте осуществления изобретения штамм производит по меньшей мере 5-кратное увеличение биомассы в условиях роста, установленных в тесте Т 7. Штамм Saccharomyces может расти в аэробных или анаэробных условиях, используя ксилозу в качестве единственного источника углерода. Обычно рост является аэробным ростом. Однако штамм Saccharomyces также может расти в анаэробных условиях или микроаэрофильных условиях, используя ксилозу как единственный источник углерода. Штамм Saccharomyces может расти на глюкозе в анаэробных условиях. Штамм Saccharomyces также может утилизировать ксилозу для продуцирования одного или более соединений, основанных на углероде. Примеры соответствующих основанных на углероде соединений включают в себя спирты, ксилит, органические кислоты, такие как уксусная кислота, глицерин, двуокись углерода или другие компоненты дрожжей, метаболиты и побочные продукты, включающие дрожжевые экстракты, белки, пептиды, аминокислоты, РНК, нуклеотиды, глюканы и т.д. Обычно спиртом является этанол. Штамм может продуцировать этанол при выращивании на ксилозе. Штамм может использовать ксилозу, чтобы продуцировать этанол без выращивания на ксилозе. Штамм может производить этанол из ксилозы. Обычно штамм подвергает ксилозу сбраживанию с образованием спирта. Штамм может продуцировать этанол при концентрации по меньшей мере 0,1 г/л в условиях, заданных в тесте ТЗ. Штамм может продуцировать этанол при концентрации по меньшей мере 0,4 г/л в условиях, заданных в тесте Т 8. Штамм может продуцировать по меньшей мере 0,2 г этанола на литр в течение 4 месяцев в условиях, заданных в тесте Т 9. Штамм может продуцировать по меньшей мере 0,5 г этанола на литр, когда осуществляют инокуляцию при плотности клеток по меньшей мере 5108 клеток на мл в минимальную минеральную среду,содержащую ксилозу. Минимальная минеральная среда, содержащая ксилозу, может содержать глюкозу. Обычно штамм продуцирует 0,5 г/л этанола в течение 5 ч инокуляции среды. В одном воплощении изобретения штамм вызывает брожение ксилозы с образованием по меньшей мере 0,05 г этанола на литр культуры в условиях, заданных в тесте Т 3. Штамм может утилизировать ксилозу как единственный источник углерода для роста на твердой среде и/или в жидкой среде. В одном воплощении изобретения штамм способен расти в жидкой среде,содержащей ксилозу в качестве единственного источника углерода. Жидкая среда может быть жидкой минеральной средой, содержащей ксилозу в качестве единственного источника углерода. Штамм Saccharomyces может быть штаммом из любого вида рода Saccharomyces. Примеры соответствующих видов дрожжей включают в себя S. cerevisiae, S. paradoxus, S. mikatae, S. cariocanus, S.kudriavzevii, S. pastorianus и S. bayanus. Обычно видом является Saccharomyces cerevisiae. Обычно штамм-7 010892 проявляет способность к спариванию с Saccharomyces такого же вида. Обычно штамм проявляет способность к спариванию с Saccharomyces cerevisiae. Обычно штаммом является Saccharomyces cerevisiae. В одном варианте восьмого или девятого аспектов штамм Saccharomyces является рекомбинантным. В десятом аспекте изобретение относится к выделенному нерекомбинантному штамму Saccharomyces, который производит увеличение биомассы по меньшей мере в 2 раза в условиях, заданных в тестеT1. В одном воплощении изобретения увеличение биомассы составляет по меньшей мере 5 раз, обычно по меньшей мере 10 раз. В одиннадцатом аспекте изобретение относится к выделенному нерекомбинантному штамму Saccharomyces, который обладает следующими характеристиками:(a) биомасса штамма увеличивается по меньшей мере в 5 раз в условиях, заданных в тесте T1;(b) по меньшей мере 10 мг сухого веса биомассы производится в условиях, заданных в тесте Т 2. В двенадцатом аспекте изобретение относится к выделенному нерекомбинантному штамму Saccharomyces,который обладает следующими характеристиками:(a) биомасса штамма увеличивается по меньшей мере в 10 раз в условиях, заданных в тесте T1;(b) по меньшей мере 50 мг сухого веса биомассы производится в условиях, заданных в тесте Т 2;(c) концентрация по меньшей мере 0,1 г/л этанола определяется в условиях, заданных в тесте Т 3;(d) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 4; и(e) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 5. В тринадцатом аспекте изобретение относится к выделенному нерекомбинантному штамму Saccharomyces, который обладает следующими характеристиками:(a) биомасса штамма увеличивается по меньшей мере в 5 раз в условиях, заданных в тесте T1;(b) по меньшей мере 40 мг сухого веса биомассы производится в условиях, заданных в тесте Т 2;(c) биомасса штамма увеличивается по меньшей мере в 5 раз в условиях, заданных в тесте Т 7;(d) концентрация по меньшей мере 0,04 г/л этанола определяется в условиях, заданных в тесте Т 8;(e) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 4; и(f) по меньшей мере 1 наномоль NAD(P)H восстанавливается или окисляется в минуту на мг белкового экстракта при 30C в условиях, заданных в тесте Т 5. Примерами подходящих штаммов Saccharomyces, которые проявляют способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя для роста ксилозу в качестве единственного источника углерода, являются такие штаммы, которые депонированы согласно Будапештскому соглашению по международному признанию депонирования микроорганизмов для процедуры выдачи патента при правительственных аналитических лабораториях Австралии, 1 Suakin Street, Pymble,NSW 2073, Australia, под депозитными инвентарными номерами NM04/41257, NM04/41258, NM05/45177(ISO 10) и NM05/45178 (ISO 7). Штаммы под депозитными инвентарными номерами NM04/41257 иNM04/41258 были депонированы 12 мая 2004. Штаммы под депозитными инвентарными номерамиNM05/4 5177 и NM05/45178 были депонированы 16 мая 2005. Штамм Saccharomyces может быть получен любым способом, указанным в тексте, в котором способность утилизировать ксилозу в качестве единственного источника углерода достигают нерекомбинантными методами. Способы, которые могут быть использованы для получения штамма, включают в себя комбинации природного отбора, процедур спаривания, мутагенеза или другие так называемые классические генетические методы, известные специалистам в данной области и обсуждаемые, например, в публикации Attfield and Bell (2003) "Genetics and classical genetic manipulations of industrial yeasts" in, Topics in Current Genetics, Vol. 2. Functional Genetics of Industrial Yeasts (J.H. de Winde, ed.), Springer-VerlagBerlin Heidelberg, или способы могут быть комбинированными. Способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при использовании ксилозы в качестве единственного источника углерода достигается путем спаривания между штаммами Saccharomyces и проведения скринирования или селекции в пользу штаммов с повышенной скоростью роста, используя ксилозу как единственный источник углерода. Например, штамм может быть получен путем проведения нечастых или направленных или множественных спариваний между совместимыми по половому признаку штаммами Saccharomyces с последующим отбором штаммов, способных утилизировать ксилозу как единственный источник углерода. Штамм может быть произведен из одного или более природных изолятов Saccharomyces, изолятов, подвергшихся спонтанной мутации, или он может быть получен путем воздействия мутагена на один или большее количество штаммов Saccharomyces и потом использован в стратегиях спаривания и селекции для того, чтобы скринировать или отобрать мутантный штамм, который способен утилизировать ксилозу как единственный источник углерода. Полученный штамм может быть отобран любым из способов селекции, рассматриваемых в данном описании.-8 010892 В четырнадцатом аспекте изобретение относится к производному штамма четвертого-тринадцатого аспектов. Способы получения производных дрожжевых штаммов хорошо известны в данной области и включают спаривания с другими дрожжевыми штаммами, слияния клеток, мутагенез и/или рекомбинантные методы. В пятнадцатом аспекте изобретение относится к использованию штамма Saccharomyces четвертогопятнадцатого аспектов или производного четырнадцатого аспекта в производстве биомассы дрожжей. Дрожжевая биомасса может быть использована, например, в хлебопекарной промышленности, для производства продуктов из биомассы. В шестнадцатом аспекте изобретение относится к использованию штамма Saccharomyces четвертого-тринадцатого аспектов или производного четырнадцатого аспекта для производства этанола из ксилозы. В семнадцатом аспекте изобретение относится к способу производства этанола, включающему инкубацию штамма Saccharomyces четвертого-тринадцатого аспектов или производного четырнадцатого аспекта со средой, содержащей ксилозу, в условиях, которые позволяют штамму подвергать брожению ксилозу с образованием этанола. В восемнадцатом аспекте изобретение относится к способу превращения ксилозы в дрожжевую биомассу, включающему культивирование штамма Saccharomyces четвертого-тринадцатого аспектов или производного четырнадцатого аспекта со средой, содержащей ксилозу, в условиях, которые способствуют росту штамма при использовании ксилозы в качестве источника углерода для роста. В девятнадцатом аспекте изобретение относится к способу получения биомассы дрожжей, включающему выращивание штамма Saccharomyces на среде или в среде, содержащей ксилозу, где по меньшей мере часть биомассы дрожжей получают при использовании ксилозы в качестве источника углерода для роста. В двадцатом аспекте изобретение относится к способу получения соединения из штамма Saccharomyces, включающему культивирование штамма Saccharomyces на среде или в среде, содержащей ксилозу, в условиях, которые способствуют продуцированию соединения, где соединение продуцируется штаммом при использовании ксилозы как источника углерода. В одном воплощении изобретения соединение продуцируется штаммом в течение роста при использовании ксилозы как источника углерода. В одном воплощении изобретения способ включает дополнительную стадию извлечения соединения. Соединение может быть любым соединением, которое может продуцироваться штаммом Saccharomyces. Примеры соответствующих соединений включают в себя этанол, CO2, ферменты, рекомбинантные ферменты, рекомбинантные белки, дрожжевые побочные продукты, витамины, нуклеотиды, рибонуклеотиды, дезоксирибонуклеотиды, липиды, дрожжевые белки, ксилит. Специалисты в данной области должны признать, что рост клеток дрожжей приводит к образованию биомассы, и поэтому любой способ, который приводит к росту дрожжевых клеток, будет приводить к продукции биомассы. Таким образом, например, образование этанола в результате роста на среде, содержащей ксилозу, будет сопровождаться производством биомассы. В одном воплощении изобретения соединения содержатся в клетках дрожжей в биомассе, и соединения могут быть извлечены из дрожжевых клеток способами, хорошо известными в данной области для экстрагирования соединений из клеток дрожжей. В двадцать первом аспекте изобретение относится к соединению, полученному способом восемнадцатого аспекта. Краткое описание фигур На фиг. 1 представлен график среднего времени удвоения популяции штаммов Saccharomyces cerevisiae во времени после применения способа согласно изобретению. Подробное описание изобретения Для осуществления настоящего изобретения авторы используют, если не указано особо, методы традиционной микробиологии и классической генетики. Такие технологии известны специалистам в данной области и полностью раскрываются в печатном материале. См., например, публикацию ShermanYork; европейский патент номер EP 0511108 В. Также следует признать, что используемая в тексте терминология приводится только для описания отдельных вариантов изобретения и не предназначена ограничить объем настоящего изобретения, который будет ограничен только приложенной формулой изобретения. Следует отметить, что используемые в тексте и приложенной формуле изобретения формы единственного числа включают в себя понятия во множественном числе, если в контексте ясно не указано иное. Таким образом, например, ссылка на определение "клетка" включает в себя множество таких клеток. Если не определено иное, все технические и научные термины, употребляемые в тексте, имеют такое же значение, которое подразумевают обычные специалисты в данной области, которым данное изобретение подходит. Хотя любые материалы и мето-9 010892 ды, подобные или эквивалентные материалам и методам, описанным в данном тексте, могут быть использованы для выполнения или проверки настоящего изобретения, предпочтительные материалы и методы здесь представлены. Все публикации, упомянутые в тексте, цитированы для описания и раскрытия протоколов и реагентов, которые указаны в публикациях и которые могут быть использованы в связи с изобретением. Ничего из того, что представлено в описании, не должно быть истолковано, как признание того, что изобретение не имеет право противопоставлять такое раскрытие предыдущему изобретению. Ксилоза представляет собой сахар, который является дешевым, может быть получен из возобновляемых ресурсов и доступен в больших количествах. Ксилоза может составлять значительную часть гемицеллюлозной растительной биомассы. Растительная биомасса включает в себя остатки сельского хозяйства, бумажные отходы, щепу и тому подобное, и является возобновляемой и доступной при низкой стоимости в больших количествах. Ксилоза находится, главным образом, в гемицеллюлозной растительной биомассе в виде полимеров, известных как ксилан и гемицеллюлоза. Полимеры ксилозы могут легко распадаться на мономерные сахара либо химическими способами, такими как кислотный гидролиз, либо ферментативным способом при использовании ферментов, таких как ксиланазы. В бумажной промышленности, например, ксилоза является одним из основных сахаров в потоке отходов, где она влияет на биологическую потребность в кислороде (BOD) и, тем самым, делает удаление сточных вод экологически трудным. На каждый килограмм бумаги, произведенной из твердой древесины, обычно приходится 100 г сахара, 35 г из которых представляет собой ксилоза. Из-за ее избыточного содержания ксилоза представляет собой главный потенциальный источник углерода для производства биомассы дрожжей и побочных продуктов метаболизма дрожжей, таких как этанол. В одном аспекте представляется штамм Saccharomyces, способный расти со скоростью, составляющей, по меньшей мере, одну генерацию за 48 ч при использовании ксилозы в качестве единственного источника углерода. Авторы изобретения обнаружили, что можно получить штаммы Saccharomyces, способные к относительно быстрому росту при использовании ксилозы в качестве единственного источника углерода без необходимости использовать технологию рекомбинантных ДНК. Это был неожиданный результат, поскольку ранее полагали, что штаммы Saccharomyces не способны расти на ксилозе как на единственном источнике углерода. До настоящего изобретения штаммы Saccharomyces, способные к росту при скоростях, соответствующих по меньшей мере одной генерации за 48 ч при использовании ксилозы в качестве единственного источника углерода, были получены только путем внесения в штаммыSaccharomyces клонированных генов утилизации ксилозы из других организмов, которые могли расти на ксилозе. В качестве альтернативы, неприродные комбинации клонированных промоторов генов Saccharomyces и клонированных последовательностей ДНК Saccharomyces получали, используя рекомбинантные методы, и вносили их в штаммы Saccharomyces. Таким образом, до настоящего изобретения получение штаммов Saccharomyces, способных к утилизации ксилозы как источника углерода, не было возможным, пока гены утилизации ксилозы из других организмов, способных к росту на ксилозе, не были клонированы и внесены в штамм Saccharomyces, или сильные промоторы гена Saccharomyces не были связаны с другими последовательностями ДНК Saccharomyces и введены в штамм Saccharomyces, используя методы рекомбинантных ДНК. До настоящего изобретения не существовало нерекомбинантных дрожжей из рода Saccharomyces,способных к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при использовании ксилозы как единственного источника углерода. Патент США 4511656 раскрывает штамм дрожжей ATCC20618, который является нерекомбинантным мутантом, способным производить этанол при инкубации в среде, содержащей ксилозу. Однако штамм ATCC 20618 не происходит из родаSaccharomyces. Морфология колоний, производимых штаммом ATCC20618, не совпадает с морфологией колоний, производимых Saccharomyces. Штамм ATCC20618 не образует споры, не спаривается со стандартными штаммами Saccharomyces cerevisiae, и упорядочение ITS областей и межгенной области гистонов Н 3-Н 4 штамма ATCC20618 показывает, что данный штамм не принадлежит к роду Saccharomyces, но тесно связан родством с Candida tropicalis. Так, ATCC 20618 филогенетически отличается от Saccharomyces, как определил Kurtzman (2003) FEMS Yeast Research, 4:233-245, и как описано в данном тексте. Хорошо известно, что организм Candida tropicalis утилизирует ксилозу. Кроме того, мутанты,описанные в патенте США 4511656, только проявляли способность производить этанол, когда среду для роста снабжали такими питательными веществами, как дрожжевой экстракт, экстракт солода и пептон. Указанные питательные вещества для роста обеспечивают альтернативные ксилозе, способные к брожению источники углерода. Таким образом, патент США 4511656 не описывает штаммы Saccharomyces, способные к росту на ксилозе или сбраживанию ксилозы в качестве единственного источника углерода. Кроме того, патент США 4511656 описывает, что подвергают отбору способные производить этанол дрожжи, которые образуют колонии на ксилозе, но не на ксилите. Не желая вдаваться в теоретические детали, авторы изобретения полагают, что в противоположность утверждениям, описанным в патенте США 4511656, метаболизм ксилита, который является промежуточным продуктом при утилизации ксилозы, может оказаться благоприятным для роста на ксилозе и продукции этанола из ксилозы.- 10010892 Изобретатели обнаружили, в противоположность утверждениям предыдущего уровня техники, что не только штаммы Saccharomyces способны расти очень медленно на ксилозе как на единственном источнике углерода, но что скорость роста при использовании ксилозы в качестве единственного источника углерода штаммов Saccharomyces может быть увеличена без внесения клонированных генов утилизации ксилозы. В одном аспекте имеется выделенный штамм Saccharomyces, который проявляет способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при использовании ксилозы в качестве единственного источника углерода. В описании указывают, что штамм Saccharomyces является штаммом из рода Saccharomyces по определению, данному в публикации Kurtzman (2003) FEMS YeastResearch, vol. 4, pp. 233-245. Употребляемое в тексте выражение "способный к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при использовании ксилозы в качестве единственного источника углерода" означает, что штамм способен использовать ксилозу как единственный источник углерода для генерирования энергии и синтезировать молекулы, которые необходимы для роста штамма, чтобы достичь скорости роста, соответствующей по меньшей мере одной генерации за 48 ч. Термин "одна генерация" будет очевиден специалистам в данной области как означающий один цикл клеточного деления. Штамм предпочтительно будет способен к росту в твердой или жидкой среде, в которой ксилоза является единственным источником углерода. Специалисты в данной области должны принять во внимание, что штамм,который способен расти со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя ксилозу как единственный источник углерода, будет способен расти на твердой и/или в жидкой минимальной минеральной среде, в которой ксилоза является единственным источником углерода. Примером соответствующей жидкой среды является коммерчески доступная среда DIFCO Laboratories YeastNitrogen Base без аминокислот, которая содержит все существенные неорганические соли и витамины,необходимые для культивирования дрожжей, кроме источника углевода или аминокислот, дополненная ксилозой между 0,01 и 50%, обычно между 1 и 10% ксилозы, как правило 5% ксилозы. Обычно твердая среда является жидкой средой, которая затвердевает при добавлении желатинирующего средства, такого как агар. Специалисты в данной области должны принять во внимание, что штамм, который способен расти, используя ксилозу в качестве единственного источника углерода, может также проявлять способность к росту на многих других сахарах. Способности штамма утилизировать ксилозу как единственный источник углерода достигают нерекомбинантными способами. Употребляемое в тексте выражение "нерекомбинантные способы" относится к любым способам, которые не применяют технологии рекомбинантных ДНК для выработки способности у штамма Saccharomyces утилизировать ксилозу. Другими словами, гены, которые вырабатывают у штамма способность утилизировать ксилозу для роста, не были внесены в штамм рекомбинантными методами. Употребляемый в тексте термин "рекомбинантный метод" является методом, в котором один или более генов вносят в организм, используя технологию рекомбинантных ДНК. В описании указывают, что технологии рекомбинантных ДНК относятся к технологиям, с помощью которых генетическую информацию регулируют in vitro, например, когда гены выделяют и клонируют из организма. Таким образом,нерекомбинантные методы являются методами, которые не включают регулирование генетической информации in vitro. Нерекомбинантный штамм является штаммом, в который рекомбинантная нуклеиновая кислота не вносится. Нерекомбинантные методы могут включать, например, мутагенез, классическое спаривание, цитодукцию, слияние клеток, такое как слияние протопластов, и их комбинации. Нерекомбинантный метод может включать культивирование популяции генетически различных клеток дрожжей Saccharomyces в условиях, которые позволяют комбинирование ДНК между клетками дрожжей in vivo, и проведение скрининга или селекции дрожжевых клеток в пользу клеток, имеющих повышенную скорость роста при использовании ксилозы в качестве единственного источника углерода, обычно путем инкубации генетически различной популяции клеток дрожжей в среде или на среде, содержащей ксилозу, в течение достаточного времени, чтобы отобрать клетки дрожжей, проявляющие повышенную скорость роста при использовании ксилозы как единственного источника углерода. Специалистам в данной области станет очевидно, что генетическую информацию, которая придает штамму Saccharomyces способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при утилизации ксилозы в качестве единственного источника углерода, получают от родаSaccharomyces. Другими словами, всю генетическую информацию, необходимую для роста со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, получают из пула генов рода Saccharomyces. Обычно генетическую информацию, которая придает штамму Saccharomyces способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, при утилизации ксилозы в качестве единственного источника углерода для роста, получают из генетически различной популяции нерекомбинантных штаммов Saccharomyces. Как обсуждали выше, до настоящего изобретения полагали, что пул генов рода Saccharomyces не содержит генетической информации, придающей клеткам способность утилизировать ксилозу как единственный источник углерода для роста. В другом аспекте имеются выделенные штаммы Saccharomyces, которые проявляют способность к- 11010892 росту на ксилозе, как на единственном источнике углерода, со скоростью роста, составляющей по меньшей мере одну генерацию за 48 ч, и которые способны экспрессировать нерекомбинантный фермент,обладающий активностью, выбранной из группы, состоящей из активности ксилозаредуктазы и ксилитдегидрогеназы. Фермент имеет активность, по меньшей мере, единицу, как определено с помощью теста Т 4 для ксилозаредуктазы и теста Т 5 для ксилитдегидрогеназы. Тесты Т 4 и Т 5 описаны в тексте. В одном воплощении изобретения активность ксилозаредуктазы составляет по меньшей мере 1,5 единицы, подходяще по меньшей мере 3 единицы. В одном воплощении изобретения активность ксилитдегидрогеназы составляет по меньшей мере 5 единиц, подходяще по меньшей мере 8 единиц. Также изобретение предоставляет способ получения штамма Saccharomyces, который проявляет способность к росту с желательной скоростью роста, используя ксилозу в качестве единственного источника углерода. "Желательная скорость роста" может быть любой скоростью роста, которая является выше скорости роста клеток дрожжей Saccharomyces до применения способа согласно настоящему изобретению. Желательная скорость роста должна быть выше, чем скорость роста штамма NL67 Saccharomycescerevisiae на ксилозе, как на единственном источнике углерода. Желательная скорость роста может составлять по меньшей мере одну генерацию за 48 ч, подходяще выше одной генерации за 24 ч, обычно выше одной генерации за 10 ч, более характерно выше одной генерации за 8 ч, и может доходить до скорости роста Saccharomyces на глюкозе, которая составляет приблизительно одну генерацию за 80 мин. Способ включает в себя получение популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces. Употребляемое в тексте выражение "генетически различные нерекомбинантные клетки дрожжей" относится по меньшей мере к двум нерекомбинантным клеткам дрожжей, которые имеют отличные генотипы. Генетически различные нерекомбинантные клетки дрожжей могут представлять собой смесь дрожжевых клеток различных штаммов Saccharomyces, полученных из штаммов дикого типа, применяемых для брожения виноградного сусла, из спиртовых дрожжей и применяемых для брожения пива, в хлебопечении или из любого другого источника Saccharomyces. Генетически различная популяция нерекомбинантных клеток дрожжей Saccharomyces может быть получена из одного штамма, который образует споры, чтобы произвести генетически различное потомство. Генетически различная популяция нерекомбинантных клеток дрожжей Saccharomyces может включать в себя одну или более дрожжевых клеток штаммов Saccharomyces, которые подвергали действию физического или химического мутагена, такого как, например, ультрафиолетовые лучи, рентгеновские лучи или гамма-лучи, или этилметансульфонат,нитрозогуанидин, митомицин С, блеомицин или любые другие средства, которые вызывают изменения в последовательностях оснований ДНК. Таким образом, генетически различные нерекомбинантные клетки дрожжей включают в свою сферу дрожжевые клетки штаммов, которые были получены посредством мутагенеза. Способы мутагенеза дрожжей и, в частности, мутагенеза Saccharomyces cerevisiae, хорошо известны специалистам в данной области и описаны, например, в публикации Sherman et al. "Methods inYeast Genetics" (1981) Cold Spring Harbor Laboratory Manual, Cold Spring Harbor, New York. Генетически различная популяция нерекомбинантных клеток дрожжей Saccharomyces также может включать в себя клетки дрожжей со спонтанными мутациями. Популяция генетически различных нерекомбинантных клеток дрожжей Saccharomyces может быть представлена одинаковыми видами или различными видамиSaccharomyces. Обычно различные виды способны спариваться друг с другом. Например, популяция генетически различных нерекомбинантных клеток дрожжей может содержать различные штаммы Saccharomyces cerevisiae или любые другие виды Saccharomyces, полученные из любых источников, упомянутых выше. Примеры соответствующих видов Saccharomyces включают в себя S. cerevisiae, S.paradoxus, S. mikatae, S. cariocanus, S. kudriavzevii, S. pastorianus и S. bayanus. Обычно популяция генетически различных клеток дрожжей Saccharomyces представлена одним и тем же видом. Обычно видом является Saccharomyces cerevisiae. Примеры дрожжей, которые могли быть использованы для получения исходного посевного материала для популяций генетически различных нерекомбинантных клеток дрожжей, включают в себя штаммы Saccharomyces, доступные из хорошо известной коллекции культур, такой как Американская коллекция типовых культур (ATCC), например, ATCC 4111, ATCC 26603, ATCC 38559, Национальная коллекция дрожжевых культур (NCYC), например, S. Cerevisiae NCYC 995, NCYC 996, the Central Bureauvoor Schimmel Cultures (CRBS), например, S. Cerevisiae CBS 745.95, CBS 755.95, или могут быть выделены из коммерчески доступных дрожжей, продаваемых рядом компаний для использования в традиционных областях пищевой промышленности, таких как хлебопечение, пивоварение, виноделие, винокурение и т.д. Популяцию генетически различных нерекомбинантных клеток дрожжей Saccharomyces культивируют в условиях, которые допускают комбинирование ДНК между дрожжевыми клетками. Комбинирование ДНК между дрожжевыми клетками может осуществляться любым методом, подходящим для комбинирования ДНК по меньшей мере из двух дрожжевых клеток, при условии, что метод не является рекомбинантным методом. Примеры подходящих методов для комбинирования ДНК клеток дрожжей включают в себя спаривание и цитодукцию. Употребляемый в тексте термин "спаривание" относится к способу обмена и рекомбинации ДНК по меньшей мере между двумя дрожжевыми клетками, включаю- 12010892 щему методы классического генетического спаривания, направленного спаривания, множественного спаривания, редкого спаривания, слияния клеток и т.п. Например, классические генетические скрещивания или слияние клеток могут быть использованы для получения внутривидовых или межвидовых гибридов. В одном аспекте клетки дрожжей культивируют в условиях, которые допускают спаривание между дрожжевыми клетками. Обычно дрожжевые клетки культивируют в условиях, которые допускают спаривание путем споруляции клеток дрожжей и после этого путем спаривания дрожжей, которые образовали споры. Например, клетки дрожжей могут быть спарены путем:(a) образования спор дрожжевых клеток;(b) проращивания образовавших споры клеток дрожжей;(c) гибридизации совместимых для спаривания типов образовавших споры дрожжевых клеток. Обычно клетки дрожжей спаривают путем(a) объединения популяции генетически различных нерекомбинантных дрожжевых клеток;(b) споруляции объединенных клеток и проращивания спор с образованием гаплоидных клеток;(c) гибридизации совместимых для спаривания типов гаплоидных клеток с образованием гибридных дрожжевых клеток. Методы споруляции, получения гаплоидов и гибридизации гаплоидов с образованием гибридных дрожжевых клеток известны в данной области и описаны, например, в публикациях Chapter 7, "Sporulation and Hybridisation of Yeast" by R.R. Fowell, in "The Yeast" vol. 1 edited by A.H. Rose and J.S. Harrison,1969, Academic Press; европейский патент EP 0511108 В. Обычно спаривание является массовым спариванием. Массовое спаривание включает в себя культивирование по меньшей мере двух и обычно миллионов различных клеток дрожжей вместе способом, который допускает спаривание, происходящее между совместимыми для спаривания типами. Методы массового спаривания описаны, например, в публикациях Higgins et al. (2001), Applied and Environmental Microbiology, vol. 67, pp. 4346-4348; Lindegren(1943), Journal of Bacteriology, vol. 46, pp. 405-419. В другом варианте осуществления изобретения дрожжи культивируют в условиях, которые позволяют клеткам сливаться. Методы генерации внутривидовых и межвидовых гибридов при использовании технологий слияния клеток описаны, например, в публикациях Morgan (1983) Experientia suppl. 46: 155166; Spencer et al. (1990) in, Yeast Technology, Spencer JFT and Spencer DM (eds.), Springer Verlag NewYork; Polaina et al. (1993) Current Genetics, 24: 369-372. Клетки дрожжей подвергают скринингу или отбору в пользу дрожжевых клеток, которые имеют повышенную скорость роста при использовании ксилозы в качестве единственного источника углерода для роста. Дрожжевые клетки скринируют или отбирают для обогащения или идентификации дрожжевых клеток, которые имеют повышенную скорость роста при использовании ксилозы в качестве единственного источника углерода. Клетки дрожжей скринируют или отбирают обычно путем инкубации дрожжевых клеток на среде или в среде, содержащей ксилозу. Дрожжевые клетки скринируют или отбирают в пользу тех дрожжевых клеток, которые проявляют улучшенную способность к росту, используя ксилозу в качестве единственного источника углерода для роста. Улучшенная способность будет выражаться в повышении скорости роста при использовании ксилозы в качестве единственного источника углерода по отношению к желательной скорости роста. Увеличение скорости роста представляет собой увеличение скорости роста клеток дрожжей относительно скорости роста клеток до культивирования дрожжевых клеток в условиях, позволяющих комбинировать ДНК между клетками дрожжей. В одном воплощении изобретения клетки дрожжей подвергают отбору. Термины "производить отбор" или "селекция" относятся к способу, в котором дрожжевых клеток, проявляющих улучшенную способность к росту, используя ксилозу в качестве единственного источника углерода для роста, при желательной скорости роста, в популяции становится больше. Дрожжевые клетки могут быть отобраны путем инкубации клеток дрожжей на среде или в среде, содержащей ксилозу, в течение достаточного времени, чтобы клетки дрожжей смогли приобрести способность к росту на ксилозе как на единственном источнике углерода, чтобы расти, используя ксилозу в качестве источника углерода, и затем путем сбора выращенных дрожжевых клеток. Авторы изобретения обнаружили, что при инкубации дрожжевых клеток в течение времени, достаточного для того, чтобы позволить даже медленно растущим клеткам дрожжей расти, используя ксилозу в качестве источника углерода, и после сбора выращенных дрожжевых клеток, включающих медленно растущие дрожжевые клетки, клетки дрожжей, растущие с большей скоростью, будут составлять большую часть собранных дрожжевых клеток и поэтому собранные клетки дрожжей будут обогащены такими клетками, но генетическое разнообразие популяции клеток дрожжей в значительной степени сохраняется за счет включения также медленно растущих дрожжевых клеток. Например, при посеве спаренных дрожжевых клеток на твердую минимальную среду, содержащую ксилозу в качестве единственного источника углерода, клетки, способные к более быстрой утилизации ксилозы как единственного источника углерода, должны образовывать больше колоний и, в результате, эти клетки должны быть отобраны для желательного генотипа(ов), превалирующего в популяции. Однако при сборе мень- 13010892 ших колоний генетическое разнообразие популяции в значительной степени должно сохраняться для следующего повторения стадий (b) и (с). Таким образом, с помощью инкубации клеток дрожжей на среде, содержащей ксилозу, в течение времени, достаточного для того, чтобы позволить дрожжевым клеткам расти, используя ксилозу в качестве источника углерода, представляется возможным не только отобрать эти дрожжевые клетки с повышенной скоростью роста на ксилозе, но также сохранить генетическое разнообразие популяции для повторных циклов стадий (b) и (с). Улучшенная селекция может быть осуществлена путем уменьшения времени, в течение которого дрожжевые клетки инкубируют на среде,содержащей ксилозу, так что отбирают только клетки дрожжей, растущие с использованием ксилозы в качестве источника углерода в период времени, предшествующий отбору. Дрожжевые клетки этого типа могут быть отобраны путем инкубации клеток дрожжей на среде или в среде, содержащей ксилозу, в течение времени, достаточного для того, чтобы клетки дрожжей имели повышенную скорость роста, используя ксилозу как единственный источник углерода, чтобы расти при использовании ксилозы в качестве источника углерода, и затем путем сбора выращенных дрожжевых клеток. Используя данный подход, большее избирательное давление оказывается на клетки дрожжей, чтобы росли при повышенной скорости, но поскольку, вероятно, этого времени недостаточно для роста части медленно растущих дрожжевых клеток, некоторое генетическое разнообразие может быть утрачено для дальнейших повторений стадий (b) и (с). В другом воплощении изобретения клетки дрожжей подвергают скринированию. Употребляемые в тексте термины "производить скринирование" или "скринирование" относятся к способу, в котором дрожжевые клетки, которые обладают улучшенной способностью к росту, используя ксилозу в качестве единственного источника углерода для роста, при желательной скорости роста, вначале идентифицируют и затем выделяют. Дрожжевые клетки могут быть скринированы путем инкубации клеток дрожжей на среде или в среде, содержащей ксилозу, в течение времени, достаточного для того, чтобы клетки дрожжей смогли расти при повышенной скорости роста, используя ксилозу в качестве единственного источника углерода, чтобы расти при использовании ксилозы как источника углерода, и потом путем сбора дрожжевых клеток, которые росли с наибольшей скоростью, используя ксилозу как источник углерода. Например, клетки дрожжей, которые обладают улучшенной способностью к росту, используя ксилозу в качестве единственного источника углерода, могут быть идентифицированы на богатой среде, содержащей ксилозу, как такие клетки, которые растут быстрее и поэтому образуют больше колоний, чем дрожжевые клетки, которые не обладают улучшенной способностью к росту, используя ксилозу в качестве единственного источника углерода. Большие колонии, появляющиеся на пластине, могут быть выделены в предпочтении к малым колониям, и выделенные таким образом дрожжевые клетки обладают улучшенной способностью к росту, используя ксилозу в качестве единственного источника углерода для роста,при желательной скорости роста. Как описано выше, обычно дрожжевые клетки подвергают скринированию или отбору путем инкубации клеток дрожжей на среде или в среде, содержащей ксилозу. "Среда, содержащая ксилозу" может быть любой средой, которая содержит ксилозу и обеспечивает избирательное преимущество тех дрожжевых клеток, которые проявляют способность к росту, используя ксилозу в качестве единственного источника углерода, с большей эффективностью или с большей скоростью, чем другие штаммы. Употребляемый в тексте термин "избирательное преимущество" означает способность клетки или штамма претерпевать большее число клеточных делений, чем другие клетки или штаммы, из-за некоторого свойства, в данном случае способности к эффективному росту, используя ксилозу. Таким образом, среда, которая обеспечивает штамму избирательное преимущество, будет способствовать более быстрому росту штамма в такой среде по сравнению с другими штаммами, растущими в среде, не обеспечивающей избирательное преимущество. Специалисты в данной области должны признать, что дрожжи могут расти на широком ряде сред, которые включают в себя по меньшей мере один источник углерода, источник азота,источник фосфора, источник сульфата, незначительные количества элементов и витамины. Среда, содержащая ксилозу, может быть минимальной средой или сложной средой. В одном воплощении изобретения среда, содержащая ксилозу, является минимальной средой. Соответствующая минимальная среда может включать в себя, например, среду DIFCO Yeast Nitrogen Base Formulae (см. Difco manual "Dehydrated culture media and reagents for microbiology" 10th Edition, Difco Labs 1984), вместе с ксилозой при концентрации между 0,1 и 50%, обычно между 2 и 15%, более характерно 5%. В другом воплощении изобретения среда, содержащая ксилозу, может быть сложной средой. Концентрация ксилозы в сложной среде может составлять между 0,1 и 50%, обычно между 2 и 30%, более характерно между 2 и 15%. В одном воплощении изобретения сложная среда является полной обогащенной средой. Примером полной обогащенной среды является среда, которая содержит дрожжевой экстракт при концентрации между 0,5 и 2%, предпочтительно 0,5%, пептон при концентрации между 0,5 и 2%, предпочтительно 1%, и ксилозу при концентрации между 0,5 и 50%, обычно между 2 и 15%, более характерно 5%. В другом воплощении изобретения сложную среду выбирают из группы, состоящей из мелассы, крахмальных гидролизатов,гидролизата целлюлозной или гемицеллюлозной биомассы (такой как выжимки, грубые корма для скота,древесная масса, солома, макулатура и т.д.) и их комбинаций, возможно, снабженной ксилозой и/или питательными веществами. Специалисты в данной области должны признать, что твердая среда может- 14010892 быть любой из вышеупомянутых сред, обычно снабженных агаром при концентрации между 1 и 10%,более характерно между 1 и 5% агара, еще более характерно между 1 и 2% агара. Дрожжевые клетки могут быть подвергнуты скринированию или отбору путем инкубации клеток на твердой и/или жидкой среде. В одном воплощении изобретения дрожжевые клетки скринируют или отбирают путем инкубации на твердой среде. В другом воплощении изобретения клетки дрожжей скринируют или отбирают путем инкубации дрожжевых клеток в жидкой среде. В предпочтительном воплощении изобретения дрожжевые клетки скринируют или отбирают путем инкубации клеток дрожжей вначале на твердой среде и затем на жидкой среде. Например, способ может включать:(a) обеспечение популяции генетически различных клеток дрожжей Saccharomyces;(b) культивирование клеток дрожжей в условиях, которые позволяют спаривать дрожжевые клетки;(c) скринирование или селекцию клеток дрожжей путем инкубации дрожжевых клеток на твердой среде, содержащей ксилозу;(d) повторение стадий (b) и (с) с прошедшими скрининг или отбор клетками, образующими популяцию генетически различных нерекомбинантных клеток дрожжей Saccharomyces, до тех пор, пока одна или более клеток дрожжей не приобретут способность к росту при желательной скорости роста, используя ксилозу в качестве единственного источника углерода для роста. Обычно стадии (b) и (с) повторяют до тех пор, пока одна или более клеток дрожжей не достигнут скорости роста на ксилозе, которая является достаточной для того, чтобы клетки могли легко расти в жидкой среде, содержащей ксилозу в качестве единственного источника углерода. Например, скорость роста на твердой минимальной минеральной среде, содержащей от 2 до 5% мас./об. ксилозы, при которой штамм можно переносить для роста в жидкой минимальной минеральной среде, содержащей от 2 до 5% мас./об. ксилозы в качестве единственного источника углерода, будет достигнута после по меньшей мере 2 повторений стадий (b) и (с). Более характерно по меньшей мере 5 повторений стадий (b) и (с). Даже более характерно по меньшей мере 10 повторений стадий (b) и (с). Специалисты в данной области должны признать, что время, в течение которого дрожжевые клетки могут быть скринированы или отобраны путем инкубации в жидкой среде, будет колебаться в зависимости от популяции, и может быть легко определено путем инкубации небольшой порции популяции в жидкой среде при каждом повторе стадий (b) и (с). Соответственно, способ может включать:(a) обеспечение популяции генетически различных клеток дрожжей Saccharomyces;(b) культивирование клеток дрожжей в условиях, которые позволяют спаривать дрожжевые клетки;(c) скринирование или селекцию клеток дрожжей путем инкубации дрожжевых клеток в жидкой среде, содержащей ксилозу;(d) повторение стадий (b) и (с) с прошедшими скрининг или отбор клетками, образующими популяцию генетически различных нерекомбинантных клеток дрожжей Saccharomyces, до тех пор, пока одна или более клеток дрожжей не приобретут способность к росту при желательной скорости роста, используя ксилозу в качестве единственного источника углерода для роста. Обычно дрожжевые клетки инкубируют на среде или в среде, содержащей ксилозу, в течение времени, достаточного для того, чтобы клетки дрожжей приобрели способность к росту, используя ксилозу в качестве единственного источника углерода для роста. Как обсуждали выше, продолжительность времени будет, по меньшей мере, достаточной для того, чтобы клетки дрожжей, которые имеют повышенную скорость роста, используя ксилозу в качестве единственного источника углерода, могли расти. Обычно продолжительность времени будет достаточной для того, чтобы позволить расти дрожжевым клеткам, которые не имеют повышенную скорость роста, используя ксилозу как единственный источник углерода. Другими словами, продолжительность времени будет достаточной, чтобы позволить, в основном, всем клеткам дрожжей расти на ксилозе. Продолжительность времени может изменяться в зависимости от популяции генетически различных нерекомбинантных клеток дрожжей и также может изменяться в зависимости от типов используемой среды и от того, как много циклов или повторений стадий(b) и (с) было проведено. Так как каждый цикл повторяется, предполагают, что продолжительность времени будет уменьшаться, поскольку способ скринирования или селекции для популяций, которые при использовании ксилозы растут быстрее с каждым повторением стадий (b) и (с), не зависит от того, твердую или жидкую среду используют. Специалисты в данной области будут признавать, что даже в сложной среде, содержащей отличные от ксилозы сахара, некоторые сахара или все из сахаров, отличных от ксилозы, в конце концов, будут истощаться в течение роста, и что присутствие ксилозы, в конечном счете, будет давать преимущество в выборе тех штаммов, которые растут быстрее на ксилозе, как единственном источнике углерода. Клетки дрожжей могут быть инкубированы в жидкой среде, содержащей ксилозу, в течение достаточного времени, чтобы позволить клеткам дрожжей, которые являются самыми эффективными при росте на ксилозе как на единственном источнике углерода, опережать в росте те дрожжевые клетки, которые являются менее эффективными при росте на ксилозе. Обычно продолжительность времени является достаточной, чтобы позволить расти даже таким дрожжевым клеткам, которые не обладают повышенной скоростью роста, используя ксилозу как единственный источник углерода. Как обсуждалось выше, быстрее растущих клеток будет больше по количеству, и поэтому они будут отобраны. Таким образом, ис- 15010892 пользование жидкой среды, содержащей ксилозу, представляет собой подходящий способ селекции тех дрожжевых клеток, которые способны утилизировать ксилозу скорее, чем остальные клетки дрожжей в популяции. Обычно период роста в жидкой среде, содержащей ксилозу, уменьшается с каждым циклом,поскольку прошедшие скрининг или отбор дрожжевые клетки становятся более эффективными при утилизации ксилозы. После скринирования или отбора клеток дрожжей путем культивирования клеток в жидкой среде, содержащей ксилозу, клетки обычно собирают из жидкой среды и спаривают без дальнейшего разделения или выделения клеток. Таким образом, прошедшие скринирование или отбор клетки дрожжей обычно спаривают как пул. Способы спаривания являются такими же, как способы спаривания после скрининга и отбора клеток дрожжей, растущих на твердой среде, содержащей ксилозу. Следует признать, что дрожжевые клетки могут быть инкубированы в среде или на среде, содержащей ксилозу, в любых условиях, которые способствуют селекции или скринированию дрожжевых клеток в популяции, утилизирующих ксилозу. В качестве примера, популяция может быть культивирована:(a) в минимальной среде или на минимальной среде, содержащей ксилозу, в аэробных, микроаэрофильных, анаэробных условиях;(b) в среде или на среде, обогащенной ксилозой, в аэробных условиях, микроаэрофильных, анаэробных условиях. Указанная выше среда может содержать другие источники углерода (например, сахара, такие как глюкоза, галактоза, многоатомные спирты, такие как ксилит, глицерин, органические кислоты и их соли,такие как уксусная кислота и ацетаты и т.д.) кроме ксилозы. Например, дрожжевые клетки могут быть подвергнуты стрессам, таким как субоптимальный или супраоптимальный рН, гиперосмотическое или гипоосмотическое давление, ионные стрессы от солей, спиртовой стресс при добавлении этанола или других спиртов, стресс от других органических ингибиторов, таких как фурфураль и его производные,субоптимальные или супраоптимальные температуры, присутствие или отсутствие ксилозы, и затем клетки могут быть подвергнуты отбору или скринированию по их способности восстанавливаться после стрессов при утилизации ксилозы в качестве единственного источника углерода. Следовало ожидать, что комбинации различных избирательных условий могут быть применены к популяциям. Следует отметить, что стадия (с) может быть повторена любое количество раз до выделения дрожжевых клеток или повторения стадии (b). Например, популяции, отобранные в жидкой среде, содержащей ксилозу, можно постоянно пересевать в свежую среду для дальнейшего скринирования или отбора дрожжевых клеток с желательной скоростью роста. Специалисты в данной области оценят, что стадии (b) и (с) могут быть повторены любое количество раз для скринирования или отбора нерекомбинантных дрожжевых клеток, у которых скорость роста на ксилозе, как на единственном источнике углерода, постепенно увеличивается с каждым повторенным циклом. Таким образом, данный способ повторяется столько раз, сколько требуется для того, чтобы получить штамм, который проявляет желательную скорость роста при использовании ксилозы в качестве единственного источника углерода. Соответственно, способ обычно включает в себя стадию выделения одной или более клеток дрожжей, имеющих желательную скорость роста. Специалисты в данной области должны признать, что способ обычно создает популяцию генетически различных нерекомбинантных дрожжевых клеток Saccharomyces, которые обладают желательной скоростью роста. Таким образом, в одном воплощении изобретения способ может быть использован для получения популяции штаммов Saccharomyces, которые проявляют способность к росту, утилизируя ксилозу в качестве единственного источника углерода, при желательной скорости роста. Популяцию можно выделить без разделения индивидуальных штаммов. Выделения популяции можно достичь, например, путем простого объединения популяции штаммов Saccharomyces, которые производятся данным способом. В другом варианте осуществления изобретения индивидуальные штаммы Saccharomyces, которые проявляют способность к росту, утилизируя ксилозу как единственный источник углерода, могут быть выделены. Выделения индивидуальных штаммов можно достичь с помощью микробиологических методов, таких как получение соответствующих колоний, посев штрихом дрожжей на агаровых пластинках для получения изолятов отдельных колоний или любые другие методы выделения чистых культур. Такие методы описаны в публикации Cruickshank et al. (1975) "Medical Microbiology", 12th edition, volume two:The practice of medical microbiology, published by Churchill Livingstone. Также изобретение предоставляет способ получения производного штамма Saccharomyces с повышенной скоростью роста на ксилозе как на единственном источнике углерода для роста. Штамм Saccharomyces, из которого получено производное, обычно имеет желательное свойство. Способ включает в себя стадию (а) получения штамма как части популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces. Другими словами, дрожжевые клетки штамма составляют часть популяции. Клетки дрожжей генетически отличной популяции могут быть получены из любых источников, упомянутых выше. На стадии (b) клетки дрожжей популяции генетически различных клеток дрожжей культивируют в любых из условий, описанных выше, которые допускают спаривание клеток дрожжей популяции. На стадии (с) дрожжевые клетки подвергают скринированию или отбору в пользу производных,- 16010892 которые обладают повышенной скоростью роста. Повышенная скорость роста представляет собой увеличение скорости роста производного относительно скорости роста штамма. Обычно дрожжевые клетки подвергают скринированию или отбору путем инкубации дрожжевой клетки в среде или на среде, содержащей ксилозу, как упомянуто выше. Среда, содержащая ксилозу, может, кроме того, содержать факторы, способствующие отбору или скринированию производного штамма. Например, штамм может включать в себя селектируемые маркеры, такие как устойчивые к антибиотикам маркеры или другие типы маркеров, которые делают возможным для производных штамма отличаться от других дрожжевых клеток популяции генетически различных клеток дрожжей. Это позволяет одновременно производить скрининг или селекцию клеток дрожжей, обладающих повышенным ростом при использовании ксилозы как единственного источника углерода, и нести селектируемый маркер. Такой эффект позволяет отличать производные от остальных клеток генетически различной популяции. Соответствующие селектируемые маркеры включают в себя, например, ADE2, HIS3, LEU2, URA3,LYS2, МЕТ 15, TRP1, URA4, сульфат-устойчивые или п-фтор-DL-фенилаланин-устойчивые (Cebolleroand Gonzales (2004) Applied and Environmental Microbiology, Vol 70: 7018-7028). Способы скринирования и селекции в пользу роста при использовании ксилозы упомянуты выше. Стадии (b) и (с) могут быть повторены любое количество раз до тех пор, пока не будет получено производное с повышенной скоростью роста. Если скорость роста повысилась, производный штамм выделяют. Способы выделения упомянуты выше. В объем настоящего изобретения также включены штаммы Saccharomyces, полученные способом согласно изобретению. Штамм Saccharomyces может быть любого вида Saccharomyces, как определено филогенетически автором Kurtzman (2003) FEMS Yeast Research 3: 417-432, и включает в себя S. cerevisiae, S. paradoxus, S. mikatae, S. cariocanus, S. kudriavzevii, S. pastorianus и S. bayanus. Методы спаривания между штаммами Saccharomyces cerevisiae и штаммами, отличными от cerevisiae, обсуждаются, например, в публикациях Johnston J.R. and Oberman H. (1979) Yeast Genetics in Industry, in Bull M.J. (ed.)Heidelberg. Специалисты в данной области должны признать, что раз уж штамм Saccharomyces получен, который проявляет способность утилизировать ксилозу в качестве единственного источника углерода для роста с желательной скоростью роста, то другие штаммы могут быть произведены из данного штамма способами, известными в данной области способами получения штаммов, включающими, например классические генетические методы скрещивания, методы мутагенеза, рекомбинантные методы или любые другие методы получения штаммов Saccharomyces. Штамм, проявляющий способность к росту со скоростью роста, составляющей по меньшей мере одну генерацию за 48 ч, утилизируя при этом ксилозу в качестве единственного источника углерода,можно спаривать с другими штаммами Saccharomyces, предпочтительно с другими штаммами Saccharomyces cerevisiae. Например, предполагают, что с помощью указанных выше методов можно получать разнообразные штаммы Saccharomyces, которые способны расти со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, утилизируя ксилозу как единственный источник углерода для роста. Так, первый штамм, способный к скорости роста по меньшей мере одной генерации за 48 ч с утилизацией ксилозы как единственного источника углерода для роста, может спариваться со вторым штаммом,способным к скорости роста по меньшей мере одной генерации за 48 ч с утилизацией ксилозы как единственного источника углерода для роста. Спаривания такого типа можно выполнить, например, для получения штамма Saccharomyces с усиленной или улучшенной способностью утилизировать ксилозу в качестве единственного источника углерода. Например, предполагают, что различные штаммы Saccharomyces, способные к быстрому росту при утилизации ксилозы как единственного источника углерода, могут быть спарены с получением спаренных штаммов, которые проявляют способность быстрее расти на ксилозе, или которые являются более эффективными в продуцировании продуктов, таких как этанол или двуокись углерода, при использовании ксилозы как источника углерода. Штаммы Saccharomyces, которые проявляют способность к росту со скоростью роста, составляющей по меньшей мере одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода, можно спаривать со штаммами Saccharomyces, которые проявляют меньшую способность утилизировать ксилозу как единственный источник углерода. Спаривания такого типа можно выполнять,например, чтобы передать улучшенную способность утилизировать ксилозу как единственный источник углерода штамму Saccharomyces, который имеет одно или более желательных свойств, не обнаруженных у штамма, который обладает улучшенной способностью к утилизации ксилозы как единственного источника углерода. Например, штамм Saccharomyces cerevisiae, обладающий меньшей способностью к использованию ксилозы в качестве единственного источника углерода для роста, может иметь желательные характеристики для хлебопекарной промышленности, и может оказаться выгодным спаривание этого штамма со штаммом, который способен расти со скоростью, составляющей по меньшей мере одну- 17010892 генерацию за 48 ч, используя ксилозу как единственный источник углерода, для разработки хлебопекарных дрожжей, которые могут расти быстрее или с большей эффективностью на ксилозе, и для использования их в хлебопекарном производстве. Подобным образом, дрожжи, которые могут быть использованы для других промышленных целей, таких как винокурение, виноделие, получение дрожжевых экстрактов,ферментов, гетерологичных белков или другие цели, могут быть спарены со штаммами, которые обладают улучшенной способностью использовать ксилозу в качестве единственного источника углерода,чтобы сделать возможным производство биомасс или побочных продуктов дрожжей на среде, содержащей ксилозу. Исследователи полагают, что путем спаривания штамма Saccharomyces, например штамма Saccharomyces cerevisiae, у которого способность к росту со скоростью, соответствующей по меньшей мере одной генерации за 48 ч, с использованием ксилозы в качестве единственного источника углерода приобретается с помощью нерекомбинантных методов, с рекомбинантным штаммом, у которого один или более генов утилизации ксилозы вводится рекомбинантными методами, возможно получить штаммы,проявляющие повышенную способность к утилизации ксилозы. Специалистам в данной области следует принять во внимание, что гены утилизации ксилозы, которые вводят рекомбинантными методами, должны просто дополнять уже присутствующие в штамме гены посредством нерекомбинантных методов. Специалисты в данной области должны принять во внимание, что хотя способности утилизировать ксилозу достигают нерекомбинантными методами, технологию рекомбинантных ДНК можно использовать, чтобы дополнить способность штамма к утилизации ксилозы в качестве единственного источника углерода. Например, один или более генов утилизации ксилозы из других источников может быть внесено в штамм, чтобы дополнить степень утилизации ксилозы. Например, ксилозаизомераза из Piromyces sp. может быть встроена в геном, как описано в публикации Kuyper et al., единственно с целью дополнения утилизации ксилозы. Ксилозаредуктаза (XYL1) или ксилитдегидрогеназа (XYL2) из Pichia stipitis может быть клонирована в Saccharomyces, как описано в публикации Wahlbom et al. (2003), чтобы дополнить способность штамма утилизировать ксилозу. Однако специалисты в данной области должны признать,что добавление последовательностей для утилизации ксилозы рекомбинантными методами проводится с целью только дополнить существующую способность штаммов к росту со скоростью по меньшей мере одна генерация за 48 ч, утилизируя ксилозу в качестве единственного источника углерода. В следующем примере один или более генов, которые кодируют метаболические активности, которые могут влиять на эффективность утилизации ксилозы посредством Saccharomyces другим путем, отличным от прямого действия на ксилозу, ксилит или ксилулозу, могут быть внесены в нерекомбинантные штаммы и их экспрессия может быть изменена при использовании технологий рекомбинантных ДНК. В некоторых случаях может быть желательным увеличить экспрессию определенных генов, в то время как в других случаях может оказаться желательным уменьшить или исключить экспрессию определенных генов. Гены-мишени для изменения экспрессии могут включать в себя такие гены, которые кодируют метаболические активности цитоплазм, митохондрий или других органелл. Такие гены могут кодировать активности, вовлеченные в транспорт сахара, транспорт питательных веществ, гликолиз, конечные стадии брожения, пентозофосфатный путь, глюконеогенез, цикл трикарбоновых кислот, цикл глиоксалата, цепь передачи электронов, внутриклеточный окислительно-восстановительный баланс,взаимодействие между брожением и дыханием, синтез и метаболизм аминокислот и т.д. Примеры генов,которые могут быть модифицированы посредством технологий рекомбинантных ДНК, включают в себяRPE1, RK11, TAL1 и TKL1 или любые другие гены, которые могут повышать способность дрожжей использовать ксилозу в качестве единственного источника углерода. Специалист в данной области должен принять во внимание, что один или более генов утилизации ксилозы можно встроить в штамм, используя рекомбинантные методы. Методы получения рекомбинантных дрожжей хорошо известны в данной области и описаны, например, в публикации Guthrie and Fink(1991) "Guide to Yeast Genetics and Molecular Biology", Methods in Enzymology, vol 194, Academic Press. Гены или интересующие исследователя последовательности могут быть клонированы с помощью подходящих векторов для трансформации в дрожжевой клетке. Ген или интересующую последовательность клонируют с помощью подходящего экспрессирующего вектора, такого как рМА 91 (Dobson et al. (1984)EMBO Journal, 3: 1115), который содержит соответствующие регуляторные области для экспрессии в штамме дрожжей. Другие векторы включают в себя эписомальные, центромерные, интегративные, модифицированные экспрессирующие векторы, известные специалистам в данной области (см., например,Guthrie and Fink (1991) "Guide to Yeast Genetics and Molecular Biology", Methods in Enzymology, Vol 194,Academic Press). Регуляторные области, подходящие для экспрессии в дрожжах, могут включать в себя,например, MAL, PGK1, ADH1, GAL1, GAL10, CUP1, GAP, CYC1, PHO5. В качестве альтернативы, регуляторные области гена сами по себе могут быть использованы для экспрессии гена в Saccharomyces. Ген или интересующая последовательность может быть встроена в геном дрожжей, например, в локус рибосомальной РНК. С этой целью, рибосомальные последовательности подходящего вектора (например,плазмидный pIRL9) выделяют и клонируют соответственно BS+вектору. Ген или интересующая последовательность связывается с соответствующими областями промотора и терминатора дрожжей с образованием экспрессирующей кассеты, и затем экспрессирующую кассету клонируют с помощью клониро- 18010892 ванных рибосомальных последовательностей. Из данной результирующей плазмиды экспрессирующая кассета, фланкированная рибосомальными последовательностями, может быть изолирована в виде одного фрагмента, используя соответствующие рестриктазы. Выделенный фрагмент может быть трансформирован вместе с автономно реплицирующей плазмидой, несущей соответствующий маркер для трансформации в дрожжах, с помощью методов, известных в данной области (см., например, Guthrie and Fink(1991) "Guide to Yeast Genetics and Molecular Biology", Methods in Enzymology, Vol 194, Academic Press). Позже плазмиду можно удалить из клетки путем культивирования клеток в условиях, которые не позволяют выбрать плазмиду. Штамм Saccharomyces spp. согласно настоящему изобретению может найти любое применение, для которого штамм Saccharomyces spp. такого вида должен быть использован. Например, штамм Saccharomyces cerevisiae, который способен утилизировать ксилозу как единственный источник углерода, может быть использован в хлебопечении, пивоварении, производстве биомассы, брожении сахара и производстве этанола или в любых других областях, в которых используют стандартный штамм Saccharomyces. Способность штамма Saccharomyces согласно настоящему изобретению расти на ксилозе в качестве единственного источника углерода приводит к подходящему фенотипу, использование которого поможет найти отличия между штаммами Saccharomyces, которые проявляют способность к росту со скоростью, составляющей по меньшей мере одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода, и теми штаммами, которые не предназначены для "мечения" штаммов дрожжей. В одном аспекте изобретение относится к способу "мечения" штамма Saccharomyces, включающему стадии:(a) культивирования желательного штамма со штаммом согласно изобретению в условиях, позволяющих комбинировать ДНК штаммов;(b) селекции или скринирования производных желательного штамма, которые имеют повышенную скорость роста, используя ксилозу в качестве единственного источника углерода для роста;(c) выделения производных желательного штамма, которые имеют повышенную скорость роста,используя ксилозу в качестве единственного источника углерода для роста. В одном варианте осуществления изобретения способ включает:(a) спаривание желательного штамма со штаммом Saccharomyces четвертого-четырнадцатого аспекта в условиях, которые позволяют комбинировать ДНК штаммов; и(b) скринирование или селекцию производных желательного штамма, которые проявляют способность к росту со скоростью выше, чем одна генерация за 48 ч, используя ксилозу в качестве единственного источника углерода, путем выращивания спаренных клеток на пластине на твердой среде, содержащей ксилозу, или путем культивирования в жидкой среде, содержащей ксилозу, или путем комбинации указанных способов;(c) выделение производных желательного штамма, которые имеют повышенную скорость роста,используя ксилозу в качестве единственного источника углерода для роста. Отмеченные штаммы могут быть определены путем инкубации штамма на минимальной среде или в минимальной среде, содержащей ксилозу, и определения скорости роста или сравнения скорости роста с таковой стандартного штамма с известной скоростью роста, растущего на среде или в среде, содержащей ксилозу. Подходящим тестом для выявления штамма является тест T1, в соответствии с которым отмеченный штамм проявляет по меньшей мере 2-кратное увеличение биомассы в тесте T1. В другом воплощении изобретения штамм вида Saccharomyces согласно изобретению может быть использован для продуцирования соединений, таких как этанол, ксилит, уксусная кислота, другие побочные продукты дрожжей, ферменты и т.д. Способы продуцирования соединений могут включать следующие стадии:(a) культивирования штамма Saccharomyces в среде, содержащей ксилозу, в условиях, которые позволяют штамму продуцировать соединение; и(b) извлечения соединения(й), которое продуцируется штаммом. Соединение может быть одним соединением или представлять более одного соединения или смесь соединений, которые продуцируются штаммом Saccharomyces при утилизации ксилозы в качестве единственного источника углерода. Например, соединение может быть этанолом, ксилитом, уксусной кислотой, двуокисью углерода или любым компонентом, метаболитами и побочными продуктами дрожжевых клеток и их метаболизма. Компоненты дрожжевых клеток могут включать в себя ферменты, кофакторы,витамины, аминокислоты, пептиды, белки, нуклеозиды, нуклеотиды, олигонуклеотиды, ДНК, РНК, компоненты клеточной стенки, глюканы, маннопротеины, мембранные компоненты, липиды, стеролы, запасные углеводы, трегалозу, гликоген, органические кислоты, янтарную кислоту, уксусную кислоту, молочную кислоту, многоатомные спирты, такие как глицерин, ксилит. Специалистам в данной области следует принять во внимание, что тип соединений, продуцируемых штаммом вида Saccharomyces, может зависеть от условий роста, которым штамм подвергается. Например, температура, аэробный или анаэробный рост, рН среды, источник азота, присутствие источников углерода, отличных от ксилозы, другие соединения в среде индивидуально или в комбинации могут вли- 19010892 ять на типы соединений, которые продуцируются штаммом Saccharomyces cerevisiae. Однако точные условия продуцирования одного или более соединений легко сможет установить специалист в данной области посредством стандартных процедур. Специалисты в данной области должны принять во внимание, что штаммы Saccharomyces согласно изобретению будут проявлять способность к утилизации сахаров, таких как глюкоза, фруктоза, манноза,галактоза, мальтотриоза, мальтоза, сахароза, мелибиоза, раффиноза, ксилоза, мелизитоза, альфаметилглюкозид, трегалоза, изомальтоза. Штаммы также проявляют способность к использованию источников углерода, отличных от сахара, таких как этанол, ацетат, глицерин, ксилит. Штамм согласно изобретению будет проявлять способность сбраживать сахара, такие как глюкоза,фруктоза, манноза, галактоза, мальтотриоза, мальтоза, сахароза, мелибиоза, раффиноза, ксилоза, мелизитоза, альфа-метилглюкозид, трегалоза или изомальтоза, в добавление к ксилозе для продуцирования двуокиси углерода и этанола. Ксилоза в среде, содержащей ксилозу, может находиться в любом виде, который может быть утилизирован дрожжами. Например, ксилоза может быть очищенной или может быть в сыром виде, таком как гемицеллюлозный гидролизат, полученный из кислотного гидролизата биомассы, такой как сахарный тростник, солома, кукурузная солома, древесные продукты и т.д. При получении биомассы и соединений инокулированную среду, содержащую ксилозу, обычно культивируют в области температур между 22 и 40C в течение времени от 2 ч до 4 дней. Кроме того, авторы изобретения обнаружили, что для того, чтобы получать этанол из ксилозы с помощью штаммов согласно изобретению, необязательно, чтобы штаммы проявляли значительный рост на ксилозе. Авторы изобретения нашли, что обильный засев среды, содержащей ксилозу, штаммами согласно изобретению, приводит к продуцированию этанола в течение 2 ч, обычно 4 ч, более характерно 5 ч. При таких условиях существенный рост не определяется. Таким образом, изобретением предоставляется способ производства этанола, включающий:(a) инокуляцию среды, содержащей ксилозу, штаммом первого-восьмого, двенадцатого или тринадцатого аспектов до плотности по меньшей мере 1108 клеток дрожжей на мл среды;(b) инкубацию засеянной среды в течение времени, достаточного для того, чтобы позволить продуцирование этанола;(с) извлечение этанола. Среда, содержащая ксилозу, может быть любой средой, содержащей ксилозу, упомянутой выше. Плотность клеток дрожжей может составлять по меньшей мере 5108, обычно по меньшей мере 8 610 дрожжевых клеток на мл среды. Инокулированную среду можно инкубировать в течение по меньшей мере 2 ч, обычно по меньшей мере 5 ч. В другом аспекте изобретение относится к способу получения этанола, включающему в себя инкубацию нерекомбинантного штамма Saccharomyces в среде, содержащей ксилозу, в условиях, достаточных для продуцирования этанола, и после этого извлечение этанола. Определение тестов от T1 до Т 9T1: Культивирование при использовании ксилозы в качестве единственного источника углерода Штаммы дрожжей сеют штрихом на среде, содержащей глюкозу, дрожжевой экстракт и бактериологический пептон (Glucose Yeast extract Bacteriological Peptone medium), затвердевающей с помощью 2%-ного агара, используя стандартные микробиологические методы. После инкубации в течение 72 ч при 30C дрожжевые клетки снимают с пластин с помощью стерильной микробиологической петли и делают посев до OD600 (оптическая плотность при 600 нм) между 0,1 и 0,2 единицами (OD600 при T0) в 50 мл бульона. Бульон содержит ксилозу (5% мас./об.), Difco Yeast Nitrogen Base без аминокислот (0,67%) в дистиллированной воде в 250 мл колбе Эрленмейера. Культуры инкубируют при 30C с перемешиванием при 220 об./мин (10 см диаметр вращения) в течение 48 ч до измерения OD600 (OD при Т 48 час.). Кратность увеличения биомассы определяют уравнением:T2: Выход клеточной биомассы при использовании ксилозы в качестве единственного источника углерода Штаммы дрожжей сеют штрихом на среде, содержащей глюкозу, дрожжевой экстракт и бактериологический пептон (Glucose Yeast extract Bacteriological Peptone medium), затвердевающей с помощью 2%-ного агара, используя стандартные микробиологические методы. После инкубации в течение 72 ч при 30C дрожжевые клетки снимают с пластин с помощью стерильной микробиологической петли и делают посев до OD600 (оптическая плотность при 600 нм) между 0,1 и 0,2 единицами в 50 мл бульона. Бульон содержит ксилозу (5% мас./об.), Difco Yeast Nitrogen Base без аминокислот (0,67%) в дистиллированной воде в 250 мл колбе Эрленмейера. Культуры инкубируют при 30C с перемешиванием при 220 об./мин (10 см диаметр вращения) в течение 72 ч до измерения выхода сухого дрожжевого материала.- 20010892 Сухой вес дрожжей измеряют путем переноса 5 мл культуры дрожжей в предварительно взвешенную стеклянную пробирку (W1) с последующим центрифугированием при 3000 g в течение 10 мин при 22C. Супернатант удаляют, не взбалтывая осадок дрожжей, и клетки ресуспендируют в 5 мл дистиллированной воды до повторного центрифугирования при 3000 g в течение 10 мин при 22C. Супернатант вновь удаляют, не взбалтывая осадок дрожжей, и клетки ресуспендируют в 5 мл дистиллированной воды до повторного центрифугирования при 3000 g в течение 10 мин при 22C. Стеклянную пробирку, содержащую клетки дрожжей, выдерживают при 105C в течение 24 ч и взвешивают (W2). Сухую дрожжевую массу оценивают путем вычитания W1 из W2 и умножения полученной величины на 10. Анализы выполняют дважды и среднюю величину рассчитывают. Т 3: Продуцирование этанола при использовании ксилозы в качестве единственного источника углерода. Инокулят дрожжей получают путем выращивания чистых клеток штамма, взятых с помощью 1 стандартной микробиологической петли, в течение 16 ч при 30 С с перемешиванием при 220 об./мин в 250 мл колбе Эрленмейера, содержащей в 50 мл дистиллированной воды: 2,5 г ксилозы, 0,5 г дрожжевого экстракта, 0,5 г бактериологического пептона. Семь культур по 50 мл выращивают одновременно. Культуры собирают центрифугированием при 22C и 3000g в течение 5 мин. Супернатант отбрасывают,и клеточные осадки вновь суспендируют в стерилизованной дистиллированной воде и вновь центрифугируют. Супернатант отбрасывают и клеточные осадки вновь суспендируют и объединяют в 20 мл содержащей ксилозу минимальной среды, которая содержит в 1 л дистиллированной воды: 50 г ксилозы,13,4 г Difco Yeast Nitrogen Base без аминокислот, снабженной 0,4 мг CuSO45H2O, 1 мг ZnSO47H2O, 2 мгMnSO44H2O, 1 мг Na2MoO42H2O, 1 мг Na2B4O710H2O, 2 мг Ca-пантотената, 2 мг тиамина HCl, 2 мг пиридоксина HCl, 4 мг инозита, 1 мг никотиновой кислоты и 0,4 мг биотина. Затем клетки высевают в 980 мл такой же минимальной среды, содержащей ксилозу, которую предварительно нагревают до 30C, и 2 л сосуд для сбраживания Braun Biostat B аэрируют до содержания кислорода 20%. Дрожжи растут при нагнетании воздуха 10 л в мин, с перемешиванием при 1200 об./мин и поддержании рН при рН 5, используя добавления KOH или фосфорной кислоты при необходимости. Через 24 ч 300 мл объема культуры удаляют и заменяют 300 мл свежей минимальной среды с ксилозой,содержащей 50 г ксилозы плюс 10 г Difco Yeast Nitrogen Base без аминокислот и незначительной количество солей и витаминов, приведенное выше. Через 7 ч 30 г свежей ксилозы добавляют к культуре, и подачу воздуха снижают до 4 л/мин, и скорость перемешивания снижают до 200 об./мин. Этанол определяют через дополнительные 20 ч с помощью анализатора YSI 2700 Select Biochemistry Analyzer, снабженного мембраной YSI 2786 для регистрации этанола (YSI Inc. Yellow Springs, Ohio, USA).T4: Исследование ксилозаредуктазы Штаммы дрожжей выращивают на глюкозе, дрожжевом экстракте и бактериологическом пептонном агаре, как описано ранее, высевают до оптической плотности при 600 нм между 0,1 и 0,2 единицами в 250 мл встряхиваемой колбе в 50 мл среды, которая содержит 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона (XYP). Культуры инкубируют при 30 С и 180 об./мин до тех пор, пока оптическая плотность культур не достигнет при 600 нм между 3 и 5 единицами. Если клетки не достигают требуемой плотности после 24 ч инкубации, их все-таки собирают. Клетки собирают путем центрифугирования при 3000g и 4 С в течение 5 мин. Супернатант отбрасывают, и клеточный осадок вновь суспендируют в охлажденной дистиллированной воде и вновь центрифугируют. Супернатант отбрасывают и процедуру повторяют для того, чтобы удалить все следы среды. Клетки вновь суспендируют в буфере для дезинтеграции, и клеточные экстракты приготовляют, как описано в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 33813386. Затем в клеточных экстрактах исследуют активности ксилозаредуктазы методом, описанным в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 3381-3386. За одну единицу активности принимают 1 наномоль NAD(P)H, восстановленный или окисленный в минуту на мг белка при 30C. Белок исследуют методом, описанным Lowry O.H., Rosebrough N.J., Farr A.L. и RandallR.J. (1951) Journal of Biological Chemistry, 193: 265-275, используя в качестве стандарта бычий сывороточный альбумин. Т 5: Исследование ксилитдегидрогеназы Штаммы дрожжей выращивают на глюкозе, дрожжевом экстракте и бактериологическом пептонном агаре, как описано ранее, высевают до оптической плотности при 600 нм между 0,1 и 0,2 единицами в 250 мл встряхиваемой колбе в 50 мл среды, которая содержит 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона (XYP). Культуры инкубируют при 30C и 180 об./мин до тех пор, пока оптическая плотность культур не достигнет при 600 нм между 3 и 5 единицами. Если клетки не достигают требуемой плотности после 24 ч инкубации, их все же собирают. Клетки собирают путем центрифугирования при 3000g и 4C в течение 5 мин. Супернатант отбрасывают, и клеточный осадок вновь суспендируют в охлажденной дистиллированной воде и вновь центрифугируют. Супернатант отбрасывают и процедуру повторяют для того, чтобы удалить все следы среды. Клетки вновь суспендируют в буфере для дезинтеграции, и клеточные экстракты приготовляют, как- 21010892 описано в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 33813386. Затем в клеточных экстрактах исследуют активности ксилитдегидрогеназы методом, описанным в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 3381-3386. За одну единицу активности принимают 1 наномоль NAD(P)H, восстановленный или окисленный в минуту на мг белка при 30C. Белок исследуют методом, описанным Lowry O.H., Rosebrough N.J., Farr A.L. и RandallR.J. (1951) Journal of Biological Chemistry, 193: 265-275, используя в качестве стандарта бычий сывороточный альбумин. Т 6: Исследование ксилулозакиназы Штаммы дрожжей выращивают на глюкозе, дрожжевом экстракте и бактериологическом пептонном агаре, как описано ранее, высевают до оптической плотности при 600 нм между 0,1 и 0,2 единицами в 250 мл встряхиваемой колбе в 50 мл среды, которая содержит 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона (XYP). Культуры инкубируют при 30C и 180 об./мин до тех пор, пока оптическая плотность культур не достигнет при 600 нм между 3 и 5 единицами. Если клетки не достигают требуемой плотности после 24 ч инкубации, их все же собирают. Клетки собирают путем центрифугирования при 3000g и 4C в течение 5 мин. Супернатант отбрасывают, и клеточный осадок вновь суспендируют в охлажденной дистиллированной воде и вновь центрифугируют. Супернатант отбрасывают и процедуру повторяют для того, чтобы удалить все следы среды. Клетки вновь суспендируют в буфере для дезинтеграции, и клеточные экстракты приготовляют, как описано в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 33813386. Затем в клеточных экстрактах исследуют активности ксилулозакиназы методом, описанным в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66 p., 3381-3386. За одну единицу активности принимают 1 наномоль NAD(P)H, восстановленный или окисленный в минуту на мг белка при 30C. Белок исследуют методом, описанным Lowry O.H., Rosebrough N. J., Farr A.L. и RandallR.J. (1951) Journal of Biological Chemistry, 193: 265-275, используя в качестве стандарта бычий сывороточный альбумин. Т 7: Культивирование с использованием ксилита в качестве единственного источника углерода Штаммы дрожжей сеют штрихом на среде, содержащей глюкозу, дрожжевой экстракт и бактериологический пептон (Glucose Yeast extract Bacteriological Peptone medium), затвердевающей с помощью 2%-ного агара, используя стандартные микробиологические методы. После инкубации в течение 72 ч при 30C дрожжевые клетки снимают с пластин с помощью стерильной микробиологической петли и делают посев до OD600 (оптическая плотность при 600 нм) между 0,1 и 0,2 единицами (OD600 при T0) в 50 мл бульона. Бульон содержит ксилит (5% мас./об.), Difco Yeast Nitrogen Base без аминокислот (0,67%) в дистиллированной воде в 250 мл колбе Эрленмейера. Культуры инкубируют при 30C с перемешиванием при 220 об./мин (10 см диаметр вращения) в течение 48 ч до измерения OD600 (OD при Т 48 час.). Кратность увеличения биомассы определяют уравнением: Т 8: Продуцирование этанола при использовании ксилозы в обогащенной среде Штаммы дрожжей сеют штрихом на среде, содержащей глюкозу, дрожжевой экстракт и бактериологический пептон (Glucose Yeast extract Bacteriological Peptone medium), затвердевающей с помощью 2%-ного агара, используя стандартные микробиологические методы. После инкубации в течение 96 ч при 30C дрожжевые клетки снимают с пластин с помощью стерильной микробиологической петли и делают посев до OD600 (оптическая плотность при 600 нм) между 1 и 2 единицами в 50 мл бульона. Бульон содержит ксилозу (5% мас./об.), дрожжевой экстракт (0,5% мас./об.) и бактериологический пептон(1% мас./об.) в дистиллированной воде в 250 мл колбе Эрленмейера. Культуры инкубируют при 30C с перемешиванием при 220 об./мин (10 см диаметр вращения). Образцы культурального супернатанта исследуют ежечасно в течение 24 ч относительно этанола с помощью анализатора YSI 2700 Select Biochemistry Analyzer, снабженного мембраной YSI 2786 для регистрации этанола (YSI Inc. Yellow Springs, Ohio,USA). Уровни этанола выражают в виде граммов на литр. Т 9: Продуцирование этанола в минимальной минеральной среде, содержащей ксилозу, при анаэробных условиях Штаммы дрожжей сеют штрихом на среде, содержащей 5% мас./об. ксилозы, 0,67% мас./об. средыDifco Yeast Nitrogen Base без аминокислот, затвердевающей с помощью 2%-ного агара, используя стандартные микробиологические методы. После инкубации в течение 96 ч при 30C дрожжевые клетки снимают с пластин и делают посев прямо в 10 мл стерилизованной 5% мас./об. ксилозы плюс 0,67% мас./об. среды Difco Yeast Nitrogen Base без аминокислот, содержащихся в стерильных РР-тестпробирках объемом 15 мл (Cellstar, Greiner bio-one) до оптической плотности при 600 нм от 0,1 до 0,4. Поверх среды наслаивают 2 мл стерилизованного минерального масла, чтобы ингибировать перенос кислорода, колпачки полностью затягивают болтами и пробирки инкубируют без перемешивания при 30C. Образцы для исследования этанола удаляют, используя стерилизованные пипетки Пастера, не взбалты- 22010892 вая клеточного осадка, который образуется в течение роста исходного посевного материала. Этанол анализируют с помощью анализатора YSI 2700 Select Biochemistry Analyzer, снабженного мембраной YSI 2786 для регистрации этанола (YSI Inc. Yellow Springs, Ohio, USA). Далее изобретение описывают подробно, ссылаясь только на следующие неограничивающие примеры. Пример 1. Штамм Saccharomyces проявляет способность к медленному росту, используя ксилозу в качестве единственного источника углерода. Хлебопекарные дрожжи Saccharomyces cerevisiae штамма NL67 (Higgins et al. (1999) Applied andEnvironmental Microbiology, 65: 680-685) засевали в затвердевшую минимальную минеральную среду с ксилозой в качестве единственного источника углерода или без ксилозы и инкубировали при 30 С в течение двух месяцев. С помощью светового микроскопа авторы наблюдали, что колонии образовывались на обоих типах пластин, однако колоний, растущих на среде, содержащей ксилозу, было заметно больше, чем колоний,растущих на среде без источника углерода. В то время как клетки на среде, не содержащей ксилозу, развивались на протяжении 5-6 генераций, клетки на среде, содержащей ксилозу, прогрессировали на протяжении 9-10 генераций. Пример 2. Генерация популяций, включающих в себя различные штаммы Saccharomyces, способные к быстрому росту на ксилозе как на единственном источнике углерода Получение штаммов дрожжей из ряда источников, которые включают штаммы, полученные из штаммов дикого типа, из штаммов, применяемых для брожения виноградного сусла, из спиртовых дрожжей и применяемых для брожения пива, а также применяемые в хлебопечении, стимулирование спорообразования у данных штаммов и использование технологий массового спаривания для произведения генетически различной популяции, сделало возможным применение давления отбора для обогащения дрожжевых штаммов штаммами, способными к более эффективному росту, используя ксилозу в качестве единственного источника углерода. При распределении генетически различных популяций на минимальной минеральной среде с ксилозой (и одновременно на такой же минимальной минеральной среде без источника углерода) и при инкубации в течение двух месяцев наблюдали неоднородность в размере колоний. Сравнивая пластины с ксилозой и без ксилозы, было сделано наблюдение, что несмотря на принятую концепцию, клетки росли благодаря добавлению ксилозы к среде, означая, что неоднородность в размере колоний объясняется неоднородностью в способности штаммов дрожжей в популяции к росту на ксилозе. Путем сбора целой популяции, растущей на ксилозе, и образования спор стало возможным произвести новые популяции дрожжей, которые были обогащены генетической информацией,дающей возможности к более эффективному росту на ксилозе. Используя большие количества популяций (по меньшей мере, 100000) и объединяя клетки, включающие клетки, которые не росли оптимально,генетическая разнородность популяции сохранялась в каждой генерации. По мере того как число циклов спаривания и отбора увеличивалось, разнородность колоний по размеру сохранялась, но конечный размер колоний увеличивался. После 5-20 циклов отбора на агаровых пластинах популяции вносили в жидкую культуру, содержащую минимальную минеральную среду с ксилозой как с единственным источником углерода, и подвергали непрерывному субкультивированию в течение приблизительно 50 генераций. Последующие популяции образовывали споры, и новые популяции были созданы посредством множества спариваний. Новые популяции неоднородных клеток Saccharomyces выращивали в жидкой культуре в минимальной среде с ксилозой в течение приблизительно 50 генераций. После этого времени некоторое количество образца хранили, и некоторое количество образца образовывало споры. Развившиеся споры, произведенные из отобранной популяции, спаривали вместе, чтобы создать новую популяцию неоднородных клетокSaccharomyces cerevisiae, которая сможет расти под давлением отбора в жидкой минимальной среде с ксилозой в течение приблизительно 50 генераций. Этот способ может быть повторен до тех пор, пока не будет достигнута желательная скорость роста. Для того, чтобы определить, увеличиваются ли скорости роста популяций на минимальной среде с ксилозой, образцы, взятые после 365, 569, 1013, 1059, 1170 и 1377 дней соответственно отбору, высевали в минимальную среду с ксилозой при оптической плотности 600 нм (OD) между 0,1 и 0,2 единицами с перемешиванием при 220 об./мин и 30C. OD измеряли повторно после 24 ч и эту величину использовали для расчета среднего времени удвоения в течение 24 ч периода согласно стандартному микробиологическому методу. Результаты были изображены графически и показаны на фиг. 1. На фиг. 1 представлены результаты, показывающие, что улучшение скоростей роста популяций в целом является экспоненциальным процессом, так как они развиваются на протяжении циклов спаривания и отбора для роста на ксилозе как на единственном источнике углерода. Это улучшение скорости роста на ксилозе как на единственном источнике углерода, как полагают, продолжается до тех пор, пока скорость роста на ксилозе не окажется эквивалентной скорости роста на глюкозе как на единственном источнике углерода.- 23010892 Пример 3. Продуцирование этанола в обогащенной среде с ксилозой неоднородными популяциями нерекомбинантных штаммов Saccharomyces коррелирует со скоростью роста на минимальной минеральной среде с ксилозой. Время удвоения популяций в минимальной среде с ксилозой определяли, как описано в примере 2,фиг. 1. Продуцирование этанола определяли путем посева образцов популяций при оптической плотности при 600 нм между 1 и 2 единицами в 250 мл встряхиваемую колбу в 50 мл среды, которая содержала 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона(XYP). Культуры инкубировали при 30C и 220 об./мин и продукцию этанола контролировали в течение 2 дней. Полученные данные (табл. 1) указывают на то, что способность продуцировать этанол в обогащенной среде с ксилозой, повышается по мере того, как время удвоения неоднородных популяций на минимальной среде с ксилозой снижается. Обе характеристики улучшались вместе с числом повторений и продолжительностью времени, которое было употреблено для способа спаривания и отбора. Таблица 1. Сбраживание ксилозы до этанола в обогащенной среде улучшается по мере того, как скорость роста неоднородных популяций нерекомбинантных штаммов Saccharomyces в минимальной минеральной среде с ксилозой увеличивается Величины продукции этанола представлены в г этанола/л, продуцированного при указанном времени (мин). Пример 4. Характеристика чистых нерекомбинантных штаммов Saccharomyces, проявляющих способность к росту на ксилозе в качестве единственного источника углерода согласно тестам T1 и Т 2 Изоляты штамма Saccharomyces очищали из популяции, утилизирующей ксилозу, примера 2 посредством стандартной микробиологической процедуры и проверяли относительно роста и выхода на ксилозе как на единственном источнике углерода согласно тесту T1 и Т 2. Штаммы CEN.PK (Karhumaa etal. (2005) Yeast 22: 259-368) и NL67 (Higgins et al. (1999) Applied and Environmental Microbiology, 65: 680685) включали в исследование как представляющие штамм типы, существующие до применения способов, описанных в данном тексте. Штаммы NM04/41257 и MN04/41258 (депонированные) произведены из популяций, которые прошли через 1059 дней выполнения протокола, описанного в примере 2 и фиг. 1. Штаммы ISO 10 (NM 05/45177) и ISO 7 (NM 05/45178) были получены из популяций, которые прошли через 1377 дней и 1431 день, соответственно, выполнения протокола, описанного в примере 2 и фиг. 1. Индивидуальные выделенные штаммы дрожжей являются членами вида Saccharomyces cerevisiae, что подтверждено с помощью технологий образования спор и спаривания впоследствии произведенных гаплоидов с известными лабораторными штаммами Saccharomyces cerevisiae с генетическими маркерами. Таблица 2. Выращивание чистых штаммов Saccharomyces cerevisiae на минимальной среде с ксилозой,как описано в тесте T1 Выход биомассы чистых штаммов Saccharomyces cerevisiae на минимальной среде с ксилозой ана- 24010892 лизировали, как описано в тесте Т 2. Штаммы CEN.PK и NL67 были вновь включены как представляющие штамм типы, которые не были произведены описанными в тексте способами. Выход CEN.PK = 1 мг сухой дрожжевой массы на 50 мл культуры; выход NL67 = 2 мг сухой дрожжевой массы на 50 мл культуры; выход NM04/41257 = 50 мг сухой дрожжевой массы на 50 мл культуры; выход NM04/41258 = 55 мг сухой дрожжевой массы на 50 мл культуры; выход ISO 10 = 145 мг сухой дрожжевой массы на 50 мл культуры; выход ISO 7 = 114 мг сухой дрожжевой массы на 50 мл культуры. Представленные выше данные указывают на то, что произведенные по протоколу штаммы обладают способностью к быстрому росту и хорошему выходу, используя ксилозу в качестве единственного источника углерода. Полученные данные, взятые с данными относительно популяций из примера 2 и фиг. 1, показывают, что протокол может быть использован повторно, чтобы произвести штаммы, которые имеют максимально возможные скорость роста и выход на ксилозе, которые могут быть эквивалентными скорости роста и выходу на глюкозе. Пример 5. Нерекомбинантные штаммы Saccharomyces, способные к быстрому росту и к продуцированию этанола, используя ксилозу в качестве единственного источника углерода Инокулят штамма ISO10 получали путем выращивания чистых клеток штамма с 1 стандартной микробиологической петли в течение 16 ч при 30C с перемешиванием при 200 об./мин в 250 мл колбе Эрленмейера, содержащей в 50 мл дистиллированной воды: 2,5 г ксилозы, 0,5 г дрожжевого экстракта,0,5 г бактериологического пептона. Семь культур по 50 мл выращивали одновременно. Культуры собирали центрифугированием при 22 С и 3000g в течение 5 мин. Супернатант отбрасывали и клеточные осадки вновь суспендировали в стерилизованной дистиллированной воде и вновь центрифугировали. Супернатант отбрасывали, и клеточные осадки вновь суспендировали и объединяли в 20 мл минимальной среды с ксилозой, которая содержала на л дистиллированной воды: 50 г ксилозы, 13,4 г среды DifcoMnSO44H2O, 1 мг Na2MoO42H2O, 1 мг Na2B4O710H2O, 2 мг Са-пантотената, 2 мг тиамина HCl, 2 мг пиридоксина HCl, 4 мг инозита, 1 мг никотиновой кислоты и 0,4 мг биотина. Затем клетки высевали в 980 мл такой же минимальной среды, содержащей ксилозу, которую предварительно нагревали до 30C, и 2 л сосуд для сбраживания Braun Biostat B аэрировали до содержания кислорода 20%. Дрожжи выращивали при нагнетании воздуха 10 л в мин, с перемешиванием при 1200 об./мин и поддержании рН при рН 5, используя добавления KOH или фосфорной кислоты при необходимости. Через 24 ч 300 мл объема культуры удаляли и заменяли 300 мл свежей минимальной среды с ксилозой, содержащей 50 г ксилозы плюс 10 г среды Difco Yeast Nitrogen Base без аминокислот и незначительное количество солей и витаминов, указанное выше. Выращивание культуры привело к клеточной массе, составившей 4 г эквивалентов сухих дрожжей на литр. Аэрацию и перемешивание поддерживали при 10 л/мин и 1200 об./мин, соответственно, и рН поддерживали при рН 5. В указанных условиях дрожжевая биомасса удваивалась за 4 ч (на основании сухой дрожжевой массы) с выходом 4 г сухой дрожжевой массы из 10 г израсходованной ксилозы. Когда дрожжи, выращенные согласно процедуре, описанной выше, достигли плотности приблизительно 12 г (эквивалент сухих дрожжей) на литр, к культуре добавили 30 г свежей ксилозы, и подачу воздуха снизили до 4 л/мин, и скорость мешалки снизили до 200 об./мин При указанных условиях, в которых растворенный кислород не обнаруживался, 17 г ксилозы было израсходовано, и, кроме того, 1 г сухой дрожжевой массы был получен наряду с 1,75 г этанола/л и 1 г ксилита/л за 20 ч. Пример 6. Активности ксилозаредуктазы (XR), ксилитдегидрогеназы (XDH) и ксилулозакиназы(XK) в экспоненциально растущих нерекомбинантных штаммах дрожжей Штаммы дрожжей выращивали на глюкозе, дрожжевом экстракте и бактериологическом пептоне с агаром, как описано в тесте T1, высевали до оптической плотности при 600 нм между 0,1 и 0,2 единицами в 250 мл встряхиваемую колбу в 50 мл среды, которая содержала 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона (XYP). Культуры инкубировали при 30C и 180 об./мин до тех пор, пока они не достигали оптической плотности при 600 нм между 3 и 5 единицами. Если, как в случае штаммов, таких как NL67 и CEN.PK, клетки не достигли требуемой плотности после 24 ч инкубации, их все же собирали и исследовали. Клетки собирали центрифугированием при 3000g и 4 С в течение 5 мин. Супернатант отбрасывали, и клеточный осадок вновь суспендировали в охлажденной дистиллированной воде и вновь центрифугировали. Супернатант отбрасывали и способ повторяли для того, чтобы удалить все следы среды. Клетки вновь суспендировали в буфере для дезинтеграции, и клеточные экстракты приготовляли,как описано в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 3381-3386. Затем клеточные экстракты исследовали относительно активностей XR, XDH и XK способами, описанными в публикации Eliasson A., et al. (2000) Applied and Environmental Microbiology, vol. 66, p. 3381-3386. Следующие активности были обнаружены, где одна единица активности определяется как 1 наномоль NAD(P)H, восстановленный или окисленный в минуту на мг белка при 30C.- 25010892 Таблица 3. Единицы активностей ферментов штаммов дрожжей Полученные данные указывают на то, что методология повторного спаривания и отбора, примененная для получения дрожжей, которые растут на ксилозе как на единственном источнике углерода, привела к улучшенным активностям ферментов XR и XDH, являющихся критическими для метаболизма ксилозы и ксилита. Вероятно, что другие ферменты и активности, такие, которые вовлечены в пентозофосфатный путь,также можно улучшить в штаммах согласно изобретению благодаря давлениям отбора, примененным в процедурах выведения потомства и селекции. Специалисты в данной области должны осознавать, что штаммы согласно настоящему изобретению могут быть использованы в качестве основы для дальнейшего улучшения штаммов путем селекций и комбинаций таких методов, как выведение потомства, мутагенез, слияние протопластов, цитодукция и/или технологии рекомбинантных ДНК, которые оптимизируют активности ферментов XR, XDH, XK или вводят и оптимизируют ксилозаизомеразу, или другие генетические изменения, требуемые для улучшения метаболизма ксилозы, ксилита и ксилулозы. Пример 7. Характеристика чистых нерекомбинантных штаммов Saccharomyces, проявляющих способность к росту на ксилите в качестве единственного источника углерода согласно тесту Т 7. Чистые штаммы выращивали на глюкозе, дрожжевом экстракте и бактериологическом пептонном агаре, как описано в тесте T1. Колонии штамма высевали в 50 мл 5% мас./об. ксилита плюс 0,67% средыDifco Yeast Nitrogen Base без аминокислот и контролировали рост, как описано в тесте Т 7. Таблица 4. Рост чистых штаммов Saccharomyces cerevisiae на минимальной среде с ксилитом, как описано в тесте Т 7 Полученные данные указывают на то, что повторяющаяся методология спаривания и селекции,применяемая для получения дрожжей, которые растут на ксилозе как на единственном источнике углерода, приводит к получению некоторых штаммов, которые также утилизируют ксилит в качестве единственного источника углерода. Пример 8. Продуцирование этанола при использовании обогащенной среды с ксилозой чистыми нерекомбинантными штаммами Saccharomyces, способными к росту на ксилозе как на единственном источнике углерода, согласно тесту Т 8. Чистые изоляты дрожжей, выращенные на глюкозе, дрожжевом экстракте и бактериологическом пептонном агаре, как описано в тесте T1, высевали до оптической плотности при 600 нм между 1 и 2 единицами в 250 мл встряхиваемую колбу в 50 мл среды, которая содержала 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона (XYP) и анализировали, как описано в тесте Т 8.- 26010892 Таблица 5. Продуцирование этанола при использовании обогащенной ксилозой среды Полученные данные показывают, что стратегия селекции, основанная на выращивании дрожжей на ксилозе в качестве единственного источника углерода, приводит к получению штаммов дрожжей, которые являются способными производить этанол из ксилозы. Эти данные, объединенные с данными примера 3 (табл. 1), показывают, что способность к росту и выход клеточной биомассы при использовании ксилозы как единственного сахара в качестве источника углерода, повышается в согласии с увеличением способности к производству этанола из ксилозы. Кроме того, штаммы, такие как NM04/41258 и ISO7,которые могут утилизировать ксилит и ксилозу, способны производить этанол. Данные, показывающие,что штаммы NM04/41258 и ISO 7 (NM05/45178), которые могут утилизировать ксилит и производить этанол из ксилозы, противоречат данным патента США 4511656, в котором авторы утверждают, что штаммы должны быть подвергнуты скринингу для того, чтобы можно было выделить специфическую колонию или колонии, которые будут утилизировать D-ксилозу, но не ксилит. Пример 9. Выделение и характеристика чистых нерекомбинантных штаммов Saccharomyces, способных к продуцированию этанола при использовании ксилозы в качестве единственного источника углерода в анаэробных условиях Изоляты очищали из популяций, утилизирующих ксилозу, которые подвергались 1106 дней селекции и проверены согласно тесту Т 9. Пятьдесят индивидуальных изолятов было проверено, и продукция этанола, контролируемая после периода от трех недель до 4 месяцев, колебалась от 0,24 до 0,75 г/л. Штаммы NM04/41257 и NM04/41258 также включали в указанные исследования. Таблица 6. Продуцирование этанола чистыми штаммами дрожжей в минимальной среде с ксилозой в анаэробных условиях Полученные данные указывают на то, что нерекомбинантные штаммы дрожжей Saccharomyces, которые способны сбраживать ксилозу в анаэробных условиях с образованием этанола, возможно получить. Штаммы NM04/41257 и NM04/41258 очищали из ранее отобранных популяций относительно других штаммов в таблице. Эти данные показывают, что повторения протокола, описанного в тексте, приводят к увеличению эффективности продуцирования этанола нерекомбинантными штаммами в анаэробных условиях. Пример 10. Быстрое продуцирование этанола нерекомбинантными штаммами Saccharomyces, посеянными при высокой плотности в минимальную среду в аэробных условиях Штамм ISO 10, выращенный на глюкозе, дрожжевом экстракте, бактериологическом пептонном агаре (как описано выше), высевали в 50 мл 5% мас./об. ксилозы, 0,5% мас./об. дрожжевого экстракта и 1% мас./об. бактериологического пептона (XYP), содержащихся в 250 мл колбе Эрленмейера, и инкубировали в течение 72 ч при 30C и 220 об./мин Двадцать колб инкубировали одновременно. Клетки собирали центрифугированием при 3000g и 22C в течение 10 мин. Супернатант отбрасывали и клеточный осадок вновь суспендировали в 10 мл стерилизованной воды до повторного центрифугирования. Супер- 27010892 натант вновь отбрасывали и клетки вновь суспендировали в дистиллированной стерилизованной воде до последующего центрифугирования. И, наконец, клетки вновь суспендировали в 20 мл стерилизованной дистиллированной воды. Среда для сбраживания была приготовлена, стерилизована посредством фильтрации как следующая: YNB содержала 0,67% среды Difco Yeast Nitrogen Base без аминокислот; XYNB была YNB плюс 5% ксилозы; GXYNB была YNB плюс 0,5% глюкозы и 4,5% ксилозы. Среды содержались в 125 мл конических стеклянных флаконах. В среды высевали по 3 мл клеточной суспензии и помещали на планетарный шейкер при 220 об./мин и 30C, и продукцию этанола определяли при ежечасных интервалах, как описано ранее. Оптические плотности культур измеряли непосредственно после инокуляции при 600 нм, и было показано, что плотности клеточных культур составляли от 5,7 до 6,1108 в мл. Таблица 7. Продуцирование этанола инокулятом нерекомбинантных клеток Saccharomyces при высокой плотности культур Числа относятся к г этанола на л культурального супернатанта при указанном времени после инокуляции. Небольшое количество этанола, продуцированного клетками, инкубированными в YNB-среде без источника углерода, было произведено, вероятнее всего, в результате переноса запасов эндогенных сахаров, синтезированных и накопленных дрожжами в течение 72 ч приготовления инокулята. Снижение концентрации этанола в YNB-культурах после 3 ч указывает на то, что запасы сахаров истощались или исчерпывались, и этанол потреблялся клетками и/или этанол испарялся. Полученные данные показывают, что можно получать нерекомбинантные штаммы Saccharomyces,которые могут быстро сбраживать ксилозу с образованием этанола в минимальной среде, в которой ксилоза является единственным источником углерода. Кроме того, указанные штаммы могут производить этанол из ксилозы в среде, в которую сбраживаемый гексозный сахар, такой как глюкоза, также был добавлен, поскольку этанол, продуцируемый в среде GXYNB в течение 4 ч, оказался в избытке по сравнению с ожидаемым количеством этанола, продуцируемого в среде только с глюкозой. Пример 11. Нерекомбинантная биомасса Saccharomyces, выращенная на ксилозе в качестве единственного источника углерода, проявляет широкие возможности, применяемые в промышленности. Специалисты в данной области должны признать, что дрожжи имеют доказанную промышленную полезность в различных областях, где применяется сбраживание (например, производство хлеба и этанола (годного для питья и негодного для питья, и также в качестве источника аминокислот и белка, нуклеотидов (например, ДНК и РНК), ферментов (например, инвертазы и фитазы), антиоксидантов (например, глутатиона) и других клеточных компонентов, таких как компоненты клеточной стенки (например,глюканов). Вышеуказанные свойства представлены в качестве примера и не предназначены быть ограничивающими изобретение. Вышеописанные свойства указывают на то, что дрожжи являются пригодными, если они могут расти на среде, содержащей ксилозу, и затем могут быть использованы для различных промышленных целей. Поэтому в качестве примера штамм ISO10 был проверен относительно различных характеристик после выращивания на ксилозе. Штамм ISO10 выращивали в среде, содержащий на литр: 50 г ксилозы, 13,4 г среды Difco Yeast Nitrogen Base без аминокислот, содержащем 0,4 мг CuSO45H2O, 1 мг ZnSO47H2O, 2 мг MnSO44H2O, 1 мгNa2MoO42H2O, 1 мг Na2B4O710H2O, 2 мг Ca-пантотената, 2 мг тиамина HCl, 2 мг пиридоксина HCl, 4 мг инозитола, 1 мг никотиновой кислоты и 0,4 мг биотина. Клетки перемешивали при 1200 об./мин в токе воздуха при 12 л в мин и температуре 30C, и рН поддерживали при рН 5, используя 1M KOH и 1M фосфорную кислоту. Когда плотность клеток достигла при А 600 14, клетки собирали центрифугированием при 3000g и 22C в течение 10 мин. Клеточный осадок вновь суспендировали в дистиллированной воде и вновь центрифугировали. Процедуру промывания повторяли три раза, и биомассу помещали на фильтровальную бумагу Whatman no. 1 для того, чтобы содержание сухого остатка во влажной биомассе достигло от 22 до 25%. Биомассу анализировали относительно следующих характеристик с целью демонстрирования того,что нерекомбинантные штаммы Saccharomyces возможно вырастить на ксилозе в качестве единственного источника углерода, чтобы получить дрожжевую биомассу со свойствами, в целом, важными для промышленного применения.- 28010892 Производительность получения этанола сбраживанием Дрожжи высевали в основанную на мелассе среду, чтобы оценить производительность получения этанола сбраживанием, определенную как способность производить этанол из сбраживаемых сахаров,таких как сахароза, глюкоза и фруктоза. Мелассу сахарного тростника разбавляли в воде и стерилизовали нагреванием до 121C в течение 5 мин. После охлаждения до 22C мелассу центрифугировали при 4000g при 22C в течение 10 мин, чтобы удалить твердые частицы. Супернатант разбавляли до конечной концентрации 18% мас./мас. эквивалентов сахарозы и снабжали стерилизованной посредством фильтрации средой Difco Yeast Nitrogen Base при 0,67% мас./об. 40 мл данной среды засевали эквивалентом 6,8 мг сухой дрожжевой материи и инкубировали при 30C без перемешивания. Этанол анализировали при 24 ч интервалах с помощью анализатора YSI 2700 Select Biochemistry Analyzer, снабженногоYSI фильтром для регистрации этанола (YSI Inc. Yellow Springs, Ohio, USA). После 24 ч дрожжи продуцировали 16,8 г этанола на л, после 1 недели дрожжи продуцировали 59 г этанола на л. Разрыхление теста Для оценки разрыхляющего действия дрожжей, определенного как способность подвергать брожению сахара, такие как глюкоза, фруктоза и мальтоза, и тем самым образовывать двуокись углерода, с помощью которой тесто поднимается, дрожжи добавляли к тесту и проверяли их способность производить хлеб из теста на опаре. Приготовливали тесто, которое содержало 500 г смеси непросеянной муки из соевых бобов и кормовой муки их жмыха семян льна (Kitchen Collection, Christchurch), 300 мл водопроводной воды и 10 г дрожжей (при 24% сухих веществ). Тесто разрыхлялось и его выпекали с помощью духовки для выпечки хлеба Breville Bakers Oven при установке в положении 3 В (HWI Electrical,Sydney, Australia). Дрожжи поднимали (разрыхляли) тесто, чтобы при выпечке получился батон хлеба высотой 14 см. Содержание глюкана Количество дрожжевой биомассы, эквивалентное 59 мг сухого материала, экстрагировали для получения глюкана способом, описанным в публикации Sutherland I.W. and Wilkinson J.F. (1971) "ChemicalExtraction Methods of Microbial Cells", in Methods in Microbiology, Vol. 5B (Eds. J.R. Norris and D.W. Ribbons), Chapter IV, pp. 345-383, Academic Press London and New York. Согласно способу Sutherland et al.,данный метод позволяет получить "глюкан клеточной стенки, который свободен от загрязняющего материала". С помощью описанной процедуры было получено 8 мг глюкана из сухого дрожжевого исходного материала. Содержание аминокислот/белка Количество дрожжевого материала, эквивалентное 24,6 мг сухой дрожжевой материи, суспендировали в стеклянной пробирке в 2,5 мл 1M NaOH и помещали в баню с кипящей водой на 15 мин. Горячий образец охлаждали до 22C, и объем доводили до 10 мл, используя дистиллированную воду. Аминокислоты/белок анализировали методом Lowry О.H., Rosebrough N.J., Farr A.L. and Randall R.J. (1951) Journalof Biological Chemistry, 193: 265-275, используя в качестве стандарта бычий сывороточный альбумин. Результаты показали, что дрожжи содержали эквивалент 39% материала аминокислот/белка от веса сухой материи. Содержание нуклеотидов Количество дрожжевого материала, эквивалентное 8,3 мг сухих дрожжей, вновь суспендировали в 1 мл 4% мас./об. NaCl и подвергали обработке в автоклаве при 121C в течение 15 мин. После охлаждения до 22C суспензию дрожжей центрифугировали при 3000g в течение 10 мин при 22C, и супернатант анализировали на содержание нуклеотидов путем определения поглощения в УФ-области спектрофотометрическим методом, описанным в публикации Herbert D., Phipps P.J. and Strange R.E. (1971) "ChemicalAnalysis of Microbial Cells", in Methods in Microbiology, Vol. 5B (Eds. J.R. Norris and D.W. Ribbons), Chapter III, pp. 209-344, Academic Press London and New York. Дрожжи содержали 1,9% нуклеотидного материала от веса сухой материи. Содержание глутатиона Количество дрожжевого материала, эквивалентное 6,82 мг сухих дрожжей, вновь суспендировали в 0,8 мл смеси 80:20 этанол:дистиллированная вода, смешивали с помощью вихревой мешалки и центрифугировали при 10000g в течение 2 мин при 22C. Супернатант анализировали следующим образом: фосфатный буфер содержал 3,99 г Na2HPO4, 0,43 г NaH2PO4H2O, 0,59 г динатрия-EDTA2H2O в 250 мл при рН 7,5. Раствор NaDPH содержал 26,6 мг NaDPH тетранатриевую соль в 100 мл фосфатного буфера. Раствор 5,5"-дитио-бис(2-нитробензойной кислоты) (DTNB) приготовляли путем взвешивания 23,8 мгDTNB в 10 мл фосфатного буфера. Глутатионовый стандарт приготовляли в дистиллированной воде до исходной концентрации 0,1 мМ. Исходный раствор глутатионредуктазы из Fluka Chemie AG содержал 162,72 единиц активности на мл. Анализ выполняли в 3 мл спектрофотометрической кювете, которая содержала 1,4 мл раствораNaDPH + 200 мкл раствора DTNB + 10 мкл образца, стандартного раствора GSH или дистиллированной воды и 390 мкл дистиллированной воды. Образец предварительно нагревали до 30C, и реакцию начинали путем добавления трех микролитров глутатионредуктазы. Кюветы инкубировали при 30C в течение- 29010892 30 мин, затем поглощение считывали против контрольной пробы с дистиллированной водой при длине волны 412 нм, используя спектрофотометр Shimadzu UV-1201. Результаты анализа показали, что дрожжи содержали 0,36% общего глутатиона от веса сухой материи. Активность фитазы Количество дрожжевого материала, эквивалентное 13,5 мг сухих дрожжей, вновь суспендировали в 0,5 мл 0,2 М натрий-ацетатного буфера при рН 4,9. Субстрат фосфатазы из Sigma-Aldrich Chemie GmbH был приготовлен до концентрации 1 мг на мл в 0,2 М натрий-ацетатном буфере при рН 4,9, и раствор фермента фитазы из Sigma-Aldrich Chemie GmbH (активность которого, определенная поставщиком, составила 1,1 единицы активности фитазы на мг твердого материала) был приготовлен до 0,909 единиц на мл в 0,2 М натрий-ацетатном буфере при рН 4,9. Анализ выполняли в кювете, содержащей 500 мкл натрий-ацетатного буфера + 250 микролитров раствора фосфатазного субстрата и 250 мкл либо суспензии дрожжей, фермента фитазы, либо дистиллированной воды. Кюветы инкубировали в течение 20 мин при 30 С, по истечении указанного времени добавляли 300 мкл 10 М NaOH. Поглощение при 405 нм считывали против контрольной пробы с дистиллированной водой. Активность фитазы дрожжей составляла 0,068 единиц на мг сухой дрожжевой материи. Активность инвертазы Количество дрожжевого материала, эквивалентное 14,48 мг сухих дрожжей, вновь суспендировали в 1 мл дистиллированной воды. Затем суспензию разбавляли в сто раз дистиллированной водой. Активность инвертазы анализировали с помощью колориметрического метода, описанного в тесте Т 3 патентов США 4396632 и 5741695. Дрожжи продуцируют инвертазу с активностью 0,93 единицы, где единица активности определена как 1 мкмоль глюкозы, высвобожденный из сахарозы в минуту при 30C и рН 4,9 на мг сухих дрожжей. Полученные результаты указывают на способность нерекомбинантных штаммов Saccharomyces cerevisiae расти на ксилозе как на единственном источнике углерода, чтобы производить биомассу, метаболиты, клеточные компоненты и/или ферментативные активности, которые находят широкое применение в различных областях промышленности. Специалисты в данной области должны признать, что точные уровни или количества указанных характеристик можно регулировать не только посредством классических и рекомбинантных генетических методов, но также путем изменения условий культивирования, так что представленные выше результаты даны только в качестве примеров. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения штамма Saccharomyces, который способен расти при желательной скорости роста, используя ксилозу в качестве единственного источника углерода для роста, где способ включает стадии:(a) обеспечения популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces;(b) культивирования клеток дрожжей в условиях, допускающих комбинирование ДНК между дрожжевыми клетками;(c) проведения скрининга или селекции дрожжевых клеток в пользу клеток дрожжей, которые проявляют повышенную скорость роста, используя ксилозу в качестве единственного источника углерода для роста;(d) выделения одной или более клеток дрожжей, проявляющих желательную скорость роста. 2. Способ по п.1, где прошедшие скрининг клетки или отобранные клетки образуют популяцию генетически различных нерекомбинантных клеток дрожжей, и стадии (b) и (с) повторяют до тех пор, пока не будет достигнута желательная скорость роста. 3. Способ получения штамма Saccharomyces в культуре, который способен расти со скоростью роста, составляющей по крайней мере одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста, где способ включает стадии:(a) обеспечения популяции генетически различных нерекомбинантных клеток дрожжей Saccharomyces;(b) культивирования клеток дрожжей в условиях, допускающих комбинирование ДНК между дрожжевыми клетками;(c) проведения скрининга или селекции дрожжевых клеток путем инкубации клеток дрожжей на среде или в среде, содержащей ксилозу;(d) повторения стадий (b) и (с) с прошедшими скрининг клетками или отобранными клетками, образующими популяцию генетически различных нерекомбинантных клеток дрожжей Saccharomyces, до тех пор, пока одна или более дрожжевых клеток не приобретут способность расти со скоростью роста,составляющей по крайней мере одну генерацию за 48 ч, используя ксилозу в качестве единственного источника углерода для роста. 4. Способ по любому из пп.1-3, где дрожжевые клетки на стадии (с) подвергают отбору путем инкубации клеток дрожжей на среде, содержащей ксилозу.
МПК / Метки
МПК: C12N 1/18, C12P 7/06, C12N 15/04
Метки: штаммы, нерекомбинантные, saccharomyces, которые, растут, ксилозе
Код ссылки
<a href="https://eas.patents.su/30-10892-nerekombinantnye-shtammy-saccharomyces-kotorye-rastut-na-ksiloze.html" rel="bookmark" title="База патентов Евразийского Союза">Нерекомбинантные штаммы saccharomyces, которые растут на ксилозе</a>
Предыдущий патент: Производные бензимидазолонкарбоновой кислоты
Следующий патент: Новые производные бензоилмочевины
Случайный патент: Бициклическое конденсированное пиримидиновое соединение и его применение в качестве терапевтического агента