Поливалентныe штаммы бактериофага, способы их получения и использования и содержащее указанные штаммы лекарственное средство
Номер патента: 7472
Опубликовано: 27.10.2006
Авторы: Мульчик Мариан, Боратыньски Януш, Сыпер Данута, Гурски Анджей, Лусяк-Шелаховска Марзанна, Вебер-Дабровска Беата
Формула / Реферат
1. Способ получения поливалентного штамма бактериофага, отличающийся тем, что:
a) выделяют достаточное количество (n) бактериальных патогенных штаммов определенного вида, случайно появляющихся в данном регионе, причем указанные бактериальные штаммы, возможно, являются лекарственно-устойчивыми;
b) выделяют достаточное количество штаммов бактериофага, специфичных по меньшей мере для одного из бактериальных штаммов, указанных в а);
c) определяют литическую активность собранных штаммов бактериофага по отношению к каждому выделенному бактериальному штамму, вычисляют значение р, которое представляет собой отношение числа штаммов, лизированных данным фагом, к числу всех выделенных бактериальных штаммов;
d) для полученного значения р тестируют, удовлетворяет ли n условию:
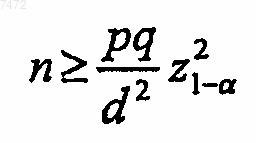
где q=1-p,
d представляет собой константу, не большую чем 0,1, оптимально не большую чем 10% р,
z1-a представляет собой случайную переменную с нормальным распределением, зависящую от доверительной вероятности 1-a, которая не меньше 0,95;
е) выбирают штамм бактериофага, который удовлетворяет критерию, раскрытому в d), и обладает значением р не меньшим чем 2/n, предпочтительно не меньшим чем 0,5.
2. Способ по п.1, где на стадии b) штаммы бактериофага выделяют из образца, происходящего из окружающей среды, посредством пропускания через мембранный фильтр с размером пор 0,2-0,4 мкм, к полученному фильтрату добавляют культуральную среду и смешивают с бульонной культурой бактериального штамма определенного вида, инкубируют примерно один час при температуре примерно 37шС, часть суспензии забирают и осуществляют посев на чашки с твердой культуральной средой, инкубируют от 2 до 24 ч примерно при 37шС, выделяют образец среды, окружающей отдельное "стерильное пятно", переносят в бульонную культуру бактериального штамма определенного вида и инкубируют до тех пор, пока культура не станет прозрачной, а штаммы бактериофага получают посредством пропускания лизата через мембранный фильтр с размером пор 0,2-0,4 мкм, при этом посев на твердую культуральную среду и повторное выделение "стерильных пятен" предпочтительно повторяют 5 раз.
3. Способ по п.1 или 2, где на стадии с) исследуемым бактериальным штаммом инокулируют соответствующую твердую среду, на которую переносят часть бактериофагов, полученных на стадии b), инкубируют примерно 4 ч при температуре примерно 37шС, затем оставляют при температуре примерно 4шС на период примерно от 2 до 24 ч, после чего литическую активность штамма бактериофага устанавливают на основании появления, по меньшей мере, отдельных "стерильных пятен".
4. Способ по п.1, где патогенные бактериальные штаммы представляют собой штаммы родов Staphylococcus или Pseudomonas.
5. Способ по п.4, где выбранный на стадии е) поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше, и представляет собой штамм бактериофагов S1 (PCM F/00001), S2 (PCM F/00002), S3 (РСМ F/00003), S4 (PCM F/00004), S5 (PCM F/00005), S6 (PCM F/00006) или S7 (PCM F/00007).
6. Способ по п.5, где указанный поливалентный штамм бактериофага обнаруживается у пациентов с муковисцидозом и представляет собой штамм S2 (PCM F/00002), S4 (PCM F/00004) или S7 (PCM F/00007).
7. Способ по п.4, где выбранный на стадии е) поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше, и представляет собой штамм бактериофага P1 (PCM F/00008), P2 (PCM F/00009), Р3 (PCM F/00010), P4 (РСМ F/00011), Р5 (РСМ F/00012), Р6 (РСМ F/00013), Р7 (РСМ F/00014), P8 (PCM F/00015), P9 (PCM F/00016), P10 (PCM F/00017), P11 (PCM F/00018), P12 (PCM F/00019), P13 (PCM F/00020), P14 (PCM F/00021), P15 (PCM F/00022), P16 (PCM F/00023), P17 (PCM F/00024), P18 (PCM F/00025), P19 (PCM F/00026) или Р20 (PCM F/00027).
8. Способ по п.7, где указанный поливалентный штамм бактериофага обнаруживается у пациентов с муковисцидозом и представляет собой штамм Р3 (PCM F/00010), P6 (PCM F/00013) или P11 (PCM F/00018).
9. Способ по п.2, включающий дополнительную очистку лизата, в частности от эндотоксина, причем смесь, содержащую бактериофаги, приводят в контакт с субстратом, содержащим целлюлозу или, по меньшей мере, ее частично этерифицированное производное, затем промывают раствором, удаляющим примеси, в частности эндотоксин, после чего элюируют очищенные бактериофаги.
10. Способ по п.9, где элюцию бактериофагов проводят водой, раствором недиссоциирующего вещества, буфером или солевым раствором в концентрации не более, чем 0,1М, в частности забуференным.
11. Способ по п.10, где концентрация солевого раствора, в частности забуференного, составляет от 0,05 до 0,1М.
12. Способ по п.9, где элюцию бактериофагов проводят при температуре от -25 до +100шС.
13. Способ по п.9, где элюцию бактериофагов проводят с солевым раствором, содержащим органический растворитель.
14. Способ по п.13, где органический растворитель выбран из группы, включающей диметилсульфоксид, диметилформамид, изопропанол и ацетон.
15. Способ по п.9, где в качестве субстрата используют целлюлозу, частично этерифицированную органической или неорганической кислотой.
16. Способ по п.15, где кислота представляет собой уксусную, азотную, серную или фосфорную кислоту.
17. Способ по п.15, где используют целлюлозу, в которой этерифицированы от 0,01 до 5% молекул глюкозы, в частности от 0,25 до 1% молекул глюкозы.
18. Лекарственное средство для лечения или профилактики инфекционных заболеваний, вызываемых патогенными бактериями, содержащее полученный способом по любому из пп.1-17 поливалентный штамм бактериофага.
19. Лекарственное средство по п.18, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше, и представляет собой штамм S1 (PCM F/00001), S2 (PCM F/00002), S3 (PCM F/00003), S4 (PCM F/00004), S5 (PCM F/00006), S6 (PCM F/00006) и S7 (РСМ F/00007).
20. Лекарственное средство по п.19, характеризующееся тем, что служит для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой S2 (PCM F/00002), S4 (PCM F/00004) или S7 (PCM F/00007).
21. Лекарственное средство по п.18, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше, и представляет собой штамм Р1 (РСМ F/00008), Р2 (РСМ F/00009), Р3 (РСМ F/00010), P4 (РСМ F/00011), Р5 (РСМ F/00012), Р6 (РСМ F/00013), P7 (РСМ F/00014), P8 (РСМ F/00015), Р9 (РСМ F/00016), P10 (РСМ F/00017), P11 (РСМ F/00018), P12 (РСМ F/00019), P13 (РСМ F/00020), P14 (РСМ F/00021), P15 (РСМ F/00022), P16 (РСМ F/00023), P17 (РСМ F/00024), P18 (РСМ F/00025), P19 (РСМ F/00026) и Р20 (РСМ F/00027), в частности фаги Р7, Р20 и Р6.
22. Лекарственное средство по п.21, характеризующееся тем, что служит для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой Р3 (РСМ F/00010), Р6 (РСМ F/00013) или P11 (PCM F/00018).
23. Применение поливалентного штамма бактериофага, полученного способом по любому из пп.1-17, для получения лекарственного средства для лечения или профилактики инфекционных заболеваний, вызванных патогенными бактериями.
24. Применение по п.23, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше, и представляет собой штамм S1 (PCM F/00001), S2 (РСМ F/00002), S3 (PCM F/00003), S4 (PCM F/00004), S5 (PCM F/00005), S6 (PCM F/00006) или S7 (PCM F/00007).
25. Применение по п.24, где лекарственное средство предназначхэю для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой S2 (PCM F/00002), S4 (PCM F/00004) или S7 (PCM F/00007).
26. Применение по п.23, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше, и представляет собой штамм P1 (PCM F/00008), P2 (PCM F/00009), Р3 (PCM F/00010), P4 (PCM F/00011), P5 (PCM F/00012), P6 (РСМ F/00013), P7 (РСМ F/00014), P8 (РСМ F/00015), P9 (РСМ F/00016), Р10 (РСМ F/00017), P11 (РСМ F/00018), P12 (РСМ F/00019), P13 (РСМ F/00020), P14 (РСМ F/00021), P15 (РСМ F/00022), P16 (РСМ F/00023), P17 (РСМ F/00024), P18 (РСМ F/00025), P19 (РСМ F/00026) и Р20 (РСМ F/00027), в частности фаги Р7, Р20 и Р6.
27. Применение по п.26, где лекарственное средство предназначено для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой Р3 (РСМ F/00010), Р6 (РСМ F/00013) или P11 (PCM F/00018).
28. Поливалентный штамм бактериофага S1 (PCM F/00001), S2 (РСМ F/00002), S3 (РСМ F/00003), S4 (РСМ F/00004), S5 (РСМ F/00005), S6 (РСМ F/00006) или S7 (РСМ F/00007), специфичный для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше.
29. Поливалентный штамм бактериофага P1 (PCM F/00008), P2 (РСМ F/00009), Р3 (РСМ F/00010), P4 (РСМ F/00011), P5 (РСМ F/00012), Р6 (РСМ F/00013), P7 (РСМ F/00014), P8 (РСМ F/00015), Р9 (РСМ F/00016), P10 (РСМ F/00017), P11 (PCM F/00018), P12 (РСМ F/00019), P13 (PCM F/00020), P14 (PCM F/00021), P15 (PCM F/00022), P16 (PCM F/00023), P17 (PCM F/00024), P18 (PCM F/00025), P19 (PCM F/00026) или Р20 (PCM F/00027), специфичный для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше.
Текст
007472 Область изобретения Настоящее изобретение относится к поливалентным штаммам бактериофагов, способам их получения и их применению для лечения бактериальных инфекций, в частности, вызываемых лекарственноустойчивыми штаммами бактерий. Предпосылки изобретения Бактериофаги (фаги) представляют собой группу разнообразных вирусов, жизненный цикл которых связан исключительно с бактериальными клетками. Бактериофаги характеризуются лизогенным или литическим жизненным циклом. В качестве противобактериальных средств особенно пригодны литические бактериофаги, которые после инфекции бактериальных клеток, чувствительных к ним, реплицируются в них, приводя к их полному уничтожению (посредством лизиса), и высвобождаются новые фаги, которые атакуют и разрушают следующие бактериальные клетки. Данный процесс может проходить и in vitro, иin vivo. Одну из важнейших характеристик бактериофагов представляет собой хорошо известная высокая специфичность их литической активности. Данное свойство используют, например, для определения видов (фаговое типирование) различных бактерий (см., например, описания патентов GB 2285684, US 5824468 и SU 543260, а также международные патентные заявки WO 0100786 и WO 0109370). Другие известные применения бактериофагов включают их пригодность в качестве инструментов в молекулярной биологии, например, для экспрессии и селекции конкретных белков (например, описание патента US 6027930) и для стерилизации и очистки сред (например, описания патентов EP 0414304, EP 0290295 и GB 2253859, а также международные патентные заявки WO 9808944 и WO 9003122). Модифицированные фаги применяют для получения вакцин (например, WO 9505454). Также применяют некоторые белки,происходящие из бактериофагов (например, EP 0510907, US 5470573, WO 9607329). Способы выделения бактериофагов и получения фаговых препаратов хорошо известны и постоянно совершенствуются (например, GB 829266, CS 192212, RU 2109055). Лечение фагами в большом масштабе применяли со Второй Мировой войны в институте микробиологии и вирусологии в Тбилиси, Грузия. Для лечения бактериальных инфекций и для профилактики там применяют банк различных фаговых препаратов. Доступные данные указывают на высокую эффективность лечения фагами. Подобные исследования проводили в Польше в течение более чем 25 лет. В лаборатории бактериофагов института иммунологии и экспериментальной терапии польской академии наук во Вроцлаве лечение фагами применяют для лечения инфекционных заболеваний, вызываемых лекарственно-устойчивыми формами бактерий и не чувствительными к антибиотикам бактериями (см. Stefan lopek et al., Archivum Immunologiae et TherapiaeExperimentalis, 2000, 48, 31-37; Beata Weber-Dabrowska et al., Archivum Immunologiae et Therapiae Experimentalis, 2000, 48, 547-551). Проводимое там в течение 14 последних лет лечение фагами, которое включило 1473 пациента с гнойными инфекциями различных тканей и органов, указывает на высокую эффективность лечения фагами. Полное устранение симптомов заболевания и возвращение к здоровому состоянию отмечено в 1289 случаях. Необходимо подчеркнуть, что, по меньшей мере, в дюжине или около того случаев лечение фагами представляло единственную возможность для уничтожения угрожающей жизни инфекции. Проводимое лечение касалось индивидуальных пациентов. Оно состояло из:b) определения чувствительности штамма к конкретным фагам и отбор фагов, показавших наивысшую литическую активность по отношению к штамму;c) получение фаговых лизатов с большим количеством фаговых частиц;d) получение стерильного фагового препарата для лечения. Данная процедура является довольно дорогостоящей, трудоемкой и требующей времени. Иногда с момента получения материала для исследования до наличия готового, стерилизованного фагового препарата для лечения проходит 7-10 дней. Такая задержка является слишком большой при некоторых состояниях заболевания. Лечение фагами в широком масштабе невозможно провести посредством применяемых до настоящего времени способов. Инфекции, сопутствующие муковисцидозу, представляют собой особую проблему. Данное заболевание представляет собой наследственное, системное заболевание, состоящее из дисфункции секретирующих слизь желез, что предрасполагает пациента к хроническим бронхиальным и легочным заболеваниям. Секретируемая слизь является густой и вязкой, что затрудняет ее удаление естественными способами (кашель). Накопление и задержка слизи в бронхах и ухудшение ее очистки создают благоприятные условия для бактериальных инфекций, приводя к хроническим бронхитам и пневмонии. Наиболее угрожающие, вызывающие инфекционные заболевания патогенные микро-1 007472 организмы, сопутствующие муковисцидозу, представляют собой Staphylococcus aureus и бациллы родаPseudomonas. Периодически повторяющиеся инфицирования данными микроорганизмами ведут к серьезным патологическим изменениям в дыхательной системе и преждевременной смерти. Немногие пациенты живут более 25 лет. Лечение таких инфекций доступными антибиотиками порождало во всем мире серьезную терапевтическую проблему, особенно в последние несколько лет. Лечение данных инфекций антибиотиками становилось все менее и менее эффективным, так как абсолютное большинство бактериальных штаммов демонстрирует устойчивость ко всем антибиотикам, включая антибиотик крайнего случая, представляющий собой ванкомицин. Поэтому существует неотложная необходимость ввести в медицинскую практику альтернативный терапевтический способ для лечения устойчивых и высокоопасных бактериальных инфекций. Цель изобретения В последние годы наблюдается сильное распространение бактериальных штаммов, устойчивых ко всем антибиотикам, включая ванкомицин, представляющий собой антибиотик крайнего случая. В результате, лечение антибиотиками бактериальных инфекций, вызываемых данными лекарственноустойчивыми формами, является неэффективным. Данная ситуация создала поразительные терапевтические проблемы. Таким образом, существует неотложная необходимость ввести в медицинскую практику альтернативные терапевтические способы для лечения устойчивых бактериальных инфекций. Принимая во внимание указанную выше цель, данное изобретение представляет собой осуществление способа получения поливалентных фаговых штаммов, которые можно применять для получения препаратов с гарантированной эффективностью лечения бактериальных инфекций без необходимости выбора индивидуального фага для каждого случая. В данной конкретной реализации цель изобретения представляет собой предоставление пути, который позволяет получить фаговые препараты высокой степени чистоты, в частности, свободные от эндотоксина. Конкретная цель изобретения представляет собой получение поливалентных фаговых препаратов,которые можно эффективно применять для лечения бактериальных инфекций, связанных с муковисцидозом, без необходимости индивидуального выбора фага для каждого случая. Сущность изобретения В настоящем изобретении представлен способ получения поливалентного штамма бактериофага, в котором: а) выделяют достаточное количество (n) различных штаммов бактериальных патогенных микроорганизмов определенного вида, случайно появляющихся в данном регионе, где указанные бактериальные штаммы, возможно, являются лекарственно-устойчивыми;b) выделяют достаточное количество различных штаммов бактериофага, специфичных по меньшей мере для одного из бактериальных штаммов, указанных в а);c) определяют литическую активность собранных штаммов бактериофага на каждом выделенном бактериальном штамме, затем подсчитывают значение р, которое представляет собой отношение числа штаммов, лизированных данным фагом, к числу всех выделенных бактериальных штаммов;d) для полученного значения р, тестируют, удовлетворяет ли n условию: где q=1-p,d представляет собой константу, не большую, чем 0,1, оптимально - не большую чем 10% р,z1- представляет собой случайную переменную с нормальным распределением, зависящую от доверительной вероятности 1-, которая не меньше 0,95; е) выбирают штамм бактериофага, который удовлетворяет критерию, определенному в d), и обладает значением р не меньшим, чем 2/n, предпочтительно не меньшим, чем 0,5. Диапазон литической активности каждого выделенного бактериофага определяют по отношению к генеральной совокупности патогенных бактериальных штаммов, представленных в данном регионе. С этой целью необходимо собрать достаточно большую коллекцию случайным образом выбранных лекарственно-устойчивых бактериальных штаммов. В отношении определенной большой выборки бактерий из генеральной совокупности размером n штаммов (в описанном примере n составляло 845 и 880, соответственно, для лекарственно-устойчивых штаммов Pseudomonas и Staphylococcus, выделенных в Польше) вычисляют частоту успеха или отношение числа штаммов, лизированных данным фагом, к общему числу изучаемых штаммов. Данную частоту рассматривают как вероятность успеха р. Тогда вероятность неуспеха представляет собой q=l-p. Существенно выбрать размер n, которым должна обладать выборка, так, чтобы ее можно было рассматривать как репрезентативную для генеральной совокупности штаммов данного рода (например,Pseudomonas или Staphylococcus). С этой целью устанавливают следующий критерий того, что выборка является репрезентативной: Р(v-pd)=P(-dv-pd)=1-2 007472 Вероятность того, что абсолютное значение разницы между частотой выборки v и вероятностью успеха р является меньшей, чем предварительно заданное значение d, представляет собой 1-, которая соответствует уровню достоверности 1-. Значение 1- обычно устанавливают 0,95 или 0,98. Число образцов n должно удовлетворять условию где z1- представляет собой случайную переменную с нормальным распределением. Для 1-=0,95Z1-=l,96, а для 1-=0,98 Основываясь на данном критерии и значении частоты р, полученной для охарактеризованного фага,посредством задания приемлемых значений d и доверительного интервала 1- можно проверить величину n, используемую для определения диапазона литической активности данного фага и удостовериться в том, можно ли рассматривать литическую активность, полученную для данного n, с назначенными значениями d и 1-, как корректную по отношению к генеральной совокупности бактериальных штаммов данного рода. Штамм бактериофагов предпочтительно выделяют на стадии b) из образца, происходящего из окружающей среды, посредством пропускания через мембранный фильтр с размером пор 0,2-0,4 мкм, добавления культуральной среды к фильтрату и смешивания его с бульонной культурой бактерий определенного рода, инкубирования смеси примерно один час при температуре примерно 37 С, забора части суспензии и осуществления посева на чашки с твердой культуральной средой, инкубирования от 2 до 24 ч примерно при 37 С, выделения образца среды, окружающей отдельное "стерильное пятно", перенесения его в бульонную культуру бактерии определенного рода и инкубирования до тех пор, пока культура не станет прозрачной, и получения препарата бактериофагов посредством пропускания лизата через мембранный фильтр с размером пор 0,2-0,4 мкм, при этом посев на твердую культуральную среду и повторное выделение "стерильных пятен" предпочтительно повторить 5 раз. Бактериальные штаммы на стадии с) предпочтительно инокулируют на твердую культуральную среду, на которой размещают часть препарата бактериофагов, полученного на стадии b), инкубируют примерно 4 ч примерно при 37 С, после чего примерно от 2 до 24 ч температуру поддерживают примерно 4 С, после чего литическую активность штамма бактериофагов доказывают появлением, по меньшей мере, отдельных "стерильных пятен". Далее возможно выполнить дополнительную очистку лизата, в частности в отношении эндотоксина, в соответствии с чем смесь, содержащую бактериофаги, приводят в контакт с субстратом, содержащим целлюлозу или ее частично этерифицированные производные, далее промывают раствором, который удаляет примеси, в частности эндотоксин, после чего очищенные бактериофаги смывают. Эндотоксин можно эффективно элюировать водой, раствором недиссоциирующего вещества или солевым раствором в концентрации не более чем 0,1 М, возможно забуференным. Фракцию бактериофагов можно также эффективно элюировать раствором недиссоциирующего вещества, или любого буфера, или солевым раствором в концентрации более чем 0,05 М, возможно забуференным. Также элюцию эндотоксина и бактериофагов проводят при температурах от -25 до +100 С. Элюцию эндотоксина и бактериофагов предпочтительно проводить с применением водного солевого раствора, содержащего органический растворитель. Органический растворитель лучше всего выбирать из группы, включающей диметилсульфоксид, диметилформамид, изопропанол и ацетон, а в качестве субстрата можно применять целлюлозу, частично этерифицированную органической или неорганической кислотой. Можно применять субстрат из целлюлозы, частично этерифицированной уксусной, азотной, серной или фосфорной кислотами, в частности, в качестве субстрата можно применять целлюлозу, у которой этерифицированы от 0,01 до 5% молекул глюкозы, предпочтительно от 0,25 до 1%, более предпочтительно от 0,5 до 1% молекул глюкозы. Предпочтительные патогенные бактериальные штаммы представляют собой штаммы родов Staphylococcus или Psevdomonas. В дополнительном аспекте изобретения представлено лекарственное средство для лечения или профилактики инфекционных заболеваний, вызванных бактериальными патогенными микроорганизмами, которое содержит активный компонент и, возможно, фармацевтически допустимый носитель, так что активный компонент включает поливалентный штамм бактериофагов, специфичный для бактерий рода и полученный с применением способа по данному изобретению. Лекарственное средство по данному изобретению может отличаться тем, что в качестве поливалентного штамма бактериофагов, специфичного для бактерий рода Staphylococcus, оно содержит по меньшей мере один штамм бактериофагов, выбранный из числа S1 (PCM F/00001), S2 (PCM F/00002), S3(РСМ F/00003), S4 (PCM F/00004), S5 (PCM F/00005), S6 (PCM F/00006) и S7 (PCM F/00007), предпочтительно фаги S1, S2 и S4 или S5. Данное лекарственное средство, полученное по одному из аспектов данного изобретения, предназначено для лечения или профилактики инфекционных заболеваний, возникающих у субъектов, страдающих от муковисцидоза, и в качестве поливалентного штамма бактериофа-3 007472 гов, специфичного к бактериям рода Staphylococcus, оно содержит по меньшей мере один штамм бактериофагов, выбранный из числа F/00002, F/00004 и F/00007. Лекарственное средство по данному изобретению может отличаться тем, что в качестве поливалентного штамма бактериофагов, специфичного для бактерий рода Pseudomonas, оно содержит по меньшей мере один штамм бактериофагов, выбранный из числа P1 (PCM F/00008), P2 (PCM F/00009), Р 3F/00025), P19 (PCM F/00026) и Р 20 (PCM F/00027), оптимально - фаги Р 7, P20 и Р 6. Лекарственное средство, полученное по одному из аспектов данного изобретения, предназначено для лечения или профилактики инфекционных заболеваний, возникающих у субъектов, страдающих от муковисцидоза, и в качестве поливалентного штамма бактериофагов, специфичного к бактериям рода Pseudomonas, оно содержит по меньшей мере один штамм бактериофагов, выбранный из числа F/00010, F/00013 и F/00018. Поливалентный штамм бактериофагов, полученный по способу данного изобретения, для разработки лекарственного средства для лечения или профилактики бактериальных инфекций, вызываемых бактериальными патогенными микроорганизмами, представляет собой дополнительный объект данного изобретения. Для получения лекарственного средства для лечения или профилактики инфекционных заболеваний, вызываемых бактериями рода Staphylococcus, преимущественным является применение, по меньшей мере, одного штамма бактериофагов, выбираемого из числа S1 (PCM F/00001), S2 (PCM F/00002), S3- фаги S1, S2 и S4 или S5. Для создания лекарственного средства для лечения или профилактики инфекционных заболеваний, вызываемых бактериями рода Staphylococcus у субъектов, страдающих от муковисцидоза, преимущественным является применение по меньшей мере одного штамма бактериофагов,выбираемого из числа F/00002, F/00004 и F/00007. Также для создания лекарственного средства для лечения или профилактики инфекционных заболеваний, вызываемых бактериями рода Pseudomonas, преимущественным является применение по меньшей мере одного штамма бактериофагов, выбираемого из числа P1 (PCM F/00008), P2 (PCM F/00009) , Р 3F/00025), P19 (PCM F/00026) и Р 20 (PCM F/00027), оптимально - фаги Р 7, P20 и Р 6. Для создания лекарственного средства для лечения или профилактики инфекционных заболеваний, вызываемых бактериями рода Pseudomonas у субъектов, страдающих от муковисцидоза, преимущественным является применение, по меньшей мере, одного штамма бактериофагов, выбираемого из числа F/00010, F/00013 и F/00018. Поливалентный штамм бактериофагов, специфичный для бактерий рода Staphylococcus, выбираемый из числа S1 (PCM F/00001), S2 (PCM F/00002), S3 (PCM F/00003), S4 (PCM F/00004), S5 (РСМF/00005), S6 (PCM F/00006) и S7 (PCM F/00007), оптимально - из числа S1, S2, S4 и S5, представляет собой дополнительный объект данного изобретения. Поливалентный штамм бактериофагов, специфичный для бактерий рода Pseudomonas, выбираемый из числа P1 (PCM F/00008), P2 (РСМ F/00009), Р 3 (РСМ F/00010), Р 4 (РСМ F/00011), Р 5 (РСМ F/00012),Р 6 (РСМ F/00013), P7 (РСМ F/00014), P8 (РСМ F/00015), P9 (РСМ F/00016), P10 (РСМ F/00017), P11(РСМ F/00023), P17 (РСМ F/00024), P18 (РСМ F/00025), Р 19 (РСМ F/00026) и Р 20 (РСМ F/00027), оптимально - из числа Р 7, Р 20 и Р 6, также представляет собой объект данного изобретения. В исследовании применяли принадлежащую авторам настоящего изобретения собственную коллекцию фагов, активных против видов бактерий, которые представляют собой наиболее частые этиологические факторы при бактериальных инфекциях у людей. Описанные практические примеры относятся к поливалентным бактериофагам, литически действующим на штаммы стафилококков (Staphylococcusaureus), включая их штаммы, устойчивые к метициллину, и синегнойную палочку (Pseudomonas aeruginosa), которые, в частности, обнаруживают у субъектов, пораженных муковисцидозом. Данные виды в настоящее время представляют собой причину серьезных инфекционных заболеваний, служащих причиной высокой смертности. Достоинства настоящего изобретения Введение в терапию препаратов поливалентных фагов, содержащих поливалентные фаги, полученные посредством данного изобретения, представляет собой главную разработку в борьбе с бактериальными инфекциями, которые не чувствительны к лечению антибиотиками. Также с данной новой технологией связаны определенные экономические преимущества. Она позволяет значительно уменьшить материальные издержки и сокращает время от отбора материала для проверки до получения терапевтического фагового препарата. Благодаря этому фаговый препарат будет ждать пациента, а не пациент - получения индивидуального фагового препарата.-4 007472 Широкий диапазон препаратов литических фагов, состоящих из нескольких поливалентных фагов, полученных посредством способа по настоящему изобретению, представляет собой очень важное преимущество с точки зрения их применения для лечения бактериальных инфекций. Хорошо известно, что в популяции бактерий с частотой примерно 1x10-7 могут появляться формы, устойчивые к бактериофагу. В присутствии двух фагов частота такой мутации составляет примерно 1x10-14, а трех фагов - только 1 х 10-21. В такой обстановке проблемы бактериального штамма, устойчивого к фагам, практически не существует. Большая применимость приведенных в примерах лекарственных средств, состоящих из поливалентных фагов, заслуживает особого упоминания. Их, как правило, можно применять в медицинской практике, и они предоставляют эффективные средства для борьбы с грозными бактериальными инфекциями. Также возможно применять фаги, полученные по данному изобретению, в препаратах лекарственных средств для внешнего применения, применяя их, например, для лечения и профилактики дерматологических инфекционных заболеваний. Обнаружено, что пероральное введение фаговых лизатов, полученных по данному изобретению, увеличивает устойчивость к возможным будущим бактериальным инфекциям. В некоторых случаях лечение фагами можно применять в сочетании с лечением антибиотиками. Препараты поливалентных фагов, применяемые для лечения бактериальных инфекций, показали высокую эффективность. Особую эффективность наблюдали при лечении сепсиса (показатель эффективности лечения - 88%) и при лечении инфекционных заболеваний у пациентов с муковисцидозом. Краткое описание чертежей На фиг. 1 представлены результаты анализа статистики, полученные для фагов S1-S7. На фиг. 2 представлены результаты анализа статистики, полученные для фагов Р 1-Р 20. На фиг. 3 представлены результаты статистического анализа эффективности выбранных фаговых штаммов в отношении бактериальных штаммов, принадлежащих роду Staphylococcus, выделенных у пациентов с муковисцидозом. На фиг. 4 представлены результаты статистического анализа эффективности выбранных фаговых штаммов в отношении бактериальных штаммов, принадлежащих роду Pseudomonas, выделенных у пациентов с муковисцидозом. Для лучшего понимания сущности данного изобретения его иллюстрируют ниже посредством примеров. Пример 1. Выделение бактериофагов. Бактериофаги для Staphylococcus и Pseudomonas выделяли из городских сточных вод. Сточные воды пропускали через мембранный фильтр с размером пор 0,2-0,4 мкм, который задерживает бактерии, но позволяет пройти бактериофагам. К полученному фильтрату добавляли концентрированную жидкую культуральную среду, и различные разведения фильтрата смешивали с молодой бульонной культурой бактерий (Staphylococcus aureus или Pseudomonas aeruginosa). Образцы инкубировали 1 ч при 37 С, после чего пипеткой извлекали по 0,2 мл суспензии из каждого образца и осуществляли посев на чашки, содержащие среду с агаром, с применением стеклянного шпателя, и инкубировали чашки в течение ночи при 37 С. В случае, если искомый фаг присутствовал на чашках, инокулированных соответствующим разведением фильтрата, содержащим молодую бактериальную культуру, наблюдали непрерывный (мутный) бактериальный газон и отдельные прозрачные маленькие поля, так называемые "стерильные пятна",которые обычно содержат несколько миллионов фаговых частиц. Отдельные "стерильные пятна" вместе с окружающим их агаром вырезали с помощью платиновой петли, затем переносили в свежую бульонную культуру бактерий и инкубировали до тех пор, пока культура не становилась прозрачной. После пропускания лизата через мембранный фильтр с размером пор 0,2-0,4 мкм, который удерживает любые бактерии, оставшиеся в лизате, фильтрат содержал только бактериофаги. Посев других разведений полученных фагов с соответствующими бактериями на среду с агаром и повторное выделение стерильных пятен проводили 5 раз, что позволяло получить чистую линию фагов. Пример 2. Определение чувствительности штаммов Staphylococcus aureus к бактериофаговым микроорганизмам, специфичным для них. Чувствительность определяли с применением культуральной среды, описанной у Whal. Чашки с данной средой сушили 30 мин при температуре 37 С, покрывали молодой 4-х часовой бульонной культурой Staphylococcus aureus, которую перемешивали посредством встряхивания, избыток суспензии удаляли пипеткой и снова сушили 30 мин при температуре 37 С. На одной чашке, разделенной на 6 сегментов, определяли чувствительность изучаемого штамма к 6 различным, но специфическим бактериофагам. Одну каплю разведения бактериофагов 1/10 наносили на поверхность каждого сегмента. Чашки инкубировали в термостате примерно 4 ч при 37C, после чего их помещали в холодильник до следующих суток. В случае высокой чувствительности штамма к определенному фагу на месте внесения фага на культуральную среду, которая была равномерно покрыта бактериальным газоном, видны прозрачные поля,являющиеся результатом полного разрушения бактериальных клеток (лизиса). Меньшая чувствительность штамма проявлялась появлением отдельных "стерильных пятен".-5 007472 Пример 3. Определение чувствительности штаммов Pseudomonas к бактериофаговым микроорганизмам, специфичным для них. Способ определения чувствительности являлся сходным со способом, описанным в примере 2. Однако в данном случае исходная среда представляла собой агар с добавлением фосфатного буфера, а время инкубации чашек с нанесенным фагом составляло 5 ч. Пример 4. Отбор фагов с широчайшим спектром активности в отношении штаммов Staphylococcus и Pseudomonas - получение поливалентных фаговых штаммов. Бактериофаги выделяли по способу, описанному в примере 1. Определяли чувствительность к фагам из коллекции бактериофагов, специфичных к Staphylococcus, 845 лекарственно-устойчивых клинических штаммов различных видов Staphylococcus, выделенных по всей Польше, и чувствительность к фагам из коллекции бактериофагов, специфичных к Pseudomonas, 880 лекарственно-устойчивых клинических штаммов различных видов Pseudomonas. Анализ чувствительности в обеих группах штаммов к соответствующим фагам позволил выбрать фаги с неожиданно высокой активностью и широким спектром литического действия. Данные фаги представлены в табл. 1 и 2. Таблица 1. Фаги с высокой литической активностью для Staphylococcus в депозитарии польской коллекции микроорганизмов (PCM), Вроцлав, Польша Таблица 2. Фаги с высокой литической активностью для Pseudomonas в депозитарии польской коллекции микроорганизмов (PCM), Вроцлав, Польша-6 007472 Результаты для фагов S1-S7 и Р 1-Р 20 подвергали статистическому анализу для определения того,можно ли рассматривать полученные для конкретных фагов значения р как корректные для общих популяций соответствующих родов бактерий. Результаты представлены на фиг. 1 и 2. Подсчитанные значенияn для большинства бактериофагов оказались меньше, чем число бактериальных штаммов в исследуемой выборке, что означает, что диапазон литического спектра корректен, по меньшей мере, по отношению к клиническим штаммам, обнаруживаемым в Польше. Принимая во внимание данные результаты, фаги, перечисленные в табл. 1 и 2, можно рассматривать как поливалентные фаги по данному изобретению. В случае фагов для Staphylococcus 3 из 1 наиболее активных, т.е. S1, S2 и S4 или S5, неожиданно обнаружили литическую активность в отношении 95% изучаемых штаммов Staphylococcus. Также 3 из 21 выбранных для Pseudomonas фагов, т.е. Р 7, Р 20 и Р 6, обнаружили литическую активность в отношении 87% изучаемых штаммов Pseudomonas. Пациентов, страдающих муковисцидозом, также можно рассматривать как "данный регион возникновения бактериальной инфекции", как определено в сущности изобретения. При изучении патогенных микроорганизмов, появляющихся у данной группы пациентов, использовали 137 бактериальных штаммов, из которых 84 идентифицировали как Pseudomonas и 53 - как S. aureus. Все штаммы выделяли из материала, полученного от пациентов с муковисцидозом со всей Польши. Анализ чувствительности штаммов Pseudomonas и S. aureus к фагам позволил выбрать фаги с наивысшей литической активностью и широчайшим диапазоном действия. В случае фагов для Pseudomonas 3 из 21 активных фагов, т.е. F/00010, F/00013 и F/00018, неожиданно показали литическую активность в отношении 75% штаммов Pseudomonas (для вероятности успеха см. фиг. 3, на которой фаг 3 = F/00010, фаг 6 = F/00013 и фаг 11 = F/00018). Среди выбранных для Staphylococcus фагов 3, т.е. F/00002, F/00004 и F/00007, показали литическую активность в отношении 98% штаммов Staphylococcus (для вероятности успеха см. фиг. 4, на которой фаг 1 = F/00002, фаг 3 = F/00004 и фаг 4 = F/00007). Пример 5. Репликация фагов Staphylococcus и фагов грамотрицательных бацилл, получение фаговых лизатов. Примерно 5% фагового лизата добавляли в молодые 4-часовые культуры Staphylococcus aureus (логарифмическая фаза) в бульонной культуре, дополненной глюкозой. Тестовые пробирки или колбы перемешивали посредством встряхивания и 3 ч инкубировали при 37 С. После возникновения прозрачной культуры (лизис) образцы выдерживали на холоде до следующих суток. Лизат пропускали через мембранный фильтр с размером пор 0,2-0,4 мкм для удаления любых оставшихся нелизированных бактериальных клеток. Концентрацию живых фаговых частиц определяли двухслойным способом Gratia. Контролем служила инкубируемая культура без добавления фагового лизата. Репликация фагов грамотрицательных бацилл (Pseudomonas) Для репликации фагов Pseudomonas использовали пептонную воду. 5% фагового лизата добавляли в молодые 4-часовые культуры Pseudomonas aeruginosa, тестовые пробирки или колбы перемешивали посредством встряхивания и образцы 5 ч инкубировали при 37 С. После возникновения прозрачной культуры образцы оставляли в холодильнике до следующих суток, после чего их пропускали через мембранный фильтр с размером пор, как указано выше. Концентрацию живых фаговых частиц в лизате определяли способом Gratia. Стерильные бульонные фаговые лизаты демонстрируют продолжительную литическую активность. Когда их содержат в холоде, они сохраняют свою жизнеспособность несколько лет, в некоторых случаях свыше 10 лет. Пример 6. Получение и применение препаратов поливалентных фагов. Стерильный бульонный лизат, полученный способом, описанным в примере 5, создаваемый выбранными в примере 4 фагами, с широким спектром литической активности, или их концентрированными или дополнительно очищенными формами (см. следующий пример), использовали для получения лекарственных средств на основе поливалентных фагов. Иллюстрируемый препарат поливалентного фага Staphylococcus представляет собой смесь, содержащую различные количества лизатов фагов S1, S2 и S4 или S5 или производные данных лизатов. Для инфекционных заболеваний, вызываемых Staphylococcus, для пациентов с муковисцидозом, следует применять препараты из фагов F/00002, F/00004 и F/00007. Иллюстрируемый препарат поливалентного фага Pseudomonas представляет собой смесь, содержащую различные количества лизатов фагов Р 7, Р 20 и Р 6 или производные данных лизатов. Для инфекционных заболеваний, вызываемых Pseudomonas, для пациентов с муковисцидозом, следует применять препараты из фагов F/00010, F/00013 и F/00018. Лекарственное средство вводят перорально 3 раза в сутки, в количествах, соответствующих 10 мл лизата, за 30 мин до еды, после предварительной нейтрализации жидкости желудка (например, посредством геля фосфата алюминия, очищенной соды или воды "Виши"). Когда препарат наносят непосредственно на раны, это следует делать 3 раза в течение 24 ч. При локальном применении раны не следует очищать дезинфицирующим средством, так как это может привести к инактивации фагов. Если необхо-7 007472 димо, раны можно очистить стерильной культуральной средой или физиологическим раствором 0,9%NaCl. В некоторых случаях лечение фагами можно применять в сочетании с лечением антибиотиками. Препараты поливалентных фагов, применяемые для лечения бактериальных инфекций, демонстрируют высокую эффективность. Особую эффективность наблюдали при лечении сепсиса (показатель эффективности лечения - 88%) и инфекционных заболеваний, возникающих у пациентов с муковисцидозом. Пример 7. Дополнительная очистка препаратов бактериофагов, удаление эндотоксина из содержащих бактериофаги смесей. Для отдельных применений в медицине или также из-за способов введения (например, внутривенной) требуются препараты бактериофагов высокой чистоты, в особенности те, которые лишены бактериального эндотоксина. Следуя способу по данному изобретению, использовали аффинность бактериофагов к субстрату, содержащему целлюлозу или, оптимально, ее этерифицированное производное. В данном примере применяли коммерчески доступное сульфатированное производное целлюлозы, которое характеризуется низким уровнем этерификации (8 мкмоль/мл геля). Субстрат применяли для удаления эндотоксина из содержащей бактериофаги смеси. После промывки субстрата и удаления эндотоксина следующая стадия очистки представляет собой элюцию адсорбированных бактериофагов. Один мл субстрата, содержащего сульфатированное производное целлюлозы, помещали в стерильную колонку хроматографа. Утечку субстрата из колонки предотвращали затыканием нижней части колонки стекловатой, пропитанной 70% этанолом. Готовили следующие буферы для элюции: Буфер I: 0,01 М фосфатный буфер, рН 7,6; Буфер II: 0,01 М фосфатный буфер, рН 7,6, содержащий 1 М хлорид натрия. Соли, входящие в состав элюента, прокаливали 1 час при 145 С. Растворы готовили с использованием дистиллированной апирогенной воды. Перед хроматографией 1 мл субстрата, набитый в хроматографическую колонку, промывали 5 мл буфера I и 5 мл буфера II. Колонку подготавливали для фактической хроматографии промыванием 10 мл буфера I. Удаление эндотоксина проводили, используя высокомолекулярную фракцию, полученную в процедуре молекулярного сита на сефарозе 4 В с применением концентрированного лизата бактериофагов PsPCM F/00018. 0,2 мл смеси бактериофагов переносили на хроматографическую колонку, содержащую 1 мл субстрата, включающего сульфатированное производное целлюлозы. Собирали фракцию объемом 0,2 мл. Первую фракцию элюировали 3 мл буфера I. В этих условиях неассоциированный токсин вытекал из колонки. Вторую фракцию элюировали буфером II. Фракция II содержала очищенные бактериофаги. Данные о единицах эндотоксина во фракциях: Материал, подвергшийся хроматографии на субстрате, содержащем сульфатированное производное целлюлозы, содержал 2500 единиц эндотоксина/мл. Фракция, элюируемая буфером I, содержала 6001000 единиц эндотоксина/мл, а та, которую элюировали буфером II, содержала бактериофаги, лишенные эндотоксина (примерно 1 единица/мл). Содержание эндотоксина в препаратах бактериофагов определяли с применением гелевого способа компании Charles River Endosafe, Charleston, USA. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения поливалентного штамма бактериофага, отличающийся тем, что:a) выделяют достаточное количество (n) бактериальных патогенных штаммов определенного вида,случайно появляющихся в данном регионе, причем указанные бактериальные штаммы, возможно, являются лекарственно-устойчивыми;b) выделяют достаточное количество штаммов бактериофага, специфичных по меньшей мере для одного из бактериальных штаммов, указанных в а);c) определяют литическую активность собранных штаммов бактериофага по отношению к каждому выделенному бактериальному штамму, вычисляют значение р, которое представляет собой отношение числа штаммов, лизированных данным фагом, к числу всех выделенных бактериальных штаммов;d) для полученного значения р тестируют, удовлетворяет ли n условию: где q=1-p,d представляет собой константу, не большую чем 0,1, оптимально не большую чем 10% р,z1- представляет собой случайную переменную с нормальным распределением, зависящую от доверительной вероятности 1-, которая не меньше 0,95;-8 007472 е) выбирают штамм бактериофага, который удовлетворяет критерию, раскрытому в d), и обладает значением р не меньшим чем 2/n, предпочтительно не меньшим чем 0,5. 2. Способ по п.1, где на стадии b) штаммы бактериофага выделяют из образца, происходящего из окружающей среды, посредством пропускания через мембранный фильтр с размером пор 0,2-0,4 мкм, к полученному фильтрату добавляют культуральную среду и смешивают с бульонной культурой бактериального штамма определенного вида, инкубируют примерно один час при температуре примерно 37 С,часть суспензии забирают и осуществляют посев на чашки с твердой культуральной средой, инкубируют от 2 до 24 ч примерно при 37 С, выделяют образец среды, окружающей отдельное "стерильное пятно",переносят в бульонную культуру бактериального штамма определенного вида и инкубируют до тех пор,пока культура не станет прозрачной, а штаммы бактериофага получают посредством пропускания лизата через мембранный фильтр с размером пор 0,2-0,4 мкм, при этом посев на твердую культуральную среду и повторное выделение "стерильных пятен" предпочтительно повторяют 5 раз. 3. Способ по п.1 или 2, где на стадии с) исследуемым бактериальным штаммом инокулируют соответствующую твердую среду, на которую переносят часть бактериофагов, полученных на стадии b), инкубируют примерно 4 ч при температуре примерно 37 С, затем оставляют при температуре примерно 4 С на период примерно от 2 до 24 ч, после чего литическую активность штамма бактериофага устанавливают на основании появления, по меньшей мере, отдельных "стерильных пятен". 4. Способ по п.1, где патогенные бактериальные штаммы представляют собой штаммы родовStaphylococcus или Pseudomonas. 5. Способ по п.4, где выбранный на стадии е) поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше, и представляет собой штамм бактериофагов S1 (PCM F/00001), S2 (PCM F/00002), S3 (РСМF/00003), S4 (PCM F/00004), S5 (PCM F/00005), S6 (PCM F/00006) или S7 (PCM F/00007). 6. Способ по п.5, где указанный поливалентный штамм бактериофага обнаруживается у пациентов с муковисцидозом и представляет собой штамм S2 (PCM F/00002), S4 (PCM F/00004) или S7 (PCMF/00007). 7. Способ по п.4, где выбранный на стадии е) поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше, и представляет собой штамм бактериофага P1 (PCM F/00008), P2 (PCM F/00009), Р 3 (PCM(PCM F/00026) или Р 20 (PCM F/00027). 8. Способ по п.7, где указанный поливалентный штамм бактериофага обнаруживается у пациентов с муковисцидозом и представляет собой штамм Р 3 (PCM F/00010), P6 (PCM F/00013) или P11 (PCMF/00018). 9. Способ по п.2, включающий дополнительную очистку лизата, в частности от эндотоксина, причем смесь, содержащую бактериофаги, приводят в контакт с субстратом, содержащим целлюлозу или, по меньшей мере, ее частично этерифицированное производное, затем промывают раствором, удаляющим примеси, в частности эндотоксин, после чего элюируют очищенные бактериофаги. 10. Способ по п.9, где элюцию бактериофагов проводят водой, раствором недиссоциирующего вещества, буфером или солевым раствором в концентрации не более, чем 0,1 М, в частности забуференным. 11. Способ по п.10, где концентрация солевого раствора, в частности забуференного, составляет от 0,05 до 0,1 М. 12. Способ по п.9, где элюцию бактериофагов проводят при температуре от -25 до +100 С. 13. Способ по п.9, где элюцию бактериофагов проводят с солевым раствором, содержащим органический растворитель. 14. Способ по п.13, где органический растворитель выбран из группы, включающей диметилсульфоксид, диметилформамид, изопропанол и ацетон. 15. Способ по п.9, где в качестве субстрата используют целлюлозу, частично этерифицированную органической или неорганической кислотой. 16. Способ по п.15, где кислота представляет собой уксусную, азотную, серную или фосфорную кислоту. 17. Способ по п.15, где используют целлюлозу, в которой этерифицированы от 0,01 до 5% молекул глюкозы, в частности от 0,25 до 1% молекул глюкозы. 18. Лекарственное средство для лечения или профилактики инфекционных заболеваний, вызываемых патогенными бактериями, содержащее полученный способом по любому из пп.1-17 поливалентный штамм бактериофага. 19. Лекарственное средство по п.18, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше, и представляет собой штамм S1 (PCM F/00001), S2 (PCM F/00002), S3 (PCM F/00003),S4 (PCM F/00004), S5 (PCM F/00006), S6 (PCM F/00006) и S7 (РСМ F/00007).-9 007472 20. Лекарственное средство по п.19, характеризующееся тем, что служит для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой S2 (PCM F/00002), S4 (PCM F/00004) или S7 (PCMF/00007). 21. Лекарственное средство по п.18, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше, и представляет собой штамм Р 1 (РСМ F/00008), Р 2 (РСМ F/00009), Р 3 (РСМ F/00010), P4F/00026) и Р 20 (РСМ F/00027), в частности фаги Р 7, Р 20 и Р 6. 22. Лекарственное средство по п.21, характеризующееся тем, что служит для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой Р 3 (РСМ F/00010), Р 6 (РСМ F/00013) или P11 (PCMF/00018). 23. Применение поливалентного штамма бактериофага, полученного способом по любому из пп.1-17, для получения лекарственного средства для лечения или профилактики инфекционных заболеваний, вызванных патогенными бактериями. 24. Применение по п.23, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше, и представляет собой штамм S1 (PCM F/00001), S2 (РСМ F/00002), S3 (PCM F/00003), S4 (PCMF/00004), S5 (PCM F/00005), S6 (PCM F/00006) или S7 (PCM F/00007). 25. Применение по п.24, где лекарственное средство предназначено для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой S2 (PCM F/00002), S4 (PCM F/00004) или S7 (PCM F/00007). 26. Применение по п.23, где указанный поливалентный штамм бактериофага является специфичным для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше, и представляет собой штамм P1 (PCM F/00008), P2 (PCM F/00009), Р 3 (PCM F/00010), P4 (PCM(РСМ F/00027), в частности фаги Р 7, Р 20 и Р 6. 27. Применение по п.26, где лекарственное средство предназначено для лечения или профилактики инфекционных заболеваний, возникающих у пациентов с муковисцидозом, а указанный поливалентный штамм бактериофага представляет собой Р 3 (РСМ F/00010), Р 6 (РСМ F/00013) или P11 (PCM F/00018). 28. Поливалентный штамм бактериофага S1 (PCM F/00001), S2 (РСМ F/00002), S3 (РСМ F/00003),S4 (РСМ F/00004), S5 (РСМ F/00005), S6 (РСМ F/00006) или S7 (РСМ F/00007), специфичный для лекарственно-устойчивых бактериальных штаммов рода Staphylococcus, обнаруживаемых в Польше. 29. Поливалентный штамм бактериофага P1 (PCM F/00008), P2 (РСМ F/00009), Р 3 (РСМ F/00010),P4 (РСМ F/00011), P5 (РСМ F/00012), Р 6 (РСМ F/00013), P7 (РСМ F/00014), P8 (РСМ F/00015), Р 9 (РСМF/00026) или Р 20 (PCM F/00027), специфичный для лекарственно-устойчивых бактериальных штаммов рода Pseudomonas, обнаруживаемых в Польше.
МПК / Метки
МПК: A61K 35/74, A61K 35/76, C12N 7/00, A61P 31/04
Метки: штаммы, содержащее, указанные, способы, поливалентные, лекарственное, средство, бактериофага, использования, получения
Код ссылки
<a href="https://eas.patents.su/13-7472-polivalentnye-shtammy-bakteriofaga-sposoby-ih-polucheniya-i-ispolzovaniya-i-soderzhashhee-ukazannye-shtammy-lekarstvennoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Поливалентныe штаммы бактериофага, способы их получения и использования и содержащее указанные штаммы лекарственное средство</a>
Предыдущий патент: Растворимый рецептор br43x2 и способы его применения
Следующий патент: Способ лечения панкреатита и способ профилактики септических осложнений острого некротизирующего панкреатита
Случайный патент: Способ получения полиэтилена со сверхвысокой молекулярной массой