Производные бензимидазолонкарбоновой кислоты
Номер патента: 10891
Опубликовано: 30.12.2008
Авторы: Мурата Йосинори, Игути Сатору, Соне Хироки, Андо Кодзи, Нумата Тойохару, Мурасе Нориаки, Утида Тикара, Уеки Тацуо
Формула / Реферат
1. Соединение формулы
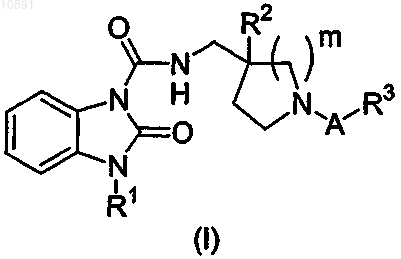
либо его фармацевтически приемлемая соль или сольват, где
A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, причем указанная алкиленовая группа является незамещенной или же замещена заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать
3-6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;
R1 представляет собой изопропильную или циклопентильную группу;
R2 представляет собой атом водорода, атом галогена или гидроксигруппу;
R3 представляет собой карбоксигруппу, тетразолильную группу, 5-оксо-1,2,4-оксадиазол-3-ильную группу или 5-оксо-1,2,4-тиадиазол-3-ильную группу и
m означает целое число, равное 1 или 2.
2. Соединение либо его фармацевтически приемлемая соль или сольват по п.1, в котором
R1 представляет собой изопропильную группу;
R2 представляет собой атом водорода, атом фтора или гидроксигруппу;
R3 представляет собой карбоксигруппу или тетразолильную группу;
A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа является незамещенной или же замещена заместителями в количестве от 1 до 2, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать
3-6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; и
m означает целое число 2.
3. Соединение или его фармацевтически приемлемая соль или сольват по п.1, в котором
R1 представляет собой изопропильную группу;
R2 представляет собой атом водорода;
R3 представляет собой карбоксигруппу или тетразолильную группу;
A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные геминальные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 3-6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; и
m означает целое число 2.
4. Соединение либо его фармацевтически приемлемая соль или сольват по п.1, в котором
R1 представляет собой изопропильную группу;
R2 представляет собой атом водорода;
R3 представляет собой карбоксигруппу или тетразолильную группу;
A представляет собой

m означает целое число 2.
5. Соединение либо его фармацевтически приемлемая соль или сольват по п.4, в котором
R1 представляет собой изопропильную группу;
R2 представляет собой атом водорода, атом фтора или гидроксигруппу;
R3 представляет собой карбоксигруппу;
A представляет собой
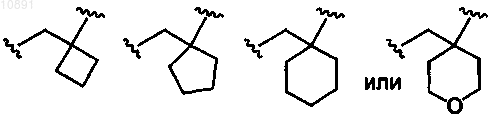
m означает целое число 2.
6. Соединение по п.1, которое выбрано из
4-{[4-({[(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}тетрагидро-2H-пиран-4-карбоновой кислоты;
1-{[4-({[(3-изопропил-2-оксо-2,3-дигидро-2H-бензимидазол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклогексанкарбоновой кислоты;
1-{[4-({[(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклопентанкарбоновой кислоты;
1-{[4-({[(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклопропанкарбоновой кислоты;
1-{[4-гидрокси-4-({[(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклогексанкарбоновой кислоты;
1-{[4-({[(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты;
либо их фармацевтически приемлемых солей или сольватов.
7. Фармацевтическая композиция, включающая соединение либо его фармацевтически приемлемую соль или сольват по любому из пп.1-6, а также фармацевтически приемлемый носитель.
8. Фармацевтическая композиция по п.7, дополнительно включающая другой фармакологически активный агент.
9. Способ лечения состояния, опосредованного активностью рецептора 5-HT4, у млекопитающего, включая человека, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединений либо их фармацевтически приемлемых солей или сольватов по любому из пп.1-6.
10. Способ по п.9, в котором указанное состояние представляет собой гастроэзофагеальную рефлюксную болезнь, желудочно-кишечные заболевания, расстройства перистальтики желудка, неязвенную диспепсию, функциональную диспепсию, синдром раздраженного кишечника (IBS), запор, диспепсию, эзофагит, гастроэзофагиальные заболевания, тошноту, заболевания центральной нервной системы, болезнь Альцгеймера, расстройства познавательной способности, рвоту, мигрень, неврологические заболевания, боль, сердечно-сосудистые расстройства, сердечную недостаточность, сердечную аритмию, диабет и синдром остановки дыхания.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Настоящее изобретение относится к соединениям формулы (I), где каждый из символов R1,R2, R3, A и m соответствует описанному в настоящем изобретении, или их фармацевтически приемлемым солям и сольватам, а также к композициям, содержащим такие соединения, и к применению таких соединений в лечении состояний, опосредованных активностью рецептора 5-НТ 4, таких как, не ограничиваясь перечисленными, гастроэзофагеальная рефлюксная болезнь,желудочно-кишечные заболевания, расстройства перистальтики желудка, неязвенная диспепсия,функциональная диспепсия, синдром раздраженного кишечника (IBS), запор, диспепсия, эзофагит,гастроэзофагиальные заболевания, тошнота, заболевания центральной нервной системы, болезнь Альцгеймера, расстройства познавательной способности, рвота, мигрень, неврологические заболевания, боль, сердечно-сосудистые расстройства, сердечная недостаточность, сердечная аритмия, диабет и синдром остановки дыхания. Примечание: библиография отражает состояние при переиздании 010891 Уровень техники Настоящее изобретение относится к производным бензимидазолонкарбоновой кислоты. Эти соединения обладают активностью селективных агонистов рецептора 5-HT4. Кроме этого, настоящее изобретение относится к фармацевтической композиции, способу лечения и применению, включающим указанные выше производные, для лечения болезненных состояний, опосредованных активностью рецептора 5-HT4; в частности активностью агониста рецептора 5-HT4. Было обнаружено, что агонисты рецептора 5-HT4 в основном применимы для лечения разнообразных заболеваний, таких как гастроэзофагеальная рефлюксная болезнь, желудочно-кишечные заболевания, расстройства перистальтики желудка, неязвенная диспепсия, функциональная диспепсия, синдром раздраженного кишечника (IBS), запор, диспепсия, эзофагит, гастроэзофагиальные заболевания, тошнота, заболевания центральной нервной системы, болезнь Альцгеймера, расстройства познавательной способности, рвота, мигрень, неврологические заболевания, боль, сердечно-сосудистые расстройства, сердечная недостаточность, сердечная аритмия, диабет и синдром остановки дыхания. (TiPs, 1992, 13, 141;Romanelli M.N. et al., Arzheim Forsch./Drug Res., 1993, 43, 913). В WO 94/00449 раскрыты бензимидазолоновые соединения в качестве агонистов или антагонистов 5-HT4 и/или антагонистов 5-HT3. Конкретно, соединения, представленные следующей структурной формулой, раскрыты в примере 10: Существует необходимость в разработке новых агонистов 5-HT4, которые являются хорошими кандидатами на роль лекарственных средств. В частности, предпочтительные соединения должны прочно связываться с рецептором 5-HT4, демонстрируя при этом незначительное сродство к другим рецепторам,а также проявлять функциональную активность агонистов. Они должны хорошо всасываться из желудочно-кишечного тракта, быть устойчивыми к метаболизму и обладать благоприятными фармакокинетическими свойствами. Если целью данных соединений являются рецепторы центральной нервной системы, они должны свободно проникать сквозь барьер кровь-мозг, и если селективной целью являются рецепторы периферической нервной системы, они не должны проникать через гематоэнцефалический барьер. Они должны быть нетоксичными и проявлять незначительные побочные эффекты. Кроме того,идеальный кандидат на роль лекарственного средства должен существовать в физической форме, которая является стабильной, негигроскопичной и которую можно легко включить в состав лекарственного препарата. Сущность изобретения В настоящем изобретении было обнаружено, что (1) замена хинуклидинового цикла пиперидиновым/пирролидиновым циклом улучшает сродство к рецептору 5-HT4 и/или (2) введение карбоксильного фрагмента снижает сродство к дофетилиду, что приводит к предотвращению увеличения продолжительности интервала QT. Следовательно, в процессе работы над настоящим изобретением было неожиданно обнаружено, что соединения по настоящему изобретению обладают более сильной и селективной активностью в качестве агонистов 5-HT4 и/или улучшенным сродством к дофетилиду по сравнению с соединениями известного уровня техники и, таким образом, они применимы для лечения болезненных состояний, опосредованных активностью 5-HT4, таких как гастроэзофагеальная рефлюксная болезнь, желудочно-кишечные заболевания, расстройства перистальтики желудка, неязвенная диспепсия, функциональная диспепсия, синдром раздраженного кишечника (IBS), запор, диспепсия, эзофагит, гастроэзофагиальные заболевания, тошнота, заболевания центральной нервной системы, болезнь Альцгеймера, расстройства познавательной способности, рвота, мигрень, неврологические заболевания, боль, сердечно-сосудистые расстройства, сердечная недостаточность, сердечная аритмия, диабет и синдром остановки дыхания (в особенности вызванных введением опиоидов). Настоящее изобретение относится к соединению следующей формулы (I):-1 010891 либо к его фармацевтически приемлемой соли или сольвату,где A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, причем указанная алкиленовая группа является незамещенной или же замещена заместителями в количестве от 1 до 4,независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 3-, 4-, 5- или 6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;R1 представляет собой изопропильную или циклопентильную группу;R2 представляет собой атом водорода, атом галогена или гидроксигруппу;m означает целое число, равное 1 или 2. Один из вариантов осуществления настоящего изобретения относится к соединению приведенной выше формулы (I) либо его фармацевтически приемлемым солям или сольватам, в которых:A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, причем указанная алкиленовая группа является незамещенной или же замещена заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 6 членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O; иR1 представляет собой изопропильную или циклопентильную группу;R2 представляет собой атом водорода, атом галогена или гидроксильную группу;R3 представляет собой карбоксильную группу, тетразолильную группу, 5-оксо-1,2,4-оксадиазол-3 ильную группу или 5-оксо-1,2,4-тиадиазол-3-ильную группу иm означает целое число, равное 1 или 2. Один из вариантов осуществления настоящего изобретения относится к соединению приведенной выше формулы (I) или его фармацевтически приемлемым солям и сольватам, в которых:A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, причем указанная алкиленовая группа замещена заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 5-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;R1 представляет собой изопропильную или циклопентильную группу;R2 представляет собой атом водорода, атом галогена или гидроксигруппу;m означает целое число, равное 1 или 2. Один из вариантов осуществления настоящего изобретения относится к соединению приведенной выше формулы (I) или его фармацевтически приемлемым солям и сольватам, в которых:A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, причем указанная алкиленовая группа замещена заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 3-4-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;R1 представляет собой изопропильную или циклопентильную группу;R2 представляет собой атом водорода, атом галогена или гидроксигруппу;m означает целое число, равное 1 или 2. Помимо этого, настоящее изобретение относится к применению соединений формулы (I) либо их фармацевтически приемлемых солей или сольватов, каждого, как описано в настоящем изобретении, для производства лекарственного средства для лечения состояния, опосредованного активностью рецептора 5-HT4; в частности активностью агониста рецептора 5-HT4. Предпочтительно настоящее изобретение также относится к применению соединения формулы (I) либо их фармацевтически приемлемых солей или сольватов, каждого, как описано в настоящем изобретении, для производства лекарственного средства для лечения заболеваний, выбранных из гастроэзофа-2 010891 геальной рефлюксной болезни, желудочно-кишечных заболеваний, расстройств перистальтики желудка,неязвенной диспепсии, функциональной диспепсии, синдрома раздраженного кишечника (IBS), запора,диспепсии, эзофагита, гастроэзофагиальных заболеваний, тошноты, заболеваний центральной нервной системы, болезни Альцгеймера, расстройств познавательной способности, рвоты, мигрени, неврологических заболеваний, боли, сердечно-сосудистых расстройств, сердечной недостаточности, сердечной аритмии, диабета и синдрома остановки дыхания. Кроме этого, настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы (I) либо его фармацевтически приемлемые соли или сольваты, каждого, как описано в настоящем изобретении, вместе с фармацевтически приемлемым носителем для указанного соединения. Далее, в настоящем изобретении разработан способ лечения состояния, опосредованного активностью рецептора 5-HT4, у млекопитающего, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) либо его фармацевтически приемлемой соли или сольвата, каждого, как описано в настоящем изобретении. Примеры состояний, опосредованных активностью рецептора 5-HT4, включают, не ограничиваясь перечисленным, гастроэзофагеальную рефлюксную болезнь, желудочно-кишечные заболевания, расстройства перистальтики желудка, неязвенную диспепсию, функциональную диспепсию, синдром раздраженного кишечника (IBS), запор, диспепсию, эзофагит, гастроэзофагиальные заболевания, тошноту,заболевания центральной нервной системы, болезнь Альцгеймера, расстройства познавательной способности, рвоту, мигрень, неврологические заболевания, боль, сердечно-сосудистые расстройства, сердечную недостаточность, сердечную аритмию, диабет и синдром остановки дыхания. Кроме того, настоящее изобретение относится к соединениям формулы (XI) или их солям,где R2 означает атом водорода, гидроксигруппу или атом галогена;R6 означает атом водорода или аминозащитную группу;Y означает алкоксигруппу, содержащую от 1 до 4 атомов углерода, диалкиламиногруппу, содержащую от 2 до 8 атомов углерода, имидазолильную, фталимидильную, сукцинимидильную или сульфонильную группу; иm представляет собой 1 или 2. Настоящее изобретение также относится к соединениям формулы (IXa) или их солям,где A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, причем указанная алкиленовая группа является незамещенной или замещена заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 3-6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;R2 означает атом водорода, гидроксигруппу или атом галогена;R4 означает гидроксигруппу или карбоксизащитную группу;R6 означает атом водорода или аминозащитную группу иm представляет собой 1 или 2. Соединения по настоящему изобретению могут демонстрировать меньшую токсичность, хорошее всасывание, распределение, хорошую растворимость, меньшее сродство к связыванию с белками, меньшее взаимодействие с другими лекарствами и хорошую устойчивость к метаболизму. Подробное описание изобретения В соединениях по настоящему изобретению описано следующее. Если A представляет собой алкиленовую группу, включающую от 1 до 4 атомов углерода, она может представлять собой группу с неразветвленной цепью, причем примеры включают, не ограничиваясь перечисленным, метилен, этилен, триметилен и тетраметилен. Из указанных групп предпочтительными являются метилен и этилен; причем наиболее предпочтительным является этилен. Если заместитель A является алкильной группой, содержащей от 1 до 4 атомов углерода, он может представлять собой группу с неразветвленной или разветвленной цепью, причем примеры включают, не ограничиваясь перечисленным, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и третбутил. Из перечисленных заместителей предпочтительными являются алкильные группы, содержащие от 1 до 3 атомов углерода; метил, этил, пропил и изопропил являются более предпочтительными; метил и этил являются наиболее предпочтительными.-3 010891 Если заместитель Y является алкоксигруппой, содержащей от 1 до 4 атомов углерода, он представляет собой атом кислорода, замещенный указанной алкильной группой, и примеры включают, не ограничиваясь перечисленным, метокси, этокси, пропилокси, изопропилокси, бутилокси, изобутилокси, вторбутилокси и трет-бутилокси. Из перечисленного предпочтительными являются алкильные группы, содержащие от 1 до 2 атомов углерода; более предпочтительной является метоксигруппа. Если заместитель Y является диалкиламиногруппой, содержащей от 2 до 8 атомов углерода, он представляет собой аминогруппу, замещенную двумя из указанных алкильных групп, и примеры включают, не ограничиваясь перечисленным, диметиламино, N-метил-N-этиламино, диэтиламино, дипропиламино, диизопропиламино, дибутиламино, диизобутиламино и N,N-ди(1-метилпропил)амино. Из этих групп предпочтительными являются диалкиламиногруппы, содержащие от 2 до 4 атомов углерода; более предпочтительными являются диметиламино, N-метил-N-этиламино и диэтиламино. Если заместитель A является гидроксиалкильной группой, содержащей от 1 до 4 атомов углерода,он может быть группой с линейной или разветвленной цепью, и примеры включают, не ограничиваясь перечисленным, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2-гидроксипропил,2-гидрокси-1-метилэтил,4-гидроксибутил,3-гидроксибутил,2-гидроксибутил,3-гидрокси-2 метилпропил и 3-гидрокси-1-метилпропил. Из указанных групп предпочтительными являются гидроксиалкильные группы, содержащие от 1 до 3 атомов углерода; более предпочтительными являются гидроксиметил, 2-гидроксиэтил и 2-гидроксипропил и наиболее предпочтительными являются гидроксиметил и 2-гидроксиэтил. Если заместитель A является алкоксиалкильной группой, содержащей от 2 до 6 атомов углерода, он может быть группой с линейной или разветвленной цепью, причем примеры включают, не ограничиваясь перечисленным, метоксиметил, этоксиметил, 2-метоксиэтил, 2-этоксиэтил, 1-метоксиэтил,3-метоксипропил, 3-этоксипропил, 2-метоксипропил, 2-метокси-1-метилэтил, 4-метоксибутил,4-этоксибутил, 3-метоксибутил, 2-метоксибутил, 3-метокси-2-метилпропил и 3-метокси-1-метилпропил. Из перечисленных заместителей предпочтительными являются алкоксиалкильные группы, включающие от 2 до 4 атомов углерода; более предпочтительными являются метоксиметил, 2-метоксиэтил и 3-метоксипропил и наиболее предпочтительными являются 2-метоксиэтил и 3-метоксипропил. Если два заместителя A, не являющиеся галогенами, могут вместе с атомами углерода, к которым они присоединены, образовывать 3-, 4-, 5- или 6-членные циклы, необязательно содержащие хотя бы один гетероатом, выбранный из N, O или S, такой цикл может являться циклоалкилом или гетероциклической группой, и примеры включают циклопропил, циклопентил, циклобутил, циклогексил, метилциклопропил, этилциклопропил, метилциклобутил, метилциклопентил, метилциклогексил, этилциклогексил,гидроксициклопропил, гидроксициклобутил, гидроксициклопентил, гидроксициклогексил, метоксициклопропил, метоксициклобутил, метоксициклопентил, метоксициклогексил, тетрагидрофурил и тетрагидропиранил, предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, метоксициклогексил и тетрагидропиранил, причем наиболее предпочтительно циклобутил, циклопентил, циклогексил и тетрагидропиранил. Если R6 является аминозащитной группой, она представляет собой защитную группу, способную к отщеплению под действием химических средств, таких как гидрогенолиз, гидролиз, электролиз или фотолиз, причем такие аминозащитные группы описаны в Protective Groups in Organic Synthesis под ред.T.W. Greene et al. (John WileySons, 1999), и примеры включают, не ограничиваясь перечисленным, бензил, C2H5O(C=O)-, CH3(C=O), т-бутилдиметилсилил, т-бутилдифенилсилил, бензилоксикарбонил и т-бутоксикарбонил. Из указанных групп предпочтительной является т-бутоксикарбонил. Если R4 является карбоксизащитной группой, она представляет собой защитную группу, способную к отщеплению под действием химических средств, таких как гидрогенолиз, гидролиз, электролиз или фотолиз, причем такие карбоксизащитные группы описаны в Protective Groups in Organic Synthesis под ред. T.W. Greene et al. (John WileySons, 1999), и примеры включают метокси, этокси, т-бутилокси,метоксиметокси,2,2,2-трихлорэтокси,бензилокси,дифенилметокси,триметилсилилокси,т-бутилдиметилсилилокси и аллилокси. Из этих групп предпочтительными являются т-бутилокси,метокси или этокси. Если R1 и заместитель A являются атомами галогена, они могут быть атомами фтора, хлора, брома или йода. Из этих атомов предпочтительными являются атомы фтора и хлора. Термин лечение в рамках настоящего изобретения относится к исцеляющему, паллиативному и профилактическому лечению, включая обращение, облегчение, замедление развития или предотвращение расстройства или состояния, к которому применяется данный термин, или одного или нескольких симптомов такого расстройства или состояния. Предпочтительными классами соединений по настоящему изобретению являются те соединения формулы (I) либо их фармацевтически приемлемые соли или сольваты, каждый, как описано в настоящем изобретении, в которых:(A) R1 представляет собой изопропильную группу;(B) R2 представляет собой атом водорода, атом фтора или гидроксигруппу;(C) R2 представляет собой атом водорода;(D) R3 представляет собой карбоксигруппу или тетразолильную группу;(F) A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа является незамещенной или замещена заместителями в количестве от 1 до 2, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;(G) A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода,гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем геминальные заместители, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;(H) A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы,включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два указанных заместителя вместе с атомами углерода, к которым они присоединены, могут образовывать 5-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;(I) A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные геминальные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 5-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S;(J) A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы,включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 3-4-членные циклы, необязательно содержащие по меньшей мере один гетероатом, выбранный из N, O и S;(K) A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные геминальные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 3-4-членные циклы, необязательно содержащие по меньшей мере один гетероатом, выбранный из N, O и S;(Q) m является целым числом, равным 2. Особенно предпочтительными соединениями по настоящему изобретению являются такие соединения формулы (I) либо их фармацевтически приемлемые соли или сольваты, в которых:R2 является атомом водорода, атомом фтора или гидроксигруппой;R3 является карбоксигруппой или тетразолильной группой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа является незамещенной или замещена заместителями в количестве от 1 до 2,независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; иm означает целое число 2;R3 является карбоксигруппой или тетразолильной группой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные геминальные заместители вместе с атомами углерода,к которым они присоединены, могут образовывать 6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; иm означает целое число 2;R3 является карбоксигруппой или тетразолильной группой;m означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа является незамещенной или замещена заместителями в количестве от 1 до 2,независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два геминальные заместителя,не являющиеся галогенами, вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; иm означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;m означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;R3 является карбоксигруппой или тетразолильной группой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода,причем любые два указанные заместителя вместе с атомами углерода, к которым они присоединены, могут образовывать 5-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; иm означает целое число 2;R3 является карбоксигруппой или тетразолильной группой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные геминальные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 5-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; иm означает целое число 2;R3 является карбоксигруппой или тетразолильной группой;m означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода,причем любые два указанные заместителя вместе с атомами углерода, к которым они присоединены, могут образовывать 5-членный цикл, необязательно содержащий по меньшей мере один гетероатом, выбранный из N, O и S; иm означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;m означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;R3 является карбоксигруппой или тетразолильной группой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода,причем указанные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 3-4-членные циклы, необязательно содержащие по меньшей мере один гетероатом, выбранный изm означает целое число 2;R3 является карбоксигруппой или тетразолильной группой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя геминальными заместителями, независимо выбранными из группы, состоящей из алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем указанные геминальные заместители вместе с атомами углерода, к которым они присоединены, могут образовывать 3-4-членные циклы, необязательно содержащие по меньшей мере один гетероатом, выбранный из N, O и S;m означает целое число 2;R3 является карбоксигруппой или тетразолильной группой;m означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;A представляет собой алкиленовую группу, включающую от 1 до 2 атомов углерода, причем указанная алкиленовая группа замещена двумя заместителями, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем любые два заместителя, не являющиеся галогенами, вместе с атомами углерода,к которым они присоединены, могут образовывать 3-4-членные циклы, необязательно содержащие по меньшей мере один гетероатом, выбранный из N, O и Sm означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;m означает целое число 2;R2 является атомом водорода, атомом фтора или гидроксигруппой;m означает целое число 2; илиR3 является карбоксигруппой или тетразолильной группой;m означает целое число 2. Один из вариантов осуществления настоящего изобретения относится к соединениям, выбранным из группы, состоящей из 4-[4-([(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилтетрагидро-2H-пиран-4-карбоновой кислоты; 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-2H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклогексанкарбоновой кислоты; 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-2H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклопентанкарбоновой кислоты; 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклопропанкарбоновой кислоты; 1-[4-гидрокси-4-([(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклогексанкарбоновой кислоты; 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклобутанкарбоновой кислоты; а также их фармацевтически приемлемых солей или сольватов. Один из вариантов осуществления настоящего изобретения относится к соединению из группы, состоящей из: 4-[4-([(3-изопропил-2-оксо-2,3-дигидро-2H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилтетрагидро-2H-пиран-4-карбоновой кислоты; 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-2H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклогексанкарбоновой кислоты; а также их фармацевтически приемлемых солей и сольватов. Один из вариантов осуществления настоящего изобретения относится к соединению из группы, состоящей из 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклопентанкарбоновой кислоты; а также ее фармацевтически приемлемых солей и сольватов. Один из вариантов осуществления настоящего изобретения относится к соединению из группы, состоящей из 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-2H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклопропанкарбоновой кислоты; 1-[4-([(3-изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклобутанкарбоновой кислоты; а также их фармацевтически приемлемых солей и сольватов. Фармацевтически приемлемые соли соединений формулы (I) включают их кислотно-аддитивные соли и соли с основаниями (в том числе двойные соли). Подходящие кислотно-аддитивные соли образованы кислотами, которые дают нетоксичные соли. Примеры включают такие соли, как ацетат, аспартат, бензоат, бесилат, бикарбонат/карбонат,бисульфат/сульфат, борат, камсилат, цитрат, эдисилат, эзилат, формиат, фумарат, глюцептат, глюконат,глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид,изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат,нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат и трифторацетат. Подходящие соли с основаниями образованы основаниями, которые дают нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Для ознакомления с обзором подходящих солей см. "Handbook of Pharmaceutical Salts: Properties,Selection and Use" Stahl и Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемые соли соединений формулы (I) могут быть легко получены при смешивании растворов соединения формулы (I) и желаемой кислоты или основания соответственно. Соль можно осадить из раствора и собрать фильтрованием или получить путем выпаривания растворителя. Степень ионизации соли может изменяться от полностью ионизированной до почти неионизированной. Соединения по настоящему изобретению могут существовать как в несольватированной, так и в сольватированной формах. Термин сольват в рамках настоящего изобретения применяется для описания молекулярного комплекса, включающего соединение по настоящему изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например этанола. Если указанный растворитель является водой, применяется термин гидрат.-9 010891 Фармацевтически приемлемые сольваты по настоящему изобретению включают гидраты и сольваты, в которых растворитель, входящий в кристаллическую структуру, может быть изотопно замещенным, например D2O, d6-ацетон, d6-ДМСО. В объем настоящего изобретения включены комплексы, такие как клатраты, комплексы включения лекарственного вещества в носитель, в которых, в противоположность упомянутым выше сольватам,лекарство и носитель представлены в стехиометрических или нестехиометрических количествах. Кроме этого, в объем изобретения включены комплексы лекарственных средств, содержащие два или более органических и/или неорганических компонента, которые могут присутствовать в стехиометрических или нестехиометрических количествах. Образующиеся комплексы могут быть ионизированными, частично ионизированными или неионизированными. Для ознакомления с обзором подобных комплексов см. Haleblian, J. Pharm. Sci., 64 (8),1269-1288 (August 1975). Далее в тексте все упоминания соединений формулы (I) включают ссылки на их соли, сольваты и комплексы, а также на сольваты и комплексы их солей. Термин соединение по настоящему изобретению или соединения по настоящему изобретению,если не указано иное, относится к соединениям формулы (I), определенным в настоящем описании выше по тексту, их полиморфным модификациям, пролекарствам и изомерам (включая оптические и геометрические изомеры, а также таутомеры), как определено далее в настоящем описании, а также изотопно меченным соединениям формулы (I). Кроме этого, в объем настоящего изобретения входят так называемые пролекарства соединений формулы (I). Так, некоторые производные соединений формулы (I), которые сами по себе могут иметь небольшую или отсутствующую фармакологическую активность, при введении в организм или нанесении на тело могут превращаться в соединения формулы (I), обладающие желаемой активностью, например, за счет гидролитического расщепления. Такие производные именуют пролекарствами. Дополнительная информация по применению пролекарств может быть найдена в "Prodrugs as Novel DeliverySystems", vol. 14, ACS Symposium Series (T. Higuchi и W. Stella) и "Bioreversible Carriers in Drug Design",Pergamon Press, 1987 (ed. E.B. Roche, American Pharmaceutical Association). Пролекарства согласно настоящему изобретению могут, например, быть получены заменой подходящих функциональных групп, имеющихся в соединениях формулы (I), определенными фрагментами,известными специалистам в данной области техники как про-фрагменты, что описано, например, в"Design of Prodrugs" H. Bundgaard (Elsevier, 1985). Некоторые примеры пролекарств по настоящему изобретению включают:(i) если соединение формулы (I) содержит функциональную группу карбоновой кислоты (-COOH),его сложный эфир, например, замену водорода (C1-C8)алкилом;(ii) если соединение формулы (I) содержит функциональную группу спирта (-OH), его простой эфир, например, замену водорода (C1-C6)алканоилоксиметилом; и(iii) если соединение формулы (I) содержит функциональную группу первичного или вторичного амина (-NH2 или NHR, где PH), его амид, например, замещение одного или обоих водородов(C1-C10)алканоилом. Другие примеры замещающих групп в соответствии с упомянутыми выше примерами, а также примеры пролекарств других типов могут быть найдены в указанных ранее ссылках. Наконец некоторые соединения формулы (I) могут сами по себе служить пролекарствами других соединений формулы (I). Соединения формулы (I), содержащие один или несколько асимметрических атомов углерода, могут существовать в виде двух или нескольких стереоизомеров. Если соединение формулы (I) содержит алкенильную или алкениленовую группу, возможно наличие геометрических цис/транс- (или Z/E) изомеров. Если соединение содержит, например, группу кетона или оксима либо ароматический фрагмент,может иметь место таутомерная изомерия (таутомерия). Из этого следует, что одно соединение может проявлять более одного типа изомерии. В объем настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (I), в том числе соединения, которые проявляют более одного типа изомерии, и смеси одного или нескольких таких соединений. Кроме этого, в объем изобретения входят кислотно-аддитивные соли или соли с основаниями, в которых противоион является оптически активным, например D-лактат или L-лизин, или рацемической смесью, например DL-тартрат или DL-аргинин. Цис/транс-изомеры могут быть разделены с помощью стандартных методик, хорошо известных специалистам в данной области техники, например хроматографией и фракционной кристаллизацией. Стандартные методики для получения/выделения отдельных энантиомеров включают хиральный синтез из подходящих оптически чистых исходных веществ или разделение рацемата (или рацемата соли или производного) с применением, например, хиральной жидкостной хроматографии высокого давления(HPLC). С другой стороны, рацемат (или рацемическое исходное вещество) может быть введен во взаимодействие с подходящим оптически активным соединением, например спиртом, или в случае, если соеди- 10010891 нение формулы (I) содержит кислотный или основный фрагмент, кислотой или основанием, такими как винная кислота или 1-фенилэтиламин. Образующаяся смесь диастереомеров может быть разделена хроматографией и/или фракционной кристаллизацией и один или оба диастереомера превращены в соответствующий чистый энантиомер (энантиомеры) способами, хорошо известными специалисту. Хиральные соединения по настоящему изобретению (и хиральные исходные вещества для их получения) могут быть получены в энантиомерно-обогащенной форме с применением хроматографии, как правило ВЭЖХ, на асимметрической смоле с применением подвижной фазы, состоящей из углеводородов, как правило гептана или гексана, содержащих от 0 до 50% изопропанола, как правило, от 2 до 20% и от 0 до 5% алкиламина, как правило, 0,1% диэтиламина. Концентрирование элюата позволяет получить обогащенную смесь. Конгломераты стереоизомеров могут быть разделены с помощью стандартных методик, известных специалистам в данной области техники, см., например, "Stereochemistry of Organic Compounds".E.L. Eliel (Wiley, New York, 1994). Настоящее изобретение включает все фармацевтически приемлемые соединения формулы (I), меченные изотопами, в которых один или несколько атомов заменены атомами, имеющими тот же самый атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа,обычно имеющегося в природе. Примеры изотопов, подходящих для введения в соединения по настоящему изобретению, включают изотопы водорода, такие как 2H и 3H; углерода, такие как 11C, 13C и 14C; хлора, такие как 36Cl; фтора, такие как 18F; йода, такие как 123I и 125I; азота, такие как 13N и 15N; кислорода, такие как 15O, 17O и 18O; фосфора, такие как 32 Р, и серы, такие как 35S. Некоторые меченные изотопами соединения формулы (I), например, те из них, которые включают радиоактивные изотопы, применимы в исследованиях распределения в тканях лекарства и/или субстрата. Радиоактивные изотопы тритий, т.е. 3H, и углерод-14, т.е. 14C, особенно применимы для этой цели ввиду легкости их включения в соединения и имеющихся в наличии средств обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может принести определенные терапевтические преимущества, являющиеся следствием более высокой метаболической устойчивости, например увеличенное время полужизни или уменьшенную необходимую дозировку и, следовательно, в некоторых обстоятельствах могут быть предпочтительными. Замещение изотопами, эмитирующими позитроны, такими как 11C, 18F, 15O и 13N, может быть применимо в исследовании позитронно-эмиссионной томографии (PET) для изучения размещения субстрата рецептора. Меченные изотопами соединения формулы (I), как правило, могут быть получены по стандартным методикам, известным специалистам в данной области техники или с помощью способов, аналогичных описанным в сопровождающих примерах и синтезах, с применением подходящих меченных изотопами реагентов вместо ранее использовавшихся не меченных реагентов. Все соединения формулы (I) могут быть получены по методикам, описанным в помещенном ниже разделе общих способов, или конкретными способами, описанными в разделах Примеры и Синтез,или же путем стандартных модификаций указанных способов. Настоящее изобретение также охватывает любые или большинство из этих способов получения соединений формулы (I) в дополнение к любым новым интермедиатам, используемым в этих способах. Общее описание способов синтеза. Соединения по настоящему изобретению могут быть получены с помощью разнообразных способов, хорошо известных для получения соединений этого типа, например, как показано в описанных далее способах A-G. Приведенные ниже способы A и B относятся к получению соединений формулы (I). Способы C-G позволяют получить различные интермедиаты. Если не указано иное, R1, R2, R3, m и A в приведенных ниже способах соответствуют данным выше определениям. Термин защитная группа, используемый далее в настоящем описании, означает гидрокси, карбокси и аминозащитные группы, которые выбраны из типичных гидрокси, карбокси и аминозащитных групп, описанных в Protective Groups in Organic Synthesis под ред. T.W.Greene et al. (JohnWileySons, 1999). Все исходные вещества в описанных ниже общих способах синтеза могут быть коммерчески доступны или получены стандартными способами, известными специалистам в данной области техники, такими как в European Journal of Medicinal Chemistry, 12 (1), 87-91; 1977, и раскрытие которых включено в настоящее описание с помощью ссылки.- 11010891 Способ A. Данное описание иллюстрирует получение соединений формулы (I). Схема реакции A На схеме реакции A R3a представляет собой R3, в соответствии с данным выше определением, или группу формулы -C(=O)-R4, где R4 является карбоксизащитной группой. Термин карбоксизащитная группа в рамках настоящего описания означает защитную группу,способную к отщеплению под действием химических средств, таких как гидрогенолиз, гидролиз, электролиз или фотолиз, и такие карбоксизащитные группы описаны в Protective Groups in Organic Synthesis под ред. T.W. Greene et al. (John WileySons, 1999). Типовые карбоксизащитные группы включают, не ограничиваясь перечисленными, метокси,этокси, т-бутилокси, метоксиметокси, 2,2,2-трихлорэтокси, бензилокси, дифенилметокси, триметилсилилокси, т-бутилдиметилсилилокси и аллилокси. Из указанных групп предпочтительными являются т-бутилокси, метокси или этокси. Стадия A1. На этой стадии желаемое соединение формулы (I) по настоящему изобретению получают карбонилированием соединения формулы (II) в присутствии соединения формулы (III). Соединение формулы (II) является коммерчески доступным. Соединение формулы (III) может быть получено по способу C, изложенному ниже. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу применяемого растворителя при условии, что он не оказывает неблагоприятного влияния на ход реакции и участвующие в ней реагенты, а также что он способен растворять реагенты,по крайней мере, до определенной степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленным, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; ароматические углеводороды, такие как бензол, толуол и нитробензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; и амиды, такие как N,N-диметилформамид и N,N-диметилацетамид. Из указанных растворителей предпочтительным является дихлорметан. Также не существует специальных ограничений на природу применяемых карбонилирующих реагентов, и любой карбонилирующий реагент, обычно применяемый в реакциях такого типа, также может быть применен и в этой реакции. Примеры таких карбонилирующих реагентов включают, не ограничиваясь перечисленным, производные имидазола, такие как N,N-карбонилдиимидазол (CDI); хлорформиаты, такие как трихлорметилхлорформиат и 4-нитрофенилхлорформиат; мочевину и трифосген. Из перечисленных реагентов предпочтительным является 4-нитрофенилхлорформиат. Описываемая реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако в основном удобно выполнять реакцию при температуре от примерно -78 до примерно 120C. Время, необходимое для протекания реакции, также может изменяться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы исходных веществ и применяемого растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше,обычно достаточен промежуток времени от примерно 5 мин до примерно 24 ч. В случае, когда R3a является группой формулы -C(=O)-R4, реакция снятия защиты приведет к получению карбоксигруппы. Эта реакция подробно описана T.W.Greene et al. в Protective Groups in OrganicSynthesis, 369-453, (1999), причем это описание включено в настоящее изобретение с помощью ссылки. Далее в качестве примера описана типовая реакция с использованием т-бутильной защитной группы. Реакцию снятия защиты обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу применяемого растворителя при условии, что он не оказывает вредного влияния на ход реакции и участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до определенной степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; и ароматические углеводороды, такие как бензол,толуол и нитробензол. Из указанных растворителей предпочтительными являются галогенированные углеводороды.- 12010891 Реакцию снятия защиты выполняют в присутствии кислоты. Также не существует особых ограничений на природу применяемых кислот и любая из кислот, обычно применяемых в реакциях данного типа, также может быть применена и в данном случае. Примеры таких кислот включают, не ограничиваясь перечисленными, такие кислоты, как хлористо-водородная кислота, уксусная кислота,п-толуолсульфоновая кислота или трифторуксусная кислота. Из этих кислот предпочтительной является трифторуксусная кислота. Реакция снятия защиты может проводиться в присутствии поглотителя радикалов. Как и в предыдущих случаях, нет конкретных ограничений на природу примененного поглотителя радикалов, и любой из поглотителей радикалов, обычно применяемых в реакциях данного типа, также может быть применен в данном случае. Примеры таких поглотителей радикалов включают, не ограничиваясь указанными, HBr,диметилсульфоксид или (CH3CH2)3SiH. Из этих веществ предпочтительным является (CH3CH2)3SiH. Реакция снятия защиты может проходить в широком диапазоне температур, и точная температура реакции не является решающей с точки зрения настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако в основном удобно выполнять эту реакцию при температурах от примерно 0 до примерно 100C, более предпочтительно от примерно 0 до примерно 50C. Время, требуемое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы исходных веществ и применяемого растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен промежуток времени от примерно 5 мин до примерно 24 ч, более предпочтительно от примерно 1 до примерно 24 ч. Способ B. Данное описание иллюстрирует альтернативное получение желаемого соединения формулы (I). Схема реакции B На схеме реакции B R3a соответствует данному выше определению, R5 представляет собой аминозащитную группу, Aa является группой A в соответствии с данным выше определением или алкиленовой группой, содержащей от 1 до 3 атомов углерода, причем указанная алкиленовая группа является незамещенной или замещена заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из атома галогена, алкильной группы, включающей от 1 до 4 атомов углерода, гидроксиалкильной группы, включающей от 1 до 4 атомов углерода, и алкоксиалкильной группы, включающей от 2 до 6 атомов углерода, причем два из числа указанных заместителей могут необязательно вместе с атомом(ами) углерода образовывать 3-6-членный цикл; и X представляет собой атом галогена, как, например, атом йода, атом хлора или атом брома. Термин аминозащитная группа в рамках настоящего описания означает защитную группу, способную к отщеплению под действием химических средств, таких как гидрогенолиз, гидролиз, электролиз или фотолиз, и такие аминозащитные группы описаны в Protective Groups in Organic Synthesis под ред.T.W. Greene et al. (John WileySons, 1999). Типовые аминозащитные группы включают, не ограничиваясь перечисленными, бензил, C2H5O(C=O)-, CH3(C=O)-, т-бутилдиметилсилил, т-бутилдифенилсилил,бензилоксикарбонил и т-бутоксикарбонил. Из указанных групп предпочтительным является т-бутоксикарбонил. Стадия B1. На этой стадии получают соединение формулы (V) путем снятия защиты с соединения формулы(IV), которое может быть получено, например, способом, сходным с описанным в способе A для получения соединения формулы (I) из соединения формулы (II). Способ снятия защиты подробно описанT.W. Greene et al. [Protective Groups in Organic Synthesis, 494-635, (1999)], причем это описание включено в настоящее изобретение с помощью ссылки. Далее в качестве примера описан типовой способ с участием т-бутоксикарбонильной защитной группы. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу применяемого растворителя при условии, что он не оказывает вредного влияния- 13010891 на ход реакции и участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленным, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; и спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из указанных растворителей предпочтительными являются спирты. Реакцию осуществляют в присутствии избытка кислоты. Как и в предыдущем случае, не существует особых ограничений на природу применяемых кислот и любая из кислот, обычно используемых в реакциях данного типа, также может быть применена и в данном случае. Примеры таких кислот включают,не ограничиваясь указанными, такие кислоты, как хлористо-водородная кислота или трифторуксусная кислота. Из этих кислот предпочтительной является трифторуксусная кислота. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей с точки зрения настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако в основном удобно выполнять эту реакцию при температурах от примерно 0 до примерно 100C. Время, требуемое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы исходных веществ и применяемого растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч. Стадия B2. На этой стадии получают желаемое соединение формулы (I) путем взаимодействия (B2-a) соединения формулы (V), полученного на стадии B1, как описано выше, с соединением формулы (VI) или с помощью восстановительного аминирования (B2-b) соединения формулы (V) с использованием соединения формулы (VII).(B2-а) взаимодействие с соединением формулы (V). Взаимодействие обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу применяемого растворителя при условии, что он не оказывает нежелательного влияния на ход реакции и участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленным, галогенированные углеводороды, такие как дихлорметан, хлороформ,четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амины, такие как N-метилморфолин, триэтиламин, трипропиламин,трибутиламин,диизопропилэтиламин,дициклогексиламин,N-метилпиперидин,N-метилпирролидин, пиридин, 4-пирролидинопиридин, N,N-диметиланилин и N,N-диэтиланилин; а также амиды, такие как N,N-диметилформамид и N,N-диметилацетамид. Из указанных растворителей предпочтительным является N,N-диметилформамид или N-метилпирролидин. Реакцию осуществляют в присутствии основания. Как и в предыдущем случае, не существует особых ограничений на природу применяемого основания и любое основание, обычно применяемое в реакциях данного типа, также может быть применено и в данном случае. Примеры таких оснований включают, не ограничиваясь указанными, амины, такие как N-метилморфолин, триэтиламин, трипропиламин,трибутиламин,диизопропилэтиламин,дициклогексиламин,N-метилпиперидин,пиридин,4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин,хинолин,N,N-диметиланилин,N,N-диэтиланилин,1,5-диазабицикло[4.3.0]нон-5-ен(DBN),1,4-диазабицикло[2.2.2]октан (DABCO) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU); гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; а также алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, т-бутоксид калия. Из перечисленных оснований предпочтительным является диизопропилэтиламин. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей с точки зрения настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако в основном удобно выполнять эту реакцию при температурах от примерно 0 до примерно 120C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов,в особенности от температуры реакции, а также природы исходных веществ и применяемого растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 48 ч.(B2-b) восстановительное аминирование. Эту реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного влияния на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, галогенированные углеводороды, такие как дихлорметан,хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир,диизопропиловый эфир, диметоксиэтан, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол,- 14010891 пропанол, 2-пропанол и бутанол; уксусную кислоту; а также воду. Из указанных растворителей предпочтительными являются галогенированные углеводороды. Реакцию осуществляют в присутствии восстанавливающего реагента. Как и в предыдущем случае,не существует особых ограничений на природу применяемого восстанавливающего реагента и любой восстанавливающий реагент, обычно применяемый в реакциях данного типа, также может быть применен и в данном случае. Примеры таких восстанавливающих реагентов включают, не ограничиваясь указанными, боргидрид натрия, цианоборгидрид натрия и триацетоксиборгидрид натрия. Из перечисленных реагентов предпочтительным является триацетоксиборгидрид натрия. Количество восстанавливающего реагента, требуемое для реакции, также может изменяться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы исходных веществ и применяемого растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, обычно будет удовлетворительным соотношение химических эквивалентов восстанавливающего реагента к исходному веществу, составляющее от 1 до 3. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако в основном удобно выполнять эту реакцию при температурах от примерно -20 до примерно 60C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы исходных веществ и применяемого растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч. В случае, когда R3a представляет собой группу формулы -C(=O)-R4, реакция снятия защиты приведет к образованию карбоксигруппы. Эта реакция может быть проведена в тех же условиях, которые описаны для стадии A1 способа A. Способ C. Данное описание иллюстрирует получение соединения формулы (III). Схема реакции C На схеме реакции каждый из символов C, X, A, Aa и R3a, R6 соответствует данным выше определениям. Следовательно, если R3a представляет собой -C(=O)-R4, приведенное выше соединение формулы Стадия C1. На этой стадии получают соединение формулы (IX) взаимодействием соединения (VIII) с соединением формулы (VI) или восстановительным аминированием соединения формулы (VIII) с соединением формулы (VII). Соединение формулы (VIII) может быть получено согласно изложенным ниже способамF и G, или оно является коммерчески доступным. Стадия C2. На этой стадии получают соединение формулы (III) путем снятия защиты с соединения формулы(IX), полученного согласно описанию стадии C1. Реакция может быть проведена в тех же условиях, которые описаны для стадии B1 способа B. Способ D. Данное описание иллюстрирует получение соединения формулы (IIIa). На схеме реакции каждый из символов D, R3a, R4, R6 и Y соответствует данным выше определениям, и R7 является кремнийсодержащей группой, такой как т-бутилдиметилсилил, т-бутилдифенилсилил,триэтилсилил или триметилсилил, предпочтительно триметилсилилом; R8 и Rs независимо представляют собой атом галогена, алкильную группу, содержащую от 1 до 4 атомов углерода, гидроксиалкильную группу, содержащую от 1 до 4 атомов углерода, и алкоксиалкильную группу, содержащую от 2 до 6 атомов углерода, причем R8 и R9 вместе с атомами углерода, к которым они присоединены необязательно могут образовывать 3-6-членный цикл;Ab представляет собой A, определенное выше, при условии, что исключаются метиленовая группа и замещенная метиленовая группа. Стадия D1. На этой стадии соединение формулы (IX) получают конденсацией соединения формулы (VIII) с соединением формулы (X) в присутствии параформальдегида. Соединение формулы (VIII) может быть получено согласно способам F и G или оно является коммерчески доступным. В случае, если Y не является алкоксигруппой, реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного влияния на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; а также спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из указанных растворителей предпочтительными являются дихлорметан или этанол. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0C до примерно 120C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах, в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 48 ч. Стадия D2. На этой стадии получают соединение формулы (IIIa) с помощью реакции Манниха между соединением формулы (XI) и соединением формулы (XII). Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного влияния на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; нитрилы, такие как ацетонитрил и бензонитрил; а также амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты. Из указанных растворителей предпочтительным является дихлорметан. Реакцию проводят в присутствии кислоты Льюиса. Как и в предыдущем случае, не существует особых ограничений на природу применяемой кислоты Льюиса и любая кислота Льюиса, обычно применяемая в реакциях данного типа, также может быть применена и в данном случае. Примеры таких кислот Льюиса включают, не ограничиваясь указанными, BF3, AlCl3, FeCl3, MgCl2, AgCl, Fe(NO3)3,CF3SO3Si(CH3)3, Yb(CF3SO3)3 и SnCl4. Из перечисленных реагентов предпочтительными являютсяYb(CF3SO3)3, MgCl2 или CF3SO3Si(CH3)3. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 100C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно бу- 16010891 дет достаточен период времени от примерно 5 мин до примерно 24 ч. Способ E. Данное описание иллюстрирует получение соединения формулы (III), где R2 является атомом водорода, и A представляет собой Ab. Схема реакции E На схеме реакции каждый из символов E, Aa, Ab и R3a соответствует данным выше определениям; каждый из заместителей R и R' представляет собой алкильную группу, включающую от 1 до 4 атомов углерода, предпочтительно метильную или аралкильную группу, такую как бензильная или фенилэтильная, предпочтительно бензильную группу. Стадия Е 1. На этой стадии получают соединения формулы (XIV) путем восстановления цианогруппы соединения формулы (XIII), которое является коммерчески доступным. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного влияния на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; а также спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из указанных растворителей предпочтительным является метанол. Реакцию осуществляют в присутствии восстанавливающего реагента. Как и в предыдущем случае,не существует особых ограничений на природу применяемого восстанавливающего реагента и любой восстанавливающий реагент, обычно применяемый в реакциях данного типа, также может быть применен и в данном случае. Примеры таких восстанавливающих реагентов включают, не ограничиваясь указанными, боргидриды металлов, такие как боргидрид натрия и цианоборгидрид натрия; комбинации газообразного водорода и катализатора, такого как палладий на угле, платина и никель Ренея, а также гидридные соединения, такие как литийалюминийгидрид и диизобутилалюминийгидрид. Из перечисленных восстановителей предпочтительным является никель Ренея. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 100C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч. Стадия E2. На этой стадии получают соединения формулы (XVI) взаимодействием соединений формулы (XV),которые являются коммерчески доступными с соединениями формулы (XIV). Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного влияния на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, воду; а также спирты, такие как метанол, этанол, пропанол,2-пропанол и бутанол. Из указанных растворителей предпочтительным является смесь воды и этанола. Реакцию осуществляют в присутствии основания. Как и в предыдущем случае, не существует особых ограничений на природу применяемого основания и любое основание, обычно применяемое в реакциях данного типа, также может быть применено и в данном случае. Примеры таких оснований включают, не ограничиваясь указанными, гидроксиды щелочных металлов, такие как гидроксид лития, гидро- 17010891 ксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, т-бутоксид калия; а также карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия. Из перечисленных оснований предпочтительным является карбонат калия. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 120C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч. Стадия E3. На этой стадии получают соединения формулы (XVII) путем превращения карбонильной группы соединения формулы (XVI) в цианогруппу в присутствии п-толуолсульфонилметилизоцианида. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного влияния на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран и диоксан; а также спирты, такие как метанол,этанол, пропанол, 2-пропанол и бутанол. Из указанных растворителей предпочтительным является смесь диметилового эфира этиленгликоля и этанола. Реакцию осуществляют в присутствии основания. Как и в предыдущем случае, не существует особых ограничений на природу применяемого основания и любое основание, обычно применяемое в реакциях данного типа, также может быть применено и в данном случае. Примеры таких оснований включают, не ограничиваясь указанными, алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия и т-бутоксид калия. Из перечисленных оснований предпочтительным является т-бутоксид калия. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 100C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах, в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч. Стадия E4. На этой стадии получают соединения формулы (IIIb) путем восстановления цианогруппы соединения формулы (XVII). Реакцию можно проводить в тех же условиях, которые описаны для стадии E1 способа E. Способ F. Данное описание иллюстрирует получение соединений формулы (VIII), в которых R2 представляет собой атом галогена. Схема реакции F На схеме реакции F R2a представляет собой атом галогена; R6 соответствует приведенному выше определению и R10 представляет собой аминозащитную группу, предпочтительно бензоильную группу. Стадия F1. На этой стадии получают соединение формулы (XIX), превращая карбонильную группу соединения формулы (XVIII) в эпоксидную группу. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного воздействия на ход реакции или участвующие в ней реагенты, а также что он способен- 18010891 растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, амиды, такие как формамид, N,N-диметилформамид,N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; сульфоксиды, такие как диметилсульфоксид или сульфолан. Из указанных растворителей предпочтительным является диметилсульфоксид. Реакцию осуществляют в присутствии основания. Как и в предыдущем случае, не существует особых ограничений на природу применяемого основания и любое основание, обычно применяемое в реакциях данного типа, также может быть применено и в данном случае. Примеры таких оснований включают, не ограничиваясь указанными, алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия и т-бутоксид калия; а также карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия. Из перечисленных оснований предпочтительным является т-бутоксид калия. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 100C, более предпочтительно от примерно 10 до примерно 50C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч, более предпочтительно от примерно 60 мин до примерно 12 ч. Стадия F2. На этой стадии получают соединение формулы (XX) взаимодействием галогеноводорода с соединением формулы (XIX). Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного воздействия на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид, N,N-диметилформамид,N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты. Из указанных растворителей предпочтительным является тетрагидрофуран. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 100C, более предпочтительно от примерно 10 до примерно 50C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч, более предпочтительно от примерно 60 мин до примерно 12 ч. Стадия F3. На данной стадии получают соединение формулы (XXI) взаимодействием соединения формулы(XX) с азидом натрия (F3-a) с последующим восстановлением азидогруппы (F3-b).(F3-a) реакция с азидом натрия. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного воздействия на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, галогенированные углеводороды, такие как дихлорметан,хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир,диизопропиловый эфир,тетрагидрофуран и диоксан; амиды,такие как формамид,N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; а также сульфоксиды, такие как диметилсульфоксид и сульфолан. Из указанных растворителей предпочтительным является N,N-диметилформамид. Перед добавлением азида натрия гидроксигруппу превращают в уходящую группу, такую как метилсульфонильная группа, трифторметилсульфонильная группа и 4-метилфенилсульфонильная группа,добавляя такие реагенты, как трифторметансульфонилхлорид, мезилхлорид и тозилхлорид. Из этих реагентов предпочтительным является мезилхлорид. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 120C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в осо- 19010891 бенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч.(F3-b) восстановление. Реакцию можно проводить в тех же условиях, которые описаны для стадии E1 способа E. Стадия F4. На этой стадии получают соединение формулы (VIIIa) введением аминозащитной группы R6 к первичной аминогруппе (F4-a) и селективным снятием аминозащитной группы R10 вторичной аминогруппы(F4-a) введение аминозащитной группы. Эта реакция подробно описана T.W. Greene et al. [Protective Groups in Organic Synthesis, 494-653,(1999)], причем это описание включено в настоящий патент с помощью ссылки. Далее в качестве примера описана типовая реакция с использованием т-бутоксикарбонильной защитной группы. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного воздействия на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, воду; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; а также сульфоксиды, такие как диметилсульфоксид и сульфолан. Из указанных растворителей предпочтительным является тетрагидрофуран. Реакцию осуществляют с применением реагента. Как и в предыдущем случае, не существует особых ограничений на природу применяемого реагента, и любой реагент, обычно применяемый в реакциях данного типа, также может быть применен и в данном случае. Примеры таких реагентов включают, не ограничиваясь указанными, ди-т-бутилкарбонат и 1-(т-бутоксикарбонил) бензтриазол. Из этих реагентов предпочтительным является ди-т-бутилкарбонат. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 120C, более предпочтительно от примерно 20 до примерно 80C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч, более предпочтительно от примерно 60 мин до примерно 12 ч.(F4-b) снятие защитной группы. Этот способ подробно описан T.W. Greene et al. Protective Groups in Organic Synthesis, 494-653,(1999), причем это описание включено в настоящий патент с помощью ссылки. Далее в качестве примера описан типовой способ с использованием бензоильной защитной группы в присутствии газообразного водорода и катализатора, такого как палладий на угле или платина. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного воздействия на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, галогенированные углеводороды, такие как дихлорметан,хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; спирты, такие как метанол, этанол, пропанол,2-пропанол и бутанол; а также простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан. Из указанных растворителей предпочтительным является метанол. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 120C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах, в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч.- 20010891 Способ G. Данное описание иллюстрирует получение соединений формулы (VIII), в которой R2 представляет собой гидроксигруппу. Схема реакции G На схеме реакции G каждый из символов R6 и R10 соответствует данному выше определению. Стадия G1. На этой стадии соединение формулы (XXII) получают взаимодействием карбонильной группы соединения формулы (XVIII), которое доступно коммерчески, с триметилсилилцианидом. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя, который следует применять, при условии, что он не оказывает нежелательного воздействия на ход реакции или участвующие в ней реагенты, а также что он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают, не ограничиваясь перечисленными, ароматические углеводороды, такие как бензол, толуол и нитробензол; галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран и диоксан; нитрилы, такие как ацетонитрил и бензонитрил; а также спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из указанных растворителей предпочтительным является толуол. Реакцию осуществляют с применением реагента. Как и в предыдущем случае, не существует особых ограничений на природу применяемого реагента и любой реагент, обычно применяемый в реакциях данного типа, также может быть применен и в данном случае. Примеры таких реагентов включают, не ограничиваясь указанными: кислоты Льюиса, такие как BF3, AlCl3, FeCl3, AgCl, ZnI2, Fe(NO3)3,CF3SO3Si(CH3)3, Yb(CF3SO3)3 и SnCl4; основания, такие как CaO; простые эфиры, такие как 18-краун-6; кислоты, такие как смола Amberlite Xad-4. Из этих реагентов предпочтительным является ZnI2. Реакция может проходить в широком диапазоне температур, и точная температура реакции не является решающей для настоящего изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходных веществ. Однако, как правило, удобно осуществлять эту реакцию при температурах от примерно 0 до примерно 100C. Время, необходимое для протекания реакции, также может варьироваться в широких пределах в зависимости от многих факторов, в особенности от температуры реакции, а также природы применяемых исходных веществ и растворителя. Однако при условии, что реакцию проводят в описанных выше предпочтительных условиях, обычно будет достаточен период времени от примерно 5 мин до примерно 24 ч. Стадия G2. На этой стадии соединение формулы (XXIII) получают превращением цианогруппы соединения формулы (XXII) в аминогруппу с последующим снятием защиты, образованной аминозащитной группойR10. Реакция может быть проведена в тех же условиях, которые описаны для стадии Е 1 способа E и стадии F4 способа F. Стадия G3. На этой стадии получают соединение формулы (VIIIb) с помощью защиты и снятия защиты аминогрупп соединения формулы (XXIII). Эта реакция может быть проведена в тех же условиях, которые описаны для стадии F4 способа F. Соединения формулы (I) и интермедиаты в описанных выше способах получения могут быть выделены и очищены с помощью общеизвестных методик, таких как перегонка, перекристаллизация или хроматографическая очистка. Соединения по настоящему изобретению, предназначенные для фармацевтического применения,могут вводиться в организм в виде кристаллических и аморфных продуктов. Они могут быть получены,например, в виде твердых прессованных лекарственных форм, порошков или пленок такими способами,как осаждение, кристаллизация, лиофилизация, распылительная сушка или сушка выпариванием. Для этой цели может применяться высушивание волнами микроволнового или радиочастотного диапазонов. Соединения по настоящему изобретению могут вводиться сами по себе или в комбинации с одним или несколькими другими веществами по настоящему изобретению, или в комбинации с одним или несколькими другими лекарственными средствами (или в виде любой их комбинации). В основном они- 21010891 будут вводиться в виде фармацевтической композиции или состава в сочетании с одним или несколькими фармацевтически приемлемыми носителями или наполнителями. Термин носитель или наполнитель в рамках настоящего изобретения используется для описания любого ингредиента, отличного от соединения (соединений) по настоящему изобретению. Выбор носителя или наполнителя в значительной степени будет зависеть от таких факторов, как конкретный способ введения, влияние наполнителя на растворимость и стабильность, а также тип лекарственной формы. Фармацевтические композиции, пригодные для доставки соединений по настоящему изобретению,и способы их получения легко понятны специалисту в данной области техники. Такие композиции и способы их получения могут быть найдены, например, в "Remington's Pharmaceutical Sciences", 19th Edition(Mack Publishing Company, 1995). Пероральное введение. Соединения по настоящему изобретению могут вводиться перорально. Пероральное введение может включать глотание, так что соединение поступает в желудочно-кишечный тракт, или же могут применяться буккальное или сублингвальное введение, с помощью которых соединение поступает в кровоток непосредственно изо рта. Составы, пригодные для перорального введения, включают твердые составы, такие как, например,таблетки, капсулы, содержащие мелкие частицы, жидкости или порошки, пастилки (в том числе заполненные жидкостью), жевательные резинки, мульти- и наночастицы, гели, твердые растворы, липосомы,пленки (включая прикрепляющиеся к слизистым оболочкам), овальные капсулы, спреи и жидкие составы. Жидкие составы включают, например, суспензии, растворы, сиропы и эликсиры. Такие составы могут применяться в качестве наполнителей в мягких или твердых капсулах и, как правило, включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, а также одно или несколько эмульгирующих средств и/или суспендирующих средств. Жидкие составы также могут быть получены путем растворения твердых, например, из упаковок саше. Соединения по настоящему изобретению также могут применяться в быстро растворяющихся или быстро дезинтегрирующихся лекарственных формах, как, например, в лекарственных формах, описанных Liang и Chen в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 (2001). Для таблетированных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от примерно 1 до примерно 80 мас.% от массы лекарственной формы, более типично от примерно 5 до примерно 60 мас.% от массы лекарственной формы. Помимо лекарственного средства, таблетки, как правило, содержат средство для дезинтеграции. Примеры средств для дезинтеграции включают натриевую соль гликолята крахмала, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, натриевую соль кросскармелозы, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшими алкилами, крахмал, предварительно желатинизированный крахмал и альгинат натрия. Как правило, средство для дезинтеграции будет включаться в состав в количестве от примерно 1 до примерно 25 мас.%,предпочтительно от примерно 5 до примерно 20 мас.% от общей массы лекарственной формы. Связующие вещества в основном применяют для придания составу таблетки способности к объединению в единое целое. Подходящие связующие вещества включают микрокристаллическую целлюлозу,желатин, сахара, полиэтиленгликоль, натуральные и синтетические камеди, поливинилпирролидон,предварительно желатинированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Кроме этого, таблетки могут содержать разбавители, такие как лактоза (моногидрат, моногидрат,высушенный распылительной сушкой, безводную и т.п.), маннит, ксилит, декстроза, сахароза, сорбит,микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Помимо этого, таблетки могут необязательно содержать ПАВ, такие как лаурилсульфат натрия и полисорбат 80, и средства для скольжения, такие как диоксид кремния и тальк. В случае наличия ПАВ их содержание может составлять от примерно 0,2 до примерно 5 мас.% от общей массы таблетки и средства для скольжения могут составлять от примерно 0,2 до примерно 1 мас.% от общей массы таблетки. Таблетки, как правило, содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества в основном содержатся в количестве от примерно 0,25 до примерно 10 мас.%, предпочтительно от примерно 0,5 до примерно 3 мас.% от общей массы таблетки. В число других возможных ингредиентов входят антиоксиданты, красители, вкусоароматические средства, консерванты и средства для маскирования вкуса. Типовые таблетки содержат до 80 мас.% лекарственного средства, от примерно 10 до примерно 90 мас.% связующего вещества, от примерно 0 примерно 85 мас.% разбавителя, от примерно 2 до примерно 10 мас.% дазинтегрирующего средства и от примерно 0,25 до примерно 10 мас.% смазывающего вещества. Смеси для получения таблеток можно прессовать непосредственно или с помощью вала. С другой стороны, смеси для получения таблеток или части этих смесей можно гранулировать во влажном, сухом или расплавленном состоянии, отверждать из расплава или экструдировать перед таблетированием.- 22010891 Окончательный состав может включать один или несколько слоев и может быть покрытым или не иметь покрытия; кроме этого он может быть инкапсулирован. Состав таблеток обсуждается в "Pharmaceutical Dosage Forms: Tablets", vol. 1 by H.Lieberman and L.Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X). Твердые составы для перорального введения могут быть рассчитаны на немедленное и/или модифицированное высвобождение лекарственного средства. Составы с модифицированным высвобождением включают составы с отсроченным, поддерживаемым, импульсным, управляемым, нацеленным и программируемым высвобождением. Подходящие для целей настоящего изобретения составы с модифицированным высвобождением описаны в патенте США 6106864. Подробности других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии, а также осмотические и покрытые частицы, следует искать вVerma et al., Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Применение жевательной резинки для достижения регулируемого высвобождения описано в WO 00/35298. Парентеральное введение. Соединения по настоящему изобретению также могут вводиться непосредственно в кровоток,мышцы и внутренние органы. Подходящие способы парентерального введения включают внутривенное,внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное,интрастернальное, внутричерепное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают устройства для инъекций с иглами (в том числе микроиглами), устройства для инъекции без игл и устройства для инфузии. Парентеральные составы, как правило, являются водными растворами, которые могут содержать наполнители, такие как соли, углеводы и буферирующие агенты (предпочтительно для поддержания pH в диапазоне от примерно 3 до примерно 9), но для некоторых применений более удобно создавать составы в виде стерильных неводных растворов или в виде сухих форм, применяемых в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Получение парентеральных составов в стерильных условиях, например с помощью лиофилизации,можно легко осуществить с применением стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Растворимость соединений формулы (I), применяемых в препаратах парентеральных растворов,может быть увеличена с помощью подходящих методик составления рецептур, таких как включение средств, увеличивающих растворимость. Составы для парентерального введения могут быть рассчитаны на немедленное и/или модифицированное высвобождение. Составы с модифицированным высвобождением включают составы с отсроченным, поддерживаемым, импульсным, управляемым, нацеленным и программируемым высвобождением. Таким образом, соединения по настоящему изобретению могут включаться в состав твердых и полутвердых препаратов, а также и тиксотропных жидкостей для введения в качестве имплантируемого депо,обеспечивающего модифицированное высвобождение действующего соединения. Примеры таких составов включают покрытые лекарственным средством эндопротезы сосудов и микросферы PGLA. Топическое введение. Соединения по настоящему изобретению также можно вводить топически на кожу или слизистую оболочку, т.е. дермально или трансдермально. Типовые составы для этой цели включают гели,гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, пластины, имплантаты, губки, волокна, бинты и микроэмульсии. Также можно применять липосомы. Типовые носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин,полиэтиленгликоль и пропиленгликоль. В состав могут быть включены средства для улучшения проникания - смотрите, например, Finnin and Morgan, J. Pharm. Sci., 88 (10), 955-958 (Октябрь 1999). Другие средства топического введения включают доставку с помощью электропорации, ионтофореза, фонофореза, сонофореза и инъекций с применением или без применения микроигл (например, Powderject, Bioject и т.п.). Составы для топического введения могут быть рассчитаны на немедленное и/или модифицированное высвобождение лекарственного средства. Составы с модифицированным высвобождением включают составы с отсроченным, поддерживаемым, импульсным, управляемым, нацеленным и программируемым высвобождением. Ингаляционное/интраназальное введение. Соединения по настоящему изобретению также могут вводиться интраназально или с помощью ингаляции, как правило, в форме сухого порошка (либо сами по себе в виде смеси, например в сухой смеси с лактозой, либо в виде смешанных компонентных частиц, например смешанные с фосфолипидами, такими как фосфатидилхолин) из ингалятора для сухих порошков, или в виде аэрозольного спрея из емкости, находящейся под давлением, насоса, распылителя, пульверизатора (предпочтительно пульверизатора, использующего электрогидродинамические силы для получения мелкодисперсного тумана), или аэрозольного аппарата с применением или без применения соответствующего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения порошок мо- 23010891 жет включать биоадгезивное средство, например хитозан или циклодекстрин. Емкость под давлением, насос, распылитель, пульверизатор или аэрозольный аппарат содержат раствор или суспензию соединения (соединений) по настоящему изобретению, включающие, например, этанол, водный этанол или другое подходящее средство для диспергирования, растворения или увеличения времени высвобождения действующего вещества, пропеллент (пропелленты) в качестве растворителя и,необязательно, ПАВ, такое как триолеат сорбитана, олеиновая кислота или олигомолочная кислота. Перед применением в сухом порошке или составе, являющемся суспензией, лекарственный продукт тонко измельчают до размера, подходящего для введения ингаляцией (как правило, менее 5 мкм). Этот результат может быть достигнут любым подходящим способом измельчения, таким как измельчение на спиральной мельнице, измельчение в кипящем слое, обработка сверхкритической жидкостью с образованием наночастиц, гомогенизация при высоком давлении или распылительная сушка. Составы капсул (изготовленных, например, из желатина или HPMC), блистерных упаковок и картриджей для применения в ингаляторах и инсуффляторах могут быть разработаны таким образом, чтобы они содержали смесь порошкообразного соединения по настоящему изобретению, подходящую порошкообразную основу, такую как лактоза или крахмал, и модификатор характеристик, такой как 2-лейцин,маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, причем последняя форма предпочтительнее. Другие подходящие наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий состав раствора для применения в пульверизаторе с использованием электрогидродинамических сил для получения тонкодисперсного тумана может содержать от примерно 1 до примерно 20 мкг соединения по настоящему изобретению на одно срабатывание, причем выделяемый при срабатывании объем может меняться от примерно 1 до примерно 100 мкл. Типовой состав может включать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Другие растворители, которые могут применяться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. К этим составам по настоящему изобретению, предназначенным для ингаляционного/внутриназального введения, могут быть добавлены подходящие вкусоароматические добавки, такие как ментол и левоментол, или подсластители, такие как сахарин или натриевая соль сахарина. Составы для ингаляционного/интраназального введения могут быть рассчитаны на немедленное и/или модифицированное высвобождение лекарственного средства, например поли-(DL)-молочная-гликолевая кислота(PGLA). Составы с модифицированным высвобождением включают составы с отсроченным, поддерживаемым, импульсным, управляемым, нацеленным и программируемым высвобождением. В случае ингаляторов сухих порошков и аэрозолей единица дозировки определяется с помощью клапана, который высвобождает отмеренное количество содержимого. Эти устройства в соответствии с настоящим изобретением, как правило, приспособлены для введения отмеренной дозы или одного пшика, содержащего от примерно 1 до примерно 100 мкг соединения формулы (I). Общая дневная доза, как правило, будет находиться в диапазоне от примерно 50 до примерно 20 мг, причем это количество может быть введено одной дозой или, чаще, отдельными дозами на протяжении дня. Ректальное/интравагинальное введение. Соединения по настоящему изобретению могут вводиться ректально или вагинально, например, в форме суппозиториев, пессариев или клизмы. Масло какао представляет собой традиционную основу суппозиториев, но можно использовать различные подходящие альтернативы. Составы для ректального/вагинального введения могут быть рассчитаны на немедленное и/или модифицированное высвобождение лекарственного средства. Составы с модифицированным высвобождением включают составы с отсроченным, поддерживаемым, импульсным, управляемым, нацеленным и программируемым высвобождением. Глазное/ушное введение. Соединения по настоящему изобретению также могут вводиться непосредственно в глаза или уши,как правило, в форме капель мелкодисперсной суспензии или раствора в изотоническом стерильном солевом растворе с подходящим значением pH. Другие составы, подходящие для глазного или ушного введения, включают мази, биоразрушаемые (например, усвояемые гелевые губки, коллаген) и небиоразрушаемые (например, силикон) имплантаты, пластины, линзы и системы микрочастиц или пузырьков, такие как ниосомы или липосомы. В состав может быть включен полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, полимеры на основе целлюлозы,например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или же полимеры на основе гетерополисахаридов, например желатиновая камедь, вместе с консервантом, таким как бензалконийхлорид. Такие составы также могут доставляться с помощью ионтофореза. Составы для глазного/ушного введения могут быть рассчитаны на немедленное и/или модифицированное высвобождение лекарственного средства. Составы с модифицированным высвобождением включают составы с отсроченным, поддерживаемым, импульсным, управляемым, нацеленным и программируемым высвобождением.- 24010891 Другие технологии. Соединения по настоящему изобретению могут быть объединены с растворимыми макромолекулярными объектами, такими как циклодекстрин и его подходящие производные или полимеры, содержащие полиэтиленгликоль, для улучшения их растворимости, скорости растворения, маскирования вкуса, биодоступности и/или стабильности для применения в любом из указанных выше способов введения. Например, было найдено, что комплексы лекарственное средство-циклодекстрин в основном применимы для большинства лекарственных форм и путей введения. Могут применяться как комплексы включения, так и комплексы, не являющиеся комплексами включения. В качестве альтернативы непосредственному образованию комплекса с лекарственным средством циклодекстрин может быть применен в качестве вспомогательной добавки, т.е. как носитель, разбавитель или солюбилизатор. Более обычным для этих целей является применение альфа-, бета- и гамма-циклодекстринов, примеры которых могут быть найдены в международных заявках на патентWO 91/11172, WO 94/02518 и WO 98/55148. Составная часть комплектов. Ввиду того, что может быть желательно введение комбинации действующих соединений, например, с целью лечения конкретного заболевания или состояния, в объем настоящего изобретения входит такой способ применения, при котором две или несколько фармацевтических композиции, хотя бы одна из которых содержит соединение по настоящему изобретению, могут быть легко объединены в форму комплекта, подходящего для совместного введения этих композиций. Таким образом, комплект по настоящему изобретению включает две или более отдельные фармацевтические композиции, хотя бы одна из которых содержит соединение формулы (I) по настоящему изобретению и средства для отдельного хранения указанных композиций, такие как контейнер, разделенная на отсеки бутыль или разделенный на отсеки пакет из фольги. Примером такого комплекта является хорошо известная блистерная упаковка, применяемая для упаковки таблеток, капсул и т.п. Комплект по настоящему изобретению является особенно подходящим для введения различных лекарственных форм, например перорального или парентерального, для введения отдельных композиций в различных интервалах дозировки или для титрования отдельных композиций по отношению друг к другу. Для содействия соблюдению правовых норм комплект, как правило, включает указания по применению и может быть снабжен так называемой памяткой. Дозировка. В случае введения людям общая дневная доза соединений по настоящему изобретению, безусловно зависящая от способа введения, как правило, находится от примерно 0,05 до примерно 100 мг, предпочтительно от примерно 0,1 до примерно 50 мг и более предпочтительно от примерно 0,5 до примерно 20 мг. Например, пероральное введение может потребовать общей дневной дозы от примерно 1 до примерно 20 мг, тогда как внутривенное введение может потребовать дозировки лишь от примерно 0,5 до примерно 10 мг. Общая дневная доза может быть введена одной дозой или отдельными дозами. Эти дозировки относятся к среднему человеку, имеющему массу от примерно 65 до примерно 70 кг. Врач без труда будет способен определить дозировку для субъектов, чей вес находится за пределами этого диапазона, а также для детей младшего возраста и престарелых. Комбинации. Как обсуждалось выше, соединения по настоящему изобретению проявляют активность агонистов 5-HT4. Агонисты 5-HT4 по настоящему изобретению могут быть успешно скомбинированы хотя бы с одним из других фармакологически активных агентов или соединений, в частности, при лечении гастроэзофагеальной рефлюксной болезни. Например, агонист 5-HT4, в частности соединение формулы (I) либо его фармацевтически приемлемая соль или сольват, определенные выше, могут вводиться одновременно,последовательно или отдельно, в комбинации с одним или несколькими фармакологически активными агентами, выбранными из:(i) антагонистов гистаминового рецептора H2, например ранитидина, лафутидина, низатидина, циметидина, фамотидина и роксатидина;(v) средств для защиты слизистых оболочек, например полапрецинка, экабета натрия, ребамипида,тепренона, цетраксата, сукралфата, хлорпиллин меди и плаунотола;(хх) селективных ингибиторов обратного захвата серотонина, например сертралина, эскиталопрама,флуоксетина, нефазодона, флувоксамина, циталопрама, милнаципрана, пароксетина, венлафаксина, трамадола, сибутрамина, дулоксетина, десвенлафаксина и дапоксетина;(R,9R)-7-[3,5-бис-(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7H[1,4]диазоцино[2,1-g][1,7]нафтридин-6-13-диона (TAK-637); 5-[(2R,3S)-2-[(1R)-1-[3,5-бис-(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869); ланепитанта, дапитанта и 3-2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S,3S). Способы оценки биологической активности. Сродство соединений по настоящему изобретению к связыванию с рецептором 5-HT4 определяли с помощью следующих методик.(1) Связывание с человеческим 5-HT4. Человеческие 5-HT4(d) трансфецированные клетки HEK293 получали и выращивали самостоятельно. Собранные клетки суспендировали в 50 мМ HEPES (pH 7,4 при 4C) с добавкой коктейля ингибитора протеазы (Boehringer, разбавление 1:1000) и гомогенизировали в течение 30 с на льду, применяя ручной измельчитель Polytron PT 1200, установленный на полную мощность. Гомогенаты центрифугировали при 40000g при 4C в течение 30 мин. Затем частицы осадка повторно суспендировали в 50 мМ HEPES(pH 7,4 при 4C) и центрифугировали еще раз таким же образом. Полученные частицы осадка вновь суспендировали в подходящем объеме 50 мМ HEPES (pH 7,4 при 25C), гомогенизировали, делили на аликвоты и хранили при -80C до использования. Аликвоту мембранных фракций использовали для определения концентрации белка, применяя набор для определения белка BCA (PIERCE) и считыватель планшетов ARVOsx (Wallac). Для экспериментов по связыванию 25 мкл исследуемых соединений инкубировали с 25 мкл[3H]-GR113808 (Amersham, конечное содержание 0,2 нМ), а также с растворами суспензий 150 мкл гомогената мембран и гранулами WGA-SPA (Amersham) (10 мкг белка и 1 мг гранул SPA/лунку) в течение 60 мин при комнатной температуре. Неспецифическое связывание определяли с помощью 1 мкМGR113808 (Tocris) при конечной концентрации. Инкубирование прерывали центрифугированием при 1000 об/мин.- 26010891 Связанную рецептором радиоактивность количественно определяли подсчетом импульсов с помощью счетчика планшетов MicroBeta (Wallac). Все соединения, описанные в примерах, демонстрировали сродство к рецептору 5-HT4.(2) Связывание с человеческим 5-HT4. Человеческие 5-HT4(d) трансфецированные клетки HEK293 получали и выращивали самостоятельно. Собранные клетки суспендировали в 50 мМ буфере Tris (pH 7,4 при 4C) с добавкой коктейля ингибитора протеазы (Boehringer, разбавление 1:1000) и гомогенизировали в течение 30 с на льду, применяя ручной измельчитель Polytron PT 1200, установленный на полную мощность. Гомогенаты центрифугировали при 40000g при 4C в течение 10 мин. Затем частицы осадка повторно суспендировали в 50 мМ буфереTris (pH 7,4 при 4C) и центрифугировали еще раз таким же образом. Полученные частицы осадка вновь суспендировали в подходящем объеме 50 мМ буфера Tris (pH 7,4 при 25C), содержащем 10 мМ MgCl2,гомогенизировали, делили на аликвоты и хранили при -80C до использования. Аликвоту мембранных фракций использовали для определения концентрации белка, применяя набор для определения белкаBCA (PIERCE) и считыватель планшетов ARVOsx (Wallac). Для экспериментов по связыванию 50 мкл исследуемых соединений инкубировали с 50 мкл[3H]5-HT (Amersham, конечное содержание 8,0 нМ) и 400 мкл гомогената мембран (300 мкг белка/пробирку) в течение 60 мин при комнатной температуре. Неспецифическое связывание определяли с помощью 50 мкМ GR113808 (Tocris) при конечной концентрации. Все инкубирования прерывали быстрой вакуумной фильтрацией через бумагу из стекловолокна, пропитанную 0,2% PEI, используя коллектор BRANDEL, с последующим трехкратным промыванием 50 мМ буфера Tris (pH 7,4 при 25C). Связанную рецептором радиоактивность количественно определяли подсчетом сцинтилляции жидкости,используя счетчик Packard LS. Все соединения, описанные в примерах, демонстрировали сродство к рецептору 5-HT4. Индуцированное агонистом повышение выработки cAMP в человеческих 5-HT4(d) трансфецированных клетках HEK293. Человеческие 5-HT4(d) трансфецированные клетки HEK293 получали самостоятельно. Клетки выращивали при 37C в атмосфере с 5% содержанием CO2 в DMEM с добавками 10% FCS, 20 мМ HEPES(pH 7,4), 200 мкг/мл гигромицина B (Gibco), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина. Клетки выращивали до 60-80% конфлюэнтности. За один день до обработки исследуемыми соединениями диализованный FCS (Gibco) заменяли на нормальный и инкубировали клетки в течение ночи. Соединения помещали в 96-луночные планшеты (12,5 мкл/лунка). Клетки собирали PBS/1 мМ ЭДТА,центрифугировали и промывали PBS. В начале анализа клеточный осадок повторно суспендировали в(Sigma) при концентрации 1,6105 клеток/мл и оставляли на 15 мин при комнатной температуре. Реакцию инициировали добавлением клеток в планшеты (12,5 мкл/лунка). После инкубирования в течение 15 мин при комнатной температуре добавляли 1% Triton X-100 для прекращения реакции (25 мкл/лунка),и планшеты оставляли при комнатной температуре на 30 мин. Осуществляли гомогенное определениеcAMP на основе флуоресценции с разрешением по времени (Shering) в соответствии с инструкцией производителя. Для измерения HTRF (возбуждение 320 нм, эмиссия 665 нм/620 нм, задержка 50 мкс, временное окно 400 мкс) применяли мультиметочный счетчик ARVOsx (Wallac). Данные анализировали,основываясь на соотношении интенсивности флуоресценции каждой лунки при 620 и 665 нм, с последующим количественным определением cAMP путем использования стандартной кривой cAMP. Увеличение выработки cAMP, вызванное каждым соединением, нормализовали по отношению к количествуcAMP, вырабатываемому под действием 1000 нМ серотонина (Sigma). Все соединения, описанные в примерах, демонстрировали активность агонистов рецептора 5-HT4. Связывание человеческого дофетилида. Человеческие HERG трансфецированные клетки HEK293S получали и выращивали самостоятельно. Собранные клетки суспендировали в 50 мМ Tris-HCl (pH 7,4 при 4C) и гомогенизировали в течение 20 с на льду, применяя ручной измельчитель Polytron PT 1200, установленный на полную мощность. Гомогенаты центрифугировали при 48000g при 4C в течение 20 мин. Затем частицы осадка вновь суспендировали, гомогенизировали и цетрифугировали еще раз аналогичным способом. Полученные в итоге частицы осадка вновь суспендировали в подходящем объеме 50 мМ Tris-HCl, 10 мМ KCl, 1 М MgCl2(pH 7,4 при 4C), гомогенизировали, делили на аликвоты и хранили при -80C до использования. Аликвоту мембранных фракций использовали для определения концентрации белка, применяя набор для определения белка BCA (PIERCE) и считыватель планшетов ARVOsx (Wallac). Анализы связывания проводили в общем объеме 200 мкл в 96-луночных планшетах. 20 мкл исследуемых соединений инкубировали с 20 мкл [3H]-дофетилида (Amersham, итоговое содержание 5 нМ) и 160 мкл гомогената мембран (25 мг белка) в течение 60 мин при комнатной температуре. Неспецифическое связывание определяли с помощью 10 мкМ дофетилида при конечной концентрации. Инкубирование прерывали быстрой вакуумной фильтрацией через предварительно пропитанный фильтр 0,5% GF/BBetaplate, применяя коллектор клеток Skarton с 50 мМ Tris-HCl, 10 мМ KCl, 1 мМ MgCl2, pH 7,4 при 4C.- 27010891 Фильтры высушивали, помещали в пакеты для образцов и заполняли Betaplate Scint. Связанную на фильтре радиоактивность подсчитывали счетчиком Wallac Betaplate. Проницаемость Caco-2. Проницаемость Caco-2 измеряли в соответствии со способом, описанным в Shiyin, Yee, Pharmaceutical Research, 763 (1997). Клетки Caco-2 выращивали на фильтрующих подложках (Falcon HTS multiwell insert system) в течение 14 дней. Культуральную среду удаляли из обоих отсеков - апикального и базолатерального, и монослои преинкубировали с предварительно подогретыми 0,3 мл апикального буфера и 1,0 мл базолатерального буфера в течение 0,5 ч при 37C в вибрационной водяной бане при 50 циклах/мин. Апикальный буфер состоял из Hanks Balanced Salt Solution, 25 мМ моногидрата D-глюкозы, 20 мМ MES BiologicalBuffer, 1,25 мМ CaCl2 и 0,5 мМ MgCl2 (pH 6,5). Базолатеральный буфер состоял из Hanks Balanced Salt(pH 7,4). В конце преинкубирования среды удаляли и в апикальный отсек добавляли раствор исследуемого соединения (10 мкМ) в буфере. Вставки на 1 ч перемещали в ячейки, содержащие свежий базолатеральный буфер. Концентрацию лекарственного средства в буфере измеряли способом ЖХ/МС. Скорость потока (F, масса/время) рассчитывали, исходя из наклона кривой интегрального поступления субстрата на сторону приемника, и рассчитывали кажущийся коэффициент проницаемости (Рарр) из следующего равенства: Рарр (см/с) = (FVD)/(SAMD),где SA означает площадь поверхности для переноса вещества (0,3 см 2);VD означает объем, из которого поступает вещество (0,3 мл);MD означает общее количество лекарственного вещества на исходной стороне в момент времениt=0. Все данные представляют собой средние значения для 2 измеренных вставок. Целостность монослоя определяли по переносу Lucifer Yellow. Время полужизни в микросомах печени человека (HLM). Исследуемые соединения (1 мкМ) инкубировали с 3,3 мМ MgCl2 и 0,78 мг/мл HLM (HL101) в 100 мМ калиевого фосфатного буфера (pH 7,4) при 37C на 96-луночном планшете с глубокими лунками. Реакционные смеси делили на две группы: группу не-Р 450 и группу Р 450. NADPH добавляли только в реакционные смеси группы Р 450. Аликвоты образцов группы Р 450 отбирали в моменты времени 0, 10, 30 и 60 мин, где момент времени 0 мин соответствовал времени, когда NADPH добавляли в реакционные смеси группы Р 450. Аликвоты образцов группы не-Р 450 отбирали в моменты времени -10 и 65 мин. Собранные аликвоты экстрагировали ацетонитрильным раствором, содержащим внутренний стандарт. Осажденный белок уплотняли вращением в центрифуге (2000 об/мин, 15 мин). Концентрацию соединения в надосадочной жидкости измеряли в системе ЖХ/МС/МС. Величину времени полужизни получали построением графика зависимости натурального логарифма соотношения площадей пиков соединений к внутреннему стандарту от времени. Наклон линии, наилучшим образом соответствующей полученным точкам, давал скорость метаболизма (k). Полученную величину пересчитывали в значение времени полужизни, используя следующее равенство: время полужизни = ln2/k. Примеры Настоящее изобретение иллюстрировано следующими неограничивающими примерами, в которых,если не указано иначе, все реагенты коммерчески доступны, все операции выполняли при комнатной температуре или температуре окружающей среды, т.е. в диапазоне примерно 18-25C; выпаривание растворителя проводили с применением роторного испарителя при пониженном давлении при температуре бани примерно до 60C; за ходом реакций следили с помощью тонкослойной хроматографии (ТСХ) и времена протекания реакций приведены лишь в качестве иллюстрации; указанные температуры плавления не откорректированы (полиморфизм может приводить к отличающимся температурам плавления); структуру и чистоту всех выделенных соединений подтверждали хотя бы одной из следующих методик: ТСХ (Merck silica gel 60 F254 предварительно покрытые пластины для ТСХ или Merck NH2 F254s предварительно покрытые пластины для ВЭТСХ), масс-спектрометрией, ядерным магнитным резонансом (ЯМР),инфракрасными абсорбционными спектрами (ИК) или микроанализом. Выходы указаны только для иллюстративных целей. Колоночную флэш-хроматографию проводили с использованием Merck silica gel 60(230-400 меш ASTM) или Fuji Silysia Chromatex DU 3050 (Amino Type, 3050 мкм). Данные масс-спектрометрии низкого разрешения (EI) регистрировали на масс-спектрометре Integrity (Waters) или масс-спектрометре Automass 120 (JEOL). Данные масс-спектрометрии низкого разрешения (ESI) получали на масс-спектрометре ZMD2 (Waters) или масс-спектрометре Quattro II (Micromass). Данные ЯМР регистрировали на 270 МГц спектрометре (JEOL JNM-LA270) или 300 МГц спектрометре (JEOLJNM-LA300), используя в качестве растворителя дейтерированный хлороформ (99,8% D) или диметилсульфоксид (99,9% D), если не указано другое, относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта в миллионных долях (м.д.); стандартными аббревиатурами являются: s=синглет,- 28010891d=дублет, t=триплет, q=квартет, m=мультиплет, br.=уширенный и т.д. ИК-спектры регистрировали на инфракрасном спектрометре Shimazu (IR-470). Оптическое вращение измеряли с использованием цифрового поляриметра JASCO DIP-370 (Japan Spectroscopic Co., LTD). Принятые обозначения: т.кип. - температура кипения,т.пл. - температура плавления,экв. - эквивалент(ы). Картину дифракции рентгеновских лучей на кристаллическом порошке (PXRD) регистрировали с применением порошкового рентгеновского дифрактометра Rigaku RINT-TTR, снабженного устройством для автоматической замены образцов, 2 - гониометром, щелями расхождения пучков, вторичным монохроматором и сцинтилляционным счетчиком. Образцы готовили для анализа, упаковывая порошок в алюминиевый резервуар для образцов. Образец вращали со скоростью 60,00 об/мин и сканировали со скоростью 4/мин при комнатной температуре с излучением Cu-K. Пример 1. 4-[4-([(3-Изопропил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилтетрагидро-2H-пиран-4-карбоновая кислота Стадия 1. трет-Бутил 4-цианотетрагидро-2H-пиран-4-карбоксилат. К перемешиваемой суспензии NaH (17,7 г, 0,443 моль) в ДМФА (200 мл) по каплям добавляли трет-бутилцианоацетат (25,0 г, 0,177 моль) в ДМФА (100 мл) при 0C в атмосфере N2. Смеси давали нагреться до комнатной температуры и перемешивали в течение 1 ч. Затем к смеси добавляли бис-(2-бромэтиловый)эфир (49,3 г, 0,177 моль) и полученную смесь перемешивали при 90C в течение 24 ч. После охлаждения до 0C смесь гасили водой (100 мл). Летучие компоненты удаляли выпариванием и осаждали остаток смесью EtOAc-толуол (1:2, 500 мл) и воды (500 мл). Органическую фазу три раза промывали водой (500 мл), высушивали над Na2SO4, фильтровали и упаривали. Твердый остаток промывали гексаном и высушивали в вакууме, получая 19,0 г (57%) указанного в заглавии соединения в виде белых кристаллов. 1(9H, с). Стадия 2. трет-Бутил 4-(аминометил)тетрагидро-2H-пиран-4-карбоксилат. Смесь трет-бутил 4-цианотетрагидро-2H-пиран-4-карбоксилата (18,95 г, 0,08 97 моль, стадия 1) и Ni Ренея (1,00 г) в метаноле (200 мл) обрабатывали газообразным водородом (3 атм) при комнатной температуре в течение 12 ч. Затем смесь фильтровали через подушку целита и фильтрат концентрировали в вакууме, получая 16,01 г (83%) указанного в заглавии соединения в виде желтого сиропа. 1H-ЯМР (CDCl3) : 3,86 (2H, дт, J=4,1, 11,4 Гц), 3,48 (2H, дт, J=2,5, 11,5 Гц), 2,75 (2H, с), 2,03 (2H,ушир.д, J=10,7 Гц), 1,55-1,35 (13H, м, включая 9H, с, 1,49 м.д.). Стадия 3. трет-Бутил 4-[(4-оксопиперидин-1-ил)метил]тетрагидро-2H-пиран-4-карбоксилат. К кипящей смеси трет-бутил 4-(аминометил)тетрагидро-2H-пиран-4-карбоксилата (8,00 г,0,0372 моль, стадия 2) и K2CO3 (0,51 г, 0,0372 моль) в EtOH-H2O (2:1, 240 мл) по каплям добавляли йодид 1-этил-1-метил-4-оксопиперидиния (12,0 г, 0,0445 моль, J. Org.Chem. 1995, 60, 4324-4330) в EtOH-H2O(2:1, 150 мл) и полученную смесь перемешивали при той же температуре (кипячение с обратным холодильником) в течение 1 ч. После охлаждения до комнатной температуры растворитель удаляли в вакууме. Остаток выливали в насыщенный водный раствор NaHCO3 (200 мл) и смесь экстрагировали CH2Cl2(200 мл 3). Экстракты высушивали над Na2SO4 и концентрировали. Остаток хроматографировали на колонке с силикагелем, элюируя смесью гексан/этилацетат (3:1 до 2:1) и получали 10,77 г (98%) указанного в заглавии соединения в виде бесцветного сиропа.H ЯМР (CDCl3) : 3,84 (2H, ушир.д, J=11,4 Гц), 3,50 (2H, дт, J=2,0, 11,7 Гц), 2,85 (4H, т, J=5,9 Гц),2,61 (2H, с), 2,39 (4H, т, J=6,1 Гц), 2,05 (2H, д, J=11,5 Гц), 1,75-1,45 (11H, м, включая 9H, с, 1,49 м.д.). Стадия 4. трет-Бутил 4-[(4-цианопиперидин-1-ил)метил]тетрагидро-2H-пиран-4-карбоксилат. К перемешиваемому раствору трет-бутил 4-[(4-оксопиперидин-1-ил)метил]тетрагидро-2H-пиран-4 карбоксилата (8,77 г, 0,0295 моль, стадия 3) в 1,2-диметоксиэтане (250 мл) добавляли п-толуолсульфонилметилизоцианид (11,51 г, 0,0590 моль), EtOH (3,96 мл, 0,0678 моль) и т-BuOK (11,58 г, 0,1032 моль) при 0C. Полученную смесь перемешивали при 50C в течение 16 ч. После охлаждения реакционную смесь выливали в насыщенный водный раствор NaHCO3 (200 мл) и смесь экстрагировали CH2Cl2(200 мл 3). Экстракты высушивали над Na2SO4 и концентрировали. Остаток хроматографировали на колонке с силикагелем, элюируя смесью гексан/этилацетат (2:1) и получали 5,76 г (63%) указанного в заглавии соединения в виде желтого сиропа.
МПК / Метки
МПК: C07D 401/12, A61K 31/4184, C07D 401/14, C07D 405/14
Метки: производные, кислоты, бензимидазолонкарбоновой
Код ссылки
<a href="https://eas.patents.su/30-10891-proizvodnye-benzimidazolonkarbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензимидазолонкарбоновой кислоты</a>
Предыдущий патент: Способ предотвращения тромбоэмболических расстройств
Следующий патент: Нерекомбинантные штаммы saccharomyces, которые растут на ксилозе
Случайный патент: Новое применение пептидных соединений для лечения боли при болезненной диабетической нейропатии


































