Композиции для лечения ретинол-ассоциированных заболеваний
Формула / Реферат
1. Композиция для лечения возрастной макулярной дегенерации или дистрофии млекопитающего, содержащая эффективное количество соединения, модулирующего уровень или активность RBP или TTR в сыворотке млекопитающего, и фармацевтически приемлемый носитель.
2. Композиция по п.1, в которой первое соединение ингибирует связывание ретинола с RBP.
3. Композиция по п.1, в которой первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего.
4. Композиция по п.1, в которой первое соединение ингибирует трансляцию RBP или TTR у млекопитающего.
5. Композиция по п.1, в которой первое соединение увеличивает клиренс RBP или TTR у млекопитающего.
6. Композиция по п.1, в которой первое соединение ингибирует связывание RBP с TTR.
7. Композиция по п.1, пригодная для орального, внутривенного, ионтофорезного или инъекционного введения.
8. Композиция по п.1, причем млекопитающее является человеком.
9. Композиция по п.1, в которой макулярная дегенерация представляет собой сухую форму возрастной макулярной дегенерации.
10. Композиция по п.1, в которой макулярная дегенерация включает географическую атрофию по крайней мере в одном глазу млекопитающего.
11. Композиция по п.1, в которой соединение имеет структуру формулы (II)
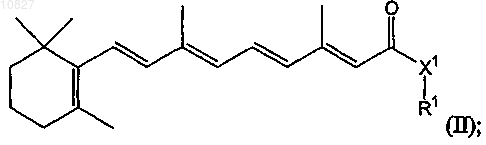
где X1 выбран из группы, включающей NR2, О, S, CHR2; R1 представляет собой (CHR2)x-L1-R3, где х равен 0, 1, 2 или 3; L1 представляет собой одинарную связь или -С(О)-; R2 представляет собой молекулу, выбранную из группы, включающей Н, (С1-С4)алкил, F, (С1-С4)фторалкил, (С1-С4)алкокси, -С(О)ОН,
-C(O)NH2, -(С1-С4)алкиламин, -С(О)-(С1-С4)алкил, -С(О)-(С1-С4)фторалкил, -С(O)-(С1-С4)алкиламин и
-C(O)-(C1-С4)алкокси; и R3 представляет собой Н или молекулу, необязательно замещенную 1-3 заместителями, независимо выбранными из группы, включающей (С2-С7)алкенил, (С2-С7)алкинил, арил, (С3-С7)циклоалкил, (С5-С7)циклоалкенил и гетероциклы; или его активный метаболит, или его фармацевтически приемлемое пролекарство или сольват.
12. Композиция по п.11, в которой соединение имеет структуру формулы (II), а X1 представляет собой NR2, где R2 представляет собой Н или (С1-С4)алкил.
13. Композиция по п.11, в которой соединение имеет структуру формулы (II), где х равен 0.
14. Композиция по п.11, в которой соединение имеет структуру формулы (II), где R3 представляет собой необязательно замещенный арил.
15. Композиция по п.11, в которой соединение имеет структуру формулы (II), где X1 представляет собой NH, a R3 представляет собой необязательно замещенный арил.
16. Композиция по п.15, в которой арильная группа имеет один заместитель, выбранный из группы, включающей галоген, ОН, О(С1-С4)алкил, NH(С1-С4)алкил, О(С1-С4)фтор и N[(С1-С4)алкил]2.
17. Композиция по п.11, в которой соединение представляет собой N-(4-гидроксифенил)ретинамид или N-(4-метоксифенил)ретинамид.
18. Композиция по любому из пп.1-17, предназначенная для системного применения.
19. Применение композиции по п.1 с другим соединением, выбранным из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротеноид, отрицательно заряженный фосфолипид, ингибитор комплемента, рыбий жир или статин.
20. Композиция для лечения витреоретинального заболевания у человека, содержащая эффективное количество соединения, модулирующего уровни или активность RBP или TTR в сыворотке человека, и фармацевтически приемлемый носитель.
21. Композиция по п.20, в которой соединение ингибирует связывание ретинола с RBP.
22. Композиция по п.20, в которой первое соединение ингибирует связывание RBP с TTR.
23. Композиция по п.20, отличающаяся тем, что она пригодна для орального, внутривенного, ионтофорезного или инъекционного введения.
24. Композиция по п.20, отличающаяся тем, что витреоретинальные заболевания выбраны из диабетической ретинопатии, макулярной дегенерации, ретинопатии беременных и пигментного ретинита.
25. Композиция по п.20, в которой соединение имеет структуру формулы (II)
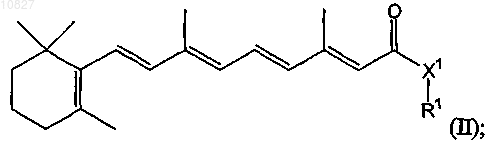
где X1 выбран из группы, включающей NR2, О, S, CHR2; R1 представляет собой (CHR2)x-L1-R3, где х равен 0, 1, 2 или 3; L1 представляет собой одинарную связь или -С(О)-; R2 представляет собой молекулу, выбранную из группы, включающей Н, (C1-С4)алкил, F, (С1-С4)фторалкил, (С1-С4)алкокси, -С(О)ОН,
-C(O)NH2, -(С1-С4)алкиламин, -С(О)-(С1-С4)алкил, -С(О)-(С1-С4)фторалкил, -С(О)-(С1-С4)алкиламин и
-C(O)-(C1-С4)алкокси; и R3 представляет собой Н или молекулу, необязательно замещенную 1-3 заместителями, независимо выбранными из группы, включающей (С2-С7)алкенил, (С2-С7)алкинил, арил, (С3-С7)циклоалкил, (С5-С7)циклоалкенил и гетероциклы; или его активный метаболит, или его фармацевтически приемлемое пролекарство или сольват.
26. Композиция по п.25, в которой соединение имеет структуру формулы (II), а X1 представляет собой NR2, где R2 представляет собой Н или (С1-С4)алкил.
27. Композиция по п.25, в которой соединение имеет структуру формулы (II), где x равен 0.
28. Композиция по п.25, в которой соединение имеет структуру формулы (II), где R3 представляет собой необязательно замещенный арил.
29. Композиция по п.25, в которой соединение имеет структуру формулы (II), где X1 представляет собой NH, a R3 представляет собой необязательно замещенный арил.
30. Композиция по п.29, в которой арильная группа имеет один заместитель, выбранный из группы, включающей галоген, ОН, О(С1-С4)алкил, NH(C1-C4)алкил, О(С1-С4)фтор и N[(С1-С4)алкил]2.
31. Композиция по п.29, в которой соединение представляет собой N-(4-гидроксифенил)ретинамид или N-(4-метоксифенил)ретинамид.
32. Композиция по любому из пп.20-31, предназначенная для системного применения.
33. Применение композиции по п.20 вместе с другим соединением, выбранным из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротеноид, отрицательно заряженный фосфолипид, ингибитор комплемента, рыбий жир или статин.
Текст
010827 Область техники Способы и композиции, заявленные в соответствии с настоящим изобретением, направлены на лечение и профилактику ретинол-ассоциированных заболеваний у пациента путем модуляции активности или доступности ретинол-связывающего белка (RBP) и транстиретина (TTR) у пациента. Предпосылки создания изобретения Ретиноиды необходимы для поддержания нормального роста, развития, иммунитета, размножения,зрения и других физиологических процессов. Напротив, аномальная продукция или процессинг ретиноидов связаны с заболеваниями. Например, у более чем 100 миллионов детей по всему миру отмечается дефицит витамина А, что приводит к слепоте и даже к смерти. Избыточное содержание витамина А в тканях и органах-мишенях,таких как глаз, может также приводить к слепоте и различным заболеваниям сетчатки, включая макулярную дегенерацию. Большое число патологических состояний, обозначаемых общим термином витреоретинальные заболевания, поражают стекловидное тело и сетчатку, которая находится в задних отделах глаза, включая ретинопатии и дегенерацию и дистрофию макулы. Макулярная дегенерация представляет собой группу заболеваний глаза, которые являются причиной слепоты у людей старше 55 лет, от данной патологии страдают более чем 10 миллионов американцев. Некоторые исследования предсказывают шестикратное увеличение числа новых случаев макулярной дегенерации в следующем десятилетии, что может приобрести характер эпидемии. Возрастная дегенерация или дистрофия макулы, особенно истощающее заболевание, приводит к прогрессирующей потере зрения и, в конечном итоге, к серьезному нарушению центрального зрения. Аномальные уровни витамина А и/или его ассоциированных транспортных белков (ретинолсвязывающего белка (RBP) и транстиретина (TTR также связаны с развитием других заболеваний,включая метаболические нарушения. Примером таких нарушений является диабет, при этом аномальные уровни ретинола характерны как для диабета 1-го, так и 2-го типа, и не встречаются у здоровых людей. К другим заболеваниям относятся ложные опухоли головного мозга (РТС, от англ. Pseudotumor cerebri),идиопатическая внутричерепная гипертензия (ПН, от англ. Idiopathic Intracranial Hypertension) и заболевания с вовлечением костей, включая цервикальный спондилоз, спинальный гиперостоз и диффузный идиопатический костный гиперостоз (DISH, от англ. Diffuse Idiopathic Skeletal Hyperostosis). Кроме того,витамин А и/или его ассоциированные транспортные белки, в частности TTR, могут играть роль в развитии заболеваний, связанных с нарушением укладки белков и их агрегации, включая болезнь Альцгеймера и системный амилоидоз. Заболевания, ассоциированные с нарушением обмена ретинола, остаются серьезной проблемой мирового здравоохранения. Таким образом, существует необходимость создания способов и композиций для лечения указанных заболеваний. Сущность изобретения В настоящем изобретении раскрыты способы и композиции для идентификации и определения агентов, которые модулируют активность и уровни ретинол-связывающего белка (RBP) или транстиретина (TTR) у млекопитающих. Кроме того, раскрыты способы идентификации соединений и терапевтических агентов, а также способы и композиции для лечения субъекта или пациента, страдающего от ретинол-ассоциированного заболевания, заключающиеся в введении указанных соединений и терапевтических агентов, при этом указанное введение приводит к модуляции уровней и активности RBP или TTR у субъекта или пациента. Также настоящее изобретение охватывает способы и композиции для лечения пациента, страдающего от ретинол-ассоциированного заболевания, заключающиеся в модуляции уровней или активности RBP или TTR у пациента путем введения указанных соединений. Согласно одному варианту осуществления настоящего изобретения способы и композиции, описанные здесь, предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются в введении млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует транскрипцию RBP или TTR у указанного млекопитающего, при этом указанная модуляция уровней или активности RBP или TTR приводит к уменьшению формирования полностью транс-ретиналя в глазу млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения агент выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты,С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, белки связывания содержащих цинк пальцеобразных областей, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции,описанные здесь, предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества ингибитора трансляции RBP или TTR, при этом такая модуляция уровней или активности RBP илиTTR приводит к уменьшению формирования полностью транс-ретиналя в глазу млекопитающего. Агент-1 010827 может быть выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонистыNHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, белки связывания Znпальцев, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции,описанные здесь, предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует связывание RBP с TTR в организме указанного млекопитающего, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования полностью транс-ретиналя в глазу млекопитающего. Модулирующий агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBPагент с TTR. Модулирующий агент может быть выбран из группы, включающей производные ретинила,полигалогенированные ароматические углеводороды, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, синтетические соединения, аналоги эндокринных гормонов, флавоноиды, нестероидные противовоспалительные средства, бивалентный ингибитор,сердечные агенты, пептидомиметики, аптамеры и антитела. Согласно одному варианту осуществления настоящего изобретения производное ретинила, заявленное в соответствии со способами и композициями настоящего изобретения, имеет следующую структуру: где X1 выбран из группы, включающей NR2, О, S, CHR2; R1 представляет собой (CHR2)x-L1-R3, где х равен 0, 1, 2 или 3; L1 представляет собой одинарную связь или -С(О)-; R2 представляет собой молекулу,выбранную из группы, включающей Н, (С 1-С 4)алкил, F, (С 1-С 4)фторалкил, (С 1-С 4)алкокси, -С(О)ОН,-C(O)NH2, -(С 1-С 4)алкиламин, -С(О)-(С 1-С 4)алкил, -С(О)-(С 1-С 4)фторалкил, -С(О)-(С 1-С 4)алкиламин и-С(О)-(С 1-С 4)алкокси; и R3 представляет собой Н или молекулу, факультативно замещенную 1-3 независимо выбранными заместителями, выбранными из группы, включающей (С 2-С 7)алкенил, (С 2-С 7)алкинил,арил, (С 3-С 7)циклоалкил, (С 5-С 7)циклоалкенил и гетероциклы; или активный метаболит, или фармацевтически доступное пролекарство или его сольват. Согласно одному варианту осуществления настоящего изобретения производное ретинила, заявленное в соответствии со способами и композициями настоящего изобретения, имеет следующую структуру: где X1 выбран из группы, включающей NR2, О, S, CHR2; R1 представляет собой (CHR2)x-L1-R3, где х равен 0, 1, 2 или 3; L1 представляет собой одинарную связь или -С(О)-; R2 представляет собой молекулу,выбранную из группы, включающей Н, (C1-С 4)алкил, F, (С 1-С 4)фторалкил, (С 1-С 4)алкокси, -С(О)ОН,-C(O)NH2, -(С 1-С 4)алкиламин, -С(О)-(С 1-С 4)алкил, -С(О)-(С 1-С 4)фторалкил, -С(О)-(С 1-С 4)алкиламин и-C(O)-(C1-С 4)алкокси; и R3 представляет собой Н или молекулу, факультативно замещенную 1-3 независимо выбранными заместителями, выбранными из группы, включающей (С 2-С 7)алкенил, (С 2-С 7)алкинил,арил, (С 3-С 7)циклоалкил, (С 5-С 7)циклоалкенил и гетероциклы; или активный метаболит, или фармацевтически доступное пролекарство или его сольват. Согласно дополнительным вариантам осуществления настоящего изобретения (а) X1 представляет собой NR2, где R2 представляет собой Н или (С 1-С 4)алкил; (b) х равен 0; (с) х равен 1 и L1 представляет собой -С(О)-; (d) R3 представляет собой факультативно замещенный арил; (е) R3 представляет собой факультативно замещенный гетероарил; (f) X1 представляет собой NH и R3 представляет собой факультативно замещенный арил, включая дополнительные варианты осуществления настоящего изобретения,согласно которым (i) арильная группа имеет один заместитель; (ii) арильная группа имеет один заместитель, выбранный из группы, включающей галоген, ОН, О(С 1-С 4)алкил, NH(C1-C4)алкил, О(С 1 С 4)фторалкил и N[(C1-C4)алкил]2; (iii) арильная группа имеет один заместитель, представляющий собой-2 010827 ОН; (v) арил представляет собой фенил; или (vi) арил представляет собой нафтил; (g) соединение имеет следующую структуру: или представляет собой его активный метаболит, или фармацевтически доступное пролекарство, или его сольват; (h) соединение представляет собой 4-гидроксифенилретинамид, или его активный метаболит,фармацевтически доступное пролекарство или сольват; (i) соединение представляет собой 4 метоксифенилретинамид, или (j) 4-оксофенретинид или его метаболит, фармацевтически доступное пролекарство или сольват. Согласно другому варианту осуществления настоящего изобретения введение соединения формулы(II) применяется для лечения офтальмологических заболеваний, поскольку позволяет снизить уровни ретинола в сыворотке крови пациентов. Согласно другим вариантам осуществления настоящего изобретения (а) эффективное количество соединения системно вводится млекопитающему; (b) эффективное количество соединения вводится млекопитающему перорально; (с) эффективное количество соединения вводится млекопитающему внутривенно; (d) эффективное количество соединения вводится млекопитающему в ткани глаза; (е) эффективное количество соединения вводится с помощью ионотопофореза; или (f) эффективное количество соединения вводится млекопитающему путем инъекции. Согласно другим вариантам осуществления настоящего изобретения млекопитающее является человеком, при этом указанные варианты подразумевают: (а) человек является носителем мутантного гена АВСА 4, отвечающего за болезнь Штаргардта, или человек является носителем мутантного гена ELOV4,отвечающего за болезнь Штаргардта, или имеет генетическую вариацию в факторе комплемента Н, ассоциированную с возрастной макулярной дегенерацией, или (b) человек страдает от офтальмологического заболевания или патологического состояния, выбранного из группы, включающей болезнь Штаргардта,рецессивный пигментный ретинит, географическую атрофию (при этом скотома не является единственным примером), фоторецепторную дегенерацию, сухую форму AMD, рецессивную дистрофию палочекколбочек, экссудативную (или влажную) форму возрастной макулярной дегенерации, дистрофию палочек и колбочек и пигментный ретинит. Согласно другим вариантам осуществления настоящего изобретения млекопитающее представляет собой животную модель дегенерации сетчатки. Согласно другим вариантам своего осуществления настоящее изобретение относится к способам,заключающимся во многократном введении эффективного количества агента, который модулирует связывание RBP с TTR в организме млекопитающего, согласно дополнительным вариантам осуществления настоящего изобретения: (i) интервал между многократными введениями составляет по крайней мере одну неделю; (ii) интервал между многократными введениями составляет по крайней мере один день;(iii) соединение вводится млекопитающему ежедневно; (iv) соединение вводится млекопитающему каждые 12 ч. Согласно другим или альтернативным вариантам осуществления настоящего изобретения способ заключается во введении лекарственного средства с перерывами, при этом введение соединения временно прекращают или вводимую дозу соединения на время уменьшают; по завершении перерыва введение соединения возобновляют. Продолжительность перерыва может составлять от 2 дней до 1 года. Согласно другим вариантам своего осуществления настоящее изобретение относится к способам,заключающимся во введении по крайней мере одного дополнительного агента, выбранного из группы,включающей индуктор продукции оксида азота, противовоспалительный агент, физиологически доступный антиоксидант, физиологически доступный минерал, отрицательно заряженный фосфолипид, кароретиноид, статин, антиангиогенетическое лекарственное средство, ингибитор матриксной металлопротеиназы, 13-цис-ретиноевую кислоту (включая производные 13-цис-ретиноевой кислоты), 11-цисретиноевую кислоту (включая производные 11-цис-ретиноевой кислоты), 9-цис-ретиноевую кислоту(включая производные 9-цис-ретиноевой кислоты) и производные ретиниламина. Согласно дополнительным вариантам осуществления настоящего изобретения:(a) дополнительный агент является индуктором образования оксида азота, включая те варианты осуществления настоящего изобретения, согласно которым индуктор образования оксида азота выбран из группы, включающей цитруллин, орнитин, нитрозилированный L-аргинин, нитрозилированный Lаргинин, нитрозилированный N-гидрокси-L-аргинин, нитрозилированный N-гидрокси-L-аргинин, нитрозилированный L-гомоаргинин и нитрозилированный L-гомоаргинин;(b) дополнительный агент является противовоспалительным агентом, включая те варианты осуществления настоящего изобретения, согласно которым противовоспалительный агент выбран из группы,включающей нестероидное противовоспалительное средство, ингибитор липоксигеназы, преднизолон,-3 010827 дексаметазон и ингибитор циклооксигеназы;(c) дополнительный агент представляет собой по крайней мере один физиологически доступный антиоксидант, включая те варианты осуществления настоящего изобретения, согласно которым физиологически доступный антиоксидант выбран из группы, включающей витамин С, витамин Е, бетакаротин, кофермент Q и 4-гидрокси-2,2,6,6-тетраметилпиперадин-N-оксил, или те варианты осуществления настоящего изобретения, согласно которым: (i) по крайней мере один физиологически доступный антиоксидант вводится вместе с агентом, который модулирует связывание RBP с TTR у указанного млекопитающего, или (ii) по крайней мере два физиологически доступных антиоксиданта вводятся вместе с агентом, который модулирует связывание RBP с TTR у указанного млекопитающего;(d) дополнительный агент представляет собой по крайней мере один физиологически доступный минерал, включая те варианты осуществления настоящего изобретения, согласно которым физиологически доступный минерал выбран из группы, включающей соединения цинка(III), соединения меди(II),соединения селена(II) или же те варианты осуществления настоящего изобретения, согласно которым млекопитающему вводится по крайней мере один физиологически доступный антиоксидант;(e) дополнительный агент представляет собой отрицательно заряженный фосфолипид, включая те варианты осуществления настоящего изобретения, согласно которым отрицательно заряженный фосфолипид представляет собой фосфатидилглицерол;(f) дополнительный агент представляет собой каротеноид, включая те варианты осуществления настоящего изобретения, согласно которым каротеноид выбран из группы, включающей лютеин и зеаксантин;(g) дополнительный агент представляет собой статин, включая те варианты осуществления настоящего изобретения, согласно которым статин выбран из группы, включающей розувастатин, питивастатин, симвастатин, правастатин, церивастатин, мевастатин, велостатин, флувастатин, компактин, ловастатин, далвастатин, флюиндостатин, аторвастатин, аторвастатин-кальций и дигидрокомпактин;(h) дополнительный агент представляет собой антиангиогенетическое лекарственное средство,включая те варианты осуществления настоящего изобретения, согласно которым антиангиогенетическое лекарственное средство представляет собой лекарственное средство Рхуфаб V2 (Rhufab V2), Триптофанил-тРНК-синтетазу и Анти-VEGF пегилированный аптамер, скваламин, анекортативный (anecortative) ацетат, пролекарство комбретастатина А 4, Макуген (Macugen), мифепристон, ацетонид триамцинолона субтенона, ацетонид интравитреального кристаллин-триамцинолона, AG3340, ацетонид фторцинолона и VEGF-Trap;(i) дополнительньш агент представляет собой ингибитор матриксной металлопротеиназы, включая те варианты осуществления настоящего изобретения, согласно которым ингибитор матриксной металлопротеиназы представляет собой тканевой ингибитор металлопротеиназ, 2-макроглобулин, тетрациклин,гидроксамат, хелатор, синтетический ММР фрагмент, сукцинил меркаптопурин, фосфонамидат, гидроксаминовую кислоту;(j) дополнительный агент представляет собой ингибитор комплемента, включая (только в качестве примера) антитела к С 1, С 2, С 3, С 4, С 5, С 6, С 7, С 8 и С 9, такие как описаны, например, в патентах США 5635178; 5843884; 5847082; 5853722 и у Rollins et al.; Transplantation, 60:1284-1292 (1995 (все источники литературы приведены здесь в качестве ссылок);(k) дополнительный агент представляет собой рыбий жир, включая (только в качестве примера) -3 жирные кислоты;(l) дополнительный агент представляет собой 13-цис-ретиноевую кислоту (включая производные 13-цис-ретиноевой кислоты); 11-цис-ретиноевую кислоту (включая производные 11-цис-ретиноевой кислоты) или 9-цис-ретиноевую кислоту (включая производные 9-цис-ретиноевой кислоты);(m) дополнительный агент представляет собой производное ретиниламина, включая производные полностью транс-ретиниламина, производные 13-цис-ретиниламина, производные 11-цис-ретиниламина или производные 9-цис-ретиниламина;(n) дополнительный агент вводится (i) перед введением агента, который модулирует связывание(о) дополнительный агент и агент, который модулирует связывание RBP с TTR у указанного млекопитающего, вводятся в составе одной фармацевтической композиции. Настоящее изобретение также относится к способам, заключающимся в осуществлении экстракорпорального реофереза млекопитающему. Настоящее изобретение также относится к способам, заключающимся в применении к млекопитающему способов лечения, выбранных из группы, включающей частичное перемещение сетчатки, фотодинамическую терапию, обработку друз лазером, хирургические вмешательства на макулярной зоне, хирургическое перемещение макулярной зоны, Phi-Motion-терапию,терапию протонным потоком, отслойку сетчатки и хирургические вмешательства на стекловидном теле,-4 010827 вдавливание склеры, хирургические вмешательства на субмакулярной зоне, транспупиллярную термотерапию, терапию с помощью фотосистемы I, стимуляцию микротоками, применение противовоспалительных агентов, РНК интерференцию, введение офтальмологических лекарственных препаратов, таких как фосфолин иодид, или эхотиофат, или ингибиторов карбон-ангидразы, имплантацию микрочипа, терапию стволовыми клетками, терапию по перемещению генов, генную терапию рибозимами, трансплантацию фоторецепторных/ретинальных клеток и акупунктуру. Согласно другим вариантам осуществления настоящего изобретения заявленные способы заключаются в использовании лазерной фотокоагуляции для удаления друз из глаза млекопитающего. Согласно другим вариантам осуществления настоящего изобретения заявленные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества второго агента, который модулирует связывание RBP с TTR у указанного млекопитающего, при этом первое соединение отличается от второго соединения. Согласно другим вариантам своего осуществления настоящее изобретение относится к аппарату,способному определять и/или подсчитывать формирование ретинол-RBP-TTR комплексов, при этом по крайней мере одна часть TTR является флуоресцентно меченой. Согласно одному варианту осуществления настоящего изобретения производное ретинила представляет собой N-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или "4-гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Согласно другому варианту осуществления настоящего изобретения полигалогенированный ароматический углеводород представляет собой метаболит гидроксилированного полигалогенированного ароматического углеводорода. Метаболит гидроксилированного полигалогенированного ароматического углеводорода может представлять собой метаболит гидроксилированного полихлоринированного бифенила. Согласно другому варианту осуществления настоящего изобретения аналоги диклофенака, заявленные в соответствии со способами и композициями настоящего изобретения, могут быть выбраны из группы, включающей 2-[(2,6 дихлорфенил)амино]бензойную кислоту; 2-[(3,5-дихлорфенил)амино]бензоевую кислоту; 3,5-дихлор-4[(4-нитрофенил)амино]бензойную кислоту; 2-[(3,5-дихлорфенил)амино]бензен уксусную кислоту и 2[(2,6-дихлор-4-карбоксильная кислота-фенил)амино]бензен уксусную кислоту. Согласно другим вариантам осуществления настоящего изобретения нестероидное противовоспалительное средство, заявленное в соответствии со способами и композициями настоящего изобретения,может представлять собой флуфенаминовую кислоту, дифлунисал, аналоги дифлунисала, диклофенамовую кислоту, индометацин, нифлумовую кислоту или сулиндак. Согласно одному варианту осуществления настоящего изобретения аналог дифлунисала может представлять собой 3',5'-дифторбифенил-3-ол; 2',4'-дифторбифенил-3-карбоксильную кислоту; 2',4'-дифторбифенил-4-карбоксильную кислоту; 2'фторбифенил-3-карбоксильную кислоту; 2'-фторбифенил-4-карбоксильную кислоту; 3',5'-дифторбифенил-3-карбоксильную кислоту; 3',5'-дифторбифенил-4-карбоксильную кислоту; 2',6'-дифторбифенил-3 карбоксильную кислоту; 2',6'-дифторбифенил-4-карбоксильную кислоту; бифенил-4-карбоксильную кислоту; 4'-фтор-4-гидроксибифенил-3-карбоксильную кислоту; 2'-фтор-4-гидроксибифенил-3-карбоксильную кислоту; 3',5'-дифтор-4-гидроксибифенил-3-карбоксильную кислоту; 2',4'-дихлор-4-гидроксибифенил-3-карбоксильную кислоту; 4-гидроксибифенил-3-карбоксильную кислоту; 3',5'-дифтор-4'гидроксибифенил-3-карбоксильную кислоту; 3',5'-дифтор-4'-гидроксибифенил-4-карбоксильную кислоту; 3',5'-дихлор-3-формилбифенил; 3',5'-дихлор-2-формилбифенил; 2',4'-дихлорбифенил-3-карбоксильную кислоту; 2',4'-дихлорбифенил-4-карбоксильную кислоту; 3',5'-дихлорбифенил-3-ил-метанол; 3',5'дихлорбифенил-4-ил-метанол или 3',5'-дихлорбифенил-2-ил-метанол. Согласно другим вариантам осуществления настоящего изобретения флавоноид, заявленный в соответствии со способами и композициями настоящего изобретения, может представлять собой 3-метил 4'6-дигидрокси-3',5-дибромфлавон или 3',5'-дибром-2',4,4',6-тетрагдироксиаурон. Согласно еще одному варианту осуществления настоящего изобретения сердечный агент, заявленный в соответствии со способами и композициями настоящего изобретения, представляет собой милринон. Согласно другим вариантам осуществления настоящего изобретения малые молекулы представляют собой N-фенилантранилиновую кислоту, метиленовый красный, мордант оранжевый I, бисариламин,N-бензил-р-аминобензоевая кислота, фуросамид, апигенин, ресвератрол, биариламин или дибензофуран. Согласно одному варианту осуществления настоящего изобретения аналоги тиреоидных гормонов могут представлять собой тироксифлавонпропионовую кислоту, тироксинуксусную кислоту или SKF94901. Способы и композиции в соответствии с настоящим изобретением также предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются в введении млекопитающему, по крайней мере однократно, эффективного количества агента, который увеличивает скорость высвобождения RBP или TTR у указанного млекопитающего, при этом указанная модуляция активности или уровней RBP или TTR приводит к уменьшению формирования полностью-транс-ретиналя в глазу у млекопитающего. Согласно одному варианту осуществления настоящего изобретения агент может быть выбран из группы, включающей производные ретинила, полигалогенированные ароматические углеводороды, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги дик-5 010827 лофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитело. Согласно одному варианту осуществления настоящего изобретения производное ретинила представляет собой соединение, имеющее следующую структуру: где X1 выбран из группы, включающей NR2, О, S, CHR2; R1 представляет собой (CHR2)x-L1-R3, где х равен 0, 1, 2 или 3; L1 представляет собой одинарную связь или -С(О)-; R2 представляет собой молекулу,выбранную из группы, включающей Н, (C1-С 4)алкил, F, (С 1-С 4)фторалкил, (С 1-С 4)алкокси, -С(О)ОН,-C(O)NH2, -(С 1-С 4)алкиламин, -С(О)-(С 1-С 4)алкил, -С(О)-(С 1-С 4)фторалкил, -С(O)-(С 1-С 4)алкиламин и-С(О)-(С 1-С 4)алкокси; и R3 представляет собой Н или молекулу, факультативно замещенную 1-3 независимо выбранными заместителями, выбранными из группы, включающей (С 2-С 7)алкенил, (С 2-С 7)алкинил,арил, (С 3-С 7)циклоалкил, (С 5-С 7)циклоалкенил и гетероциклы; или активный метаболит, или фармацевтически доступное пролекарство или его сольват. Согласно другому варианту осуществления настоящего изобретения производное ретинила представляет собой соединение, имеющее следующую структуру: где X1 выбран из группы, включающей NR2, О, S, CHR2; R1 представляет собой (CHR2)x-L1-R3, где х равен 0, 1, 2 или 3; L1 представляет собой одинарную связь или -С(О)-; R2 представляет собой молекулу,выбранную из группы, включающей Н, (C1-С 4)алкил, F, (С 1-С 4)фторалкил, (С 1-С 4)алкокси, -С(О)ОН,-C(O)NH2, -(С 1-С 4)алкиламин, -С(О)-(С 1-С 4)алкил, -С(О)-(С 1-С 4)фторалкил, -С(O)-(С 1-С 4)алкиламин и-C(O)-(C1-С 4)алкокси; и R3 представляет собой Н или молекулу, факультативно замещенную 1-3 независимо выбранными заместителями, выбранными из группы, включающей (С 2-С 7)алкенил, (С 2-С 7)алкинил,арил, (С 3-С 7)циклоалкил, (С 5-С 7)циклоалкенил и гетероциклы; или активный метаболит, или фармацевтически доступное пролекарство или его сольват. Согласно дополнительным вариантам осуществления настоящего изобретения (а) X1 представляет собой NR2, где R2 представляет собой Н или (С 1-С 4)алкил; (b) x равен 0; (с) х равен 1 и L1 представляет собой -С(О)-; (d) R3 представляет собой факультативно замещенный арил; (е) R3 представляет собой факультативно замещенный гетероарил; (f) X1 представляет собой NH и R3 представляет собой факультативно замещенный арил, включая дополнительные варианты осуществления настоящего изобретения,согласно которым (i) арильная группа имеет один заместитель; (ii) арильная группа имеет один заместитель, выбранный из группы, включающей галоген, ОН, О(С 1-С 4)алкил, NH(С 1-С 4)алкил, О(С 1 С 4)фторалкил и N[(С 1-С 4)алкил]2, (iii) арильная группа имеет один заместитель, представляющий собой ОН; (v) арил представляет собой фенил или (vi) арил представляет собой нафтил; (g) соединение имеет следующую структуру: или представляет собой его активный метаболит, или фармацевтически доступное пролекарство, или его сольват; (h) соединение представляет собой 4-гидроксифенилретинамид или его активный метаболит,фармацевтически доступное пролекарство или сольват; (i) соединение представляет собой 4 метоксифенилретинамид или (j) 4-оксофенретинид или его метаболит, фармацевтически доступное пролекарство или сольват. Согласно другому варианту осуществления настоящего изобретения введение соединения формулы(II) применяется для лечения офтальмологических заболеваний, поскольку позволяет снизить уровни ретинола в сыворотке крови пациентов. Согласно другим вариантам осуществления настоящего изобре-6 010827 тения (а) эффективное количество соединения системно вводится млекопитающему; (b) эффективное количество соединения вводится млекопитающему перорально; (с) эффективное количество соединения вводится млекопитающему внутривенно; (d) эффективное количество соединения вводится млекопитающему в ткани глаза; (е) эффективное количество соединения вводится с помощью ионотопофореза; или (f) эффективное количество соединения вводится млекопитающему путем инъекции. Согласно другим вариантам осуществления настоящего изобретения млекопитающее является человеком, при этом указанные варианты подразумевают: (а) человек является носителем мутантного гена АВСА 4, отвечающего за болезнь Штаргардта, или человек является носителем мутантного гена ELOV4,отвечающего за болезнь Штаргардта, или имеет генетическую вариацию в факторе комплемента Н, ассоциированную с возрастной макулярной дегенерацией, или (b) человек страдает от офтальмологического заболевания или патологического состояния, выбранного из группы, включающей болезнь Штаргардта,рецессивный пигментный ретинит, географическую атрофию (при этом скотома не является единственным примером), фоторецепторную дегенерацию, сухую форму AMD, рецессивную дистрофию палочекколбочек, экссудативную (или влажную) форму возрастной макулярной дегенерации, дистрофию палочек и колбочек и пигментный ретинит. Согласно другим вариантам осуществления настоящего изобретения млекопитающее представляет собой животную модель дегенерации сетчатки. Согласно другим вариантам своего осуществления настоящее изобретение относится к способам,заключающимся в многократном введении эффективного количества агента, который модулирует связывание RBP с TTR в организме млекопитающего, согласно дополнительным вариантам осуществления настоящего изобретения (i) интервал между многократными введениями составляет по крайней мере одну неделю; (ii) интервал между многократными введениями составляет по крайней мере один день; (iii) соединение вводится млекопитающему ежедневно; (iv) соединение вводится млекопитающему каждые 12 ч. Согласно другим или альтернативным вариантам осуществления настоящего изобретения способ заключается во введении лекарственного средства с перерывами, при этом введение соединения временно прекращают или вводимую дозу соединения на время уменьшают; по завершении перерыва введение соединения возобновляют. Продолжительность перерыва может составлять от 2 дней до 1 года. Согласно другим вариантам своего осуществления настоящее изобретение относится к способам,заключающимся во введении по крайней мере одного дополнительного агента, выбранного из группы,включающей индуктор продукции оксида азота, противовоспалительный агент, физиологически доступный антиоксидант, физиологически доступный минерал, отрицательно заряженный фосфолипид, кароретиноид, статин, антиангиогенетическое лекарственное средство, ингибитор матриксной металлопротеиназы, 13-цис-ретиноевую кислоту (включая производные 13-цис-ретиноевой кислоты), 11-цисретиноевую кислоту (включая производные 11-цис-ретиноевой кислоты), 9-цис-ретиноевую кислоту(включая производные 9-цис-ретиноевой кислоты) и производные ретиниламина. Согласно дополнительным вариантам осуществления настоящего изобретения:(а) дополнительный агент является индуктором образования оксида азота, включая те варианты осуществления настоящего изобретения, согласно которым индуктор образования оксида азота выбран из группы, включающей цитруллин, орнитин, нитрозилированный L-аргинин, нитрозилированный Lаргинин, нитрозилированный N-гидрокси-L-аргинин, нитрозилированный N-гидрокси-L-аргинин, нитрозилированный L-гомоаргинин и нитрозилированный L-гомоаргинин;(b) дополнительный агент является противовоспалительным агентом, включая те варианты осуществления настоящего изобретения, согласно которым противовоспалительный агент выбран из группы,включающей нестероидное противовоспалительное средство, ингибитор липоксигеназы, преднизолон,дексаметазон и ингибитор циклооксигеназы;(c) дополнительный агент представляет собой по крайней мере один физиологически доступный антиоксидант, включая те варианты осуществления настоящего изобретения, согласно которым физиологически доступный антиоксидант выбран из группы, включающей витамин С, витамин Е, бетакаротин, кофермент Q и 4-гидрокси-2,2,6,6-тетраметилпиперадин-N-оксил, или те варианты осуществления настоящего изобретения, согласно которым (i) по крайней мере один физиологически доступный антиоксидант вводится вместе с агентом, который увеличивает клиренс RBP или TTR у указанного млекопитающего, или (ii) по крайней мере два физиологически доступных антиоксиданта вводятся вместе с агентом, который увеличивает клиренс RBP или TTR у указанного млекопитающего;(d) дополнительный агент представляет собой по крайней мере один физиологически доступный минерал, включая те варианты осуществления настоящего изобретения, согласно которым физиологически доступный минерал выбран из группы, включающей соединения цинка(III), соединения меди(II),соединения селена(II) или же те варианты осуществления настоящего изобретения, согласно которым млекопитающему вводится по крайней мере один физиологически доступный антиоксидант;(e) дополнительный агент представляет собой отрицательно заряженный фосфолипид, включая те варианты осуществления настоящего изобретения, согласно которым отрицательно заряженный фосфолипид представляет собой фосфатидилглицерол;(f) дополнительный агент представляет собой каротеноид, включая те варианты осуществления настоящего изобретения, согласно которым каротеноид выбран из группы, включающей лютеин и зеаксан-7 010827 тин;(g) дополнительный агент представляет собой статин, включая те варианты осуществления настоящего изобретения, согласно которым статин выбран из группы, включающей розувастатин, питивастатин, симвастатин, правастатин, церивастатин, мевастатин, велостатин, флувастатин, компактин, ловастатин, далвастатин, флюиндостатин, аторвастатин, аторвастатин-кальций и дигидрокомпактин;(h) дополнительный агент представляет собой антиангиогенетическое лекарственное средство,включая те варианты осуществления настоящего изобретения, согласно которым антиангиогенетическое лекарственное средство представляет собой лекарственное средство Рхуфаб V2 (Rhufab V2), Триптофанил-тРНК-синтетазу и Анти-VEGFпегилированный аптамер, скваламин, анекортативный ацетат, пролекарство комбретастатина А 4, Макуген (Macugen), мифепристон, ацетонид триамцинолона субтенона,ацетонид интравитреального кристаллин-триамцинолона, AG3340, ацетонид фторцинолона и VEGFTrap.(i) дополнительный агент представляет собой ингибитор матриксной металлопротеиназы, включая те варианты осуществления настоящего изобретения, согласно которым ингибитор матриксной металлопротеиназы представляет собой тканевой ингибитор металлопротеиназ, 2-макроглобулин, тетрациклин,гидроксамат, хелатор, синтетический ММР фрагмент, сукцинил меркаптопурин, фосфонамидат, гидроксаминовую кислоту;(j) дополнительный агент представляет собой ингибитор комплемента, включая (только в качестве примера) антитела к С 1, С 2, С 3, С 4, С 5, С 6, С 7, С 8 и С 9, такие как описаны, например, в патентах США 5635178; 5843884; 5847082; 5853722 и у Rollins et al.; Transplantation, 60:1284-1292 (1995 (все источники литературы приведены здесь в качестве ссылок);(k) дополнительный агент представляет собой рыбий жир, включая (только в качестве примера) -3 жирные кислоты;(l) дополнительный агент представляет собой 13-цис-ретиноевую кислоту (включая производные 13-цис-ретиноевой кислоты); 11-цис-ретиноевую кислоту (включая производные 11-цис-ретиноевой кислоты) или 9-цис-ретиноевую кислоту (включая производные 9-цис-ретиноевой кислоты);(m) дополнительный агент представляет собой производное ретиниламина, включая производные полностью-транс ретиниламина, производные 13-цис-ретиниламина, производные 11-цис-ретиниламина или производные 9-цис-ретиниламина;(n) дополнительный агент вводится (i) перед введением агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, (ii) после введения агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, (iii) одновременно с введением агента, увеличивающего клиренс(о) дополнительный агент и агент, который увеличивает клиренс RBP с TTR у указанного млекопитающего, вводятся в составе одной фармацевтической композиции. Настоящее изобретение также относится к способам, заключающимся в осуществлении экстракорпорального реофереза млекопитающему. Настоящее изобретение также относится к способам, заключающимся в применении к млекопитающему способов лечения, выбранных из группы, включающей частичное перемещение сетчатки, фотодинамическую терапию, обработку друз лазером, хирургические вмешательства на макулярной зоне, хирургическое перемещение макулярной зоны, Phi-Motion-терапию,терапию протонным потоком, отслойку сетчатки и хирургические вмешательства на стекловидном теле,вдавливание склеры, хирургические вмешательства на субмакулярной зоне, транспупиллярную термотерапию, терапию с помощью фотосистемы I, стимуляцию микротоками, применение противовоспалительных агентов, РНК интерференцию, введение офтальмологических лекарственных препаратов, таких как фосфолин иодид, или эхотиофат, или ингибиторов карбонангидразы, имплантацию микрочипа, терапию стволовыми клетками, терапию по перемещению генов, генную терапию рибозимами, трансплантацию фоторецепторных/ретинальных клеток и акупунктуру. Согласно другим вариантам осуществления настоящего изобретения заявленные способы заключаются в использовании лазерной фотокоагуляции для удаления друз из глаза млекопитающего. Согласно другим вариантам осуществления настоящего изобретения заявленные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества второго агента, который увеличивает клиренс RBP с TTR у указанного млекопитающего, при этом первое соединение отличается от второго соединения. Согласно другим вариантам своего осуществления настоящее изобретение относится к аппарату,способному определять и/или подсчитывать формирование ретинол-RBP-TTR комплексов, при этом по крайней мере одна часть TTR является флуоресцентно меченой. Согласно одному варианту осуществления настоящего изобретения производное ретинила представляет собой N-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или "4-гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее предпочтительный метаболит HPR) или этилретинамид. Согласно другому вари-8 010827 анту осуществления настоящего изобретения полигалогенированный ароматический углеводород представляет собой метаболит гидроксилированного полигалогенированного ароматического углеводорода. Метаболит гидроксилированного полигалогенированного ароматического углеводорода может представлять собой метаболит гидроксилированного полихлоринированного бифенила. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора транскрипции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования N-ретинилиден-N-ретинилэтаноламина в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы,включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена,агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона,агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1,антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора трансляции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования Nретинилиден-N-ретинилэтаноламина в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей агонисты RXR/RAR,антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонистыNHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6,аптамеры, рибозимы и моноклональные антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует связывание RBP с TTR у указанного млекопитающего, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования N-ретинилиден-N-ретинилэтаноламина в глазу млекопитающего. Модулирующий агент может также связываться с RBP или TTR, a также ингибировать связывание RBP с TTR в организме млекопитаюшего. Модулирующий агент также может препятствовать связыванию ретинола сRBP или ингибировать связывание RBP или комплекса RBP-агент с TTR. Агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, при этом указанная модуляция активности или уровней RBP или TTR приводит к уменьшению формирования N-ретинилиден-N-ретинилэтаноламин в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид,нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора транскрипции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования липофусцина в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей агонистыNHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения способы и комопозиции,заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора трансляции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования липофусцина в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты,С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, рибозимы и моноклональные антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует связывание RBP с TTR у указанного млекопитающего, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования липофусцина в глазу млекопитающего. Модулирующий агент может также связываться с RBP или TTR, а также ингибировать связывание RBP с TTR в организме млекопитающего. Модулирующий агент также может препятствовать связыванию ретинола с RBP или ингибировать связывание RBP или комплекса RBP-агент с TTR. Агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, при этом указанная модуляция активности или уровней RBP или TTR приводит к уменьшению формирования липофусцина в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора транскрипции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования друз в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3,антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения способы и комопозиции,заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора трансляции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования друз в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей: агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона,антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олиго- 10010827 нуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4,антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, рибозимы и моноклональные антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует связывание RBP с TTR у указанного млекопитающего, при этом такая модуляция уровней или активности RBP или TTR приводит к уменьшению формирования друз в глазу млекопитающего. Модулирующий агент может также связываться с RBP или TTR, а также ингибировать связывание RBP с TTR в организме млекопитающего. Модулирующий агент также может препятствовать связыванию ретинола с RBP или ингибировать связывание RBP или комплекса RBP-агент с TTR. Агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, при этом указанная модуляция активности или уровней RBP или TTR приводит к уменьшению формирования друз в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора транскрипции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR препятствует возрастной макулярной дегенерации или дистрофии в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей: агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков,связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонистыNHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6,антагонисты NHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора трансляции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR препятствует возрастной макулярной дегенерации или дистрофии в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей агонистыNHF-6, аптамеры, рибозимы и моноклональные антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует связывание RBP с TTR у указанного млекопитающего, при этом такая модуляция уровней или активности RBP или TTR препятствует возрастной макулярной дегенерации или дистрофии в глазу млекопитающего. Модулирующий агент может также связываться с RBP или TTR, a также ингибировать связывание RBP с TTR в организме млекопитающего. Модулирующий агент также может препятствовать связыванию ретинола с RBP или ингибировать связывание RBP или комплекса RBP-агент с TTR. Агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид,нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидоми- 11010827 метик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, при этом указанная модуляция активности или уровней RBP или TTR препятствует возрастной макулярной дегенерации или дистрофии в глазу млекопитающего. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора транскрипции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR защищает глаз млекопитающего от воздействия света. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей: агонисты RXR/RAR, антагонистыRXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты,С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества ингибитора трансляции RBP или TTR, при этом такая модуляция уровней или активности RBP или TTR защищает глаз млекопитающего от воздействия света. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR,агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3,агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающего и заключаются во введении указанному млекопитающему, по крайней мере однократно, эффективного количества агента, который модулирует связывание RBP с TTR у указанного млекопитающего, при этом такая модуляция уровней или активности RBP или TTR защищает глаз млекопитающего от воздействия света. Модулирующий агент может также связываться с RBP или TTR, а также ингибировать связывание RBP с TTR в организме млекопитающего. Модулирующий агент также может препятствовать связыванию ретинола с RBP или ингибировать связывание RBP или комплекса RBP-агент с TTR. Агент может быть выбран из группы, включающей производные ретинила,агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака,малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества агента, который увеличивает клиренс RBP или TTR у указанного млекопитающего, при этом указанная модуляция активности или уровней RBP или TTR защищает глаз млекопитающего от воздействия света. Согласно некоторым вариантам осуществления настоящего изобретения агент может быть выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство,бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, предназначены для модуляции уровней или активности ретинол-связывающего белка(RBP) или транстиретина (TTR) у млекопитающих; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества одного из соединений, выбранного- 12010827 из группы, включающей ингибитор транскрипции RBP, ингибитор транскрипции TTR, ингбитор трансляции RBP, ингибитор трансляции TTR, агент, усиливающий высвобождение RBP, агент, усиливающий высвобождение TTR, антагонист RBP, агонист RBP, антагонист TTR и агонист TTR. Согласно некоторым вариантам осуществления настоящего изобретения ингибитор транскрипцииRBP выбран из группы, включающей агонисты RXB/RAR, антагонисты RXB/RAR, агонисты эстрогенов,антагонисты эстрогенов, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siPHK, NHF-4 агонисты, NHF-4 антагонисты, аптамеры, белки связывания содержащих цинк пальцеобразных областей, рибозимы и моноклональные антитела. Согласно другим вариантам осуществления настоящего изобретения ингибитор транскрипции TTR выбран из группы, включающей антагонисты белков, связывающих жирные кислоты, агонисты С/ЕВР, антагонисты С/ЕВР, антисмысловые олигонуклеотиды, siPHK, агонисты HNF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF3, агонисты NHF-4, антагонисты NHF-4, NHF-6 агонисты, NHF-6 антагонисты, аптамеры, белки связьшания содержащих цинк пальцеобразных областей, рибозимы и моноклональные антитела. Согласно другим вариантам осуществления настоящего изобретения ингибитор трансляции RBP выбран из группы, включающей агонисты RXB/RAR, антагонисты RXB/RAR, агонисты эстрогенов, антагонисты эстрогенов, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siPHK, NHF-4 агонисты, NHF-4 антагонисты, аптамеры, белки связывания содержащих цинк пальцеобразных областей, рибозимы и моноклональные антитела. Согласно другим вариантам осуществления настоящего изобретения ингибитор трансляции TTR выбран из группы, включающей антагонисты белков, связывающих жирные кислоты, агонисты С/ЕВР, антагонисты С/ЕВР, антисмысловые олигонуклеотиды, siPHK, агонисты HNF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, NHF-6 агонисты, NHF-6 антагонисты, аптамеры, белки связывания содержащих цинк пальцеобразных областей, рибозимы и моноклональные антитела. Согласно другим вариантам осуществления настоящего изобретения агент, усиливающий высвобождение RBP, выбран из группы, включающей производные ретинила, агонисты тиреоидных гормонов,антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор,сердечный агент, пептидомиметик, аптамер и антитела. Согласно еще одному варианту осуществления настоящего изобретения агент, усиливающий высвобождение TTR, выбран из группы, включающей агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака,малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Согласно другому варианту осуществления настоящего изобретения агонист RBP или антагонистRBP представляет собой производное ретинила. Согласно другим вариантам осуществления настоящего изобретения агонист или антагонист TTR выбран из группы, включающей агонисты тиреоидных гормонов, антагонисты тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидное противовоспалительное средство, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для лечения возрастной макулярной дегенерации или дистрофии; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения,при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP,так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для уменьшения формирования полностью-транс-ретиналя в глазу млекопитающего; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения, при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществле- 13010827 ния настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP, так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для уменьшения формирования N-ретинилиден-N-ретинилэтаноламина в глазу млекопитающего; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения, при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP илиTTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP, так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для уменьшения формирования липофусцина в глазу млекопитающего; указанные способы заключаются во введении млекопитающему,по крайней мере однократно, эффективного количества первого соединения, при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP илиTTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP, так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBPагент с TTR. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для уменьшения формирования друз в глазу млекопитающего; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения,при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP, так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для защиты глаза млекопитающего от воздействия света; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения, при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP,так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Согласно другим вариантам осуществления настоящего изобретения способы и композиции, заявленные в нем, предназначены для лечения ретинол-ассоциированных заболеваний; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества по крайней мере одного соединения, выбранного из группы, включающей ингибитор транскрипции RBP,ингибитор транскрипции TTR, ингбитор трансляции RBP, ингибитор трансляции TTR, агент, усиливающий высвобождение RBP, агент, усиливающий высвобождение TTR, антагонист RBP, агонист RBP, ан- 14010827 тагонист TTR и агонист TTR и антагонист ретинол-связывающего рецептора. Согласно одному варианту осуществления настоящего изобретения ингибитор транскрипции RBP выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, антагонисты белков,связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонистыNHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4, антагонисты NHF-4, агонисты NHF-6,антагонисты NHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Согласно другому варианту осуществления настоящего изобретения ингибитор транскрипции TTR выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR, агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, агонисты NHF-4, антагонисты NHF-4, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения ингибитор трансляции RBP выбран из группы, включающей агонисты RXR/RAR, антагонисты RXR/RAR,агонисты эстрогена, антагонисты эстрогена, агонисты тестостерона, антагонисты тестостерона, агонисты прогестерона, антагонисты прогестерона, агонисты дексаметазона, антагонисты дексаметазона, антисмысловые олигонуклеотиды, siRNA, агонисты NHF-4, антагонисты NHF-4, аптамеры, белки связыванияZn-пальцев, рибозимы и моноклональные антитела. Согласно еще одному варианту осуществления настоящего изобретения ингибитор трансляции TTR выбран из группы, включающей антисмысловые олигонуклеотиды, siRNA, антагонисты белков, связывающих жирные кислоты, С/ЕВР агонисты, С/ЕВР антагонисты, агонисты NHF-1, антагонисты NHF-1, агонисты NHF-3, антагонисты NHF-3, агонисты NHF-4,антагонисты NHF-4, агонисты NHF-6, антагонисты NHF-6, аптамеры, белки связывания Zn-пальцев, рибозимы и моноклональные антитела. Согласно одному варианту осуществления настоящего изобретения агент, увеличивающий высвобождение RBP, выбран из группы, включающей производные ретинила, полигалогенированный ароматический углеводород, агонист тиреоидных гормонов, антагонист тиреоидных гормонов, диклофенак,аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидные противовоспалительные средства, бивалентный ингибитор, сердечный агент, пептидомиметик, аптамер и антитела. Альтернативно, производное ретинила представляет собой N-(4-гидроксифенил)ретинамид"гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Согласно еще одному варианту осуществления настоящего изобретения полигалогенированный ароматический углеводород может представлять собой метаболит полигалогенированного ароматического углеводорода, специфически, матаболит гидроксилированного полихлоринированного бифенила. Согласно еще одному варианту осуществления настоящего изобретения агент, увеличивающий высвобождение TTR, выбран из группы, включающей агонисты тиреоидных гормонов, антагонисты тиреодиных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов,флавоноид, нестероидные противовоспалительные средства, бивалентный ингибитор, сердечный агент,пептидомиметик, аптамер, полигалогогенированный ароматический углеводород и антитела. Согласно еще одному варианту осуществления настоящего изобретения агонист или антагонистRBP может представлять собой производное ретинила, такое как N-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или "4-гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболитHPR) или этилретинамид. Согласно другому варианту осуществления настоящего изобретения агонист или антагонист TTR выбран из группы, включающей полигалогенированный ароматический углеводород, агонист тиреоидных гормонов, антагонист тиреоидных гормонов, диклофенак, аналоги диклофенака, малые молекулы, аналоги эндокринных гормонов, флавоноид, нестероидные противовоспалительные средства, бивалентный ингибитор, сердечный агент, петидомиметик, аптамер и антитела. Согласно одному варианту осуществления настоящего изобретения синтетическое соединение может представлять собой ресвератрол или биариламин. Согласно еще одному варианту осуществления настоящего изобретения антагонист ретинол-связывающего рецептора может представлять собой ингибитор ретинилпальмитатгидролазы, более специфично, ингибитор ретинилпальмитатгидролазы представляет собой 3,4,3',4'тетрахлорбифенил. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные здесь, подразумевают введение второго соединения, выбранного из группы,включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал,антиоксидант, каротиноид, отрицательно заряженный фосфолипид или статин. Согласно некоторым вариантам осуществления настоящего изобретения ретинол-ассоциированное заболевание представляет собой диабет, гиперостоз, идиопатическую внутричерепную гипертензию, амилоидоз, болезнь Альцгеймера и синдром Альстрема-Хальгрена. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначе- 15010827 ны для лечения диабета 1-го и 2-го типов у млекопитающего; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения, при этом указанное первое соединение модулирует уровни или активность RBP или TTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться как с RBP,так и с TTR и таким образом ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные здесь, подразумевают введение млекопитающему второго соединения, выбранного из группы,включающей: (а) гормон, понижающий уровень глюкозы в крови, или миметик указанного гормона (например, инсулин, GLP-1 или GLP-1 аналог, эксендин-4 или пираглютид), (b) производное сульфонилмочевины, понижающее уровень глюкозы в крови (например, ацетогексамид, хлорпропамид, толбутамид,толазамид, глимепирид, глипизид, микронизированный гилбурид или гликлазид), (с) бигуанид, понижающий уровень глюкозы в крови (например, метформин), (d) меглитинид, понижающий уровень глюкозы в крови (например, натеглинид или репаглинид), (е) тиазолидиндион или другие агонисты PPARгамма, понижающие уровень глюкозы в крови (например, пиоглитазон, розиглитазон, троглитазон или изагитазон), (f) понижающий уровень глюкозы в крови PPAR агонист с двойным действием с аффинностью к PPAR- и к PPAR- (например, BMS-298585 и тезаглитазар), (g) ингибитор альфаглюкозидазы,понижающий уровень глюкозы в крови (например, акарбоза или миглитол), (h) антисмысловое соединение, понижающее уровень глюкозы в крови, не направленное против глюкозо-6-фосфаттранслоказы, (i) соединение, подавляющее аппетит, для лечения ожирения (например, фентермин), (j) ингибитор абсорбции жирных кислот для лечения ожирения, такой как орлистат, (k) модифицированная форма цилиарного нейротрофического фактора, который ингибирует сигналы голода и стимулирует аппетит, для лечения ожирения, (l) секвестранты желчных кислот, понижающие уровень липидов в крови (например, холестирамин, колестипол и гидрохлорид колесевелама), (m) ингибитор ГМГ-Коа-редуктазы (например, ловастатин, церивастатин, превастатин, аторвастатин, симвастатин и флувастатин), (n) никотиновую кислоту,(о) производное фиброевой кислоты, понижающее уровень липидов в крови (например, клофибрат, гемфиброзил, фенофибрат, безафибрат и ципрофибрат), (р) агенты, включая пробукол, неомицин, декстротироксин, (q) сложные эфиры растительного станола, (r) ингибиторы абсорбции холестерина (например,эзетимиб), (s) ингибиторы СЕТР (например, торцетрапиб и JTT-705), (t) ингибиторы МТР (например,имлитапид), (u) ингибиторы переносчиков желчных кислот (апикальный натрийзависимых переносчиков желчных кислот), (v) регуляторы печеночного CYP7a, (w) ангибиторы АСАТ (например, Авасимиб), (х) лекарственные средства с антиэстрогенным действием (например, тамоксифен), (y) синтетические HDL(например, ЕТС-216), или (z) противовоспалительные средства, понижающие уровни липидов в крови(например, глюкокортикоиды). В том случае, когда второе соединение имеет другую мишень и/или действует по-другому, нежели чем агенты, описанные здесь (т.е. те, которые модулируют уровни или активность RBP или TTR), введение двух агентов в комбинации (например, одновременно, последовательно или отдельно) должно обеспечивать дополнительный или синергический терапевтический эффект у пациента, страдающего диабетом. По этой же причине введение двух агентов в комбинации (одновременно, последовательно или отдельно) должно подразумевать введение меньших доз каждого из агентов, по сравнению с терапией каждым из них в отдельности, при этом достигается желаемый терапевтический эффект, включая (только в качестве примера) снижение уровня глюкозы и HbAl c контроля в крови. Согласно одному варианту осуществления настоящего изобретения первое соединение вводят млекопитающему, страдающему от диабета 2-го типа. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает высвобождение RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Согласно некоторым вариантам осуществления настоящего изобретения первое соединение может представлять собой производное ретинила, такое как N-(4-гидроксифенил)ретинамид"гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для лечения идиопатической внутричерепной гипертензии у млекопитающих; указанные способы заключаются в введении млекопитающему, по крайней мере однократно, эффективного количества первого соединения, при этом указанное первое соединение модулирует уровни или активность RBP илиTTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение уменьшает транскрипцию RBP или TTR у млекопитающего.- 16010827 Согласно другому варианту осуществления настоящего изобретения первое соединение уменьшает трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться с RBP или с TTR, а также ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Согласно некоторым вариантам осуществления настоящего изобретения первое соединение может представлять собой производное ретинила, при этом указанное производное представляет собой N-(4 гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или "4 гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Способы и композиции, заявленные в соответствии с настоящим изобретением, также могут подразумевать введение второго соединения, выбранного из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротиноид, отрицательно заряженный фосфолипид и статин. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для лечения гиперостоза у млекопитающих; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, первого соединения, которое модулирует уровень или активность RBP или TTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение ингибирует трансляцию RBP илиTTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться с RBP или с TTR, а также ингибировать связывание RBP с TTR у млекопитающего. Кроме того,указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связываниеRBP или комплекса RBP-агент с TTR. Согласно некоторым вариантам осуществления настоящего изобретения первое соединение может представлять собой производное ретинила, при этом указанное производное представляет собой N-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP",или "фенретинид", или "4-гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4 метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Способы и композиции, заявленные в соответствии с настоящим изобретением, также могут подразумевать введение второго соединения, выбранного из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротиноид, отрицательно заряженный фосфолипид и статин. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для лечения амилоидоза у млекопитающих; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, первого соединения, которое модулирует уровень или активность RBP или TTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение ингибирует транскрипцию или трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение увеличивает клиренс RBP или TTR. Согласно еще одному варианту осуществления настоящего изобретения первое соединение ингибирует связывание RBP с TTR. Указанный агент может связываться с RBP или с TTR, а также ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBPагент с TTR. Согласно некоторым вариантам осуществления настоящего изобретения первое соединение может представлять собой производное ретинила, при этом указанное производное представляет собойN-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или "4 гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Способы и композиции, заявленные в соответствии с настоящим изобретением, также могут подразумевать введение второго соединения, выбранного из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротиноид, отрицательно заряженный фосфолипид и статин. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для лечения болезни Альцгеймера у млекопитающих; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, первого соединения, которое модулирует уровень или активность RBP или TTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение увеличивает транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение увеличивает трансляциюRBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение уменьшает клиренс RBP или TTR. Согласно еще одному варианту осуществления настоящего изобретения первое соединение обеспечивает связывание RBP с TTR. Указанный агент мо- 17010827 жет связываться с RBP или с TTR, а также ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплекса RBP-агент с TTR. Согласно некоторым вариантам осуществления настоящего изобретения первое соединение может представлять собой производное ретинила, при этом указанное производное представляет собой N-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или "4-гидроксифенилретинамид", или "гидроксифенил ретинамид"),N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Способы и композиции, заявленные в соответствии с настоящим изобретением, также могут подразумевать введение второго соединения, выбранного из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротиноид, отрицательно заряженный фосфолипид и статин. Способы и композиции, заявленные в соответствии с настоящим изобретением, также предназначены для лечения синдрома Альстрема-Хальгрена у млекопитающих; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, первого соединения, которое модулирует уровень или активность RBP или TTR у млекопитающего. Согласно одному варианту осуществления настоящего изобретения первое соединение модулирует транскрипцию RBP или TTR у млекопитающего. Согласно другому варианту осуществления настоящего изобретения первое соединение модулирует трансляцию RBP или TTR у млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения первое соединение модулирует клиренс RBP или TTR. Согласно еще одному варианту осуществления настоящего изобретения первое соединение модулирует связывание RBP с TTR. Указанный агент может связываться с RBP или сTTR, а также ингибировать связывание RBP с TTR у млекопитающего. Кроме того, указанный агент может препятствовать связыванию ретинола с RBP, а также ингибировать связывание RBP или комплексаRBP-агент с TTR. Согласно некоторым вариантам осуществления настоящего изобретения первое соединение может представлять собой производное ретинила, при этом указанное производное представляет собой N-(4-гидроксифенил)ретинамид (также обозначаемый в тексте как "HRP", или "фенретинид", или"4-гидроксифенилретинамид", или "гидроксифенил ретинамид"), N-(4-метоксифенил)ретинамид ("MPR"; наиболее распространенный метаболит HPR) или этилретинамид. Способы и композиции, заявленные в соответствии с настоящим изобретением, также могут подразумевать введение второго соединения, выбранного из группы, включающей индуктор образования оксида азота, антиоксидант, противовоспалительный агент, минерал, антиоксидант, каротиноид, отрицательно заряженный фосфолипид и статин. Согласно другим вариантам осуществления настоящего изобретения эффективное количество соединения, заявленного в соответствии со способами и композициями настоящего изобретения, может вводиться млекопитающему системно. Согласно некоторым вариантам осуществления настоящего изобретения соединение может вводиться млекопитающему перорально. Согласно другим вариантам осуществления настоящего изобретения соединение может вводиться млекопитающему внутривенно. Согласно еще одним вариантам осуществления настоящего изобретения соединение может вводиться в ткани глаза млекопитающего. Согласно другим вариантам осуществления настоящего изобретения соединение может вводиться млекопитающему путем инъекции. Согласно любому из изложенных выше вариантов осуществления настоящего изобретения млекопитающее, заявленное в соответствии со способами и композициями настоящего изобретения, является человеком. Согласно другим вариантам осуществления настоящего изобретения способы и композиции,заявленные здесь, подразумевают многократное введение эффективного количества соединения. Согласно некоторым вариантам осуществления настоящего изобретения интервал между многократными введениями составляет по крайней мере одну неделю. Согласно другим вариантам осуществления настоящего изобретения интервал между многократными введениями составляет по крайней мере один день. Согласно еще одному варианту осуществления настоящего изобретения соединение вводится млекопитающему ежедневно. Способы и композиции, заявленные в соответствии с настоящим изобретением, могут также подразумевать введение млекопитающему индуктора образования оксида азота. Согласно другим вариантам осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение млекопитающему противовоспалительного агента. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение млекопитающему по крайней мере одного антиоксиданта. Антиоксидант, заявленный в соответствии со способами и композициями настоящего изобретения, может быть выбран из группы,включающей витамин С, витамин Е, -каротин, коэнзим А и 4-гидрокси-2,2,6,6-тетраметилпиперадин-Nоксил. Согласно другому варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение по крайней мере одного антиоксиданта совместно с соединениями, заявленными в соответствии с настоящим изобретением. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение млекопитающему по крайней мере одного минерала. Согласно этому варианту- 18010827 осуществления настоящего изобретения минерал может быть выбран из группы, включающей соединения цинка(II), соединения меди(II), соединения селена(II). Согласно другому варианту осуществления настоящего изобретения минералы, заявленные в соответствии со способами и композициями настоящего изобретения, могут вводиться совместно по крайней мере с одним антиоксидантом. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение млекопитающему каротиноида. Каротиноид,заявленный в соответствии с настоящим изобретением, может быть выбран из группы, включающей лютеин и зеаксантин. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение млекопитающему отрицательно заряженного фосфолипида. Согласно данному варианту осуществления настоящего изобретения отрицательно заряженный фосфолипид может представлять собой фосфатидилглицерол. Согласно другому варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать введение млекопитающему статина. Статин, заявленный в соответствии с настоящим изобретением, может быть выбран из группы, включающей розувастатин, питивастатин, симвастатин,правастатин, церивастатин, мевастатин, велостатин, флувастатин, компактин, ловастатин, дальвастатин,флуиндостатин, аторвастатин кальций и дигидрокомпактин. Согласно другим вариантам осуществления настоящего изобретения способы и композиции, заявленные в нем, могут вводиться млекопитающему каждые 12 ч. Согласно некоторым вариантам осуществления настоящего изобретения способы и композиции, заявленные в нем, могут дополнительно включать применение у млекопитающего реофореза. Согласно другому варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, дополнительно включают контроль над формированием друз в глазу млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, дополнительно включают измерение уровней липофусцина в глазу млекопитающего. Согласно еще одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, дополнительно включают измерение остроты зрения у млекопитающего. Согласно одному варианту осуществления настоящего изобретения, способы и композиции, заявленные в нем, дополнительно включают измерение аутофлуоресценции А 2 Е и предшественников А 2 Е. Согласно некоторым вариантам осуществления настоящего изобретения макулярная дегенерация представляет собой болезнь Штаргардта. Согласно другому варианту осуществления настоящего изобретения макулярная дегенерация представляет собой сухую форму возрастной макулярной дегенерации. Способы и композиции, заявленные в соответствии с настоящим изобретением, могут дополнительно включать определение носительства гена, ответственного за болезнь Штаргардта. Согласно некоторым вариантам осуществления настоящего изобретения фармацевтическая композиция для лечения макулярной дегенерации может включать соединения, заявленные в соответствии со способами и композициями настоящего изобретения, и фармацевтически доступный носитель. Согласно одному варианту осуществления настоящего изобретения фармацевтически доступный носитель подходит для введения в ткани глаза. Другие цели, характеристики и преимущества способов и композиций, заявленных в соответствии с настоящим изобретением, будут очевидны из последующего детального описания изобретения. Специалисту должно быть понятно, что детальное описание изобретения и специфические примеры, раскрывающие специфические варианты осуществления настоящего изобретения, приведены с иллюстративной целью, поэтому возможны различные изменения и модификации в пределах представленной ниже формулы изобретения. Все публикации, заявки на патент и другие источники литературы приведены в настоящем описании в качестве ссылочного и иллюстративного материала. Краткое описание чертежей Новизна способов и композиций, заявленных в соответствии с настоящим изобретением, раскрыта в представленной ниже формуле изобретения. Лучшее понимание характеристик и преимуществ настоящего изобретения будет достигнуто при помощи представленного ниже детального описания, которое включает иллюстративные варианты осуществления настоящего изобретения, сопровождающиеся следующими чертежами: на фиг. 1 представлена блок-схема методики лечения ретинол-ассоциированных заболеваний и/или витреальных болезней с использованием способов и композиций, заявленных в соответствии с настоящим изобретением; на фиг. 2 - соотношение уровней HRP в сыворотке к уровням ретинола в сыворотке, а также уровни ретиноидов и А 2 Е в глазном яблоке; на фиг. 3 - эффект от введения HRP диким мышам на (А) уровни ретинола в сыворотке и (В) уровни ретиноида в глазном яблоке; на фиг. 4 - пример FRET спектра для комплекса RBP-TTR в отсутствие и в присутствии HPR, при этом TTR мечен флуоресцентной меткой; на фиг. 5 - пример дозозависимого ингибирования формирования ретинол-RBP-TTR комплекса, из- 19010827 меренного с помощью способов FRET, как описано в тексте; на фиг. 6 - результаты сравнения ингибирования комплекса ретинол-RBP-TTR с использованиемHPR, 13-цис-ретиноевой кислоты и полностью-транс-ретиноевой кислоты, измеренные с помощью способов FRET, как описано в тексте; на фиг. 7 а-7 с - различный обратнофазный LC анализ ацетонитритных экстрактов сыворотки. Сыворотку получают от мышей, которые получали или DMSO (фиг. 7 а), 10 мг/кг, или N-4(гидроксифенил)ретинамид (HRP) (фиг. 7b), или 20 мг/кг HPR (фиг. 7 с) в течение 14 дней; на фиг. 8 - анализ уровня сывороточного ретинола как функции концентрации фенретинида; на фиг. 9 а - анализ взаимодействий между ретинолом и ретинол-связывающим белком, осуществленный с помощью гашения флуоресценции; на фиг. 9b - анализ связывания взаимодействий между ретинолом и ретинол-связывающим белком в присутствии HPR (2 мкМ), осуществленный с помощью гашения флуоресценции; на фиг. 10 а - влияние HPR на биосинтез А 2 РЕ-Н 2 у нулевых по abca4 гену мутантных мышей; на фиг. 10b - влияние HPR на биосинтез А 2 Е у нулевых по abca4 гену мутантных мышей; на фиг. 11 - связывание N-4-(метоксифенил)ретинамида (MPR) с ретинол-связывающим белком,измеренное с помощью гашения флуоресценции; на фиг. 12 - модуляция связывания TTR с RBP-MPR, измеренная с помощью хроматографии с исключением по размеру и УФ-спектрофотометрии; на фиг. 13 - анализ уровней А 2 РЕ-Н 2 и А 2 Е как функции дозы фенретинида за период лечения (панели A-F) и аутофлуоресценция липофусцина в RPE ABCA4 null мутантных мышей как функция дозы фенретинида (панели G-I); на фиг. 14 - корреляция между концентрацией фентретида и уменьшением уровня ретинола, А 2 РЕН 2 и А 2 Е у нулевых по АВСА 4 гену мутантных мышей; на фиг. 15 - композиция ретиноида у адаптированных к свету мышей, получавших DMSO и HPR(панель А); влияние HPR на регенерацию зрительного хромофора (панель В); влияние HPR на регенерацию выцветшего хромофора (панель С); электрофизиологическое измерение функции палочек (панельD), функции палочек и колбочек (панель Е) и восстановление после фотоослепления (панель F); на фиг. 16 - изображения сетчатки мышей, получавших DMSC и HPR, полученные с помощью световой микроскопии; на фиг. 17 - поглощающая и флуоресцентная хроматограмма экстрактов глазного яблока контрольных мышей (панель А) и мышей, которые предварительно получали лечение HPR (панель В) с последующим перерывом в 12 дней, поглощающая и флуоресцентная хроматограммы экстрактов глазного яблока контрольных мышей (панель С) и мышей, которые предварительно получали терапию HPR (панельD) с последующим 28-дневным перерывом; на гистограммах представлены относительные уровни А 2 Е у мышей, показанных на панелях A-D; на фиг. 18 - относительная концентрация А 2 Е, А 2 РЕ и А 2 РЕ-Н 2 у мышей трех линий возрастом 3 месяца. Детальное описание изобретения В данном разделе представлено детальное описание вариантов осуществления настоящего изобретения, способов и композиций, заявленных в нем. Примеры вариантов осуществления настоящего изобретения представлены ниже в разделе примеры. Если дополнительно не оговаривается иное, технические и научные термины, используемые в настоящем описании, имеют общепринятое значение, понятное любому специалисту в той области, к которой относится настоящее изобретение. Все публикации, заявки на патент и другие источники литературы приведены в настоящем описании в качестве ссылочного и иллюстративного материала. Используемый здесь термин "ген АВСА 4" относится к гену, кодирующему rim белок или RmP. Ген АВСА 4 также известен как ген ABCR. Используемый здесь термин "антиоксидант" относится к синтетическому или природному соединению, которое может предотвращать, препятствовать или каким-либо образом ингибировать окисление другого соединения или биологического вещества. Используемый здесь термин "деконволюция" обозначает процесс раскладывания данных, информации и/или изображений (по крайней мере, частично) на составные части. Например, флуоресцентный спектр или спектр поглощения, который отражает комплексную волну, можно математически деконволировать на раздельные поглощающие и флуоресцентные пики, которые составляют комплексную волну. Подходящие математические методики и алгоритмы хорошо известны специалистам в данной области, а подходящие программы для деконволюции данных, информации и/или изображений являются коммерчески доступными. Используемый здесь термин "прерывание зрительного цикла" или ему подобный относится к любому способу модулирования активности, напрямую или нет, по крайней мере одного фермента, вовлеченного в зрительный цикл. Используемый здесь термин "диспергирование" относится к суспендированию соединения в другой среде. Диспергирование может включать этапы гомогенизации, фракционирования, расслаивания,- 20010827 флюидизации или уменьшения размера вещества для ускорения этапа суспендирования. Используемый здесь термин "производное ретинила" относится к соединению, которое может быть получено путем взаимодействия различных цис- или транс-изомеров с другим соединением или рядом соединений. Используемый здесь термин "возрастная макулярная дегенерация или дистрофия" или "ARMD" (от англ. Age-related macular degeneration or dystrophy) относится к истощающему заболеванию, которое имеет две формы - сухую и влажную ARMD. Сухая форма ARMD, которая встречается в 90% случаев,также известна как атрофическая, неэкссудативная или друзеноидная макулярная дегенерация. При сухой форме ARMD друзы обычно формируются в пигментом эпителии сетчатки (RPE, от англ. RetinalPigment Epithelium) под и/или в пределах мембраны Бруха. Потеря зрения происходит, когда друзы начинают препятствовать функционированию фоторецепторов макулы. Сухая форма ARMD проявляется постепенно прогрессирующей потерей зрения в течение многих лет. Влажная форма ARMD прогрессирует быстрее и приводит к серьезному нарушению центрального зрения. К макулярным дистрофиям относятся болезнь Штаргардта, также известная как макулярная дистрофия Штаргардта или Fundus Flavimaculatus, которая является наиболее распространенной ювенильной формой макулярной дистрофии. Используемый здесь термин "млекопитающее" относится ко всем млекопитающим, включая человека. К млекопитающим относятся (только в качестве примеров) люди, приматы, коровы, собаки, кошки,козы, овцы, свиньи, крысы, мыши и кролики. Используемый здесь термин "биологический образец" относится к образцу плазмы, крови, мочи,фекалий, ткани, слизи, слезы или слюны. Используемый здесь термин "эффективное количество" относится к общему количеству терапевтического агента в фармацевтической композиции или к способу, который является достаточным для достижения значимого благоприятного результата у пациента. Используемый здесь термин "модуляция" обозначает как увеличение, так и уменьшение уровней экспрессии нуклеиновой кислоты или полипептида, или же степени связывания, или других функциональных характеристик нуклеиновой кислоты или полипептида. Используемый здесь термин "офтальмологическое заболевание или состояние" относится к любому заболеванию или патологическому состоянию, при котором в процесс вовлекается глаз или окружающие его ткани. К примерам (без ограничений указанными) относятся заболевания или патологические состояния, включающие дегенерацию сетчатки и/или макулы, включая дистрофию сетчатки и/или макулы и/или дегенерацию сетчатки и/или макулы. Используемый здесь термин "иммобилизованный" относится к ковалентному или нековалентному связыванию химического или биологического вещества с матрицей. Используемый здесь термин "примат" относится к высшему роду млекопитающих, включая людей и человекообразных обезьян. Используемый здесь термин "витреоретинальное заболевание" относится к любому заболеванию или патологическому состоянию, при котором в процесс вовлекаются стекловидное тело и сетчатка,включая (только в качестве примера) диабетическую ретинопатию, макулярную дегенерацию, ретинопатию беременных и пигментный ретинит. Используемый здесь термин "ретинол-ассоциированное заболевание" относится к любому заболеванию или патологическому состоянию, ассоциированному с аномальными уровнями витамина А, ретинола и его родственных транспортных белков, включая заболевания, ассоциированные с анормальными уровнями ретинол-связывающего белка и транстиретина у пациента. Используемый здесь термин "риск" относится к возможности того, что событие произойдет. Зрительный цикл В сетчатке позвоночных имеется два типа фоторецепторных клеток. Палочки отвечают за зрение при слабом освещении. Колбочки являются менее чувствительными и обеспечивают боковое и пространственное, а также цветное зрение. При дневном освещении ответ палочек является насыщенным, и зрение опосредуется главным образом колбочками. Оба типа клеток имеют в своем составе структуру,называемую внутренним сегментом и содержащую множество мембранных дисков. Реакции зрительной трансдукции происходят на поверхности этих дисков. Первым этапом является поглощение фотона молекулой опсинового фермента, которая включает изомеризацию 11-цис-формы ретинального хромофора в 13-цис-форму. Прежде чем чувствительность к свету восстановится, должна произойти диссоциация полностью-транс-ретиналя из апопротеина опсина и обратная его изомеризация в 1-цис-ретиналь. Полностью-транс-ретиналь представляет собой ретиноид зрительного цикла, который в результате конденсации с фосфатидилэтаноламином превращается в диретиналь N-ретинилиден-N-ретинилэтаноламин. 11 цис-Ретиналь представляет собой фотореактивную порцию родопсина, которая конвертируется в полностью-транс-ретиналь, когда фотон света после активного поглощения попадает на молекулу. Во время указанных химических реакций нервное волокно, прикрепленное к этой определенной палочке или колбочке, получает стимул, который передается в головной мозг как зрительный сигнал. Зрительный цикл и восстановление родопсина Родопсин, рецептор, связанный с G-белком, может существовать в двух формах: фототрансдукция- 21010827 и/или восстановление после выцветания (возвращение активированных компонентов в темное состояние) и ретиноидный цикл (образование 11-цис-ретиналя). Фототрансдукция у позвоночных инициируется фотохимической реакцией, при этом 11-цис-ретиналь связывается с его опсиновой молекулой (родопсин = опсин + 11-цис-ретиналь) подвергается изомеризации в полностью-транс ретиналь, что приводит к конформационным изменениям опсина. У позвоночных восстановление конформации фоточувствительного рецептора (возврат к темному состоянию) требует формирования 11-цис-ретиналя из полностьютранс-ретиналя посредством ретиноидного цикла. Полный цикл изомеризации и восстановления пигмента у людей происходит в течение нескольких минут для родопсина и значительно быстрее для пигментов колбочек. Восстановление полностью транс-ретиналя в полностью-транс-ретинол происходит на внешних сегментах фоторецепторных клеток, в то время как другие реакции, включая изомерацию, происходят в пигментном эпителии сетчатки (RPE). Основание Шиффа полностью-транс-ретинилидена гидролизируется, а полностью-транс-ретиналь диссоциируется из связывающего кармана опсина, хотя молекулярные этапы, которые приводят к их высвобождению из связывающего кармана опсина, до настоящего времени окончательно не объяснены. Высвобождение полностью-транс-ретиналя из дисков может быть ускорено с помощью АТР-связывающего кассетного транспортера (АВСА 4), мутации которого являются причиной заболеваний сетчатки, включая болезнь Штаргардта, дистрофию палочек-колбочек, пигментный ретинит и, возможно, макулярную дегенерацию. Кроме того, полностью-транс-ретинол восстанавливается в полностью-транс-ретинол с помощью НАДФ-зависимой полностью-транс-ретинолдегидрогеназы, ассоциированного с мембраной феремента,который принадлежит к большому семейству алкогольдегидрогеназ с короткими цепями (SCAD, от англ.Short-chain Alcohol Dehydrogenases). Польностью-транс-ретинол переносится на RPE с помощью малоизученного процесса, возможно, с вовлечением таких компонентов, как IRBP и RBP, которые присутствуют в интерфоторецепторном матриксе (IPM, от англ. Interphotoreceptor matrix), или путем пассивной диффузии, управляемой ретиноидами захвата (например, нерастворимыми ретиниловыми сложными эфирами жирных кислот) в RPE. Этерификация в RPE включает перенос ацильной группы с лецитина на ретинол, который катализируется лецитинретинолацилтрансферазой (LRAT, от англ. Lecitin:Retinol Acyltransferase). Указанные эфиры могут являться субстратами до сих пор точно не установленного фермента, обозначаемого термином изомерогидролаза, который использует энергию гидролиза ретиниловых сложных эфиров для изомеризации полностью-транс-ретинола в 11-цис-ретинол и, следовательно,управляет реакцией. Альтернативно, указанные две реакции могут происходить раздельно, то есть сложный эфир сначала гидролизуется ретинилгидролазой и затем изомеризуется в 11-цис-ретинол. 11-цисРетинол затем окисляется в 11-цис-ретиналь в реакции, катализируемой НАД- и НАДФ-зависимыми 11 цис-трансретинолдегидрогеназами, которые являются другими членами семейства дегидрогеназ с короткими цепями. В конце концов, 11-цис-ретиналь возвращается обратно в фоторецепторные клетки, какIRBP-зависимым, так и IRBP-независимым образом, где он снова связывается с опсином для восстановления зрительного пигмента. Дополнительная информация, касающаяся анатомической структуры глаза позвоночных, зрительного цикла и восстановления родопсина, а также биогенеза А 2 Е-оксиранов, представлена в заявке на патент США 11/150641 от 10 июня 2005 г., заявки РСТ 2005/29455 от 17 августа 2005 г. и патента США 60/622213 от 25 октября 2004 г., все указанные источники приведены здесь в качестве ссылочного материала. Дистрофии и дегенерации сетчатки и макулы Макулярная дегенерация (также обозначаемая термином дегенерация сетчатки) представляет собой заболевание глаза, при котором происходит повреждение макулы центрального участка сетчатки. Приблизительно в 85-90% макулярная дегенерация является "сухой" (атрофический или не-неоваскулярный тип). При сухой форме макулярной дегенерации повреждение сетчатки связано с формированием небольших желтых отложений, известных как друзы, в зоне макулы; аккумуляция липофусцина в RPE приводит к географической атрофии. Данный феномен приводит к утончению и высушиванию макулы. Локализация и количество участков утончения сетчатки, вызываемых образованием друз, прямо коррелирует со степенью потери центрального зрения. Дегенерация друз пигментного слоя сетчатки и фоторецепторных клеток При "влажной" форме макулярной дегенерации формируются новые кровеносные сосуды (то есть происходит неоваскуляризация) для улучшения кровоснабжения ретинальной ткани, в особенности вблизи макулы - участка сетчатки, который отвечает за остроту центрального зрения. Новые сосуды легко травмируются и иногда разрываются, что приводит к слепоте и повреждению окружающих тканей. Хотя "влажная" форма макулярной дегенерации встречается всего в 10% случаев, она в 90% случаев вызывает слепоту, обусловленную макулярной дегенерацией. Неоваскуляризация может приводить к быстрой потере зрения и к образованию рубцовых изменений в сетчатке и, в конечном итоге, к слепоте. Такая рубцовая ткань и кровеносные сосуды вызывают затемнения, искажение зрительного восприятия и часто приводят к полной слепоте на пораженный глаз. Влажная макулярная дегенерация обычно начинается с искажения центрального поля зрения. Прямые линии становятся изогнутыми. Многие пациенты, страдающие от макулярной дегенерации, отмечают,- 22010827 что зрение становится расплывчатым и появляются темные пятна. Было показано, что факторы роста,например васкулярный эндотелиальный фактор роста, или VEGF (от англ. Vascular Epithelial Growth Factor), может способствовать такому аномальному росту сосудов в глазу. Это открытие привело к активным исследованиям экспериментальных лекарственных средств, которые ингибируют или блокируютVEGF. Исследования показали, что анти-VEGF-агенты могут быть использованы для блокирования и предотвращения аномального роста сосудов. Указанные анги-VEGF-агенты блокируют или ингибируютVEGF стимуляцию, что приводит к уменьшению роста сосудов. Такие анти-VEGF агенты также могут быть полезны для антиангиогенеза и блокирования способности VEGF индуцировать рост новых сосудов в сетчатке, а также увеличивать их плотность. Болезнь Штаргардта представляет собой макулярную дистрофию, которая манифестирует как рецессивная форма макулярной дегенерации в раннем детстве. См., например, Allikmets et al., Science,277:1805-07 (1997); Lewis et al., Am. J. Hum. Genet., 64:422-34 (1999); Stone et al., Nature Genetics, 20:32829 (1998); Allikmets, Am. J. Hum. Gen., 67:793-799 (2000); Klevering, et al., Ophthalmology, 111:546-553(2004). Болезнь Штаргардта клинически характеризуется прогрессирующей потерей центрального зрения и прогрессирующей атрофией RPE, покрывающего макулу. Мутации гена АВСА 4 гена человека, отвечающего за Rim белок (RmP), вызывают болезнь Штаргардта. На начальных стадиях заболевания у пациентов отмечается нарушение адаптации к темноте, но при этом функция палочек остается нормальной. Гистологически болезнь Штаргардта ассоциируется с отложением гранул пигмента липофусцина в RPE клетках. Мутации гена АВСА 4 также ассоциированы с рецессивной формой пигментного ретинита, см., например, Cremers et al., Hum. Mol. Genet., 7:355-62 (1998), рецессивной дистрофией палочек-колбочек, см. те же источники, и неэкссудативной возрастной макулярной дегенерацией, см., например, Allikmets et al.,Science, 277:1805-07 (1997); Lewis et al., Am. J. Hum. Genet., 64:422-34 (1999), хотя первичная роль мутаций АВСА 4 в развитии AMD до настоящего времени не доказана. См. Stone et al., Nature Genetics,20:328-29 (1998); Allikmets, Am. J. Him. Gen., 67:793-799 (2000); Klevering et al., Ophthalmology, 111:546553 (2004). Аналогично болезни Штаргардта, указанные заболевания характеризуются замедленной адаптацией палочек к темноте. См. Steinmetz et al., Brit. J. Ohpthalm., 77:549-54 (1993). Отложение липофусцина в RPE клетках также наблюдается главным образом при AMD, см. Kliffen et al., Microse. Res.Tech., 36:106-22 (1997), и некоторых вариантах пигментного ретинита. См. Bergsma et al., Nature, 265:6267 (1977). Кроме того, существует несколько типов макулярной дегенерации, которые встречаются у детей,подростков или взрослых людей и известны под общим названием ювенильная макулярная дегенерация или макулярная дегенерация с ранним дебютом. Многие из указанных типов макулярной дегенерации являются наследственными и представляют собой больше дистрофию, чем дегенерацию. Некоторыми примерами макулярной дистрофии являются дистрофия палочек-колбочек, дистрофия роговицы, дистрофия Fuch's, макулярная дистрофия Сорсби, болезнь Беста, ювенильный ретиношизис, а также болезнь Штаргардта. Офтальмолог, осматривающий пациента на данной стадии заболевания, может увидеть друзы, хотя у многих пациентов еще нет симптомов. С того момента, когда друзы обнаруживаются при осмотре, требуется постоянный мониторинг. У многих людей старше 60 лет встречаются друзы в небольшом количестве. Метаболические заболевания Метаболические заболевания, включая сахарный диабет 1-го и 2-го типов, также ассоциированы с анормальным уровнем ретинола в крови. Сахарный диабет 1-го типа (инсулинзависимый сахарный диабет) Сахарный диабет 1-го типа представляет собой тяжелую форму заболевания. При отсутствии лечения он приводит к развитию кетоацидоза у пациента и быстрой дегенерации. Приблизительно 10-20% пациентов, страдающих диабетом, имеют диабет 1-го типа, при этом обычно это молодые люди. У пациентов, не страдающих ожирением, также встречается сахарный диабет 1-го типа, хотя и нечасто. Сахарный диабет 1-го типа представляет собой катаболическое заболевание, при котором уровень циркулирующего инсулина в плазме понижен, а уровень глюкагона в плазме повышен. Считается, что сахарный диабет 1-го типа имеет аутоиммунную природу и, возможно, развивается в результате инфекционного или токсического поражения В-островковых клеток поджелудочной железы. В подтверждение теории об аутоиммунном механизме развития сахарного диабета 1-го типа у пациентов определяются аутоантитела к инсулину и островковым клеткам поджелудочной железы, что не встречается у людей, не страдающих диабетом. У молодых людей низкий уровень ретинола и заметное снижение уровня ретинол-связывающего белка (RBP) с усиленной его экскрецией ассоциированы с сахарным диабетом 1-го типа. См. Basu, T.K.,et al., Am. J. Clin. Nutr. 50:329-331 (1958); Durbey, S.W. et al., Diabetes Care 20:84-89 (1997). Снижение уровней ретинола и RBP сопровождается существенным нарушением метаболизма цинка, фактора, необходимого для синтеза RBP в гепатоцитах. См. Cunningham, J.J., et al., Metabolism 42:1558-1562 (1994). В- 23010827 противоположность этому у пациентов с сахарным диабетом 1-го типа уровни токоферола или витамина Е остаются неизменными. См. Basu, T.K. et al. (1989). Низкий уровень ретинола отмечается, несмотря на высокий уровень витамина А в гепатоцитах. См.Tuitoek P.J., et al., Br. J. Nutr. 75:615-622 (1996). Исследования, демонстрирующие связь между содержанием витамина А и секрецией инсулина, показали, что только лечение инсулином может привести к повышению уровня витамина А у пациентов с сахарным диабетом 1-го типа. См. Tuitoek, P.J. et al., J. Clin.Biochem. Nutr. 19:165-169 (1996). В противоположность этому, специальная диета, обогащенная витамином А, не приводит к нормализации метаболической доступности указанного витамина. Id. Указанные исследования демонстрируют наличие взаимосвязи между витамином А и регуляцией инсулином транспорта глюкозы в мышечные и жировые клетки. Дополнительные исследования подтвердили эту взаимосвязь и продемонстрировали, что витамин А необходим для нормальной секреции инсулина. См. Chertow, B.S., et al., J. Clin. Invest. 79:163-169 (1987). Было показано, что ретинол необходим для высвобождения инсулина из витамин-А-дефицитных островковых клеток. Эксперименты in vivo продемонстрировали, что у крыс с дефицитом витамина А происходит нормализация быстрого опосредованного глюкозой выброса инсулина после введения только витамина A. Id. Витамин А может оказывать свое влияние не секрецию инсулина посредством модуляции активности трансглутаминазы островковых и секретирующих инсулин клеток, см. Driscoll H.K., et al., Pancreas 15:69-77 (1997); следовательно,витамин А необходим для эмбрионального развития островковых клеток и профилактики нарушения толерантности к глюкозе у взрослых, см. Matthews, K.A. et al., J. Nutr. 134:1958-1963 (2004), что лишний раз доказывает важную роль витамина А и ретинола в секреции инсулина и регуляции уровня глюкозы в крови у пациентов с сахарным диабетом. Сахарный диабет 2-го типа (инсулиннезависимый сахарный диабет) Сахарный диабет 2-го типа объединяет гетерогенную группу заболеваний средней степени тяжести. Сахарный диабет 2-го типа обычно встречается у взрослых людей, однако, иногда может проявиться и в детстве. При сахарном диабете 2-го типа наблюдается инсулинорезистентность при повышенном уровне глюкозы в крови. Около 85% пациентов с сахарным диабетом 2-го типа страдают ожирением, имеют резистентность к эндогенному инсулину, которая ассоциирована с избыточным абдоминальным отложением жировой ткани. Инсулинорезистентность связана с пострецепторным дефектом действия инсулина. Это, в свою очередь, обусловлено наличием жировых включений в клетках, в результате чего клетки"переполняются" жиром и разбухают (например, адипоциты, гепатоциты и мышечные клетки), а также теряют способность усваивать нутриенты, циркулирующие в крови после приема пищи. Последующая гиперинсулинемия также может приводить к дополнительной пониженной регуляции клеточных инсулиновых рецепторов. Кроме того, активность белков транспортеров глюкозы (например, ГЛЮТ 4), также подавляется в результате постоянной их стимуляции, что приводит к нарастанию гипергликемии у пациента. В отличие от сахарного диабета 1-го типа, при сахарном диабете 2-го типа у пациентов выборочно отмечается повышение уровня RBP в крови и нормальный или повышенный уровень ретинола. См. Sasaki, H. et al., "Am. J. Med. Sci 310:177-82 (1995); Basuado C.G. et al., J. Am. Coll. Nutr. 16:39-45 (1997);Abahausain, M.A. et al., Eur. J. Clin. Nutr. 53:630-635 (1999). Уровни ретиноевой кислоты (полностью транс-RA и 13-цис-RA) у пациентов с сахарным диабетом 2-го типа также понижены. Yamakoshi, Y. etal., Biol. Pharm. Bull 25:1268-1271 (2002). Уровни других витаминов, включая витамин Е (токоферол), и каротиноидов остаются неизменными как при сахарном диабете 1-го типа, так и при сахарном диабете 2 го типа, так и в контрольных группах, так же как и уровни цинка, альбумина и TTR, которые влияют на метаболизм витамина A. Id. Указанное селективное повышение уровней RBP у пациентов с сахарным диабетом 2-го типа в сочетании с селективным снижением уровня RBP у пациентов с сахарным диабетом 1-го типа позволяет предположить, что RBP и витамин А играют важную роль в регуляции уровня инсулина и глюкозы в крови. Считается, что повышенный уровень RBP связан с повышенным уровнем инсулина (гиперинсулинемией) у пациентов с сахарным диабетом. Basualdo et al. (1997). Уровень RBP также связан с тяжестью гипергликемии у пациентов. См. Hartmann, D. et al., Eur. J. Clin. Pharmacol. 42:523-8 (1992). Обратная корреляция уровня RBP с чувствительностью к инсулину при сахарном диабете 1-го и 2-го типов свидетельствует о наличии терапевтических показаний к мониторингу чувствительности к инсулину у млекопитающих. Идиопатическая внутричерепная гипертензия (ПН) ПН, также известная под названием - ложные опухоли головного мозга (РТС), представляет собой состояние, при котором отмечается повышение давления спинно-мозговой жидкости без какой-либо причины. Указанное состояние чаше всего встречается у молодых женщин во время беременности и вскармливания. Симптомы обычно появляются в тот период, когда женщина набирает вес. К типичным симптомам относятся головная боль, пульсирующий звон в ушах и проблемы со зрением (отек диска зрительного нерва), которые при отсутствии лечения могут привести к серьезной и нарастающей потере зрения.- 24010827 Несмотря на то, что этиология ПН неизвестна, ученые считают, что избыточный уровень витамина А может являться причиной, поскольку симптомы и проявления гипервитаминоза А аналогичны таковым при ПН. Исследования показали, что уровни ретинола в сыворотке значительно выше у пациентов с ПН по сравнению с контрольными группами, несмотря на отсутствие существенных различий в потреблении витамина А и концентрацией ретиниловых сложных эфиров в обеих группах. См. Jacobson, D.M. etal., Neurology, 54:2192-3 (1999). Заболевания костей Гиперостоз представляет собой патологическое состояние, при котором отмечается избыточный рост костной ткани. Указанное состояние может привести к формированию костной массы, выступающей за пределы нормальной кости, и встречается при многих скелетно-мышечных заболеваниях. Диффузный идиопатический костный гиперостоз (DISH) представляет собой форму гиперостоза, которая характеризуется нарастающей кальцификацией и оссификацией тел позвонков. Рентгенологические изменения у пациентов с DISH наблюдаются главным образом в грудном отделе позвоночника и заключаются в появлении рентгеноконтрастного участка впереди позвоночного столба. Оссификация задней продольной связки (OPLL) также встречается у пациентов с DISH, кроме того, результатом гиперостоза или оссификации связок позвоночника является компрессия позвоночного канала. К другим заболеваниям, сопровождающим гиперостоз или DISH, относятся острые переломы и псевдоартрозы позвоночника. Несмотря на то, что патогенез DISH и OPLL в настоящее время остается неизвестным, оба указанных заболевания ассоциированы с высокими уровнями ретинола и RBP в сыворотке. См. Kodama, T. etal., In vivo 12:339-344 (1998); Kilcoyne, R.F., J. Am. Acad. Dermatol. 19:212-216 (1988), что позволяет предположить, что витамин А играет роль в патогенезе DISH и OPLL. Другие исследования показали, что у пациентов с гиперостозом имеется функциональная недостаточность RBP в сочетании с аномальными уровнями ретинола и RBP в сыворотке. De Bandt, M., et al., J. Rheumatol. 22:1395-8 (1995). В медицинских источниках сообщается также, что у пожилых пациентов с дегенеративными заболеваниями суставов имеется гипервитаминоз А. См. Romero, J.B. et al., Bull Hosp. Jt. Dis. 54:169-174 (1996). Заболевания, ассоциированные с неправильной укладкой белков и их накоплением Неправильная укладка белков и их агрегация встречается при многих заболеваниях, известных под общим названием амилоидоз, включая болезнь Альцгеймера, болезнь Паркинсона и системный амилоидоз. Указанные заболевания возникают, когда нарушается формирование вторичной структуры белка,при котором растворимый в норме белок формирует нерастворимые внеклеточные фибриллярные депозиты -складчатой структуры, обозначаемые как амилоидные фибриллы, которые приводят к органной дисфункции. Более двадцати фибриллярных белков, включая транстиретин (TTR), описаны для амилоидоза человека, при этом для каждого из них характерны свои клинические симптомы.TTR белки дикого типа задействованы в патогенезе сенильного системного амилоидоза, спорадического заболевания, которое является результатом отложения фибрилл TTR в тканях сердца. МутантныеTTR белки, в противоположность этому, ассоциированы с семейной амилоидогенной полинейропатией и кардиомиопатией, при этом депозиты главным образом формируются в периферической и центральной нервной системе и сердце. Механизмы, отвечающие за селективное отложение белков в тканях, неизвестны. При амилоидозе TTR ассоциирован с формированием фибрилл в своей мономерной форме. Соединения, которые способствуют стабилизации тетрамеров TTR, таких как небольшие молекулы ресвератрол и биариламин, ингибируют формирование амилоидных фибрилл in vitro. См. Reixach, N. et al.,PNAS 101:2817-2822 (2004). Транстиретин также вовлечен в патогенез болезни Альцгеймера, однако, в противоположность формированию амилоидных фибрилл при амилоидозе, TTR ингибирует формирование -амилоидного белка как in vivo, так и in vitro. См. Schwartzman, A.L. et al., Amyloid. 11:1-9 (2004); Stein T.D. and JohnsonJ.A., J.Neurosci. 22:7380-7388 (2002). Было показано, что витамин А оказывает антиамилоидогенный эффект и дестабилизирующий эффект в отношении фибрилл -амилоида in vitro. См. Опо K., et al., Exp.Neural. 189:380-392 (2004). Синдром Альстрема-Хальгрена Синдром Альстрема-Хальгрена (также известный как синдром Альстрема) представляет собой редкое аутосомно-рецессивное заболевание, поражающее детей в очень раннем возрасте. К симптомам относятся слепота или серьезное искажение зрения, дистрофия палочек-колбочек, глухота, ожирение, развивающееся в первый год жизни, развитие сахарного диабета 2-го типа и серьезной инсулинорезистентности, акантокератодермия (появление темных пятен на коже), гипергонадотрофический гипогонадизм и тиреоидная недостаточность. Мутации, ассоциированные с синдромом Альстрема, локализуются в 14,9 см участке на хромосоме 2 р. Collin, G.B. et al., Hum. Mol. Gen. 6:213-219 (1997). Кроме симптоматических способов лечения в настоящее время не существует каких-либо других способов лечения пациентов с синдромом Альстрема. Модуляция уровня витамина А Витамин А (полностью-транс-ретинол) представляет собой жизненно необходимый клеточный нутриент, который не может быть синтезирован de novo и, таким образом, должен поступать в организм из- 25010827 продуктов питания. Витамин А является общим термином и может обозначать любое соединение, обладающее биологической активностью ретинола, включая связывающую активность. Один ретиноловый эквивалент (RE, от англ. Retinol Equivalent) является специфической биологической активностью 1 мкг полностью-транс-ретинола (3,33 ME) или 6 мкг (10 ME) -каротина. -Каротин, ретинол и ретиналь (альдегид витамина А) обладают эффективной и подтвержденной активностью витамина А. Каждое из указанных соединений получают из растительной молекулы предшественника, каротина (член семейства соединений, известных как каротеноиды). -Каротин, который состоит из двух молекул ретиналя, соединенных между собой на альдегидных участках, также обозначается как предшественник витамина А. Поступивший в организм -каротин расщепляется в просвете кишечника ферментом каротиндиоксигеназой с получением ретиналя. Ретиналь восстанавливается до ретинола ретинальдегидредуктазой, НАДФН-зависимым ферментом кишечника, после чего этерифицируется пальмитиновой кислотой. После расщепления ретинол из пищи транспортируется в печень в связи с липидными агрегатами. См. Bellovino et al., Mol. Aspects Med., 24:411-20 (2003). В печени ретинол формирует комплекс с ретинол-связывающим белком (RBP) и затем секретируется в системный кровоток. Перед тем как ретинолRBP доставляется в ткани-мишени за пределами печени, например в ткани глаза, он должен быть связан с транстиретином (TTR). Zanotti and Berni, Vitam. Horm., 69:271-95 (2004). Этот вторичный комплекс позволяет ретинолу длительное время циркулировать в крови. Ассоциация с TTR усиливает высвобождение RBP из гепатоцитов и препятствует почечной фильтрации комплекса RBP-ретинол. Комплекс ретинол-RBP-TTR доставляется в ткани-мишени, где ретинол захватывается и используется в различных клеточных процессах. Доставка ретинола клеткам посредством циркуляции RBP-TTR комплекса является основным путем, с помощью которого клетки и ткани организма обеспечиваются ретинолом. Захват ретинола клетками из комплекса ретинол-RBP-TTR осуществляется путем связывания RBP с рецепторами на клетках-мишенях. Указанное взаимодействие приводит к эндоцитозу комплекса RBPрецептор и последующему высвобождению ретинола из этого комплекса или к связыванию ретинола с клеточными ретинол-связывающими белками (CRBP, от англ. Cellular Retinol Binding Proteins), после чего апоRBP высвобождается клетками в плазму. Известны альтернативные механизмы поступления ретинола в клетки, включающие, например, захват только ретинола клетками. См. Blomhoff (1994). Способы и композиции, заявленные в соответствии с настоящим изобретением, полезны для модуляции уровня витамина А у млекопитающих. В частности, модуляция уровня витамина А может осуществляться посредством регуляции доступности или активности ретинол-связывающего белка (RBP) или транстиретина (TTR) у млекопитающего. Способы и композиции, заявленные в соответствии с настоящим изобретением, предназначены для модуляции уровней или активности RBP или TTR у млекопитающих и, следовательно, для модуляции уровня витамина А. Повышение или понижение уровня витамина А у субъекта может оказывать влияние на доступность ретинола клеткам и органам мишеням. Таким образом, способы модуляции доступности ретинола или его производных могут быть полезны для лечения заболеваний, вызванных избытком или недостатком ретинола или его производных в клетках и органах-мишенях. Например, А 2 Е, основной флуорофор липофусцина, образуется при макулярной или ретинальной дегенерации или дистрофии, включая возрастную макулярную дегенерацию и болезнь Штаргардта, что является следствием избыточной продукции ретиноида зрительного цикла, полностью-трансретинальдегида, предшественника А 2 Е. Снижение уровня витамина А и полностью-трансретинальдегида в сетчатке, таким образом, может способствовать снижению уровня А 2 Е и препятствовать отложению липофусцина, что является полезным для лечения возрастной макулярной дегенерации. Исследования подтвердили, что снижение уровня ретинола в сыворотке оказывает благоприятный эффект на уменьшение уровня А 2 Е и липофусцина в RPE. Например, было показано, что у животных, находящихся на диете с пониженным содержанием витамина А, наблюдается существенное уменьшение агрегации липофусцина. Katz et al., Mech. Ageining Dev., 35:291-305 (1986); Katz et al., Mech. Ageing Dev.,39:81-90 (1987); Katz et al., Biochim. Biophys. Acta, 924:432-41 (1987). Дополнительное доказательство того, что снижение уровня витамина А может оказывать благоприятный эффект на уменьшение макулярной дегенерации и дистрофии, было предоставлено Radu и коллегами, которые показали, что снижение уровня витамина А в глазу приводит к уменьшению уровней как А 2 Е, так и липофусцина. Radu et al.,Proc. Natl. Acad. Sci. USA, 100:4742-7 (2003); Radu et al., Proc. Natl. Acad. Sci. USA, 101:5928-33 (2004). Было показано, что введение аналога ретиноевой кислоты, N-4-(гидроксифенил)ретинамида (HPR или фенретида), приводит к снижению уровня ретинола и RBP в сыворотке. Formelli et al., Cancer Res. 49:6149-52 (1989); Formelli et al., J. Clin. Oncol., 11:2036-42 (1993); Torrisi et al., Cancer Epidemiol. Biomarkers Prev., 3:507-10 (1994). Исследования in vitro показали, что HPR препятствует нормальному взаимодействию TTR с RBP. Mapleli et al., Biochim. Biophys. Acta 1294: 48-54 (1996). Holven et al., Int. J. Cancer 71:654-9 (1997). Модуляторы (например, HPR), которые ингибируют доставку ретинола к клеткам как посредством прерывания связывания ретинола с апоRBP или голоRBP (RBP + ретинол) и с его транспортным белком,- 26010827TTR, так и посредством усиления почечной экскреции RBP или TTR, могут оказаться полезными для уменьшения уровня витамина А в сыворотке и агрегации ретинола и его производных в тканях-мишенях,таких как глаз. Аналогично, модуляторы, которые снижают доступность транспортных белков ретинола, ретинолсвязывающего белка (RBP) и транстиретина (TTR), также будут полезными для уменьшения уровня витамина А в сыворотке и агрегации ретинола и его производных в тканях-мишенях, таких как глаз. Например, было показано, что TTR является компонентом друз, что позволяет предположить его непосредственное участие в патогенезе возрастной макулярной дегенерации. Mullins, R.F., FASEB J. 14:835-846(2000); Pfeffer B.A., et al., Molecular Vision 10:23-30 (2004). Ожидается, что аналогичный подход к модуляции уровней или активности TTR и/или RBP у млекопитающих может найти применение для лечения метаболических нарушений, таких как сахарный диабет 1-го и 2-го типов, ПН, заболевания костей, такие как гиперостоз, заболевания, связанные с неправильной укладкой и отложением белков, такие как амилоидоз и болезнь Альцгеймера, а также синдром Альстрема-Хальгрена. Согласно одному варианту осуществления настоящего изобретения способы и композиции, заявленные в нем, предназначены для модуляции уровней или активности RBP или TTR у млекопитающих; указанные способы заключаются во введении млекопитающему, по крайней мере однократно, эффективного количества по крайней мере одного из соединений, выбранного из группы, включающей ингибитор транскрипции RBP, ингибитор транскрипции TTR, ингибитор трансляции RBP, ингибитор трансляцииRBP, агонист RBP, антагонист TTR, агонист TTR и антагонист рецептора ретинол-связывающего белка. Ретинол-связывающий белок (RBP) и транстиретин (TTR) Ретинол-связывающий белок или RBP представляет собой белок с одной полипептидной цепью с молекулярной массой приблизительно 21 кД. RBP был клонирован и секвенирован, а его аминокислотная последовательность определена. Colantuni et al., Nuc. Acids Res., 11:7769-7776 (1983). Конструирование трехмерной структуры RBP показало, что у него имеется специализированный гидрофобный карман для связывания и защиты жирорастворимого витамина - ретинола. Newcomer et al., EMBO J., 3:1451-1454(1984). В экспериментах in vitro было показано, что культивированные гепатоциты синтезируют и секретируют RBP. Blaner, W.S. Endocrine Rev., 10:308-316 (1989). Последующие эксперименты показали, что многие клетки содержат мРНК РВР, что позволяет сделать предположение о том, что синтез RBP происходит во многих тканях организма. См. Blaner (1989). Большая часть RBP, секретируемая печенью, содержит ретинол в молярном соотношении 1:1, связывание ретинола с RBP необходимо для нормальной секреции RBP. В клетках RBP крепко связывается с ретинолом в эндоплазматическом ретикулуме, где он обнаруживается в высоких концентрациях. Связывание ретинола с RBP инициирует перемещение комплекса ретинол-RBP из эндоплазматического ретикулума в комплекс Гольджи, после чего происходит секреция комплекса RBP-ретинола из клеток. RBP, секретируемый гепатоцитами, также способствует перемещению ретинола в звездчатые клетки печени, откуда происходит непосредственная секреция комплекса ретинол-RBP в плазму. В плазме приблизительно 95% плазменного RBP находится в ассоциации с транстиретином (TTR) в молярном соотношении 1:1, при этом практически весь витамин А связан с RBP. TTR представляет собой хорошо изученный плазменный белок, состоящий из четырех идентичных субъединиц с молекулярной массой 54,980. Конструирование трехмерной структуры с помощью рентгенодиффракции показало наличие протяженных -складчатых структур, организованных в тетраэдры. Blake et al., J. Mol. Biol.,121:339-356 (1978). В центре тетрамера проходит канал, в котором расположены два сайта связывания тироксина. Однако только одна молекула тироксина нормально связывается с TTR, согласно отрицательной кооперативности. Считается, что формирование комплекса TTR-RBP-ретинол уменьшает фильтрацию ретинола в почечных канальцах, что увеличивает период полураспада ретинола и RBP в плазме приблизительно в три раза. Модуляция транскрипции и трансляции RBP и TTR У мышей с дефицитом RBP отмечаются нарушения, связанные с неполноценным функционированием ретиналя и недостаточной доступностью витамина A. Quardro, L., et al., EMBO J. 18:4633-4644(1999), данный источник литературы включен в настоящее описание в качестве ссылки. Несмотря на то,что RBP -/-мыши способны захватывать и сохранять ретинол в гепатоцитах, у них снижена способность мобилизовывать эти запасы ретинола из печени, что приводит к гиповитаминозу А и делает животных полностью зависимыми от регулярного поступления витамина А с пищей. Quardro (1999). Аналогично,уровни ретинола и RBP значительно снижены у мышей с дефицитом транстиретина, Epiksopou, V., et al.,Proc. Natl. Acad. Sci 90:2375-2379 (1993); van Bennekum, A.M. et al., J. Biol. Chem. 276:1107-1113 (2001),что свидетельствует о том, что TTR поддерживает нормальные уровни ретинола и его метаболитов в плазме. Способы и композиции, которые модулируют уровни и активность TTR или RBP у субъекта, таким образом, непосредственно влияют на связывание ретинола и его последующую доставку в ткани глаза. В- 27010827 том случае, если агент уменьшает доставку ретинола в ткани глаза у пациента с витреоретинальным заболеванием, таким как ретинопатия или макулярная дегенерация, в тканях глаза будет генерироваться меньшее количество полностью-транс-ретиналя и, следовательно, меньшее количество А 2 Е. Поскольку А 2 Е является токсичным по отношению к клеткам глаза, в особенности к клеткам, составляющим сетчатку глаза, уменьшение количества генерируемого А 2 Е является благоприятным для пациента с витреоретинальным заболеванием. Таким образом, модуляция (или, в частности, понижающая регуляция) уровней RBP и TTR в сыворотке является благоприятной для пациентов с различными витреоретинальными заболеваниями, включая, без ограничений указанными, ретинопатии и макулярные дегенерации. Кроме того, такая модуляция может оказаться эффективной для лечения пациентов, страдающих, например, метаболическими заболеваниями, такими как сахарный диабет 1-го и 2-го типов, заболевания костей, такие как гиперостоз, заболевания, связанные с неправильной укладкой и накоплением белков, такие как системный амилоидоз и болезнь Альйгеймера, а также синдром Альстрема-Хальгрена. Способы понижения сывороточных уровней RBP и TTR включают, например, понижающую регуляцию транскрипции RBP и/или TTR, понижающую регуляцию трансляции RBP и/или TTR, ингибирование пострансляционных изменений RBP и/или TTR, обеспечение внутриклеточной деградации RBP и/или TTR, ингибирование секреции RBP и/или TTR из клеток и/или увеличение скорости выведения TTR и/или RBP из организма. Одним вариантом осуществления способов и композиций, заявленных в соответствии с настоящим изобретением, является модуляция уровней или активности TTR или RBP посредством воздействия на транскрипцию RBP или TTR и, следовательно, на экспрессию соответствующего мРНК транскрипта в клетках. Таким образом, экспрессия RBP или TTR рецептора может быть супрессирована с помощью,например, антисмысловых олигонуклеотидов к мРНК, кодирующей RBP или TTR, или путем подавления транскрипции указанной мРНК, или путем модуляции транспорта, процессинга, деградации указанной мРНК и т.д. Указанная понижающая регуляция (супрессия) или модуляция может осуществляться с помощью способов, хорошо известных специалистам в данной области, например с помощью ингибиторов транскрипции. Трансляция рецептора ретинол-связывающего белка на основании RBP или TTR мРНК также может регулироваться с помощью понижающей регуляции экспрессии указанного белка. Такая понижающая регуляция или модуляция может осуществляться с помощью способов, хорошо известных специалистам в данной области, например путем использования неспецифических или специфических ингибиторов трансляции RBP или TTR. Например, модуляция транскрипции или трансляции RBP может осуществляться путем введения специфических или неспецифических ингибиторов транскрипции или трансляции RBP. 5' транскрипционный регуляторный участок RBP человека был клонирован и секвенирован. См. D'Onofrio, С., et al.,EMBO J. 4:1981-1989 (1985); Colontuoni, V., et al., EMBO J. 6:631-636 (1987), оба источника литературы включены в настоящее изобретение в качестве ссылок. Было показано, что у мышей экспрессия RBP регулируется ретиноевой кислотой, при этом как полностью-транс-ретиноевая кислота, так и 9-цисретиноевая кислота индуцируют экспрессию мРНК RBP, при этом индукция зависит от дозы и времени.Jessen, K.A. and Stare, M.A., Mol. Cell BIochem.211:85-94 (2000). Таким образом, согласно одному варианту своего осуществления настоящее изобретение относится к использованию агонистов и антагонистов ретиноевой кислоты, таких как RXR и RAR антагонистов или ретинилового метилового эфира (см. Sani,B.P., et al., Biochem. Biophys. Res. Commun., 223:293-298 (1996), источник литературы включен в настоящее описание в качестве ссылки) для модуляции транскрипции и трансляции RBP в клетках. К другим регуляторам транскрипции и трансляции RBP относятся эстроген, прогестерон, тестостерон и дексаметазон (см. Eberhardt, D.M., et al., Biol. Reprod. 60:714-720 (1999); Bucco R.A., et al., Endocrinology 37:31113122 (1996); McKearin, D.M., et al., J. Biol. Chem 263:3261-3265 (1988. NHF-4, член семейства белков,связывающих цинксодержащие пальцеобразные области, также регулирует экспрессию RBP и TTR. Duncan, S.A., et al., Development 124:279-287 (1997); Hayashi, Y., et al., J. Clin. Pathol.: Mol. Pathol. 52:19-24(1999), оба источника литературы включены в настоящее описание в качестве ссылок. Таким образом,агонисты и антагонисты HNF-4 и белки, связывающие цинксодержащие пальцеобразные области, могут быть полезными для модуляции транскрипции или трансляции RBP или TTR.TTR регулируется различными печеночными специфическими факторами транскрипции, включая печеночный ядерный фактор (HNF, от англ. Hepatic Nuclear Factor) 1, HNF-3, NHF-4 и HNF-6. См. Hayashi, Y, et al., J. Clin. Pathol.:Mol. Pathol. 52:19-24 (1999); Samadani, U., et al., Mol. Cell. Biol. 16:6273-6284(1996), оба источника литературы включены в настоящее описание в качестве ссылок. ССААТ/энхансерсвязывающий белок (С/ЕВР) и белки связывания жирных кислот также играют роль в трансактивацииTTR в гепатоцитах. См. Hayashi (1999); Puskas, L.G., et al., Proc. Natl. Acad. Sci. 100:1580-1585 (2003),источник литературы включен в настоящее описание в качестве ссылки. К другим регуляторам транскрипции и трансляции RBP или TTR относятся siPHK, рибозимы, антитела, антисмысловые олигонуклеотиды и аптамеры. Согласно одному варианту осуществления настоящего изобретения короткие интерферирующие молекулы РНК (siPHK, от англ. Short Interfering) могут модулировать транскрипцию или трансляциюRBP или TTR посредством интерферирования РНК (РНКи) или пост-трансляционного сайленсинга генов(PTGS, от англ. Post-translational Gene Silencing) (см., например, Ketting et al., (2001) Genes Develop,15:2654-2659). Молекулы siPHK могут разрушать гомологичные молекулы мРНК путем расщепления молекулы мРНК по участку, который перекрывается siPHK. Соответственно, siPHK обладают способностью связываться и расщеплять гомологичную мРНК RBP или TTR и, таким образом, полезны для модуляции уровней или активности TTR или RBP у пациента. Согласно другому варианту осуществления настоящего изобретения рибозимы могут быть полезными для модуляции транскрипции или трансляции RBP или TTR. Рибозимы или ферментные молекулы РНК обладают способностью катализировать специфическое расщепление РНК. Механизм расщепления включает последовательно-специфическую гибридизацию молекулы рибозима к комплементарной молекуле-мишени РНК с последующим эндонуклеотическим расщеплением. Композиция молекулы рибозима должна включать одну или более последовательность, комплементарную молекуле-мишени мРНК, а также хорошо известную каталитическую последовательность, способную к расщеплению мРНК. Такая последовательность описана в патенте США 5093246. Помимо рибозимов, которые расщепляют мРНК на сайт-специфических распознаваемых последовательностях, и могут использоваться для разрушения мРНК, кодирующей RBP или TTR, также могут использоваться рибозимы, образующие пространственную структуру типа "головки молотка" (Hammerhead - НН). НН рибозимы расщепляют молекулы мРНК на участках, которые обозначены фланкирующими участками, которые формируют комплементарные пары оснований с молекулой-мишенью мРНК. Основное требование заключается в том, чтобы молекуламишень мРНК имела следующую последовательность из двух оснований: 5'-UG-3'. Конструирование и получение НН рибозимов хорошо известно специалистам в данной области. К рибозимам, которые могут использоваться в соответствии с настоящим изобретением, также относятся РНК эндорибонуклеазы (далее в тексте обозначаемые как рибозимы "чешского типа"), такие, которые существуют в природе в Tetrahymena thermophila (известная как IVS или L-19 IVS РНК). Рибозимы чешского типа имеют активный сайт из восьми пар оснований, который гибридизуется с последовательностью молекулы-мишени РНК,где потом происходит расщепление данной молекулы. Способы и композиции, заявленные в соответствии с настоящим изобретением, включают использование рибозимов чешского типа, которые взаимодействуют с последовательностями, имеющими активный сайт из восьми пар оснований и присутствующими в генах, кодирующих RBP или TTR. Согласно другому варианту осуществления настоящего изобретения для модуляции транскрипции или трансляции RBP или TTR у пациента используются антитела. Термин "антитело", используемый здесь, относится к полипептиду, имеющему в своем составе каркасный участок гена иммуноглобулина или его фрагменты, которые специфически связываются с антигеном и распознают его. К распознаваемым иммуноглобулиновым генам относятся -, -, -, -, -, - и -константные участки, а также большое число генов, кодирующих вариабельные участки иммуноглобулинов. Легкие цепи классифицируются как - и -цепи. Тяжелые цепи классифицируются как -, -, -, - и -цепи, которые, в свою очередь,определяют и классы иммуноглобулинов, IgG, IgM, IgA, IgD и IgE соответственно. В каждом классе IgG существует несколько различных изотипов (например, IgG1, IgG2 и т.д.). Обычно антигенсвязывающий участок антитела является наиболее важной структурой, которая определяет специфичность и аффинность связывания. Типичная структурная единица иммуноглобулина (антитела) представляет собой тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара включает одну легкую цепь (около 25 кД) и одну тяжелую цепь (около 50-70 кД). N-концевой участок каждой цепи определяет вариабельный участок, состоящий из 100-110 или более аминокислот и отвечающий за распознавание антигена. Термины "вариабельная легкая цепь" (VL) И вариабельная тяжелая цепь VH относятся к таким легким и тяжелым цепям соответственно. Способы получения антител хорошо известны специалистам в данной области, см., например, KohlerMilstein (1975) Nature 256:495-497; HarlowLane (1988) Antibodies: a Laboratory Manual, ColdSpring Harbor, N.Y.). Гены, кодирующие тяжелые и легкие цепи антитела, представляющего интерес, могут быть клонированы из клетки, например гены, кодирующие моноклональное антитело, могут быть клонированы из гибридомы и использоваться для получения рекомбинантного моноклонального антитела. Библиотеки генов, кодирующих тяжелые и легкие цепи моноклональных антител, также могут быть получены из гибридомы или плазматических клеток. Случайное комбинирование продуктов генов, кодирующих легкие и тяжелые цепи, позволяет получить большое количество антител с различной антигенной специфичностью. Методики получения одноцепочечных антител или рекомбинантных антител (патент США 4946778; патент США 4816567) могут быть адаптированы для получения антител, используемых в белках слияния и способах, заявленных в соответствии с настоящим изобретением. Также для экспрессии антител человека и гуманизированных антител могут использоваться трансгенные мыши или другие организмы и млекопитающие. Альтернативно, для идентификации антител и гетеромерныхFab-фрагментов, которые специфически связываются с выбранными антигенами, могут использоваться фагово-дисплейные методики.- 29010827 Скринирование и селекция предпочтительных антител может осуществляться с помощью различных способов, хорошо известных специалистам в данной области. Первичное скринирование моноклональных антител, специфичных для антигена-мишени, может осуществляться, например, с помощью способов на основании ELISA. Вторичное скринирование предпочтительно осуществляется для идентификации и отбора желаемого моноклонального антитела, которое в дальнейшем используется для конструирования полиспецифического белков слияния, заявленных в соответствии с настоящим изобретением. Вторичное скринирование может осуществляться с помощью любого подходящего способа, известного специалистам в данной области. Модулятор, заявленный в соответствии с настоящим изобретением, может также включать одно или более антисмысловое соединение, включая антисмысловую РНК и антисмысловую ДНК, которые обладают способностью снижать уровень эндогенного RBP или TTR у субъекта. Таким образом, модулятор, обладающий способностью снижать уровень экспрессии RBP или TTR в клетке, что приводит к уменьшению уровней или активности RBP или TTR у пациента, включен в настоящее изобретение. Предпочтительно антисмысловые соединения имеют в своем составе последовательности, комплементарные нуклеиновым кислотам RBP или TTR. Согласно одному варианту осуществления настоящего изобретения антисмысловые соединения представляют собой антисмысловые олигомерные соединения, в частности олигонуклеотиды. Антисмысловые соединения специфически гибридизуются с одной или более нуклеиновой кислотой, кодирующейRBP или TTR. Используемый здесь термин "нуклеиновая кислота, кодирующая RBP или TTR" объединяет молекулы ДНК, кодирующие RBP или TTR, молекулы РНК (включая пре-мРНК и мРНК), транскрибируемые на указанной ДНК, а также кДНК, полученную на основании такой РНК. Специфическая гибридизация олигомерного соединения с нуклеиновой кислотой-мишенью препятствует нормальному функционированию нуклеиновой кислоты. Такая модуляция функции нуклеиновой кислоты соединениями, которые специфически гибридизуются с ней, в целом обозначается термином"антисмысловая" модуляция. К функциям ДНК, на которые можно воздействовать, относятся репликация и транскрипция. К функциям РНК, на которые можно воздействовать, относятся все витальные функции, такие как, например, транслокация РНК к месту трансляции белка, трансляция белка на РНК,сплайсинг РНК для получения одного или более образца мРНК и каталитическая активность, которая может обеспечиваться и облегчаться с помощью РНК. Конечным результатом такого вмешательства в функционирование нуклеиновой кислоты является модуляция экспрессии рецептора ретинолсвязывающего белка или фермента синтеза ретиноевой кислоты (включая ретинолдегидрогеназу и ретинальдегидрогеназу). Антисмысловые конструкты подробно описаны в патенте США 6100090 (Moniaet al.) и у Neckers et al., 1992., Crit Rev Oncog 3 (1-2): 175-231, указанные источники литературы включены в настоящее описание в качестве ссылок. Согласно другому варианту осуществления настоящего изобретения для модуляции транскрипции или трансляции RBP или TTR у пациента используются аптамеры. Аптамеры относятся к реагентам, которые выделяют из комбинаторных библиотек методами селекции (обычно in vitro), при этом молекуламишень, обычно белок или нуклеиновая кислота (без ограничении указанными), используется для селекции из комбинаторного пула молекул, обычно олигонуклеотидов (без исключения указанными), тех молекул, которые обладают способностью связывать молекулу-мишень. Отобранные реагенты могут быть идентифицированы как первичные аптамеры. Термин "аптамер" относится не только к первичным аптамерам в их оригинальной форме, но и ко вторичным аптамерам, полученным на основании первичных аптамеров (то есть полученным путем минимизации или модификации первичных аптамеров). Аптамеры, таким образом, функционируют как лиганды, связываясь со своими молекулами-мишенями. См. Stull и Szoka, Pharmaceutical Res. 12(4):465-483 (1995). Согласно способам и композициям, заявленным в соответствии с настоящим изобретением, аптамеры, которые связываются как с нуклеиновой кислотой, так и с белками, и участвуют в транскрипции или трансляции, или в регуляции транскрипции или трансляции,используются для модуляции транскрипции или трансляции RBP или TTR у пациента. Может использоваться комбинация двух или более модуляторов, например комбинация модулятора транскрипции или трансляции RBP и модулятора транскрипции или трансляции TTR. Указанные лекарственные средства могут вводиться одновременно, или последовательно, или по очереди. Модуляция связывания RBP и TTR и скорости их высвобождения у пациента Перед тем как ретинол, связанный с RBP, транспортируется с током крови в ткани глаза, он должен быть связан с TTR. Этот вторичный комплекс обеспечивает длительную циркуляцию ретинола в крови. При отсутствии TTR комплекс ретинол-RBP будет быстро экскретироваться с мочой. Аналогично, при отсутствии RBP транспорт ретинола и его захват клетками уменьшается. Согласно другому варианту своего осуществления настоящее изобретение относится к модуляции доступности RBP или TTR путем воздействия на формирование комплексов ретинола и ретинола-RBP в кровотоке, что осуществляется за счет модуляции связывания RBP и TTR и скорости их высвобождения. Как упоминалось выше, связывание TTR с голопротеином RBP приводит к уменьшению скорости высвобождения RBP и ретинола. Таким образом, за счет модуляции доступности или активности как RBP,так и TTR, можно модулировать уровни ретинола в крови у пациента.
МПК / Метки
МПК: A61K 31/07, A61P 27/00
Метки: ретинол-ассоциированных, заболеваний, лечения, композиции
Код ссылки
<a href="https://eas.patents.su/30-10827-kompozicii-dlya-lecheniya-retinol-associirovannyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции для лечения ретинол-ассоциированных заболеваний</a>












