Нацеливание на опухолевую сосудистую сеть при использовании меченного радиоактивным изотопом антитела l 19 к ed – b фибронектину
Номер патента: 10653
Опубликовано: 30.10.2008
Авторы: Царди Лучано, Бальца Энрика, Фрибе Маттиас, Борси Лаура, Кастеллани Патриция, Карнемолла Барбара, Хильгер Кристоф-Штефан
Формула / Реферат
1. Специфический связывающий элемент, который связывает человеческий ED-B, где специфический связывающий элемент является меченным с помощью изотопа, выбранного из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At, и включает сайт связывания антигена, содержащий домен VH антитела и домен VL антитела, при этом домен VH антитела является выбранным из группы, состоящей из домена L19 VH и домена VH, включающего VH CDR1, VH CDR2 и VH CDR3, где VH CDR3 представляет собой L19 VH CDR3 последовательности SEQ ID NO. 3, VH CDR1 необязательно представляет собой L19 VH CDR1 последовательности SEQ ID NO. 1, a VH CDR2 необязательно представляет собой L19 VH CDR2 последовательности SEQ ID NO. 2; и где домен VL антитела является необязательно выбранным из группы, состоящей из домена L19 VL и домена VL антитела, включающего VL CDR1, VL CDR2 и VL CDR3, где VL CDR3 представляет собой L19 VL CDR3 последовательности SEQ ID NO. 6, VL CDR1 необязательно представляет собой L19 VL CDR1 последовательности SEQ ID NO. 4, a VL CDR2 необязательно представляет собой L19 VL CDR2 последовательности SEQ ID NO. 5; последовательности домена L19 VH
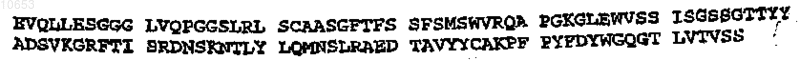
и домена L19 VL
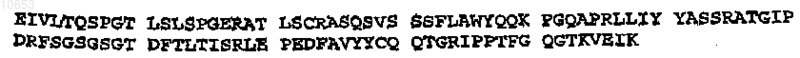
при этом специфический связывающий элемент включает мини-иммуноглобулин, содержащий указанные домен VH антитела и домен VL антитела, слитый с eS2-CH4 и димеризованный, или включает молекулу IgG1 антитела.
2. Специфический связывающий элемент по п.1, включающий домен VH антитела, содержащий VH CDR с аминокислотными последовательностями SEQ ID NO. 1, SEQ ID NO. 2 и SEQ ID NO. 3, при этом специфический связывающий элемент конкурирует за связывание ED-B с ED-B-связывающим доменом антитела, включающего домен L19 VH и домен L19 VL.
3. Специфический связывающий элемент по п.1 или 2, включающий домен L19 VH.
4. Специфический связывающий элемент по п.3, включающий домен L19 VL.
5. Специфический связывающий элемент по любому из предыдущих пунктов, который представляет собой мини-иммуноглобулин, включающий eS2-СН4.
6. Специфический связывающий элемент по п.5, где домен VH антитела и домен VL антитела находятся в пределах молекулы scFv антитела, слитой с eS2-СН4.
7. Специфический связывающий элемент по п.6, где молекула scFv антитела является слитой с eS2-CH4 посредством линкерного пептида.
8. Специфический связывающий элемент по п.7, в котором линкерный пептид имеет аминокислотную последовательность GGSG (SEQ ID NO. 7).
9. Специфический связывающий элемент по любому из пп.1-4, который включает цельную молекулу IgG1 антитела.
10. Специфический связывающий элемент по любому из пп.1-9, где изотоп представляет собой 131I.
11. Способ получения специфического связывающего элемента по любому из пп.1-10, при этом указанный способ включает мечение специфического связывающего элемента с помощью изотопа, выбранного из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At.
12. Способ по п.11, в котором мечение включает окисление галогенида, выбранного из группы, состоящей из 76Br, 77Br, 123I, 121I, 131I и 211At, в присутствии специфического связывающего элемента.
13. Способ по п.11, в котором мечение включает конъюгацию активированного бифункционального носителя галогена, содержащего радиоизотоп, выбранный из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At, с остатком лизина или цистеина или с N-терминальным концом специфического связывающего элемента.
14. Способ по любому из пп.11-13, в котором способ включает экспрессию нуклеиновой кислоты, кодирующей специфический связывающий элемент, перед мечением.
15. Способ по п.14, включающий культивирование хозяйских клеток в условиях для получения специфического связывающего элемента.
16. Способ по любому из пп.11-15, который дополнительно включает изоляцию и/или очистку специфического связывающего элемента.
17. Способ по любому из пп.11-16, который дополнительно включает рецептирование специфического связывающего элемента в композицию, включающую по крайней мере один дополнительный компонент.
18. Способ по любому из пп.11-17, который дополнительно включает связывание специфического связывающего элемента с ED-B или фрагментом ED-B.
19. Способ, включающий связывание специфического связывающего элемента, который связывает ED-B, по любому из пп.1-10 с ED-B или фрагментом ED-B.
20. Способ по п.18 или 19, где указанное связывание происходит in vitro.
21. Способ по любому из пп.18-20, включающий определение количества связывания специфического связывающего элемента с ED-B или фрагментом ED-B.
22. Применение связывающего элемента по любому из пп.1-10 в терапевтическом способе лечения организма человека или животного.
23. Применение по п.22, в котором способ терапевтического лечения является способом лечения повреждения, связанного с патологическим ангиогенезом.
24. Применение по п.22, в котором способ терапевтического лечения является способом лечения опухоли.
25. Применение связывающего элемента по любому из пп.1-10 в способе диагностики заболевания организма человека или животного.
26. Применение специфического связывающего элемента по любому из пп.1-10 в производстве лекарственного средства для лечения повреждения, связанного с патологическим ангиогенезом.
27. Применение специфического связывающего элемента по любому из пп.1-10 в производстве лекарственного средства для лечения опухоли.
28. Применение специфического связывающего элемента по любому из пп.1-10 в производстве диагностического реагента.
Текст
010653 Настоящее изобретение относится к нацеливанию на опухолевую сосудистую сеть при использовании молекул меченного радиоактивным изотопом антитела. В частности, изобретение относится к применению молекул антитела, которые связываются с ED-B фибронектином и демонстрируют полезность при нацеливании на опухоли. В различных воплощениях настоящего изобретения молекулы антитела используются в различных формах молекул. В определенных воплощениях молекулы антитела включают IgG1 человека. В других воплощениях молекулы антитела представляют собой мини-иммуноглобулины, например такие, которые получены путем слияния молекулы scFv антитела с константным доменом СН 4 секреторной изоформы IgE, содержащей обычно цистеин на своем терминальном СООН-конце, который образует ковалентно связанный димер. Скорость выведения из крови, стабильность in vivo и другие благоприятные свойства используются в различных аспектах и воплощениях настоящего изобретения, например при нацеливании на опухоли. Различное поведение в условиях in vivo различных форм молекул антитела может использоваться для различных диагностических и/или терапевтических целей, в зависимости от клинических потребностей и заболевания. Несмотря на свой громадный потенциал в качестве терапевтических агентов, моноклональные антитела (монАТ), имеющие происхождение не от человека, являлись неуспешными в клинических экспериментах в результате своей иммуногенности (1 Shawlert и др., 1985; 2 Miller и др., 1983), слабых фармакокинетических свойств (3 Hakimi и др., 1991; 4 Stephens и др., 1995) и недостаточной эффективности относительно пополнения эффекторных функций (5 Riechmann и др., 1988; 6 Junghens и др., 1990). Последние исследования изоляции фрагментов человеческого антитела из фаговых дисплейных библиотек(7 McCafferty и др., 1990; 8 Lowman и др., 1991; для обзора см. 9 Nilsonn и др., 2000 и 10 Winter и др.,1994) преодолели эти проблемы, оживили исследования и воскресили надежды относительно применения этих реагентов для лечения важных заболеваний. Несомненно, эти молекулы служили бы идеальными строительными блоками для новых диагностических и терапевтических средств (11 Reichert, 2001; 12Huls и др., 1999). Кроме того, для клинического применения эти антитела могут быть подвергнуты "созреванию" для достижения аффинностей в пикомолярном интервале (13 Pini и др., 1998), что является, по крайней мере, желательным, если не обязательным. Однако клиническое применение фрагментов человеческих антител для селективной доставки диагностических или терапевтических агентов требует высокоспецифических мишеней. В случае опухолей наиболее пригодными мишенями являются антигены поверхности клетки, которые обычно не являются такими, которые имеются в избытке, а также являются нестабильными. Тем не менее, во время развития опухоли микросреда, окружающая опухолевые клетки, подвергается значительной модификации, что порождает "опухолевую окружающую среду", которая представляет собой мишень для опухолевой терапии, основанной на антителах (14 Neri и Zardi, 1998). В действительности, концепция, что измененная микросреда, окружающая опухоли, сама по себе представляет собой канцерогенный фактор, который может быть подвергнут нацеливанию, все больше и больше получает всеобщее признание. Молекулы,которые являются способными доставлять терапевтические агенты к микросреде, окружающей опухоли,таким образом, представляют собой многообещающие и важные новые средства для раковой терапии(15 Bissel, 2001; 14 Neri и Zardi, 1998). Фибронектин представляет собой компонент экстрацеллюлярного матрикса (ЕСМ), который широко экспрессируется в разнообразии нормальных тканей и жидкостей организма. Различные изоформы FN могут быть получены с помощью альтернативного сплайсинга пре-мРНК, процесса, который модулируется цитокинами и значением экстрацеллюлярного рН (16 Balza и др., 1988; 17 Carnemolla и др., 1989; 18 Borsi и др., 1990; 19 Borsi и др., 1995). Полный повтор типа III ED-B, который также известен как повтор экстратипа III (EIIIB), может быть полностью включен или не включен в молекулу FN (20 Zardi и др., 1987). ED-B является высококонсервативным в различных видах и имеет 100%-ную гомологию у всех млекопитающих, изученных до сих пор (человек, крыса, мышь, собака), и 96%-ную гомологию с подобным доменом у кур. Изоформа FN, содержащая ED-B (B-FN), не определяется иммуногистохимически в нормальных тканях взрослого человека, за исключением тканей, подвергшихся реконструкции(например, эндометрий и яичник), и во время заживления ран (17 Carnemolla и др., 1989; 21 FrenchConstant, и др., 1989). В противовес этому, его экспрессия в опухолях и тканях плода является высокой(17 Carnemolla и др., 1989). Кроме того, было продемонстрировано, что B-FN представляет собой маркер ангиогенеза (22 Castellani и др., 1994) и что эндотелиальные клетки, прорастающие в опухолевые ткани,мигрируют вдоль волокон ЕСМ, содержащих B-FN (23 Tarli и др., 1999). Селективное нацеливание опухолевой сосудистой сети было описано при использовании человеческого рекомбинантного антитела, scFv (L19) (13 Pini и др., 98), специфического для изоформы B-FN(24 Carnemolla и др., 1996; 23 Tarli и др., 99; 25 Viti и др., 99; 26 Neri и др., 97; 27 Demartis и др., 2001). Антитело может использоваться как при диагностике in vivo (иммуно-гамма-топография), так и при терапевтических подходах, предназначенных для селективной доставки терапевтических радионуклидов или токсических агентов к опухолевой сосудистой сети. В дополнение, Birchler и др. (28, 1999) показали,что scFv (L19), химически слитый с фотосенсибилизатором, селективно аккумулируется во вновь образовавшихся кровеносных сосудах на ангиогенной модели роговицы кролика и после облучения с помощью части спектра, расположенной вблизи ИК, опосредует полную и селективную окклюзию окулярной-1 010653 недавно образовавшейся сосудистой сети. Совсем недавно Nilsson и др. (29, 2001) сделали сообщение, что scFv (L19) с внеклеточным доменом тканевого фактора роста опосредует селективный некроз вследствие нарушения кровоснабжения на различных типах мышиных опухолей. Кроме того, слитые белки scFv (L19) и IL-2 или IL-12 продемонстрировали улучшенную терапевтическую эффективность этих двух цитокинов (30 Halin и др., в печати; 31Carnemolla и др., 2002). См. также WO 01/62298 для применения слитых белков при лечении повреждений, связанных с патологическим ангиогенезом, включая опухоли. В завершение, поскольку L19 в равной степени реагирует как с мышиным, так и с человеческим ED-B, оно может использоваться как для предклинических, так и клинических исследований. См. также PCT/GB97/01412, РСТ/ЕР 99/03210,PCT/EP01/02062 и PCT/IB01/00382. Различные формы антител показали различное поведение в отношении стабильности, клиренса и характеристики опухолевого нацеливания (32 Wu и др., 2000). Мини-иммуноглобулин или небольшой иммунопротеин (SIP) описан в 33 Li и др., 1997. Настоящее изобретение основывается на получении, характеристике и исследовании биораспределения in vivo молекул человеческого антитела L19 в виде различных форм, а именно scFv, мини-иммуноглобулина и полного IgG1, и мечении их с помощью радиоизотопов. Краткое описание фигур Фиг. 1 показывает модели, иллюстрирующие структуры различных белков. А: модель структуры домена субъединицы FN. Последовательности белка, подвергающиеся альтернативному сплайсингу,обозначены серым цветом. Как указано, эпитоп рекомбинантного антитела L19 размещается в пределах повтора ED-B. В-D: схемы элементов, используемых для экспрессии, соответственно, L19 (scFv) (В);L19-SIP (С) и L19-IgG1/. Фиг. 2 показывает кривые роста опухоли SK-MEL-28 у бесшерстных мышей (треугольники) и опухоли F9 в мышином штамме 129 (кружочки). Объем (мм 3) представлен против времени (дни). Каждая точка представляет собой среднее значение для 6 мышей SD. Фиг. 3 показывает результаты вытеснительной хроматографии, полученные на различных формахL19. В наборах А, В и С показаны профили вытеснительной хроматографии (Супердекс 200) форм L19,scFv, мини-иммуноглобулина и IgG1, соответственно, после мечения с помощью радиоактивного йода. Наборы D, Е и F показывают профили вытеснительной хроматографии (Супердекс 200) плазмы крови в указанные моменты времени после внутривенной инъекции меченных радиоактивным йодом форм L19,scFv, мини-иммуноглобулина и IgG1, соответственно. Не определяли никаких изменений в профилях кривых L19-SIP или L19-IgG1, когда использовали загрузку плазмой, взятой в различные моменты времени после инъекции, в то время, как через 3 ч после инъекции L19 (scFv) наблюдали второй пик более высокой молекулярной массы. Фиг. 4 показывает результаты экспериментов по биораспределению у мышей, несущих опухоль SKMEL-28, при использовании различных видов меченной радиоактивным йодом молекулы антитела L19. Показаны вариации значения % ID/г в опухоли (фиг. 4 А) и в крови (фиг. 4 В) в указанные моменты времени после внутривенной инъекции. На фиг. 4 С нанесены соотношения значений % ID/г в опухоли и крови. Кривые для L19 (scFv) указаны ромбами, для мини-иммуноглобулина L19 - квадратами, а дляIgG1 L19 - треугольниками. Фиг. 5 показывает результаты экспериментов по биораспределению у мышей, несущих опухоль F9,при использовании меченного радиоактивным йодом L19 (scFv) (квадраты) и L19 мини-иммуноглобулина (ромбы). Показаны вариации значений % ID/г опухоли (А) и крови (В) в определенные моменты времени после внутривенной инъекции. Фиг. 6 показывает изменения площади опухоли U251 (квадратные миллиметры) в течение времени(дни) после инъекции физиологического раствора и I-131-L19-SIP, соответственно. Настоящее изобретение относится к специфическим связывающим элементам, которые связываются с ED-B фибронектином человека, при этом специфические связывающие элементы являются меченными с помощью одного или более изотопов, выбранных из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At. Изобретение также обеспечивает способы получения таких специфических связывающих элементов и их применение для диагностических и терапевтических целей. Специфические связывающие элементы в соответствии с изобретением демонстрируют полезные свойства в экспериментах на животных, такие как доставка более высоких доз к опухоли по сравнению с костным мозгом и более высокая аккумуляция в опухоли. В одном аспекте настоящее изобретение обеспечивает специфические связывающие элементы, которые связываются с ED-B фибронектина человека и которые включают домен VH L19 и домен VL, необязательно домен VL L19, при этом специфический связывающий элемент включает мини-иммуноглобулин, содержащий указанный домен VH антитела и домен VL антитела, слитый с S2-CH4 и димеризованный, или включает цельную молекулу IgG1 антитела, где специфический связывающий элемент является радиоактивно меченным с помощью изотопа, выбранного из группы, которая состоит из 76Br, 77Br, 123I, 124I,131I и 211At. Предпочтительно, когда изотопы представляют собой 123I или 131I, наиболее предпочтительно 131I.-2 010653 Радиоактивная метка или радиоактивно меченная молекула, которая может быть присоединена к специфическому связывающему элементу, может быть меченной на остатке тирозина, лизина или цистеина. Последовательности домена VH L19 и домена VL L19 приведены у Pini и др. (1998) J. Biol. Chem. 273: 21769-21776, эти последовательности полностью введены в данную заявку ссылкой на Pini и др. так,как будто представлены в данной заявке. В общем случае, домен VH образует пару с доменом VL с образованием сайта связывания антигена и антитела. В предпочтительном воплощении домен VH L19 образует пару с доменом VL L19 так, что образующийся сайт связывания антигена и антитела включает оба домена VH и VL L19. В других воплощениях VH L19 образует пару с доменом VL, отличным от VL L19. Промискуитет легких цепей является хорошо установленным в области техники. Один или более CDR могут быть взяты из домена VH или VL L19 и встроены в приемлемую рамку считывания. Это дополнительно обсуждается ниже. CDR 1, 2 и 3 VH L19 представлены в SEQ ID NO. 1,2 и 3, соответственно. CDR 1, 2 и 3 VL L19 представлены в SEQ ID NO. 1, 2 и 3, соответственно. В предпочтительном воплощении специфический связывающий элемент представляет собой L19SIP, наиболее предпочтительно меченный 123I L19-SIP (в данной заявке обозначается как I-123-L19-SIP) или меченный 131I L19-SIP (в данной заявке обозначается как I-131-L19-SIP). Варианты доменов VH и VL, а также CDR, последовательности которых представлены в данной заявке и которые могут использоваться при специфическом связывании элементов с ED-B, могут быть получены с помощью способов изменения или мутации последовательности и скрининга. Варианты аминокислотной последовательности вариабельного домена любого из доменов VH и VL, последовательности которых специфически раскрыты в данной заявке, могут использоваться в соответствии с настоящим изобретением, как обсуждается в данной заявке. Частные варианты могут включать одно или более изменений аминокислотной последовательности (добавление, делеция, замена и/или инсерция аминокислотного остатка), может быть осуществлено менее чем приблизительно 20 изменений, менее чем приблизительно 15 изменений, менее чем приблизительно 10 изменений или менее чем приблизительно 5 изменений, 4, 3, 2 или 1. Изменения могут быть осуществлены в одном или более участках рамки считывания и/или одного или более CDR. Специфический связывающий элемент в соответствии с изобретением может быть таким, который конкурирует за связывание с антигеном со специфическим связывающим элементом, при этом обе конструкции связываются с ED-B и включают сайт связывания антигена, образованный доменом VH L19 и доменом VL L19. Конкуренция между связывающими элементами может быть легко подвергнута оценкеin vitro при использовании, например, ELISA и/или путем мечения специфического связывающего элемента специфической репортерной молекулой, которая может быть определена в присутствии другого(их) не меченого(ых) элемента(ов), для того, чтобы позволить проводить идентификацию специфических связывающих элементов, которые связывают с тем же эпитопом или перекрывающимся эпитопом. Таким образом, дополнительные аспекты настоящего изобретения используют специфический связывающий элемент, включающий сайт связывания антитела и антигена, при этом указанный сайт конкурирует с L19 за связывание с ED-B. Специфический связывающий элемент в соответствии с настоящим изобретением может связываться с ED-B, по крайней мере, с аффинностью, свойственной L19, при этом связывающая аффинность различных специфических связывающих элементов сравнивается при приемлемых условиях. В дополнение к последовательностям антитела, специфический связывающий элемент в соответствии с настоящим изобретением может включать дополнительные аминокислоты, например образующие пептид или полипептид, такой как складчатый домен, или для придания молекуле другой функциональной характеристики в дополнение к способности связывать антиген. Специфические связывающие элементы в соответствии с изобретением могут нести определяемую метку или могут быть конъюгированы с токсином или ферментом (например, посредством пептидильной связи или линкера). При лечении расстройств или поражений, связанных с патологическим ангиогенезом, специфический связывающий элемент в соответствии с изобретением может быть конъюгирован с токсической молекулой, например биоцидной или цитотоксической молекулой, которая может быть выбрана из интерлейкина-2 (IL-2), доксорубицина, интерлейкина-12 (IL-12), гамма-интерферона (IFN-), фактора некроза опухоли(TNF) и тканевого фактора (предпочтительно укороченного тканевого фактора, например до остатков 1-219). См., например, WO 01/62298. Специфические связывающие элементы в соответствии с изобретением могут использоваться в способе лечения или диагностики организма человека или животного, в таком как способ лечения (который может включать профилактическое лечение) заболевания или расстройства у пациента, который представляет собой человека, который включает введение указанному пациенту эффективного количества специфического связывающего элемента в соответствии с изобретением. Предпочтительно, когда специфический связывающий элемент в соответствии с изобретением вводится пациенту путем парентерального введения. Состояния, которые подвергаются лечению в соответствии с настоящим изобретением, включают опухоли, в частности солидные опухоли, и другие повреждения, связанные с патологиче-3 010653 ским ангиогенезом, включая ревматоидный артрит, диабетическую ретинопатию, старческую дегенерацию желтого пятна и ангиомы. Специфические связывающие элементы являются хорошо пригодными для мечения радиоактивными изотопами, выбранными из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At, и последующего применения в радиодиагностике и радиотерапии. Еще один аспект обеспечивает способ получения специфического связывающего элемента в соответствии с изобретением, включающий мечение специфического связывающего элемента радиоизотопом, выбранным из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At. Для непосредственного мечения радиоактивным изотопом можно метить остатки тирозина в молекуле. При этой специфической процедуре галогенид, например Br-, I-, At-, окисляют с помощью приемлемого окислителя, например йодогена (пробирки с покрытием), гранул йода, хлорамина-Т (натриевая соль N-хлор-n-толуолсульфонамида) и др., в присутствии активного фармацевтического ингредиента (API). Косвенное мечение с помощью брома, йода или астата можно осуществлять при использовании предварительного мечения бифункционального носителя галогена, который предпочтительно получают,например, из производных бензойной кислоты, производных Болтона-Хантера, производных бензола и др. Носитель может быть трансформирован в активированные формы, которые конъюгируют к -аминогруппе остатков лизина или к N-терминальному концу API. Такой косвенный способ также обеспечивает синтетический путь получения радиоактивно меченных пептидных соединений хемо-селективно на сульфгидрильной группе остатка цистеина. Мостиковые молекулы цистеина могут сначала восстанавливаться с помощью приемлемого восстанавливающего агента, например хлорида олова(II), трис(2-карбоксиэтил)фосфина (ТСЕР), формирующего свободные группы SH цистеина, которые могут реагировать с носителем галогена. Производные малеимида и -бромацетамида могут использоваться в качестве функциональных групп для связывания. Способ получения специфического связывающего элемента в соответствии с изобретением может включать экспрессию нуклеиновой кислоты, кодирующей специфический связывающий элемент, перед мечением специфического связывающего элемента. Таким образом, в качестве более раннего этапа способ получения специфического связывающего элемента может необязательно включать индукцию и обеспечение возможности осуществления экспрессии кодирующей нуклеиновой кислоты, то есть нуклеиновой кислоты, включающей последовательность, кодирующую специфический связывающий элемент. Такой способ может включать культивирование хозяйских клеток в условиях, необходимых для получения указанного специфического связывающего элемента. Способ получения может включать этап изоляции и/или очистки продукта. Специфический связывающий элемент может быть изолирован или очищен после экспрессии нуклеиновой кислоты и/или выделен из хозяйских клеток. Изоляция и/или очистка может предварять мечение. Альтернативно или дополнительно, специфический связывающий элемент может быть изолирован и/или очищен после мечения. Способ получения может включать рецептирование продукта в композицию, включающую по крайней мере один дополнительный компонент, такой как фармацевтически приемлемый наполнитель. Таким образом, (меченый) специфический связывающий элемент может быть рецептирован в композицию, включающую по крайней мере один дополнительный компонент, такой как фармацевтически приемлемый наполнитель. Эти и другие аспекты изобретения описаны более подробно ниже. Терминология Специфический связывающий элемент. Этот термин описывает элемент пары молекул, которые обладают связывающей специфичностью по отношению друг к другу. Элементы специфической связывающей пары могут иметь природное происхождение или могут быть полностью или частично полученными синтетически. Один элемент специфической связывающей пары молекул имеет участок или полость на своей поверхности, которые специфически связываются и, следовательно, являются комплементарными к определенной пространственной и полярной организации другого элемента пары молекул. Таким образом, элементы пары имеют свойство специфического связывания друг с другом. Примеры типов пар специфического связывания представляют собой пары антиген-антитело, биотин-авидин, гормон-рецептор гормона, рецептор-лиганд, фермент-субстрат. Эта заявка относится к реакциям типа антиген-антитело. Молекула антитела. Это понятие описывает иммуноглобулин, либо природный, либо частично или полностью полученный синтетически. Термин также охватывает любой полипептид или белок, включающий домен связывания антитела. Фрагменты антитела, которые включают домен связывания антигена, представляют собой такие, как Fab, scFv, Fv, dAb, Fd; диантитела. Настоящее изобретение относится к цельным молекулам IgG1 антитела и мини-иммуноглобулинам, включающим S2-CH4, как раскрыто в данной заявке. Для получения из исходной молекулы антитела других молекул антитела, которые сохраняют специфичность исходной молекулы антитела, могут использоваться способы технологии рекомбинантной ДНК. Такие методики могут вовлекать встраивание ДНК, кодирующей вариабельный участок иммуноглобулина-4 010653 или участки, определяющие комплементарность (CDR) антитела, в константные участки или константные участки плюс участки рамки считывания. См., например, ЕР-А-184187, GB 2188638A или ЕР-А-239400. Поскольку антитела могут быть модифицированы с помощью ряда способов, термин "молекула антитела" будет толковаться как такой, который охватывает любой специфический связывающий элемент или вещество, содержащие связывающий антиген домен антитела с требуемой специфичностью. Таким образом, этот термин охватывает фрагменты или производные антитела, включая любой полипептид,содержащий иммуноглобулиновый домен связывания антигена, либо природный, либо частично или полностью синтетический. Следовательно, сюда также относятся химерные молекулы, включающие связывающий домен иммуноглобулина, или аналог, слитый с дополнительным полипептидом. Клонирование и экспрессия химерных антител описаны в ЕР-А-0120694 и ЕР-А-0125023. Домен, связывающий антиген. Этот термин описывает часть молекулы антитела, которая включает участок, который специфически связывается с антигеном или является комплементарным части или всему антигену. Если антиген является большим, то антитело может связывать только определенную часть антигена, при этом такая часть называется эпитопом. Домен связывания антигена может быть обеспечен с помощью одного или более вариабельных доменов антитела (например, так называемого Fd фрагмента антитела, состоящего из домена VH). Предпочтительно, когда домен, связывающий антиген, включает вариабельный участок легкой цепи антитела (VL) и вариабельный участок тяжелой цепи антитела (VH). Специфичный. Этот термин может использоваться для отнесения к ситуации, при которой один элемент пары специфического связывания не будет выявлять какого-либо значительно связывания с молекулами, отличными от их специфического(их) партнера(ов) связывания. Этот термин также используется тогда, когда,например, домен связывания является специфичным для определенного эпитопа, который образуется рядом антигенов, в этом случае специфический связывающий элемент, несущий домен связывания антигена, будет способен к связыванию с различными антигенами, несущими эпитоп. Включать. Этот термин, в общем случае, используется в смысле "содержать", то есть как такой, который разрешает наличие одной или более характеристик или компонентов. Изолированный. Этот термин относится к состоянию, в котором в соответствии с изобретением, как правило, будут пребывать специфические связывающие элементы в соответствии с изобретением или нуклеиновая кислота, кодирующая такие связывающие элементы. Элементы и нуклеиновая кислота будут свободными или существенно свободными от материала, с которым они закономерно ассоциированы, таким как другие полипептиды или нуклеиновые кислоты, с которыми их обнаруживают в их естественной окружающей среде или в окружающей среде, из которой их получают (например, культуре клеток), если такой препарат получают при использовании технологии рекомбинантной ДНК in vitro или in vivo. Элементы и нуклеиновая кислота могут быть рецептированы с разбавителями или вспомогательными веществами и,кроме того, для практических целей могут быть изолированы; например, элементы будут обычно смешиваться с желатином или другими наполнителями, если они используются для покрытия микротитровальных планшетов в иммуноанализах, или будут смешиваться с фармацевтически приемлемыми наполнителями или разбавителями, когда используются в диагностике или терапии. Специфические связывающие элементы могут быть гликозилированными либо естественным путем, либо с помощью систем гетерологических эукариотических клеток (например, СНО или NS0 (ЕСАСС 85110503) клеток), или они могут быть негликозилированными (например, если получены с помощью экспрессии в прокариотической клетке). Под выражением "существенно так, как изложено" понимают, что релевантный CDR, VH или VL домен в соответствии с изобретением будет либо идентичным, либо высоко подобным указанным участкам, последовательности которых представлены в данной заявке. Под выражением "высоко подобные" подразумевают, что от 1 до 5, предпочтительно от 1 до 4 , например от 1 до 3, или 1, или 2, или 3, или 4 замены могут быть сделаны в CDR и/или в домене VH или VL. Структура, предназначенная для содержания CDR, в соответствии с изобретением будет обычно представлять собой последовательность тяжелой или легкой цепи антитела или существенную ее часть, в которой CDR находится в положении, соответствующем таковому для CDR существующих в природе вариабельных доменов VH и VL антитела, которые кодируются перегруппированными генами иммуноглобулина. Структуры и расположение вариабельных доменов иммуноглобулина могут быть определены со ссылкой на Rabat, E.A. и др., Sequences of Proteins of Immunological Interest. 5-ое изд. US Department ofHealth and Human Services. 1991, и уточнения, которые являются сейчас доступными в Интернете(http://immuno.bme.nwu.edu или при поиске "Kabat" с использованием любого поискового средства). Предпочтительно, когда аминокислотная последовательность CDR, как представлено в данной заявке, содержится в виде CDR вариабельного домена человека или его существенной части. Последовательности CDR3 VH L19 и/или CDR3 VL L19 существенно так, как представлено в данной заявке, могут использоваться в предпочтительных воплощениях настоящего изобретения, и является предпочтительным, когда каждая из них содержится в виде CDR3 в вариабельном домене тяжелой или легкой цепи че-5 010653 ловека, в зависимости от обстоятельств, или в виде его существенной части. Существенная часть вариабельного домена иммуноглобулина будет включать по крайней мере три участка CDR вместе с их промежуточными участками рамки считывания. Предпочтительно, когда часть будет также включать по крайней мере около 50% участков одной или обеих, первой и четвертой, рамок считывания, указанные 50% состоят из 50% С-терминальной части участка первой рамки считывания и 50% N-терминальной части участка четвертой рамки считывания. Дополнительные остатки на N-терминальном или С-терминальном конце существенной части вариабельного домена могут быть такими, которые обычно не ассоциированы с существующими в природе участками вариабельного домена. Например, конструирование специфических связывающих элементов в соответствии с настоящим изобретением, которое осуществляют с помощью способов рекомбинантной ДНК, может приводить к встраиваниюN- или С-терминальных остатков, которые кодируются линкерами, введенными для улучшения клонирования или других манипуляционных этапов. Другие манипуляционные этапы включают введение линкеров для соединения вариабельных доменов в соответствии с изобретением с дополнительными белковыми последовательностями, включая тяжелые цепи иммуноглобулина, другие вариабельные домены или белковые метки, как обсуждается более подробно ниже. В молекуле IgG1 антитела в соответствии с изобретением домены VL могут быть присоединены на С-терминальном конце к константным доменам легкой цепи антитела, включая С или С, предпочтительно цепи С. В дополнение к мечению с помощью 76Br, 77Br, 123I, 124I, 131I и/или 211At, специфические связывающие элементы в соответствии с изобретением могут быть меченными с помощью второй обнаруживаемой или функциональной метки. Обнаруживаемые метки описаны ниже и включают радиоактивные метки, такие как радиоизотопы технеция, индия, иттрия, меди, лютеция или рения, в частности 94mTc, 99mTc,186Re, 188Re, 111In, 86Y, 88Y, 177Lu, 64Cu и 67Cu, которые могут быть присоединены к антителам в соответствии с изобретением при использовании традиционных способов, известных в области визуализации антител, как описано в данной заявке. Другие изотопы, которые могут использоваться, включают 203Pb,67Ga, 68Ga, 43Sc, 47Sc, 110mIn, 97Ru, 62Cu, 68Cu, 86Y, 88Y, 90Y, 121Sn, 161Tb, 153Sm, 166Ho, 105Rh, 177Lu, 72Lu и 18F. Метки также включают ферментные метки, такие как пероксидаза хрена. Метки также дополнительно включают химические остатки, такие как биотин, которые могут определяться посредством связывания со специфическим определяемым остатком, например меченым авидином. Пример прописи для осуществления мечения является следующим. Для прямого мечения радиоактивным изотопом специфические связывающие элементы молекулы с мостиковым цистеином сначала восстанавливали при использовании приемлемого восстанавливающего агента, например хлорида олова(II), трис(2-карбоксиэтил)фосфина (ТСЕР), получая при этом свободныеSH-группы цистеина, которые могут реагировать с изотопами, например Тс или Re. При осуществлении этой конкретной процедуры перметалаты, полученные с помощью настоящей системы, восстанавливали с помощью восстанавливающего агента, например хлорида олова(II), в присутствии вспомогательного лиганда, например тартрата натрия API (подробности приведены ниже в экспериментальной части). Непрямое мечение с помощью, например, индия, иттрия, лантаноидов или технеция и рения может быть осуществлено с помощью предварительной конъюгации хелатирующего лиганда, который предпочтительно получен из этилендиаминтетрауксусной кислоты (EDTA), диэтилентриаминпентауксусной кислоты (DTPA), циклогексил 1,2-диаминтетрауксусной кислоты (CDTA), этиленгликоль-О,О'-бис(2 аминоэтил)-N,N,N',N'-диуксусной кислоты (HBED), триэтилентетраамингексауксусной кислоты (ТТНА),1,4,7,10-тетраазациклононан-N,N',N-тетрауксусной кислоты (DOTA), 1,4,7-тетраазациклононан-N,N',N"триуксусной кислоты (NOTA), 1,4,8,11-тетраазациклотетрадекан-N,N',N",N-тетрауксусной кислоты(ТЕТА), меркаптоацетилдиглицина (MAG2), меркаптоацетилтриглицина (MAG3), меркаптоацетилглицилцистеина (MAGC), цистеинилглицилцистеина (CGC), либо с аминогруппами, либо с группами тиола специфического связывающего элемента. Хелатирующие лиганды имеют приемлемую связывающую группу, например активные эстеры, малеимиды, тиокарбаматы или -галогенированные ацетамидные остатки. Для конъюгации хелатирующих лигандов с аминогруппами, например -NH2-группами остатков лизина, предварительное восстановление соединения L-19-SIP не является необходимым. Способы мечения специфического связывающего элемента могут включать конъюгацию активированного бифункционального галоидного носителя, содержащего радиоизотоп, выбранный из группы,состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At, с остатком лизина или N-терминальным концом и с остатком цистеина специфического связывающего элемента. Способ может включать конъюгацию галоидного носителя с остатком лизина или цистеина специфического связывающего элемента или с N-терминальным концом специфического связывающего элемента. Один из двух или оба (i) остатка цистеина и (ii) остатка лизина или N-терминальный конец могут быть меченными с помощью одного и того же или различных радиоизотопов в соответствии с изобретением. Специфические связывающие элементы в соответствии с настоящим изобретением предназначены для применения в способах диагностики или лечения человека или животных, предпочтительно человека. Специфические связывающие элементы являются особенно приемлемыми для применения в спосо-6 010653 бах радиотерапии и радиодиагностики. В соответствии с этим дополнительные аспекты изобретения обеспечивают способы лечения,включающие введение специфического связывающего элемента, как обеспечивается в данной заявке,фармацевтические композиции, включающие такой специфический связывающий элемент, и применение такого специфического связывающего элемента при производстве лекарственного средства для введения, например, в способе получения лекарственного средства или фармацевтической композиции,включающем рецептирование специфического связывающего элемента с фармацевтически приемлемым наполнителем. Клинические показания, при которых может использоваться специфический связывающий элемент в соответствии с изобретением для обеспечения терапевтического преимущества, включают опухоли, такие как солидная опухоль, а также другие повреждения, ассоциированные с патологическим ангиогенезом, включая ревматоидный артрит, диабетическую ретинопатию, старческую макулярную дегенерацию и ангиомы. Специфические связывающие элементы в соответствии с изобретением могут использоваться в способе лечения организма человека или животного, таком как способ лечения заболевания или расстройства у пациента, представляющего собой человека, который включает введение указанному пациенту эффективного количества специфического связывающего элемента в соответствии с изобретением. Является предпочтительным, когда лечение представляет собой радиотерапию. Состояния, которые могут лечиться в соответствии с настоящим изобретением, обсуждаются и в другом месте в данной заявке. Специфические связывающие элементы в соответствии с изобретением могут использоваться при создании изображений с помощью SPECT (компьютерная томография), при создании изображений с помощью PET (позитронная эмиссионная томография) и терапии. Предпочтительные изотопы для SPECTвизуализации включают 123I и 131I. Предпочтительный изотоп для PET представляет собой 124I. 131I представляет собой предпочтительный изотоп для использования в терапии. Благодаря применению различных изотопов одного элемента для создания изображений и терапии биораспеределение соответствующих иммуноконъюгатов является идентичным. Это представляет собой преимущество по сравнению с другими подходами, которые применяют меченные 111In производные для визуализации с целью предсказания биораспределения соответствующих меченных 90Y терапевтических производных, так как биораспределение соответствующих производных, меченных 111In и 90Y, может быть различным; см. Carrasquillo J.A. и др. (1999) J. Nucl. Med. 40: 268-276. В соответствии с этим дальнейшие аспекты настоящего изобретения обеспечивают способы лечения,включающие введение специфического связывающего элемента, как обеспечивается в данной заявке,фармацевтических композиций, включающих такой специфический связывающий элемент, и применение такого специфического связывающего элемента при производстве лекарственного средства для введения,например, в способе получения лекарственного средства или фармацевтической композиции, включающем рецептирование специфического связывающего элемента с фармацевтически приемлемым наполнителем. В соответствии с настоящим изобретением композиции, которые обеспечиваются, могут назначаться индивидуумам. Введение предпочтительно осуществляют в "терапевтически эффективном количестве", это является достаточным для того, чтобы продемонстрировать преимущество для пациента. Такое преимущество может заключаться, по крайней мере, в улучшении по крайней мере одного симптома. Фактическое количество, которое вводится, частота и длительность курса введения будут зависеть от природы и тяжести состояния, которое подвергается лечению. Назначение лечения, например выбор дозировки и т.п., находятся в рамках компетенции терапевтов и врачей других медицинских специальностей. Приемлемые дозы антитела являются хорошо известными в области техники; см. Ledermann J.A. и др. (1991) Int. J. Cancer 47: 659-664; Bagshawe K.D. и др. (1991) Antibody, Immunoconjugates and Radiopharmaceuticals 4: 915-922. Композиция может вводиться отдельно или в сочетании с другими способами лечения либо одновременно, либо последовательно, в зависимости от состояния, которое подвергается лечению. Специфические связывающие элементы в соответствии с настоящим изобретением, включая те, что содержат домен связывания антигена антителом, могут вводиться пациенту, который нуждается в таком лечении, с помощью любого приемлемого способа, обычно путем инъекции в кровяное русло и/или непосредственно в место, которое подвергается лечению, например опухоль. Предпочтительно, когда специфический связывающий элемент вводится парентерально. Точная доза будет зависеть от ряда факторов: способа лечения, размера и расположения области, которую подвергают лечению (например, опухоли), определенной природы антитела (например, цельная молекула IgG1 антитела, молекула мини-иммуноглобулина) и природы какой-либо определяемой метки или другой молекулы, присоединенной к молекуле антитела. Типичная доза антитела будет находиться в пределах от 10 до 50 мг. Указанная доза представляет собой дозу для однократного лечения взрослого пациента, которая может быть пропорционально подобрана для детей и младенцев, а также подогнана для других форм антитела пропорционально молекулярному весу. Лечения можно повторять ежедневно, 2 раза в неделю, с недельными или месячными интервалами, по усмотрению лечащего врача. Специфические связывающие элементы в соответствии с настоящим изобретением будут обычно вводиться в форме фармацевтической композиции, которая может содержать по крайней мере один компонент в дополнение к специфическому связывающему элементу.-7 010653 Таким образом, фармацевтические композиции в соответствии с настоящим изобретением и для применения в соответствии с настоящим изобретением могут включать в дополнение к активному ингредиенту фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие материалы, которые хорошо известны квалифицированному специалисту в данной области. Такие материалы должны быть нетоксическими и не должны препятствовать действенности активного ингредиента. Точная природа носителя или другого материала будет зависеть от способа введения, который может быть пероральным или путем инъекции, например внутривенным. Для внутривенной инъекции или инъекции в сайт болезни активный ингредиент будет находиться в форме парентерально приемлемого водного раствора, который является свободным от пирогенов и имеет приемлемое значение рН, изотоничность и стабильность. Тот, кто владеет навыками в данной области,способен легко приготовить приемлемые растворы при использовании, например, изотонических носителей, таких как физиологический раствор для инъекции, раствор Рингера для инъекции, лактат Рингера для инъекции. В случае необходимости могут также включаться консерванты, стабилизаторы, буферы,антиоксиданты и/или другие дополнительные агенты. Композиция может вводиться отдельно или в комбинации с другими способами лечения либо одновременно, либо последовательно, в зависимости от состояния, которое подвергают лечению. Другие способы лечения могут включать введение приемлемых доз лекарственных средств, которые ослабляют боль, таких как нестероидные противовоспалительные лекарственные средства (например, аспирин, парацетамол, ибупрофен или кетопрофен) или опиаты, такие как морфин, или противорвотных средств. Настоящее изобретение обеспечивает способ, включающий индукцию или обеспечение возможности для осуществления связывания специфического связывающего элемента, как обеспечивается в данной заявке, с ED-B. Как отмечалось ранее, такое связывание может происходить in vivo, например, после введения специфического связывающего элемента или нуклеиновой кислоты, кодирующей специфический связывающий элемент, или этот процесс может происходить in vitro, например, при осуществленииELISA, Вестерн-блоттинга, иммуноцитохимии, иммунопреципитации или аффинной хроматографии. Может быть проведена количественная оценка связывания специфического связывающего элемента с ED-B. Количественная оценка может относиться к количеству антигена в исследуемом образце, который может представлять диагностический интерес. Реактивности антител по образцу могут быть определены с помощью любого приемлемого средства. Радиоиммуноанализ (RIA) представляет собой одну из таких возможностей. Меченный радиоактивным изотопом антиген смешивают с немеченым антигеном (исследуемый образец) и позволяют связаться с антителом. Связанный антиген физически отделяется от несвязанного антигена, и определяется количество радиоактивного антигена, связанного с антителом. Чем больше антигена находится в исследуемом образце, тем меньше радиоактивного антигена будет связываться с антителом. Анализ конкурентного связывания можно также использовать с нерадиоактивным антигеном при использовании антигена или аналога, связанного с репортерной молекулой. Репортерная молекула может представлять собой флуорохром, фосфорный или лазерный краситель со спектрально изолированными характеристиками поглощения или излучения. Приемлемые флуорохромы включают флуоресцеин, родамин, фикоэритрин и техасский красный. Приемлемые хромогенные красители включают диаминобензидин. Другие репортерные молекулы включают макромолекулярные коллоидные частицы или корпускулярный материал, такой как гранулы латекса, которые могут быть окрашенными, магнитными или парамагнитными, а также биологически или химически активными агентами, которые могут непосредственно или опосредовано вызывать обнаруживаемые сигналы, которые наблюдают визуально, определяют с помощью электронных приборов или регистрируют иным образом. Такие молекулы могут быть ферментами, катализирующими реакции, которые обеспечивают появление окрашивания или изменение окрашивания или, например, вызывают изменения в электрических свойствах. Они могут быть молекулярно возбудимыми, так что электронные переходы между электрическими состояниями приводят к характерным спектральным поглощениям или излучениями. Они могут включать химические структуры, которые используются при конъюгации с биосенсорами. Могут использоваться системы определения биотин/авидин, биотин/стрептавидин или на основе щелочной фосфатазы. Сигналы, генерируемые индивидуальными конъюгатами антитело-репортерная молекула, могут использоваться для получения определяемых абсолютных или относительных данных для релевантного связывания антитела в образцах (нормальных и исследуемых). Настоящее изобретение также распространяется на специфический связывающий элемент, который конкурирует за связывание с ED-B с любым специфическим связывающим элементом, где оба связываются с антигеном и содержат V домен, включая CDR с аминокислотной последовательностью, которая является существенно такой, как представлено в данной заявке, предпочтительно домен VH, включающий VH CDR3, который имеет последовательность SEQ ID NO. 3. Конкуренция между связывающими элементами может быть легко оценена in vitro, например, путем мечения одного связывающего элемента с помощью специфической репортерной молекулы, при этом связывающий элемент может быть определен в присутствии другого(их) немеченого(ых) связывающего(их) элемента(ов), для того, чтобы иметь возможность идентифицировать специфические связывающие элементы, которые связываются с тем же-8 010653 эпитопом или перекрывающимся эпитопом. Конкуренция может определяться, например, при использовании ELISA, как описано у Carnemolla и др. (24, 1996). Как указано выше, способы получения специфических связывающих элементов в соответствии с изобретением могут включать экспрессию кодирующей молекулы нуклеиновой кислоты и могут необязательно вовлекать культивирование хозяйских клеток при условиях, когда осуществляется продукция специфического связывающего элемента. Специфические связывающие элементы и кодирующие их молекулы нуклеиновой кислоты и векторы в соответствии с настоящим изобретением или для применения в настоящем изобретении могут обеспечиваться как изолированные и/или очищенные, например, от их естественной окружающей среды, в существенно чистой или гомогенной форме или, в случае нуклеиновой кислоты, свободные или существенно свободные от нуклеиновой кислоты или генов, которые имеют происхождение, отличное от последовательности, которая кодирует полипептид с требуемой функцией. Нуклеиновая кислота, которая используется в соответствии с настоящим изобретением, может включать ДНК или РНК и может быть полностью или частично синтетической. Ссылка на нуклеотидную последовательность, как представлено в данной заявке, охватывает молекулу ДНК с указанной последовательностью, а также охватывает молекулу РНК с указанной последовательностью, в которой U заменен на Т, если в контексте не требуется иное. Системы для клонирования и экспрессии полипептида в разнообразии различных хозяйских клеток являются хорошо известными. Приемлемые хозяйские клетки включают бактерии, клетки млекопитающих, дрожжевые и бакуловирусные системы. Линии клеток млекопитающих, доступные в области техники для экспрессии гетерологичных полипептидов, включают клетки яичника китайского хомяка, клетки HeLa, клетки почки детеныша китайского хомяка, клетки мышиной меланомы NSO и многие другие. В общем случае, предпочтительным бактериальным хозяином является Е. coli. Экспрессия антител и фрагментов антител в прокариотических клетках, таких как Е. coli, является хорошо зарекомендовавшей себя в области техники. Для обзора см., например, Pluckthun, A.Bio/Technology 9: 545-551 (1991). Экспрессия в эукариотических клетках в культуре также является доступной специалисту в области техники как возможность получения специфического связывающего элемента, для обзора последних сведений см., например, Ref, М.Е. (1993) Curr. Opinion Biotech. 4: 573-576;Trill J.J. и др. (1995) Curr. Opinion Biotech. 6: 553-560. Приемлемые векторы, которые могут быть выбраны или сконструированы, содержат приемлемые регуляторные последовательности, включая промоторные последовательности, терминаторные последовательности, последовательности полиаденилирования, последовательности энхансеров, маркерные гены и другие последовательности, если это является приемлемым. Векторы могут быть плазмидами, могут иметь вирусное происхождение, например фаги или фагемиды, если это является приемлемым. Более подробно см., например, Molecular Cloning: a Laboratory Manual: 3-е изд., Sambrook и др., 2001, ColdSpring Harbor Laboratory Press. Множество известных способов и прописей для манипуляции с нуклеиновой кислотой, например, при получении конструкций нуклеиновой кислоты, мутагенезе, секвенировании, встраивании ДНК в клетки и экспрессии генов, а также анализ белков описаны подробно в CurrentProtocols In Molecular Biology, 2-е изд., Ausubel и др. изд., John WileySons, 1992. Раскрытия, представленные в Sambrook и др. и Ausubel и др., введены в данную заявку в качестве ссылок. Способ получения специфического связывающего элемента в соответствии с изобретением может также включать введение нуклеиновой кислоты в хозяйскую клетку. При введении можно использовать любой доступный способ. Для эукариотических клеток приемлемые методики могут включать кальцийфосфатную трансфекцию, DEAE-декстран, электропорацию, трансфекцию, опосредованную липосомами,и трансдукцию при использовании ретровируса и других вирусов, например коровьей оспы, или для клеток насекомых - бакуловируса. Для бактериальных клеток приемлемые методики могут включать трансформацию на основе хлорида кальция, электропорацию и трансфекцию при использовании бактериофага. Введение может сопровождаться индукцией или предоставлением возможности для осуществления экспрессии при использовании нуклеиновой кислоты, например, путем культивирования хозяйских клеток при условиях, необходимых для экспрессии гена. В одном воплощении нуклеиновая кислота в соответствии с изобретением интегрируется в геном (например, хромосому) хозяйской клетки. Интеграция может быть стимулирована путем включения последовательностей, которые стимулируют рекомбинацию с геномом в соответствии со стандартными методиками. Дополнительные аспекты и воплощения настоящего изобретения будут очевидными специалисту в данной области техники в свете настоящего раскрытия, включающего следующие экспериментальные примеры. Способы синтеза и мечения специфических связывающих элементов в соответствии с настоящим изобретением наиболее полно иллюстрируются следующими примерами. Эти примеры представлены с целью иллюстрации, но не с целью ограничения. Все документы, упомянутые где-либо в этом описании, введены путем ссылки. Экспериментальные примеры аспектов и воплощений в соответствии с настоящим изобретением 1. Получение и характеристика специфических связывающих элементов в соответствии с настоящим изобретением. В описанных ниже примерах используются радиоактивно меченные пептидные соединения L19-SIP.-9 010653 1.1. Синтез 1-131-L19-SIP (хлорамин-Т способ). 200 мкг L19-SIP в 230 мкл PBS (0,2 М PBS, рН 7,4) помещали в реакционную пробирку, перемешивали с 185 МБк [131I]NaI и подвергали реакции с 30 мкл свежеприготовленного раствора хлорамина-Т (2 мг/мл) в 0,2 М PBS (рН 7,4). Через 1 мин прибавляли 50 мкл раствора Na2S2O5 (10 мг/мл в PBS 0,2 М, рН 7,4). Меченный 131I L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS), предварительно блокированной с помощью 5 мл 0,5% бычьего сывороточного альбумина в PBS. Радиохимический выход: 45,7%. Радиохимическая чистота: 88,3% (SDS-ПАГЭ). Специфическая активность: 31,7 МБк/нмоль. Иммунореактивность: 76%. 1.2. Синтез I-131-L19-SIP (йодогенный способ). 800 мкг L19-SIP в 800 мкл PBS (0,2 М PBS, рН 7,4) и 500 МБк [131I]NaI перемешивали и помещали в реакционную пробирку (йодогенная пробирка (йодоген-1,3,4,6-тетрахлор-3,6-дифенилглюколурил), PierceInc.). Смесь осторожно встряхивали в течение периода времени 30 мин при комнатной температуре. Меченный 131I L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS), предварительно блокированной с помощью 5 мл 0,5% бычьего сывороточного альбумина в PBS. Радиохимический выход: 93,2%. Радиохимическая чистота: 91,1% (SDS-ПАГЭ). Специфическая активность: 46,6 МБк/нмоль. Иммунореактивность: 78%. 1.3. Синтез I-123-L19-SIP (йодогенный способ). 200 мкг L19-SIP в 230 мкл PBS (0,2 М PBS, рН 7,4) и 200 МБк [123I]NaI перемешивали и помещали в реакционную пробирку (йодогенная пробирка Pierce Inc.). Смесь осторожно встряхивали в течение периода времени 30 мин при комнатной температуре. Меченный 123I L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS), предварительно блокированной с помощью 5 мл 0,5% бычьего сывороточного альбумина в PBS. Радиохимический выход: 81,6%. Радиохимическая чистота: 89,6% (SDS-ПАГЭ). Специфическая активность: 61,2 МБк/нмоль. Иммунореактивность: 84%. 1.4. Синтез I-124-L19-IP (йодогенный способ). 200 мкг L19-SIP в 230 мкл PBS (0,2 М PBS, рН 7,4) и 200 МБк [124I]NaI перемешивали и помещали в реакционную пробирку (йодогенная пробирка Pierce Inc.). Смесь осторожно встряхивали в течение периода времени 30 мин при комнатной температуре. Меченый 124I L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS), предварительно блокированной с помощью 5 мл 0,5% бычьего сывороточного альбумина в PBS. Радиохимический выход: 84,5%. Радиохимическая чистота: 89,6% (SDS-ПАГЭ). Специфическая активность: 22,8 МБк/нмоль. Иммунореактивность: 86%. 1.5. Синтез (3-(4-гидрокси-3-[131I]йодфенил)пропионат)-L19-SIP. 500 мкг (3-(4-гидроксифенил)-N-(сульфонатсукцинимидил)пропионата) растворяли в 1 мл ДМСО. 10 мл хлорамина-Т (5 мг/мл в PBS) перемешивали с 74 МБк [131I]NaI, нейтрализованного с помощью 15 мклPBS (0,2 М, рН 7,4). 1 мкл раствора (3-(4-гидроксифенил)-N-(сульфонатсукцинимидил)пропионата) прибавляли к раствору хлорамин-Т/[131I]NaI и оставляли смесь для осуществления реакции в течение 1 мин. Реакцию останавливали путем прибавления 40 мкл раствора Na2S2O5 (10 мг/мл в PBS 0,2 М, рН 7,4), после чего немедленно прибавляли 200 мкг L19-SIP в 230 мкл боратного буфера (0,2 М PBS, рН 8,5).(3-(4-гидрокси-3-[131I]йодфенил)пропионат)-L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS), предварительно блокированной с помощью 5 мл 0,5% бычьего сывороточного альбумина в PBS. Радиохимический выход: 37,2%. Радиохимическая чистота: 94,6% (SDS-ПАГЭ). Специфическая активность: 10,3 МБк/нмоль. Иммунореактивность: 69%. 1.6. MIRD подсчеты I-131-L19-SIP. Основываясь на данных относительно биораспеределения у мышей, несущих опухоль, поглощенные дозы меченного I-131 L19-SIP могут быть подсчитаны с помощью математической модели MIRD. Биокинетическое моделирование осуществляли при использовании данных % ID для I-131-L19-SIP у мышей, которые несут глиобластому человека (U251). Время удержания подсчитывали как площади под кривой би- и моноэкспоненциальных функций, интегрированных от нуля до бесконечности, включая биологический и физический период полувыведения соединения. Рассматривая органы мыши как источник излучения и как излучающую мишень, дозы, поглощен- 10010653 ные органом как самостоятельные дозы (отсутствует радиационная перекрестная наводка), могут быть оценены для I-131-L19-SIP при использовании S-значений из программного обеспечения MIRDOSE 3.1. Органные дозы для мышей (мГр/МБк): При использовании подсчитанных с помощью программы MIRDOSE 3.1 значений времени удержания поглощенные дозы для человека могут быть оценены для I-131-L19-SIP.- 11010653 Был сделан вывод о том, что костный мозг и репродуктивные органы (яичники/матка и яички) будут лимитирующими дозу органами. Тем не менее, терапевтическое окно, основанное на дозиметрических расчетах, выглядело благоприятно и многообещающе. Было обнаружено соотношение опухолевой дозы и дозы костного мозга, которое составляло 18. Таким образом, I-131-L19-SIP продемонстрировало значительное 18-кратное повышение доставляемой дозы для опухоли по сравнению с костным мозгом. 1.7. Изучение лечения опухоли после единичного внутривенного введения I-131-L19-SIP бесшерстным мышам, несущим опухоль.I-131-L19-SIP вводили 1 раз внутривенно бесшерстным мышам (вес тела приблизительно 27 г). Исследуемые дозы составляли 37 МБк и 74 МБк, соответственно. В дополнение исследовали контрольную группу животных (которым 1 раз вводили физиологический раствор). В течение последующих дней после инъекции размер опухолей (представленный в мм 2) определяли при использовании кронциркуля. Рост опухолей U251 у бесшерстных мышей подвергали наблюдению после единичной внутривенной инъекции физиологического раствора и I-131-L19-SIP, соответственно, как представлено на фиг. 6. Единичная инъекция I-131-L19-SIP с дозой 74 МБк на животное показала ощутимое влияние на рост опухоли U251, который приводил к остановке развития опухоли на 18 дней. То же самое было справедливым для группы низкой дозы (37 МБк), за исключением слабого опухолевого роста, который начинался в течение последних 5 дней для группы низкой дозы. В противовес этому, опухоли контрольной группы выявляли постоянный рост в течение всего периода наблюдения. Результаты этого исследования показали отличный потенциал I-131-L19-SIP для лечения солидных опухолей. 1.8. Визуализация I-123-L19-SIP после единичной внутривенной инъекции бесшерстным мышам,несущим опухоль. Вещество в соответствии с изобретением внутривенно вводили в дозе приблизительно 9,25 МБк бесшерстным мышам, несущим F9 (тератокарциному). Визуализацию с помощью гамма-камеры осуществляли в различные моменты времени после введения вещества. С помощью плоскостной гамма-топографии I-123-L19-SIP у бесшерстных мышей, несущих F9 (тератокарциному), спустя 4 ч после инъекции и 24 ч после инъекции в опухоль можно было получить четкое изображение опухоли. Через 4 ч после инъекции, кроме сильного поглощения в опухоли, может быть определен только слабый фон в остальной части организма (не связанный с определенным органом, но имеющий происхождение от кровяного пула). В то время, как сигнал в опухоли поддерживается, фоновый сигнал в остальной части организма исчезает со временем. Таким образом, через 24 ч после инъекции может быть определена только опухоль. Результаты этого исследования показывают отличный потенциал I-123-L19-SIP для получения изображений солидных опухолей. 2. Дополнительные примеры и эксперименты. Материалы и методы Получение и экспрессия scFv, малого иммунопротеина (SIP) и IgG1 конструкций scFv.ScFv (L19) (фиг. 1A) представляет собой аффинно зрелый (Kd=5,410-11 М) фрагмент антитела, специфично направленный против домена ED-B фибронектина (13 Pini и др., 1998). ScFv (D1.3) (7 McCafferty и др.; 26 Neri и др., 1997), scFv мышиного антитела к лизоциму куриного яичного белка использовали в качестве контроля. scFv экспрессировали в штамме Е. coli НВ 2151 (Maxim. Biotech., San Francisco СА) в соответствии с Pini и др. (34, 1997). Мини-иммуноглобулин. Для конструирования гена малого иммунопротеина L19 (L19-SIP) (фиг. 1 С) последовательность ДНК,кодирующую scFv (L19), подвергали амплификации с помощью полимеразной цепной реакции (ПЦР) при использовании Pwo ДНК-полимеразы (Roche) в соответствии с рекомендациями производителя, с праймерами ВС-618 (gtgtgcactcggaggtgcagctgttggagtctggg - SEQ ID NO. 8) и ВС-619 (gcctccggatttgatttccaccttggtcccttggcc SEQ ID NO. 9), содержащими рестрикционные сайты ApaLI и BspEI, соответственно. Продукт амплификации встраивали в ApaLI/BspEI вектора pUT-SIP, который обеспечивает ген scFv с сигналом секреции,необходимым для секреции белков во внеклеточную среду. Вектор pUT-SIP получали из ранее описанного pUT-SIP-long (33 Li и др., 1997) после замены константного домена 1-СН 3 доменом СН 4 IgE секреторной изоформы IgE-S2 человека (S2-CH4; 35 Batista и др., 1996). СН 4 представляет собой домен, который позволяет осуществлять димеризацию в молекуле IgE, а изоформа S2 содержит цистеин на карбокситерминальном конце, что стабилизирует димер IgE посредством внутрицепочечной дисульфидной связи. В заключительной молекуле SIP scFv (L19) является связанным с доменом S2-CH4 посредством короткого линкера GGSG. Ген SIP потом вырезали из плазмиды pUT-SIP-L19 с помощью рестрикционных ферментов HindIII и EcoRI и клонировали в экспрессионный вектор млекопитающих pcDNA3 (Invitrogen,Groningen, Netherlands), который содержит промотор цитомегаловируса (GMV), для того, чтобы получить конструкцию pcDNA3-L19-SIP. Последовательность ДНК, кодирующую scFv(D1.3), подвергали амплификации при использовании праймеров ВС-721 (ctcgtgcactcgcaggtgcagctgcaggagtca - SEQ ID NO. 10) и ВС-732 (ctctccggaccgtttgatctcgcgcttggt - 12010653SEQ ID NO. 11) и встраивали ApaLI/BspEI в вектор pUT-SIP. Ген D1.3-SIP потом вырезали из pUT-SIPD1.3 с помощью рестрикционных ферментов HindIII и EcoRI и клонировали в pcDNA3 для того, чтобы сконструировать pcDNA3-D1.3-SIP. Эти конструкции использовали для трансфекции мышиных клеток меланомы SP2/0 (АТСС, AmericanType Culture Collection, Rockville, MD, USA) при использовании реагента для трансфекции FuGENE 6(Roche), следуя прописи для прикрепленных клеток, оптимизированной производителем. Трансфектомы выращивали в среде DMEM с добавкой 10% FCS и подвергали отбору при использовании 750 мкг/мл генетицина (G418, Calbiochem, San Diego, CA).IgG1. Для получения полного IgG1 вариабельный участок тяжелой цепи L19 (L19-VH) вместе с его пептидной последовательностью секреции вырезали с помощью HindIII и XhoI из ранее описанного L19pUT-SIP и встраивали в вектор pUC-IgG1, который содержал ген полного константного участка 1 тяжелой цепи человека. Рекомбинантный ген IgG1 потом вырезали из pUC-IgG1-L19-VH с помощью HindIII иEcoRI и клонировали в pcDNA3 для получения конструкции pcDNA3-L19-IgG1. Для получения полной легкой цепи L19 L19-VL амплифицировали из L19-pUT-SIP (описано выше) с помощью ПЦР при использовании праймеров ВС-696 (tggtgtgcactcggaaattgtgttgacgcagtc - SEQ IDApaLI и BsiWI, соответственно. После переваривания с помощью ApaLI и BsiWI продукт амплификации встраивали в вектор pUT-SEC-hC, содержащий последовательность сигнала секреции и последовательность константного участка легкой цепи . Рекомбинантный ген потом вырезали из pUT-SEC-hC-L19VL с помощью HindIII и XhoI и встраивали в экспрессионный вектор млекопитающих pCMV2A, полученный из вектора pcDNA3 путем удаления гена устойчивости к G418, для получения конструкцииpCMV2-L19-. Эквимолярные количества этих конструкций использовали для котрансфекции клеток мышиной миеломы SP2/0, как описано выше. Отобранные на генетицине клоны подвергали скринингу на способность секретировать химерный иммуноглобулин, содержащий тяжелые и легкие цепи, при использовании ELISA. Все конструкции ДНК очищали при использовании системы Maxiprep от Qiagen (Hilden, Germany),и последовательности ДНК обеих цепей подтверждали при использовании готового реакционного набора родаминового терминатора цикла секвенирования ABI PRISM (Perkin Elmer, Foster City, CA). Все рестрикционные ферменты (RE) получали от Roche Diagnostics (Milan, Italy), за исключением BsiWI (NewEngland Biolabs, Beverly, MA). После переваривания с помощью рестрикционных ферментов вставки и векторы восстанавливали из агарозных гелей при использовании способа Qiaquick (Qiagen). Очистка и качественный контроль антител. Иммуноаффинную хроматографию осуществляли для очистки различных антител в соответствии с процедурой, описанной Carnemolla и др. (24, 1996).ED-B, конъюгированный с сефарозой 4 В (Amersham Pharmacia Biotech., Uppsala, Sweden) в соответствии с инструкциями производителя (24 Carnemolla и др., 96), использовали для иммуноочистки различных форм антитела L19, в то время, как лизоцим куриного яичного белка (Sigma, St. Louis, USA),конъюгированный с сефарозой 4 В (Amersham Pharmacia) использовали для антител D1.3. Иммуноочищенные формы антитела L19-SIP и L19-IgG1 не требовали дополнительной очистки, и их диализировали против PBS, рН 7,4, при температуре +4 С. Поскольку scFv, полученные в результате иммуноаффинной хроматографии, состояли из двух форм, мономерной и димерной, второй этап очистки,как описано Demartis и др. (27, 2001), требовался для изоляции последней формы. Получали серии различных форм антитела и анализировали их при использовании SDS-ПАГЭ при восстановительных и невосстановительных условиях, в анализах иммуногистохимии, вытеснительной хроматографии (Супердекс 200, Amersham Pharmacia Biotech.) и ELISA. Додецилсульфат натрия-электрофорез в полиакриламидном геле (SDS-ПАГЭ), метод твердофазного иммуноферментного анализа (ELISA), вытеснительная хроматография и иммуногистохимия. Эксперименты по скринингу с использованием ELISA осуществляли на кондиционированной культуральной среде в соответствии с Carnemolla и др. (24, 1996). Для выявления экспрессии различных форм антитела L19 рекомбинантный фрагмент 7 В 89 (24 Carnemolla и др., 1996), содержащий домен ED-B FN,включающий эпитоп, который узнается L19, иммобилизовали на иммунопланшетах Maxisorp (Nunc,Roskilde, Denmark). Для определения антител D1.3 в экспериментах ELISA лизоцим куриного яичного белка (Sigma) иммобилизовали на NH2 поверхности планшетов EIA (Costar, Cambridge, MA). Кроличий античеловеческий IgE, конъюгированный с пероксидазой (Pierce, Rockford, IL), разведенный в соответствии с рекомендациями производителя, использовали в качестве вторичного антитела для определенияIgG1. Для scFv, содержащих последовательность метки FLAG, в качестве вторичного и третичного антител использовали, соответственно, мышиное античеловеческое FLAG моноклональное антитело (М 2,Kodak) и конъюгированное с пероксидазой козье антимышиное антитело (Pierce). Во всех случаях имму- 13010653 нореактивность с иммобилизованным антигеном определяли при использовании субстрата ABTS для пероксидазы (Roche) и измеряли фотометрическое поглощение при 405 нм. Супердекс 200 (Amersham Pharmacia) хроматографическую колонку использовали для анализа профилей гель-фильтрации очищенных антител при естественных условиях с использованием жидкостной хроматографии быстрого разрешения (FPLC; Amersham Pharmacia). Иммуногистохимию различных тканевых криостатных срезов осуществляли так, как описано Castellani и др.(22, 1994), а 4-18% градиентный SDS-ПАГЭ проводили в соответствии с Carnemolla и др. (17, 1989) при восстанавливающих и невосстанавливающих условиях. Животные и клеточные линии. Бесшерстных мышей с удаленным тимусом (бесшерстные в возрасте 8 недель/бесшерстные самкиGDI) получали от Harlan Italy (Correzzana, Milano, Italy), мышиный штамм 129 (клон SvHsd) (в возрасте 8-10 недель, самки) получали от Harlan UK (Oxon, England). Эмбриональные мышиные клетки тератокарциномы (F9), клетки, полученные из меланомы человека (SK-MEL-28), и клетки миеломы мышей (SP2/0) были приобретены в Американской Коллекции Типовых Культур (Rockville, MD). Для индукции опухолей бесшерстных мышам подкожно инъецировали 16106 клеток SK-MEL-28, а мышиный штамм 129 инъецировали с помощью 3106 клеток F9. Объем опухоли определяли в соответствии со следующей формулой: (d)2D0,52, где d и D представляют собой, соответственно, короткое и длинное измерения (см) опухоли, измеренные с помощью микрометра. Содержание, лечение и умерщвление животных осуществляли в соответствии с национальным законодательством (Итальянский закон 116 от 27 января 1992),касающимся защиты животных, используемых для научных целей. Мечение рекомбинантных антител радиоактивным йодом. Мечение белков радиоактивным йодом осуществляется с помощью опосредованного способа в соответствии с Chizzonite (36 Riske и др., 1991) при использовании предварительно покрытых йодогеном пробирок (Pierce) для активации Na125I (NEN Life Science Products, Boston, MA) в соответствии с рекомендациями производителя. В описанных экспериментах 1,0 мКи Na125I использовали для 0,5 мг белка. Радиоактивно меченные молекулы отделяли от свободного 125I при использовании колонок PD10 (AmershamPharmacia), предварительно обработанных с помощью 0,25% бычьего сывороточного альбумина и уравновешенных с использованием PBS. Радиоактивность образцов устанавливали при использовании кристаллического -счетчика (Packard Instruments, Milano, Italy). Анализ иммунореактивности радиоактивно меченного белка осуществляли на ED-B сефарозной колонке с объемом 200 мкл, насыщенной с помощью 0,25% БСА в PBS. Известное количество меченного радиоактивным йодом антитела в 200 мкл 0,25% БСА в PBS загружали в верхнюю часть колонки и предоставляли возможность поступления в колонку. Потом колонку промывали с помощью 1,5 мл 0,25% БСА в PBS для удаления неспецифически связанных антител. В завершение, иммунореактивный связанный материал элюировали при использовании 1,5 мл 0,1 М TEA, pH 11. Подсчитывали радиоактивность несвязанного и связанного материала в процентах, после чего определяли процент иммунореактивных антител. Иммунореактивность всегда была выше чем 90%. Для дальнейшего анализа меченных радиоактивным йодом антител известное количество меченного радиоактивным йодом белка в 200 мкл загружали в колонку Супердекс 200. Удерживаемый объем различных белков не варьировал после мечения радиоактивным йодом. Для 3 меченных радиоактивным йодом форм антитела L19 и их негативных контролей извлечение из колонки Супердекс 200 составляло 100% (фиг. 3 А, 3 В и 3 С). Эксперименты по биораспределению. Для блокирования неспецифической аккумуляции йода в желудке и концентрирования его в щитовидной железе за 30 мин до инъекции радиоактивно меченных антител мыши перорально получали 20 мг перхлората натрия (Carlo Erba, Italy) в воде. Эту процедуру повторяли с интервалами 24 ч для продолжительности эксперимента по биораспределению. Мышам, несущим опухоль, вводили путем инъекции в хвостовую вену 0,1 нмоля различных радиоактивно меченных антител (соответствует 6 мкг для scFvs, 8 мкг для SIP и 18 мкг для IgG) в 100 мкл физиологического раствора. На каждый момент времени умерщвляли 3 животных, вычленяли различные органы, включая опухоль, взвешивали, подсчитывали на -счетчике, а потом фиксировали с помощью 5% формальдегида в PBS, рН 7,4 для того, чтобы подвергнуть микроауторадиографии, которую осуществляли в соответствии с Tarli и др. (23, 1999). Кровь также разделяли для получения препаратов плазмы для определения стабильности радиоактивно меченных молекул в токе крови при использовании уже описанных анализа иммунореактивности и анализа гель-фильтрации. В обоих случаях использовали 200 мкл плазмы. Содержание радиоактивности для различных органов выражали как процент от инъецируемой дозы на грамм (% ID/г). Параметры клиренса крови для меченных радиоактивным йодом антител устанавливали с помощью метода минимизации наименьших квадратов при использовании программы Macintosh Kaleidagraph (Synergy Software,Reading PA, USA) и уравнения- 14010653 биэкспоненциальный профиль клиренса крови, в котором амплитуда альфа фазы определяется какA100/(А+В), а амплитуда бета фазы выведения определяется как В 100/(А+В). Альфа и бета представляют собой оценочные параметры, связанные с периодом полувыведения соответствующих фаз клиренса крови. Т 1/2 (альфа-фаза)=ln2/альфа=0,692/альфа Т 1/2 (бета-фаза)=ln2/альфа=0,692/альфа. Х(0) предполагается равным 40%, соответствующим объему крови 2,5 мл для каждой мыши. Результаты Получение антитела. Использовали вариабельные участки различных форм антитела L19 (13 Pini и др., 1998) (scFv, мини-иммуноглобулин и полный IgG1 человека) и их поведение in vivo в нацеливании на опухолевую сосудистую сеть. Фиг. 1 показывает конструкции, которые используются для экспрессии различных форм антителаL19. Подобные конструкции были получены при использовании вариабельных участков scFv, специфических для нерелевантного антигена (D1.3; 7 McCafferty; 26 Neri и др., 1997). Для получения SIP и IgG1 клетки SP2/0 миеломы мышей трансфецировали с помощью конструкций, представленных на фиг. 1, и стабильные трансфектомы подвергали селекции при использованииG418. Наилучшие продуценты определяли с помощью ELISA и эти клоны размножали для очистки антитела. Очистка всех трех форм антитела основывается на иммуноаффинной хроматографии при использовании рекомбинантного ED-B, конъюгированного с сефарозой. Выход составлял приблизительно 8 мг/л для scFv (L19), 10 мг/л для L19-SIP, 3 мг/л для L19-IgG1. Для контрольных белков использовали scFv(D1.3), специфический для лизоцима яичного куриного белка, и при использовании вариабельных участков scFv D1.3 конструировали D1.3-SIP. Эти два антитела очищали на лизоциме куриного яичного белка,конъюгированном с сефарозой. Выход составлял 8 и 5 мг/л, соответственно. В качестве контроля дляL19-IgG1 мы использовали коммерчески доступный IgG1/ человека (Sigma). Проводили SDS-ПАГЭ анализ трех очищенных форм L19 при восстанавливающих и невосстанавливающих условиях. Для scFv (L19) присоединенная масса, как предполагалось, составляла приблизительно 28 кДа как при восстанавливающих, так и при невосстанавливающих условиях (не показано).L19-SIP показал молекулярную массу приблизительно 80 кДа при невосстанавливающих условиях и имел молекулярную массу 40 кДа при восстанавливающих условиях. Результаты продемонстрировали, что более чем 95% природной молекулы существует в виде ковалентно связанного димера. L19-IgG1 показал,как и предполагалось, основную полосу с массой приблизительно 180 кДа при невосстанавливающих условиях, в то время, как при восстанавливающих условиях он показал две полосы, соответствующие тяжелой цепи с массой приблизительно 55 кДа и легкой цепи с массой приблизительно 28 кДа. Получали профили элюирования трех форм антитела L19, проанализированных с помощью вытеснительной хроматографии (Супердекс 200). Во всех трех случаях определяли единственный пик с нормальным распределением, и представляющий более чем 98%. При использовании стандартной калибровочной кривой были установлены присоединенные молекулярные массы, которые составляли 60 кДа для scFv (L19)2, 80 кДа для L19-SIP и 180 кДа для L19-IgG1. В дополнение, молекулярные агрегаты, которые часто присутствуют в препаратах рекомбинантного белка и которые могут делать недействительными результаты, полученные в исследованиях in vivo, как было продемонстрировано, являются отсутствующими. SDS-ПАГЭ и вытеснительная хроматография (Супердекс 200), которые осуществляли на очищенных контрольных белках, дали подобные результаты. Используя эти три различных формы антитела L19, проводили иммуногистохимический анализ на криостатных срезах меланомы человека SK-MEL-28, индуцированной у бесшерстных мышей, и мышиной тератокарциномы F9, индуцированной в штамме 129 мышей. Оптимальные результаты были получены при концентрациях, которые были ниже чем 0,25-0,5 нМ. Все три очищенных антитела L19 узнавали идентичные структуры. Стабильность in vivo радиоактивно меченных форм антитела L19. Для изучения биораспределения in vivo использовали человеческую меланому SK-MEL-28 и мышиную тератокарциному F9. Опухоль SK-MEL-28 имела относительно медленный рост, в то время, как опухоль F9 росла быстро (фиг. 2). Таким образом, использование опухоли SK-MEL-28 позволило проводить долгосрочные эксперименты (вплоть до 144 ч), в то время, как опухоль F9 позволяла проводить короткие исследования биораспределения (вплоть до 48 ч). Все эксперименты по биораспределению осуществляли тогда, когда опухоль имела размер приблизительно 0,1-0,3 см 3. Для сравнения различных форм антитела инъецировали эквимолярные количества (0,1 нмоля) в 100 мкл стерильного физиологического раствора. Перед инъекцией меченные радиоактивным йодом соединения фильтровали через фильтр 0,22 мкм и проверяли иммунореактивность и профиль гель-фильтрации (см. материалы и методы). Иммунореактивность радиоактивно меченных белков всегда была большей, чем 90%. Фиг. 3 А-С показывает профили анализа гель-фильтрации (Супердекс 200) меченных радиоактивных йодом форм антитела L19. Образцы крови брали от обработанных животных в различные промежутки времени от инъекции и радиоактивность, присутствующую в плазме, анализировали на иммунореактивность и с помощью гель- 15010653 фильтрационной хроматографии. Профили гель-фильтрации показали один основной пик, который имел массу инъецированного белка, для всех трех форм антитела L19. Только профиль scFv выявил второй пик, имеющий более высокую молекулярную массу, что предполагало образование агрегатов (фиг. 3DF). Кроме того, образование агрегатов с более высокой молекулярной массой, которые не элюировались из колонки Супердекс 200, наблюдали для scFv (L19)2. Фактически, несмотря на то, что выход из колонки Супердекс 200 составлял 90-100% использованной радиоактивности для обоих L19-SIP и L19-IgG,выход для scFv (L19)2 составлял примерно 55% от загруженной радиоактивности. Удерживаемая радиоактивность извлекалась только после промывания хроматографической колонки с помощью 0,5 М NaOH,демонстрируя при этом то, что большие агрегаты блокировались на колоночном фильтре (табл. 1). Табл. 1 также представляет результаты анализа иммунореактивности, полученные на плазме (см. материалы и методы). На протяжении времени экспериментов L19-SIP и L19-IgG1 поддерживали такую же иммунореактивность в плазме, что и исходные реагенты. В противовес этому, уже через 3 ч после инъекции иммунореактивность scFv (L19)2 в плазме снижалась до менее чем 40%. Сравнительные эксперименты по биораспределению. Табл. 2 а, b, с и фиг. 4 представляют результаты, полученные в экспериментах по биораспределению с радиоактивно меченными антителами L19 у мышей, несущих опухоль SK-MEL-28. Табл. 2 а, b, с показывают средние значения (SD) % ID/г для тканей и органов, включая опухоли, в различные моменты времени от внутривенной инъекции радиоактивно меченных антител. На фиг. 4 показаны вариации значения % Id/г различных форм антитела в опухоли (А) и крови (В) в различные моменты времени экспериментов, а также соотношения (С) между % ID/г в опухоли и крови. Все три формы антитела L19 селективно аккумулировались в опухоли и соотношения % ID/г опухоли и других органов представлены в табл. 3. Как было продемонстрировано с помощью микроауторадиографии, антитела аккумулируются только в опухолевой сосудистой сети, в то время, как не наблюдали никакой специфической аккумуляции в сосудистой сети нормальных органов. В противовес этому, не было обнаружено никакой специфической аккумуляции контрольных молекул, меченных радиоактивным йодом, ни в опухолях, ни в нормальных тканях. (табл. 2 а, b, с). Все три формы антитела L19 продемонстрировали клиренс, который был, в основном, опосредован почками, что было определено путем подсчета образцов мочи. Как и ожидалось, скорость клиренса была большей для scFv (L19)2 и меньшей для L19-IgG1. Выравнивание кривой с помощью биэкспоненциальной функции обеспечило значения полувыведения, представленные в табл. 4. Фиг. 5 отображает вариации значений % ID/г (SD) опухоли и крови, полученные с меченными радиоактивным йодом scFv (L19)2 и L19-SIP при использовании модельной опухоли тератокарциномы F9. Благодаря высокой ангиогенной активности тератокарциномы F9 аккумуляция радиоактивных молекул в этой опухоли была в 3-4 раза выше через 3 и 6 ч после внутривенной инъекции, чем в опухоли SK-MEL28, и также была устойчиво более высокой на протяжении 48 ч эксперимента. Что касается SK-MEL-28,то специфическая аккумуляция в опухолевой сосудистой сети была подтверждена с помощью микроауторадиографии, в то время, как никакой специфической для опухоли аккумуляции не наблюдали после инъекции контрольных молекул. В табл. 5 представлены значения % ID/г для L19 (scFv) и L19SIP в различные моменты времени после внутривенной инъекции в опухоли F9 и других органах. Синтез восстановленного L19-SIP. К раствору 375 мкг (5 нмолей) L19-SIP в 422 мкл PBS прибавляли 50 мкл раствора ТСЕР (14,34 мг ТСЕРHCl/5 мл водного Na2HPO4, 0,1 М, рН 7,4). Реакционную смесь осторожно встряхивали в течение 1 ч при 37 С. Восстановленный L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Анализ при использовании SDS-ПАГЭ изолированного продукта подтвердил количественную трансформацию L19-SIP до восстановленного L19-SIP. Выход: 100,3 мкг/200 мкл PBS (26,7%). Синтез Tc-99m-L19-SIP. 3,0 мг L-тартрата динатрия помещали в пробирку, после чего прибавляли 100,3 мкг восстановленного L19-SIP в 200 мкл PBS и раствор разводили 100 мкл водного Na2HPO4-буфера (1 М, рН 10,5). Прибавляли 85 мкл элюата источника Тс-99m (24 ч) и 10 мкл раствора SnCl2 (5 мг SnCl2/1 мл 0,1M HCl). Реакционную смесь встряхивали в течение 0,5 ч при 37 С. Меченный Тс-99m L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 35,6%. Радиохимическая чистота: 90,2% (SDS-ПАГЭ). Специфическая активность: 26,4 МБк/нмоль. Иммунореактивность: 91,4%. Синтез Tc-99m-MAG2-L19-SIP карбоксиметил-т-бутилдисульфида. Раствор 21,75 мл (0,312 моля) 1-меркаптоуксусной кислоты, 43,5 мл (0,312 моля) триэтиламина и 100 г (0,312 моля) N-(трет-бутилтио)-N,N-ди-ВОС-гидразина в 1 л EtOH (абс.) нагревали при температуре кипения (в атмосфере N2) в течение 60 ч. EtOH выпаривали под сниженным давлением до конечного- 16010653 объема приблизительно 200 мл. Остаток выливали в 1,8 л H2O и рН полученной суспензии доводили до значения 7,14 при использовании 5-молярного NaOH. Ди-ВОС-гидразин отфильтровывали и значение рН полученного раствора доводили до 2,2 при использовании наполовину концентрированной HCl. Сырьевой материал экстрагировали из воды 3 с помощью 600 мл CH2Cl2. Объединенные органические слои высушивали над MgSO4 и растворитель выпаривали при сниженном давлении с получением 41,1 г (80%) в виде желтого масла. Материал был очищен в достаточной мере для дальнейшего синтеза.N-(Бензилоксикарбонил-Gly)Gly т-бутиловый эстер (Z-(N-Gly)Gly т-бутиловый эстер. Раствор 35,02 г (114 ммоля) Z-Gly-О-сукцинимида и 15 г (114 ммолей) Gly-О-tBu в 1,4 л CH2Cl2 перемешивали в атмосфере N2 при комнатной температуре в течение 20 ч. Органический слой промывали 3 с помощью 250 мл 1% водной лимонной кислоты, 2 с помощью 200 мл полунасыщенного водногоNaHCO3 и 1 с помощью 200 мл воды. Органический слой высушивали над MgSO4. Выпаривание CH2Cl2 в условиях сниженного давления обеспечивало получение 36,5 г (99%) Z-Gly-Gly-O-tBu в виде желтого масла. Сырьевой материал был очищен в достаточной мере для дальнейшего синтеза.Gly-Gly т-бутиловый эстер. 36,5 г (113 ммолей) Z-Gly-Gly-O-tBu растворяли в 1 л ТГФ, после чего прибавляли 3,65 г палладия на древесном угле (10%). Смесь перемешивали в атмосфере Н 2 (1 атм) в течение 3 ч при комнатной температуре. Через суспензию продували N2, фильтровали (PTFE-фильтр: 0,45 мкм) и фильтрат концентрировали при сниженном давлении, получая при этом 20,3 г (95%) Gly-Gly-O-tBu в виде желтого масла. Сырьевой материал был очищен в достаточной мере для дальнейшего синтеза. Карбоксиметил-т-бутилдисульфидглицилглицин т-бутиловый эстер. Раствор 23,85 г (115,6 ммолей) DCC в 430 мл CH2Cl2 по каплям прибавляли к раствору 21,76 гNHS в 1 л CH2Cl2. Полученную суспензию перемешивали в течение ночи в атмосфере N2 при комнатной температуре. После фильтрования полученный раствор промывали 3 с помощью 400 мл полунасыщенного водного NaHCO3 и 1 с помощью 400 мл воды. Высушенный органический слой (MgSO4) выпаривали под сниженным давлением. Сырьевой продукт очищали с помощью хроматографии на силикагеле при использовании градиента растворителя в пределах от CH2Cl2/MeOH 99:1 до CH2Cl2/MeOH 98,5:1,5. 26,1 г (64%) изолировали в виде желтого масла. Меркаптоацетилглицилглицин. 26,32 г (75,09 ммоля) т-бутилового эстера карбоксиметил-т-бутилдисульфидглицилглицина растворяли в 233 мл ТФУ в атмосфере N2. Полученный раствор перемешивали в течение 20 мин при комнатной температуре. ТФУ выпаривали в условиях сниженного давления (5-1010-2 мбар) и полученное масло высушивали при перемешивании в течение дополнительных 2 ч (5-1010-2 мбар). После прибавления 250 млEt2O белый порошок осаждали и суспензию перемешивали в течение 3 ч. Материал отфильтровывали и ресуспендировали в 100 мл Et2O. Полученную суспензию перемешивали в течение ночи, продукт отфильтровывали и материал высушивали при комнатной температуре в условиях сниженного давления с получением 20,46 г (92,5%) в виде белого порошка.NHS эстер меркаптоацетилглицилглицина. Меркаптоацетилглицилглицин (1 г, 3,4 ммоля) и N-гидроксисукцинимид (391 мг, 3,4 ммоля) соединяли в сухой круглодонной колбе и растворяли в безводном ДФМ (4 мл). При перемешивании реакционной смеси прибавляли DCC (700 мг, 3,4 ммоля) в безводном диоксане (2 мл). В течение 15 мин начинал образовываться преципитат (DCU). Через 1 ч преципитат удаляли путем вакуумной фильтрации. Преципитат промывали холодным диоксаном. Диоксан удаляли из фильтрата. Продукт осаждали из оставшегося раствора ДМФ при добавлении диэтилового этера. Продукт изолировали с помощью фильтрации,промывали с помощью холодного диэтилового этера и высушивали в вакуумном эксикаторе в течение ночи. Выход: 1,33 (99%). Синтез Tc-99m-MAG2HN (Lys)-L19-SIP. 200 мкг (2,66 нмоля) восстановленного L19-SIP в 111 мкл PBS разводили с помощью 300 мкл натрийборатного буфера (0,1 М, рН 8,5) и подвергали диализу 21 ч с 200 мл фосфатного буфера (0,1 М, рН 8,5), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 50 мкл раствора меркаптоацетилглицилглицин NHS эстера (0,50 мг, растворенные в 500 мкл фосфатного буфера,0,1 М, рН 8,5) и реакционную смесь нагревали в течение 3 ч при 37 С. Реакционную смесь диализировали 21 ч и 117 ч (в течение ночи) каждый раз с 200 мл фосфатного буфера (0,1 М, рН 8,5), используя SlideA-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). 3,0 мг L-тартрата динатрия прибавляли в пробирку и после этого прибавляли 90 мкл элюата Тс-99m в качестве источника (элюировали ежедневно), а также прибавляли 25 мкл раствора SnCl2 (5 мг SnCl2/1 мл 0,1 М HCl). Реакционную смесь встряхивали в течение 0,5 ч при 37 С. Меченный с помощью Тс-99m L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 55,1%. Радиохимическая чистота: 94,5% (SDS-ПАГЭ).- 17010653 Специфическая активность: 15,2 МБк/нмоль. Иммунореактивность: 81,1%. Синтез Re-188-L19-SIP. 3,0 мг L-тартрата динатрия помещали в пробирку, после чего прибавляли 150 мкг восстановленногоL19-SIP-SH в 310 мкл PBS и раствор разводили с помощью 100 мкл водного Na2HPO4-буфера (1 М, рН 10,5). Прибавляли 100 мкл элюата в качестве источника Re-188 и 50 мкл раствора SnCl2 (5 мг SnCl2/1 мл 0,1 М HCl). Реакционную смесь встряхивали в течение 1,5 ч при 37 С. Меченный Re-188 L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 34,8%. Радиохимическая чистота: 97,2% (SDS-ПАГЭ). Специфическая активность: 13,5 МБк/нмоль. Иммунореактивность: 91,7%. Синтез восстановленного L19-SIP для специфической конъюгации с EDTA, CDTA, TETA, DTPA,TTHA, HBED, DOTA, NOTA, D03A и подобными типами комплексонов с SH-группами цистеина. 50 мкл раствора ТСЕР (14,34 мг TCEPHCl/5 мл водного Na2HPO4, 0,1 М, рН 7,4) прибавляли к раствору 375 мкг (5 нмолей) L19-SIP в 422 мкл PBS. Реакционную смесь осторожно встряхивали в течение 1 ч при 37 С. Восстановленный L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: натрий ацетатный буфер, 0,1 М, рН 5,0). SDS-ПАГЭ анализ изолированного продукта подтверждал количественную трансформацию L19-SIP до восстановленного L19-SIP. Выход: 105,7 мкг/200 мкл (28,2%). Синтез In-111-MX-DTPA-малеимид-S(Cys)-L19-SIP-R (R=восстановленный). 105 мкг (2,8 нмоля) восстановленного L19-SIP в 200 мкл натрийацетатного буфера (0,1 М, рН 5) подвергали реакции с 50 мкл растворенного 1,4,7-триаза-2-(N-малеимидоэтилен-п-амино)бензил-1,7 бис(карбоксиметил)-4-карбоксиметил-6-метилгептана (0,25 мг DTPA-малеимида в 500 мкл натрийацетатного буфера 0,1 М рН 5) в течение 3 ч при 37 С. Реакционную смесь диализировали 21 ч с 200 мл натрийацетатного буфера (0,1 М, рН 6), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL,U.S.A.). Прибавляли 80 мкл раствора [In-111]InCl3 (HCl, IN, 40 МБк, Amersham Inc.) и реакционную смесь нагревали при температуре 37 С в течение 30 мин. Меченный In-111 DTPA-малеимид-S(Cys)-L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 51,6%. Радиохимическая чистота: 97,2% (SDS-ПАГЭ). Специфическая активность: 79 МБк/нмоль. Иммунореактивность: 88,5%. Синтез MX-DTPA-малеимида (1,4,7-триаза-2-(N-малеимидоэтилен-п-амино)бензил-1,7-бис(карбоксиметил)-4-карбоксиметил-6-метилгептана). 512 мг (1 ммоль) [3-(4-аминофенил)-2-(бис-карбоксиметиламино)пропил]-[2-(бис-карбоксиметиламино)пропил]аминоуксусной кислоты (Macrocyclics Inc. Dallas, TX, U.S.A.) и 707 мг (7 ммолей) триэтиламина растворяли в 3 мл сухого ДМФ. По каплям прибавляли 400 мг (1,5 ммоля) 2,5-диоксопирролидин-1-илового эстера 3-(2,5-диоксо-2,5-дигидропиррол-1-ил)пропионовой кислоты (Aldrich) в 1 мл ДМФ. Раствор перемешивали в течение 5 ч при 50 С. Медленно прибавляли 30 мл диэтилового этера. Реакционную смесь перемешивали в течение последующих 30 мин. Преципитат собирали фильтрованием. Сырьевой продукт очищали с помощью RP-ВЭЖХ (ацетонитрил:вода:трифторуксусная кислота/ 3:96,9:0,199,9:0:0,1). Выход: 61% (405 мг, 0,61 ммоля). MS-ESI: 664=М 1. Синтез In-111-MX-DTPAHN(Lys)-L19-SIP. 200 мкг (2,66 нмоля) невосстановленного L19-SIP в 111 мкл PBS разводили с помощью 300 мкл натрийборатного буфера (0,1 М, рН 8,5) и диализировали 21 ч с помощью 200 мл натрийборатного буфера(0,1 М, рН 8,5), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 50 мкл раствора 1,4,7-триаза-2-(п-изотиоцианато)бензил-1,7-бис(карбоксиметил)-4-карбоксиметил-6-метилгептана (MX-DTPA) (0,33 мг MX-DTPA, растворенного в 500 мкл натрийборатного буфера, 0,1 М, рН 8,5) и реакционную смесь нагревали в течение 3 ч при 37 С. Реакционную смесь диализировали 21 ч и 117 ч(в течение ночи) каждый раз с 200 мл натрийацетатного буфера (0,1 М, рН 6,0), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 80 мкл раствора [In-111]InCl3 (HCl, 1N, 40 МБк, Amersham Inc.) и реакционную смесь нагревали при температуре 37 С в течение 30 мин. Меченный In-111 MX-DTPAHN(Lys)-L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 72,4%. Радиохимическая чистота: 80,3% (SDS-ПАГЭ). Специфическая активность: 8,8 МБк/нмоль. Иммунореактивность: 77,5%.- 18010653 Синтез In-111-DOTA-C-бензил-n-NCSHN(Lys)-L19-SIP. 200 мкг (2,66 нмоля) невосстановленного L19-SIP в 108 мкл PBS разводили с помощью 300 мкл натрийборатного буфера (0,1 М, рН 8,5) и диализировали 21 ч с помощью 200 мл натрийборатного буфера(0,1 М, рН 8,5), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли к раствору 50 мкл раствора 1,4,7,10-тетрааза-2-(п-изотиоцианат)бензилциклододекан-1,4,7,10-тетрауксусной кислоты (бензил-п-SCN-DOTA, Macrocyclics Inc., Dallas TX, U.S.A.) (1,5 мг бензил-п-SCN-DOTA,растворенного в 5 мл натрийборатного буфера, 0,1 М, рН 8,5) и реакционную смесь нагревали в течение 3 ч при 37 С. Реакционную смесь диализировали 21 ч и 117 ч (в течение ночи) каждый раз с 200 мл натрийацетатного буфера (0,1 М, рН 6,0), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL,U.S.A.). Прибавляли 80 мкл раствора [In-111]InCl3 (HCl, 1N, 40 МБк, Amersham Inc.) и реакционную смесь нагревали при температуре 37 С в течение 30 мин. Меченный In-111 DOTA-С-бензил-п-NCSHN(Lys)L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 70,8%. Радиохимическая чистота: 92,1% (SDS-ПАГЭ). Специфическая активность: 10,1 МБк/нмоль. Иммунореактивность: 75,1%. Синтез Y-88-MX-DTPAHN(Lys)-L19-SIP. 200 мкг (2,66 нмоля) невосстановленного L19-SIP в 108 мкл PBS разводили с помощью 300 мкл натрийборатного буфера (0,1 М, рН 8,5) и диализировали 21 ч с 200 мл натрийборатного буфера (0,1 М, рН 8,5), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 50 мкл раствора MX-DTPA (0,33 мг MX-DTPA, растворенного в 500 мкл натрийборатного буфера, 0,1 М, рН 8,5) и реакционную смесь нагревали в течение 3 ч при 37 С. Реакционную смесь диализировали 21 ч и 117 ч(в течение ночи) каждый раз с 200 мл натрийацетатного буфера (0,1 М, рН 6,0), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 100 мкл раствора [Y-88]YCl3 (HCl, 1N, 75 МБк, Oak Ridge National Lab.) и реакционную смесь нагревали при температуре 37 С в течение 30 мин. Меченный Y-88 MX-DTPAHN(Lys)L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5 (Amersham, элюент: PBS). Радиохимический выход: 68,1%. Радиохимическая чистота: 91,5% (SDS-ПАГЭ). Специфическая активность: 11,4 МБк/нмоль. Иммунореактивность: 70,5%. Синтез Lu-177-DOTA-C-бензил-n-NCSHN(Lys)-L19-SIP. 200 мкг (2,66 нмоля) невосстановленного L19-SIP в 108 мкл PBS разводили с помощью 300 мкл натрийборатного буфера (0,1 М, рН 8,5) и диализировали 21 ч с 200 мл натрийборатного буфера (0,1 М, рН 8,5), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 50 мкл раствора бензил-п-SCN-DOTA (1,5 мг, растворенного в 5 мл натрийборатного буфера, 0,1 М, рН 8,5) и реакционную смесь нагревали в течение 3 ч при 37 С. Реакционную смесь диализировали 21 ч и 117 ч (в течение ночи) каждый раз с 200 мл натрийацетатного буфера (0,1 М, рН 6,0), используя Slide-A-Lyzer 10,000 MWCO (Pierce Inc., Rockford, IL, U.S.A.). Прибавляли 200 мкл раствора [Lu-177]LuCl3 (HCl, 1N, 80 МБк, NRH-Petten, Netherlands) и реакционную смесь нагревали при температуре 37 С в течение 30 мин. Меченный Lu-177 DOTA-C-бензил-пNCSHN(Lys)-L19-SIP очищали с помощью гель-хроматографии при использовании колонки NAP-5(Amersham, элюент: PBS). Радиохимический выход: 72,2%. Радиохимическая чистота: 94,9% (SDS-ПАГЭ). Специфическая активность: 18,3 МБк/нмоль. Иммунореактивность: 73,4%. Распределение в органах и выведение In-III-MX-DTPA-L19-SIP после однократного внутривенного введения бесшерстным мышам, несущим опухоль. Меченые пептиды в соответствии с изобретением вводили внутривенно в дозе приблизительно 37 кБк животным, несущим F9 (тератокарцинома) (вес тела приблизительно 25 г). Концентрацию радиоактивности в различных органах и радиоактивность в выделениях измеряли при использовании -счетчика в различные моменты времени после введения вещества. Биораспределение In-III-MX-DTPA-L19-SIP у бесшерстных мышей, несущих F9 (тератокарцинома)(среднее значение SD, n=3), показано в табл. 6. Распределение в органах и выведение Tc-99m-L19-SIP после однократного внутривенного введения бесшерстным мышам, несущим опухоль. Меченые пептиды в соответствии с изобретением вводили внутривенно в дозе приблизительно 56 кБк- 19010653 животным, несущим F9 (тератокарцинома) (вес тела приблизительно 25 г). Концентрацию радиоактивности в различных органах и радиоактивность в выделениях измеряли при использовании -счетчика в различные моменты времени после введения вещества. Кроме того, соотношение опухоли и крови определяли в различные моменты времени на основе концентрации пептида в опухоли и крови. Биораспределение Tc-99m-L19-SIP у бесшерстных мышей, несущих F9 (тератокарцинома) (среднее значение SD, n=3), показано в табл. 7. Соотношение концентрации Tc-99m-L19-SIP в опухоли и крови у бесшерстных мышей, несущих F9(тератокарцинома) (среднее значение SD, n=3), показано в табл. 8. Как было доказано, радиоактивно меченные пептиды обладают благоприятными свойствами в экспериментах на животных. Например, Tc-99m-L19-SIP и In-111-MX-DTPAHN(Lys)-L19-SIP демонстрируют высокую аккумуляцию в опухоли 17,2 (Тс-99m) или 12,9 (In-III) % от инъецируемой дозы на грамм(ID/г) через 1 ч после инъекции. Наблюдали значительное удерживание опухолью 9,4 (Тс-99m) или 13,0(In-III) % ID/г через 24 ч после инъекции. Таким образом, абсорбция опухолью является значительно более высокой по сравнению с другими известными меченными In-III или Тс-99m фрагментами антитела(5), с. 868-872, 1996). Выведение из крови соединения приводит к соотношениям опухоль/кровь 13:1 и 6:1, соответственно, через 24 ч после инъекции. Наиболее удивительным является то, что In-111-MX-DTPAHN(Lys)-L19-SIP демонстрирует значительно более низкое поглощение и удержание почками (22,5% ID/г) по сравнению с другими меченными In-111 фрагментами антитела (120% ID/g), которые имеют способность к высокой степени удержания почками через 24 ч после введения, что описано Kobayashi. Удержание почками является весьма общей проблемой и обычно затрудняет применение соединений, меченных лантаноидами, в радиотерапии. Экспериментальные результаты демонстрируют отличный потенциал радиоиммуноконъюгатов, которые предпочтительно вводятся пациенту путем парентерального введения. Обсуждение Наблюдение, что цитотоксические противораковые лекарственные средства более эффективно локализуются в нормальных тканях, чем в опухолях (37 Bosslet и др., 1998), вызвало волну исследований,изучающих возможность селективной доставки лекарственного средства в опухоли. Эффективное нацеливание на опухоли, однако, должно отвечать двум основным требованиям: 1) мишень в опухоли должна быть специфической, присутствовать в избытке, быть стабильной и легко доступной для молекул лиганда, поступающих из крови; и 2) молекула лиганда должна обладать приемлемыми фармакокинетическими свойствами, то есть быть способной легко распространяться из тока крови к опухоли, а также обладать высокой аффинностью для мишени с целью обеспечения его эффективной и селективной аккумуляции в опухоли. Благодаря этим отличительным признакам микросреда, окружающая опухоли, представляет собой возможную пан-опухолевую мишень. В действительности, развитие опухоли индуцирует (и последовательно требует) значительных модификаций компонентов микросреды, окружающей опухоли, в частности таковых экстрацеллюлярного матрикса (ЕСМ). Молекулы, составляющие ЕСМ солидных опухолей,отличаются как качественно, так и количественно от таковых нормального ЕСМ. Более того, многие из этих компонентов опухолевого ЕСМ являются общими для всех солидных опухолей, отвечая за общие свойства и функции, такие как клеточная инвазия (как нормальных клеток в опухолевые ткани, так и раковых клеток в нормальные ткани) и ангиогенез. Среди множества молекул, составляющих модифицированный опухолевый ЕСМ, авторы настоящего изобретения сфокусировали свое внимание на изоформеB-FN широко экспрессируется в ЕСМ всех солидных опухолей и, таким образом, хорошо определяется и постоянно ассоциируется с ангиогенными процессами (22 Castellani и др., 1994) и, в противовес этому, не определяется в нормальных тканях взрослого (17 Carnemolla и др., 1989). Целевая доставка терапевтических агентов к субэндотелиальному ЕСМ преодолевает проблемы, ассоциированные с интерстициальной гипертензией солидных опухолей (38 Jain и др., 1988; 39 Jain, 1997; 40 Jain R.K., 1999).(Kd=5,410-11 М) для домена ED-B FN, селективно и эффективно аккумулируется in vivo вокруг опухолевой вновь появившейся сосудистой сети, и является способным к селективному транспорту, и концентрирует в опухолевой массе любую из ряда терапевтических молекул, с которыми оно является конъюгированным (28 Birchler и др., 1999; 29 Nilsson, и др., 2001; 30 Halin и др., 2002; 31 Carnemolla и др.,2002). Способность L19 селективно нацеливаться на опухоли была продемонстрирована у пациентов при использовании методик радиоизотопной ангиографии. Настоящее описание описывает мечение небольших иммунопротеинов (SIP) радиоизотопами, применение радиоактивно меченных SIP и нацеливание на опухолевую сосудистую сеть действия и фармакокинетики трех различных форм антитела человека L19: scFv, мини-иммуноглобулина/небольшого иммунопротеина и полного IgG1 человека. Молекула SIP была получена путем слияния scFv (L19) с доменом СН 4 секреторной изоформы S2- 20010653 человеческого IgE. CH4 представляет собой домен, который позволяет осуществлять димеризацию молекул IgE, а изоформа S2 содержит цистеин на своем СООН-терминальном конце, который ковалентно стабилизирует димер посредством внутрицепочечной дисульфидной связи (35 Batista и др., 1996). Сайты связывания IgE с остатком FcRI принадлежат домену СН 3 (41 Turner и Kinet, 1999; 42 Vangelista и др.,1999; 43 Garman и др., 2000), так, что scFv, слитый с доменом СН 4 в соответствии с воплощениями настоящего изобретения, не активирует какую-либо передачу сигнала, которая ведет к реакциям гиперчувствительности. Была исследована эффективность этих трех форм на двух различных моделях опухолей у мышей: на мышиной тератокарциноме F9 и человеческой меланоме SK-MEL-28. Первая представляет собой быстро растущую опухоль, которая после имплантации убивает животное в течение приблизительно 2 недель. Опухоль SK-MEL-28, с одной стороны, представляет собой двухфазную кривую роста с ранней,быстрой фазой роста, за которой следует вторая, более медленная фаза. Ранее было показано, что количество ED-B в тератокарциноме F9 остается стабильным во время опухолевого роста (23 Tarli, и др.,1999); в противовес этому, ED-B аккумулируется в меланоме SK-MEL-28 пропорционально способности опухоли к росту (23 Tarli и др., 1999), с избытком ED-B, который обнаруживается на первой фазе, и с меньшим количеством на второй. Применение опухоли меланомы SK-MEL-28 позволило провести долгосрочные исследования биораспределения без значительных вариаций опухолевой массы (фиг. 2), что может вызывать неправильную трактовку результатов. Сравнительные исследования трех форм антитела L19 в отношении стабильности in vivo показали,что L19-SIP и L19-IgG1 поддерживают на протяжении экспериментов (144 ч) такую же иммунореактивность и молекулярную массу в плазме, что и до инъекции. В противовес этому, scFv(L19) быстро теряет свою иммунореактивность в плазме и вызывает образование агрегатов, которые являются настолько большими, что не проходят через хроматографическую колонку при гель-фильтрации. Такая агрегацияscFv, весьма очевидно, является ответственной за соотношение между % ID/г опухоли и легких, поскольку агрегаты могут аккумулироваться в микрососудистой сети легких (табл. 3). Для всех трех форм выведение из крови, в основном, опосредуется почками, демонстрируя двухфазную кривую с - и -фазами, как представлено в табл. 4, которая является обратно пропорциональной молекулярному размеру. Аккумуляция различных форм антитела в изученных опухолях была результатом скорости клиренса и стабильности молекул in vivo. При использовании scFv наблюдали максимальное процентное содержание инъецируемой дозы на грамм (% ID/г) через 3 ч после инъекции радиоактивно меченного антитела, а потом оно быстро падало. При использовании SIP % ID/г в опухолях было в 2-5 раз выше, чем таковое для scFv, достигая максимума через 6-8 ч после инъекции. Эту модель наблюдали как в случаеF9 опухолей, так и в случае SK-MEL-28 опухолей. В противовес этому, аккумуляция IgG1 в опухолях непрерывно возрастала в опухолях во время экспериментов. Однако благодаря его медленному клиренсу соотношение % ID/г опухоль-кровь через 144 ч составляло только примерно 3 по сравнению с соотношением, которое равнялось 10 для scFv и 70 для SIP спустя такой же период времени (фиг. 4). Подобные отличительные свойства в отношении in vivo стабильности, клиренса и эффективности нацеливания на опухоли, продемонстрированные тремя изученными в данной заявке формами антитела,могут быть использованы для различных диагностических и/или терапевтических целей в зависимости от клинических нужд и заболевания. Например, радиоактивно меченные антитела, демонстрирующие хорошие соотношения опухоль-орган и опухоль-кровь вскоре после инъекции, являются необходимыми для in vivo диагностической иммунорадиоизотопной ангиографии, в основном, благодаря короткому периоду полураспада изотопов, используемых в таком анализе. Различные подходы являются возможными при использовании антитела в качестве вектора для терапевтических агентов: доставки веществ, которые выявляют свои терапевтические эффекты после достижения своих мишеней (например, фотосенсибилизаторы, активируемые только на мишенях), для которых абсолютное количество, доставляемое к опухоли, является релевантным; доставки веществ, которые выявляют свой терапевтический и токсический эффекты даже перед достижением мишени (например, излучатель иттрий-90), для которых особое внимание должно быть уделено соотношению площади под кривыми опухолевой аккумуляции и аккумуляции в крови как функции времени, для того, чтобы минимизировать систематическую токсичность и максимизировать противоопухолевый терапевтический эффект.L19-SIP, например, как представляется, предлагает лучший компромисс молекулярной стабильности, скорости клиренса и опухолевой аккумуляции. Подобные слитые белки, которые состоят из фрагментов scFv антитела, связанных с доменом димеризации, уже были описаны (44 Hu и др., 1996; 33 Li и др., 1997), однако, в обоих случаях 1 СН 3 человека использовали в качестве димеризирующего домена. Применение домена S2CH4 человека обеспечивает легкий путь получения ковалентной стабилизации димера. Кроме того, дисульфидный мостик, образованный С-терминальными остатками цистеина, может быть легко восстановлен в достаточно мягких условиях для сохранения общей структуры молекулы,обеспечивая, таким образом, легкодоступную реактивную группу для радиоактивного мечения или химической конъюгации. Это свойство представляется особенно многообещающим ввиду клинического потенциала.L19-IgG1 в избытке накапливается в опухолях, и даже хотя такая аккумуляция компенсируется слабой скоростью клиренса, трехэтапная процедура для удаления циркулирующих антител может использоваться для того, чтобы позволить использовать их не только для терапевтических целей, но также для диагностической иммунорадиоизотопной ангиографии (45 Magnani и др., 2000). Ссылки 1. Shawler и др. J. Immunol., 135: 1530-1535, 1985. 2. Miller и др. Blood, 62: 988-995, 1983. 3. Hakimi и др. J. Immunol., 147: 1352-1359, 1991. 4. Stephens и др. Immunology, 85: 668-614, 1995. 5. Riechmann и др. Nature, 332: 323-327, 1988. 6. Junghans и др. Cancer Res., 50: 1495-1502, 1990. 7. McCafferty и др. Nature, 348: 552-554, 1990. 8. Lowman и др. Biochemistry, 30: 10832-10838, 1991. 9. Nilsonn и др. Advanced Drug Delivery Reviews, 43: 165-196, 2000. 10. Winter и др. Annu. Rev. Immunol., 12: 433-455, 1994. 11. Reichert. Nature Biotech., 19: 819-822, 2001. 12. Huls и др. Nature Biotech., 17: 276-281, 1999. 13. Pini и др. J. Biol. Chem., 273: 21769-21776, 1998. 14. Neri и Zardi. Advanced Drug Delivery Reviews, 32: 43-52, 1998. 15. Bissel и Radisky. Nature Reviews - Cancer, 1: 46-54, 2001. 16. Balza и др. FEBS Lett., 228: 42-44, 1988. 17. Carnemolla и др. J. Cell. Biol., 108: 1139-1148, 1989. 18. Borsi и др. FEBS Lett., 261: 175-178, 1990. 19. Borsi и др. J. Biol.Chem., 270: 6243-6245, 1995. 20. Zardi и др. ЕМВО J., 6: 2337-2342, 1987. 21. French-Constant и др. J.Cell Biol., 109: 903-914, 1989. 22. Castellani и др. Int. J. Cancer, 59: 612-618, 1994. 23. Tarli и др. Blood, 54: 192-198, 1999. 24. Carnemolla и др. Int. J. Cancer, 68: 397-405, 1996. 25. Viti и др. Cancer Res., 59: 347-353, 1999. 26. Neri и др. Nature Biotechnol., 15: 1271-1275, 1997. 27. Demartis и др. Eur. J. Nucl. Med., 28: 4534-4539, 2001. 28. Birchler и др. Nat. Biotechnol., 17: 984-988, 1999. 29. Nilsson и др. Cancer Res., 61: 711-716, 2001. 30. Halin и др. Nature Biotechnol. В печати, 2002. 31. Carnemolla и др. Blood, 99, 2002. 32. Wu и др. Proc. Nat. Acad. Sci. U.S.A., 97: 8495-8500, 2000. 33. Li и др. Protein Engineering, 10: 731-736, 1997. 34. Pini и др. J. Immunol. Methods, 206: 171-183, 1997. 35. Batista и др. J. Exp. Med., 184: 2197-205, 1996. 36. Riske и др. J. Biol. Chem., 266: 11245-11251, 1991. 37. Bosslet и др. Cancer Res., 55: 1195-1201, 1998. 38. Jain и Baxter. Cancer Res., 48: 7022-7032, 1988. 39. Jain. Vascular and interstitial physiology of tumors. Role in cancer detection and treatment. In: R. Bicknell,C.E. Lewis и N. Ferrara (ред.). Tumour Angiogenesis, cc. 45-59. New York: Oxford University Press, 1997. 40. Jain. Annu. Rev. Biomed. Eng., 2: 241-263, 1999. 41. Turner и Kinet. Nature, 402 Suppl., B24-B30, 1999. 42. Vangelista и др. Jour. Clin. Invest., 703: 1571-1578, 1999. 43. Garman и др. Nature, 406: 259-266, 2000. 44. Hu и др. Cancer Res., 56: 3055-3061, 1996. 45. Magnani и др. Br. J. Cancer, 82: 616-620, 2000.- 22010653 Таблица 1 Иммунореактивность (I) и извлечение радиоактивности (R) из Супердекс 200 радиоактивно меченных антител в различные моменты времени после внутривенной инъекции Иммунореактивность (%) и извлечение радиоактивности (%) из Супердекс 200 определяли в плазме, как описано в материалах и методах. Для нормализации результатов анализ иммунореактивности соотносится с процентными значениями иммунореактивности перед внутривенной инъекцией. н/о: не определяли. Таблица 2 а Эксперименты по биораспределению радиоактивно меченных фрагментов антител L19 и D1.3 Результаты выражены в виде процента от введенной дозы антитела на грамм ткани (% ID/г)SD. н/о: не определяли.- 23010653 Таблица 2b Эксперименты по биораспределению радиоактивно меченных фрагментов антител L19-SIP и D1.3-SIP у мышей, несущих опухоль SK-MEL-28 Результаты выражены в виде процента от введенной дозы антитела на грамм ткани (% ID/г)SD. н/о: не определяли. Таблица 2 с Эксперименты по биораспределению радиоактивно меченных фрагментов антител L19IgG1 и hIgG1 у мышей, несущих опухоль SK-MEL-28 Результаты выражены в виде процента от введенной дозы антитела на грамм ткани (% ID/г)SD. н/о: не определяли.- 24010653 Таблица 3 Соотношение опухоль-орган значений % ID/г радиоактивно меченных форм антитела L19 в мышах, несущих опухоль SK-MEL-28 Таблица 4 Кинетические параметры для клиренса крови трех форм антитела L19 Относительное значение двух периодов полувыведения компонентов. Таблица 5 Эксперименты по биораспределению радиоактивно меченного L19 (scFv) и L19 SIP у мышей, несущих опухоль F9 Результаты выражены в виде процента от введенной дозы антитела на грамм ткани (% ID/г)SD. н/о: не определяли. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Специфический связывающий элемент, который связывает человеческий ED-B, где специфический связывающий элемент является меченным с помощью изотопа, выбранного из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At, и включает сайт связывания антигена, содержащий домен VH антитела и домен VL антитела, при этом домен VH антитела является выбранным из группы, состоящей из доменаL19 VH CDR3 последовательности SEQ ID NO. 3, VH CDR1 необязательно представляет собой L19 VHCDR1 последовательности SEQ ID NO. 1, a VH CDR2 необязательно представляет собой L19 VH CDR2 последовательности SEQ ID NO. 2; и где домен VL антитела является необязательно выбранным из группы, состоящей из домена L19 VL и домена VL антитела, включающего VL CDR1, VL CDR2 и VLCDR3, где VL CDR3 представляет собой L19 VL CDR3 последовательности SEQ ID NO. 6, VL CDR1 необязательно представляет собой L19 VL CDR1 последовательности SEQ ID NO. 4, a VL CDR2 необязательно представляет собой L19 VL CDR2 последовательности SEQ ID NO. 5; последовательности домена при этом специфический связывающий элемент включает мини-иммуноглобулин, содержащий указанные домен VH антитела и домен VL антитела, слитый с S2-CH4 и димеризованный, или включает молекулу IgG1 антитела. 2. Специфический связывающий элемент по п.1, включающий домен VH антитела, содержащий VHCDR с аминокислотными последовательностями SEQ ID NO. 1, SEQ ID NO. 2 и SEQ ID NO. 3, при этом специфический связывающий элемент конкурирует за связывание ED-B с ED-B-связывающим доменом- 29010653 антитела, включающего домен L19 VH и домен L19 VL. 3. Специфический связывающий элемент по п.1 или 2, включающий домен L19 VH. 4. Специфический связывающий элемент по п.3, включающий домен L19 VL. 5. Специфический связывающий элемент по любому из предыдущих пунктов, который представляет собой мини-иммуноглобулин, включающий S2-СН 4. 6. Специфический связывающий элемент по п.5, где домен VH антитела и домен VL антитела находятся в пределах молекулы scFv антитела, слитой с S2-СН 4. 7. Специфический связывающий элемент по п.6, где молекула scFv антитела является слитой с S2CH4 посредством линкерного пептида. 8. Специфический связывающий элемент по п.7, в котором линкерный пептид имеет аминокислотную последовательность GGSG (SEQ ID NO. 7). 9. Специфический связывающий элемент по любому из пп.1-4, который включает цельную молекулу IgG1 антитела. 10. Специфический связывающий элемент по любому из пп.1-9, где изотоп представляет собой 131I. 11. Способ получения специфического связывающего элемента по любому из пп.1-10, при этом указанный способ включает мечение специфического связывающего элемента с помощью изотопа, выбранного из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At. 12. Способ по п.11, в котором мечение включает окисление галогенида, выбранного из группы, состоящей из 76Br, 77Br, 123I, 121I, 131I и 211At, в присутствии специфического связывающего элемента. 13. Способ по п.11, в котором мечение включает конъюгацию активированного бифункционального носителя галогена, содержащего радиоизотоп, выбранный из группы, состоящей из 76Br, 77Br, 123I, 124I, 131I и 211At, с остатком лизина или цистеина или с N-терминальным концом специфического связывающего элемента. 14. Способ по любому из пп.11-13, в котором способ включает экспрессию нуклеиновой кислоты,кодирующей специфический связывающий элемент, перед мечением. 15. Способ по п.14, включающий культивирование хозяйских клеток в условиях для получения специфического связывающего элемента. 16. Способ по любому из пп.11-15, который дополнительно включает изоляцию и/или очистку специфического связывающего элемента. 17. Способ по любому из пп.11-16, который дополнительно включает рецептирование специфического связывающего элемента в композицию, включающую по крайней мере один дополнительный компонент. 18. Способ по любому из пп.11-17, который дополнительно включает связывание специфического связывающего элемента с ED-B или фрагментом ED-B. 19. Способ, включающий связывание специфического связывающего элемента, который связываетED-B, по любому из пп.1-10 с ED-B или фрагментом ED-B. 20. Способ по п.18 или 19, где указанное связывание происходит in vitro. 21. Способ по любому из пп.18-20, включающий определение количества связывания специфического связывающего элемента с ED-B или фрагментом ED-B. 22. Применение связывающего элемента по любому из пп.1-10 в терапевтическом способе лечения организма человека или животного. 23. Применение по п.22, в котором способ терапевтического лечения является способом лечения повреждения, связанного с патологическим ангиогенезом. 24. Применение по п.22, в котором способ терапевтического лечения является способом лечения опухоли. 25. Применение связывающего элемента по любому из пп.1-10 в способе диагностики заболевания организма человека или животного. 26. Применение специфического связывающего элемента по любому из пп.1-10 в производстве лекарственного средства для лечения повреждения, связанного с патологическим ангиогенезом. 27. Применение специфического связывающего элемента по любому из пп.1-10 в производстве лекарственного средства для лечения опухоли. 28. Применение специфического связывающего элемента по любому из пп.1-10 в производстве диагностического реагента.
МПК / Метки
МПК: A61K 51/10, A61P 35/00
Метки: фибронектину, нацеливание, антитела, сосудистую, использовании, радиоактивным, изотопом, сеть, меченного, опухолевую
Код ссылки
<a href="https://eas.patents.su/30-10653-nacelivanie-na-opuholevuyu-sosudistuyu-set-pri-ispolzovanii-mechennogo-radioaktivnym-izotopom-antitela-l-19-k-ed-b-fibronektinu.html" rel="bookmark" title="База патентов Евразийского Союза">Нацеливание на опухолевую сосудистую сеть при использовании меченного радиоактивным изотопом антитела l 19 к ed – b фибронектину</a>












