4-(аминометил) пиперидинбензамиды, обладающие 5нт4-антагонистической активностью
Номер патента: 10630
Опубликовано: 30.10.2008
Авторы: Гейсен Хенрикус Якобус Мария, Мевеллек Лоранс Анн, Босман Жан-Поль Рене Мари Андре
Формула / Реферат
1. Соединение формулы (I)
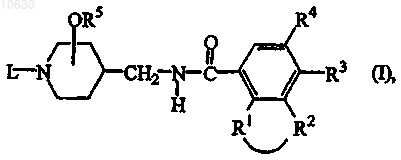
его стереохимическая изомерная форма, N-оксидная форма или фармацевтически приемлемая кислотно- или основно-аддитивная соль, где -R1-R2- представляет собой двухвалентный радикал формулы
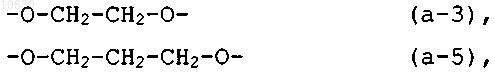
R3 представляет собой C1-6алкил, C1-6алкилокси или галоген;
R4 представляет собой водород или галоген;
R5 представляет собой водород или C1-6алкил, и радикал -OR5 находится в положении 3 или 4 пиперидинового фрагмента;
L представляет собой водород, или L представляет собой радикал формулы
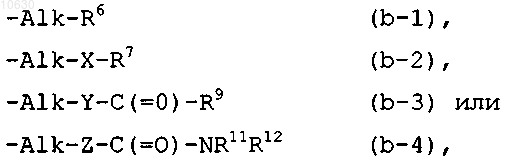
где каждый Alk представляет собой C1-6алкандиил; и
R6 представляет собой водород; гидрокси; циано; C1-6алкилсульфониламино или Het;
R7 представляет собой C1-6алкил; C1-6алкил, замещенный гидроксигруппой; C3-6циклоалкил; арил или Het;
X представляет собой О, SO2 или NR8, где указанный R8 представляет собой водород;
R9 представляет собой водород;
Y представляет собой прямую связь;
Z представляет собой прямую связь;
R11 и R12 представляют собой водород;
арил представляет собой незамещенный фенил или фенил, замещенный аминосульфонилом; и
Het представляет собой тетрагидрофуранил; диоксоланил; 2,3-дигидро-2-оксо-1Н-имидазолил, замещенный C1-6алкилом; или пиридазинил, замещенный C1-6алкилом.
2. Соединение по п.1, где радикал -OR5 находится в положении 3 пиперидинового цикла, имеющего транс-конфигурацию.
3. Соединение по п.2, где абсолютной конфигурацией пиперидинового фрагмента является (3S,4S)-конфигурация.
4. Соединение по любому из пп.1-3, где -R1-R2- представляет собой радикал формулы (а-5), R3 представляет собой хлор и R4 представляет собой хлор.
5. Соединение по любому из пп.1-3, где -R1-R2- представляет собой радикал формулы (а-5), R3 представляет собой хлор и R4 представляет собой бром.
6. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-5.
7. Способ получения фармацевтической композиции по п.6, где терапевтически активное количество соединения по любому из пп.1-5 тщательно смешивается с фармацевтически приемлемым носителем.
8. Соединение формулы (III)
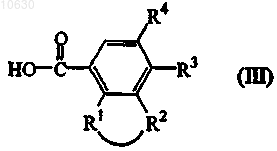
где -R1-R2- представляет собой двухвалентный радикал формулы -O-СН2-СН2-СН2-O- (а-5),
R3 представляет собой C1-6алкил, C1-6алкокси или галоген и
R4 представляет собой водород или галоген.
9. Способ получения соединения формулы (I), где промежуточный продукт формулы (II) подвергается взаимодействию с производным карбоновой кислоты формулы (III) или ее реакционноспособным функциональным производным
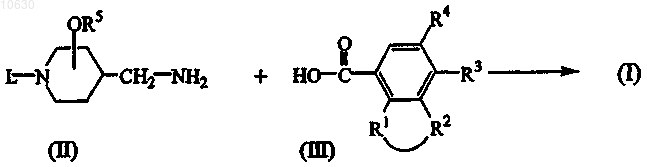
где в приведенных выше схемах реакций радикалы -R1-R2-, R3, R4 и R5, L принимают значения, определенные в п.1; или соединения формулы (I) подвергаются превращению одно в другое в соответствии с известными реакциями превращения; или, если нужно, соединение формулы (I) подвергается превращению в фармацевтически приемлемую кислотно-аддитивную соль, или наоборот, кислотно-аддитивная соль соединения формулы (I) подвергается превращению в форму свободного основания путем обработки щелочью; и, если нужно, с получением его стереохимически изомерных форм.
10. Способ получения соединения формулы (I), где промежуточный продукт формулы (IV) подвергается N-алкилированию соединением формулы (I-а), которое определено как соединение формулы (I), в котором L является водородом, в реакционно-инертном растворителе, и необязательно в присутствии подходящего основания, при этом получая соединение формулы (I-b), определенного как соединение формулы (I), где L не является водородом

где в приведенных выше схемах реакций радикалы -R1-R2-, R3, R4 и R5 принимают значения, определенные в п.1, и W представляет собой подходящую удаляемую группу; или
соединения формулы (I) подвергаются превращению одно в другое в соответствии с известными реакциями превращения; или, если нужно, соединение формулы (I) подвергается превращению в фармацевтически приемлемую кислотно-аддитивную соль, или
наоборот, кислотно-аддитивная соль соединения формулы (I) подвергается превращению в форму свободного основания путем обработки щелочью; и, если нужно, с получением его стереохимически изомерных форм.
11. Способ получения соединения формулы (I), где подходящий кетоновый или альдегидный промежуточный продукт формулы L'=O (V), где L'=O представляет собой соединение формулы L-H, в котором два парных атома водорода в C1-12алкандиильном фрагменте замещены группой =O, подвергается взаимодействию с соединением формулы (I-а) с получением, таким образом, соединений формулы (I-b);
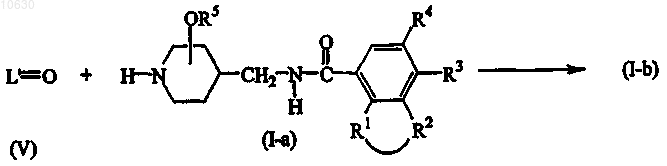
где в приведенных выше схемах реакций радикалы -R1-R2-, R3, R4 и R5 принимают значения, определенные в п.1; или
d) соединения формулы (I) подвергаются превращению одно в другое в соответствии с известными реакциями превращения; или, если нужно, соединение формулы (I) подвергается превращению в фармацевтически приемлемую кислотно-аддитивную соль, или наоборот, кислотно-аддитивная соль соединения формулы (I) подвергается превращению в форму свободного основания путем обработки щелочью; и, если нужно, с получением его стереохимически изомерных форм.
Текст
010630 Данное изобретение относится к новым соединениям формулы (I), обладающим 5 НТ 4 антагонистическими свойствами. Данное изобретение относится также к способам получения таких новых соединений, фармацевтическим композициям, включающим указанные новые соединения, а также к применению указанных соединений в качестве лекарственных средств. В WO-00/37461 описываются бициклические бензамиды производных 3- или 4-замещенных 4(аминометил)пиперидинов, обладающие 5 НТ 4-антагонистическими свойствами. Соединения настоящего изобретения структурно отличаются от указанных описанных ранее соединений наличием функциональной группы в положении 3 бензамидного фрагмента, которая отлична от водорода. Неожиданно оказалось, что соединения формулы (I) настоящего изобретения обладают улучшенными свойствами метаболической стабильности по сравнению с соединениями, описанными в WO00/37461. Настоящее изобретение относится к соединениям формулы (I) его стереохимическая изомерная форма, N-оксидная форма или фармацевтически приемлемая кислотно- или основно-аддитивная соль, где -R1-R2- представляет собой двухвалентный радикал формулыR3 представляет собой C1-6 алкил, C1-6 алкилокси или галоген; R4 представляет собой водород или галоген;R5 представляет собой водород или C1-6 алкил, и радикал -OR5 находится в положении 3 или 4 пиперидинового фрагмента;L представляет собой водород, или L представляет собой радикал формулыY представляет собой прямую связь;Z представляет собой прямую связь;R11 и R12 представляют собой водород; арил представляет собой незамещенный фенил или фенил, замещенный аминосульфонилом; иHet представляет собой тетрагидрофуранил; диоксоланил; 2,3-дигидро-2-оксо-1 Н-имидазолил, замещенный C1-6 алкилом; или пиридазинил, замещенный C1-6 алкилом. В приведенных выше определениях термин галоген представляет собой фтор, хлор, бром и йод; термин C1-4 алкил определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил и т.п.; термин C1-6 алкил, как подразумевается, включает C1-6 алкил и его высшие гомологи, содержащие 5 или 6 атомов углерода, такие как, например, 2-метилбутил, пентил, гексил и т.п.; термин C3-6 циклоалкил представляет собой общее название циклопропила, циклобутила,циклопентила и циклогексила; термин С 1-12 алкандиил определяет двухвалентные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 12 атомов углерода, такие как, например, метандиил, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил, 1,7 гептандиил, 1,8-октандиил, 1,9-нанандиил, 1,10-декандиил, 1,11-ундекандиил, 1,12-додекандиил и их разветвленные изомеры. Термин C1-4 алкандиил определяет двухвалентные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метандиил, 1,2-этандиил, 1,3-пропандиил и 1,4-бутандиил. Термин стереохимически изомерные формы, используемый в данном описании, определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). За исключением особо-1 010630 оговоренных случаев, химическое определение соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Точнее, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично)насыщенных радикалах могут иметь цис- или траснконфигурацию. Соединения, включающие двойные связи, могут иметь Е или Z-стереохимию при указанной двойной связи. Подразумевается, что стереохимически изомерные формы соединений формулы(I) включены в объем настоящего изобретения. Подразумевается, что фармацевтически приемлемые кислотно-и основно-аддитивные соли, которые упомянуты выше, включают фармацевтически активные нетоксичные кислотно- и основноаддитивные солевые формы, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены обычными методами обработкой основной формы такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например, соляная или бромисто-водородная, серная, азотная, фосфорная и т.п. кислоты; или органические кислоты, такие как, например, уксусная, пропановая,гидроксиуксусная, молочная, пировиноградная, оксалиловая (т.е. этандионовая), малоновая, янтарная(т.е. бутандионовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая,этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, паминосалициловая, памовая и т.п. кислоты. И наоборот, указанные солевые формы могут быть превращены стандартным способом обработкой подходящим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, также могут быть превращены в нетоксичные соли металлов или амино-аддитивные солевые формы обработкой подходящими органическими или неорганическими основаниями. Подходящие основные солевые формы включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например лития, натрия, калия, магния,кальция и т.п., соли с органическими основаниями, например, бензатином, N-метил-D-глюкамином, гидрабаминовые (hydrabamine) соли и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин аддитивная соль, упомянутый выше, включает также сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты,алкоголяты и т.п. Некоторые из соединений формулы (I) могут также существовать в таутомерной форме. Подразумевается, что такие формы, хотя конкретно и не показаны в приведенной выше формуле, включены в объем настоящего изобретения. Например, когда ароматический гетероцикл замещен гидроксильной группой, кето-форма может быть наиболее известным таутомером.N-оксидные формы соединений формулы (I), которые могут быть получены известными способами,включают соединения формулы (I), в которых один или несколько атомов азота окислены до N-оксида. В частности, изучены N-оксиды, в которых атом азота пиперидинового цикла находится в форме N-оксида. Группу соединений, представляющих интерес, составляют соединения формулы (I), в которых выполняется одно или несколько из следующих ограничений:a) -R1-R2- представляют собой радикал формулы (а-3); и/илиb) -R1-R2- представляют собой радикал формулы (а-5); и/илиe) R4 представляет собой водород или галоген; и/илиf) R5 представляет собой водород или метил, и радикал -OR5 находится в положении 3 или 4 пиперидинового цикла; и/илиj) радикал -OR5 находится в положении 3 пиперидинового цикла и в транс-положении относительно метилена в положении 4 пиперидинового фрагмента, и абсолютная конфигурация указанного пиперидинового фрагмента представляет собой (3S, 4S); и/илиl) L представляет собой радикал формулы (b-1), (b-2), (b-3) или (b-4); илиm) L представляет собой радикал формулы (b-1), где Alk представляет собой C1-4 алкандиил и R6 представляет собой водород, гидрокси, циано, С 1-6 алкилсульфониламино или Het, который представляет собой тетрагидрофуранил, диоксоланил или 2,3-дигидро-2-оксо-1 Н-имидазолил, замещенный C1-6 алкилом; илиL представляет собой радикал (b-2), где Alk представляет собой С 1-4 алкандиил, X представляет собой О и R7 представляет собой C1-6 алкил, C1-6 алкил, замещенный гидрокси, или арил, представляющийL представляет собой радикал (b-2), где Alk представляет собой С 1-4 алкандиил, X представляет собой NR8, где R8 представляет собой водород и R7 представляет собой C1-6 алкил, или Het, который представляет собой пиразинил, замещенный C1-6 алкилом; илиL представляет собой радикал (b-2), где Alk представляет собой C1-4 алкандиил, X представляет собой SO2 и R7 представляет собой C1-6 алкил; илиL представляет собой радикал (b-3), где Alk представляет собой С 1-4 алкандиил, Y представляет собой прямую связь и R9 представляет собой гидрокси; илиL представляет собой радикал формулы (b-4), где Alk представляет C1-4 алкандиил, Z представляет собой прямую связь и R11 и R12 оба представляют собой водород. Другими соединениями, представляющими интерес, являются соединения формулы (I), где -R1-R2 представляет собой двухвалентный радикал формулыR4 представляет собой водород или галоген;R5 представляет собой водород или C1-6 алкил, и -OR5 радикал находится в положении 3 или 4 пиперидинового фрагмента;L - водород, или L представляет собой радикал формулыY представляет собой прямую связь;Z представляет собой прямую связь;R11 и R12 каждый независимо представляет собой водород; арил представляет собой незамещенный фенил, фенил, замещенный аминосульфонилом; иHet представляет собой тетрагидрофуранил; диоксоланил; 2,3-дигидро-2-оксо-1 Н-имидазолил, замещенный C1-6 алкилом, или пиразинил, замещенный C1-6 алкилом. Соединениями, представляющими особый интерес, являются соединения формулы (I), в которых радикал -OR5, предпочтительно представляющий собой гидрокси или метоксигруппу, находится в положении 3 пиперидинового фрагмента и имеет трансконфигурацию, т.е. радикал -OR5 находится в трансположении относительно метилена на пиперидиновом фрагменте. Соединениями, представляющими еще больший интерес, являются соединения формулы (I), в которых двухвалентный радикал -R1-R2- представляет собой радикал формулы (а-3) или (а-5), радикал -OR5 представляет собой гидрокси и находится в положении 3 пиперидинового фрагмента с (3Sтранс)конфигурацией, что соответствует абсолютной (3S,4S) конфигурации указанного пиперидинового фрагмента. Предпочтительными соединениями являются соединения, представляющие особый или еще больший интерес, в которых L представляет собой радикал формулы (b-1), где Alk представляет собой C16 4 алкандиил, и R представляет собой водород, гидрокси, циано, C1-6 алкилсульфониламино или Het, который представляет собой тетрагидрофуранил, диоксоланил, или 2,3-дигидро-2-оксо-1 Н-имидазолил, замещенный C1-6 алкилом. Другими предпочтительными соединениями являются соединения, представляющие особый или еще больший интерес, в которых L представляет собой радикал (b-2), где Alk представляет собой C1-4 алкандиил, х представляет собой О и R7 представляет собой C1-6 алкил, C1-6 алкил, замещенный гидрокси,или арил, который представляет собой фенил, замещенный аминосульфонилом. Другими предпочтительными соединениями являются соединения, представляющие особый или еще больший интерес, в которых L представляет собой радикал (b-2), где Alk представляет собой C1-6 алкандиил, Х представляет собой NR8, где R8 представляет собой водород и R7 представляет собой C1-6 алкил или Het, который представляет собой пиразинил, замещенный C1-6 алкилом. Другими предпочтительными соединениями являются соединения, представляющие особый или еще больший интерес, в которых L представляет собой радикал (b-2), где Alk представляет собой C1-4 алкандиил, X представляет собой SO2 и R7 представляет собой C1-6 алкил.-3 010630 Другими предпочтительными соединениями являются соединения, представляющие особый или еще больший интерес, в которых L представляет собой радикал (b-3), где Alk представляет собой C1-4 алкандиил, Y представляет собой прямую связь и R9 представляет собой гидрокси. Другими предпочтительными соединениями являются соединения, представляющие особый или еще больший интерес, в которых L представляет собой радикал формулы (b-4), где Alk представляет собой C1-4 алкандиил, и Z представляет собой прямую связь, и R11 и R12 оба представляют собой водород. Наиболее предпочтительными соединениями являются соединения, заслуживающие особого внимания, или еще более интересные соединения, в которых R3 представляет собой метокси и R4 представляет собой водород. Соединения формулы (I) могут быть получены взаимодействием промежуточного продукта формулы (II) с замещенной карбоновой кислотой формулы (III) или, необязательно, ее реакционноспособным производным, содержащим функциональную группу, таким как, например, карбонилимидазольные производные, ацилгалогениды или смешанные ангидриды. Указанное образование амидной связи может осуществляться при перемешивании реагентов в подходящем растворителе, необязательно в присутствии основания, такого как триэтиламин. Соединения формулы (I-b), определенные как соединения формулы (I), в которых L отличен от водорода, обычно могут быть получены N-алкилированием промежуточного продукта формулы (I-а) промежуточным продуктом формулы (IV), где W представляет собой подходящую удаляемую группу, такую как, например, галоген, например фтор, хлор, бром, йод, или в некоторых случаях W может также представлять собой сульфонилоксигруппу, например метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и т.п. реакционноспособные удаляемые группы. Соединения формулы (I-а) определены как соединения формулы (I), в которых L представляет собой водород. Реакция может проводиться в инертном для данной реакции растворителе, таком как, например, ацетонитрил, 2-пентанол, изобутанол, диметилацетамид или ДМФА, и необязательно в присутствии подходящего основания, такого как,например, карбонат натрия, карбонат калия, N-метилпирролидон или триэтиламин. Перемешивание может повышать скорость реакции. Взаимодействие может удобно осуществляться при температуре в интервале от комнатной температуры до температуры кипения реакционной смеси. Альтернативно, соединения формулы (I-b) также могут быть получены восстановительным Nалкилированием соединения формулы (I-а) промежуточным продуктом формулы L'=O(V), где L'=O представляет собой производное формулы L-H, в котором два соседних атома водорода замещены кислородом, в соответствии с известными методиками восстановительного N-алкилирования. Указанное восстановительное N-алкилирование может проводиться в растворителе, инертном для данного взаимодействия, таком как, например, дихлорметан, этанол, толуол или их смесь, и в присутствии восстановителя, такого как, например, борогидрид, например борогидрид натрия, цианоборогидрид или триацетоксиборогидрид натрия. Может быть удобно использовать в качестве восстановителя водород в сочетании с подходящим катализатором, таким как, например, палладий на углероде или платина на углероде. При применении в качестве восстановителя водорода может быть полезно добавлять в реакционную смесь осушитель, такой как, например, трет-бутоксид алюминия. Для предотвращения дальнейшего нежелательного гидрирования некоторых функциональных групп в реагентах и продуктах реакции также может быть полезно добавлять в реакционную смесь подходящий каталитический яд, например тиофен или хинолин-серу. Для повышения скорости реакции температура может подниматься до температуры в интервале от комнатной температуры до температуры кипения реакционной среды и, необязательно, может подниматься давление водорода. Соединения формулы (I-а) могут быть получены взаимодействием промежуточного продукта фор-4 010630 мулы (VI), где PG представляет собой подходящую известную в данной области защитную группу, такую как, например, трет-бутоксикарбонильная или бензильная группа, или удаляемую под действием света группу, с кислотой формулы (III) или ее подходящими реакционноспособными функциональными производными, такими как, например, карбонилимидазольные производные, с последующим удалением защитных групп из полученного таким образом промежуточного продукта, то есть удаление защитной группы способами, известными в данной области. Соединения формулы (I) также могут быть получены превращением соединений формулы (I) друг в друга в соответствии с известными способами превращения групп. Исходные вещества и некоторые из промежуточных продуктов являются известными соединениями и коммерчески доступны или могут быть получены в соответствии со стандартными методиками, известными в данной области техники. Например, промежуточные продукты формулы (II) могут быть получены в соответствии с методиками, описанными в WO-99/02156 или WO-00/37461. Промежуточные продукты формулы (VI) могут быть получены в соответствии с общей методикой,описанной в WO-99/02156 или WO-00/37461 для получения описанных промежуточных продуктов(VIII). Соединения формулы (I), полученные в соответствии с описанными выше способами, могут синтезироваться в форме рацемических смесей энантиомеров, которые могут разделяться в соответствии с известными в данной области техники методиками разделения. Рацемические соединения формулы (I) могут превращаться в соответствующие диастереомерные солевые формы путем взаимодействия с подходящей хиральной кислотой. Указанные диастереомерные солевые формы последовательно разделяются, например, селективной или фракционной кристаллизацией, и энантиомеры выделяются из них с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием стационарной хиральной фазы. Указанные стереохимически чистые изомерные формы также могут быть получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ, при условии стереоспецифического проведения реакции. Предпочтительно, если целевым соединением является специфический стереоизомер, указанное соединение будет синтезировано стереоспецифическими способами получения. В таких способах будут преимущественно применяться энантиомерно чистые исходные вещества. Соединения формулы (I), их N-оксиды, пролекарства, фармацевтически приемлемые соли и стереоизомерные формы обладают 5 НТ 4-антагонистическими свойствами, как описано в примере С.l. Кроме того, соединения формулы (I) проявляют улучшенную метаболическую стабильность по сравнению со структурными аналогами, описанными в публикации WO-00/37461, как показано в примере С.2. Указанные преимущественные свойства метаболической стабильности приводят к снижению риска взаимодействия лекарство-лекарство на уровне цитохромных Р 450 ферментов, таких как, например, CYP1A2, CYP3A4, CYP2D6, CYP2C9 и CYP2C19 и, следовательно, данные соединения обладают улучшенным профилем безопасности лекарства. Кроме того, указанные свойства метаболической стабильности могут позволить вводить соединения формулы (I) один раз вместо обычного введения активного ингредиента в режиме от двух до четырех раз в день, что предоставляет пациенту большее удобство. Ввиду наличия 5 НТ 4-антагонистических свойств соединений данного изобретения указанные соединения обычно могут использоваться для лечения или профилактики желудочно-кишечных расстройств, таких как гиперкинезия, синдром воспаленной толстой кишки, IBS с преобладающей констипацией или диареей, IBS с преобладающей болью и неболевой IBS, повышенная чувствительность кишечника, и снижения боли, связанной с повышенной чувствительностью или повышенной активностью желудочно-кишечного тракта. Считается также, что соединения формулы (I) применимы для предотвращения или профилактики нарушенной, затрудненной или ослабленной желудочной аккомодации, такой как диспепсия. Симптомами диспепсии являются, например, эпигастральное давление, потеря аппетита, ощущение наполненности желудка, быстрого насыщения, тошнота, рвота, вздутие и отрыжка воздухом. Соединения формулы (I) также могут применяться для лечения других 5 НТ 4-опосредуемых расстройств, таких как булемия и гиперфагия (hyperphagia). Поскольку соединения формулы (I) обладают полезными свойствами, настоящее изобретение относится также к способу лечения теплокровных животных, включая человека (называемых в данном описании пациентами), страдающих желудочно-кишечными расстройствами, такими как синдром раздраженной толстой кишки (IBS). Следовательно, настоящее изобретение относится к способу лечения для облегчения состояния пациентов, страдающих такими расстройствами, как гиперкинезия, синдром вос-5 010630 паленной толстой кишки (IBS), IBS с преобладающей констипацией или диареей, IBS с преобладающей болью и неболевой IBS, повышенная чувствительность кишечника, а также для снижения боли, связанной с повышенной чувствительностью или повышенной активностью желудочно-кишечного тракта. Соединения формулы (I) могут также потенциально применяться при других расстройствах, таких как расстройства, связанные с повышенной перистальтикой кишечника. В частности, они также потенциально применимы для лечения желудочных симптомов гастроэзофагеального рефлюкса, таких как изжога (включая эпизодическую изжогу, ночную изжогу и изжогу, вызванную приемом пищи). Кроме того, соединения формулы (I), обладающие 5 НТ 4-антагонистической активностью, также потенциально применимы для лечения или профилактики повышенной чувствительности мочевого пузыря,повышенной активности мочевого пузыря, снижения симптома мочевых путей, начальной доброкачественной гиперплазии предстательной железы (ВРН), простатита, гиперрефлексии сжимателя, закупорки истечения, частого мочеиспускания, ночной боли, сильной потребности в мочеиспускании, сопровождающейся опасением непроизвольного мочеиспускания, повышенной чувствительности таза, подтекания мочи при сильном желании мочиться, уретрита, простатодинии, цистита, идиопатической повышенной чувствительности мочевого пузыря, недержания мочи или недержания мочи, связанного с синдромом раздраженной толстой кишки. В связи с этим может быть полезно комбинировать соединения формулы(I), обладающие 5 НТ 4-антагонистической активностью, с альфа-адренорецепторным антагонистом, таким как альфузосин, индорамин, тамсулосин, доксазосин, теразосин, абаноквил или празосин, для получения фармацевтических композиций, включающих такой альфа-адренорецепторный антагонист и 5 НТ 4-рецепторный антагонист формулы (I). Следовательно, данное изобретение относится к соединениям формулы (I) для применения в качестве лекарственного средства, в частности, для применения соединения формулы (I) для производства лекарственного средства для лечения желудочно-кишечных расстройств, таких как гиперкинезия, IBS,IBS с преобладающей констипацией или диареей, IBS с преобладающей болью и неболевой IBS, повышенная чувствительность кишечника, а также для снижения боли, связанной с повышенной чувствительностью или повышенной активностью желудочно-кишечного тракта. Исследовалось как профилактическое, так и терапевтическое действие. Вследствие наличия 5 НТ 4-антагонистических свойств соединения данного изобретения также могут применяться для лечения или профилактики 5 НТ 4-опосредуемых CNS расстройств у человека. В частности, соединения формулы (I) могут использоваться для лечения ряда CNS расстройств, включая, но без ограничения, токсикоманию, расстройства познавательной способности, такие как болезнь Альцгеймера,старческое слабоумие; поведенческих расстройств, таких как шизофрения, маниакальный синдром, обсессивно-компульсивное расстройство и расстройства, связанные с применением психотропных веществ; расстройств, связанных с настроением, таких как депрессия, аффективное биполярное расстройство, тревога и расстройство, связанное с состоянием панического страха; расстройства контроля функции, относящейся к вегетативной нервной системе, таких как гипертензия и нарушения сна; обсессивнокомпульсивных расстройств, включая анорексию и булимию, и нейропсихиатрических расстройств, таких как синдром Жиля де ла Туретта и болезнь Хантингтона. Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения в форме свободного основания или кислотно-аддитивной соли в качестве активного ингредиента тщательно смешивается с фармацевтически приемлемым носителем, который может иметь различные формы в зависимости от желательного способа введения. Такие фармацевтические композиции желательно представляют собой лекарственную форму стандартной дозы, предпочтительно подходящую для введения перорально, ректально или парентеральной инъекцией. Например, при получении композиций в лекарственной форме для перорального введения может использоваться любая фармацевтически приемлемая среда, такая как, например, вода, гликоли, масла, спирты и т.п. в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие добавки, дезинтеграторы и т.п., в случае порошков, пилюль, капсул и таблеток. Ввиду легкости введения таблетки и капсулы представляют собой наиболее преимущественную лекарственную форму стандартной дозы, в которой очевидно применяются твердые фармацевтические носители. В композициях для парентерального введения носитель обычно будет включать стерильную воду, по меньшей мере, в значительном количестве,хотя могут включаться и другие ингредиенты, например, способствующие растворимости. Например,могут быть получены растворы для инъекций, в которых носитель включает физиологический раствор,раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть получены также суспензии для инъекций, в которых могут применяться подходящие жидкие носители, суспендирующие вещества и т.п. В композициях, подходящих для подкожного введения, носитель необязательно включает добавку для повышения проникновения и/или подходящий смачивающий агент, необязательно в сочетании с подходящими добавками любой природы в минимальных количествах, которые не оказывают значительного неблагоприятного воздействия на кожу. Указанные добавки могут способствовать нанесению на кожу и/или могут быть полезны для получения желательных композиций. Такие композиции могут вводиться различными способами, например в виде трансдермального пластыря, в виде пятна, в виде-6 010630 мази. Кислотно-аддитивные соли (I) благодаря их повышенной растворимости в воде по сравнению с соответствующим свободным основанием являются, несомненно, более приемлемыми для получения водных композиций. Особенно преимущественно приготавливать упомянутые фармацевтические композиции в форме стандартной лекарственной дозы для простоты введения и однородности дозирования. Термин лекарственная стандартная форма, используемый в описании и формуле изобретения, относится к физически дискретным единицам, приемлемым в качестве стандартных доз, каждая из которых содержит предопределенное количество активного ингредиента, которое, как подсчитано, обеспечивает желательное терапевтическое действие, в сочетании с необходимым фармацевтическим носителем. Примерами таких лекарственных стандартных форм являются таблетки (включая таблетки с насечками или покрытие оболочкой), капсулы, пилюли, расфасованные в пакеты порошки, пластины, растворы или суспензии для инъекций, чайные ложки для наполнения раствором, столовые ложки для наполнения и т.п. множества их сочетаний. Фармацевтические композиции для перорального введения могут принимать форму твердых лекарственных форм, например таблеток (как таблеток, предназначенных только для проглатывания, так и форм для разжевывания), капсул или желатиновых капсул (gelcaps), полученных стандартными способами в сочетании с фармацевтически приемлемыми разбавителями, такими как связующие агенты (например, предварительно желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества, (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натрийкрахмалгликолят); или смачивающие агенты (например, натрийлаурилсульфат). Таблетки могут покрываться оболочкой способами, хорошо известными в данной области техники. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта, предназначенного для смешения с водой или другим подходящим разбавителем перед применением. Такие жидкие препараты могут быть получены стандартными способами, необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитовый сироп, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрированные пищевые жиры); эмульгирующие добавки (например, лецитин или акация); неводные разбавители (например, миндальное масло, эфирные масла или этиловый спирт); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащивающие вещества предпочтительно включают по меньшей мере одно выраженное подслащивающее вещество, такое как сахарин, натриевая или кальциевая соль сахарина, аспартам, ацесульфам калий, цикламат натрия, алитам, дигидрохальконовое подслащивающее вещество, монеллин, стевиозид или сахароза (4,1',6'-трихлор-4,1',6'-тридеоксигалактосахароза), предпочтительно сахарин, натриевую или кальциевую соль сахарина, и необязательно, подслащивающий наполнитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, сироп гидрированной глюкозы, ксилит, карамель или мед. Выраженные подслащивающие вещества обычно применяются в низких концентрациях. Например,в случае натриевой соли сахарина концентрация может находиться в интервале от 0,04 до 0,1% (мас./об.) из расчета на общий объем конечной композиции и предпочтительно составляет примерно 0,06% в препаратах низкой дозы и примерно 0,08% в препаратах высокой дозы. Подслащивающий наполнитель может эффективно применяться в больших количествах, которые составляют от примерно 10 до примерно 35%, предпочтительно от примерно 10 до 15% (мас./об.). Фармацевтически приемлемые вкусовые добавки, которые могут маскировать горький вкус ингредиентов в препаратах низкой дозы, предпочтительно представляют собой фруктовые вкусовые вещества,такие как вишневое, малиновое, черносмородиновое или земляничное вкусовое вещество. Сочетание двух вкусовых веществ может приводить к хорошим результатам. В препаратах высокой дозы могут быть необходимы более выраженные вкусовые вещества, такие как вкусовое вещество карамельного шоколада (Caramel Chocolate), мятное прохладительное вкусовое вещество (Mint Cool flavour), фантазийное вкусовое вещество (Fantasy flavour) и другие фармацевтически приемлемые выраженные вкусовые вещества. Каждое вкусовое вещество может быть представлено в конечной композиции в концентрации в интервале от 0,05 до 1% (мас./об). Преимущественно применяются сочетания указанных выраженных вкусовых веществ. Предпочтительно применяется вкусовое вещество, которое не подвергается какому-либо изменению или не теряет вкус и цвет в кислотной среде препарата. Препараты данного изобретения могут необязательно включать ветрогонное средство, такое как симетикон (simethicone), альфа-D-галактоза и т.п. Соединения данного изобретения могут также вводиться в депо-препараты. Такие препараты длительного действия могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так соединения могут, например, вводиться в препарат с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионнообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно рас-7 010630 творимой соли. Соединения данного изобретения могут вводиться в препарат для парентерального инъекционного введения, обычно внутривенной, внутримышечной или подкожной инъекции, например болюсной инъекции или непрерывного внутривенного вливания. Препараты для инъекции могут быть представлены в стандартной лекарственной форме, например, в ампулах или в контейнерах множественной дозы с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в маслянистых или водных разбавителях, и могут содержать такие добавки в препараты, как вещества, придающие раствору изотоничность, суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть представлен в форме порошка для смешения перед применением с подходящим разбавителем, например стерильной, не содержащей пирогена водой. Соединения данного изобретения могут также вводиться в композиции для ректального применения, такие как свечи или клизмы удержания, например, содержащие стандартные основы свечей, такие как какао-масло или другие глицериды. Для назального введения соединения данного изобретения могут применяться, например, в виде жидкого спрея, в виде порошка или в форме капель. Обычно подразумевается, что терапевтически эффективное количество должно составлять от примерно 0,0001 до примерно 1 мг/кг массы тела, предпочтительно от примерно 0,001 до примерно 0,5 мг/кг массы тела. Экспериментальная часть В методиках, представленных далее в описании, использовались следующие аббревиатуры: ACN означает ацетонитрил; ТГФ означает тетрагидрофуран; ДХМ означает дихлорметан; DIPE означает диизопропилэфир; EtOAc означает этилацетат; NH4OAc означает ацетат аммония; НОАс означает уксусную кислоту; MIK означает метилизобутилкетон. Для некоторых химических соединений использовались химические формулы, например, NaOH для гидроксида натрия, Na2CO3 для карбоната натрия, K2CO3 для карбоната калия, Н 2 для газообразного водорода, N2 для газообразного азота, CH2Cl2 для дихлорметана, СН 3 ОН для метанола, NH3 для аммиака,HCl для соляной кислоты, NaH для гидрида натрия, CaCO3 для карбоната кальция, СО для оксида углерода и KOH для гидроксида калия. А. Получение промежуточных продуктов Пример А.1 а) Получение промежуточного продукта (1)(0,444 моль) и CuO (1,4 г) в ДМФА (1000 мл) перемешивают в течение 6 ч, охлаждают, фильтруют и фильтрат упаривают. К полученному остатку добавляют воду (300 мл). Смесь дважды экстрагируют ДХМ (300 мл). Органический слой отделяют, промывают насыщенным раствором NaHCO3, сушат,фильтруют и растворитель выпаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат,получая 32,1 г метил-2,3-дигидро-8-метокси-1,4-бензодиоксин-5-карбоксилата (промежуточный продукт 1, т.пл. 84 С).b) получение промежуточного продукта (2) Смесь промежуточного продукта (1) (0,118 моль) и N-хлорсукцинимида (0,125 моль) в ACN (350 мл) перемешивают при комнатной температуре в течение двух дней. Растворитель выпаривают и остаток распределяют между ДХМ (500 мл) и водой (500 мл). Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Часть остатка кристаллизуют из смеси DIPE и ACN, получая метил-7-хлор 2,3-дигидро-8-метокси-1,4-бензодиоксин-5-карбоксилат (промежуточный продукт 2, т.пл. 99 С) с) Получение промежуточного продукта (3) Смесь промежуточного продукта (2) (0,138 моль) в 2N растворе NaOH (500 мл) кипятят с обратным холодильником при перемешивании в течение 1 ч, затем охлаждают и промывают ДХМ. Смесь разделяют на слои. Водный слой подкисляют концентрированным раствором HCl до рН=2. Твердое вещество отфильтровывают, промывают водой и сушат в вакууме. Часть (2,5 г) полученной фракции кристаллизуют из метанола. Осадок отфильтровывают и сушат, получая 0,88 г 7-хлор-2,3-дигидро-8-метокси-1,4-8 010630 бензодиоксин-5-карбоновой кислоты (промежуточный продукт 3, т.пл. 172 С). Пример А.2 а) Получение промежуточного продукта (4) Смесь метилового эфира 2,3-дигидрокси-4-метилбензойной кислоты (1,2 моль), 1,3-дибромпропан(152 мл) и K2CO3 (380 г) в 2-пропаноне (2500 мл) кипятят с обратным холодильником при перемешивании в течение 20 ч. Реакционную смесь охлаждают, фильтруют и фильтрат упаривают, получая 300 г промежуточного продукта (4).b) Получение промежуточного продукта (5) Смесь промежуточного продукта (4) (1,12 моль) в NaOH (2 М) (1800 мл) и ТГФ (500 мл) кипятят с обратным холодильником при перемешивании в течение 3 ч. Реакционную смесь охлаждают и органический растворитель выпаривают. Водный концентрат подкисляют HCl и полученный осадок отфильтровывают, промывают водой и сушат, получая 403 г промежуточного продукта (5). Пример А.3 а) Получение промежуточного продукта (6) Смесь метилового эфира 2,3-дигидрокси-4-метоксибензойной кислоты (0,45 моль), 1,3 дибромпропана (0,72 моль), K2CO3 (155 г) и CuO (3,6 г) в ДМФА (2500 мл) перемешивают при температуре в интервале от 120 до 130 С в течение 7 ч, охлаждают и фильтруют. Растворитель выпаривают. Добавляют HCl (0,5 N водный раствор, 1000 мл). Смесь экстрагируют дважды ДХМ (750 мл). Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/ДХМ 70/30/15). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из DIPE, получая метил-3,4-дигидро-9 метокси-2 Н-1,5-6 ензодиоксепин-6-карбоксилат (промежуточный продукт 6).b) Получение промежуточного продукта (7) Раствор NaOH (500 мл, 2N) добавляют к раствору промежуточного продукта (б) в ТГФ (250 мл). Смесь перемешивают при комнатной температуре в течение ночи. Часть растворителя выпаривают. Остаток экстрагируют ДХМ. Смесь делят на слои. Водный слой подкисляют концентрированным раствором HCl до рН=1-2. Твердое вещество отфильтровывают, промывают водой и сушат, получая 35,5 г 9 метокси-3,4-дигидро-2 Н-1,5-6 ензодиоксепин-6-карбоновой кислоты (промежуточный продукт 7). Пример А.4 а) Получение промежуточного продукта (8) Промежуточный продукт (7) превращают в 8-хлор-3,4-дигидро-9-метокси-2 Н-1,5-6 ензодиоксепин 6-карбоновую кислоту (промежуточный продукт 8, т.пл. 173 С) в соответствии с приведенной выше методикой (описанной в примере A.1.b) с использованием N-хлорсукцинимида. Пример А. 5 а) Получение промежуточного продукта (9) Смесь 3-фтор-1,2-6 ензолдиола (0,078 моль) и K2CO3 в атмосфере CO2 (газ, 50 атм или 5,1 МПа) перемешивают при температуре 170 С в течение 16 ч. Реакционную смесь подкисляют водным растворомHCl и растворитель выпаривают. К остатку добавляют диэтиловый эфир (500 мл) и смесь перемешивают-9 010630 в течение 15 мин, затем охлаждают и фильтруют через целит. Растворитель из фильтрата выпаривают,получая 3,8 г промежуточного продукта (9).b) Получение промежуточного продукта (10)(9) (0,022 моль) растворяют в метаноле (70 мл) и добавляют к смеси (I). Полученную реакционную смесь кипятят с обратным холодильником при перемешивании в течение 20 ч. Растворитель выпаривают и остаток распределяют между этилацетатом и водой. Органический слой сушат и растворитель выпаривают. Реакцию повторяют несколько раз с неочищенной смесью и все фракции продукта объединяют, получая 31 г промежуточного продукта (10). с) Получение промежуточного продукта (11) Смесь промежуточного продукта (10) (0,166 моль) и K2CO3 (0,365 моль) в 1,3-дибромпропане (0,166 моль) и ацетоне (500 мл) кипятят с обратным холодильником при перемешивании в течение 24 ч. Реакционную смесь охлаждают, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле. Фракции, содержащие продукт, объединяют и растворитель выпаривают. Остаток очищают высокоэффективной жидкостной хроматографией (с обращенной фазой). Фракции продукта собирают и растворитель выпаривают, получая 3 г промежуточного продукта (11).d) Получение промежуточного продукта (12) Смесь промежуточного продукта (11) (0,013 моль) в NaOH (80 мл, 2N) и ТГФ (50 мл) перемешивают при температуре 30 С в течение 6 ч. Часть растворителя выпаривают, концентрат охлаждают на ледяной бане и подкисляют HCl (конц.). Твердые вещества отфильтровывают, промывают водой и сушат,получая 2,45 г промежуточного продукта (12). Пример А.6 а) Получение промежуточного продукта (13) Смесь метилового эфира 5-хлор-2,3-дигидроксибензойной кислоты (0,49 моль) и уксусной кислоты(2000 мл) при перемешивании нагревают до температуры кипения. По каплям в кипяшую смесь добавляют раствор N-хлорсукцинимида (0,49 моль) в уксусной кислоте (600 мл). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 30 мин. В кипящую смесь добавляют дополнительную порцию раствора N-хлорсукцинимида (0,075 моль) в уксусной кислоте (100 мл). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 30 мин, затем охлаждают и выливают в воду (500 мл). Остаток экстрагируют толуолом (3 раза). Отделенный органический слой промывают водой, сушат и упаривают. Остаток кристаллизуют из DIPE и петролейного эфира, получая 70 г промежуточного продукта (13).b) Получение промежуточного продукта (14) Смесь промежуточного продукта (13) (0,3 моль), 1,3-дибромпропана (0,35 моль) и K2CO3 (0,7 моль) в 2-пропаноне (1000 мл) кипятят с обратным холодильником при перемешивании в течение 30 ч. Реакционную смесь охлаждают, разбавляют водой (2000 мл) и два раза экстрагируют ДХМ. Отделенный органический слой промывают водой, сушат и растворитель выпаривают. Остаток кристаллизуют из DIPE и петролейного эфира, получая 55 г промежуточного продукта (14). с) Получение промежуточного продукта (15) Смесь промежуточного продукта (14) (0,2 моль) и KOH (1 моль) в воде (1000 мл) кипятят с обратным холодильником при перемешивании в течение 90 мин. Реакционную смесь охлаждают, подкисляютHCl, образующийся осадок отфильтровывают, промывают водой и сушат, получая 46 г промежуточного продукта (15). Пример А.7 а) Получение промежуточного продукта (16) Смесь метилового эфира 5-хлор-2,3-дигидроксибензойной кислоты (0,1 моль), уксусной кислоты(250 мл) и N-бромсукцинимида (0,11 моль) кипятят с обратным холодильником при перемешивании в течение 4 ч. Реакционную смесь охлаждают и выливают в воду (500 мл). Осадок отфильтровывают и сушат, получая 23 г промежуточного продукта (16).b) Получение промежуточного продукта (17) Смесь промежуточного продукта (16) (0,7 моль), 1,3-дибромпропана (0,94 моль) и K2CO3 (1,55 моль) в 2-пропаноне (1300 мл) кипятят с обратным холодильником при перемешивании в течение 20 ч. Реакционную смесь охлаждают, фильтруют и растворитель выпаривают. Остаток растирают в петролейном эфире, фильтруют и сушат, получая 240 г промежуточного продукта (17). с) Получение промежуточного продукта (18) Смесь промежуточного продукта (17) (0,053 моль) и KOH (0,2 моль) в воде (160 мл) кипятят с обратным холодильником при перемешивании в течение 90 мин. Реакционную смесь охлаждают и водный слой экстрагируют ДХМ. Водный слой подкисляют HCl и полученный осадок отфильтровывают, промывают водой и сушат, получая 13 г промежуточного продукта (18). Пример А.8 Получение промежуточного продукта (19) Смесь 1,1-диметилэтил(транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилата [описанного в WO-00/37461 в качестве промежуточного продукта (I-d)] (0,023 моль) и метанола (100 мл) гидрируют с использованием палладия на углероде (10%, 1 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток обрабатывают DIPE + ACN с получением твердого осадка, который отфильтровывают и сушат, получая 4 г 1,1 диметилэтил-(транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилат (промежуточный продукт 19,т.пл. 178 С). Аналогичным способом, но исходя из цис-3-гидрокси-4-пиперидинметанола (описанного в публикации J. Org. Chem., 34, pp. 3674-3676 (1969, получают 1,1-диметилэтил-(цис)-4-(аминометил)-3 гидрокси-1-пиперидинкарбоксилат (промежуточный продукт 20).- 11010630 Пример А.9 а) Получение промежуточного продукта (21) 1,1-Димемилэтил-(транс)-3-гидрокси-4-(феншметил)амино]метил]-1-пиперидинкарбоксилат [описанный в WO-00/37461 в качестве промежуточного продукта (I-d)] (2,73 моль) выделяют и очищают хиральной колоночной хроматографией на Chiralcel AD (элюент : гексан/этанол 80/20). Целевые фракции собирают и растворитель выпаривают. К остатку добавляют толуол и ацеотропно отгоняют его на роторном испарителе, получая 377 г 1,1-диметилэтил-(3S-транс)-3-гидрокси-4-(фенилметил)амино]метил]-1 пиперидинкарбоксилата (промежуточный продукт 21).b) Получение промежуточного продукта (22) Смесь промежуточного продукта (21) (0,028 моль) и метанола (100 мл) гидрируют с использованием палладия на углероде (10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают, получая 4,7 г 1,1 -диметилэтил- (3 S-транс)-4(аминометил)-3-гидрокси-1-пиперидинкарбоксилата (промежуточный продукт (22); []20,D= +4,37(с=24,03 мг/5 мл в СН 3 ОН. Пример А.10 а) Получение промежуточного продукта (23)[который описан в WO-00/37461 в качестве промежуточного продукта (I-е)] (0,27 моль) в ТГФ (1300 мл). Смесь перемешивают в течение 30 мин. К полученной смеси добавляют метилйодид (0,54 моль) и полученную реакционную смесь перемешивают в течение 90 мин. Добавляют небольшое количество воды. Раствор выпаривают и остаток распределяют между водой и ДХМ. Органический слой отделяют, сушат,фильтруют и растворитель выпаривают,получая 1,1-диметилэтил транс-4-(4-метилфенил)сульфонил]окси]-метил]-3-метокси-1-пиперидинкарбоксилат (промежуточный продукт 23). b) Получение промежуточного продукта (24) Смесь промежуточного продукта (23) (0,065 моль) и ТГФ (250 мл) обрабатывают жидким NH3 в автоклаве при 125 С в течение 16 ч. Реакционную смесь фильтруют и фильтрат упаривают. Остаток распределяют между 5% водным раствором NaOH и ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают, получая 16 г 1,1-диметилэтил-(транс)-4-(аминометил)-3-метокси-1 пиперидинкарбоксилата (промежуточный продукт (24). Пример А.11 а) Получение промежуточного продукта (25)(200 мл) перемешивают при температуре 10 С. По каплям при 10 С добавляют метаноат натрия (0,11 моль). Реакционную смесь перемешивают в течение 20 ч при комнатной температуре. Растворитель выпаривают. Остаток переносят в воду, затем нейтрализуют уксусной кислотой, затем экстрагируют дважды ДХМ. Отделенный органический слой промывают водой, сушат, фильтруют и растворитель выпаривают. Остаток суспендируют в DIPE, отфильтровывают, промывают и сушат, получая 17,2 г промежуточного продукта (25) (т.пл. 160 С).b) Получение промежуточного продукта (26) Смесь промежуточного продукта (25) (0,058 моль) и уксусной кислоты (12 мл) в метаноле (250 мл) гидрируют при 14 С с использованием палладия на углероде (10%, 1 г) в качестве катализатора. После поглощения водорода (3 эквивалента) катализатор отфильтровывают и фильтрат упаривают. Остаток переносят в смесь лед/вода, затем подщелачивают гидроксидом натрия и высаливают с помощью K2CO3. Эту смесь дважды экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток суспендируют в DIPE, отфильтровывают, промывают и сушат, получая 7,5 г промежуточного продукта (26). Пример А.12 а) Получение промежуточного продукта (27) Смесь 1,1-диметилэтил-(транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилата (описан в качестве промежуточного продукта (I-d) в WO-99/02156) (0,426 моль), бензальдегида (0,5 моль) и палладия на углероде (10%) (5 г) в тиофеновом растворе (5 мл) и метаноле (1000 мл) перемешивают при 70-80 С в течение ночи. Растворитель выпаривают. Остаток распределяют между ДХМ (150 мл) и 5% водным раствором NaOH (150 мл). Смесь разделяют на слои. Водный слой экстрагируют ДХМ. Объединенные органические слои сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 90/10). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из DIPE. Осадок отфильтровывают и сушат, получая 2,35 г 1,1-диметилэтил (транс)-4-бис(фенилэтил)амино]метил]-3-гидрокси-1-пиперидинкарбоксилата (промежуточный продукт 27), т.пл. 133 С).b) Получение промежуточного продукта (28) Смесь промежуточного продукта (27) (0,284 моль) в 2-пропаноле (1000 мл) и 6N HCl в 2-пропаноле(250 мл) кипятят с обратным холодильником при перемешивании в течение 15 мин и затем охлаждают. Раствор выпаривают. Добавляют 5% водный раствор NaOH (750 мл). Смесь трижды экстрагируют ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают, получая 88,95 г (транс)-4 бис(фенилметил)амино]метил]-3-пиперидинола (промежуточный продукт 28). с) Получение промежуточного продукта (29) Смесь промежуточного продукта (28) (0,083 моль) и бутилальдегида (7 г) в метаноле (300 мл) гидрируют с использованием в качестве растворителя палладия на углероде (10%) (2 г) в присутствии тиофенового раствора (3 мл). После поглощения водорода (1 эквивалент) катализатор фильтруют через целит и фильтрат упаривают. Остаток растворяют водной 2N HCl (500 мл). Смесь промывают толуолом и затем делят на слои. Водный слой подщелачивают 50% водным NaOH и затем трижды экстрагируют толуолом. Объединенный органический слой сушат, фильтруют и растворитель выпаривают, получая 29 гd) Получение промежуточного продукта (30)- 13010630 Смесь промежуточного продукта (29) (0,079 моль) и метанола (250 мл) гидрируют с использованием в качестве катализатора палладия на углероде (10%) (2 г). После поглощения водорода (2 эквивалента) катализатор фильтруют через целит и фильтрат упаривают, получая 13,8 г (транс)-4-(аминометил)-16 утил-3-пиперидинола (промежуточный продукт 30). Пример А. 13 а) Получение промежуточного продукта (31) Смесь (транс)-4-(фенилметил)амино]метил]-3-пиперидинола (описанного в качестве промежуточного продукта (6) в WO-00/37461) (0,04 моль), 3-6 ром-1-пропанола (0,04 моль) и Na2CO3 (0,08 моль) в метилизобутилкетоне (400 мл) кипятят с обратным холодильником при перемешивании в течение 18 ч. Растворитель выпаривают. Остаток распределяют между водой и ДХМ. Органический слой отделяют,сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 93/7). Фракции, содержащие продукт, собирают и растворитель выпаривают. К остатку добавляют толуол, затем снова выпаривают, получая 7,2 г промежуточного продукта (31).b) Получение промежуточного продукта (32) Смесь промежуточного продукта (31) (0,026 моль) и метанола (150 мл) гидрируют с использованием палладия на углероде (10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают, получая 4,4 г промежуточного продукта (32). Пример А.14 а) Получение промежуточного продукта (33) Смесь (транс)-4-(фенилметил)амино]метил]-3-пиперидинола (получен в качестве промежуточного продукта (6) в WO-00/37461) (0,05 моль), 2-(2-хлорэтокси)этанола (0,05 моль) и карбоната натрия (0,1 моль) в MIK (500 мл) кипятят с обратным холодильником при перемешивании в течение 20 ч. Добавляют еще одну порцию 2-(2-хлорэтокси)этанола (0,02 моль) и реакционную смесь кипятят с обратным холодильником при перемешивании в течение 20 ч. Раствор выпаривают. Остаток распределяют между водой и ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 93/7). Чистые фракции собирают и растворитель выпаривают. Добавляют толуол и азеотропно отгоняют его на роторном испарителе, получая 8,4 г промежуточного продукта (33).b) Получение промежуточного продукта (34) Смесь промежуточного продукта (33) (0,027 моль) в метаноле (150 мл) гидрируют с использованием палладия на углероде (10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают, получая 5,4 г промежуточного продукта (34). Пример А.15 а) Получение промежуточного продукта (35) Смесь (транс)-4-(фенилметил)амино]метил]-3-пиперидинола (получение в качестве промежуточного продукта (6) описано в WO-00/37461) (0,068 моль), 2-(бромметил)-1,3-диоксолана (0,07 моль) и карбоната натрия (0,28 моль) в MIK (500 мл) кипятят с обратным холодильником при перемешивании в течение 24 ч. Реакционную смесь охлаждают. Раствор выпаривают. Остаток переносят в ДХМ, промывают водой, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на- 14010630 силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 95/5). Чистые фракции собирают и растворитель выпаривают,получая 10,8 г промежуточного продукта (35).b) Получение промежуточного продукта (36) Смесь промежуточного продукта (35) (0,035 моль) в метаноле (250 мл) гидрируют с использованием палладия на углероде (10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают, получая 7,2 г промежуточного продукта (36). Пример А.16 а) Получение промежуточного продукта (37) Смесь (транс)-4-(фенилметил)амино]метил]-3-пиперидинола (получен в качестве промежуточного продукта (6) в WO-00/37461) (0,04 моль), 1-хлор-3-метоксипропана (0,04 моль) и Na2CO3 (0,08 моль) в метилизобутилкетоне (300 мл) кипятят с обратным холодильником при перемешивании в течение 20 ч,затем охлаждают и растворитель выпаривают. Остаток переносят в ДХМ, затем промывают водой, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 97/3). Чистые фракции собирают и растворитель выпаривают, получая 5 г промежуточного продукта (37).b) Получение промежуточного продукта (38) Смесь промежуточного продукта (37) (0,016 моль) и метанола (150 мл) гидрируют с использованием палладия на углероде (10%, 1 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают, получая 3,3 г промежуточного продукта (38). Пример А.17 а) Получение промежуточного продукта (39) 1,1-Диметилэтил-(транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилат (получение в качестве промежуточного продукта (I-е) описано в WO-00/37461) (0,06 моль) в насыщенном растворе HCl в 2-пропаноле (60 мл) и 2-пропаноле (400 мл) кипятят с обратным холодильником при перемешивании в течение 30 мин, затем охлаждают. Раствор выпаривают и совместно выпаривают с толуолом. Остаток сушат, получая 12 г промежуточного продукта (39).b) Получение промежуточного продукта (40) Смесь 4-6 ром-6 утаннитрила (0,06 моль), промежуточного продукта (39) (0,06 моль) и Na2CO3 (0,24 моль) в ACN (600 мл) кипятят с обратным холодильником при перемешивании в течение 20 ч; затем охлаждают и фильтруют. Раствор выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 85/15). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 4,5 г промежуточного продукта (40). Пример А.18 а) Получение промежуточного продукта (41)- 15010630 Промежуточный продукт (28) (0,0387 моль) растворяют в 2-метилпропаноле (200 мл). В полученный раствор добавляют тетрагидрофурфурилметансульфонат (0,05 моль) и Na2CO3 (0,0774 моль). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 24 ч; затем охлаждают. Осадок отфильтровывают. Раствор выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 97/3). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 11,1 г промежуточного продукта (41).b) Получение промежуточного продукта (42) Промежуточный продукт (41) (0,0279 моль) в метаноле (150 мл) гидрируют с использованием палладия на углероде (10%, 2 г) в качестве катализатора. После поглощения водорода (2 эквивалента) катализатор отфильтровывают через dicalite и растворитель выпаривают, получая 5,74 г промежуточного продукта (42). Пример А.19 а) Получение промежуточного продукта (43)Na2CO3 (10%, 0,08 моль) в MIK (400 мл) кипятят с обратным холодильником при перемешивании в течение 20 ч и затем охлаждают. Раствор выпаривают. Остаток переносят в смесь ДХМ и воды. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 96/4). Чистые фракции собирают и растворитель выпаривают. Добавляют толуол, который снова выпаривают, получая 6 г (транс)-1-[2-(1,3 диоксолан-2-ил)этил]-4-(фенилметил)амино]метил]-3-пиперидинола (промежуточный продукт 43).b) Получение промежуточного продукта (44) Промежуточный продукт (43) (0,019 моль) в метаноле (150 мл) гидрируют с использованием палладия на углероде (10%, 2 г) в качестве катализатора. После поглощения 1 эквивалента водорода катализатор отфильтровывают и фильтрат упаривают, получая 4 г (транс)-4-(аминометил)-1-[2-(1,3-диоксолан-2 ил)этил]-3-пиперидинола (промежуточный продукт 44). Пример А.20 Получение промежуточного продукта (45) Смесь 2,3-дигидро-8-метокси-1,4-6 ензодиоксин-5-карбоновой кислоты (0,05 моль) и 1,1'карбонилдиимидазола (0,052 моль) в ДХМ (150 мл) перемешивают при комнатной температуре в течение 30 мин, получая смесь (I). Указанную смесь (I) добавляют к смеси 1,1-диметилэтил-(3S-транс)-4(аминометил)-3-гидрокси-1-пиперидинкарбоксилата альфа-гидроксибензолацетата (1:1) (0,052 моль) в ДХМ (100 мл) при комнатной температуре. Смесь перемешивают в течение 48 ч и промывают водой. Органический слой сушат, фильтруют и растворитель выпаривают, получая 22 г промежуточного продукта (45). Пример А. 21 а) Получение промежуточного продукта (62) Смесь 4-феноксибутилхлорида (0,135 моль) и ДХМ (50 мл) охлаждают при перемешивании до 0 С. По каплям в течение 45 мин добавляют хлорсерную кислоту (chlorosulfuric acid) (0,149 моль). Ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем по каплям добавляют этандиоилдихлорид (0,176 моль) и затем ДМФА (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 20 ч. Затем смесь выливают в лед, экстрагируют ДХМ,сушат и растворитель выпаривают, получая промежуточный продукт (62).b) Получение промежуточного продукта (63) Раствор промежуточного продукта (62) (0,135 моль) в ТГФ (500 мл) при перемешивании охлаждают до 0 С, затем через раствор барботируют аммиак (газ). Реакционную смесь фильтруют и растворитель выпаривают. К остатку добавляют ДХМ (600 мл) и смесь промывают HCl (600 мл, 1N). Водный слой отделяют и экстрагируют ДХМ (2300 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат и растворитель выпаривают. Остаток кристаллизуют из CH3OH/DIPE, отфильтровывают и сушат, получая 18,5 г промежуточного продукта (63). Аналогично, но исходя из 4-феноксипропилхлорида или 4-феноксиэтилхлорида, получают промежуточные продукты (64) и (65).- 18010630 Пример А.22 Получение промежуточного продукта (66) 4-Метокси-1-6 утанол (0,9 моль) смешивают с ДХМ (1500 мл), добавляют триэтиламин (1,35 моль),затем по каплям добавляют метилсульфонилхлорид (1,1 моль) (температура возрастает до 40 С) и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Смесь промывают водой. Органический слой отделяют, сушат, растворитель выпаривают и затем совместно выпаривают с толуолом,получая 167 г промежуточного продукта (66). Для получения конечных соединений используют также известные промежуточные продукты, такие как,например,3-цианопропилбромид,тетрагидрофурфурилметансульфонат,3 гидроксипропилбромид, 2-метоксиэтилбромид, 3-метоксипропилхлорид, (транс)-4-(аминометил)-1-[2(1,3-диоксолан-2-ил)этил]-3-пиперидинол (описан в качестве промежуточного продукта 8 в WO00/37461), 1-хлор-3-(I-метилэтокси)пропан, 2-(3-хлорпропил)-2-метил-1,3-диоксолан, 2-(2-6 ромэтил)-1,3 диоксолан,метил 4-6 ромбутаноат,2-хлор-ацетонитрил,2-(2-хлорэтокси)этанол,N-(2 хлорэтил)метансульфонамид и N-[3-[(метилсульфонил)окси]пропил]метансульфонамид, 1-(2-хлорэтил)1,3-дигидро-3-(1-метилэтил)-2 Н-имидазол-2-он, этиловый эфир (3-хлорпропил)карбаминовой кислоты. В. Получение конечных соединений Пример В.1 Раствор промежуточного продукта (45) (0,05 моль) в смеси HCl/2-пропанол (6N) (0,24 моль) и 2 пропанола (300 мл) кипятят с обратным холодильником при перемешивании в течение 1 ч. Реакционную смесь охлаждают и растворитель выпаривают. Остаток переносят в ДХМ и промывают 5% водным раствором NaOH. Органический слой сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 93/7). Фракции продукта собирают и растворитель выпаривают. Остаток кристаллизуют из DIPE, получая 7,5 г соединения (117) (т.пл. 160 С). Пример В.2 Смесь соединения (157) (0,0156 моль), 1-хлор-3-метоксипропана (0,0234 моль) и карбоната калия(0,0312 моль) в ацетонитриле (85 мл) кипятят с обратным холодильником при перемешивании в течение 15 ч, затем охлаждают до комнатной температуры, выливают в воду и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 94/6/0,1). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из смеси изопропилового эфира и 2 пропанона. Осадок отфильтровывают и сушат, получая 2,29 г соединения (2) (т.пл. 109 С). Пример В.3 Смесь соединения (8) (0,01 моль) и бутаналя в метаноле (150 мл) гидрируют с использованием платины на углероде (5%, 1 г) в качестве катализатора в присутствии тиофенового раствора (1 мл). После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток распределяют между водой и ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток кристаллизуют из DIPE. Осадок отфильтровывают и сушат, получая 2,94 г соединения(7) (т. пл. 127 С). Пример В.4 а) Получение промежуточного продукта (67)(0,0244 моль),1,1-диметилзтилового эфира метил-(4 оксобутил)карбаминовой кислоты (0,0244 моль), палладия на углероде (10%, 1,86 г) в тиофеновом растворе (1,86 мл), метанола (186 мл) и ТГФ (10 мл) гидрируют в течение 45 мин водородом с давлением 2 бара (0,2 МПа), затем фильтруют через целит. Фильтрат упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,1 - 95/5/0,5). Чистые фракции собирают и растворитель выпаривают, получая 4,8 г промежуточного продукта (67).b) Смесь раствора промежуточного продукта (67) (0,0095 моль) в 2-пропаноле (85 мл) и HCl (5-6N,10,3 мл) перемешивают при 50 С в течение 2 ч, затем охлаждают до комнатной температуры и растворитель выпаривают. Остаток переносят в воду, подщелачивают карбонатом калия и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют, растворитель выпаривают досуха и остаток превращают в соль этандионовой кислоты, получая соединение (4) (т.пл. 120 С). Пример В.5 Смесь промежуточного продукта (15) (0,01 моль) и ДХМ (80 мл) перемешивают при 0 С. Добавля- 19010630 ют триэтиламин (0,01 моль), поддерживая температуру на уровне 0 С. К полученной смесь по каплям добавляют этилхлоркарбонат (0,01 моль) при 0 С. Смесь перемешивают при 0 С в течение 30 мин. Добавляют смесь промежуточного продукта (30) (0,01 моль) и ДХМ (20 мл) при 0 С. Смесь нагревают до комнатной температуры и затем перемешивают при комнатной температуре в течение 30 мин. Смесь промывают водой, 5% водным раствором NaOH и снова водой. Органический слой отделяют, сушат,фильтруют и растворитель выпаривают. Остаток обрабатывают DIPE, получая твердый осадок. Осадок отфильтровывают, промывают и сушат, получая 2,95 г соединения (16) (т. пл. 115 С). Пример В.6 К раствору соединения (157) (0,0134 моль) и бутаналя (0,02 моль) в метаноле (80 мл) в потоке азота при комнатной температуре добавляют цианоборогидрид натрия (0,02 моль). Смесь перемешивают в течение 1 ч. Добавляют воду. Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат,фильтруют и растворитель выпаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,3). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат, получая 1,59 г соединения (1) (т.пл. 127 С). Пример В.7 а) Получение промежуточного продукта (68) Соединение (148) (0,013 моль) в CH3OH/NH3 (300 мл) гидрируют с использованием никеля Ренея (1 г) в качестве катализатора. После поглощения Н 2 (2 экв.) катализатор отфильтровывают и фильтрат упаривают, получая 5,1 г (100%) промежуточного продукта (68).b) К раствору промежуточного продукта (68) (0,013 моль) и триэтиламина (0,026 моль) в ДХМ (120 мл) при комнатной температуре по каплям добавляют метансульфонилхлорид (1,16 мл). Спустя 3 ч добавляют метансульфонилхлорид (0,4 мл) и смесь перемешивают в течение ночи. Смесь промывают водой, органический слой сушат, фильтруют и растворитель выпаривают. Остаток очищают флэшхроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 99/1, 98/2, 97/3). Фракции, содержащие продукт, собирают и растворитель выпаривают. Остаток кристаллизуют из DIPE/CH3CN, отфильтровывают, промывают и сушат, получая 1,9 г соединения (107) (т.пл. 124 С). Пример В.8 Этилхлоркарбонат (0,005 моль, 0 С) по каплям добавляют к смеси соединения (149) (0,0047 моль) и триэтиламина (0,01 моль) в ДХМ (50 мл) при температуре 0 С. Реакционную смесь перемешивают при 0 С в течение 1 ч и растворитель выпаривают. Остаток переносят в ТГФ. Осадок отфильтровывают и фильтрат перемешивают при 5 С. К полученному раствору добавляют ТГФ/NH3 (100 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч и растворитель выпаривают. Остаток переносят в ДХМ и промывают водой. Органический слой сушат, отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NH3) 93/7). Фракции продукта собирают и растворитель выпаривают. Остаток кристаллизуют из DIPE, отфильтровывают, промывают и сушат, получая 0,36 г соединения (109) (т.пл. 160 С). Пример В.9 Смесь соединения (150) (0,0122 моль) и гидроксида калия (0,0331 моль) в этаноле (180 мл) кипятят с обратным холодильником при перемешивании в течение 4 дней, затем охлаждают до комнатной температуры. Раствор выпаривают. Остаток переносят в воду и этилацетат. Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH от 89/11/1 до 85/15/1), получая 0,832 г соединения (128). Пример В.10 а) Получение промежуточного продукта (69) Смесь соединения (150) (0,006 моль) и никеля Ренея (2,4 г) в NH4OH/CH3OH (50 мл) гидрируют при комнатной температуре в течение 5 ч водородом с давлением 3 бара (0,3 МПа), затем фильтруют через целит. Фильтрат упаривают досуха, получая 2,5 г промежуточного продукта (69).b) Смесь промежуточного продукта (69) (0,0061 моль) и 2-хлор-3-метилпиразина (0,0073 моль) перемешивают при 100 С в течение ночи, затем охлаждают до комнатной температуры и очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 90/10/1). Чистые фракции собирают и растворитель выпаривают. Остаток сушат, получая 0,463 г соединения (130).- 20010630 Пример В.11 Смесь соединения (151) (0,0027 моль), серной кислоты (20 мл) и воды (2 мл) перемешивают при 0 С, затем при комнатной температуре в течение 24 ч. Реакционную смесь выливают в лед и добавляют к водному раствору NH3 при 0 С. Смесь экстрагируют ДХМ, сушат и растворитель выпаривают. Остаток кристаллизуют из ACN, отфильтровывают и сушат, получая 0,394 г соединения (140) (т.пл. 180 С). Пример В.12 Гидроксид калия (0,0082 моль) растворяют в этаноле (40 мл), добавляют соединение (158) (0,00306 моль) и реакционную смесь кипятят с обратным холодильником при перемешивании в течение 5 дней. Растворитель выпаривают, остаток распределяют между ДХМ и 2% водным раствором NaOH и экстрагируют ДХМ (4 раза). Органический слой сушат и растворитель выпаривают. Остаток очищают колоночной флэш-хроматографией (Biotage) на силикагеле (элюент 1: чистыйCH2Cl2, элюент 2: CH2Cl2/(CH3OH/NH3) от 97/3 до 90/10). Собирают две фракции продукта и растворитель выпаривают, получая 0,41 г соединения (145) (т. пл. 131 С) и 0,13 г соединения (146) (т.пл. 154 С). Пример В.13 а) Получение промежуточного продукта (70) Смесь соединения (152) (0,036 моль), метилового эфира 4-бромбутановой кислоты (0,047 моль),триэтиламина (0,09 моль) в ДМФА (200 мл) перемешивают при 75 С в течение 16 ч. Реакционную смесь охлаждают, выливают в воду и экстрагируют толуолом. Органический слой сушат, отфильтровывают и растворитель выпаривают. Остаток очищают на селикагеле на стеклянном фильтре (элюент:CH2Cl2/(CH3OH/NH3) 97/3). Фракции продукта собирают и растворитель выпаривают, получая 12,4 г промежуточного продукта (70).b) Смесь промежуточного продукта (70) (0,0295 моль) и воды (50 мл) перемешивают при 95 С в течение двух дней. Реакционную смесь охлаждают и растворитель выпаривают, получая 8,5 г соединения- 21010630 Таблица F-1. Соединения, полученные в соответствии с методикой одного из приведенных выше примеров.
МПК / Метки
МПК: C07D 405/14, A61K 31/445, C07D 405/12
Метки: обладающие, активностью, 4-(аминометил, 5нт4-антагонистической, пиперидинбензамиды
Код ссылки
<a href="https://eas.patents.su/30-10630-4-aminometil-piperidinbenzamidy-obladayushhie-5nt4-antagonisticheskojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">4-(аминометил) пиперидинбензамиды, обладающие 5нт4-антагонистической активностью</a>












