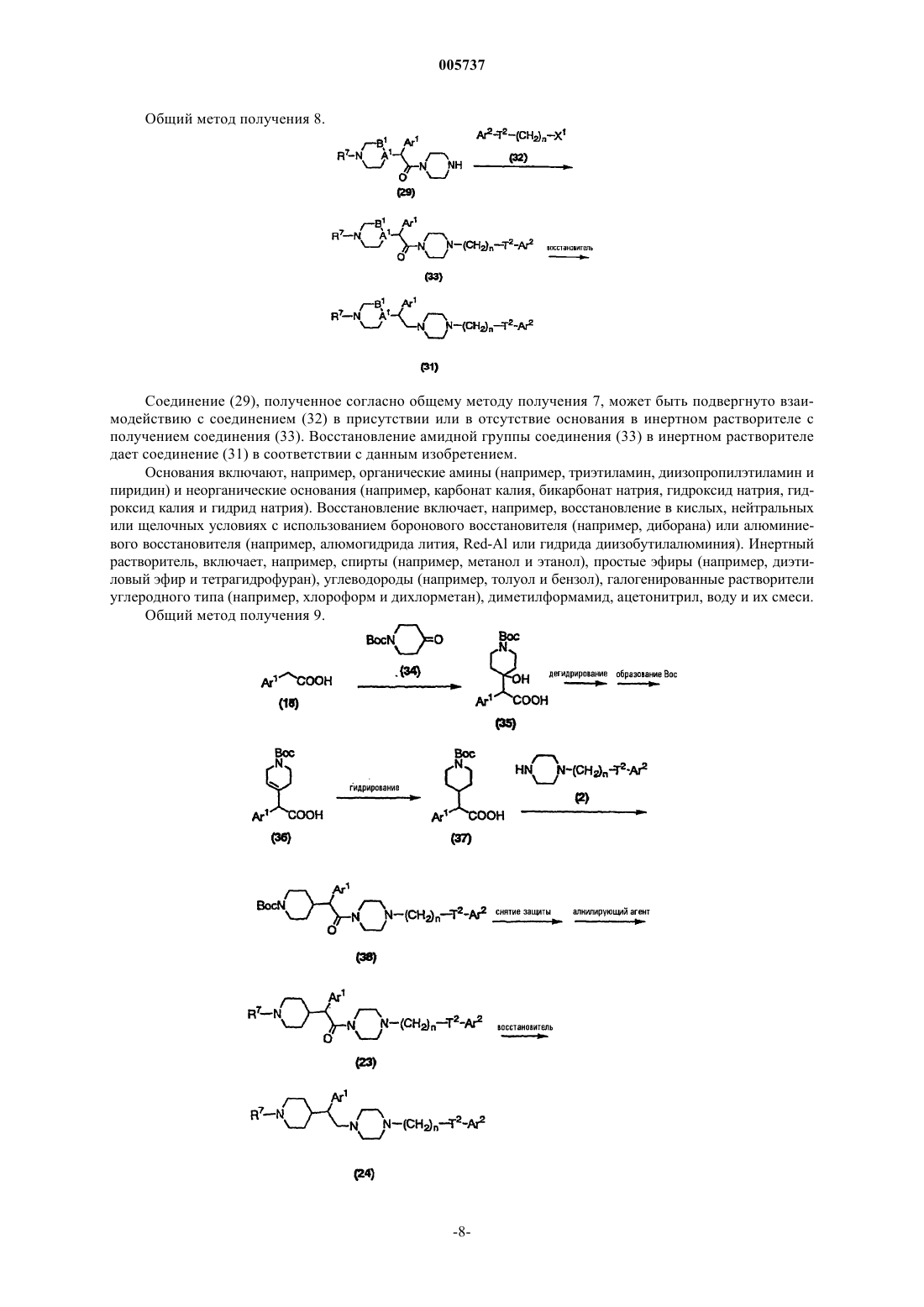
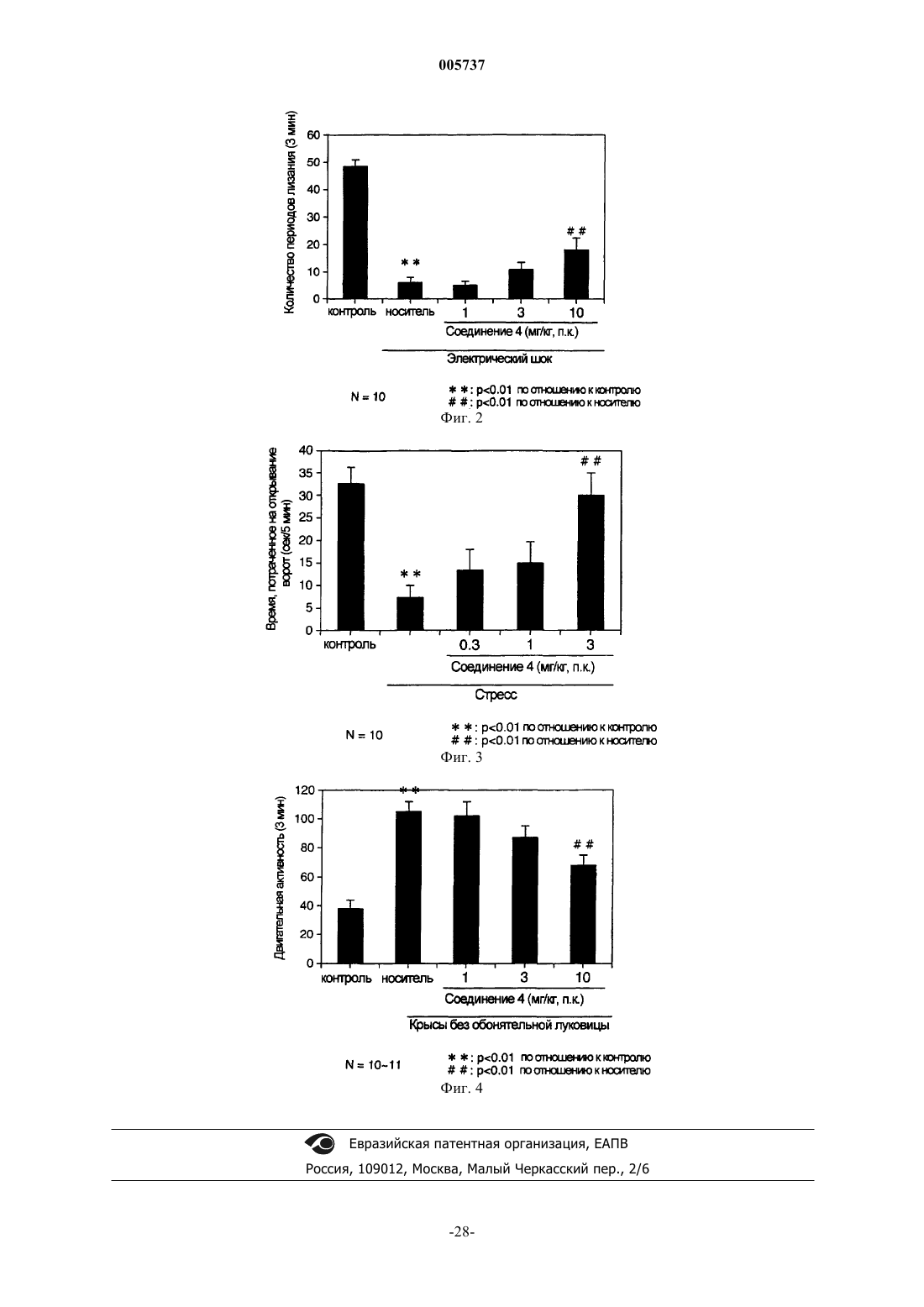
Терапевтический препарат для лечения невроза страха (тревоги) или депрессии
Номер патента: 5737
Опубликовано: 30.06.2005
Авторы: Огава Синити, Наказато Ацуро, Таки Сигейуки, Исии Такааки, Окубо Такетоси
Формула / Реферат
1. Терапевтический препарат для лечения невроза страха (тревоги) или депрессии, который содержит антагонист рецептора MK4 в качестве эффективного ингредиента.
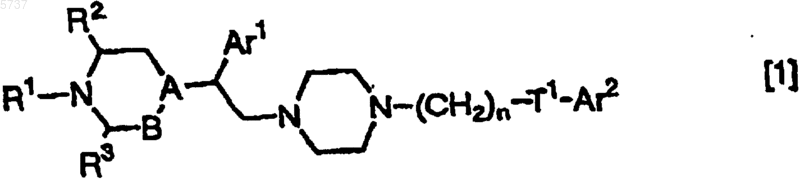
2. Терапевтический препарат для лечения невроза страха или депрессии по п.1, в котором антагонистом рецептора MK4 является производное пиперазина, представленное формулой [1]
[где Ar1 является фенильной группой, замещенной фенильной группой, нафтильной группой или замещенной нафтильной группой; Ar2 является нафтильной группой, замещенной нафтильной группой, хинолильной группой, группой, представленной формулой
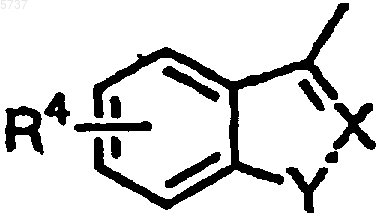
(где R4 является атомом водорода или атомом галогена и X-Y является CH-NH, CH-O, CH-S или N-O) или группой, представленной формулой
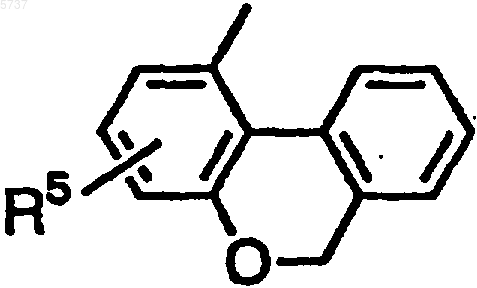
(где R5 является атомом водорода, гидроксильной группой или C1-10 алкоксигруппой); R1 является атомом водорода, C1-10 алкильной группой, C3-8 циклоалкильной группой, C3-10 алкенильной группой, фенильной группой, 1-цианоэтильной группой, пиримидин-2-ильной группой или амидильной группой; R2 и R3 являются одинаковыми или разными и каждый является атомом водорода или C1-10 алкильной группой; A-B является N-CH2, CH-CH2, C(OH)-CH2 или C=CH; T1 является одинарной связью, -N(R6)- (где R6 является атомом водорода или C1-10 алкильной группой), -O-, -CH=CH- или -C(=O)-; n является целым числом от 1 до 10, если T1 является одинарной связью, -CH=CH- или -C(=O)-, и n является целым числом от 2 до 10, если T1 является -N(R6)- или -O-], или его фармацевтически приемлемая соль.
3. Терапевтический препарат для лечения невроза страха или депрессии по п.2, в котором в формуле [1] Ar1 является фенильной группой или замещенной фенильной группой; Ar2 является нафтильной группой или замещенной нафтильной группой.
4. Терапевтический препарат для лечения невроза страха или депрессии по п.2, в котором в формуле [1] Ar1 является фенильной группой или замещенной фенильной группой; Ar2 является нафтильной группой или замещенной нафтильной группой; R1 является атомом водорода, C1-10 алкильной группой или C3-8 циклоалкильной группой; R2 и R3 каждый является атомом водорода; A-B является N-CH2 или CH-CH2; T1 является одинарной связью.
5. Терапевтический препарат для лечения невроза страха или депрессии по любому из пп.2-4, в котором замещенная фенильная группа является фенильной группой, которая замещена от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, бензилоксигруппу, гидроксильную группу, атом галогена, нитрогруппу, аминогруппу, аминогруппу, замещенную одной или двумя C1-6 алкильными группами, трифторметильную группу, цианогруппу, карбамоильную группу и фенильную группу; и замещенная нафтильная группа является нафтильной группой, замещенной от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, гидроксильную группу, C1-5 алкоксикарбонилметоксигруппу, карбамоилметоксигруппу, атом галогена, аминогруппу и аминогруппу, замещенную одной или двумя C1-6 алкильными группами.
6. Терапевтический препарат для лечения невроза страха или депрессии по п.2, в котором в формуле [1] Ar1 является фенильной группой или замещенной фенильной группой; Ar2 является группой, представленной формулой
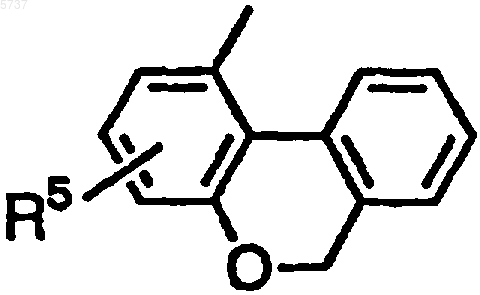
(где R5 является атомом водорода, гидроксильной группой или C1-10 алкоксигруппой); R1 является атомом водорода, C1-10 алкильной группой или C3-8 циклоалкильной группой; R2 и R3 каждый является атомом водорода; A-B является N-CH2 или CH-CH2; и T1 является одинарной связью.
7. Терапевтический препарат для лечения невроза страха или депрессии по п.6, в котором замещенная фенильная группа является фенильной группой, которая замещена от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, бензилоксигруппу, гидроксильную группу, атом галогена, нитрогруппу, аминогруппу, аминогруппу, замещенную одной или двумя C1-6 алкильными группами, трифторметильную группу, цианогруппу, карбамоильную группу и фенильную группу.
Текст
005737 Уровень техники Данное изобретение относится к терапевтическому препарату для лечения невроза страха (тревоги) или депрессии, который содержит антагонист рецептора МК 4 в качестве эффективного ингредиента. Последние данные, полученные в области патофизиологии, позволяют предположить, что стресс играет значительную роль в развитии механизма невроза страха и депрессии. Среди интрацеребральных реакций, вызываемых стрессом, можно назвать функциональные нарушения нейроэндокринной системы, показательными для которой являются функциональные нарушения системы гипоталамус-гипофиз-надпочечник. Среди причин развития тревоги/депрессии, описанных в известном уровне техники, особое внимание привлекают нейропептиды, которые расположены в гипофизе и влияют на нейроэндокринную систему. Среди таких нейропептидов можно выделить кортикотропин рилизинг-факторы (КРФ, фактор высвобождения кортикотропина) и проопиомеланокортин (ПОМК). Известно, что КРФ играет центральную роль в стрессовых реакциях, таких как чувствительность системы гипоталамус-гипофиз-надпочечник, и,как полагают, имеет отношение к тревоге/депрессии. Меланокортины [адренокортикотропный гормон(АКТГ), меланоцитстимулирующий гормон (МСГ)], продуцируемые из ПОМК, являются основными нейропептидами в гипоталамусе, однако, нет никаких данных, касающихся веществ, действующих на рецепторы меланокортина, связанные со стрессовой реакцией и депрессией/неврозом страха. Рецепторы меланокортина классифицируют на 5 подтипов MК 1-MК 5. Среди указанных подтипов рецептор меланокортина подтипа МК 4 известен как пептидэргический селективный агонист или антагонист, но нет никаких данных относительно действия указанных агонистов или антагонистов на стрессовую реакцию или состояние тревоги. Соединение 4 в соответствии с данным изобретением, представленное в табл. 1, действует как высокоселективный антагонист по отношению к рекомбинантным рецепторам меланокортина человека. Были проведены исследования взаимоотношений подтипов рецептора меланокортина и тревоги/депрессии и стрессовой реакции, а также новых производных пиперазина. Описание изобретения В результате обширных исследований указанного выше объекта было обнаружено, что агонисты МК 4 рецептора обладают действием, вызывающим состояние тревоги, и что антагонисты рецептора МК 4 являются эффективными для лечения невроза страха и депрессии благодаря их действию против стресса,тревоги и депрессии. Более того, было обнаружено, что новые производные пиперазина являются антагонистами рецептора МК 4, и, таким образом, было создано данное изобретение. Данное изобретение заключается в следующем и включает 1. терапевтический препарат для лечения невроза страха или депрессии, который содержит антагонист рецептора МК 4 в качестве эффективного ингредиента; 2. терапевтический препарат для лечения невроза страха или депрессии, в котором антагонистом рецептора МК 4 является производное пиперазина, представленное формулой [1][где Аr1 является фенильной группой, замещенной фенильной группой, нафтильной группой или замещенной нафтильной группой; Аr2 является нафтильной группой, замещенной нафтильной группой, хинолильной группой, группой, представленной формулой(где R4 является атомом водорода или атомом галогена, и X-Y является CH-NH, СН-O, CH-S или N-O) или группой, представленной формулой(где R5 является атомом водорода, гидроксильной группой или C1-10 алкоксигруппой); R1 является атомом водорода, C1-10 алкильной группой, С 3-8 циклоалкильной группой, С 3-10 алкенильной группой, фенильной группой, 1-цианоэтильной группой, пиримидин-2-ильной группой или амидильной группой; R2 и R3 являются одинаковыми или разными и каждый является атомом водорода или C1-10 алкильной группой; А-В является N-CH2, СН-СН 2, С(ОН)-СН 2 или С=СН; Т 1 является одинарной связью, -N(R6)- (где R6 является атомом водорода или C1-10 алкильной группой), -О-, -СН=СН- или -С(=O)-; n является целым числом от 1 до 10, если Т 1 является одинарной связью, -СН=СН- или -С(=O)-, и n является целым числом от 2 до 10, если Т 1 является -N(R6)- или -О-], или его фармацевтически приемлемая соль. В данном изобретении антагонист, который используют по отношению к рецептору МК 4, означает соединение, которое обладает антагонистическим действием по отношению к рецептору МК 4, и предпочтительно означает соединение, обладающее зависимым от концентрации ингибирующим действием при-1 005737 тестировании на связывание рецептора с использованием клеток, вырабатывающих рецептор МК 4, согласно методу, описанному в J. Biol. Chem., 268; 15174-15179, 1993, и имеющее эквивалентное или более высокое сродство к рецептору МК 4 по сравнению с -МСГ, и являющееся антагонистом действия -МСГ,когда количество сАМФ, стимулированного -МСГ, измеряют с помощью набора для измерения сАМФ. Термины, используемые в данном изобретении, определены следующим образом. В данном изобретении Сх-у означает, что обозначенная группа содержит атомы углерода в количестве от х до y."Замещенная фенильная группа" относится к фенильной группе, которая замещена от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, С 3-8 циклоалкильную группу, С 3-8 циклоалкил C1-5 алкильную группу, C1-10 алкоксигруппу, С 3-8 циклоалкоксигруппу, С 3-8 циклоалкил C1-5 алкоксигруппу, бензилоксигруппу, гидроксильную группу, атом галогена, нитрогруппу,группу формулы NR11(R22) (где R11 и R22 являются одинаковыми или разными, и каждый является атомом водорода или C1-6 алкильной группой, или R11 и R22 вместе с атомом азота, к которому они присоединены, образуют 5-8-членный циклический амин), трифторметильную группу, цианогруппу, карбамоильную группу и фенильную группу, и, предпочтительно, к фенильной группе, которая замещена от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, бензоилоксигруппу, гидроксильную группу, атом галогена, нитрогруппу, аминогруппу, аминогруппу,замещенную одной или двумя C1-6 алкильными группами, трифторметильную группу, цианогруппу, карбамоильную группу и фенильную группу; примерами которой являются 2-метилфенильная группа, 3 метилфенильная группа, 4-метилфенильная группа, 2-этилфенильная группа, 3-этилфенильная группа, 4 этилфенильная группа, 2-пропилфенильная группа, 3-пропилфенильная группа, 4-пропилфенильная группа, 2-циклопентилфенильная группа, 2-метоксифенильная группа, 3-метоксифенильная группа, 4 метоксифенильная группа, 4-этоксифенильная группа, 4-изопропоксифенильная группа, 4-бензилоксифенильная группа, 4-гидроксифенильная группа, 2-фторфенильная группа, 3-фторфенильная группа, 4 фторфенильная группа, 2-хлорфенильная группа, 3-хлорфенильная группа, 4-хлорфенильная группа, 2 бромфенильная группа, 3-бромфенильная группа, 4-бромфенильная группа, 4-нитрофенильная группа, 4 аминофенильная группа, 4-трифторметилфенильная группа, 3-цианофенильная группа, 4-цианофенильная группа, 3-карбамоилфенильная группа, 4-карбамоилфенильная группа и 4-бифенильная группа."Замещенная нафтильная группа" относится к нафтильной группе, замещенной от 1 до 3 заместителями,произвольно выбранными из группы, включающей C1-10 алкильную группу, С 3-8 циклоалкильную группу,С 3-8 циклоалкил C1-5 алкильную группу, C1-10 алкоксигруппу, С 3-8 циклоалкоксигруппу, С 3-8 циклоалкил C1-5 алкоксигруппу, бензилоксигруппу, гидроксильную группу, C1-5 алкоксикарбонилметоксигруппу, карбамоилметоксигруппу, атом галогена, нитрогруппу, группу формулы NR33(R44) (где R33 и R44 являются одинаковыми или разными, и каждый является атомом водорода или C1-6 алкильной группой, или R33 и R44, вместе с атомом азота, к которому они присоединены, образуют 5-8-членный циклический амин) и трифторметильную группу; и, предпочтительно, к нафтильной группе, замещенной от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, гидроксильную группу, C1-5 алкоксикарбонилметоксигруппу, карбамоилметоксигруппу, атом галогена, аминогруппу и аминогруппу, замещенную одной или двумя C1-6 алкильными группами; примерами которой являются 2-метилнафталин-1-ильная группа, 3-метилнафталин-1-ильная группа, 4-метилнафталин-1-ильная группа, 2-этилнафталин-1-ильная группа, 3-этилнафталин-1-ильная группа, 4-этилнафталин-1-ильная группа,2-пропилнафталин-1-ильная группа, 3-пропилнафталин-1-ильная группа, 4-пропилнафталин-1-ильная группа, 2-метоксинафталин-1-ильная группа, 3-метоксинафталин-1-ильная группа, 4-метоксинафталин-1 ильная группа, 6-метоксинафталин-1-ильная группа, 4-этоксинафталин-1-ильная группа, 4-изопропоксинафталин-1-ильная группа, 4-бензилоксинафталин-1-ильная группа, 2-гидроксинафталин-1-ильная группа,4-гидроксинафталин-1-ильная группа, 2-метоксикарбонилметоксинафталин-1-ильная группа, 2-карбамоилметоксинафталин-1-ильная группа, 2-фторнафталин-1-ильная группа, 3-фторнафталин-1-ильная группа,4-фторнафталин-1-ильная группа, 2-хлорнафталин-1-ильная группа, 3-хлорнафталин-1-ильная группа, 4 хлорнафталин-1-ильная группа, 2-бромнафталин-1-ильная группа, 3-бромнафталин-1-ильная группа, 4 бромнафталин-1-ильная группа, 4-нитронафталин-1-ильная группа, 4-аминонафталин-1-ильная группа, 4 трифторметилнафталин-1-ильная группа и 4-диметиламинонафталин-1-ильная группа."C1-10 алкильная группа" относится к прямой или разветвленной алкильной группе, имеющей от 1 до 10 атомов углерода, примеры которой включают метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, пентильную группу, изопентильную группу, 1-этилпропильную группу, гексильную группу, изогексильную группу, 1-этилбутильную группу, гептильную группу, изогептильную группу, октильную группу, нонильную группу и децильную группу. С 3-8 циклоалкильная группа относится к циклоалкильной группе, содержащей от 3 до 8 атомов углерода, примеры которой включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу. С 3-8 циклоалкил C1-5 алкильная группа относится к C1-5 алкильной группе, замещенной циклоалкильной группой, содержащей от 3 до 8 атомов углерода, примеры которой включают циклопропилметильную группу, циклобутилметильную группу, циклопентилметильную группу и циклогексилметильную группу."С 3-10 алкенильная группа" относится к прямой или разветвленной алкенильной группе, содержащей от 3 до 10 атомов углерода, примерами которой являются аллильная группа, 1-бутен-4-ильная группа, 2-бутен-4-ильная группа, 1-пентен-5-ильная группа, 2-пентен-5-ильная группа и пренильная группа."C1-10 алкоксигруппа" относится к прямой или разветвленной алкоксигруппе, содержащей от 1 до 10 атомов углерода; примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу,бутоксигруппу, изобутоксигруппу, пентилоксигруппу, изопентилоксигруппу, гексилоксигруппу, гептилоксигруппу, октилоксигруппу, нонилоксигруппу и децилоксигруппу. С 3-8 циклоалкоксигруппа относится к циклоалкоксигруппе, содержащей от 3 до 8 атомов углерода; ее примеры включают циклопропоксигруппу,циклопентилоксигруппу и циклооктилоксигруппу. С 3-8 циклоалкил C1-5 алкоксигруппа относится к C1-5 алкоксигруппе, замещенной циклоалкильной группой, содержащей от 3 до 8 атомов углерода; ее примеры включают циклопропилметоксигруппу, циклопентилметоксигруппу и циклогексилэтоксигруппу."Аминогруппа, замещенная одной или двумя C1-6 алкильными группами" относится к аминогруппе,замещенной 1 или 2 прямыми или разветвленными алкильными группами, содержащими от 1 до 6 атомов углерода; ее примеры включают метиламиногруппу, этиламиногруппу, пропиламиногруппу, диметиламиногруппу, диэтиламиногруппу и дипропиламиногруппу. Примеры аминогруппы, представленной формулой NR11(R22), включают метиламиногруппу, этиламиногруппу, пропиламиногруппу, диметиламиногруппу, диэтиламиногруппу и дипропиламиногруппу. Далее, примеры циклической аминогруппы, представленной формулой NR11(R22), включают пирролидиногруппу, пиперидиногруппу, пиперазиногруппу, морфолиногруппу и тиоморфолиногруппу. Примеры аминогруппы, представленной формулой NR33(R44), включают метиламиногруппу, этиламиногруппу, пропиламиногруппу, диметиламиногруппу, диэтиламиногруппу и дипропиламиногруппу. Далее, примеры циклической аминогруппы, представленной формулой NR33(R44), включают пирролидиногруппу, пиперидиногруппу, пиперазиногруппу, морфолиногруппу и тиоморфолиногруппу. Атомом галогена является атом фтора, атом хлора, атом брома или атом йода. Примерами фармацевтически приемлемой соли в соответствии с данным изобретением являются соли с минеральными кислотами, такими как серная кислота, хлористо-водородная кислота или фосфорная кислота, или соли с органическими кислотами, такими как уксусная кислота, щавелевая кислота, молочная кислота, винная кислота, фумаровая кислота, малеиновая кислота, метансульфокислота или бензолсульфокислота. Соединения формулы [1] могут быть получены представленными ниже общими методами получения 1-17 (в представленных ниже схемах реакций Ar1, Ar2, R6, Т 1 и n такие, как определены выше; Х 1 является атомом хлора, атомом брома или атомом йода; А 1-В 1 является СН-СН 2, С(ОН)-СН 2 или С=СН; Т 2 является одинарной связью, -N(R6)- или -О-; R7 является C1-10 алкильной группой; R8 является С 1-10 алкильной группой, С 3-10 алкенильной группой, фенильной группой или пиримидин-2-ильной группой; и R9 является обычной аминозащитной группой, такой как трет-бутоксикарбонильная группа, этоксикарбонильная группа или бензилоксикарбонильная группа; R10 является C1-10 алкильной группой, 1 цианоэтильной группой или амидиногруппой; R11 является группой, определенной для R9, отличной от трет-бутоксикарбонильной группы; Воc-группа является трет-бутоксикарбонильной группой; Вn является бензильной группой, иозначает оптически активную форму). Общий метод получения 1.-3 005737 Соединение (1) может быть подвергнуто взаимодействию с соединением (2) в присутствии или в отсутствие основания в инертном растворителе с превращением в соединение (3), с последующим восстановлением карбонильной группы в инертном растворителе с получением соединения (4). Соединение(4) может быть подвергнуто взаимодействию с галогенирующим агентом или сульфонилирующим агентом, таким как алкилсульфонилгалогенид или арилсульфонилгалогенид, в присутствии или в отсутствие основания в инертном растворителе, таким образом, превращая гидроксильную группу в подходящую уходящую группу. Затем соединение (5) может реагировать в присутствии или в отсутствие основания в инертном растворителе с получением соединения (6) в соответствии с данным изобретением. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия и гидрид натрия). Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например,боргидрида натрия, цианборгидрида натрия, боргидрида лития, L-cелектрида и K-cелектрида) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Аl или гидрида диизобутилалюминия). Галогенирующие агенты включают обычные галогенирующие агенты гидроксильной группы (например,тионилхлорид, тионилбромид или фосфорилхлорид). Сульфирующие агенты, такие как алкилсульфонилгалогенид или арилсульфонилгалогенид, включают, например, обычные спиртовые сульфирующие агенты (например, метансульфонилхлорид, бензолсульфонилхлорид, толуолсульфонилхлорид или трифторметансульфонилхлорид). Инертный растворитель включает, например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 2. Используя методику, аналогичную получению соединения (6) из соединения (1) общего метода получения 1, получают соединение (9) из соединения (1). Затем с аминогруппы соединения (9) снимают защиту с получением соединения (10), которое затем может быть сконденсировано с соединением (11) в инертном растворителе с получением соединения (12). Амидная группа соединения (12) может быть восстановлена в инертном растворителе с получением соединения (6) в соответствии с данным изобретением. Снятие защиты в соединении (9) может быть проведено с использованием метода, описанного вProtective Groups in Organic Synthesis by Theodora W. Green and Peter G.M. Wuts. Конденсация включает,например, амидирование с использованием галогенангидрида (например, хлорангидридом и бромангидридом), амидирование с использованием смешанного галогенангидридом с использованием этилхлоркарбоната, изобутилхлоркарбоната и т.д. и амидирование с использованием конденсирующего агента,-4 005737 такого как 1-(3,3-диметиламинопропил)-3-этилкарбодиимид, 1,3-дициклогексилкарбодиимид, дифенилфосфорилазид, диэтилцианофосфат или карбонилдиимидазол. Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например, диборана) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Al или гидрида диизопропилалюминия). Инертный растворитель включает, например, спирты (например,метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 3. Используя методику, сходную с получением соединения (6) из соединения (1) общего метода получения 1, получают соединение (13) из соединения (1). Удаление Воc-группы соединения (13) дает соединение (14) в соответствии с данным изобретением. Затем соединение (14) может быть подвергнуто взаимодействию с алкилирующим агентом или амидилирующим агентом в присутствии или в отсутствие основания в инертном растворителе с получением соединения (15) в соответствии с данным изобретением. Удаление Воc-группы из соединения (13) может быть проведено согласно методу, описанному вProtective Groups in Organic Synthesis by Theodora W. Green and Peter G.M. Wuts. Алкилирующие агенты включают, например, алкилкалогениды (например, метилйодид, этилйодид, 1-бромпропан, 2-бромпропан и 2-бромпропионитрил), алкилсульфаты (например, диметилсульфат и диэтилсульфат). Амидилирующие агенты включают, например, амидилирующие агенты, такие как цианамид, S-метилтиомочевину и аминоиминометансульфокислоту. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия и гидрид натрия). Инертный растворитель включает,например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 4. Соединение (10), полученное по методике общего метода получения 2, может быть подвергнуто взаимодействию с соединением (16) в присутствии или в отсутствие основания в инертном растворителе с получением соединения (17) в соответствии с данным изобретением. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия и гидрид натрия). Инертный растворитель включает, например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды(например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси.-5 005737 Общий метод получения 5. Соединение (18) может быть обработано основанием в инертном растворителе и подвергнуто взаимодействию с соединением (19) с получением соединения (20), которое затем может быть обработано кислотой в инертном растворителе с получением соединения (21). Соединение (21) может быть гидрировано в инертном растворителе с получением соединения (22), которое затем может быть сконденсировано с соединением (2) в инертном растворителе с получением соединения (23). Амидная группа соединения (23) может быть восстановлена в инертном растворителе до соединения (24) в соответствии с данным изобретением. Основания включают, например, амиды металлов (например, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия) и гидриды металлов (например, гидрид натрия и гидрид калия). Кислоты включают, например, неорганические кислоты (например, хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту) и органические кислоты (например, п-толуолсульфокислоту, метансульфокислоту,трифторуксусную кислоту и муравьиную кислоту). Гидрирование включает, например, реакцию, которую проводят в инертном растворителе, используя обычные металлические катализаторы (например,палладий на угле, палладиевая чернь, гидроксид палладия, диоксид платины и никель Ренея) в атмосфере водорода. Конденсация включает, например, амидирование с использованием галогенангидрида (например, хлорангидридом и бромангидридом), амидирование с использованием смешанного галогенангидрида с использованием этилхлоркарбоната, изобутилхлоркарбоната и т.д. и амидирование с использованием конденсирующего агента, такого как 1-(3,3-диметиламинопропил)-3-этилкарбодиимид, 1,3-дициклогексилкарбодиимид, дифенилфосфорилазид, диэтилцианофосфат или карбонилдиимидазол. Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например, диборана) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Al или гидрида диизобутилалюминия). Инертный растворитель включает, например,спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран),углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси.-6 005737 Общий метод получения 6. Используя методику, сходную с получением соединения (24) из соединения (22) общего метода получения 5, получают соединение (25) в соответствии с данным изобретением из соединения (20) и соединение (26) в соответствии с данным изобретением из соединения (21). Общий метод получения 7. Соединение (27), полученное согласно общему методу получения 5, может быть сконденсировано с соединением (7) в инертном растворителе с получением соединения (28), с последующим снятием защиты аминогруппы соединения (28) с получением соединения (29). Соединение (29) может быть сконденсировано с соединением (11) в инертном растворителе с получением соединения (30), с последующим восстановлением амидной группы соединения (30) в инертном растворителе с получением соединения(31) в соответствии с данным изобретением. Конденсация включает, например, амидирование с использованием галогенангидрида (например,хлорангидрида и бромангидрида), амидирование с использованием смешанного галогенангидрида с использованием этилхлоркарбоната, изобутилхлоркарбоната и т.д. и амидирование с использованием конденсирующего агента, такого как 1-(3,3-диметиламинопропил)-3-этилкарбодиимид, 1,3-дициклогексилкарбодиимид, дифенилфосфорилазид, диэтилцианофосфат или карбонилдиимидазол. Снятие защиты в соединении (28) может быть проведено с использованием метода, описанного в Protective Groups inOrganic Synthesis by Theodora W. Green and Peter G.M. Wuts. Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например, диборана) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Al или гидрида диизобутилалюминия). Инертный растворитель включает, например, спирты (например,метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси.-7 005737 Общий метод получения 8. Соединение (29), полученное согласно общему методу получения 7, может быть подвергнуто взаимодействию с соединением (32) в присутствии или в отсутствие основания в инертном растворителе с получением соединения (33). Восстановление амидной группы соединения (33) в инертном растворителе дает соединение (31) в соответствии с данным изобретением. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия и гидрид натрия). Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например, диборана) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Al или гидрида диизобутилалюминия). Инертный растворитель, включает, например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол и бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 9.-8 005737 Используя методику, сходную с получением соединения (20) из соединения (18) общего метода получения 5, получают соединение (35) из соединения (18). Используя методику, сходную с получением соединения (21) из соединения (20) общего метода получения 5, используя соединение (35) и защищая аминогруппу Воc-группой, получают соединение (36). Соединение (36) может быть гидрировано в инертном растворителе с получением соединения (37), которое затем может быть сконденсировано с соединением (2) в инертном растворителе с получением соединения (38). Воc-группа соединения (38) может быть удалена с последующим взаимодействием с алкилирующим агентом в присутствии или в отсутствие основания в инертном растворителе с получением соединения (23). Амидная группа соединения (23) может быть восстановлена в инертном растворителе с получением соединения (24) в соответствии с данным изобретением. Защита аминогруппы Воc-группой или удаление Воc-группы может быть проведено согласно методу,описанному в Protective Groups in Organic Synthesis by Theodora W. Green and Peter G.M. Wuts. Гидрирование включает, например, реакцию, которую проводят в инертном растворителе, используя обычные металлические катализаторы (например, палладий на угле, палладиевая чернь, гидроксид палладия, диоксид платины и никель Ренея) в атмосфере водорода. Конденсация включает, например, амидирование с использованием галогенангидрида (например, хлорангидрида и бромангидрида), амидирование с использованием смешанного галогенангидрида с использованием этилхлоркарбоната, изобутилхлоркарбоната и т.д. и амидирование с использованием конденсирующего агента, такого как 1-(3,3-диметиламинопропил)-3-этилкарбодиимид, 1,3-дициклогексилкарбодиимид, дифенилфосфорилазид, диэтилцианофосфат или карбонилдиимидазол. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия и гидрид натрия). Алкилирующие агенты включают, например, алкилгалогениды (например, метилйодид, этилйодид, 1-бромпропан, 2-бромпропан и 2-бромпропионитрил) и алкилсульфаты (например, диметилсульфат и диэтилсульфат). Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например, диборана) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Al или гидрида диизобутилалюминия). Инертный растворитель включает, например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол и бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 10. Используя методику, сходную с получением соединения (24) из соединения (37) общего метода получения 9, получают соединение (25) и соединение (26) в соответствии с данным изобретением из соединения (35) и соединения (36), соответственно. Общий метод получения 11.-9 005737 Соединение (39), полученное согласно общему методу получения 9, может быть сконденсировано с соединением (40) в инертном растворителе с получением соединения (41), и Вос-группа соединения (41) может быть удалена с последующей реакцией с алкилирующим агентом в присутствии или в отсутствие основания в инертном растворителе с получением соединения (42). С аминогруппы соединения (42) может быть снята защита с получением соединения (26). Затем, используя методику получения соединения(29) общего метода получения 7 или общего метода получения 8, получают соединения (31) в соответствии с данным изобретением. Конденсация включает, например, амидирование с использованием галогенангидрида (например,хлорангидрида и бромангидрида), амидирование с использованием смешанного галогенангидрида, например с использованием этилхлоркарбоната, изобутилхлоркарбоната и т.д., и амидирование с использованием конденсирующего агента, такого как 1-(3,3-диметиламинопропил)-3-этилкарбодиимид, 1,3-дициклогексилкарбодиимид, дифенилфосфорилазид, диэтилцианофосфат или карбонилдиимидазол. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия,гидроксид калия и гидрид натрия). Алкилирующие агенты включают, например, алкилкалогениды (например, метилйодид, этилйодид, 1-бромпропан, 2-бромпропан и 2-бромпропионитрил) и алкилсульфаты(например, диметилсульфат и диэтилсульфат). Удаление Воc-группы или снятие защиты с аминогруппы может быть проведено согласно методу, описанному в Protective Groups in Organic Synthesis by TheodoraW. Green and Peter G.M. Wuts. Инертный растворитель включает, например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например,толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 12. Используя методику, сходную с получением соединения (42) из соединения (39) общего метода получения 11, получают соединение (44) из соединения (37). Восстановление амидной группы соединения(44) в инертном растворителе дает соединение (45), и бензильная группа соединения (45) может быть удалена последующей реакцией с соединением (16) в присутствии или в отсутствие основания в инертном растворителе с получением соединения (46) в соответствии с данным изобретением. Восстановление включает, например, восстановление в кислых, нейтральных или щелочных условиях с использованием боронового восстановителя (например, диборана) или алюминиевого восстановителя (например, алюмогидрида лития, Red-Al и гидрида диизобутилалюминия). Удаление бензильной группы может быть проведено согласно методу, описанному в Protective Groups in Organic Synthesis byTheodora W. Green and Peter G.M. Wuts. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия и гидрид натрия). Инертный растворитель включает, например, спирты (например, метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси.-10 005737 Общий метод получения 13. Оптически активные соединения (6), (14), (15), (17), (24), (25), (26), (31) и (46) в соответствии с данным изобретением могут быть получены оптическим разделением рацемических смесей соединений (6),(14), (15), (17), (24), (25), (26), (31) и (46) в соответствии с данным изобретением, соответственно, обычным оптическим разделением с использованием кислотного хирального разделяющего агента или оптического разделения с помощью ВЭЖХ, используя хиральную стационарную фазу. Далее, оптически активное соединение (6) может быть синтезировано разделением рацемической смеси синтетических промежуточных соединений (4), (8), (9), (10) или (12) посредством оптического разделения с использованием кислотного хирального разделяющего агента или оптического разделения с помощью ВЭЖХ, используя хиральную стационарную фазу с последующим применением методики, описанной в общих методах получения 1 или 2. Далее, оптически активное соединение (14) или (15) может быть синтезировано разделением рацемической смеси синтетического промежуточного соединения (13) посредством оптического разделения с использованием кислотного хирального разделяющего агента или оптического разделения с помощью ВЭЖХ, используя хиральную стационарную фазу с последующим применением методики, описанной в общем методе получения 3. Оптически активное соединение (17) может быть синтезировано разделением рацемической смеси синтетического промежуточного соединения (10) посредством оптического разделения с использованием кислотного хирального разделяющего агента или оптического разделения с помощью ВЭЖХ, используя хиральную стационарную фазу с последующим применением методики, описанной в общем методе получения 4. Оптически активное соединение (46) может быть синтезировано разделением рацемической смеси синтетического промежуточного соединения (45) посредством оптического разделения с использованием кислотного хирального разделяющего агента или оптического разделения с помощью ВЭЖХ, используя хиральную стационарную фазу с последующим применением методики, описанной в общем методе получения 12. Кислотные хиральные разделяющие агенты включают, например, оптически активные органические кислоты, такие как (+) или (-)-ди-п-толуоилвинная кислота, (+) или (-)-дибензоилвинная кислота, (+) или (-)-винная кислота, (+) или (-)-миндальная кислота, (+) или (-)-камфорная кислота или (+) или (-)камфорсульфокислота. Хиральная стационарная фаза включает, например, сложный эфир целлюлозы, карбамат целлюлозы, карбамат амилозы, краун-эфир или полиметакрилат или их производные. Общий метод получения 14. Соединение (1) может быть подвергнуто асимметрическому восстановлению в инертном растворителе с получением оптически активного спирта (47). Соединение (47) может быть подвергнуто эпоксидированию в присутствии или в отсутствие основания в инертном растворителе и затем подвергнуто взаимодействию с соединением (2) в инертном растворителе с получением оптически активного соединения (4). Затем по методике получения, такой же, что и для получения соединения (6) из соединения (4) общего метода получения 1, оптически активное соединение (6) в соответствии с данным изобретением может быть получено из оптически активного соединения (4). Асимметричное восстановление включает, например, восстановление комплексом боран-тетрагидрофуран с использованием оксазаборолидинов, таких как (R)-5,5-дифенил-2-метил-3,4-пропано-1,3,2 оксазаборолидин или (S)-5,5-дифенил-2-метил-3,4-пропано-1,3,2-оксазаборолидин в качестве дополнительной хиральной группы, восстановление с использованием оптически активных гидридов металлов,таких как (R)-В-3-пиналил-9-борабицикло[3,3,1]нонан, (S)-В-3-пиналил-9-борабицикло[3,3,1]нонан, (-)-хлордиизопинокамфенилборан, (+)-хлордиизопинокамфенилборан, (R,R)-2,5-диметилборан, (S,S)-2,5-диме-11 005737 тилборан, (R)-BINAL-H и (S)-BINAL-H или асимметричное гидрирование с использованием оптически активного металлического катализатора, такого как оптически активный комплекс BINAP-рутения. Основания включают, например, органические амины (например, триэтиламин, диизопропилэтиламин и пиридин) и неорганические основания (например, карбонат калия, бикарбонат натрия, гидроксид натрия,гидроксид калия и гидрид натрия) , амиды металлов (например, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия или гексаметилдисилазид калия) и гидриды металлов (например, гидрид натрия и гидрид калия). Инертный растворитель включает, например, спирты (например,метанол и этанол), простые эфиры (например, диэтиловый эфир и тетрагидрофуран), углеводороды (например, толуол или бензол), галогенированные растворители углеродного типа (например, хлороформ и дихлорметан), диметилформамид, ацетонитрил, воду и их смеси. Общий метод получения 15. Используя методику получения соединения (4) из соединения (1) общего метода получения 14, получают оптически активное соединение (8) из соединения (1). Затем, используя методику получения соединения (6) из соединения (8) общего метода получения 2, получают оптически активное соединение (6) из оптически активного соединения (8). Общий метод получения 16. Используя методику, сходную с получением соединения (6) из соединения (1) общего метода получения 14, получают оптически активное соединение (13) из соединения (1). Затем, используя методику общего метода получения 3, получают оптически активные соединения (14) и (15) в соответствии с данным изобретением из оптически активного соединения (13). Общий метод получения 17.-12 005737 Используя методику общего метода получения 4, получают оптически активное соединение (17) из оптически активного соединения (10), которое может быть получено по методике общего метода получения 15. Соединения в соответствии с данным изобретением могут вводиться перорально или парентерально, и их дозированными формами являются, например, таблетки, капсулы, гранулы, тонкоизмельченные порошки, порошки, пастилки, мази, кремы, эмульсии, суспензии, суппозитории и инъекции; все они могут быть получены обычными методами (например, методом, описанным в Japanese Pharmacopoeia, 12thedition). Такие дозированные формы могут быть подходящим образом выбраны в соответствии с состоянием и возрастом пациента и целью терапии. Такие формы могут быть приготовлены с использованием обычных наполнителей (например, кристаллической целлюлозы, крахмалов, лактозы и маннита), связующих агентов (например, гидроксипропилцеллюлозы и поливинилпирролидона), смазывающих агентов (например, стеарата магния и талька), разрыхлителей (например, кальций карбоксиметилцеллюлозы). Доза соединения в соответствии с данным изобретением для лечения взрослого человека может варьировать от 1 до 2000 мг в день, в виде одной дозы или нескольких отдельных доз, и может быть соответствующим образом увеличена или уменьшена в зависимости от возраста, массы тела и состояния пациента. Варианты осуществления данного изобретения Данное изобретение более подробно иллюстрировано представленными ниже примерами и экспериментами. Пример 1. Синтез 1-[2-(4-метоксифенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил) пиперазина трималеата (соединение 32 в табл. 1).(1) В 6,0 мл хлороформа растворяют 0,69 г 4-метоксифенацилбромида и добавляют 3,0 мл N-этилдиизопропиламина и 1,20 г 1-(4-нафталин-1-ил-бутил)пиперазиндигидрохлорида с последующим кипячением с обратным холодильником в течение часа. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. К остатку добавляют насыщенный водный раствор бикарбоната натрия и, после экстракции этилацетатом, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении с получением неочищенного 1-[2-(4-метоксифенил)-2-оксоэтил]-4-(4-нафталин-1-ил-бутил)пиперазина.(2) Неочищенный 1-[2-(4-метоксифенил)-2-оксоэтил]-4-(4-нафталин-1-ил-бутил)пиперазин, полученный в (1), растворяют в 10 мл этанола и затем добавляют раствор, полученный добавлением 10% водного раствора гидроксида калия (1 капля) и 0,18 г боргидрида натрия к 1,0 мл воды, с последующим перемешиванием при 50 С в течение часа. В реакционный раствор выливают воду и, после экстракции этилацетатом, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении с получением неочищенного 1-[2-гидрокси-2-(4-метоксифенил)этил]-4-(4-нафталин-1-ил-бутил)пиперазина.(3) Неочищенный 1-[2-гидрокси-2-(4-метоксифенил)этил]-4-(4-нафталин-1-ил-бутил)пиперазин, полученный в (2), и 1,25 мл триэтиламина растворяют в 10 мл метиленхлорида и, после охлаждения на льду, добавляют 0,46 мл метансульфонилхлорида, с последующим перемешиванием при комнатной температуре в течение 30 мин. К реакционному раствору последовательно добавляют 0,84 мл триэтиламина и 1,0 мл 1-метилпиперазина, с последующим перемешиванием при комнатной температуре в течение 3 ч. После концентрации реакционного раствора при пониженном давлении вливают насыщенный водный раствор бикарбоната натрия и, после экстракции этилацетатом, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=1:1) с получением 0,94 г 1-[2-(4-метоксифенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-илбутил)пиперазина.(4) 0,94 г 1-[2-(4-метоксифенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина растворяют в 5,0 мл этанола, добавляют 0,56 г раствора малеиновой кислоты в 5,0 мл этанола с последующим выстаиванием в течение 2 ч. Выпавшие кристаллы собирают фильтрацией и промывают этанолом с получением 1,24 г 1-[2-(4-метоксифенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил) пиперазина трималеата в виде кристаллов. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1 и 2. Пример 2. Синтез 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина тетрагидрохлорида (соединение 4 в табл. 1).(30 мл) и кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры реакционный раствор концентрируют при пониженном давлении и добавляют 25% водный раствор аммиака с последующей экстракцией простым эфиром. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении с получением неочищенного 1-этоксикарбонил-4-[2-(4-фторфенил)-2-оксоэтил]пиперазина, кото-13 005737 рый затем растворяют в 40 мл этанола, и добавляют раствор, полученный добавлением 5% гидроксида калия (1 капля) и 1,0 г боргидрида натрия в 5 мл воды с последующим нагреванием при 50 С в течение часа. После концентрации реакционного раствора при пониженном давлении добавляют воду с последующим экстрагированием простым эфиром и органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. В остаток вливают 50 мл 4 М раствор хлороводорода/этилацетата, раствор концентрируют при пониженном давлении и полученное твердое вещество промывают простым эфиром с получением 8,3 г 1-этоксикарбонил-4-[2-(4-фторфенил)-2-гидроксиэтил]пиперазина гидрохлорида.(2) К 8,3 г гидрохлорида 1-этоксикарбонил-4-[2-(4-фторфенил)-2-гидроксиэтил]пиперазина добавляют 20 мл бензола и 2,5 мл тионилхлорида с последующим нагреванием при 50 С в течение 10 мин. Реакционный раствор концентрируют при пониженном давлении, вливают 25% водный раствор аммиака с последующей экстракцией этилацетатом. Органический слой сушат над безводным сульфатом натрия и, после удаления осушителя фильтрацией, фильтрат концентрируют при пониженном давлении. К остатку вливают 50 мл 4 М раствора хлороводорода/этилацетата, раствор концентрируют при пониженном давлении и полученное твердое вещество промывают эфиром с получением 8,1 г 1-этоксикарбонил-4-[2 хлор-2-(4-фторфенил)этил]пиперазина гидрохлорида.(3) К 7,6 г гидрохлорида 1-этоксикарбонил-4-[2-хлор-2-(4-фторфенил)этил]пиперазина вливают 5 мл 25% водного раствора аммиака и воду и, после экстракции эфиром, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток растворяют в 20 мл бензола и добавляют 5,4 мл 1-метилпиперазина с последующим нагреванием при 65 С в течение 3,5 ч. К реакционному раствору добавляют 25% водный раствор аммиака и воду и, после экстракции эфиром, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=4:1) с получением 6,58 г 1-этоксикарбонил-4-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]пиперазина в виде масла.(4) 1,25 г 1-этоксикарбонил-4-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]пиперазина растворяют в 2 мл этанола, добавляют 1,3 г гидроксида калия с последующим кипячением с обратным холодильником в течение часа. Реакционный раствор охлаждают до комнатной температуры и, после добавления 2 мл воды, экстрагируют этилацетатом и органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией, фильтрат концентрируют при пониженном давлении с получением 1,0 г неочищенного 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]пиперазина.(5) 0,37 г 4-нафталин-1-илмасляной кислоты растворяют в 5,0 мл толуола и добавляют 0,35 мл тионилхлорида и диметилформамид (1 капля) с последующим нагреванием при 70 С в течение 30 мин. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении с получением неочищенного 4-нафталин-1-ил-бутирилхлорида. К полученному неочищенному 4-нафталин-1-ил-бутирилхлориду добавляют 0,40 г раствора 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]пиперазина в 2,3 мл толуола с последующим перемешиванием при комнатной температуре в течение 30 мин. К реакционному раствору добавляют насыщенный водный раствор бикарбоната натрия и, после экстракции этилацетатом, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wako-gel С-200, хлороформ:метанол=10:1) с получением 0,58 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутирил)пиперазина в виде масла.(6) 0,32 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутирил)пиперазина растворяют в 10 мл тетрагидрофурана и добавляют 50 мг алюмогидрида лития с последующим кипячением с обратным холодильником в течение 30 мин. Реакционный раствор охлаждают до комнатной температуры и, после добавления 1 мл 10% водного раствора гидроксида натрия, вливают эфир с последующей сушкой над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=1:1) с получением 0,30 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина в виде масла.(7) 0,30 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина растворяют в 4 мл метанола и добавляют 1 мл 4 М раствора хлороводорода/этилацетата. Раствор концентрируют при пониженном давлении и полученное твердое вещество промывают метанолом с получением 0,20 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина тетрагидрохлорида. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1 и 2. Пример 3. Синтез 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-(4-нафталин-1-ил-бутил) пиперазина трималеата (соединение 16 в табл. 1).(1) 0,62 г 1-[2-(4-фторфенил)-2-(4-трет-бутоксикарбонилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина растворяют в смеси 3 мл этилацетата и 3 мл метанола и добавляют 4 мл 4 М раствора хлороводорода/этилацетата с последующим перемешиванием при комнатной температуре в течение 6 ч. Выпавшие кристаллы собирают фильтрацией и кристаллы промывают этилацетатом с получением 0,42 г 1-[2-(4-фторфенил)-2-пиперазиноэтил]-4-(4-нафталин-1-ил-бутил)пиперазина тетрагидрохлорида в виде масла.(2) 0,2 г 1-[2-(4-фторфенил)-2-пиперазиноэтил]-4-(4-нафталин-1-ил-бутил)пиперазина тетрагидрохлорида растворяют в 0,7 мл диметилформамида и добавляют 74 мг 60% гидрида натрия в масле при охлаждении на льду. Температуру повышают до комнатной с последующим перемешиванием в течение 10 мин. К реакционному раствору добавляют раствор 0,2 г 2-бромпропана в 0,3 мл диметилформамида с последующим перемешиванием в течение ночи. Реакционный раствор выливают в воду и, после экстракции этилацетатом, органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH,гексан:этилацетат=1:1) с получением 0,13 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-(4 нафталин-1-ил-бутил)пиперазина в виде масла.(3) 0,13 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина растворяют в 1,5 мл этанола и добавляют раствор 0,11 г малеиновой кислоты в 1 мл этанола с последующим выстаиванием в течение 2 ч. Выпавшие кристаллы собирают фильтрацией и промывают этанолом с получением 0,18 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-(4-нафталин-1-ил-бутил) пиперазина трималеата в виде кристаллов. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 4. Синтез 4-1-(4-фторфенил)-2-[4-(4-нафталин-1-ил-бутил)пиперазин-1-ил]этилпиперазин-1-карбоксамидина трималеата (соединение 20 в табл. 1).(1) 0,72 г 1-[2-(4-фторфенил)-2-пиперазиноэтил]-4-(4-нафталин-1-ил-бутил)пиперазин тетрагидрохлорида, полученного в примере 3 (1), растворяют в 10 мл этанола и добавляют 0,20 г цианамида с последующим кипячением с обратным холодильником при перемешивании в течение 4 ч. После охлаждения до комнатной температуры реакционный раствор концентрируют при пониженном давлении, добавляют насыщенный водный раствор бикарбоната натрия и, после экстракции этилацетатом, органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток растворяют в 3,0 мл этанола и добавляют раствор 0,50 г малеиновой кислоты в 3,0 мл этанола с последующим выстаиванием в течение 2 ч. Выпавшие кристаллы собирают фильтрацией и промывают этанолом с получением 0,52 г 4-1-(4-фторфенил)-2-[4-(4 нафталин-1-ил-бутил)пиперазин-1-ил]этилпиперазин-1-карбоксамидина трималеата в виде кристаллов. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 5. Синтез 1-[2-(4-аминофенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина трималеата (соединение 39 в табл. 1). 0,54 г 1-[2-(4-нитрофенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазина трималеата, полученного по методике примера 1, растворяют в 1 М водном растворе гидроксида натрия и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток растворяют в 20 мл этанола и добавляют 10 мг оксида платины с последующим перемешиванием в атмосфере водорода в течение 2 ч. После удаления оксида платины фильтрацией фильтрат концентрируют при пониженном давлении. Остаток растворяют в 3,0 мл этанола и добавляют раствор 0,19 г малеиновой кислоты в 3,0 мл этанола с последующим выстаиванием в течение 2 ч. Выпавшие кристаллы собирают фильтрацией и промывают этанолом с получением 0,35 г 1-[2-(4-аминофенил)-2-(4-метилпиперазино)этил]-4-(4 нафталин-1-ил-бутил)пиперазина трималеата в виде кристаллов. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 6. Синтез 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-[4-(6-фтор-1,2-бензизоксазол 3-ил)бутил]пиперазина трималеата (соединение 46 в табл. 1).(1) 0,37 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]пиперазина, полученного в примере 2 (4),растворяют в 4,0 мл диметилформамида и добавляют 0,19 г N-этилдиизопропиламина и 0,31 г 4-(6-фтор 1,2-бензизоксазол-3-ил)бутилхлорида с последующим перемешиванием при 120 С в течение 3 ч. Реакционный раствор охлаждают до комнатной температуры, разбавляют этилацетатом и промывают водой и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=1:1) с получением 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-[4-(6-фтор-1,2-бензизоксазол-3-ил)бутил] пиперазина, 0,22 г, в виде масла.(2) 0,21 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-[4-(6-фтор-1,2-бензизоксазол-3-ил)бутил]пиперазина растворяют в 2,0 мл этанола и добавляют раствор 0,16 г малеиновой кислоты в 2,0 мл этанола с последующим выстаиванием в течение 2 ч. Выпавшие кристаллы собирают фильтрацией и промывают этанолом с получением 0,30 г 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-[4-(6-фтор 1,2-бензизоксазол-3-ил)бутил]пиперазина трималеата в виде кристаллов. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1 и 2. Пример 7. Синтез 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-гидроксинафталин 1-ил)бутил]пиперазина трималеата (соединение 55 в табл. 1). 0,06 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-(4-(2-метоксинафталин-1-ил)бутил) пиперазина, полученного по методике примера 2, растворяют в 10 мл 48% водного раствора бромистоводородной кислоты и кипятят с обратным холодильником в течение 2 ч. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении и добавляют 1 М водный раствор гидроксида натрия с последующей экстракцией эфиром. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=1:1) с получением 0,06 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2 гидроксинафталин-1-ил)бутил]пиперазина в виде масла. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 8. Синтез 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-изопропоксинафталин-1-ил)бутил]пиперазина трималеата (соединение 56 в табл. 1).(1) 0,05 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-гидроксинафталин-1-ил)бутил]пиперазина, полученного в примере 7, растворяют в 5 мл диметилформамида и добавляют 0,19 г карбоната калия и 0,068 мл 2-йодпропана с последующим перемешиванием при 70 С в течение 6 ч. Реакционный раствор охлаждают до комнатной температуры, разбавляют этилацетатом и промывают водой и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH,гексан:этилацетат=1:1) с получением 0,03 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2 изопропоксинафталин-1-ил)бутил]пиперазина в виде масла.(2) 0,03 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-изопропоксинафталин-1-ил) бутил]пиперазина растворяют в 2,0 мл этанола и добавляют раствор 0,02 г малеиновой кислоты в 2,0 мл этанола с последующим выстаиванием в течение 2 ч. Выпавшие кристаллы собирают фильтрацией с получением 0,03 г 1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-изопропоксинафталин-1-ил) бутил]пиперазина трималеата в виде кристаллов. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 9. Синтез 1-[2-(4-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида (соединение 75 в табл. 1).(1) 0,50 г 1-[2-(4-метоксикарбонилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина, полученного по методике примера 2, растворяют в 2 мл концентрированной хлористо-водородной кислоты и перемешивают при 80 С в течение 5 ч. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток суспендируют в 5 мл тионилхлорида и кипятят с обратным холодильником в течение 2 ч. После концентрирования реакционной смеси при пониженном давлении остаток растворяют в 2,5 мл тетрагидрофурана и добавляют 25% водный раствор аммиака с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=1:1) с получением 0,10 г 1-[2-(4-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4-[4(2-метоксинафталин-1-ил)бутил]пиперазина в виде масла.(2) 0,10 г 1-[2-(4-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина растворяют в 4 мл метанола и добавляют этилацетата 1 мл 4 М раствора хлороводорода/этилацетата. Раствор концентрируют при пониженном давлении и полученное твердое вещество промывают этилацетатом с получением 0,10 г 1-[2-(4-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 10. Синтез 1-[2-(3-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида (соединение 76 в табл. 1).(1) 0,20 г 1-[2-(3-цианокарбонилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин 1-ил)бутил]пиперазина, полученного по методике примера 2, растворяют в 2 мл трет-бутанола и добавляют 70 мг гидроксида калия с последующим кипячением с обратным холодильником в течение 2 ч. Реакционный раствор охлаждают до комнатной температуры, разбавляют хлороформом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=2:1) с получением 74 мг 1-[2-(3-карбамоилфенил)-2-(4 изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина в виде масла.(2) 74 мг 1-[2-(3-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина растворяют в 4 мл метанола и добавляют 1 мл 4 М раствора хлороводорода/этилацетата. Раствор концентрируют при пониженном давлении и полученное твердое вещество промывают этилацетатом с получением 70 мг 1-[2-(3-карбамоилфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 11. Синтез 1-[2-(4-фторфенил)-2-пиперидин-1-ил-этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина (соединение 81 в табл. 2).(1) 48,3 мл диизопропиламина растворяют в 200 мл тетрагидрофурана и по каплям добавляют 137 мл 2,5 М раствора н-бутиллития/гексана при охлаждении на льду. К реакционному раствору по каплям добавляют раствор 25,2 г п-фторфенилуксусной кислоты в 100 мл тетрагидрофурана, добавляют 28,4 мл гексаметилфосфорного триамида (ГМФА) и температуру повышают до комнатной температуры с последующим перемешиванием в течение 30 мин. После охлаждения на льду к реакционному раствору по каплям добавляют раствор 32,5 г 1-трет-бутоксикарбонил-4-пиперидона в 100 мл тетрагидрофурана и температуру повышают до комнатной температуры с последующим перемешиванием в течение 3 ч. К реакционному раствору по каплям добавляют воду и, после экстракции этилацетатом, водный слой подкисляют кислым сульфатом калия и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. К остатку добавляют простой эфир с последующим перемешиванием при комнатной температуре. Выпавшие кристаллы собирают фильтрацией и промывают простым эфиром с получением 30,0 г 1-трет-бутоксикарбонил-4-[карбокси-(4 фторфенил)метил]-4-гидроксипиперидина в виде порошка.(2) 20,0 г 1-трет-бутоксикарбонил-4-[карбокси(4-фторфенил)метил]-4-гидроксипиперидина суспендируют в 40 мл хлороформа и по каплям добавляют 40 мл концентрированной серной кислоты при охлаждении на льду. Реакционный раствор кипятят с обратным холодильником в течение 3 ч и, после охлаждения до температуры замерзания, добавляют 250 мл 4 М раствора гидроксида натрия, 200 мл 1,4-диоксана и 14,8 г ди-трет-бутилдикарбоната. После перемешивания при комнатной температуре в течение 30 мин реакционный раствор подкисляют кислым сульфатом калия с последующей экстракцией хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Wako-gel С-200,хлороформ:метанол=10:1) с получением 18,0 г 1-трет-бутоксикарбонил-4-[карбокси-(4-фторфенил)метил]-3,6-дигидро-2 Н-пиридина в виде масла.(3) 5,0 г 1-трет-бутоксикарбонил-4-[карбокси(4-фторфенил)метил]-3,6-дигидро-2 Н-пиридина растворяют в 50 мл метанола и добавляют 0,50 г гидроксида палладия на угле с последующим перемешиванием в атмосфере водорода при комнатной температуре в течение 2 дней. После удаления катализатора фильтрацией через Celite фильтрат концентрируют при пониженном давлении с получением 3,6 г 1-третбутоксикарбонил-4-[карбокси(4-фторфенил)метил]пиперидина.(4) 2,2 г 1-трет-бутоксикарбонил-4-[карбокси(4-фторфенил)метил]пиперидина растворяют в 20 мл диметилформамида и добавляют 2,0 г 1-[4-(2-метоксинафталин-1-ил)бутил]пиперазина дигидрохлорида,1,9 г 1-(3,3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида, 1,9 г 1-гидроксибензотриазола моногидрата и 3,5 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH,гексан:этилацетат=3:1) с получением 2,4 г 1-трет-бутоксикарбонил-4-(1-(4-фторфенил)-2-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазин-1-ил-2-оксоэтил)пиперидина в виде масла.(5) 2,1 г 1-трет-бутоксикарбонил-4-(1-(4-фторфенил)-2-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазин-1-ил-2-оксоэтил)пиперидина растворяют в 10 мл метанола и добавляют 10 мл 4 М раствора хлороводорода/1,4-диоксана с последующим перемешиванием при комнатной температуре в течение 2 ч. После концентрации реакционного раствора при пониженном давлении к остатку добавляют простой-17 005737 эфир с последующим перемешиванием при комнатной температуре. Выпавшие кристаллы фильтруют и промывают простым эфиром с получением 1,7 г 4-(1-(4-фторфенил)-2-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазин-1-ил-2-оксоэтил)пиперидина дигидрохлорида.(6) 0,15 г 4-(1-(4-фторфенил)-2-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазин-1-ил-2-оксоэтил) пиперидина дигидрохлорида растворяют в 1 М водном растворе гидроксида натрия и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток растворяют в 5 мл тетрагидрофурана и добавляют 10 мг алюмогидрида лития с последующим перемешиванием при 50 С в течение 15 мин. Реакционный раствор охлаждают до комнатной температуры и разбавляют простым эфиром, по каплям добавляют 25% водный раствор аммиака. Осадок удаляют фильтрацией через Celite, фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=4:1) с получением 0,13 г 1-[2-(4-фторфенил)-2-пиперидин-4-илэтил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина в виде масла. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 2. Пример 12. Синтез 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]этил-1-метилпиперидин-4-ола тригидрохлорида (соединение 83 в табл. 2).(1) 2,37 г 1-трет-бутоксикарбонил-4-[карбокси(4-фторфенил)метил]-4-гидроксипиперидина, полученного в примере 11 (1), растворяют в 20 мл диметилформамида и добавляют 2,50 г 1-(4-нафталин-1-илбутил)пиперазина дигидрохлорида, 1,9 г 1-(3,3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида, 1,9 г 1-гидроксибензотриазола моногидрата и 3,5 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=3:1) с получением 1,96 г 1-трет-бутоксикарбонил 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]-2-оксоэтил-4-гидроксипиперидина в виде масла.(2) 1,04 г 1-трет-бутоксикарбонил-4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]2-оксоэтил-4-гидроксипиперидина растворяют в 10 мл метанола и добавляют 20 мл 4 М раствора хлороводорода/1,4-диоксана с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционный раствор концентрируют при пониженном давлении, к остатку добавляют этилацетат и смесь промывают 1 М водным раствором гидроксида натрия и насыщенным водным раствором натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении, остаток растворяют в 9 мл ацетонитрила и добавляют 640 мкл 37% формалина, 190 мкл уксусной кислоты и 160 мг цианборгидрида натрия с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=2:1) с получением 0,44 г 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]-2-оксоэтил-1-метилпиперидин-4-ола в виде масла.(3) 0,25 г 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]-2-оксоэтил-1-метилпиперидин-4-ола растворяют в 3 мл тетрагидрофурана и добавляют 18 мг алюмогидрида лития с последующим перемешиванием при 50 С в течение 15 мин. Реакционный раствор охлаждают до комнатной температуры и разбавляют простым эфиром и по каплям добавляют 25% водный раствор аммиака. Осадок отделяют фильтрацией через Celite, фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=4:1) с получением 33 мг 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]этил-1-метилпиперидин-4 ола в виде масла.(4) 33 мг 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]этил-1-метилпиперидин 4-ола растворяют в 4 мл метанола и добавляют 1 мл 4 М раствора хлороводорода/этилацетата. Раствор концентрируют при пониженном давлении и полученное твердое вещество промывают этилацетатом с получением 35 мг 4-1-(4-фторфенил)-2-[4-(нафталин-1-ил-бутил)пиперазин-1-ил]этил-1-метилпиперидин-4-ола тригидрохлорида. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл 2. Пример 13. Синтез 1-[2-(4-фторфенил)-2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)этил]-4-(4-нафталин-1-ил-бутил)пиперазина (соединение 84 в табл. 2).(1) 0,49 г 1-трет-бутоксикарбонил-4-[карбокси(4-фторфенил)метил]-3,6-дигидро-2 Н-пиридина, полученного в примере 11 (2), растворяют в 5 мл диметилформамида и добавляют 0,55 г 1-(4-нафталин-1 ил-бутил)пиперазина гидрохлорида, 0,34 г 1-(3,3-диметиламинопропил)-3-этилкарбодиимида гидрохло-18 005737 рида, 0,34 г 1-гидроксибензотриазола моногидрата и 0,5 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=2:1) с получением 0,53 г 1-трет-бутоксикарбонил-4-1-(4-фторфенил)-2-[4-(4-нафталин-1-ил-бутил)пиперазин-1-ил]-2-оксоэтил-3,6-дигидро-2 Н-пиридина в виде масла.(2) 0,49 г 1-трет-бутоксикарбонил-4-1-(4-фторфенил)-2-[4-(4-нафталин-1-ил-бутил)пиперазин-1 ил]-2-оксоэтил-3,6-дигидро-2 Н-пиридина растворяют в 5 мл метанола и добавляют 20 мл 4 М раствора хлороводорода/1,4-диоксана с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционный раствор концентрируют при пониженном давлении, к остатку добавляют этилацетат и смесь промывают 1 М водным раствором гидроксида натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток растворяют в 5 мл ацетонитрила и добавляют 340 мкл 37% формалина, 200 мкл уксусной кислоты и 90 мг цианборгидрида натрия с последующим перемешиванием при комнатной температуре в течение часа. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=2:1) с получением 0,25 г 4-1(4-фторфенил)-2-[4-(4-нафталин-1-ил-бутил)пиперазин-1-ил]-2-оксоэтил-1-метил-3,6-дигидро-2 Н-пиридина в виде масла.(3) 0,25 г 4-1-(4-фторфенил)-2-[4-(4-нафталин-1-ил-бутил)пиперазин-1-ил]-2-оксоэтил-1-метил 3,6-дигидро-2 Н-пиридина растворяют в 3 мл тетрагидрофурана и добавляют 18 мг алюмогидрида лития с последующим перемешиванием при 50 С в течение 15 мин. Реакционный раствор охлаждают до комнатной температуры и разбавляют эфиром, по каплям добавляют 25% водный раствор аммиака. Осадок отделяют фильтрацией через Celite, фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=4:1) с получением 0,10 г 1-[2-(4-фторфенил)-2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)этил]-4-(4-нафталин-1-ил-бутил) пиперазина в виде масла. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 2. Пример 14. Синтез 1-[2-(4-фторфенил)-2-(1-изопропилпиперидин-4-ил)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тригидрохлорида (соединение 82 в табл. 2).(1) 0,20 г 4-(1-(4-фторфенил)-2-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазин-1-ил-2-оксоэтил) пиперидина гидрохлорида, полученного в примере 11 (5), растворяют в 2 мл диметилформамида и добавляют 93 мг карбоната калия и 41 мкл 2-йодпропана с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем(2) 0,14 г 1-изопропил-4-(1-(4-фторфенил)-2-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазин-1 ил-2-оксоэтил)пиперидина растворяют в 5 мл тетрагидрофурана и добавляют 10 мл алюмогидрида лития с последующим перемешиванием при 50 С в течение 15 мин. Реакционный раствор охлаждают до комнатной температуры и разбавляют эфиром и по каплям добавляют 25% водный раствор аммиака. Осадок отделяют фильтрацией через Celite, фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=4:1) с получением 0,13 г 1-[2-(4-фторфенил)-2-(1-изопропилпиперидин-4-ил)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина в виде масла.(3) 0,11 г 1-[2-(4-фторфенил)-2-(1-изопропилпиперидин-4-ил)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина растворяют в 4 мл метанола и добавляют 1 мл 4 М раствора хлороводорода/этилацетата. Раствор концентрируют при пониженном давлении и полученное твердое вещество промывают этилацетатом с получением 0,12 г 1-[2-(4-фторфенил)-2-(1-изопропилпиперидин-4-ил)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тригидрохлорида. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 2. Пример 15. Синтез 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-[4-нафталин-1-илбутил]пиперазина гидрохлорида (оптически активное соединение).-19 005737 1-[2-(4-Фторфенил)-2-(4-метилпиперазино)этил]-4-(4-нафталин-1-ил-бутил)пиперазин гидрохлорид,полученный в примере 2 (6), разделяют ВЭЖХ (Chiralpack AD (производства Daicel Co.), 2 х 25 см, подвижная фаза: гексан-изопропанол-диэтиламин=95:5:0,1, скорость потока 5,0 мл/мин). После разделения растворитель концентрируют при пониженном давлении, растворяют в этаноле и вводят в гидрохлорид с помощью 4 М раствора хлороводорода/этилацетата и растворитель концентрируют при пониженном давлении с получением 1-[2-(4-фторфенил)-2-(4-метилпиперазино)этил]-4-[4-нафталин-1-илбутил]пиперазина гидрохлорида (оптически активного соединения).[]d25=-15,0 (с=0,24 МеОН), время хранения; 10,9 мин, т.пл. 193-195 С (этанол). Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 16. Синтез (+)-1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида (соединение 61 в табл. 1).(1) 1,0 г 2-Хлор-4'-фторацетофенона растворяют в 5 мл тетрагидрофурана и добавляют 0,16 г (S)5,5-дифенил-2-метил-3,4-пропано-1,3,2-оксазаборолидина и раствора комплекса 1 М боран-тетрагидрофуран в 7,0 мл тетрагидрофурана при охлаждении на льду, с последующим перемешиванием в течение 10 мин. Затем к реакционному раствору добавляют 4 М водный 2 мл раствора гидроксида натрия с последующим перемешиванием при комнатной температуре в течение 4 ч. Реакционный раствор концентрируют при пониженном давлении и остаток растворяют в простом эфире и промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Wako-gel С-200,гексан:этилацетат=10:1) с получением 0,85 г оптически активного 2-(4-фторфенил)оксирана в виде масла.(2) 0,80 г оптически активного 2-(4-фторфенил)оксирана растворяют в этаноле и добавляют 3,2 г 1[4-(2-метоксинафталин-1-ил)бутил]пиперазина с последующим кипячением с обратным холодильником в течение 2 ч. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в хлороформе и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=2:1) с получением оптически активного 1,2 г 1-[2-гидрокси-2-(4-фторфенил)этил]-4-[4-(2 метоксинафталин-1-ил)бутил]пиперазина в виде твердого вещества.(3) 0,12 г оптически активного 1-[2-гидрокси-2-(4-фторфенил)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина и 0,15 мл триэтиламина растворяют в 5 мл метиленхлорида и, после охлаждения на льду, добавляют 43 мкл метансульфонилхлорида с последующим перемешиванием при комнатной температуре в течение 30 мин. К реакционному раствору последовательно добавляют 0,15 мл триэтиламина и 0,11 г 1-изопропилпиперазина дигидрохлорида с последующим перемешиванием при комнатной температуре в течение 3 ч. Реакционный раствор концентрируют при пониженном давлении и остаток растворяют в этилацетате и промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (Chromatorex NH, гексан:этилацетат=4:1) с получением 0,12 г (+)-1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина.(4) 0,12 г (+)-1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина растворяют в 4 мл метанола и добавляют 1 мл 4 М раствора хлороводорода/этилацетата. После концентрации при пониженном давлении полученное твердое вещество промывают этилацетатом с получением 0,12 г (+)-1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида. Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Пример 17. Синтез (-)-1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил)бутил]пиперазина тетрагидрохлорида (соединение 62 в табл. 1). Используя (R)-5,5-дифенил-2-метил-3,4-пропано-1,3,2-оксазаборолидин, по методике примера 16 получают 0,12 г (-)-1-[2-(4-фторфенил)-2-(4-изопропилпиперазино)этил]-4-[4-(2-метоксинафталин-1-ил) бутил]пиперазина тетрагидрохлорида.-20 005737 Структуры и физические свойства данного соединения и соединений, полученных по той же методике, описаны в табл. 1. Таблица 11 Эксперимент 1. Тестирование на связывание рецептора МК 4. Тестирование на связывание рецептора МК 4 проводят согласно методу, описанному в PharmacologyToxicology, 79, 161-165, 1996. Мембраны клеток НЕК-293, экспрессирующие человеческий рецептор МК 4, закупают у Biolinks Co. Мембраны клеток гомогенизируют в 50 мМ растворе Трис буфера в соляной кислоте (рН 7,4), содержащем 2 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 10 мМ хлорида кальция и 100 мкМ фенилметансульфонилфторида. Гомогенат центрифугируют при 48000 х g в течение 20 мин при 4 С. Эту процедуру повторяют дважды. Осадок суспендируют в 50 мМ растворе Трис буфера в соляной кислоте (рН 7,4), содержащем 2 мМ этилендиаминтетрауксусной кислоты, 10 мМ хлорида кальция, 100 мкМ фенилметансульфонилфторида и 0,1% альбумин бычьей сыворотки до концентрации белка 100 мкг/мл с получением неочищенного препарата мембраны, который используют для проведения тестирования на связывание. Неочищенный препарат мембраны (0,25 мл, 25 мкг белка) подвергают взаимодействию с [125I]Nle4-D-Рhе 7 МSН (конечная концентрация 0,2 нМ) при 25 С в течение 120 мин. После завершения реакции реакционный раствор фильтруют отсасыванием через GF/C стеклянный фильтр, предварительно пропитанный в течение 2 ч в 50 мМ раствором Трис буфера в соляной кислоте(рН 7,4), содержащим 0,5% бычью сыворотку, с использованием коллектора клеток, для тестирования на связывание рецептора. Радиоактивность фильтровальной бумаги измеряют на гамма-счетчике. Связывание в присутствии 1 мкМ Nle4-D-Phe7MSH определяют как неспецифическое связывание. Специфическое связывание получают вычитая показатель неспецифического связывания из общего показателя связывания, которое представляет собой связывание в отсутствие 1 мкМ Nle4-D-Phe7MSH. Тестируемое соединение растворяют в 100% ДМСО и одновременно с [125I]Nle4-D-Рhе 7 МSН добавляют к препарату мембраны. Значение IC50 рассчитывают исходя из кривой ингибирования при концентрации 10-9-10-5. В результате, например, соединение 4 демонстрирует IC50 164 нМ и оптически активное соединение 6 демонстрирует IС 50 90 нМ. Эксперимент 2. Исследуют действие -МСГ и МТИИ, подобное анксиогенному, тестированием по Вогелю, проводимым на крысах (проконфликтный тест).-МСГ и МТИИ покупают у Peninsula Laboratories. В качестве животных используют самцов крысSD весом 220-240 г (Charles River Japan Inc.). Крыс, лишенных питьевой воды в течение 48 ч, делят на группы по 5 животных в каждой группе. Тестируемое соединение вводят крысам интрацеребровентрикулярно в количестве 10 мкл/2 мин тестируемого соединения, полученного растворением определенного количества -МСГ или МТИИ в физиологическом растворе, содержащем 0,1% альбумина бычьей сыво-24 005737 ротки. Контрольной группе крыс, которым не вводят тестируемое соединение, интрацеребровентрикулярно в количестве 10 мкл/2 мин вводят физиологический раствор, содержащий 0,1% альбумина бычьей сыворотки. Через 30 мин после введения крыс помещают в аппарат для тестирования и наблюдают их поведение в течение 3 мин свободного доступа к питьевой воде. В течение времени свободного доступа к питьевой воде каждые 2 с суммарного лизания к питьевому отверстию применяют электрический удар(0,4 мА). Оценку данного эксперимента проводят исходя из числа электрических ударов. Результаты показаны на фиг. 1. Символыина фиг. 1 показывают, что при определении значительного различия согласно тесту Даннетта р 0,05 и р 0,01 означают, что имеется значительное различие по сравнению с контрольной группой, которой вводили физиологический раствор, содержащей 0,1% альбумина бычьей сыворотки. Как очевидно из результатов, показанных на фиг. 1, число подходов к воде дозозависимо и значительно снижается при интрацеребровентрикулярном введении -МСГ и МТИИ по сравнению с контрольной группой. Эксперимент 3. Исследуют антитревожное действие соединения 4 в табл. 1 тестированием по Вогелю, проводимым на крысах (конфликтный тест). В качестве животных используют самцов крыс SD весом 220-240 г (Charles River Japan Inc.). Крыс,лишенных питьевой воды в течение 48 ч, делят на группы по 10 животных в каждой группе. Группе крыс, которым вводят тестируемое соединение, подкожно вводят тестируемое соединение, полученное растворением предопределенного количества соединения 4 из табл. 1 в физиологическом растворе для инъекций, с добавлением 0,5 М водного раствора гидроксида натрия для доведения рН до 4-5. Через 30 мин после введения крыс помещают в аппарат для тестирования и наблюдают их поведение в течение 3 мин свободного доступа к питьевой воде. В течение времени свободного доступа к питьевой воде каждые 2 с суммарного лизания к питьевому отверстию применяют электрический удар (1,0 мА). Оценку данного эксперимента проводят исходя из числа электрических ударов. Результаты показаны на фиг. 2. Символна фиг. 2 показывает, что при определении значительного различия согласно тесту Даннетта р 0,01 означает, что имеется значительное различие по сравнению с контрольной группой, которую не подвергали электрическому удару у питьевого отверстия. Символна фиг. 2 показывает, что,при определении значительного различия согласно тесту Даннетта, р 0,01 означает, что имеется значительное различие по сравнению с контрольной группой, которой вводили изотонический раствор хлорида натрия и подвергали электрическому удару у питьевого отверстия. Как очевидно из результатов, показанных на фиг. 2, число подходов к воде в группе, которую подвергали электрическому удару, существенно снижено по сравнению с таковым в группе, которую не подвергали электрическому шоку. Однако сниженное число подходов к воде значительно, дозозависимо было антагонизировано подкожным введением 1, 3 или 10 мг/кг соединения 4 из табл. 1. Эксперимент 4. Противотревожное действие соединения 4 из табл. 1 в модели состояния тревоги,вызванного принудительным плаванием у крыс. В качестве животных используют самцов крыс SD весом 220-240 г (Charles River Japan Inc.). Крыс делят на группы по 10 животных в каждой группе. Группе крыс, которым вводят тестируемое соединение,подкожно вводят соединение, полученное растворением предопределенного количества соединения 4 из табл. 1 в физиологическом растворе для инъекций с добавлением 0,5 М водного раствора гидроксида натрия для доведения рН до 4-5. Через 30 мин после введения крыс заставляют плавать, помещая в черный цилиндр (внутренний диаметр 20 см, высотой 40 см), содержащий слой воды глубиной 25 см с температурой 25 С. Принудительное плавание продолжают в течение 2 мин, снижающее тревогу действие изучают с помощью тестирования в приподнятом крестообразном лабиринте, которое проводят через 5 мин после принудительного плавания. Приподнятый крестообразный лабиринт для тестирования состоит из открытых ворот (10 см шириной, 50 см длиной) и закрытых ворот (10 см шириной, 50 см длиной), и открытые ворота и закрытые ворота покрывают прозрачным плексигласом высотой 1 см и 40 см, соответственно. Лабиринт помещают на высоте 50 см от пола. Освещение в центре лабиринта составляет 40 лк. Каждую крысу помещают в центр крестообразного лабиринта мордой к одним из закрытых ворот. Количество времени, потраченное на открывание ворот в лабиринте, записывают в течение 5 мин. Результаты показаны в табл. 3. Символна фиг. 3 показывает, что при определении значительного различия согласно тесту Даннетта р 0,01 означает, что имеется значительное различие по сравнению с контрольной группой, которую не подвергали принудительному плаванию. Символна фиг. 3 показывает, что при определении значительного различия согласно тесту Даннетта р 0,01 означает, что имеется значительное различие по сравнению с контрольной группой, которую подвергали принудительному плаванию при введении физиологического раствора. Как очевидно из результатов, показанных на фиг. 3, количество времени, потраченного на открывание ворот в группе, которую подвергали принудительному плаванию, значительно снижается по сравнению с группой, которую не подвергали принудительному плаванию. Однако снижение времени, необхо-25 005737 димого для открывания ворот, значительно, дозозависимо было антагонизировано подкожным введением 0,3, 1 или 3 мг/кг соединения 4 из табл. 1. Эксперимент 5. Антидепрессивное действие соединения 4 из табл. 1 у крыс с удаленной обонятельной луковицей. В качестве животных используют самцов крыс SD весом 220-240 г (Charles River Japan Inc.). Крыс анестезируют пентобарбиталом натрия, обонятельные луковицы удаляют отсасыванием, используя металлическую трубку, соединенную с водяным насосом. Через 2 недели после удаления обонятельных луковиц крыс делят на группы по 10-11 животных в каждой группе. Группе крыс, которым вводят тестируемое лекарство, 1 раз в день в течение 2 недель подкожно вводят тестируемое соединение, полученное растворением определенного количества соединения 4 из табл. 1 в физиологическом растворе для инъекций, с добавлением 0,5 М водного раствора гидроксида натрия для доведения рН до 4-5. Через 24 ч после введения крыс помещают в центр круглого аппарата с открытым полем (25 блоков, диаметром 70 см) и считают количество переходов из блока в блок в течение 3 мин. Результаты показаны на фиг. 4. Символна фиг. 4 показывает, что при определении значительного различия согласно тесту Даннетта р 0,01 означает, что имеется значительное различие по сравнению с контрольной группой, которой не удаляли обонятельные луковицы. Символна фиг. 4 показывает, что при определении значительного различия согласно тесту Даннетта р 0,01 означает, что имеется значительное различие по сравнению с контрольной группой, которой удалили обонятельную луковицу и которой вводили физиологический раствор. Как очевидно из результатов, показанных на фиг. 4, количество переходов между блоками в открытом аппарате у крыс, которым удалили обонятельную луковицу, значительно повышается по сравнению с группой, которой не удаляли обонятельную луковицу. Однако увеличение числа переходов между блоками в аппарате с открытым полем значительно, дозозависимо было антагонизировано подкожным введением 1, 3 или 10 мг/кг соединения 4 из табл. 1. Исходя из представленных выше результатов, можно утверждать, что соединения, являющиеся антагонистами МК 4 рецептора, могут быть использованы в качестве терапевтических агентов для лечения депрессии или тревоги благодаря их ингибирующему действию на подобные тревожным и депрессивные симптомы. Краткое описание фигур На фиг. 1 показаны результаты тестирования действия, подобного анксиогенному, у крыс, полученные тестированием по Вогелю в эксперименте 2; на фиг. 2 показаны результаты противотревожного действия у крыс, полученные тестированием по Вогелю в эксперименте 3; на фиг. 3 показаны результаты тестирования противотревожного действия в модели состояния тревоги, вызванного принудительным плаванием у крыс в эксперименте 4; на фиг. 4 показаны результаты антидепрессивного действия у крыс с удаленной обонятельной луковицей в эксперименте 5. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Терапевтический препарат для лечения невроза страха (тревоги) или депрессии, который содержит антагонист рецептора МК 4 в качестве эффективного ингредиента. 2. Терапевтический препарат для лечения невроза страха или депрессии по п.1, в котором антагонистом рецептора МК 4 является производное пиперазина, представленное формулой [1][где Аr1 является фенильной группой, замещенной фенильной группой, нафтильной группой или замещенной нафтильной группой; Аr2 является нафтильной группой, замещенной нафтильной группой, хинолильной группой, группой, представленной формулой(где R4 является атомом водорода или атомом галогена и X-Y является CH-NH, СН-O, CH-S или N-O) или группой, представленной формулой(где R5 является атомом водорода, гидроксильной группой или C1-10 алкоксигруппой); R1 является атомом водорода, C1-10 алкильной группой, С 3-8 циклоалкильной группой, С 3-10 алкенильной группой, фенильной группой, 1-цианоэтильной группой, пиримидин-2-ильной группой или амидильной группой; R2 и R3 являются одинаковыми или разными и каждый является атомом водорода или C1-10 алкильной группой; А-В является N-CH2, СН-СН 2, С(ОН)-СН 2 или С=СН; Т 1 является одинарной связью, -N(R6)- (где R6 является атомом водорода или C1-10 алкильной группой), -О-, -СН=СН- или -С(=O)-; n является целым числом от 1 до 10, если Т 1 является одинарной связью, -СН=СН- или -С(=O)-, и n является целым числом от 2 до 10, если Т 1 является -N(R6)- или -О-], или его фармацевтически приемлемая соль. 3. Терапевтический препарат для лечения невроза страха или депрессии по п.2, в котором в формуле [1] Аr1 является фенильной группой или замещенной фенильной группой; Аr2 является нафтильной группой или замещенной нафтильной группой. 4. Терапевтический препарат для лечения невроза страха или депрессии по п.2, в котором в формуле [1] Аr1 является фенильной группой или замещенной фенильной группой; Аr2 является нафтильной группой или замещенной нафтильной группой; R1 является атомом водорода, C1-10 алкильной группой или С 3-8 циклоалкильной группой; R2 и R3 каждый является атомом водорода; А-В является N-СН 2 или СН-СН 2; Т 1 является одинарной связью. 5. Терапевтический препарат для лечения невроза страха или депрессии по любому из пп.2-4, в котором замещенная фенильная группа является фенильной группой, которая замещена от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу,бензилоксигруппу, гидроксильную группу, атом галогена, нитрогруппу, аминогруппу, аминогруппу, замещенную одной или двумя C1-6 алкильными группами, трифторметильную группу, цианогруппу, карбамоильную группу и фенильную группу; и замещенная нафтильная группа является нафтильной группой, замещенной от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, гидроксильную группу, C1-5 алкоксикарбонилметоксигруппу, карбамоилметоксигруппу, атом галогена, аминогруппу и аминогруппу, замещенную одной или двумя C1-6 алкильными группами. 6. Терапевтический препарат для лечения невроза страха или депрессии по п.2, в котором в формуле [1] Аr1 является фенильной группой или замещенной фенильной группой; Аr2 является группой, представленной формулой(где R5 является атомом водорода, гидроксильной группой или C1-10 алкоксигруппой); R1 является атомом водорода, C1-10 алкильной группой или С 3-8 циклоалкильной группой; R2 и R3 каждый является атомом водорода; А-В является N-CH2 или СН-СН 2; и Т 1 является одинарной связью. 7. Терапевтический препарат для лечения невроза страха или депрессии по п.6, в котором замещенная фенильная группа является фенильной группой, которая замещена от 1 до 3 заместителями, произвольно выбранными из группы, включающей C1-10 алкильную группу, C1-10 алкоксигруппу, бензилоксигруппу, гидроксильную группу, атом галогена, нитрогруппу, аминогруппу, аминогруппу, замещенную одной или двумя C1-6 алкильными группами, трифторметильную группу, цианогруппу, карбамоильную группу и фенильную группу.
МПК / Метки
МПК: C07D 295/12, A61P 25/24, A61K 45/00
Метки: препарат, невроза, тревоги, лечения, страха, терапевтический, депрессии
Код ссылки
<a href="https://eas.patents.su/29-5737-terapevticheskijj-preparat-dlya-lecheniya-nevroza-straha-trevogi-ili-depressii.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтический препарат для лечения невроза страха (тревоги) или депрессии</a>