Применение n-замещенных 1,5-дидезокси-1,5-имино-d-глюцитных производных для лечения инфекций, вызываемых вирусами гепатита
Номер патента: 4705
Опубликовано: 24.06.2004
Авторы: Пэртис Ричард А., Мюллер Ричард А., Брайант Мартин Л.
Формула / Реферат
1. Способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, включающий введение млекопитающему антивирусной композиции, характеризующийся тем, что в указанной композиции содержится только глюкаминовое соединение или его фармацевтически приемлемая соль в количестве, эффективном в отношении вируса гепатита, и состоящее по меньшей мере из одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли
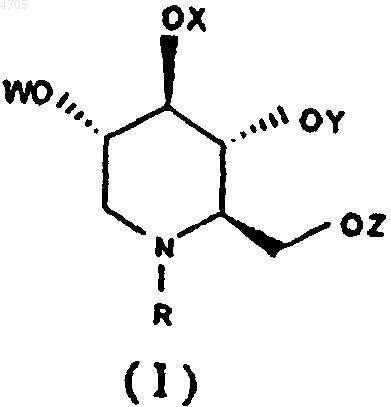
где R выбирают из группы, включающей алкил с прямой цепью длиной C7-C20, алкил с разветвленной цепью с длиной основной цепи C3-C20, алкоксиалкил, арилалкил с вышеуказанным числом атомов углерода в алкильной части для алкоксиалкила, а для арилалкила число атомов углерода в арильной части составляет от C6 до C18, а алкильная часть имеет длину цепи от C1 до C20, циклоалкил, содержащий от C3 до C12, W, X, Y и Z, каждый независимо друг от друга, выбирают из группы, включающей атом водорода, алканоил с длиной цепи от C1 до C20, ароил, арильная часть которого составляет от C6 до C18, и трифторалканоил.
2. Способ по п.1, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает атом водорода.
3. Способ по п.1, где R обозначает нонил.
4. Способ по п.1, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от C1 до C20.
5. Способ по п.4, где R обозначает нонил.
6. Способ по п.5, где алканоил представляет собой бутаноил.
7. Способ по п.1, где N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное производное выбирают из группы, включающей
N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октадецил)-1,5 -дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(7-метилоктил)-1,5 -дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетраацетат N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетраацетат N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит и
N-(7,10,13-триокса-н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит.
8. Способ по п.1, где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат.
9. Способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, включающий введение млекопитающему антивирусной композиции, содержащей эффективное в отношении вируса количество по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли
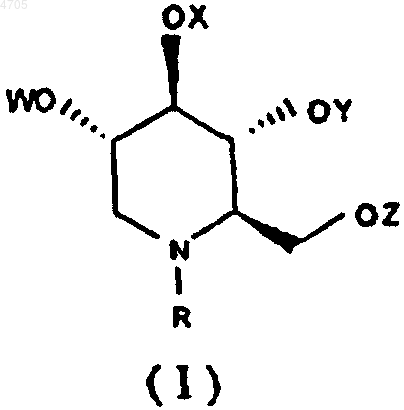
где R выбирают из группы, включающей алкил с прямой цепью длиной C7-C20, алкил с разветвленной цепью с длиной основной цепи C3-C20, алкоксиалкил, арилалкил и циклоалкилалкил, а W, X, Y и Z, каждый независимо друг от друга, выбирают из группы, включающей атом водорода, алканоил, ароил и трифторалканоил, где количесттр атомов углерода определены в п.1, без введения антивирусного агента, выбранного из группы, включающей нуклеозид, нуклеотид, иммуномодулятор или иммуностимулятор.
10. Способ по п.9, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает атом водорода.
11. Способ по п.10, где R обозначает нонил.
12. Способ по п.9, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от C1 до C20.
13. Способ по п.12, где R обозначает нонил.
14. Способ по п.13, где алканоил представляет собой бутаноил.
15. Способ по п.9, где N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное производное выбирают из группы, включающей
N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетраацетат N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетраацетат N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит и
N-(7,10,13-триокса-н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит.
16. Способ по п.9, где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат.
17. Фармацевтическая композиция, включающая эффективное количество в отношении вируса гепатита по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли
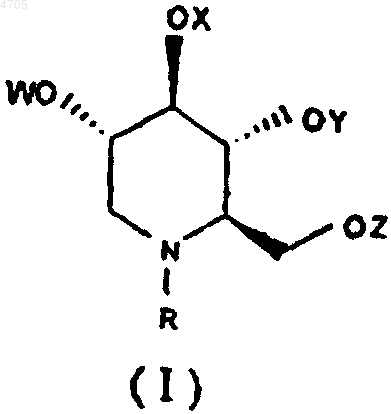
где R выбирают из группы, включающей алкил с прямой цепью длиной C7-C20, алкил с разветвленной цепью с длиной основной цепи C3-C20, алкоксиалкил, арилалкил с вышеуказанным числом атомов углерода в алкильной части для алкоксиалкила, а для арилалкила число атомов углерода в арильной части составляет от C6 до C18, а алкильная часть имеет длину цепи от C1 до C20, циклоалкил, содержащий от C3 до C12, W, X, Y и Z, каждый независимо друг от друга, выбирают из группы, включающей атом водорода, алканоил с длиной цепи от C1 до C20, ароил, арильная часть которого составляет от C6 до C18, и трифторалканоил и фармацевтически приемлемый носитель, эксципиент или разбавитель.
18. Фармацевтическая композиция по п.17, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает атом водорода.
19. Фармацевтическая композиция по п.18, где R обозначает нонил.
20. Фармацевтическая композиция по п.17, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от C1 до C20.
21. Фармацевтическая композиция по п.20, где R обозначает нонил.
22. Фармацевтическая композиция по п.21, где алканоил представляет собой бутаноил.
23. Фармацевтическая композиция по п.17, где N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное производное выбирают из группы, включающей
N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетраацетат N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетраацетат N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит и
N-(7,10,13-триокса-н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит.
24. Фармацевтическая композиция по п.17, где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат.
25. Фармацевтическая композиция, включающая эффективное количество в отношении вируса гепатита по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли
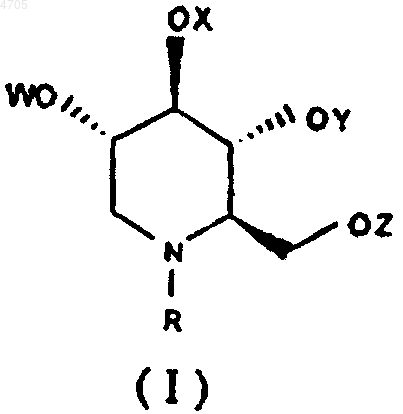
где R выбирают из группы, включающей алкил с прямой цепью длиной C7-C20, алкил с разветвленной цепью с длиной основной цепи C3-C20, алкоксиалкил, арилалкил с вышеуказанным числом атомов углерода в алкильной части для алкоксиалкила, а для арилалкила число атомов углерода в арильной части составляет от C6 до C18, а алкильная часть имеет длину цепи от C1 до C20, циклоалкил, содержащий от C3 до C12, W, X, Y и Z, каждый независимо друг от друга, выбирают из группы, включающей атом водорода, алканоил с длиной цепи от C1 до C20, ароил, арильная часть которого составляет от C6 до C18, и трифторалканоил и фармацевтически приемлемый носитель, эксципиент или разбавитель, и не содержащая любой антивирусный агент, выбранный из группы, включающей нуклеозид, нуклеотид, иммуномодулятор или иммуностимулятор.
26. Фармацевтическая композиция по п.25, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает атом водорода.
27. Фармацевтическая композиция по п.26, где R обозначает нонил.
28. Фармацевтическая композиция по п.25, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от C1 до C20.
29. Фармацевтическая композиция по п.28, где R обозначает нонил.
30. Фармацевтическая композиция по п.29, где алканоил представляет собой бутаноил.
31. Фармацевтическая композиция по п.25, где N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное производное выбирают из группы, включающей
N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-октадецил)-1,5-дидезоксш-1,5-имино-D-глюцит,
N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(н-гептил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-ундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-додецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тридецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-пентадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гексадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-гептадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-октадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-нонадецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(н-эйкозил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(2-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-этилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(5-метилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-пропилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-пентилпентилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-бутилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(7-метилоктил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(8-метилнонил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(9-метилдецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(10-метилундецил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-циклогексилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(4-циклогексилбутил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(2-циклогексилэтил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-циклогексилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(1-фенилметил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(3-(4-метил)фенилпропил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетрабутират N-(6-фенилгексил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетрабутират N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
тетраацетат N-(7-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(9-окса-н-децил)-1,5-дидезокси-1,5-имино-D-глюцит,
N-(7-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит,
тетраацетат N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита,
N-(3-окса-н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит и
N-(7,10,13-триокса-н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит.
32. Фармацевтическая композиция по п.25, где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат.
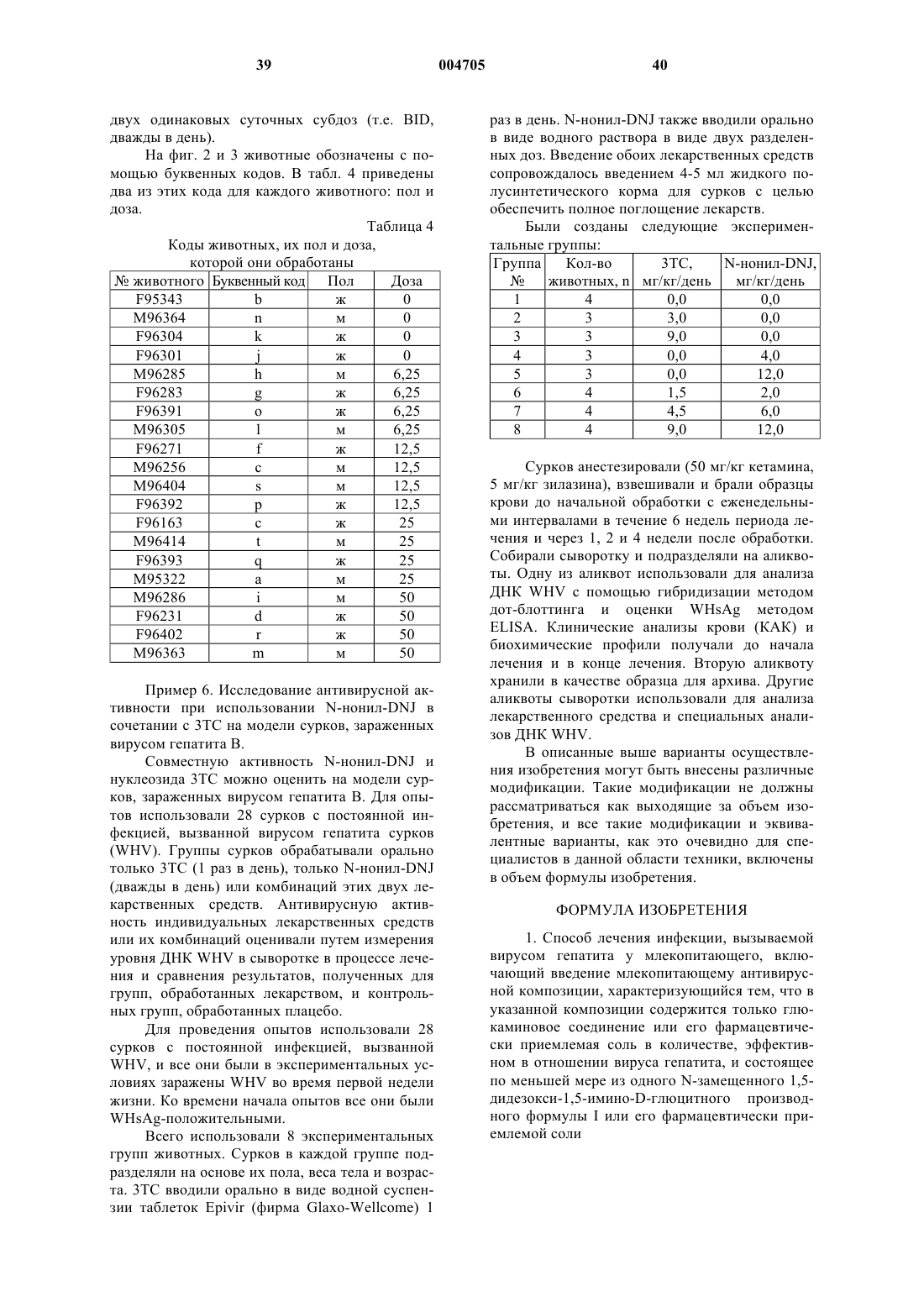
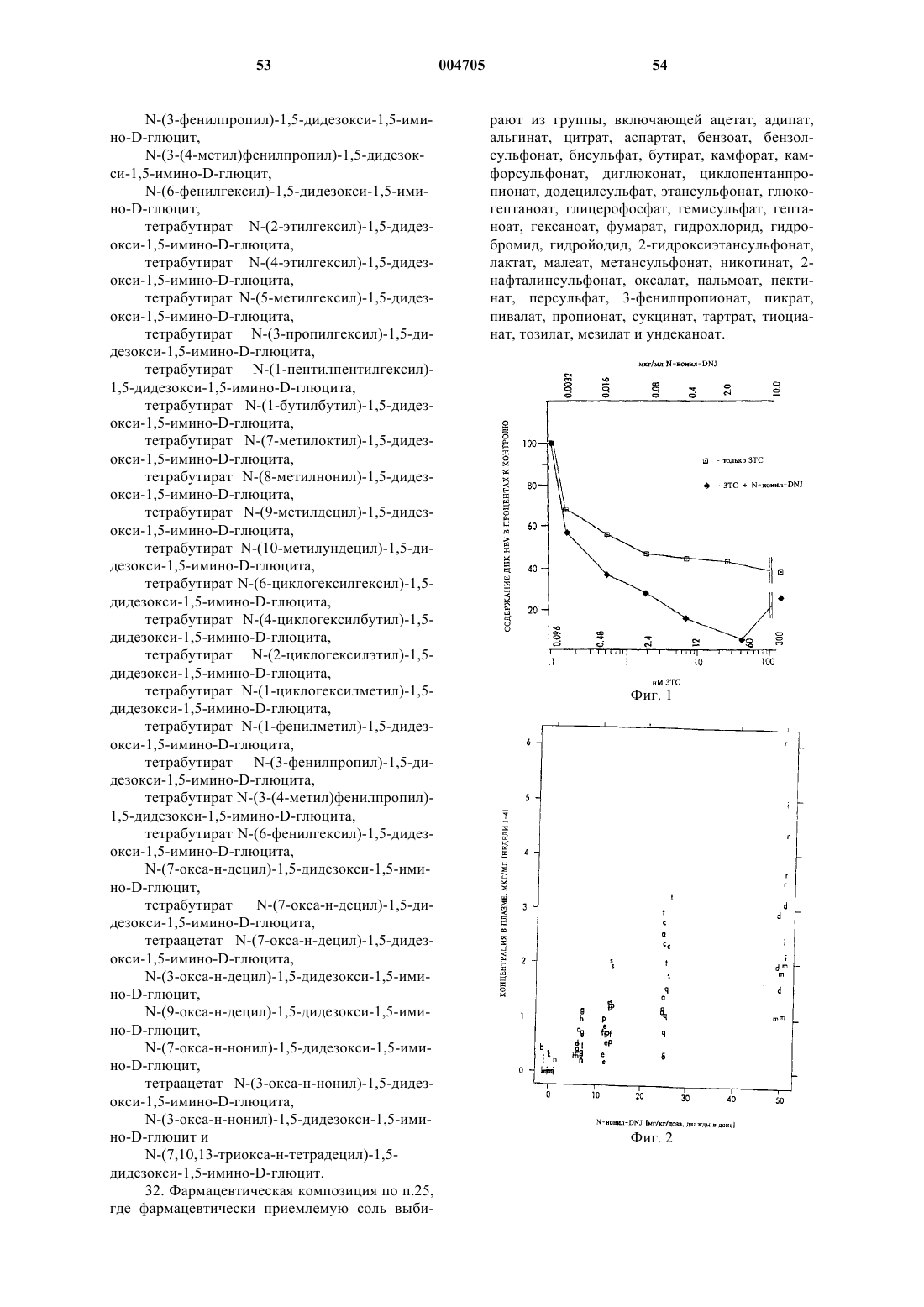
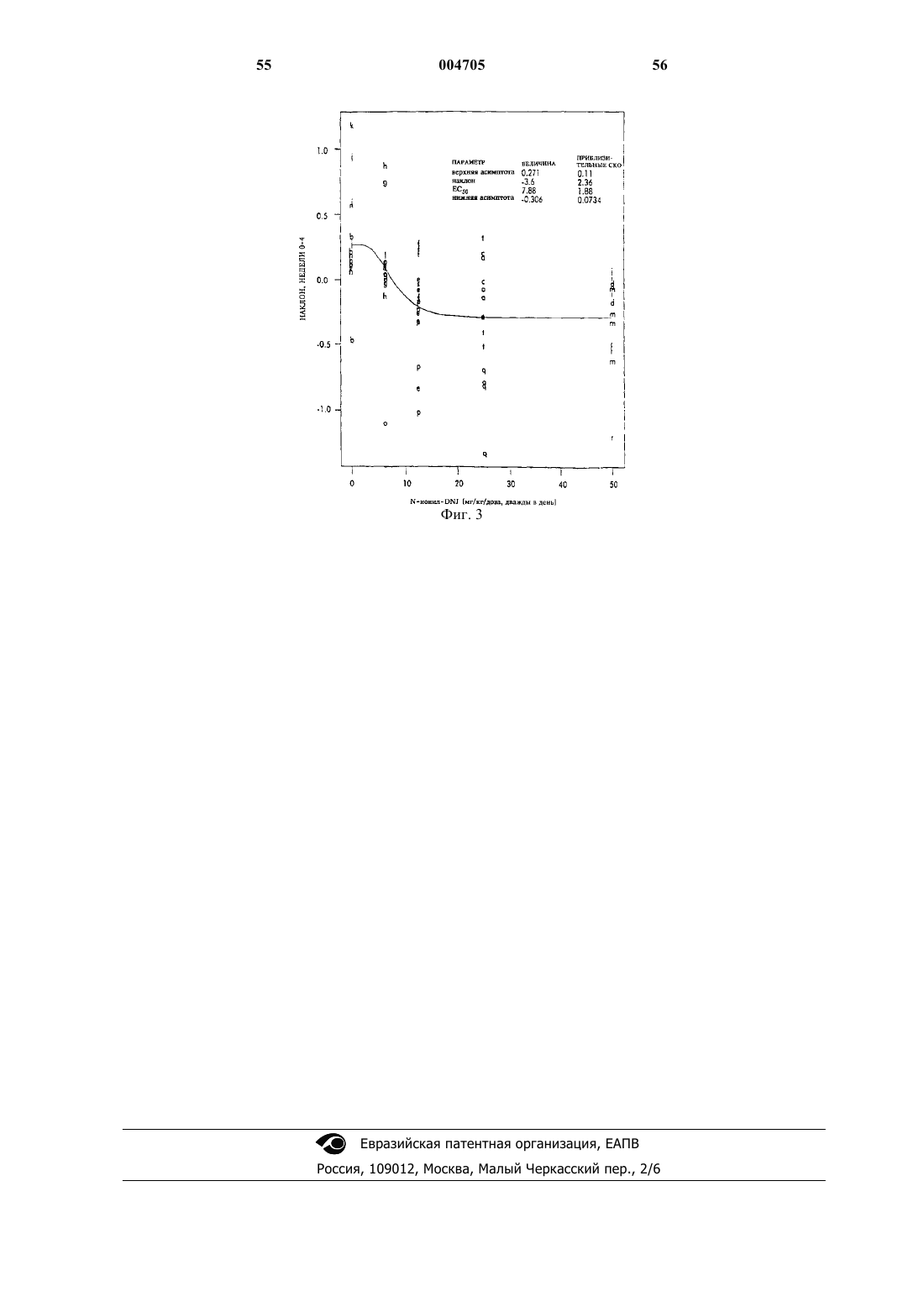
Текст
1 Данные о родственной заявке По настоящей заявке испрашивается приоритет по предварительной заявке на патент США 60/074508, поданной 12 февраля 1998 г. Настоящая заявка также является частичным продолжением заявки на патент США 09/023401, поданной 12 февраля 1998 г. Содержание каждой из этих заявок в полном объеме включено в настоящее описание в качестве ссылки. Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к способам и к композициям, предназначенным для лечения инфекций, вызываемых вирусами гепатита, прежде всего инфекций, вызываемых вирусом гепатита В у млекопитающих, главным образом у людей. Указанные способы предусматривают (1) введение N-замещенных 1,5 дидезокси-1,5-имино-D-глюцитных производных индивидуально или в сочетании с нуклеозидными антивирусными агентами, нуклеотидными антивирусными агентами, их смесями или иммуномодулирующими/иммуностимулирующими агентами или (2) введение N-замещенных 1,5-дидезокси-1,5-имино-D-глюцитных производных индивидуально или в сочетании с нуклеозидными антивирусными агентами, нуклеотидными антивирусными агентами или их смесями и иммуномодулирующими/иммуностимулирующими агентами. Такие комбинации агентов против вирусов гепатита проявляют неожиданную эффективность в отношении ингибирования репликации и выделения вирусов в клетках млекопитающих, зараженных этими вирусами. Описание известного уровня техники Вирусы гепатита Вирус гепатита В (HBV, НерВ) является возбудителем острого и хронического заболевания печени, включая фиброз печени, цирроз,воспалительное заболевание печени и рак печени, которые могут привести к смерти пациентов(Joklik Wolfgang K., Virology, 3-е изд. AppletonLange, Norwalk, Connecticut, 1988 (ISBN 08385-9462-Х. Хотя в настоящее время существуют эффективные вакцины, все еще более 300 миллионов людей в мире, т.е. 5% населения Земного шара, хронически инфицированы вирусом (Locarnini S.A. и др., Antiviral ChemistryChemotherapy 7(2): 53-64 (1996. Такие вакцины не оказывают терапевтического действия на людей, уже зараженных вирусом. В Европе и Северной Америке заражено от 0,1 до 1% населения. Установлено, что у 15-20% пораженных вирусом людей развивается цирроз или другая хроническая форма нарушения трудоспособности в результате HBV-инфекции. При возникновении цирроза печени болезненное состояние и смерть являются практически неизбежными примерно после 5-летнего периода (Blume Н.Е. 2 и др., Advanced Drug Delivery Reviews 17: 321331 (1995. Вследствие этого разработка улучшенных и эффективных терапевтических средств, эффективных в отношении вирусов гепатита, в том числе HBV, является необходимой и исключительно важной задачей (LocarniniS.A. и др., Antiviral ChemistryChemotherapy 7(2): 53-64 (1996. Другие вирусы гепатита, важные в качестве возбудителей болезней человека, включают вирусы гепатита А, гепатита В, гепатита С, гепатита дельта, гепатита Е, гепатита F и гепатитаG (Coates J.A.V. и др., Exp. Opin. Ther. Patents 5(8): 747-756 (1995. Кроме того, известны также вирусы гепатита животных, которые обладают видоспецифичностью. Они включают, например, вирусы, поражающие уток, сурков и мышей. 1,5-Дидезокси-1,5-имино-D-глюцитные производные 1,5-Дидезокси-1,5-имино-D-глюцит (также известный как 1-дезоксинойиримицин, DNJ) и его N-алкильные производные (вместе обозначенные как "иминосахара") являются известными ингибиторами участвующих в превращенииBiol. Chem. 257: 14155-14161 (1982); Elbein,Ann. Rev. Biochem. 56: 497-534 (1987. В качестве аналогов глюкозы они также являются потенциальными ингибиторами транспорта глюкозы, глюкозилтрансфераз и/или синтеза гликолипидов (Newbrun и др., Arch. Oral Biol. 28: 516536 (1983); Wang и дp., Tetrahedron Lett. 34: 403406 (1993. С учетом их ингибирующей активности в отношении глюкозидаз были получены такие соединения, которые являются антигипергликемическими агентами и антивирусными агентами (см., например, WO 87/03903, US 4065562, US 4182767, US 4533668, US 4639436,US 4849430, US 4957926, US 5011829 и US 5030638). Было установлено, что ингибиторы глюкозидаз, такие как N-алкил-1,5-дидезокси-1,5 имино-D-глюцитные производные, в которых алкильная группа содержит от 3 до 6 атомов углерода, обладают эффективностью при лечении инфекций, вызываемых вирусами гепатитаB (WO 95/19172). Так, например, для этой цели эффективенSci. USA 91: 2235-2239 (1994); Ganem В. Chemtracts: Organic Chemistry 7(2) 106-107 (1994. NБутил-DNJ также исследован в качестве агента против ВИЧ-1-инфекции на ВИЧ-инфицированных пациентах, и было установлено, что он хорошо переносится больными. Другой ингибитор альфа-глюкозидазы дезоксинойиримицин (DNJ) является потенциальным антивирусным агентом при применении совместно с N(фосфоноацетил)-L-аспарагиновой кислотой(PAI.A) (WO 93/18763). Однако ранее не было описано или не предполагалось применение комбинацийN-замещенных имино-Dглюцитных производных и других антивирусных агентов для лечения инфекций, вызываемых вирусами гепатита. На основе результатов,полученных при моделировании инфекции, вызываемой вирусом гепатита, на животном, таком как сурок, Block и др. (Nature Medicine 4(5): 610-614 (1998 было высказано предположение,что такие ингибиторы глюкозидазы, как Nнонил-DNJ, которые воздействуют на определенные стадии пути N-связанного гликозилирования гликопротеинов вируса гепатита, вследствие их влияния на процесс гликозилирования могут использоваться в качестве веществ, оказывающих терапевтическое воздействие на вирус гепатита В. Нуклеозидные и нуклеотидные антивирусные агенты Ингибиторы обратной транскриптазы,включая класс нуклеозидных и нуклеотидных аналогов, впервые были разработаны в качестве лекарственных средств, предназначенных для лечения болезней, вызываемых ретровирусами,такими как вирус иммунодефицита человека(ВИЧ), возбудитель СПИДа. С помощью проведенного на вирусах скрининга и с использованием стратегий химической модификации выявляется все более широкий спектр активности этих соединений в отношении других вирусов,включая как РНК-овые, так и ДНК-овые вирусы. Антивирусная активность нуклеозидных и нуклеотидных аналогов проявляется в ингибировании соответствующих ДНК- и РНКполимераз, ответственных за синтез вирусной ДНК и РНК соответственно. Поскольку вирусы содержат разные формы полимераз, одно и то же нуклеозидное/нуклеотидное производное может обладать абсолютно различным действием в отношении разных вирусов. Так, например,ламивудин (3 ТС), вероятно, является эффективным в отношении HBV-инфекции, в то время как зидовудин (AZT), вероятно, обладает низкой эффективностью в отношении этого вируса (Gish R.G. и др., Exp. Opin. Invest. Drugs 4(2): 95-115 (1995. Некоторые нуклеозидные антивирусные аналоги обладают выраженной токсичностью. Так, например, клинические испытания нуклеозидного аналога фиалуридина (FIAU) в качестве агента для лечения хронического гепатита В в настоящее время приостановлены из-за связанного с лекарством повреждения печени, повлекшего за собой смерть нескольких пациентов. Таким образом, все еще существует потребность в разработке безопасных режимов лечения заболеваний гепатитом В и другими формами гепатита (Mutchnick M.G. и др., Antiviral Research 24: 245-257 (1994. 4 Иммуномодуляторы и иммуностимуляторы Иммуномодуляторы/иммуностимуляторы,такие как альфа-интерферон и другие цитокины,применялись для лечения HBV-инфекции с многообещающими результатами. К сожалению, полученный эффект оказался ниже ожидаемого. Лечение гепатита В с помощью интерферона в настоящее время одобрено Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств(FDA) при Министерстве торговли США. В настоящее время продолжается исследование других оказывающих воздействие на иммунную систему потенциальных лекарственных средств. Они включают относящиеся к вилочковой железе пептиды, предназначенные для лечения хронического гепатита В (СНВ), изопринозин, стероиды, образующие основания Шиффа производные салицилальдегидов, такие как тукарезол,левамизол и т.п. (Gish R.G. и др., Exp. Opin. Invest. Drugs 4(2): 95-115 (1995); Coates J.A.V. и др., Exp. Opin. Ther. Patents 5(8): 747-765(1995. Краткое изложение сущности изобретения Как уже отмечалось выше, применение Nзамещенных имино-D-глюцитных соединений и их производных, представленных в настоящем описании, индивидуально или в сочетании с другими соединениями, обладающими активностью в отношении вирусов гепатита, по известным заявителям данным ранее никогда не предлагалось и не было описано. Применение двух или большего количества антивирусных агентов с целью повышения эффективности лечения инфекций, вызываемых вирусом гепатита В,является актуальным в связи с распространенностью заболевания и высокой смертностью. Совместная терапия также является актуальной,поскольку она должна уменьшить токсическое воздействие на пациентов, позволяя лечащему врачу применять более низкие дозы одного или нескольких лекарственных средств, которые назначены пациенту. Совместная терапия также может способствовать предупреждению развития у пациентов устойчивости к лекарствам(Wiltink E.H.H., Pharmaceutish Weekblads Scientific Edition 14 (4A): 268-274 (1992. В результате улучшенной эффективности в сочетании с относительным уменьшением токсичности и снижением возможности развития устойчивости создается в значительной степени улучшенный профиль лечения лекарственными средствами. При создании изобретения неожиданно установлено, что применение представленных в настоящем описании N-замещенных 1,5-дидезокси-1,5-имино-D-глюцитных производных эффективно для лечения инфекций, вызываемых вирусами гепатита. Кроме того, применение этих соединений в сочетании с нуклеозидными или нуклеотидными антивирусными соединениями или с их комбинацией и/или с иммуномодулирующими/иммуностимулирую 5 щими агентами приводит к неожиданно более высокой эффективности этих соединений в отношении вирусов гепатита по сравнению с ожидаемой суммарной активностью индивидуальных соединений при их применении по отдельности. В настоящее время остается неясным,является ли это результатом различных механизмов действия различных классов лекарственных средств или связано с каким-то другим биологическим явлением. Таким образом, первым объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, предусматривающий введение млекопитающему эффективного в отношении вируса гепатита количества по меньшей мере одногоN-замещенного 1,5-дидезокси-1,5-имино-Dглюцитного производного формулы I или его фармацевтически приемлемой соли: где R выбирают из группы, включающей алкил с прямой цепью длиной от С 7 до С 20, алкил с разветвленной цепью при длине основной цепи от C3 до С 20, алкоксиалкил, арилалкил и циклоалкилалкил и где W, X, Y и Z каждый независимо друг от друга выбирают из группы, включающей атом водорода, алканоил, ароил и трифторалканоил. Вторым объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, предусматривающий введение млекопитающему антивирусной композиции, которая включает эффективное в отношении вируса количество по меньшей мере одного N-замещенного 1,5 дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше. Третьим объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего,предусматривающий введение млекопитающему антивирусной композиции, которая включает главным образом эффективное в отношении вируса количество по меньшей мере одного Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше. Четвертым объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего,предусматривающий главным образом введение млекопитающему эффективного в отношении 6 вируса количества по меньшей мере одного Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше. Пятым объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, предусматривающий, главным образом, введение млекопитающему эффективного в отношении вируса количества антивирусного соединения,главным образом, представляющего собой по меньшей мере одно N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное производного формулы I или его фармацевтически приемлемую соль, как они описаны выше. Шестым объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего,предусматривающий, главным образом, введение млекопитающему эффективного в отношении вируса первого количества по меньшей мере одного N-замещенного 1,5-дидезокси-1,5 имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, и второго количества антивирусного соединения, выбранного из группы,включающей нуклеозидное антивирусное соединение, нуклеотидное антивирусное соединение, иммуномодулятор, иммуностимулятор и их смеси, где первое и второе количества этих соединений вместе представляют собой эффективное в отношении вируса гепатита количество этих соединений. Еще одним объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита В у млекопитающего,предусматривающий введение млекопитающему от примерно 0,1 до примерно 100 мг/кг/день по меньшей мере одного N-замещенного 1,5 дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, и от примерно 0,1 до примерно 500 мг/особь/день соединения, выбранного из группы, включающей нуклеозидное антивирусное соединение, нуклеотидное антивирусное соединение и их смесь. Другим объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита В у больного человека, предусматривающий введение больному человеку от примерно 0,1 до примерно 100 мг/кг/день Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного, выбранного из группы,включающейN-(н-нонил)-1,5-дидезокси-1,5 имино-D-глюцит или его фармацевтически приемлемую соль, тетрабутират N-(н-нонил)-1,5 дидезокси-1,5-имино-D-глюцита или его фармацевтически приемлемую соль и их смесь, и от примерно 0,1 до примерно 500 мг/человека/день 7 Следующим объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего,предусматривающий введение млекопитающему эффективного в отношении вируса количества по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, практически без введения антивирусной композиции, включающей нуклеозид, нуклеотид, иммуномодулятор или иммуностимулятор. Еще одним объектом настоящего изобретения является способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего,предусматривающий введение млекопитающему эффективного в отношении вируса количества по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, практически без введения антивирусных соединений, отличных от соединений формулы I. Далее, объектом настоящего изобретения является фармацевтическая композиция, включающая эффективное в отношении вируса количество по меньшей мере одного Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, и фармацевтически приемлемый носитель, эксципиент или разбавитель. Следующим объектом настоящего изобретения является фармацевтическая композиция,включающая главным образом эффективное в отношении вируса количество по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, и фармацевтически приемлемый носитель, разбавитель или эксципиент. Другим объектом настоящего изобретения является фармацевтическая композиция, включающая эффективное в отношении вируса количество по меньшей мере одного Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, практически не содержащая нуклеозид, нуклеотид, иммуномодулятор или иммуностимулятор и включающая фармацевтически приемлемый носитель, разбавитель или эксципиент. Еще одним объектом настоящего изобретения является фармацевтическая композиция,включающая эффективное в отношении вируса количество по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, практически не содержащая антивирусных соединений, отличных от соединений фор 004705 8 мулы I, и включающая фармацевтически приемлемый носитель, разбавитель или эксципиент. Объектом настоящего изобретения является далее фармацевтическая композиция, включающая по меньшей мере одно N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное производное формулы I или его фармацевтически приемлемую соль, как они описаны выше, и антивирусное соединение, выбранное из группы, включающей нуклеозидное антивирусное соединение, нуклеотидное антивирусное соединение, иммуномодулятор, иммуностимулятор и их смеси. Следующим объектом настоящего изобретения является фармацевтическая композиция,включающая первое количество по меньшей мере одного N-замещенного 1,5-дидезокси-1,5 имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, как они описаны выше, второе количество антивирусного соединения, выбранного из группы,включающей нуклеозидное антивирусное соединение, нуклеотидное антивирусное соединение, иммуномодулятор, иммуностимулятор и их смеси, и фармацевтически приемлемый носитель, разбавитель или эксципиент, где первое и второе количества этих соединений вместе представляют собой эффективное в отношении вируса количество этих соединений. Еще одним объектом настоящего изобретения является фармацевтическая композиция,предназначенная для лечения инфекции, вызываемой вирусом гепатита В у млекопитающего,включающая от примерно 0,1 мг до примерно 100 мг по меньшей мере одного N-замещенного 1,5-дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли, от примерно 0,1 мг до примерно 500 мг соединения, выбранного из группы, включающей нуклеозидное антивирусное соединение, нуклеотидное антивирусное соединение и их смеси, и фармацевтически приемлемый носитель, разбавитель или эксципиент. Следующим объектом настоящего изобретения является фармацевтическая композиция,предназначенная для лечения инфекции, вызываемой вирусом гепатита В у больного человека, включающая от примерно 0,1 мг до примерно 100 мг N-замещенного 1,5-дидезокси-1,5 имино-D-глюцитного производного, выбранного из группы, включающей N-(н-нонил)-1,5 дидезокси-1,5-имино-D-глюцит или его фармацевтически приемлемую соль, тетрабутират N(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита или его фармацевтически приемлемую соль и их смеси, от примерно 0,1 мг до примерно 500 мг(-)-2'-дезокси-3'-тиоцитидин-5'-трифосфата и фармацевтически приемлемый носитель, разбавитель или эксципиент. Еще одним объектом настоящего изобретения является соль, включающая N-замещенное 1,5-дидезокси-1,5-имино-D-глюцитное 9 производное формулы I, как оно описано выше,и соединение, выбранное из группы, включающей нуклеозид, несущий кислотный фрагмент,и нуклеотид. Следующим объектом настоящего изобретения является способ, предусматривающий взаимодействие N-(н-нонил)-1,5-дидезокси-1,5 имино-D-глюцита и (-)-2'-дезокси-3'-тиоцитидин-5'-трифосфата в солеобразующих условиях, а также полученная таким способом соль. Другие возможности применения настоящего изобретения рассмотрены в приведенном ниже подробном описании изобретения со ссылкой на прилагаемые чертежи. При этом предполагается, что приведенные ниже подробное описание изобретения и примеры, которые представляют собой предпочтительные варианты осуществления изобретения, приведены только с иллюстрaтивной целью, поскольку для специалистов в данной области на основе этого подробного описания должны быть очевидны различные изменения и модификации, не противоречащие сущности и объему изобретения. Краткое описание чертежей Другие задачи, отличительные особенности и преимущества изобретения более подробно рассмотрены ниже со ссылкой на прилагаемые чертежи, которые приведены только с иллюстративной целью и не ограничивают объем изобретения и на которых показано на фиг. 1 - данные об активности in vitro в отношении вируса гепатита В (-)-2'-дезокси-3'тиоцитидин-5'-трифосфата (3TC) одного и в сочетании с N-нонил-DNJ; на фиг. 2 - данные о концентрации в плазме N-нонил-DNJ в зависимости от дозы Nнонил-DNJ для каждого из животных, полученные, как описано в примере 5, для образцов,взятых в процессе лечения, при этом животные обозначены отдельными буквами, а с той целью, чтобы можно было отличить перекрывающиеся значения, к величинам доз добавлены небольшие случайные отклонения; и на фиг. 3 - данные о наклонах кривой зависимости Log (ИПДНК +10) от дозы, полученных в течение недели, при этом для обозначения каждого животного использована отдельная буква; аппроксимирующая кривая получена с помощью четырехпараметрического логарифмического уравнения; на графике показаны параметры аппроксимирующей кривой и среднеквадратичные ошибки, полученные при их аппроксимации. Подробное описание изобретения Приведенное ниже подробное описание изобретения предназначено для пояснения отличительных особенностей настоящего изобретения и адресовано в первую очередь специалистам в данной области техники с целью помочь при его практической реализации. Однако это подробное описание не следует рассматривать как ограничивающее объем изобретения, по 004705 10 скольку в описанные ниже варианты осуществления могут быть внесены различные, очевидные для специалистов модификации и изменения, не выходящие за объем изобретения. Содержание каждой из патентных публикаций и иных указанных в настоящем описании литературных источников, включая содержание других публикаций, процитированных в этих первичных материалах, в полном объеме включено в настоящее описание в качестве ссылки. Было установлено, что применение N-замещенных 1,5-дидезокси-1,5-имино-D-глюцитных производных является эффективным при использовании их индивидуально для лечения инфекций, вызываемых вирусами гепатита. Кроме того, было установлено, что комбинацииN-замещенных 1,5-дидезокси-1,5-имино-D-глюцитных производных с обладающими активностью в отношении вирусов гепатита нуклеозидами или нуклеотидами и/или иммуномодуляторами/иммуностимуляторами также эффективны для решения этой задачи. Получены данные о том, что определенные комбинации могут проявлять более высокую эффективность в отношении ингибирования репликации вирусов гепатита, чем суммарная эффективность, которая ожидалось при применении соединений по отдельности. Таким образом, настоящее изобретение относится к фармацевтическим композициям и способам лечения инфекций, вызываемых вирусом гепатита, прежде всего инфекций, вызываемых вирусами гепатита В, у людей, других млекопитающих и в клетках при использовании Nзамещенных 1,5-дидезокси-1,5-имино-Dглюцитных производных индивидуально или в сочетании с антивирусным нуклеозидом, антивирусным нуклеотидом, их смесями и/или иммуномодулятором или иммуностимулятором.N-замещенные 1,5-дидезокси-1,5-имино-Dглюцитные производные имеют основные атомы азота и могут использоваться в форме фармацевтически приемлемой соли. Нуклеозиды и нуклеотиды, которые могут применяться согласно настоящему изобретению, представляют собой замещенные пуриновые или пиримидиновые гетероциклы, дополнительно замещенные радикалом R1 в формулах II-VI в положении 9 в случае пуринов или радикалом R1 в положении 1 в случае пиримидинов. Иммуномодуляторы и иммуностимуляторы, которые могут применяться согласно настоящему изобретению, включают агенты, которые стимулируют иммунные реакции, эффективные для борьбы или уничтожения вирусов или других инфекционных агентов. Примеры таких иммуномодуляторов и иммуностимуляторов включают (но не ограничиваясь только ими) имицитокины, пептидные агонисты, стероиды и классические лекарственные средства, такие как левамизол. Комбинации лекарственных средств по изобретению могут применяться для лечения клетки 11 либо клеток, человека или другого больного млекопитающего либо в виде отдельных фармацевтически приемлемых композиций, которые вводятся одновременно или последовательно,либо в виде композиций, включающих более одного терапевтического агента, либо в виде набора композиций, содержащих отдельные агенты и несколько агентов. Независимо от особенностей применения эти комбинации лекарственных средств обеспечивают эффективное в отношении вирусов гепатита количество компонентов. В контексте настоящего описания понятие"эффективное в отношении вирусов гепатита количество" означает количество только Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцита или объединенное количество (1) N-замещенного 1,5-дидезокси-1,5-имино-D-глюцита и любого антивирусного нуклеозида, антивирусного нуклеотида, смеси антивирусного нуклеозида и антивирусного нуклеотида или иммуномодулятора/иммуностимулятора (или их смесей) или (2) объединенное количество Nзамещенного 1,5-дидезокси-1,5-имино-D-глюцита и антивирусного нуклеозида, антивирусного нуклеотида или их смеси, иммуномодулятора/иммуностимулятора (или их смесей), эффективное в отношении лечения инфекции, вызываемой вирусом гепатита. Антивирусная эффективность вышеуказанных комбинаций может быть основана на целом ряде различных механизмов, связанных с репликацией и сборкой вирусов. Такие механизмы могут включать, например, блокировку синтеза ДНК вируса гепатита, блокировку транскрипции вируса, блокировку сборки вируса, блокировку высвобождения или выделения вируса из зараженных клеток, блокировку или изменение функции протеинов вируса, включая функцию протеина(-ов) вирусной оболочки, и/или продуцирование незрелых или нефункционирующих по какимлибо иным причинам вирионов. Общее действие заключается в ингибировании репликации вируса и заражения дополнительных клеток и,следовательно, в ингибировании развития инфекции у пациента.N-замещенные 1,5-дидезокси-1,5-имино-Dглюцитные производные, которые могут применяться согласно настоящему изобретению,имеют строение, представленное ниже формулой I: где R выбирают из группы, включающей алкил с прямой цепью длиной от С 7 до С 20, предпоч 004705 12 тительно от C8 до С 20, преимущественно от C8 до С 16, более предпочтительно от C8 до С 12, еще более предпочтительно от C8 до С 10 и наиболее предпочтительно С 9, алкил с разветвленной цепью с длиной основной цепи C3-C20, предпочтительно С 3-С 16, более предпочтительно C3-C14,еще более предпочтительно С 4-С 12 и преимущественно С 6-С 12 и наиболее предпочтительно C8 С 10, алкоксиалкил, арилалкил и циклоалкилалкил, W, X, Y и Z каждый независимо друг от друга выбирают из группы, включающей атом водорода, алканоил, ароил и трифторалканоил. Понятие "в основной цепи" относится к наиболее длинной прилегающей или соседней цепи атомов углерода, которая начинается с места присоединения разветвленной цепи алкильной группы к атому азота в соединениях формулы I. Понятие "алкокси" и "алкилокси" означает линейные или разветвленные кислородсодержащие радикалы, каждый из которых включает алкильные части, содержащие от 1 до примерно 10 атомов углерода. Алкоксиалкильные группы("алкилэфирные" или "окса"производные) согласно настоящему изобретению могут иметь длину цепи C3-C20, предпочтительно С 4-С 18, более предпочтительно C5-C16, еще более предпочтительно С 6-С 12 и наиболее предпочтительно С 8-С 12, где от 1 до 5 неконцевых атомов углерода, предпочтительно 1-3 неконцевых атома углерода, более предпочтительно 1-2 неконцевых атома углерода, наиболее предпочтительно 1 неконцевой атом углерода может быть замещен кислородом. Понятие "арил" индивидуально или в сочетании с другим радикалом означает карбоциклическую ароматическую систему, содержащую 1, 2 или 3 кольца, причем такие кольца могут быть соединены друг с другом в виде боковых цепей или могут быть сконденсированы. Под понятие "арил" подпадают ароматические радикалы, такие как фенил, нафтил, тетрагидронафтил, индил и бифенил. Понятие "арилалкил" означает замещенные арилом алкильные радикалы, такие как бензил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил. Понятие "циклоалкил" означает насыщенные карбоциклические радикалы, имеющие от 3 до примерно 12 атомов углерода. Более предпочтительными циклоалкильными радикалами являются "(низш.)циклоалкильные" радикалы,имеющие от 3 до примерно 8 атомов углерода. Примеры таких радикалов включают циклопропил, циклобутил, циклопентил и циклогексил."Циклоалкилалкил" означает алкильную группу,замещенную циклоалкильной группой. Понятие "ацил" означает радикал, который представляет собой фрагмент, полученный после удаления гидроксильной группы из органической кислоты. Примеры таких ацильных радикалов включают алканоильные и ароильные 13 радикалы. "Алканоил" означает алканкарбонил с разветвленной или прямой цепью длиной С 1 С 20, предпочтительно С 1-С 10, более предпочтительно С 1-С 5, "ароил" означает арилкарбонил, и"трифторалканоил" означает алканоил, содержащий 3 атома фтора в качестве заместителей. Примеры таких алканоильных радикалов включают формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и остатки янтарной, гликолевой, глюконовой, молочной, яблочной, винной, лимонной,аскорбиновой, глюкуроновой, малеиновой, фумаровой, пировиноградной, миндальной, пантотеновой, -гидроксимасляной, галактаровой и галактуроновой кислот. При использовании в сочетании с другим радикалом для обозначения иминосахаров, которые могут применяться согласно настоящему изобретению, понятие "алкил" означает углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до примерно 20 атомов углерода, предпочтительно от 1 до примерно 16 атомов углерода, более предпочтительно от примерно 2 до примерно 12 атомов углерода,наиболее предпочтительно от примерно 3 до примерно 10 атомов углерода. Под понятие "алкенил" подпадают радикалы, имеющие "цис"- и "транс"-ориентации или в альтернативном варианте"Z"ориентации. Понятие "алкинил" означает линейные или разветвленные радикалы, имеющие по меньшей мере одну тройную связь углеродуглерод и включающие от 2 до примерно 20 атомов углерода или предпочтительно от 2 до примерно 12 атомов углерода. Более предпочтительными алкинильными радикалами являются"(низш.)алкинильные" радикалы, имеющие от 2 до примерно 6 атомов углерода. Примеры алкинильных радикалов включают пропаргил, 1 пропинил, 2-пропинил, 1-бутинил, 2-бутинил и 1-пентинил. Понятие "циклоалкилалкил" означает алкильные радикалы, замещенные циклоалкильным радикалом. Предпочтительными циклоалкилалкильными радикалами являются C4-C20-,более предпочтительно C8-C14-радикалы. Понятие "(низш.)циклоалкилалкильные радикалы" означает "(низш.)алкильные" радикалы, замещенные (низш.)циклоалкильным радикалом, как он определен выше. Примеры таких радикалов включают циклопропилметил, циклобутилметил, циклопентилметил и циклогексилметил. Настоящее изобретение включает любые таутомерные формы соединений формулы I. Настоящее изобретение также включает соединения формулы I, имеющие один или несколько асимметричных атомов углерода. Специалистам в данной области известно, что иминосахара по настоящему изобретению, имеющие асимметричные атомы углерода, могут находиться в диастереомерных, рацемических или оптически активных формах. Все эти формы подпадают 14 под объем данного изобретения. В частности,настоящее изобретение включает энантиомеры,диастереомеры, рацемические смеси и другие их смеси. Репрезентативные N-замещенные 1,5 дидезокси-1,5-имино-D-глюцитные производные, которые могут применяться согласно настоящему изобретению, включают (но не ограничиваясь только ими):N-(7,10,13-тpиoкca-н-тeтpaдeцил)-1,5-дидeзoкcи-1,5-иминo-D-глюцит. Предпочтительными соединениями являются N-(н-нонил)-1,5-дидезокси-1,5-имино-Dглюцит и тетрабутират N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцита.N-замещенные 1,5-дидезокси-1,5-имино-Dглюцитные производные, включая пролекарства, которые могут применяться согласно настоящему изобретению, могут быть получены хорошо известными в данной области методами. Например, в примере 13 патента US 5144037 описан метод получения N-нонил-DNJ. В столбце 4, строка 62 патента US 4806650 описано получение различных алкоксипроизводных,т.е. соединений, несущих алкильные цепи, замещенные алкоксигруппами. В патенте US 4260622 описано получение многочисленных соединений. В качестве других литературных источников, в которых описано получение Nзамещенных имино-D-глюцитных производных и пролекарств, можно назвать US 4182767, US 4260622, US 4611058, US 4639436, US 5003072,US 5411970, US 5151519, WO 95/19172, Tan и др., Journal of Biological Chemistry 266(22): 14504-14510 (1991) и указанные в этих публикациях ссылки. Методы введения кислорода в боковые алкильные цепи описаны у Tan и др.,Glycobiology 4(2): 141-149 (1994), а у Broek и др., Recl. Trav. Chim. Pays-Bas 113: 107-116(1994), описано получение простого эфира кислородсодержащих DNJ-производных. 17 Способы получения приведены ниже в иллюстративных примерах 1 и 2, которые не ограничивают объем изобретения. Для лечения инфекций, вызываемых вирусами гепатита, могут применяться Nзамещенные 1,5-дидезокси-1,5-имино-D-глюцитные производные по настоящему изобретению как таковые или в сочетании в форме солей, полученных с неорганическими или органическими кислотами. Эти соли включают следующие соли: ацетат, адипат, альгинат, цитрат,аспаратат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид,2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат,3-фенилпропионат, пикрат, пивалат, пропионат,сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат, но не ограничены ими. Основные азотсодержащие группы могут быть кватернизованы с помощью таких агентов,как (низш.)алкилгалогениды, например метил-,этил-, пропил- и бутилхлориды, -бромиды и-йодиды, аралкилгалогениды, например бензили фенэтилбромиды, и других соединений. При этом при необходимости получают водо- или жирорастворимые или диспергируемые продукты. Соли получают взаимодействием этих основных соединений с требуемой кислотой. Нуклеозиды и нуклеотиды Нуклеозиды и нуклеотиды, которые могут применяться согласно настоящему изобретению, представляют собой пуриновые (формулаII) основания или пиримидиновые (формула III) основания или их аналоги, такие как соединения формулы IV или V. Нумерация положений в пуринах и пиримидинах приведена на структурных формулах II и III. R1 выбирают из группы, включающей гидроксиалкил, гидроксиалкенил, карбоксиалкил,карбоксиалкенил, тиолалкил, алкилтиоалкил,алкоксиалкил, алкоксиалкенил, гетероцикл, гетероциклоалкил, гидроксиалкилалкоксиалкил,алкоксиалкилалкоксиалкил и циклоалкилалкил. 18 Пуриновые производные могут быть дополнительно замещены в положениях 1, 2, 3, 6, 7 или 8 пуринового гетероцикла, а пиримидиновые производные могут быть замещены в положениях 2, 3, 4, 5 или 6 пиримидинового гетероцикла. Такие заместители могут быть выбраны из ряда, включающего гидрокси-, алкоксигруппу,галоген, тиол, аминогруппу, карбоксил, монозамещенную амино-, дизамещенную аминогруппу и алкил. Приведенные ниже определения применимы только к структурным формулам II, III, IV, V и VI. При использовании в сочетании с другим радикалом по отношению к пуринам и пиримидинам, которые могут применяться согласно настоящему изобретению, понятие "алкил" означает углеводородный радикал с прямой или разветвленной цепью, содержащий 1-8 атомов,предпочтительно 1-4 атома углерода. При использовании в сочетании с другим радикалом понятие "алкенил" означает углеводородный радикал с прямой или разветвленной цепью,имеющий 1 или несколько двойных связей и содержащий 2-8 атомов углерода, предпочтительно 1-4 атома углерода. При использовании по отдельности по отношению к пуринам и пиримидинам, которые могут применяться согласно настоящему изобретению, понятие "алкил" означает углеводородный радикал с прямой или разветвленной цепью, содержащий 6-14 атомов,предпочтительно 7-12 и наиболее предпочтительно 8-11 атомов углерода. Понятие "арил" отдельно или в сочетании с другим радикалом означает фенильное, нафтильное или инденильное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из ряда, включающего алкил, алкоксигруппу,галоген, гидрокси- или нитрогруппу. "Алканоил" означает алканкарбонил с прямой или разветвленной цепью длиной C1-C20, предпочтительно С 2-С 14, более предпочтительно C4-C10,"ароил" означает арилкарбонил, и "трифторалканоил" означает алкил, включающий в качестве заместителей три атома фтора. "Галоген" означает фтор, хлор, бром или йод. "Тиол" означает серу, замещенную атомом водорода (-SH)."Амино" обозначает азот с двумя атомами водорода, "монозамещенная аминогруппа" и "дизамещенная аминогруппа" означают аминогруппы, которые независимо друг от друга дополнительно замещены одной или несколькими алкильными или арилалкильными группами."Гидроксиалкил" означает алкильную группу,замещенную одной или несколькими гидроксильными группами, "гидроксиалкенил" означает алкенильную группу, замещенную одной или несколькими гидроксильными группами,"тиоалкил" означает алкил, замещенный одной или несколькими тиольными (SH) группами,"алкоксиалкил" означает алкил, замещенный одной или несколькими алкильными эфирными группами, "алкоксиалкенил" означает алке 19 нильную группу, замещенную одной или несколькими алкильными эфирными группами,"гидроксиалкилалкоксиалкил" означает алкоксиалкильную группу, замещенную гидроксиалкильной группой, "алкоксиалкилалкоксиалкил" означает алкоксиалкильную группу, замещенную алкосиалкильной группой, "циклоалкилалкил" означает алкильную группу, замещенную циклоалкильной группой. Понятие "гетероцикл" индивидуально или в различных сочетаниях означает насыщенное или частично ненасыщенное 5-или 6-членное кольцо, содержащее один или несколько таких гетероатомов, как кислород, азот и/или сера. Гетероцикл может быть дополнительно замещен 1-4 заместителями, независимо друг от друга выбранными из ряда,включающего гидроксигруппу, гидроксиалкил,тиол, алкокси-, азидо-, нитрогруппу, атом галогена, амино-, монозамещенную амино- или дизамещенную аминогруппу. "Гетероциклоалкил" означает алкильную группу, в которой один или несколько атомов водорода заменены замещенным или незамещенным гетероциклическим кольцом. В объем изобретения также включены таутомеры заместителей соединений по изобретению. Не ограничивающими объем изобретения примерами таутомеров являются таутомеры кетон/енол, таутомеры имино/амино, таутомерыN-замещенный имино/N-замещенный амино,таутомеры тиол/тиакарбонил и таутомеры с кольцевой цепью, такие как 5-и 6-членные, содержащие в кольце кислород, азот, серу или кислород- и серосодержащие гетероциклы, которые также имеют замещения в -положении на гетероатомы. Кроме того, в объем настоящего изобретения включены энантиомеры и диастереомеры, а также рацематы и изомерные смеси приведенных в настоящем описании соединений. Репрезентативные нуклеозидные и нуклеотидные производные, которые могут применяться согласно изобретению, включают (но не ограничиваясь только ими):(-)-2'-дезокси-3'-тиоцитидин-5'-трифосфат (3 ТС). Методы синтеза, используемые для получения нуклеозидов и нуклеотидов, которые могут применяться согласно настоящему изобретению, также хорошо известны в данной области, и они описаны, например, в Acta Biochim.(1995), в Chem. Nucleosides Nucleotides 3, 421535 (1994), в Ann. Reports in Med. Chem., Academic Press, и в Exp. Opin. Invest. Drugs 4, 95115 (1995). Химические реакции, представленные в приведенных выше ссылках, как правило, описаны в рамках их наиболее широкого применения для получения соединений по изобретению. В некоторых случаях реакции, в том виде, в котором они описаны, могут быть не пригодны для получения каждого соединения, включенного в объем соединений, приведенных в описании. Соединения, для которых это имеет место,могут быть легко обнаружены специалистами в данной области. Во всех таких случаях для получения соответствующих соединений по данному изобретению можно либо легко модифицировать реакции по обычным известным специалистам в данной области методам, например путем соответствующей защиты препятствующих взаимодействию групп, замены на альтернативные обычных реагентов, общепринятой модификацией условий реакции и т.д., либо можно использовать другие реакции, приведенные в настоящем описании, или другие общепринятые реакции. Во всех методах получения все исходные продукты являются известными или могут быть легко получены из известных исходных продуктов. В то время как нуклеозидные аналоги, как правило, применяются в качестве антивирусных агентов индивидуально, нуклеотиды (нуклеозидфосфаты) иногда необходимо превращать в нуклеозиды для того, чтобы облегчить их транспорт через клеточные мембраны. Например, химически модифицированным нуклеотидом, который способен проникать в клетки, является S-1-3-гидрокси-2-фосфонилметоксипропилцитозин (НРМРС, фирма Gilead Science). Нуклеозидные и нуклеотидные производные по изобретению, которые представляют собой кислоты, могут образовывать соли. Примеры солей включают соли с щелочными металлами или с щелочно-земельными металлами,такими как натрий, калий, кальций или магний,или соли с органическими основаниями, или соли четвертичного аммония. Иммуномодуляторы и иммуностимуляторы Большое число иммуномодуляторов и иммуностимуляторов, которые могут применяться в способах по настоящему изобретению, являются доступными в настоящее время. Список этих соединений приведен ниже в табл. 1. Таблица 1Anticort иммуноген антигастрин-17, Ар система для введения антигена, Vac композиция на основе антигена, IDBC иммуногенен антиGnRН, Aphton 23 терапевтические агенты против ВИЧинфекции, United BiomedMIMP миримостим смешанная бактериальная вакцина, Tem ММ-1 монилиастатMS-705 мурабутид мурабутид, Vacsyn производное мурамилдипептида производные мурамилпептида миелопидTHF, Yeda тималфасин факторы гормона вилочковой железы тимокартин тимолимфотропин тимопентин аналоги тимопентина тимопентин, Peptech фракция 5 тимозина, Alpha тимостимулин тимотринанN-замещенные 1,5-дидезокси-1,5-имино-Dглюцитные производные, применяемые согласно настоящему изобретению, могут вводиться людям в количестве от примерно 0,1 до примерно 100 мг/кг/день, более предпочтительно от примерно 1 до примерно 75 мг/кг/день и наиболее предпочтительно от примерно 5 до примерно 50 мг/кг/день. Нуклеозидное или нуклеотидное производное с антивирусной активностью или их смеси могут вводиться людям в количестве от примерно 0,1 до примерно 500 мг/человека/день, предпочтительно от примерно 10 до примерно 300 мг/человека/день, более предпочтительно от примерно 25 до примерно 200 мг/человека/день, еще более предпочтительно от примерно 50 до примерно 150 мг/человека/день и наиболее предпочтительно от примерно 1 до примерно 50 мг/человека/день. Иммуномодуляторы и иммуностимуляторы, применяемые согласно настоящему изобретению, могут вводиться в более низких количествах, чем те, которые обычно применяются в данной области. Например, тимозин альфа 1 и фракцию 5 тимозина обычно вводят людям для лечения НерВ-инфекций в количестве примерно 900 мкг/м 2 дважды в неделю (Hepatology 8: 1270(1988); Hepatology 10: 575 (1989); Hepatology 14: 409 (1991); Gastroenterology 108: А 1127 (1995. В соответствии с предлагаемыми в изобретении способами и композициями эта доза может составлять от примерно 10 мкг/м 2 дважды в неделю до примерно 750 мкг/м 2 дважды в неделю,более предпочтительно от примерно 100 мкг/м 2 дважды в неделю до примерно 600 мкг/м 2 дважды в неделю, наиболее предпочтительно от примерно 200 мкг/м 2 дважды в неделю до примерно 400 мкг/м 2 дважды в неделю. Интерферон альфа, как правило, вводят людям для лечения НерС-инфекций в количестве от примерно 1 х 106 ед./человека трижды в неделю до примерно 10 х 106 ед./человека трижды в неделю (Simon и др., Hepatology 25: 445-448 (1977. В соответствии с предлагаемыми в изобретении способами и композициями эта доза может составлять от примерно 0,1 х 106 ед./человека трижды в неделю до примерно 7,5 х 106 ед./человека трижды в неделю, более предпочтительно от примерно 0,5 х 106 ед./человека трижды в неделю до примерно 5 х 106 ед./человека трижды в неделю,наиболее предпочтительно от примерно 1 х 106 ед./человека трижды в неделю до примерно 3 х 106 ед./человека трижды в неделю. Благодаря повышению эффективности в отношении вируса гепатита этих иммуномодуляторов и иммуностимуляторов в присутствии предлагаемых N-замещенных 1,5-дидезокси-1,5 имино-D-глюцитных производных в способах и композициях по настоящему изобретению могут применяться пониженные количества дру 27 гих иммуномодуляторов/иммуностимуляторов. Такие пониженные количества могут быть определены путем стандартного мониторинга вируса гепатита у подвергающихся терапии зараженных пациентов. С этой целью можно, например, контролировать ДНК вируса гепатита в сыворотке пациента с помощью слот-блоттинга,дот-блоттинга, методик ПЦР или количественно оценивать уровень в сыворотке поверхностного антигена вируса гепатита или других антигенов,таких как е-антиген. Эти методы описаны уHoofnagle и др., New Engl. Jour. Med. 336(5): 347-356 (1997), и у F.B. Hollinger в Fields Virology, 3-е изд., том 2 (1996), под ред. Bernard N.,Fields и др., глава 86 "Hepatitis B Virus", стр. 2738-2807, Lippincott-Raven, Philadelphia PA, и в указанных в этих публикациях ссылках. Аналогичным образом можно вести наблюдение за пациентами во время совместной терапии с применением N-замещенных 1,5 дидезокси-1,5-имино-D-глюцитных производных и нуклеозидных и/или нуклеотидных антивирусных агентов с целью определения наименьших эффективных доз для каждого из этих агентов. Описанные выше дозы могут вводиться пациенту в виде однократной дозы или в виде соответствующих нескольких субдоз. В последнем случае содержащая стандартную дозу композиция может включать такие количества нескольких субдоз, чтобы обеспечить введение суточной дозы. Количество доз в день также может превышать общую суточную дозу, если это требуется по мнению специалиста, прописывающего лекарство. Фармацевтические композиции Соединения по настоящему изобретению могут быть приготовлены в виде фармацевтической композиции. Такие композиции затем можно вводить орально, парентерально, с помощью аэрозоля для ингаляции, ректально,внутрикожно, трансдермально или местно в виде композиций, содержащих суточную дозу, в состав которых при необходимости входят обычные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Местное применение также может предусматривать использование таких методов трансдермального применения, как трансдермальные бляшки или устройства для ионофореза. Понятие "парентеральный" в контексте настоящего описания означает подкожную, внутривенную,внутримышечную, интраназальную инъекцию или использование методов инфузии. Композиции лекарственных средств описаны, например,у Hoover John E., Remington's PharmaceuticalSciences, Mack Publishing Co. Easton, Pennsylvania (1975) и в Pharmaceutical Dosage Forms, под ред. Liberman H.A. и Lachman L., Marcel Decker,New York, N.Y. (1980). Инъецируемые препараты, например, стерильные инъецируемые водные или масляни 004705 28 стые суспензии, могут быть приготовлены по известным в данной области методам с использованием приемлемых диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном приемлемом для парентерального применения разбавителе или растворителе, например раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, следует назвать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели может применяться любое чистое нелетучее мало,включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, широко применяются для приготовления инъецируемых форм. Могут применяться диметилацетамид,поверхностноактивные вещества, включая ионогенные и неионогенные детергенты, полиэтиленгликоли. Также могут использоваться смеси растворителей и смачивающих агентов, таких как перечисленные выше. Суппозитории для ректального введения представленных в настоящем описании соединений могут быть приготовлены смешением действующего вещества с приемлемым не вызывающим раздражение эксципиентом, таким как масло какао, синтетические моно-, ди- или триглицериды, жирные кислоты или полиэтиленгликоли, которые являются твердыми при обычных температурах, но являются жидкими при температуре в прямой кишке и в результате этого могут расплавляться в прямой кишке и высвобождать лекарство. Твердые дозируемые формы для орального введения могут включать капсулы, таблетки,пилюли, порошки и гранулы. В таких твердых дозируемых формах соединения по настоящему изобретению, как правило, объединяют с одним или несколькими адъювантами, приемлемыми для соответствующего пути введения. При пероральном введении соединения могут быть смешены с лактозой, сахарозой, порошкообразным крахмалом, эфирами целлюлозы и алкановых кислот, алкиловыми эфирами целлюлозы,тальком, стеариновой кислотой, стеаратом магния, оксидом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, желатином, аравийской камедью, альгинатом натрия,поливинилпирролидоном и/или поливиниловым спиртом, а затем таблетированы или капсулированы для их обычного применения. Такие капсулы или таблетки могут содержать композицию с контролируемым высвобождением, которая может быть получена в виде дисперсии действующего вещества в гидроксипропилметилцеллюлозе. В случае капсул, таблеток и пилюль 29 дозируемые формы могут также включать забуферивающие агенты, такие как цитрат натрия,карбонат или бикарбонат магния или кальция. Кроме того, таблетки и пилюли могут быть изготовлены с энтеросолюбильными покрытиями. Для терапевтических целей композиции для парентерального введения могут быть представлены в форме водных или неводных изотоничных стерильных инъецируемых растворов или суспензий. Эти растворы и суспензии могут быть получены из стерильных порошков или гранул, включающих один или несколько носителей или разбавителей, которые, как указано выше, могут применяться в композициях для орального введения. Соединения могут быть растворены в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле, хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, хлориде натрия и/или в различных буферах. Другие адъюванты и пути введения хорошо известны и широко применяются в области фармацевтики. Жидкие дозируемые формы для орального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии,сиропы и эликсиры, содержащие инертные разбавители, обычно применяемые в данной области, такие как вода. Такие композиции также могут включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, а также подслащивающие вещества, корригенты и отдушки. Количество действующего вещества, которое может быть объединено с носителями для получения однократной дозируемой формы,варьируется в зависимости от пациента и конкретного пути введения. Определенные фармацевтически приемлемые соединения по настоящему изобретению,которые применяются согласно предлагаемым способам, могут служить пролекарствами для других соединений по изобретению. Пролекарства представляют собой лекарства, которые могут быть химическим путем превращены invivo или in vitro с помощью биологических систем в активное производное или производные. Пролекарства вводят практически тем же методом, что и другие фармацевтически приемлемые соединения по изобретению. В качестве примеров, которые не ограничивают объем изобретения, можно назвать сложные эфиры предлагаемых N-замещенных 1,5-дидезокси-1,5-имино-Dглюцитных производных. Соединения, входящие в состав композиций по изобретению, например N-(н-нонил)-1,5 дидезокси-1,5-имино-D-глюцит, и различные нуклеозиды или нуклеотиды могут быть представлены в форме кислот или оснований. В результате они могут применяться в форме солей друг с другом. Нуклеозиды представляют собой пуриновые или пиримидиновые соединения, в которых отсутствует фосфатный эфир. Соеди 004705 30 нения формул II, III, IV, V или VI по настоящему изобретению, которые не содержат фосфатный эфир, но содержат фрагмент карбоновой кислоты, могут образовывать соль с Nзамещенным 1,5-дидезокси-1,5-имино-Dглюцитным производным по изобретению. Нуклеотиды представляют собой пуриновые или пиримидиновые соединения,являющиеся моно-, ди- или трифосфорными эфирами. Эти фосфорные эфиры содержат свободные -ОНгруппы, которые являются кислотными и в результате образуют соли с неорганическими кислотами или органическими основаниями. Образование солей с органическими основаниями зависит от значений рКа кислоты и основания.N-замещенные 1,5-дидезокси-1,5-имино-D-глюцитные производные согласно описанию являются основными и образуют фармацевтически приемлемые соли. В этом случае пригодные соли могут быть получены не только с фармацевтически приемлемыми кислотами, но и с биологически активными кислотами, такими как описанные выше нуклеозиды и нуклеотиды. Эти соли могут быть получены обычным для получения солей методом, хорошо известным в данной области. Так, например, свободное основание N-замещенного 1,5-дидезокси-1,5 имино-D-глюцитного производного можно обрабатывать нуклеотидным аналогом формулыII, III, IV, V или VI с образованием соли. Это превращение можно осуществлять либо как отдельную химическую реакцию, либо оно может являться частью процесса приготовления композиции. Имеющим решающее значение агентом в реакции образования соли является либо кислота, либо основание, выбранные специалистом таким образом, чтобы получить требуемый биологический результат. Композиция может содержать смеси различных солей, кислот или свободных оснований, как они описаны выше. Например, фосфорная кислота в форме (-)-2'дезокси-3'-тиоцитидин-5'-трифосфата может образовывать соль тетрабутират, представляющий собой основание N-(н-нонил)-1,5-дидезокси-1,5-имино-D-глюцит. Этот тип соли затем может вводиться пациенту в фармацевтически приемлемой композиции либо в виде одной чистой соли, либо в виде компонента смеси. В некоторых случаях соли могут использоваться с целью выделения, очистки или разделения соединений по изобретению. Схема лечения Схему лечения пациента, страдающего от инфекции, вызываемой вирусом гепатита, с помощью соединений и/или композиций по настоящему изобретению выбирают с учетом различных факторов, включая возраст, вес, пол,диету и медицинское состояние пациента, серьезность инфекции, путь введения, фармакологические особенности, такие как активность, эффективность, фармакокинетические профили и профили токсичности конкретного применяемо 31 го соединения, а также с учетом конкретно используемой для введения лекарственного средства системы. Описанные выше лекарственные композиции, как правило, следует применять в течение периода времени, составляющего от нескольких недель до нескольких месяцев или лет, до тех пор, пока титр вируса не достигнет приемлемых уровней, свидетельствующих о том, что инфекция находится под контролем или уничтожена. Как отмечалось выше, пациенты, которых лечат с помощью лекарственных композиций, представленных в настоящем описании, подвергаются обследованию путем количественной оценки ДНК вируса гепатита в сыворотке пациента с помощью слот-блоттинга, дот-блоттинга,методик ПЦР, или путем количественной оценки антигенов вирусов гепатита, таких как поверхностный антиген гепатита В (HBsAg) и еантиген гепатита В (HBeAg), в сыворотке с целью оценки эффективности терапии. При хроническом заболевании вирусом гепатита В, например, стадия ремиссии характеризуется исчезновением ДНК вируса гепатита В, т.е. снижением ее количества ниже определяемых уровней при оценке в опытах по гибридизации,с помощью которых можно определить уровни 105 вирусных геномов/мл сыворотки, а также исчезновением HBeAg из сыворотки несмотря на постоянное присутствие HBsAg. Эти серологические особенности сопровождаются улучшением биохимической и гистологической картины болезни. Конечной точкой успешного лечения при использовании большинства методов оценки антивирусной терапии является исчезновение HBeAg и вирусной ДНК из сыворотки. У пациентов, у которых исчезает е-антиген, ремиссия обычно является длительной и приводит к образованию неактивного состояния носителяHBsAg. Многие пациенты в конечном итоге становятся HBsAg-отрицательными (обзор см. уHoofnagle и др. New Engl. Jour. Med. 336(5): 347356 (1997. Постоянный анализ данных, полученных с помощью этих методов, позволяет модифицировать схему лечения в процессе терапии таким образом, чтобы применять оптимальные количества каждого компонента в комбинации, а также таким образом, чтобы точно установить продолжительность лечения. В результате схему лечения/схему применения можно рационально модифицировать в процессе терапии с таким расчетом, чтобы вводить минимальные количества каждого из используемых в комбинации антивирусных соединений, которые вместе обеспечивают достаточную эффективность в отношении вируса гепатита, а также с таким расчетом, чтобы лечение с помощью таких используемых в комбинации антивирусных соединений продолжать только в течение времени, необходимого для успешного лечения инфекции. 32 Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Пример 1. Получение 1,5-(бутиламино)1,5-дидезокси-D-глюцита. Раствор, содержащий 1,5-дидезокси-1,5 имино-D-глюцит (5,14 г, 0,0315 моля), бутировый альдегид (3,35 мл, 0,0380 моля) и черныйPd (1 г) в 200 мл метанола, гидрировали (60 фунтов/кв.дюйм/29 С/21 ч). После фильтрации образовавшейся смеси фильтрат концентрировали в вакууме, получая масло. Указанное в заголовке соединение кристаллизовали из ацетона и перекристаллизовывали из метанола/ацетона,tпл примерно 132 С. Строение подтверждали с помощью ЯМР, ИК-спектра и элементного анализа. Элементный анализ: рассчитано дляC10H21NO4: С 54,78; Н 9,65; N 6,39; обнаружено: С 54,46; Н 9,33; N 6,46. Пример 2. Получение тетраацетата 1,5(бутиламино)-1,5-дидезокси-D-глюцита. Уксусный ангидрид (1,08 г, 0,0106 моля) добавляли к соединению, указанному в заголовке примера 1 (0,50 г, 0,0023 моля), в 5 мл пиридина и перемешивали в течение 17 дней при комнатной температуре. Продукт упаривали в газообразном азоте. Образовавшееся указанное в заголовке соединение очищали хроматографией на силикагеле. Строение подтверждали с помощью ЯМР, ИК-спектра и элементного анализа. Элементный анализ: рассчитано дляC18H29NO8: С 55,80; Н 7,54; N 3,62; обнаружено: С 55,42; Н 7,50; N 3,72. Пример 3. Активность в отношении вируса гепатита В различных N-замещенных 1,5 дидезокси-1,5-имино-D-глюцитных производных in vitro. Активность в отношении вируса гепатита В и воздействие на жизнеспособность клеток целого ряда различных N-замещенных 1,5 дидезокси-1,5-имино-D-глюцитных производных оценивали с помощью анализа in vitro с использованием постоянно экспрессирующей вирус гепатита В линии клеток HepG2.2.15. Использованный метод практически соответствовал методу, описанному у Block и др., Proc. Natl.Acad. Sci. USA 91: 2235-2239 (1994). Результаты приведены в табл. 2 и 3. Таблица 2 Воздействие N-замещенных 1,5-дидезокси-1,5-иминоD-глюцитных производных на выделение вируса гепатита В и жизнеспособность клеток линии HepG2.2.15 Соединение Контроль[1000] н.о.5 5,020 (n=3) Примечания: 1 Постоянно экспрессирующую вирус гепатита В линию клеток HepG2.2.15 (примерно 500000 клеток/лунку) инкубировали в присутствии тестируемого соединения в течение 3 дней. 2 После культивирования в течение 3 дней без соединения или в присутствии соединения клетки удаляли обработкой трипсином, инкубировали с трипановым голубым и визуально с помощью микроскопа оценивали отсутствие(исключение) красителя. Величины представляют собой количество клеток, не включающих трипановый голубой(отсутствие трипанового голубого считается эквивалентом жизнеспособности), в процентах относительно общего количества исследованных клеток. 3 После культивирования в течение 3 дней без соединения или в присутствии соединения выделившиеся вирионы осаждали из культуральной среды с помощью иммунопреципитации с использованием моноклонального антитела,специфичного для антигена preS1 (Meiscl и др. Intervirology 37: 330-339 (1995); Lu и др. Virology 213: 660-665 (1995. Вирусную ДНК, присутствующую в иммунопреципитатах,определяли с помощью количественного денсиометрического анализа фрагмента ДНК правильного размера, полученного с помощью полимеразной цепной реакции. Количество амплифицированных в контроле ДНК (клетки, не обработанные соединением) принимали за 100%. 4NBDNJ означает N-(н-бутил)-1,5-дидезокси-1,5 имино-D-глюцит; N-бутил-DNJ. 5 Хотя для этих вариантов не проводили окрашивание трипановым голубым, при грубом микроскопическом обследовании клетки не были заметны (здоровые клетки). СКО означает среднеквадратичное отклонение (стандартное отклонение). Соединения: 1. N-(3-фенилпропил)-1,5-дидезокси-1,5 имино-D-глюцит,2. тетрабутират N-(н-бутил)-1,5-дидезокси 1,5-имино-D-глюцита,3. N-(2-этилбутил)-1,5-дидезокси-1,5-имино-D-глюцит. Таблица 3 Воздействие N-замещенных 1,5-дидезокси-1,5-иминоD-глюцитных производных на выделение вируса гепатита В и жизнеспособность клеток линии НерG2.2.15 Концентрация, обеспечи- Концентрация, обеспечиСоедивающая 90%-ное ингиби- вающая 50%-ное сниженение рование выделения 1 HBV ние концентрации 2 МТТ 1 0,5-1,0 100-200 2 200 н.о 3 Примечания: 1 в мкг/мл, полученная с помощью взятых с дублированием результатов ПЦР; 2 в мкг/мл, МТТ представляет собой бромид 3-(4,5 диметилтиазол-2-ил)-2,5-дифенил-тетразолия. Колориметрический анализ с помощью МТТ позволяет оценить жизнеспособность клеток (Нео и др., Cancer Research 50: 36813690 (1990; 3 н.о. означает "не определяли";наименьшая из исследованных концентраций;при самой высокой из исследованных концентраций (200 мкг/мл) не обнаружено ингибирования. 34 Пример 4. Активность в отношении вируса гепатита В (-)-2'-дезокси-3'-тиоцитидин-5'-трифосфата (3 ТС) индивидуально и в сочетании сN-нонил-DNJ. Активность в отношении вируса гепатита ВKorba, Antiviral Research 29(1): 49-51 (1996,используя стратегию "combostat" (Comstat Program, Combostat Corp., Дулут, шт. Миннесота). Этот метод "combostat" предусматривает применение серийных разведений для определения значения IC90 каждого соединения. Было установлено, что значение IC90 для N-нонил-DNJ находится в диапазоне от 4 и 10 мкг/мл (Т.(фирма Gibco BRL, 066-1811). Посев клеток производили на матрасы площадью 25 см 2 до 80%-ной конфлуэнции. Через 5 дней матрасы,используемые в трех параллельных опытах, либо не обрабатывали, либо обрабатывали серийными разведениями одного 3 ТС, либо серийными разведениями 3 ТС+N-нонил-DNJ. Через 2, 4 и 6 дней после добавления соединения (причем среду в эти дни заменяли) количество ДНК вируса гепатита В (HBV) в культуральной среде определяли с помощью ПЦР-анализа частиц,осажденных полиэтиленгликолем. Таким образом, в этих экспериментах частицы с покрытием не отличались от нуклеокапсидов. Аплифицированные с помощью ПЦР продукты разделяли электрофорезом на агарозном геле (1,5% агарозы) и нуклеотидный фрагмент длиной 538 пар оснований оценивали количественно сканированием полос (прибор типа HP Jet Imager). Количество HBV, полученное из необработанных клеток, принимали за 100%. Данные, полученные для анализа через 6 дней, приведены на фиг. 1 в виде средних значений, полученных по меньшей мере для трех отдельных матрасов,квадратичная ошибка для которых не превышает 20%, средняя квадратичная ошибка составляет 12%. В каждый из трех исследованных моментов времени комбинация 3TC+N-нонил-DNJ проявила существенно большую эффективность в отношении ингибирования выделения HBV,чем любое из соединений по отдельности. Данные, полученные только с помощью ПЦРанализа, не позволяют определить точные значения IC50. Исключительно высокая чувствительность и "деликатная" природа ПЦР могут не 35 позволить, например, достичь уровня ингибирования HBV, более высокого чем 90%, при использовании одного 3 ТС даже при 300 нМ. В каждом эксперименте использовали контроль,который позволял гарантировать проведение ПЦР в таком диапазоне концентраций ДНК, в котором выход реакций пропорционален количеству ДНК в образце. Разрешение является примерно 3-кратным, т.е. могут быть обнаружены 3-кратные различия в концентрациях ДНК. Невозможность точно определить менее чем 3 кратные различия, возможно, объясняет невозможность достижения 90%-ного ингибирования при использовании только 3 ТС. Поэтому можно предположить, что при использовании ПЦР для обнаружения ингибирования должен применяться очень высокий стандарт ингибирования. В целом достаточно четко прослеживается следующая тенденция, обнаруженная для трех различных моментов времени: объединенное действие 3TC+N-нонил-DNJ выше, чем эффективность любого из соединений по отдельности или сумма активностей каждого из отдельных соединений. Эти данные позволяют предположить, что значение IC50 3 ТС снижается с примерно 60 мМ до примерно 0,48 нМ, когда Nнонил-DNJ присутствует в концентрации 0,016 мкг/мл. Пример 5. Активность в отношении вируса гепатита В только N-нонил-DNJ при использовании в качестве модели сурка. С целью оценки эффективности N-нонилDNJ в комбинации с 3 ТС (или с другим нуклеозидным или нуклеотидным аналогом) в отношении вируса гепатита В на модели животного сурке - сначала проводили эксперименты с использованием только N-нонил-DNJ. Это необходимо для определения того, обладает ли Nнонил-DNJ анти-НВV-активностью для сурка и обладает ли N-нонил-DNJ достаточно высокой активностью для того, чтобы можно было проводить общее исследование, основанное на оценке зависимости ответа от дозы для одного этого соединения. С этой целью животных, которых разбивали на 5 групп по 4 животных в каждой (во всех группах присутствовали животные обоих полов; во всех группах, кроме контрольной, было по 2 особи каждого пола), обрабатывали дважды в день (BID) соединением в дозах, составляющих 0, 12,5, 25, 50 и 100 мг/кг/день. Сурки представляли собой выращенных в лабораторных условиях диких животных. Все животные были заражены вирусом гепатита сурков (WHV) в новорожденном состоянии и у всех обнаружена положительная реакция в серологических тестах в отношении поверхностного антигена WHV. Образцы крови брали за одну неделю до обработки (-1 неделя), непосредственно перед обработкой (0 неделя), каждую неделю в процессе обработки (через 1, 2, 3 и 4 недели) и после окончания обработки (через 5, 6, 8 и 10 недель). 36 Известны два критерия эффективности лекарственного средства: уменьшение общей ДНКHBV (измеренное с помощью количественной ПЦР) и уменьшение ДНК HBV в капсидах с интактными поверхностными гликопротеинами,которые являются активной формой вируса (измеренное с помощью анализа иммунопреципитации типа ELISA-анализа с последующей количественной оценкой с помощью ПЦР). Эксперименты с N-нонил-DNJ, проведенные на культуре клеток, продемонстрировали небольшое воздействие или отсутствие воздействия этого соединения на общую ДНК HBV, но заметную активность в отношении полученной с помощью иммунопреципитации ДНК (ИПДНК). Известно, что ИПДНК-анализ является очень вариабельным; для частичной компенсации этого проводили по 4 анализа, в каждом из которых использовали образцы, полученные из всех животных, но использовали различные субнаборы,взятые из ежеденедельных опытов. Обобщенные результаты свидетельствуют о том, что N-нонил-DNJ не оказывал действия на содержание общей ДНК HBV, и эта величина остается практически постоянной для всех доз как в экспериментах, проведенных до начала обработок, так и в экспериментах, проведенных после начала обработок. С другой стороны,уровни ИПДНК не были постоянными в течение всего времени эксперимента. У животных, обработанных низкими дозами, наблюдалась тенденция к увеличению уровней ИПДНК в период обработки (0-4 недели), в то время как у животных, обработанных высокими дозами, наблюдалась тенденция к уменьшению уровней ИПДНК во время этого же периода. Аппроксимация прямой линией данных, полученных еженедельно для каждого животного, показала существенное различие в наклоне этих линий как в зависимости от дозы, так и от уровня лекарства в плазме. Уровни лекарства в плазме оказались также весьма вариабельными: животные, у которых оказались наиболее низкие уровни в плазме в своей группе, обработанной одной дозой, имели более низкие уровни в плазме, чем животные с наиболее высокими уровнями в плазме из следующей группы, которую обрабатывали более низкой дозой. Ни в одном из опытов не обнаружено различий в реакциях самцов и самок. Уровни в плазме Не выявлено явной системы в изменениях уровня N-нонил-DNJ в плазме, которые могли бы коррелировать с конкретной неделей или со временем, прошедшим после предыдущей обработки. Поскольку уровни в плазме животного,вероятно, оставались сравнительно постоянными в процессе обработки, для последующего моделирования использовали средний уровень в плазме каждого животного. Строили график зависимости уровней в плазме для каждой недели периода обработки для каждого животного в 37 зависимости от дозы (чтобы можно было отличить перекрывающиеся значения, к величинам доз добавляют небольшие случайные отклонения) (фиг. 2). ДНК HBV Уровни общей ДНК оказались практически постоянными во времени для каждого животного (данные не приведены). У зависимости реакции от дозы была обнаружена слабая тенденция к понижению уровней вируса при повышении уровней лекарства, за исключением случая, когда три животных, которых обрабатывали наиболее высокой из доз, имели очень высокие уровни вируса. Это не позволяет сделать заключения о наличии зависимости общей ДНКHBV от дозы N-нонил-DNJ. Вероятно, существуют две популяции животных, чувствительных к этому соединению (респондеры; такие как животное r) и нечувствительные (такие как животные i, m и d), однако, для получения более надежных результатов необходимы дополнительные данные. Полученная с помощью иммунопреципитапии ДНК HBV При анализе ИПДНК обнаружена существенная вариабельность как между опытами, так и в каждом опыте (данные не приведены). Но даже несмотря на это с помощью этих результатов можно обнаружить, что через 0-4 недели наклон, как правило, возрастает для животных,которых обрабатывали низкой дозой, и понижается для животных, которых обрабатывали высокой дозой, что позволяет использовать эти результаты для построения модели. Это изменение в наклоне оказалось статистически достоверным (р 0,005). Перед построением моделей, соответствующих этим данным, применяли логарифмическое преобразование поскольку; 1) вариации для ИПДНК возрастают при увеличении уровней ИПДНК; логарифмическое преобразование позволяет получить значения с относительно близкой вариабельностью и 2) это позволяет ожидать, что активность лекарства можно выразить в виде постоянного коэффициента (множителя) к уровню ИПДНК. Поскольку для ИПДНК могут быть получены и нулевые значения, перед осуществлением логарифмического преобразования ко всем значениям добавляют небольшую величину (примерно 1/2 от наименьшего ненулевого значения). Для моделирования изменений наклонов кривых зависимостей продолжительности обработки в неделях и дозы N-нонил-DNJ применяли два подхода: подход с использованием линейного моделирования и подход с использованием нелинейного моделирования. Оба подхода основаны на предположении о том, что (линейная) скорость изменения величины log(ИПДНК) в течение периода обработки является"истинной" характеристикой, отражающей воздействие лекарства на вирус. Оба подхода со 004705 38 стоят из отдельных стадий, а первая стадия является общей для обоих подходов. Сначала методом регрессии получают простую линейную модель с использованием аппроксимации данных, полученных в течение 0-4 неделей для предсказания log (ИПДНК+10) отдельно для каждого животного путем комбинаций испытаний. На второй стадии переменной величиной ответа является наклон, определенный на первой стадии. При линейном подходе, когда модель подбирается таким образом, чтобы можно было описать наклон, полученный для каждой недели и являющийся ответом, где эксперимент рассматривается как блок, доза оказывает ярко выраженное действие (это действие почти полностью обусловлено наклоном кривой по отношению к дозе), и соответствующая ошибка при оценке эффекта дозы представляет собой вариацию среди животных, обработанных одинаковым образом (после упорядочивания экспериментов как блоков). Это аналогично использованию калибровочных данных внутри каждого эксперимента для первичного описания зависимости данных для каждого эксперимента от концентрации общей вирусной ДНК; различия состоят в том, что для описания зависимостей данных для каждого эксперимента используют данные, полученные для сурков, а не только калибровочные данные. Для нелинейного подхода с помощь четырехпараметрического логарифмического уравнения аппроксимируют наклон за неделю как ответ, где доза рассматривается как переменная величина. И в этом случае эксперимент рассматривают как блок, но поскольку нет эксперимента, проведенного во все недели, не представляется возможным полностью применить систему построения блоков при нелинейном подходе. Тем не менее с помощью нелинейной модели было получено значение ЕС 50 7,88 мг/кг/ВID-доза. Средний максимальный наклон,который был обнаружен, составил 2,71 дополнительных величин log (ИПДНК мкг/мл)/ неделю), что соответствует возрастанию, равному примерно 150%/неделю, при этом средний минимальный наклон, который был обнаружен при применении N-нонил-DNJ, был меньше на 0,31 log (ИПДНК мкг/мл)/неделю), что соответствует понижению приблизительно на 25%/неделю. Наклоны, модель аппроксимации,установленные с помощью модели параметры, и приблизительные среднеквадратичные отклонения этих параметров приведены на фиг. 3. Данные свидетельствуют о том, что приблизительная эффективная для монотерапий доза Nнонил-DNJ для сурков составляет около 16 мг/кг/день. Эффективная доза как N-нонил-DNJ,так нуклеозида или нуклеотида с антивирусной активностью, вводимая и людям, и суркам в виде комбинации, может применяться в виде 39 двух одинаковых суточных субдоз (т.е. BID,дважды в день). На фиг. 2 и 3 животные обозначены с помощью буквенных кодов. В табл. 4 приведены два из этих кода для каждого животного: пол и доза. Таблица 4 Коды животных, их пол и доза,которой они обработаныживотного Буквенный код Пол Дозаm м 50 Пример 6. Исследование антивирусной активности при использовании N-нонил-DNJ в сочетании с 3 ТС на модели сурков, зараженных вирусом гепатита В. Совместную активность N-нонил-DNJ и нуклеозида 3 ТС можно оценить на модели сурков, зараженных вирусом гепатита В. Для опытов использовали 28 сурков с постоянной инфекцией, вызванной вирусом гепатита сурков(WHV). Группы сурков обрабатывали орально только 3 ТС (1 раз в день), только N-нонил-DNJ(дважды в день) или комбинаций этих двух лекарственных средств. Антивирусную активность индивидуальных лекарственных средств или их комбинаций оценивали путем измерения уровня ДНК WHV в сыворотке в процессе лечения и сравнения результатов, полученных для групп, обработанных лекарством, и контрольных групп, обработанных плацебо. Для проведения опытов использовали 28 сурков с постоянной инфекцией, вызваннойWHV, и все они были в экспериментальных условиях заражены WHV во время первой недели жизни. Ко времени начала опытов все они былиWHsAg-положительными. Всего использовали 8 экспериментальных групп животных. Сурков в каждой группе подразделяли на основе их пола, веса тела и возраста. 3 ТС вводили орально в виде водной суспензии таблеток Epivir (фирма Glaxo-Wellcome) 1 40 раз в день. N-нонил-DNJ также вводили орально в виде водного раствора в виде двух разделенных доз. Введение обоих лекарственных средств сопровождалось введением 4-5 мл жидкого полусинтетического корма для сурков с целью обеспечить полное поглощение лекарств. Были созданы следующие экспериментальные группы: Группа Кол-во 3 ТС,N-нонил-DNJ, животных, n мг/кг/день мг/кг/день 1 4 0,0 0,0 2 3 3,0 0,0 3 3 9,0 0,0 4 3 0,0 4,0 5 3 0,0 12,0 6 4 1,5 2,0 7 4 4,5 6,0 8 4 9,0 12,0 Сурков анестезировали (50 мг/кг кетамина,5 мг/кг зилазина), взвешивали и брали образцы крови до начальной обработки с еженедельными интервалами в течение 6 недель периода лечения и через 1, 2 и 4 недели после обработки. Собирали сыворотку и подразделяли на аликвоты. Одну из аликвот использовали для анализа ДНК WHV с помощью гибридизации методом дот-блоттинга и оценки WHsAg методомELISA. Клинические анализы крови (КАК) и биохимические профили получали до начала лечения и в конце лечения. Вторую аликвоту хранили в качестве образца для архива. Другие аликвоты сыворотки использовали для анализа лекарственного средства и специальных анализов ДНК WHV. В описанные выше варианты осуществления изобретения могут быть внесены различные модификации. Такие модификации не должны рассматриваться как выходящие за объем изобретения, и все такие модификации и эквивалентные варианты, как это очевидно для специалистов в данной области техники, включены в объем формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, включающий введение млекопитающему антивирусной композиции, характеризующийся тем, что в указанной композиции содержится только глюкаминовое соединение или его фармацевтически приемлемая соль в количестве, эффективном в отношении вируса гепатита, и состоящее по меньшей мере из одного N-замещенного 1,5 дидезокси-1,5-имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли где R выбирают из группы, включающей алкил с прямой цепью длиной С 7-С 20, алкил с разветвленной цепью с длиной основной цепи С 3-С 20,алкоксиалкил, арилалкил с вышеуказанным числом атомов углерода в алкильной части для алкоксиалкила, а для арилалкила число атомов углерода в арильной части составляет от С 6 до С 18, а алкильная часть имеет длину цепи от С 1 до С 20, циклоалкил, содержащий от С 3 до С 12,W, X, Y и Z, каждый независимо друг от друга,выбирают из группы, включающей атом водорода, алканоил с длиной цепи от С 1 до С 20, ароил, арильная часть которого составляет от С 6 до С 18, и трифторалканоил. 2. Способ по п.1, где R обозначает алкил с прямой цепью длиной C7-C20, а W, X, Y и Z каждый обозначает атом водорода. 3. Способ по п.1, где R обозначает нонил. 4. Способ по п.1, где R обозначает алкил с прямой цепью длиной С 7-С 20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от С 1 до С 20. 5. Способ по п.4, где R обозначает нонил. 6. Способ по п.5, где алканоил представляет собой бутаноил. 7. Способ по п.1, где N-замещенное 1,5 дидезокси-1,5-имино-D-глюцитное производное выбирают из группы, включающейN-(7,10,13-тpиoкca-н-тeтpaдeцил)-1,5-дидeзoкcи-1,5-иминo-D-глюцит. 8. Способ по п.1, где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, 004705 44 этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат,оксалат, пальмоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, пропионат,сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат. 9. Способ лечения инфекции, вызываемой вирусом гепатита у млекопитающего, включающий введение млекопитающему антивирусной композиции, содержащей эффективное в отношении вируса количество по меньшей мере одногоN-замещенного 1,5-дидезокси-1,5 имино-D-глюцитного производного формулы I или его фармацевтически приемлемой соли: где R выбирают из группы, включающей алкил с прямой цепью длиной С 7-С 20, алкил с разветвленной цепью с длиной основной цепи С 3-С 20,алкоксиалкил, арилалкил и циклоалкилалкил, aW, X, Y и Z, каждый независимо друг от друга,выбирают из группы, включающей атом водорода, алканоил, ароил и трифторалканоил, где количества атомов углерода определены в п.1,без введения антивирусного агента, выбранного из группы, включающей нуклеозид, нуклеотид,иммуномодулятор или иммуностимулятор. 10. Способ по п.9, где R обозначает алкил с прямой цепью длиной С 7-С 20, а W, X, Y и Z каждый обозначает атом водорода. 11. Способ по п.10, где R обозначает нонил. 12. Способ по п.9, где R обозначает алкил с прямой цепью длиной С 7-С 20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи отC1 до С 20. 13. Способ по п.12, где R обозначает нонил. 14. Способ по п.13, где алканоил представляет собой бутаноил. 15. Способ по п.9, где N-замещенное 1,5 дидезокси-1,5-имино-D-глюцитное производное выбирают из группы, включающейN-(7,10,13-тpиoкca-н-тeтpaдeцил)-1,5-дидeзoкcи-1,5-иминo-D-глюцит. 16. Способ по п.9, где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат,этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат,оксалат, пальмоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, пропионат,сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат. 17. Фармацевтическая композиция, включающая эффективное количество в отношении вируса гепатита по меньшей мере одного Nзамещенного 1,5-дидезокси-1,5-имино-Dглюцитного производного формулы I или его фармацевтически приемлемой соли где R выбирают из группы, включающей алкил с прямой цепью длиной С 7-С 20, алкил с разветвленной цепью с длиной основной цепи С 3-С 20,алкоксиалкил, арилалкил с вышеуказанным числом атомов углерода в алкильной части для алкоксиалкила, а для арилалкила число атомов углерода в арильной части составляет от C6 доC18, а алкильная часть имеет длину цепи от С 1 до С 20, циклоалкил, содержащий от С 3 до С 12,W, X, Y и Z, каждый независимо друг от друга,выбирают из группы, включающей атом водорода, алканоил с длиной цепи от С 1 до С 20, ароил, арильная часть которого составляет от С 6 до С 18, и трифторалканоил и фармацевтически приемлемый носитель, эксципиент или разбавитель. 18. Фармацевтическая композиция по п.17,где R обозначает алкил с прямой цепью длиной С 7-С 20, а W, X, Y и Z каждый обозначает атом водорода. 19. Фармацевтическая композиция по п.18,где R обозначает нонил. 48 20. Фармацевтическая композиция по п.17,где R обозначает алкил с прямой цепью длиной С 7-С 20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от С 1 до С 20. 21. Фармацевтическая композиция по п.20,где R обозначает нонил. 22. Фармацевтическая композиция по п.21,где алканоил представляет собой бутаноил. 23. Фармацевтическая композиция по п.17,где N-замещенное 1,5-дидезокси-1,5-имино-Dглюцитное производное выбирают из группы,включающейN-(7,10,13-триокса-н-тетрадецил)-1,5-дидезокси-1,5-имино-D-глюцит. 24. Фармацевтическая композиция по п.17,где фармацевтически приемлемую соль выбирают из группы, включающей ацетат, адипат,альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтан-сульфонат,лактат, малеат, метансульфонат, никотинат, 2 нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат,пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, мезилат и ундеканоат. 25. Фармацевтическая композиция, включающая эффективное количество в отношении вируса гепатита по меньшей мере одного Nзамещенного 1,5-дидезокси-1,5-имино-Dглюцитного производного формулы I или его фармацевтически приемлемой соли 51 где R выбирают из группы, включающей алкил с прямой цепью длиной С 7-С 20, алкил с разветвленной цепью с длиной основной цепи С 3-С 20,алкоксиалкил, арилалкил с вышеуказанным числом атомов углерода в алкильной части для алкоксиалкила, а для арилалкила число атомов углерода в арильной части составляет от C6 до С 18, а алкильная часть имеет длину цепи от С 1 до С 20, циклоалкил, содержащий от С 3 до С 12,W, X, Y и Z каждый независимо друг от друга выбирают из группы, включающей атом водорода, алканоил с длиной цепи от С 1 до C20, ароил, арильная часть которого составляет от С 6 доC18 и трифторалканоил и фармацевтически приемлемый носитель, эксципипент или разбавитель, и не содержащая любой антивирусный агент, выбранный из группы, включающей нуклеозид, нуклеотид, иммуномодулятор или иммуностимулятор. 26. Фармацевтическая композиция по п.25,где R обозначает алкил с прямой цепью длинойC7-C20, а W, X, Y и Z каждый обозначает атом водорода. 27. Фармацевтическая композиция по п.26,где R обозначает нонил. 28. Фармацевтическая композиция по п.25,где R обозначает алкил с прямой цепью длиной С 7-С 20, а W, X, Y и Z каждый обозначает алканоил с длиной цепи от С 1 до С 20. 29. Фармацевтическая композиция по п.28,где R обозначает нонил. 30. Фармацевтическая композиция по п.29,где алканоил представляет собой бутаноил. 31. Фармацевтическая композиция по п.25,где N-замещенное 1,5-дидезокси-1,5-имино-Dглюцитное производное выбирают из группы,включающейN-(7,10,13-триокса-н-тетрадецил)-1,5 дидезокси-1,5-имино-D-глюцит. 32. Фармацевтическая композиция по п.25,где фармацевтически приемлемую соль выби 004705
МПК / Метки
МПК: A61K 31/706
Метки: 1,5-дидезокси-1,5-имино-d-глюцитных, применение, n-замещенных, вызываемых, лечения, вирусами, инфекций, производных, гепатита
Код ссылки
<a href="https://eas.patents.su/29-4705-primenenie-n-zameshhennyh-15-didezoksi-15-imino-d-glyucitnyh-proizvodnyh-dlya-lecheniya-infekcijj-vyzyvaemyh-virusami-gepatita.html" rel="bookmark" title="База патентов Евразийского Союза">Применение n-замещенных 1,5-дидезокси-1,5-имино-d-глюцитных производных для лечения инфекций, вызываемых вирусами гепатита</a>
Предыдущий патент: Производные феноксипропиламина
Следующий патент: Полиморфы n-метил-n-(3-{3-[2-тиенилкарбонил]пиразол [1,5-а]пиримидин-7-ил}фенил)ацетамида и относящиеся к ним композиции и способы
Случайный патент: Производные пептидов