Цефалоспорины, имеющие в положении 7 замещенный бензилоксииминный радикал, способ их получения и применения
Формула / Реферат
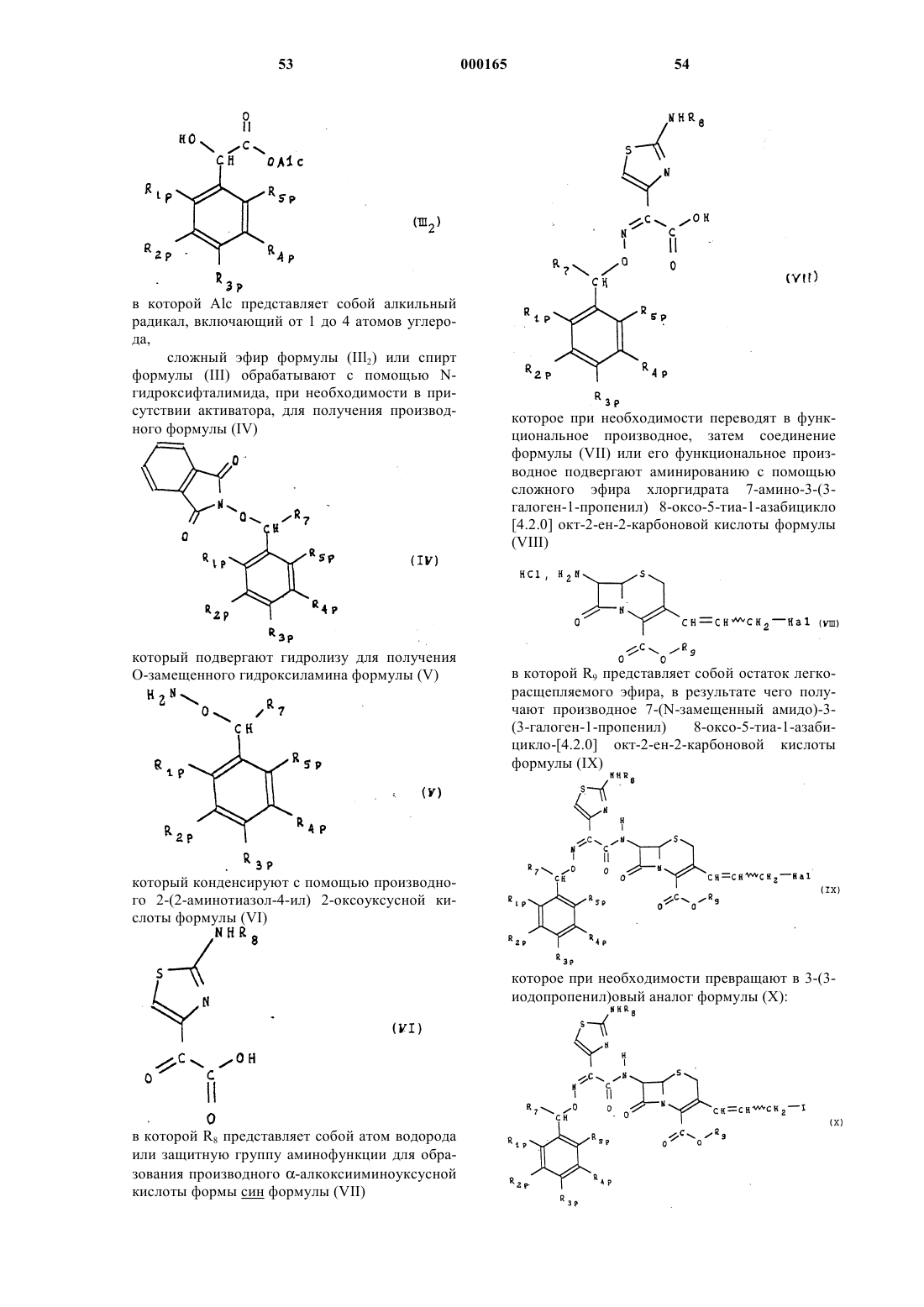
1. Цефалоспорины общей формулы (I):
изомер син в виде внутрикомплексных солей или солей неорганических или органических кислот или оснований, где
R1, R2, R3 и R5, одинаковые или различные, представляют собой атом водорода, атом галогена или радикал, выбранный из группы, состоящей из радикалов: гидроксильный, алкильный, включающий от 1 до 4 атомов углерода, с возможностью замещения одним или несколькими атомами галогена, алкилоксильный, включающий от 1 до 4 атомов углерода, меркапто-радикал, алкилтио-радикал, включающий от 1 до 4 атомов углерода, нитро, циано, амино, алкиламино, содержащий от 1 до 4 атомов углерода, диалкиламино, содержащий от 2 до 8 атомов углерода, карбамоильный, (алкиламино) карбонильный, содержащий от 2 до 5 атомов углерода, (диалкиламино) карбонильный, содержащий от 3 до 9 атомов углерода, карбоксильный, алкоксикарбонильный, содержащий от 2 до 5 атомов углерода, ацилокси-радикал, содержащий от 1 до 8 атомов углерода, и
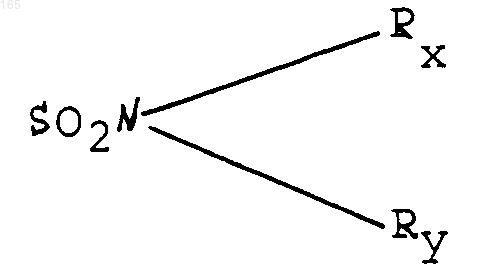
в котором Rx и Ry, одинаковые или различные, представляют собой атом водорода или алкильный радикал, включающий от 1 до 4 атомов углерода,
R4 представляет собой гидроксильный радикал или ацилоксильный радикал, включающий от 1 до 8 атомов углерода,
R7 представляет собой атом водорода или алкилоксикарбонильный радикал, в котором алкилоксильный радикал включает от 1 до 3 атомов углерода,
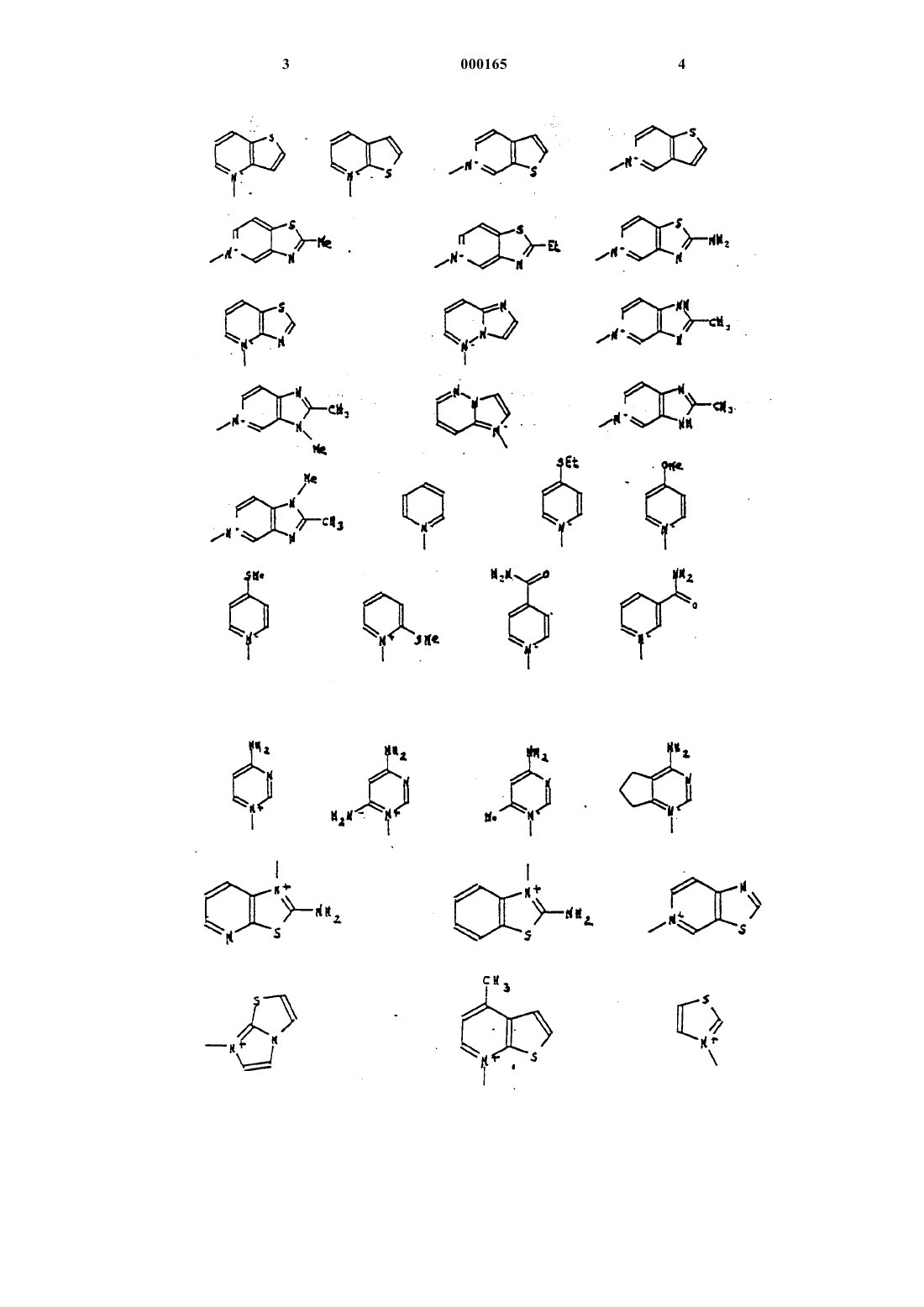
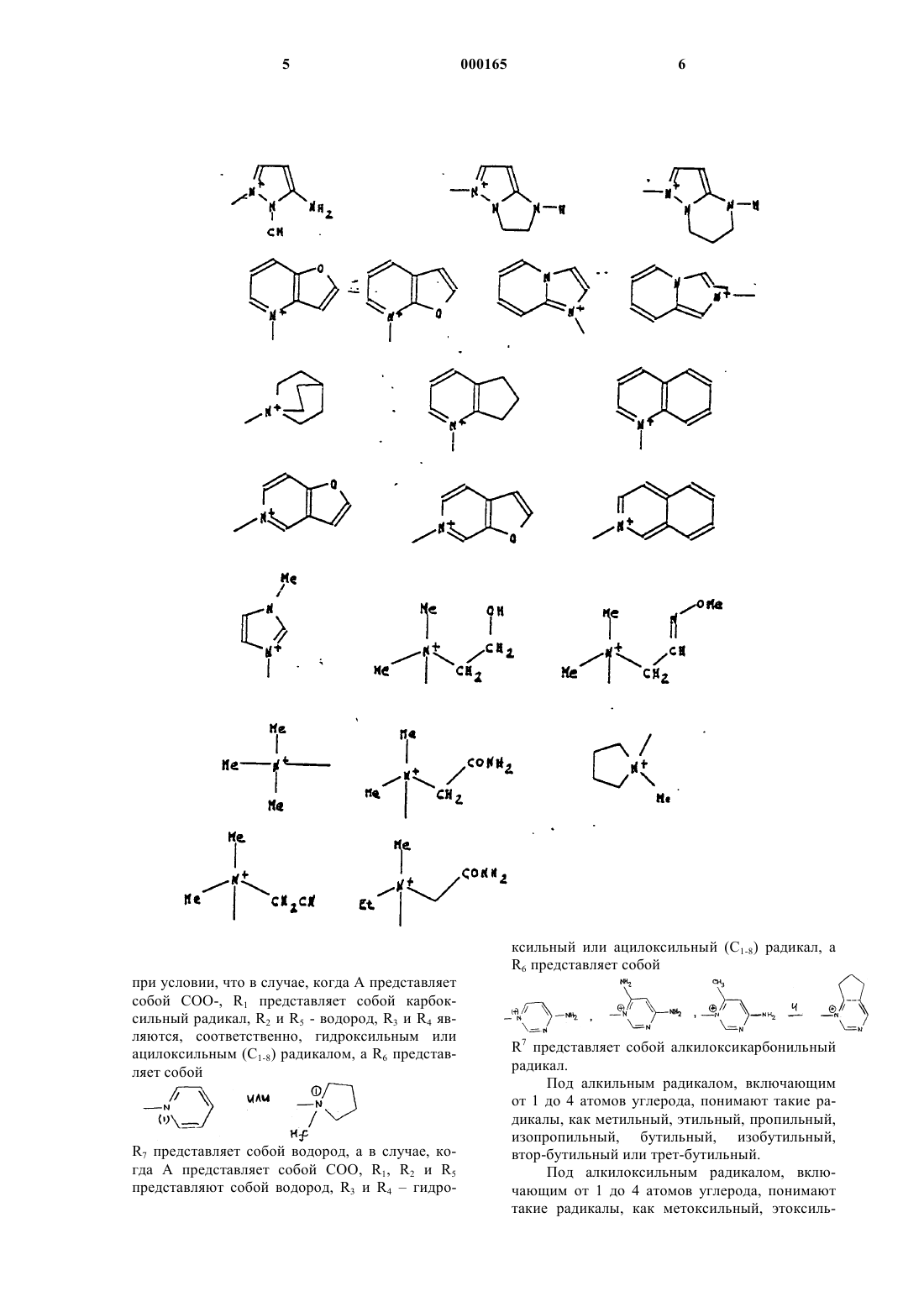
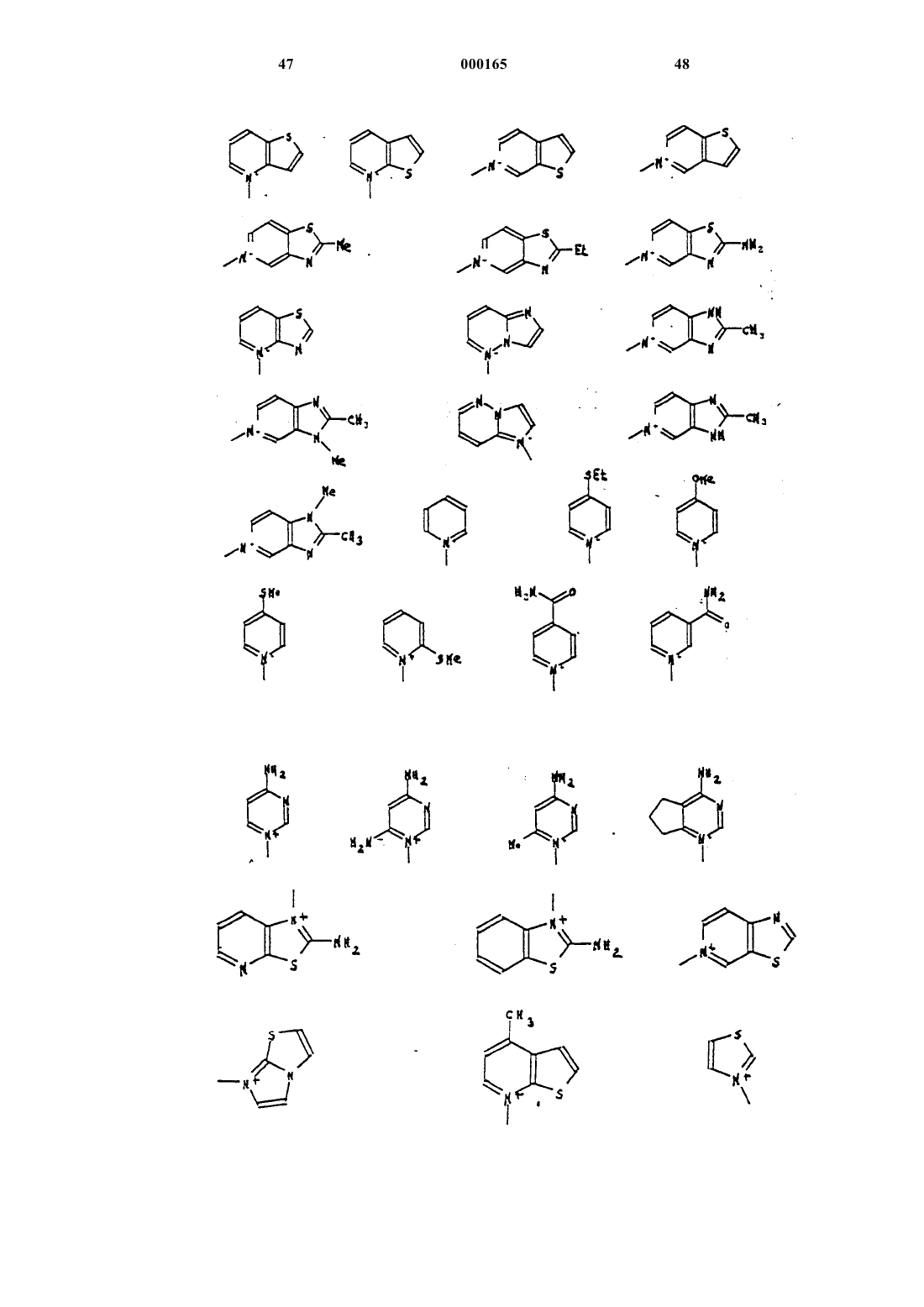
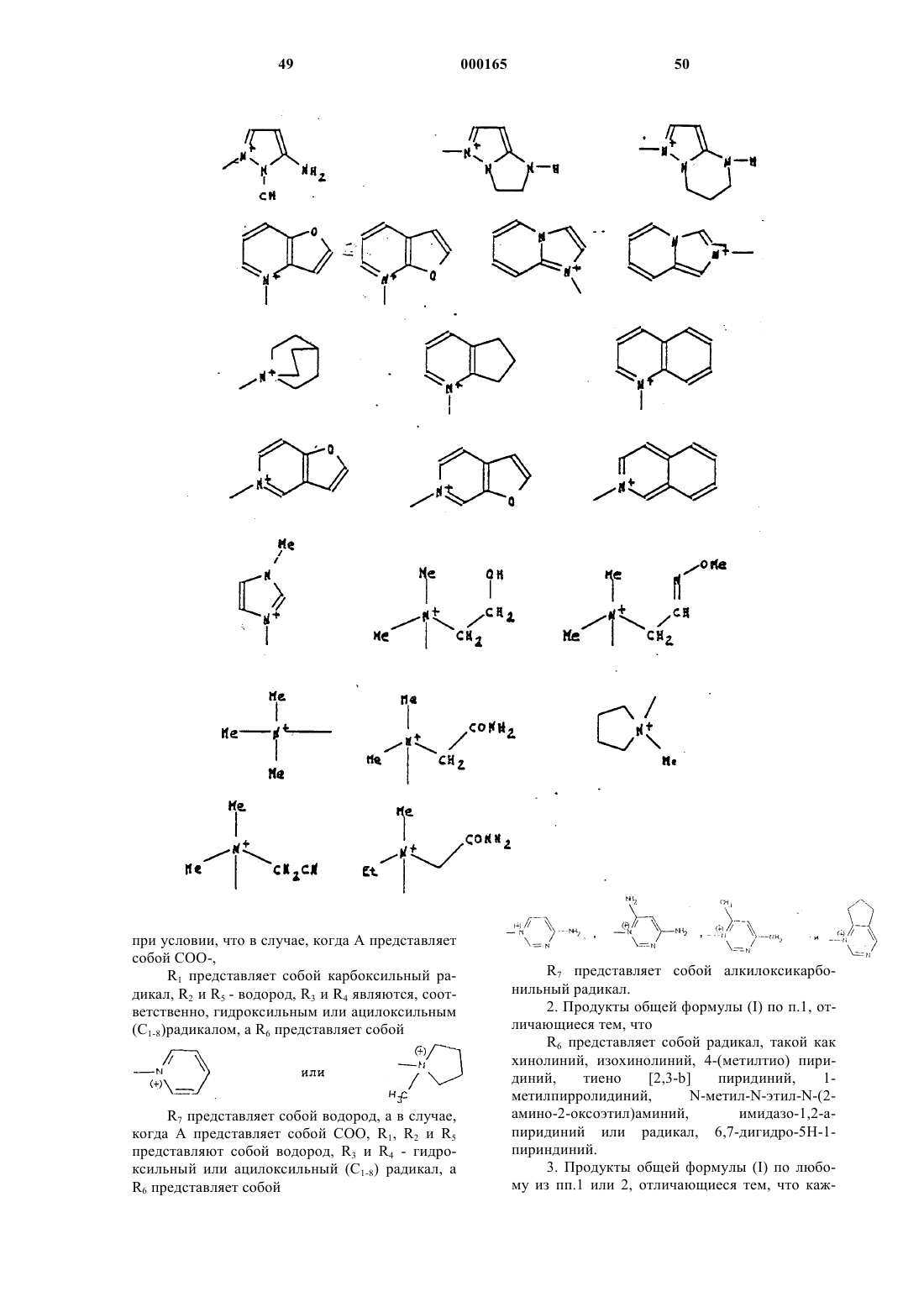
А представляет собой атом водорода, эквивалент щелочного или щелочно-земельного металла, магния, аммония или аминированного органического основания, или же А представляет собой остаток сложноэфирной легкорасщепляемой группы, или же СО2А представляет собой СО2y, при этом волнистая линия означает, что группа CH2R6 может находиться в положении Е или Z , a R6 представляет собой, в виде четвертичного аммония, один из нижеследующих радикалов:


при условии, что в случае, когда А представляет собой СОО-,
R1 представляет собой карбоксильный радикал, R2 и R5 - водород, R3 и R4 являются, соответственно, гидроксильным или ацилоксильным (C1-8)радикалом, a R6 представляет собой
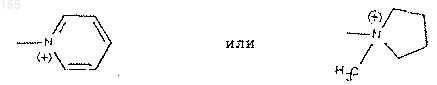
R7 представляет собой водород, а в случае, когда А представляет собой COO, R1, R2 и R5 представляют собой водород, R3 и R4 - гидроксильный или ацилоксильный (С1-8) радикал, a R6 представляет собой
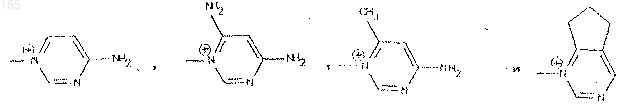
R7 представляет собой алкилоксикарбонильный радикал.
2. Продукты общей формулы (I) по п.1, отличающиеся тем, что
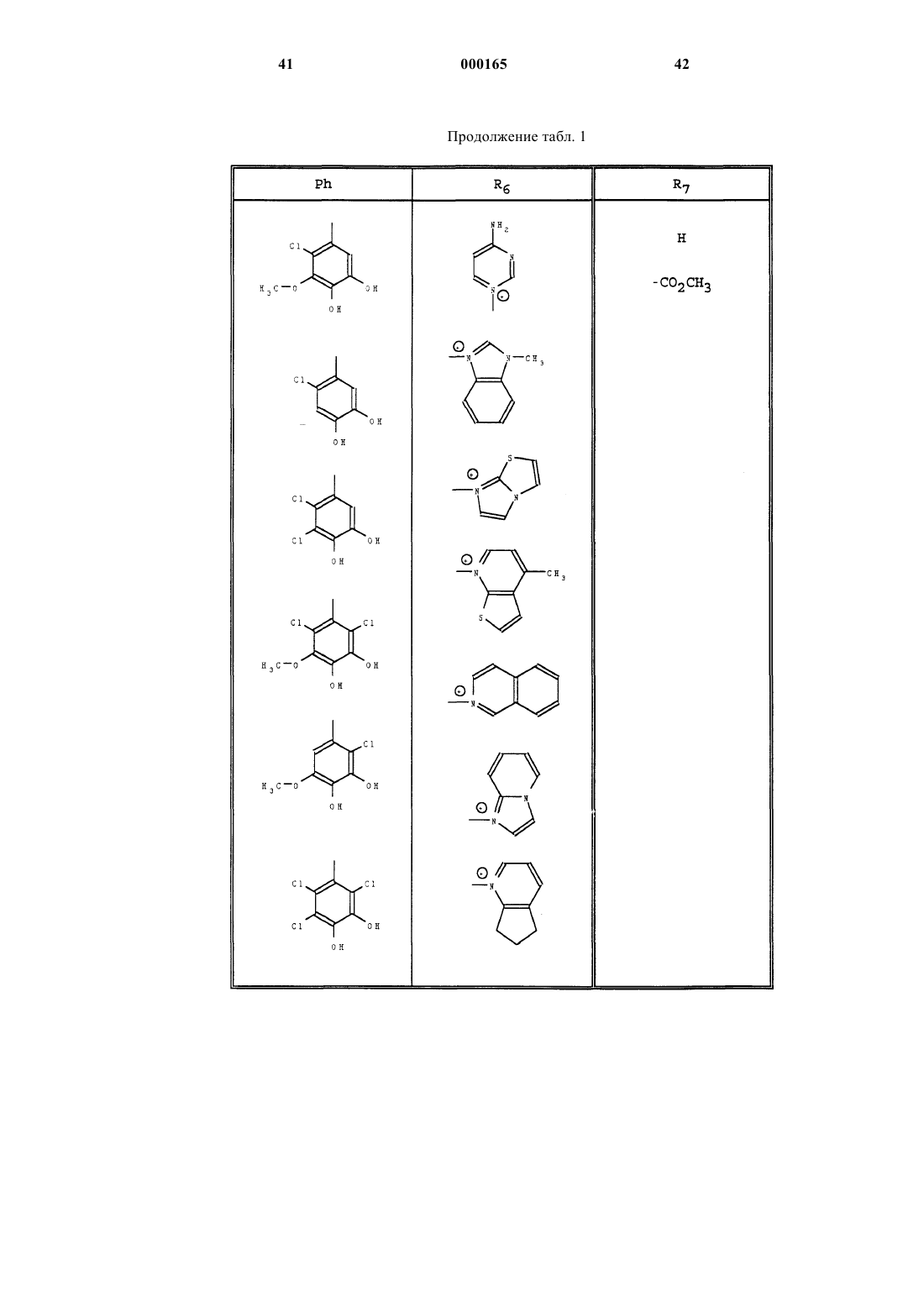
R6 представляет собой радикал, такой как хинолиний, изохинолиний, 4-(метилтио) пиридиний, тиено [2,3-b] пиридиний, 1-метилпирролидиний , N-метил-N-этил-N-(2-амино-2-оксоэтил)аминий, имидазо-1,2-а-пиридиний или радикал, 6,7-дигидро-5Н-1-пириндиний.
3. Продукты общей формулы (I) по любому из пп.1 или 2, отличающиеся тем, что каждый из R3 и R4 представляет собой гидроксильный радикал.
4. Продукты общей формулы (I) по любому из пп. 1, 2, 3, отличающиеся тем, что каждый из R2 и R5 представляет собой атом хлора или фтора.
5. Продукты общей формулы (I) по любому из пп. 1, 2, 3, отличающиеся тем, что R2 представляет собой атом фтора.
6. Продукты общей формулы (I) по любому из пп. 1, 2, 3, отличающиеся тем, что R2 представляет собой метоксильный радикал, а один из R1 и R5 представляет собой атом хлора.
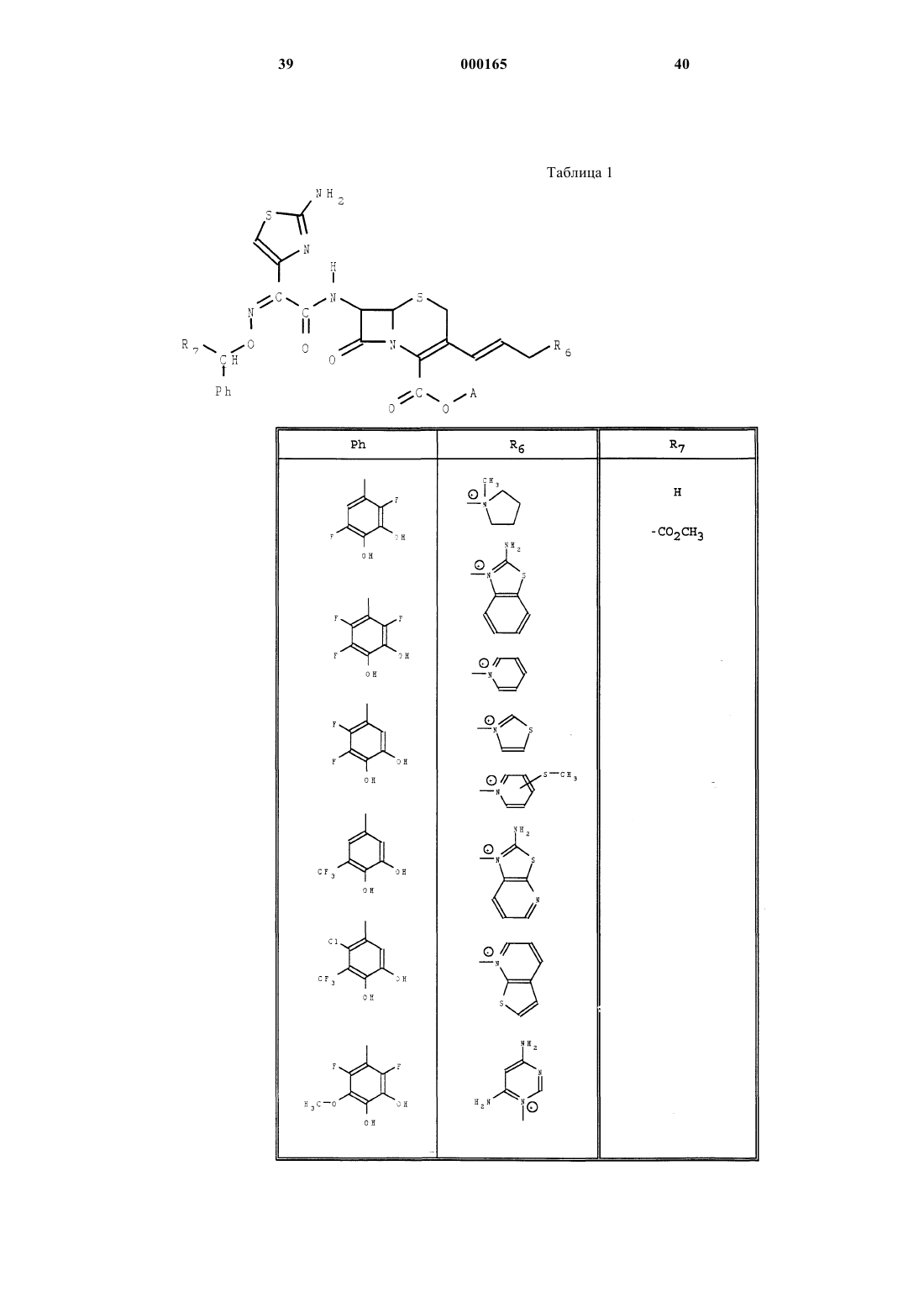
7. Продукты общей формулы (I), представляющие собой следующие соединения:
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил) ((2,5-дифтор 2,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа 1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) хинолиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил)-((2,5-дихлор-3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-каобокси-8-оксо-5-тиа 1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) хинолиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил)-((2,5-ди-фтор-3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси-8-оксо 5-тиа-1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) имидазо (1,2-а) пиридиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z)))1-(3-(7-(((2-амино-4-тиазолил) (((2,5-дихлор-3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа-1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) имидазо (1,2-а) пиридиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил) (((2,5-дифтор-3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа-1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) 6,7-дигидро-5Н-1-пириндиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил) ((2,5-дихлор-3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси-8-оксо 5-тиа-1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) 6,7-дигидро-5Н-1-пириндиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил) ((5-фтор-3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо-5-тиа-1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) хинолиния;
- внутрикомплексная соль (6R-(3-(Е) 6a, 7b-(Z))) 1-(3-(7-(((2-амино-4-тиазолил) ((метоксикарбонил) (3,4-дигидрокси-5-фторфенил) метокси) имино) ацетил) амино) 2-карбокси-8-оксо-5-тиа-1-азабицикло [4.2.0] акт-2-ен-3-ил) 2-пропенил) хинолиния.
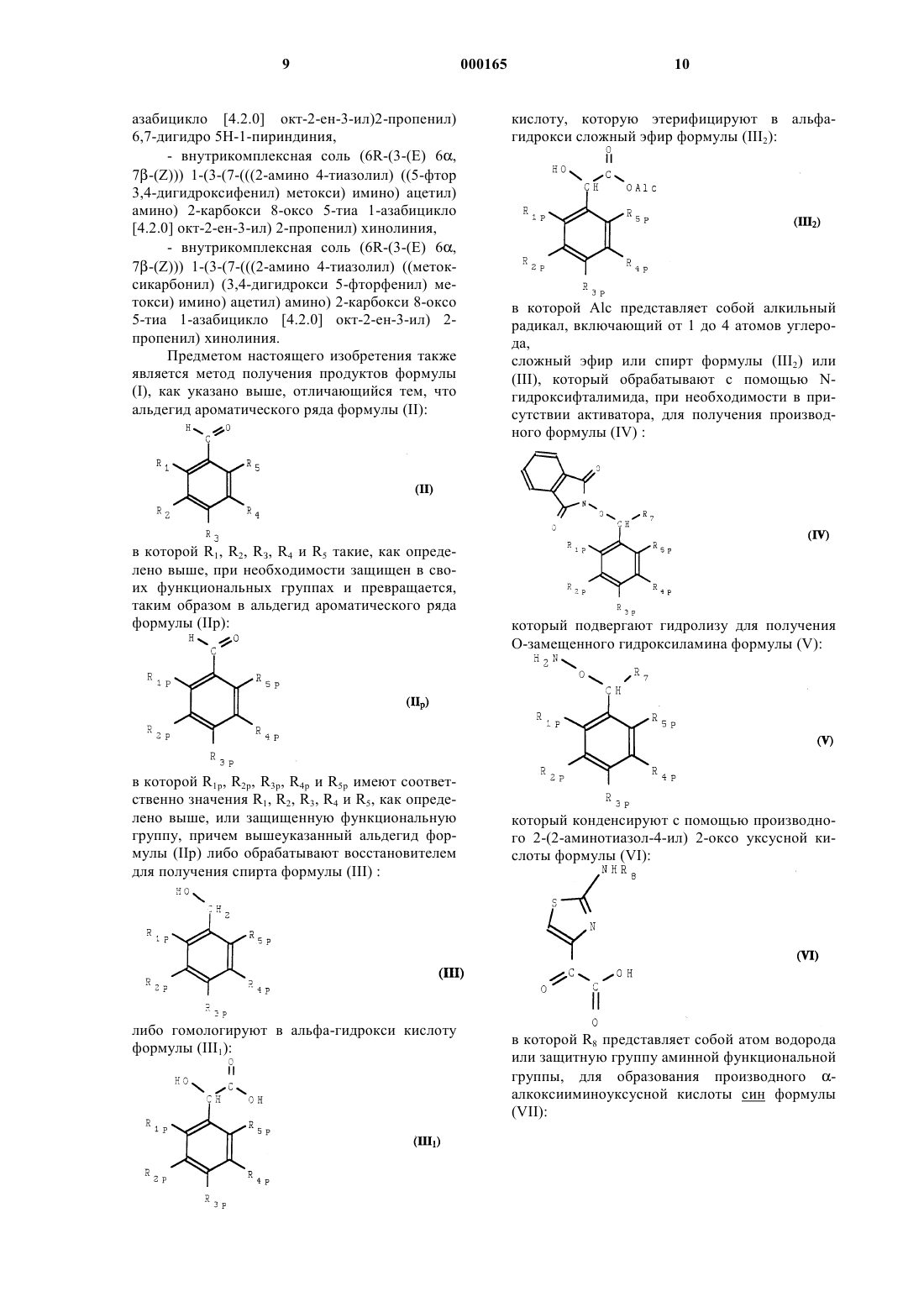
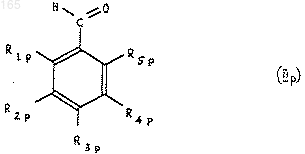
8. Способ получения продуктов общей формулы (I), отличающийся тем, что альдегид ароматического ряда формулы (II)

в которой R1, R2, R3, R4 и R5 такие, как определено в п.1, при необходимости защищен в своих функциональных группах и превращен, таким образом, в альдегид ароматического ряда формулы (IIp)
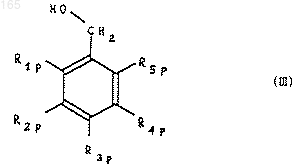
в которой R1p, R2p, R3p, R4p и R5р имеют соответственно значения R1, R2, R3, R4 и R5, как определено выше, или защищенную функциональную группу, причем вышеуказанный альдегид формулы (IIр) либо обрабатывают восстановителем для получения спирта формулы (III)
либо гомологируют в альфа-гидрокси кислоту формулы (III1)
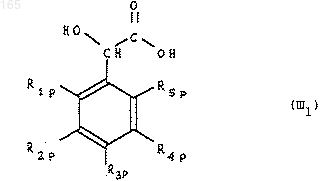
которуюэтерифицируют до альфа-гидрокси-сложного эфира формулы (III2)
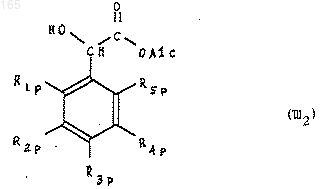
в которой Alc представляет собой алкильный радикал, включающий от 1 до 4 атомов углерода,
сложный эфир формулы (IIl2) или спирт формулы (III) обрабатывают с помощью N-гидроксифталимида, при необходимости в присутствии активатора, для получения производного формулы (IV)
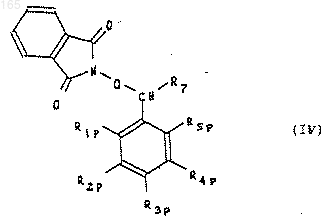
который подвергают гидролизу для получения О-замещенного гидроксиламина формулы (V)
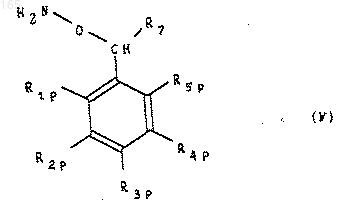
который конденсируют с помощью производного 2-(2-аминотиазол-4-ил) 2-оксоуксусной кислоты формулы (VI)
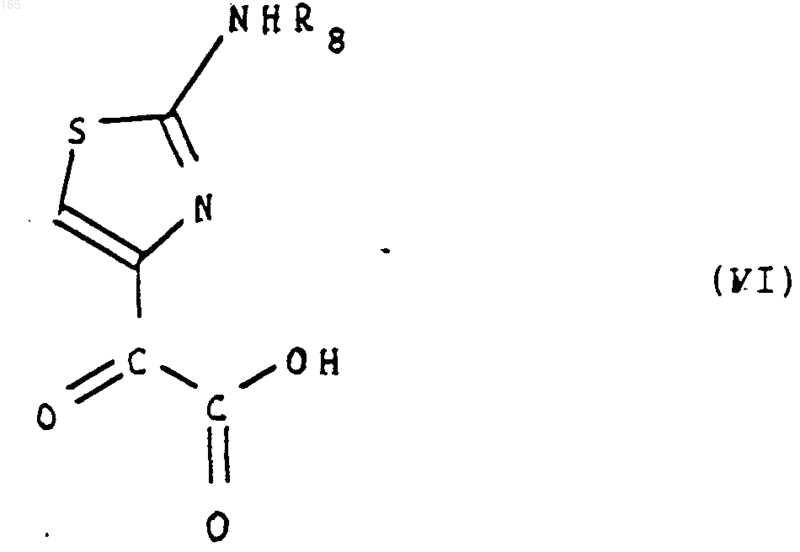
в которой R8 представляет собой атом водорода или защитную группу аминофункции для образования производного a-алкоксииминоуксусной кислоты формы син формулы (VII)
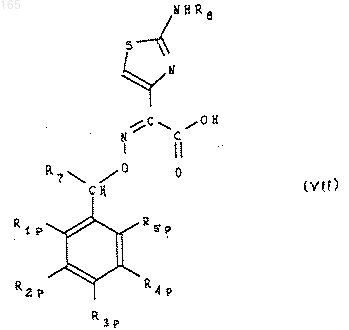
которое при необходимости переводят в функциональное производное, затем соединение формулы (VII) или его функциональное производное подвергают аминированию с помощью сложного эфира хлоргидрата 7-амино-3-(3-галоген-1-пропенил) 8-оксо-5-тиа-1-азабицикло [4.2.0] окт-2-ен-2-карбоновой кислоты формулы (VIII)
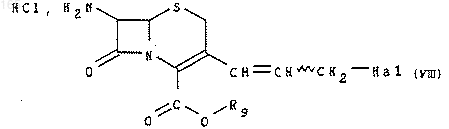
в которой R9 представляет собой остаток легкорасщепляемого эфира, в результате чего получают производное 7-(N-замещенный амидо)-3-(3-галоген-1-пропенил) 8-оксо-5-тиа-1-азаби-цикло-[4.2.0] окт-2-ен-2-карбоновой кислоты формулы (IX)
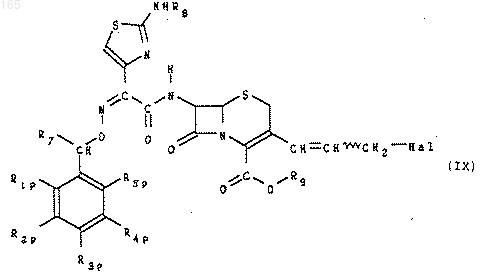
которое при необходимости превращают в 3-(3-иодопропенил)овый аналог формулы (X):
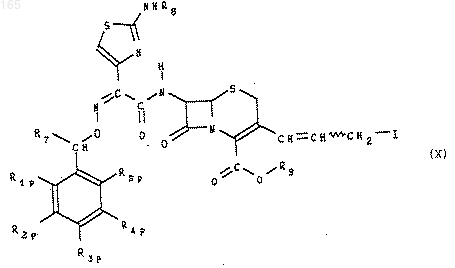
который обрабатывают основанием формулы R6 для получения продукта формулы (XI)
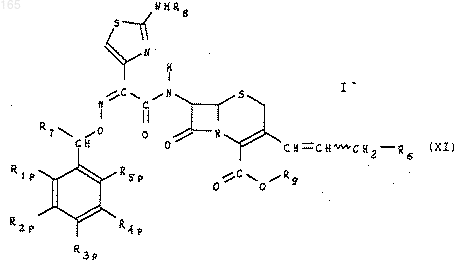
из которого при необходимости выделяют изомеры (Е) или (Z) или превращают изомеры (Z) в изомеры (Е) или соединение формулы (XI) подвергают, при необходимости, одной или нескольким из нижеследующих реакций, в соответствующем порядке:
а) удаление путем гидролиза или путем обработки тиомочевиной всех или части сложноэфирных защитных групп и защитных групп амино-радикала или гидроксильных радикалов,
б) этерификация или солеобразование карбоксильного радикала с использованием основания,
в) солеобразование амино-радикала с использованием кислоты,
г) разделение продуктов в виде смеси R, S на R и S изомеры.
9. Способ получения продуктов формулы (I), отличающийся тем, что О-замещенный гидроксиламин формулы (V) подвергают конденсации с соединением формулы (XII):
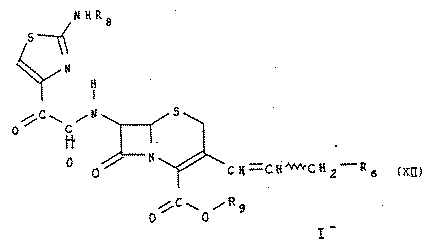
для получения соединения формулы (ХI), описанного в п.8, из которого, при необходимости, выделяют изомеры (Е) или (Z), или превращают изомеры (Z) в изомеры (Е), или соединение формулы (XI) подвергают, при необходимости, одной или нескольким из нижеследующих реакций, в соответствующем порядке:
а) удаление путем гидролиза или путем обработки тиомочевиной всех или части сложноэфирных защитных групп и защитных групп амино-радикала или гидроксильных радикалов,
б) этерификация или солеобразование карбоксильного радикала с использованием основания,
в) солеобразование амино-радикала с использованием кислоты,
г) разделение продуктов в виде смеси R, S на R и S изомеры.
10. Применение продуктов формулы (I) , а также их солей с кислотами в качестве фармацевтического препарата.
11. Применение по п.10, отличающееся тем, что используют продукты формулы (I) по пп. 2-8 или их соли с кислотами в качестве фармацевтического препарата.
12. Фармацевтическая композиция, включающая в качестве действующего начала препарат по п.10 или 11.
Текст
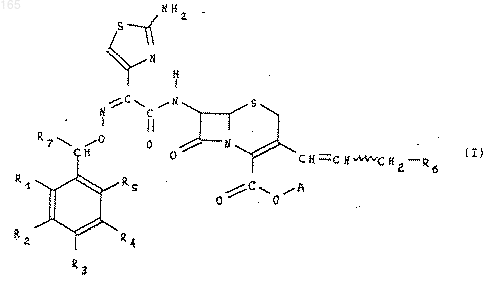
1 Настоящее изобретение относится к цефалоспоринам, имеющим в боковой цепи в положении 7 замещенный бензилоксииминный радикал, к способу их получения, к их использованию в качестве фармацевтических препаратов. Объектом настоящего изобретения являются соединения общей формулы (I) : изомер син в виде внутрикомплексных солей или солей органических или неорганических кислот или оснований, гдеR1, R2, R3 и R5, одинаковые или различные,представляют собой атом водорода, атом галогена или радикал, выбранный из группы, состоящей из радикалов: гидроксильный, алкильный, включающий от 1 до 4 атомов углерода, с возможностью замещения одним или несколькими атомами галогена, алкилоксильный, включающий от 1 до 4 атомов углерода, меркапторадикал, алкилтио-радикал, включающий от 1 до 4 атомов углерода, нитро, циано, амино, алкиламино, содержащий от 1 до 4 атомов углерода, диалкиламино, содержащий от 2 до 8 атомов углерода, карбамоильный, (алкиламино) карбо 000165 в котором Rx и Ry одинаковые или различные,представляют собой атом водорода или алкильный радикал, включающий от 1 до 4 атомов углерода,R4 представляет собой гидрдксильный радикал или ацилоксильный радикал, включающий от 1 до 8 атомов углерода,R7 представляет собой атом водорода или алкилоксикарбонильный радикал, в котором алкилоксильный радикал включает от 1 до 3 атомов углерода,А представляет собой атом водорода, эквивалент щелочного или щелочно-земельного металла, магния, аммония или аминированного органического основания, или же А представляет собой остаток сложноэфирной легкорасщепляемой группы, или же СО 2 А представляет собой СО 2, при этом волнистая линия означает,что группа СН 2R6 может находиться в положении Е или Z,a R6 представляет собой, в виде четвертичного аммония, один из нижеследующих радикалов: при условии, что в случае, когда А представляет собой СОО-, R1 представляет собой карбоксильный радикал, R2 и R5 - водород, R3 и R4 являются, соответственно, гидроксильным или ацилоксильным (C1-8) радикалом, a R6 представляет собой ксильный или ацилоксильный (C1-8) радикал, aR7 представляет собой алкилоксикарбонильный радикал. Под алкильным радикалом, включающим от 1 до 4 атомов углерода, понимают такие радикалы, как метильный, этильный, пропильный,изопропильный, бутильный, изобутильный,втор-бутильный или трет-бутильный. Под алкилоксильным радикалом, включающим от 1 до 4 атомов углерода, понимают такие радикалы, как метоксильный, этоксиль 7 ный, пропоксильный, изопропоксильный, бутоксильный,изобутоксильный,вторбутоксильный или трет-бутоксильный. Под алкилтионильным радикалом, включающим от 1 до 4 атомов углерода, понимают такие радикалы, как метилтионильный, этилтионильный, пропилтионильный, изопропилтионильный, бутилтионильный, изобутилтионильный, втор-бутилтионильный или третбутилтионильный. Под алкиламинным радикалом, включающим от 1 до 4 атомов углерода, понимают такие радикалы, как метиламинный, этиламинный,пропиламинный, изопропиламинный, бутиламинный, изобутиламинный, втор-бутиламинный или трет-бутиламинный. Под диалкиламинным радикалом, включающим от 2 до 8 атомов углерода, понимают, в частности, такие радикалы, как диметиламинный, диэтиламинный, дипропиламинный, диизопропиламинный, дибутиламинный, диизобутиламинный, этилметиламинный, пропилметиламинный, бутилметиламинный или пропилэтиламинный. Под (алкиламино) карбонильным радикалом, включающим от 2 до 5 атомов углерода,понимают, в частности, такие радикалы, как(диметиламино) карбонильный, (диэтиламино) карбонильный или (дипропиламино) карбонильный. Под алкоксикарбонильным радикалом,включающим от 2 до 5 атомов углерода, понимают, в частности, метоксикарбонильный или этоксикарбонильный радикал. Под ацилоксильным радикалом, включающим от 1 до 8 атомов углерода, понимают, в частности, такие радикалы, как ацетоксильный,пропионилоксильный или бензоилоксильный. Под атомом галогена понимают атом фтора, хлора, брома или иода. Соединение формулы (I) могут также быть представлены в виде чистой внутрикомплексной соли, в солевой форме или в форме, ассоциированной с кислотами. Среди кислот, с помощью которых можно образовать соль соединений формулы (I), можно, в частности, назвать такие кислоты, как уксусная, трифторуксусная, фумаровая, малеиновая, винная, фосфорная, серная, хлористоводородная, метансульфокислота, бензосульфокислота, паратолуолсульфокислота, бромистый водород, йодистый водород. Среди оснований, с помощью которых можно образовать соль соединений формулы (I),можно, в частности, назвать основания, соответ 000165 8 ствующие вышеуказанным солям. Примеры солеобразования с помощью оснований приводятся ниже. В предпочтительном методе изобретения СО 2 А представляет собой СO2. Выражение "в виде четвертичного аммония" указывает, что радикал R связан атомом азота, который он содержит, или одним из нескольких атомов азота, которые он содержит. Объектом изобретения являются, в частности, соединения общей формулы (I), указанной выше, в которой R6 представляет собой радикал,такой как хинолиний, изохинолиний, 4(метилтио)пиридиний, тиено [2.3-b] пиридиний,1-метилпирролидиний,N-метил-N-этил-N-(2 амино-2-оксоэтил)-аминий, имидазо (1,2-а) пиридиний или радикал 6,7-дигидро-5 Н-1 пириндиний, соединения, в которых каждый изR3 и R4 представляет собой гидроксильный радикал, и соединения, в которых каждый из R2 иR5 представляет собой атом хлора или фтора,соединения, в которых R2 представляет собой атом фтора, и соединения, в которых R2 представляет собой метоксильный радикал, а один из R1 и R5 представляет собой атом хлора. Более конкретно изобретение касается соединений, следующих наименований:[4.2.0] окт-2-ен-3-ил) 2-пропенил) хинолиния,- внутрикомплексная соль (6R-(3-(Е) 6,7-(Z 1-(3-(7-2-амино 4-тиазолил) метоксикарбонил) (3,4-дигидрокси 5-фторфенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа 1-азабицикло [4.2.0] окт-2-ен-3-ил) 2 пропенил) хинолиния. Предметом настоящего изобретения также является метод получения продуктов формулы(I), как указано выше, отличающийся тем, что альдегид ароматического ряда формулы (II): в которой R1, R2, RЗ, R4 и R5 такие, как определено выше, при необходимости защищен в своих функциональных группах и превращается,таким образом в альдегид ароматического ряда формулы (IIр): в которой R1p, R2p, R3p, R4p и R5p имеют соответственно значения R1, R2, R3, R4 и R5, как определено выше, или защищенную функциональную группу, причем вышеуказанный альдегид формулы (IIр) либо обрабатывают восстановителем для получения спирта формулы (III) : 10 кислоту, которую этерифицируют в альфагидрокси сложный эфир формулы (III2): в которой Alc представляет собой алкильный радикал, включающий от 1 до 4 атомов углерода,сложный эфир или спирт формулы (III2) или(III), который обрабатывают с помощью Nгидроксифталимида, при необходимости в присутствии активатора, для получения производного формулы (IV) : который подвергают гидролизу для получения который конденсируют с помощью производного 2-(2-аминотиазол-4-ил) 2-оксо уксусной кислоты формулы (VI): в которой R8 представляет собой атом водорода или защитную группу аминной функциональной группы, для образования производного алкоксииминоуксусной кислоты син формулы из которого при необходимости получают функциональное производное, продукт формулы (VII), или функциональное производное,которое подвергают аминированию с помощью сложного эфира хлоргидрата 7-амино 3-(3-гало 1-пропенил) 8-оксо 5-тиа 1-азабицикло [4.2.0] окт-2-ен-2-карбоновой кислоты формулы (VIII): в которой R9 представляет собой остаток легкорасщепляемого сложного эфира, в результате чего получают производный продукт 7-(Nзамещенный амидо) 3-(3-гало 1-пропенил) 8 оксо 5-тиа 1-азабицикло- [4.2.0] окт-2-ен-2 карбоновой кислоты формулы (IX): который при необходимости превращают в 3-(3 иодопропенил) аналог формулы (X): который обрабатывают основанием формулы R6 для получения продукта формулы (XI): продукт формулы (XI), из которого при необходимости выделяют изомеры (Е) или (Z) или превращают изомеры (Z) в изомеры (Е), продукт формулы (XI), который подвергают при необходимости одной или нескольким из нижеследующих реакций в соответствующем порядке: а) разделению методом гидролиза или за счет воздействия тиомочевины всех или части сложноэфирных защитных групп и защитных групп аминного радикала или гидроксильных радикалов,б) этерификации или солеобразованию с использованием основания карбоксильного радикала,в) солеобразованию путем использования кислоты аминного радикала,г) разделению продуктов в виде смеси R, S на R и S. Предметом настоящего изобретения также является вариант вышеописанного метода, отличающийся тем, что O-замещенный гидроксиламин формулы (V1) подвергают конденсации в продукт формулы (XII): для получения в конечном итоге продукта формулы (XI), как указано выше. Защищенные гидроксильные функциональные группы, которые могут быть представлены R1p, R2p, R3p, R4p и R5p, выбирают среди ацилоксильных групп, таких как, например,формилоксильная, ацетоксильная, пропионилоксильная,хлорацетоксильная,бромацетоксильная, дихлорацетоксильная, трихлорацетоксильная, трифторацетоксильная, метоксиацетоксильная, феноксиацетоксильная, бензоилоксильная,бензоилформоксильная,n-нитробензоилоксильная. Можно также назвать такие группы, как этоксикарбонилоксильная, метоксикарбонилоксильная, пропоксикарбонилоксильная, 2,2,2-трихлорэтоксикарбонилоксильная, аллилоксикарбонилоксильная, триметилсилилэто 13 ксикарбонилоксильная, бензилоксикарбонилоксильная, трет-бутоксикарбонилоксильная, 1-циклопропилэтоксикарбонилоксильная,фталоилоксильная, бутирилоксильная, изобутирилоксильная, валерилоксильная, изовалерилоксильная, оксалилоксильная, сукцинилоксильная и триметилацетилоксильная, фенилацетоксильная,фенилпропионилоксильная,мезилоксильная,хлорбензоилоксильная,паранитробензоилоксильная, пара-трет-бутилбензоилоксильная, каприлилоксильная, акрилоилоксильная, метилкарбамоилоксильная, фенилкарбамоилоксильная, нафтилкарбамоилоксильная. Они могут также быть выбраны среди таких радикалов, как феноксильный, 4-хлорфеноксильный, толилоксильный или третбутилфеноксильный,толилсульфонилоксильный, тетрагидропиранилоксильный, тетрагидротиопиранилоксильный,метокситетрагидропиранилоксильный, тритилоксильный, бензилоксильный, 4-метоксибензилоксильный, бензогидрилоксильный, трихлорэтоксильный, 1 метил 1-метоксиэтоксильный, алкоксиалкоксиметоксильные радикалы, такие как метоксиэтоксиметоксильный, или же триметилсилилэтоксиметоксильный или триметилсилилэтоксильный. Два примыкающих гидроксильных радикала могут также быть защищены, образуя метилендиоксильный, изопропилендиоксильный,1,1-циклогексил бис (оксильный), дифенилметилендиоксильный, карбонатный или гидроксиборанил-бис (оксильный) радикал. Защищенные гидроксильные функциональные группы, которые могут быть представлены R1p, R2p, R3p, R4p и R5p, выбирают, в первую очередь, среди таких групп как метоксиэтоксиметоксильная,пропионилоксиметоксильная,ацетоксиметоксильная, бутоксильная, изобутоксильная, трет-бутоксилъная, пентоксильная,гексилоксильная,бутирилоксиметоксильная,валерилоксиметоксильная, триметилацетилоксиметоксильная, 2-ацетоксиэтоксильная, 2 пропионилоксиэтоксильная,2-бутирилоксиэтоксильная, 2-иодоэтоксильная, 2,2,2-трихлорэтоксильная, винилоксильная, аллилоксильная,этинилоксильная, пропинилоксильная, бензилоксильная, 4-метоксибензилоксильная, 4-нитробензилоксильная, фенилэтоксильная, тритилоксильная, дифенилметилоксильная или 3,4 диметоксифеноксильная. Предпочтение отдается 2-метоксиэтоксиметоксильной группе (МЭМ-O). Остаток легкорасщепляемой сложноэфирной группы, которую представляет R9, выбирают, в частности, среди таких групп, как бутильная, изобутильная, трет-бутильная, пентильная,гексильная, метоксиметильная, этоксиметильная, изопропилоксиметильная, альфа-метоксиэтильная, альфа-этоксиэтильная, метилтиометильная, этилтиометильная, изопропилтиометильная, триметилацетилоксиметильная, аце 000165 14 токсиметильная, пропионилоксиметильная, бутирилоксиметильная,изобутирилоксиметильная, валерилоксиметильная, изовалерилоксиметиль-ная,трет-бутилкарбонилоксиметильная,гексадеканоилоксиметильная, триметилацетилоксиметильная, пропионилоксиметильная, изовалерилоксиэтильная, 1-ацетоксиэтильная, 2 ацетоксиэтильная, 1-пропионилоксиэтильная, 2 пропионилоксиэтильная, 1-бутирилоксиэтильная, 2-бутирилоксиэтильная, 1-(трет-бутилкарбонилокси) этильная, 1-ацетоксипропильная,1-гексадеканоилоксиэтильная,1-пропионилоксипропильная, 1-метоксикарбонилоксиэтильная, метоксикарбонилоксиметильная, 1-ацетоксибутильная,1-ацетоксигексильная,1 ацетоксигептильная, фталидильная, 5,6-диметоксифталидильная,трет-бутилкарбонилметильная, винильная, аллильная, 2-хлораллильная, этинильная, пропинильная, метоксикарбонилметильная, бензильная, 4-метоксибензильная, 4-нитробензильная, фенетильная,тритильная, дифенилметильная, фенильная, 4 хлорфенильная,толильная,трет-бутилфенильная, 3,4-диметоксифенильная, метоксиэтоксиметильная, диметиламиноэтильная, цианометильная, трет-бутоксикарбонилметильная,2,2-этилендиоксиэтильная, цианоэтильная, 2,2 диметоксиэтильная, 2-хлорэтоксиметильная, (2 гидроксиэтокси) этильная, 2,3-эпоксипропильная, 3-диметиламино 2-гидроксипропильная, 2 гидроксиэтильная,2-метиламиноэтоксиметильная, (2-аминоэтокси) метильная, 3-метокси 2,4-тиадиазол-5-ильная, тетрагидропиран-2 ильная, 1-метокси 1-метилэтильная, 2-гидрокси 1-метилэтильная, изопропильная, карбамоилметильная, хлорметильная, 2-хлорэтильная, 2,2,2 трихлорэтильная, 2-иодоэтильная, ацетильная,метильная, 2-метилтиоэтильная, тиоцианатометильная, 2-хлор 1-ацетоксиэтильная, 2-бром 1 ацетоксиэтильная, 2-фтор 1-ацетоксиэтильная,2-метокси 1-ацетоксиэтильная, 2-метил 1 ацетоксипропильная,1-метил 1-ацетоксиэтильная, 1-(метоксиацетокси) этильная, 1 ацетилкарбонилоксиэтильная,1-гидроксиацетоксиэтильная, 1-(2-тиенил) карбонилоксиэтильная, 1-(2-фурил) карбонилоксиэтильная, 1(5-нитро 2-фурил) карбонилоксиэтильная, 1-(2 пирролил) карбонилоксиэтильная,1(пропионилоксикарбонилокси) этильная, 1(пропоксикарбонилокси) этильная, 1-(изопропоксикарбонилокси) этильная,1-(метоксиэтоксикарбонилокси) этильная, 1-(аллилоксикарбонилокси) этильная, изопропоксикарбонилметильная, 1-[(2,3-эпоксипропил) оксикарбонилокси] этильная, 1-[(2-фурил) метоксикарбонилокси] этильная, 1-[(2-фторэтокси) карбонилокси] этильная, 1-(метоксикарбонилокси) пропильная, 1-(метоксикарбонилокси) 1 метилэтильная, (метоксикарбонилокси) хлорметильная,1-(метоксикарбонилокси) 2-хлорэтильная, 1-(метоксикарбонилокси) 2-метокси 15 этильная, 1-(метоксикарбонилокси) аллильная или 5-метил 2-оксо 1,3-диоксол-4-ильная. Предпочтение отдается дифенилметильному радикалу. Защитной группой аминного радикала, которую может представлять R8, может быть, например, карбамоильная, метилкарбамоильная,фенилкарбамоильная,нафтилкарбамоильная группа, а также соответствующие тиокарбамоилы, замещенный или незамещенный алкильный радикал, включающий от 1 до 6 атомов углерода, такой как, в первую очередь, трихлорэтильный, трет-бутилъный или трет-амильный, аралкильный радикал, такой как бензильный, 4 метоксибензильный, фенетильный, тритильный,3,4-диметоксибензильный или бензогидрильный, ацильный алифатический, ароматический или гетероциклический радикал, замещенный или незамещенный, такой как, например, формильный, ацетильный, пропионильный, бутирильный, изобутирильный, валерильный, изовалерильный, хлорацетильный, дихлорацетильный, трихлорацетильный, бромацетильный,трифторацетилбензоильный,толуолильный,нафтоильный, хлорбензоильный, паранитробензоильный, пара-трет-бутилбензоильный, феноксиацетильный, каприлильный, деканоильный, акрилоильный, фталоильный, мезильный,фенилацетильный, фенилпропионильный, оксалильный, сукцинильный, триметилацетильный,низший алкоксикарбонильный или циклоалкоксикарбонильный радикал, такой как, например, метоксикарбонильный, этоксикарбонильный, пропоксикарбонильный, 1-циклопропилэтоксикарбонильный, изопропоксикарбонильный,бутоксикарбонильный,третбутоксикарбонильный, пентоксикарбонильный,гексилоксикарбонильный,трихлорэтоксикарбонильный, аралкоксикарбонильная группа,такая как бензилоксикарбонильная. Предпочтение отдается тритильной группе. Приведенный выше перечень не является исчерпывающим; очевидно, что использоваться могут также другие аминозащитные группы,хорошо знакомые специалистам, группы, известные, в частности, в химии пептидов. Восстановителем, которым воздействуют на альдегид формулы (IIp), является, в частности, гидрид, такой как боргидрид натрия или алюмогидрид лития или же гидрид диизобутилалюминия. Этерификация альфа-гидрокси кислоты формулы (III1) может осуществляться методами,хорошо известными специалистам, в частности,путем воздействия диазометаном, растворенным в метиленхлориде или в тетрагидрофуране. Активатором, в присутствии которого осуществляется реакция N-гидроксифталимида,может быть агент переноса фазы. Подобные реактивы хорошо известны специалистам. 16 Гидролиз фталимида формулы (IV) выполняется путем воздействия гидразином, желательно в форме гидрата. Функциональным производным кислоты формулы (VII) может быть, например, галогенид, симметричный или смешанный ангидрид,амид, азид или активированный сложный эфир. В качестве примера смешанного ангидрида можно назвать, например, ангидрид, полученный с помощью изобутилхлорформиата, или ангидрид, полученный с помощью хлорида триметилацетата, и смешанные карбоксисульфоновые ангидриды, полученные, например, с помощью хлорида паратолуолсульфонила. В качестве примера активированного сложного эфира можно назвать сложный эфир,полученный с помощью 2,4-динитрофенола, а также сложный эфир, полученный с помощью гидроксибензотиазола. В качестве примера галогенида можно назвать хлорид или бромид. Ангидрид может быть получен на месте путем воздействия N,N'-двузамещенным карбодиимидом,например,N,N-дициклогексилкарбодиимидом. Реакция ацилирования выполняется, предпочтительно, в органическом растворителе, таком как метиленхлорид. Однако использовать можно также и другие растворители, такие как тетрагидрофуран, трихлорметан или диметилформамид. При использовании галогенида кислоты и,вообще, когда в ходе реакции происходит выделение молекулы кислоты, реакция выполняется преимущественно в присутствии основания,такого как карбонаты и бикарбонаты натрия или калия, ацетат натрия, триэтиламин, N,Nдиизопропилэтиламин, пиридин, морфолин илиN-метилморфолин. Как правило, температура реакции ниже комнатной температуры или равна ей. Может также производиться непосредственная реакция продукта формулы (VII) с продуктом формулы (VIII) в присутствии карбодиимида, такого как диизопропилкарбодиимид или 1-(3-диметиламинопропил) 3-этилкарбодиимид (ЭКД). Пример подобного приготовления приводится в нижеследующей экспериментальной части. Операция с реактивами, способная ввести радикал R6 и привести к получению продукта формулы (XI), выполняется при следующих условиях: Когда Hal представляет собой, например,атом хлора, на месте или отдельно можно произвести замещение атома хлора атомом иода в присутствии иодида натрия с последующим добавлением желаемого реактива, в присутствии или отсутствии органического растворителя, такого как дихлорметан, ацетонитрил, тетрагидрофуран, ацетон или метилэтилкетон. Можно также вызвать непосредственную реакцию продукта формулы (IX) или (X) с соот 17 ветствующим реактивом формулы R6, в присутствии тетрафторбората серебра. Изомерия продуктов формулы (XI) может отличаться от изомерии продуктов формулы(IХ) или (X). В случае выделения изомера Z указанный изомер может быть превращен в изомер Е обычно применяемыми методами, в частности, путем воздействия иодом. В зависимости от значений R8, R9, R1p, R2p,R3p, R4p и R5p воздействие на продукт формулы(XI) одного или нескольких гидрозилирующих,гидрогенолизирующих веществ или тиомочевины имеет целью удаление радикала R8, когда он представляет собой защитную группу аминного радикала, превращение радикалов R1p, R2p, R3p,R4p и R5 р соответственно в радикалы R1, R2, R3,R4 и R5, когда последние представляют собой защитную группу гидроксильных радикалов и/или удаление радикала R9, когда он представляет одну из тех легко расщепляемых сложноэфирных групп, которые требуется удалить. Вместе с тем, имеется возможность удаления R8 и превращения радикалов R1p, R2p, R3p,R4p и R5 р соответственно в радикалы R1, R2, R3,R4 и R5, когда последние содержат защитную группу гидроксильных радикалов, не касаясь заместителя R9, если последний должен быть сохранен. Реактивы, используемые в этом случае, хорошо известны специалистам. Описание различных методов выделения различных защитных групп приводится, например, во французском патенте В. F. 2.499.995. Примеры подобных реакций приводятся ниже, в экспериментальной части. В соответствии с характером предпочтительно используемых защитных групп: тритила для R8, 2-метоксиэтоксиметила - для защиты гидроксильных функциональных групп, и 4 метоксибензила - для R9, используется, в первую очередь, смесь трифторуксусной кислоты и анизола без растворителя или в таком растворителе, как метиленхлорид. Таким образом получают соль с трифторуксусной кислотой. При желании, вернуться к свободному основанию можно воздействием основания, такого как карбонат или триэтиламин. Солеобразование продуктов может выполняться обычными методами, хорошо известными специалистам; оно может выполняться, например, путем воздействия на продукт в виде кислоты или на сольват, такой как, например,этаноловый сольват или гидрат этой кислоты,минеральным основанием, таким как едкий натр или едкое кали, карбонат или бикарбонат натрия или калия. Использовать можно также кислые минеральные соли, такие как третичный фосфат натрия. Возможно также и использование кислых органических солей, таких как, например,натриевые соли алифатических карбоновых кислот, линейные или разветвленные, насыщенные или ненасыщенные, включающие от 1 до 18 или, предпочтительно, от 2 до 10 атомов угле 000165 18 рода. Алифатические цепи указанных кислот могут прерываться одним или несколькими гетероатомами, такими как кислород или сера,или быть замещены арильными радикалами,такими как фенил, тиенил или фурил, одним или несколькими гидроксильными радикалами или одним или несколькими галогенными атомами, такими как фтор, хлор или бром, в первую очередь хлор, одним или несколькими низшими карбоксильными или алкоксикарбонильными радикалами, в первую очередь метоксикарбонильным, этоксикарбонильным или пропилоксикарбонильным, одним или несколькими арилоксильными радикалами, в первую очередь феноксильным. Кроме этого, в качестве органических кислот можно использовать достаточно растворимые ароматические кислоты, такие как, например, бензойные кислоты, замещенные, в первую очередь, низшими алкильными радикалами. В качестве примеров подобных органических кислот можно назвать такие кислоты, как муравьиная, уксусная, акриловая, бутановая,адипиновая, изомасляная, н-капроновая, изокапроновая, хлорпропионовая, кротоновая, фенилуксусная, (2-тиенил) уксусная, (3-тиенил) уксусная, (4-этилфенил) уксусная, глутаровая,сложный моноэтиловый эфир адипиновой кислоты, 2-гексеновая, гептановая, декановая,олеиновая, стеариновая, пальмитиновая, 3 гидроксипропионовая, 3-метоксипропионовая,3-метилтиобутановая,4-хлорбутановая,4 фенилбутановая, 3-феноксибутановая, 4-этилбензойная, 1-пропилбензойная кислоты. Однако в качестве натриевых солей предпочтительно использование ацетата натрия, 2 этилгексаноата натрия или диэтилацетата натрия. Солеобразование может также производиться путем воздействия органического основания, такого как триэтиламин, диэтиламин,триметиламин,пропиламин,N,Nдиметилэтаноламин, три [(гидроксиметил) амино] метан, метиламин, этаноламин, пиридин,пиколин, дициклогексиламин, морфолин и бензиламин. Оно может также производиться воздействием аргинина, лизина, прокаина, гистидина, Nметилглюкамина. Указанное солеобразование желательно осуществлять в растворителе или в смеси растворителей, таких как вода, этиловый эфир, метанол, этанол или ацетон. В зависимости от условий выполнения реакции, полученные соли могут иметь аморфную или кристаллическую форму. Кристаллические соли получают, в первую очередь, путем воздействия свободными кислотами на одну из солей вышеуказанных алифатических карбоновых кислот. Солеобразование с помощью неорганических или органических кислот производится в 19 обычных условиях, хорошо известных специалистам. Возможное превращение продуктов в сложный эфир также осуществляется в обычных условиях. Как правило, указанная операция производится путем реакции кислоты формулы(I) или функционального производного с одним из производных формулы: ZRe, в которой Z представляет собой гидроксильный радикал или галогенный атом, такой как хлор, бром, иод, aRe означает вводимую сложноэфирную группу из групп, перечисленных в вышеприведенном неисчерпывающем перечне. В некоторых случаях может оказаться интересным выполнить этерификацию на продукте, в котором амин и/или функциональные группы, имеющиеся в оксиимино, заблокированы до удаления защитной группы амина и функциональной группы, присутствующих в оксиимино. Продукты формулы (I) включают несколько асимметричных атомов углерода. В цефемном ядре, содержащем два асимметричных атома углерода, оба атома расположены в конформации R. Кроме того, радикал, присутствующий в оксииминной функциональной группе, также может включать асимметричный атом углерода,который может иметь форму R или S или же форму смеси R + S. Разделение двух диастереоизомеров может производиться методами, хорошо известными специалистам, например, методом хроматографии. Продукты общей формулы (I) обладают высокой антибиотической активностью в отношении грамположительных бактерий, таких как стафилококки, стрептококки и, в частности, пенициллинустойчивые стафилококки. Их эффективность в отношении энтеробактерий, производящих хромосомные или плазмидические лактамазы, особенно примечательна. Вышеперечисленные свойства позволяют использовать указанные продукты, а также их кислые соли, приемлемые с фармацевтической точки зрения, в качестве медикаментов при лечении инфекций, связанных с чувствительными микробами, в частности, при лечении стафилококковых инфекций, таких как стафилококковая септицемия, злокачественные лицевые или кожные стафилококковые инфекции, пиодермии,септические или гнойные раны, карбункулы,флегмоны, рожа, острые первичные или постгриппозные стафилококковые инфекции, бронхопневмонии, легочные нагноения, менингиты,а также при лечении инфекций у лиц, страдающих иммунодепрессией. Вышеуказанные продукты могут также использоваться в качестве медикаментов при лечении коли-инфекций и сочетаний инфекций,в случае протеусных, клебсиелльных и сальмонелльных инфекций и иных заболеваний, вызванных грамотрицательными бактериями. В соответствии с изложенным, предметом настоящего изобретения на медикаментозном 20 уровне и, в частности, на уровне антибиотиков являются также продукты формулы (I), как указано выше, а также их кислые соли, приемлемые с фармацевтической точки зрения. Предметом настоящего изобретения на медикаментозном уровне являются, в частности,предпочтительные продукты формулы (I), как указано выше, и, в частности те, в которых R6 выбран среди таких радикалов, как хинолиний,изохинолиний, 4-(метилтио) пиридиний, тиено[2,3-b] пиридиний, 1-метилпирролидиний, Nметил N-этил N-(2-амино 2-оксоэтил) аминий,имидазо (1,2-а) пиридиний и 6,7-дигидро 5 Н-1 пиридиний. Предметом настоящего изобретения на медикаментозном уровне являются, в первую очередь, антибиотики, имеющие следующие наименования:- внутрикомплексная соль (6R-(3-(Е) 6,7-(Z 1-(3-(7-2-амино 4-тиазолил) метоксикарбонил) (3,4-дигидрокси 5-фторфенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа 1-азабицикло [4.2.0] окт-2-ен-3-ил) 2 пропенил) хинолиния,а также их соли, допустимые с фармацевтической точки зрения. Изобретение относится к применению соединений формулы (I) в качестве действующего начала в фармацевтических композициях. Указанные композиции могут применяться внутрь, ректальным путем, парентеральным путем, в частности внутримышечно, или локально нанесением на кожу и на слизистые оболочки. Соединения формулы (I), в частности те из них, в которых А представляет собой расщепляемый сложный эфир, могут применяться внутрь. Композиции настоящего изобретения могут быть твердыми или жидкими и иметь любую фармацевтическую форму, широко применяемую при лечении человека, как, например,простые или дражевидные таблетки, капсулы,гранулы, суппозитории, препараты для инъекций, мази, кремы, гели; изготавливают их в соответствии с общепринятыми у специалистов методами. Действующее начало (действующие начала) вводится (вводятся) в основы, обычно используемые при изготовлении фармацевтических композиций, такие как тальк, аравийская камедь, лактоза, амидон, стеарат магния, какаомасло, водные или безводные связующие, жиры животного или растительного происхождения,производные парафина, гликоли, различные увлажняющие, диспергирующие или эмульсионные агенты, консерванты. Указанные композиции могут, в частности,иметь форму порошка, предназначенного для предварительного растворения в соответствующем связующем, например в стерильной апирогенной воде. Применяемые дозы зависят от заболевания, от особенностей больного, способа приема и особенностей используемого препарата. Дозы для человека могут, например, составлять от 0,250 до 4 г в день, при приеме внутрь - в случае продукта, описанного в примере 1, или же от 0,500 г до 1 г три раза в день при внутримышечном введении. Продукты формулы (I) могут также использоваться для дезинфекции хирургических инструментов. Продукты формулы (II) общеизвестны и,большей частью встречаются в торговой сети. Другие продукты могут быть получены на основе продуктов, встречающихся в торговой сети, с использованием методов, описанных в патентной заявке ЕЭС 0551034. Для получения продуктов формулы (II) можно также использовать 22 методы, описанные в специализированной литературе, в частности так называемое восстановление Роземунда, восстановление бензойных кислот, или формилирование ароматических циклов, как, например реакция ВилсмейераХаака, Гаттермана-Коха, реакция РеймераТиманна или реакция с использованием фтористого формила (J. Am. Chem. Soc. 82, 2380(I960. Продукты формул (VI) и (VIII) также известны по специализированной литературе, в частности по бельгийской патентной заявке BE 864828 и патентной заявке ЕЭС ЕР 0333154. Продукты формулы (XII) можно получить по способу, согласно которому соединение формулы VI, при необходимости его функциональное производное, подвергают взаимодействию с соединением формулы VIII с получением соответствующего амида, у которого, при необходимости, 3-галоген-1-пропенильный радикал,находящийся в положении 3, переводят в соответствующее иодное производное и обрабатывают 3-галоген- или 3-иод-1-пропенильное соединение основанием формулы R6 с получением соединения формулы ХII. Приводимые далее примеры иллюстрируют изобретение, вместе с тем не ограничивая его. Пример 1. Внутрикомплексная соль (6R-(3(Е) 6, 7-(Z 1-(3-(7-2-амино 4-тиазолил) 2,5-дихлор 3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа 1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) хинолиния. ЭТАП А. 2,5-дихлор 3,4-бис (2-метоксиэтокси) метоксибензиловая кислота. В раствор 16,1 г 2,5-дихлор-3,4-бис-(2 метоксиэтокси) метоксибензальдегида в 200 мл метанола добавляют при температуре 0 С порциями 1,59 г боргидрида натрия. Затем взбалтывают в течение 30 мин при температуре 0 С и добавляют 2,4 мл уксусной кислоты, давая температуре подняться до уровня комнатной. После этого выпаривают досуха при пониженном давлении и поглощают остаток в 80 мл этилацетата,промывают водным солевым раствором, высушивают, фильтруют и выпаривают досуха при пониженном давлении, в результате чего получают 13,6 г искомого продукта, который используют на следующем этапе без дополнительной обработки. Инфракрасный спектр (СНС 1 з) ОН: 3610 см-1 Ароматическое соединение: 1555 см-1 Спектр ЯМР (CDCl3) 3,38 (m) : СН 3 ОМЕМ; 3,58 (m) 4,00 (m) 5,24 (s) 5,25 (s) : СН 2 ОМЕМ; 4,78 (s) : СН 2 спирта; 7,35 (s) : Н ароматические соединения. 23 ЭТАП Б. (2,5-дихлор 3,4-бис (2-метоксиэтокси) метокси)-фенил) 1,3-дигидро 1,3 диоксо-2 Н-изоиндол-2 ил) окси) метил. В охлажденный до температуры 0 С раствор 18,39 г трифенилфосфина в 150 мл тетрагидрофурана добавляют по капле, не превышая температуры +5 С, 11,09 мл азодикарбоксилата диэтила, затем взбалтывают в течение 15 мин и добавляют порциями 11,43 г N-гидроксифталимида. После этого охлаждают до температуры 0 С и добавляют по капле раствор 13,6 г продукта, полученного на вышеописанном этапе А, в 40 мл тетрагидрофурана; после взбалтывания в течение 1 ч при температуре 0 С доводят досуха при пониженном давлении. Затем остаток поглощают в 100 мл этилацетата, промывают водой, высушивают, фильтруют и выпаривают досуха при пониженном давлении. Таким образом, получают 50 г продукта, который подвергают хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и этилацетата (80 : 20. В результате получают 17,9 г искомого продукта. Инфракрасный спектр 1790 см-1 1750 см-1 С=O 1736 см-1 1610 см-1 Ароматич. 1560 см-1 Спектр ЯМР (CDCl3) 3,38 (s) : СН 3 ОМЕМ; 3,57 - 3,98 - 5,25 5,27 : СН 2 ОМЕМ; 7,52 (s) - 7,75 по 7,84 (m) : ароматические соединения. ЭТАП В. 2,5-дихлор 3,4-бис (2-метоксиэтокси) метоксиоксиаминобензил. В охлажденный до температуры 0 С раствор 17,7 г продукта, полученного на вышеописанном этапе Б, в 120 мл дихлорметана добавляют 3,24 мл гидразингидрата, а затем взбалтывают в течение 1 ч при температуре 0 С. Нерастворимую фракцию фильтруют и концентрируют досуха при пониженном давлении, после чего остаток поглощают в 50 мл этилового эфира, промывают водой, высушивают и выпаривают досуха при пониженном давлении. Полученный продукт подвергают хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и этилацетата (80 : 20. Таким образом получают 9,6 г продукта, который поглощают в 80 мл этилового эфира, промывают водой, высушивают и выпаривают досуха при пониженном давлении. В результате получают 9,15 г искомого продукта. Инфракрасный спектр (СНС 13) 3324 см-1(2-трифенилметил) амино) 4-тиазолуксусная кислота. В суспензию 8,34 г продукта, полученного на вышеописанном этапе В, в 80 мл метанола добавляют порциями при комнатной температуре 9,5 г оксо-[2-[(трифенилметил) амино]тиазол-4-ил] уксусной кислоты (описание которой приводится в бельгийской патентной заявке 864828). Затем взбалтывают в течение 1 ч и выпаривают досуха. Остаток поглощают в метиленхлориде, промывают 0,1 н. хлористоводородной кислотой, высушивают, фильтруют и концентрируют досуха. Таким образом получают 20 г продукта, который подвергают хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и метанола. Затем повторно подвергают хроматографии в тех же условиях и получают 13,51 г искомого продукта. Инфракрасный спектр (СНСl3) 3404 см-1(2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. В раствор 8,1 г продукта, полученного на вышеописанном этапе Г, в 40 мл метиленхлорида добавляют 4,37 г хлоргидрата 7-амино 3-[3 хлор 1-пропенил) 8-оксо 5-тиа 1-азабицикло(4.2.0) окт-2-ен-2-карбоксилат (4-метоксифенил) метила (описание которого приводится в патентной заявке ЕЭС 0333154). Затем охлаждают до температуры -5 С и вводят 2,33 г диметиламинопропилэтилкарбодиимида, после чего взбалтывают в течение 2 ч 30 мин при температуре 0 С. Затем дважды промывают, используя оба раза 10 мл фосфатного буферного раствора при рН 7, а затем промывают соленой водой,высушивают, фильтруют и выпаривают досуха при пониженном давлении, в результате чего получают 10,54 г продукта, который подвергают хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и этилового эфира (90 : 10. В результате получают 6,52 г искомого продукта. Спектр ЯМР (CDCl3) 3,27 (d, j = 18) - 3,45 (d, j = 18) : CH2S; 3,36-CH=CH=CH2Cl (дельта Z); 6,02 (dt) и 7,04 (d, j = 15) : -CH=CH=CH2Cl (дельта Е); 7,30 (m) : тритил; 6,88 по 7,30 : ароматические соединения; 5,15 по 5,37 : О-СН 2-Ф. ЭТАП Е. [6R (3 (Е), 6, 7 (Z] 3-(3-иод 1 пропенил) 7-2,5-дихлор-3,4-бис 2-метоксиэтокси) метокси) фенилметокси) имино) (2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. В раствор 3,1 г продукта, полученного на вышеописанном этапе Д, в 12,5 мл ацетона добавляют 1,59 г иодида натрия и один кристалл иода. Затем взбалтывают в течение 40 мин при комнатной температуре, выпаривают досуха при пониженном давлении и поглощают в 10 мл метиленхлорида, промывают 10%-ным водным раствором тиосульфата натрия, а затем соленой водой, высушивают, фильтруют и концентрируют досуха при пониженном давлении. В результате получают 3,79 г искомого продукта,который используют без дополнительной обработки на следующем этапе. ЭТАП Ж. (6R (3 (Е), 6, 7 (Z] иодид 1(3-(7-2,5-дихлор-3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино)(2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 2-4-метоксифенил) метокси) карбонил) 8-оксо-5-тиа-1-азабицикло (4.2.0) окт-2-ен 3-ил)-2-пропенил)-хинолиния. В раствор соединения, полученного на вышеописанном этапе Е, в 3-4 мл метиленхлорида добавляют 1,57 мл повторно дистиллированного хинолина. Затем растворитель выпаривают при пониженном давлении и взбалтывают в течение 1 ч при нормальном давлении. После этого добавляют этиловый эфир, взбалтывают в течение 30 мин, центрифугируют, промывают эфиром и высушивают при пониженном давлении. Таким образом получают 4 г продукта, который подвергают хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и метанола (95 : 05. В результате получают 2,18 г искомого продукта. Инфракрасный спектр 3404 см-1(4.2.0) окт-2-ен-3-ил)-2-пропенил)-хинолиния. В течение 10 мин при температуре 0 С взбалтывают раствор 2,1 г продукта, полученного на вышеописанном этапе Ж, в 20 мл охлажденного до температуры 0 С раствора трифторуксусной кислоты при 10% анизола, после чего дают температуре подняться и взбалтывают в течение 2 ч 30 мин при комнатной температуре. Затем фильтруют, промывают с использованием нескольких миллилитров трифторуксусной кислоты, охлаждают до температуры 0 С и добавляют 70 мл этилового эфира. После этого взбалтывают в течение 10 мин при температуре 0 С, а затем в течение 90 мин при комнатной температуре. Затем фильтруют, трижды промывают,используя каждый раз 10 мл этилового эфира, и снова взбалтывают полученный продукт в течение 1 ч с 30 мл этилового эфира. Затем фильтруют, как указано выше, и высушивают при пониженном давлении. В результате получают 1,076 г целевого продукта. Инфракрасный спектр (Вазелиновое масло) Поглощение в области ОН/ТР 1778 см-1(Е) 6, 7-(Z 1-(3-(7-2-амино 4-тиазолил) 2,5-дихлор 3,4-дигидроксифенил) метокси) имино) ацетил) амино) 2-карбокси 8-оксо 5-тиа 1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил)-имидазо (1,2-а) пиридиния. ЭТАП А. [6R (3 (Е), 6, 7 (Z] 3-(3-хлор 1-пропенил) 7-2,5 дихлор-3,4-бис 2-метоксиэтокси) метокси) фенилметокси) имино) (2 27 трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. Операции выполняют как на этапе Е примера 1 на основе 3,2 г продукта, полученного на этапе Д примера 1, в результате чего получают 3,55 г искомого продукта, который используют на следующем этапе без дополнительной обработки. ЭТАП Б. (6R (3 (Е), 6, 7 (Z иодид 1-(3(7-2,5 дихлор-3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 24-метоксифенил) метокси) карбонил) 8-оксо 5-тиа-1-азабицикло (4.2.0) окт-2-ен-3-ил)-2 пропенил)-имидазо (1,2 а) пиридиния. Операции выполняют как на этапе Ж примера 1 на основе 3,55 г продукта, полученного на вышеописанном этапе А, с использованием 0,69 мл имидазо (1,2 а) пиридина, в результате чего получают 4,05 г сырого продукта, который подвергают хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и метанола(4.2.0) окт-2-ен-3-ил)-2-пропенил)-имидазо (1,2-а) пиридиния. Операции выполняют как на этапе З примера 1 на основе 1,45 г продукта, полученного на вышеописанном этапе Б, с использованием 14 мл раствора трифторуксусной кислоты при 28 10% анизола, в результате чего получают 0,678 г целевого продукта. Инфракрасный спектр (Вазелиновое масло) Поглощение в области OH/NH 1774 см-1(2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. Операции выполняют как на этапе Е примера 1 на основе 3,2 г продукта, полученного на этапе Д примера 1, в результате чего получают 3,33 г искомого продукта, который используют на следующем этапе без дополнительной обработки. ЭТАП Б. (6R (3 (Е), 6, 7 (Z иодид 1-(3(7-2,5 дихлор-3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино)(2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 2-4-метоксифенил) метокси) карбонил) 8-оксо-5-тиа-1-азабицикло (4.2.0) окт-2-ен 3-ил)-2-пропенил)-6,7 дигидро 5 Н-1-пиридиния. Операции выполняют как на этапе Ж примера 1 на основе 3,33 г продукта, полученного на вышеописанном этапе А, с использованием 1,60 мл (2,3) циклопентапиридина, после чего получают 3,55 г сырого продукта, который подвергают хроматографии на двуокиси кремния(4.2.0) окт-2-ен-3-ил)-2-пропенил)-6,7 дигидро 5 Н-1-пиридиния. Операции выполняют как на этапе 3 примера 1 на основе 2,18 г продукта, полученного на вышеописанном этапе Б, с использованием 20 мл раствора трифторуксусной кислоты при 10% анизола, в результате чего получают 1,094 г целевого продукта. Инфракрасный спектр (Вазелиновое масло) Поглощение в области OH/NH 1780 см-1(Е) 6, 7-(Z 1-(3-(7-2-амино-4-тиазолил) 2,5-дифтор-3,4-дигидроксифенил)-метокси)имино)-ацетил)-амино)-2-карбокси-8-оксо-5 тиа-1-азабицикло (4.2.0) окт-2-ен-3-ил)-2-пропенил) хинолиния. ЭТАП А. 2,5 дихлор-3,4-бис 2-метоксиэтокси) метоксибензиловый спирт. Операции выполняют как на этапе А примера 1 на основе 21 г 2,5-дифтор 3,4-бис (2 метоксиэтокси) метоксибензальдегида с использованием 2,26 г боргидирида натрия. В результате получают 20,53 г искомого продукта. Спектр ЯМР (CDCl3) 3,36 (s) : СН 3 ОМЕМ; 3,56 (m) 3,94 (m) 5,22(s) 5,24 (s) : СН 2 OMEM; 4,67 (s) : СН 2 спирта; 5,96 (s) : Н 6 ароматическое соединение. ЭТАП Б. (2,5 дифтор-3,4-бис (2-метоксиэтокси) метокси)-фенил) (1,3-дигидро 1,3 диоксо-2 Н-изоиндол-2-ил) окси) метил. Операции выполняют как на этапе Б примера 1 на основе 2 г спирта, полученного на вышеописанном этапе А, с использованием 2,98 г трифенилфосфина, 1,79 мл азодикарбоксилата(dd) : H6; 7,78 : ароматические соединения. ЭТАП В. 2,5 дифтор-3,4-бис (2-метоксиэтокси) метоксиоксиаминобензил. Операции выполняют как на этапе В примера 1 на основе 14,8 г продукта, полученного на вышеописанном этапе Б, и 2,12 мл гидразингидрата и получают после хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и этилацетата (60 : 40 7,2 г искомого продукта. Инфракрасный спектр (СНС 13) 3335 и 1585 см-1(2-трифенилметил) амино) 4-тиазолуксусная кислота. Операции выполняют как на этапе Г примера 1 на основе 4 г продукта, полученного на вышеописанном этапе В, с использованием 4,92 г оксо-[2-[(трифенилметил) амино] тиазол-4-ил] уксусной кислоты (описание которой приводится в бельгийской патентной заявке 864828). В результате после хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и метанола (90 : 10 получают 7,53 г искомого продукта. Инфракрасный спектр (СНСl3)H6 ароматическое соединение. ЭТАП Д. [6R (3 (Е), 6, 7 (Z] 3-(3-хлор 1-пропенил) 7-2,5 дифтор-3,4-бис (метоксиэтокси) метокси) фенилметокси) имино) (2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. Операции выполняют как на этапе Д примера 1 на основе 1,78 г продукта, полученного на вышеописанном этапе Г, и 780 мг хлоргидрата 7-амино 3-[3-хлор 1-пропенил) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2-ен-2-карбоксилат (4 метоксифенил) метила (описание которого приводится в патентной заявке ЕЭС 0333154). В результате после хроматографии на двуокиси 31 кремния (элюант : смесь метиленхлорида и этилацетата (80 : 20 получают 1 г искомого продукта. Спектр ЯМР (CDCl3). 3,30 - 3,44 (s) : CH2S; 3,33 - 3,35 (s) : СН 3 ОМЕМ; 3,55 - 3,92 (m) и 3,74 (dd) : СН 2 ОМЕМ,СН=СН-СН 2-Х; 5,15 - 5,21 (АВ) - 5,31 (АВ) : OСН 2-O ОМЕМ, CH2-O-N, О-СН 3-Ф; 3,80 : метоксибензил; 7,30 (m) : тритил; 6,88 : ароматические соединения; 5,91(dd) : Н 7; 6,75 : Н 5 тиазол; 6,71 (d) : CO-NH-CH; 6,98 (s) : NH для Z : 5,09 (d) : Н 6; 5,72 (dt) : -СH=СНСН 2; 6,74 (d, j = 8,5) : -СН=СН-СН 2 для Е : 4,99 : Н 6; 6,85 : (CН=СН-СН 2) ЭТАП Е. [6R (3 (Е), 6, 7 (Z] 3-(3-иод 1 пропенил) 7-2,5 дифтор-3,4-бис 2-метоксиэтокси) метокси) фенилметокси) имино) (2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. Операции выполняют как на этапе Е примера 1 на основе 6 г продукта, полученного как на вышеописанном этапе Д, с использованием 3,15 г иодида натрия. В результате было получено 6,45 г искомого продукта, который используют на следующем этапе без дополнительной обработки. ЭТАП Ж. (6R (3 (Е), 6, 7 (Z иодид 1(3-(7-2,5 дифтор-3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино)(2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 2-4-метоксифенил) метокси) карбонил) 8-оксо-5-тиа-1-азабицикло (4.2.0) окт-2-ен 3-ил)-2-пропенил)-хинолиния. Операции выполняют как на этапе Ж примера 1 на основе 2 г соединения, полученного на вышеописанном этапе Е, с использованием 0,954 мл хинолина. В результате, после хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и метанола (92 : 08 получают 684 мг искомого продукта. ЭТАП З. Внутрикомплексная соль (6R (3(Е), 6, 7 (Z 1-3-(7-2-амино-4-тиазолил) 2,5 дифтор-3,4-дигидроксифенил)-метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа 1-азабицикло (4.2.0) окт-2-ен-3-ил)-2-пропенил) хинолиния. Операции выполняют как на этапе 3 примера 1 на основе 663 мг продукта, полученного на вышеописанном этапе Ж, с использованием 6 мл трифторуксусной кислоты при 10% анизола,в результате чего получают 321 г целевого продукта. Спектр ЯМР (Диметилсульфоксид). 3,53 - 3,72 (d, j = 17,5) : CH2S; 5,04 (s) : ФCH2-O; 5,16 (d, j = 5) : H6; 5,78 (dd, j = 58) :(Е) 6, 7 (Z 1-(3-(7-2-амино 4-тиазолил) 2,5-дифтор-3,4-дигидроксифенил) метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа 1-азабицикло (4.2.0) окт-2-ен-3-ил)-2-пропенил)-имидазо (1,2-а) пиридиния. ЭТАП А. (6R (3 (Е), 6, 7 (Z иодид 1-(3(7-2,5-дифтор-3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 24-метоксифенил) метокси) карбонил) 8-оксо 5-тиа-1-азабицикло (4.2.0) окт-2-ен-3-ил)-2 пропенил)-имидазо (1,2-а) пиридиния. Операции выполняют как на этапе Ж примера 1 на основе 2 г продукта, полученного на этапе Е примера 4, с использованием 0,492 мл имидазо (1,2-а) пиридина, в результате чего после хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и метанола (96 : 04 получают 950 мг искомого продукта. ЭТАП Б. Внутрикомплексная соль (6R (3(4.2.0) окт-2-ен-3-ил)-2-пропенил)-имидазо (1,2-а) пиридиния. Операции выполняют как на этапе З примера 1 на основе 940 мг продукта, полученного на вышеописанном этапе А, с использованием 9 мл раствора трифторуксусной кислоты при 10% анизола, в результате чего получают 0,351 г целевого продукта. Спектр ЯМР (Диметилсульфоксид). 3,53 - 3,72 (d) : CH2S; 5,05 (s) : Ф-СН 2-O; 5,17 (d) : Н 6; 5,78 (dd) : H7; 5,28 (m) : =CH-CH2N+; 6,25 (dt, j = 166) : =CH-CH2-N+; 6,70 (dd, j(2 трифенилметил) амино) 4-тиазолил) ацетил) амино) 2-4-метоксифенил) метокси) карбонил) 8-оксо-5-тиа-1-азабицикло (4.2.0) окт-2-ен 3-ил)-2-пропенил)-6,7-дигидро 5 Н-1-пиридиния. Операции выполняют как на этапе Ж примера 1 на основе 2 г продукта, полученного на этапе Е примера 4, с использованием 0,595 мл(2,3) циклопентенопиридина, в результате чего после хроматографии на двуокиси кремния(4.2.0) окт-2-ен-3-ил)-2-пропенил)-6,7 дигидро 5 Н-1-пиридиния. Операции выполняют как на этапе З примера 1 на основе 899 мг продукта, полученного на вышеописанном этапе А, с использованием 8 мл раствора трифторуксусной кислоты при 10% анизола, в результате чего получают 420 мг целевого продукта. Спектр ЯМР (Диметилсульфоксид). 2,24 (m) - 3,14 (t) - 3,37 (t) : пиридиний; 3,55 - 3,78 (d) : CH2S; 5,06 (s) : Ф-СН 2-O; 5,19 (d)(Е) 6, 7-(Z 1-(3-(7-2-амино-4-тиазолил) 3,4-дигидрокси-5-фторфенил) метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа-1 азабицикло (4.2.0) окт-2-ен-3-ил)-2-пропенил)хинолиния. ЭТАП А. 5-фтор 3,4-бис (2-метоксиэтокси) метоксибензиловый спирт. Операции выполняют как на этапе А примера 1 на основе 9,2 г (5-фтор 3,4 дигидроксифенил) метоксибензальдегида, с использованием 1,02 г боргидрида натрия. В результате получают 7,7 г искомого продукта, который используют на следующем этапе без дополнительной обработки. ЭТАП Б. (5-фтор-3,4 бис (2-метоксиэтокси) метокси) фенил) 1,3-дигидро 1,3 диоксо-2 Н-изоиндол-2-ил) окси) метил. Операции выполняют как на этапе Б примера 1 с использованием 2,98 г трифенилфосфина и 1,79 мл азодикарбоксилата диэтила, 1,38 г N-гидроксифталимида, на основе 1,9 г продукта, полученного на вышеописанном этапе А. В результате получают 1,87 г искомого продукта. Инфракрасный спектр 1794 см-1 1737 см-1: Ароматич. 1510 см-1 Спектр ЯМР (CDCl3) 3,36 (s) - 3,38 (s) : СН 3 ОМЕМ; 3,56 - 3,89 3,96 - 5,12 : СН 2 ОМЕМ : 7,01 (s) no 7,75 : ароматические соединения. ЭТАП В. 5-фтор 3,4-бис (2-метоксиэтокси) метоксиоксиаминобензил. Операции выполняют как на этапе В примера 1 на основе 1,3 г продукта, полученного на вышеописанном этапе Б, с использованием 0,2 мл гидразингидрата. После хроматографии на двуокиси кремния (элюант : смесь метиленхло 000165: ароматическое соединение ЭТАП Г. (Z) (5-фтор-3,4-бис 2 метоксиэтокси) метокси) фенилметоксиимино)(2-трифенилметил) амино) 4-тиазолуксусная кислота. Операции выполняют как на этапе Г примера 1 на основе 745 г продукта, полученного на вышеописанном этапе В, с использованием 650 мг оксо-[2-[(трифенилметил) амино] тиазол 4-ил] уксусной кислоты (описание которой приводится в бельгийской патентной заявке 864828). В результате получают 1,18 г искомого продукта. Инфракрасный спектр (СНСl3) 3404 см-1(2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2 ен-2-карбоксилат (4-метоксифенил) метила. Операции выполняют как на этапе Д примера 1 на основе 1,1 г продукта, полученного на вышеописанном этапе Г, с использованием 699 мг хлоргидрата 7-амино 3-(3-хлор 1-пропенил) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2-ен-2 карбоксилата (4-метоксифенил) метила (описание которого приводится в патентной заявке ЕЭС 0333154) и 336 мг диметиламинопропилэтилкарбодиимида. После хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и этилового эфира (85 : 15 получают 860 мг искомого продукта, который используют на следующем этапе без дополнительной обработки. ЭТАП Е. [6R (3 (Е), 6, 7 (Z] 3-(3-иод 1 пропенил) 7-5-фтор 3,4-бис 2 метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4-тиазолил) ацетил) амино 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2-ен-2-карбоксилат (4-метоксифенил) метила. 35 Операции выполняют как на этапе Е примера 1 на основе 720 мг продукта, полученного на вышеописанном этапе Д, с использованием 286 мг иодида натрия и одного кристалла иода. В результате получают 770 мг искомого продукта, который используют на следующем этапе без дополнительной обработки. ЭТАП Ж. (6R (3 (Е), 6 7 (Z] иодид 1(3-(7-5-фтор-3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 2-4-метоксифенил) метокси) карбонил) 8 оксо-5-тиа-1-азабицикло (4.2.0) окт-2-ен-3-ил)2-пропенил)-хинолиния. В течение 1 ч при комнатной температуре взбалтывают 770 мг продукта, полученного на вышеописанном этапе Е, с 0,43 мл повторно дистиллированного хинолина. Затем выполняют осаждение за счет добавления этилового эфира,центрифугируют, промывают эфиром и высушивают при пониженном давлении. Таким образом получают 820 мг продукта, который подвергают хроматографии на двуокиси кремния-3,4-дигидрокси-5-фторфенил) метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа-1 азабицикло (4.2.0) окт-2-ен-3-ил)-2-пропенил)хинолиния. Операции выполняют как на этапе З примера 1 на основе 120 мг продукта, полученного на вышеописанном этапе Ж, с использованием 1,2 мл трифторуксусной кислоты при 10% анизола, в результате чего получают 31 г целевого продукта. Спектр ЯМР (Диметилсульфоксид) 6,59 (m) : Н ароматическое соединение; 4,92 (s) : -CH2-O-N=; 9,66 (d, мобильн.) : NH; 6,72 (s) : Н тиазол; 5,17 (d) : N-CH-CH-S; 5,78 36 ЭТАП А. [3-фтор 4,5-бис [(2-метоксиэтокси) метокси] фенил] гидроксиацетат метила. В среде инертного газа при температуре+20 С растворяют 5,3 г [3-фтор 4,5-бис [(2 метоксиэтокси) метокси] фенил] гидроксиуксусной кислоты (описание которой приводится в патентной заявке ЕЭС 551034) в 66 см 3 тетрагидрофурана, после чего при температуре+15 С добавляют 78 см 3 раствора диазометана в эфире при 15 г/л (2 эквивалента диазометана) и выдерживают при взбалтывании в течение 16 ч. Затем добавляют воды и подкисляют путем добавления уксусной кислоты. Органическую фазу промывают насыщенным раствором бикарбоната натрия, высушивают и выпаривают досуха. В результате получают 5,5 г сырого искомого продукта, который используют без дополнительной обработки на следующем этапе. ЭТАП Б. [3-фтор 4,5-бис [(2-метоксиэтокси) метокси] фенил] фталимидоксиацетат метила. 2,25 г N-гидроксифталимида и 7 г трифенилфосфина добавляют в раствор 5,5 г продукта, полученного на вышеописанном этапе А, в 60 см 3 тетрагидрофурана. Затем охлаждают до температуры -10 С и добавляют 4,1 см 3 азодикарбоксилата диэтила, после чего выдерживают при взбалтывании в течение 2 ч при температуре 0 С. Затем концентрируют досуха и промывают сырой продукт изопропиловым эфиром и высушивают. В результате получают 6,5 г искомого продукта. Спектр ЯМР (CDCl3) Поглощение в 1745, 1759, 1739 см-1 : С=O,1615, 1597, 1509, 1490 см-1 : С=С ароматические соединения. ЭТАП В. Оксиамино [3-фтор 4,5-бис [(2 метоксиэтокси) метокси) фенил] метилацетат. В течение 2 ч при температуре +20 С взбалтывают 2 г продукта, полученного на вышеописанном этапе Б, 40 мл этанола, 4 мл 1 М раствора гидразингидрата в этаноле. Затем образовавшуюся нерастворимую фазу фильтруют,промывают метиленхлоридом, добавляют в фильтрат 20 мл фосфатного буферного раствора, взбалтывают в течение 5 мин и экстрагируют с помощью метиленхлорида, промывают водой,высушивают и выпаривают досуха при пониженном давлении. Остаток поглощают в 5 мл метиленхлорида, взбалтывают в течение 30 мин при температуре 0 С, фильтруют, промывают метиленхлоридом и концентрируют фильтрат досуха при пониженном давлении. В результате получают 1,6 г искомого продукта. Инфракрасный спектр (Вазелиновое масло) Поглощение в области OH/NH 1751, 1722 см-1: С=O 1615, 1590, 1507 см-1 : Ароматические соединения ЭТАП Г. (Z) -метоксикарбонил)-5-фтор 3,4-бис 2-метоксиэтокси) метокси) фенилме 37 токси) карбоксиметил) имино)(2 трифенилметил) амино) 4-тиазолуксусная кислота. Операции выполняют как на этапе Г примера 1 на основе 710 мг продукта, полученного на вышеописанном этапе В, с использованием 747 мг оксо-[2-[(трифенилметил) амино] тиазол 4-ил] уксусной кислоты (описание которой приводится в бельгийской патентной заявке 864828). В результате получают 1,14 г искомого продукта. Спектр ЯМР (CDCl3) 3,36 (s) - 3,42 (s) : СН 3 ОМЕМ; 3,56 (m) 3,64 (m) - 3,82 (m) - 3,965 (m) : СН 2 ОМЕМ; 3,79(s) : СО 2 СН 3; 5,21 (s) - 5,20 по 5,28 (m) : O-CH2O; 5,80 (s) : CH-O-N; 6,78 (s) : H тиазол; 6,88 по 7,32 : ароматическое соединение. ЭТАП Д. [6R (3 (Е), 6, 6 (Z] 3-(3-хлор 1-пропенил) 7-метоксикарбонил) 5-фтор 3,4 бис 2-метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4 тиазолил) ацетил) амино) 8-оксо 5-тиа 1 азабицикло (4.2.0) окт-2-ен-2-карбоксилат (4 метоксифенил) метила. Операции выполняют как на этапе Д примера 7 на основе 1,14 г продукта, полученного на вышеописанном этапе Г, с использованием 786 мг хлоргидрата 7-амино 3-(3-хлор 1 пропенил) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт 2-ен-2-карбоксилат (4-метоксифенил) метила(описание которого приводится в патентной заявке ЕЭС 0333154) и 378 мг диметиламинопропилэтилкарбодиимида. После хроматографии на двуокиси кремния (элюант : смесь метиленхлорида и этилового эфира (85 : 15 получают 1,01 г искомого продукта, который используют без дополнительной обработки на следующем этапе. ЭТАП Е. [6R (3 (Е), 6, 7 (Z] 3-(3-иод 1 пропенил) 7-метоксикарбонил) 5-фтор 3,4-бис 2-метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 8-оксо 5-тиа 1-азабицикло (4.2.0) окт-2-ен-2-карбоксилат (4-метоксифенил) метила. Операции выполняют как на этапе Е примера 1 на основе 1 г продукта, полученного на вышеописанном этапе Д, с использованием 380 мг иодида натрия и одного кристалла иода. В результате получают 1,05 г искомого продукта,который используют без дополнительной обработки на следующем этапе. ЭТАП Ж. (6R (3 (Е), 6, 7 (Z иодид 1(3-(7-метоксикарбонил) 5-фтор 3,4-бис 2 метоксиэтокси) метокси) фенил) метокси) имино) (2-трифенилметил) амино) 4-тиазолил) ацетил) амино) 2-4-метоксифенил) метокси) карбонил) 8-оксо-5-тиа-1-азабицикло (4.2.0) окт-2-ен-3-ил)-2-пропенил)-хинолиния изомер 38 Операции выполняют как на этапе Ж примера 1 на основе 1 г продукта, полученного на вышеописанном этапе Е, с использованием 0,5 мл повторно дистиллированного хинолина. В результате получают 0,99 г искомого продукта. Спектр ЯМР (CDCl3) (изомер дельта Z) 3,32 - 3,35 - 3,36 (s) : СН 3 ОМЕМ; 3,30 (m) по 4,05 (m) и 5,24 по 5,35 : СН 2 ОМЕМ; 5,86 (s) 5,87 (s) : CH-O-N=; 8,48 (d) : NH; 6,76 по 7,35(Е), 6, 7 (Z 1-3-(7-2-амино-4-тиазолил) метоксикарбонил)-3,4-дигидрокси-5-фторфенил) метокси) имино) ацетил) амино)-2 карбокси-8-оксо-5-тиа-1-азабицикло (4.2.0) окт 2-ен-3-ил)-2-пропенил)-хинолиния. Операции выполняют как на этапе З примера 1 на основе 300 мг продукта, полученного на вышеописанном этапе Ж, с использованием 3 мл трифторуксусной кислоты и 0,3 мл анизола. В результате получают 112 мг целевого продукта. Инфракрасный спектр (Вазелиновое масло) Общее поглощение в области OH/NH 1770, 1742 и 1670 см-1 : С=O 1627, 1590 и 1525 см-1 : Сопряж. система, СОО- и вторичный амид Спектр ЯМР (Диметилсульфоксид) 3,64 - 3,65 (s) : СО 2 СН 3; 6,69 (m) по 6,78(dd раздв.) : CH пропенил; 5,88 (m) : СН 2 пропенил; 8,07 по 9,58 : 7 Н хинолин. Помимо продуктов, описанных выше в примерах, согласно настоящему изобретению могут быть также получены продукты, отвечающие нижеуказанной формуле и полученные в результате комбинирования различных значений заместителей, представленных в приведенной далее табл.1. Пример 9. Были изготовлены препараты для инъекций, имеющие следующую формулу: Продукт формулы 1 500 мг Водная стерильная основа (достаточное количество) 5 см 3 ФАРМАКОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРОДУКТОВ ИЗОБРЕТЕНИЯ. Активность ин витро, метод растворения в твердой среде. Для начала подготавливают серию коробок, в которые закладывают одинаковое количество стерильной питательной среды, содержащей возрастающее количество исследуемого 45 продукта, а затем каждую коробку засеивают несколькими бактериальными штаммами. После инкубации в течение 24 ч в сушильном шкафу при температуре +37 С ингибирование роста оценивается по отсутствию какого бы то ни было бактериального развития, что дает возможность определить минимальные ингибирующие концентрации (МИК), выраженные в мкг/см 3. Результаты выражаются в средних геометрических значениях всех полученных МИК для той или иной группы штаммов. Таблица 2(23 штамсимоштамма) устойчи- ма) вые (36 штаммов) 1 0,78 0,11 0,086 2 0,91 0,19 0,42 3 1,37 0,13 0,26 4 0,37 0,38 0,14 5 0,55 0,26 6 0,63 0,36 1,12 7 0,3 0,2 0,47 8 0,3 0,49 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Цефалоспорины общей формулы (I): изомер син в виде внутрикомплексных солей или солей неорганических или органических кислот или оснований, гдеR1, R2, R3 и R5, одинаковые или различные,представляют собой атом водорода, атом галогена или радикал, выбранный из группы, состоящей из радикалов: гидроксильный, алкильный, включающий от 1 до 4 атомов углерода, с возможностью замещения одним или несколькими атомами галогена, алкилоксильный, включающий от 1 до 4 атомов углерода, меркапторадикал, алкилтио-радикал, включающий от 1 до 4 атомов углерода, нитро, циано, амино, алкиламино, содержащий от 1 до 4 атомов углерода, диалкиламино, содержащий от 2 до 8 атомов углерода, карбамоильный, (алкиламино) карбонильный, содержащий от 2 до 5 атомов углерода, (диалкиламино) карбонильный, содержащий от 3 до 9 атомов углерода, карбоксильный, алкоксикарбонильный, содержащий от 2 до 5 атомов углерода, ацилокси-радикал, содержащий от 1 до 8 атомов углерода, и в котором Rx и Ry, одинаковые или различные,представляют собой атом водорода или алкильный радикал, включающий от 1 до 4 атомов углерода,R4 представляет собой гидроксильный радикал или ацилоксильный радикал, включающий от 1 до 8 атомов углерода,R7 представляет собой атом водорода или алкилоксикарбонильный радикал, в котором алкилоксильный радикал включает от 1 до 3 атомов углерода,А представляет собой атом водорода, эквивалент щелочного или щелочно-земельного металла, магния, аммония или аминированного органического основания, или же А представляет собой остаток сложноэфирной легкорасщепляемой группы, или же СО 2 А представляет собой СО 2, при этом волнистая линия означает,что группа CH2R6 может находиться в положении Е или Z , a R6 представляет собой, в виде четвертичного аммония, один из нижеследующих радикалов: при условии, что в случае, когда А представляет собой СОО-,R1 представляет собой карбоксильный радикал, R2 и R5 - водород, R3 и R4 являются, соответственно, гидроксильным или ацилоксильнымR7 представляет собой водород, а в случае,когда А представляет собой COO, R1, R2 и R5 представляют собой водород, R3 и R4 - гидроксильный или ацилоксильный (С 1-8) радикал, aR7 представляет собой алкилоксикарбонильный радикал. 2. Продукты общей формулы (I) по п.1, отличающиеся тем, что[2,3-b] пиридиний,1 метилпирролидиний,N-метил-N-этил-N-(2 амино-2-оксоэтил)аминий,имидазо-1,2-апиридиний или радикал, 6,7-дигидро-5 Н-1 пириндиний. 3. Продукты общей формулы (I) по любому из пп.1 или 2, отличающиеся тем, что каж 51 дый из R3 и R4 представляет собой гидроксильный радикал. 4. Продукты общей формулы (I) по любому из пп. 1, 2, 3, отличающиеся тем, что каждый из R2 и R5 представляет собой атом хлора или фтора. 5. Продукты общей формулы (I) по любому из пп. 1, 2, 3, отличающиеся тем, что R2 представляет собой атом фтора. 6. Продукты общей формулы (I) по любому из пп. 1, 2, 3, отличающиеся тем, что R2 представляет собой метоксильный радикал, а один из R1 и R5 представляет собой атом хлора. 7. Продукты общей формулы (I), представляющие собой следующие соединения: 52 оксо-5-тиа-1-азабицикло [4.2.0] окт-2-ен-3-ил) 2-пропенил) хинолиния. 8. Способ получения продуктов общей формулы (I), отличающийся тем, что альдегид ароматического ряда формулы (II) в которой R1, R2, R3, R4 и R5 такие, как определено в п.1, при необходимости защищен в своих функциональных группах и превращен, таким образом, в альдегид ароматического ряда формулы (IIp) в которой R1p, R2p, R3p, R4p и R5 р имеют соответственно значения R1, R2, R3, R4 и R5, как определено выше, или защищенную функциональную группу, причем вышеуказанный альдегид формулы (IIр) либо обрабатывают восстановителем для получения спирта формулы (III) которую этерифицируют до альфа-гидроксисложного эфира формулы (III2) в которой Alc представляет собой алкильный радикал, включающий от 1 до 4 атомов углерода,сложный эфир формулы (IIl2) или спирт формулы (III) обрабатывают с помощью Nгидроксифталимида, при необходимости в присутствии активатора, для получения производного формулы (IV) который подвергают гидролизу для получения О-замещенного гидроксиламина формулы (V) которое при необходимости переводят в функциональное производное, затем соединение формулы (VII) или его функциональное производное подвергают аминированию с помощью сложного эфира хлоргидрата 7-амино-3-(3 галоген-1-пропенил) 8-оксо-5-тиа-1-азабицикло в которой R9 представляет собой остаток легкорасщепляемого эфира, в результате чего получают производное 7-(N-замещенный амидо)-3(3-галоген-1-пропенил) 8-оксо-5-тиа-1-азабицикло-[4.2.0] окт-2-ен-2-карбоновой кислоты формулы (IX) которое при необходимости превращают в 3-(3 иодопропенил)овый аналог формулы (X): в которой R8 представляет собой атом водорода или защитную группу аминофункции для образования производного -алкоксииминоуксусной кислоты формы син формулы (VII) который обрабатывают основанием формулы R6 для получения продукта формулы (XI) из которого при необходимости выделяют изомеры (Е) или (Z) или превращают изомеры (Z) в изомеры (Е) или соединение формулы (XI) подвергают, при необходимости, одной или нескольким из нижеследующих реакций, в соответствующем порядке: а) удаление путем гидролиза или путем обработки тиомочевиной всех или части сложноэфирных защитных групп и защитных групп амино-радикала или гидроксильных радикалов,б) этерификация или солеобразование карбоксильного радикала с использованием основания,в) солеобразование амино-радикала с использованием кислоты,г) разделение продуктов в виде смеси R, S на R и S изомеры. 9. Способ получения продуктов формулы для получения соединения формулы (ХI), описанного в п.8, из которого, при необходимости,выделяют изомеры (Е) или (Z), или превращают изомеры (Z) в изомеры (Е), или соединение формулы (XI) подвергают, при необходимости,одной или нескольким из нижеследующих реакций, в соответствующем порядке: а) удаление путем гидролиза или путем обработки тиомочевиной всех или части сложноэфирных защитных групп и защитных групп амино-радикала или гидроксильных радикалов,б) этерификация или солеобразование карбоксильного радикала с использованием основания,в) солеобразование амино-радикала с использованием кислоты,г) разделение продуктов в виде смеси R, S на R и S изомеры. 10. Применение продуктов формулы (I) , а также их солей с кислотами в качестве фармацевтического препарата. 11. Применение по п.10, отличающееся тем, что используют продукты формулы (I) по пп. 2-8 или их соли с кислотами в качестве фармацевтического препарата. 12. Фармацевтическая композиция, включающая в качестве действующего начала препарат по п.10 или 11.
МПК / Метки
МПК: C07D 501/04, C07C 239/20, A61K 31/545
Метки: способ, применения, имеющие, положении, цефалоспорины, радикал, получения, бензилоксииминный, замещенный
Код ссылки
<a href="https://eas.patents.su/29-165-cefalosporiny-imeyushhie-v-polozhenii-7-zameshhennyjj-benziloksiiminnyjj-radikal-sposob-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Цефалоспорины, имеющие в положении 7 замещенный бензилоксииминный радикал, способ их получения и применения</a>
Предыдущий патент: Состав для печати изображения на поверхности изделия каучукового латекса, способ печати изображения и изделия из каучукового латекса
Следующий патент: Биологически активные уреидо-производные, полезные при лечении рассеянного склероза
Случайный патент: Способ и устройство для определения состава флюида в скважине