Способ получения гликозилированного интерферона бета
Номер патента: 15901
Опубликовано: 30.12.2011
Авторы: Фишер Дина, Дюкоммен Поль, Бернар Ален, Росси Мара
Формула / Реферат
1. Способ получения гликозилированного рекомбинантного интерферона бета человека, включающий стадию культивирования клетки, продуцирующей интерферон бета человека, в бессывороточной среде, где бессывороточная среда содержит
от приблизительно 10 до приблизительно 30 мМ HEPES, предпочтительно 20 мМ HEPES;
от приблизительно 0,5 до приблизительно 3 мМ пролина, предпочтительно приблизительно 1 мМ пролина;
от приблизительно 5500 до приблизительно 7000 мг/л хлорида натрия, предпочтительно приблизительно 6100 мг/л хлорида натрия; и
стадии выделения и очистки белка.
2. Способ по п.1, где бессывороточная среда дополнительно содержит от 10 до приблизительно 20 мг/л фенола красного, предпочтительно приблизительно 15 мг/л фенола красного.
3. Способ по любому из предшествующих пунктов, включающий фазу роста I, фазу роста II и фазу продукции, где фазу роста I проводят при приблизительно 37°С, фазу роста II проводят при приблизительно 35°С и фазу продукции проводят при приблизительно 33°С.
4. Способ по любому из предшествующих пунктов, где способ представляет собой проточный способ со степенью разбавления в диапазоне от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1,5 до приблизительно 7 в сутки.
5. Способ по п.4, где степень разбавления увеличивают в течение первых двух-трех недель культивирования клеток от начального значения приблизительно 1-2 в сутки до значения приблизительно 7-10 в сутки.
6. Композиция гликозилированного рекомбинантного интерферона бета, получаемого способом по любому из предшествующих пунктов.
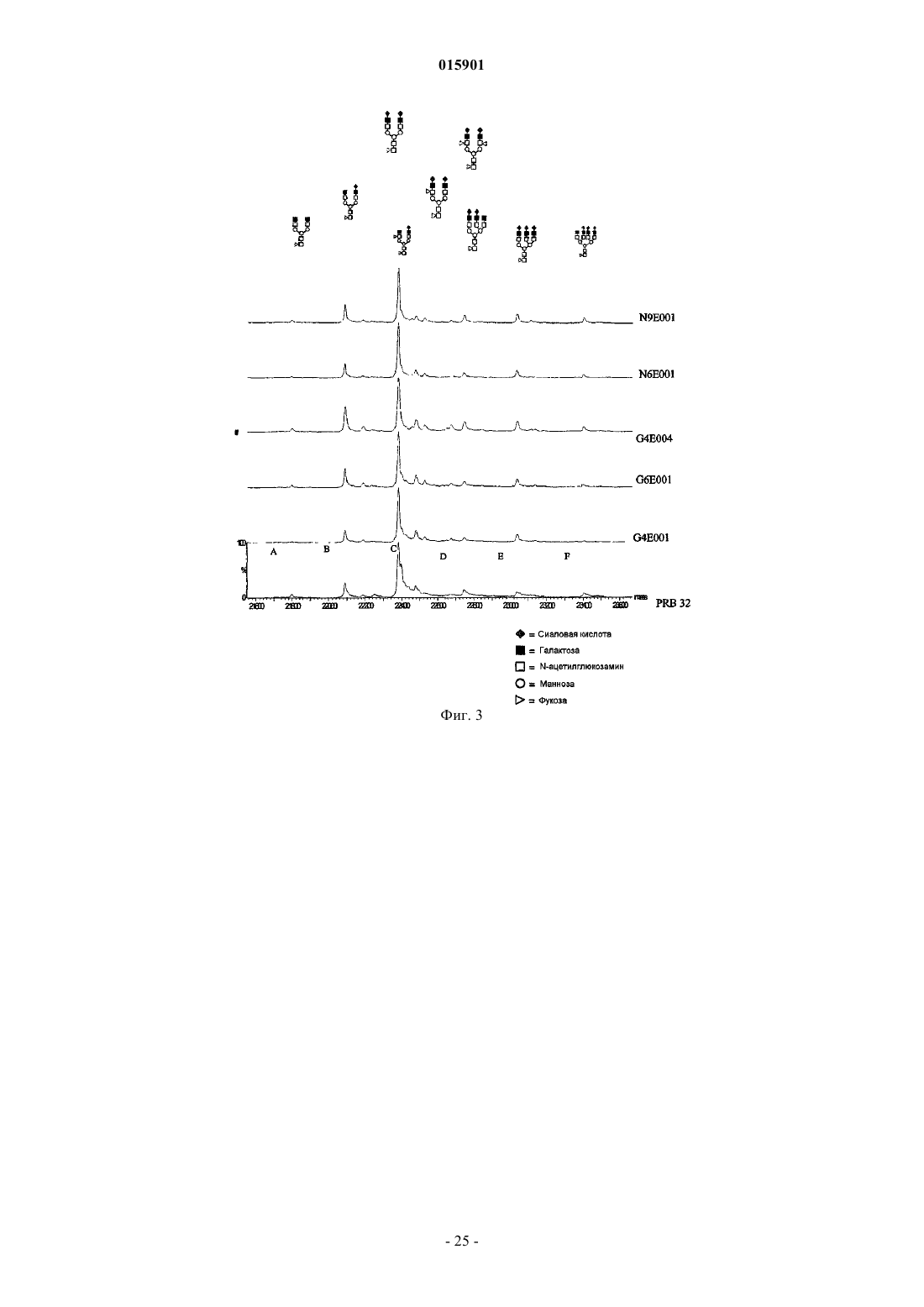
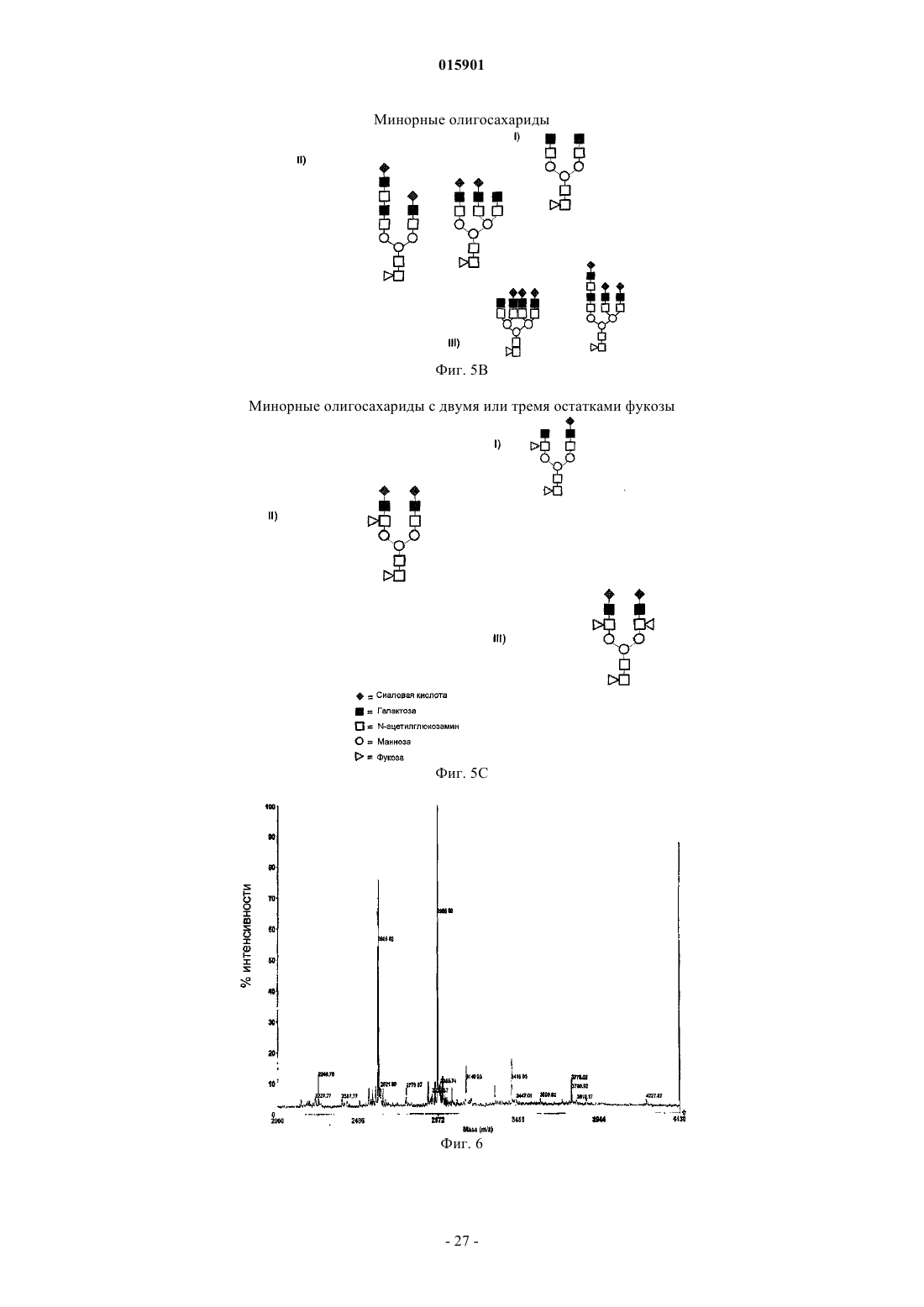
7. Композиция интерферона бета по п.6, содержащая олигосахаридную структуру, содержащую два или три фукозных сахарида.
8. Композиция интерферона бета по п.6 или 7, где указанная олигосахаридная структура содержит дисиалированный биантенный трифукозилированный гликан (Neu2Ac×Hex5×HexNAc4×Fuc3).
9. Композиция интерферона бета по любому из пп.6-8, дополнительно содержащая одну или несколько из следующих олигосахаридных структур:
несиалированная биантенная структура (Нех5×HexNAc4×Fuc);
дисиалированная триантенная структура или дисиалированная биантенная структура с повторяющимися структурами N-ацетиллактозамина (NeuAc2×Нех6×HexNAc5×Fuc);
трисиалированная триантенная структура (NeuAc3×НеХ6×HexNAc5×Fuc);
трисиалированная триантенная структура с повторяющимися структурами N-ацетиллактозамина или трисиалированная тетраантенная структура (NeuAc3×Hex7×HexNAc6×Fuc);
моносиалированная и дисиалированная биантенная структура с двумя единицами фукозы (NeuAc×Hex5×HexNAc4×Fuc2, NeuAc2×Нех5×HexNAc4×Fuc2).
10. Композиция интерферона бета по любому из пп.6-9, характеризующаяся профилем сиалирования, включающим от приблизительно 1 до приблизительно 5% несиалированных N-гликанов, от приблизительно 5 до приблизительно 25% моносиалированных гликанов, от приблизительно 55 до приблизительно 75% дисиалированных N-гликанов, от приблизительно 10 до приблизительно 25% трисиалированных N-гликанов.
11. Применение композиции рекомбинантного интерферона бета человека по любому из пп.6-10 для получения лекарственного средства для лечения рассеянного склероза.
12. Применение по п.11, где рассеянный склероз выбран из группы, состоящей из рецидивирующего, нерецидивирующего рассеянного склероза и юношеского рассеянного склероза.
13. Применение композиции рекомбинантного интерферона бета человека по любому из пп.6-10 для получения лекарственного средства для лечения рака.
14. Применение композиции рекомбинантного интерферона бета человека по любому из пп.6-10 для получения лекарственного средства для лечения вирусных инфекций.
15. Применение бессывороточной среды для культивирования клеток, содержащей
от приблизительно 10 до приблизительно 30 мМ HEPES, предпочтительно 20 мМ HEPES;
от приблизительно 0,5 до приблизительно 3 мМ пролина, предпочтительно приблизительно 1 мМ пролина;
от приблизительно 5500 до приблизительно 7000 мг/л хлорида натрия, предпочтительно приблизительно 6100 мг/л хлорида натрия,
для культивирования клетки, продуцирующей рекомбинантный интерферон бета человека.
16. Набор, включающий упаковочный материал и терапевтически эффективное количество выделенной, очищенной композиции рекомбинантного интерферона бета по любому из пп.6-10, или гликозилированного рекомбинантного интерферона бета, полученного способом по любому из пп.1-5, где указанный упаковочный материал содержит этикетку или вкладыш, где указано, что указанный рекомбинантный интерферон бета человека можно вводить человеку для его лечения.
Текст
Дата публикации и выдачи патента Номер заявки СПОСОБ ПОЛУЧЕНИЯ ГЛИКОЗИЛИРОВАННОГО ИНТЕРФЕРОНА БЕТА Настоящее изобретение относится к способу получения интерферона бета и к композиции интерферона бета, обладающего уникальным характером гликозилирования. 015901 Область изобретения Настоящее изобретение относится к способу получения рекомбинантного интерферона бета человека в условиях культивирования в бессывороточной среде, к способам очистки рекомбинантного интерферона бета человека и к белку интерферона бета, обладающему уникальным характером гликозилирования. Предпосылки изобретения Белки приобрели коммерческую важность в качестве лекарственных средств, которые, как правило,называют также "биологическими". Одной из наиболее значительных задач является разработка экономически выгодных и эффективных способов получения рекомбинантных белков в промышленном масштабе. В биотехнологической промышленности широко используют клетки млекопитающих для получения рекомбинантных гликопротеинов для лечения человека. Подходящими клетками, которые широко используют для получения полипептидов, оказались клетки яичника китайского хомячка (СНО). Клетки СНО впервые культивировал Puck (1958) из биопсии яичника самки китайского хомячка. Из этих исходных клеток получили ряд дочерних линий с различными характеристиками. Одной из этих линий клеток СНО, СНО-K1, необходим пролин, и она является диплоидной по гену дигидрофолатредуктазы (DHFR). Другой линией клеток, полученной из этой линии клеток, является дефицитная поDHFR линия клеток СНО (СНО DUK B11) (PNAS 77, 1980, 4216-4220), характеризующаяся потерей функции DHFR вследствие мутации в одном гене DHFR и последующей потери другого гена. Другими клетками, которые часто используют для получения белков, предназначенных для введения человеку, являются линии клеток человека, такие как линия клеток фибросаркомы человека НТ 1080 или линия клеток эмбриональной почки человека 293, линия клеток, полученная из эмбриональных ретинобластов человека, например, такая как PER.C6, линия клеток, полученная из амниотических клеток,или линия клеток, полученная из нервных клеток. Клетки из подходящей линии клеток стабильно трансфицируют экспрессирующим вектором, содержащим кодирующую последовательность интересующего белка, подлежащего получению, вместе с регуляторными последовательностями, такими как промоторы, энхансеры или поли А-сигналы, обеспечивающие стабильную и правильную экспрессию интересующего белка. Дополнительные гены, обычно присутствующие в экспрессирующих векторах, представляют собой маркерные гены, например, такие как маркеры для положительного отбора (например, ген neo) для отбора стабильно трансфицированных клеток от не трансфицированных и временно трансфицированных клеток. Гены, поддающиеся амплификации, такие как ген DHFR, используют для амплификации кодирующих последовательностей. После получения клона, экспрессирующего интересующий белок, необходимо организовать способ получения, начинающийся с этого клона, позволяющий получать белок в больших количествах и такого качества, какое необходимо для белков, предназначенных для введения человеку. Такие способы получения обычно осуществляют в биореакторах. Существуют различные режимы работы. В настоящее время подпитываемая и проточная культуры представляют собой два преобладающих способа промышленной эксплуатации процессов культивирования клеток млекопитающего, когда требуются большие количества белков (Hu and Aunins, 1997). Вне зависимости от выбранной технологии получения целью проектно-конструкторских работ является обеспечение способа получения, гарантирующего высокую объемную эффективность, стабильность от партии к партии, одинаковое качество продукта при низкой стоимости. Решение о выборе между подпитываемым и проточным способом получения главным образом продиктовано биологией клона и свойствами продукта, его принимают в зависимости от конкретного случая в ходе разработки нового лекарственного продукта (Kadouri and Spier, 1997). При выборе проточного способа одной из выбираемых систем культивирования является стационарный биореактор с фильтрующим наполнителем, в котором клетки иммобилизованы на твердых носителях. Этой системой легко управлять и с помощью соответствующих носителей и условий культивирования можно достигать очень высокой плотности клеток (107-108 клетокмл-1). Последствием такой высокой плотности клеток является необходимость высокой средней скорости перфузии (подпитки и сбора), которую необходимо использовать, чтобы поддерживать клетки жизнеспособными и продуктивными. По-видимому, скорость перфузии является одним из центральных параметров такого способа: он управляет объемной продуктивностью белка, качеством белкового продукта и вносит очень сильный вклад в общие технико-экономические показатели способа. В случае способа культивирования клеток в прошлом культуральную среду дополняли сывороткой,служащей универсальной питательным веществом для роста и поддержания всех линий клеток млекопитающих, продуцирующих биологически активные продукты. Сыворотка содержит гормоны, факторы роста, белки-носители, факторы прикрепления и распластывания, пищевые добавки, микроэлементы и т.д. Культуральная среда обычно содержит вплоть до 10% сыворотки животных, такой как эмбриональная бычья сыворотка (FBS), называемая также эмбриональной телячьей сывороткой (FCS). Несмотря на широкое использование, сыворотка обладает множеством ограничений. Она содержит-1 015901 высокие уровни различных белков, создающих помехи, ограничивая количества желаемого интересующего белка, продуцируемого клетками. Эти белки, происходящие из сыворотки, необходимо отделить от продукта в ходе последующей переработки, такой как очистка интересующего белка, что осложняет способ и увеличивает стоимость. Появление BSE (губчатая энцефалопатия крупного рогатого скота), трансмиссивного нейродегенеративного заболевания крупного рогатого скота с длинным латентным или инкубационным периодом,вызвало нормативно-правовые вопросы использования полученной от животных сыворотки при получении биологически активных продуктов. Таким образом, существует большая необходимость разработки альтернативной среды для культивирования клеток, свободной от полученных от животных компонентов, поддерживающих рост клеток и поддерживающих клетки во время получения биологически активных продуктов. Как правило, среда для культивирования клеток содержит много компонентов различных категорий, таких как аминокислоты, витамины, соли, жирные кислоты и дополнительные соединения. Аминокислоты: например, в патенте США 6048728 (Inlow et al.) описано, что в среде для культивирования клеток можно использовать следующие аминокислоты: аланин, аргинин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин,фенилаланин, пролин, серин, триптофан, тирозин, треонин и валин. Витамины: в US 2003/0096414 (Ciccarone et al.) или в US 5811299 (Renner et al.) например, описано,что в среде для культивирования клеток можно использовать следующие витамины: биотин, пантотенат,хлорид холина, фолиевую кислоту, миоинозитол, ниацинамид, пиридоксин, рибофлавин, витамин В 12,тиамин, путресцин. Соли: например, в US 6399381 (Blum et al.) описана среда, содержащая CaCl2, KCl, MgCl2, NaCl, одноосновный фосфат натрия, двухосновный фосфат натрия, селенит натрия, CuSO4, ZnCl2. Другим примером документа, описывающего неорганические соли, которые можно использовать в среде для культивирования клеток, является US 2003/0153042 (Arnold et al.), описывающий среду, содержащую CaCl2,KCl, MgCl2, NaCl, одноосновный фосфат натрия, двухосновный фосфат натрия, CuCl22 Н 2 О, ZnCl2. Жирные кислоты: жирными кислотами, которые, как известно, можно использовать в среде, являются арахидоновая кислота, линолевая кислота, олеиновая кислота, лауриновая кислота, миристиновая кислота, так же как метил-бета-циклодекстрин, см., например, US 5045468 (Darfler). Следует отметить,что циклодекстрин не является липидом по существу, однако обладает способностью образовывать комплекс с липидами и, таким образом, его используют для растворения липидов в среде для культивирования клеток. Дополнительными компонентами, в частности, используемыми в контексте бессывороточной среды для культивирования клеток, являются такие соединения, как глюкоза, глутамин, Na-пируват, инсулин или этаноламин (например, ЕР 274445), или защитный агент (стабилизатор), такой как Pluronic F68. Pluronic F68 (известный также как полоксамер 188) представляет собой блок-сополимер оксида этилена(ЕО) и оксида пропилена (РО). Стандартные "основные среды" также известны специалистам в данной области. Эти среды уже содержат некоторые из компонентов среды, упомянутых выше. Примерами таких сред, которые широко используются, являются модифицированная по способу Дульбекко среда Игла (DMEM), среда RoswellPark Memorial Institute (RPMI) или среда Хэма. После получения интересующего белка в биореакторе интересующий белок необходимо очистить от собранной культуры клеток. Собранная культура клеток может, например, представлять собой экстракты клеток в случае внутриклеточных белков или супернатант культуры клеток в случае секретируемых белков. Несмотря на то что в настоящее время доступно множество способов для крупномасштабного получения белков, неочищенные продукты, такие как собранная культура клеток, содержат не только желаемый продукт, но также примеси, которые трудно отделить от желаемого продукта. Органы здравоохранения требуют высоких стандартов чистоты для белков, предназначенных для введения человеку. В качестве дополнительного осложнения многие способы очистки могут содержать стадии, требующие использования низкого или высокого рН, высокой концентрации соли или других экстремальных условий, которые могут ставить под угрозу биологическую активность данного белка. Таким образом, для любого белка является сложной задачей определить способ очистки, обеспечивающий достаточную чистоту при сохранении биологической активности белка. Ионообменные хроматографические системы широко используют для разделения белков, в первую очередь, на основе разницы зарядов. При ионообменной хроматографии заряженные участки на поверхности растворенного вещества притягиваются противоположными зарядами, присоединенными к хроматографической смоле, при условии, что ионная сила окружающего буфера является низкой. Элюции, как правило, достигают посредством увеличения ионной силы (т.е. проводимости) буфера для конкуренции с растворенным веществом за заряженные участки на ионообменной смоле. Изменение рН и, таким образом, изменение заряда растворенного вещества представляет собой другой способ для обеспечения элю-2 015901 ции растворенного вещества. Изменение проводимости или рН может являться плавным (градиентная элюция) или ступенчатым (ступенчатая элюция). Смолы, которые можно использовать для ионообменной хроматографии, могут содержать различные функциональные группы: диэтиламиноэтил (DEAE) или диэтил(2-гидроксипропил)аминоэтил (QAE) с хлоридом в качестве противоиона, в то время как, например, карбоксиметил (СМ) и сульфопропил (SP) обладают натрием в качестве противоиона. Хроматографические системы с гидрофобной неподвижной фазой предлагают альтернативную основу для разделения и их также широко применяют для очистки белков. В эту категорию включены хроматография с гидрофобным взаимодействием (HIC) и обращенно-фазовая жидкостная хроматография(RPLC). Физико-химической основой для разделения посредством HIC и RPLC является гидрофобный эффект, белки разделяют на гидрофобной неподвижной фазе на основании различий в гидрофобности. Обращенно-фазовая хроматография представляет собой способ очистки белка, близкородственныйHIC, так как оба эти способа основаны на взаимодействиях между доступными для растворителя неполярными группами на поверхности биомолекул и гидрофобными лигандами на смоле. Однако лиганды,используемые для обращенно-фазовой хроматографии, являются более сильно замещенными гидрофобными лигандами, чем лиганды для HIC. В то время как степень замещения адсорбентов для HIC С 2-С 8 ариловыми лигандами может лежать в диапазоне 10-50 мкмоль/мл смолы, для адсорбентов для обращенно-фазовой хроматографии обычно используют несколько сотен мкмоль/мл смолы С 4-С 8-алкиловых лигандов. Колонка Source 30RPC содержит полимерную обращенно-фазовую смолу. Она состоит из жестких однородных бусин из полистирол/дивинилбензола диаметром 30 мкм. Ее характеристики можно суммировать следующим образом: исключительно широкий диапазон pH 1-12, высокая избирательность, высокая химическая устойчивость, высокая емкость и высокое разрешение при высоких скоростях потока. В эксклюзионной хроматографии (SEC), называемой также гельпроникающей хроматографией(GPC), используют пористые частицы для разделения молекул различных размеров. Ее обычно используют для разделения биологических молекул и для определения молекулярных масс и распределения молекулярных масс полимеров. Молекулы, которые меньше, чем размер пор, могут проникать в частицы,и таким образом обладают более длинным путем и более длительным временем прохождения, чем более крупные молекулы, которые не могут проникать в частицы. Все молекулы, превышающие размер пор, не задерживаются и элюируются вместе. Молекулы, которые могут проникать в поры, будут обладать средним временем удержания в частицах, которое зависит от размера и формы молекул. Таким образом, различные молекулы обладают различным временем прохождения через колонку.Blue Sepharose представляет собой хроматографическую смолу на основе смолы с аффинностью краситель-лиганд. Лиганд, цибакрон Blue F3G-A, ковалентно связан с sepharose через хлортриазиновое кольцо (Clonis et al., 1987). Голубую сефарозу использовали для очистки интерферона бета (Mory et al., 1981). Интерферон бета (интерферонили IFN-) представляет собой природный растворимый гликопротеин, принадлежащий к классу цитокинов. Интерфероны (IFN) обладают широким диапазоном видов биологической активности, такими как противовирусные, антипролиферативные и иммуномодулирующие свойства. Три основных интерферона обозначены IFN-альфа, IFN-бета и IFN-гамма. Эти интерфероны первоначально классифицировали согласно клеткам, из которых они произошли (лейкоциты, фибробласты или Т-клетки). Однако стало понятно, что одна клетка может продуцировать несколько типов. Таким образом, интерферон лейкоцитов в настоящее время называют IFN-альфа, интерферон фибробластов называют IFN-бета, и интерферон Т-клеток называют IFN-гамма. Существует также четвертый тип интерферона, из лимфобластов, IFN, который продуцирует линия клеток "Namalwa" (полученная из лимфомы Беркитта), которая, по-видимому, продуцирует смесь IFN лейкоцитов и фибробластов. Интерферон фибробластов человека (IFN-бета) обладает противовирусной активностью, известно также, что он ингибирует пролиферацию клеток. Он представляет собой полипептид приблизительно 20000 Да, индуцируемый вирусами и двухцепочечными РНК. Из нуклеотидной последовательности гена интерферона фибробластов, клонированного способом рекомбинантной ДНК, Derynck et al., 1980, вывели полную аминокислотную последовательность белка длиной 166 аминокислот. Интерферонтакже клонировали. В патенте США 5326859 описана последовательность ДНКIFN- человека и плазмида для его рекомбинантной экспрессии в бактериях, таких как Е. coli. В европейском патенте 0287075 описана линия клеток СНО (яичника китайского хомячка), трансфицированная последовательностью, кодирующей интерферон , и способная продуцировать рекомбинантный интерферон . Описано, что белок является гликозилированным биантенным (двухразветвленным) олигосахаридом, характеризующимся одиночной группой фукозы. Интерферон бета экспрессируют несколько линий клеток, таких как клетки СНО, ВНК 21 (клетки почки детеныша хомяка) и клетки LTK (клетки мыши с отсутствием L-тимидинкиназы) (Reiser andHauser, 1987). Отрицательные по DHFR клетки СНО также использовали для экспрессии интерферона бета (Innis and McCormick, 1982; Chernajovsky et al., 1984).-3 015901 Известно, что интерфероны являются гликозилированными, часто различными гликоформами. Например, было показано, что структура сахарида IFN- включает биантенную структуру, характеризующуюся одиночным фукозным сахаридом и концевым сиалированием галактозы (Conradt et al., 1987). Показано также, что гликозилирование является важным для растворимости, поскольку IFN- осаждается после дегликозилирования гликопептидазой F. Кроме того, для IFN-, продуцируемого Е.coli, показаны проблемы укладки из-за отсутствия гликозилирования в бактериальной системе экспрессии. В европейском патенте 0529300 описан рекомбинантный интерферон , обладающий специфическим характером гликозилирования, а именно гликозилированием углеводными структурами, характеризующимися одной фукозой на единицу олигосахарида. Эти углеводные структуры являются биантенными, триантенными и тетраантенными (двух-, трех- и четырехразветвленными соответственно) олигосахаридами. В патентной заявке РСТWO 99/15193 также описано гликозилирование рекомбинантного интерферона , характеризующееся биантеннными, триантеннными и тетраантенными олигосахаридами. Составляющие моносахариды включают маннозу, фукозу, N-ацетилглюкозамин, галактозу и сиаловую кислоту. В различных исследованиях была показана важность гликозилирования для стабильности. Например, для негликозилированных форм рекомбинантного интерферонапоказана значительно более низкая стабильность, а также более низкая биологическая активность (Runkel et al., 1998). В других исследованиях было показано, что белки рекомбинантного и природного интерфероначеловека обладают различными характерами гликозилирования (Kagawa et al., 1988). Интерферон бета использовали в качестве терапевтического белкового, так называемого биологического, лекарственного средства при ряде заболеваний, например, таких как рассеянный склероз, рак или вирусные заболевания, например, такие как инфекции SARS или вирусом гепатита С. Таким образом, существует необходимость в способах эффективного получения и очистки интерферона бета и в клетках, экспрессирующих интерферон бета в больших количествах. Сущность настоящего изобретения Настоящее изобретение основано на разработке способа получения рекомбинантного интерферона бета человека в бессывороточной среде. Таким образом, в первом аспекте изобретение относится к способу получения гликозилированного рекомбинантного, предпочтительно человеческого интерферона , включающему стадию культивирования клетки, продуцирующей интерферон , в бессывороточной среде, где бессывороточная среда содержит от приблизительно 10 до приблизительно 30 мМ HEPES, предпочтительно 20 мМ HEPES; от приблизительно 0,5 до приблизительно 3 мМ пролина, предпочтительно приблизительно 1 мМ пролина; от приблизительно 5500 до приблизительно 7000 мг/л хлорида натрия, предпочтительно приблизительно 6100 мг/л хлорида натрия. Настоящее изобретение, кроме того, основано на разработке способа очистки рекомбинантного интерферона бета из жидкости, в частности, из собранной культуры клеток, полученной из клеток, продуцирующих интерферон бета. Таким образом, во втором аспекте изобретение относится к способу очистки рекомбинантного интерферона человека из жидкости, включающему стадии: подвергания жидкости аффинной хроматографии; подвергания элюата аффинной хроматографии; катионообменной хроматографии; подвергания элюата катионообменной хроматографии гидрофобной хроматографии посредствомRP-HPLC. Анализом интерферона бета, полученного способом по настоящему изобретению, выяснили, что он представляет собой композицию избирательно гликозилированного интерферона бета, т.е. интерферона бета, обладающего уникальным характером или профилем гликозилирования. Таким образом, в третьем аспекте изобретение относится к композиции интерферона бета, содержащей олигосахаридную структуру, содержащую два или три фукозных сахарида. Дополнительные аспекты настоящего изобретения относятся к применениям рекомбинантного интерфероначеловека, полученного согласно способам по изобретению, для получения лекарственного средства для лечения опухолей, рассеянного склероза, вирусных инфекций и к применениям бессывороточной среды для культивирования клеток по изобретению для получения интерферона бета.-4 015901 Краткое описание чертежей На фиг. 1 показано графическое представление способа, используемого для получения линии клеток, продуцирующих интерферон бета. На фиг. 2 показано графическое представление нового способа очистки IFN1a. На фиг. 3 показаны преобразованные спектры ES-MS для серий IFN1a, где сверху показано схематическое изображение структуры олигосахаридов. На фиг. 4 показаны преобразованные спектры ES-MS для IFN1 а, полученного посредством нового способа, где Р - белок (IFN-);Fuc Biant - фукозилированный биантенный олигосахарид комплексного типа;Fuc Triant - фукозилированный триантенный олигосахарид комплексного типа;Fuc Tetrant - фукозилированный тетраантенный олигосахарид комплексного типа;SA - сиаловая кислота. На фиг. 5 показаны структуры олигосахарида в IFN1a; где: на фиг. 5 А показаны основные олигосахариды:II) моно- и дисиалированная триантенная структура или дисиалированная биантенная структура с повторяющейся структурой N-ацетиллактозамина (NeuAc2Hex6HexNAc5Fuc);III) трисиалированный триантенный с повторяющейся структурой N-ацетиллактозамина или трисиалированная тетраантенная структура (NeuAc3Hex7HexNAc6Fuc); на фиг. 5 С показаны минорные олигосахариды с двумя или тремя остатками фукозы:I) моносиалированная биантеннная структура с двумя группами фукозыII) дисиалированная биантенная структура с двумя группами фукозы (NeuAc2Hex5HexNAc4Fuc2);III) дисиалированная биантенная структура с тремя группами фукозы (NeuAc2 Нех 5HexNAc4Fuc3). На фиг. 6 показан спектр MALDI для нового IFN1a с перметилированными гликанами. Подробное описание изобретения Первый аспект настоящего изобретения основан на развитии способа получения интерферона бета в условиях культивирования в бессывороточной среде. Согласно настоящему изобретению способ получения гликозилированного рекомбинантного интерферона бета включает стадию культивирования клетки, продуцирующей интерферон бета, в бессывороточной среде, где бессывороточная среда содержит от приблизительно 10 до приблизительно 30 мМ HEPES, предпочтительно 20 мМ HEPES; от приблизительно 0,5 до приблизительно 3 мМ пролин, предпочтительно приблизительно 1 мМ пролин; и от приблизительно 5500 до приблизительно 7000 мг/л хлорида натрия, предпочтительно приблизительно 6100 мг/л хлорида натрия. Бессывороточная среда может, например, содержать 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 мМ буфер HEPES (2-(4-(2-гидроксиэтил)-1-пиперазинил)этансульфоновая кислота). Она может содержать также, например, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3,2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1 мМ пролин. Концентрации хлорида натрия в бессывороточной среде по изобретению могут составлять, например, приблизительно 5400, 5500, 5600, 5700, 5800, 5900, 6000, 6100, 6200, 6300, 6400, 6500, 6600, 6700,6800, 6900, 7000, 7100 мг/л. В предпочтительном варианте осуществления бессывороточная среда дополнительно содержит от приблизительно 10 до приблизительно 20, предпочтительно приблизительно 15 мг/л фенола красного. Концентрация фенола красного может составлять, например, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21 мг/л. В контексте способа по настоящему изобретению указанные выше компоненты можно использовать в любой подходящей бессывороточной среде. Примеры такой бессывороточной среды перечислены далее. Клетка, продуцирующая интерферон бета, которую можно культивировать согласно настоящему изобретению, может представлять собой любую клетку млекопитающих, включая клетки животного или человека, например, такие как клетки 3 Т 3, клетки COS, клетки остеосаркомы человека, клетки MRC-5,клетки ВНК, клетки VERO, клетки СНО, клетки CHO-S, клетки HEK 293, нормальные фибробласты человека, клетки стромы, гепатоциты и клетки PER.C6, модифицированные, чтобы экспрессировать и предпочтительно секретировать интерферон бета. Клетка для использования в способе по настоящему изобретению предпочтительно представляет собой экспрессирующий интерферон бета клон СНО, например, такой как линия клеток, описаннаяIFN-, и он относится к интерферону бета, полученному из любых видов, и предпочтительно к интерферону бета человека, гликопротеину из 166 аминокислот с молекулярной массой приблизительно 22500 Да. Термин "интерферон бета", как используют в настоящем описании, относится также к функциональным производным, мутеинам, аналогам или фрагментам IFN-бета. Термин "интерферон бета-1 а" относится к гликозилированному интерферону бета. Активность интерферона бета можно измерять, например, с использованием контрольного стандарта, откалиброванного против стандарта природного интерферона бета Всемирной организации здравоохранения (Second International Standard for interferon, Human Fibroblast GB 23 902 531). Единицы выражены в международных единицах (IU) противовирусной активности на 1 мг интерферона бета-1a, определенной в биологическом анализе цитопатического эффекта in vitro с использованием клеток WISH и вируса везикулярного стоматита. Таблица преобразования для MIU и mcg IFN-beta"Варианты" или "мутеины", как используют в контексте настоящего изобретения, относятся к аналогам IFN-бета, в которых один или несколько аминокислотных остатков природного IFN-бета заменены различными аминокислотными остатками или делетированы, или один или несколько аминокислотных остатков добавлены к природной последовательности IFN-бета, без значительного уменьшения активности полученных продуктов по сравнению с IFN-бета дикого типа. Эти мутеины получают известными способами синтеза и/или сайт-специфического мутагенеза, или любым другим подходящим для этого способом. Термины "вариант" или "мутеин" в соответствии с настоящим изобретением относятся к белкам,кодируемым нуклеиновой кислотой, такой как ДНК или РНК, которая гибридизуется с ДНК или РНК,кодирующей IFN-бета, как описано, например, в US 4738931, в строгих условиях. Термин "строгие условия" относится к условиям гибридизации и последующей промывки, к которым относится обозначениеlar Biology, выше, Interscience, N.Y., 6.3 и 6.4 (1987, 1992). Неограничивающие примеры строгих условий включают в себя условия промывки на 12-20 С ниже рассчитанной Tm изучаемого гибрида, например, в 2SSC и 0,5% SDS в течение 5 мин, 2SSC и 0,1% SDS в течение 15 мин; 0,1SSC и 0,5% SDS при 37 С в течение 30-60 мин и затем в 0,1SSC и 0,5% SDS при 68 С в течение 30-60 мин. Обычному специалисту в данной области понятно, что строгие условия зависят также от длины последовательностей ДНК, олигонуклеотидных зондов (например, 10-40 оснований) или смешанных олигонуклеотидных зондов. При использовании смешанных зондов предпочтительно использовать хлорид тетраметиламмония(ТМАС) вместо SSC. См. Ausubel, выше. Идентичность отражает родство между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определенное сравнением последовательностей. Как правило, идентичность относится к точному соответствию нуклеотида нуклеотиду или аминокислоты аминокислоте в двух полинуклеотидных или двух полипептидных последовательностях соответственно на протяжении длины сравниваемых последовательностей. Для последовательностей с неточным соответствием можно определить "% идентичности". Как правило, две последовательности, подлежащие сравнению, выравнивают для получения максимальной корреляции между последовательностями. Это может включать вставку "пропусков" либо в одну, либо в обе последовательности для увеличения степени выравнивания. % идентичности можно определить на протяжении полной длины каждой из сравниваемых последовательностей (так называемое глобальное выравнивание), которое особенно подходит для последовательностей одинаковой или очень похожей длины, или на протяжении более коротких, определенных отрезков длины, (так называемое локальное выравнивание), которое больше подходит для последовательностей неравной длины. Способы сравнения идентичности и гомологии двух или более последовательностей хорошо известны в данной области. Так, например, программы, доступные в пакете программ Wisconsin SequenceAnalysis Package, версия 9.1 (Devereux J et al., 1984), например программы BESTFIT и GAP, можно использовать для определения % идентичности между двумя полинуклеотидами и % идентичности и% гомологии между двумя полипептидными последовательностями. В BESTFIT используют алгоритм"локальной гомологии" Смита и Уотермана (1981) и находят наилучшую отдельную область сходства между двумя последовательностями. Другие программы для определения идентичности и/или сходства между последовательностями также известны в данной области, например, семейство программ BLAST(Altschul S.F. et al., 1990, Altschul S.F. et al., 1997, доступное через домашнюю страницу NCBI наwww.ncbi.nlm.nih.gov), FASTA (Pearson W.R., 1990). Любой такой вариант или мутеин предпочтительно обладает последовательностью аминокислот,значительно дублирующей последовательность IFN-бета, так что обладает, по существу, сходной активностью с IFN-бета. Функциональным анализом для оценки, обладает ли какой-либо вариант или мутеин такой же активностью, как IFN-бета, является, например, анализ, измеряющий активность интерферона для цитопатического эффекта вируса везикулярного стоматита в клетках WISH, например, описанныйYoucefi et al., 1985. Таким образом, можно определить, обладает ли любой данный мутеин, по существу,такой же активностью, как IFN-бета, посредством общепринятых экспериментов. Любой такой вариант или мутеин может обладать по меньшей мере 40% идентичностью или гомологией с последовательностью IFN-бета, как описано, например, в US 4738931. Более предпочтительно он обладает по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или наиболее предпочтительно по меньшей мере 90% идентичностью или гомологией с ней. Мутеины IFN-бета, которые можно использовать в соответствии с настоящим изобретением, или кодирующая их нуклеиновая кислота, включают ограниченное множество, по существу, аналогичных последовательностей в виде пептидов или полинуклеотидов с заменами, которые обычный специалист в данной области может получить общепринятым образом, без излишнего экспериментирования, на основе объяснений и руководства, представленных здесь. Предпочтительными изменениями для мутеинов по настоящему изобретению являются изменения,известные как "консервативные" замены. Консервативные замены аминокислот полипептидов IFN-бета могут включать синонимические аминокислоты внутри группы, обладающие достаточно сходными физико-химическими свойствами, чтобы замены между членами группы сохраняли биологическую функцию молекулы (Grantham, 1974). Понятно, что можно выполнять также вставки и делеции аминокислот в обозначенные выше последовательности без изменения их функции, особенно, если вставки или делеции содержат только небольшое число аминокислот, например менее тридцати, и предпочтительно, менее десяти, и не удаляют или не заменяют аминокислоты, критические для функциональной конформации,например остатки цистеина. Белки и мутеины, полученные посредством делеций и/или вставок, попадают под действие настоящего изобретения. Примеры замен аминокислот в белках, которые можно использовать для получения мутеинов IFNбета для применения по настоящему изобретению, включают любые известные стадии способов, такие как представленные в патентах США 4959314, 4588585 и 4737462, Mark et al.; 5116943, Koths et al.,4965195, Namen et al.; 4879111, Chong et al.; и 5017691, Lee et al.; и замещенные лизином белки, пред-7 015901 ставленные в патенте США 4904584 (Shaw et al.). Недавно описан особый вид вариантов интерферона. Так называемые "консенсусные интерфероны" представляют собой не встречающиеся в природе варианты IFN (US 6013253). Консенсусные интерфероны также можно получать по настоящему изобретению."Функциональные производные" IFN-бета, как используют в настоящем описании, относится к производным, которые можно получать из функциональных групп, присутствующих на боковых цепях остатков, или из N- или С-концевых групп, способами, известными в данной области, и они относятся к настоящему изобретению, пока они остаются фармацевтически приемлемыми, т.е. не нарушают биологической активности белков, как описано выше, т.е. способности связывать соответствующий рецептор и запускать передачу сигнала рецептором, и не придают токсических свойств содержащим их композициям. Производные могут обладать такими химическими группами, как углеводные или фосфатные остатки, при условии, что производное сохраняет биологическую активность белка и остается фармацевтически приемлемым. Производные интерферона бета могут, например, содержать боковые цепи полиэтиленгликоля, которые могут улучшать другие свойства белка, такие. как стабильность, время полужизни, биодоступность, переносимость организмом человека или иммуногенность. Для достижения этой цели к IFN-бета можно присоединять, например, полиэтиленгликоль (PEG). Пегилирование можно выполнять известными способами, например, описанными в WO 92/13095. В частности, PEG-IFN можно получить согласно объяснениям из WO 99/55377. Функциональное производное IFN-бета может содержать по меньшей мере одну группу, присоединенную к одной или нескольким функциональным группам, присутствующим в качестве одной или нескольких боковых цепей в аминокислотных остатках. Особенно предпочтительным является вариант осуществления, в котором группа представляет собой группу полиэтиленгликоля (PEG). Согласно настоящему изобретению к IFN-бета можно присоединить несколько групп PEG. Другие производные включают алифатические сложные эфиры карбоксильных групп, амиды карбоксильных групп, полученные посредством реакции с аммиаком или с первичными или вторичными аминами, N-ацил-производные свободных аминогрупп аминокислотных остатков, полученные с помощью ацильных групп (например, групп алканоила или карбоциклического ароила), или О-ацилпроизводные свободных гидроксильных групп (например, групп остатков серила или треонила), полученные с помощью ацильных групп."Фрагмент" в соответствии с настоящим изобретением относится к любому сокращенному вариантуIFN-бета, т.е. более короткому пептиду, который сохраняет желаемую биологическую активность, как можно измерить, например, биологическим анализом, описанным выше. Фрагменты можно легко получить удалением аминокислот с любого конца молекулы и тестированием полученного продукта по его свойствам в качестве агониста рецептора. Известны протеазы для удаления одной аминокислоты за один раз либо с N-конца, либо с С-конца полипептида, и таким образом, определение фрагментов, сохраняющих желаемую биологическую активность, можно провести, например, в тесте, описанном Youcefi et al.,1985, и оно включает только общепринятые эксперименты. Способ получения интерферона бета по изобретению можно осуществлять при постоянной температуре или при меняющихся температурах. Его можно осуществлять, например, при 37 С в течение всего процесса. Его можно также осуществлять при температуре, которая первоначально, например в течение фазы роста, составляет 37 С и затем уменьшается до 35, 33 или 30 С для фазы продукции. В предпочтительном варианте осуществления способ по изобретению включает фазу роста I, фазу роста II и фазу продукции, где фазу роста I проводят при приблизительно 37 С, фазу роста II проводят при приблизительно 35 С и фазу продукции осуществляют при приблизительно 33 С. Определение конца фаз находится полностью в компетенции специалиста в данной области, и его определяют, например, на основании плотности клеток, потребления глюкозы или любого другого метаболического признака. Как правило, фаза роста I может составлять, например, 10-12 суток. Фаза роста II,как правило, является более короткой и в основном служит для адаптации клеток к более низкой температуре. Фаза роста II может составлять, например, 1-2 суток. Способ по изобретению можно осуществлять подпитываемым или проточным способом. Согласно настоящему изобретению проточный способ является предпочтительным. Предпочтительно способ представляет собой проточный способ со степенью разбавления в диапазоне от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1,5 до приблизительно 7 в сутки. Термин "степень разбавления", как определяют здесь, обозначает степень разбавления D, рассчитываемую как литр среды на литр рабочего объема всей системы в сутки (общий объем=объем фильтрующего слоя+контактного чана). По настоящему изобретению степень разбавления может находиться в диапазоне, например, 0,5, 1, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 8,8,5, 9, 9,5, 10, 10,5. Более предпочтительно степень разбавления увеличивают в течение первых двух-трех недель культивирования клеток от начального значения приблизительно 1-2 в сутки до значения приблизительно-8 015901 7-10 в сутки, в частности в течение фазы продукции. Стадию культивирования способа по изобретению можно проводить на любом подходящем оборудовании, таком как чашки Петри, Т-флаконы или роллерные флаконы, но предпочтительно в резервуарах большего объема, например таких как биореактор. При выборе проточного способа система может представлять собой, например, стационарный биореактор с фильтрующим наполнителем, в котором клетки иммобилизованы на твердых носителях. Этой системой легко управлять и с помощью соответствующих носителей и условий культивирования можно достигать очень высокой плотности клеток (107-108 клетокмл-1). Твердый носитель, который можно использовать по настоящему изобретению, может, например,представлять собой микроноситель. Микроносители представляют собой небольшие твердые частицы,на которых можно выращивать клетки в суспензионной культуре. Клетки способны к адгезии и размножению на поверхности микроносителей. Как правило, микроносители состоят из бусин, диаметр которых составляет между 90 и 300 мкм. Микроносители можно изготавливать из различных материалов, для которых показано успешное прикрепление и размножение клеток, например, таких как стекло, полистирол,полиэтилен, декстран, желатин и целлюлоза. Кроме того, поверхности микроносителей можно покрывать материалом, стимулирующим прикрепление и рост клеток, например, таким как N,N-диэтиламиноэтил,стекло, коллаген или рекомбинантные белки. Существуют как макропористые, так и не пористые микроносители. Макропористые поверхности предоставляют клеткам легкий доступ к внутренней части микроносителя после инокуляции и при попадании внутрь микроносителя клетки защищены от сдвигающих сил, происходящих от механического перемешивания и аэрации в биореакторе. Дополнительный твердый носитель, который можно использовать по настоящему изобретению,может, например, представлять собой диск, например диск, состоящий из полиэфирного нетканого волокна, связанного с листом полипропиленовой сетки (см., например, патент США 5266476). Такие диски обычно обрабатывают электростатически для облегчения адгезии суспензии клеток на дисках и их захвата системой волокон, где они остаются на всем протяжении процесса культивирования. Плотность и продуктивность, достигаемые для клеток, выращенных на дисках, могут быть вплоть до десяти раз выше, чем для клеток, выращенных на микроносителях. Способ получения гликозилированного интерферона бета предпочтительно дополнительно включает стадию сбора культуры клеток, содержащей интерферон бета. В предпочтительном варианте осуществления собранную культуру клеток дополнительно подвергают процессу очистки. Способ очистки может представлять собой любой способ, приводящий к интерферону бета требуемой чистоты, и может включать любое сочетание стадий очистки на основе хроматографии или любого другого способа очистки, такого как фракционирование с помощью соли или т.п. Очистку предпочтительно проводят согласно второму аспекту настоящего изобретения. Во втором аспекте изобретение относится к способу очистки рекомбинантного интерферона человека из жидкости, включающего стадии:a) подвергания жидкости аффинной хроматографии;b) подвергания элюата аффинной хроматографии катионообменной хроматографии;c) подвергания элюата катионообменной хроматографии гидрофобной хроматографии посредствомRP-HPLC. Стадию (а) предпочтительно проводят на голубой сефарозе, например, на колонке Blue Sepharosefast flow. Стадию (b) предпочтительно проводят на карбоксиметиловой смоле, например, на CM Sepharose fast flow. В предпочтительном варианте осуществления способ очистки по изобретению дополнительно содержит перед стадией (а) стадию осветления жидкости микрофильтрацией. В другом предпочтительном варианте осуществления способ очистки по изобретению дополнительно включает:e) подвергание диализата эксклюзионной хроматографии;f) подвергание элюата эксклюзионной хроматографии фильтрации. Стадию (f) можно проводить, например, посредством микро- или нанофильтрации. Ультрафильтрация является применимой для удаления низкомолекулярных компонентов из элюатов, полученных на предыдущих стадиях хроматографии. Например, ультрафильтрация позволяет удалять органический растворитель, TFA и соли из предыдущей стадии для уравновешивания интерферона бета в требуемом буфере, или для концентрирования молекулы до желаемой концентрации. Такую ультрафильтрацию можно, например, проводить на материале для ультрафильтрации, удаляющем компоненты, обладающие молекулярными массами ниже 5 кДа. Если белок, очищенный согласно способу по изобретению, предназначен для введения человеку,является преимущественным дополнительно включать стадии удаления вирусов. Стадию фильтрации для удаления вируса можно, например, проводить между стадиями (d) и (е), или после стадии (е). Более предпочтительно способ включает две стадии удаления вирусов.-9 015901 Чистота, которую можно получить способом очистки по изобретению, составляет предпочтительно 80%, более предпочтительно 90% и наиболее предпочтительно 98%. Способ очистки интерферона бета по настоящему изобретению предпочтительно дополнительно включает стадию составления очищенного интерферона бета в фармацевтическую композицию, необязательно, вместе с фармацевтически приемлемым носителем. Интерферон бета для получения или очистки по настоящему изобретению можно экспрессировать посредством любой линии клеток или клона. Однако предпочтительнее использовать линию клеток яичника китайского хомячка (СНО), обозначенную DUKX-B11, в которой отсутствует активность DHFR(дигидрофолатредуктазы), в качестве клетки-хозяина для получения гликозилированного интерферона бета. Последовательность ДНК, кодирующая интерферончеловека, описана, например, в патенте США 5326859. Предпочтительный вариант осуществления настоящего изобретения относится к способу получения рекомбинантного интерфероначеловека в трансфицированных клетках, способных продуцировать по меньшей мере приблизительно 100000 IU рекомбинантного интерфероначеловека при конкретной продуктивности клеток (IU/106 клеток/24 ч). Предпочтительно клетки способны продуцировать по меньшей мере приблизительно 200000 IU, или по меньшей мере приблизительно 200000 IU, или по меньшей мере приблизительно 300000 IU, или по меньшей мере приблизительно 400000 IU, или по меньшей мере приблизительно 500000 IU, или по меньшей мере приблизительно 600000 IU рекомбинантного интерферона бета человека при конкретной продуктивности клеток. Предпочтительно клетка, продуцирующая интерферон бета, представляет собой клетку СНО,трансфицированную конструкцией нуклеиновой кислоты, содержащей по меньшей мере один промоторный/энхансерный элемент, функционально связанный с геном IFN- человека. Более предпочтительно по меньшей мере один промоторный/энхансерный элемент содержит промотор/энхансер SV40. Наиболее предпочтительно конструкция нуклеиновой кислоты содержит по меньшей мере первую единицу транскрипции, состоящую из промотора/энхансера SV40, функционально связанного с геном IFN- человека,где ген IFN- человека функционально связан с ранней областью полиаденилирования SV40 Т Ag. Особенно предпочтительно также, чтобы конструкция нуклеиновой кислоты дополнительно содержала по меньшей мере вторую единицу транскрипции, состоящую из промотора/энхансера SV40, гена DHFR мыши и поли А-содержащей ранней области полиаденилирования SV40 Т Ag. Другой вариант осуществления настоящего изобретения относится к конструкции нуклеиновой кислоты, содержащей по меньшей мере один промоторный/энхансерный элемент, функционально связанный с геном IFN- человека, для трансфекции в клетки, характеризующейся тем, что трансфицированные клетки способны продуцировать по меньшей мере приблизительно 100000 IU, по меньшей мере приблизительно 200000 IU, или по меньшей мере приблизительно 300000 IU, или по меньшей мере приблизительно 400000 IU, или по меньшей мере приблизительно 500000 IU, или по меньшей мере приблизительно 600000 IU рекомбинантного интерфероначеловека при конкретной продуктивности клеток(IU/106 клеток/на 24 ч). Предпочтительно по меньшей мере один промоторный/энхансерный элемент содержит промотор/энхансер SV40. Более предпочтительно конструкция нуклеиновой кислоты содержит по меньшей мере первую единицу транскрипции, состоящую из промотора/энхансера SV40, функционально связанного с геном IFN- человека, где ген IFN- человека функционально связан с ранней областью полиаденилирования SV40 Т Ag. Наиболее предпочтительно конструкция нуклеиновой кислоты дополнительно содержит по меньшей мере вторую единицу транскрипции, состоящую из промотора/энхансера SV40,гена DHFR мыши и поли А-содержащей ранней области полиаденилирования SV40 Т Ag. Изобретение дополнительно относится к интерферону бета, который можно получить способом по настоящему изобретению. В дополнительном аспекте изобретение относится к композиции интерферона бета, обладающего уникальным профилем гликозилирования. Такой интерферон бета предпочтительно получают способом по настоящему изобретению. В одном варианте осуществления гликозилированный белок рекомбинантный интерферончеловека содержит олигосахаридную структуру, обладающую двумя или тремя фукозными сахаридами. В предпочтительном варианте осуществления олигосахаридная структура дополнительно содержит дисиалированный биантенный трифукозилированный гликан (Neu2AcHex5HexNAc4Fuc3). В дополнительном предпочтительном варианте осуществления уникальный профиль гликозилирования дополнительно включает несиалированную биантенную структуру (Hex5HexNAc4Fuc); дисиалированную триантенную структуру или дисиалированную биантенную структуру с повторяющимися структурами N-ацетиллактозамина (NeuAc2 Нех 6HexNAc5Fuc); трисиалированную триантенную структуру (NeuAc3 Нех 6HexNAc5Fuc); трисиалированную триантенную структуру с повторяющимися структурами N-ацетиллактозамина или трисиалированную тетраантенную (NeuAc3-Hex7HexNAc6-Fuc); моносиалированную и дисиалированную биантенную структуру с двумя единицами фукозы- 10015901 Предпочтительно уникальный профиль гликозилирования включает гликаны, характеризующиеся одинаковым уровнем N-ацетилнейраминовой кислоты:N-гликолилнейраминовой кислоты, как в случае профиля гликозилирования природного белка человека. В дополнительном предпочтительном варианте осуществления композиция интерферона бета по изобретению характеризуется профилем сиалирования, включающим от приблизительно 1 до приблизительно 5% несиалированных N-гликанов, от приблизительно 5 до приблизительно 25% моносиалированных гликанов, от приблизительно 55 до приблизительно 75% дисиалированных N-гликанов, от приблизительно 10 до приблизительно 25% трисиалированных N-гликанов. Дополнительный аспект настоящего изобретения относится к получению интерферона бета по настоящему изобретению для получения лекарственного средства для лечения заболевания человека, в частности рассеянного склероза, рака или вирусных инфекций. Рассеянный склероз можно выбирать из группы, состоящей из рецидивирующего, нерецидивирующего рассеянного склероза и юношеского рассеянного склероза. Дополнительный аспект изобретения относится к способу лечения субъекта, нуждающегося в лечении интерфероном- по изобретению, включающий введение субъекту белка рекомбинантного интерфероначеловека, как описано здесь. Предпочтительно лечение является лечением рассеянного склероза. Более конкретно, рассеянный склероз можно выбирать из группы, состоящей из рецидивирующего, нерецидивирующего рассеянного склероза и юношеского рассеянного склероза. Альтернативно, лечение представляет собой противоопухолевое лечение. В качестве дополнительной альтернативы, лечение представляет собой лечение против вирусов. В дополнительном аспекте настоящего изобретения изобретение относится к фармацевтической композиции, содержащей в качестве активного ингредиента композицию выделенного, очищенного, рекомбинантного интерфероначеловека, как описано здесь, и фармацевтически приемлемый носитель для введения фармацевтической композиции. Предпочтительно фармацевтическая композиция, обладающая противоопухолевой или противовирусной активностью, или активностью против рассеянного склероза, содержит в качестве активного ингредиента выделенный, очищенный, рекомбинантный белок интерферончеловека, как описано здесь, и фармацевтически приемлемый носитель для введения фармацевтической композиции. В дополнительном аспекте настоящего изобретения изобретение относится к изделию, содержащему упаковочный материал и терапевтически эффективное количество выделенного, очищенного белка рекомбинантного интерферона , где упаковочный материал содержит этикетку или вкладыш, где указано, что белок рекомбинантный интерферончеловека, как описано здесь, можно вводить человеку для его лечения. Выделенный, очищенный, рекомбинантный белок интерферончеловека или фармацевтическую композицию, как описано здесь, предпочтительно используют для получения лекарственного средства для лечения рецидивирующего, нерецидивирующего рассеянного склероза и юношеского рассеянного склероза. Режимы дозирования для конкретного субъекта (пациента) может легко определить обычный специалист в данной области, так как эти режимы хорошо известны в данной области. Далее приведена ссылка на следующие примеры, которые вместе с вышеизложенным описанием иллюстрируют изобретение не ограничивающим образом. В основном применяемая здесь номенклатура и лабораторные способы, применяемые по настоящему изобретению, включают молекулярные, биохимические, микробиологические способы и способы рекомбинантной ДНК. Такие способы подробно описаны в литературе. См., например, "Molecular Cloning:Characterization - A Laboratory Course Manual", CSHL Press (1996); полное содержание всех из которых приведено здесь в качестве ссылки. Специалистам в данной области понятно, что при наличии приведенного здесь полного описания настоящего изобретения то же самое можно осуществлять в пределах широкого диапазона эквивалент- 11015901 ных параметров, концентраций и условий без отклонения от сущности и объема изобретения и без излишнего экспериментирования. В то время как настоящее изобретение описано в связи с конкретными вариантами его осуществления, понятно, что оно поддается дополнительным модификациям. Эта патентная заявка предназначена,чтобы перекрывать любые варианты, применения или адаптации изобретения, в основном следующие принципам изобретения и включающие такие отклонения от настоящего описания, какие входят в известную или общепринятую практику в пределах области, к которой относится изобретение, и какие можно прилагать к заявленным в настоящем документе существенным признакам, изложенным ниже в объеме прилагаемой формулы изобретения. Полное содержание всех процитированных здесь ссылок, включая статьи в журналах или рефераты,опубликованные или неопубликованные патентные заявки США или иностранные патентные заявки,выданные патенты США или иностранные патенты, или любые другие ссылки, приведено здесь в качестве ссылки, включая все данные, таблицы, фигуры и текст, приведенные в процитированных ссылках. Кроме того, полное содержание ссылок, процитированных в процитированных здесь ссылках, также приведено здесь в качестве ссылки. Ссылки на известные стадии способов, общепринятые стадии способов, известные способы или общепринятые способы никаким образом не являются признанием того, что любой аспект, описание или вариант осуществления настоящего изобретения описан, объяснен или предложен в данной области. Приведенное выше описание конкретных вариантов осуществления будет настолько полно раскрывать основную сущность изобретения, что другие могут, посредством применения знаний в данной области (включая содержание процитированных здесь ссылок), легко модифицировать и/или адаптировать для различных применений такие конкретные варианты осуществления, без излишнего экспериментирования, без отклонения от общих принципов настоящего изобретения. Таким образом, такие адаптации и модификации предназначены, чтобы входить в подразумеваемый диапазон эквивалентов описанных вариантов осуществления на основании объяснений и руководства, представленных здесь. Понятно, что формулировки или терминология здесь приведена с целью описания, а не ограничения, так что терминология или формулировки настоящего описания предназначены для интерпретации специалистом в данной области в свете объяснений и руководства, представленных здесь, в сочетании со знаниями обычного специалиста в данной области. Примеры Пример 1. Получение клона клеток яичника китайского хомячка (СНО), продуцирующего высокие уровни IFN-бета. В данном примере описано получение клона СНО, продуцирующего интерферон бета. Основной способ, в частности, что касается получения экспрессирующей плазмиды, описан в Mory et al. (1981). Краткое описание способа получения клона изображено на фиг. 1. Фрагмент ДНК, содержащий кодирующую область интерфероначеловека, выделяли из библиотеки геномной ДНК из клеток периферической крови человека. DHFR-дефицитную линию клеток СНО трансфицировали рекомбинантной плазмидой, содержащей как кодирующую последовательность IFN- человека, так и ген DHFR мыши в качестве селектируемого и амплифицируемого маркера. После отбора на среде без тимидина, амплификации гена с метотрексатом (МТХ) и клонирования выделили клетку, продуцирующую высокие уровниIFN1a. Клетки подвергали генотипической и фенотипической характеризации. Конструирование экспрессирующей плазмиды, несущей гены hIFN- и mDHFR. Сконструировали экспрессирующий вектор, содержащий как геномную последовательность, кодирующую IFN- человека, так и ген устойчивости к DHFR мыши. Эта конструкция исключала необходимость котрансфекции клеток-хозяев СНО двумя отдельными плазмидами, одной, содержащей кодирующую последовательность IFN-, и второй, содержащей последовательность DHFR мыши, как известно,например, из Chernajovsky et al., 1984. Экспрессирующий вектор, содержащий кодирующую последовательность IFN-, освобождали отIFN- 3'UTR и, таким образом, от области полиаденилирования IFN-. Экспрессирующий вектор по изобретению, таким образом, содержит две единицы транскрипции,первую единицу транскрипции IFN-, состоящую из промотора/энхансера SV40, кодирующей последовательности IFN- человека и ранней области полиаденилирования SV40 Т Ag, и вторую единицу транскрипции DHFR, состоящую из промотора/энхансера SV40, гена DHFR мыши и поли А-содержащей ранней области полиаденилирования SV40 Т Ag. За этими единицами транскрипции следовали последовательности из плазмиды pBR322, несущие бактериальную точку начала репликации ColEI и ген устойчивости к ампициллину. Структуру экспрессирующего вектора верифицировали анализом рестрикционной карты и полным секвенированием (двухцепочечным, автоматическим секвенированием). Правильную последовательность фрагментов, применяемых для его конструирования, подтверждали по двум направлениям.- 12015901 Описание клетки-хозяина. Линию клеток яичника китайского хомячка (СНО), обозначенную DUKX-B11, с отсутствием активности DHFR (дигидрофолатредуктазы), использовали в качестве клетки-хозяина. Линию клеток выделили из линии клеток СНО-К 1, нуждающейся в пролине (Kao and Puck, 1968), посредством мутагенеза с помощью этилметансульфата с последующим облучением гамма-лучами. DHFR-дефицитные мутанты отбирали посредством воздействия [3 Н]-дезоксиуридина с высокой удельной активностью (Urlaub andChasin, 1980). Полностью дефицитным мутантам для роста необходимы глицин, гипоксантин и тимидин. Центральная роль DHFR в синтезе предшественников нуклеиновой кислоты, вместе с чувствительностьюDHFR-дефицитных клеток к таким аналогам, как метотрексат (МТХ), предоставляет два главных преимущества. Во-первых, трансфекция таких DHFR-дефицитных клеток плазмидами, содержащими генDHFR, позволяет отбор рекомбинантных клеток, растущих на свободной от тимидина среде. Во-вторых,культивирование этих клеток в селективной среде, содержащей возрастающие концентрации МТХ, приводит к амплификации гена DHFR и связанной ДНК (Kaufman and Sharp 1982, и Sambrook, J., Fritsch,E.F., Molecular Cloning : A laboratory manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NewYork, 1989). Получение клона. Как представлено на фиг. 1, зависимые от культуральной подложки DHFR-дефицитные клетки СНО трансфицировали способом кальций-фосфатной преципитации (Graham F.L. и Van Der Е.В., 1973;Busslinger, et al., 1981) плазмидой, содержащей как кодирующую последовательность h-IFN-, так и маркерный ген mDHFR, описанный выше. Для амплификации трансфицированного гена избранные клоны подвергали обработке МТХ (метотрексатом). Клоны выделяли после отбора с МТХ. Трансфекция. Линию DHFR-дефицитных клеток СНО DUKX-B11 культивировали в питательной смеси Хэма F12,дополненной 10% FBS, при 37 С, 5% СО 2. За сутки перед трансфекцией клетки СНО DUKX-B11 рассевали при 5105 клеток/9 см чашку. Копреципитаты CaPO4-ДНК получали смешиванием ДНК вектора, растворенной в 0,45 мл 10 мМ Трис-HCl рН 7,9, 0,1 мМ ЭДТА с 0,05 мл раствора 2,5 М CaCl2. Затем при осторожном встряхивании добавляли 0,5 мл 280 мМ Na2HPO4, 50 мМ HEPES рН 7,1 и смесь оставляли на 30-40 мин при комнатной температуре, чтобы позволить преципитацию. После добавления СаРО 4-ДНК к клеткам на 30 мин добавляли 9 мл среды для культивирования клеток и возвращали клетки в инкубатор на 4 ч. Затем среду удаляли и подвергали клетки осмотическому шоку с помощью 10% глицерина в среде в течение 4 мин. Затем клетки обрабатывали трипсином и субкультивировали с индексом разведения 1:4-1:10 в селективной среде, состоящей из модифицированной по способу Дульбекко среды Игла (DMEM) без тимидина, но дополненной 150 мкг/мл пролина и 10% диализованной FBS. Культуры содержали при 37 С и 8% СО 2, и селективную среду меняли каждые 3-4 суток. Выделение линии клеток с конститутивной продукцией hIFN-. Клетки, продуцирующие интерферон бета, выделяли спустя 10-12 суток посредством обработки трипсином с помощью смоченных трипсином 3 мм бумажных дисков. Отобрали сорок три клона, выращивали индивидуальные клоны и супернатанты культур клеток тестировали по продукции hIFN- посредством ELISA. Три клона с продукцией более 30000 IFN- IU/106 клеток/24 ч отобрали для амплификации гена. Каждый из клонов подвергали культивированию при низких концентрациях МТХ. Всю популяцию клеток, переживших обработку, подвергали воздействию более высоких концентраций МТХ. Субклонирование и отбор клонов проводили только после последней стадии амплификации. Отобранные продуценты с высокой продукцией (более чем 400000 IU/106 клеток/24 ч) подвергали исследованиям стабильности клонов. Отобрали и субклонировали относительно стабильный клон с высокой продукцией. Из полученных клонов отобрали стабильный клон с высокой продукцией. Амплификация увеличила уровни продукции (удельную продуктивность) IFN1a от 30000 до 500000 IU/106 клеток/24 ч, как определили ELISA. После первоначального выделения клонов с высокой продукцией IFN1a проводили анализы Нозерн-блоттингом. Как ожидали для экспрессирующей конструкции, отдельная мРНК hIFN- приблизительно 0,9 т.н. являлась экспрессированной (данные не представлены). Для анализа Нозерн-блоттингом тотальной РНК из первичных клонов блот получали следующим образом. 20 мкг тотальной РНК разделяли электрофорезом в агарозных гелях с формальдегидом. РНК переносили на нейлоновую мембрану и гибридизовали с зондом из ДНК IFN-. Маркерами размера (М) служили 28S и 18S рРНК, соответствующие 4700 и 1900 нуклеотидам соответственно (не показано).- 13015901 Продуктивность. Затем продуктивность клеток тестировали следующим образом. Среда для культивирования (выращивания) клеток представляла собой DMEM (модифицированную по способу Дульбекко среду Игла),дополненную пролином (150 мг/л) и 10% FBS (эмбриональной бычьей сывороткой), или бессывороточную среду, например, Ex-Cell 302 из JRH. Клетки из продуцирующего интерферон клона рассевали в колбы ТС 80 (2106 клеток/колба) в 30 мл среды для выращивания (либо DMEM и FBS, либо бессывороточной среды). При достижении начальной конфлюэнтности, как определяли микроскопическим исследованием, среду для выращивания заменяли на 20 мл свежей среды и культуры инкубировали при приблизительно 32 С в течение 24 ч. Из каждой колбы получали образцы культуры. Уровень IFN1a определяли посредством ELISA по культуральной среде с помощью коммерческого набора для ELISA (например, набора Toray ELISA из Toray,Japan). Конкретную продуктивность клеток вычисляли посредством умножения IU/мл IFN1a, продуцированного за 24 ч, на объем колбы ТС 80 и деления на общее число клеток (в миллионах) на колбу. Результаты и заключения. Продуцирующий интерферон бета клон клеток представлял собой линию клеток, обладающую высокой продуктивностью для рекомбинантного интерфероначеловека в диапазоне от приблизительно 100000 IU удельной продуктивности клеток (IU/106 клеток/24 ч) до приблизительно 600000 IU удельной продуктивности клеток. Средняя продуктивность новой линии клеток составляла 556000119000 IU/106 клеток/24 ч. Общую морфологию клеток также исследовали фазово-контрастной микроскопией через одничетверо суток после посева. Морфологию документировали с помощью микрофотографий (не показаны). Результаты показали, что при низкой плотности (24-48 ч после посева) клетки обладают округлой веретенообразной морфологией (результаты не показаны). При конфлюэнтности клетки формировали плотные монослои, состоящие из вытянутых, веретенообразных и меньших по размеру, плотно упакованных клеток, подобных эпителиальным (результаты не показаны). Морфологические характеристики, которыми обладали эти клетки, являлись типичными для клеток СНО. Определение последовательности ДНК кодирующей области hIFN- в клетках из клона. ДНК-продукты ПЦР, полученные по матричной РНК (мРНК) hIFN-3, использовали для определения нуклеотидных последовательностей кодирующих областей, так как последовательность мРНК обеспечивает прямое доказательство, что транскрипты РНК процессированы правильно. Способ секвенирования ДНК. Реакция получения кДНК и ПЦР. Тотальную РНК клеток получали из клеток в фазе экспоненциального роста в культурах в Т-колбах(Chomczynski and Sacchi, 1987). Комплементарную ДНК (кДНК) синтезировали для образцов мРНК в реакционной смеси, содержащей 2 микрограмма (мкг) тотальной РНК, 0,5 мкМ случайных гексамеров,2,5 мМ MgCl2, 1X буфер для ПЦР II [10 мМ Трис-HCl (рН 8,3), 50 мМ KCl], 0,5 мМ каждый из dATP,dCTP, dGTP и dTTP, 40 единиц ингибитора РНКазы и 200 единиц обратной транскриптазы в конечном объеме 100 мкл. Матрицу РНК, праймер и не содержащую нуклеаз воду объединяли, инкубировали при 65 С в течение 10 мин и затем помещали в ледяную баню. Добавляли остальные компоненты и реакционную смесь инкубировали при 42 С в течение 60 мин, затем при 70 С в течение 15 мин и затем содержали при 4 С в течение неопределенного времени. Продукты RT (кДНК) сохраняли при -20 С до последующего использования. В качестве контроля получали реакционную смесь со всеми компонентами за исключением обратной транскриптазы. Контроль "без RT" присутствует для исключения маловероятной возможности,что в препаратах РНК присутствует контаминация ДНК. Амплификацию ПЦР проводили с использованием праймеров SRB1 AP1 и АР 2 для матриц кДНК. Последовательности этих праймеров являлись следующими: Реакционные смеси для ПЦР состояли из следующего: 4,0 мкл реакционной смеси с кДНК,50 пмоль каждого из пары праймеров и 25 мкл готовой смеси для HotStarTaq в реакционном объеме 50 мкл. Реакционные смеси нагревали при 95 С в течение 15 мин с последующими 30-35 циклами:(а) 94 С в течение 30 с, (b) 55 С в течение 30 с и (с) 72 С в течение 1 мин. Затем выполняли последний цикл, идентичный первым 30-35, но со временем инкубации при 12 С, продленным до 10 мин. Продукты ПЦР hIFN- очищали посредством гель-электрофореза в агарозе с низкой температурой плавления (LMP) с последующей экстракцией с использованием набора для экстракции из геля QIAquick(Qiagen). Секвенирование амплифицированной ДНК. Продукты ПЦР секвенировали напрямую с использованием готового набора для реакции секвенирования с остановкой цикла Big Dye с ДНК-полимеразой AmpliTaq. Все результаты реакций секве- 14015901 нирования анализировали в 5,75% гелях Long Ranger в автоматическом ДНК-секвенаторе ABI373-S. Необработанные данные отслеживали и анализировали с использованием программного обеспечения для анализа ABD. Результаты. В результате амплификации ПЦР получали предсказанный фрагмент приблизительно 815 п.н. Не обнаружили продуктов ПЦР ни для контроля "без RT", ни для других отрицательных контролей. Получены данные о полной последовательности кодирующей белок области гена hIFN-; все нуклеотиды прочтены по двум или более электроферограммам (данные не представлены). При сравнении последовательностей с экспрессирующим вектором разницы не обнаружено (данные не представлены). Заключения. Данные секвенирования показали, что ген hIFN-, интегрированный в геном клеток из клона, правильно транскрибирован до мРНК hIFN-. Определение числа копий гена. Число копий гена определяли посредством анализа блоттингом по Саузерну после расщепленийBamHI. Специфические праймеры, применяемые для получения зондов для анализа числа копий гена, являлись следующими: Способы получения геномной ДНК и блоттинга по Саузерну. Геномную ДНК выделяли из культур клеток в Т-колбах в фазе экспоненциального роста с использованием модификации способа высаливания (Martinez et al., 1998). Кратко, клетки ресуспендировали в буфере Трис-NaCl-ЭДТА и затем лизировали в буфере Трис-NaCl-ЭДТА-SDS. Эту суспензию обрабатывали в течение ночи протеиназой К. После добавления насыщенного раствора соли и центрифугирования геномную ДНК осаждали добавлением изопропанола к водной фазе. После промывки 70% этанолом осадок ДНК ресуспендировали в растворе ТЕ/РНКазы А (10 мМ Трис-HCl рН 8,0, 1 мМ ЭДТА, 20 мкг/мл РНКазы А). Аликвоты препаратов геномной ДНК расщепляли AflIII, BbsI, BglI, DraI, HincII, PstI и XmnI. Стандарты получали расщеплением образца ДНК экспрессирующего вектора теми же рестрикционными эндонуклеазами, используемыми для геномных образцов. ДНК фракционировали по размеру посредством электрофореза в агарозных гелях и затем переносили на нейлоновые мембраны в 10 Х SSC посредством капиллярного действия. Количество нанесенной геномной ДНК составляло 0,5 мкг. Блоты получали для гибридизации с 32 Р-меченным фрагментом hIFN-, который амплифицировали ПЦР с плазмиды с использованием указанных выше праймеров. Предгибридизацию и гибридизацию проводили при 65 С. Проводили определение размеров на основании миграции полос, как визуализировали посредством 32 Р на авторадиограмме. Экспрессирующий вектор использовали в качестве контроля. Определения числа копий гена основаны на относительных уровнях 32 Р в полосах, как оценивали количественно на PhosphoImager модели 445SI (Molecular Dynamics; Sunnyvale, СА). Авторадиограммы фотографировали для обеспечения регистрации результатов (данные не представлены). Результаты. Определение размеров фрагментов, полученных для продуцирующих интерферон бета клеток из клона проводили для всех расщеплений. Ферментативным расщеплением ДНК, выделенной из линии клеток, продуцирующих интерферон бета, получили заметные полосы, совпадающие с полосами, предсказанными по расщеплениям экспрессирующего вектора BamHI, BglI, DraI и HincII. Для геномных ДНК, расщепленных BglI, наблюдали очень слабую полосу (1,77 т.п.н.), наиболее вероятно, в результате неполного расщепления. Участки узнавания этих ферментов фланкируют экспрессирующую единицу hIFN-, что указывает на то, что интактная, функциональная, полноразмерная единица интегрирована в геном. В случае остальных расщеплений обнаружили различия между характером полос в экспрессирующем векторе и геномных ДНК. Это не являлось неожиданным, так как некоторые перестройки должны происходить, когда кольцевой вектор интегрирует в геном клетки СНО. Уровни числа копий, определенные для клеток из клона, лежали в диапазоне 96-105 копий на клетку. Например, для одной группы клеток среднее число копий гена (n=3) составляло 105, со стандартным отклонением 23 и CV (%) 22. Определение размера мРНК. Тотальную РНК выделяли из продуцирующих интерферон бета клеток в фазе экспоненциального роста и из не трансфицированных клеток СНО DUKX (Chomczynski and Sacchi, 1987). Используемые зонды включали 32 Р-меченный зонд hIFN-, полученный, как описано в разделе "Определение числа копий гена" и контрольный зонд для кДНК G3PDH (Clontech; Palo Alto, СА).- 15015901 Способ. Тотальную РНК, 5 мкг на дорожку, фракционировали по размеру посредством электрофореза в агарозных гелях, содержащих формальдегид в качестве денатурирующего средства. Образцы наносили в двойных наборах. РНК переносили на нейлоновые мембраны в 10 Х SSC посредством капиллярного действия. Предгибридизацию и гибридизацию проводили при 65 С в модифицированном растворе Churchand Gilbert, описанном в разделе "Restriction endonuclease map analysis". Блоты гибридизовали с 32 Рмеченным зондом hIFN- и с контрольным зондом кДНК G3PDH. Размер полос определяли по авторадиограмме блотов. Результаты и заключения. В клетках наблюдали один главный вид мРНК IFN-. Определили, что размер мРНК составляет мРНК 0,9 т.н. Этот размер хорошо коррелирует с мРНК со стартом в участке инициации транскрипцииSV40, что приводит к транскрипту приблизительно 800 нуклеотидов без учета поли А-хвоста. Общие заключения и резюме. Фенотипическими и генотипическими исследованиями клеток, продуцирующих интерферон бета,подтвердили идентичность и стабильность клеток. Интеграцию гена hIFN- в хромосому генома клеток СНО показали исследованием гибридизации insitu. Сравнением картин картирования рестрикционными эндонуклеазами, секвенированием ДНК и анализами мРНК клеток не выявили доказательств обширных перестроек ДНК или точечных мутаций в генеhIFN-. Уровни числа копий гена hIFN- измеряли анализом блоттингом по Саузерну для ДНК, выделенной из клеток клона в соответствии с настоящим изобретением. Результаты показали, что уровни числа копий гена лежали в одинаковых диапазонах для всех клеток, независимо от уровней удвоения в популяции. Анализом Нозерн-блоттинга РНК, полученной из клеток, выявили отдельную полосу размером приблизительно 0,9 п.н. Анализами последовательности кДНК из клеток подтвердили правильность последовательности мРНК, в то время как по последовательностям геномной ДНК 5'- и 3'-контрольных областей гена hIFNподтвердили интеграцию целой единицы транскрипции гена IFN-. В заключение, показали, что клетки, продуцирующие интерферон бета, синтезируют транскрипты мРНК hIFN- с правильной последовательностью кодирующей области белка, что указывает на то, что клетки, продуцирующие интерферон бета, продуцируют рекомбинантный IFN- (IFN1a) с правильной первичной аминокислотной последовательностью. Для генотипической характеризации проводили анализ рестрикционной карты для клеток, продуцирующих интерферон бета. Продукты множественных расщеплений разделяли гель-электрофорезом в агарозе, переносили на нейлоновые мембраны и гибридизовали с мечеными зондами, специфическими для hIFN-. Соответствующими картинами рестрикционных фрагментов показали интеграцию интактной функциональной единицы экспрессии hIFN- во всех банках клеток. Число копий гена IFN- определяли посредством анализа блоттингом по Саузерну ДНК, выделенной из клеток, продуцирующих интерферон бета (данные не представлены). Результаты показали, что число копий гена составляет приблизительно 100 копий на клетку, что приблизительно в четыре раза выше, чем для клона, описанного в литературе (Chernajovsky et al., 1984). Посредством анализа Нозерн-блоттингом для клеток из клона идентифицировали одну мРНК приблизительно 0,9 т.н., кодирующую ген hIFN- (данные не представлены). кДНК hIFN-, полученные для мРНК клеток, секвенировали, и результаты показали, что последовательность гена hIFN- для клеток являлась на 100% идентичной ожидаемой последовательности. Таким образом, ген hIFN- являлся правильно транскрибированным в мРНК. Для клеток клона определили последовательность геномной ДНК 5'- и 3'-областей, фланкирующих ген hIFN-, и обнаружили, что она на 100% идентична соответствующим последовательностям экспрессирующего вектора и опубликованной последовательности гена hIFN-. Одиночную интеграцию в хромосому гена hIFN- показали также посредством флуоресцентной гибридизации in situ (FISH, результаты не показаны). Представленными выше анализами показали также стабильность продуцирующей линии. Таким образом, можно предполагать, что трансфицированный ген стабильно интегрирован в геном клеток, продуцирующих интерферон бета. Пример 2. Способ получения интерферона бета. Общей целью этого эксперимента являлась разработка способа получения IFN бета-1a из клона,описанного в примере 1, в условиях бессывороточной среды. Способ в бессывороточной среде разработали в масштабе 75 л биореактора с внутренним фильтрующим слоем носителей Fibra-Cel.- 16015901 Клетки оттаивали и размножали в течение 21 суток в коммерчески доступной бессывороточной среде со следующими модификациями: Таблица 1 Модификация бессывороточной среды 30109 клеток засевали в 75 л биореактор (высокий засев). Прогоны разделяли на следующие фазы: фаза роста I при 37 С (до суток работы 2 или до суток работы 4, или до достижения скорости потребления глюкозы (GCR) 2,01,0 гл-1 сутки-1); фаза роста II при 35 С (до суток работы 7 или до GCR8,00,5 гл-1 сутки-1); фаза продукции при 33 С. Эта стратегия температур привела к продуктивности около 6,0106 IU/мл биомассы в сутки. Эта продуктивность приблизительно в пять раз выше, чем продуктивность клона, описанного в литературе(Chernajovsky et al., 1984), в содержащей сыворотку среде. Дополнительно тестировали, оказывает ли добавление N-ацетилцистеина (NAC) отдельно или в сочетании с цинком (NAC+Zn) благоприятным эффектом для продуктивности. Добавление NAC или NAC+ Zn увеличивает продуктивность до приблизительно 12106 IU/мл биомассы в сутки в конце прогона. Тестировали также на 66% более низкую плотность засева клеток (1,3109 клеток), чтобы определить ее влияние на продолжительность фазы роста, метаболизм и продуктивность. Низкий засев не влияет на метаболизм и продуктивность. Единственным эффектом низкого засева являлось добавление двух суток к фазе роста. Таким образом, конечные условия, применяемые для получения интерферона бета, являлись следующими: Пример 3. Очистка белкового продукта интерферона. Способ очистки IFN1a из супернатанта культуры клеток включает в себя четыре хроматографические и четыре фильтрационные стадии, как показано на фиг. 2. Стадии очистки проводили в следующем порядке: стадия I: осветление собранной культуры фильтрацией; стадия II: аффинная хроматография на колонке Blue Sepharose 6 fast flow (6 FF); стадия III: ультрафильтрация; стадия IV: катионообменная хроматография, предпочтительно, с использованием колонки CMSepharose FF; стадия V: гидрофобная хроматография RP-HPLC; стадия VI: ультрафильтрация и диализ; стадия VII: эксклюзионная (SE) хроматография; стадия VIII: микрофильтрация. Очистка активного ингредиента начиналась с хроматографии со сродством к красителю на BlueSepharose 6 FF (BS 6 FF), которая являлась основной стадией очистки. Количество белков, происходящих из клетки-хозяина, так же как ДНК из разрушенных клеток СНО, уменьшалось на несколько порядков величины, и таким образом, IFN1a в элюате BS 6 FF являлся значительно обогащенным. Перед нанесением элюата на следующую колонку проводили ультрафильтрацию для уменьшения объема раствора и исключения низкомолекулярного материала. Для получения высокоочищенного IFN1a выбрали три основных типа разделения белка с помощью колонки. Ионообменной хроматографией на смоле CM-sepharose FF удаляют нуклеиновую кислоту и белки, происходящие из FBS/CHO. Обращенно-фазовой HPLC уменьшают количество пирогенов, остатков белков, происходящих из клеток-хозяев и деградированных форм IFN1a. Стадию финишной обработки гель-фильтрацией проводили с использованием смолы Sephacryl S-100 HR. Элюат подвергали микрофильтрации (0,22 мкм) и хранили при -70 С или ниже. Все исходные материалы, применяемые для получения буферов и растворов для очистки, удовлетворяли требованиям Ph. Eur. и/или USP или являлись химически чистыми или чистыми для анализа.- 17015901 Пример 4. Анализ сиалирования. Очищенный IFN-бета подвергали анализу профиля сиалирования посредством ES-MS (массспектрометрии с электрораспылением) со следующими результатами: Пример 5. Анализ гликоформ. Для дополнительного анализа IFN1a, полученного новым способом, анализировали гликоформы белка. Как описано ранее, гликозилированные белки часто существуют в виде смеси различных гликоформ, или белков, обладающих различными сахаридными структурами при гликозилировании. Для анализа этих гликоформ использовали различные способы, как более подробно описано ниже, включая масс-спектрометрию с электрораспылением, FAB-MS, MALDI-MS, тандемную масс-спектрометрию(MS/MS) и GC-MS (анализы связи). Всеми этими различными способами показали, что из различных изучаемых сахаридных структур, одна такая структура впервые присутствовала в IFN1a, полученном из клона. Определение распределения гликоформ посредством масс-спектрометрии с электрораспылением. Способ. Объемные пробы IFN1a из интерферона бета получали из клона с использованием массспектрометрии с электрораспылением (ES-MS). Способ описан, например, Fenn, et al. (1989).MS/MS гликанов. Этот способ позволяет быстрое мониторирование распределения гликоформ в объемных пробах на уровне молекулярной массы. Этот способ описан, например, Domon, В. and Costello,CE (1988). Результаты. Результаты представлены на фиг. 3-5. Для всех фигур схематические изображения различных олигосахаридов показаны сверху каждого пика. На фиг. 3 и 4 показаны преобразованные спектры ES-MS для нескольких серий IFN1a из интерферона бета, полученного посредством нового способа. Во всех тестированных сериях основными гликоформами являлись фукозилированные по кору дисиалированные (пик С) и моносиалированные (пик В) биантенные углеводные структуры, и минорные гликоформы соответствовали фукозилированным по кору несиалированным биантенным (пик А), фукозилированным по кору триантенным трисиалированным (пик Е) и 2 другим фукозилированным по кору минорным комплексным структурам (пики D и F). Минорные сигналы при 22524 Да 0,01%, приписываемые дисиалированным биантенным дифукозилированным гликанам (NeuAc2Hex5HexNAc4Fuc2), детектировали посредством ES-MS в образцахIFN1a, полученных из интерферона бета, полученного посредством нового способа. Эту гликоформу можно также определить как биантенный гликан с антенной из сиалила Льюиса(Lex). Следует заметить, что Льюис(Lex) гликан, состоящий из структуры HexHexNAcFuc, обычно обнаруживают в гликобелках на поверхности как лимфоцитов (L-селектин), так и специализированных эндотелиальных клеток (Cummings, 1999; Dell and Morris, 2001). Другие минорные гликоформы с центром среднего значения молекулярной массы 22670 Да 0,01%,со средним количеством 4% из всех гликоформ, приписываемые дисиалированному биантенному трифукозилированному гликану (Neu2AcHex5HexNAc4Fuc3) детектировали посредством ES-MS в сериях IFN-1a из интерферона бета, полученного новым способом, независимо от масштаба продукции. Среднее количество этой минорной гликоформы составляет 4%, с SD 0,90. Заключения. Характер гликоформ IFN1a, полученного из интерферона бета, полученного новым способом,анализировали посредством ES-MS. Минорные сигналы, приписываемые дифукозилированным гликанам, обнаруженные посредствомMALDI-MS. В продукте из интерферона бета, полученного новым способом, посредством ES-MS обнаружили также дополнительную минорную гликоформу (в среднем 4% от всех гликоформ), приписываемую трифукозилированной структуре. Анализ углеводов посредством FAB-MS, MALDI-MS, тандемной масс-спектрометрии (MS/MS) иGC-MS (исследования связи). Объемные пробы IFN1a, полученного из интерферона бета, полученного новым способом, подвергали обширным исследованиям для характеризации углевода. Состав углеводов IFN1a получали с использованием анализов FAB-MS, MALDI-MS, наноспрей-MS/MS и анализов связи (GC-MS) для перметилированного IFN1a после расщепления трипсином и пептид N-гликозидазой F. Определение уча- 18015901 стков гликозилирования выполняли анализами FAB-MS для полученных расщеплением химотрипсином пептидов, предварительно расщепленных трипсином и N-гликозидазой F. Способ. Смесь пептидов с гликопептидами, полученную из IFN1a при расщеплении трипсином, обрабатывали ферментом пептид-N-гликозидазой F (например, как описано в Tarentino et al., 1985). После остановки реакции (лиофилизацией), полученные продукты расщепления очищали посредством картриджа С 18 Sep-pak. Углеводы во фракциях, элюируемых 5% уксусной кислотой, перметилировали с использованием NaOH/метилиодида, как описано, например, Costello (1997). Часть перметилированного гликана анализировали катионной FAB-MS (получали в низких диапазонах масс для фрагментных ионов и в высоких диапазонах масс для молекулярных ионов), как описано,например, в Barber, et al. (1981) и Taylor (1983).MALDI-масс-спектрометрию проводили, как описано, например, в Hillenkamp, et al., 1991. Наноспрей-масс-спектрометрию проводили, как описано, например, в Wilm and Mann, 1996. Остаток перметилированных олигосахаридов использовали для анализа связей посредством газожидкостной хроматографии/масс-спектрометрии (GC/MS) после дериватизации, как описано, например,в Gray, 1990. Наконец, для наблюдения пептида, содержащего потенциальный участок гликозилирования Asn 80,полученные расщеплением трипсином пептиды расщепляли пептид-N-гликозидазой F и очищали посредством Sep-pak. Фракции, элюируемые пропанолом (20-40%) с Sep-pak дополнительно расщепляли химотрипсином и анализировали посредством FAB/MS. Результаты.MALDI и FAB-MS перметилированных углеводов. Проводили исследование белка для интерферона бета, полученного новым способом. Показательный спектр MALDI представлен на фиг. 6. Соответствующий список сигналов m/z, наблюдаемых для спектров при перметилировании (MALDI-MS и FAB-MS), представлен в табл. 3. Результаты для всех серий показали присутствие преобладающей дисиалированной биантенной структуры, обладающей составом NeuAc2Hex5HexNAc4Fuc и моносиалированной биантенной структуры, обладающей составом NeuAcHex5HexNAc4Fuc. Нефукозилированных гликанов не обнаружили. Во всех наблюдали также минорные сигналы, возможно, соответствующие следующим олигосахаридным структурам: несиалированная биантенная структура (Hex5HexNAc4Fuc); дисиалированная триантенная структура или дисиалированная биантенная структура с повторяющимися структурами N-ацетиллактозамина (NeuAC2 НеХ 6HexNAc5Fuc); трисиалированная триантенная структура (NeuAc3Hex6HexNAc5Fuc); трисиалированная триантенная структура с повторяющимися структурами N-ацетиллактозамина или трисиалированная тетраантенная структура (NeuAc3 Нех 7HexNAc6Fuc); моносиалированная и дисиалированная биантенная структура с двумя единицами фукозы(NeuAcНех 5HexNAc4Fuc2, NeuAc2 Нех 5HexNAc4Fuc2); минорные количества трифукозилированных структур (NeuAc2Hex5HexNAc4Fuc3) также наблюдали в сериях, полученных для интерферона бета, полученного способом по изобретению, однако, они отсутствовали в контрольном IFN1a; минорное количество N-гликолилнейраминовой кислоты как части сиаловых кислот гликанов. Относительное содержание N-гликолилнейраминовой кислоты рассчитывали по высоте пика для сигналов по данным FAB и MALDI-TOF для перметилированного N-связанного гликана. Как и ожидали, гликоформы IFN1a содержат преимущественно N-ацетилнейраминовую кислоту,как и большинство гликопротеинов человека. Наноспрей-MS/MS. Чтобы дополнительно подтвердить структуры следовых количеств N-связанных мультифукозилированных олигосахаридных структур, проводили анализ MS/MS для перметилированных олигосахаридов для сигналов при m/z 919, 1040 и 1098, что соответствует ионам с тройным зарядом ([М+3 Н]3+) дляNeuAcНех 5HexNAc4Fuc2, NeuAc2Hex5HexNAc4Fuc2 и NeuAc2Hex5HexNAc4Fuc3 соответственно. Ионы типа А, наблюдаемые в спектре MS/MS, подтверждают следующее установление структур. Таблица 2 Однако соответствующий сигнал наблюдали по MALDI.- 19015901 Анализ связей посредством GC/MS. Для всех тестированных серий интерферона бета, полученного посредством нового способа, получили комплексные хроматограммы GC с несколькими пиками примесей, происходящих из дериватизующих реагентов. Сравнение времени удержания при GC со временем удержания для стандартной смеси частично метилированных ацетатов альдита при прогоне в тех же условиях GC позволяет предварительное определение содержащих сахар пиков. Результаты анализа связей показали, что все образцы являлись, по существу, одинаковыми, показав присутствие 4-связанного N-ацетилглюкозамина (4-GlcNAc), 4,6-связанного N-ацетилглюкозамина (4,6Glc-NAc), 3,6-связанной маннозы (3,6-Man), 2-связанной маннозы (2-Man), терминальной галактозы (tGal), 3-связанной галактозы (3-Gal) и терминальной фукозы (t-Fuc), убедительно поддерживая данныеFAB-MS. 2,6-связанную маннозу также наблюдали в качестве минорного компонента во всех образцах,что указывает на присутствие некоторых триантенных структур. Постулированные основные олигосахаридные структуры, наблюдаемые в объемных образцах IFN1a, представлены на фиг. 5. Эти данные позволяют предполагать, что основной углеводной группой является фукозилированная по кору биантенная структура с одним и двумя остатками сиаловой кислоты. Участок N-гликозилирования по FAB-MS после расщепления химотрипсином. Для всех тестированных серий IFN1a наблюдали минорный сигнал FAB-MS, приписываемый связанным с натрием пептидным остаткам 80-88 (D.E.Т.I.V.E.N.L.L+Na+) с Asn-80, превращенным в аспарагиновую кислоту после освобождения от углевода с помощью пептид N-гликозидазы F. Этот эксперимент обеспечивает подтверждающее доказательство того, что Asn-80 действительно является гликозилированным. На фиг. 6 показан спектр MALDI для IFN1a с перметилированными гликанами (список сигналов в табл. 3). И в этом случае, как показано в таблице и сопутствующей фигуре, IFN1a, полученный способом по настоящему изобретению, содержит трифукозную структуру, NeuAc2Hex5HexNAc4Fuc3, как описано выше.- 20015901 Таблица 3 Список сигналов в спектре при перметилировании IFN1a, полученного новым способом,после расщепления трипсином и пептид N-гликозидазой F Заключения. Анализами MALDI-MS и FAB-MS перметилированных N-гликанов для объемных образцов IFN-1a, полученного новым способом, обнаружили следующие фукозилированные по кору углеводные структуры (нефукозилированных гликанов не обнаружили). Основные гликоформы: моносиалированная биантенная структура (NeuAc Нех 5HexNAc4Fuc); дисиалированная биантенная структура (NeuAc2Hex5HexNAc4Fuc). Минорные гликоформы: несиалированная биантенная структура (Hex5HexNAc4Fuc); дисиалированная триантенная структура или дисиалированная биантенная структура с повторяющимися структурами N-ацетиллактозамина (NeuAc2Hex6HexNAc5Fuc);- 21015901 трисиалированная триантенная структура (NeuAc3Hex6HexNAc5Fuc); трисиалированная триантенная структура с повторяющимися структурами N-ацетиллактозамина или трисиалированная тетраантенная структура (NeuAc3 Нех 7HexNAc6Fuc); дисиалированная и моносиалированная биантенная структура с двумя единицами фукозы(NeuAcHex5HexNAc4Fuc2 и NeuAc2 Нех 5HexNAC4Fuc2); дисиалированная биантенная структура с тремя единицами фукозы (NeuAc2Hex5HexNAc4Fuc3). Наноспрей-MS/MS перметилированных гликанов подтвердил детекцию следовых количеств олигосахаридов NeuAc2Hex5HexNAc4Fuc2 во всех образцах, в то время как следовые количестваNeuAc2Hex5HexNAc4Fuc3 наблюдали только в IFN1a по способу настоящего изобретения. Анализами связи подтвердили ожидаемые моносахариды, выявленные по данным FAB-MS. Наконец, детальными анализами FAB-MS для полученных с помощью трипсина и химотрипсина пептидов в продукте IFN1a, полученном новым способом, показали присутствие N-гликановой связи на Asn-80. Относительное содержание N-гликолилнейраминовой кислоты рассчитывали по высоте пика для сигналов по данным FAB и MALDI-TOF для перметилированного N-связанного гликана. Соотношение N-ацетилнейраминовая кислота:N-гликолилнейраминовая кислота в образце составляло 31,7:1,0, что позволяло предполагать, что 3,1% сиаловой кислоты представляет собойN-гликолилнейраминовую кислоту. Эти результаты согласуются со сходными уровнями (5%), полученными для природного интерферона человека, продуцируемого фибробластами человека. Как и ожидали,гликоформы IFN1a содержат преимущественно N-ацетилнейраминовую кислоту, как и большинство гликопротеинов человека. Список литературы 1. Altschul S.F. et al., J. Mol. Biol., 215, 403-410, 1990. 2. Altschul S.F. et al., Nucleic Acids Res., 25:389-3402, 1997. 3. Barber, M., Bordoli, R.S., Sedgwick, R.D. and Tyler A.N. (1981), Chem.Commun., 325-327. 4. Morris, H.R., Panico, M. and Taylor W. (1983), Biochem. Biophys. Res. Commun., 117, 299-305. 5. Chernajovsky et al., Efficient Constitutive Production of Human Fibroblast interferon by Hamster CellsPress, Cold Spring Harbor, New York, 1989. 30. Smith and Waterman. J. Mol. Biol., 147,195-197, 1981, Advances in Applied Mathematics, 2, 482-489,1981. 31. Tarentino, A.L., Gomez, С.М., and Plummer, T.H.Jr (1985), Biochemistry, 24, 4665-4671. 32. Urlaub G. and Chasin L.A. Isolation of Chinese hamster cell mutants deficient in dihydrofolate reductase activity. Proc. Natl. Acad. Sci. USA 77(7):4216-4220, 1980. 33. Wilm, M., Mann, M. (1996), Anal. Chem. 68, 1-8. 34. Youcefi et al., Am. J. Clin. Pathol. 1985 Jun; 83(6):735-40. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения гликозилированного рекомбинантного интерферона бета человека, включающий стадию культивирования клетки, продуцирующей интерферон бета человека, в бессывороточной среде, где бессывороточная среда содержит от приблизительно 10 до приблизительно 30 мМ HEPES, предпочтительно 20 мМ HEPES; от приблизительно 0,5 до приблизительно 3 мМ пролина, предпочтительно приблизительно 1 мМ пролина; от приблизительно 5500 до приблизительно 7000 мг/л хлорида натрия, предпочтительно приблизительно 6100 мг/л хлорида натрия; и стадии выделения и очистки белка. 2. Способ по п.1, где бессывороточная среда дополнительно содержит от 10 до приблизительно 20 мг/л фенола красного, предпочтительно приблизительно 15 мг/л фенола красного. 3. Способ по любому из предшествующих пунктов, включающий фазу роста I, фазу роста II и фазу продукции, где фазу роста I проводят при приблизительно 37 С, фазу роста II проводят при приблизительно 35 С и фазу продукции проводят при приблизительно 33 С. 4. Способ по любому из предшествующих пунктов, где способ представляет собой проточный способ со степенью разбавления в диапазоне от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1,5 до приблизительно 7 в сутки. 5. Способ по п.4, где степень разбавления увеличивают в течение первых двух-трех недель культивирования клеток от начального значения приблизительно 1-2 в сутки до значения приблизительно 7-10 в сутки. 6. Композиция гликозилированного рекомбинантного интерферона бета, получаемого способом по любому из предшествующих пунктов. 7. Композиция интерферона бета по п.6, содержащая олигосахаридную структуру, содержащую два или три фукозных сахарида. 8. Композиция интерферона бета по п.6 или 7, где указанная олигосахаридная структура содержит дисиалированный биантенный трифукозилированный гликан (Neu2AcHex5HexNAc4Fuc3). 9. Композиция интерферона бета по любому из пп.6-8, дополнительно содержащая одну или несколько из следующих олигосахаридных структур: несиалированная биантенная структура (Нех 5HexNAc4Fuc); дисиалированная триантенная структура или дисиалированная биантенная структура с повторяющимися структурами N-ацетиллактозамина (NeuAc2 Нех 6HexNAc5Fuc); трисиалированная триантенная структура (NeuAc3 НеХ 6HexNAc5Fuc); трисиалированная триантенная структура с повторяющимися структурами N-ацетиллактозамина или трисиалированная тетраантенная структура (NeuAc3Hex7HexNAc6Fuc); моносиалированная и дисиалированная биантенная структура с двумя единицами фукозы(NeuAcHex5HexNAc4Fuc2, NeuAc2 Нех 5HexNAc4Fuc2). 10. Композиция интерферона бета по любому из пп.6-9, характеризующаяся профилем сиалирования, включающим от приблизительно 1 до приблизительно 5% несиалированных N-гликанов, от приблизительно 5 до приблизительно 25% моносиалированных гликанов, от приблизительно 55 до приблизительно 75% дисиалированных N-гликанов, от приблизительно 10 до приблизительно 25% трисиалированных N-гликанов. 11. Применение композиции рекомбинантного интерферона бета человека по любому из пп.6-10 для получения лекарственного средства для лечения рассеянного склероза. 12. Применение по п.11, где рассеянный склероз выбран из группы, состоящей из рецидивирующего, нерецидивирующего рассеянного склероза и юношеского рассеянного склероза. 13. Применение композиции рекомбинантного интерферона бета человека по любому из пп.6-10 для получения лекарственного средства для лечения рака. 14. Применение композиции рекомбинантного интерферона бета человека по любому из пп.6-10- 23015901 для получения лекарственного средства для лечения вирусных инфекций. 15. Применение бессывороточной среды для культивирования клеток, содержащей от приблизительно 10 до приблизительно 30 мМ HEPES, предпочтительно 20 мМ HEPES; от приблизительно 0,5 до приблизительно 3 мМ пролина, предпочтительно приблизительно 1 мМ пролина; от приблизительно 5500 до приблизительно 7000 мг/л хлорида натрия, предпочтительно приблизительно 6100 мг/л хлорида натрия,для культивирования клетки, продуцирующей рекомбинантный интерферон бета человека. 16. Набор, включающий упаковочный материал и терапевтически эффективное количество выделенной, очищенной композиции рекомбинантного интерферона бета по любому из пп.6-10, или гликозилированного рекомбинантного интерферона бета, полученного способом по любому из пп.1-5, где указанный упаковочный материал содержит этикетку или вкладыш, где указано, что указанный рекомбинантный интерферон бета человека можно вводить человеку для его лечения. Фиг. 5 В Минорные олигосахариды с двумя или тремя остатками фукозы
МПК / Метки
МПК: C07K 14/565, C12N 5/00, C07K 1/20, C07K 1/22, C07K 1/18
Метки: получения, интерферона, способ, гликозилированного, beta
Код ссылки
<a href="https://eas.patents.su/29-15901-sposob-polucheniya-glikozilirovannogo-interferona-beta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения гликозилированного интерферона бета</a>
Предыдущий патент: Напорная труба, содержащая мультимодальную полиэтиленовую композицию с неорганическим наполнителем
Следующий патент: Ингибиторы киназ
Случайный патент: Наружная стена многоэтажного каркасного здания системы аркос и способ ее возведения