Применение il-18 в качестве диагностического маркера
Формула / Реферат
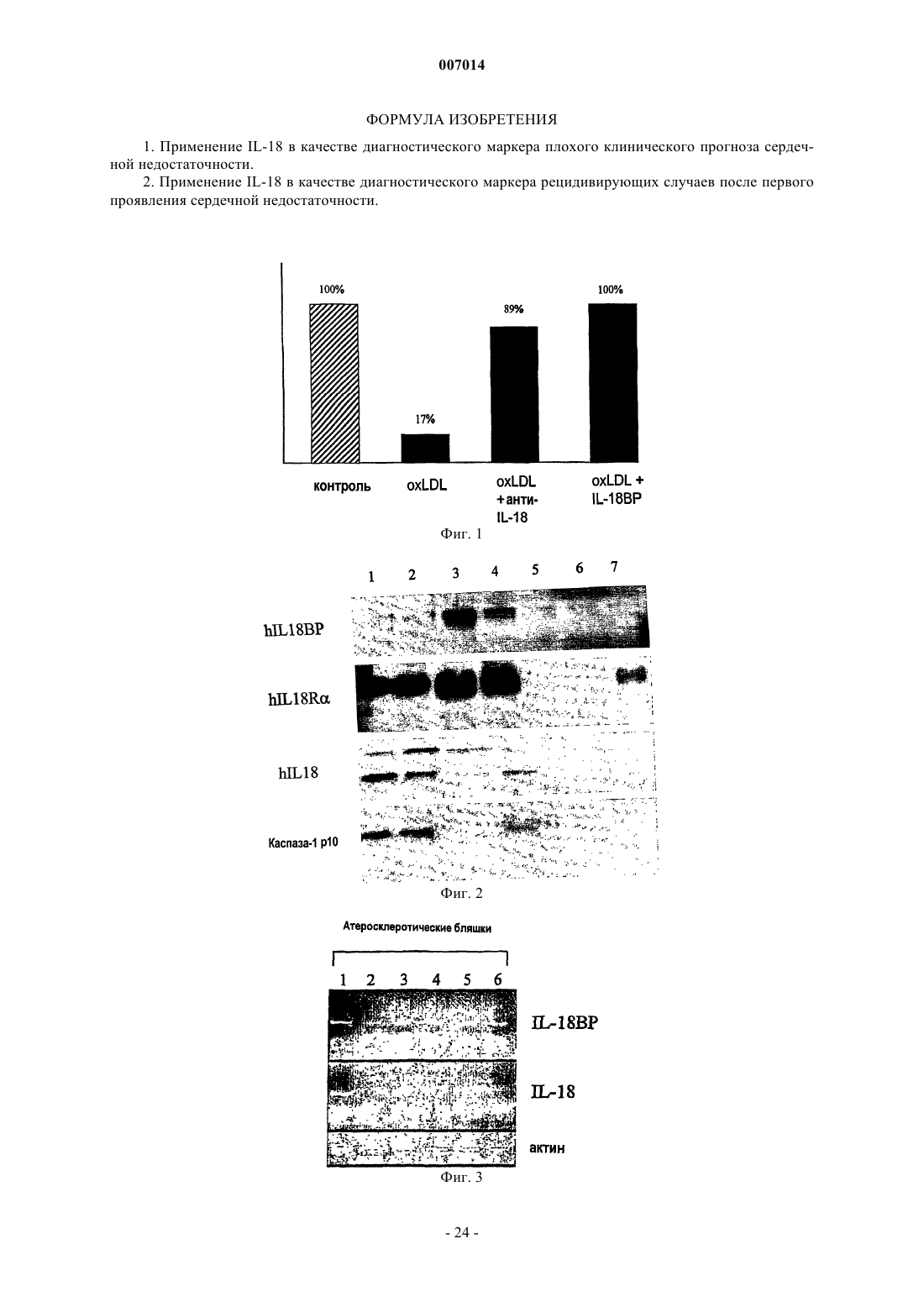
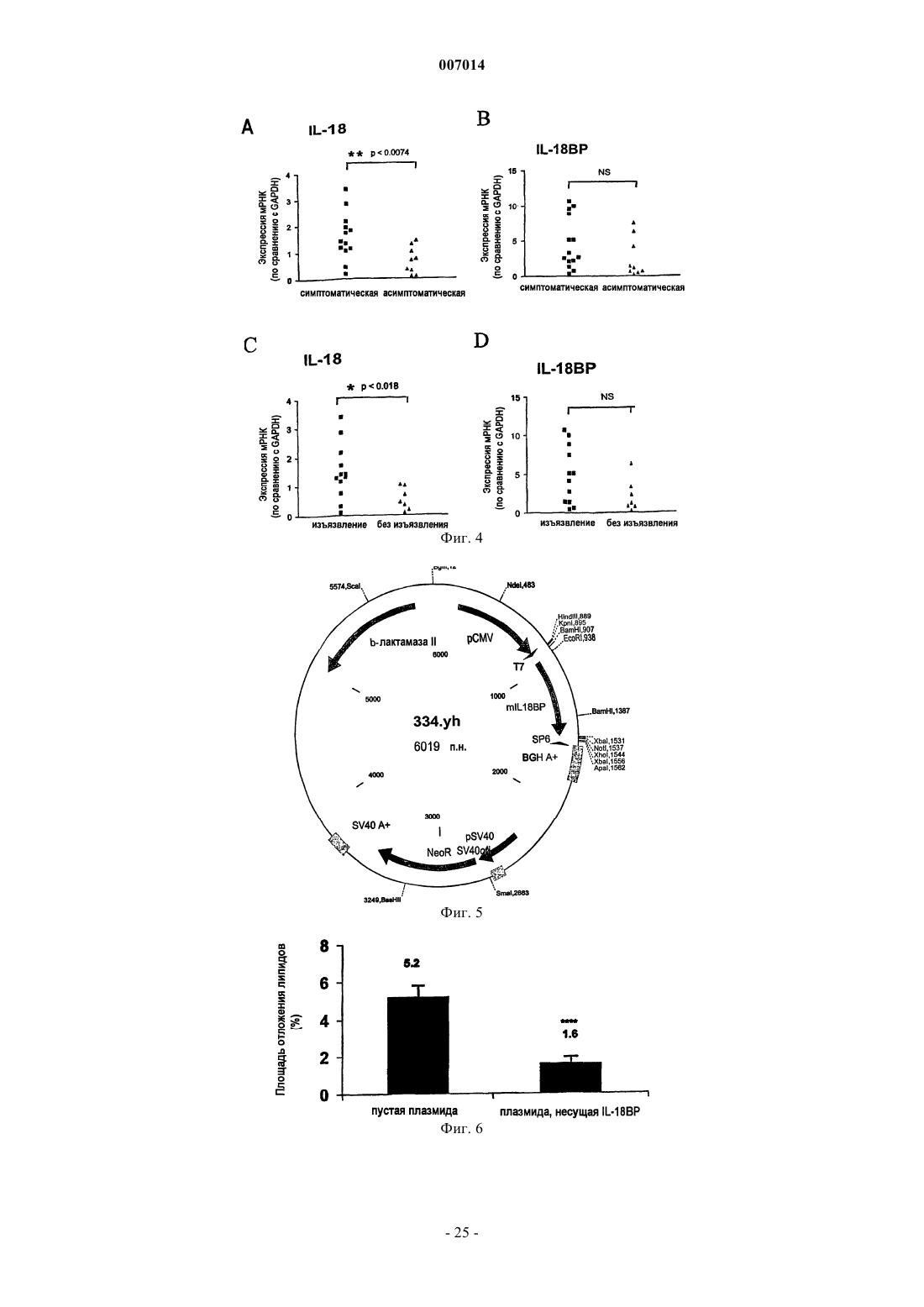
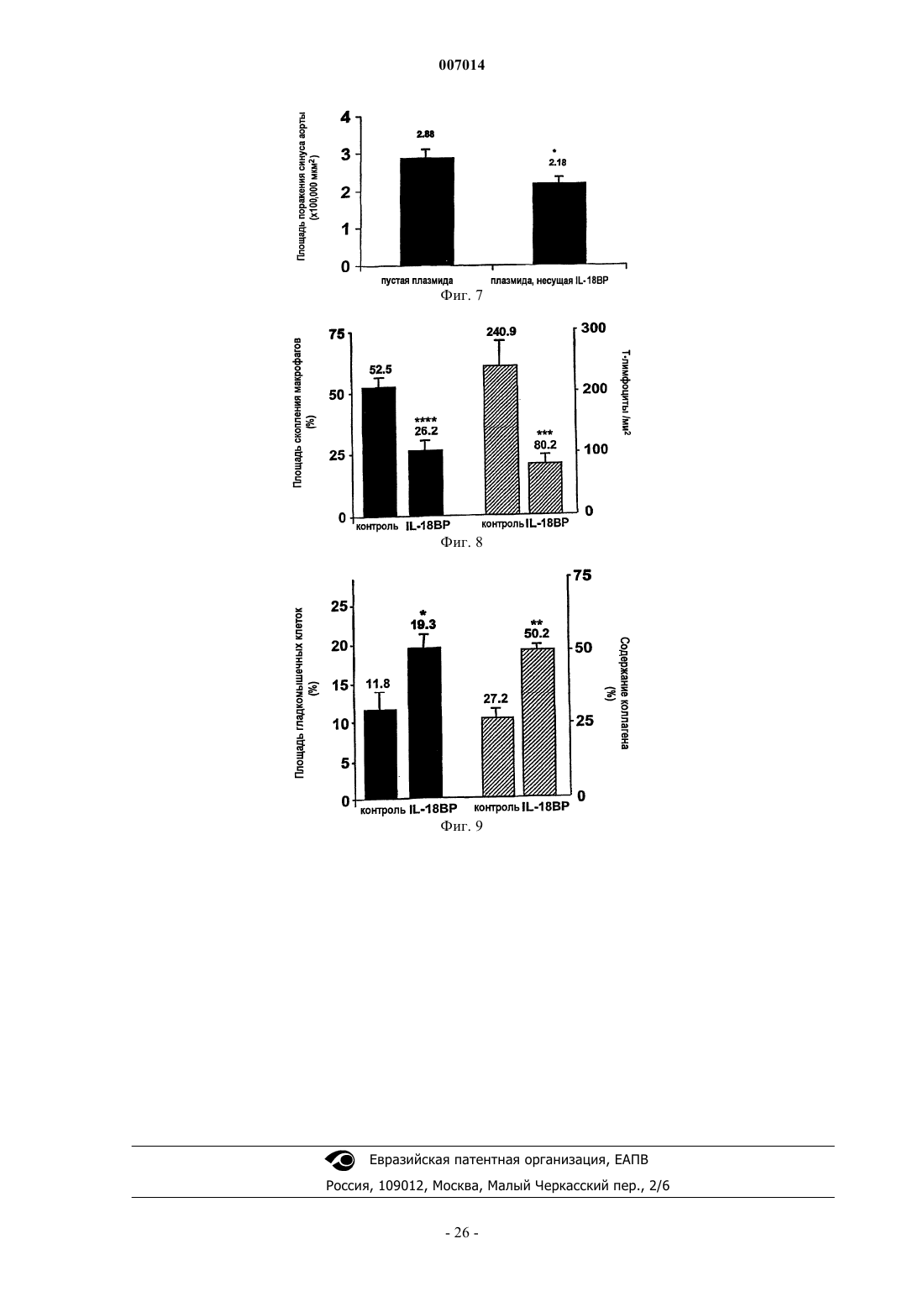
1. Применение IL-18 в качестве диагностического маркера плохого клинического прогноза сердечной недостаточности.
2. Применение IL-18 в качестве диагностического маркера рецидивирующих случаев после первого проявления сердечной недостаточности.
Текст
007014 Область изобретения Настоящее изобретение относится к области заболеваний сосудов. Более конкретно, изобретение относится к применению ингибиторов IL-18 для лечения и/или предотвращения атеросклероза. Уровень техники Атеросклероз является широко распространенным и наиболее важным заболеванием сосудов, но известно множество других заболеваний сосудов. Атеросклероз в основном поражает крупные и средние артерии, и повреждения включают полоски жира, фиброзные бляшки и осложненные поражения. Атеросклероз представляет собой хроническое воспалительное заболевание артериальной стенки, характеризующееся прогрессивным накоплением липидов, таких как холестерин, клеток, таких как макрофаги, Тлимфоциты или гладкомышечные клетки, и экстрацеллюлярного матрикса (1). Наиболее крупные скопления называют атеромами или бляшками, которые часто содержат кальций. Жировая ткань может разъедать стенку артерии, снижать эластичность артерии и препятствовать току крови. В итоге, вокруг бляшкообразных отложений могут образовываться тромбы, дополнительно препятствуя току крови, что может привести к полной окклюзии кровеносного сосуда. Обычно атеросклероз связан с повышенными уровнями LDL-холестерина, Lp(a) фибриногена и фактора VII, так же как и со сниженным уровнем HDLхолестерина. Факторы риска включают более старший возраст, мужской пол, курение, диабет, ожирение,высокий уровень холестерина в крови, диету, богатую жирами, и наличие индивидуального или семейного анамнеза болезни сердца. Он является главной причиной органической ишемии, такой как, например, инфаркта миокарда. Атерома является наиболее распространенным повреждением артерий, которое далее может осложняться тромбоэмболией. Атероматозные бляшки часто сужают просвет артерий, приводя к ишемии и иногда к атрофии тканей в области с плохим кровоснабжением. Серьезные последствия включают симптом стенокардии вследствие ишемии миокарда, сердечную недостаточность вследствие ишемии или неишемических причин, и гипертензию вследствие сужения почечной артерии и плохого кровоснабжения почек, которое физиологически приводит к увеличению секреции ренина. Иногда атеросклероз и артериосклероз относят к отдельным патологическим состояниям и, в данном случае, атеросклероз подразумевает уплотнение (склероз) или потерю эластичности артерий конкретно в результате атеромы, хотя атеросклероз представляет собой уплотнение или потерю эластичности артерий в результате любых причин. Осложнения или последствия атеросклероза включают заболевания коронарных артерий (атеросклероз коронарных артерий), недостаточность кровоснабжения в результате обструкции (ишемия/стенокардия), острый ИМ (инфаркт миокарда, сердечный приступ), транзиторную ишемическую атаку (TIA) или инсульт и повреждение кровеносных сосудов, мышечной ткани или органов. Аневризмы, которые представляют собой постоянные аномальные расширения кровеносных сосудов, также являются широко распространенными последствиями атеросклероза. Атеросклеротические аневризмы брюшной аорты обычно развиваются у пожилых пациентов. Они могут разрываться в забрюшинное пространство. В атеросклеротических аневризмах обычно присутствуют резко выраженная потеря эластичной ткани и фиброз средней оболочки, в основном, в результате ишемии мышечной ткани средней оболочки аорты, сопровождающейся высвобождением макрофагальных ферментов, приводящим к фрагментации эластичных волокон. Лекарственные средства, рекомендованные для лечения или предотвращения атеросклероза, направлены на снижение уровня липидов/холестерина в крови. В частности, широко применяется терапия,направленная на снижение LDL-холестерина. В настоящее время наиболее широко применяются статины, специфические ингибиторы HMG СоА-редуктазы. Другие средства, снижающие уровень липидов,включают такие лекарственные средства, как холестирамин, колестипол, никотиновая кислота, гемфиброзил, пробукол, ловастатин и другие. Другим подходом является минимизирование риска образования тромба на установившемся атероматозном повреждении. Аспирин, который представляет собой специфический ингибитор тромбоксана А 2, опосредующего агрегацию тромбоцитов, или антикоагулянты могут применяться для снижения риска образования тромба. В чрескожной баллонной ангиопластике применяется катетер с баллоном на конце для уплощения бляшки и увеличения тока кроки после окклюзии. Технология подобна применяемой технологии для открытия артерий сердца, но она может применяться в отношении многих других артерий организма. Стеноз коронарных артерий шунтируют с помощью сегментов подкожной вены, вшитой в проксимальную часть аорты, или с помощью отсечения внутренней грудной артерии со стороны грудной стенки и создания анастомоза ее дистального конца с артерией на передней поверхности сердца. Хирургическое удаление отложений (эндартерэктомия) может быть рекомендовано в некоторых случаях (например, эндартерэктомия сонной артерии). Однако основной рекомендацией остается воздействие или контроль над факторами риска, подобно поддержанию диеты с низким содержанием жира, низким содержанием холестерина и низким содержанием соли и с последующими направленными на поддержание здорового состояния рекомендациями в отношении лечения и контроля за гипертонией, диабетом и другими заболеваниями, снижение массы-1 007014 тела и прекращение курения, так же как и регулярные физические упражнения для улучшения состояния сердца и кровообращения. Воспалительный процесс присутствует на различных стадиях атеросклероза (1). Активация эндотелия с помощью ряда факторов, включающих небольшое касательное напряжение, модифицированные липопротеины и провоспалительные цитокины, считается первой стадией атеросклероза и находится под воспалительным контролем (1). Многие недавние исследования показали, что взаимодействия между клетками сосуда и клетками воспаления являются решающими в атерогенезе (1). В частности, ингибирование отдельных провоспалительных путей замедляет развитие атеросклероза (1). Воспаление также играет главную роль в распаде атеросклеротической бляшки и тромбозе (2-5) и поэтому влияет на появление острых ишемических синдромов и связанную с ними летальность (6). Действительно тяжелые клинические проявления атеросклероза, включающие инфаркты сердца, мозга и любых других органов, пораженных атеросклерозом, в основном являются результатом окклюзии просвета сосуда тромбом, образованным при взаимодействии с разрушенной атеросклеротической бляшкой (3, 4). Патологические исследования показали, что уязвимые или нестабильные бляшки, т.е. бляшки, склонные к распаду или распадающиеся, сильно отличаются по клеточному и матриксному составу по сравнению со стабильными бляшками, не склонными к распаду (7). Уязвимые бляшки богаты клетками воспаления(макрофаги и Т-лимфоциты), содержат тромбогенное липидное ядро и характеризуются тонким фиброзным верхним слоем с существенным недостатком внеклеточного матрикса (7). Снижение синтеза коллагена, опосредованное провоспалительным цитокином IFN-, и повышение активности макрофагальных металлопротеаз, разрушающих матрикс, являются причинами истончения и хрупкости фиброзного верхнего слоя (7). Разрушение хрупкого фиброзного верхнего слоя открывает высоко тромбогенное липидное ядро для контакта с циркулирующей кровью и приводит к образованию окклюзивного тромба (1, 7). Поэтому полагают, что плотность клеток воспаления в определенном атеросклеротическом повреждении является хорошим показателем его нестабильности. Клинический прогноз для пациента с атеросклерозом только частично зависит от размера повреждения (19, 20). В настоящее время широко признано, что качество (состав бляшки), скорее, чем размер повреждения, может быть даже лучшим показателем развития ишемических случаев. Действительно,тяжелые клинические проявления атеросклероза (инфаркты сердца или мозга) в основном являются результатом окклюзии просвета сосуда тромбом, образованном на поверхности распадающейся атеросклеротической бляшки (19). Патологические исследования показали, что уязвимые или нестабильные бляшки, которые склонны к распаду или распавшиеся, богаты клетками воспаления и характеризуются существенным недостатком содержания гладкомышечных клеток и коллагена (20, 21). Более того, в подобных бляшках обнаружено увеличение апоптотической гибели клеток, ведущей к образованию высоко тромбогенного липидного ядра (13, 22). Провоспалительные цитокины участвуют в воспалении. Цитокин интерлейкин 18 (IL-18) первоначально был описан как фактор, индуцирующий интерферон- (IFN-) (8). Он представляет собой ранний сигнал развития ответа лимфоцитов Т-хелперов типа 1 (Th1). IL-18 действует совместно с IL-12, IL-2,антигенами, митогенами и возможно другими факторами, индуцируя продукцию IFN-. IL-18 также усиливает продукцию GM-CSF и IL-2, усиливает пролиферацию Т-клеток, вызванную анти-СD3, и повышает Fas-опосредованную гибель естественных киллеров. Зрелая форма IL-18 образуется из его предшественника с помощью IL-1-превращающего фермента (ICE, каспаза-1). Рецептор IL-18 состоит по крайней мере из двух компонентов, участвующих в связывании лиганда. Высоко- и низкоаффинные сайты связывания IL-18 были найдены на мышиных Т-клетках, стимулированных IL-12 (9), предполагая существование многоцепочечного рецепторного комплекса. Две рецепторные субъединицы идентифицированы в настоящий момент, обе принадлежащие к семейству рецептора IL-1 (10). Передача сигнала IL-18 включает активацию NF-В (11). Недавно был выделен растворимый белок, обладающий высокой аффинностью к IL-18, из мочи человека и были клонированы кДНК мыши и человека, так же как и ген человека (12; WO 99/09063). Белок был назван IL-18-связывающий белок (IL-18BP).IL-18BP не является внеклеточным доменом одного из известных рецепторов IL-18, а секретируемым естественно циркулирующим белком. Он принадлежит к новому семейству секретируемых белков,кроме того, включающему различные белки, кодируемые Poxvirus (12). IL-18BP постоянно экспрессируется в селезенке (12). Мочевой IL-18BP, так же как и рекомбинантный, специфически связывает IL-18 с высокой аффинностью и модулирует биологическую аффинность IL-18. Ген IL-18BP расположен на хромосоме человека 11q13, и в геномной последовательности размером 8,3 т.п.н. не было найдено экзона, кодирующего трансмембранный домен. Четыре варианта сплайсинга или изоформы IL-18BP были найдены у человека и обозначены как IL-18BP а, b, с и d, все несущие одинаковые N-концевые последовательности и отличающиеся С-концевыми последовательностями (12). Четыре изоформы IL-18BP человека и две мышиные изоформы, полученные в результате сплайсинга мРНК и найденные в различных библиотеках кДНК, экспрессировали, очищали и оценивали на связывание и нейтрализацию биологической активности IL-18 (23). Изоформа IL-18BP человека (IL-18BPa)-2 007014 проявила наибольшую аффинность к IL-18 с быстрой активацией (rapid on-rate), медленной инактивацией (slow off-rate) и константой диссоциации (K(d 399 пМ. IL-18BPC содержит Ig-домен IL-18BPa за исключением 29 С-концевых аминокислот; K(d) для IL-18BPC в 10 раз меньше (2,94 нМ). Тем не менее, IL18BPa и IL-18BPC нейтрализуют IL-18 95% при двойном мольном избытке. В изоформах IL-18BPb иIL-18BPd отсутствует полный Ig-домен и отсутствует способность связывать или нейтрализовать IL-18. Мышиные изоформы IL-18BPC и IL-18BPd, обладающие идентичным Ig-доменом, также нейтрализуют 95% мышиного IL-18 при двойном мольном избытке. Однако мышиный IL-18BPd, содержащий общую С-концевую последовательность с IL-18BPa человека, также нейтрализует IL-18 человека. Молекулярное моделирование выявило большой смешанный электростатический и гидрофобный сайт связывания на Igдомене IL-18BP, который может являться объяснением его высокой аффинности связывания лиганда(23). Сущность изобретения Изобретение основано на данных, что ингибитор IL-18 обладает выраженным благотворным воздействием на образование бляшки, развитие бляшки и стабильность бляшки на мышиной модели атеросклероза. Ингибитор IL-18 не только предотвращает образование поражения грудной аорты, но также и индуцирует переключение на фенотип стабильной бляшки для уже сформировавшихся атеросклеротических бляшек. Поэтому изобретение относится к применению ингибитора IL-18 для получения лекарственных средств для предотвращения и/или лечения атеросклероза. Изобретение, кроме того, относится к способам лечения с генным терапевтическим подходом лечения и/или предотвращения атеросклероза. Краткое описание фигур На фиг. 1 представлена гистограмма, отражающая процентное значение выживаемости эндотелиальных клеток пупочной вены человека после инкубации только с окисленными липопротеинами или инкубации вместе с комбинацией окисленных липопротеинов с антителами к IL-18 или IL-18BP соответственно. На фиг. 2 представлен Вестерн-блот, проведенный для белковых экстрактов из атеросклеротических артерий в сравнении с контрольными артериями. В Вестерн-блоте применяли антитела против IL-18BP(hIL-18BP), -субъединицу рецептора IL-18 (hIL-18 ВР), IL-18 (hIL-18) и каспазу-1 (Caspase-1 p10). На фиг. 3 представлен агарозный гель, окрашенный бромистым этидием, показывающий результат ОТ-ПЦР-анализа мРНК IL-18 и IL-18BP в клетках атеросклеротической бляшки. На фиг. 4 представлены результаты ОТ-ПЦР для IL-18BP и IL-18 в атеросклеротической бляшке по сравнению с экспрессией h-актина (контроль) в симптоматических и асимптоматических бляшках. На фиг. 5 представлена карта экспрессирующего вектора, использованного для внутримышечного электропереноса у мышей. На фиг. 6 представлена гистограмма, отражающая площадь липидных пятен в атеросклеротических артериях. Количественный компьютерный анализ изображения липидного отложения. Данные представлены в виде средних величин со станд. ошибкой, (n=19 для свободной плазмиды, n=14 для плазмиды,содержащей IL-18BP). Четырьмя звездочками отмечено р 0,0001. На фиг. 7 представлена гистограмма, отражающая площадь поражения синуса аорты после обработки с помощью IL-18BP по сравнению с контролем (свободная плазмида). Количественный компьютерный анализ изображения площади поражения. Данные представлены в виде средних величин со станд. ошибкой. (n=19 для свободной плазмиды, n=14 для плазмиды, содержащей IL-18 ВР). Двумя звездочками отмечено р 0,01. На фиг. 8 представлено влияние обработки с помощью IL-18BP на содержание клеток воспаления в области поражения. Количественный компьютерный анализ изображения применяли для определения процентной величины площадей, положительных по содержанию макрофагов (черные столбики) и количества инфильтрирующих Т-лимфоцитов на мм 2 (серые столбики) в зонах поражений синуса аорты контрольных (n=12 для окрашивания макрофагов, n=15 для окрашивания Т-лимфоцитов) или обработанных с помощью IL-18BP мышей (n=13 для макрофагов, n=12 для Т-лимфоцитов). Данные представлены в виде средних величин со станд. ошибкой. Тремя звездочками отмечено р 0,005; и четырьмя звездочками отмечено р 0,0001. На фиг. 9 представлено влияние обработки IL-18BP на содержание гладкомышечных клеток и коллагена в области поражения. Количественный компьютерный анализ изображения применяли для определения процентной величины площадей, положительных по содержанию гладкомышечных клеток (черные столбики), и накопления коллагена (серые столбики) в зонах поражений синуса аорты контрольных(n=6 для гладкомышечных клеток, n=13 для коллагена). Данные представлены в виде средних величин со станд. ошибкой. Одной звездочкой отмечено р 0,05; и двумя звездочками отмечено р 0,01. Описание изобретения Изобретение основано на данных о повышенных уровнях циркулирующего IL-18 у пациентов с острыми коронарными синдромами и повышенной продукции IL-18 в нестабильных атеросклеротиче-3 007014 ских бляшках сонной артерии, ответственных за инсульт. Кроме того, показано, что электроперенос invivo экспрессирующей плазмидной ДНК, кодирующей IL-18BP, предотвращает развитие жировых полосок в грудной аорте и замедляет прогрессию сформированных атеросклеротических бляшек в синусе аорты на хорошо изученной мышиной модели атеросклероза. Более важно, перенос плазмиды, содержащей IL-18BP, индуцирует сильные изменения в составе бляшки (уменьшение содержания макрофагов, Тклеток, гибели клеток и содержания липидов и увеличение содержания гладкомышечных клеток и коллагена), приводящее к стабильному фенотипу бляшки. Данные результаты впервые показывают важную роль ингибиторов IL-18 в снижении формирования бляшки/прогрессии и в стимулировании стабильности бляшки. Изобретение также относится к применению ингибитора IL-18 для получения лекарственного средства для лечения и/или предотвращения атеросклероза. Термин предотвращение в контексте данного изобретения относится не только к полному предотвращению основного последствия, но также и к любому частичному или достаточно существенному предотвращению, ослаблению, уменьшению, снижению или сокращению последствия перед или на ранней стадии начала заболевания. Термин лечение в контексте данного изобретения относится к любому благоприятному воздействию на развитие заболевания, включая ослабление, уменьшение, снижение или сокращение патологического процесса после начала заболевания. Термин ингибитор IL-18 в контексте данного изобретения относится к любой молекуле, модулирующей продукцию и/или функционирование IL-18 таким образом, что продукция и/или функционирование ослабляются, уменьшаются или частично, существенно или полностью предотвращаются или блокируются. Ингибитор продукции может представлять собой любую молекулу, отрицательно влияющую на синтез, процессинг или созревание IL-18. Ингибиторы, рассматриваемые согласно изобретению, могут являться, например, супрессорами экспрессии гена IL-18, антисмысловыми мРНК, уменьшающими или предотвращающими транскрипцию мРНК IL-18 или приводящими к деградации мРНК, белками, нарушающими правильную укладку или частично или существенно предотвращающими созревание или секрецию IL-18, протеазами, разрушающими IL-18 сразу после его синтеза, и подобными. Ингибитор продукции может представлять собой ингибитор каспазы-1 или ингибитор ICE, например, предотвращающий созревание IL-18. Ингибитор функционирования IL-18 может представлять собой, например, антагонист IL-18. Антагонисты могут как связывать, так и секвестировать саму молекулу IL-18 с достаточной аффинностью и специфичностью для частичной или существенной нейтрализации IL-18 или сайтов связывания IL-18,ответственных за связывание IL-18 с его лигандами (такими как, например, его рецепторами). Антагонист также может ингибировать путь передачи сигнала IL-18, активирующийся в клетках при связывании IL-18/рецептор. Ингибиторы функционирования IL-18 могут также представлять собой растворимые рецепторы IL18 или молекулы, имитирующие рецепторы, или вещества, блокирующие рецепторы IL-18, антитела против IL-18, такие как, например, моноклональные антитела, или любое другое вещество или молекулу,предотвращающие связывание IL-18 со своими мишенями, таким образом ослабляя или предотвращая запуск внутри- или внеклеточных реакций, опосредованных IL-18. Атеросклерозом также называют артериосклероз или уплотнение артерий. Согласно контексту настоящего изобретения термин атеросклероз включает в себя все заболевания или болезненные состояния артерий, обычно описываемые как атеросклероз, в ходе которых липидное вещество откладывается на сосудистой стенке, в итоге приводя к сужению и ухудшению тока крови, так же как и к разрыву и/или эрозии с формированием тромба. Согласно настоящему изобретению атеросклероз означает как уплотнение, так и потерю эластичности артерий в результате атеромы (атеросклероз) и в результате любой другой причины(артериосклероз). Патологические факторы атеросклероза, так же как и осложнения или последствия,которые подразумевается включить в применяемый в описании изобретения термин атеросклероз,подробно описаны выше в уровне техники. Прогрессирование атеросклероза включает образование атеросклеротических бляшек и их переход во все более и более нестабильные формы. Поэтому изобретение также относится к применению ингибитора IL-18 для получения лекарственного средства, снижающего или предупреждающего прогрессирование атеросклероза. Окклюзия сосуда тромбом, сформировавшимся на атеросклеротической бляшке, является решающим событием для инфарктов сердца или мозга, которые находятся в числе наиболее серьезных последствий атеросклероза. Поэтому изобретение также относится к применению ингибитора IL-18 для получения лекарственного средства для лечения и/или предотвращения тромбоза на атеросклеротической бляшке. Стабильность бляшки оказывает влияние на преобразование атеросклеротической бляшки в неблагоприятную или уязвимую бляшку, которая склонна к инициированию тромбоза. Поэтому изобретение,-4 007014 кроме того, относится к применению ингибитора IL-18 для получения лекарственного средства для предотвращения и/или лечения нестабильности атеросклеротической бляшки. Нестабильная бляшка склонна к распаду, и распад бляшки может привести к тромбозу. Поэтому изобретение, кроме того, относится к применению ингибитора IL-18 для получения лекарственного средства для предотвращения эрозии или распада атеросклеротической бляшки. Нестабильность бляшки и тромбоз, например, могут быть результатом апоптотической гибели клеток, которая приводит к высокой прокоагулянтной активности и может являться ключевым событием,приводящим к тромбозу эрозированных или распавшихся бляшек, так же как и к эмболическим процессам (13, 14). Показано, что окисленные липопротеины (oxLDL) индуцируют апоптоз макрофагов и эндотелиальных клеток в культуре (15). Как показано на примерах ниже, в настоящее время установлено, что ингибитор IL-18 способен значительно снижать гибель клеток, индуцированную oxLDL. Согласно настоящему изобретению неожиданно было установлено, что уровни IL-18 в крови были значительно повышены у пациентов с сердечной недостаточностью, страдающих от рецидивирующих явлений, таких как, например, смерть, рекуррентная ишемия, реваскуляризация, прогрессирование атеросклероза или периодически повторяющаяся госпитализация по поводу сердечной недостаточности, по сравнению с пациентами, не требующими повторной госпитализации. Данное повышение уровня IL-18 особенно характерно для пациентов, которые умерли спустя некоторое время, по сравнению с выжившими больными. Повышенные уровни IL-18 в крови наблюдались как у пациентов с ишемией, так и у пациентов без ишемии. Поэтому изобретение также относится к применению ингибитора IL-18 для получения лекарственного средства для лечения и/или предотвращения рецидивирующих случаев сердечной недостаточности. Рецидивирующие случаи могут представлять собой любые случаи сердечной недостаточности, такие как смерть, рекуррентная ишемия, реваскуляризация, прогрессирование атеросклероза или периодически повторяющаяся госпитализация по поводу сердечной недостаточности. Согласно предпочтительному воплощению изобретения сердечная недостаточность является ишемической, т.е. результатом ишемии миокарда. Согласно другому предпочтительному воплощению сердечная недостаточность является не ишемической, например, в результате системной гипертензии, порока клапана сердца или заболевания легких,приводящих к правой и затем застойной сердечной недостаточности. Согласно предпочтительному воплощению изобретения ингибитор IL-18 выбран из группы, включающей ICE-ингибиторы, антитела против IL-18, антитела против любой из субъединиц рецептора IL-18,ингибиторы передачи сигнала от рецептора IL-18, антагонисты IL-18, которые конкурируют с IL-18 и блокируют рецептор IL-18, и белки, связывающие IL-18, изоформы, мутеины, гибридные белки, функциональные производные, активные фракции или их производные с круговой перестановкой, обладающие такой же активностью. Применяемый здесь термин мутеины относится к аналогам IL-18 ВР или аналогам вирусного IL18BP, в котором один или несколько аминокислотных остатков нативного IL-18BP или вирусного IL18BP замещены различными аминокислотными остатками или отсутствуют, или один или несколько аминокислотных остатков добавлены к нативной последовательности IL-18BP или вирусному IL-18BP без значительного изменения активности полученных продуктов по сравнению с исходным типом IL18BP или вирусным IL-18BP. Данные мутеины получают с помощью известных способов синтеза и/или сайт-специфического мутагенеза или любых известных способов, пригодных для применения в настоящем изобретении. Любой подобный мутеин предпочтительно имеет аминокислотную последовательность, достаточно повторяющую последовательность IL-18BP или достаточно повторяющую вирусный IL-18BP, такой,чтобы обладать в значительной степени сходной активностью с IL-18BP. Одним проявлением активности IL-18BP является его способность связывания IL-18. Насколько мутеин обладает достаточной связывающей активностью по отношению к IL-18BP, настолько он может применяться для очистки IL-18, например, с помощью аффинной хроматографии, и, таким образом, можно считать обладает достаточно схожей активностью с IL-18BP. Таким образом, можно определить у любого данного мутеина наличие достаточно схожей активности с IL-18BP посредством обычного экспериментирования, подвергая подобный мутеин, например, простому конкурентному сэндвич-анализу для установления способности связывания соответствующим образом меченного IL-18, например, радиоиммуноанализу или анализуELISA. Мутеиновые полипептиды IL-18BP или мутеины вирусных IL-18BP, которые могут применяться согласно настоящему изобретению, или кодирующая их нуклеиновая кислота включают ограниченный набор значительно совпадающих последовательностей как замещающих пептидов или полинуклеотидов,которые могут быть просто получены специалистом в данной области без большого количества экспериментов, основываясь на принципах и руководстве, представленных в описании изобретения. Предпочтительные модификации мутеинов согласно настоящему изобретению представляют собой замены, известные как консервативные. Консервативные аминокислотные заместители полипептидовIL-18BP, или белков, или вирусных IL-18BP могут включать синонимичные аминокислоты в пределах-5 007014 группы, обладающей достаточно схожими физико-химическими свойствами, так что при замещении одного члена группы другим будет сохраняться биологическая функция молекулы (16). Понятно, что также можно осуществить вставки и делеции аминокислот в вышеуказанных последовательностях без изменения их функции, особенно если вставки или делеции содержат только небольшое количество аминокислот, например менее тридцати и предпочтительно менее десяти, и без удаления или перемещения аминокислот, являющихся решающими в функциональной структуре, например, остатков цистеина. Белки и мутеины, полученные с помощью подобных делеции и/или вставок, входят в объем настоящего изобретения. Предпочтительно синонимичные аминокислотные группы представляют собой указанные в табл. 1. Более предпочтительно синонимичные аминокислотные группы указаны в табл. 2; и наиболее предпочтительные синонимичные аминокислотные группы указаны в табл. 3. Таблица 1. Предпочтительные группы синонимичных аминокислот-6 007014 Таблица 2. Более предпочтительные группы синонимичных аминокислот Таблица 3. Наиболее предпочтительные группы синонимичных аминокислот Примеры проведения замещений аминокислот в белках, которые могут применяться для получения мутеиновых полипептидов или белков IL-18BP, или мутеиновых вирусных IL-18BP для применения со-7 007014 гласно настоящему изобретению, включают любые известные стадии способов, таких как представленные в патентах США 4959314, 4588585 и 4737462 Mark et al.; 5116943 Koths et al.; 4965195 Namen et al.; 4879111 Chong et al.; и 5017691 Lee et al.; и белки, замещенные по лизину, представленные в патенте США 4904584 (Shaw et al.). Термин гибридный белок относится к полипептиду, содержащему IL-18BP, или вирусный IL18BP, или их мутеин, слитые с другим белком, который, например, обладает продолжительным периодом пребывания в жидких средах организма. IL-18BP и вирусный IL-18BP может подобным образом быть присоединен к другому белку, полипептиду или подобному, например, иммуноглобулину или его фрагменту. Применяемый термин функциональные производные включает производные IL-18BP или вирусного IL-18BP и их мутеинов и гибридных белков, которые могут быть получены из функциональных групп, которые располагаются в виде боковых цепей на остатках или N- или С-концевых групп, с помощью известных в данной области способов, и включены в изобретение, пока они остаются фармацевтически приемлемыми, т.е. они не нарушают активности белка, которая достаточно схожа с активностьюIL-18BP или вирусных IL-18BP, и не придают токсических свойств содержащей их композиции. Данные производные могут, например, включать полиэтиленгликольные боковые цепи, которые могут маскировать антигенные сайты и увеличивать пребывание IL-18BP или вирусного IL-18BP в жидких средах организма. Другие производные включают алифатические сложные эфиры карбоксильных групп, амиды карбоксильных групп, полученные взаимодействием аммиака с первичными или вторичными аминами,N-ацильные производные свободных аминогрупп аминокислотных остатков, полученные с помощью ацильных групп (например, алканоил или карбоциклические ароильные группы), или О-ацильные производные свободных гидроксильных групп (например, гидроксильные группы остатков серина или треонила), полученные с помощью ацильных групп. Под термином активные фракции IL-18BP или вирусного IL-18BP, мутеинов и гибридных белков настоящее изобретение подразумевает любой фрагмент или предшественники полипептидной цепи белковой молекулы отдельно или вместе со связанными молекулами или остатками, присоединенными к ним, например, остатками Сахаров или фосфатными остатками, или агрегатами самой белковой молекулы или остатков сахаров, обеспечивая, чтобы указанная фракция обладала достаточно схожей активностью с IL-18BP. Согласно другому предпочтительному воплощению изобретения ингибитор IL-18 представляет собой антитело против IL-18. Антитела против IL-18 могут быть поликлональными или моноклональными,химерными, гуманизированными или даже полностью человеческими. Рекомбинантные антитела или их фрагменты характеризуются высокой аффинностью связывания с IL-18 in vivo и низкой токсичностью. Антитела, которые могут применяться согласно изобретению, характеризуются по их способности лечения пациентов в течение периода, достаточного для достижения от хорошей до превосходной степени регрессии или ослабления патогенного состояния или любого симптома или группы симптомов, связанных с патогенным состоянием и низкой токсичностью. Нейтрализующие антитела легко получают от животных, таких как кролики, козы или мыши, путем иммунизации с помощью IL-18. Иммунизированные мыши являются особенно пригодными для обеспечения источников В-клеток для получения гибридом, которые по очереди культивируют для получения больших количеств моноклональных антител против IL-18. Химерные антитела представляют собой молекулы иммуноглобулина, характеризующиеся двумя или несколькими сегментами или частями, полученными от различных видов животных. Обычно вариабельную область химерного антитела получают из антитела млекопитающего, не человека, такого как мышиное моноклональное антитело, и константную область иммуноглобулина получают из молекулы иммуноглобулина человека. Предпочтительно обе области и комбинация обладают низкой иммуногенностью, что определяется обычным образом (24). Гуманизированные антитела представляют собой молекулы иммуноглобулина, созданные с помощью генно-инженерных технологий, в которых константная область мыши замещена эквивалентной областью человека, при этом сохраняя антиген-связывающие регионы мыши. Полученное химерное антитело мышь-человек предпочтительно обладает пониженной иммуногенностью и улучшенными фармакокинетическими свойствами у человека (25). Таким образом, согласно другому предпочтительному воплощению антитело против IL-18 представляет собой гуманизированное антитело против IL-18. Предпочтительные примеры гуманизированных антител против IL-18 описаны, например, в заявке на выдачу европейского патента ЕР 0974600. Согласно еще другому предпочтительному воплощению антитело против IL-18 является полностью человеческим. Технология получения антител человека описана подробно, например, в WO 00/76310,WO 99/53049, US 6162963 или AU 5336100. Полностью человеческие антитела являются предпочтительно рекомбинантными антителами, продуцируемыми трансгенными животными, например химерными мышами, содержащими полностью или части функциональных локусов Ig человека. Согласно очень предпочтительному воплощению настоящего изобретения ингибитор IL-18 представляет собой IL-18BP или его изоформу, мутеин, гибридный белок, функциональное производное, активную фракцию или производное с круговой перестановкой. Данные изоформы, мутеины, гибридные-8 007014 белки или функциональные производные сохраняют биологическую активность IL-18BP, особенно связывания с IL-18, и предпочтительно обладают, по крайней мере, существенной активностью, сходной сIL-18BP. Идеально, подобные белки обладают биологической активностью, которая даже повышена по сравнению с неизмененным IL-18BP. Предпочтительные активные фракции обладают активностью, более высокой, чем активность IL-18BP, или имеющей дополнительные преимущества, подобные более высокой стабильности или более низкой токсичности или иммуногенности, или их легче получить в большом количестве или легче очистить. Последовательности IL-18BP и его вариантов/изоформ сплайсинга могут быть взяты из WO 99/09063 или из (12) так же как и из (23). Функциональные производные IL-18BP могут быть присоединены к полимерам для улучшения свойств белка, таких как стабильность, полупериод существования, биодоступность, толерантность в отношении организма человека или иммуногенность. Для выполнения данной цели IL-18BP может быть присоединен, например, к полиэтиленгликолю (PEG). Присоединение PEG может проводиться с помощью известных способов, описанных, например, в WO 92/13095. Поэтому, согласно предпочтительному воплощению настоящего изобретения, IL-18BP присоединен к PEG. Согласно другому предпочтительному воплощению изобретения ингибитор IL-18 представляет собой гибридный белок, содержащий целиком IL-18-связывающий белок или его часть, которая присоединена к целому иммуноглобулину или его части. Специалисту в данной области будет понятно, что полученный гибридный белок сохраняет биологическую активность IL-18BP, в частности, связывания с IL18. Слияние может быть прямым или посредством короткого линкерного белка, который может быть коротким длиной от 1 до 3 аминокислотных остатков или длиннее, например длиной 13 аминокислотных остатков. Указанный линкер может быть трипептидом с последовательностью, например, E-F-M (GluPhe-Met), или с линкерной последовательностью в 13 аминокислот, включающей Glu-Phe-Gly-Ala-GlyLeu-Val-Leu-Gly-Gly-Gln-Phe-Met, встроенной между последовательностью IL-18BP и последовательностью иммуноглобулина. Полученный гибридный белок обладает улучшенными свойствами, такими как увеличенный период пребывания в жидких средах организма (полупериод существования), повышенная специфическая активность, повышенный уровень экспрессии или облегчение очистки гибридного белка. Согласно предпочтительному воплощению IL-18BP присоединяют к константной области молекулы Ig. Предпочтительно, проводят присоединение к области тяжелых цепей, например, подобно СН 2 и СН 3-доменам IgG1 человека. Получение специфических гибридных белков, содержащих IL-18BP и часть иммуноглобулина, например, описаны в примере 11 WP 99/09063. Другие изоформы молекулы Ig также пригодны для получения гибридных белков согласно настоящему изобретению, такие как изоформыIgG2, или IgG4, или другие классы Ig, например, подобно IgM или IgA. Гибридные белки могут быть мономерными или мультимерными, гетеро- или гомомультимерными. Интерфероны преимущественно известны по эффектам ингибирования вирусной репликации и клеточной пролиферации. Интерферон-, например, играет важную роль в развитии иммунного и воспалительного ответов. Указывают, что интерферон- (IFN-, интерферон типа I) играет противовоспалительную роль. Изобретение также относится к применению комбинации ингибитора IL-18 и интерферона для получения лекарственного средства для лечения атеросклероза. Интерфероны также могут быть присоединены к полимерам для улучшения стабильности белков. Конъюгат интерферонаи полиола полиэтиленгликоля (PEG), например, описан в WO 99/55377. Согласно другому предпочтительному воплощению изобретения интерферон представляет собой интерферон- (IFN-) и более предпочтительно IFN- 1 а. Ингибитор продукции и/или функции IL-18 предпочтительно применяют одновременно, последовательно или отдельно с интерфероном. Согласно еще другому воплощению изобретения ингибитор IL-18 применяют в сочетании с антагонистом TNF. Антагонисты TNF проявляют свою активность различными путями. Первый, антагонисты могут связывать или секвестировать саму молекулу TNF с достаточной аффинностью и специфичностью для частичной или значительной нейтрализации эпитопа TNF или эпитопов, ответственных за связывание с рецептором TNF (здесь и далее называемые секвестирующие антагонисты). Секвестирующие антагонисты могут, например, быть антителом против TNF. Альтернативно, антагонисты TNF могут ингибировать путь передачи сигнала TNF, активирующийся с помощью рецептора на поверхности клетки после связывания TNF (здесь и далее называемые сигнальные антагонисты). Обе группы антагонистов являются приемлемыми как по отдельности, так и вместе, в сочетании с ингибитором IL-18 при лечении атеросклероза. Антагонисты TNF легко распознаются и оцениваются с помощью обычного отбора кандидатов по их влиянию на активность нативного TNF на чувствительных клеточных линиях in vitro, например, Вклетках человека, в которых TNF вызывает пролиферацию и секрецию иммуноглобулинов. Анализ включает состав TNF при различных разведениях кандидата-антагониста, например, от 0,1 до 100-9 007014 кратного мольного количества TNF, применяемого для анализа, и контроли с отсутствием TNF или только антагонистом (26). Секвеcтирующими антагонистами являются предпочтительные антагонисты TNF, применяемые согласно настоящему изобретению. Среди секвеcтирующих антагонистов предпочтительными являются такие полипептиды, которые связывают TNF с высокой аффинностью и обладают низкой иммуногенностью. Растворимые молекулы рецептора TNF и нейтрализующие антитела против TNF являются особенно предпочтительными. Например, растворимый TNF-RI и TNF-RII являются пригодными согласно настоящему изобретению. Усеченные формы данных рецепторов, включающие внеклеточные домены рецепторов или их функциональные части, представляют собой особенно предпочтительные антагонисты согласно настоящему изобретению. Усеченные растворимые рецепторы TNF типа I и TNF типа II, например, описаны в ЕР 914431. Усеченные формы рецепторов TNF растворимы и определяемы в моче и сыворотке как 30 и 40 кДа ингибиторные белки, связывающие TNF, которые обозначаются TBPI и TBPII соответственно (27). Согласно изобретению предпочтительно одновременное, последовательное или отдельное применение ингибитора IL-18 с антагонистом TNF и/или интерфероном. Согласно изобретению TBPI и TBPII являются предпочтительными антагонистами TNF, применяемыми в сочетании с ингибитором IL-18. Производные, фрагменты, области и биологически активные участки молекулы рецепторов функционально имеют сходство с молекулами рецепторов и также могут применяться в настоящем изобретении. Подобный биологически активный эквивалент или производное молекулы рецептора относится к участку полипептида или последовательности, кодирующей молекулу рецептора, который имеет существенный размер и способен связывать TNF с такой аффинностью, что взаимодействие с мембраносвязанным рецептором TNF ингибируется или блокируется. Согласно дополнительному предпочтительному воплощению растворимый TNF-RI (TBPI) человека представляет собой антагонист TNF, применяемый согласно изобретению. Нативные и рекомбинантные молекулы растворимого рецептора TNF и способы их получения описаны в eвропейских патентах ЕР 308378, ЕР 398 327 и ЕР 433900. Ингибитор IL-18 может применяться одновременно, последовательно или отдельно от ингибитораTNF. Преимущественно применяется комбинация антитела против IL-18 или антисыворотка и растворимый рецептор TNF, обладающий ингибирующей активностью по отношению к TNF. Согласно другому предпочтительному воплощению изобретения лекарственное средство дополнительно включает ингибитор СОХ, предпочтительно ингибитор СОХ-2. Ингибиторы СОХ известны в данной области. Конкретные ингибиторы СОХ-2 описаны, например, в WO 01/00229. Ингибиторы тромбоксана, в частности тромбоксана А 2, в настоящее время широко применяются для лечения атеросклероза. Следовательно, согласно другому предпочтительному воплощению изобретения лекарственное средство дополнительно включает ингибитор тромбоксана, и в частности, ингибитор тромбоксана А 2,для одновременного, последовательного или отдельного применения. Согласно изобретению особенно предпочтительным является применение аспирина в сочетании с ингибитором IL-18. Одной из причин атеросклероза становится наличие высокой концентрации липидов в крови. Следовательно, согласно другому предпочтительному воплощению лекарственное средство дополнительно включает агент, снижающий уровень липидов, для одновременного, последовательного или отдельного применения. Любой агент, снижающий уровень липидов, известный в данной области, может применяться согласно изобретению, такой как следующие агенты, снижающие уровень липидов, включающие лекарственные средства, такие как холестирамин, колестипол, никотиновая кислота, гемфиброзил, пробукол и другие. Особенно предпочтительными являются ингибиторы HMG СоА-редуктазы и предпочтительно так называемые статины. Многие статины являются известными в данной области, такие как симвастатин или ловастатин. Для улучшения предотвращения и/или лечения атеросклероза предпочтительное воплощение изобретения относится к применению ингибитора IL-18 в сочетании с диетой с низким содержанием жира и/или холестерина, и/или соли. Согласно предпочтительному воплощению настоящего изобретения ингибитор IL-18 применяют в дозе приблизительно от 0,0001 до 10 мг/кг массы тела или приблизительно от 0,01 до 5 мг/кг массы тела,или приблизительно от 0,1 до 3 мг/кг массы тела, или приблизительно от 1 до 2 мг/кг массы тела. Согласно еще одному предпочтительному воплощению ингибитор IL-18 применяют в дозе приблизительно от 0,1 до 1000 мкг/кг массы тела или от 1 до 100 мкг/кг массы тела, или от 10 до 50 мкг/кг массы тела. Изобретение, кроме того, относится к применению экспрессирующего вектора, содержащего последовательность, кодирующую ингибитор IL-18, для получения лекарственного средства для предотвращения и/или лечения атеросклероза. Таким образом, для лечения и/или предотвращения заболевания применяются подходы генной терапии. Преимущественно, экспрессия ингибитора IL-18 далее будет проходить in situ, таким образом эффективно блокируя IL-18 непосредственно в ткани(ях) или клетках,подверженных этому заболеванию.- 10007014 Как подробно изложено в примерах ниже, показано, что эффективная экспрессия IL-18BP может быть представлена на мышиной модели заболевания после электропереноса экспрессирующего вектора,содержащего последовательность, кодирующую IL-18BP. Следовательно, согласно предпочтительному воплощению экспрессирующий вектор вводят с помощью электропереноса предпочтительно внутримышечно. Применение вектора для индукции и/или усиления эндогенной продукции ингибитора IL-18 в клетке, обычно не экспрессирующей ингибитор IL-18 или в которой количество экспрессируемого ингибитора не существенно, также рассматривается согласно изобретению. Вектор может содержать регуляторные последовательности, функционирующие в клетках, в которых желательна экспрессия ингибитора IL18. Подобные регуляторные последовательности могут, например, содержать промоторы или энхансеры. Регуляторная последовательность далее может быть встроена в правильный локус генома путем гомологичной рекомбинации, таким образом реально связывая регуляторную последовательность с геном, экспрессию которого необходимо индуцировать или усилить. Технологию обычно относят к эндогенной активации гена (EGA), и она описана, например, в WO 91/09955. Специалисту в данной области будет понятно, что также возможно прекратить экспрессию IL-18,применяя такие же способы, т.е. с помощью встраивания отрицательно регулирующего элемента, например сайленсера, в локус гена IL-18, таким образом, приводя к отрицательной регуляции или прекращению экспрессии IL-18. Специалисту в данной области будет понятно, что подобная отрицательная регуляция или подавление экспрессии IL-18 имеет такой же эффект, что и применение ингибитора IL-18 для предотвращения и/или лечения заболевания. Изобретение, кроме того, относится к применению клетки, генетически модифицированной, для продукции ингибитора IL-18 для получения лекарственного средства для лечения и/или предотвращения атеросклероза. Изобретение, кроме того, относится к фармацевтическим композициям, особенно пригодным для предотвращения и/или лечения атеросклероза, которые включают терапевтически эффективное количество ингибитора IL-18 и терапевтически эффективное количество интерферона. В качестве ингибитораIL-18 композиция может включать ингибиторы каспазы-1, антитела против IL-18, антитела против любой из субъединиц рецептора IL-18, ингибиторы пути передачи сигнала IL-18, антагонисты IL-18, конкурирующие с IL-18 и блокирующие рецептор IL-18, и белки, связывающие IL-18, их изоформы, мутеины,гибридные белки, функциональные производные, активные фракции или производные с круговой перестановкой, обладающие такой же активностью.IL-18BP и их изоформы, мутеины, гибридные белки, функциональные производные, активные фракции и производные с круговой перестановкой, описанные выше, являются предпочтительными активными составляющими фармацевтических композиций. Интерферон, входящий в фармацевтическую композицию, предпочтительно представляет собойIFN-. Согласно еще другому предпочтительному воплощению фармацевтическая композиция включает терапевтически эффективное количество ингибитора IL-18, необязательно интерферон и антагонистTNF. Антагонисты TNF могут являться антителами, нейтрализующими активность TNF или растворимыми усеченными фрагментами рецептора TNF, также обозначаемыми TPBI и TPBII. Фармацевтическая композиция согласно изобретению может дополнительно содержать один или несколько ингибиторов СОХ, предпочтительно ингибиторы СОХ-2. Фармацевтическая композиция согласно изобретению может дополнительно содержать ингибитор тромбоксана, такой как аспирин, и/или вещество, снижающее уровень липидов, такое как статин. Определение фармацевтически приемлемый означает включение любого носителя, который не препятствует эффективности биологической активности активного компонента, и не является токсичным по отношению к хозяину, которому он вводится. Например, для парентерального введения активные белки могут быть сформированы в стандартную дозированную форму для инъекций вместе с носителями, такими как солевой раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Активные компоненты фармацевтической композиции согласно изобретению могут вводиться индивидуально различными путями. Пути введения включают внутрикожный, чрескожный (например, при медленно высвобождающихся составах), внутримышечный, внутрибрюшинный, внутривенный, подкожный, пероральный, эпидуральный, местный и интраназальный путь. Может применяться любой другой терапевтически эффективный путь введения, например абсорбция через эпителиальные или эндотелиальные ткани, или путем генной терапии, при котором молекула ДНК, кодирующая активный компонент, вводится пациенту (например, с помощью вектора), что приводит к экспрессии активного компонента и секреции in vivo. Кроме того, белок (белки) согласно изобретению могут вводиться вместе с другими компонентами биологически активных препаратов, такими как фармацевтически приемлемые сурфактанты, эксципиенты, наполнители, разбавители и носители. Для парентерального введения (например, внутривенного, подкожного, внутримышечного) активный белок (белки) может быть представлен в форме раствора, суспензии, эмульсии или лиофилизованного порошка в сочетании с фармацевтически приемлемым парентеральным носителем (например, водой,- 11007014 солевым раствором, раствором декстрозы) и добавками, поддерживающими изотоничность (например,маннит) или химическую стабильность (например, консерванты или буферы). Форму стерилизуют с помощью обычно применяемых способов. Биодоступность активного белка (белков) согласно изобретению также можно улучшить с помощью способов присоединения, которые увеличивают полупериод существования молекулы в организме человека, например, присоединением молекулы к полиэтиленгликолю, как описано в РСТ-заявке на выдачу патента WO 92/13095. Терапевтически эффективное количество активного белка (белков) может быть функцией многих переменных, включая тип антагониста, аффинность антагониста к IL-18, какая-либо остаточная цитотоксическая активность, проявляемая антагонистом, путь введения, клиническое состояние пациента (включая желательность поддержания нетоксичного уровня активности эндогенного IL-18). Терапевтически эффективное количество является таким, что при введении ингибитора IL-18 наблюдается ингибирование биологической активности IL-18. Вводимая доза в виде одной или многократной дозы пациенту будет изменяться в зависимости от ряда факторов, включающих фармакокинетические свойства ингибитора IL-18, путь введения, состояние пациента и характеристики (пол, возраст, масса тела, состояние здоровья, размер), выраженность симптомов, сопутствующая терапия, частота лечения и желаемый эффект. Подбор и манипулирование установленными границами дозирования входит в компетенцию специалиста в данной области, так же как и способами определения in vitro и in vivo ингибирования IL-18 у пациента. Согласно изобретению ингибитор IL-18 применяют в количестве приблизительно от 0,0001 до 10 мг/кг или приблизительно от 0,01 до 5 мг/кг массы тела, или приблизительно от 0,01 до 5 мг/кг массы тела, или приблизительно от 0,1 до 3 мг/кг массы тела, или приблизительно от 1 до 2 мг/кг массы тела. Другое предпочтительное количество ингибиторов IL-18 составляет приблизительно от 0,1 до 1000 мкг/кг массы тела или приблизительно от 1 до 100 мкг/кг массы тела, или от 10 до 50 мкг/кг массы тела. Путь введения, являющийся предпочтительным согласно изобретению, представляет собой введение подкожным путем. Внутримышечное введение является другим предпочтительным путем согласно изобретению. Согласно другим предпочтительным воплощениям ингибитор IL-18 вводится ежедневно или через день. Суточные дозы обычно даются в разделенных дозах или в форме с замедленным высвобождением для достижения желаемых результатов. Вторые или последующие введения могут проводиться в такой же дозированной форме в меньшей или большей дозе по сравнению с начальной или предыдущей дозой,вводимой пациенту. Второе или последующее введение может проводиться в ходе или перед началом заболевания. Согласно изобретению ингибитор IL-18 может вводиться профилактически или терапевтически пациенту перед, одновременно или последовательно с другими терапевтическими схемами или препаратами (например, схема, включающая несколько лекарств) в терапевтически эффективном количестве. Активные вещества, вводимые одновременно с другими терапевтическими препаратами, могут вводиться в одной или различных композициях. Изобретение, кроме того, относится к способу лечения и/или предотвращения атеросклероза, включающему введение нуждающемуся в этом хозяину эффективного ингибирующего количества ингибитора IL-18. Изобретение, кроме того, относится к способу предотвращения и/или лечения атеросклероза, включающему введение нуждающемуся в этом хозяину экспрессирующего вектора, содержащего последовательность, кодирующую ингибитор IL-18. Согласно предпочтительному воплощению изобретения экспрессирующий вектор вводят системно и более предпочтительно с помощью внутримышечных инъекций. Изобретение, кроме того, относится к применению IL-18 как диагностического маркера плохого клинического прогноза сердечной недостаточности. Плохой клинический прогноз включает любое ухудшение состояния пациента, подобно рецидивным явлениям или даже смерти, последующей за первым инфарктом миокарда. Предпочтительно IL-18 применяют как диагностический маркер рецидивирующих случаев после первого проявления сердечной недостаточности. Рецидивирующие случаи включают, но не ограничиваются, смерть, рекуррентную ишемию, реваскуляризацию, прогрессию атеросклероза или периодически повторяющуюся госпитализацию по поводу сердечной недостаточности. Только что описанное изобретение будет более легко понятно с помощью ссылки на последующие примеры, которые представлены для иллюстрации и не предназначены для ограничения настоящего изобретения.- 12007014 Примеры Материалы и методы Образцы. Собирали 41 атеросклеротическую бляшку человека, удаленные у 36 пациентов, подвергшихся эндартерэктомии сонной артерии. Для контроля 2 сонные артерии и 3 внутренних грудных артерии, не пораженные атеросклерозом (2 с минимальными фибромышечными уплотнениями), получали путем аутопсии или в ходе операции коронарного шунтирования. Их быстро погружали в жидкий азот и хранили при -80 С. Бляшки, которые применяли для экстракции белка и РНК, быстро промывали, погружали в жидкий азот перед помещением на хранение при -80 С. Для иммуногистохимических исследований бляшки помещали на 2 ч в свежеприготовленный 4% параформальдегид, далее переносили в 30% раствор сахароза-РВS перед быстрым замораживанием в оптимальной среде обработки ткани до температуры резания (О.С.Т. Compound, Miles Inc, Diagnostics Division) с помощью жидкого азота и хранили при -80 С для криостатного секционирования. Несколько срезов от 8 до 10 мкм получали из каждого образца для гистологического анализа и иммуногистохимического исследования. Классификация пациентов. Для изучения возможной связи между экспрессией IL-18/IL-18 ВР и признаками нестабильности бляшки авторы собирали клинические данные in prospective и слепым способом у 23 следующих друг за другом пациентов (из 36), подвергшихся процедуре эндартерэктомии между апрелем и маем 2000. Наличие или отсутствие изъязвления внутри бляшки при макроскопическом исследовании систематически отмечалось хирургом, проводившим процедуру эндартерэктомии. Это давало возможность авторам классифицировать бляшки как изъявленные или неизъязвленные бляшки. Кроме того, пациентов систематизировали согласно клиническим симптомам на две отдельные группы. Пациентов, у которых присутствовали клинические симптомы ишемического нарушения мозгового кровообращения, относящиеся к стенозу сонной артерии, классифицировали как симптоматических. Эндартерэктомию проводили спустя 2-66 дней (17,65,3 дней) после появления клинических симптомов у данных пациентов. Пациентов,которые никогда не испытывали симптомы ишемического нарушения мозгового кровообращения в области сонной артерии, классифицировали как асимптоматических. Асимптоматический стеноз сонной артерии определяли на основе систематической клинической оценки пациентов с заболеванием сердца или периферических сосудов, и его тяжесть устанавливали с помощью повторной Допплер-эхографии действительно опытным эхографистом. Даже если асимптоматические пациенты никогда не имели ишемического эпизода в области стеноза сонной артерии, эндартерэктомия сонной артерии была показана полезной данным пациентам, как показано исследователями асимптоматического атеросклероза сонной артерии (ACAS) (28). Вестерн-блот-анализ. Белки экстрагировали из 12 атеросклеротических бляшек и 5 контрольных нормальных артерий. Замороженные образцы растирали в присутствии жидкого азота. Порошкообразные массы ресуспендировали в ледяном лизирующем буфере (20 ммоль/л Трис-НСl, рН 7,5, 5 ммоль/л EGTA, 150 ммоль/лNaXl, 20 ммоль/л глицерофосфата, 10 ммоль/л NaF, 1 ммоль/л ортованадата натрия, 1% Тритон Х-100,0,1% Tween 20, 1 мкг/мл апротинина, 1 ммоль/л PMSF, 0,5 ммоль/л N-тозил-Lфенилаланинхлорметилкетона (ТРСК), 0,5 ммоль/л N(а)-п-тозил-L-лизинхлорметилкетона (TLCK в соотношении 0,3 мл/10 мг по массе. Экстракты инкубировали на льду в течение 15 мин и далее центрифугировали (12000 g, 15 мин, 4 С). Детергент-растворимые супернатантные фракции сохраняли, и концентрации белка в образцах определяли с помощью белкового анализа Bio-Rad. Для проведения Вестерн-блоттинга для IL-18 и IL-18R белковые экстракты кипятили в течение 5 мин и наносили на 7,5 или 15% SDS-полиакриламидный гель. Для IL-18BP rhIL-18, выделенный из Е.Coli (Serono Pharmaceutical Research Institute, Geneva) соединяли с Affligel 15 (Biorad) на 1 мг/мл смолы согласно протоколу производителей. Белковый экстракт (60 мкг) инкубировали в течение ночи при 4 С с мешалкой вместе с 20 мкл смолы, доведенной до 500 мкл PBS 0,05% Tween. Для удаления любого неспецифического связывания смолу центрифугировали и промывали 10 мМ Трис рН 8, 140 мМ NaCI,0,5% Тритон-Х-100 (Fluka), 0,5% дезоксихлоратом, затем 50 мМ Трис рН 8, 200 мМ NaCI, 0,05% ТХ 100,0,05% nonidet P40 (Fluka), 2 мМ CHAPS (Boehringer, Mannheim), с последующей последней промывкой 50 мМ Трис рН 8. Далее смолу центрифугировали, ресуспендировали в буфере для образцов в приведенных условиях, кипятили в течение 5 мин и, наконец, наносили на 10% SDS-полиакриламидный гель NuPAGE (Invitrogen). Образцы электрофоретически переносили из полиакриламидных гелей на нитроцеллюлозу. Нитроцеллюлозные мембраны пропитывали в течение 2 ч при комнатной температуре в TBST (50 ммоль/л Трис-НСl (рН 7,5), 250 ммоль/л NaCl и 0,1% солевой раствор Tween), содержащем 5% безлипидного сухого молока. Далее мембраны инкубировали с козьими поликлональными антителами против IL-18 и IL18R (-цепь) человека (1 мкг/мл) (RD Systems), мышиными моноклональными антителами против IL18BP человека (Mab 657,27 5 мкг/мл) (Corbaz et al., 2000, рукопись в печати), кроличьими поликлональными антителами против каспазы-1 человека (1 мкг/мл) (А-19, Santa Cruz). Специфичность Mab 657,27 анализировали на полоске мембраны путем конкурентного анализа с помощью 200-молярного избыткаrhIL-18PB-6his (выделенного из клеток яичника китайского хомячка, Serono Pharmaceutical Research Institute), совместно инкубированного с Mab 657.27 в концентрации 5 мкг/мл в течение 1 ч. Последующую инкубацию с HRP, связанным с соответствующими антителами, хемилюминесцентными веществами(ECL, Western blotting; Amersham Corp) проводили для обнаружения положительных полос согласно инструкциям производителей, и полосы визуализировали после экспозиции с фотопленкой Hyperfuilm ECL(Amersham Corp). Иммуногистохимия. Замороженные срезы 6 атеросклеротических бляшек инкубировали с нормальной лошадиной сывороткой 1:10 или нормальной козьей сывороткой 1:10 в течение 30 мин при комнатной температуре, однократно промывали PBS, далее инкубировали либо с первыми мышиными моноклональными антителами против CD68 для распознавания макрофагов (DAKO-CD68, КР 1), либо с первыми мышиными моноклональными антителами против -актина гладкомышечной ткани человека (1 А 4, DAKO) для распознавания гладкомышечных клеток. Для распознавания IL-18 и рецептора IL-18 в атеросклеротических бляшках применяли специфические козьи поликлональные антитела (RD Systems) в разведении 5 мкг/мл. IL-18 ВР определяли с помощью специфических моноклональных антител против рекомбинантной изоформы IL-18BP человека (Н 20) (Corbaz et al., 2000, рукопись в печати). После промывания в PBS стекла инкубируют со следующими вторыми связанными с биотином антителами: связанные с биотином лошадиные IgG против иммуноглобулина мыши (Vector Laboratories, Inc) в разведении 1:200 для определения мест присоединения антител против CD68, -актина гладкомышечных клеток и IL-18BP и связанные с биотином лошадиные IgG против иммуноглобулина козы (Vector) в разведении 1:200 для определения антител против IL-18 и рецептора IL-18. Иммуноокрашивание визуализировали с помощью авидин-биотиновой HRP системы визуализации (Vectastain ABC kit PK-6100 Vector). Для отрицательных контролей параллельные срезы выдерживали с подходящими по изотипу посторонними антителами взамен первых антител. Выделение РНК. Суммарную РНК экстрагировали из 29 атеросклеротических бляшек в кислом гуанидинтиоцианатном растворе и экстрагировали фенолом и хлороформом согласно способу Chomczynski and Sacchi (29). Выделенную РНК растворяли в воде и концентрацию измеряли поглощением при 260 нм. Степень деградации РНК оценивали с помощью электрофореза на 1% агарозных гелях. кДНК синтезировали из 1 мкг суммарной РНК, применяя систему обратной транскрипции Promega согласно протоколу производителей. Полуколичественная и проводимая в режиме реального времени ПЦР IL-18 и IL-18BP человека из атеросклеротических бляшек человека. Полуколичественные реакции ПЦР проводили в полном объеме 50 мкл в присутствии 1 ЕД ДНКполимеразы AmpliTaq (Perkin Elmer, Roche, U.S.A.), 2,5 мМ dNTP (Amersham, U.S.A.) и 50 пмоль прямых и обратных ПЦР-праймеров. Реакционные смеси инкубировали в РТС-200 Peltier Effect Thermal Cycler(MJ Research, U.S.A.) при следующих условиях: денатурация 1 мин при 94 С, отжиг в течение 1 мин при 55 С и элонгация в течение 1 мин при 72 С. Для убеждения наличия соответствующего количества ПЦРпродуктов в течение линейной стадии ПЦР-реакции IL-18BP, IL-18 и -актин анализировали после 25, 28 и 31 цикла. Устанавливали оптимальное количество циклов для IL-18BP, IL-18 и -актина до насыщения полос (31, 28 и 25 соответственно). ПЦР-праймеры подбирали на основе описанных последовательностейIL-18,обратная 5'GCGTCACTACACTCAGCTAA-3'; прямая 5'-GCCTAGAGGTATGGCTGTAA-3'; IL-18BP, прямая 5'ACCTGTCTACCTGGAGTGAA-3'; обратная 5'-GCACGAAGATAGGAAGTCTG-3'; -актин, обратная 5'GGAGGAGCAATGATCTTGATCTTC-3'; прямая 5'-GCTCACCATGGATGATGATATCGC-3'. Для исключения амплификации возможной геномной ДНК, присутствующей в образцах, реакции ПЦР проводили в отсутствие матрицы кДНК. ПЦР-продукты (10 мкл) анализировали на 1% агарозных гелях, проводя электрофорез в 1-кратном буфере ТАЕ. Размер ПЦР-продуктов определяли сравнением с последовательно расположенными в виде лестницы окрашенными полосами в 1 т.п.н. на гелях. (Gibco). Относительную количественную оценку полос, окрашенных бромистым этидием, проводили под воздействием УФсвета с помощью Kodak Digital Sciences analytical software, и отмечали как соотношение искомого гена(hIL-18BP, hIL-18) к контрольно-диспетчерскому гену (h-актин). Праймеры SYBR Green Real Time PCR для IL-18, IL-18BP и GAPDH (контрольный контрольнодиспетчерский ген) подбирали с помощью Primer Express software from PE Biosystems согласно опубликованным последовательностям (AF110799, D49950, NM 002046), являющимся следующими: IL-18, обратная 5'-CAGCCGCTTTAGCAGCCA-S'; прямая 5'-CAAGGAATTGTCTCCCAGTGC-3'; IL-18BP, обратная 5 -AACCAGGCTTGAGCGTTCC-3 ; прямая 5'-TCCCATGTCTCTGCTCATTTAGTC-3'; GAPDH,обратная 5'-GATGGGATTTCCATTGATGACA-3'; прямая 5'-CCACCCATGGCAAATTCC-3'; интронGAPDH, обратная 5'-CCTAGTCCCAGGGCTTTGATT-3'; прямая 5'-CTGTGCTCCCACTCCTGATTTC-3'. Оценивали специфичность и оптимальную концентрацию праймера. Возможное загрязнение геномной ДНК исключали с помощью проведения ПЦР-реакций со специфическими праймерами интрон-GAPDH.- 14007014 Отсутствие неспецифической амплификации устанавливали по анализу ПЦР-продуктов с помощью электрофореза в 3,5% агарозном геле. ПЦР SYBR Green Real Time проводили с применением 5 мкл/лунка ОТ-продуктов (0,5 нг суммарной РНК), 25 мкл/лунку SYBR Green PCR master mix (PE Biosystem, CA,USA) с урацил-N-гликозилазой AmpErase (UNG) (0,5 Ед/лунка) и 20 мкл праймеров (300 нМ). ПЦР проводили при 50 С в течение 2 мин (для инкубации с AmpErase UNG для удаления всего урацила, встроенного в кДНК), 95 С в течение 10 мин (для активации AmpliTaq Gold) и далее прохождение 40 циклов при 95 С в течение 15 с, 60 С в течение 1 мин на ABI PRISM 7700 Detection system. Обратно транскрибированные образцы кДНК таким образом амплифицировали и определяли значения их Ct (порогового значения циклов). Все Ct-величины нормализовали по отношению к контрольно-диспетчерскому генуGAPDH. Отдельные специфические полосы ДНК для IL-18, IL-18 ВР и GAPDH получали с помощью гель-электрофореза. Принцип определения в режиме реального времени с помощью SYBR Green PCR master mix основан на непосредственном определении ПЦР-продуктов с помощью измерения увеличения флуоресценции в результате связывания красителя SYBR Green с двойной цепью ДНК. Статистический анализ. Данные представлены в виде средних величинстанд. ошибка. Уровни IL-18 сравнивали между группами с помощью теста Манна-Уитни. Значение р 0,05 рассматривали как статистически значимое. Пример 1. Предотвращение ингибиторами IL-18 гибели эндотелиальных клеток, индуцированной окисленными липопротеинами (oxLDL). Культивированные эндотелиальные клетки пупочной вены человека (HUVEC) инкубировали в течение 16 ч вместе с oxLDL в присутствии или в отсутствие IL-18-связывающего белка или антител против IL18. Как представлено на фиг. 1, 83% HUVEC погибают после инкубации с oxLDL. Совместная инкубация с IL-18BP или антителами против IL-18 почти полностью предохраняет клетки от гибели. При применении IL-18BP не было отмечено гибели. При применении антител против IL-18 89% клеток выжили. Данный эксперимент ясно показывает защитный эффект двух различных ингибиторов IL-18, направленный против гибели клеток в результате апоптоза в атеросклеротической бляшке. Пример 2. Экспрессия белка IL-18 и его эндогенного ингибитора IL-18BP в атеросклеротических бляшках. Вестерн-блоттинг проводили для белковых экстрактов, полученных из 12 атеросклеротических сонных артерий и 5 нормальных контролей. Белок IL-18, включая активную форму, высоко экспрессировался во всех атеросклеротических бляшках, несмотря на обнаружение небольшой экспрессии или ее отсутствие в нормальных артериях (фиг. 2). Линии 1-4 содержат образцы из атеросклеротических бляшек, линии 5-7 - из нормальных артерий. Интересно, определение активной формы IL-18 возможно коррелирует с экспрессией активной формы каспазы-1, которая участвует в процессинге IL-18 (фиг. 2 четвертый ряд). Значительная экспрессия белка рецептора IL-18 (-цепь) также обнаружена во всех атеросклеротических бляшках по сравнению с очень низким уровнем экспрессии в нормальных артериях (фиг. 2 второй ряд). Кроме того, большинство атеросклеротических бляшек экспрессирует IL-18BP, хотя уровень экспрессии гетерогенный (фиг. 2 первый ряд). Пример 3. Клеточная локализация белка IL-18 и его эндогенного ингибитора IL-18BP в атеросклеротических бляшках. Для установления клеточной локализации IL-18 и IL-18BP проводили иммуногистохимические исследования на 6 атеросклеротических бляшках сонных артерий. Как представлено на фиг. 2, IL-18 в основном экспрессируется в макрофагах, данные клетки, возможно, являются главным источником IL-18 в бляшке (не показано). Данные области также богаты СD3-положительными лимфоцитами. Однако не видно, что Т-лимфоциты непосредственно участвуют в продуцировании IL-18. IL-18 также экспрессируется в некоторых гладкомышечных клетках интимы и в редких эндотелиальных клетках. Напротив, значительную экспрессию IL-18BP обнаружили в эндотелиальных клетках бляшки микрососудов и в их поверхности со стороны просвета, хотя экспрессию во всех сосудах не обнаружили. Относительно низкую и более гетерогенную экспрессию IL-18BP также обнаружили, в основном экстрацеллюлярно, в некоторых богатых макрофагами областях. Пример 4. Экспрессия транскриптов мРНК IL-18 и IL-18BP в атеросклеротических бляшках и взаимосвязь с нестабильностью бляшки. Для установления наличия экспрессии мРНК IL-18 и IL-18BP в атеросклеротических бляшках сонной артерии человека проводили полуколичественную ОТ-ПЦР на шести атеросклеротических бляшках(фиг. 3). мРНК IL-18 и IL-18BP обнаружили во всех атеросклеротических бляшках, хотя количество мРНК IL-18 и IL-18BP было гетерогенным. Поэтому, для точного количественного определения уровней экспрессии мРНК IL-18 и IL-18BP дополнительно анализировали 23 атеросклеротические бляшки с помощью метода SYBR Green Real-Time PCR (фиг. 4). Бляшки характеризовали с помощью клинических и патологических признаков как симптоматические (нестабильные) или асимптоматические (стабильные) бляшки, содержащие макроскопически определяемые изъязвления или не содержащие. Клинические характеристики пациентов суммированы в табл. 4. Процентное значение уменьшения диаметра сонной ар- 15007014 терии (60-95%) и факторы риска, включающие возраст, диабет, гиперхолестеринемию, гипертензию и курение, не отличались для двух групп. Таблица 4. Характеристики пациентов Представлены пациенты с транзиторным или преходящим ишемическим нарушением мозгового кровообращения за 2-66 дней до эднартерэктомии. 2 Количество пациентов с клинически выраженной гипертензией перед началом лечения антигипертензивными препаратами. 3 Количество пациентов с клинически выраженной гиперхолестеринемией перед началом лечения препаратами, снижающими уровень липидов. Обнаружили, что количество IL-18 подвержено положительной регуляции в симптоматических по сравнению с асимптоматическими бляшками (2,030,5 против 0,670,17 соответственно) (фиг. 4 А). Статистический анализ показал, что данное увеличение продукции IL-18, наблюдаемое в симптоматических бляшках, является высоко значимым (р 0,0074), в то время как сниженное количество IL-18BP, обнаруживаемое в симптоматических бляшках по сравнению с асимптоматическими, не является значимым (4,640,98 против 2,50,92 соответственно) (фиг. 4 В). Другими словами, хотя обе симптоматическая и асимптоматическая группы обнаруживают положительную корреляцию между мРНК IL-18 и IL18BP, углы наклона значительно отличаются между 2 группами (симптоматическая группа: угол наклона 1,16 [0,19-2,14], r2=0,36 против асимптоматической группы: угол наклона 4,79 [2,39-7,20], r2=0,76; р 0,05). Поэтому предполагается, что относительное увеличение экспрессии IL-18BP в симптоматической группе не является достаточным для компенсации увеличения экспрессии IL-18. Более того, при рассмотрении наличия изъязвления как признака нестабильности бляшки статистический анализ дополнительно проводили для бляшек без изъязвлений или с изъязвлением внутри бляшки и показали существенную положительную регуляцию IL-18 для бляшек с наличием изъязвлений (р 0,018) (фиг. 4 С). Полученные данные показывают, что увеличение экспрессии IL-18, наблюдаемое в атеросклеротических бляшках, коррелирует с нестабильностью бляшки. Пример 5. Регуляция IL-18BP развития и стабильности атеросклеротического поражения на модели заболевания in vivo. Методы Характеристика пациентов. Образцы плазмы получали от пациентов с острым ишемическим коронарным синдромом (нестабильная стенокардия и инфаркт миокарда), менее чем 7 дней спустя после появления симптомов. Нестабильную стенокардию устанавливали по ассоциации типичной загрудинной боли вместе с либо ишемическими изменениями на электрокардиограмме, либо присутствием заболевания коронарных артерий. Инфаркт миокарда диагностировали на основании типичных ишемических изменений на электрокардиограмме, ассоциированных со значительным повышением ферментов миокарда (креатинфосфокиназы и тропонина I) в крови. Пациенты без ишемии были набраны в это же кардиологическое отделение и совсем не проявляли признаков ишемии. Уровни IL-18 человека в плазме определяли с помощью коммерчески доступного набора (MBL, Japan). Внутримышечный электроперенос in vivo мышам плазмиды, экспрессирующей IL-18BP. Четырнадцать мышей самцов C57BL/6 ароЕ КО 14-недельного возраста получали с 3-недельным интервалом 3 инъекции плазмиды, экспрессирующей IL-18BP, pcDNA3-IL18BP. Контрольные мыши(n=19) получали инъекции контрольной пустой плазмиды. кДНК изоформы d IL-18BP, выделенную как описано (номер доступаQ9ZOM9) (23), субклонировали по сайтам EcoR1/Not1 в экспрессирующий вектор клеток млекопитающих pcDNA3 под контролем цитомегаловирусного промотора (Invitrogen). Конструкция, обозначенная 334.yh, представлена на фиг. 5. Контрольная плазмида представляла собой подобную конструкцию, лишенную терапевтической кДНК. Плазмиду, экспрессирующую IL-18BP, или контрольную плазмиду (60 мкг) вводили инъекционно в обе большеберцовые краниальные мышцы мыши под анестезией, как описано ранее (13). Кратко, чрескожные электрические импульсы (8 электриче- 16007014 ских сигналов прямоугольной формы 200 В/см, продолжительностью 20 мс при 2 Гц) посылали с помощью электроимпульсатора PS-15 (Genetronics, France), применяя два плоских электрода из нержавеющей стали, расположенные друг от друга на 4,2-5,3 мм на каждой стороне ноги.ELISA mIL-18BP. Плашки покрывали в течение ночи r-mIL-18 ВРd-аффинными кроличьими поликлональными антителами (5 мкг/лунку). Растворимый mIL-18BP определяли с помощью связанных с биотином кроличьих поликлональных антител (0,3 мкг/мл), направленных против r-mIL-18 ВР Е. Coli (Peprotec) с последующим добавлением пероксидазы extravidin (1/1000) (Sigma). Связывание кроличьих поликлональных антител оценивали с помощью Вестерн-блота для определения специфичности mIL-18BP. РекомбинантныйmIL-18BPd, продуцируемый клетками НЕК 293, применяли в качестве стандарта. ЧувствительностьELISA составила 5 нг/мл. Анализ мышей. Криостатные срезы (8 мкм) получали из синуса аорты и применяли для определения липидных отложений с помощью Oil красного, определения коллагена с помощью Sirius красного и для иммуногистохимического анализа, как описано ранее (13). Срезы выдерживали со специфическими первыми антителами: против макрофагов мыши, клон МОМА 2 (BioSourse), против -актина, конъюгированные со щелочной фосфатазой, для гладкомышечных клеток и против CD3 для Т-лимфоцитов (Dako), как описано ранее (13). Определение гибели клеток проводили с помощью метода TUNEL (13). СD3 положительные клетки подсчитывали микроскопически слепым способом. Атеросклеротические бляшки в синусе аорты и областях у окрашивающихся положительно на наличие макрофагов, гладкомышечных клеток, коллагена или TUNEL, измеряли с помощью количественного компьютерного анализа изображения (NS15000, Microvision), как описано ранее (13). Инкубированием с неиммунными подходящими по изотипу иммуноглобулинами оценивали специфичность иммуноокрашивания. Специфичность TUNEL оценивали с помощью опущения фермента терминальной дезоксинуклеотидилтрансферазы. Грудные аорты, располагающиеся от левой подключичной артерии до почечных артерий, фиксировали с помощью 10% буферного раствора формалина и окрашивали на отложение липидов с помощью Oil красного. Далее их разрезали в продольном направлении и процентное количество липидных отложений вычисляли с помощью количественного компьютерного анализа изображения (NS15000, Microvision). Результаты В ходе настоящего исследования проверяли гипотезу о том, что регуляция IL-18/IL-18BP играет решающую роль как в атерогенезе, так и в стабильности бляшки. Определяли уровни IL-18 в плазме пациентов с острыми коронарными синдромами (30 мужчин, 18 женщин, средний возраст 66,21,8 лет, из которых 14 имеют нестабильную стенокардию и 34 имеют инфаркт миокарда) и у контрольных пациентов без ишемии, находящихся в том же кардиологическом отделении (10 мужчин, 3 женщины, средний возраст 60,05,2 лет). Уровни IL-18 в плазме были значительно повышены у пациентов с острыми коронарными синдромами по сравнению с контролем (146,917,1 против 73,012,2 пг/мл соответственно, р 0,05) в отличие от уровней циркулирующих IL-18 ВР, которые были немного повышенными (20,1 2,7 против 7,52,5 нг/мл соответственно, р=0,06). Кроме того, уровни IL-18 коррелировали с тяжестью заболевания, так как наиболее повышенные уровни были найдены у пациентов с тяжелым ишемическим нарушением сердечной деятельности и клиническими признаками отека легких (224,0339,1 пг/мл,р 0,001 при сравнении с контролем). Данные результаты, полученные для пациентов с острым коронарным заболеванием, вместе с предыдущими наблюдениями, что IL-18 повышен в атеросклеротических бляшках пациентов с инсультами [Mallat, 2001], отводят возможную важную роль регуляции IL-18/IL18BP в атеросклеротическом процессе. Поэтому авторы проверили данную гипотезу с применением мышей knockout (КО) ароЕ, у которых спонтанно образуются атеросклеротические поражения, подобные человеческим. Четырнадцать 14 недельных мышей самцов получали добавление IL-18 ВР путем внутримышечного электропереноса invivo экспрессирующей плазмидной ДНК, кодирующей мышиный IL-18BPd, при этом 19 подходящих по возрасту контрольных мышей получали пустую плазмиду. Электроперенос плазмиды повторяли каждые 3 недели и мышей забивали в 23-недельном возрасте после 9 недель обработки. Уровни мышиного IL18BP в плазме были ниже, чем пороговое определяемое значение (5 нг/мл) у мышей ароЕ КО, получавших пустую плазмиду. Однако отдельная инъекция плазмиды, содержащей IL-18BP, приводила к высоким уровням IL-18BP в крови с максимумом спустя 2 дня после инъекции (323,5100,9 нг/мл) и 127,435,4 нг/мл спустя 2 недели. После 9 недель обработки плазмидой, содержащей IL-18BP, или пустой плазмидой сывороточные уровни общего холестерина (489,434,6 против 480,836,3 мг/дл соответственно) и липопротеинов высокой плотности (52,39,4 против 48,85,1 мг/дл соответственно) не отличались между двумя группами. Умеренное, но достоверное увеличение массы животных получали в обрабатываемой IL-18BP группе по сравнению с контрольной группой (31,80,9 против 28,60,8 г соответственно, р 0,05). Результат влияния добавления IL-18BP на атеросклероз оценивали в 2 различных локализациях: нисходящей грудной аорте и синусе аорты. Грудная аорта была выбрана для определения роли IL-18BP в- 17007014 образовании жировых полосок (атерогенез), поскольку атеросклеротические поражения грудной аорты всегда отсутствуют в возрасте 14 недель (данные не представлены), когда начинали перенос IL-18BP. Синус аорты, где атеросклеротические поражения уже присутствуют в возрасте 14 недель (данные не представлены), оценивали в отношении развития сформированной бляшки и состава, важного определяющего фактора стабильности бляшки. Обработка с помощью IL-18BP мышей ароЕ КО достоверно влияет на развитие атеросклеротического поражения и развития. Оценка грудной аорты показала заметное уменьшение липидного отложения у мышей, обрабатываемых плазмидой IL-18BP, по сравнению с пустой плазмидой (фиг. 6). Количественный компьютерный анализ изображения показал 69% уменьшение размера атеросклеротических поражений (р 0,0001) (фиг. 6), указывая на решающую содействующую роль IL-18 в атерогенезе. Кроме того, обработка с помощью плазмиды, включающей IL-18BP, только в течение 9 недель достоверно ограничила развитие сформированной бляшки в синусе аорты (24% уменьшение размера бляшки, р=0,01) по сравнению с обработкой пустой плазмидой (фиг. 7). Более важно, что состав сформированного поражения, важный определяющий фактор стабильности бляшки, оказался сильно подвержен влиянию обработки IL-18BP. Атеросклеротические поражения мышей, обрабатываемых с помощью плазмиды, включающей IL-18BP, проявили очень значительное 50% уменьшение инфильтрации макрофагами (р 0,0001) (фиг. 8), содержание менее 67% Т-лимфоцитов(р 0,005) (фиг. 8) и показали 2-кратное увеличение накопления гладкомышечных клеток (р 0,05) (фиг. 9). Кроме того, данные важные изменения в клеточном составе поражения были ассоциированы с достоверным 85% увеличением содержания коллагена (р 0,0005), что установили с помощью окрашиванияSirius красным, и со снижением общего содержания липидов. Поэтому обработка с помощью IL-18BP значительно ослабляет воспалительный процесс в пределах атеросклеротического поражения и индуцирует признаки процесса восстановления стабильности атеросклеротических бляшек. Более того, заметное уменьшение воспалительного компонента в поражениях у мышей, обработанных с помощью IL-18BP, было ассоциировано с существенным снижением гибели клеток в бляшках (2,90,9% у обработанных IL-18BP мышей против 10,53,6% в контроле, р 0,05),следовательно ограничивая рост и тромбогенность бесклеточного липидного ядра [Mallat, 1999]. Выводы Применяя хорошо изученную мышиную модель атеросклероза, подобного человеческому, представленные выше результаты ясно установили несомненную и решающую роль регуляции IL-18 и IL18BP в образовании атеросклеротической бляшки, развитии и стабильности. Несмотря на предотвращение начальной стадии образования поражения в грудной аорте, ингибирование активности IL-18 с помощью добавления IL-18BP также сильно влияет на состав сформированного поражения в синусе аорты,индуцируя переключение на стабильный фенотип бляшки. Клинический прогноз пациента с атеросклерозом только частично зависит от размера поражений. В настоящее время широко признано, что качество (состав бляшки) поражения может являться даже лучшим показателем развития ишемических явлений, чем ее размер. Действительно тяжелые клинические проявления атеросклероза (инфаркты сердца и мозга) являются в основном результатом окклюзии просвета сосуда тромбом, образовавшимся при взаимодействии с распадающейся атеросклеротической бляшкой (19). Патологические исследования показали, что уязвимые или нестабильные бляшки, которые склонны к распаду или распавшиеся, богаты клетками воспаления и обнаруживают существенный недостаток содержания гладкомышечных клеток и коллагена (20, 21). Более того, в подобных бляшках показано значительное увеличение апоптотической гибели клеток, приводящее к образованию высоко тромбогенного липидного ядра (13, 22). Замечательно, что все данные признаки повышения нестабильности бляшки заметно ослаблялись у мышей, обработанных IL-18BP, указывая, что передача сигнала IL-18 является основным определяющим фактором нестабильности бляшки. Значимость результатов, полученных на мышах ароЕ КО, для заболевания человека усиливается обнаружением авторами повышенных уровней циркулирующего IL-18 у пациентов с острыми коронарными синдромами и повышенной продукции IL-18 в нестабильных атеросклеротических бляшках сонной артерии, ответственных за инсульт. Данные находки в совокупности определили ингибиторы активности IL-18 как новый важный терапевтический способ предотвращения и лечения развития атеросклеротических бляшек и ограничения осложнений бляшек. Пример 6. Повышенные уровни IL-18 коррелируют с рецидивирующими явлениями у пациентов с сердечной недостаточностью. Уровни IL-18 определяли в сыворотке крови пациентов с помощью ELISA со специфическими антителами против IL-18. В целом обследовали 56 ишемических или неишемических пациентов с признаками сердечной недостаточности или без нее. У пациентов, скончавшихся позже, уровни IL-18 составили 216,041,5 пг/мл против 112,212,2 пг/мл у пациентов без летального исхода (р=0,0018). У пациентов с любым рецидивирующим случаем, таким как смерть, рекуррентная ишемия, реваскуляризация, прогрессия атеросклероза или периодически повторяющаяся госпитализация по поводу- 18007014 сердечной недостаточности определяли следующие уровни IL-18: 165,823,8 против 107,714,6 у пациентов с отсутствием любого рецидивного случая (р=0,03). Данные результаты показывают, что уровни IL-18 достоверно повышены у пациентов, имеющих плохой клинический прогноз, подобный рецидивирующим случаям или даже смерти. В образцах крови 16 неишемических пациентов с признаками сердечной недостаточности или без нее определяли уровень IL-18. У пациентов, которые позже скончались, уровень составил 199,034,8 пг/мл против 95,320,4 пг/мл у выживших пациентов (p=0,09). Пациенты с любым рецидивирующим случаем: 146,634,4 пг/мл IL-18 против 95,423,9 пг/мл у пациентов с отсутствием любого рецидивирующего случая (р=0,03). Хотя различие в уровнях IL-18 не достигало статистически значимой величины вследствие небольшого количества пациентов, можно увидеть ясную тенденцию к повышению уровня IL-18. У ишемических пациентов уровень IL-18 составил 214,245,9 пг/мл для скончавшихся пациентов против 118,412,8 пг/мл для выживших пациентов (р=0,007). 162,824,7 пг/мл IL-18 определяли у пациентов, имеющих любой рецидивирующий случай, против 116,216,0 у пациентов с отсутствием любых рецидивирующих случаев. Ссылки 1. Ross R. Atherosclerosis-an inflammatory disease. N. Engl. J. Med. 1999; 340:115-126. 2. van der Wal AC, Becker AE, van der Loos CM, Das PK. Site of intimal rupture or erosion of thrombosed coronary atherosclerotic plaques is characterized by an inflammatory process irrespective of the dominant- 23007014 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение IL-18 в качестве диагностического маркера плохого клинического прогноза сердечной недостаточности. 2. Применение IL-18 в качестве диагностического маркера рецидивирующих случаев после первого проявления сердечной недостаточности.
МПК / Метки
МПК: A61K 39/395, A61P 7/02, C07K 16/24, A61K 39/00, A61P 9/10, C07K 14/54, C07K 14/81
Метки: маркера, il-18, применение, диагностического, качестве
Код ссылки
<a href="https://eas.patents.su/27-7014-primenenie-il-18-v-kachestve-diagnosticheskogo-markera.html" rel="bookmark" title="База патентов Евразийского Союза">Применение il-18 в качестве диагностического маркера</a>
Предыдущий патент: Фармацевтические композиции ингибиторов белка переноса холестериловых эфиров
Следующий патент: Способ и устройство для выращивания растений
Случайный патент: Способ получения огнеупорных зерен, содержащих оксид хрома (3)