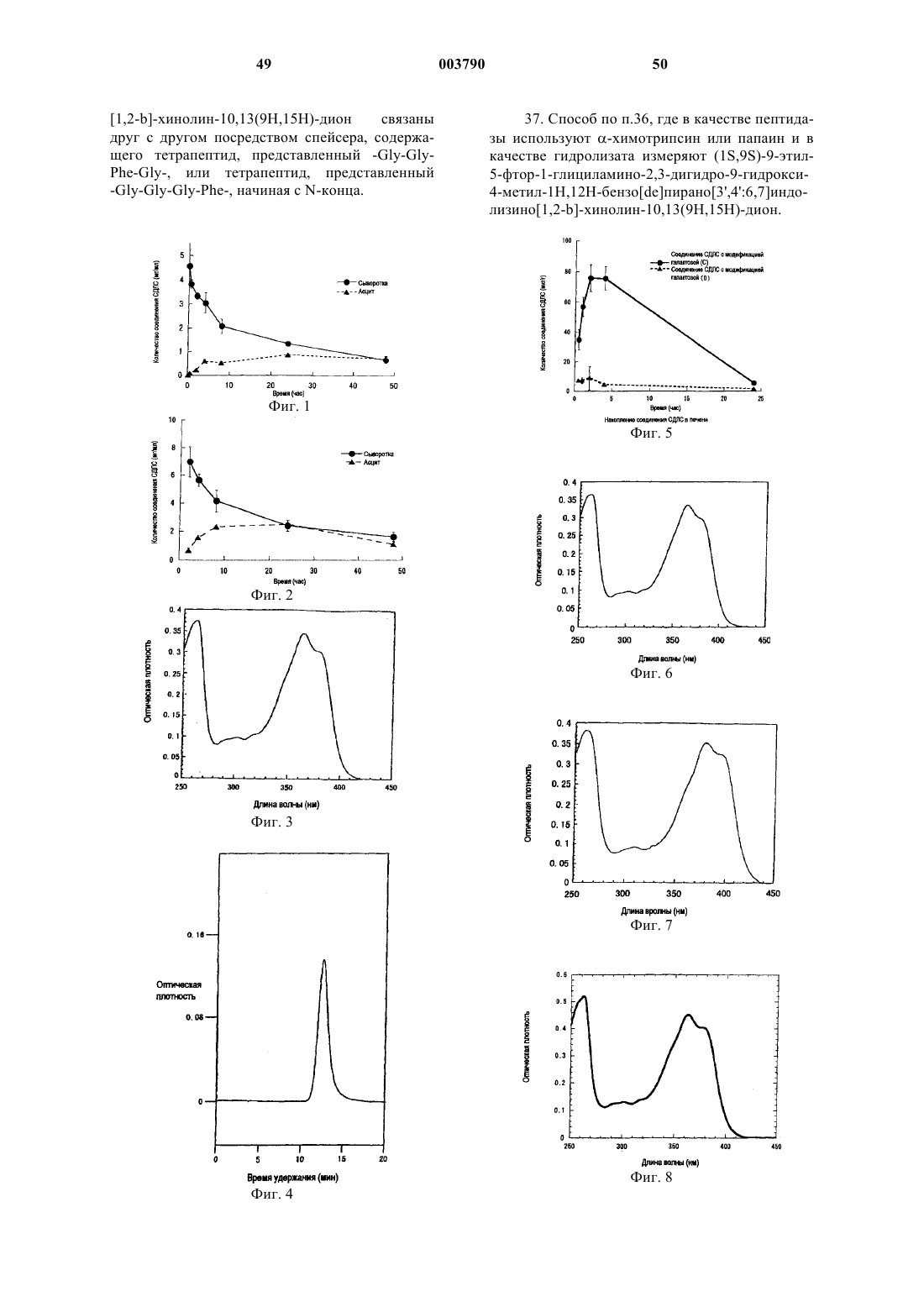
Соединение сдлс и способ его измерения
Номер патента: 3790
Опубликовано: 30.10.2003
Авторы: Сиосе Ёсинобу, Иноуе Казухиро, Икеда Масахиро, Куга Хироси, Сусаки Хироси, Коренага Хироси
Формула / Реферат
1. Соединение СДЛС, которое содержит полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения, связанный с полиспиртом на основе карбокси(C1-4) алкилдекстрана.
2. Соединение СДЛС по п.1, где полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера.
3. Соединение СДЛС по п.2, где спейсер содержит одну аминокислоту или от 2 до 8 аминокислот, связанных пептидной связью(ями).
4. Соединение СДЛС по любому из пп.1-3, где полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, образован связыванием сахаридного соединения и полиспирта на основе карбокси(C1-4)алкилдекстрана посредством линкера.
5. Соединение СДЛС по п.4, где полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, имеет кластерную модификацию сахаридными соединениями, связанными посредством линкера.
6. Соединение СДЛС, которое получают связыванием остатка лекарственного соединения с полиспиртом на основе карбокси(C1-4)алкилдекстрана, в котором часть карбоксильных групп карбокси(C1-4)алкильного фрагмента модифицирована сахаридным соединением.
7. Соединение СДЛС по п.6, которое получают связыванием полиспирта на основе карбокси(C1-4)алкилдекстрана и остатка лекарственного соединения посредством спейсера.
8. Соединение СДЛС по п.6 или 7, которое получают связыванием остатка лекарственного соединения с полиспиртом на основе карбокси(C1-4)алкилдекстрана, который получают связыванием сахаридного соединения или линкера, связанного с сахаридным соединением, с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента полиспирта на основе карбокси(C1-4)алкилдекстрана.
9. Соединение СДЛС, которое получают модифицированием сахаридным соединением полиспирта на основе карбокси(C1-4)алкилдекстрана, в котором остаток лекарственного средства связан с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента посредством спейсера.
10. Соединение СДЛС по п.9, которое получают связыванием полиспирта на основе карбокси(C1-4)алкилдекстрана и сахаридного соединения посредством линкера.
11. Соединение СДЛС по п.9 или 10, которое получают модифицированием сахаридным соединением полиспирта на основе карбокси(C1-4)алкилдекстрана, полученного связыванием остатка лекарственного соединения с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента полиспирта на основе карбокси(C1-4)алкилдекстрана посредством спейсера, содержащего одну аминокислоту, или спейсера, содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями).
12. Соединения СДЛС по любому из пп.1-11, где сахаридным соединением является галактоза или галактозамин или их производные.
13. Соединения СДЛС по любому из пп.1-12, где сахаридным соединением является N-ацетилгалактозамин.
14. Соединения СДЛС по п.12, где степень замещения галактозы, или галактозамина, или их производных или кластера галактозы, или галактозамина, или их производных составляет 0,01-1,0 на остаток сахарида полиспирта на основе карбокси(C1-4) алкилдекстрана.
15. Соединения СДЛС по любому из пп.1-14, где полиспирт на основе декстрана, который составляет карбокси(C1-4) алкилдекстрановый полиспирт, является полиспиртом на основе декстрана, который получают обработкой декстрана в условиях, которые обеспечивают, по существу, полную полиалкоголизацию.
16. Соединение СДЛС по любому из пп.1-15, где полиспиртом на основе карбокси(C1-4)алкилдекстрана является карбоксиметилдекстрановый полиспирт.
17. Соединение СДЛС по любому из пп.1-16, где лекарственным соединением является противоопухолевое средство или противовоспалительное средство.
18. Соединение СДЛС по п.17, где лекарственным соединением является противоопухолевое средство.
19. Соединение СДЛС по любому из пп.1-17, где лекарственным соединением является (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)дион.
20. Соединение СДЛС по п.19, которое является лекарственным средством для лечения рака печени.
21. Полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, для применения в производстве соединения СДЛС по любому из пп.1-20.
22. Полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением.
23. Полимерный носитель, содержащий полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением.
24. Способ измерения соединения СДЛС, в котором полимерный носитель, представляющий полиспирт на основе карбокси(C1-4)алкилдекстрана, и остаток лекарственного соединения связаны друг с другом посредством спейсера, содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями), который включает в себя этапы обработки соединения СДЛС пептидазой и измерения полученного в результате гидролизата.
25. Способ по п.24, который используют для измерения соединения СДЛС, содержащегося в биологическом образце.
26. Способ по п.24, который используют для измерения содержания остатка лекарственного соединения, введенного в соединение СДЛС.
27. Способ по п.24, где гидролизат представляет собой лекарственное соединение.
28. Способ по п.24, где гидролизат представляет собой соединение, содержащее остаток лекарственного соединения, связанный с частью спейсера.
29. Способ по п.24, где часть спейсера представляет собой одну аминокислоту, полученную из спейсера.
30. Способ по п.24, где полимерным носителем является полисахаридное производное, имеющее карбоксильные группы.
31. Способ по п.24, где лекарственным соединением, введенным в соединение СДЛС, является противоопухолевое средство или противовоспалительное средство.
32. Способ по любому из пп.24-31, где спейсером является тетрапептид, представленный -Gly-Gly-Phe-Gly-, начиная с N-конца, или тетрапептид, представленный -Gly-Gly-Gly-Phe, начиная с N-конца.
33. Способ по любому из пп.24-31, где спейсером является группа, представленная Gly-Gly-Phe-Gly-NH-Y'-CH2-O-CO-, начиная с N-конца, или группа, представленная -Gly-Gly-Gly-Phe-NH-Y'-CH2-O-CO-, начиная с N-конца, где Y' означает группу парафенилена.
34. Способ по любому из пп.24-33, где пептидазой является a -химотрипсин или папаин.
35. Способ по любому из пп.24-34, где лекарственным соединением является (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)дион.
36. Способ по любому из пп.24-29, который используют для измерения соединения СДЛС, в котором полиспирт на основе карбокси(C1-4)алкилдекстрана и (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано [3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)дион связаны друг с другом посредством спейсера, содержащего тетрапептид, представленный -Gly-Gly-Phe-Gly-, или тетрапептид, представленный -Gly-Gly-Gly-Phe-, начиная с N-конца.
37. Способ по п.36, где в качестве пептидазы используют a -химотрипсин или папаин и в качестве гидролизата измеряют (1S,9S)-9-этил-5-фтор-1-глициламино-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)дион.
Текст
1 Область техники Данное изобретение относится к СДЛС(СДЛС: система доставки лекарственного средства), в которой полиспирт на основе карбокси(С 1-4)алкилдекстрана,модифицированный сахаридным соединением, и лекарственное соединение, такое как противоопухолевые средства, связаны друг с другом. Данное изобретение также относится к способу измерения соединения СДЛС, в котором полимерный носитель и лекарственное соединение, такое как противоопухолевые средства, связаны друг с другом. Предпосылки создания изобретения Противоопухолевые средства, используемые для лечения твердых раковых опухолей,таких как рак легкого или карцином пищеварительных органов, и раковых заболеваний крови,таких как лейкоз, систематически вводятся через такие пути введения, как внутривенное или пероральное введение, и затем распространяются к определенным местам опухолей и ингибируют или подавляют пролиферацию раковых клеток, проявляя свою терапевтическую эффективность. Однако систематически вводимые противоопухолевые средства быстро захватываются из крови печенью и ретикулоэндотелиальными органами, или быстро экскретируются в мочу, и, соответственно, их концентрации в крови могут быть иногда слишком низкими,чтобы в достаточном количестве распространиться до мест опухолей. Кроме того, обычные противоопухолевые средства сами по себе не распределяются избирательно в местах опухолей (опухолевая избирательность), и поэтому противоопухолевые средства равномерно распределяются по различным тканям и клеткам целого организма и как цитотоксины также действуют против нормальных клеток и тканей,результатом этого являются проблемы возникновения побочных эффектов, например, рвоты,гипертермии, или алопеции при очень высокой дозе. Поэтому желательно было разработать средства эффективного и избирательного распределения противоопухолевых средств в места опухолей. В качестве одного из таких средств был предложен способ, при котором в качестве полимерного носителя используют полисахаридное производное, имеющее карбоксильные группы, и противоопухолевое средство связано с полимерным носителем, чтобы замедлить исчезновение противоопухолевого средства из крови и повысить избирательность по отношению к опухолевым тканям. Например, в опубликованной международной заявке WO 94/ 19376 заявлено соединение СДЛС, в котором пептидная цепь (количество аминокислотных остатков: от 1 до 8) связана с карбоксильной группой полисахарида, имеющего карбоксильные группы, и доксорубицин, даунорубицин,митомицин С, блеомицин или им подобное средство, кроме того, связано посредством пеп 003790 2 тидной цепи. В дополнение в заявке на патент Японии (KOKOKU) No. (Hei) 7-84481/1995 заявлено соединение СДЛС, в котором вышеуказанное противоопухолевое средство введено в карбоксиметилированное производное манноглюкана посредством основания Шиффа или кислотно-амидной связи. Эти соединения СДЛС (также называемые комплексами лекарственных средств) отличаются тем, что они обладают гораздо превосходящей противоопухолевой активностью, пониженной токсичностью и меньшими неблагоприятными воздействиями, по сравнению с самими противоопухолевыми средствами, которые связаны с полимерными носителями. Авторы данного изобретения предоставили соединение СДЛС, которое образуется при связывании полимерного носителя, такого как полисахаридные соединения, с лекарственным соединением,таким как противоопухолевые средства, с помощью спейсера, состоящего из аминокислот в количестве от одной до восьми, и который может сайт-специфично распределять лекарственное средство, такое как противоопухолевые средства, к тканям-мишеням (международная заявка WO 97/46260). Авторы данного изобретения также обнаружили, что полиспирт на основе карбокси(C1-4)алкилдекстрана обладает чрезвычайно желательными свойствами как полимерными носитель, и предоставили соединение СДЛС, содержащее в качестве полимерного носителя полиспирт на основе карбокси(C1-4) алкилдекстрана (указанная выше международная заявка). Что касается способов, имеющих отношение к соединениям СДЛС, использующим в качестве полимерных носителей полиспиртовые производные полисахаридов, имеется несколько сообщений, например, "Researches on polysaccharide-peptide-doxorubicin complexes - Correlation between stabilities of polysaccharide carriers inJapan, 51, 1995). В качестве средств усиления органной избирательности полисахаридных соединений и им подобных известны модифицированные сахаридом производные полиглутаминовой кислоты (не прошедшая экспертизу заявка на патент Японии (KOKAI) (Hei) No. 5-178986/1993),модифицированные сахаридом производные 3 полилизина (не прошедшая экспертизу заявка на патент Японии (KOKAI) (Hei) No. 5222187/1993), производные полизамещенногоL-лизина, модифицированного D-галактопиранозилглюконовой кислотой (не прошедшая экспертизу заявка на патент Японии (KOKAI) (Hei)No. 7-70311/1995), модифицированные сахаридом производные полизамещенной Lглютаминовой кислоты (не прошедшая экспертизу заявка на патент Японии (KOKAI) (Hei)No. 7-228688/1995), полисахаридные соединения, связанные с сахаридным соединением посредством линкера (не прошедшая экспертизу заявка на патент Японии (KOKAI) (Hei) No. 885703/1996), производные глюкозил-белка (не прошедшая экспертизу заявка на патент Японии(KOKAI) (Hei) No. 9-118699/1997) и им подобные. Однако до настоящего времени не сообщалось ни одного способа усиления органной избирательности соединений СДЛС, в которых в качестве полимерного носителя используется полиспирт на основе карбокси (C1-4) алкилдекстрана. В том случае, когда для клинических целей используется соединение СДЛС, в котором полимерный носитель и остаток лекарственного соединения связаны друг с другом посредством спейсера, содержащего олигопептид, необходимо точно измерить концентрацию самого соединения СДЛС в крови, а также точно измерить содержание остатка лекарственного соединения, такого как противоопухолевые средства,введенного в соединение СДЛС, чтобы определить соответствующую дозу или контролировать различия партий продуктов. Измерения концентраций соединения СДЛС в крови и содержания остатка лекарственного соединения в соединении СДЛС обычно выполняли, непосредственно измеряя само соединение СДЛС на основании флюоресценции лекарственного соединения или поглощения им УФ без отщепления лекарственного соединения или лекарственного соединения, связанного с частью спейсера, от соединения СДЛС. Кроме того, также был предложен способ, основанный на анализе ЯМР соединения СДЛС, как такового, и способ измерения расщепленного продукта, полученного при обработке соединения СДЛС кислотой. Однако данные способы имеют проблемы,так как количественное измерение продукта,расщепленного посредством обработки кислотой, не может быть выполнено в том случае,когда лекарственное соединение чувствительно к кислоте, и точность анализа ЯМР не достаточна. Кроме того, поглощение УФ остатком лекарственного соединения, присутствующего в соединении СДЛС, может вызывать сдвиг длины волны максимального поглощения или изменение коэффициента молярной экстинкции относительно самого лекарственного соедине 003790 4 ния из-за воздействий полимерного носителя или пептидного спейсера, и, поэтому, в большинстве случаев трудно точно измерить содержание остатка лекарственного соединения, введенного в соединение СДЛС. Чрезвычайно трудно количественно измерить соединение СДЛС в тканях после введения в живые организмы способами, основанными на анализе ЯМР или поглощении УФ. Описание изобретения Целью данного изобретения является предоставление способов усиления органной избирательности (например, избирательности по отношению к печени, или подобным органам) соединений СДЛС, содержащих в качестве полимерного носителя полиспирт на основе карбокси(С 1-4)алкилдекстрана, и предоставление соединения СДЛС, обладающего вышеуказанными свойствами. Другой целью данного изобретения является предоставление полисахаридного соединения, пригодного в качестве сырья для производства соединений СДЛС, обладающих вышеуказанными свойствами. Еще одной целью данного изобретения является предоставление способа измерения соединения СДЛС, в котором полимерный носитель и остаток лекарственного соединения связаны друг с другом посредством спейсера, который содержит олигопептид. Более конкретно,целью данного изобретения является предоставление способа точного измерения соединения СДЛС, как такового, или содержания остатка лекарственного соединения, такого как противоопухолевые средства, введенного в соединение СДЛС. Еще более конкретно, целью данного изобретения является предоставление способа определения точной концентрации соединения СДЛС в крови или ткани после введения,или способа точного определения содержания остатка лекарственного соединения, введенного в соединение СДЛС. Авторы данного изобретения провели убедительные интенсивные исследования, чтобы достичь упомянутых выше целей, и в результате обнаружили, что соединение СДЛС с экстремально высокой избирательностью можно было получить с использованием в качестве полимерного носителя полиспирта на основе карбокси(C1-4)алкилдекстрана,модифицированного сахаридным соединением, и такое соединение СДЛС, содержащее полиспирт на основе карбокси(C1-4)алкилдекстрана, связанный с галактозой, в частности, обладало прекрасной избирательностью по отношению к печени. Кроме того, авторы данного изобретения также обнаружили, что концентрацию соединения СДЛС в крови, или содержание остатков лекарственного соединения, введенного в соединение СДЛС, можно точно и легко определить, обрабатывая пептидазой соединение СДЛС, в котором полимерный носитель и оста 5 ток лекарственного соединения связаны друг с другом посредством спейсера, содержащего олигопептид, и измеряя полученный в результате гидролизат. Данное изобретение было выполнено на основе этих полученных данных. Таким образом, данное изобретение предоставляет соединение СДЛС, содержащее полиспирт на основе карбокси (С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного средства,связанный с полиспиртом на основе карбокси(C1-4)алкилдекстрана. Согласно предпочтительным вариантам соединения СДЛС данное изобретение предоставляет указанное выше соединение СДЛС, в котором полиспирт на основе карбокси (C1-4) алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера; указанное выше соединение СДЛС, в котором спейсер содержит одну аминокислоту или от 2 до 8 аминокислот, связанных пептидной связью(ями); указанное выше соединение СДЛС, в котором полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, образован посредством связывания сахаридного соединения и полиспирта на основе карбокси (C1-4)алкилдекстрана с помощью линкера; и указанное выше соединение СДЛС, в котором полиспирт на основе карбокси (C1-4)алкилдекстрана, модифицированный сахаридным соединением представляет собой соединение с кластерной модификацией сахаридным соединением, связанным с помощью линкера. Данное изобретение также предоставляет соединение СДЛС, которое можно получить связыванием остатка лекарственного соединения с полиспиртом на основе карбокси(С 1-4) алкилдекстрана, в котором часть карбоксильных групп карбокси(С 1-4)алкильного фрагмента модифицирована сахаридным соединением. Согласно предпочтительным вариантам соединения СДЛС данное изобретение предоставляет указанное выше соединение СДЛС, которое получается при связывании полиспирта на основе карбокси(C1-4)алкилдекстрана и остатка лекарственного соединения посредством спейсера; и указанное выше соединение СДЛС, которое получается при связывании остатка лекарственного средства с полиспиртом на основе карбокси(С 1-4)алкилдекстрана, который получен связыванием сахаридного соединения или линкера, связанного с сахаридным соединением, с частью карбоксильных групп карбокси(С 1-4) алкильного фрагмента полиспирта на основе карбокси (C1-4)алкилдекстрана. Более того данное изобретение предоставляет соединение СДЛС, которое получается при модифицировании сахаридным соединением полиспирта на основе карбокси(C1-4)алкилдекстрана, в котором остаток лекарственного 6 соединения связан с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента посредством спейсера. Согласно предпочтительным вариантам вышеупомянутого соединения СДЛС данное изобретение предоставляет указанное выше соединение СДЛС, которое получается при связывании полиспирта на основе карбокси(C1-4)алкилдекстрана и сахаридного соединения посредством линкера; и указанное выше соединение СДЛС, которое получается при модифицировании сахаридным соединением полиспирта на основе карбокси(С 1-4)алкилдекстрана, получаемого связыванием остатка лекарственного соединения с частью карбоксильных групп карбокси(С 1-4)алкильного фрагмента с помощью спейсера, состоящего из одной аминокислоты,или спейсера, включающего в себя от 2 до 8 аминокислот, связанных пептидной связью(ями). Согласно следующему предпочтительному варианту данного изобретения, представлены указанные выше соединения СДЛС, в которых сахаридным соединением является галактоза,галактозамин или их производные; указанные выше соединения СДЛС, в которых полиспирт на основе декстрана, который образует полиспирт карбокси (C1-4)алкилдекстрана, представляет собой полиспирт на основе декстрана, который получают при обработке декстрана в условиях, которые обеспечивают по существу полную полиалкоголизацию (введение множества спиртовых групп); указанные выше соединения СДЛС, в которых полиспирт на основе карбокси (C1-4)алкилдекстрана представляет собой карбоксиметилдекстрановый полиспирт; указанные выше соединения СДЛС, в которых степень замещения галактозы или галактозамина, или их производных, или степень замещения кластеров галактозы или галактозамина, или их производных составляет от 0,01 до 1,0 на остаток сахарида полиспирта на основе карбокси(C1-4)алкилдекстрана; указанные выше соединения СДЛС, в которых лекарственным соединением является противоопухолевое средство или противовоспалительное средство; указанные выше соединения СДЛС, в которых лекарственным соединением является (1S,9S)-1-амино-9 этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил 1 Н,12 Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-10,13(9 Н,15 Н)-дион; и указанные выше соединения СДЛС, которые являются лекарственным средством для лечения рака печени. Согласно другим аспектам данного изобретения предоставлены полиспирт на основе карбокси (C1-4)алкилдекстрана, модифицированный сахаридным соединением; полимерный носитель, содержащий полиспирт на основе карбокси (C1-4)алкилдекстрана, модифицированный сахаридным соединением; и полиспирт на основе карбокси (C1-4)алкилдекстрана, моди 7 фицированный сахаридным соединением, для применения в производстве указанных выше соединений СДЛС. Согласно следующему аспекту данного изобретения предоставлено применение полиспирта на основе карбокси (C1-4) алкилдекстрана, модифицированного сахаридным соединением для производства указанных выше соединений СДЛС. Согласно еще одному аспекту данного изобретения предоставлен способ измерения соединения СДЛС, в котором полимерный носитель и остаток лекарственного соединения связаны друг с другом посредством спейсера,содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями), который включает в себя этапы обработки соединения СДЛС пептидазой, и измерения полученного в результате гидролизата. Согласно предпочтительным вариантам вышеупомянутого способа предоставлены указанный выше способ, который используют для измерения соединения СДЛС, содержащегося в образце из живого организма; указанный выше способ, который используют для измерения содержания остатка лекарственных соединений,введенных в соединение СДЛС; указанный выше способ, в котором гидролизат представляет собой лекарственное соединение; указанный выше способ, в котором гидролизат представляет собой соединение, состоящее из остатка лекарственного соединения, связанного с частью спейсера; и указанный выше способ, в котором часть спейсера представляет собой одну аминокислоту, полученную из спейсера. Согласно следующим предпочтительным вариантам вышеупомянутого способа данного изобретения предоставлены указанный выше способ, в котором полимерным носителем является носитель, имеющий карбоксильные группы, предпочтительно полисахаридное производное, имеющее карбоксильные группы; указанный выше способ, в котором полимерным носителем является полиспирт на основе карбокси (C1-4)алкилдекстрана, предпочтительно полиспирт на основе карбоксиметилдекстрана; указанный выше способ, в котором полиспирт на основе декстрана, который образует карбокси(C1-4)алкилдекстрановый полиспирт, является полиспиртом на основе декстрана, который получают обработкой декстрана в условиях, которые обеспечивают по существу полную полиалкоголизацию; указанный выше способ, в котором полимерный носитель модифицирован сахаридным соединением; указанный выше способ, в котором лекарственным соединением,введенным в соединение СДЛС, является противоопухолевое средство или противовоспалительное средство; указанный выше способ, в котором спейсер является тетрапептидом, представленным, начиная с N-конца, -Gly-Gly-PheGly- или тетрапептидом, представленным, начиная с N-конца, -Gly-Gly-Gly-Phe-; указанный 8 выше способ, в котором спейсер является группой, представленной, начиная с N-конца, -GlyGly-Phe-Gly-NH-Y'-CH2-О-CO- или -Gly-GlyGly-Phe-NH-Y'-СН 2-O-СО-, где Y представляет собой группу пара-фенилена; указанный выше способ, в котором пептидазой является химотрипсин или папаин; и указанный выше способ, в котором лекарственным соединением является (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1 Н,12 Н-бензо[dе] пирано[3',4':6,7]индолизино[1,2-b]-хинолин-10,13(9 Н,15 Н)дион. Согласно особенно предпочтительному варианту указанного выше способа данного изобретения указанный выше способ может быть использован для измерения соединения СДЛС, в котором полиспирт на основе карбокси(С 1-4)алкилдекстрана и (1S, 9S)-1-амино-9-этил 5-фтор-2,3-дигидро-9-гидрокси-4-метил-1 Н,12 Н-бензо[de]пирано[3',4':6,7]индолизино [1,2b]-хинолин-10,13(9 Н,15 Н)дион связаны друг с другом посредством спейсера, содержащего тетра-пептид, представленный, начиная с Nконца, -Gly-Gly-Phe-Gly- или тетрапептид,представленный, начиная с N-конца, -Gly-GlyGly-Phe-, и соединение СДЛС или содержание противоопухолевого средства, введенного в соединение СДЛС, можно измерить, используя в качестве пептидазы -хемотрипсин, и измеряя в качестве гидролизата (1S,9S)-9-этил-5-фтор-1 глициламино-2,3-дигидро-9-гидрокси-4-метил 1 Н,12 Н-бензо[dе]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-10,13(9 Н,15 Н)дион. Краткое пояснение к рисункам На фиг. 1 показаны концентрации соединения СДЛС в крови и асците, измеренные способом согласно данному изобретению (пример 4). На фиг. 2 показаны концентрации соединения СДЛС в крови и асците, измеренные способом согласно данному изобретению (пример 5). На фиг. 3 показан спектр поглощения ультрафиолета соединением СДЛС, содержащим полимерный носитель, модифицированный сахаридным соединением (пример 6). На фиг. 4 показан график ГПХ соединения СДЛС, содержащего полимерный носитель, модифицированный сахаридным соединением(пример 6). На фиг. 5 показаны свойства соединений СДЛС, полученных в примере 6 С) и (D, которые накапливаются в печени. На фиг. 6 показан спектр поглощения ультрафиолета соединением СДЛС данного изобретения (пример 6, (D. На фиг. 7 показан спектр поглощения ультрафиолета соединением СДЛС данного изобретения (пример 7). 9 На фиг. 8 показан спектр поглощения ультрафиолета соединением СДЛС данного изобретения (пример 9). На фиг. 9 показан график ГПХ соединения СДЛС данного изобретения (пример 6, (D. На фиг. 10 показан график ГПХ соединения СДЛС данного изобретения (пример 7). На фиг. 11 показан график ГПХ соединения СДЛС данного изобретения (пример 9). Наилучший способ выполнения изобретения Соединение СДЛС данного изобретения отличается тем, что оно содержит полиспирт на основе карбокси (С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения, связанного с полиспиртом на основе карбокси (С 1-4)алкилдекстрана. Более конкретно соединение СДЛС данного изобретения включает в себя соединение, (1) в котором полиспирт на основе карбокси (C1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом без спейсера, и (2) в котором полиспирт на основе карбокси (С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера. Примеры таких соединений, в которых полиспирт на основе карбокси (С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера,включают, например, соединения, в которых полиспирт на основе карбокси(С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера, который содержит одну аминокислоту; соединения,в которых полиспирт на основе карбокси(С 1-4) алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера, который содержит от 2 до 8 аминокислот, связанных пептидной связью(ями), или спейсера, содержащего олигопептид, который содержит от 2 до 8 аминокислот, связанных пептидной связью(ями), и связан с линкерной группой, представленной -NH-Y-CO-, где Y означает группу алкилена, имеющую от 1 до 8 атомов углерода, или -С 6 Н 4-СН 2-O-, где -С 6 Н 4 означает группу фенилена, которая может иметь один или большее количество заместителей,предпочтительно означает группу парафенилена. Используемый здесь термин "модифицированный" следует толковать в его широком смысле, который включает в себя модификации с ковалентной связью посредством прямого связывания, или непрямого связывания посредством линкера сахаридного соединения и полиспирта на основе карбокси(С 1-4) алкилдекстрана, и термин не следует толковать в каком либо ограниченном смысле. 10 Остаток лекарственного соединения, содержащегося в указанном выше соединении СДЛС, представляет собой основную неполную структуру, полученную из лекарственного соединения, используемого для терапевтического и/или профилактического лечения болезней млекопитающих, включая людей, в качестве лекарственного средства, например противоопухолевого средства, противовоспалительного средства, антибактериального агента или подобных средств. Однако применение лекарственного соединения, из которого получают остаток, не ограничено указанным выше применением. В качестве лекарственного соединения могут быть использованы любые соединения,при условии, что они имеют одну или большее количество химически активных функциональных групп, способных принимать участие в образовании связи с полиспиртом на основе карбокси(С 1-4)алкилдекстрана или спейсером (например, аминогруппу, карбоксильную группу,гидроксильную группу, тиольную группу,сложноэфирную группу или подобную группу). Остаток лекарственного соединения может быть связан либо с карбоксильной группой полиспирта на основе карбокси (С 1-4)алкилдекстрана,либо с реакционноспособной функциональной группой, присутствующей в спейсере (например, в случае использования пептидного спейсера, N-концевая аминогруппа, С-концевая карбоксильная группа, реакционноспособная функциональная группа, присутствующая в аминокислоте, образующей спейсер, и им подобные). Используемый в данном описании термин "лекарственное соединение" также включает в себя соединение пролекарства, которое содержит в виде своей части основную структуру лекарственного соединения, которая сама по себе обладает фармакологической активностью, и может воспроизвести соединение in vivo. Более конкретно используемый в данном описании термин "остаток лекарственного соединения" означает неполную структуру, полученную из лекарственного соединения, имеющуюся в соединении после образования связи,при этом предполагается, что связь между полиспиртом на основе карбокси(С 1-4)алкилдекстрана или спейсером и остатком лекарственного соединения образована посредством реакции(например, конденсации с отщеплением воды и подобной реакции) реакционноспособной функциональной группы лекарственного соединения и реакционноспособной функциональной группы полиспирта на основе карбокси(С 1-4)алкилдекстрана или спейсера. Например, в случае, когда лекарственное соединение представлено D-NH2, D-COOH, D-COOR, D-OH, DSH, D-CONH2 или D-NH-COOR (R означает низшую алкильную группу или подобную группу), остаток лекарственного соединения представлен D-NH-(D-NH-CO-Q и т.д.), D-CO- (DCO-NH-Q, D-CO-O-Q, D-CO-S-Q и т.д.), D-CO 11(D-CO-NH-Q, D-CO-O-Q, D-CO-S-Q и т.д.), DO-(D-O-CO-Q, D-O-Q и т.д.), D-S- (D-S-CO-Q,D-S-Q и т.д.), D-CONH- (D-CO-NH-CO-Q и т.д.) и D-NH-CO- (D-NH-CO-O-Q, D-NH-CO-NH-Q и т.д.), соответственно (формулы, заключенные в скобки, представляют типы связывания между спейсером или полиспиртом на основе карбокси(С 1-4)алкилдекстрана и остатком лекарственного соединения, где Q означает неполную структуру спейсера и полиспирта на основе карбокси(С 1-4)алкилдекстрана, за исключением реакционноспособной функциональной группы и карбоксильной группы, соответственно). Однако тип связи между спейсером или полиспиртом на основе карбокси(С 1-4)алкилдекстрана и остатком лекарственного соединения не ограничен связями, указанными выше. В качестве остатка лекарственного соединения предпочтительно, например, могут быть использованы остатки противоопухолевых средств, таких как доксорубицин, даунорубицин, митомицин С, блеомицин, циклоцитидин,винкристин, винбластин, метотрексат, платиновые противоопухолевые средства (цисплатин или его производные), таксол или его производные, камптотецин или его производные (противоопухолевые средства, описанные в не прошедшей экспертизу заявке на патент Японии(1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1 Н,12 Н-бензо[dе] пирано[3',4':6,7]индолизино[1,2-b]-хинолин 10,13-(9 Н,15 Н)дион, заявленный в п.2 или ему подобные). Кроме того, также предпочтительны остатки стероидных противовоспалительных средств, таких как сукцинат гидрокортизона и сукцинат преднизолона, и нестероидных противовоспалительных средств, таких как мефенаминовая кислота, флуфенаминовая кислота,диклофенак, ибупрофен и тиноридин. Там, где используется спейсер, содержащий одну аминокислоту, или спейсер, содержащий от 2 до 8 аминокислот, связанных пептидной связью(ями), в качестве спейсера, который связывает лекарственное соединение с полиспиртом на основе карбокси(С 1-4)алкилдекстрана, спейсер имеет форму остатка одной аминокислоты, что означает остаток, полученный при удалении одного атома водорода и одной гидроксильной группы от аминогруппы и карбоксильной группы аминокислоты, соответственно, или остаток олигонуклеотида, содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями), что означает остаток, полученный при удалении одного атома водорода и одной гидроксильной группы от N-концевой аминогруппы и С-концевой карбоксильной группы олигопептида, соответственно. Предпочтительными спейсерами являются остатки олигопептидов, содержащих от 2 до 6 аминокислот. Виды аминокислот, составляющих спейсер, особым образом не ограничены, и 12 например, могут использоваться L- или D-аминокислоты, предпочтительно L-аминокислоты,и также как -аминокислоты, могут быть использованы -аланин, -аминокапроновая кислота, -аминомасляная кислота и им подобные. Эти другие аминокислоты, отличные от -аминокислот, предпочтительно локализованы в спейсере около полисахаридного соединения. Например, там, где используется олигопептидный спейсер, направление связывания особым образом не ограничено, и в большинстве случаев N-конец спейсера может быть связан с карбоксильной группой полиспирта на основе карбокси(С 1-4)алкилдекстрана посредством кислотно-амидной связи, и С-конец спейсера может быть связан с аминогруппой лекарственного соединения. В альтернативном случае, например, когда в качестве единицы пептидного спейсера включен остаток лизина, -аминогруппа и -аминогруппа остатка лизина позволяют образовать соответствующие кислотноамидные связи с карбоксильными группами других аминокислот так, чтобы сформироватьN-концы на обоих концах пептидного спейсера,и это позволяет образовать связи с карбоксильными группами лекарственных соединений. Кроме того, благодаря включению в спейсер в качестве единиц одного или большего количества остатков диаминовых соединений или соединений дикарбоновых кислот (остатки диаминовых соединений, таких как этилендиамин или соединений дикарбоновых кислот, таких как янтарная кислота), может быть использован спейсер, имеющий либо N-концы, либо С-концы на обоих концах. В тех случаях, где используется спейсер,содержащий олигопептид, его аминокислотная последовательность особым образом не ограничена. Предпочтительно используемые спейсеры включают, например, спейсер, являющийся остатком дипептида, представленного -X-Z-, где X означает остаток гидрофобной аминокислоты иZ означает остаток гидрофильной аминокислоты; и -X-Z- означает остаток, который состоит из дипептида, который образован пептидной связью между гидрофобной аминокислотой (X) и гидрофильной аминокислотой (Z) с Nконцевой стороны и С-концевой стороны, соответственно, и один атом водорода и одна гидроксильная группа которых удалены из аминогруппы на N-конце и из карбоксильной группы на С-конце, соответственно, и спейсер, содержащий остаток дипептида в качестве частичной последовательности пептида. В качестве гидрофобной аминокислоты может быть использован,например, фенилаланин, тирозин, лейцин или подобная аминокислота, и в качестве гидрофильной аминокислоты может быть использован, например, глицин, аланин, или подобная аминокислота. Спейсер может иметь повторяющуюся последовательность остатков дипеп 13 тида (например, -X-Z-X-Z-, -X-Z-X-Z-X-Z- и им подобные). При использовании спейсера, содержащего такую дипептидную структуру, спейсер может гидролизоваться в местах опухолей или местах воспаления, которые, как считают, богаты пептидазами, высвобождая лекарственное соединение в высокой концентрации непосредственно в этих местах. Таким образом, неполная структура, образованная связыванием друг с другом спейсера, содержащего указанный выше дипептид, и лекарственного соединения, является предпочтительной неполной структурой соединения СДЛС согласно данному изобретению. Там, где в качестве остатка лекарственного соединения используется остаток противоопухолевого средства, проявляющий противоопухолевую активность (например, доксорубицин) в зависимости от концентрации, предпочтительно может быть использован спейсер, состоящий из указанного выше остатка дипептида, представленного -X-Z-, или спейсера, содержащего указанный остаток дипептида в качестве частичной последовательности пептида. Кроме того, там, где в качестве остатка лекарственного соединения используется тип противоопухолевого средства, для которого характерна временная зависимость и который требует пролонгированного времени работы при определенной концентрации, повышенная противоопухолевая активность иногда может быть получена с использованием указанного выше спейсера. Примеры таких противоопухолевых средств включают в себя противоопухолевые средства, заявленные в не прошедшей экспертизу заявке на патент Японии (KOKAI) No. (Hei) 6-87746/1994, предпочтительно противоопухолевое средство, заявленное в п.2. Спейсеры не ограничены спейсерами, указанными выше, и как правило необходимо выбирать спейсер,подходящий с точки зрения способа действия противоопухолевого средства, фармакокинетических параметров или появления токсичности,способности высвобождения in vivo противоопухолевого средства и тому подобного. Для карцином, проявляющих быструю скорость пролиферации, в большинстве случаев предпочтительно выбирать указанный выше спейсер,способный высвобождать лекарственное средство при высоких концентрациях в короткий промежуток времени. Конкретными примерами олигопептидов,которые могут быть использованы в качестве спейсера, являются олигопептиды, показанные в следующей таблице; однако, спейсеры, используемые для соединений СДЛС данного изобретения не ограничены спейсерами, указанными ниже. Легко можно понять, что обычный специалист в данной области может соответствующим образом определить использовать ли, или не использовать спейсер, или выбрать тип спейсера в том случае, когда спейсер используется 14 так, чтобы достичь оптимальной скорости высвобождения лекарственного соединения. В таблице левые концы пептидных последовательностей являются N-концами, и остатки лекарственных соединений связаны с С-концами.D-Phe означает остаток D-фенилаланина, а другие аминокислоты представляют собой Lаминокислоты. Степени скорости высвобождения оцениваются на основании степени появления эффективности соединений СДЛС, несущих доксорубицин, в отношении крыс Walker 256,являющихся опухоленосителями, или на основании концентраций свободного доксорубицина в местах опухолей у крыс Walker 256, являющихся опухоленосителями. Для доксорубицина из перечисленных в списке спейсеров предпочтительно используется спейсер, который может сразу же высвобождать лекарственное соединение в высокой концентрации, например, -GlyGly-Phe-Gly-. Таблица 1(a) Спейсеры, обладающие высокой скоростью высвобождения,-Leu-Gly-Tyr-Gly-Phe-Gly-Gly-Phe-Gly-Gly-Gly-Phe-Gly-Gly-Phe-Gly-Gly-Phe-Gly-Gly-Gly-Phe-Phe-Gly-Gly-Gly-Gly-Gly-Phe-Gly(b) Спейсеры, обладающие сравнительно высокой скоростью высвобождения,-Gly-Gly-Phe-Phe-Gly-Gly-Gly-Gly-Gly-Gly(c) Спейсеры, обладающие сравнительно низкой скоростью высвобождения,-Phe-Pne-Ala-Gly-Pro-Gly-Gly-Gly-Gly-Phe(d) Спейсеры, обладающие низкой скоростью высвобождения,-Gly-D-Phe-Gly-Gly-Phe-Ser-Gly-Gly-Gly-Gly-Gly-Gly-Gly-Gly-Gly-GlyСоединение СДЛС данного изобретения отличается тем, что в качестве полимерного носителя имеет полиспирт на основе карбокси(С 1-4)алкилдекстрана, модифицированный сахаридным соединением. Степень полиалкоголизации полиспирта на основе карбокси (С 1-4)алкилдекстрана, входящего в состав соединения СДЛС особым образом не ограничена. Предпочтительно полиспиртами на основе декстрана,составляющими карбокси(С 1-4)алкилдекстрановый полиспирт, могут быть полиспирты, по 15 лученные обработкой декстрана в условиях,которые по существу обеспечивают полную полиалкоголизацию. Вид декстрана, используемого для приготовления полиспирта на основе карбокси(С 1-4) алкилдекстрана, особым образом не ограничен,и декстран может содержать -D-1,6-связи в любом процентном соотношении. Например,можно использовать декстран, содержащий D-1,6-связи на уровне 85% или больше, 90% или больше, или 95% или больше. Молекулярная масса декстрана особым образом не ограничена,и можно использовать декстран, имеющий, например, молекулярную массу примерно от 1000 до 2000000, предпочтительно примерно от 3000 до 800000. В качестве (С 1-4)алкильной группы,составляющей карбокси (С 1-4)алкильную группу полиспирта на основе карбокси(C1-4)алкилдекстрана, может быть использована линейная или разветвленная (С 1-4)алкильная группа, в частности, метильная группа, этильная группа, нпропильная группа, изопропильная группа, нбутильная группа, втор-бутильная группа или им подобные, и предпочтительно может быть использована метильная группа. В том случае, когда в качестве исходного материала используют декстран, декстран может быть последовательно обработан большим избыточным количеством периодата натрия и борогидрата натрия, чтобы получить полиспирт на основе декстрана, подвергнутый по существу полной полиалкоголизации. Однако способ полиалкоголизации декстрана не ограничен способом, указанным выше, и может быть использован любой способ, имеющийся в распоряжении специалистов в данной области. Карбокси(С 1-4)алкилирование может быть выполнено,например, путем осуществления реакции галогенированной (С 1-4)алкилкарбоновой кислоты,такой как хлоруксусная кислота, бромуксусная кислота, -хлорпропионовая кислота, -метил-хлорпропионовая кислота, -хлорпропионовая кислота, -метилхлорпропионовая кислота, -хлормасляная кислота, -хлормасляная кислота, или -хлормасляная кислота, предпочтительно хлоруксусная кислота, с гидроксильными группами полиспирта на основе декстрана, чтобы достичь частичного или полного каргидроксильных бокси(C1-4)алкилирования групп. Например, полиспирт на основе декстрана растворяют в инертном растворителе, который не участвует в реакциях (например, в воде, N,Nдиметилформамиде, или диметилсульфоксиде),и к полученному в результате раствору добавляют галогенированную (C1-4)алкилкарбоновую кислоту или ее соль в присутствии основания(например, гидроксида натрия или гидроксида калия), и затем смеси дают возможность реагировать в течение периода времени от нескольких минут до нескольких дней при температуре, 003790 16 от достигаемой при охлаждении льдом до примерно 100 С. Степень введения карбокси (C1-4) алкильной группы можно легко контролировать,например, выбором подходящей температуры реакции карбокси (C1-4)алкилирования или количества галогенированной (С 1-4)алкилкарбоновой кислоты, или оснований, используемых в качестве реагентов, и такие способы хорошо известны специалистам в данной области. Степень карбокси(C1-4)алкилирования, из расчета на один остаток сахара декстранового полиспирта особым образом не ограничена, и, например,степень может быть в пределах от 0,01 до 2,0,предпочтительно от 0,1 до 1,0. Виды сахаридного соединения, используемого для модификации полиспирта на основе карбокси (С 1-4)алкилдекстрана, особым образом не ограничены, и специалисты в данной области могут соответствующим образом выбрать сахаридное соединение в зависимости от типа органа, являющегося мишенью соединения СДЛС,фармакокинетики и тому подобного. В качестве сахаридного соединения может быть использован любой из моносахаридов, олигосахаридов и их производных. Кроме того, виды связи между сахаридным соединением и полиспиртом на основе карбокси(С 1-4)алкилдекстрана особым образом не ограничены. Сахаридное соединение и полиспирт на основе карбокси(С 1-4)алкилдекстрана могут быть, например, прямо связаны посредством Огликозидной связи или O-гликозидной связи, или они могут быть связаны друг с другом посредством подходящего линкера. Используемый здесь термин "линкер" необходимо понимать в его широком смысле так,чтобы он включал в себя любые линкеры, которые могут быть использованы для связывания остатка сахаридного соединения с полиспиртом на основе карбокси(С 1-4)алкилдекстрана. Количество сахаридного соединения, введенного в полиспирт на основе карбокси(С 1-4)алкилдекстрана, (степень замещения) особым образом не ограничено, и подходящее количество может быть выбрано в зависимости от различных условий, таких как вид сахаридного соединения,требуемая степень избирательности и вид лекарственного соединения. Количество, как правило, может быть примерно от 0,01 до 1,0 на остаток сахарида полиспирта на основе карбокси (C1-4)алкилдекстрана. В случае использования линкера виды линкера особым образом не ограничены. Предпочтительно использовать, например, линкер,представленный -О-(CH2)n-NH- (n означает целое число от 1 до 16) или - (O-CH2CH2)m-NH-(m означает целое число от 1 до 10). Полиспирт на основе карбокси(С 1-4)алкилдекстрана может быть модифицирован сахаридным соединением связыванием О-конца или N-конца, предпочтительно N-конца вышеупомянутого линкера с сахаридным соединением посредством О- 17 гликозидной связи или Огликозидной связи,и связыванием другого конца линкера с карбоксильной группой полиспирта на основе карбокси(С 1-4)алкилдекстрана посредством амидной связи или сложноэфирной связи. Также возможно получение кластерномодифицированного соединения с использованием линкера, подходящего для так называемой кластерной модификации. Кластерно-модифицированными соединениями являются соединения с кластером сахаридных соединений, присоединенных к карбоксильной группе полиспирта на основе карбокси(С 1-4)алкилдекстрана посредством линкера, подходящего для кластерной модификации, и конкретные способы их производства заявлены, например, в патентах Японии No. 2774417, 2774429, Biol. Pharm. Bull.,20, pp. 259-266, 1977 и т.д. В кластерномодифицированном соединении множество сахаридных соединений локализовано в определенном ограниченном пространстве, поэтому соединение обладает характерными свойствами повышенного сродства к рецептору и прекрасной органной избирательностью. Пример кластерной модификации соединения СДЛС данного изобретения показан ниже (в нижеследующей формуле показана неполная структура молекулы полиспирта на основе карбокси(С 1-4) алкилдекстрана, модифицированного кластером, а остаток лекарственного соединения не включен). Однако способ кластерной модификации,используемый для соединения СДЛС данного изобретения, не ограничен нижеследующим примером, и следует понимать, что специалистами в данной области могут быть выбраны любые подходящие способы. Примеры моносахаридов включают в себя,например, гексозы, такие как глюкоза, фруктоза,манноза, галактоза, фукоза, нейраминовая кислота и уроновая кислота; гексозамины, такие как галактозамин и глюкозамин; пентозы, такие как рибоза, дезоксирибоза, арабиноза и ксилоза,и им подобные. В качестве их производных могут быть использованы, например, их N- или Oацильные производные, O-алкильное производное, сложные эфиры серной кислоты, сложные эфиры фосфорной кислоты и им подобные. Более конкретные примеры производных моносахаридов включают в себя N-ацетилнейраминовую кислоту, N-ацетилгалактозамин, N-ацетилглюкозамин, манноза-6-фосфат, галактоза-3 фосфат, 6-O-бензоилглюкозу, 6-O-карбоксиме 003790 18 тил-N-ацетилглюкозамин, 2-N-бензилглюкозамин и им подобные. В качестве олигосахаридов могут быть, например, использованы линейные или разветвленные гетероолигосахариды или гомоолигосахариды, образованные вышеупомянутыми моносахаридами или их производными. Более конкретно могут быть использованы сахароза, сиалил-Льюис А, сиалил-Льюис X, лактоза, мальтоза, Льюис X, сульфатированный Льюис X и им подобные. Среди них в качестве сахаридного соединения, которое усиливает избирательность по отношению к печени, предпочтительны галактоза или галактозамин, или их производные, и олигосахариды, которые имеют галактозу или N-ацетилгалактозамин на не восстанавливающем конце (например, лактоза), и особенно предпочтительны галактоза и Nацетилгалактозамин. Способы получения соединения СДЛС данного изобретения особым образом не ограничены. Основные способы производства показаны ниже, и их конкретные примеры будут обсуждаться детально в примерах в описании. Специалисты в данной области могут легко получить соединение СДЛС, которое входит в рамки данного изобретения, обращаясь к общему объяснению, изложенному ниже, и способам получения, описанным в примерах, и путем выбора подходящих исходных материалов, реагентов, условий реакции и тому подобного, и при необходимости путем модифицирования и изменения способов. В общем, соединение СДЛС согласно данному изобретению, можно получить, модифицируя полиспирт на основе карбокси(С 1-4)алкилдекстрана сахаридным соединением в соответствии с подходящим способом,и давая возможность модифицированному соединению реагировать с остатком лекарственного соединения, или со спейсером, который связан с остатком лекарственного соединения. В большинстве случаев полиспирт на основе карбокси (С 1-4)алкилдекстрана может быть получен в форме водного раствора соли щелочного металла, такой как натриевая соль, или калиевая соль, и модификация сахаридным соединением и реакция с лекарственным соединением (или спейсером, связанным с лекарственным соединением) могут быть выполнены в воде, или органическом растворителе, содержащем воду. В альтернативном случае, полиспирт на основе карбокси (C1-4)алкилдекстрана или полиспирт на основе карбокси (C1-4)алкилдекстрана,модифицированный сахаридным соединением,может быть превращен в соль органического амина, и последующие реакции могут быть выполнены в органическом растворителе, который в значительной степени освобожден от воды. В качестве соли органического амина могут быть использованы, например, соли алифатических аминов, таких как триэтиламин, триметиламин или триэтаноламин; соли алициклических и ароматических аминов, таких как N-метилпир 19 ролидин, N-метилпиперидин, N-метилморфолин или диметиламинопиридин; или четвертичные соли аммония, такие как хлорид тетраметиламмония или хлорид тетраэтиламмония. Превращение натриевой соли полиспирта на основе карбокси (C1-4)алкилдекстрана или полиспирта на основе карбокси (C1-4)алкилдекстрана, модифицированного сахаридным соединением, в соответствующую соль органического амина может быть выполнено с использованием ионообменной смолы и тому подобного. Например,натриевая соль полиспирта на основе карбоксиметилдекстрана или этого соединения, модифицированного сахаридом, можно растворить в воде, нанести на колонку, загруженную смолойBio-Rad AG50W-X2 (200-400 меш, Н+ - типа) и элюировать водой, и затем к полученному в результате эффлюенту можно добавить органический амин, такой как триэтиламин и лиофильно высушить. В альтернативном случае также можно выполнить превращение в одну стадию,т.е. растворяя натриевую соль полиспирта на основе карбоксиметилдекстрана или этого соединения, модифицированного сахаридом, в воде, и затем пропуская раствор через смолу триэтиламмониевого типа. Связь между лекарственным соединением,как таковым, и карбоксильной группой полиспирта на основе карбокси(С 1-4)алкилдекстрана,или связь между спейсером, связанным с лекарственным соединением и карбоксильной группой полиспирта на основе карбокси(С 1-4)алкилдекстрана, в большинстве случаев может быть образована связыванием реакционноспособной аминогруппы самого лекарственного соединения или реакционноспособной аминогруппы спейсера (N-концевая аминогруппа или подобная в пептидном спейсере) с карбоксильной группой полиспирта на основе карбокси (С 1-4) алкилдекстрана посредством кислотно-амидной связи. Однако связь между лекарственным соединением или спейсером и карбоксильной группой полиспирта на основе карбокси(С 1-4) алкилдекстрана не ограничена описанной выше связью, и могут быть использованы другие химически связи и соединения с использованием одного или большего количества спейсеров. Например, может быть образован ангидрид карбоновой кислоты между С-концевой карбоксильной группой пептидного спейсера или карбоксильной группой лекарственного соединения и карбоксильной группой полиспирта на основе карбокси(С 1-4)алкилдекстрана, или с применением диаминового соединения, такого как этилендиамин, используемого в качестве спейсера,при этом каждая из карбоксильных групп может быть связана посредством кислотно-амидной связи с каждой из аминогрупп диаминового соединения. В том случае, когда реакционноспособную аминогруппу лекарственного соединения, самого по себе, или N-концевую аминогруппу спей 003790 20 сера связывают с карбоксильной группой полиспирта на основе карбоксиметилдекстрана посредством кислотно-амидной связи, могут быть использованы агенты конденсации, идущей с отщеплением воды, обычно используемые для синтеза пептидных цепей, например, N,N'-дициклоалкилкарбодиимиды, такие как N,N'-дициклогексилкарбодиимид (DCC), производные карбодиимида, такие как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDAPC), 1-этоксикарбонил-2-этокси-1,2-дигидроксихинолин(EEDQ) и им подобные. В этом случае при необходимости могут быть добавлены производные бензотриазола, такие как 1-гидроксибензотриазол (НОВТ). Кроме того, реакцию также можно выполнять методом активированных сложных эфиров или галогенангидридным методом. В том случае, когда реакцию проводят в неводной системе, могут быть использованы любые органические растворители, при условии, что из них в значительной степени удалена вода, и они могут растворять реагирующие вещества (соль органического амина и полиспирта на основе карбоксиметилдекстрана, модифицированного сахаридным соединением, и лекарственное соединение или спейсер, связанный с лекарственным соединением и тому подобное). Например, предпочтительно могут быть использованы N,N-диметилформамид, диметилсульфоксид, ацетамид, N-метилпирролидон, сульфолан и тому подобное. Хотя количество остатка лекарственного соединения, которое вводится в полиспирт на основе карбокси(С 1-4)алкилдекстрана, модифицированного сахаридным соединением, особым образом не ограничено,количество следует подходящим образом выбирать в зависимости от вида остатка лекарственного соединения, и с точки зрения фармакокинетики, эффективности и токсичности соединения СДЛС. Как правило, могут быть выбраны пределы примерно от 0,1 до 30 мас.%, предпочтительно примерно от 2 до 15 мас.%. В том случае, когда в качестве лекарственного соединения используется противоопухолевое средство,заявленное в пункте 2 не прошедшей экспертизу заявки на патент Японии (KOKAI) No. (Hei) 687746/1994, количество вводимого лекарственного соединения может быть, например, примерно от 1 до 15 мас.%, предпочтительно примерно от 4 до 8 мас.%. Долю остатков лекарственного соединения, введенных в полиспирт на основе карбокси (С 1-4)алкилдекстрана легко можно определить, например, абсорбционным спектрометрическим анализом. Например, в отношении использования в качестве лекарственного соединения противоопухолевого средства, заявленного в п.2 не прошедшей экспертизу заявки на патент Японии(KOKAI) No. (Hei) 6-87746/1994, известно, что равновесие сдвигается в сторону соединения,лактонное кольцо которого замкнуто (соедине 21 ние с замкнутым кольцом) в кислой водной среде (например, примерно при рН 3), тогда как в основной водной среде (например, примерно при рН 10) равновесие сдвигается в сторону соединения, лактонное кольцо которого раскрыто (соединение с открытым кольцом). Соединения СДЛС, в которые введен остаток, соответствующий каждому из соединений с замкнутым кольцом и открытым кольцом, обладают сходной противоопухолевой активностью. Однако в том случае, когда будет присутствовать реагирующее вещество в форме соединения с открытым кольцом и полиспирт на основе карбокси(С 1-4)алкилдекстрана, модифицированный сахаридным соединением, будет реагировать со спейсером, связанным с вышеупомянутым лекарственным соединением (например, олигопептидным спейсером), реакция конденсации будет происходить между карбоксильной группой лактонного кольца, и аминогруппой спейсера. Вследствие побочной реакции выход может быть существенно снижен, и более того, иногда требуемое соединение СДЛС не может быть получено унифицированным образом. Такая побочная реакция может быть устранена использованием соединения с замкнутым кольцом в качестве реагирующего вещества в неводной системе, которая не допускает установления равновесия. Соединение СДЛС согласно данному изобретению характеризуется тем, что оно может специфично проявлять желаемую фармакологическую активность в локальном месте, таком как места опухолей или места воспаления, в зависимости от вида остатка лекарственного соединения (например, остатков лекарственных соединений, таких как противоопухолевые средства или противовоспалительные средства),и может снижать токсичность, присущую лекарственному соединению, как таковому. Кроме того, соединение СДЛС согласно данному изобретению также обладает прекрасной проницаемостью через кровеносные сосуды. Поскольку протеаза (пептидаза) экспрессируется в местах опухолей или местах воспаления, соединение СДЛС, имеющее спейсер, содержащий олигопептид, легко гидролизуется в спейсерном фрагменте, давая возможность высвобождаемому лекарственному соединению включиться в клетки и проявить свою эффективность, или соединение СДЛС захватывается клетками с помощью рецептора, присутствующего в клетке-мишени, который узнает сахарид, и лекарственное соединение, высвобожденное под действием протеазы, проявляет свою эффективность. Полиспирт на основе карбокси(С 1-4)алкилдекстрана плохо распознается как экзогенная макромолекула в живых организмах, например, в печени, селезенке, костном мозге и им подобным, и по этой причине соединение распределяется в эти виды органов недостаточно. В то время как в зависимости от вида сахаридного 22 соединения соединение может быть в высокой концентрации распределено в органы, имеющие большое количество рецепторов сахаридов для сахаридного соединения. Например, соединение СДЛС согласно данному изобретению, которое содержит полиспирт на основе карбокси(С 1-4) алкилдекстрана, модифицированный галактозой, обладает прекрасной избирательностью по отношению к печени. Поэтому соединение СДЛС, которое связано с противоопухолевым средством, используемым в качестве лекарственного соединения, пригодно для лечения рака печени. Лекарственное средство, содержащее соединение СДЛС данного изобретения, в большинстве случаев может быть упаковано во флаконы или подобные емкости в форме лиофилизированного или другого продукта, и предоставлено для клинического применения в виде препаратов для парентерального введения, такого как инъекции или капельные вливания, которые растворяют при использовании. Однако форма фармацевтических препаратов лекарственного средства не ограничена вышеупомянутыми формами. Для производства вышеупомянутых фармацевтических препаратов могут быть использованы фармацевтические добавки,имеющиеся в данной области, например, солюбилизаторы, модификаторы рН, стабилизаторы и им подобные, и фармацевтический препарат может быть приготовлен в виде фармацевтической композиции. Хотя доза указанного выше лекарственного средства особым образом не ограничена, обычно следует принимать решение с точки зрения дозы лекарственного соединения, которое образует остаток лекарственного соединения, количества остатка лекарственного соединения, введенного в соединение СДЛС,состояния пациента, вида заболевания и тому подобного. Например, когда парентерально вводят соединение СДЛС, в которое введено примерно 6 мас.%, остатка противоопухолевого средства, указанного в п.2 не прошедшей экспертизу заявки на патент Японии (KOKAI) No.(Hei) 6-87746/1994, как правило, один раз в сутки может быть введено примерно от 0,1 до 100 мг, предпочтительно примерно от 1 до 30 мг на м 2 площади поверхности тела в сутки, и введение предпочтительно можно повторять каждые 3-4 недели. Согласно другому аспекту данного изобретения предоставляется способ измерения соединения СДЛС, в котором полимерный носитель и остаток лекарственного соединения связаны друг с другом посредством спейсера, содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями), который включает в себя этап обработки соединения СДЛС пептидазой и измерения полученного в результате гидролизата. Используемый здесь термин "измерение" следует толковать в его широком смысле, включая измерения, выполненные для количествен 23 ных и качественных определений. Предпочтительно термин означает количественное измерение. Соединениями СДЛС, измеряемыми способом измерения согласно данному изобретению, являются соединения, содержащие полимерный носитель и остаток лекарственного соединения, связанные друг с другом посредством спейсера, который содержит от 2 до 8 аминокислот, связанных пептидной связью(ями), и соединение не следует толковать каким-либо ограниченным образом. Примеры спейсера, содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями) включают в себя, например, спейсер, состоящий, главным образом,из аминокислот в количестве от 2 до 8, связанных пептидной связью(ями), а также спейсер,который содержит олигопептид, состоящий из от 2 до 8 аминокислот, связанных пептидной связью(ями), и при этом указанный олигопептид связан с мостиковой группой, представленной NH-Y-CO-, где Y означает мостиковую группу,такую как группа алкилена, имеющая от 1 до 8 атомов углерода, или -С 6 Н 4-СН 2-O-, где-С 6 Н 4 означает группу фенилена, которая может иметь один или большее количество заместителей, предпочтительно означает группу парафенилена. Способ измерения согласно данному изобретению может быть использован, например, для измерения концентрации соединения СДЛС, как такового, содержащегося в биологических образцах, таких как кровь или общая вода организма. Способ данного изобретения также может быть использован для измерения количества остатка лекарственных соединений,введенных в соединение СДЛС (например,мас.%, остатка лекарственных соединений относительно общей массы соединения СДЛС или тому подобное). Остаток лекарственного соединения, входящего в состав соединения СДЛС, измеряемого способом согласно данному изобретению, имеет то же значение, объяснению которому дано выше. Могут быть использованы любые лекарственные соединения, при условии, что они имеют одну или большее количество функциональных групп, способных связываться со спейсером (например, аминогруппа, карбоксильная группа, гидроксильная группа, тиольная группа,сложноэфирная группа и т.д.). Остаток лекарственного соединения может быть связан с Nконцевой аминокислотой или С-концевой карбоксильной группой спейсера, или реакционноспособной функциональной группой,присутствующей в аминокислоте, которая входит в состав спейсера. Конкретными примерами остатка лекарственного соединения являются такие остатки,объяснение которым дано для соединений СДЛС, содержащим полиспирт на основе карбокси(С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения, связанные друг с другом 24 посредством спейсера. Предпочтительными остатками лекарственных соединений также являются такие остатки, пояснение для которых приведено выше. Остаток лекарственного соединения, заключенный в соединении СДЛС, измеряемом способом данного изобретения, связывается с полимерным носителем посредством спейсера. Предпочтительный спейсер представляет собой остаток олигопептида, который состоит из от 2 до 8 аминокислот, связанных пептидной связью(ями), или спейсер, содержащий от 2 до 8 аминокислот, связанных пептидной связью(ями), который связан с мостиковой группой, представленной -NH-Y'-CH2-O-CO-, где Y' означает группу парафенилена. Вид аминокислот, составляющих спейсер, направление связывания спейсера, аминокислотные последовательности, его конкретные примеры и тому подобное, точно такие же, как приведено в объяснении для соединений СДЛС, содержащих полиспирт на основе карбокси (С 1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения,связанные друг с другом посредством спейсера. В качестве полимерного носителя, который образует соединение СДЛС, измеряемое способом согласно данному изобретению, могут быть использованы, например, синтетические полимеры и им подобные, а также полисахаридные производные. Могут быть использованы любые полисахаридные производные и синтетические полимеры, при условии, что они не проявляют существенной токсичности по отношению к живым организмам, и они могут функционировать в качестве носителя лекарственного средства. Например, в качестве полимерного носителя могут быть использованы любые полисахаридные производные и синтетические полимеры, которые традиционно использовались для получения соединений СДЛС. Например, предпочтительно могут быть использованы полисахаридные производные, имеющие карбоксильные группы, и наиболее предпочтительно могут быть использованы полиалкоголизированные полисахаридные производные. Примеры синтетического полимера включают в себя, например, полиэтиленгликоли; полиаминокислоты, такие как полиглютаминовые кислоты,полиаспарагиновые кислоты и полилизины; производные поливиниловых соединений, таких как производные N-(2-гидроксипропил)метакриламида. Более конкретно в качестве полисахаридных производных, имеющих карбоксильные группы, могут быть использованы, например,полисахариды и их производные, которые химически или биологически модифицированы, и предпочтительно могут быть использованы производные, имеющие в своих молекулах карбоксильные группы. В качестве примеров полимерных носителей, имеющих карбоксильные 25 группы в молекуле, могут быть использованы полисахариды, такие как гиалуроновая кислота,пектиновая кислота, альгиновая кислота, хондроитин и гепарин; и полисахариды, такие как пуллулан, декстран, маннан, хитин, инулин,леван, ксилан, арабан, манноглюкан и хитозан,во все, или в часть гидроксильных групп которых введены функциональные группы, имеющие карбоксильную группу. Например, предпочтительно могут быть использованы соединения, имеющие карбокси (С 1-4)алкилированные гидроксильные группы или соединения, имеющие гидроксильные группы этерифицированные одной из карбоксильных групп многоосновной кислоты. Кроме того, также могут быть использованы соединения, полученные полиалкоголизацией указанных выше полисахаридов и затем введением функциональных групп, имеющих карбоксильную группу. Соединение СДЛС с использованием в качестве полимерного носителя полиспирта на основе карбокси (С 1-4)алкилдекстрана является особенно предпочтительным объектом измерения согласно способу данного изобретения. Степень полиалкоголизации полиспирта на основе карбокси (C1-4) алкилдекстрана, виды декстрана, используемые для его производства,способ производства и тому подобное являются точно такими же, как дано в объяснении для соединения СДЛС, содержащего полиспирт на основе карбокси (C1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения, связанные друг с другом посредством спейсера. Кроме того, соединение СДЛС, использующее в качестве полимерного носителя полимерный носитель, модифицированный сахаридным соединением, также является предпочтительным объектом для способа измерения согласно данному изобретению. Например, в качестве полимерного носителя подходящим для использования может быть полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением. Способ модифицирования полимерного носителя сахаридным соединением, вид сахаридного соединения и тому подобное являются точно такими же, как дано в объяснении для полиспирта на основе карбокси(C1-4)алкилдекстрана, модифицированного сахаридным соединением. Объектом способа измерения согласно данному изобретению может быть соединение СДЛС, полученное с использованием линкера,подходящего для так называемой кластерной модификации (так называемое соединение с кластерной модификацией). Понятие кластерной модификации является таким же, как дано в объяснении для полиспирта на основе карбокси(С 1-4)алкилдекстрана, модифицированного сахаридным соединением. Способ согласно данному изобретению отличается тем, что измеряют гидролизат, кото 003790 26 рый получают, подвергая соединение СДЛС обработке пептидазой для измерения соединения СДЛС. Виды пептидазы особым образом не ограничены, при условии, что они могут гидролизовать олигопептидный фрагмент (олигопептидный фрагмент, содержащий от 2 до 8 аминокислот, связанных пептидной связью(ями, содержащийся в спейсере соединения СДЛС. Например, могут быть использованы субтилизин,-химотрипсин, коллагеназа типа IV, пепсин,термолизин, папаин, эластаза и тому подобное. Среди них предпочтительными являются химотрипсин и папаин. Хотя типы гидролизата особым образом не ограничены, предпочтительными являются такие, которые регистрируются традиционными спектрометрическими методами, такими как методы, использующие спектр поглощения ультрафиолета и спектр флюоресценции. Как правило, может быть обнаружено лекарственное соединение, само по себе, а также соединение,содержащее часть спейсера, который остается и связывается с остатком лекарственного соединения, например, лекарственное соединение, с которым связана одна аминокислота, полученная из спейсера, лекарственное соединение, с которым связан олигопептид, состоящий из от 2 до 8 аминокислот, полученных из спейсера, лекарственное соединение, с которым связана одна аминокислота или вышеупомянутый олигопептид, полученные из спейсера, посредством мостиковой группы, представленной -NH-YCO-, где Y означает группу алкилена, имеющую от 1 до 8 атомов углерода, или группу, представленную -С 6H4-СН 2-О-, где -С 6 Н 4- означает группу фенилена, которая может иметь один или большее количество заместителей, предпочтительно означает группу парафенилена. Что касается вышеупомянутого гидролизата,может быть гидролизована часть или все реакционноспособные функциональные группы лекарственного соединения. Требуемый гидролизат может быть измерен посредством выбора подходящей пептидазы в зависимости от вида соединения СДЛС. В качестве образца для измерения могут быть использованы образцы из живых организмов, которые собраны от животных, включая людей, которым ввели соединение СДЛС, такие как кровь, лимфа, слюна, моча, кал и извлеченные ткани, а также водный раствор соединения СДЛС или раствор соединения СДЛС в водном органическом растворителе, который существенно не ингибирует ферментативную реакцию. Условия, подходящие для различных пептидаз,известны в данной области, и специалисты в данной области легко могут выбрать подходящие условия реакции, такие как концентрация субстрата, рН, буферное средство, температура реакции и время реакции, в зависимости от вида пептидазы. Обычно образец подвергают пред 27 варительной обработке, такой как гомогенизация и депротеинизация, затем добавляют пептидазу к реакционной смеси после такого разведения, чтобы в качестве субстрата иметь требуемую концентрацию соединения СДЛС, и реакция может продолжаться вплоть до полного гидролиза соединения СДЛС. Способ измерения гидролизата особым образом не ограничен. В том случае, когда количественно измеряют соединение СДЛС или количество введенного лекарственного соединения, желательно использовать обычные спектрофотометрические способы, такие как способы, основанные на измерении спектра поглощения ультрафиолета и измерении спектра флюоресценции, которые используются отдельно,или в комбинации. Измерение может быть необязательно выполнено с применением разделения, такого как с использованием высокоэффективной жидкостной хроматографии. Точное количественное измерение может быть выполнено с предварительным получением калибровочной кривой в системе измерения. Типичными примерами способа согласно данному изобретению являются способы, конкретно детально описанные в примерах спецификации, и таким образом, специалисты в данной области могут легко выполнить способ данного изобретения, обращаясь к приведенному выше общему объяснению и конкретному объяснению в примерах, и при необходимости, добавляя модификации или изменения заявленных способов. Примеры Данное изобретение более конкретно будет объяснено на примерах; однако, рамки данного изобретения нижеследующими примерами не ограничены. Пример 1. Соединение СДЛС (соединение 1), в котором полиспирт на основе карбоксиметилдекстрана (иногда в дальнейшем в примерах сокращенно называемый "КМ-декс-ПС" или"КМ-декстановый полиспирт") в качестве полимерного носителя и противоопухолевое средство(9 Н,15 Н)дион, заявленный в п.2 не прошедшей экспертизу заявки на патент Японии (KOKAI)(Hei) No. 6-87746/1994 (в дальнейшем в примерах сокращенно называемое "DX-8951") были связаны посредством тетрапептидного спейсера,представленного в виде -Gly-Gly-Phe-Gly- (олигопептид показан в виде последовательности,начиная с ее N-конца, и другие олигопептиды в дальнейшем в примерах показаны таким же образом), было получено согласно способу, описанному в примере 15 международной заявкиWО 97/46260. В качестве КМ-декс-ПС использовали КМ-декс-ПС, имеющий среднюю молекулярную массу 228 кД и степень карбоксиметилирования (степень замещения карбоксиме 003790 28 тильными группами на остаток сахарила в структуре), равную 0,4. 10 мкл раствора указанного выше соединения СДЛС, приготовленного в концентрации 400 мкг/мл в дистиллированной воде, добавляли к 180 мкл в буфере Бриттона-Робинсона (рН 6,0), и затем к смеси добавляли 10 мкл раствора-химотрипсина, приготовленного в концентрации 10 мг/мл в дистиллированной воде. Реакционную смесь инкубировали при 40 С в течение 2 ч, и добавляли 200 мкл 0,5 н. раствора HCl,содержащего 50% ацетонитрила, и освобожденный гидролизат (соединение, в котором глицин,полученный из спейсера, был связан пептидной связью с аминогруппой DX-8951, который представляет собой соединение, указанное в примере 50 международной заявки WO 97/46260, в дальнейшем в примерах сокращенно называемое "G-DX-8951") количественно измеряли ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 x 100 мм; 3,5 мкм, Watars Co.), и элюирование выполняли 0,1 М ацетатом натрия (рН 5,5), содержащим 36,5% органического растворителя (метанол : ацетонитрил = 1:2), и гидролизат регистрировали флуоресцентной спектроскопией (экстинкция 375 нм и эмиссия 445 нм). В результате было найдено содержание DX-8951 вышеуказанного соединения СДЛС, составляющее 5,7%. С другой стороны, содержание DX-8951 вышеуказанного соединения СДЛС, равное 4,9%, было рассчитано на основании поглощения УФ (366 нм) Соединение СДЛС (соединение 2), в котором КМ-декс-ПС и DX-8951 были связаны посредством спейсера, представленного -Gly-GlyGly-Phe-NH-(СН 2)4-СО-, было получено следующим образом. 5-Аминопентановой кислоте(1,0 г), паратолуолсульфокислоте (1,95 г) и бензиловому спирту (5 мл) давали возможность реагировать в толуоле (50 мл) при 140 С в течение 5 ч, удаляя получаемую воду с помощью аппарата Дина-Старка. Реакционную смесь концентрировали, и полученный в результате осадок переводили в твердое состояние, добавляя эфир. Полученное твердое вещество отфильтровывали, промывали эфиром и сушили, получая 2,9 г соли тозиловой кислоты и сложного бензилового эфира 5-аминопентановой кислоты.(DMF) (20 мл), и смесь перемешивали в течение 30 мин. К раствору добавляли раствор соли паратолуолсульфокислоты и сложного бензилового эфира 5-аминопентановой кислоты (500 мг) и триэтиламина (0,184 мл), растворенных в ДМФА (10 мл), и смесь перемешивали в течение 3 дней при комнатной температуре. Реакционную смесь концентрировали, и остаток очищали колоночной хроматографией (СН 2 Сl2: МеОН = 20:1), получая 380 мг Boc-Gly-Gly-GlyPhe-NH-(CH2)4-COOBzl (Bzl означает бензильную группу). Boc-Gly-Gly-Gly-Phe-NH-(CH2)4COOBzl (380 мг) растворяли в метаноле, содержащем 50% воды (20 мл), и к раствору добавляли 5% Pd-C (содержание воды: 50%, 300 мг) и перемешивали в течение ночи в атмосфере водорода при обычном давлении. Катализатор из реакционной смеси извлекали фильтрованием, и фильтрат концентрировали досуха, получая(150 мг), DCC (70 мг) и HOSu (40 мг) растворяли в ДМФА, и раствор перемешивали в течение 30 мин. Раствор DX-8951 (160 мг) и триэтиламина (0,040 мл), растворенных в ДМФА, добавляли к указанному выше раствору, и затем смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали, и полученный в результате остаток очищали колоночной хроматографией(СН 2 Сl2: МеОН = 20:1), получая Boc-Gly-GlyGly-Phe-NH-(СН 2)4-CO-DX-8951 (110 мг). BocGly-Gly-Gly-Phe-NH-(CH2)4-CO-DX-8951 (110 мг) растворяли в ТФУ (TFA) (2 мл), и раствору давали возможность реагировать в течение 1 ч. Реакционную смесь концентрировали, и полученный в результате остаток переводили в твердое состояние, добавляя эфир. Надосадок удаляли, и твердое вещество сушили, получая 100 мг соли трифторуксусной кислоты и H-Gly-GlyGly-Phe-NH-(CH2)4-CO-DX-8951. 1 Н-ЯМР (DMSO-d6):8,45-8,55 (м, 2 Н),8,28-8,35 (м, 2 Н), 7,95-8,10 (уш, 2 Н), 7,79 (д, 1 Н,J=10,7 Гц), 7,70-7,75 (м, 1 Н), 7,32 (с, 1 Н), 7,207,30 (м, 5 Н), 7,15-7,25 (м, 4 Н), 6,50-6,60 (уш.,1 Н), 5,50-5,60 (м, 1 Н), 5,40-5,50 (м, 2 Н), 5,18 (с,2 Н), 4,50-4,60 (м, 1 Н), 3,55-3,95 (м, 7 Н), 3,003,25 (м, 5 Н), 2,75-2,85 (м, 1 Н), 2,50 (с, 3H), 2,152,25 (м, 4 Н), 1,86-2,00 (м, 2 Н), 1,55-1,65 (м, 2 Н),1,45-1,55 (м, 2 Н), 0,88 (т, 3H, J=7,35 Гц). КМ-декс-ПС (350 мг), полученный способом, описанным в примере 13 WO 97/46260,имеющий среднюю молекулярную массу 337 кД и степень карбоксиметилирования (степень замещения карбоксиметильными группами на остаток сахарида в структуре), равную 0,4, растворяли в воде (10 мл). К полученному раствору добавляли раствор соли трихлоруксусной кислоты и H-Gly-Gly-Gly-Phe-NH-(CH2)4-CO-DX8951 (50 мл), растворенной в метаноле (10 мл), и 30 затем к смеси добавляли раствор HOBt (7 мг),растворенного в метаноле (5 мл). рН реакционной смеси доводили до рН 7,0, добавляли водорастворимый карбодиимид (10 мг), и затем смесь перемешивали в течение 14 ч. К реакционной смеси добавляли дополнительно водорастворимый карбодиимид (10 мл), перемешивали в течение 2 ч, и затем добавляли водорастворимый карбодиимид (10 мг) и перемешивали в течение 2 ч. Реакционную смесь разбавляли водой высшей степени очистки, и вещества с низкой молекулярной массой извлекали, используя мембрану для ультрафильтрации (50 К). Фильтрат лиофильно сушили, и полученный в результате порошок растворяли в 3 М водном раствореNaCl, и раствор по каплям добавляли к этанолу. Осажденное твердое вещество отделяли центрифугированием. После удаления надосадка твердое вещество снова растворяли в воде. Вещества с низкой молекулярной массой извлекали с помощью мембраны для ультрафильтрации(50 К), и фильтрат пропускали через фильтр с размером пор 0,22 мкм, и лиофильно сушили,получая 280 мг целевого соединения. К раствору вышеупомянутого соединения СДЛС, приготовленного в концентрации 2,63 мг/мл в дистиллированной воде (10 мкл) добавляли 490 мкл раствора -химотрипсина, приготовленного в концентрации 2 мг/мл в буфере Бриттона-Робинсона (рН 6), или раствор субтилизина А, приготовленный в концентрации 2 мг/мл в трис-HCl (рН 9). Реакционную смесь инкубировали при 40 С в течение 2 ч, и добавляли 500 мкл 0,5 н. раствора HCl, содержащего 50% ацетонитрила. Высвобожденный гидролизат [NH2-(CH2)4-CO-DX-8951] количественно измеряли ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 x 100 мм; 3,5 мкм, Watars Co.) и элюирование выполняли 0,1% раствором трифторуксусной кислоты, содержащим 32% органического растворителя(метанол : ацетонитрил = 1:2), и гидролизат регистрировали флуоресцентной спектроскопией(экстинкция 375 нм и эмиссия 445 нм). В результате примерно на 4,8 мин был элюированNH2-(CH2)4-CO-DX-8951. В это время содержание DX-8951 в указанном выше соединении СДЛС было рассчитано с использованием калибровочной кривой, полученной с NH2-(CH2)4CO-DX-8951, и составляло 3,2%. С другой стороны, когда содержание DX-8951 было рассчитано на основании поглощения УФ вышеупомянутым соединением СДЛС с использованием калибровочной кривой, полученной с DX-8951,содержание было рассчитано равным 2,9%. Пример 3. Содержание DX-8951 в соединении СДЛС,полученном в примере 1 (соединение 1) было измерено с использованием (1) субтилизина А 31 М трис-НСl/1 мМ СаСl2, рН 9,0). 10 мкл раствора соединения 1, приготовленного в концентрации 400 мкг/мл, добавляли к 180 мкл буфера для каждого фермента (конечная концентрация: 20 мкг/мл). К полученной смеси добавляли 10 мкл каждого фермента, приготовленного в концентрации 100 мг/мл в каждом буфере (конечная концентрация: 5 мг/мл), и давали возможность смеси реагировать в течение 3 ч при 40 С. После окончания реакции к смеси добавляли 200 мкл 0,5 н. раствора HCl, содержащего 50% ацетонитрила, и 10 мкл смеси анализировали ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 x 250 мм), и элюирование выполняли 0,1 М AcONa буфером (рН 5,0), содержащим 31% органического растворителя (ацетонитрил : метанол = 2:1). Гидролизат измеряли флуоресцентной спектроскопией (экстинкция 375 нм и эмиссия 445 нм), и количественно определяли гидролизат в смеси для ферментативной реакции, используя калибровочные кривые, которые были получены с использованием растворов, содержащих 2 нмоль/мл каждого из соединений G-DX-8951, DX-8951 иDX-8951, связанного с фенилаланиномглицином, полученным из спейсера соединения 1 (FGDX-8951). В результате было обнаружено, что субтилизин А и -химотрипсин высвобождали 100% G-DX-8951 из соединения 1 при указанных выше условиях. Термолизин высвобождал 100% FG-DX-8951. Пример 4. Клетки Meth А, субкультивированные в брюшной полости, внутрибрюшинно трансплантировали мышам BALB/c(1 x 106 клеток/мышь). Через 5 дней мышам внутрибрюшинно вводили соединение 1 (содержание DX8951: 5,2%) в количестве 10 или 2,5 мг/кг (количество в переводе на DX-8951). Через 2, 4, 8, 24 и 48 ч после введения, брали кровь из сердца. Собранную кровь оставляли на 10 мин, и центрифугировали при 12000 об/мин в течение 10 мин, чтобы получить сыворотку крови. В то же время также собирали опухолевый асцит. К 25 мкл каждого - сыворотки и опухолевого асцита,добавляли 100 мкл воды, содержащих 80% метанола, и центрифугировали при 12000 об/мин в течение 5 мин. К 25 мкл надосадка добавляли 225 мкл раствора термолизина, приготовленного в концентрации 2 мг/мл в 0,1 М трис-НСl, рН 8,5/0,1 М CaCl2, и смеси давали возможность реагировать при 50 С в течение 1 ч. Затем к реакционной смеси добавляли 250 мкл 0,5 н. раствора HCl, содержащего 50% ацетонитрила, и 20 мкл смеси подвергали анализу ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 х 100 мм), и элюирование выполняли 0,1 М раствором AcONa (рН 5,0), содержащим 41% смеси метанола и ацетонитрила(1:2), и гидролизат регистрировали флуоресцентной спектроскопией (экстинкция 375 нм и эмиссия 445 нм). В результате, в том случае, 003790 32 когда вводили 10 мг/кг, концентрация соединения 1 в асците снижалась во времени, тогда как концентрация в крови после введения постепенно возрастала и достигала максимальной концентрации через 24 ч, и после этого концентрация сохранялась почти на том же самом уровне,что и концентрация в асците (фиг. 1). При введении 2,5 мг/кг изменения концентраций в крови и асците были сходными с изменениями, наблюдаемыми при введении 10 мг/кг. Пример 5. Клетки Meth А, субкультивированные в брюшной полости, внутрибрюшинно трансплантировали мышам BALB/c(1 х 106 клеток/мышь). Через 5 дней мышам внутрибрюшинно вводили соединение 1 (содержание DX8951: 6,6%) в количестве 10 или 2,5 мг/кг (количество на основании DX-8951, каждая группа состояла из 3 мышей). После введения собирали кровь из сердца через промежутки времени (5 и 30 мин, и 2, 4, 8, 24 и 48 ч) . Собранную кровь оставляли на 10 мин, и центрифугировали при 12000 об/мин в течение 10 мин, чтобы получить сыворотку крови. В то же время также собирали опухолевый асцит. К 25 мкл каждого - сыворотки и опухолевого асцита, добавляли 225 мкл раствора -химотрипсина, приготовленного в концентрации 2 мг/мл в буфере БриттонаРобинсона (рН 6), и смеси давали возможность реагировать при 40 С в течение 2 ч. Затем к реакционной смеси добавляли 250 мкл 0,5 н. раствора HCl, содержащего 50% ацетонитрила, и центрифугировали при 12000 об/мин в течение 5 мин, и 10 мкл надосадка подвергали анализу ВЭЖХ. Определенные концентрации соединения 1 были рассчитаны, исходя из концентрации GDX-8951, полученной анализом ВЭЖХ, и содержания DX-8951 используемого соединения 1. Анализ ВЭЖХ выполняли при таких же условиях, как в примере 4. В результате, в том случае, когда вводили 10 мг/кг, концентрация соединения 1 в крови снижалась во времени. Концентрация в асците после введения постепенно возрастала и достигала по существу такого же уровня, как концентрация в крови, через 48 ч(фиг. 2). При введении 2,5 мг/кг изменения концентраций соединения 1 в крови и асците были сходными с изменениями, наблюдаемыми при введении 10 мг/кг. Пример 6. Соединение СДЛС, содержащее полимерный носитель, модифицированный сахаридным соединением, получали следующим образом. В нижеследующей схеме в качестве примеров структурных единиц сахаридной цепи были приведены только одна или две структурные единицы с введенными карбоксильными группами, однако, следует понимать, что фрагмент полиспирта на основе карбоксиметилдекстрана в соединениях СДЛС, описанных в примерах, не образован повторением структурных единиц. 33 Степень карбоксиметилирования (степень замещения карбоксильными группами на остаток сахарида, как единицы строения) определяли,превращая натриевую соль полиспирта на основе карбоксиметилдекстрана в форму свободной кислоты, и затем растворяя свободную кислоту в 0,1 н. водном растворе гидроксида натрия, и титруя раствор 0,1 н. соляной кислотой. Водный раствор натриевой соли полиспирта на основе карбоксиметилдекстрана наносили на колонкуBio-Rad AG50W-x2 (Н+) и пропущенный через колонку раствор лиофильно сушили и использовали в качестве образца. Образец растворяли в заданном избыточном количестве 0,1 н. водного раствора гидроксида натрия и титровали 0,1 н. соляной кислотой, используя в качестве индикатора фенолфталеин. Степень карбоксиметилирования определяли в соответствии с уравнением: 13,4(а - b)/[s-5,8(a - b)], где символ "s" означает количество собранного образца (мг), символ "а" означает заданное избыточное количество 0,1 н. водного раствора гидроксида натрия(мл). Количество введенного лекарственного средства (мас.%) рассчитывали на основании результатов абсорбционной спектрометрии(около 362 нм), использующей поглощение, характерное для лекарственного средства. Гельфильтрацию выполняли при следующих условиях: колонка: TSK gel G4000 PWXL; элюат: 0,1 М NaCl; скорость потока: 0,8 мл/мин; и температура колонки: 40 С. Соединение 2-1 (5,0 г) и 2-[2-(2-хлорэтокси)этокси]этанол (3,75 мл) растворяли в дихлорметане (75 мл), и к раствору добавляли комплекс эфирата трехфтористого бора (7,7 г) и перемешивали в течение 5 ч. Реакционную смесь разбавляли дихлорметаном (100 мл), и органический слой промывали водой, насыщенным водным гидрогенкарбонатом натрия, и затем насыщенным раствором соли, и сушили над сульфатом магния. После удаления сульфата магния с помощью фильтрования растворитель выпаривали и полученный в результате остаток очищали колоночной хроматографией (гексан : этилацетат = 2:1), используя силикагель и получая 3,3 г хлорированного соединения. Полученное хлорированное соединение (3,3 г) и NaN3(2,0 г) перемешивали при 60 С в течение 2 дней в ДМФА (15 мл) . Растворитель выпаривали, и остаток растворяли в смеси этилацетата и воды. Органический слой промывали водой и сушили над сульфатом магния, и затем сульфат магния удаляли фильтрованием. Растворитель выпаривали, получая 2,8 г азидного соединения. 34 Полученное азидное соединение (1,5 г) растворяли в метаноле (30 мл), и к раствору добавляли 28% раствор MeONa в метаноле вплоть до того, как значение рН достигало 10, и полученную в результате смесь перемешивали в течение 1 ч. Затем к реакционной смеси добавлялиDowex 50 WX8 (Н+) до тех пор, пока смесь не становилась нейтральной, и смолу извлекали фильтрованием, и растворитель выпаривали. Полученный в результате остаток растворяли в смеси метанола (50 мл) и воды (10 мл), и к раствору добавляли 5% Pd-C (содержание воды: 50%, 2,0 г) и перемешивали в течение ночи в атмосфере водорода при обычном давлении. Катализатор извлекали фильтрованием, и растворитель выпаривали, получая 1,2 г соединения 2-2. 1 Н-ЯМР (DMSO-d6):4,20-4,30 (1 Н, уш) ,4,00-4,10 (1 Н, уш) , 3,80-3,85 (1 Н, уш), 3,50-3,75(В) Синтез полиспирта на основе КМдекстрана, модифицированного галактозой(рН 5,5, 2000 мл). Смесь закрывали от света и перемешивали при 4 С в течение 10 дней. Затем к смеси добавляли этиленгликоль (14,0 мл) и перемешивали в течение ночи. Реакционную смесь доводили до рН 7,5 с помощью 8 М водного раствора гидроксида натрия при охлаждении на льду, и добавляли борогидрид натрия (28 г). После растворения борогидрида натрия смесь перемешивали в течение ночи при комнатной температуре. Смесь доводили до рН 5,5 уксусной кислотой при охлаждении на льду, и перемешивали при 4 С в течение 1 ч. Значение рН смеси доводили до значения рН 7,5 с помощью 8 М водного раствора гидроксида натрия при охлаждении на льду. Указанную выше процедуру повторяли два раза, и полученные в результате две партии водных растворов объединяли,низкомолекулярные фракции извлекали ультрафильтрацией, используя мембрану Biomax-3(Millipore), получая остаточный раствор. Остаточный раствор пропускали через мембрануBiomax-30. Пропущенный раствор обессоливали ультрафильтрацией с использованием мембраныBiomax-3 и лиофильно сушили, получая очищенный полиспирт на основе декстрана (12,0 г). Молекулярная масса (гель-фильтрация, стандарт пуллулан) полученного в результате продукта составляла 9 кД. Указанный выше очищенный полиспирт на основе декстрана (9,4 г) добавляли к водному раствору, полученному растворением гидроксида натрия (39,3 г) в воде (282 мл), и растворяли при комнатной температуре. К раствору при охлаждении на льду добавляли монохлоруксусную кислоту (56,4 г) и растворяли, смеси давали возможность реагировать в течение 20 ч при комнатной температуре. Значение рН реакционной смеси доводили до 8 уксусной кислотой, и подвергали ультрафильтрации с использованием мембраны Biomax-5, для извлечения фракций с низкой молекулярной массой. Оставшийся раствор лиофильно сушили, получая натриевую соль карбоксиметил (в дальнейшем в примерах сокращенно называемом"КМ")-декстранполиспирта (12 г). Полученную в результате натриевую соль КМ-декстранового полиспирта(4,0 г) добавляли к водному раствору, полученному растворением гидроксида натрия (17 г) в воде (120 мл), и растворяли при комнатной температуре. К раствору при охлаждении во льду добавляли монохлоруксусную кислоту (24 г) и растворяли, и затем смеси давали возможность реагировать в течение 20 ч при комнатной температуре. Значение рН реакционной смеси доводили до 8 уксусной кислотой, и фракции с низкой молекулярной массой извлекали ультрафильтрацией с использованием мембраны Biomax-5. Оставшийся раствор лиофильно сушили, получая натриевую соль КМ-декстранового полиспирта (4,0 г). Молекулярная масса (гельфильтрация, стандарт пуллулан) полученного в результате продукта составляла 14 кД, и степень карбоксиметилирования на остаток сахарида составляла 0,7, как было определено алкалиметрией. Полученную в результате натриевую соль КМ-декстранового полиспирта (1,0 г) растворяли в воде (100 мл) и к раствору добавляли метанольный раствор (100 мл) соединения 2-2 (800 мг) примера 1. Далее к раствору добавляли водорастворимый гидрохлорид карбодиимида (240 мг) 3 раза каждые 2 ч, и при этом смесь в итоге перемешивали в течение 6 ч. Растворитель выпаривали из реакционной смеси, и полученное в результате масло растворяли в воде и обессоливали ультрафильтрацией, используя мембрануBiomax-3. Полученный в результате водный раствор лиофильно сушили, получая 1,1 г указанного в заголовке соединения. Содержание галактозы в продукте составляло 1,0 на 10 сахаридных остатков, как было определено методом с использованием фенола - серной кислоты. Натриевую соль (1,0 г) модифицированного галактозой полиспирта на основе КМдекстрана, полученную в указанном выше пункте (В), растворяли в воде (30 мл), и к раствору добавляли раствор соли трифторуксусной кислоты и Gly-Gly-Phe-Gly-DX-8951 (150 мг) и 1 гидроксибензотриазола (35 мг) в метаноле (40 мл). Значение рН раствора доводили до 7,0, и затем добавляли водорастворимый гидрохлорид карбодиимида (35 мг) 3 раза каждые 2 ч и перемешивали в течение ночи. Растворитель удаляли из реакционной смеси выпариванием, и полученный в результате остаток растворяли в 3 М водном растворе хлорида натрия (20 мл) и раствор по каплям добавляли в этанол (100 мл). Осадки собирали центрифугированием (3500 об/мин, 8 мин). Осадки растворяли в воде и обессоливали ультрафильтрацией с использованием мембраны Biomax-3. Оставшийся раствор,который не прошел через мембрану, фильтровали через фильтр Millipore (0,22 мкм) и лиофильно сушили, получая 900 мг указанного в заголовке соединения. Полученный в результате продукт растворяли в 0,1 М водном растворе хлорида натрия и анализировали ГПХ (колонка:TOSOH TSK GelPW-4000XL, растворитель: 0,1 М водный NaCl, скорость потока: 0,8 мл/мин). Результаты анализа ГПХ и спектр поглощения ультрафиолета (в 0,1 М трис-буфере, рН 9,0) соединения показаны на фиг. 4 и 3, соответственно. Содержание DX-8951 в соединении было найдено равным 4,9% (мас./мас.) с помощью количественного анализа на основании абсорбционной спектрофотометрии при 366 нм в 0,1 М трис-буфере, содержащем 30% ацетонитрила Натриевую соль полиспирта на основе КМ-декстрана, полученную в указанном выше пункте (В) (2,0 г), растворяли в воде и раствор пропускали через Dowex-50 WX8 (Et3NH+), чтобы получить триэтиламмониевую соль КМдекстранового полиспирта (1,9 г). Полученную в результате триэтиламмониевую соль КМдекстранового полиспирта (1,9 г) растворяли в 37 водном растворе, содержащем 50% N,N-диметилформамида. К раствору последовательно добавляли раствор триэтиламина (0,112 мл) и соли трифторуксусной кислоты и Gly-Gly-PheGly-DX-8951 (350 мг) в N,N-диметилформамиде(10 мл) и 1-этоксикарбонил-2-этокси-1,2-дигидроксихинолин (1,9 г), и смеси давали возможность реагировать в течение ночи при комнатной температуре с перемешиванием. Растворитель удаляли из реакционной смеси выпариванием, и полученный в результате остаток растворяли в 3 М водном растворе хлорида натрия(20 мл), и раствор по каплям добавляли в этанол(3500 об/мин). Полученные осадки растворяли в воде и обессоливали ультрафильтрацией с использованием мембраны Biomax-3. Оставшийся раствор, который не прошел через мембрану,фильтровали через фильтр Millipore (0,22 мкм) и лиофильно сушили, получая 1,4 г указанного в заголовке соединения. Полученный в результате продукт растворяли в 0,1 М водном растворе хлорида натрия и анализировали ГПХ (колонка:TOSOH TSK GelPW-4000XL, растворитель: 0,1 М водный NaCl, скорость потока: 0,8 мл/мин). Результат анализа ГПХ и спектр поглощения ультрафиолета (в 0,1 М трис-буфере, рН 9,0) соединения показаны на фиг. 9 и 6 соответственно. Содержание DX-8951 в соединении было найдено равным 5,2% (маc./маc.) с помощью количественного анализа на основании абсорбционной спектрофотометрии при 366 нм в 0,1 М трис-буфере, содержащем 30% ацетонитрила(Е) Измерение соединения СДЛС. Каждое из соединений - модифицированное галактозой соединение СДЛС, полученное согласно указанному выше пункту (С), и соединение СДЛС согласно указанному выше пункту(D) в качестве контроля - растворяли в дистиллированной воде для инъекций так, чтобы получить концентрацию 0,5 мг/мл, исходя из DX8951. Каждый из водных растворов соединений СДЛС инъецировали внутривенно в хвосты мышам C57BL/6 (каждая группа состояла из пяти мышей). Доза составляла 5 мг/кг, исходя изDX-8951. После введения извлекали печень во временных точках (0,5, 1, 2, 4 и 24 ч), и определяли количества соединений СДЛС в печени. К печени добавляли 5 кратную массу воды и гомогенизировали. Гомогенат центрифугировали при 3000 об/мин в течение 10 мин, и надосадок далее центрифугировали при 15000 об/мин в течение 15 мин. К 50 мкл полученного в результате надосадка добавляли 450 мкл раствора химотрипсина, приготовленного в концентрации 2 мг/мл в буфере Бриттона-Робинсона(B.R.B.), и смеси давали возможность реагировать при 40 С в течение 2 ч. После чего к смеси добавляли 500 мкл 0,5 н. раствора HCl, содержащего 50% ацетонитрила, и центрифугировали при 12000 об/мин в течение 5 мин. Чтобы опре 003790 38 делить количества соединений СДЛС, измеряли количество высвобожденного G-DX-8951, подвергая 20 мкл надосадка анализу ВЭЖХ. Используемые для введения водные растворы каждого соединения СДЛС в концентрации 50, 10 и 2 мкг/мл готовили в дистиллированной воде, и 50 мкл каждого раствора подвергали ферментативной обработке, и G-DX8951 количественно определяли, чтобы получить калибровочные кривые. Условия анализа ВЭЖХ: Колонка: симметричная С 18 (4,6 x 100 мм); Скорость потока: 1,0 мл/мин; Температура колонки: 40 С; Длина волны регистрации (флуоресценция): экстинкция 375 нм и эмиссия 445 нм; Элюат: метанол : ацетонитрил = 1:2 (29%),0,1% ТФУ (71%). Результаты показаны на фиг. 5. Вышеуказанное модифицированное галактозой соединение СДЛС проявляло высокую степень накопления в печени по сравнению с контрольным соединением СДЛС (вышеупомянутым в пункте(D. Пример 7. Синтез соединения - модифицированный галактозой КМ-декстрановый полиспирт-Glу-Glу-Рhе-Glу-DХ-8951. К раствору декстрана Т 500 (Pharmacia, молекулярная масса: 500 кД, 50 г) в 0,1 М ацетатном буфере (рН 5,5, 5000 мл) добавляли водный раствор (5000 мл) периодата натрия (165,0 г). Раствор закрывали от света и перемешивали при 4 С в течение 10 дней, и затем добавляли этиленгликоль (35,0 мл) и перемешивали в течение ночи. Значение рН реакционной смеси доводили до рН 6,5 с помощью 8 М водного раствора гидроксида натрия при охлаждении во льду, и добавляли суспензию борогидрида натрия (70 г) в воде (2000 мл). После растворения борогидрида натрия раствор перемешивали в течение ночи при комнатной температуре. Раствор охлаждали во льду, доводили значение рН до рН 5,5 уксусной кислотой и перемешивали при 4 С в течение 1 ч. рН раствора доводили до значения рН 7,5 с помощью 8 М водного раствора гидроксида натрия при охлаждении во льду. Полученный в результате раствор подвергали ультрафильтрации, используя мембрану Biomax-50, чтобы извлечь фракции с низкой молекулярной массой, и получали оставшийся раствор. Оставшийся раствор пропускали через мембрану для ультрафильтрации (1000 кД, Filtron Co.). Пропущенный раствор обессоливали ультрафильтрацией с использованием мембраны Biomax-50 и лиофильно сушили, получая полиспирт на основе декстрана (21,1 г). Молекулярная масса (гельфильтрация, стандарт пуллулан) продукта составляла 128 кД. Полученный в результате полиспирт (5 г) добавляли к водному раствору, полученному растворением гидроксида натрия (13,84 г) в воде(150 мл), и растворяли в растворе при комнатной температуре. К раствору при охлаждении во льду добавляли натриевую соль монохлоруксусной кислоты (61,6 г) и растворяли в растворе,и затем смеси давали возможность реагировать в течение ночи при комнатной температуре. Значение рН реакционной смеси доводили до 8,5, и затем фракции с низкой молекулярной массой удаляли ультрафильтрацией с использованием мембраны Biomax-50. Фракции с высокой молекулярной массой лиофильно сушили,получая натриевую соль КМ-декстранового полиспирта (6,2 г). Молекулярная масса(гель-фильтрация, стандарт - пуллулан) полученного в результате продукта составляла 428 кД, и степень карбоксиметилирования на сахаридный остаток была найдена с помощью алкалиметрии и составляла 0,9. Полученную в результате натриевую соль КМ-декстранового полиспирта (500 мг) растворяли в воде (50 мл) и к раствору добавляли раствор соединения 2-2(400 мг), полученного согласно примеру 6, в метаноле (20 мл) и раствор 1-гидроксибензотриазола (160 мг) в метаноле (20 мл). Далее к смеси добавляли водорастворимый гидрохлорид карбодиимида (120 мг) 3 раза каждые 2 ч, и смесь в итоге перемешивали в течение 6 ч. Растворитель удаляли из реакционной смеси выпариванием, и полученное в результате масло растворяли в воде и подвергали ультрафильтрации,используя мембрану Biomax-50 для извлечения фракций с низкой молекулярной массой. Полученный в результате раствор лиофильно сушили, получая 600 мг требуемого соединения. Содержание галактозы в продукте было найдено равным 1,7 на 10 сахаридных остатков, как было определено методом с использованием фенола серной кислоты. Полученную в результате натриевую соль модифицированного галактозой КМ-декстранового полиспирта (200 мг) растворяли в воде (3 мл) и к раствору добавляли раствор соли трифторуксусной кислоты и Gly-Gly-Phe-Gly-DX8951 (27 мг) в метаноле (3 мл) и раствор 1 гидроксибензотриазола (7 мг) в метаноле (3 мл). Значение рН полученного в результате раствора доводили до рН 7,0, добавляли водорастворимый гидрохлорид карбодиимида (7 мг) 3 раза каждые 2 ч, и перемешивали в течение ночи. Растворитель удаляли из реакционной смеси выпариванием, и полученный в результате остаток растворяли в 3 М водном растворе хлорида натрия (10 мл), и затем раствор по каплям добавляли в этанол (100 мл). Осадки собирали центрифугированием (3500 об/мин). Осадки растворяли в воде и обессоливали ультрафильтрацией с использованием мембраны Biomax-50. Оставшийся раствор, который не прошел через мембрану, фильтровали через фильтр MilliporeTSK GelPW-4000XL, растворитель: 0,1 М водный NaCl, скорость потока: 0,8 мл/мин). Результат анализа ГПХ и спектр поглощения ультрафиолета (в 0,1 М трис-буфере, рН 9,0) продукта показаны на фиг. 10 и 7 , соответственно. Содержание DX-8951 в продукте было найдено равным 3,7% (маc./маc.) с помощью количественного анализа на основании абсорбционной спектрофотометрии при 366 нм в 0,1 М трисбуфере, содержащем 30% ацетонитрила (рН 10,0). Пример 8. Синтез 2-[2-(2-аминоэтокси) этокси]этилD-2-амино-2-дезоксигалактозы. Раствор 2-[2-(2-азидэтокси)этокси]этил-D-2-ацетиламино-2-дезокси-3,4,6-триацетилгалактозы (2,64 г), синтезированной способом,описанным в не прошедшей экспертизу заявке на патент Японии (KOKAI) (Hei) No. 5202085/1993, растворенной в метаноле (10 мл),охлаждали на льду. К раствору добавляли 28% раствор метоксида натрия в метаноле (0,64 мл),и смесь перемешивали в течение 5 ч при охлаждении на льду, к реакционной смеси добавляли уксусную кислоту (0,186 мл) и сушили при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюат: раствор дихлорметан : метанол = 9:1), получая 2-[2-(2-азидэтокси)этокси]этилD-2-амино-2 дезоксигалактозу (1,98 г). 1(дд, 1 Н, J=3,4; 10,7 Гц), 3,49 (дд, 1 Н, J=5,9; 6,3 Гц), 3,39 (т, 2 Н, J=4,9 Гц), 1,99 (с, 3H). К раствору указанной выше 2-[2-(2-азидэтокси)этокси]этилD-2-амино-2-дезоксигалактозы (640 мг), растворенной в этаноле (10 мл) добавляли катализатор Линдлара (430 мг),смесь подвергали каталитическому восстановлению в течение 1,5 ч в атмосфере водорода при обычном давлении. Затем к смеси добавляли катализатор Линдлара (215 мг) и каталитическое восстановление выполняли в течение 3,5 ч в атмосфере водорода при обычном давлении. Катализатор удаляли фильтрованием, и фильтрат сушили при пониженном давлении, получая 2-[2-(2-аминоэтокси)этокси]этилD-2-амино 2-дезоксигалактозу (601 мг). 1(10 мл). Значение рН полученного в результате раствора доводили до рН 7,0 и добавляли водорастворимый гидрохлорид карбодиимида (90 мг) 3 раза каждые 2 ч. Смесь перемешивали в течение ночи и подвергали ультрафильтрации,используя мембрану Biomax-50 для удаления из реакционной смеси фракций с низкой молекулярной массой. Оставшийся раствор, который не прошел через мембрану, лиофильно сушили,получая модифицированный N-ацетилгалактозамином КМ-декстрановый полиспирт (443 мг). Методом Элсона-Моргана определяли содержание N-ацетилгалактозамина в продукте, составившее 1,6 на 10 сахаридных остатков. Полученный в результате модифицированный N-ацетилгалактозамином КМ-декстрановый полиспирт (200 мг) растворяли в воде (10 мл) и к раствору добавляли раствор соли трифторуксусной кислоты и Gly-Gly-Phe-Gly-DX8951 (30 мг), растворенной в метаноле (10 мл) и раствор 1-гидроксибензотриазола (30 мг), растворенного в метаноле (10 мл). Значение рН раствора доводили до рН 7,0, добавляли водорастворимый гидрохлорид карбодиимида (10 мг) 3 раза каждые 2 ч. Смесь перемешивали в течение 2 ч и доводили до рН 8,5. Фракции с низкой молекулярной массой удаляли из реакционной смеси ультрафильтрацией с использованием мембраны Biomax-50. Оставшийся раствор, который не прошел через мембрану,фильтровали через фильтр Millipore (0,22 мкм) и лиофильно сушили, получая указанное в заголовке соединение (203 мг). Полученный в результате продукт растворяли в 0,1 М водном растворе хлорида натрия и анализировали ГПХ(колонка: TOSOH TSK GelPW-6000 ХL, растворитель: 0,1 М ацетатный буфер (рН 5,0), содержащий 20% ацетонитрила, скорость потока: 0,8 мл/мин). Результат анализа ГПХ и спектр поглощения ультрафиолета данного соединения(0,1 М трис-буфер (рН 10,0): ацетонитрил = 7:3,0,16 мг/мл) показаны на фиг. 11 и 8 , соответственно. Содержание остатка лекарственного соединения в продукте было найдено равным 4,6% (мас./мас.) с помощью количественного анализа на основании абсорбционной спектро 003790 42 фотометрии при 366 нм в смеси 0,1 М трисбуфер (рН 10,0) : ацетонитрил - 7:3. Пример 10. Измерение содержания DX8951 в КМ-декс-ПС-Gly-Gly-Phe-Gly-PABC-DX8951. К 5 мкл раствора КМ-декс-ПС-Glу-GlуPhe-Gly-РАВС-DХ-8951 (РАВС означает группу п-аминобензилоксикарбонила), полученному по способу, описанному в WO 99/61061, приготовленного в концентрации 1 мг/мл в дистиллированной воде, добавляли 95 мкл раствора папаина, приготовленного в концентрации 2 мг/мл в буфере Бриттона-Робинсона (рН 6). Реакционную смесь инкубировали при 40 С в течение 4 ч, добавляли 100 мкл 0,5 н. раствора HCl, содержащего 50% ацетонитрила, и содержание освобожденного гидролизата [DX-8951] определяли ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 x 100 мм; 3,5 мкм,Watars Co.), и элюирование выполняли 0,1% раствором трихлоруксусной кислоты с добавлением органического растворителя (метанол : ацетонитрил - 1:2) так, чтобы был создан градиент от 20 до 70% в течение 12 мин, и гидролизат регистрировали флуоресцентной спектроскопией (экстинкция 375 нм и эмиссия 445 нм). В результате DX-8951 элюировали примерно в точке, соответствующей 5,7 мин. Содержание DX8951 в вышеуказанном соединении СДЛС было рассчитано с помощью калибровочной кривой,полученной для DX-8951, и составляло 4,0%. С другой стороны, содержание DX-8951 было рассчитано на основании поглощения УФ вышеуказанным соединением СДЛС с использованием калибровочной кривой, полученной для DX8951, и составляло 3,3%. Пример 11. Измерение содержания DX8951 в КМ-декс-ПС-Gly-Gly-Phe-Gly-PABC-DX8951. К 5 мкл раствора KM-декс-ПС-Gly-GlyPhe-Gly-PABC-DX-8951, приготовленного в концентрации 1 мг/мл в дистиллированной воде,добавляли 95 мкл раствора -химотрипсина,приготовленного в концентрации 2 мг/мл в буфере Бриттона-Робинсона (рН 6). Реакционную смесь инкубировали при 40 С в течение 4 ч, и затем добавляли 100 мкл 0,5 н. раствора HCl,содержащего 50% ацетонитрила, и содержание освобожденного гидролизата [DX-8951] определяли ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 х 100 мм; 3,5 мкм, Watars Co.), и элюирование выполняли 0,1% раствором трихлоруксусной кислоты с добавлением органического растворителя (метанол : ацетонитрил = 1:2) так, чтобы был создан градиент от 20 до 70% в течение 12 мин, и гидролизат регистрировали флуоресцентной спектроскопией (экстинкция 375 нм и эмиссия 445 нм). В результате DX-8951 элюировали примерно в точке, соответствующей 5,7 мин. Содержание DX-8951 в вышеуказанном соединении СДЛС было рассчитано с помощью ка 43 либровочной кривой, полученной для DX-8951,и составляло 2,5%. С другой стороны, содержание DX-8951 было рассчитано на основании поглощения УФ вышеуказанным соединением СДЛС с использованием калибровочной кривой,полученной для DX-8951, и составляло 1,7%. Пример 12. Измерение содержания DX8951 в КМ-декс-ПС-Gly-Gly-Phe-Gly-NH(CH2)4-CO-DX-8951. К 5 мкл раствора КМ-декс-ПС-Gly-GlyPhe-Gly-NH-(СН 2)4-СО-DX-8951, приготовленного в концентрации 100 мкг/мл в дистиллированной воде, добавляли 95 мкл раствора папаина, приготовленного в концентрации 2 мг/мл в буфере Бриттона-Робинсона (рН 6). Реакционную смесь инкубировали при 40 С в течение 4 ч, и затем добавляли 100 мкл 0,5 н. раствора HCl,содержащего 50% ацетонитрила, и содержание освобожденного гидролизата [NH2-(CH2)4-CODX-8951] определяли ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 x 100 мм; 3,5 мкм, Watars Co.), и элюирование выполняли 0,1% раствором трихлоруксусной кислоты, содержащей 32% органического растворителя (метанол : ацетонитрил = 1:2), и гидролизат регистрировали флуоресцентной спектроскопией (экстинкция 375 нм и эмиссия 445 нм). В результате NH2-(CH2)4-CO-DX-8951 элюировали примерно в точке, соответствующей 5,3 мин. Содержание DX-8951 в вышеуказанном соединении СДЛС было рассчитано с помощью калибровочной кривой, полученной для NH2-(CH2)4-CO-DX-8951, и составляло 3,0%. С другой стороны, содержание DX-8951 было рассчитано на основании поглощения УФ вышеуказанным соединением СДЛС с использованием калибровочной кривой, полученной для DX-8951, и составляло 3,1%. Пример 13. Измерение содержания DXR в КМ-декс-ПС-Gly-Gly-Phe-Gly-DXR (DXR: доксорубицин). К 10 мкл раствора соединения СДЛС, приготовленного в концентрации 1 мг/мл в дистиллированной воде, добавляли 190 мкл раствора папаина, приготовленного в концентрации 2 мг/мл в буфере Бриттона-Робинсона (рН 6). Реакционную смесь инкубировали при 40 С в течение 2 ч, и добавляли 200 мкл ацетонитрила, и содержание освобожденного гидролизата [DXR] определяли ВЭЖХ. Для анализа ВЭЖХ использовали симметричную колонку С 18 (4,6 x 100 мм; 3,5 мкм, Watars Co.), и элюирование выполняли 0,1% раствором трихлоруксусной кислоты,содержащей 34% органического растворителя(метанол : ацетонитрил = 1:2), и гидролизат регистрировали флуоресцентной спектроскопией(экстинкция 480 нм и эмиссия 590 нм). В результате DXR элюировали примерно в точке,соответствующей 3,8 мин. Содержание DXR в вышеуказанном соединении СДЛС было рассчитано с помощью калибровочной кривой, полученной для DXR, и составляло 5,3%. С другой 44 стороны, содержание DXR было рассчитано на основании поглощения УФ вышеуказанным соединением СДЛС с использованием калибровочной кривой, полученной для DXR, и составляло 4,3%. Пример 14. Синтез соединения - КМдекстрановый полиспирт-Gly-Gly-Phe-Gly-DXR. Натриевую соль полиспирта на основе карбоксиметилдекстрана (30 мг), имеющего среднюю молекулярную массу 274 кД и степень карбоксиметилирования (степень замещения карбоксиметильными группами на остаток сахарида в структуре), равную 0,4, которая была получена согласно способу, описанному в примере 24 WO 97/46260, растворяли в 0,05 М коллидин-HCl буфере (2 мл), содержащей 50% метанола. К раствору добавляли раствор гидрохлорида Gly-Gly-Phe-Gly-DXR (4 мг) в метаноле(400 мкл), и этот гидрохлорид был получен согласно способу, описанному в примере 43 WO 97/46260, и раствор гидрохлорида 1-этил-3-(3 диметиламинопропил) карбодиимида (2,4 мг) в метаноле (240 мкл), и перемешивали в течение 2 ч. К раствору добавляли 30 мл 3 М раствора соли, и обессоливали ультрафильтрацией с использование мембраны Biomax-50K. Оставшийся раствор, который не прошел через мембрану,фильтровали через фильтр Millipore (0,22 мкм) и лиофильно сушили, получая указанное в заголовке соединение (25 мг). Содержание остатка лекарственного соединения в данном соединении определяли абсорбционной спектроскопией при 480 нм в PBS (рН 7,4), и оно составляло 4,3% (мас./мас). Пример 15. Синтез КМ-декс-ПА-Gly-GlyPhe-Gly-Nh-(СН 2) 4-CO-DX-8951.(DMF) (20 мл), и смесь перемешивали в течение 30 мин. К полученному в результате раствору добавляли раствор соли паратолуолсульфокислоты и сложного бензилового эфира 5-аминопентановой кислоты (500 мг) и триэтиламина(0,184 мл), растворенного в ДМФА (10 мл), и смесь перемешивали при комнатной температуре в течение трех дней. Реакционную смесь концентрировали, и остаток очищали колоночной хроматографией (СН 2 Сl2 : МеОН = 20:1),получая 560 мг Boc-Gly-Gly-Phe-Gly-NH-(CH2)4COOBzl.Boc-Gly-Gly-Phe-Gly-NH-(CH2)4COOBzl (560 мг) растворяли в метаноле (60 мл),содержащем 50% воды, и к раствору добавляли 5% Pd-C (содержание воды: 50%, 1,5 г) и перемешивали в течение ночи в атмосфере водорода при обычном давлении. Затем катализатор из реакционной смеси извлекали фильтрованием, и смесь концентрировали досуха, получая 300 мг(300 мг), DCC (138 мг) и HOSu (77 мг) растворяли в ДМФА, и раствор перемешивали в течение 30 мин. К полученному в результате раство 45 ру добавляли раствор DX-8951 (317 мг) и триэтиламина (0,078 мл), растворенных в ДМФА, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали, и полученный в результате остаток очищали колоночной хроматографией (СН 2 Сl2 : МеОН = 10:1), получая 400 мг Boc-Gly-Gly-PheGly-NH-(CH2)4-CO-DX-8951.Boc-Gly-Gly-Phe-Gly-NH-(CH2)4-CO-DX8951 (300 мг) растворяли в ТФУ (TFA) (2 мл), и раствору давали возможность реагировать в течение одного часа, и затем реакционную смесь концентрировали. Полученный в результате остаток переводили в твердое состояние,добавляя эфир, и надосадок удаляли. Твердую массу сушили, получая 250 мг соли трифторуксусной и H-Gly-Gly-Phe-Gly-NH-(СН 2)4-CO-DX8951. 1H-ЯМР (DMSO-d6):8,45-8,55 (м, 2 Н),8,28-8,35 (м. 2 Н), 7,95-8,10 (уш, 2 Н), 7,79 (д, 1 Н,J=10,7 Гц), 7,70-7,75 (м, 1 Н), 7,32 (с, 1 Н), 7,207,30 (м, 5 Н), 7,15-7,25 (м, 4 Н), 6,50-6,60 (уш,1 Н), 5,50-5,60 (м, 1 Н), 5,40-5,50 (м, 2 Н), 5,18 (с,2 Н), 4,50-4,60 (м, 1 Н), 3,55-3,95 (м, 7 Н), 3,003,25 (м, 5 Н), 2,75-2,85 (м, 1 Н), 2,50 (с, 3H), 2,152,25 (м, 4 Н), 1,86-2,00 (м, 2 Н), 1,55-1,65 (м, 2 Н),1,45-1,55 (м, 2 Н), 0,88 (т, 3H, J=7,35 Гц). Триэтиламмониевую соль полиспирта на основе карбоксиметилдекстрана (200 мг),имеющего среднюю молекулярную массу 337 кД и степень карбоксиметилирования (степень замещения карбоксиметильными группами на остаток сахарида в структуре), равную 0,4, которая была получена согласно способу, описанному в примере 24 WO 97/46260, растворяли в ДМФА (10 мл) . К указанному выше раствору добавляли раствор соли трихлоруксусной кислоты и H-Gly-Gly-Phe-Gly-NH-(CH2)4-CO-DX8951 (30 мг) и триэтиламина (10 мкл) в метаноле(4 мл), затем добавляли раствор 1-этоксикарбонил-2-этокси-1,2-дигидроксихинолина(200 мг) в метаноле (3 мл) и перемешивали в течение ночи при комнатной температуре, защищая от света. Реакционную смесь разбавляли 3 М раствором соли, и фракции с низкой молекулярной массой извлекали ультрафильтрацией через мембрану (50 кД), и полученный в результате остаток пропускали через фильтр с диаметром пор 0,22 мкм, и лиофильно сушили, получая 178 мг целевого соединения. Возможность промышленного использования Соединение СДЛС согласно данному изобретению, которое использует в качестве полимерного носителя полиспирт на основе карбокси (С 1-4)алкилдекстрана, модифицированный сахаридным соединением, обладает чрезвычайно высокой органной избирательностью и пригодно в качестве лекарственного средства, с которым достигается превосходное терапевтическое действие. Способ измерения соединения СДЛС согласно данному изобретению можно 46 использовать как чрезвычайно полезный способ при клиническом применении соединения СДЛС, поскольку способ дает возможность точного и простого определения концентрации в крови соединения СДЛС или содержания остатка лекарственного соединения, введенного в соединение СДЛС. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение СДЛС, которое содержит полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения,связанный с полиспиртом на основе карбокси(C1-4) алкилдекстрана. 2. Соединение СДЛС по п.1, где полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, и остаток лекарственного соединения связаны друг с другом посредством спейсера. 3. Соединение СДЛС по п.2, где спейсер содержит одну аминокислоту или от 2 до 8 аминокислот, связанных пептидной связью(ями). 4. Соединение СДЛС по любому из пп.1-3,где полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, образован связыванием сахаридного соединения и полиспирта на основе карбокси(C1-4)алкилдекстрана посредством линкера. 5. Соединение СДЛС по п.4, где полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением, имеет кластерную модификацию сахаридными соединениями, связанными посредством линкера. 6. Соединение СДЛС, которое получают связыванием остатка лекарственного соединения с полиспиртом на основе карбокси(C1-4) алкилдекстрана, в котором часть карбоксильных групп карбокси(C1-4)алкильного фрагмента модифицирована сахаридным соединением. 7. Соединение СДЛС по п.6, которое получают связыванием полиспирта на основе карбокси(C1-4) алкилдекстрана и остатка лекарственного соединения посредством спейсера. 8. Соединение СДЛС по п.6 или 7, которое получают связыванием остатка лекарственного соединения с полиспиртом на основе карбокси(C1-4)алкилдекстрана, который получают связыванием сахаридного соединения или линкера,связанного с сахаридным соединением, с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента полиспирта на основе карбокси(C1-4) алкилдекстрана. 9. Соединение СДЛС, которое получают модифицированием сахаридным соединением полиспирта на основе карбокси(C1-4)алкилдекстрана, в котором остаток лекарственного средства связан с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента посредством спейсера. 47 10. Соединение СДЛС по п.9, которое получают связыванием полиспирта на основе карбокси(C1-4)алкилдекстрана и сахаридного соединения посредством линкера. 11. Соединение СДЛС по п.9 или 10, которое получают модифицированием сахаридным соединением полиспирта на основе карбокси(C1-4)алкилдекстрана, полученного связыванием остатка лекарственного соединения с частью карбоксильных групп карбокси(C1-4)алкильного фрагмента полиспирта на основе карбокси(C1-4)алкилдекстрана посредством спейсера, содержащего одну аминокислоту, или спейсера,содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями). 12. Соединения СДЛС по любому из пп.111, где сахаридным соединением является галактоза или галактозамин или их производные. 13. Соединения СДЛС по любому из пп.112, где сахаридным соединением является Nацетилгалактозамин. 14. Соединения СДЛС по п.12, где степень замещения галактозы, или галактозамина, или их производных или кластера галактозы, или галактозамина, или их производных составляет 0,01-1,0 на остаток сахарида полиспирта на основе карбокси(C1-4) алкилдекстрана. 15. Соединения СДЛС по любому из пп.114, где полиспирт на основе декстрана, который составляет карбокси(C1-4) алкилдекстрановый полиспирт, является полиспиртом на основе декстрана, который получают обработкой декстрана в условиях, которые обеспечивают, по существу, полную полиалкоголизацию. 16. Соединение СДЛС по любому из пп.115, где полиспиртом на основе карбокси(C1-4)алкилдекстрана является карбоксиметилдекстрановый полиспирт. 17. Соединение СДЛС по любому из пп.116, где лекарственным соединением является противоопухолевое средство или противовоспалительное средство. 18. Соединение СДЛС по п.17, где лекарственным соединением является противоопухолевое средство. 19. Соединение СДЛС по любому из пп.117, где лекарственным соединением является(9 Н,15 Н)-дион. 20. Соединение СДЛС по п.19, которое является лекарственным средством для лечения рака печени. 21. Полиспирт на основе карбокси(C1-4) алкилдекстрана, модифицированный сахаридным соединением, для применения в производстве соединения СДЛС по любому из пп.1-20. 22. Полиспирт на основе карбокси(C1-4) алкилдекстрана, модифицированный сахаридным соединением. 48 23. Полимерный носитель, содержащий полиспирт на основе карбокси(C1-4)алкилдекстрана, модифицированный сахаридным соединением. 24. Способ измерения соединения СДЛС, в котором полимерный носитель, представляющий полиспирт на основе карбокси(C1-4)алкил декстрана, и остаток лекарственного соединения связаны друг с другом посредством спейсера,содержащего от 2 до 8 аминокислот, связанных пептидной связью(ями), который включает в себя этапы обработки соединения СДЛС пептидазой и измерения полученного в результате гидролизата. 25. Способ по п.24, который используют для измерения соединения СДЛС, содержащегося в биологическом образце. 26. Способ по п.24, который используют для измерения содержания остатка лекарственного соединения, введенного в соединение СДЛС. 27. Способ по п.24, где гидролизат представляет собой лекарственное соединение. 28. Способ по п.24, где гидролизат представляет собой соединение, содержащее остаток лекарственного соединения, связанный с частью спейсера. 29. Способ по п.24, где часть спейсера представляет собой одну аминокислоту, полученную из спейсера. 30. Способ по п.24, где полимерным носителем является полисахаридное производное,имеющее карбоксильные группы. 31. Способ по п.24, где лекарственным соединением, введенным в соединение СДЛС,является противоопухолевое средство или противовоспалительное средство. 32. Способ по любому из пп.24-31, где спейсером является тетрапептид, представленный -Gly-Gly-Phe-Gly-, начиная с N-конца, или тетрапептид, представленный -Gly-Gly-Gly-Phe,начиная с N-конца. 33. Способ по любому из пп.24-31, где спейсером является группа, представленная GlyGly-Phe-Gly-NH-Y'-CH2-O-CO-, начиная с Nконца, или группа, представленная -Gly-GlyGly-Phe-NH-Y'-СН 2-O-СО-, начиная с N-конца,где Y' означает группу парафенилена. 34. Способ по любому из пп.24-33, где пептидазой является -химотрипсин или папаин. 35. Способ по любому из пп.24-34, где лекарственным соединением является (1S,9S)-1 амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4 метил-1 Н,12 Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-10,13(9 Н,15 Н)-дион. 36. Способ по любому из пп.24-29, который используют для измерения соединения СДЛС, в котором полиспирт на основе карбокси(C1-4)алкилдекстрана и (1S,9S)-1-амино-9 этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил 1 Н,12 Н-бензо[de]пирано[3',4':6,7]индолизино 50 37. Способ по п.36, где в качестве пептидазы используют -химотрипсин или папаин и в качестве гидролизата измеряют (1S,9S)-9-этил 5-фтор-1-глициламино-2,3-дигидро-9-гидрокси 4-метил-1 Н,12 Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-10,13(9 Н,15 Н)-дион.
МПК / Метки
МПК: A61K 47/48, A61P 35/00
Метки: сдлс, соединение, способ, измерения
Код ссылки
<a href="https://eas.patents.su/27-3790-soedinenie-sdls-i-sposob-ego-izmereniya.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение сдлс и способ его измерения</a>
Предыдущий патент: Конъюгаты полиол-&beta-интерферон
Следующий патент: Способ лечения больного с расстройством сна
Случайный патент: Таблетка для профилактики и лечения заболеваний зубов и пародонта