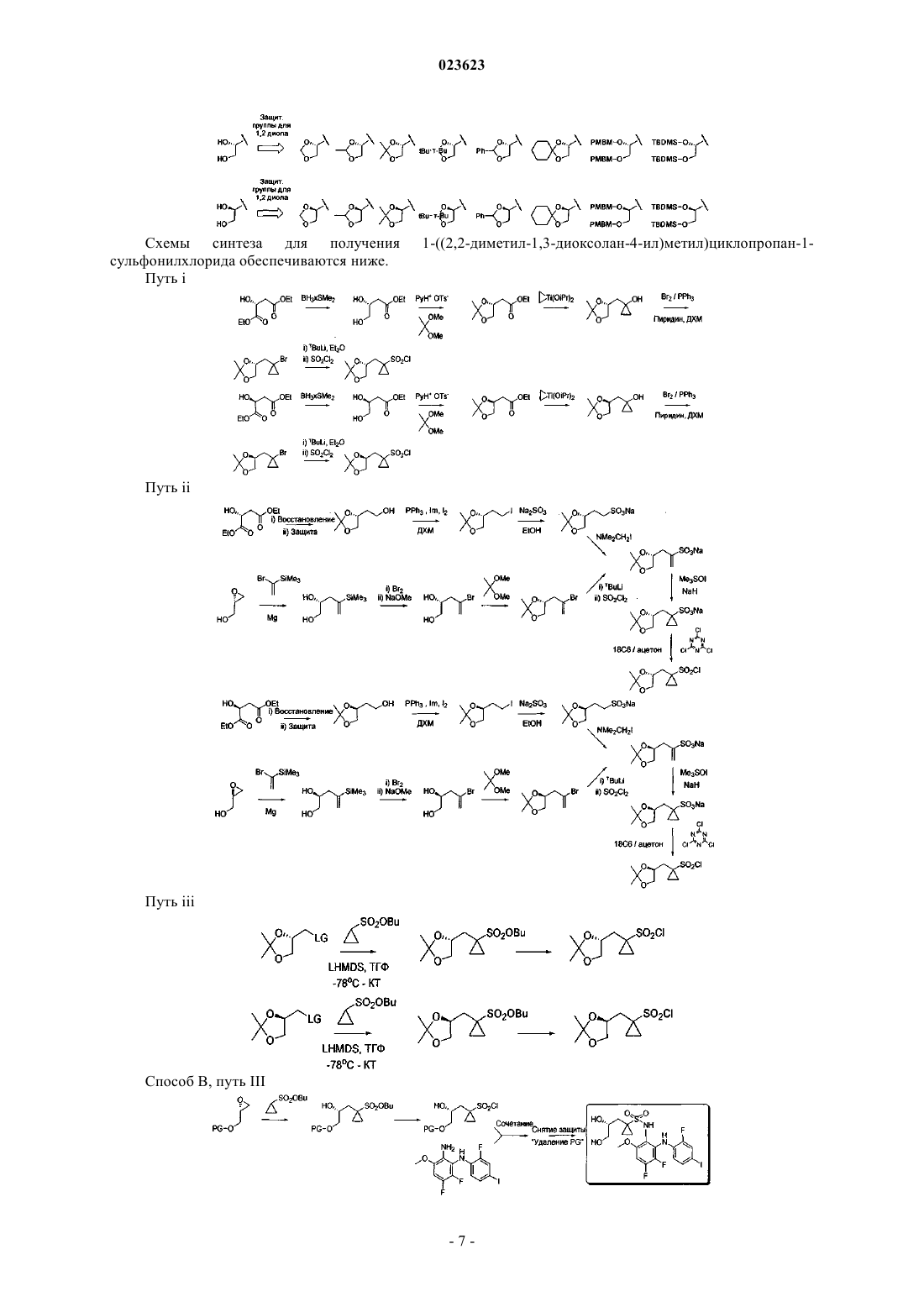
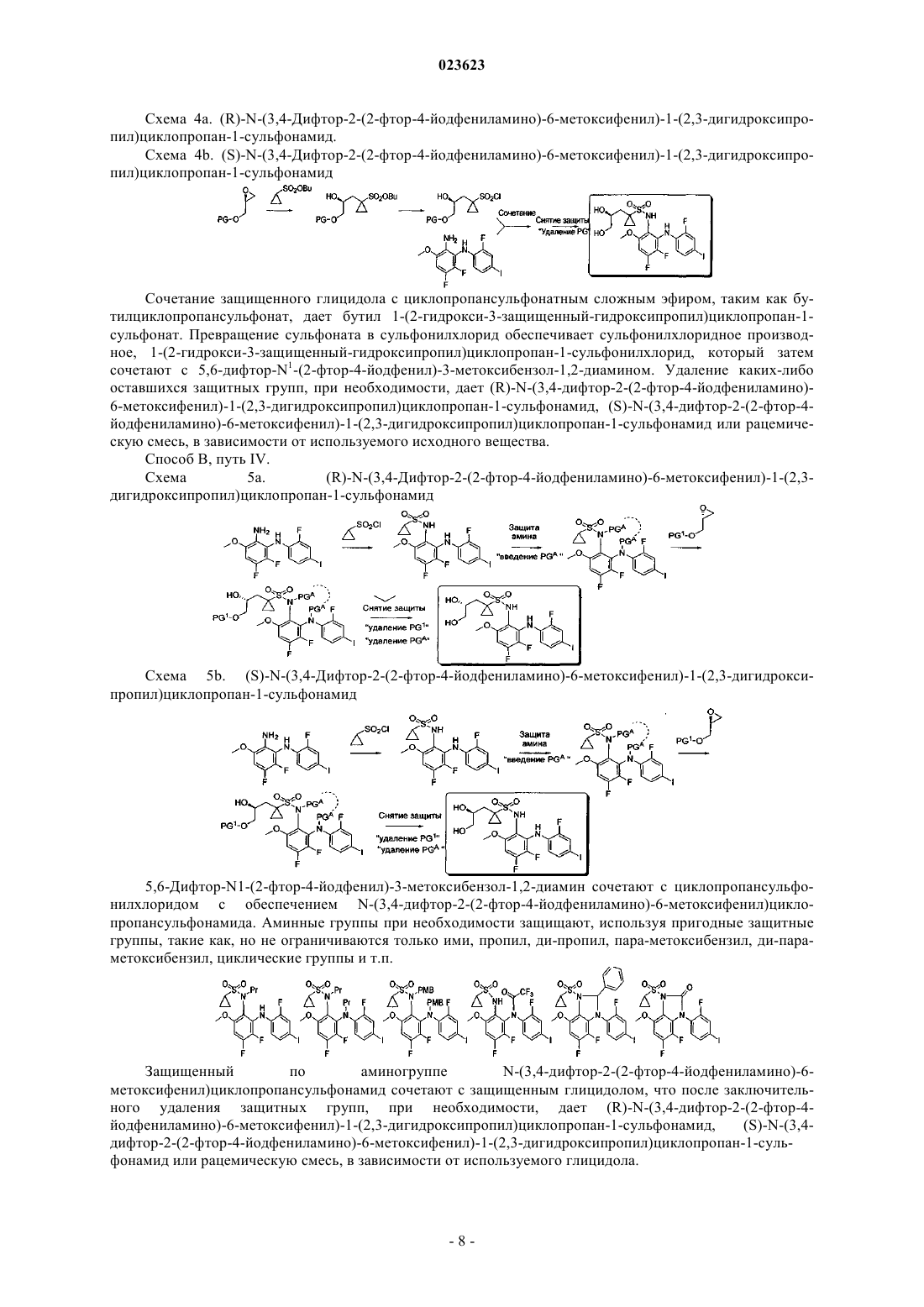
Получение защищенных производных (r)- и (s)-n-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида
Формула / Реферат
1. Способ получения соединения формулы (I-а)
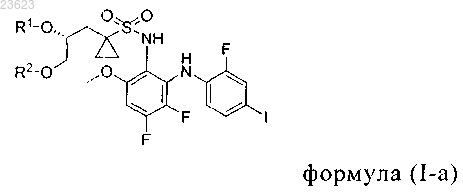
который включает введение во взаимодействие 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамина с соединением формулы (II-а)
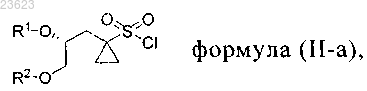
где R1 означает Н и R2 означает защитную группу для спиртовой группы; или
R2 означает Н и R1 означает защитную группу для спиртовой группы; или
оба R1 и R2 означают защитную группу для спиртовой группы; или
R1 и R2 вместе с атомами кислорода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы;
где защитные группы для спирта включают метоксиметил, бензилоксиметил, n-метоксибензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксициклогексил, метокситетрагидропиранил, тетрагидрофуранил, этоксиэтил, m-бутил, аллил, пропаргил, n-метоксибензил, пиколил, дифенилметил, трифенилметил, триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил, карбонаты, сульфонаты;
защитные группы для 1,2-диолов включают 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3-диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан.
2. Способ получения соединения формулы (I-b)
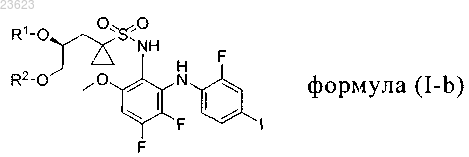
который включает введение во взаимодействие 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамина с соединением формулы (II-b)
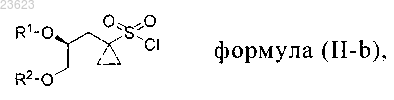
где R1 означает Н и R2 означает защитную группу для спиртовой группы; или
R2 означает Н и R1 означает защитную группу для спиртовой группы; или
оба R1 и R2 означают защитную группу для спиртовой группы; или
R1 и R2 вместе с атомами кислорода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы;
где защитные группы для спирта включают метоксиметил, бензилоксиметил, n-метоксибензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксициклогексил, метокситетрагидропиранил, тетрагидрофуранил, этоксиэтил, m-бутил, аллил, пропаргил, n-метоксибензил, пиколил, дифенилметил, трифенилметил, триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил, карбонаты, сульфонаты;
защитные группы для 1,2-диолов включают 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3-диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан.
3. Способ по п.1 или 2, где циклическая защитная группа для 1,2-диольной группы представляет собой 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3-диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан.
4. Способ по п.3, где циклическая защитная группа для 1,2-диольной группы представляет собой 2,2-диметил-1,3-диоксолан-4-ил.
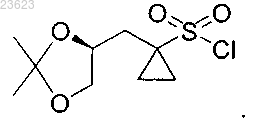
5. Соединение (R)-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид
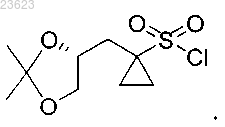
6. Соединение (S)-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид
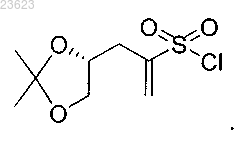
7. Соединение (R)-3-(2,2-диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид
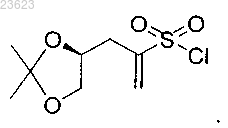
8. Соединение (S)-3-(2,2-диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид
Текст
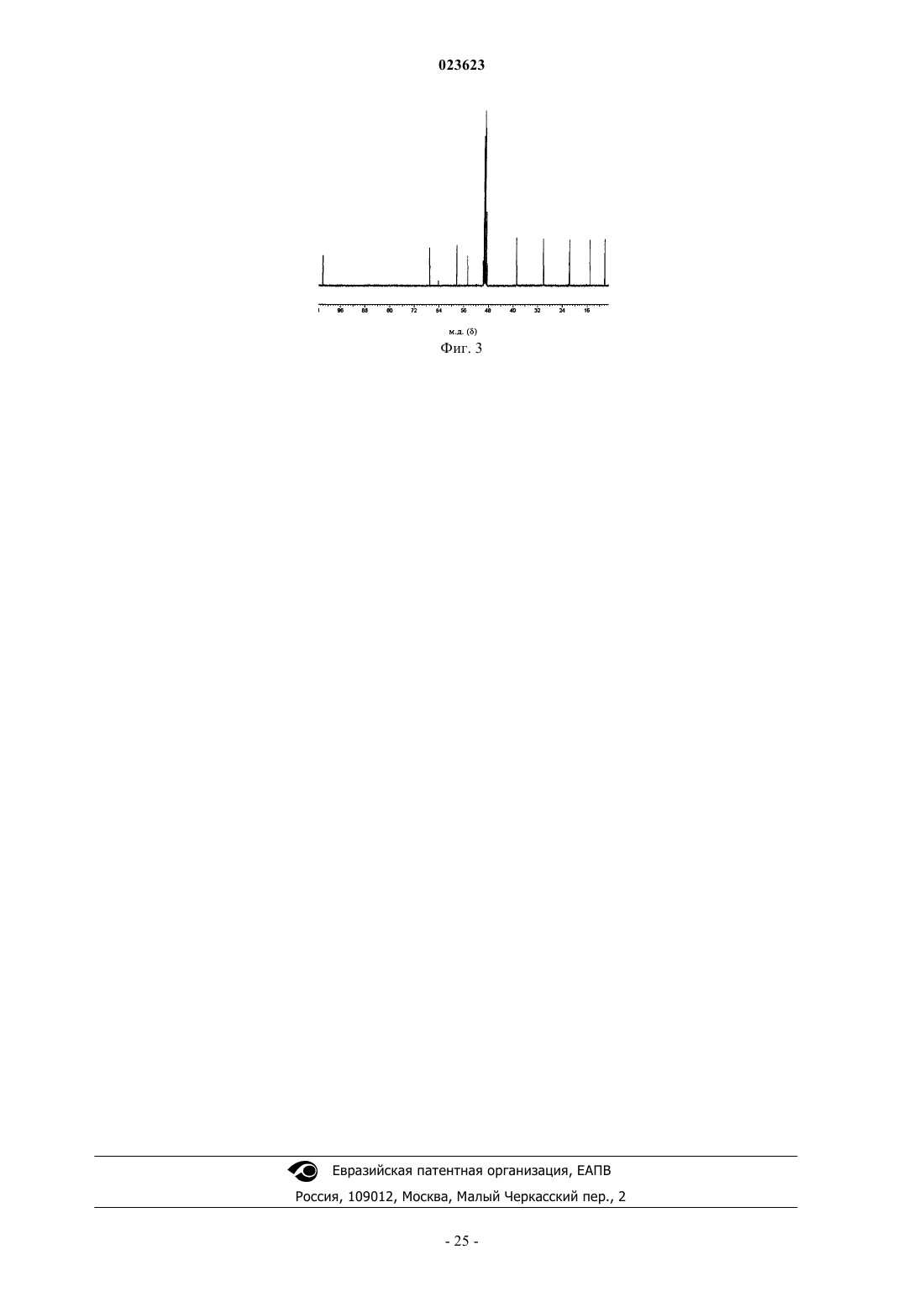
ПОЛУЧЕНИЕ ЗАЩИЩЕННЫХ ПРОИЗВОДНЫХ (R)- И (S)-N-(3,4 ДИФТОР-2-(2-ФТОР-4-ЙОДФЕНИЛАМИНО)-6-МЕТОКСИФЕНИЛ)-1-(2,3 ДИГИДРОКСИПРОПИЛ)ЦИКЛОПРОПАН-1-СУЛЬФОНАМИДА Изобретение относится к получению соединений формул (I-а) и (I-b) Предпосылки создания изобретения Настоящее изобретение относится к областям фармацевтической химии и синтетической органической химии.(R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамид и (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид являются известными соединениями, обладающими ингибирующими свойствами относительно MEK ферментов и имеют терапевтическую ценность (см. опубликованную заявку на патент США US 2008/0058340 А 1). В данной заявке описываются способы их получения. Краткое изложение сущности изобретения В данной заявке обеспечиваются способы получения соединений формулы (I-а) которые включают введение во взаимодействие метоксибензол-1,2-диамина с соединением формулы (II-а) 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3 где R1 означает Н и R2 означает защитную группу для спиртовой группы; илиR2 означает Н и R1 означает защитную группу для спиртовой группы; или оба R1 и R2 означают защитную группу для спиртовой группы; илиR1 и R2 вместе с атомами кислорода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы; где защитные группы для спирта включают метоксиметил, бензилоксиметил, n-метоксибензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксициклогексил, метокситетрагидропиранил, тетрагидрофуранил, этоксиэтил, m-бутил, аллил, пропаргил, n-метоксибензил, пиколил, дифенилметил, трифенилметил, триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил, карбонаты, сульфонаты; защитные группы для 1,2-диолов включают 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3 диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан. В некоторых вариантах осуществления соединение формулы (I-а) представляет собой (R)-N-(3,4 дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамид В некоторых вариантах осуществления соединение формулы (II-а) представляет собой (R)-1-2,2 диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Также в данной заявке обеспечиваются способы получения соединений формулы (I-b) которые включают введение во взаимодействие метоксибензол-1,2-диамина с соединением формулы (II-b) 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3 где R1 означает Н и R2 означает защитную группу для спиртовой группы; илиR2 означает Н и R1 означает защитную группу для спиртовой группы; или оба R1 и R2 означают защитную группу для спиртовой группы; илиR1 и R2 вместе с атомами кислорода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы; где защитные группы для спирта включают метоксиметил, бензилоксиметил, n-метокси-1 023623 бензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксицикло гексил, метокситетрагидропиранил, тетрагидрофуранил, этоксиэтил, m-бутил, аллил, пропаргил, n-метоксибензил, пиколил, дифенилметил, трифенилметил, триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил, карбонаты, сульфонаты; защитные группы для 1,2-диолов включают 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3 диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан. В некоторых вариантах осуществления соединение формулы (I-b) представляет собой (S)-N-(3,4 дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамид В некоторых вариантах осуществления соединение формулы (II-b) представляет собой (S)-1-2,2 диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид(R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамида включает введение во взаимодействие соединения формулы (I-а) с кислотой, основанием или нуклеофилом; или экспонирование соединения формулы (I-а) УФ-излучением где R1 означает Н или защитную группу для спиртовой группы;R2 означает Н или защитную группу для спиртовой группы; илиR1 и R2 вместе с атомами углерода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы. Соединение формулы (I-а) представляет собой (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамид(S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамида, включает введение во взаимодействие соединения формулы (I-b) с кислотой, основанием или нуклеофилом; или экспонирование соединения формулы (I-b) УФ-излучением где R1 означает Н или защитную группу для спиртовой группы;R2 означает Н или защитную группу для спиртовой группы; илиR1 и R2 вместе с атомами углерода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы. Соединение формулы (I-b) представляет собой (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамид-2 023623 В некоторых вариантах осуществления R1 означает Н и R2 означает защитную группу для спиртовой группы. В дальнейших или дополнительных вариантах осуществления R2 означает Н и R1 означает защитную группу для спиртовой группы. В дальнейших или дополнительных вариантах осуществления оба R1 и R2 означают защитную группу для спиртовых групп. В дальнейших или дополнительных вариантах осуществления оба R1 и R2 означают водород. В дальнейших или дополнительных вариантах осуществления защитные группы являются одинаковыми. В дальнейших или дополнительных вариантах осуществления защитные группы являются разными. В дальнейших или дополнительных вариантах осуществления R1 и R2 вместе с атомами углерода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы. В дальнейших или дополнительных вариантах осуществления циклическая защитная группа для 1,2-диольной группы представляет собой 5-членную циклическую защитную группу для 1,2-диольной группы. В дальнейших или дополнительных вариантах осуществления циклическая защитная группа для 1,2-диольной группы представляет собой 2,2-диметил-1,3 диоксолан-4-ил. Также в данной заявке обеспечиваются соединения, пригодные для получения (R)-N(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1 сульфонамида или (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида. В некоторых вариантах осуществления обеспечиваются соединения (R)-1-2,2-диметил-1,3 диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид и В некоторых вариантах осуществления обеспечиваются соединения (R)-3-(2,2-диметил-1,3 диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид и (S)-3-(2,2-диметил-1,3-диоксолан-4-ил)проп-1-ен-2 сульфонилхлорид Включение признаков путем ссылки Все публикации и заявки на патенты, упоминаемые в данном описании изобретения, включены посредством ссылки в той же самой степени, как если бы для каждой отдельной публикации или заявки на патент было специально и индивидуально указано, что она включена посредством ссылки. Краткое описание чертежей Новые признаки изобретения подробно излагаются в прилагаемой формуле изобретения. Лучшего понимания признаков и преимуществ настоящего изобретения будет достигнуто путем ссылки на следующее подробное описание, которое предлагает иллюстративные варианты осуществления, в которых используются принципы изобретения, и прилагаемые чертежи, где: фиг. 1 представляет три ЖХВР следа N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида, где верхний след 1(а) является ЖХВР следом сырого вещества, инжектированного вместе с аутентичным образцом (-) энантиомера (полученного путем хирального разделения рацемической смеси обоих изомеров); средний след 1(b) является ЖХВР следом сырого вещества и нижний след 1(с) является ЖХВР следом сырого вещества, инжектированного вместе с аутентичным образцом (+) энантиомера (полученного путем хирального разделения рацемиче-3 023623 ской смеси обоих изомеров); фиг. 2 представляет 1H ЯМР спектр (S)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1 сульфоната натрия в CD3OD; фиг. 3 представляет 13 С ЯМР спектр (S)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1 сульфоната натрия в CD3OD. Подробное описание изобретения В то время как предпочтительные варианты осуществления настоящего изобретения показаны и описаны в данном описании, для специалиста в данной области техники будет очевидно, что такие варианты осуществления предоставлены исключительно с целью иллюстрации. Многочисленные вариации,изменения и замены могут быть осуществлены специалистом в данной области техники без отклонения от настоящего изобретения. Следует понимать, что различные альтернативы вариантам осуществления изобретения, описанным здесь, могут использоваться при осуществлении изобретения. Подразумевается,что объем изобретения определяет следующая ниже формула изобретения, и что способы и структуры в рамках объема этой формулы изобретения и их эквиваленты таким образом покрываются. Часто необходимо иметь альтернативные способы получения полезных соединений. В данной заявке описаны разнообразные способы получение (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида и (S)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида, которые, как известно, обладают ингибирующими свойствами относительно ферментов MEK.I. Получение соединений. Способ химического синтеза. Рассмотрение ниже предлагается для иллюстрации того, каким образом, в принципе, получить доступ к соединениям, заявленным в настоящем изобретении, и предоставления деталей некоторых из множества способов, доступных для применения в синтезе соединений изобретения. Тем не менее, это рассмотрение не предназначено для определения или ограничения рамок реакций или последовательностей реакций, которые являются пригодными для получения соединений настоящего изобретения. Соединения настоящего изобретения могут быть получены с помощью порядка действий и методик, раскрытых в разделе "Примеры" ниже, так же, как и с помощью известных методик органического синтеза. Способы, известные практикующему среднему специалисту в данной области техники, могут быть установлены через различные справочники и базы данных. Пригодные справочники и научные труды,которые подробно описывают синтез реагентов, пригодных для получения соединений, описанных в данной заявке, или предоставляют ссылки на статьи, которые описывают получение, включают, например, "Synthetic Organic Chemistry", John WileySons, Inc., Нью-Йорк; S.R. Sandier и др., "Organic Functional Group Preparations," 2-е изд., Academic Press, Нью-Йорк, 1983; H.O. House, "Modern Synthetic Reactions", 2-е изд., W.A. Benjamin, Inc. Менло Парк, Калиф. 1972; Т. L. Gilchrist, "Heterocyclic Chemistry", 2-е изд., John WileySons, Нью-Йорк, 1992; J. March, "Advanced Organic Chemistry: Reactions, Mechanismsand Structure", 4-e изд., Wiley-Interscience, Нью-Йорк, 1992. Дополнительные пригодные справочники и научные труды, которые подробно описывают синтез реагентов, пригодных для получения соединений,описанных в данной заявке, или предоставляют ссылки на статьи, которые описывают получение, включают, например, Fuhrhop, J. and Penzlin G. "Organic Synthesis: Concepts, Methods, Starting Materials", Second, Revised and Enlarged Edition (1994) John WileySons ISBN: 3-527-29074-5; Hoffman, R.V. "OrganicUllmann's Encyclopedia" (1999) John WileySons, ISBN: 3-527-29645-Х, в 8 т.; "Organic Reactions" (19422000) John WileySons, в более 55 т. и "Chemistry of Functional Groups" John WileySons, в 73 т. В общем, соединения, используемые в реакциях, описанных в данном описании, могут быть получены в соответствии с методиками органического синтеза, которые известны специалисту в данной области техники, исходя из доступных для приобретения химических реагентов и/или из соединений, описанных в химической литературе. "Доступные для приобретения химические реагенты" могут быть получены из обычных коммерческих источников, включая Acros Organics (Питсбург, Пенсильвания), Aldrich Chemical (Милуоки, Висконсин, в том числе Sigma Chemical and Fluka), Apin Chemicals Ltd. (Милтон Парк, Соединенное Королевство), Avocado Research (Ланкашир, Соединенное Королевство), BDHChemical Co. (Рокфорд, Иллинойс), Riedel de Haen AG (Ганновер, Германия), Spectrum Quality Product,Inc. (Нью-Брансуик, Нью-Джерси), TCI America (Портленд, Орегон), Trans World Chemicals, Inc. (Роквилл, Мэриленд), и Wako Chemicals USA, Inc. (Ричмонд, Вирджиния). Особые и аналогичные реагенты также могут быть идентифицированы через индексы известных химических реагентов, составленные химической реферативной службой (Chemical Abstract Service),подразделением Американского химического общества, которые доступны в большинстве публичных и университетских библиотек так же, как и через онлайн базы данных. Химических реагенты, которые известны, но не доступны для приобретения в каталогах, могут быть получены обычными фирмами химического синтеза, причем многие из стандартных фирм-поставщиков химических реагентов (например,перечисленных выше) предоставляют услуги синтеза на заказ. Способ А. Ахиральный синтез с последующим хиральным разделением. Ахиральный синтезN-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамида был описан ранее (см. опубликованную заявку на патент США US 2008/0058340 А 1) и обобщен ниже на схеме 1. Продукт получают в виде рацемической смеси (R)- и (S)-энантиомеров, которую разделяют с помощью хиральной ЖХВР. Схема 1. Ахиральный синтез N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамида Способ В. Синтез из хиральных исходных веществ. Схемы 2 а, 3 а, 4 а, 5 а и 6 а показывают пути синтеза, с помощью которых можно было бы получить(R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид, и они рассмотрены ниже. Схемы 2b, 3b, 4b, 5b и 6b показывают пути синтеза, с помощью которых можно было бы получить (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид, и они рассмотрены ниже. Схема 2 а. Способ В, путь I. Циклопропильную группу вводят по концах алкена диол-защищенного 4-йодпент 4-ен-1,2-диола, с образованием защищенного производного 3-(1-йодциклопропил)пропан-1,2-диола, которое затем сульфонилируют. Сочетание с 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2 диамином и заключительное снятие защиты дает (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид, (S)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид или рацемическую смесь, в зависимости от используемого исходного вещества. Способ В, путь II. В способе, который незначительно отличается от вышеуказанного пути А, реакция циклопропанирования может быть проведена после сочетания с диариламином. Диол-защищенный 4-йодпент-4-ен-1,2-диол превращают в сульфонилхлорид и затем сочетают с 5,6-дифтор-N1-(2-фтор-4 йодфенил)-3-метоксибензол-1,2-диамином. Аминные функциональности защищают, при необходимости,алкен превращают в циклопропильную группу и в заключение какие-либо остающиеся защитные группы удаляют при необходимости с получением (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида, (S)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида или рацемической смеси, в зависимости от используемого исходного вещества. Оба из этих путей требуют в качестве исходного вещества диол-защищенный 4-йодпент-4-ен-1,2 диол, который может быть получен в соответствии со следующей схемой. Схема 3 а. (R)-Диол-защищенный 4-йодпент-4-ен-1,2-диол(R/S)-(+/-)-смеси. Спирт может быть защищен, например, с помощью реакции с тбутилдиметилсилилхлоридом, или другой пригодной защитной группой. Альтернативно, TBS защищенный глицидол имеется в продаже в виде (R)-энантиомера, (S)-энантиомера или (R/S)-(+/-)-рацемической смеси. Сочетание с защищенным ацетиленом, с последующим снятием защиты и йодированием реагентом, таким как 9-йод-9 борабицикло[3.3.1]нонан (9-I-BBN), обеспечивает 4-йодпент-4-ен-1,2-диол, который затем защищают по диольной группе. Необходимо отметить, что несмотря на то, что при этом синтезе не происходит инверсии стереохимии, использование в качестве исходного вещества (R)-(+)-глицидола будет приводить к образованию(S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида; использование в качестве исходного вещества (S)-(-)-глицидола будет приводить к образованию (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамида. Способ В. Диол-защищенный 1-(2,3-дигидроксипропил)циклопропан-1-сульфонилхлорид. В некоторых вариантах осуществления используют промежуточное соединение диол-защищенный 1-(2,3-дигидроксипропил)циклопропан-1-сульфонилхлорид. 1,2-Диол-защитные группы хорошо известны в уровне техники и включают такие как, но не ограничиваются только ими, 1,3-диоксолан, 2-метил 1,3-диоксолан, 2,2-диметил-1,3-диоксолан, 2-тбутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4 диоксаспиро[4.5]декан, ди-пара-метоксибензилоксиметиловый простой эфир, ди-тбутилдиметилсилил простой эфир и т.п. Схемы синтеза для получения сульфонилхлорида обеспечиваются ниже. Путь i Сочетание защищенного глицидола с циклопропансульфонатным сложным эфиром, таким как бутилциклопропансульфонат, дает бутил 1-(2-гидрокси-3-защищенный-гидроксипропил)циклопропан-1 сульфонат. Превращение сульфоната в сульфонилхлорид обеспечивает сульфонилхлоридное производное, 1-(2-гидрокси-3-защищенный-гидроксипропил)циклопропан-1-сульфонилхлорид, который затем сочетают с 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамином. Удаление каких-либо оставшихся защитных групп, при необходимости, дает (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид, (S)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид или рацемическую смесь, в зависимости от используемого исходного вещества. Способ В, путь IV. Схема 5 а. 5,6-Дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамин сочетают с циклопропансульфонилхлоридом с обеспечением N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)циклопропансульфонамида. Аминные группы при необходимости защищают, используя пригодные защитные группы, такие как, но не ограничиваются только ими, пропил, ди-пропил, пара-метоксибензил, ди-параметоксибензил, циклические группы и т.п.N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)циклопропансульфонамид сочетают с защищенным глицидолом, что после заключительного удаления защитных групп, при необходимости, дает (R)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид,(S)-N-(3,4 дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид или рацемическую смесь, в зависимости от используемого глицидола. 5,6-Дифтор-N1-(2-фтор-4-йодфенил)-3-метокси-N1-защищенный бензол-1,2-диамин обрабатывают тионилхлоридом, превращая первичный амин в тиазат. Сочетание с диол-защищенным (1-(2,3 дигидроксипропил)циклопропил)литием дает сульфинамидное производное, которое окисляют до сульфонамида. Заключительное удаление защитных групп, при необходимости, дает (R)-N-(3,4-дифтор-2-(2 фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид, (S)-N(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1 сульфонамид или рацемическую смесь, в зависимости от используемого исходного вещества. Способ С 1. Синтез с использованием хиральных реагентов - (i) хиральное эпоксидирование Хиральное эпоксидирование (наприм. эпоксидирование по Якобсену (J. Am. Chem. Soc., 1991, 113,7063-7064 или J. Am. Chem. Soc, 2003,125, 5250-5251) с использованием гипохлорита натрия/Mnсаленового катализатора; или эпоксидирование по Ши (J. Org. Chem., 2007, 72, 4093-4097) с использованием глюкоза-производных кетонов и оксона, защищенного по аминогруппе 1-аллил-N-(3,4-дифтор-2-(2 фтор-4-йодфениламино)-6-метоксифенил)циклопропан-1-сульфонамида, с последующим раскрытием эпоксидного цикла и удалением защитных групп, при необходимости, дает целевые хиральные продукты. Способ С 2. Синтез с использованием хиральных реагентов - (ii) хиральное окисление кетона Окислительное расщепление (наприм. озонолиз или окисление по Лемье-Джонсону) защищенного по аминогруппе 1-аллил-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)циклопропан-1-9 023623 сульфонамида, с последующим превращением в -гидроксикетон, хиральное восстановление кетона (наприм. восстановление по Кори, CBS) и удаление защитных групп при необходимости дает целевые хиральные продукты. Способ С 3. Синтез с использованием хиральных реагентов - (iii) хиральное окисление алкенов где L означает хиральный вспомогательный агент. Защита 1-аллил-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)циклопропан-1 сульфонамида в виде трифторацетамида с последующим асимметрическим дигидроксилированием (наприм. асимметрическим дигидроксилированием по Шарплессу) и удаление защитных групп при необходимости дает целевые хиральные продукты. Способ С 4. Синтез из хиральных исходных веществ. Схема 7 а ниже показывает синтетический путь получения (R)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида. Схема 7b ниже показывает синтетический путь получения (S)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида. Схема 7 а. (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид Сочетание диол-защищенного 1-(2,3-дигидроксипропил)циклопропан-1-сульфонилхлорида с 5,6 дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамином обеспечивает диол-защищенный продукт. В некоторых случаях сочетание может быть выполнено при повышенных температурах. Заключительное снятие защиты дает (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3 дигидроксипропил)циклопропан-1-сульфонамид,(S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид или рацемическую смесь, в зависимости от используемого исходного вещества. Условия снятия защиты будут зависеть от используемых защитных групп(-ы) и известны специалисту в области органической химии. Способы получения диол-защищенного 1-(2,3-дигидроксипропил)циклопропан-1 сульфонилхлорида включают следующее. Путьi. Через сочетание глицидола с ацетиленом/галогенирование/циклопропанирование/сульфонилирование(R/S)-(+/-)-смеси. Спирт может быть защищен, например, с помощью реакции с тбутилдиметилсилилхлоридом (TBS-C1) или другой пригодной защитной группой. Альтернативно, TBS защищенный глицидол имеется в продаже в виде (R)-энантиомера, (S)-энантиомера или (RS)-(+/-)-рацемической смеси. Сочета- 10023623 ние с защищенным ацетиленом, (=-PG2) с последующим снятием защиты и йодированием реагентом,таким как 9-йод-9-борабицикло[3.3.1]нонан (9-I-BBN), обеспечивает 4-йодпент-4-ен-1,2-диол, который затем защищают по диольной группе. Циклопропильную группу вводят по концах алкена диолзащищенного 4-йодпент-4-ен-1,2-диола, с образованием защищенного производного 3-(1 йодциклопропил)пропан-1,2-диола, которое затем сульфонилируют. Необходимо отметить, что несмотря на то, что при этом не происходит инверсии стереохимии, использование в качестве исходного вещества(R)-(+)-глицидола будет приводить к образованию (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида; использование в качестве исходного вещества (S)-(-)-глицидола будет приводить к образованию (R)-N-(3,4-дифтор-2-(2-фтор-4 йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида. Путь ii. Через 3,3'-(1,1'-дисульфандиил-бис-(циклопропан-1,1-диилдипропан-1,2-диольное промежуточное соединение (где PG3=2,2-диметил-1,3-диоксолан). Путь ii-a Промежуточное соединение 1,2-бис-(1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропил) дисульфан может быть получено либо непосредственно путем реакции 1,2-дициклопропилдисульфана с 4(бромметил)-2,2-диметил-1,3-диоксоланом (путь ii-a) или путем сочетания 1,2-дициклопропилдисульфана с трет-бутилдиметил(оксиран-2-илметокси)силаном, с последующим удалением TBS защитной группы и защитой получающегося диола (путь ii-b). 1,2-бис-(1-2,2-Диметил-1,3-диоксолан-4 ил)метил)циклопропил)дисульфан может быть превращен в сульфонилхлорид непосредственно (путь iic) либо через сульфонатную соль, которую затем превращают в хлорид (путь ii-d). Альтернативно, дисульфан может быть восстановлен до сульфида, который затем окисляют до сульфоната и превращают в сульфонилхлорид (путь ii-e). Путь ii-cII. Защитные группы. В описанных реакциях, может существовать необходимость в защите химически активных спиртовых и/или аминных функциональных групп. Защитные группы применяют для блокирования некоторых или всех спиртовых и/или аминных функциональных групп для предупреждения их участия в химических реакциях до тех пор, пока защитную группу не удаляют. В некоторых вариантах осуществления, где- 11023623 требуется несколько защитных групп, каждую защитную группу снимают различными способами. В других вариантах осуществления, где требуется несколько защитных групп, разнообразные защитные группы снимают одинаковыми способами. В некоторых вариантах осуществления, где требуется несколько защитных групп, одна защитная группа может быть использована для защиты различных функциональностей (наприм. циклическая группа). Защитные группы могут быть удалены путем обработки кислотой, основанием, нуклеофилом, гидрогенолиза или путем экспонирования УФ-излучением или комбинацией перечисленного. Например, группы, такие как тритильная, диметокситритильная, ацетальная и m-бутилдиметилсилильная являются неустойчивыми к действию кислот; группы, такие как метильная, этильная и ацетильная являются неустойчивыми к действию оснований, а группы, такие как mбутилкарбаматная и бензильная удаляют гидролитически. Другими формами защитных групп являются смола, к которой может быть присоединено соединение или промежуточное соединение. До тех пор пока остаток присоединен к смоле, эта функциональная группа является блокированной и не может вступать в реакции. Как только упомянутую функциональную группу отщепить от смолы, она становится способной вступать в реакции. Другие защитные группы, плюс описания методик, пригодных для присоединения и удаления защитных групп, описаны в работе "Protecting Groups in Organic Synthesis" авт. Greene.Wuts, 3-e изд., 1999, John Wiley and Sons, Inc., Нью-Йорк, штат Нью-Йорк, включенной в данное описание путем ссылки. В некоторых вариантах осуществления требуются промежуточные соединения, содержащие защищенные спиртовые группы. Защитные группы для спирта хорошо известны специалисту в области органической химии, и хорошо описаны в литературе (см., например, "Protecting Groups in Organic Synthesis" авт. GreeneWuts, 3-e изд., 1999, John Wiley and Sons, Inc., Нью-Йорк, штат Нью-Йорк; глава 2 - "Protection for the Hydroxyl Group, Including 1,2-and 1,3-Diols'). Примеры защитных групп для спирта включают,но не ограничиваются только ими, замещенные метиловые простые эфиры, такие как метоксиметил, бензилоксиметил, n-метоксибензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксициклогексил,метокситетрагидропиранил, тетрагидрофуранил; замещенные этиловые простые эфиры, такие как этоксиэтил, m-бутил, аллил, пропаргил; замещенные бензиловые простые эфиры, такие как n-метоксибензил,пиколил, дифенилметил, трифенилметил; силиловые простые эфиры, такие как триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил; сложные эфиры, карбонаты,сульфонаты и т.п. В некоторых вариантах осуществления требуются промежуточные соединения, содержащие защищенные 1,2-диольные группы. Защитные группы для 1,2-диолов хорошо известны специалисту в области органической химии. Примеры защитных групп для 1,2-диолов включают, но не ограничиваются только ими, 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3-диоксолан, 2-тбутил-1,3-диоксолан, 2-фенил 1,3-диоксолан, 1,4-диоксаспиро[4.5]декан, ди-пара-метоксибензилоксиметиловый простой эфир, дит бутилдиметилсилиловый простой эфир и т.п. Примеры Примеры и синтезы, обеспеченные ниже, дополнительно иллюстрируют и служат примерами соединений настоящего изобретения и способов получения таких соединений. Следует понимать, что объем настоящего изобретения не ограничен, так или иначе, объемом следующих примеров и синтезов. Пример 1. (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид трет-BuLi (12.4 мл, 1.7 М, 21.1 ммоль) добавляют к раствору TMS-ацетилена (2.12 г, 21.7 ммоль) в ТГФ (40 мл) при -78 С и реакционную смесь перемешивают в течение дополнительных 30 мин. Добавляют (R)-трет-бутилдиметил(оксиран-2-илметокси)силан (2 г, 10.6 ммоль) и BF3EtO2 (3 г, 21.1 ммоль) и перемешивают при -78C в течение 4.5 ч. Реакцию затем гасят путем добавления водного раствора хлорида аммония и смесь экстрагируют этилацетатом (350 мл). Объединенные органические слои промывают соляным раствором, сушат (MgSO4) и концентрируют при пониженном давлении с получением целевого вещества с количественным выходом. Вещество используют на следующей стадии без дополнительной очистки. Стадия В. (R)-1-(трет-Бутилдиметилсилилокси)пент-4-ин-2-ол Карбонат калия (2.14 г, 15.5 ммоль) добавляют к раствору (R)-1-(трет-бутилдиметилсилилокси)-5(триметилсилил)пент-4-ин-2-ола (3 г, 10.6 ммоль) в метаноле (100 мл) и смесь перемешивают при комнатной температуре в течение 8 ч. Растворитель удаляют при пониженном давлении и к получающемуся маслу добавляют водный раствор хлорида аммония (100 мл). Смесь экстрагируют этилацетатом (350 мл). Объединенные органические слои промывают соляным раствором, сушат (MgSO4) и концентрируют при пониженном давлении. Сырое вещество очищают с помощью флэш-хроматографии (biotage), используя градиент EtOAc в гексане с получением (R)-1-(трет-бутилдиметилсилилокси)пент-4-ин-2-ола 9-Йод-9-борабицикло[3.3.1]нонан (9-I-BBN) по каплям добавляют к раствору (R)-1-(третбутилдиметилсилилокси)пент-4-ин-2-ола (476 мг, 2.22 ммоль) в дихлорметане (2 мл) при 0C и реакционную смесь перемешивают при 0C в течение 4 ч. Затем добавляют ледяную уксусную кислоту (0.26 мл) и смесь перемешивают в течение дополнительного часа при 0C. Реакцию гасят путем добавления водной смеси Na2CO3/Na2S2O3 (40 мл, 1:1) и получающийся раствор экстрагируют этилацетатом (330 мл). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением (R)-4-йодпент-4-ен-1,2-диола. 1 Раствор (R)-4-йодпент-4-ен-1,2-диола (224 мг, 1 ммоль) в ТГФ (6 мл) охлаждают до 0C и по каплям добавляют пиридин (293 мг, 3.7 ммоль) и трет-бутилдиметилсилил трифторметансульфонат (TBSOTf). Реакционную смесь нагревают до комнатной температуры, перемешивают в течение дополнительных 20 мин и растворители удаляют при пониженном давлении. Сырое вещество растворяют в хлороформе,промывают соляным раствором, сушат (MgSO4), концентрируют при пониженном давлении, и очищают с помощью флэш-хроматографии, используя градиент этилацетата в гексане, с получением (R)-5-(2 йодаллил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (254 мг, 56%). 1Трифторуксусную кислоту (ТФУ; 281 мг, 2.47 ммоль) добавляют к раствору диэтилцинка (ZnEt2,2.5 мл, 2.5 М в гексане) в ДХЭ (1 мл) при 0C и перемешивают в течение 35 мин. Затем при 0C добавляют дийодметан (CH2I2, 66 мг, 2.5 ммоль) и смесь перемешивают в течение дополнительных 20 мин. Добавляют раствор (R)-5-(2-йодаллил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (стадия D; 188 мг, 0.41 ммоль) в ДХЭ (2 мл) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию затем гасят путем добавления смеси метанола (5 мл) и соляного раствора (0.5 мл). После перемешивания в течение дополнительного часа, смесь концентрируют при пониженном давлении. Сырое вещество экстрагируют водн. NH4Cl/CHCl3 и органический слой промывают соляным рас- 13023623 твором, сушат (MgSO4) и концентрируют при пониженном давлении. Сырое вещество растирают в гексане и раствор фильтруют и упаривают с получением (R)-5-1-йодциклопропил)метил)-2,2,3,3,8,8,9,9 октаметил-4,7-диокса-3,8-дисшгадекана (148 мг, 77%). 1 Водный раствор HCl (0.3 мл, 1 н.) добавляют к раствору (R)-5-1-йодциклопропил)метил)2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (стадия Е, 281 мг, 0.598 ммоль) в ТГФ (2 мл) при 0C. Смесь медленно нагревают при комнатной температуре и перемешивают в течение 24 ч. Реакцию гасят путем добавления водного раствора NaHCO3 и экстрагируют этилацетатом. Объединенные органические слои промывают соляным раствором, сушат (MgSO4) и концентрируют при пониженном давлении с обеспечением (R)-3-(1-йодциклопропил)пропан-1,2-диола (0.598 ммоль), который используют на следующей стадии без дополнительной очистки. Стадия G. (R)-4-1-Йодциклопропил)метил)-2,2-диметил-1,3-диоксолан 2,2-Диметоксипропан (140 мг, 1.337 ммоль) и n-толуолсульфонат пиридиния (PPTS, 6 мг) добавляют к раствору сырого (R)-3-(1-йодциклопропил)пропан-1,2-диола (стадия F, 0.598 ммоль), растворенного в дихлорметане (3 мл), и смесь перемешивают при комнатной температуре в течение 2 ч. Растворители удаляют при пониженном давлении и сырой продукт очищают с помощью флэш-хроматографии, используя элюант этилацетат/гексан (1:10) с получением (R)-4-1-йодциклопропил)метил)-2,2-диметил 1,3-диоксолана (84 мг, 50%). 1 трет-Бутиллитий (0.2 мл, 304 ммоль, 1.7 М) добавляют к раствору (R)-4-1 йодциклопропил)метил)-2,2-диметил-1,3-диоксолана (стадия G, 45 мг, 0.16 ммоль) в эфире (1 мл) при 78C, и смесь перемешивают при -78C в течение 30 мин. Затем добавляют раствор тионилхлорида (26 мкл) в эфире (0.5 мл). Получающийся оранжевый раствор нагревают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, фильтруют и сушат при пониженном давлении с получением (R)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1 сульфонилхлорида (23.7 мг, 57%). m/z=255 [М+1]-. Стадия I. (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2-диметил-1,3 диоксолан-4-ил)метил)циклопропан-1-сульфонамид Раствор 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамина (22 мг, 0.065 ммоль) в сухом пиридине (0.8 мл) добавляют к (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамиду (стадия h) и смесь перемешивают при комнатной температуре в течение ночи. Растворитель затем удаляют при пониженном давлении и остаток растворяют в этилацетате, промывают соляным раствором, сушат (MgSO4) и концентрируют с получением сырого (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2 диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамида, который используют на следующей стадии без дополнительной очистки. m/z=611 [М-1]-. Стадия- 14023623 и перемешивают в течение ночи при комнатной температуре. Растворители удаляют при пониженном давлении, и остаток растворяют в этилацетате. Органическую фазу промывают водным NaHCO3, сушат(Na2SO4) и концентрируют с получением (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6 метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида (1.4 мг, сырой). Соединение анализировали с помощью ЖХВР с нормальными фазами, используя колонку CHIRALPAK AD-H (20250 мм) при комнатной температуре, и используя подвижную фазу, состоящую из гексана и 2-пропанола(80:20) при 12 мл/мин. Детектирование проводили при 254 нм. Время удержания определяли равным 22 мин., что соответствовало времени удержания (+)N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)фенил)-1(2,3-дигидроксипропил) циклопропан-1-сульфонамида. Фиг. 1(а) представляет ЖХВР след сырого вещества, инжектированного вместе с аутентичным образцом (-) энантиомера (полученного с помощью хирального разделения рацемической смеси обоих изомеров). Фиг. 1(b) представляет ЖХВР след сырого вещества. Фиг. 1(с) представляет ЖХВР след сырого вещества, инжектированного вместе с аутентичным образцом (+) энантиомера (полученного с помощью хирального разделения рацемической смеси обоих изомеров). Пример 2. трет-Бутиллитий (2 экв.) добавляют к раствору TMS-ацетилена (2 экв.) в ТГФ при -78C и реакционную смесь перемешивают в течение дополнительных 30 мин. Добавляют (S)-третбутилдиметил(оксиран-2-илметокси)силан (1 экв.) и BF3.EtO2 (2 экв.) и перемешивают при -78C в течение 4.5 ч. Реакцию гасят путем добавления водного раствора хлорида аммония и экстрагируют этилацетатом (3). Объединенные органические слои промывают соляным раствором, сушат (MgSO4) и концентрируют при пониженном давлении с получением (S)-1-(трет-бутилдиметилсилилокси)-5(триметилсилил)пент-4-ин-2-ола. Стадия В. (S)-1-(трет-Бутилдиметилсилилокси)пент-4-ин-2-ол Карбонат калия (1.5 экв.) добавляют к раствору (R)-1-(трет-бутилдиметилсилилокси)-5(триметилсилил)пент-4-ин-2-ола (1 экв.) в метаноле и смесь перемешивают при комнатной температуре в течение 8 ч. Растворитель удаляют при пониженном давлении и добавляют водный раствор хлорида аммония. Смесь экстрагируют этилацетатом (3) и объединенные органические слои промывают соляным раствором, сушат (MgSO4), концентрируют при пониженном давлении и очищают с помощью флэшхроматографии (biotage), используя градиент EtOAc в гексане. Стадия С. (S)-4-Йодпент-4-ен-1,2-диол 9-Йод-9-борабицикло[3.3.1]нонан (9-I-BBN) по каплям добавляют к раствору (S)-1-(третбутилдиметилсилилокси)пент-4-ин-2-ола в дихлорметане при 0C и реакционную смесь перемешивают при 0C в течение 4 ч. Добавляют ледяную уксусную кислоту и смесь перемешивают в течение дополнительного часа при 0C. Реакцию гасят путем добавления водной смеси Na2CO3/Na2S2O3 (40 мл, 1:1), экстрагируют этилацетатом (3) и объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением (S)-4-йодпент-4-ен-1,2-диола. Раствор (S)-4-йодпент-4-ен-1,2-диола (1 экв.) в ТГФ охлаждают до 0C, и по каплям добавляют пиридин (3.7 экв.) и трет-бутилдиметилсилил трифторметансульфонат (TBSOTf). Реакционную смесь нагревают до комнатной температуры, перемешивают в течение дополнительных 20 мин и растворители удаляют при пониженном давлении. Сырое вещество растворяют в хлороформе, промывают соляным раствором, сушат (MgSO4), концентрируют при пониженном давлении и очищают с помощью флэшхроматографии, используя градиент этилацетата в гексане, с получением (S)-5-(2-йодаллил)2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана. Стадия Е. (S)-5-1-Йодциклопропил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекан Трифторуксусную кислоту (8 экв.) добавляют к раствору диэтилцинка (16 экв.) в ДХЭ при 0C и перемешивают в течение 35 мин. Дийодметан (8 экв.) добавляют при 0C и смесь перемешивают в течение дополнительных 20 мин. Добавляют раствор (S)-5-(2-йодаллил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса 3,8-дисиладекана (1 экв.) в ДХЭ и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят путем добавления смеси метанола и соляного раствора. После перемешивания в течение дополнительного часа, смесь концентрируют при пониженном давлении. Сырое вещество экстрагируют водным NH4Cl/CHCl3 и органический слой промывают соляным раствором, сушат (MgSO4) и концентрируют при пониженном давлении. Сырое вещество растирают в гексане и раствор фильтруют и упаривают с получением (S)-5-1-йодциклопропил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8 дисиладекана. Стадия F. (S)-3-(1-Йодциклопропил)пропан-1,2-диол Водный раствор HCl добавляют к раствору (S)-5-1-йодциклопропил)метил)-2,2,3,3,8,8,9,9 октаметил-4,7-диокса-3,8-дисиладекана в ТГФ при 0C. Смесь медленно нагревают до комнатной температуры и перемешивают в течение 24 ч. Реакцию гасят путем добавления водного раствора NaHCO3, экстрагируют этилацетатом и объединенные органические слои промывают соляным раствором, сушат(MgSO4) и концентрируют при пониженном давлении с обеспечением (S)-3-(1-йодциклопропил)пропан 1,2-диола (0.598 ммоль). Стадия G. (S)-4-1-Йодциклопропил)метил)-2,2-диметил-1,3-диоксолан 2,2-Диметоксипропан и n-толуолсульфонат пиридиния добавляют к раствору (S)-3-(1 йодциклопропил)пропан-1,2-диола, растворенного в дихлорметане, и смесь перемешивают при комнатной температуре в течение 2 ч. Растворители удаляют при пониженном давлении и сырой продукт очищают с помощью флэш-хроматографии, используя элюант этилацетат/гексан (1:10). Стадия Н. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид трет-Бутиллитий (2 экв.) добавляют к раствору (S)-4-1-йодциклопропил)метил)-2,2-диметил-1,3 диоксолана (1 экв.) в эфире при -78C и смесь перемешивают при -78C в течение 30 мин. Добавляют раствор тионилхлорида в эфире, смесь нагревают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, фильтруют и сушат при пониженном давлении. Стадия I. (S)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2-диметил-1,3 диоксолан-4-ил)метил)циклопропан-1-сульфонамид Раствор 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамина в сухом пиридине добавляют к (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонамиду и смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении, и остаток растворяют в этилацетате, промывают соляным раствором, сушат (MgSO4) и концентрируют.(S)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропан-1-сульфонамид растворяют в смеси ТГФ и HCl и перемешивают в течение ночи при комнатной температуре. Растворители удаляют при пониженном давлении, и остаток растворяют в этилацетате. Органическую фазу промывают водным NaHCO3, сушат (Na2SO4) и концентрируют. Пример 3. (R)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид Карбонат калия (2.14 г, 15.5 ммоль) добавляют к раствору (R)-1-(трет-бутилдиметилсилилокси)-5(триметилсилил)пент-4-ин-2-ола (3 г, 10.6 ммоль) в метаноле (100 мл) и смесь перемешивают при комнатной температуре в течение 8 ч. Растворитель удаляют при пониженном давлении и к получающемуся маслу добавляют водный раствор хлорида аммония (100 мл). Смесь экстрагируют этилацетатом (350 мл). Объединенные органические слои промывают соляным раствором, сушат (MgSO4) и концентрируют при пониженном давлении. Сырое вещество очищают с помощью флэш-хроматографии (biotage), используя градиент EtOAc в гексане, с получением (R)-1-(трет-бутилдиметилсилилокси)пент-4-ин-2-ола 9-Йод-9-борабицикло[3.3.1]нонан (9-I-BBN) по каплям добавляют к раствору (R)-1-(третбутилдиметилсилилокси)пент-4-ин-2-ола (476 мг, 2.22 ммоль) в дихлорметане (2 мл) при 0C и реакционную смесь перемешивают при 0C в течение 4 ч. Затем добавляют ледяную уксусную кислоту (0.26 мл) и смесь перемешивают в течение дополнительного часа при 0C. Реакцию гасят путем добавления водной смеси Na2CO3/Na2S2O3 (40 мл, 1:1) и получающийся раствор экстрагируют этилацетатом (330 мл). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением (R)-4-йодпент-4-ен-1,2-диола. 1 2,2-Диметоксипропан и n-толуолсульфонат пиридиния (PPTS) добавляют к раствору (R)-4-йодпент 4-ен-1,2-диола в дихлорметане и смесь перемешивают при комнатной температуре в течение 2 ч. Растворители удаляют при пониженном давлении и сырой продукт очищают с помощью флэш-хроматографии,используя элюант этилацетат/гексан (1:10). Стадия D. (R)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид-78C и смесь перемешивают при -78C в течение 30 мин. Затем добавляют раствор тионилхлорида в эфире, смесь нагревают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, фильтруют и сушат при пониженном давлении. Пример 4. (S)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид Карбонат калия добавляют к раствору (S)-1-(трет-бутилдиметилсилилокси)-5-(триметилсилил)пент 4-ин-2-ола в метаноле и смесь перемешивают при комнатной температуре в течение 8 ч. Растворитель удаляют при пониженном давлении, добавляют водный раствор хлорида аммония и смесь экстрагируют этилацетатом (3). Объединенные органические слои промывают соляным раствором, сушат (MgSO4),концентрируют при пониженном давлении и очищают с помощью флэш-хроматографии (biotage; градиент этилацетат/гексан). Стадия В. (S)-4-Йодпент-4-ен-1,2-диол 9-Йод-9-борабицикло[3.3.1]нонан (9-I-BBN) по каплям добавляют к раствору (S)-1-(третбутилдиметилсилилокси)пент-4-ин-2-ола в дихлорметане при 0C и реакционную смесь перемешивают при 0C в течение 4 ч. Добавляют ледяную уксусную кислоту и смесь перемешивают в течение дополнительного часа при 0C. Добавляют водную смесь Na2CO3/Na2S2O3 (1:1) и получающийся раствор экстрагируют этилацетатом (3). Объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении. Стадия С. (S)-4-(2-Йодаллил)-2,2-диметил-1,3-диоксолан 2,2-Диметоксипропан и n-толуолсульфонат пиридиния (PPTS) добавляют к раствору (S)-4-йодпент 4-ен-1,2-диола в дихлорметане и смесь перемешивают при комнатной температуре в течение 2 ч. Растворители удаляют при пониженном давлении и сырой продукт очищают с помощью флэш-хроматографии,используя элюант этилацетат/гексан (1:10). Стадия D. (S)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид-78C и смесь перемешивают при -78C в течение 30 мин. Затем добавляют раствор тионилхлорида в эфире, смесь нагревают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, фильтруют и сушат при пониженном давлении. Пример 5. (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-3-(2,2-диметил-1,3 диоксолан-4-ил)проп-1-ен-2-сульфонамид Раствор 9-бром-9-борабицикло[3.3.1]нонана (9-Br-BBN) в дихлорметане (1 М, 10.6 мл) по каплям добавляют к раствору (R)-1-(трет-бутилдиметилсилилокси)пент-4-ин-2-ола (755 мг, 3.53 ммоль) в дихлорметане (4 мл) при 0C и смесь перемешивают при 0C в течение 4 ч. Добавляют ледяную уксусную кислоту (0.65 мл, 11.35 ммоль) и перемешивание продолжают при 0C в течение дополнительного 1 ч. Этаноламин (2.5 мл, 41.5 ммоль) добавляют и смеси позволяют нагреться до комнатной температуры. Реакцию гасят путем добавления водной смеси Na2CO3/Na2S2O3 (40 мл, 1:1), экстрагируют этилацетатом(330 мл) и объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением (R)-4-бромпент-4-ен-1,2-диола. m/z=182[M+1]-. Стадия В. (R)-4-(2-Йодаллил)-2,2-диметил-1,3-диоксолан 2,2-Диметоксипропан (993 мг, 9.5 ммоль) и n-толуолсульфонат пиридиния (PPTS, 320 мг, 1.27 ммоль) добавляют к раствору (R)-4-бромпент-4-ен-1,2-диола (1.15 г, 6.36 ммоль) в дихлорметане (15 мл) и смесь перемешивают при комнатной температуре в течение 4 ч. Растворители удаляют при пониженном давлении, и сырой продукт очищают с помощью флэш-хроматографии (элюант этилацетат:гексан,1:10) с получением (R)-4-(2-йодаллил)-2,2-диметил-1,3-диоксолана (1.12 г, 80%). Раствор трет-бутиллития в гексане (1.7 М, 7.65 мл) по каплям добавляют к раствору (R)-4-(2 йодаллил)-2,2-диметил-1,3-диоксолана (1.21, 6.5 ммоль) в диэтиловом эфире (12 мл) при -78C, и реакционную смесь перемешивают при -78C в течение 30 мин. Добавляют сульфурилдихлорид (SO2Cl2, 538 мкл, 6.5 ммоль), смесь нагревают до комнатной температуры и растворители удаляют при пониженном давлении. Продукт используют на следующей стадии без дополнительной очистки. Стадия D. (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-3-(2,2-диметил-1,3 диоксолан-4-ил)проп-1-ен-2-сульфонамид(R)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид из стадии С растворяют в пиридине (12 мл) и добавляют 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамин (2.56 г,6.5 ммоль). Раствор перемешивают при 100C в течение 2 ч и затем распределяют между водой и этилацетатом. Органический слой промывают соляным раствором, сушат (MgSO4), концентрируют при пониженном давлении и очищают с помощью колоночной флэш-хроматографии на силикагеле (элюант 30% этилацетат/гексаны) с получением Раствор 9-бром-9-борабицикло[3.3.1]нонана (9-Br-BBN) в дихлорметане по каплям добавляют к раствору (S)-1-(трет-бутилдиметилсилилокси)пент-4-ин-2-ола в дихлорметане при 0C и смесь перемешивают при 0C в течение 4 ч. Добавляют ледяную уксусную кислоту и перемешивание продолжают при 0C в течение дополнительного 1 ч. Добавляют этаноламин и смеси позволяют нагреться до комнатной температуры. Реакцию гасят путем добавления водной смеси Na2CO3/Na2S2O3 (1:1), экстрагируют этилацетатом (3) и объединенные органические слои сушат (MgSO4) и концентрируют при пониженном давлении с получением (S)-4-бромпент-4-ен-1,2-диола. Стадия В. (S)-4-(2-Йодаллил)-2,2-диметил-1,3-диоксолан 2,2-Диметоксипропан (7.5 экв.) и n-толуолсульфонат пиридиния (1 экв.) добавляют к раствору (R)4-бромпент-4-ен-1,2-диола (5 экв.) в дихлорметане и смесь перемешивают при комнатной температуре в течение 4 ч. Растворители удаляют при пониженном давлении и сырой продукт очищают с помощью флэш-хроматографии (10% этилацетат/гексан, элюант). Стадия С. (S)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид Раствор трет-бутиллития в гексане (1.7 М, 2 экв.) по каплям добавляют к раствору (S)-4-(2 йодаллил)-2,2-диметил-1,3-диоксолана (1 экв.) в диэтиловом эфире при -78C и реакционную смесь перемешивают при -78C в течение 30 мин. Добавляют сульфурил дихлорид (1 экв.), смесь нагревают до- 19023623 комнатной температуры и растворители удаляют при пониженном давлении. Стадия D. (S)-N-(3,4-Дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-3-(2,2-диметил-1,3 диоксолан-4-ил)проп-1-ен-2-сульфонамид(S)-3-(2,2-Диметил-1,3-диоксолан-4-ил)проп-1-ен-2-сульфонилхлорид (1 экв.) растворяют в пиридине и добавляют 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3-метоксибензол-1,2-диамин (1 экв.). Раствор перемешивают при 100C в течение 2 ч и затем распределяют между водой и этилацетатом. Органический слой промывают соляным раствором, сушат (MgSO4), концентрируют при пониженном давлении и очищают с помощью колоночной флэш-хроматографии на силикагеле (30% этилацетат/гексаны элюант). Пример 7. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид н-Бутиллитий (1.7 М в гексане, 1.2 экв.) по каплям добавляют в течение 1 ч к раствору 1,2 дициклопропилдисульфана (1 экв.) в ТГФ (1.5 мл/ммоль) при -20C. Затем при -78C добавляют (S)-4(бромметил)-2,2-диметил-1,3-диоксолан (1.1 экв.) и перемешивание при -78C продолжают в течение дополнительных 4 ч. Добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом (3). Объединенные органические экстракты сушат (Na2SO4) и очищают с помощью флэшхроматографии (элюант этилацетат в гексане). Стадия В. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид(NCS, 1 экв.) и смесь охлаждают до 10C. Раствор 1,2-бис-(1-R)-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропил)дисульфана (2.5 экв.) в ацетонитриле (0.25 мл/ммоль) по каплям добавляют к смеси, которую перемешивают при температуре ниже 20C в течение 20 мин. Добавляют ди-изопропиловый простой эфир (15 мл/ммоль) и отделенный органический слой промывают соляным раствором, сушат (Na2SO4), концентрируют при пониженном давлении и сырое вещество очищают с помощью флэш-хроматографии (элюант этилацетат в гексане); см. Nishiguchi и др., Synthesis, 2006, 24,4131-4134 для дополнительных подробностей. Пример 8. 1,2-бис-(1-S)-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропил)дисульфан н-Бутиллитий (1.7 М в гексане, 1.2 экв.) по каплям добавляют в течение 1 ч к раствору 1,2 дициклопропилдисульфана (1 экв.) в ТГФ (1.5 мл/ммоль) при -20C. Затем при -78C добавляют (R)-4(бромметил)-2,2-диметил-1,3-диоксолан (1.1 экв.) и перемешивание при -78C продолжают в течение дополнительных 4 ч. Добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом (3). Объединенные органические экстракты сушат (Na2SO4) и очищают с помощью флэшхроматографии (элюант этилацетат в гексане). Стадия В. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлоридN-Хлорсукцинимид (NCS, 1 экв.) добавляют к смеси 2 М HCl (0.6 мл/ммоль) и ацетонитрила (3.4 мл/ммоль) и охлаждают до 10C. Раствор 1,2-бис-(1-S)-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропил)дисульфана (2.5 экв.) в ацетонитриле (0.25 мл/ммоль) по каплям добавляют к смеси, которую перемешивают при температуре ниже 20C в течение 20 мин. Добавляют ди-изопропиловый простой эфир (15 мл/ммоль) и отделенный органический слой промывают соляным раство- 20023623 ром, сушат (Na2SO4), концентрируют при пониженном давлении и сырое вещество очищают с помощью флэш-хроматографии (элюант этилацетат в гексане); см. Nishiguchi и др., Synthesis, 2006, 24, 4131-4134 для дополнительных подробностей. Пример 9. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид 30% пероксид водорода (9 экв.) добавляют к раствору 1,2-бис-(1-R)-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропил)дисульфана (1 экв.) и ацетата натрия (2 экв.) в уксусной кислоте (5 мл/ммоль). Раствор нагревают при 80C в течение 1 ч, охлаждают, концентрируют при пониженном давлении и сырое вещество очищают с помощью перекристаллизация; см. Fernandez-Bolanos, и др., Carbohydrate Research, 1988, 173(1), 33-40, для дополнительных подробностей. Стадия В. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Раствор (R)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфоната натрия (1 экв.) и фосфорилтрихлорида (POCl3, 0.7 мл/ммоль) нагревают при 80C в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, выливают на лед, перемешивают в течение 30 мин и экстрагируют хлороформом (2). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Пример 10. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид 30% пероксид водорода (9 экв.) добавляют к раствору 1,2-бис-(1-S)-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропил)дисульфана (1 экв.) и ацетата натрия (2 экв.) в уксусной кислоте (5 мл/ммоль). Раствор нагревают при 80C в течение 1 ч, охлаждают, концентрируют при пониженном давлении и сырое вещество очищают с помощью перекристаллизации; см. Fernandez-Bolanos, и др., Carbohydrate Research, 1988,173(1), 33-40, для дополнительных подробностей. Стадия В. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Раствор (S)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфоната натрия (1 экв.) и фосфорилтрихлорида (POCl3, 0.7 мл/ммоль) нагревают при 80C в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, выливают на лед, перемешивают в течение 30 мин и экстрагируют хлороформом (2). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Пример 11. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Стадия A. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропантиол Раствор 1,2-бис-(1-R)-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропил)дисульфана (1 экв.) и трифенилфосфина в смеси диоксана и воды (4/1), содержащей две капли концентрированной соляной кислоты, перемешивают при 40C в течение 20 мин и концентрируют при пониженном давлении. Сырое вещество очищают с помощью флэш-хроматографии (элюант этилацетат в гексане); см. Overman и др.,Synthesis, 1974, 59-60 для дополнительных подробностей. Ггидроксид натрия (4 экв.) добавляют к раствору (R)-1-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропантиола (1 экв.) в ДМФА (0.5 мл/ммоль), перемешивают при комнатной температуре в течение ночи и гидролизуют. Смесь экстрагируют этилацетатом (3) и объединенные органические слои сушат (MgSO4), концентрируют при пониженном давлении и сырое вещество перекристаллизовывают. Стадия С. (R)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Раствор (R)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфоната натрия (1 экв.) и фосфорилтрихлорида (POCl3, 0.7 мл/ммоль) нагревают при 80C в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, выливают на лед, перемешивают в течение 30 мин и экстрагируют хлороформом (2). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Пример 12. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Раствор 1,2-бис-(1-S)-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропил)дисульфана (1 экв.) и трифенилфосфина в смеси диоксана и воды (4/1), содержащей две капли концентрированной соляной кислоты, перемешивают при 40C в течение 20 мин и концентрируют при пониженном давлении. Сырое вещество очищают с помощью флэш-хроматографии (элюант этилацетат в гексане); см. Overman и др.,Synthesis, 1974, 59-60 для дополнительных подробностей. Стадия В. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонат натрия Гидроксид натрия (4 экв.) добавляют к раствору (S)-1-2,2-диметил-1,3-диоксолан-4 ил)метил)циклопропантиола (1 экв.) в ДМФА (0.5 мл/ммоль), и перемешивают при комнатной температуре в течение ночи и гидролизуют. Смесь экстрагируют этилацетатом (3) и объединенные органические слои сушат (MgSO4), концентрируют при пониженном давлении и сырое вещество перекристаллизовывают. Стадия С. (S)-1-2,2-Диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид Раствор (S)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфоната натрия (1 экв.) и фосфорилтрихлорида (POCl3, 0.7 мл/ммоль) нагревают при 80C в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, выливают на лед, перемешивают в течение 30 мин и экстрагируют хлороформом (2). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Пример 13. Фиг. 2 демонстрирует 1 Н ЯМР спектр (S)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан 1-сульфоната натрия в CD3OD. 1 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I-а) который включает введение во взаимодействие метоксибензол-1,2-диамина с соединением формулы (II-а) 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3 где R1 означает Н и R2 означает защитную группу для спиртовой группы; илиR2 означает Н и R1 означает защитную группу для спиртовой группы; или оба R1 и R2 означают защитную группу для спиртовой группы; илиR1 и R2 вместе с атомами кислорода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы; где защитные группы для спирта включают метоксиметил, бензилоксиметил, nметоксибензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксициклогексил, метокситетрагидропиранил, тетрагидрофуранил, этоксиэтил, m-бутил, аллил, пропаргил, n-метоксибензил, пиколил, дифенилметил, трифенилметил, триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил, карбонаты, сульфонаты; защитные группы для 1,2-диолов включают 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3 диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан. 2. Способ получения соединения формулы (I-b) который включает введение во взаимодействие метоксибензол-1,2-диамина с соединением формулы (II-b) 5,6-дифтор-N1-(2-фтор-4-йодфенил)-3 где R1 означает Н и R2 означает защитную группу для спиртовой группы; илиR2 означает Н и R1 означает защитную группу для спиртовой группы; или оба R1 и R2 означают защитную группу для спиртовой группы; илиR1 и R2 вместе с атомами кислорода, к которым они присоединены, образуют циклическую защитную группу для 1,2-диольной группы; где защитные группы для спирта включают метоксиметил, бензилоксиметил, nметоксибензилоксиметил, m-бутоксиметил, тетрагидропиранил, метоксициклогексил, метокситетрагидропиранил, тетрагидрофуранил, этоксиэтил, m-бутил, аллил, пропаргил, n-метоксибензил, пиколил, дифенилметил, трифенилметил, триметилсилил, триизопропилсилил, m-бутилдиметилсилил, трибензилсилил, трифенилсилил, карбонаты, сульфонаты; защитные группы для 1,2-диолов включают 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3 диоксолан, 2-m-бутил-1,3-диоксолан, 2-фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан. 3. Способ по п.1 или 2, где циклическая защитная группа для 1,2-диольной группы представляет собой 1,3-диоксолан, 2-метил-1,3-диоксолан, 2,2-диметил-1,3-диоксолан, 2-m-бутил-1,3-диоксолан, 2 фенил-1,3-диоксолан, 1,4-диоксаспиро[4.5]декан. 4. Способ по п.3, где циклическая защитная группа для 1,2-диольной группы представляет собой 2,2-диметил-1,3-диоксолан-4-ил. 5. Соединение (R)-1-2,2-диметил-1,3-диоксолан-4-ил)метил)циклопропан-1-сульфонилхлорид
МПК / Метки
МПК: C07C 309/82, C07C 303/40, C07C 309/85, C07C 303/38, C07C 311/28
Метки: получение, защищенных, s)-n-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида, производных
Код ссылки
<a href="https://eas.patents.su/26-23623-poluchenie-zashhishhennyh-proizvodnyh-r-i-s-n-34-diftor-2-2-ftor-4-jjodfenilamino-6-metoksifenil-1-23-digidroksipropilciklopropan-1-sulfonamida.html" rel="bookmark" title="База патентов Евразийского Союза">Получение защищенных производных (r)- и (s)-n-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамида</a>
Предыдущий патент: Производное фенантроиндолизидина и ингибитор nfkb, содержащий его в качестве активного ингредиента
Следующий патент: Паровой двигатель и способ его работы
Случайный патент: Способ и перевалочная система для перегрузки или, соответственно, погрузки по меньшей мере одной грузовой единицы