Ароматические амиды, способ их получения и их применение в качестве лекарственных средств
Номер патента: 3275
Опубликовано: 24.04.2003
Авторы: Лорэн Патрик, Асслейн Жан-Люк, Клиш Мишель, Перье Анн-Мари, Мусицки Бранислав
Формула / Реферат
1. Соединения формулы (I)
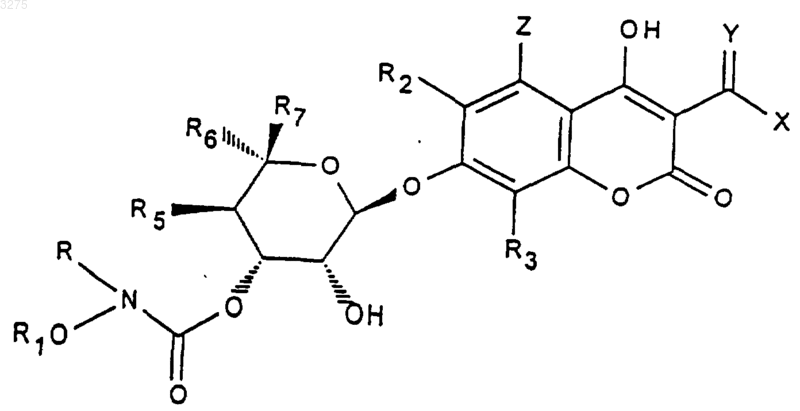
в которой Y означает атом кислорода или радикал N-Nалк1 или NOалк2 в котором алк1 и алк2 означают радикал алкил, содержащий до 12 атомов углерода, при необходимости прерванный одним или несколькими атомами кислорода, серы или азота, при необходимости замещенный одним или несколькими атомами галогена, радикалом арил [при необходимости замещенным одним или несколькими атомами галогена], гетероциклическим радикалом, одним или несколькими радикалами
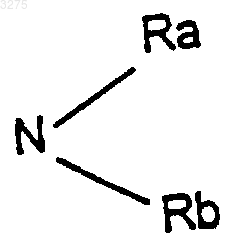
в котором Ra и Rb одинаковые или различные означают атом водорода, радикал алкил, содержащий до 8 атомов углерода, при необходимости замещенный, или Ra и Rb образуют вместе с атомом азота, с которым они соединены, гетероцикл, который может содержать также другой гетероатом, выбираемый из кислорода, серы или азота,
X означает атом водорода, гидроксильный радикал, радикал алкил, алкенил или алкинил, при необходимости прерванный одним или несколькими атомами кислорода, серы или азота, линейный, разветвленный или циклический, содержащий до 12 атомов углерода, при необходимости замещенный одним или несколькими атомами галогена, гетероциклическим радикалом, одним или несколькими радикалами OH, свободными или тарифицированными группой Cу N, NO2,
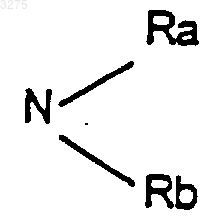
в которой Ra и Rb, одинаковые или разные, означают атом водорода, радикал алкил, содержащий до 8 атомов углерода, или Ra и Rb вместе с атомом азота, с которым они связаны, образуют гетероцикл, содержащий при необходимости другой гетероатом, выбираемый из азота, серы или кислорода, или X означает радикал алкокси или радикал
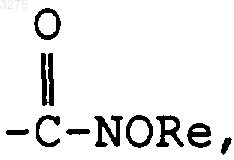
в котором Re означает радикал алкил, содержащий до 8 атомов углерода, при необходимости замещенный одним или несколькими заместителями, указанными выше,
или X означает радикал NRcRd, в котором Rc и Rd, одинаковые или разные, означают атом водорода или радикал алкил, содержащий до 12 атомов углерода, при необходимости замещенный одним или несколькими заместителями, указанными выше; или Rc и Rd образуют вместе с атомом азота, с которым они связаны, гетероцикл, содержащий при необходимости другой гетероатом, выбираемый из азота, серы или кислорода,
Z означает атом водорода или галогена или группу OH, свободную или превращенную в простой или сложный эфир,
R2 означает атом водорода или галогена,
R3 означает атом водорода, радикал алкил, содержащий до 8 атомов углерода, или атом галогена,
R означает атом водорода или радикал алкил, содержащий до 4 атомов углерода,
R1 означает атом водорода, радикал алкил, алкенил или алкинил, линейный, разветвленный или циклический, содержащий до 8 атомов углерода, при необходимости замещенный одним или несколькими атомами галогена, радикал Cу N, радикал арил, содержащий до 14 атомов углерода,
R5 означает атом водорода, радикал O-алкил, содержащий до 4 атомов углерода,
или R6 означает радикал алкил или CH2-O-алкил, в котором алкил означает содержащий до 8 атомов углерода радикал, а также этенил и пропенил,
R7 означает атом водорода или радикал алкил, содержащий до 8 атомов углерода,
или R6 и R7 вместе с атомом углерода, с которым они связаны, образуют цикл, содержащий до 8 атомов углерода,
а также соли соединения формулы (I), когда соединения формулы (I) имеют основную функцию.
2. Соединения формулы (I) по п.1, в которых Y означает атом кислорода.
3. Соединения формулы (I), в которых Y означает радикал NO-алкил, в котором алкил содержит до 4 атомов углерода.
4. Соединения формулы (I) по п.3, в которых Y означает радикал NOC2H5.
5. Соединения формулы (I) по любому из пп.1-4, в которых X означает радикал алкил, содержащий до 4 атомов углерода, и в частности радикал CH3.
6. Соединения формулы (I) по любому из пп.1-4, в которых X означает радикал NH2.
7. Соединения формулы (I) по любому из пп.1-4, в которых X означает радикал
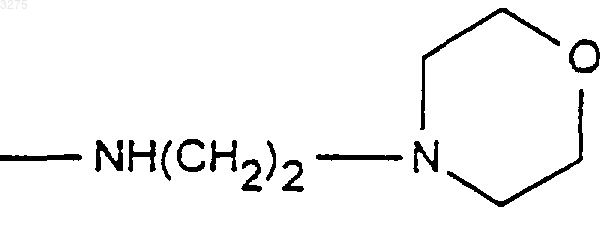
8. Соединения формулы (I) по любому из пп.1-7, в которых R1 означает радикал
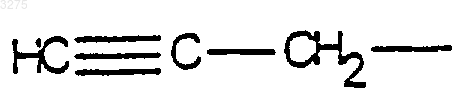
9. Соединения формулы (I) по любому из пп.1-8, в которых R означает атом водорода.
10. Соединения формулы (I) по любому из пп.1-9, в которых R3 означает радикал метил.
11. Соединения формулы (I) по любому из пп.1-10, в которых Z означает атом водорода.
12. Соединения формулы (I) по любому из пп.1-11, в которых R2 означает атом водорода.
13. Соединения формулы (I) по любому из пп.1-12, в которых R5 означает радикал OCH3.
14. Соединения формулы (I) по любому из пп.1-13, в которых R6 означает радикал метил.
15. Соединения формулы (I) по любому из пп.1-14, в которых R7 означает радикал метил.
16. Соединения формулы (I) по любому из пп.1-14, в которых R7 означает радикал этил.
17. Соединения формулы (I) по любому из пп.1-13, в которых R6 и вместе с атомом углерода, с которым они связаны, образуют радикал циклопентил.
18. Соединения формулы (I) по п.1, имеющие следующие наименования:
7-[[6-деокси-5-C-метил-4-O-метил-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8-метил-2-оксо-2H-1-бензопиран-3-карбоксамид, 3'-эфир (2-пропинилокси)карбаминовой кислоты,
7-[[6-деокси-5-C-метил-4-O-метил-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8-метил-N-[2-(4-морфолинил)этил]-2-оксо-2H-1-бензопиран-3-карбоксамид, 3'-эфир (2-пропинилокси)карбаминовой кислоты,
7-[[6-деокси-5-C-метил-4-O-метил-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2H-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты,
7-[(6-деокси-5-C-метил-4-O-метил-альфа-L-ликсогексопиранозил)окси]-3-)[1-(этоксиимино)этил]-4-гидрокси-8-метил-2Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты.
19. Соединения формулы (I) по п.1, имеющие следующие названия:
7-[(6-деокси-5-C-этил-4-O-метил-бета-D-гулопиранозил)окси]-4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2H-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты,
[7R-(7-альфа, 8-бета, 9-бета, 10-альфа)]-(2-пропинилокси)карбамат 8-гидрокси-7-[4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2-оксо-2H-1-бензопиран-7-ил]-10-метокси-6-оксаспиро[4.5]декан-9-ила.
20. Применение соединений формулы (I) по любому из пп.1-18, а также их фармацевтически приемлемые соли в качестве лекарственных средств.
21. Применение соединений формулы (I) по п.19, а также их фармацевтически приемлемые соли в качестве лекарственных средств.
22. Фармацевтические композиции, содержащие в качестве активного начала, по меньшей мере, одно лекарственное средство, определенное в п.20 или 21.
23. Способ получения соединений формулы (I), определенных по любому из пп.1-19, заключающийся в том, что соединение формулы (II)
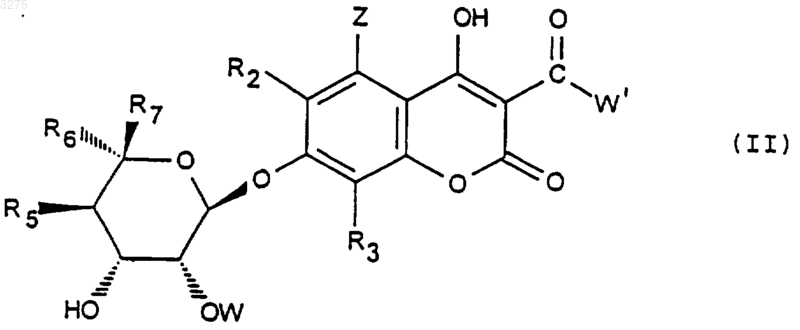
в которой радикалы R2, R3, Z, R5, R6 и R7 имеют указанное выше значение, OW означает блокированную гидроксильную группу, a W' означает радикал алкил или O-алкил, содержащий до 4 атомов углерода, подвергают
воздействию агента, способного вводить радикал
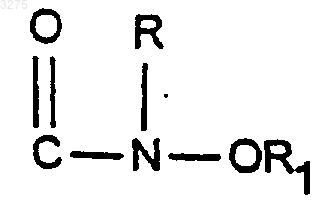
или ряду операций, способных вводить радикал

причем R и R1 имеют указанное выше значение,
воздействию агента, способного высвобождать гидроксильный радикал из радикала OW,
возможному воздействию агента, способного заменить W' на радикал X, отличный от алкила или O-алкила,
возможному воздействию агента, способного ввести радикал Y, отличный от кислорода,
возможному воздействию солеобразующего агента.
24. Применение соединений формулы (II), описанных в п.23, в качестве промежуточных соединений.
25. Способ по п.23, заключающийся в том, что соединение формулы (II) получено путем воздействия соединения формулы (III)
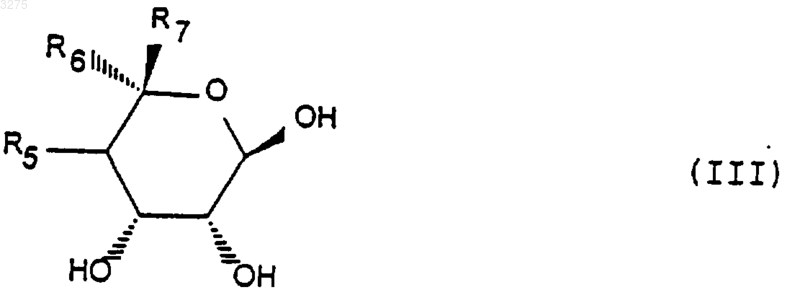
в которой R5, R6 и R7 имеют указанное выше значение, на соединение формулы (IV)
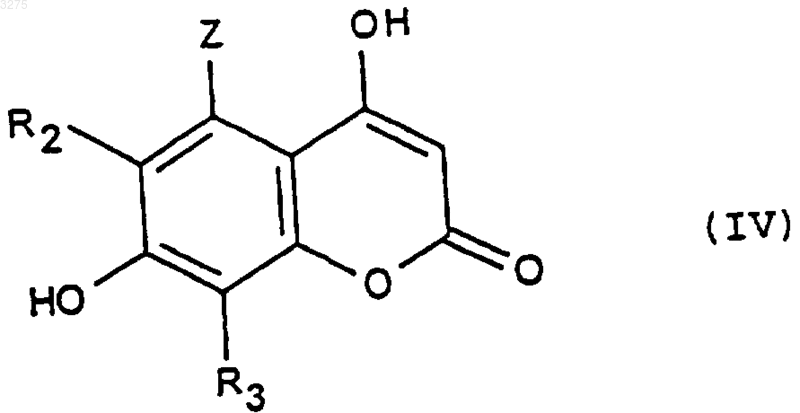
в которой R2, R3 и Z имеют указанное выше значение, затем воздействию агента, блокирующего свободный гидроксильный радикал.
26. Применение соединений формулы (III), описанных в п.25, таких как
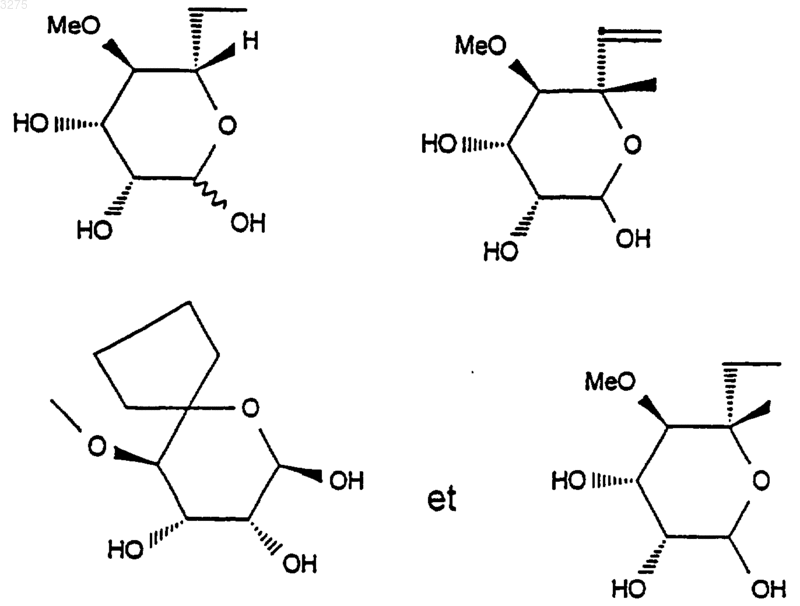
в качестве промежуточных соединений.
Текст
1 Настоящее изобретение касается новых ароматических амидов, способа их получения и их применения в качестве лекарственных средств. Объектом настоящего изобретения являются соединения формулы (I) в которой Y означает атом кислорода или радикал N-Nалк 1 или NOалк 2 в котором алк 1 и алк 2 означают радикал алкил, содержащий до 12 атомов углерода, при необходимости прерванный одним или несколькими атомами кислорода, серы или азота, при необходимости замещенный одним или несколькими атомами галогена, радикалом арил [при необходимости замещенным одним или несколькими атомами галогена], гетероциклическим радикалом, одним или несколькими радикалами в котором Ra и Rb, одинаковые или различные,означают атом водорода, радикал алкил, содержащий до 8 атомов углерода, при необходимости замещенный, или Ra и Rb образуют вместе с атомом азота, с которым они соединены, гетероцикл, который может содержать также другой гетероатом, выбираемый из кислорода, серы или азота,Х означает атом водорода, гидроксильный радикал, радикал алкил, алкенил или алкинил,при необходимости прерванный одним или несколькими атомами кислорода, серы или азота,линейный, разветвленный или циклический,содержащий до 12 атомов углерода, при необходимости замещенный одним или несколькими атомами галогена, гетероциклическим радикалом, одним или несколькими радикалами ОН,свободными или этерифицированными группой в которой Ra и Rb, одинаковые или разные, означают атом водорода, радикал алкил, содержащий до 8 атомов углерода, или Ra и Rb вместе с атомом азота, с которым они связаны, образуют гетероцикл, содержащий при необходимости другой гетероатом, выбираемый из азота,серы или кислорода, или Х означает радикал алкокси или радикал 2 замещенный одним или несколькими указанными выше заместителями,или Х означает радикал NRcRd, в которомRc и Rd, одинаковые или разные, означают атом водорода или радикал алкил, содержащий до 12 атомов углерода, при необходимости замещенный одним или несколькими, указанными выше заместителями; или Rc и Rd вместе с соединенным с ними атомом азота образуют гетероцикл,содержащий при необходимости другой гетероатом, выбираемый из азота, серы или кислорода,Z означает атом водорода или галогена или группу ОН, свободную или превращенную в простой или сложный эфир,R2 означает атом водорода или галогена,R3 означает атом водорода, радикал алкил,содержащий до 8 атомов углерода или атом галогена,R означает атом водорода или радикал алкил, содержащий до 4 атомов углерода,R1 означает атом водорода, линейный, разветвленный или циклический радикал алкил,алкенил или алкинил, содержащий до 8 атомов углерода, при необходимости замещенный одним или несколькими атомами галогена, радикал CN; радикал арил, содержащие до 14 атомов углерода,R5 означает атом водорода, радикал Oалкил, содержащий до 4 атомов углерода,или R6 означает радикал алкил или CH2-Oалкил, в котором алкил означает содержащий до 8 атомов углерода радикал алкил,R7 означает атом водорода или содержащий до 8 атомов углерода радикал алкил,или R6 и R7 вместе с атомом углерода, с которым они связаны, образуют цикл, содержащий до 8 атомов углерода, а также соли соединения формулы (I), когда соединения формулы(I) имеют основную функцию. В качестве примеров солей можно назвать также соли, образованные с уксусной, пропионовой, трифторуксусной, малеиновой, винной,метансульфоновой, бензолсульфоновой, паратолуолсульфоновой,соляной,бромистоводородной, йодисто-водородной, серной, фосфорной кислотой, а также со стеариновой, этилянтарной или лаурилсульфоновой кислотой. В определении заместителей:- радикал алкил, алкенил или алкинил предпочтительно обозначают радикал метил,этил, пропил, изопропил, н-бутил, изобутил,третбутил, децил, или додецил, винил, аллил,этинил, пропинил, циклобутил, циклопентил или циклогексил,- галоген предпочтительно обозначает атом фтора или хлора, или брома,- радикал арил предпочтительно обозначает радикал фенил,- гетероциклический радикал предпочтительно обозначает радикал пиррорил, пирролидинил, пиридил, пиразинил, пиримидил, пипе 3 ридинил, пиперазинил, хинуклидинил, оксазолил, изоксазолил, морфолинил, индолил, имидазолил, бензимидазолил, триазолил, тиазолил,азетидинил, азиридинил. Более конкретно объектом изобретения являются соединения формулы (I), в которой Y означает атом кислорода, соединения, в которыхY означает радикал NO-алкил, в котором радикал алкил содержит до 4-х атомов углерода, например соединения, в которых Y означает радикал NOC2H5. Среди предпочтительных соединений изобретения можно назвать соединения формулы Среди предпочтительных соединений согласно изобретению можно назвать соединения формулы (I), в которой R1 означает радикал соединения, в которых R означает атом водорода, или же соединения, в которых R3 означает радикал метил, или соединения, в которых Z означает атом водорода, или соединения, в которых R2 означает атом водорода,или соединения, в которых R5 означает радикал ОСН 3, или соединения, в которых R6 означает радикал метил, или соединения, в которых R7 означает радикал метил, соединения,в которых R7 означает радикал этил, соединения, в которых R6 и R7 вместе с атомом углерода, с которым они соединены, образуют радикал циклопентил. Среди предпочтительных соединений можно назвать соединения, получение которых описано ниже в экспериментальной части, в частности соединения 1, 2, 3, 4, 5 и 9. Соединения общей формулы (I) обладают высокой антибиотической активностью по отношению к грамбактериям, таким как стафилококки, стрептококки, пневмококки, энтерококки, листерия, анаэробные бактерии. Соединения согласно изобретению могут использоваться в качестве лекарственных средств при лечении инфекций, чувствительных к лекарствам, и в частности при лечении стафилококковых инфекций, таких как стафилококковый сепсис, злокачественные стафилококковые заболевания лица и кожи, пиодермиты, септические или гнойные язвы, фурункулы, карбункулы, флегмоны, рожистые воспаления и угри,при лечении таких стафилококковых инфекций как острые простые ангины или постгриппозные ангины, бронхопневмония, легочные нагноения, при лечении стрептококковых инфекций, таких как острые ангины, отиты, си 003275 4 нуситы, скарлатина, пневмококковых воспалений, таких как пневмония, бронхиты и дифтерия. Соединения настоящего изобретения активны также против инфекций, вызываемыхHaemophilus influenzae. Таким образом объектом настоящего изобретения являются соединения формулы (I) в качестве лекарственных средств. Более конкретно в качестве лекарственных средств могут использоваться соединения, которые указаны выше как предпочтительные. Объектом настоящего изобретения являются также фармацевтические композиции, содержащие в качестве активного начала, по меньшей мере, одно из вышесказанных лекарственных средств. Эти композиции могут вводиться через рот, ректальным путем, парентеральным путем или наносятся локально при топическом нанесении на кожу и на слизистые, но предпочтительный способ введения - это через рот или путем инъекции. Они могут быть твердыми или жидкими и представлять собой обычно используемые в медицине фармацевтические формы, например,простые или дражированные таблетки, капсулы,гранулы, свечи, инъецируемые препараты, мази,кремы, гели; эти фармацевтические формы получают в соответствии с обычными методиками приготовления. Активное начало может вводиться в эти фармацевтические композиции вместе с одним или несколькими эксципиентами, традиционно используемыми в фармацевтических композициях. Эксципиентами могут быть тальк, гуммиарабик, лактоза, крахмал,стеарат магния, масло какао, водные или неводные носители, жировые вещества растительного или животного происхождения, производные парафинов, гликоли, различные смачивающие агенты, диспергаторы, эмульгаторы, консерванты. Эти композиции могут находиться также в форме порошка, предназначенного для растворения перед самым употреблением в соответствующем носителе, например в апирогенной стерильной воде. Вводимая доза изменяется в зависимости от конкретного заболевания, пациента, способа приема и самого лекарственного средства. Она может составлять, например, от 50 до 3000 мг предпочтительных соединений в день для приема через рот или в виде инъекции для взрослого человека. Объектом данного изобретения является также способ получения соединений формулы(I), заключающийся в том, что соединение формулы (II) 6 Объектом настоящего изобретения является также способ, заключающийся в том, что соединение формулы (II) получают путем воздействия соединения формулы (III) в которой радикалы R2, R3, Z, R5, R6 и R7 имеют указанное выше значение, OW означает блокированную гидроксильную группу, a W означает радикал алкил или O-алкил, содержащий до 4 атомов углерода, подвергают в которой R5, R6 и R7 имеют указанное выше значение, на соединение формулы (IV) причем R и R1 имеют указанное выше значение,- воздействию агента, способного высвобождать гидроксильный радикал из радикалаOW,- возможному воздействию агента, способного заменить W' на радикал X, отличный от алкила или O-алкила,- возможному воздействию агента, способного ввести радикал Y отличный от кислорода,- возможному воздействию солеобразующего агента. Соединения формулы (II), используемые в качестве исходных в способе согласно изобретению, являются новыми соединениями, получение некоторых соединений формулы (II) описано ниже в экспериментальной части. Другие соединения формулы (II) могут быть синтезированы аналогично способам, описанным в экспериментальной части. Более конкретно изобретение относится к соединениям формулы (II), получение которых дается в экспериментальной части. Предпочтительный вариант осуществления изобретения заключается в том, что введение радикала осуществляют в несколько этапов, сначала действуют фенилхлорформиатом, замещенным или незамещенным, затем воздействуют соединением формулы R1OHR, в которой R1 и R имеют указанное выше значение, группу ОН блокируют в виде тетрагидрофурана, высвобождение гидроксильной группы осуществляют путем кислого гидролиза, например, путем воздействия паратолуолсульфоновой кислотой, возможное преобразование радикала W' в радикал Х и преобразование радикала Y осуществляют согласно классическим методам. Преобразование радикала Y осуществляют, в частности, воздействием амина. в которой R2, R3 и Z имеют указанное выше значение, затем путем воздействия агента, блокирующего свободный гидроксильный радикал. Нижеследующие соединения формулы (III) являются новыми соединениями и сами являются объектом настоящего изобретения, а именно Следующие примеры, не имеющие ограничительного характера, иллюстрируют данное изобретение. Приготовление 1. Этил-7-6-деокси-5-Сметил-4-O-метил-2-O-(тетрагидро-2 Н-пиран-2 ил)-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8-метил-2-оксо-2 Н-1-бензопиран-3-карбоксилат. СТАДИЯ А. Этил-7-[(6-деокси-5-С-метил 4-O-метил-альфа-L-ликсогексопиранозил)окси]-8-метил-2-оксо-4-(фенилметокси)-2 Н-1 бензопиран-3-карбоксилат. Перемешивают в атмосфере аргона раствор, содержащий 80 г этил-7-гидрокси-8-метил-2-оксо-4-(фенилметокси)-2 Н-1-бензопиран 3-карбоксилат в 1200 мл метиленхлорида. При температуре 0 С добавляют 52,07 г 6-деокси-5 С-метил-4-O-метил-L-ликсогексопиранозы и 71,22 г трифенилфосфина. При температуре 0 С вводят 54,78 мл диизопропилазокарбоксилата. Через час после начала реакции при комнатной температуре снова добавляют 34 г трифенилфосфина и 25,6 мл диизопропилазокарбоксилата. Перемешивают в(95-5). Когда продукт начинает проходить, продолжают элюирование смесью, содержащей 6% изопропилового спирта. После загущения в 700 мл смеси гексан/этилацетат (4-1) получают 64,4 г целевого продукта, который используют на следующей стадии. СТАДИЯ B. Этил-[(6-деокси-5-С-метил-4O-метил-3-O-(триэтилсилил)-альфа-L-ликсогексопиранозил)окси]-8-метил-2-оксо-4-(фенилметокси)-2 Н-1-бензопиран-3-карбоксилат. Перемешивают в атмосфере аргона при комнатной температуре 50 г раствора продукта,полученного на стадии А, в 500 мл метиленхлорида. Добавляют 42 мл диизопропилэтиламина и 9,68 г имидазола. Раствор перемешивают в течение 15 мин или охлаждают до 0 С, а затем в течение 30 мин прикапывают 20,64 мл триэтилхлорсилана и перемешивают в течение 2 ч при 0 С. Выливают реакционную смесь в молярный раствор первичного фосфата натрия. Экстрагируют метиленхлорид. Сушат и выпаривают досуха. Получают 66,27 г продукта, который очищают на двуокиси кремния, элюируя смесью метиленхлорида с 0,75% ацетона. Когда продукт практически выделен, элюируют раствором метиленхлорида, содержащим 1% ацетона. После загущения в смеси гексан/этилацетат (9-1) получают 41,04 г целевого продукта. ЯМР 1 Н (300 Мгц, СDСl3, ч/млн) 0,73 (к, 6 Н), 1,04 (т, 9 Н), 1,04 (с, 3 Н) 1,30(м, 1 Н) , 4,27 (дд, 1 Н, J=3,5 и 9 Гц), 4,43 (к, 2 Н) ,5,31 (с, 2 Н), 5,62 (д, 1 Н, J=2 Гц), 7,12 (д, 1 Н, J=9 Гц), 7,43 (м, 5 Н), 7,63 (д, 1 Н, J=9 Гц). СТАДИЯ C. Этил-7-6-деокси-5-С-метил 4-O-метил-2-O-(тетрагидро-2 Н-пиран-2-ил)-3-O(триэтилсилил)-альфа-L-ликсогексопиранозил] окси]-8-метил-2-оксо-4-(фенилметокси)-2 Н-1 бензопиран-3-карбоксилат. Раствор, содержащий 40,9 г продукта, полученного на предыдущей стадии, в 400 мл метиленхлорида перемешивают в атмосфере аргона при комнатной температуре. Добавляют несколько капель паратолуолсульфоновой кислоты, затем 11,54 мл дигидрофурана. Перемешивают в течение 2 ч при комнатной температуре. Добавляют 6 г бикарбоната натрия. Перемешивают суспензию в течение 15 мин. Разбавляют в 1000 мл смеси гексан/этилацетат (2-1) и выливают на воду. Декантируют, сушат органическую фазу над сульфатом натрия и выпаривают досуха. Получают 54,67 г продукта, который очищают, элюируя смесью гексан/этилацетат (4-1). Таким образом получают 36,83 г продукта. СТАДИЯ D. Этил-7-6-деокси-5-С-метил 4-O-метил-2-O-(тетрагидро-2 Н-пиран-2-ил)-3-O 003275(триэтилсилил)-альфа-L-ликсогексопиранозил] окси]-4-гидрокси-8-метил-2-оксо-2 Н-1-бензопиран-3-карбоксилат. Гидрируют 18 г продукта, полученного на предшествующей стадии, растворенного в 360 мл тетрагидрофурана, в присутствии 0,240 г палладия на угле. Фильтруют, катализатор промывают небольшим количеством тетрагидрофурана. Выпаривают 100 мл растворителя и получают раствор, который используют как таковой на следующей стадии. СТАДИЯ Е. Этил-7-6-деокси-5-С-метил 4-O-метил-2-O-(тетрагидро-2 Н-пиран-2-ил)-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8 метил-2-оксо-2 Н-1-бензопиран-3-карбоксилат. Охлаждают в атмосфере аргона при 0 С раствор, содержащий 15,31 г продукта, полученного на предшествующей стадии, в 250 мл тетрагидрофурана. По капле добавляют 31 мл тетрабутиламмонийфторида (1 М в ТГФ). Разбавляют реакционную среду с помощью 400 мл смеси гексан/этилацетат (1-2). Добавляют 300 мл 10%-ного раствора вторичного сульфата натрия и декантируют. Сушат и выпаривают досуха. Растворяют полученный неочищенный продукт в 20 мл этилового эфира, охлаждают до-10 С и добавляют при перемешивании 80 мл пентана. Перемешивают полученную суспензию при -20 С, фильтруют при -16 С. Промывают полученный продукт пентаном и сушат. Получают 9,4 г целевого продукта. Приготовление 2. 3-Ацетил-7-6-деокси-5 С-метил-4-O-метил-2-O-(тетрагидро-2 Н-пиран 2-ил)-альфа-L-ликсогексопиранозил]окси]-4 гидроки-8-метил-2 Н-1-бензопиран-2-он. СТАДИЯ А. 4-(Дифенилметокси)-8-метил 7-(тетрагидро-2 Н-пиран-2-ил)-2 Н-1-бензопиран 2-он. Вводят 55 г 4-гидрокси-8-метил-7-(тетрагидро-2 Н-пиран-2-ил)-2 Н-1-бензопиран-2-она в 250 мл безводного диметилформамида, нагретого до 40 С, и добавляют по капле раствор из 58,3 г дифенилдиазометана в 250 мл диметилформамида. Добавление осуществляют в течение 3 ч при температуре 40 С. Снова добавляют несколько порций по 3 г дифенилдиазометана и перемешивают в течение часа при 40 С. Выливают реакционную среду на 2 л этилового эфира. Промывают органический раствор водным раствором бикарбоната натрия,раствором едкого натра (0,1 М) водой и рассолом. Выпаривают досуха. Остаток перемешивают в смеси изопропиловый эфир/гексан (1-2). Отжимают и сушат нерастворенный продукт. Получают 20,5 г целевого продукта. Тонкослойная хроматография CH2Cl2AcOEt (95-5). Rf = 0,44. СТАДИЯ В. 4-(Дифенилметокси)-7 гидрокси-8-метил-2 Н-1-бензопиран-2-он. Добавляют 35 мл 0,9 молярного раствора соляной кислоты в метаноле в раствор, содер 9 жащий смесь 20 г продукта, полученного на стадии А, 100 мл дихлорметана и 100 мл метанола. Перемешивают в течение 2 ч при комнатной температуре и выпаривают растворители. Остаток обрабатывают в абсолютном этаноле,охлажденном до 0 С. Отжимают нерастворенный продукт, промывают ледяным спиртом,затем этиловым эфиром. Сушат и получают 15,53 г продукта, который обрабатывают простым эфиром, отжимают и сушат. Получают 14,54 г целевого продукта. ЯМР 1 Н (300 Мгц, СDСl3, ч/млн) 2,31 (с, 3H), 5,62 (с, 1 Н), 6,35 (с, 1 Н), 6,78(д, 1 Н, J= Гц), 7,75 (д, 1 Н, J=Гц), 6,99-7,10 (м,Н), 7,30-7,42 (м, Н). СТАДИЯ С. 7-[(6-Деокси-5-С-метил-4-O-метил-альфа-L-ликсогексопиранозил)окси]-4-(дифенилметокси)-8-метил-2 Н-1-бензопиран-2-он. Охлаждают до 0 С смесь из 91,13 г продукта, полученного на стадии В, 58,6 г 6-деокси 5-С-метил-4-O-метил-L-ликсогексопиранозы и 80 г трифенилфосфина в 900 мл дихлорметана. Добавляют по капле 60 мл диизопропилазодикарбоксилата. В течение часа перемешивают при комнатной температуре. Добавляют 34 г трифенилфосфина и 25 мл диизопропилазодикарбоксилата. Перемешивают в течение 1 ч при комнатной температуре. Добавляют 34 г трифенилфосфина и 25 мл диизопропилазодикарбоксилата и перемешивают 12 ч при комнатной температуре. Концентрируют под пониженным давлением. Хроматографируют путем элюирования смесью толуол/изопропиловый спирт (95-5). После объединения фракций и выпаривания растворителей получают после перекристаллизации в изопропиловом эфире 86,83 г целевого продукта. ЯМР 1 Н (300 Мгц, СDСl3, ч/млн) 1,13 (с, 3H), 1,37 (с, 3H), 2,24 (с, 3H), 2,69(с, 3H), 4,24 (м, 1 Н), 4,28 (м, 1 Н), 5,56 (с, 1 Н),5,64 (д, 1 Н, J=1,5 Гц), 6,35 (с, 1 Н), 7,18 (д, 1 Н),7,81 (д, 1 Н), 7,39 (м, 10 Н). СТАДИЯ D. 7-6-Деокси-5-С-метил-4-Oметил-3-O-(триэтилсилил)-альфа-L-ликсогексопиранозил]окси]-4-(дифенилметокси)-8-метил 2 Н-1-бензопиран-2-он. Добавляют 26,6 г имидазола и 70,15 мл диизопропилэтиламина в раствор, охлажденный до 0 С, содержащий 80 г продукта, полученного на предшествующей стадии, и 600 мл дихлорметана. Добавляют по капле 33,5 мл триэтилсилилхлорида. Перемешивают 1 ч при комнатной температуре. Промывают одномолярным водным раствором первичного фосфата натрия, водой и рассолом. Сушат над сульфатом магния, фильтруют и концентрируют. Получают 97,53 г продукта, который очищают хроматографией на двуокиси кремния,элюируя смесью дихлорметан/ацетон (от 0,8 до 1%). Получают 46,5 г продукта. ЯМР 1 Н (300 Мгц, СDСl3-d6, ч/млн) 100,60 (к, J=8 Гц, 2H); 0,74 (к, J=8 Гц, 4H); 0,98 (т, J=8 Гц, 3H); 1,05 (т, J=8 Гц, 6 Н); 1,10 (с,3H); 1,32 (с, 3H); 2,24 (с, 3H); 2,74 (д, J=1,5 Гц,1H); 3,29 (д, J=9,5 Гц, 1H); 3,54(с, 3H); 4,07 (ддд,J=1,5; 3; 2 Гц, 1H); 4,28 (дд, J=9,5; 3 Гц, 1H); 5,64 (д, J=2 Гц, 1H); 5,56 (с, 1H); 6,35 (с, 1H); 7,19 (д, 1H, J=9 Гц); 7,82 (д, J=9 Гц, 1H); 7,297,42 (м, 10 Н). СТАДИЯ Е. 7-6-Деокси-5-С-метил-4-Oметил-2-O-(тетрагидро-2H-пиран-2-ил)-3-O(триэтилсилил)-альфа-L-ликсогексопиранозил] окси]-4-(дифенилметокси)-8-метил-2H-1-бензопиран-2-он. Добавляют 19 мл дигидропирана и 400 мг паратолуолсульфоновой кислоты (APTS) в раствор, содержащий 67 г продукта, полученного на предыдущей стадии, и 1 л дихлорметана. Перемешивают в течение 40 мин при комнатной температуре и добавляют 300 мг паратолуолсульфоновой кислоты. После 30 мин перемешивания добавляют 100 мг паратолуолсульфоновой кислоты, затем еще 100 мг этой же кислоты. Перемешивают еще дополнительно 20 мин,затем вводят вторичный карбонат натрия в мелкоизмельченном состоянии. Перемешивают в течение 10 мин, разбавляют реакционную смесь смесью гексан/этилацетат (1-2), промывают водой и рассолом. Сушат. Фильтруют и выпаривают растворители. Полученный продукт хроматографируют,элюируя смесью гептан/этилацетат (4-1). Получают 77,9 г целевого продукта. ЯМР 1H (300 Мгц, DMSO-d6, ч/млн) Смесь 65/35 изомеров 0,64 (к) и 0,73 (к) (J=8 Гц, 6H); 0,98 (т) и 1,05 (т) (J=8 Гц, 9 Н); 2,25 (С) и 2,27 (с) (3H); 3,30(д, J=7,5 Гц) и 3,41 (д, J=10 Гц) (1H); 3,53 (с шир.) и 3,54 (с шир., 3H); 3,88 (м) 3,92 (м) 3,96(м) (1H); 5,56 (с шир., 1H); 5,55 (экранирован) и 5,66 (д, J=2 Гц) (1H); 4,07 (дд, J=2 Гц и 3 Гц) и 4,14 (дд, J=3 Гц и 7,5 Гц) (1H); 6,36 (с шир., 1H); 7,15 (д) и 7,19 (д) (J=9 Гц, 1H); 7,80 (д расщеплен, J=9 Гц, 1H); 1,48 - 1,97 (м, 8 Н); 1,09 (с) и 1,17 (с) 1,32 (с) и 1,43 (с) (6H); 7,30-7,44 (м,10 Н). СТАДИЯ F. 7-6-деокси-5-С-метил-4-O-метил-2-O-(тетрагидро-2 Н-пиран-2-ил)-3-O-(триметилсилил)-альфа-L-ликсогексопиранозил]окси]-4 гидрокси-8-метил-2 Н-1-бензопиран-2-он. Гидрируют в присутствии палладия на угле (2 г, 10%), 15 г продукта, полученного на предыдущей стадии, в 150 мл абсолютного этанола. Удаляют катализатор путем фильтрации и выпаривают растворители досуха. Получают 14,4 г продукта. СТАДИЯ G. 3-Ацетил-7-6-деокси-5-Ометил-4-O-метил-2-O-(тетрагидро-2 Н-пиран-2 ил)-3-O-(триэтилсилил)-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8-метил-2 Н-1-бензопиран-2-он. 11 Добавляют в раствор, содержащий 14,37 г продукта, полученного на предшествующей стадии, и 150 мл дихлорметана, 6,52 г диметиламинопиридина. Вводят по капле 2,72 мл уксусного ангидрида. Перемешивают при комнатной температуре в атмосфере аргона в течение 1 ч. Разбавляют в 200 мл дихлорметана, промывают водным раствором первичного фосфата натрия. Сушат над сульфатом магния, фильтруют и концентрируют. Получают 14,9 целевого продукта. СТАДИЯ Н. 3-ацетил-7-6-деокси-5-Ометил-4-O-метил-2-O-(тетрагидро-2 Н-пиран-2 ил)-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8-метил-2 Н-1-бензопиран-2-он. Вводят по капле при 0 С 27 мл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране в раствор, содержащий 15,2 мл полученного на предыдущей стадии продукта в 250 мл тетрагидрофурана. Перемешивают в атмосфере аргона в течение 48 ч при комнатной температуре. Разбавляют реакционную среду смесью этилацетат/гексан,промывают водой и рассолом. Сушат, фильтруют и концентрируют досуха. Получают 13 г продукта,который измельчают до порошка пентаном, удаляют всплывшую часть и повторяют процесс несколько раз. Поддерживают продукт при температуре +4 С измельчают в присутствии пентана,фильтруют нерастворенный продукт, промывают и сушат. Получают 6,99 г целевого продукта. ЯМР 1 Н (300 Мгц, CDCl3-d6, ч/млн) 1,09 (с, 3H), 1,11 (с, 3H), 1,35 (с, 3H), 1,36(д, 1 Н, J=Гц), 7,88 (м, Н). Пример 1. 7-6-Деокси-5-С-метил-4-O-метилальфа-L-ликсогексопиранозил]окси]-4-гидрокси-8 метил-2-оксо-2 Н-1-бензопиран-3-карбоксамид, 3'эфир (2-пропинилокси)карбаминовой кислоты. СТАДИЯ А. 3-(4-Нитрофенилкарбонат) этил-7-6-деокси-5-С-метил-4-O-метил-2-O-(тетрагидро-2 Н-пиран-2-ил)-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-8-метил-2-оксо-2 Н-1 бензопиран-3-карбоксилата. В атмосфере аргона в 80 мл метиленхлорида растворяют 4 г продукта получения 1. Добавляют 2,15 г диметиламинпиридина и при 0 С 2 г 4-нитрофенилхлорформиата. Перемешивают в течение 1 ч при 0 С. Выпаривают метиленхлорид и получают целевой продукт. СТАДИЯ В. Этил-7-6-деокси-5-С-метил 4-O-метил-3-O-(2-пропинилокси)амино]карбонил]-2-O-(тетрагидро-2 Н-пиран-2-ил) альфа-Lликсогексопиранозил]окси]-4-гидрокси-8-метил-2-оксо-2 Н-1-бензопиран-3-карбоксилат. Растворяют 1,215 г хлоргидрата О-пропаргилгидроксиламина в 40 мл диметилформамида. При 0 С добавляют 0,392 г гидрата натрия 12 при этой температуре. При 0 С вводят в эту суспензию 4 мл раствора продукта, полученного на предшествующей стадии, в диметилформамиде и 940 мг диметиламинопиридина. Перемешивают в течение 1 ч при 0 С. Разбавляют смесью гексан/этилацетат (1-2). Органический раствор промывают 400 мл 10%-ного раствора вторичного сульфата натрия, сушат над сульфатом натрия и выпаривают досуха. Получают 7,87 г неочищенного целевого продукта. СТАДИЯ С. 7-6-Деокси-5-С-метил-4-Oметил-2-O-(тетрагидро -2 Н-пиран-2-ил)альфа-Lликсогексопиранозил]окси]-4-гидрокси-8-метил-2-оксо-2 Н-1-бензопиран-3-карбоксамид, 3'эфир (2-пропинилокси)карбоновой кислоты. Растворяют в 50 мл тетрагидрофурана 2 г полученного на предыдущей стадии продукта. Полученный раствор насыщают гидроксидом аммония при 0 С в течение 10 мин и перемешивают 48 ч при комнатной температуре. Разбавляют с помощью 100 мл смеси гексан/ этилацетат (1-1). Органический раствор промывают 100 мл 1 М раствора первичного фосфата натрия,затем сушат над сульфатом магния и выпаривают досуха. Получают 2 г целевого продукта. СТАДИЯ D. 7-6-Деокси-5-С-метил-4-Oметил-альфа-L-ликсогексопиранозил]окси]-4 гидрокси-8-метил-2-оксо-2 Н-1-бензопиран-3 карбоксамид, 3'-эфир (2-пропинилокси)карбаминовой кислоты. Растворяют в 20 мл метанола 2 г продукта,полученного на предшествующей стадии, и 200 мг паратолуолсульфоновой кислоты. Перемешивают в течение 1 ч. Разбавляют в 100 мл смеси гексан/ этилацетат (1-1). Промывают насыщенным раствором первичного фосфата натрия, сушат досуха. Получают 1,6 г продукта, который очищают элюируя смесью метиленхлорид/метанол 8%. Загущают смесью этиловый эфир/пентан. Получают 0,574 г целевого продукта. ЯМР 1 Н (300 Мгц, DMSO-d6, ч/млн) 1,04 (с, 3H), 1,26 (с, 3H), 2,20 (с, 3H), 3,45,(с, 3H), 3,52 (д, 1 Н), 3,56 (м, 1 Н), 4,14 (м, 1 Н),4,46 (м, 2 Н), 5,20 (м, 1 Н), 5,59 (с шир., 1 Н), 5,77(2-пропинилокси)карбаминовой кислоты. СТАДИЯ А. 7-6-Деокси-5-С-метил-4-Oметил-2-O-(тетрагидро-2 Н-пиран-2-ил)-альфа-Lликсогексопиранозил]окси]-4-гидрокси-8-метил-N-[2-(4-морфолинил)этил]-2-оксо-2 Н-1 бензопиран-3-карбоксамид, 3'-эфир (2-пропинилокси)карбаминовой кислоты. Вводят 7,5 мл 2-(4-морфолино)этиламина в раствор, содержащий 1 г продукта, полученного на стадии В примера 1, в 4 мл тетрагидрофурана. Перемешивают 24 ч при комнатной температуре. Разбавляют в 100 мл гек 13 сан/этилацетат/тетрагидрофуран (1-4-1). Промывают насыщенным раствором первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 1 г целевого продукта. СТАДИЯ В. 7-[(6-Деокси-5-С-метил-4-Oметил-альфа-L-ликсогексопиранозил)окси]-4 гидрокси-8-метил-N-2-(4-морфолинил)этил-2 оксо-2 Н-1-бензопиран-3-карбоксамид, 3'-эфир(2-пропинилокси)карбаминовой кислоты. Растворяют 0,97 ммолей продукта, полученного на предыдущей стадии, в 10 мл метанола. Добавляют 100 мг паратолуолсульфоновой кислоты. Перемешивают в течение 1 ч при комнатной температуре. Добавляют снова 80 г паратолуолсульфоновой кислоты. Перемешивают в течение 3 ч. Разбавляют в 50 мл смеси гексан/этилацетат (1-3). Промывают с помощью 75 мл 1 М раствора первичного фосфата натрия,сушат над сульфатом магния и выпаривают досуха. Очищают продукт путем хроматографии на двуокиси кремния, элюируя смесью метиленхлорид/метанол (91-9). Загущают полученный продукт смесью этиловый эфир/пентан. Получают 0,150 г целевого продукта. ЯМР 1 Н (300 Мгц, DMSO-d6, ч/млн) 1,03 (с, 3H), 1,27 (с, 3H), 2,21 (с, 3H), 2,50(экранирован 4 Н), 2,57 (т, 24), 3,45 (с, 3H), 3,403,69 (м, 4 Н), 4,13 (м, 1 Н), 4,47 (д, 2 Н, J=2,5 Гц),5,20 (дд, 1 Н, J=3 и 10 Гц), 5,60 (д, 1 Н, J=2 Гц),5,77 (д, 1 Н, J=5 Гц), 7,21 (д, 1 Н, J=9 Гц), 7,84 (д,1 Н, J=9 Гц), 9,45 (т, 1 Н подвижн.), 10,72 (м, 1 Н подвижн.). Пример 3. 76-Деокси-5-С-метил-4-С-метил-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты. СТАДИЯ А. 7-6-Деокси-5-С-метил-4-O-метил-2-O-тетрагидро-2 Н-пиран-2-ил-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2 Н-1-бензопиран-2-он. Нагревают при 40 С в присутствии 0,597 г ацетата калия и 0,407 мг хлоргидрата Oметилгидроксиламина раствор, содержащий 1,2 г продукта, полученного в примере приготовления 2. Перемешивают в течение 1 ч и 30 мин при 40 С реакционную смесь, затем разбавляют ее смесью этилацетат/гексан (4-1), промывают с помощью 150 мл раствора вторичного фосфата натрия. Промывают водой, сушат, фильтруют и выпаривают досуха. СТАДИЯ В. 3-(4-Нитрофенилкарбонат) 7 о-деокси-5-С-метил-4-O-метил-2-O-(тетрагидро-2 Н-пиран-2-ил)-альфа-L-ликсогексопиранозил]окси]-4-гидрокси-3-[1-(метоксиимино) этил]-8-метил-2 Н-бензопиран-2-она. В раствор, содержащий 1,28 ммоля продукта предыдущей стадии и 12 мл дихлорметана, добавляют 0,390 г диметиламинопиридина. Добавляют 0,319 г 4-нитрофенилхлорформата. Перемешивают 30 мин при 0 С. Выпа 003275 14 ривают метилхлорид и сушат полученный продукт. Получают таким образом 1,218 ммолей целевого продукта. СТАДИЯ С. 7-6-Деокси-5-С-метил-4-Ометил-2-O-(тетрагидро-2 Н-пиран-2-ил)альфа-Lликсогексопиранозил]окси]-4-гидрокси-3-[1(метоксиимино)этил]-8-метил-2 Н-1-бензопиран 2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты. В раствор, охлажденный до 0 С, 0,655 г хлоргидрата O-пропаргилгидроксиламина в 6 мл диметилформамида добавляют 0,240 г гидрида натрия (в виде 55%-ного минерального масла). Перемешивают в течение 30 мин при 0 С и выливают в раствор,содержащий 1,218 ммолей продукта, полученного на предшествующей стадии и 6 мл ДМФ в присутствии 0,150 г диметиламинопиридина. По истечении часа при 0 С выливают реакционную смесь в смесь этилацетат/гексан (20%), промывают 10%ным раствором вторичного сульфата натрия, водой и рассолом. Сушат и выпаривают растворители досуха. Получают 0,865 г целевого продукта. СТАДИЯ D. 7-6-Деокси-5-С-метил-4-Oметил-альфа-L-ликсогексопиранозил]окси]-4 гидрокси-3-[1-(метоксиимино)этил]-8-метил 2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты. В раствор, содержащий 1,218 ммолей продукта, полученного на предшествующей стадии, и 12 мл метанола, добавляют 150 мг паратолуолсульфоновой кислоты. Перемешивают в течение часа при комнатной температуре. Разбавляют смесью этилацетат/гексан (1-1) и промывают 1 М водным раствором первичного фосфата натрия, затем рассолом. Органическую фазу сушат над сульфатом магния. Выпаривают растворители досуха. Полученный продукт хроматографируют, элюируя смесью дихлорметан/ацетон, (85-15) и получают 0,394 г продукта, который снова растворяют в простом эфире и осаждают пентаном. Нерастворившийся продукт выделяют путем фильтрации и сушат при пониженном давлении. Получают таким образом 0,380 г целевого продукта. Данные анализа ЯМР: CDCl3, 300 МГц,ч/млн 0,88 (3 Н, т, J=7,0) СН 3; 1,56 (2 Н, к, J=7,0) СН 2; 2,19 (3H, с) и 2,25 (3H, с): группы СН 3-С=; 3,43 (3H, с) С-ОМе; 3,93 (3H, с) =N-OMe; 3,56 15 Работают, как описано выше и получают целевой продукт. ЯМР СDCl3, ч/млн 1,17 (с) - 1,38 (с): 2 СН 3 Gem; 1,38 (т:): СН 3 СН 2 О; 1,61 (с): 4 подвижн., 2,25 (с) - 2,53 (с):H'6; 7,77 (д): Н'5; Н подвижн. 7,78: 14,15 и 15,11. Абсорбция вдоль спектра. 2,05 (ацетон) 4,13, 4,75-4,60-15,67. Пример 5. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-(2-пропинилокси)карбамат 8-гидрокси 7-[4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2-оксо-2 Н-1-бензопиран-7-ил]-10-метокси 6-оксаспиро[4.5]декан-9-ила. Получение этого этого соединения, а также получение используемых исходных соединений может быть схематизировано следующим образом. 16 Приготовление 3. [8R-(8 альфа, 9 альфа, 10 бета)]-10-метокси-6-оксаспиро[4.5]декан-7,8,9 триол. СТАДИЯ А. [4S-[4 альфа, 5 альфа (S)-2,2 диметил-5-[(1-гидроксициклопентил)метоксиметил]-1,3-диоксолан-4-метанол. Вводят 20 мл раствора дибромбутана (106 мл дибромбутана в 200 мл тетрагидрофурана) в смесь, содержащую 43 г магния, 100 мл тетрагидрофурана и один кристалл йода. Реакционную смесь обрабатывают ультразвуком. Добавляют 1,7 л тетрагидрофурана. Добавляют остаток дибромированного раствора. Перемешивают в течение 2 ч 30 мин. Добавляют при 17 С раствор, содержащий 80,37 г дельта-лактона 2-Oметил-3,4-O-(1-метилэтилиден)-L-арабиноновой кислоты и 1 л тетрагидрофурана. Перемешивают приблизительно 5 ч при комнатной температуре. Охлаждают до 0 С, добавляют насыщенный раствор хлорида аммония. Декантируют,сцеживают органическую фазу, экстрагируют раствором этилацетата с 20% гептана. Промывают, сушат и выпаривают досуха. Получают 111,85 г целевого продукта. СТАДИЯ В. [3'аS-(3'а альфа, 7' альфа, 7'а бета)]-7'-метоксидигидроспиро[циклопентан 1,6'-[6 Н]-1,3-диоксоло[4,5-с] пиран]-4'(3 аH)-он. Добавляют 221 г пиридинтриоксида серы(TEA). Перемешивают 2 ч при комнатной температуре. Выливают на водный раствор кислого фосфата натрия, экстрагируют смесью этилацетат/гептан (1-1). Сушат, фильтруют и выпаривают досуха. Получают 57,7 г целевого продукта. СТАДИЯ С. [8R-(8 альфа, 9 альфа, 10 бета)]10-метокси-6-оксаспиро[4.5]декан-7,8,9-триол. Добавляют при -5 С 157 мл 1,5 М раствора гидрида диизобутилалюминия (DIBAH) в толуоле в раствор, содержащий 56 г продукта,полученного на предыдущем этапе, и 300 мл ТГФ. Перемешивают при -3 С в течение 1 ч. Добавляют 1 л 1 М раствора двойного тартрата натрия и калия. Перемешивают в течение 15 мин при комнатной температуре. Реакционную среду экстрагируют смесью этилацетат-гептан 1-1. Промывают водой, рассолом, сушат и выпаривают досуха. Осадок, полученный в присутствии 150 мл 0,1 н. раствора серной кислоты и 150 мл воды, перемешивают при 70 С в течение 2,5 ч. Охлаждают до комнатной температуры, добавляют карбонат бария и перемешивают в течение часа при комнатной температуре. Фильтруют и выпаривают досуха. Получают 49 г целевого продукта. Пример 5. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-(2-пропинилокси)карбамат 8-гидрокси 7-[4-гидрокси-3-[(1-метоксиимино)этил]-8-метил-2-оксо-2 Н-1-бензопиран-7-ил]-10-метокси 6-оксаспиро[4.5]декан-9-ила. 17 СТАДИЯ A. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-7-[(8,9-дигидрокси-10-метокси-6-оксаспиро[4.5]декан-7-ил)окси]-4-(дифенилметокси)-8-метил-2 Н-1-бензопиран-2-он. Добавляют по капле при 0 С 45,30 г диизопропилазодикарбоксилата (DIAD) в смесь из 49 г продукта. Приготовления 3, 73 г продукта этапа В Приготовления 2, а именно 4(дифенилметокси)-7-гидрокси-8-метил-2 Н-1 бензопиран-2-она и 59 г трифенилфосфина. Перемешивают 1,5 ч при комнатной температуре. Добавляют при 0 С 1 эквивалент трифенилфосфина и DIAD. Выпаривают растворители, обрабатывают эфиром и получают целевой продукт. СТАДИЯ В. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-4-(дифенилметокси)-7-8-гидрокси-10 метокси-9-[(триэтилсилил)окси]-6-оксаспиро[4.5]декан-7-ил]окси]-8-метил-2 Н-1-бензопиран 2-он. Добавляют при 0 С 15,21 г имидазола, 40,1 мл диизопропиламииа и 18,75 г триэтилсиланхлорида в раствор, содержащий 48 г продукта,полученного на предыдущем этапе, и 400 мл метиленхлорида. Перемешивают в течение 1 ч при 0 С, промывают 1 М раствором кислого фосфата натрия и ополаскивают водой. Сушат. Полученный продукт хроматографируют на двуокиси кремния, элюируя смесью метиленхлорид/ацетон 99-1, затем смесью толуол/ трет.бутилметилэфир. Получают 28,37 г целевого продукта. СТАДИЯ С. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-4-(дифенилметокси)-7-10-метокси-8[(тетрагидро-2 Н-пиран-2-ил)окси]-9-[(триэтилсилил)окси]-6-оксаспиро[4.5]декан-7-ил]окси]8-метил-2 Н-1-бензопиран-2-он. Добавляют 7, 57 мл 3,4-дигидропирана и 400 мг паратолуолсульфоновой кислоты в раствор, содержащий 28,1 г продукта, полученного на предыдущем этапе, и 250 мл дихлорметана. Перемешивают в течение 1 ч при комнатной температуре. Добавляют бикарбонат натрия и перемешивают 20 мин при комнатной температуре. Промывают водой, сушат органические фазы над сульфатом натрия. Полученный продукт хроматографируют на двуокиси кремния,элюируя смесью гептан/этилацетат 4/1. Получают 16,81 г целевого продукта. СТАДИЯ D. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-4-гидрокси-7-10-метокси-8-[(тетрагидро-2 Н-пиран-2-ил)окси]-9-[(триэтилсилил)окси]-6-оксаспиро[4.5]декан-7-ил]окси]-8-метил 2 Н-1-бензопиран-2-он. Перемешивают в атмосфере водорода раствор из 16,19 г продукта, полученного на предыдущем этапе, 150 мл ТГФ, в присутствии 810 мг палладия на угле. Фильтруют и получают 15,1 г целевого продукта. СТАДИЯ Е. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-3-ацетил-4-гидрокси-7-10-метокси-8[(тетрагидро-2 Н-пиран-2-ил)окси]-9-[(триэтил 003275 18 силил)окси]-6-оксаспиро [4.5] декан-7-ил]окси]8-метил-2 Н-1-бензопиран-2-он. Добавляют 2,28 мл уксусного ангидрида в смесь, содержащую 13,8 г продукта, полученного на предыдущем этапе, и 150 мл метиленхлорида и 5,94 г диметиламинопиридина(DMAP). Перемешивают в течение 1 ч при комнатной температуре. Обрабатывают молярным раствором кислого фосфата натрия, экстрагируют метиленхлоридом, промывают водой и сушат. Получают 16,21 г целевого продукта,который используют как таковой на следующем этапе. СТАДИЯ F. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-3-ацетил-4-гидрокси-7-9-гидрокси-10 метокси-8-[(тетрагидро-2 Н-пиран-2-ил)окси]-6 оксаспиро[4.5]декан-7-ил]окси]-8-метил-2 Н-1 бензопиран-2-он. Добавляют при 0 С 1,5 эквивалента 1 М раствора в ТГФ тетрабутиламмонийфторида в раствор, содержащий продукт, полученный на предыдущем этапе, и 200 мл ТГФ. Реакционную смесь постоянно перемешивают при комнатной температуре в течение 15 ч. Выливают реакционную смесь на смесь гептан-этилацетат, (3070). Промывают водой, фильтруют и сушат. Получают продукт, который используют как таковой на следующем этапе. СТАДИЯ G. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-4-гидрокси-7-9-гидрокси-10-метокси 8-[(тетрагидро-2 Н-пиран-2-ил)окси]-6-оксаспиро[4.5]декан-7-ил]окси]-3-[1-(метоксиимино) этил]-8-метил-2 Н-1-бензопиран-2-он. Добавляют 4,6 г ацетата калия и 3,12 г хлоргидрата О-метилгидроксиламина в раствор,содержащий 18,69 ммолей продукта, полученного на предыдущем этапе, и 100 мл этанола. Перемешивают в течение 1,5 ч при комнатной температуре. Выливают в 1 М раствор кислого фосфата натрия, экстрагируют смесью гептан/этилацетат 30-70. Промывают водой, сушат и выпаривают досуха. Полученный продукт хроматографируют, элюируя смесью гептан/этилацетат (1:1). Получают 6,54 г целевого продукта. СТАДИЯ Н. [7R-(7 альфа, 8 бета, 9 бета, 10 альфа)]-(2-пропинилокси)карбамат 8-гидрокси 7-[4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2-оксо-2 Н-1-бензопиран-7-ил]-10-метокси 6-оксаспиро[4.5]декан-9-ила. 1) Вводят при 0 С 3,70 г DMAP и 3,05 г паранитробензолхлорформиата в раствор, содержащий 6,37 г продукта, полученного на предыдущем этапе и 70 мл дихлорметана. Перемешивают 1 ч при 0 С. 2) Добавляют 2,3 г гидрида натрия при 0 С в раствор, содержащий 6,26 г хлоргидрата пропаргилгидроксиламина и 50 мл ДМФ. Перемешивают 1 ч при 0 С. Раствор (1) концентрируют досуха. Полученный осадок растворяют в 50 мл ДМФ. Добавляют 1,42 DMAP. Добавляют при 0 С раствор (2) в полученный таким образом 19 раствор. Перемешивают 1 ч при 0 С. Обрабатывают кислым фосфатом натрия, промывают водой, сушат и концентрируют досуха. Полученный осадок растворяют в 100 мл метанола. Добавляют 2,1 г паратолуолсульфоновой кислоты(APTS) и перемешивают при комнатной температуре. Полученный продукт хроматографируют, элюируя толуолом, а затем смесью толуол изопропиловый эфир (92-8). Продукт диспергируют ультразвуком в смеси изопропиловый эфир - пентан. Получают целевой продукт. Спектр ЯМР: CDCl, ч/млн 1,30-2,00 СН 2 цикл 2,20 (с) С 6 Н 5-Ме 2,50 (с) Растворяют в атмосфере аргона 20,4 г 2-Oметил-3,4-O-(1-метилэтилиден)L-арабинозы в 200 мл тетрагидрофурана. Добавляют при 0 С в атмосфере аргона 200 мл 2 М раствора аллилмагнийбромида в тетрагидрофуране. Раствор перемешивают 1 ч при 0 С. Реакционную среду охлаждают до -15 С и разбавляют с помощью 100 мл гептана. Чтобы нейтрализовать избыток магния, добавляют по капле 300 мл 10%-ного водного раствора вторичного сульфата натрия. Органическую фазу отделяют, а водную фазу экстрагируют смесью гептан (1)/этилацетат (2). Органические фазы объединяют, сушат над сульфатом магния и выпаривают досуха. Получают 22,96 г целевого продукта. Выход продукта 94%. СТАДИЯ В. Растворяют в атмосфере аргона 22,96 г продукта, полученного на предыдущем этапе, в 175 мл диметилформамида. Добавляют 14,88 г имидазола, затем при 0 С в атмосфере аргона по капле в течение 30 мин 23,31 дифенилтретбутилсилилхлорида. Раствор перемешивают в те 003275 20 чение 30 мин при 0 С. Реакционную среду разбавляют с помощью 400 мл смеси гептан(1)/этилацетат(2). Органическую фазу промывают двумя объемами 200 мл 1 М водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 45 г смолообразного продукта, который очищают хроматографией на двуокиси кремния,элюируя смесью гептан(4)/этилацетат(1). Получают 39,5 г целевого продукта. Выход продукта 85%. СТАДИЯ С. Суспендируют 25,1 г хлорхромата пиридиния в 200 мл метиленхлорида. Добавляют 53,8 г молекулярного сита 4. В эту суспензию вводят за один раз 39,5 г продукта, полученного на предыдущем этапе, растворенного в 100 мл метиленхлорида. Перемешивают в течение 3 ч. Суспензию фильтруют. Элюируют смесью метиленхлорида с 3% метанола. Фильтрат выпаривают досуха. Полученный осадок (35 г) фильтруют на двуокиси кремния, элюируя смесью гептан (4) этилацетат (1). Получают 32,9 г целевого продукта. Выход продукта 87%. СТАДИЯ D. Растворяют 32,5 г продукта, полученного на предыдущем этапе, в 250 мл тетрагидрофурана. В атмосфере аргона при -5 С добавляют по капле 60 мл раствора метилмагнийбромида в простом эфире (3 М). Перемешивают в течение 1 ч при комнатной температуре. При 0 С нейтрализуют избыток магния 10%-ным водным раствором вторичного сульфата натрия. Добавляют 200 мл смеси гептан(1)/этилацетат(2). Органическую фазу промывают с помощью 200 мл 1 М водного раствора первичного фосфата натрия,сушат над сульфатом магния и выпаривают досуха. Полученный продукт загущают в 200 мл смеси пентан/простой эфир. Получают 16,9 г целевого продукта. Выход продукта 64%. СТАДИЯ Е. Растворяют 16,9 г продукта, полученного на предыдущем этапе, в 150 мл тетрагидрофурана. В атмосфере аргона при 0 С добавляют по капле 68 мл молярного раствора тетрабутилам 21 монийфторида в тетрагидрофуране. Перемешивают 30 мин при комнатной температуре. Добавляют 200 мл смеси гептан(1)/этилацетат(2). Органическую фазу промывают с помощью 200 мл молярного водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт очищают хроматографией на двуокиси кремния,элюируя смесью метиленхлорид 95/метанол 5. Получают 10,1 г целевого продукта. СТАДИЯ F. Растворяют 10,15 г продукта, полученного на предыдущем этапе, в 103 мл метиленхлорида. В атмосфере аргона при комнатной температуре добавляют 55 мл триэтиламина и 103 мл диметилсульфоксида, находящегося на молекулярном сите. Раствор охлаждают до приблизительно 5 С с помощью водно-ледяной бани и добавляют фракционно 19,77 г пиридинтриоксид серы так, чтобы температура не превышала 15 С. Перемешивают в течение 1 ч. Реакционную среду выливают в 1 л молярного водного раствора первичного фосфата натрия,водную фазу экстрагируют два раза с помощью смеси гептан(1)/этилацетат(2). Органическую фазу промывают водой, сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт кристаллизуют и загущают пентаном. Получают 6,8 г целевого продукта. Выход продукта 68%. СТАДИЯ G. Растворяют 5,3 г продукта, полученного на предыдущем этапе, в 30 мл тетрагидрофурана. В атмосфере аргона при -6 С добавляют 13,85 млDIBAH. Через 1 ч 30 мин перемешивания при 0 С реакцию заканчивают. Реакционную среду сливают в 100 мл 1 М раствора двойного тартрата натрия и калия; водную фазу экстрагируют с помощью смеси гептан(1)/этилацетат(2). Органическую фазу промывают с помощью 150 мл 10%-ного водного раствора вторичного сульфата натрия,сушат над сульфатом магния и выпаривают досуха. Получают 5,5 г целевого продукта. Выход продукта - количественный. СТАДИЯ Н. Эмульгируют 5,5 г продукта, полученного на предыдущем этапе, в 32 мл 0,05 н. раствора серной кислоты. Через 1 ч 30 мин нагревания при 70 С реакцию заканчивают. Эмульсию доводят до комнатной температуры, реакционную среду нейтрализуют с помощью 0,6 г карбоната 22 бария. Суспензию перемешивают в течение часа при комнатной температуре (рН=7), затем фильтруют и выпаривают досуха. Для сушки продукта делают две отгонки толуолом. Сушат и получают 4,4 г целевого продукта. Выход продукта 96%. ПРИМЕР 6. 7-6-Деокси-4-O-метил-5-С(2-пропенил)-3-O-(2-пропинилокси)амино] карбонил]-бета-D-гулопиранозил]окси]-4-гидрокси-8-метил-3-[1-[(2-пропинилокси)имино] этил]-2 Н-1-бензопиран-2-он и 7-6-деокси-4-Oметил-5-С-(2-пропенил)-3-O-(2-пропинилокси)амино]карбонил]-бета-D-гулопиранозил] окси]-4-гидрокси-3-[1-(метоксиимино)этил]-8 метил-2 Н-1-бензопиран-2-он. СТАДИЯ А. Растворяют 4,4 г продукта, полученного в приготовлении 4, в 100 мл метиленхлорида. При комнатной температуре в атмосфере аргона добавляют 7,33 г кумарин (7-гидрокси-3[(метоксиимино)метил]-8-метил-4-(2-пропенилокси)-2 Н-1-бензопиран-2-она), (полученного как указано в приготовлении 8 заявки на международный патент WO 9747634) и 6,29 г трифенилфосфина. Суспензию охлаждают до 0 С. Добавляют по капле 3,73 мл диэтилазодикарбоксилата(DEAD). Суспензию перемешивают 1 ч при комнатной температуре. Добавляют снова 6,06 г трифенилфосфина и при 0 С 3,11 мл DEAD. После перемешивания в течение 1 ч при комнатной температуре добавляют 50 мл пентана,чтобы восстановленный DEAD выпал в осадок. Суспензию фильтруют, фильтрат выпаривают досуха и очищают на двуокиси кремния элюирующей смесью толуола с 3%, а затем с 6% изопропилового спирта. Получают 7,1 г продукта. Продукт фильтруют на двуокиси кремния 60,элюируя сначала смесью простого эфира с гептаном, затем простым эфиром. Получают 6,13 г целевого продукта. СТАДИЯ В. Растворяют 6 г продукта, полученного на предыдущем этапе, в 75 мл тетрагидрофурана. Добавляют 3,86 г карбонилдиимидазола и реакцию осуществляют в течение 1 ч при кипячении с обратным холодильником. Реакционную смесь разбавляют с помощью 100 мл смеси гептан(1)/этилацетат(2). Органическую фазу промывают с помощью 10%-ного водного раствора вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 4,94 г целевого продукта. Растворяют 4,94 г продукта, полученного на предыдущем этапе, в 120 мл тетрагидрофурана. Добавляют 8,44 мл диизопропиламина при 0 С, 1,05 г палладийтетракистрифенилфосфина. Перемешивают в течение 20 мин при 0 С. Реакционную среду разбавляют с помощью 50 мл смеси гептан(1)/этилацетат(2). Органическую фазу промывают 10%-ным водным раствором вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 5,5 г неочищенного продукта, который очищают на двуокиси кремния, элюируя смесью метиленхлорид с 2% ацетона. Получают 3,1 г целевого продукта. СТАДИЯ D. Растворяют 0,65 г продукта, полученного на предыдущем этапе, в 6,5 мл пиридина, высушенного над гидроксидом калия. При комнатной температуре добавляют 1,5 г хлоргидрата пропаргилгидроксиламина и 0,149 перхлората лития. Перемешивают при комнатной температуре в течение 48 ч. Разбавляют смесью гептан(1)/этилацетат (2) органическую фазу промывают 10%-ным раствором вторичного сульфата натрия, сушат над сульфатом магния. Получают 1,8 г продукта, который очищают хроматографией на двуокиси кремния, с элюирующей смесью метиленхлорид 80/трет.бутил-метилэфир 20. Получают 200 мг целевого продукта в виде изомера в положении 3 и 500 г продукта в виде изомера в положении 2. СТАДИЯ Е. Растворяют в атмосфере аргона 0,5 г изомера в положении 2, полученного на предыдущем этапе, в 10 мл метиленхлорида. Добавляют 100 мкл DBU. Перемешивают 24 ч при комнатной температуре. Разбавляют в 50 мл смеси гептан (1)/этилацетат (3) и промывают органическую фазу 1 М раствором первичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Полученный выше продукт растворяют в 5 мл этанола. При комнатной темпе 003275 24 ратуре добавляют 0,72 г хлоргидрата метилгидроксиламина и 0,94 г ацетата натрия. Реакционную среду перемешивают 5 ч при комнатной температуре. Разбавляют в 50 мл смеси гептан(1)/этилацетат (3) и промывают органическую фазу 1 М раствором первичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,45 г неочищенного продукта, который очищают хроматографией на двуокиси кремния с элюирующей смесью метиленхлорид (80)/трет.бутил-метилэфир (20). Получают 100 мг целевого продукта. Приготовление 5. СТАДИЯ А. Растворяют в атмосфере аргона 20,4 г 2-Oметил-3,4-0(1-метилэтилиден)L-арабинозы в 250 мл тетрагидрофурана. Добавляют при 0 С в атмосфере аргона 100 мл 1 М раствора винилмагнийбромида в тетрагидрофуране, затем 200 мл 1,7 М раствора хлорида магния в тетрагидрофуране; (0,34 моля). Раствор перемешивают 1 ч при комнатной температуре. Реакционную среду охлаждают до -15 С и разбавляют с помощью 100 мл гептана. Для нейтрализации избытка магния добавляют по капле 300 мл смеси тетрагидрофурана с 20% молярного водного раствора первичного фосфата натрия. Соли магния осаждаются. Добавляют 200 мл смеси гептан (1)/этилацетат (2) и 150 мл 10%-ного раствора вторичного сульфата натрия. Органический раствор сушат над сульфатом магния и выпаривают досуха. Получают 19,3 г целевого продукта. Выход продукта 83%. СТАДИЯ В. Растворяют 19,3 г продукта, полученного на предыдущем этапе, в 150 мл диметилформамида. Добавляют 10,8 г имидазола, затем при 0 С в атмосфере аргона по капле в течение 30 мин добавляют 23,4 мл дифенилтретбутилсилилхлорида. Раствор перемешивают 30 мин при 0 С. Реакционную среду разбавляют с помощью 400 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 1 М водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 30,2 г смолообразного продукта, который очищают хроматографией на двуокиси кремния, элюируя смесью гептан (4)/этилацетат (1). Получают 30,2 г целевого продукта. Выход продукта 77%. Растворяют 19,1 г хлорхромата пиридиния в 250 мл метиленхлорида. Добавляют затем 40 г молекулярно сита 4. В эту суспензию вводят за один прием 28,19 г продукта, полученного на предыдущем этапе, растворенного в 100 мл метиленхлорида. Через 4 ч перемешивания при комнатной температуре реакцию заканчивают. Фильтруют. Фильтрат выпаривают досуха. Хроматографируют полученный продукт на двуокиси кремния, элюируя смесью гептан/этилацетат(6-1). Получают 10,5 г целевого продукта. Выход продукта 36%. СТАДИЯ D. Растворяют 10 г продукта, полученного на предыдущем этапе, в 100 мл тетрагидрофурана. В атмосфере аргона, при -5 С, добавляют по капле 14 мл 3 М раствора метилмагнийбромида в простом эфире. Перемешивают 30 мин при 0 С, нейтрализуют избыток магния 10%-ным водным раствором вторичного сульфата натрия. Добавляют 200 мл смеси гептан (1)/этилацетат(2). Органическую фазу промывают с помощью 200 мл молярного водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт очищают на двуокиси кремния, элюируя смесью гептан(4)/этилацетат(1). Полученный продукт загущают пентаном. Получают 2,76 г целевого продукта. Выход продукта 27%. СТАДИЯ Е. Растворяют 2,79 г продукта, полученного на предыдущем этапе, в 15 мл тетрагидрофурана. В атмосфере аргона при 0 С добавляют по капле 11,8 мл молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. Перемешивают 1 ч при комнатной температуре. Добавляют 200 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 200 мл молярного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт очищают хроматографией на двуокиси кремния, элюируя смесью метиленхлорида с 5% метанола. Получают 1,2 г целевого продукта. Выход продукта 86%. Растворяют 1,2 г продукта, подученного на предыдущем этапе, в 12,5 мл метиленхлорида. В атмосфере аргона при комнатной температуре добавляют 6,67 мл триэтиламина и 12,5 мл диметилсульфоксида, находящегося на молекулярном сите. Раствор охлаждают до приблизительно 5 С с помощью водно-ледяной бани и добавляют фракциями 2,39 г пиридинтриоксида серы так, чтобы температура на превышала 15 С. Через 1 ч перемешивания при комнатной температуре реакцию заканчивают. Перемешивают 1 ч при комнатной температуре. Реакционную среду выливают на 100 мл молярного водного раствора первичного сульфата натрия,водную фазу экстрагируют дважды с помощью смеси гептан (1)/этилацетат (2). Органическую фазу промывают водой, сушат над сульфатом магния и выпаривают досуха. Полученный продукт загущают пентаном. Получают 0, 75 г целевого продукта. Выход продукта 59%. СТАДИЯ G. Растворяют 0,73 г продукта, полученного на предыдущем этапе, в 30 мл тетрагидрофурана. В атмосфере аргона при -6 С добавляют 2,5 мл 1,5 М раствора DIBAH в толуоле. Перемешивают 1 ч 30 мин при -6 С. Реакционную среду выливают в 1 М раствор двойного тартрата натрия и калия; водную фазу экстрагируют с помощью смеси гептан (1)/этилацетат (2). Органическую фазу промывают 10%-ным водным раствором вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Сгущают полученный продукт пентаном. Получают 0,95 г целевого продукта. Выход продукта - количественный. СТАДИЯ Н. Эмульгируют 0,9 г продукта, полученного на предыдущем этапе, в 5 мл 0,05 н. раствора серной кислоты. Через 1 ч нагревания при 70 С реакция заканчивается. Эмульсию доводят до комнатной температуры, реакционную смесь экстрагируют пентаном, а водную фазу нейтрализуют с помощью 0,1 г карбоната бария. Суспензию перемешивают в течение 1 ч при комнатной температуре (рН=7), затем фильтруют и выпаривают досуха. Чтобы высушить продукт,делают две отгонки толуола, затем растворяют в метиленхлориде, сушат раствор над сульфатом Растворяют 0,5 г продукта, полученного в приготовлении 5, в 17 мл метиленхлорида. При комнатной температуре в атмосфере аргона добавляют 0,89 г курамина (полученного как указано в заявке на международный патент WO 9747634) и 0,76 г трифенилфосфина. Суспензию охлаждают до 0 С, добавляют по капле 0,45 мл диэтилазодикарбоксилата (DEAD). Суспензию перемешивают 1 ч при комнатной температуре. Снова добавляют 0,63 г трифенилфосфина и,при 0 С, 0,37 мл (DEAD). Получают желтый раствор. Через час перемешивания при комнатной температуре добавляют 10 мл пентана для того, чтобы восстановленный DEAD выпал в осадок. Суспензию фильтруют, фильтрат выпаривают досуха и очищают хроматографией на двуокиси кремния, элюируя смесью толуол(97)/изопропиловый спирт (3) (элюирование заканчивают при 6%). Полученный продукт в виде смеси затем фильтруют на двуокиси кремния 60, элюируя смесью гептан (1)/простой эфир (2), затем простым эфиром. Получают 0,55 г белых кристаллов. Выход продукта 47%. СТАДИЯ В. Растворяют 0,55 г продукта, полученного на предыдущем этапе, в 7 мл тетрагидрофурана. Добавляют 0,364 г карбонилдиимидазола и нагревают реакционную смесь 1 ч при кипячении с обратным холодильником. Реакционную среду разбавляют с помощью 40 мл смеси гептан(1)/этилацетат (2). Органическую фазу промывают с помощью 50 мл 10%-ного водного раствора вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,5 г целевого продукта. Выход продукта 88%. СТАДИЯ С. 28 Растворяют 0,5 г продукта, полученного на предыдущем этапе, в 12 мл тетрагидрофурана. Добавляют 0,82 г диизопропиламина и при 0 С 0,11 г палладийтетракистрифенилфосфина (0,1 эквивалента). Перемешивают в течение 20 мин при 0 С. Реакционную среду разбавляют с помощью 50 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 50 мл 10%-ного водного раствора вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,58 г неочищенного продукта, который очищают хроматографией на двуокиси кремния, элюируя смесью гептан (3)/этилацетат (2). Получают 0,257 г целевого продукта. Выход продукта 57%. СТАДИЯ D. Растворяют 0,257 г продукта, полученного на предыдущем этапе, в 2,5 мл пиридина, высушенного над карбонатом калия. При комнатной температуре добавляют 0,58 г пропаргилгидроксиламин хлоргидрата и 0,057 г перхлората лития. Реакционную среду перемешивают в течение 48 ч при комнатной температуре. Разбавляют смесью гептан (1)/этилацетат (2) и органическую фазу промывают 10%-ным раствором вторичного сульфата натрия, сушат над сульфатом магния. Получают 0,28 г целевого продукта. Полученный неочищенный продукт растворяют в 5 мл этанола, добавляют 0,45 г метилгидроксиламинхлоргидрата и 0,58 г ацетата натрия. Реакционную среду перемешивают 5 ч при комнатной температуре. Разбавляют смесью гептан(1)/этилацетат (2) и органическую фазу промывают (1 М) раствором первичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,3 г неочищенного продукта, который очищают хроматографией на двуокиси кремния элюируя смесью метиленхлорид (80)/этилацетат (19)/уксусная кислота Растворяют 10,5 г в 110 мл тетрагидрофурана. В атмосфере аргона при -6 С добавляют 329 мл 0,135 М раствора тетраборогидрида цинка в простом эфире. Оставляют при перемешивании на 30 мин без ледяной бани, реакция при этом заканчивается. Добавляют 1 М раствор первичного фосфата натрия. Водную фазу экст 29 рагируют смесью гептан (1)/этилацетат (2). Органическую фазу сушат над сульфатом магния и выпаривают досуха. Получают 10,5 г целевого продукта, которые очищают хроматографией элюируя смесью гептан (4)/этилацетат (1). Получают 8,75 г целевого продукта. Выход продукта 83%. СТАДИЯ В. Растворяют 8,75 г продукта, полученного на предыдущем этапе, в 100 мл тетрагидрофурана. В атмосфере аргона при 0 С добавляют 37 мл молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. Через 30 мин перемешивания при 0 С добавляют 200 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 200 мл молярного водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт (10,5 г) очищают хроматографией на двуокиси кремния, элюируя смесью метиленхлорида с 20% ацетона. Получают 3,6 г целевого продукта. Выход продукта 78%. СТАДИЯ С. 3,57 г продукта, полученного на предыдущем этапе, помещают в 38 мл метиленхлорида. В атмосфере аргона, при комнатной температуре, добавляют 20,5 мл триэтиламина и 38 мл диметилсульфоксида. Раствор охлаждают до приблизительно 5 С и добавляют 7,6 г пиридинтриоксид серы так, чтобы температура не превышала 15 С. Перемешивают в течение 2 ч. Реакционную среду выливают на 500 мл молярного водного раствора первичного фосфата натрия, водную фазу экстрагируют два раза с помощью смеси гептан (1)/этилацетат (2). Органическую фазу промывают два раза с помощью 500 мл воды, сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт кристаллизуют и загущают пентаном. Получают 1,92 г целевого продукта. Выход продукта 56%. СТАДИЯ D. Растворяют 1,9 г продукта, полученного на предыдущем этапе, в 10 мл тетрагидрофурана. В атмосфере аргона при 0 С добавляют 6,66 мл 1,5 М раствора DIBAH в толуоле. Перемешивают в течение 1 ч 30 мин. Реакционную среду выливают в 100 мл 1 М раствора двойного тартрата натрия и калия; водную фазу экстрагиру 003275 30 ют с помощью смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 150 мл 10%-ного водного раствора вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Выход продукта - количественный. СТАДИЯ Е. Эмульгируют 1,95 г продукта, полученного на предыдущем этапе, в 11,5 мл 0,05 н. раствора серной кислоты. Нагревают в течение 1 ч 30 мин до 70 С. Оставляют охладиться до комнатной температуры,и реакционную среду нейтрализуют с помощью 0,3 г карбоната бария. Суспензию перемешивают в течение 1 ч при комнатной температуре (рН=7), затем фильтруют и выпаривают досуха. Для сушки продукта делают 2 отгонки толуолом. После сушки (в течение одной ночи при 40 С в присутствии Р 2O5) получают 1,2 г целевого продукта. Выход продуктаколичественный. Пример 8. 7-6-Деокси-6-С-метил-4-Ометил-3-О-(2-пропинилокси)амино]карбонил]альфа-L-маннопиранозил]окси]-4-гидрокси-8 метил 3-[1-[(2-пропинилокси)имино]этил-2 Н-1 бензопиран-3-ил]-2-он. 7-[(6-деокси-6-С-метил-4-О-метил-3-О(2-пропинилокси)амино]карбонил]-альфа-Lманиопиранозил)окси]-4-гидрокси-3-1-(метоксиимино)этил]-8-метил-2 Н-1-бензопиран-3-ил]2-он. СТАДИЯ А. Растворяют 1,16 г продукта, полученного в приготовлении 6, в 25 мл метиленхлорида. При комнатной температуре в атмосфере аргона добавляют 2,19 г кумарин 7-гидрокси-3[(метоксиимино)метил]-8-метил-4-(2-пропенилокси)-2 П 1-бензопиран-2-она, (полученного как указано в заявке на международный патент WO9747634) и 1,89 г трифенилфосфина. Суспензию охлаждают до 0 С, добавляют по капле 1,12 мл DEAD. Суспензию перемешивают 1 ч при комнатной температуре. Снова добавляют 1,58 г трифенилфосфина и при 0 С 0,93 мл DEAD. Через час перемешивания при комнатной температуре добавляют 50 мл пентана, чтобы выпал в осадок восстановленный DEAD. Суспензию фильтруют, фильтрат выпаривают досуха и очищают хроматографией на двуокиси кремния, элюируя смесью толуола с 30% изопропилового спирта. Получают 0,870 г белых кристаллов и 0,850 г смеси, содержащей следы восстановленногоDEAD. Продукт быстро фильтруют на 100 г Растворяют 1,27 г продукта, полученного на предыдущем этапе, в 10 мл тетрагидрофурана. Добавляют 0,85 г карбонилдиимидазола и нагревают 1 ч с обратным холодильником. Реакционную среду разбавляют с помощью 50 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают два раза объемами по 50 мл 10%-ного водного раствора вторичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 1,41 г целевого продукта. Выход продуктаколичественный. СТАДИЯ С. Растворяют 0,6 г продукта, полученного на предыдущем этапе, в 6,5 мл пиридина, высушенного над гидроксидом калия. При комнатной температуре добавляют 1,5 г хлоргидрата пропаргилгидроксиламина и 0,149 перхлората лития. Перемешивают 48 ч при комнатной температуре. Разбавляют смесью гептан(1)/этилацетат (2) и промывают органическую фазу 10%-ным раствором вторичного сульфата натрия, сушат над сульфатом магния. Получают 1,8 г продукта, который хроматографируют на двуокиси кремния, элюируя смесью метиленхлорид (80)/этилацетат (19)/уксусная кислота(1). Получают 186 мг целевого соединения изомерией в положении 3 и 400 мг соединения изомерией в положении 2. Выход продукта 74%. Раскрытие цикла с образованием карбоната, в котором 30% - изомер с изомерией в положении 3. СТАДИЯ D. Растворяют 0,4 г продукта, полученного на предыдущем этапе, (изомера, в положении 2), в 10 мл метиленхлорида. Добавляют 100 мкл(1)/этилацетат (2) и органическую фазу промывают 1 М раствором первичного фосфата натрия, 003275 32 сушат над сульфатом магния и выпаривают досуха. 0,4 г смеси, полученной выше, растворяют в 10 мл этанола в колбе объемом 100 мл. При комнатной температуре добавляют 0,59 г хлоргидрата метилгидроксиламина и 0,76 г ацетата натрия. Реакционную среду перемешивают 5 ч при комнатной температуре. Разбавляют смесью гептан (1)/этилацетат (2) и органическую фазу промывают 1 М раствором первичного сульфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,45 г неочищенного продукта, который очищают на двуокиси кремния,элюируя смесью метиленхлорид(80)/этилацетат (19)/уксусная кислота (1). Выделяют только соединения с изомерией в положении 3. Получают 0,140 г целевого продукта. Выход продукта 37%. Приготовление 7. СТАДИЯ А. Растворяют 26,8 г продукта в атмосфере аргона в 250 мл тетрагидрофурана. Добавляют при 0 С в атмосфере аргона по капле 400 мл 1 М раствора этилмагнийбромида в тетрагидрофуране. Раствор перемешивают 2 ч при комнатной температуре. Реакционную среду охлаждают до 0 С и разбавляют с помощью 100 мл гептана. Чтобы нейтрализовать избыток магния, добавляют по капле 300 мл молярного водного раствора первичного фосфата натрия. Соли магния осаждаются. Добавляют 200 мл смеси гептан(1)/этилацетат (2) и 150 мл 10%-ного раствора вторичного сульфата натрия. Органический раствор сушат над сульфатом магния и выпаривают досуха. Получают 29 г продукта, который хроматографируют на двуокиси кремния, элюируя смесью гептан (1)/этилацетат (4). Получают 17 г целевого продукта. Выход продукта 52%. СТАДИЯ В. Растворяют 16,7 г продукта, полученного на предыдущем этапе, в атмосфере аргона в 150 мл диметилформамида. Добавляют 10,07 г имидазола, затем при 0 С в атмосфере аргона по капле в течение 30 мин 19,23 мл дифенилтретбутилсилилхлорида. Раствор перемешивают 1 ч 30 мин при комнатной температуре. Реакционную среду разбавляют с помощью 400 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают молярным водным раствором первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 38 г продукта, который очищают хроматографией на 33 двуокиси кремния, элюируя смесью метиленхлорида с 10% ацетона. Получают 33,23 г целевого продукта. Выход продуктаколичественный. СТАДИЯ С. Суспендируют 22,57 г хлорохроматпиридиния (0,104 моля) в 300 мл метиленхлорида. Добавляют 110 г молекулярного сита 4. В эту суспензию вводят 33 г продукта, полученного на предыдущем этапе, растворенного в 100 мл метиленхлорида. После 3 ч перемешивания при комнатной температуре суспензию фильтруют. Фильтрат выпаривают досуха. Полученный осадок (35 г) очищают на двуокиси кремния, элюируя смесью гептан (4)/этилацетат (1). Получают 27 г целевого продукта. Выход продукта 83%. СТАДИЯ D. Растворяют 16,5 г продукта, полученного на предыдущем этапе, в 150 мл тетрагидрофурана. В атмосфере аргона при -5 С добавляют по капле 17,52 г 3 М раствора метилмагнийбромида в простом эфире. Перемешивают 1 ч при комнатной температуре. При 0 С нейтрализуют избыток магния 1 М водным раствором первичного фосфата натрия. Добавляют 200 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 200 мл молярного водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Полученный продукт сгущают пентаном. Получают 14,85 г целевого продукта. Выход продукта 87%. СТАДИЯ Е. Растворяют 14,85 г продукта, полученного на предыдущем этапе, в 150 мл тетрагидрофурана. В атмосфере аргона при 0 С добавляют по капле 33 мл молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. Через 30 мин перемешивания при комнатной температуре реакцию заканчивают. Добавляют 200 мл смеси гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 200 мл молярного водного раствора первичного фосфата натрия,сушат над сульфатом магния и выпаривают досуха. Неочищенный продукт очищают на двуокиси кремния, элюируя смесью метиленхлорида с 15% ацетона, а затем с 30% ацетона. Получают 7,85 г целевого продукта. Растворяют 7,85 г продукта, полученного на предыдущем этапе, в 82,5 мл метиленхлорида. В атмосфере аргона при комнатной температуре добавляют 44,5 мл триэтиламина и 82,5 мл диметилсульфоксида, находящегося на молекулярном сите. Раствор охлаждают до примерно 5 С водно-ледяной баней и добавляют по фракциям 15,8 г пиридинтриоксида серы так, чтобы температура не превышала 15 С. Перемешивают в течение 1 ч. Реакционную среду сливают на 1 л молярного водного раствора первичного фосфата натрия, водную фазу экстрагируют смесью гептан (1)/этилацетат (2). Органическую фазу промывают водой, сушат над сульфатом магния и выпаривают досуха. Полученный продукт сгущают пентаном. Получают 5,77 г целевого продукта. Выход продукта 80%. СТАДИЯ G. Растворяют 5,46 г продукта, полученного на предыдущем этапе, в 25 мл тетрагидрофурана. В атмосфере аргона при 0 С добавляют 16,7 мл 1,5 М раствора DIBAH в толуоле. Перемешивают в течение 1 ч 30 мин при 0 С. Реакционную среду выливают в 250 мл 1 М раствора двойного тартрата натрия и калия; водную фазу экстрагируют смесью гептан (1)/этилацетат (2). Органическую фазу промывают с помощью 150 мл 10%-ного водного раствора сульфата натрия,сушат над сульфатом магния и выпаривают досуха. Получают 5,5 г целевого продукта. Выход продукта - количественный. СТАДИЯ Н. Эмульгируют 5,5 г продукта, полученного на предыдущем этапе, в 32 мл 0,05 н. раствора серной кислоты. Через 1 ч 30 мин нагревания при 70 С реакцию заканчивают. Реакционную среду доводят до комнатной температуры и нейтрализуют с помощью 0,6 г карбоната бария; суспензию перемешивают в течение 1 ч при комнатной температуре (рН=7), затем фильтруют на фильтровальной бумаге milipore и выпаривают досуха. Чтобы высушить продукт, делают две отгонки толуолом. Сушат при 40 С в присутствии Р 2O5, получают 4,8 г белого смолистого осадка. Выход продукта - количественный. Растворяют 4,8 г продукта, полученного в приготовлении 7, в 100 мл метиленхлорида. При комнатной температуре в атмосфере аргона добавляют 9,98 г курамина и 7,23 г трифенилфосфина, суспензию охлаждают до 0 С, добавляют по капле 4,34 мл DEAD. Светло-желтую суспензию перемешивают 1 ч при комнатной температуре. Опять добавляют 6 г трифенилфосфина и при 0 С, 3,57 мл DEAD. Получают раствор желтого цвета. Через 1 ч перемешивания при комнатной температуре добавляют 50 мл пентана,чтобы восстановленный DEAD выпал в осадок. Суспензию фильтруют, фильтрат выпаривают досуха и очищают на 1,750 кг двуокиси кремния 60 с элюирующей смесью толуола с 3% изопропилового спирта, а затем с 6% изопропилового спирта. Получают 10 г белых кристаллов, содержащих следы восстановленного DEAD. Продукт быстро фильтруют на двуокиси кремния 60 с элюирующей смесью гептан (1)/этилацетат (2),чтобы удалить восстановленный DEAD, затем смесью метиленхлорид (95)/метанол (5) для получения 7,3 г целевого продукта. Выход продукта 58%. СТАДИЯ В. Вводят 7,2 г продукта, полученного на предыдущем этапе, в 100 мл ТГФ. Добавляют 4,41 г диимидазолкарбоната и нагревают 1 ч с обратным холодильником. Выливают в 150 мл 10%-ного раствора вторичного фосфата и экстрагируют смесью гексан/этилацетат. Сушат и получают 7,1 г целевого продукта. СТАДИЯ С. 36 Растворяют 7,1 г продукта в 100 мл тетрагидрофурана. Добавляют 0,7 г палладия на угле и помещают в атмосферу водорода. Через 3 ч перемешивания реакцию завершают. Реакционную среду фильтруют и фильтрат выпаривают досуха. Продукт перекристаллизовывают в смеси эфир/пентан. Получают 4,75 г целевого продукта. Выход продукта 95%. СТАДИЯ D. Растворяют 1,5 г продукта, полученного на предыдущем этапе, в 25 мл метиленхлорида. Добавляют 0,99 г диметиламинопиридина и в атмосфере аргона при 0 С по капле 0,38 мл уксусного ангидрида. Через 30 мин перемешивания при 0 С добавляют 95 мкл уксусного ангидрида и 0,225 г диметиламинопиридина. Перемешивают 45 мин. Реакционную среду разбавляют с помощью 100 мл смеси гептан(1)/этилацетат (2). Органическую фазу промывают два раза по 150 мл 1 М водного раствора первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Выделяют целевой продукт. Получают 1,56 г целевого продукта. Выход продукта 93%. СТАДИЯ Е. Растворяют 1,5 г продукта, полученного на предыдущем этапе, в 15 мл пиридина, высушенного над гидроксидом калия. При комнатной температуре добавляют 3,6 г пропаргилгидроксиламин хлоргидрата и 0,36 г перхлората лития. Реакционную среду перемешивают 48 ч при комнатной температуре. Разбавляют смесью гептан (1)/этилацетат (2) и органическую фазу промывают 10%-ным раствором вторичного сульфата натрия, сушат над сульфатом магния. Получают 1,8 г целевого продукта. 200 мг этого неочищенного продукта очищают на двуокиси кремния, элюируя смесью метиленхлорид(80)/трет.бутилметилэфир (20). Получают 90 мг целевого продукта с изомерией в положении 3 и 75 мг продукта с изомерией в положении 2. Выход 77% 55/45 с изомерией в положении 3. Растворяют 0,5 г продукта, полученного на предыдущем этапе, в 5 мл этанола. При комнатной температуре добавляют 0,85 г хлоргидрата метилгидроксиламина и 0,94 г ацетата калия. Реакционную среду перемешивают 5 ч при комнатной температуре. Разбавляют смесью гептан(1)/этилацетат (2) и органическую фазу промывают 1 М раствором первичного фосфата натрия,сушат над сульфатом магния и выпаривают досуха. Получают неочищенный продукт, который очищают на двуокиси кремния с элюирующей смесью метиленхлорида с 20% трет.бутилметилэфира. Получают 0,095 г целевого продукта. СТАДИЯ G. Растворяют 0,6 г продукта, полученного как описано на стадии С примера 9, в 15 мл метиленхлорида. Добавляют 0,36 г диметиламинопиридина и в атмосфере аргона при 0 С по капле 0,20 г пропионового ангидрида. Перемешивают 30 мин при 0 С, затем 1 ч при 38 комнатной температуре. Реакционную среду разбавляют с помощью 100 мл смеси гептан(1)/этилацетат (2). Органическую фазу промывают 1 М водным раствором первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,6 г целевого продукта. Выход продукта 68%. СТАДИЯ В. Растворяют 0,6 г продукта, полученного на предыдущем этапе, в 6 мл пиридина, высушенного над гидроксидом калия. При комнатной температуре добавляют 1,39 г пропаргилгидроксиламин хлоргидрата и 0,13 г перхлората лития. Реакционную среду перемешивают 48 ч при комнатной температуре. Разбавляют смесью гептан(1)/этилацетат(2) и органическую фазу промывают 10%-ным раствором вторичного сульфата натрия, сушат над сульфатом магния. Получают 0,56 г продукта, который растворяют в 10 мл этанола, добавляют 1,07 г хлоргидрата метилгидроксиламина и 1,39 г ацетата натрия. Реакционную среду перемешивают 5 ч при комнатной температуре. Разбавляют смесью гептан(1)/этилацетат(2) и органическую фазу промывают 1 М раствором первичного фосфата натрия, сушат над сульфатом магния и выпаривают досуха. Получают 0,45 г неочищенного продукта, который очищают хроматографией на двуокиси кремния, элюируя смесью метиленхлорида с 20% трет.бутилметилэфира. Получают 0,170 г целевого продукта. При выполнении вышеописанных действий были также получены продукты, отвечающие формуле В результате выполнения действий, описанных выше, были получены следующие продукты, отвечающие формуле (I) При выполнении вышеуказанных операций были получены следующие соединения: 3-[1-(5-хлор-1,2,3-тиадиазол-4-ил)метокси]имино]этил]-7-[(6-деокси-5-С-метил-4-Oметил-альфа-L-ликсогексопиранозил)окси]-4 гидрокси-8-метил-2 Н-1-бензопиран-2-он,3'эфир (2-пропинилокси)карбаминовой кислоты; 3-[1-[(цианометокси)имино]этил]-7-[(6 деокси-5-С-метил-4-O-метил-альфа-L-ликсогексопиранозил)окси]-4-гидрокси-8-метил-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 3-[1-[(2-аминоэтокси)имино]этил]-7-[(6 деокси-5-С-метил-4-O-метил-альфа-L-ликсогексопиранозил)окси]-4-гидрокси-8-метил-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси) карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-[1-[(2-гидроксиэтокси)имино]этил]-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-[1-(3-пиперидинил)окси]имино]этил]2H-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты (изомер В); 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-[1-(3-пиперидинил)окси]имино]этил] 41 2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты (изомер А); 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8 метил-3-[1-[(1-метилэтокси)имино]этил]-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 3-[1-[(циклобутилокси)имино]этил]-7-[(6 деокси-5-С-метил-4-O-метил-альфа-L-ликсогексопиранозил)окси]-4-гидрокси-8-метил-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-[1-(пропоксиимино)этил]-2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-1-[2,2,2-трифторэтоксиимино]этил]-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-[1-(пентафторфенил)метокси]имино] этил]-2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси) карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-4-гидрокси-8-метил-3-[1-3-[4-(3-пиридинил)-1H-имидазол-1 ил]пропокси]имино]этил]-2 Н-1-бензопиран-2 он, 3'-эфир (2-пропинилокси)-карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-8-метил-3[1-2-(1-пиперидинил)этокси]имино]этил]-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-8-метил-3[1-2-(4-морфолинил)этокси]имино]этил]-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-8-метил-3[1-(метоксиимино)пропил]-2 Н-1-бензопиран-2-он,3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-8-метил-3[1-[(2,2,2-трифторэтокси)имино]пропил]-2 Н-1 бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-8-метил-3[1-(пропоксиимино)пропил]-2 Н-1-бензопиран-2 он, 3'-эфир (2-пропинилокси) карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-3-[1-(этоксиимино) пропил]-4-гидрокси-8-метил-2 Н-1-бензопиран-2 он, 3'-эфир (2-пропинилокси)карбаминовой кислоты;(2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-3-метил-3[1-(3-тиенил)метокси]имино]этил]-2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-3-[1-(2 фуранил)метокси]имино]этил]-8-метил-2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-3-[1-(3,5 диметилизоксазол-4-ил)метокси]имино]этил]-8 метил-2 Н-1-бензопиран-2-он, 3'-эфир (2-пропинилокси) карбаминовой кислоты; 7-[(6-деокси-5-С-метил-4-O-метил-альфа-Lликсогексопиранозил)окси]-4-гидрокси-8-метил-3[1-(феноксиимино)этил]-2 Н-1-бензопиран-2-он, 3'эфир (2-пропинилокси)карбаминовой кислоты; метил 1-[7-6-деокси-5-С-метил-4-O-метил-3O-(2-пропинилокси)амино]карбонил]-альфа-Lликсогексопиранозил]окси]-4-гидрокси-8-метил-2 оксо-2 Н-1-бензопиран-3-ил]этилиден]амино]окси] ацетат. ПРИМЕРЫ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ Были приготовлены таблетки, содержащие: Соединение примера 1 150 мг Эксципиент До 1 г Эксципиент: крахмал, тальк или стеарат магния. Соединение примера 5 150 мг Эксципиент До 1 г Эксципиент: крахмал, тальк или стеарат магния. На основе соединений в солевой форме были получены растворы для инъекций. ФАРМАКОЛОГИЧЕСКОЕ ИСПЫТАНИЕ СОЕДИНЕНИЙ СОГЛАСНО ИЗОБРЕТЕНИЮ А. Метод разбавлений в жидкой среде 43 Был подготовлен ряд пробирок, в которые поместили одинаковое количество стерильной питательной среды. В каждую пробирку помещают изучаемый продукт в возрастающем количестве, затем каждую пробирку осеменяют бактериальным штаммом. После 24-х часовой инкубации в сушильном шкафу (термостате) при 37 С, замедление роста оценивают путем трансиллюминации, что позволяет определить минимальные ингибирующие концентрацииEntero faecalis 0,3 1,2 1,2 1,2 02D2UC5 Б. Ингибирование гиразы В Соединения согласно изобретению являются ингибиторами гиразы В; доза соединения,вызывающая 50%-ую суперспиролизацию ДНК,ниже 5 мг/мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой Y означает атом кислорода или радикал N-Nалк 1 или NОалк 2, в котором алк 1 и алк 2 означают радикал алкил, содержащий до 12 атомов углерода, при необходимости прерванный одним или несколькими атомами кислорода, серы или азота, при необходимости замещенный одним или несколькими атомами галогена, радикалом арил [при необходимости замещенным одним или несколькими атомами 44 галогена], гетероциклическим радикалом, одним или несколькими радикалами в котором Ra и Rb одинаковые или различные означают атом водорода, радикал алкил, содержащий до 8 атомов углерода, при необходимости замещенный, или Ra и Rb образуют вместе с атомом азота, с которым они соединены, гетероцикл, который может содержать также другой гетероатом, выбираемый из кислорода, серы или азота,Х означает атом водорода, гидроксильный радикал, радикал алкил, алкенил или алкинил,при необходимости прерванный одним или несколькими атомами кислорода, серы или азота,линейный, разветвленный или циклический,содержащий до 12 атомов углерода, при необходимости замещенный одним или несколькими атомами галогена, гетероциклическим радикалом, одним или несколькими радикалами ОН,свободными или тарифицированными группойCN, NO2, в которой Ra и Rb, одинаковые или разные, означают атом водорода, радикал алкил, содержащий до 8 атомов углерода, или Ra и Rb вместе с атомом азота, с которым они связаны, образуют гетероцикл, содержащий при необходимости другой гетероатом, выбираемый из азота,серы или кислорода, или Х означает радикал алкокси или радикал в котором Re означает радикал алкил, содержащий до 8 атомов углерода, при необходимости замещенный одним или несколькими заместителями, указанными выше,или Х означает радикал NRcRd, в которомRc и Rd, одинаковые или разные, означают атом водорода или радикал алкил, содержащий до 12 атомов углерода, при необходимости замещенный одним или несколькими заместителями,указанными выше; или Rc и Rd образуют вместе с атомом азота, с которым они связаны, гетероцикл, содержащий при необходимости другой гетероатом, выбираемый из азота, серы или кислорода,Z означает атом водорода или галогена или группу ОН, свободную или превращенную в простой или сложный эфир,R2 означает атом водорода или галогена,R3 означает атом водорода, радикал алкил,содержащий до 8 атомов углерода, или атом галогена,R означает атом водорода или радикал алкил, содержащий до 4 атомов углерода,R1 означает атом водорода, радикал алкил,алкенил или алкинил, линейный, разветвленный или циклический, содержащий до 8 атомов уг 45 лерода, при необходимости замещенный одним или несколькими атомами галогена, радикалCN, радикал арил, содержащий до 14 атомов углерода,R5 означает атом водорода, радикал Oалкил, содержащий до 4 атомов углерода,или R6 означает радикал алкил или СН 2-Оалкил, в котором алкил означает содержащий до 8 атомов углерода радикал, а также этенил и пропенил,R7 означает атом водорода или радикал алкил, содержащий до 8 атомов углерода,или R6 и R7 вместе с атомом углерода, с которым они связаны, образуют цикл, содержащий до 8 атомов углерода,а также соли соединения формулы (I), когда соединения формулы (I) имеют основную функцию. 2. Соединения формулы (I) по п.1, в которых Y означает атом кислорода. 3. Соединения формулы (I), в которых Y означает радикал NO-алкил, в котором алкил содержит до 4 атомов углерода. 4. Соединения формулы (I) по п.3, в которых Y означает радикал NOC2H5. 5. Соединения формулы (I) по любому из пп.1-4, в которых Х означает радикал алкил,содержащий до 4 атомов углерода, и в частности радикал СН 3. 6. Соединения формулы (I) по любому из пп.1-4, в которых Х означает радикал NH2. 7. Соединения формулы (I) по любому из пп.1-4, в которых Х означает радикал 8. Соединения формулы (I) по любому из пп.1-7, в которых R1 означает радикал 9. Соединения формулы (I) по любому из пп.1-8, в которых R означает атом водорода. 10. Соединения формулы (I) по любому из пп.1-9, в которых R3 означает радикал метил. 11. Соединения формулы (I) по любому из пп.1-10, в которых Z означает атом водорода. 12. Соединения формулы (I) по любому из пп.1-11, в которых R2 означает атом водорода. 13. Соединения формулы (I) по любому из пп.1-12, в которых R5 означает радикал ОСН 3. 14. Соединения формулы (I) по любому из пп.1-13, в которых R6 означает радикал метил. 15. Соединения формулы (I) по любому из пп.1-14, в которых R7 означает радикал метил. 16. Соединения формулы (I) по любому из пп.1-14, в которых R7 означает радикал этил. 17. Соединения формулы (I) по любому из пп.1-13, в которых R6 и вместе с атомом углерода, с которым они связаны, образуют радикал циклопентил. 18. Соединения формулы (I) по п.1, имеющие следующие наименования: 46 7-6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил]окси]-4-гидрокси-8-метил-2-оксо-2 Н-1-бензопиран-3-карбоксамид, 3'эфир (2-пропинилокси)карбаминовой кислоты,7-6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил]окси]-4-гидрокси-8-метил-N-[2-(4-морфолинил)этил]-2-оксо-2 Н-1-бензопиран-3-карбоксамид, 3'-эфир (2-пропинилокси)карбаминовой кислоты,7-6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил]окси]-4-гидрокси-3-[1(метоксиимино)этил]-8-метил-2 Н-1-бензопиран 2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты,7-[(6-деокси-5-С-метил-4-O-метил-альфаL-ликсогексопиранозил)окси]-3-[1-(этоксиимино)этил]-4-гидрокси-8-метил-2 Н-1-бензопиран 2-он, 3'-эфир (2-пропинилокси)карбаминовой кислоты. 19. Соединения формулы (I) по п.1, имеющие следующие названия: 7-[(6-деокси-5-С-этил-4-O-метил-бета-Dгулопиранозил)окси]-4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2 Н-1-бензопиран-2-он, 3'эфир (2-пропинилокси)карбаминовой кислоты,[7R-(7-альфа, 8-бета, 9-бета, 10-альфа)]-(2 пропинилокси)карбамат 8-гидрокси-7-[4-гидрокси-3-[1-(метоксиимино)этил]-8-метил-2-оксо 2 Н-1-бензопиран-7-ил]-10-метокси-6-оксаспиро[4.5]декан-9-ила. 20. Применение соединений формулы (I) по любому из пп.1-18, а также их фармацевтически приемлемые соли в качестве лекарственных средств. 21. Применение соединений формулы (I) по п.19, а также их фармацевтически приемлемые соли в качестве лекарственных средств. 22. Фармацевтические композиции, содержащие в качестве активного начала, по меньшей мере, одно лекарственное средство, определенное в п.20 или 21. 23. Способ получения соединений формулы (I), определенных по любому из пп.1-19, заключающийся в том, что соединение формулы в которой радикалы R2, R3, Z, R5, R6 и R7 имеют указанное выше значение, OW означает блокированную гидроксильную группу, a W' означает радикал алкил или O-алкил, содержащий до 4 атомов углерода, подвергают воздействию агента, способного вводить радикал причем R и R1 имеют указанное выше значение,воздействию агента, способного высвобождать гидроксильный радикал из радикала OW,возможному воздействию агента, способного заменить W' на радикал X, отличный от алкила или O-алкила,возможному воздействию агента, способного ввести радикал Y, отличный от кислорода,возможному воздействию солеобразующего агента. 24. Применение соединений формулы (II),описанных в п.23, в качестве промежуточных соединений. 25. Способ по п.23, заключающийся в том,что соединение формулы (II) получено путем воздействия соединения формулы (III) в которой R2, R3 и Z имеют указанное выше значение, затем воздействию агента, блокирующего свободный гидроксильный радикал. 26. Применение соединений формулы (III),описанных в п.25, таких как в качестве промежуточных соединений. в которой R5, R6 и R7 имеют указанное выше значение, на соединение формулы (IV)
МПК / Метки
МПК: C07H 17/075, A61K 31/7048, A61P 3/04
Метки: применение, ароматические, амиды, средств, лекарственных, качестве, способ, получения
Код ссылки
<a href="https://eas.patents.su/25-3275-aromaticheskie-amidy-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Ароматические амиды, способ их получения и их применение в качестве лекарственных средств</a>
Предыдущий патент: Оксазолидиноны в качестве активного вещества при лечении инфекционных глазных болезней
Следующий патент: Производные тетрагидрохинолина в качестве антагонистов глицина
Случайный патент: Композиционные материалы на основе природных алюмосиликатов и наполнителей, смешиваемых в щелочной среде, и технологический процесс их производства





























