Способы и промежуточные соединения для получения замещенных производных хроманола
Номер патента: 2204
Опубликовано: 28.02.2002
Авторы: Пископио Энтони Д., Раггери Сэлли Г., Даггер Роберт В., Келли Сара И., Рэггон Джеффри В., Кэстэлди Майкл Дж., Хокинс Джоэл М., Кейрон Стивен
Формула / Реферат
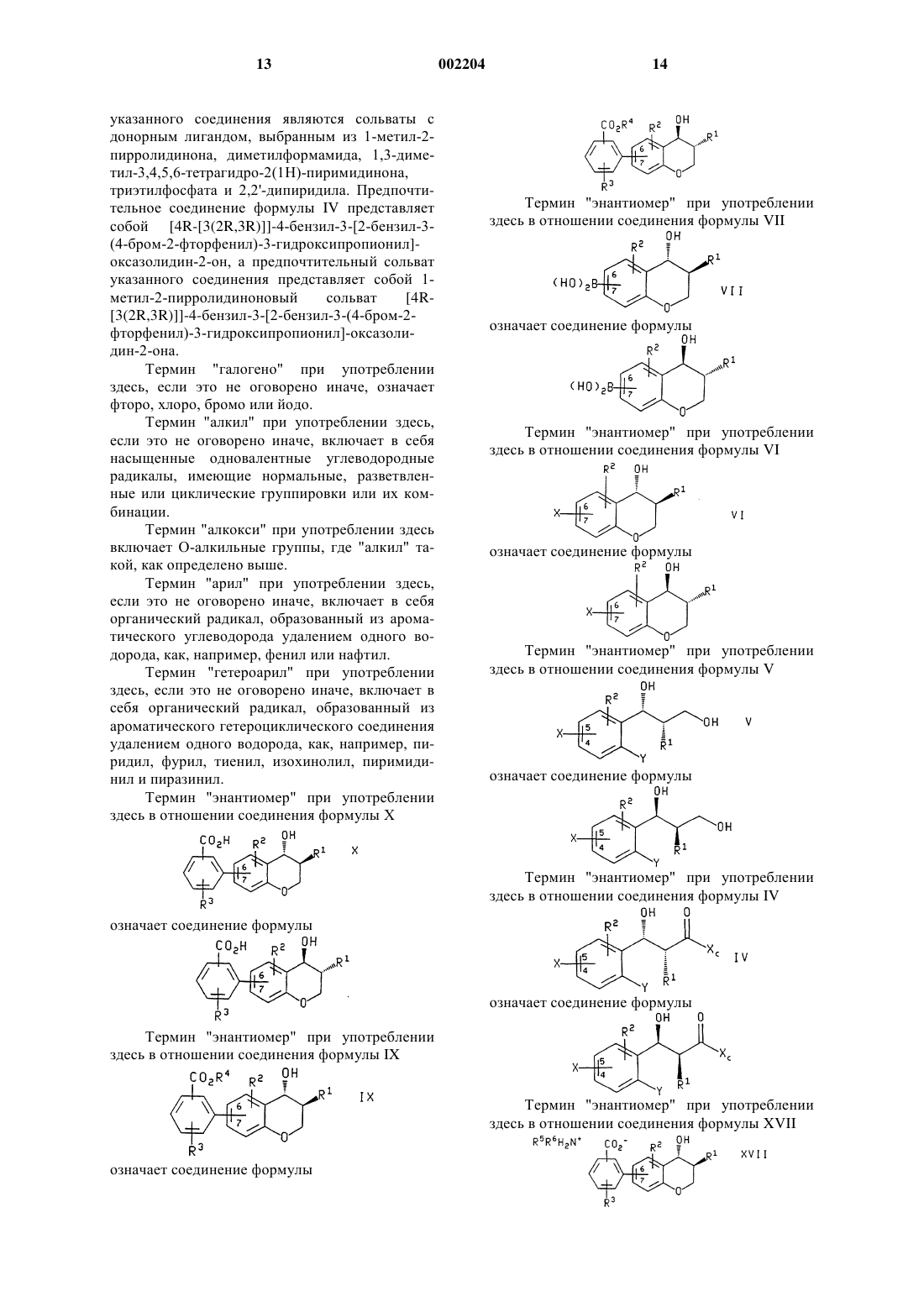
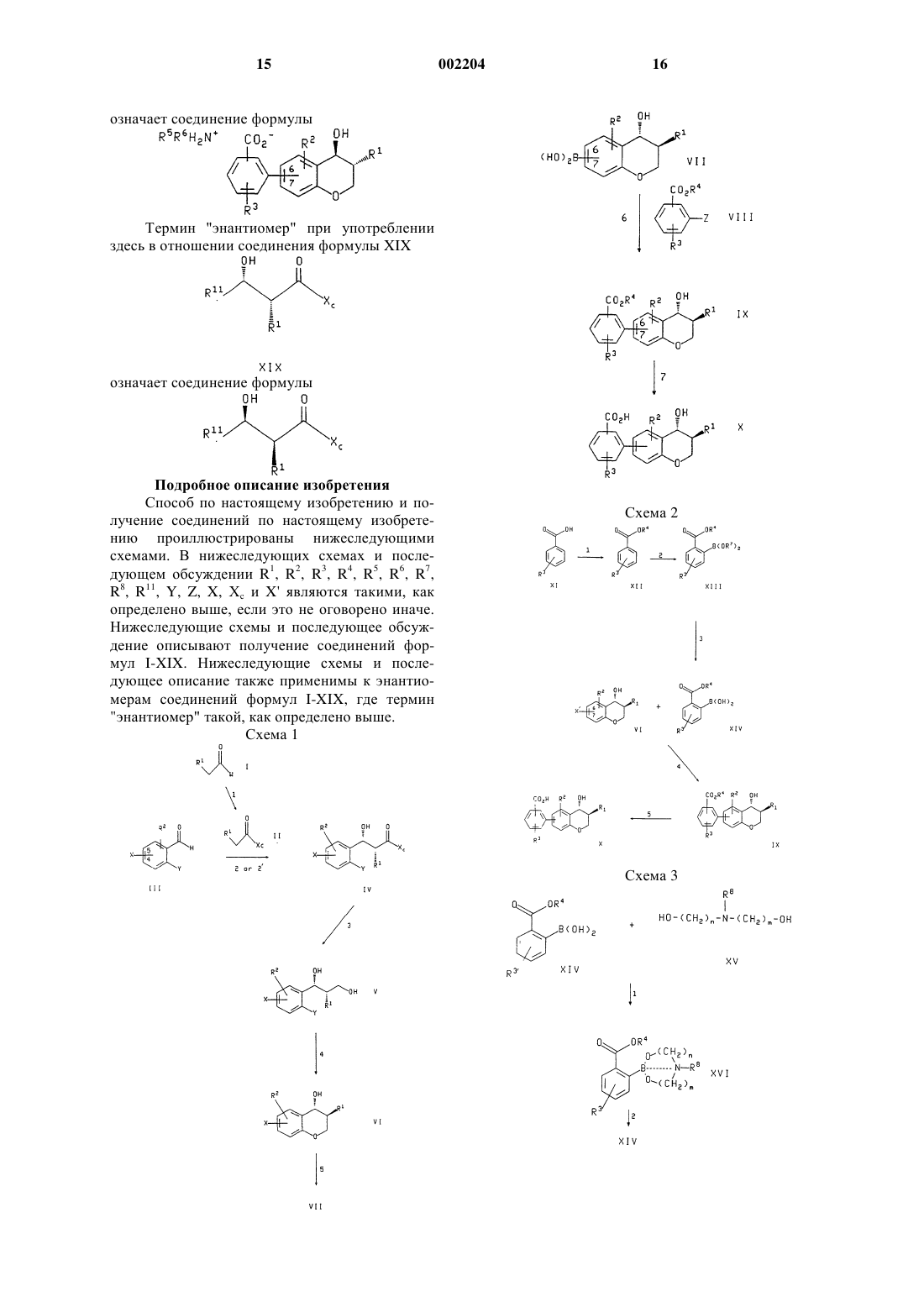
1. Способ получения соединения формулы
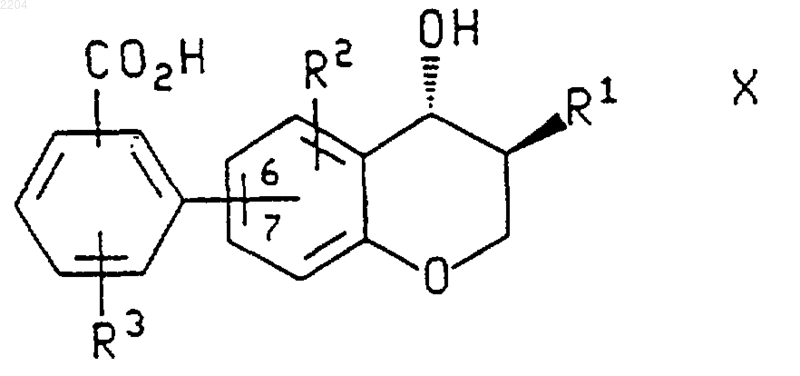
или энантиомера указанного соединения, где в указанном соединении формулы Х группировка R3-замещенной бензойной кислоты присоединена по атомам углерода 6 или 7 хроманового кольца;
R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2;
при котором соединение формулы
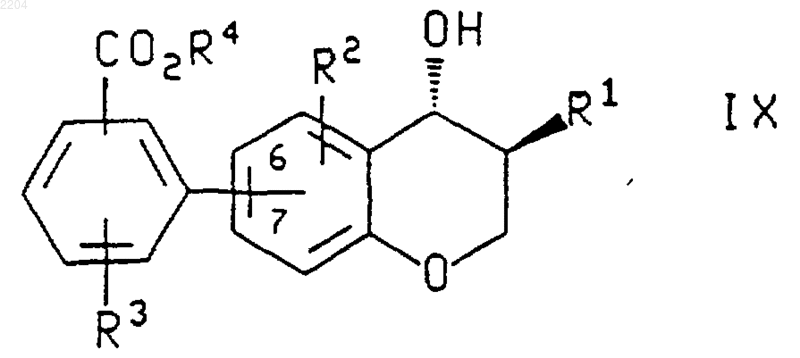
или энантиомер указанного соединения формулы IX в случае получения энантиомера указанного соединения формулы X, где R1, R2 и R3 такие, как определено выше, R4 представляет собой (С1-С6)алкил, а бензоатная группировка присоединена в положении 6 или 7 хроманового кольца, обрабатывают основанием.
2. Способ по п.1, при котором соединение формулы IX или энантиомер указанного соединения получают обработкой соединения формулы
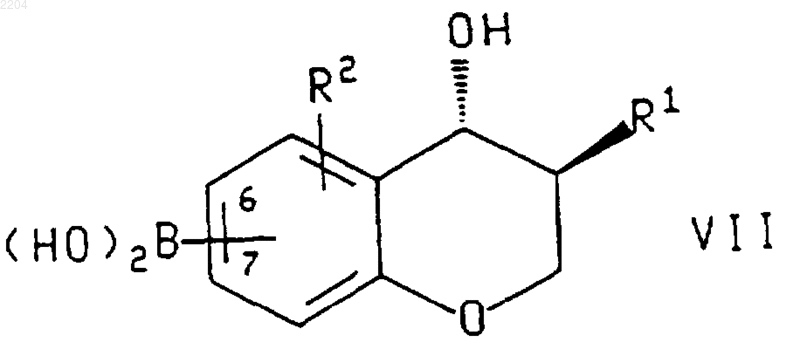
или энантиомера указанного соединения формулы VII в случае получения энантиомера указанного соединения формулы IX, где R1 и R2 такие, как определено в п.1, а группировка бороновой кислоты присоединена в положении 6 или 7 хроманового кольца, соединением формулы
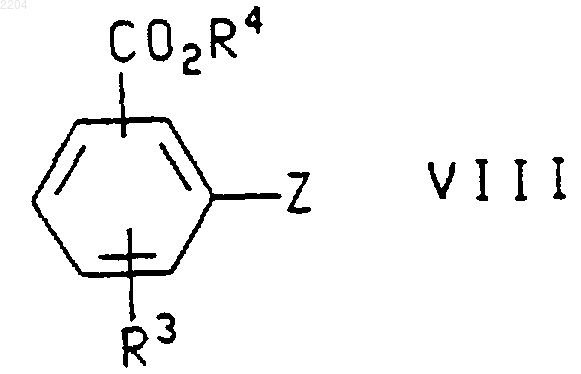
где R3 и R4 такие, как определено в п.1, a Z представляет собой галогено или (С1-С4)перфторалкилсульфонат, в присутствии основания или соли фтороводородной кислоты и палладиевого катализатора.
3. Способ по п.2, при котором соединение формулы VII или энантиомер указанного соединения, где R1 и R2 такие, как определено в п.2, получают обработкой соединения формулы
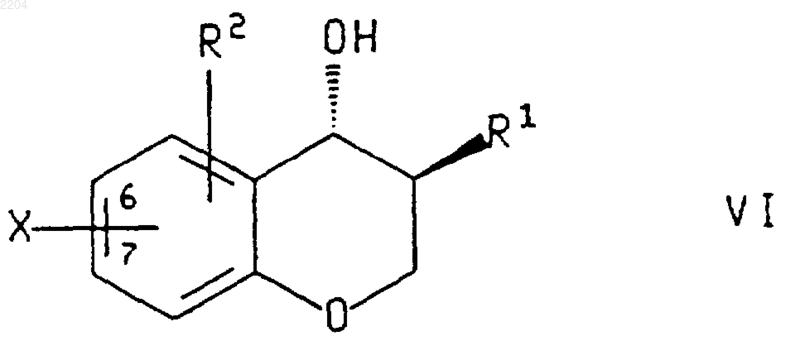
или энантиомера указанного соединения формулы VI в случае получения энантиомера указанного соединения формулы VII, где R1 и R2 такие, как определено в п.2, а Х представляет собой галогенид и присоединен в положении 6 или 7 хроманового кольца, (1) (С1-С4)алкиллитием и (2) борирующим реагентом.
4. Способ по п.3, при котором соединение формулы VI или энантиомер указанного соединения, где R1, R2 и Х такие, как определено в п.3, получают обработкой соединения формулы
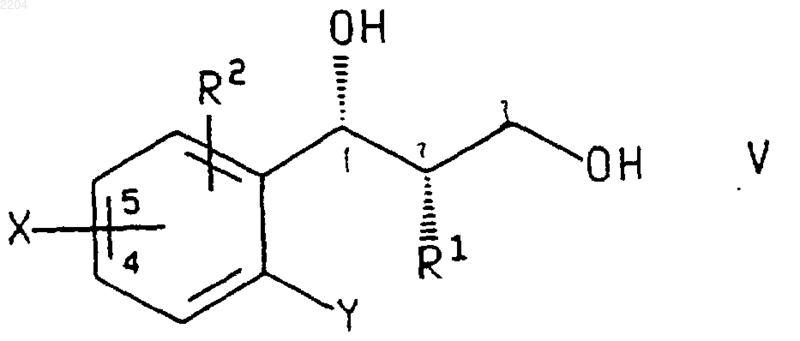
или энантиомера указанного соединения формулы V в случае получения энантиомера указанного соединения формулы VI, где R1, R2 и Х такие, как определено в п.3, и Х присоединен в положении 4 или 5 фенильного кольца, а Y представляет собой галогено или нитро, основанием, возможно в присутствии добавленных солей меди.
5. Способ по п.4, при котором соединение формулы V или энантиомер указанного соединения, где R1, R2, Х и Y такие, как определено в п.4, получают обработкой соединения формулы
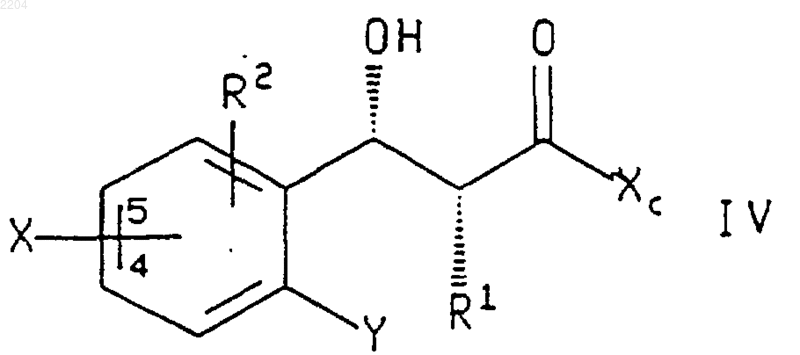
или энантиомера указанного соединения формулы IV в случае получения энантиомера указанного соединения формулы V, где R1, R2, Х и Y такие, как определено в п.4, и Х присоединен в положении 4 или 5 фенильного кольца, а Хc представляет собой (R)-4-бензил-2-оксазолиди-
нон, (S)-4-бензил-2-оксазолидинон, (4R,5S)-4-метил-5-фенилоксазолидин-2-он или (4S,5R)-4-метил-5-фенилоксазолидин-2-он, присоединенный по атому азота оксазолидин-2-онового кольца, гидридным восстанавливающим агентом.
6. Способ по п.5, при котором соединение формулы IV или энантиомер указанного соединения, где R1, R2, X, Xc и Y такие, как определено в п.5, получают обработкой соединения формулы R1-CH2C(O)-Xc, где R1 и Хc такие, как определено выше, (1) кислотой Льюиса, (2) основанием и (3) соединением формулы
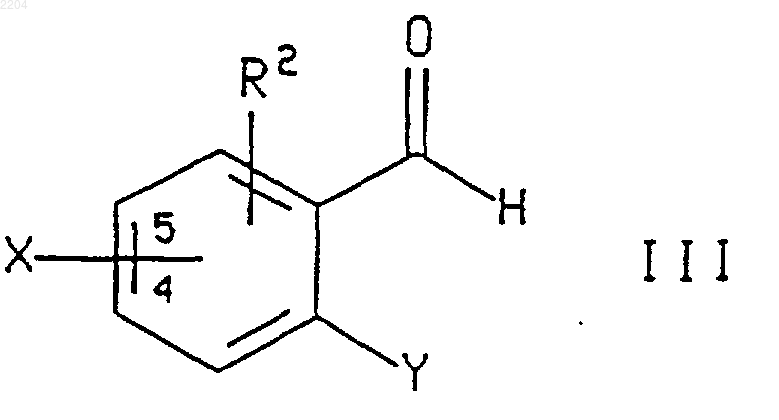
где R2, Х и Y такие, как определено в п.5, и Х присоединен в положении 4 или 5 фенильного кольца.
7. Способ по п.5, при котором соединение формулы IV или энантиомер указанного соединения формулы IV, где R1, R2, X, Хc и Y такие, как определено в п.5, получают обработкой соединения формулы R1-CH2C(O)-Xc, где R1 и Хc такие, как определено в п.5, (1) галогенидом титана (IV), (2) основанием, возможно с последующей обработкой донорным лигандом, и (3) соединением формулы
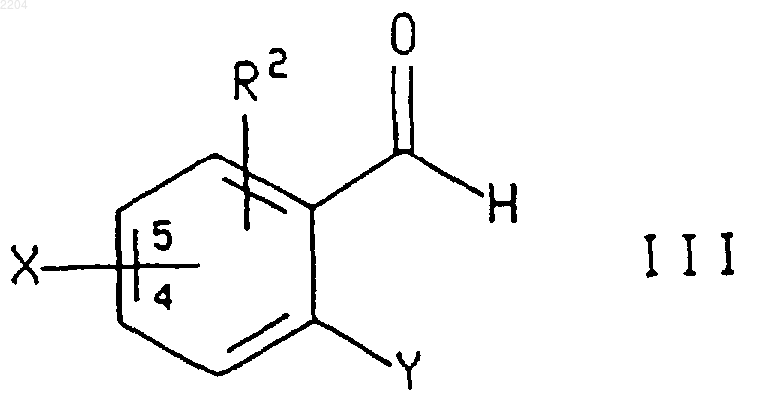
где R2, Х и Y такие, как определено в п.5, и Х присоединен в положении 4 или 5 фенильного кольца.
8. Способ по п.1, при котором соединение формулы IX или энантиомер указанного соединения, где R1, R2, R3 и R4 такие, как определено в п.1, получают сочетанием соединения формулы
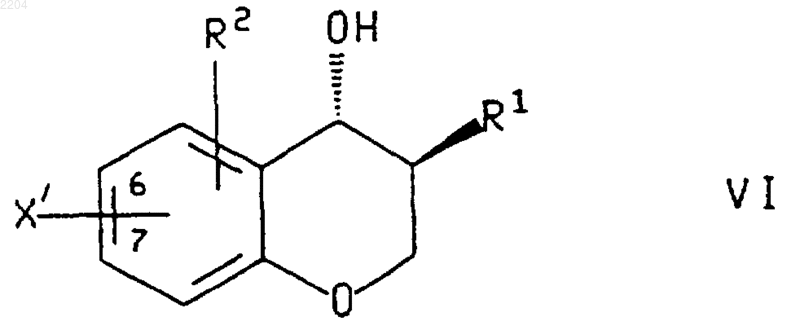
или энантиомера указанного соединения формулы VI в случае получения энантиомера указанного соединения формулы IX, где R1 и R2 такие, как определено в п.1, а X', который присоединен в положении 6 или 7 хроманового кольца, представляет собой галогено или (С1-С4)перфторалкилсульфонат, с соединением формулы
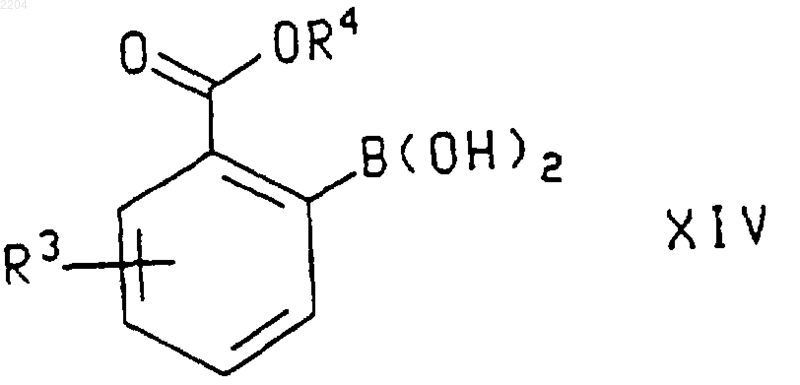
где R3 и R4 такие, как определено в п.1, в присутствии основания или соли фтороводородной кислоты и палладиевого катализатора.
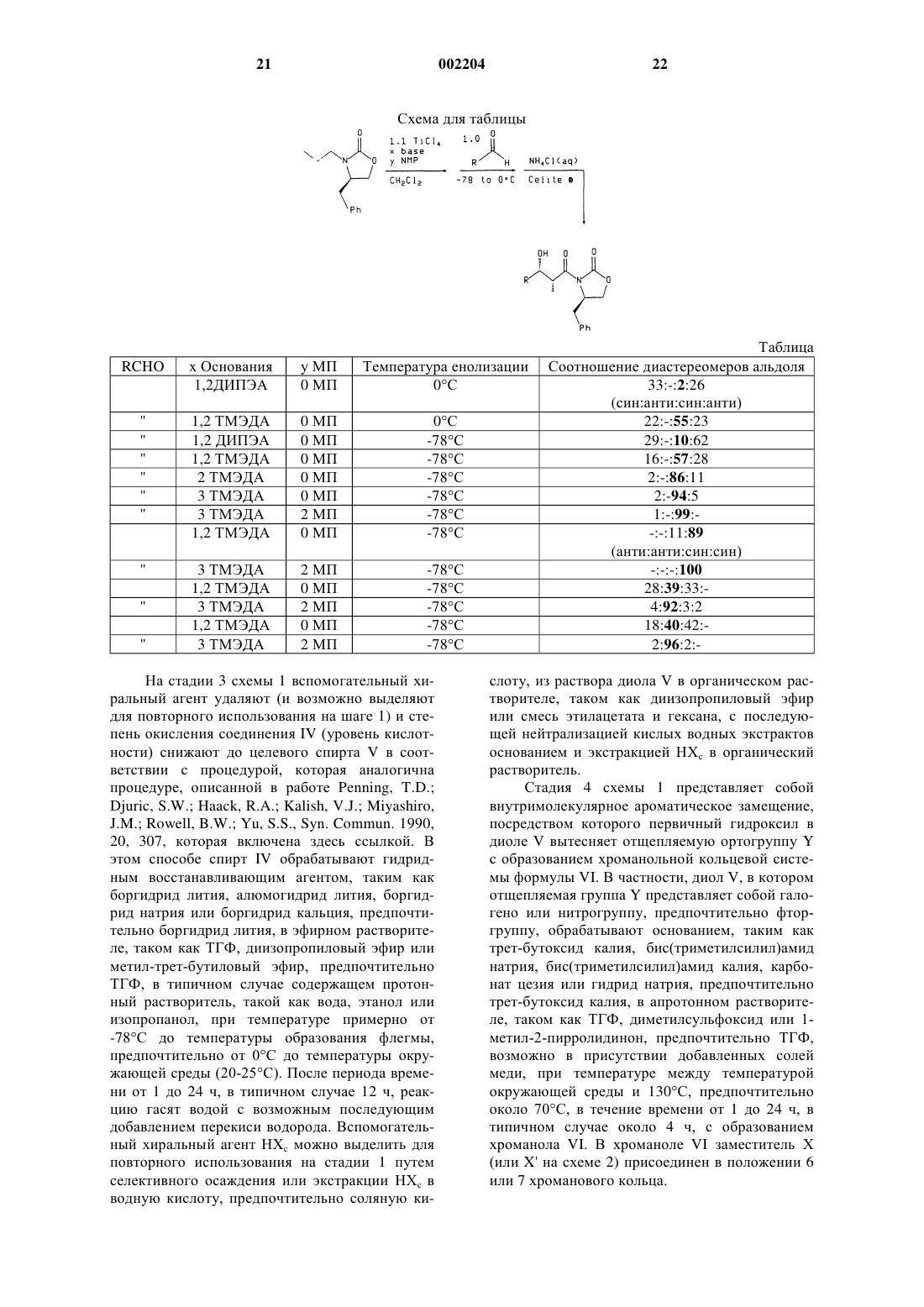
9. Способ по п.8, при котором соединение формулы XIV, где R3 и R4 такие, как определено в п.8, получают гидролизом соединения формулы
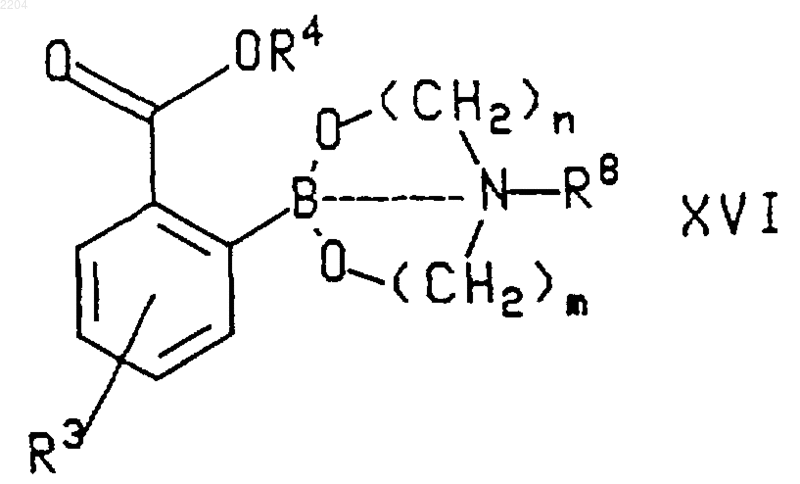
где R3 и R4 такие, как определено в п.8, пунктирная линия обозначает связь или отсутствие связи между атомами В и N, n и m независимо являются числом от 2 до 5, а R8 представляет собой Н или (С1-С6)алкил.
10. Способ по п.9, при котором соединение формулы XVI, где R3, R4 и R8 такие, как определено в п.9, получают взаимодействием соединения формулы
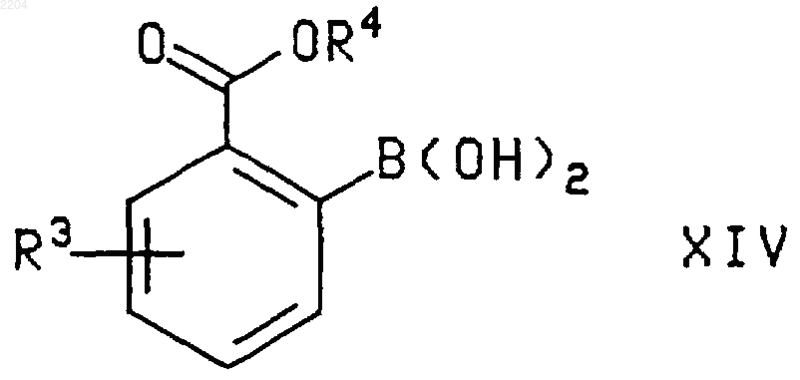
где R3 и R4 такие, как определено в п.9, с соединением формулы H(O)(CH2)m-N(R8)-(CH2)nOH, где n, m и R8 такие, как определено в п.9.
11. Способ по п.8, при котором соединение формулы XIV, где R4 и R3 такие, как определено в п.8, получают гидролизом соединения формулы

где R3 и R4 такие, как определено в п.8, а R7 представляет собой (С1-С6)алкил.
12. Способ по п.11, при котором соединение формулы XIII, где R3, R4 и R7 такие, как определено в п.11, получают обработкой соединения формулы
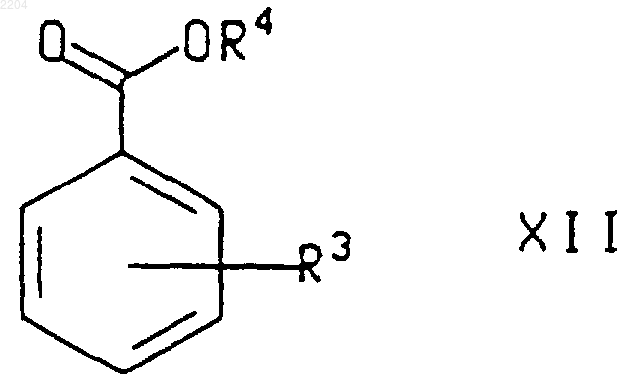
где R3 и R4 такие, как определено в п.11, металламидным основанием в присутствии три((С1-С6)алкил)бората.
13. Способ по п.1, дополнительно включающий в себя взаимодействие соединения формулы Х или энантиомера указанного соединения, где R1, R2 и R3 такие, как определено в п.1, со вторичным амином формулы NHR5R6, где R5 и R6 такие, как определено в п.1, с образованием карбоксилата аммония формулы
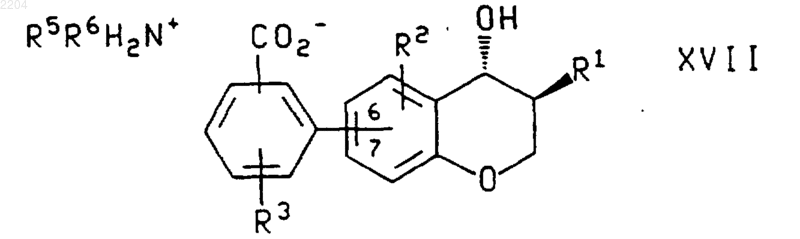
или энантиомера указанного соединения формулы XVII, если его получают из энантиомера указанного соединения формулы X, где R1, R2, R3, R5 и R6 такие, как определено в п.1.
14. Способ получения соединения формулы
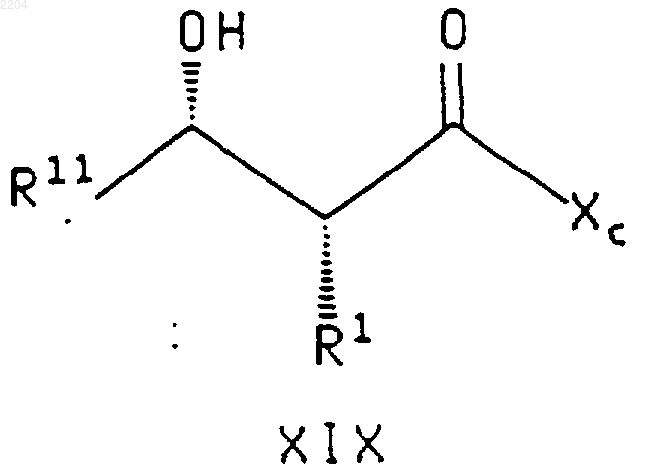
или энантиомера указанного соединения,
где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((C1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2;
Хс представляет собой (R)-4-бензил-2-оксазолидинон, (S)-4-бензил-2-оксазолидинон, (4R,5S)-4-метил-5-фенилоксазолидин-2-он или (4S,5R)-4-метил-5-фенилоксазолидин-2-он, присоединенный по атому азота оксазолидин-2-онового кольца; и
R11 представляет собой (С1-С9)алкил, (С2-С9)алкенил или фенил, замещенный группой Y в положении 2, Х в положении 4 или 5 и R2 в одном из остальных положений фенильной группировки, где Y представляет собой галогено, нитро или (С1-С4)алкокси, а Х представляет собой галогенид,
при котором соединение формулы R1-CH2C(O)-Xc, где R1 и Хс такие, как определено выше, обрабатывают (1) галогенидом титана (IV), (2) основанием, возможно с последующей обработкой донорным лигандом и (3) менее чем двумя эквивалентами соединения формулы R11C(O)H, где R11 такой, как определено выше, относительно количества указанного соединения формулы R1-CH2C(O)-Xc.
15. Соединение формулы
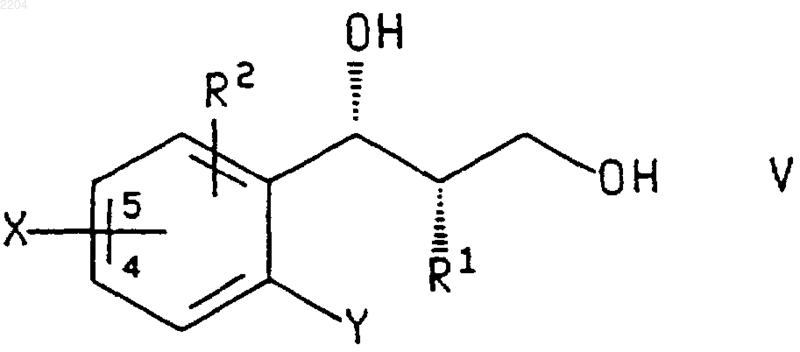
или энантиомер указанного соединения,
где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((C1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2;
Х представляет собой галогеногруппу и присоединен по положению 4 или 5 фенильного кольца; и
Y представляет собой галогено или нитро.
16. Соединение формулы
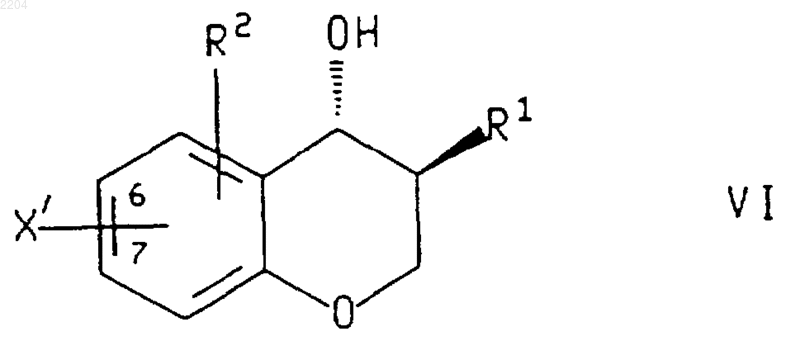
или энантиомер указанного соединения,
где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2;
X' представляет собой галогено или (С1-С4)перфторалкилсульфонат и присоединен в положении 6 или 7 хроманового кольца.
17. Соединение формулы
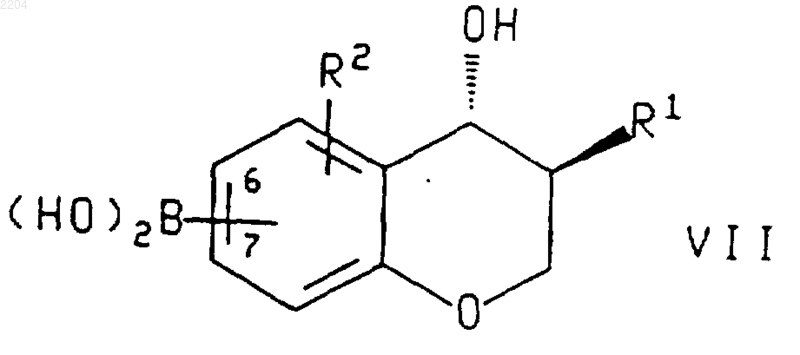
или энантиомер указанного соединения,
где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((C1-С6)алкил) и фенильные группировки указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; и
группировка бороновой кислоты присоединена в положении 6 или 7 хроманового кольца.
18. Соединение формулы

или энантиомер указанного соединения, где бензоатная группировка присоединена по атому углерода 6 или 7 хроманового кольца;
R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка групп алкокси и -S(O)n((С1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R4 представляет собой (С1-С6)алкил;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2.
19. Соединение формулы

где R3 выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R4 представляет собой (С1-С6)алкил; и
R7 представляет собой (С1-С6)алкил.
20. Соединение формулы
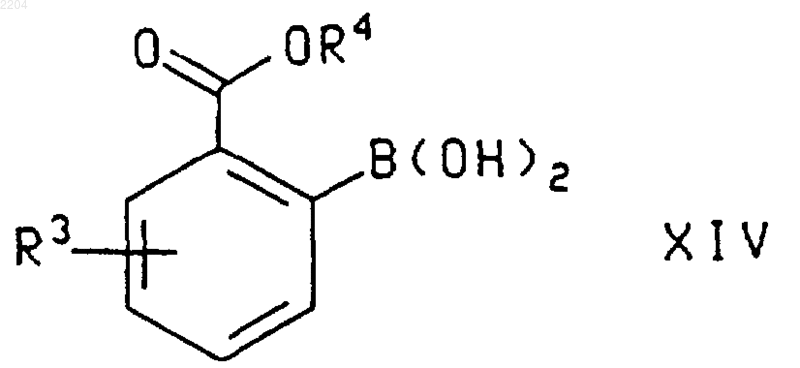
где R3 выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильные группировки указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3; и
R4 представляет собой (С1-С6)алкил.
21. Соединение формулы
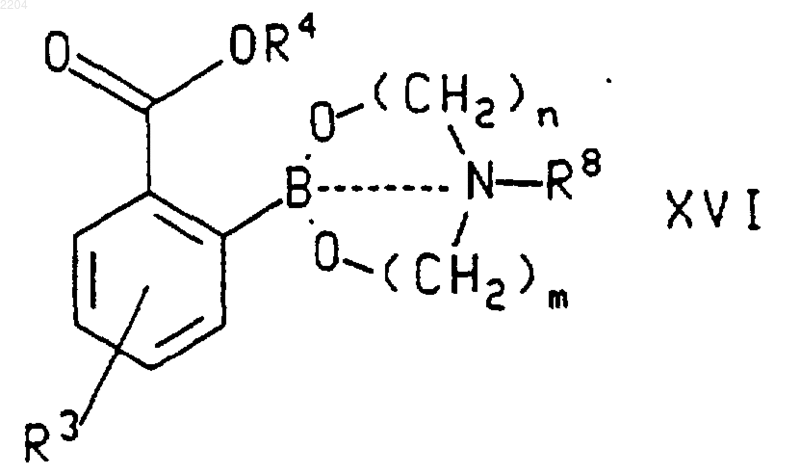
где пунктирная линия обозначает связь или отсутствие связи между атомами В и N;
n и m независимо являются числом от 2 до 5;
R3 выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильные группировки указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R4 представляет собой (С1-С6)алкил; и
R8 представляет собой Н или (С1-С6)алкил.
22. Карбоксилат аммония формулы
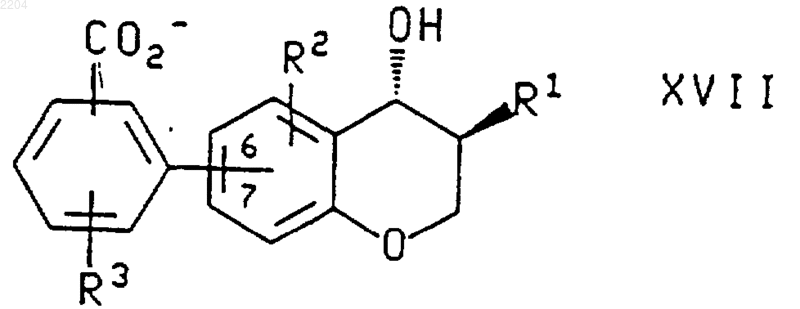
или энантиомер указанного соединения, где в указанном карбоксилате формулы XVII R3-замещенная фенильная группировка присоединена по атому углерода 6 или 7 хроманового кольца;
R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
каждый R5 независимо представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
каждый R6 независимо представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2.
23. Соединение формулы
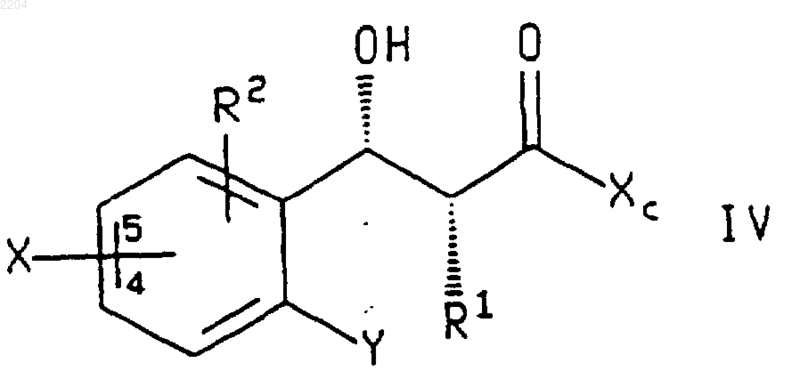
или энантиомер указанного соединения, где Х присоединен в положении 4 или 5 фенильной группировки;
R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4;
каждый R2 независимо выбран из группы, которую составляют Н, фторо, хлоро, (С1-С6)алкил, (С1-С6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)n((С1-С6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)n((С1-С6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
R5 представляет собой Н, (С1-С6)алкил или R2-замещенный фенил;
R6 представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2;
Х представляет собой галогено;
Y представляет собой галогено или нитро; и
Хс представляет собой (R)-4-бензил-2-оксазолидинон, (S)-4-бензил-2-оксазолидинон, (4R,5S)-4-метил-5-фенилоксазолидин-2-он или (4S,5R)-4-метил-5-фенилоксазолидин-2-он, присоединенный по атому азота оксазолидин-2-онового кольца.
Текст
1 Предпосылки изобретения Данное изобретение относится к получению замещенных производных хроманола и к промежуточным соединениям, которые полезны при указанном получении. Замещенные производные хроманола, которые получают в соответствии с настоящим изобретением, известны[публикация международной заявки РСТWO 96/11925 (опубликована 25 апреля 1996 г.); публикация международной заявки РСТWO 96/11920 (опубликована 25 апреля 1996 г.); публикация международной заявки РСТWO 93/15066 (опубликована 5 августа 1993 г.)]. Содержание всех вышеупомянутых международных заявок РСТ включено здесь посредством ссылки. Известен (WO 96/11925) способ получения соединения формулы Х или энантиомера указанного соединения, где R1,R2 и R3 имеют значения, определенные ниже,при котором соединение формулы или энантиомер указанного соединения формулы XXV, где R1, R2 и R3 такие, как определено выше, обрабатывают избытком метилиодида с последующим омылением полученной иминиевой соли щелочью в воде или в смеси воды и смешивающегося с ней сорастворителя. В задачу настоящего изобретения входило создание нового альтернативного способа получения известных производных хроманола с использованием новых промежуточных соединений. Замещенные производные хроманола, которые получают в соответствии с данным изобретением, ингибируют действие LTB4 (лейкотриена В 4), как это раскрыто в заявке на патент США серийный номер 08/295827, упомянутой выше. В качестве антагонистов LTB4 замещенные производные хроманола, которые получают в соответствии с данным изобретением, полезны при лечении заболеваний, которые вызываетLTB4, таких как воспалительные нарушения,включая ревматоидный артрит, остеоартрит,воспаление кишечника, псориаз, экзему, эритему, зуд, воспаление сальных желез, инсульт,отторжение трансплантата, аутоиммунные заболевания и астму. Сущность изобретения Данное изобретение относится к способу получения соединения формулы или энантиомера указанного соединения, где в указанном соединении формулы Х группировкаR3-замещенной бензойной кислоты присоединена по атомам углерода 6 и 7 хроманового кольца;q является числом от 0 до 4; каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро,(С 1-С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил,фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами числом от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; при котором соединение формулы или энантиомер указанного соединения формулы IX в случае получения энантиомера указанного соединения формулы X, где R1, R2 и R3 такие, как определено выше, R4 представляет собой (С 1-С 6)алкил, а бензоатная группировка присоединена в положении 6 или 7 хроманового кольца, обрабатывают основанием. В указанном способе получения соединения формулы Х соединение формулы IX предпочтительно обрабатывают водным гидроксидным основанием, R1 предпочтительно представляет собой бензил, 4-фторбензил, 4-фенилбензил, 4-(4-фторфенил)-бензил или фенэтил, R2 предпочтительно представляет собой водород или фторо, R3 предпочтительно представляет собой фторо, хлоро или метил, возможно замещенный атомами фтора в количестве от 1 до 3, аR4 предпочтительно представляет собой этил или 2,2-диметилпропил. Наиболее предпочтительно указанное соединение формулы IX обрабатывают основанием, содержащим водный гидроксид натрия, указанное соединение формулы IX представляет собой этиловый эфир(3S,4R)-2-(3-бензил-4-гидроксихроман-7-ил)-4 трифторметилбензойной кислоты и указанное соединение формулы Х представляет собой(3S,4R)-2-(3-бензил-4-гидроксихроман-7-ил)-4 трифторметилбензойную кислоту. Согласно еще одному аспекту настоящего изобретения указанное соединение формулы IX или энантиомер указанного соединения, где R1,R2, R3 и R4 такие, как определено выше, получают обработкой соединения формулы или энантиомера указанного соединения формулы VII в случае получения энантиомера соединения формулы IX, где R1 и R2 такие, как определено выше, а группировка бороновой кислоты присоединена в положении 6 или 7 хроманового кольца, соединением формулы где R3 и R4 такие, как определено выше, a Z представляет собой галогено или (С 1-С 4) перфторалкилсульфонат, в присутствии основания или соли фтороводородной кислоты и палладиевого катализатора. В указанном способе получения производства соединения формулы IX или энантиомера указанного соединения предпочтительные заместители для R1, R2, R3 и R4 являются такими же, как обозначено выше для указанного способа производства соединения формулы X. В другом предпочтительном воплощении Z представляет собой галогено, основание или соль фтороводородной кислоты выбраны из карбоната натрия, триэтиламина, бикарбоната натрия, карбоната цезия, ортофосфата калия, фторида калия,фторида цезия, гидроксида натрия, гидроксида бария и фторида тетрабутиламмония, палладиевый катализатор выбран из тетракис(трифенилфосфин)палладия (0), дихлорбис(трифенилфосфин)палладия (II), ацетата палладия (II), димера хлорида аллилпалладия,трис(дибензилиденацетон)дипалладия (0) и 10% палладия на углероде. Наиболее предпочтительно основание или соль фтороводородной кислоты представляет собой фторид калия, палладиевый катализатор представляет собой 10% палладий на углероде, соединение формулы VII представляет собой(3S,4R)-(3-бензил-4 гидроксихроман-7-ил)-бороновую кислоту, а соединение формулы VIII представляет собой 2 йод-4-трифторметилбензоат. Согласно еще одному аспекту этого изобретения соединение формулы VII или энантиомер указанного соединения, где R1 и R2 такие, как определено выше, получают обработкой соединения формулы или энантиомера указанного соединения формулы VI в случае получения энантиомера соединения формулы VII, где R1 и R2 такие, как определено выше, а Х представляет собой галогенид и присоединен в положении 6 или 7 хроманового кольца, (1) (С 1-С 4)алкиллитием и (2) борирующим агентом. В указанном способе производства соединения формулы VII или энантиомера указанного соединения предпочтительные заместители дляR1 и R2 являются такими, как обозначено выше для указанного способа производства соединения формулы X. В другом предпочтительном воплощении Х представляет собой бромо или йодо, а указанное соединение формулы VI обрабатывают (1) метиллитием, (2) бутиллитием и(3) указанным борирующим агентом, который выбирают из борантетрагидрофуранового комплекса, триизопропилбората и триметилбората. Наиболее предпочтительно соединение формулы VI представляет собой (3S,4R)-3-бензил-7 бромхроман-4-ол, а указанный борирущий агент представляет собой борантетрагидрофурановый комплекс. Согласно еще одному аспекту этого изобретения соединение формулы VI или энантиомер указанного соединения, где R1, R2 и Х такие, как определено выше, получают обработкой соединения формулы или энантиомера указанного соединения формулы V в случае получения энантиомера соединения формулы VI, где R1, R2 и Х такие, как определено выше, и Х присоединен в положении 4 или 5 фенильного кольца, a Y представляет собой галогено или нитрогруппу, основанием, возможно в присутствии добавленных солей меди. В указанном способе производства соединения формулы VI или энантиомера указанного соединения предпочтительные заместители дляR1, R2 и Х являются такими, как обозначено выше для указанного способа производства соединения формулы VII. В другом предпочтительном воплощении Y представляет собой галогено, а указанное основание представляет собой трет-бутоксид калия, бис(триметилсилил)амид натрия, бис(триметилсилил)амид калия, карбонат цезия или гидрид натрия. Наиболее предпочтительно указанное основание представляет собой трет-бутоксид калия, а соединение формулы V представляет собой (1R,2S)-2-бензил-1(4-бром-2-фторфенил)-пропан-1,3-диол. 5 Согласно еще одному аспекту этого изобретения соединение формулы V или его энантиомер, где R1, R2, Х и Y такие, как определено выше, получают обработкой соединения формулы или энантиомера указанного соединения формулы IV в случае получения энантиомера соединения формулы V, где R1, R2, Х и Y такие,как определено выше, и Х присоединен в положении 4 или 5 фенильного кольца, а Хc представляет собой (R)-4-бензил-2-оксазолидинон,(S)-4-бензил-2-оксазолидинон, (4R,5S)-4-метил 5-фенилоксазолидин-2-он или (4S,5R)-4-метил 5-фенилоксазолидин-2-он, присоединенный по атому азота оксазолидин-2-онового кольца, гидридным восстанавливающим агентом. В указанном способе производства соединения формулы V или энантиомера указанного соединения предпочтительные заместители дляR1, R2, Х и Y являются такими, как обозначено выше для указанного способа производства соединения формулы VI. В другом предпочтительном воплощении указанным восстанавливающим агентом является боргидрид лития,алюмогидрид лития, боргидрид натрия или боргидрид кальция. Наиболее предпочтительно соединение формулы IV представляет собой 1 метил-2-пирролидиноновый сольват[4R[3(2R,3R)-4-бензил-3-[2-бензил-3-(4-бром-2 фторфенил)-3-гидроксипропионил]-оксазолидин-2-она или [4R-[3(2R,3R)-4-бензил-3-[2 бензил-3-(4-бром-2-фторфенил)-3-гидроксипропионил]-оксазолидин-2-он, а указанный восстанавливающий агент представляет собой боргидрид лития. Согласно еще одному аспекту этого изобретения соединение формулы IV или энантиомер указанного соединения, где R1, R2, X, Хc и Y такие, как определено выше, получают обработкой соединения формулы R1-CH2C(O)-Xc, где R1 и Хс такие, как определено выше, (1) кислотой Льюиса, (2) основанием и (3) соединением формулы где R2, Х и Y такие, как определено выше, и Х присоединен в положении 4 или 5 фенильного кольца. В указанном способе производства соединения формулы IV или энантиомера указанного соединения предпочтительные заместители дляR1, R2, X, Хс и Y являются такими, как обозначено выше для указанного способа производства соединения формулы V. В другом предпочтительном воплощении указанная кислота 6 Льюиса представляет собой галогенид или сульфонат бора, а указанное основание представляет собой триэтиламин или диизопропилэтиламин. Наиболее предпочтительно указанное соединение формулы R1-CH2C(O)-Xc представляет собой (R)-4-бензил-3-(3-фенилпропионил)оксазолидин-2-он, указанное соединение формулы III представляет собой 4-бром-2 фторбензальдегид, указанная кислота Льюиса представляет собой дибутилбортрифлат, а указанное основание представляет собой триэтиламин. Согласно еще одному аспекту этого изобретения соединение формулы IV или энантиомер указанного соединения, где R1, R2, X, Хс и Y такие, как определено выше, получают обработкой соединения формулы R1-CH2C(O)-Xc, где R1 и Хс такие, как определено выше, (1) галогенидом титана (IV), (2) основанием, возможно с последующей обработкой донорным лигандом,и (3) соединением формулы где R2, Х и Y такие, как определено выше, и Х присоединен в положении 4 или 5 фенильного кольца. В указанном способе производства соединения формулы IV или энантиомера указанного соединения предпочтительные заместители дляR1, R2, X, Хс и Y являются такими, как обозначено выше для указанного способа производства соединения формулы V. В другом предпочтительном воплощении указанный галогенид титана (IV) является тетрахлоридом титана, а указанное основание является третичным аминным или третичным диаминным основанием. В другом предпочтительном воплощении указанное основание является триэтиламином илиN,N,N',N'-тетраметилэтилендиамином, а за указанной обработкой указанным основанием следует обработка донорным лигандом, который выбран из 1-метил-2-пирролидинона, диметилформамида,1,3-диметил-3,4,5,6-тетрагидро 2(1 Н)-пиримидинона, триэтилфосфата и 2,2'дипиридила. Наиболее предпочтительно указанное соединение формулы R1-CH2C(O)-Xc представляет собой (R)-4-бензил-3-(3-фенилпропионил)-оксазолидин-2-он, указанное соединение формулы III представляет собой 4 бром-2-фторбензальдегид, указанное основание представляет собой N,N,N',N'-тетраметилэтилендиамин, а указанный донорный лиганд представляет собой 1-метил-2-пирролидон. Согласно еще одному аспекту этого изобретения указанное соединение формулы IX или энантиомер указанного соединения, где R1, R2,R3 и R4 такие, как определено выше, получают сочетанием соединения формулы или энантиомера указанного соединения в случае получения энантиомера соединения формулы IX, где R1 и R2 такие, как определено выше, аX', который присоединен в положении 6 или 7 хроманового кольца, представляет собой галогено или (С 1-С 4)перфторалкилсульфонат, с соединением формулы где R3 и R4 такие, как определено выше, в присутствии основания или соли фтороводородной кислоты и палладиевого катализатора. В способе производства соединения формулы IX или энантиомера указанного соединения, как изложено непосредственно выше,предпочтительные заместители для R1, R2, R3 иR4 являются такими, как обозначено выше для способа получения соединения формулы X. В другом предпочтительном воплощении X' предпочтительно представляет собой бромо, йодо или трифторметансульфонат, палладиевый катализатор предпочтительно выбран из тетракис(трифенилфосфин)палладия (0), дихлорбис(трифенилфосфин)палладия (II), ацетата палладия (II), димера хлорида аллилпалладия,трис(дибензилиденацетон)дипалладия (0) и 10% палладия на углероде, а основание или соль фтороводородной кислоты выбраны из карбоната натрия, триэтиламина, бикарбоната натрия,карбоната цезия, ортофосфата калия, фторида калия, фторида цезия, гидроксида натрия, гидроксида бария и фторида тетрабутиламмония. Наиболее предпочтительно соединение формулы VI представляет собой (3S,4R)-3-бензил-7 бромхроман-4-ол, соединение формулы XIV представляет собой 2-(2,2-диметилпропоксикарбонил)-5-трифторметилбензолбороновую кислоту, основание или соль фторводородной кислоты представляет собой карбонат натрия, а палладиевый катализатор представляет собой тетракис(трифенилфосфин)палладий (0). Согласно еще одному аспекту этого изобретения соединение формулы XIV, где R3 и R4 такие, как определено выше, получают гидролизом соединения формулы где R3 и R4 такие, как определено выше, пунктирная линия обозначает связь или отсутствие связи между атомами В и N, n и m независимо являются числом от 2 до 5, а R8 представляет собой Н или (С 1-С 6)алкил. Предпочтительно R8 8 представляет собой Н, а предпочтительные заместители для R3 и R4 такие, как обозначено выше для указанного способа получения соединения формулы X. Предпочтительно указанный гидролиз осуществляют с использованием кислоты, такой как соляная кислота, а n и m каждый равен 2. Наиболее предпочтительно указанное соединение формулы XVI представляет собой 2,2 диметилпропиловый эфир 2-[1,3,6,2]-диоксазаборокан-2-ил-4-трифторметилбензойной кислоты. Согласно еще одному аспекту этого изобретения соединение формулы XVI, где R3, R4 иR8 такие, как определено выше, получают взаимодействием соединения формулы XIV, где R3 иXV), где n, m и R8 такие, как определено выше. В указанном способе получения соединения формулы XVI предпочтительные заместители для R3 и R4 являются такими, как обозначено выше для указанного процесса приготовления соединения формулы X. Наиболее предпочтительно указанным соединение формулы XIV представляет собой 2-(2,2-диметилпропоксикарбонил)-5-трифторметилбензолбороновую кислоту, а указанное соединение формулы XV представляет собой диэтаноламин. Согласно еще одному аспекту этого изобретения соединение формулы XIV, где R3 и R4 такие, как определено выше, получают гидролизом соединения формулы где R3 и R4 такие, как определено выше, а R7 представляет собой (С 1-С 6)алкил. Предпочтительно указанный гидролиз осуществляют с использованием кислоты, такой как соляная кислота. Предпочтительные заместители для R3 и R4 являются такими, как обозначено выше для указанного процесса изготовления соединения формулы X. Согласно еще одному аспекту этого изобретения соединение формулы XIII, где R3, R4 иR7 такие, как определено выше, получают обработкой соединения формулы где R3 и R4 такие, как определено выше, металламидным основанием в присутствии триС 1 С 6)алкил)бората. В указанном способе производства соединения формулы XIII предпочтительные заместители для R3 и R4 являются такими, как обозначено выше для указанного способа произ 9 водства соединения формулы X. В другом предпочтительном воплощении указанное металламидное основание, выбрано из диизопропиламида лития, диэтиламида лития, 2,2,6,6 тетраметилпиперидина лития и бис(2,2,6,6 тетраметилпиперидино)магния, а указанный три-С 1-С 6)алкил)борат выбран из триизопропилбората, триэтилбората и триметилбората. Наиболее предпочтительно соединение формулы XII представляет собой 2,2-диметилпропиловый эфир 4-трифторметилбензойной кислоты, указанное металламидное основание представляет собой диизопропиламид лития, а указанный три-C1-С 6)алкил)борат представляет собой триизопропилборат. Согласно еще одному аспекту этого изобретения соединение формулы Х или энантиомер указанного соединения, где R1, R2 и R3 такие, как определено выше, подвергают взаимодействию со вторичным амином формулыNHR5R6, где R5 и R6 такие, как определено выше, с образованием карбоксилата аммония формулы или энантиомера указанного соединения формулы XVII, где R1, R2, R3, R5 и R6 такие, как определено выше. Предпочтительные заместители для R1, R2 и R3 являются такими, как обозначено выше для указанного способа производства соединения формулы X. Предпочтительно в указанном вторичном амине R5 и R6 каждый представляет собой циклогексил. Наиболее предпочтительно указанное соединение формулы XVII представляет собой (3S,4R)-дициклогексиламмоний-2-(3-бензил-4-гидроксихроман-7-ил)4-трифторметилбензоат. Изобретение также относится к способу получения соединения формулы или энантиомера указанного соединения, где R1 и Хс такие, как определено выше для указанного способа получения соединения формулы V, аR11 представляет собой (С 1-С 9)алкил, (С 2 С 9)алкенил или фенил, замещенный группой Y в положении 2, Х в положении 4 или 5 и R2 в одном из остальных положений фенильной группировки, причем Y, Х и R2 такие, как определено выше для указанного способа получения соединения формулы V путем обработки соединения формулы R1-CH2C(O)-Xc, где R1 и Хс такие,как определено выше, (1) галогенидом титана(IV), (2) основанием, возможно с последующей обработкой донорным лигандом, и (3) менее чем 10 двумя эквивалентами, предпочтительно примерно одним эквивалентом, соединения формулы R11-C(O)H, где R11 такой, как определено выше, относительно количества указанного соединения формулы R1-CH2C(O)-Xc. Предпочтительные заместители и реагенты для указанного способа получения указанного соединения формулы XIX или энантиомера указанного соединения являются такими, как обозначено выше для указанного способа получения соединения формулы IV с использованием указанного галогенида титана (IV). Изобретение также относится к соединению формулы и к энантиомеру указанного соединения, где R1,R2, Х и Y такие, как обозначено выше для указанного способа получения соединения формулы VI. В указанном соединении формулы V и в энантиомере указанного соединения предпочтительные заместители для R1, R2, Х и Y такие,как обозначено выше для указанного способа получения соединения формулы VI. Наиболее предпочтительно указанное соединение формулы V представляет собой (1R,2S)-2-бензил-1-(4 бром-2-фторфенил)-пропан-1,3-диол. Изобретение также относится к соединению формулы и к энантиомеру указанного соединения, где R1 и R2 такие, как обозначено выше для указанного соединения формулы V, а X' представляет собой галогено или (С 1-С 4)перфторалкилсульфонат и присоединен в положении 6 или 7 хроманового кольца. В указанном соединении формулы VI и в энантиомере указанного соединения предпочтительные заместители для R1 и R2 такие же, как обозначено выше для указанного соединения формулы V, а X' предпочтительно представляет собой бромо, йодо или трифторметансульфонат. Наиболее предпочтительно указанное соединение формулы VI представляет собой (3S,4R)-3 бензил-7-бромхроман-4-ол. Изобретение также относится к соединению формулы 11 и к энантиомеру указанного соединения, где R1 и R2 такие, как обозначено выше для указанного соединения формулы VI. В указанном соединении формулы VII и в энатиомере указанного соединения предпочтительные заместители для R1 и R2 такие, как обозначено выше для указанного соединения формулы VI. Наиболее предпочтительно указанное соединение формулы VII представляет собой(3S,4R)-3-бензил-4-гидроксихроман-7-ил)-бороновую кислоту. Изобретение также относится к соединению формулы и к энантиомеру указанного соединения, где R1,R2, R3 и R4 такие, как обозначено выше для указанного способа получения соединения формулы X, а бензоатная группировка присоединена в положении 6 или 7 хроманового кольца. В указанном соединении формулы IX и в энантиомере указанного соединения предпочтительные заместители для R1, R2, R3 и R4 такие,как обозначено выше для указанного способа получения соединения формулы X. Наиболее предпочтительно соединение формулы IX представляет собой этиловый эфир (3S,4R)-2-(3 бензил-4-гидроксихроман-7-ил)-4-трифторметилбензойной кислоты. Изобретение также относится к соединению формулы где R3, R4 и R7 такие, как обозначено выше для указанного способа получения соединения формулы XIV с использованием соединения формулы XIII. В указанном соединении формулы XIII предпочтительные заместители для R7, R3 и R4 являются такими же, как обозначено выше для указанного способа получения соединения формулы XIV с использованием соединения формулы XIII. Изобретение также относится к соединению формулы где R3 и R4 такие, как обозначено выше для указанного соединения формулы XIII. В указанном соединении формулы XIV предпочтительные заместители для R3 и R4 являются такими, как обозначено выше для указанного соединения формулы XIII. Наиболее 12 предпочтительно указанное соединение формулы XIV представляет собой 2-(2,2-диметилпропоксикарбонил)-5-трифторметилбензолбороновую кислоту. Изобретение также относится к соединению формулы где пунктирная линия обозначает связь или отсутствие связи между атомами В и N, n и m независимо являются числом от 2 до 5, R3 и R4 такие, как обозначено выше для указанного соединения формулы XIV, а R8 представляет собой Н или (С 1-С 6)алкил. В указанном соединении формулы XVI n иm каждый предпочтительно равен 2, предпочтительные заместители для R3 и R4 такие, как обозначено выше для указанного соединения формулы XIV, а R8 предпочтительно представляет собой Н. Наиболее предпочтительно соединение формулы XVI представляет собой 2,2 диметилпропиловый эфир 2-[1,3,6,2]-диоксазаборокан-2-ил-трифторметилбензойной кислоты. Изобретение также относится к аммонийкарбоксилатному соединению формулыR1, R2, R3, R5 и R6 такие, как обозначено выше для указанного способа получения соединения формулы X. Предпочтительные заместители дляR1, R2 и R3 являются такими, как указано выше для указанного способа получения соединения формулы X. В аммониевой группировке R5 и R6 каждый предпочтительно является циклогексилом. Наиболее предпочтительно указанное соединение формулы XVII представляет собой(3S,4R)-дициклогексиламмоний-2-(3-бензил-4 гидроксихроман-7-ил)-4-трифторметилбензоат. Настоящее изобретение также относится к соединению формулы и к энантиомеру указанного соединения, где R1,R2, X, Y и Хс такие, как определено выше для указанного способа получения соединения формулы V. Настоящее изобретение также относится к сольватам указанного соединения формулыIV и энантиомера указанного соединения формулы IV. Предпочтительными сольватами указанного соединения формулы IV и энантиомера 13 указанного соединения являются сольваты с донорным лигандом, выбранным из 1-метил-2 пирролидинона, диметилформамида, 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинона,триэтилфосфата и 2,2'-дипиридила. Предпочтительное соединение формулы IV представляет собой [4R-[3(2R,3R)-4-бензил-3-[2-бензил-3(4-бром-2-фторфенил)-3-гидроксипропионил]оксазолидин-2-он, а предпочтительный сольват указанного соединения представляет собой 1 метил-2-пирролидиноновый сольват[4R[3(2R,3R)-4-бензил-3-[2-бензил-3-(4-бром-2 фторфенил)-3-гидроксипропионил]-оксазолидин-2-она. Термин "галогено" при употреблении здесь, если это не оговорено иначе, означает фторо, хлоро, бромо или йодо. Термин "алкил" при употреблении здесь,если это не оговорено иначе, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие нормальные, разветвленные или циклические группировки или их комбинации. Термин "алкокси" при употреблении здесь включает O-алкильные группы, где "алкил" такой, как определено выше. Термин "арил" при употреблении здесь,если это не оговорено иначе, включает в себя органический радикал, образованный из ароматического углеводорода удалением одного водорода, как, например, фенил или нафтил. Термин "гетероарил" при употреблении здесь, если это не оговорено иначе, включает в себя органический радикал, образованный из ароматического гетероциклического соединения удалением одного водорода, как, например, пиридил, фурил, тиенил, изохинолил, пиримидинил и пиразинил. Термин "энантиомер" при употреблении здесь в отношении соединения формулы Х Термин "энантиомер" при употреблении здесь в отношении соединения формулы VII Термин "энантиомер" при употреблении здесь в отношении соединения формулы VI Термин "энантиомер" при употреблении здесь в отношении соединения формулы V Термин "энантиомер" при употреблении здесь в отношении соединения формулы IV означает соединение формулы означает соединение формулы Термин "энантиомер" при употреблении здесь в отношении соединения формулы IX Термин "энантиомер" при употреблении здесь в отношении соединения формулы XVII означает соединение формулы Термин "энантиомер" при употреблении здесь в отношении соединения формулы XIX Подробное описание изобретения Способ по настоящему изобретению и получение соединений по настоящему изобретению проиллюстрированы нижеследующими схемами. В нижеследующих схемах и последующем обсуждении R1, R2, R3, R4, R5, R6, R7,R8, R11, Y, Z, X, Хс и X' являются такими, как определено выше, если это не оговорено иначе. Нижеследующие схемы и последующее обсуждение описывают получение соединений формул I-XIX. Нижеследующие схемы и последующее описание также применимы к энантиомерам соединений формул I-XIX, где термин В целом последовательность реакций в синтезе на схеме 1 включает в себя присоединение вспомогательного хирального агента Хс к содержащему R1 соединению I (стадия 1), асимметрическую альдольную конденсацию с альдегидом III (стадия 2 или 2'), восстановительное удаление вспомогательного хирального агента из альдоля IV (стадия 3), опосредованную основанием циклизацию диола V (стадия 4), литиирование и борирование галогенохроманола VI(стадия 5), сочетание бороновой кислоты VII с арилгалогенидом или арилсульфонатом VIII(стадия 6) и гидролиз эфира IX (стадия 7). На стадии 1 схемы 1 вспомогательный хиральный агент НХс превращают в соответствующий анион обработкой достаточно сильным основанием, таким как аликиллитиевое основание, предпочтительно бутиллитием, в апротонном растворителе, таком как эфирный растворитель, предпочтительно тетрагидрофуран (ТГФ),при температуре примерно от -80 до 0 С, предпочтительно от -78 до -55 С, в течение времени от около 20 мин до одного часа. Заместитель Хс является вспомогательным хиральным агентом,который подходит для регулирования относительной и абсолютной стереохимии в асимметрических альдольных реакциях. Примеры НХс включают в себя (R)-4-бензил-2-оксазолидинон,(S)-4-бензил-2-оксазалидинон, (4R,5S)-4-метил 5-фенилоксазолидин-2-он и (4S,5R)-4-метил-5 фенилоксазолидин-2-он. Полученный анион обрабатывают ацилирующим агентом I, в котором группа W представляет собой галогенид,предпочтительно хлорид, а R1 такой, как определено выше, в том же растворителе при температуре примерно от -80 до 0 С, предпочтительно примерно -75 С, в течение примерно одного часа, а затем нагревают до температуры примерно от -20 до 20 С, предпочтительно до 0 С перед водной обработкой, которую предпочтительно проводят обработкой водным бикарбонатом натрия с получением ацилированного вспомогательного хирального агента II. 18 Стадия 2 на схеме 1 представляет собой альдольную реакцию Эванса, которую проводят в условиях, аналогичных условиям, известным по работам Evans, D.A.; Bartoli, J.; Shih, T.L, J.Evans, D.A., Org. Syn. 1989, 68, 83, причем обе включены здесь ссылкой. В частности, на стадии 2 схемы 1 ацилированный вспомогательный хиральный агент II обрабатывают кислотой Льюиса, основанием и замещенным бензальдегидом III с получением спирта IV с высокой степенью стереоселективности. Бензальдегид III замещают орто-заместителем Y, который служит отщепляемой группой при циклизации на стадии 4, группой Х (или X' на схеме 2, в частности, на стадии сочетания 4 на схеме 2), которую замещают арильной боковой цепью при реакции сочетания на стадии 6 и заместителемR2, который является таким, как определено выше. Заместитель Х (или X' на схеме 2) присоединяют в положении 4 или 5 фенильной группировки бензальдегида III. Отщепляемая группа Y в типичном случае является галогено или нитрогруппой, а Х является галогенидом (и,на схеме 2, X' является галогенидом или (С 1 С 6)перфторалкилсульфонатом). Для получения альдольного продукта IV ацилированный вспомогательный хиральный агент II обрабатывают галогенидом или сульфонатом бора, таким как сульфонатом диалкилбора, предпочтительно трифлатом дибутилбора, в апротонном растворителе, таком как дихлорметан, 1,2-дихлорэтан,толуол или диэтиловый эфир, предпочтительно в дихлорметане, при температуре примерно от-78 до 40 С, предпочтительно -5 С, в течение примерно 20 мин с последующей обработкой основанием, представляющим собой третичный амин, таким как триэтиламин или диизопропилэтиламин, предпочтительно триэтиламин, при температуре примерно от -78 до 40 С, предпочтительно от -5 до 5 С, в течение примерно 1 ч. Эту смесь обрабатывают замещенным бензальдегидом III при температуре примерно от-100 до 0 С, предпочтительно около -70 С, в течение примерно 30 мин. Этой смеси дают нагреться до температуры примерно от -20 до 25 С, предпочтительно около -10 С, в течение примерно одного часа, после чего обрабатывают протонным окислительным гасителем реакции,предпочтительно путем последовательного добавления буферного раствора с рН 7, метанола и водной перекиси водорода при температуре ниже примерно 15 С, с получением спирта IV. Стадия 2' схемы 1 является альтернативным и предпочтительным способом получения спирта IV с использованием содержащей титан кислоты Льюиса. На стадии 2' схемы 1 ацилированный вспомогательный хиральный агент обрабатывают галогенидом титана (IV), предпочтительно тетрахлоридом титана, в апротонном растворителе, таком как дихлорметан, 1,2 дихлорэтан или толуол, предпочтительно ди 19 хлорметан, при температуре примерно от -80 до 0 С, предпочтительно от -80 до -70 С, в течение примерно 30 мин с дополнительным перемешиванием в течение примерно 30 мин и с последующей обработкой третичным аминным или третичным диаминным основанием, таким как триэтиламин или N,N,N',N'-тетраметилэтилендиамин, предпочтительно N,N,N',N'-тетраметилэтилендиамин, при температуре примерно от -80 до 0 С, предпочтительно от -80 до -65 С,в течение примерно 30 мин. За этим возможно и предпочтительно следует обработка донорным лигандом, таким как 1-метил-2-пирролидинон,диметилформамид, 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинон, триэтилфосфат или 2,2'-дипиридил, предпочтительно 1-метил-2 пирролидинон, при температуре примерно от-80 до 0 С, предпочтительно от -80 до -65 С, с последующим перемешиванием в течение примерно 30 мин. Эту смесь обрабатывают замещенным бензальдегидом III при температуре примерно от -100 до 0 С, предпочтительно от-80 до -65 С, в течение примерно 30 мин и дают нагреться до температуры примерно от -30 до 30 С, предпочтительно от 0 до 25 С, в течение времени примерно от 1 до 24 ч, предпочтительно около 4 ч. Эту смесь обрабатывают протонным гасителем реакции, предпочтительно водным хлоридом аммония, при температуре от-30 до 30 С, предпочтительно от 0 до 25 С, с получением спирта IV. По завершении обработки донорным лигандом спирт IV в некоторых случаях получают в виде кристаллического сольвата с лигандом, играющим роль донора. Перемешивание погашенной реакционной смеси с твердым носителем, таким как Celite, в течение примерно 12 ч при температуре около 20 С улучшает фильтрацию реакционной смеси для удаления побочных титановых продуктов. Условия титановой альдольной реакции на стадии 2' схемы 1 предпочтительней и возможно проще в выполнении, чем условия проведения борной альдольной реакции на стадии 2 схемы 1, по той причине, что они позволяют избежать использования пирофорного реагента - трибутилборана, коррозирующего реагента - трифторметансульфоновой кислоты, и их экзотермической комбинации при приготовлении кислоты Льюиса дибутилбортрифлата. Далее, в отличие от титановых альдольных реакций, известных по публикациям, таким как Evans, D.A.; Rieger,D.L; Bilodeau, M.Т.; Urpi, F., J. Am. Chem. Soc. 1991, 113, 1047, условия титановой альдольной реакции на стадии 2' схемы 1 обеспечивают высокую селективность с использованием менее чем двух эквивалентов альдегида III. Предпочтительно на этой стадии используют около одного эквивалента альдегида III. Фраза "около одного эквивалента" при употреблении здесь в отношении альдегида III или соединения фор 002204Evans et al. сообщается, что для титановой альдольной реакции, аналогичной стадии 2' схемы 1, потребовалось два эквивалента альдегида. В дополнение к тому, что условия титановой альдольной реакции на стадии 2 схемы 1 полезны для получения терапевтических агентов формулы X, они полезны для получения соединений с активностью ингибитора протеазы вируса иммунодефицита человека, которые описаны в заявке на патент Великобритании номер 2270914 (опубликована 30 марта 1994 г.) и в статье B.D. Dorsey et al., Tetrahedron Letters 1993, 34(12), 1851. Схема 4 иллюстрирует применение титановой альдольной реакции к альдегиду XVIII, в котором R11 представляет собой(С 1-С 9)алкил, (С 2-С 9)алкенил или фенил, замещенный группой Y в положении 2, Х в положении 4 или 5 и R2 в одном из остальных положений фенильной группировки, где Y, Х и R2 такие, как определено выше. Условия реакции для схемы 4 такие же, как описано выше для стадии 2' схемы 1. Альдегид XVIII охватывает альдегидIII из схемы 1, а спирт XIX охватывает спирт IV со схемы 1. Реакцию схемы 4 можно использовать для получения соединений с активностью ингибитора протеазы вируса иммунодефицита человека, которые описаны в вышеупомянутой заявке на патент Великобритании номер 2270914, где R11 представляет собой (С 1 С 9)алкил или (С 2-С 9)алкенил, предпочтительно 3-циклогексилпропенил. Нижеприведенная таблица иллюстрирует то, как продукт схемы 4 или стадии 2' схемы 1 может варьировать в зависимости от используемых условий реакции и, в частности, как возрастает диастереоселективность с увеличением количества ТМЭДА от 1,2 до 3 эквивалентов и с добавлением двух эквивалентов МП. В таблице использован 1,0 эквивалент альдегида RCHO для каждой реакции, х и у представляют собой число эквивалентов основания и МП, соответственно, МП означает 1-метил-2-пирролидинон,ТМЭДА означает N,N,N',N'-тетраметилэтилендиамин, ДИПЭА означает диизопропилэтиламин, соотношение диастереоизомеров определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Изомеры альдолей были идентифицированы разделением и превращением в известные изомеры карбоновых кислот гидролизом с использованиемVan Draanen, N.A.; Arseniyadis, S.; Crimmins,M.Т.; Heathcock, С.Н., J. Org. Chem. 1991, 56,2499 и Gage, J.R.; Evans, D.A., Org. Syn. 1989,68, 83. Целевые изомеры указаны жирным шрифтом. На стадии 3 схемы 1 вспомогательный хиральный агент удаляют (и возможно выделяют для повторного использования на шаге 1) и степень окисления соединения IV (уровень кислотности) снижают до целевого спирта V в соответствии с процедурой, которая аналогична процедуре, описанной в работе Penning, T.D.;Djuric, S.W.; Haack, R.A.; Kalish, V.J.; Miyashiro,J.M.; Rowell, B.W.; Yu, S.S., Syn. Commun. 1990,20, 307, которая включена здесь ссылкой. В этом способе спирт IV обрабатывают гидридным восстанавливающим агентом, таким как боргидрид лития, алюмогидрид лития, боргидрид натрия или боргидрид кальция, предпочтительно боргидрид лития, в эфирном растворителе, таком как ТГФ, диизопропиловый эфир или метил-трет-бутиловый эфир, предпочтительно ТГФ, в типичном случае содержащем протонный растворитель, такой как вода, этанол или изопропанол, при температуре примерно от-78 С до температуры образования флегмы,предпочтительно от 0 С до температуры окружающей среды (20-25 С). После периода времени от 1 до 24 ч, в типичном случае 12 ч, реакцию гасят водой с возможным последующим добавлением перекиси водорода. Вспомогательный хиральный агент НХс можно выделить для повторного использования на стадии 1 путем селективного осаждения или экстракции НХс в водную кислоту, предпочтительно соляную ки Таблица Соотношение диастереомеров альдоля 33:-:2:26-:-:-:100 28:39:33:4:92:3:2 18:40:42:2:96:2: слоту, из раствора диола V в органическом растворителе, таком как диизопропиловый эфир или смесь этилацетата и гексана, с последующей нейтрализацией кислых водных экстрактов основанием и экстракцией НХс в органический растворитель. Стадия 4 схемы 1 представляет собой внутримолекулярное ароматическое замещение,посредством которого первичный гидроксил в диоле V вытесняет отщепляемую ортогруппу Y с образованием хроманольной кольцевой системы формулы VI. В частности, диол V, в котором отщепляемая группа Y представляет собой галогено или нитрогруппу, предпочтительно фторгруппу, обрабатывают основанием, таким как трет-бутоксид калия, бис(триметилсилил)амид натрия, бис(триметилсилил)амид калия, карбонат цезия или гидрид натрия, предпочтительно трет-бутоксид калия, в апротонном растворителе, таком как ТГФ, диметилсульфоксид или 1 метил-2-пирролидинон, предпочтительно ТГФ,возможно в присутствии добавленных солей меди, при температуре между температурой окружающей среды и 130 С, предпочтительно около 70 С, в течение времени от 1 до 24 ч, в типичном случае около 4 ч, с образованием хроманола VI. В хроманоле VI заместитель Х 23 На стадии 5 схемы 1 заместитель Х в хроманоле VI превращают в литий, а затем в группу, представляющую собой бороновую кислоту. Для литиирования хроманол VI предпочтительно обрабатывают сначала метиллитием с образованием алкоксида лития, а затем бутиллитием с образованием ариллития. В этом способе хроманол VI, в котором Х представляет собой галогенид, предпочтительно бромид или йодид, обрабатывают двумя эквивалентами алкиллития,предпочтительно сначала одним эквивалентом метиллития, а потом одним эквивалентом бутиллития, в эфирном растворителе, предпочтительно ТГФ, при температуре от -78 до 0 С,предпочтительно от -70 до -65 С, в течение примерно 1 ч, с последующей обработкой борирующим агентом,таким как борантетрагидрофурановый комплекс, триизопропилборат или триметилборат, предпочтительно борантетрагидрофурановый комплекс, при температуре от -78 до 0 С, предпочтительно от -70 до-65 С, в течение примерно 30 мин, с последующим гашением водой или возможно водной кислотой при температуре примерно от -65 С до температуры окружающей среды, предпочтительно около 0 С, с получением бороновой кислоты VII, в которой группировка бороновой кислоты присоединена в положении 6 или 7 хроманового кольца. Стадия 6 схемы 1 представляет собой реакцию сочетания Сузуки между бороновой кислотой VII и соединением VIII с образованием биарильной связи соединения IX. В соединенииVIII Z представляет собой галогенид или сульфонат, предпочтительно бромид, йодид или трифторметансульфонат, R4 представляет собой(С 1-С 6)алкил, а R3 такой, как определено выше. Эта процедура аналогична процедуре, описанной в работе Miyara, N.; Suzuki, A., Chem. Rev. 1995, 95, 2457, которая включена здесь ссылкой. Эта процедура более предпочтительна, чем сочетание с соединениями, которые содержат цинк или олово, из-за трудности получения цинкорганических соединений в больших количествах и токсичности оловоорганических соединений. В этом способе смесь бороновой кислоты VII, арена VIII, палладиевого катализатора, такого как тетракис(трифенилфосфин) палладий (0), дихлорбис(трифенилфосфин) палладий (II), ацетат палладия (II), димер хлорида аллилпалладия, трис(дибензилиденацетон) дипалладий (0) или 10% палладий на углероде,предпочтительно 10% палладий на углероде, и основания или соли фтороводородной кислоты,таких как карбонат натрия, триэтиламин, бикарбонат натрия, карбонат цезия, ортофосфат калия, фторид калия, фторид цезия, или фторид тетрабутиламмония, предпочтительно фторид калия, в растворителе, таком как этанол, диметоксиэтан или толуол, возможно содержащем воду, предпочтительно в этаноле, перемешивают при температуре между температурой окру 002204 24 жающей среды и 130 С, предпочтительно при температуре образования флегмы, в течение времени примерно от 1 до 24 ч, предпочтительно около 3 ч, с получением биарила IX, в котором группировка, представляющая собой бензиловый эфир, присоединена в положении 6 или 7 хроманового кольца. На стадии 7 схемы 1 эфир IX обрабатывают водным гидроксидным основанием, таким как водный гидроксид натрия, в спиртовом растворителе, таком как изопропиловый спирт, при температуре между 40 С и температурой образования флегмы, предпочтительно при температуре образования флегмы, в течение времени примерно от 1 до 24 ч, предпочтительно около 6 ч. Реакционную смесь охлаждают до температуры окружающей среды и распределяют между водным основанием и органическим растворителем, таким как смесь гексана и изопропилового эфира. Водный раствор подкисляют, и конечное соединение Х экстрагируют в органический растворитель, такой как этилацетат. Этот метод экстрагирования соединения Х органическими растворителями удаляет нейтральные примеси,что создает особые преимущества на последней стадии этого синтеза. Чтобы облегчить обращение с карбоновой кислотой X, это соединение можно обработать вторичным амином формулы NHR5R6, где R5 иR6 такие, как определено выше, в растворителе,таком как толуол, с образованием карбоксилата аммония формулы где R1, R2, R3, R5 и R6 такие, как определено выше. Карбоксилат аммония XVII можно обработать водной кислотой, такой как соляная кислота или серная кислота, предпочтительно соляной кислотой, в растворителе, таком как этилацетат, толуол или метиленхлорид, предпочтительно этилацетат, при температуре в пределах от 0 С до температуры окружающей среды в течение времени от 30 мин до 3 ч, предпочтительно 1 ч, с получением карбоновой кислотыX. Схема 2 иллюстрирует альтернативу последовательности реакций сочетания на стадиях 5 и 6 схемы 1. Способ схемы 2 предпочтителен. Стадия 1 схемы 2 представляет собой этерификацию карбоновой кислоты XI спиртом R4OH, в которых R3 и R4 такие, как определено выше, с получением эфира XII. В этом способе карбоновую кислоту XI обрабатывают спиртом R4OH,предпочтительно первичным или вторичным спиртом, таким как 2,2-диметилпропиловый спирт, и кислотой, такой как серная кислота,соляная кислота, метансульфоновая кислота,толуолсульфоновая кислота или камфорсульфоновая кислота, предпочтительно серной кисло 25 той, в растворителе, таком как толуол, дихлорметан или дихлорэтан, предпочтительно в толуоле, при температуре от 0 С до температуры образования флегмы, предпочтительно при температуре образования флегмы, в течение времени от 1 до 24 ч, в типичном случае 4 ч, с получением эфира XII. На стадии 2 схемы 2 эфир XII обрабатывают основанием, и полученные производные с металлами в орто-положении улавливают триалкилборатом с получением боронатного эфираXIII. На стадии 3 схемы 2 боронатный эфир XIII гидролизуют до соответствующей бороновой кислоты XIV с использованием способов, известных специалистам. На стадиях 2 и 3 схемы 2 эфир XII обрабатывают металламидным основанием, таким как диизопропиламид лития, диметиламид лития, 2,2,6,6-тетраметилпиперидин лития или бис(2,2,6,6-тетраметилпиперидино) магний, предпочтительно диизопропиламидом лития, в присутствии триС 1-С 4)алкил)бората,такого как триизопропилборат, триэтилборат или триметилборат, предпочтительно триизопропилбората, в эфирном растворителе, таком как ТГФ, диизопропиловый эфир, диоксан или метил-трет-бутиловый эфир, предпочтительно в ТГФ, в температурном диапазоне от примерно-78 С до температуры окружающей среды (2025 С), предпочтительно около 0 С. После периода времени от 10 мин до 5 ч, в типичном случае 1 ч, реакцию гасят водной кислотой с получением бороновой кислоты XIV. Чтобы облегчить обращение с бороновой кислотой XIV перед переходом к стадии 4 схемы 2, бороновую кислоту XIV можно подвергнуть взаимодействию с аминодиолом, как проиллюстрировано на схеме 3. На схеме 3 бороновую кислоту XIV подвергают взаимодействию с аминодиолом XV, где R8, m и n такие, как определено выше, в растворителе, таком как изопропанол, этанол, метанол, смесь гексанов, толуол или комбинация вышеназванных растворителей,предпочтительно в изопропаноле, при температуре в диапазоне от 0 С до температуры образования флегмы, предпочтительно при температуре окружающей среды, в течение времени от 15 мин до 10 ч, предпочтительно 10 ч, с получением аминного комплекса XVI. Чтобы перейти к стадии 4 схемы 2, аминный комплекс XVI гидролизуют до бороновой кислоты XIV согласно способам, которые известны специалистам. Такие способы включают в себя использование водной кислоты, такой как соляная кислота. Стадия 4 схемы 2 представляет собой реакцию сочетания Сузуки между бороновой кислотой XI и хроманолом VI с образованием биарила формулы IX. В этом способе получают смесь, содержащую бороновую кислоту XIV,хроманол VI, палладиевый катализатор, такой как тетракис(трифенилфосфин)палладий (0),дихлорбис(трифенилфосфин)палладий (II), ацетат палладия (II), димер хлорида аллилпалладия, 002204 26 трис(дибензилиденацетон)дипалладий (0) или 10% палладия на углероде, предпочтительно тетракис(трифенилфосфин)палладий (0), основание или соль фтороводородной кислоты, такие как карбонат натрия, триэтиламин, бикарбонат натрия, карбонат цезия, ортофосфат калия, фторид калия, фторид цезия, гидроксид натрия, гидроксид бария или фторид тетрабутиламмония, предпочтительно карбонат натрия, и растворитель, такой как толуол, этанол, диметоксиэтан, возможно содержащий воду, предпочтительно толуол, содержащий воду. В хроманоле VI, который получают в соответствии со схемой 1, X', который присоединен в положении 6 или 7 хроманового кольца, представляет собой галогенид или (C1-С 4)перфторалкилсульфонат,предпочтительно бромид, йод ид или трифторметансульфонат. Эту смесь перемешивают при температуре между температурой окружающей среды до температуры образования флегмы,предпочтительно при температуре образования флегмы, в течение времени примерно от 10 мин до 6 ч, предпочтительно 1 ч, с получением биарила IX. На стадии 5 схемы 2 эфир IX гидролизуют с получением карбоновой кислоты X, как описано выше для стадии 7 схемы 1. Настоящее изобретение проиллюстрировано нижеследующими примерами, но не ограничено их деталями. В нижеследующих примерах термин "температура окружающей среды" означает температуру в диапазоне от примерно 20 до примерно 25 С. Пример 1. (R)-4-Бензил-3-(3-фенилпропионил)-оксазолидин-2-он. К раствору (R)-(+)-4-бензил-2-оксазолидинона (910 г; 5,14 моль) и 500 мг 2,2'дипиридила в качестве индикатора в тетрагидрофуране (9 л) при -78 С добавляли в течение 30 мин 2,5 М раствор бутиллития в смеси гексанов (2,03 л; 5,14 моль). Во время добавления температуру реакционной смеси поддерживали ниже -55 С. Реакционную смесь охлаждали до-75 С и в течение 5 мин добавляли гидроциннамонилхлорид (950 г; 5,63 моль). Реакционной смеси давали нагреться до температуры 0 С, по достижении которой судили о завершении реакции по результатам тонкослойной хроматографии (смесь гексанов и этилацетата, 2:1). Реакцию гасили добавлением 10% водного бикарбоната натрия (3,6 л) и воды (3,6 л). Водную фазу отделяли и экстрагировали этилацетатом (3 л). Объединенные органические слои промывали 5% водным карбонатом натрия (3,6 л) и насыщали водным хлоридом натрия (2 л), сушили над сульфатом магния и концентрировали в вакууме до примерно 2 л вязкой желтой суспензии. Эту суспензию растворяли в этилацетате (3 л), концентрировали до твердого состояния и растворяли в этилацетате при 50 С. Добавляли смесь гексанов (10 л) и медленно охлаждали эту смесь до 10 С, получая в осадке твердые веще 27 ства, которые перемешивали при 10 С 30 мин. Эти твердые вещества собирали фильтрацией,промывали смесью гексанов и сушили на воздухе при температуре окружающей среды с получением 1,4 кг (88%) (R)-4-бензил-3-(3-фенилпропионил)-оксазолидин-2-она в виде бледножелтых игл: 1H-ЯМР (300 MHz, CDCl3)7.147.33 (m, 10 Н), 4.66 (m, 1 Н), 4.17 (t, J=3.4 Hz, 2H),3.26 (m, 3H), 3.03 (t, J=7 Hz, 2H), 2.75 (dd, J=9.5,14.3 Hz, 1H); ИК 1787, 1761, 1699, 1390, 1375,1308, 1208, 1203, 746, 699 cm-1, т.пл. 102-104 С. Пример 2. [4R-[3(2R,3R)-4-Бензил-3-[2 бензил-3-(4-бром-2-фторфенил)-3-гидроксипропионил 1-оксазолидин-2-он. К раствору (R)-4-бензил-3-(3-фенилпропионил)-оксазолидин-2-она (1064 г; 3,44 моль) в дихлорметане (5,6 л) при -5 С добавляли дибутилбортрифлат (1133 г; 4,13 моль) в течение 20 мин, после чего добавляли триэтиламин (719 мл; 5,16 моль), поддерживая температуру реакционной смеси ниже 5 С. Эту смесь охлаждали до -70 С и на протяжении 30 мин добавляли к ней раствор 4-бром-2-фторбензальдегида (699 г; 3,44 моль) в дихлорметане (2 л). Этой смеси в течение часа давали нагреваться до температуры -10 С, по достижении которой судили о завершении реакции по результатам тонкослойной хроматоргафии (смесь гексанов и этилацетата, 2:1). Реакцию гасили добавлением в течение 30 мин 3,5 л буфера с рН 7, состоящего из одноосновного фосфата калия и гидроксида натрия, а затем 1,8 л метанола и 1,8 л 35% водной перекиси водорода в течение 1,5 ч, поддерживая температуру реакционной смеси ниже 15 С. Органический слой отделяли, промывали насыщенным водным бикарбонатом натрия (6,7 л) и разбавляли безводным этанолом (4 л) и 25% водным бисульфитом натрия. Органический слой отделяли, промывали водой (4 л), сушили над сульфатом магния и концентрировали в вакууме с получением 1818 г (103% по массе неочищенного продукта)[4R-[3(2R,3R)-4 бензил-3-[2-бензил-3-(4-бром-2-фторфенил)-3 гидроксипропионил]-оксазолидин-2-она в виде очень вязкого масла янтарного цвета: 1 Н-ЯМРHz, 1H), 4.92-5.29 (m, 1H), 4.45-4.51 (m, 1H),3.92 (m, 2 Н), 3.01-3.14 (m, 3 Н), 2.83 (dd, J=3.1,13.6 Hz, 1H), 2.05 (dd, J=10.0, 13.5 Hz, 1H); ИК 3460 (br), 1780, 1696, 1483, 1388, 1350, 1209,1106, 1068, 877, 760, 747, 701, 583,512,486 cm-1. Пример 3. 1-Метил-2-пирролидиноновый сольват [4R-[3(2R,3R)-4-бензил-3-[2-бензил-3(4-бром-2-фторфенил)-3-гидроксипропионил]оксазолидин-2-она. К раствору (R)-4-бензил-3-(3-фенилпропионил)-оксазолидин-2-она (12,0 кг; 38,8 моль) в дихлорметане (180 л) при температуре от -70 до-80 С в течение 30 мин добавляли тетрахлорид титана (8,8 кг; 46,6 моль) с получением густой 28 суспензии, которую перемешивали еще 30 мин при температуре от -70 до -80 С. N,N,N',N'Тетраметилэтилендиамин (17,6 л; 116,4 моль) добавляли в течение 30 мин с получением более жидкой реакционной смеси. Добавляли 1 метил 2-пирролидинон (7,6 кг; 16,4 моль) и перемешивали реакционную смесь 30 мин, все это время поддерживая температуру реакционной смеси ниже -65 С. В течение 30 мин добавляли раствор 4-бром-2-фторбензальдегида (7,9 кг; 38,8 моль) в дихлорметане (38 л), поддерживая температуру реакционной смеси ниже или равной-68 С. Реакционной смеси давали нагреваться в течение 8 ч до температуры 20 С, по достижении которой ее охлаждали до 10 С и гасили раствором 5,0 кг хлорида аммония в 11 л воды, что вызывало образование белого осадка и экзотермическое повышение температуры до 28 С. Добавляли Celite (12 кг) и перемешивали реакционную смесь 12 ч при 20 С. Реакционную смесь фильтровали, концентрировали при атмосферном давлении до масла, обрабатывали смесью гексанов (120 л), концентрировали до примерно 50 л, медленно охлаждали до 0 С и гранулировали в течение 24 ч. Неочищенный продукт(24,3 кг) отделяли фильтрацией, объединяли с сырыми продуктами двух сходным образом проведенных реакций в 110 л дихлорметана,обрабатывали смесью гексанов (320 л), концентрировали при атмосферном давлении до конечного объема примерно 250 л (температура дистиллята 65 С), добавляли затравку истинного продукта и медленно охлаждали с образованием гранул в течение 18 ч при 20 С. Фильтрация дала 67,4 кг (94%) 1-метил-2-пирролидинонового сольвата [4R-[3(2R,3R)-4-бензил 3-[2-бензил-3-(4-бром-2-фторфенил)-3-гидроксипропионил]-оксазолидин-2-она в виде светлорыжевато-коричневатого твердого кристаллического вещества: 1H-ЯМР (400 MHz, CDCl3)7.46 (t, J=8.0 Hz, 1H), 7.15-7.29 (m, 10 Н), 6.94(m, 3H); ИК 3150 (br), 1776, 1695, 1652, 1600,1221, 1050, 996, 953, 875 cm-1; т.пл. 80-83 С. Пример 4. (1R,2S)-2-Бензил-1-(4-бром-2 фторфенил)-пропан-1,3-диол. 2M раствор боргидрида лития в тетрагидрофуране (1,7 л; 3,4 моль) разбавляли тетрагидрофураном (1,7 л) и осторожно обрабатывали водой (61 мл; 3,4 моль) в течение 15 мин. Эту смесь перемешивали при температуре окружающей среды до прекращения выделения водорода (от 0,5 до 1 ч), а затем добавляли ее к раствору [4R-[3(2R,3R)-4-бензил-3-[2-бензил 3-(4-бром-2-фторфенил)-3-гидроксипропионил]оксазолидин-2-она (1,75 кг; 3,4 моль) в тетрагидрофуране (8,75 л) в течение 30 мин при температуре 0 С. Полученной молочно-белой сус 29 пензии давали в течение 12 ч нагреться до температуры окружающей среды, по достижении которой о ее завершении реакции судили по результатам тонкослойной хроматографии(смесь гексанов и этилацетата, 2:1). Эту реакционную смесь охлаждали до 15 С и гасили водой(5,25 л) в течение 15 мин и перемешивали еще 10 мин перед добавлением 35% водной перекиси водорода (2,6 л) в течение 20 мин. Эту реакционную смесь перемешивали 15 мин, а затем разбавляли этилацетатом (5,3 л) и водой (4 л). Органический слой отделяли и промывали водой (5,3 л), 5% водным бисульфитом натрия(5,25 л) и 50% насыщенным водным хлоридом натрия (7,5 л). В органическом были обнаружены пероксиды, поэтому его промывали дальше 5% водным бисульфитом натрия (5 л) и 50% насыщенным водным хлоридом натрия (6 л). Органический слой концентрировали в вакууме до масла, разбавляли этилацетатом (4 л) и смесью гексанов (13 л) и промывали 1 н. водной соляной кислотой (6 раз, 17 л) до удаления (R)(+)-4-бензил-2-оксазолидинона. Органический слой промывали насыщенным водным бикарбонатом натрия (5,3 л), разбавляли толуолом (2 л) и концентрировали в вакууме с получением 1138 г (98%) (1R,2S)-2-бензил-1-(4-бром-2 фторфенил)-пропан-1,3-диола в виде маслянистого вещества: 1H-ЯМР (400 MHz, CDCl3)7.74-7.51 (m, 1H), 7.33 (dd, J=1.9, 83 Hz, 1H),7.15-7.25 (m, 4H), 7.04-7.06 (m, 2H), 5.39 (d,J=2.6 Hz, 1H), 3.77 (dd, J=3.0, 10.7 Hz, 1H), 3.64(9,88 л) при температуре окружающей среды. Эту смесь медленно нагревали до 60 С под вакуумом от водоструйного насоса для удаления тетрагидрофурана из реакционной смеси, а затем нагревали при температуре от 60 до 65 С в течение 5 ч под вакуумом от водоструйного насоса, после чего судили о завершении реакции по результатам тонкослойной хроматографии(смесь гексанов и этилацетата, 2:1). Эту реакционную смесь охлаждали до температуры окружающей среды и гасили добавлением воды (10 л), а затем 1 н. соляной кислоты (10 л). Полученную рыжевато-коричневую суспензию фильтровали, промывали водой (2 л) и растворяли в этилацетате (12 л). Этот раствор промывали водой (дважды по 12 л), концентрировали до малого объема, растворяли в изопропиловом эфире (4 л) и концентрировали под атмосфер 002204 30 ным давлением при температуре от 50 до 60 С до 1,0 л, по достижении чего начинали осаждаться твердые вещества. Полученную суспензию охлаждали до температуры окружающей среды, перемешивали 12 ч, концентрировали до половины ее объема, охлаждали до температуры от 0 до 5 С и фильтровали с получением 916 г(49%) (3S,4R)-3-бензил-7-бромхроман-4-ола в виде белого твердого вещества. Фильтрат концентрировали до темного масла (906 г), растворяли в изопропиловом эфире (1,5 л) при температуре образования флегмы, охлаждали до температуры окружающей среды, перемешивали и фильтровали с получением дополнительных 82 г твердого вещества. Фильтрат концентрировали и хроматографировали на силикагеле (60-230 меш), элюируя смесью гексанов с этилацетатом 3:1. Обогащенные продуктом фракции концентрировали и перекристаллизовывали из изопропилового эфира с получением дополнительных 82 г твердого вещества. Общий выход (3S,4R)-3 бензил-7-бромхроман-4-ола составил 1080 гHz, 1H), 3.97 (dd, J=4.5, 11.3 Hz, 1H), 2.68 (dd,J=6.5, 13.8 Hz, 1H), 2.51 (dd, J=9.1, 13.8 Hz, 1H),2.18-2.23 (m, 1H), 1.85 (d, J=4.3 Hz, 1H); ИК 3274 (br), 3181 (br), 1598, 1573, 1493, 1480, 1410,1219, 1070, 1052, 1023, 859, 700 cm-1; т.пл. 143.5144.0 С. Пример 6. (3S,4R)-3-Бензил-7-бромхроман 4-ол. К раствору (1R,2S)-2-бензил-1-(4-бром-2 фторфенил)-пропан-1,3-диола (получен из 33,5 кг (54,8 моль) 1-метил-2-пирролидинонового сольвата [4R-[3(2R,3R)-4-бензил-3-[2-бензил 3-(4-бром-2-фторфенил)-3-гидроксипропионил]ксазолидин-2-она, без выделения) в 185 л тетрагидрофурана добавляли 12,9 кг (115 моль) тертбутоксида калия. Реакционную смесь нагревали с обратным холодильником в течение 4 ч, после чего убеждались в завершении реакции с помощью тонкослойной хроматографии (смесь гексанов с этилацетатом, 3:1). Реакционную смесь охлаждали до температуры окружающей среды,гасили 170 л воды, разбавляли этилацетатом (83 л) и подкисляли до рН 5,3 (водный слой) 7,5 л концентрированной соляной кислоты. Органический слой концентрировали под вакуумом до получения примерно 38 л суспензии, разбавляли изопропиловым эфиром (76 л), нагревали до растворения твердых веществ, медленно охлаждали до 0 С и гранулировали при 0 С в течение 12 ч. (3S,4R)-3-Бензил-7-бромхроман-4-ол в виде белого твердого вещества, 5,1 кг, выделяли фильтрованием. Маточную жидкость промывали насыщенным водным хлоридом натрия (4 л),концентрировали до конечного объема 57 л и гранулировали при 0 С в течение 12 ч с получе 31 нием 4,3 кг второй порции (3S,4R)-3-бензил-7 бромхроман-4-ола. Вторую идентичную реакционную смесь гасили, разбавляли этилацетатом и подкисляли как описано выше. Органический слой сушили над 10 кг сульфата магния, концентрировали при атмосферном давлении до примерно 30 л суспензии, разбавляли изопропиловым эфиром(38 л), концентрировали до примерно 57 л, медленно охлаждали и гранулировали при температуре от 0 до 10 С в течение 12 ч. (3S,4R)-3 Бензил-7-бромхроман-4-ол в количестве 8,7 кг выделяли фильтрованием. Маточную жидкость объединяли с маточной жидкостью от второй порции, полученной от первой реакции, концентрировали до масла, отверждали путем охлаждения, гранулировали в 6 л изопропилового эфира при 20 С в течение 12 ч и при 0 С в течение 2 ч и фильтровали с получением 6,3 кг(3S,4R)-3-бензил-7-бромхроман-4-ола после промывания холодным изопропиловым эфиром. Объединенные порции конечного продукта от обеих реакций сушили с получением 20,8 кг-65 С. Эту реакционную смесь перемешивали при температуре менее -65 С в течение часа, а затем добавляли 2,5 М раствор бутиллития в смеси гексанов (440 мл; 1,3 моль) в течение 15 мин. Эту реакционную смесь перемешивали при температуре ниже -65 С в течение часа, а затем на протяжении 30 мин добавляли 1,0 М раствор борантетрагидрофуранового комплекса в тетрагидрофуране (5,9 л; 5,9 моль). Эту реакционную смесь нагревали до 0 С, гасили добавлением воды (4,4 л), доводили до рН 2 с помощью 1 н. водной соляной кислоты (4 л) и экстрагировали изопропиловым эфиром (4 л). Водный слой экстрагировали изопропиловым эфиром (4 л) и объединенные органические слои промывали 0,5 н. водным гидроксидом натрия (7,2 л). Водный слой доводили до рН 3 с помощью 1 н. водной соляной кислоты (5,5 л) и экстрагировали этилацетатом (5,4 л и 2,7 л). Объединенные этилацетатные слои сушили над сульфатом магния и концентрировали под вакуумом с получением 304,5 г (91%) (3S,4R)-(3-бензил-4 гидроксихроман-7-ил)-бороновой кислоты в виде желтой пены: 1H-ЯМР (300 MHz, CDCl3)7.35-7.00 (m, 8H), 4.42 (d, J=4.1, 1H), 4.19 (d,J=11 Hz, 1H), 3.90 (m, 1H), 2.68 (dd, J=6.2, 13,8(723 г; 2,1 моль), (3S,4R)-(3-бензил-4-гидроксихроман-7-ил)-бороновой кислоты (627 г; 2,2 моль), фторида калия (366 г; 6,3 моль), 10% палладия на углероде (157 г; 50% увлажнение водой) и безводного этанола (6,26 л) нагревали с обратным холодильником в течение 3 ч, после чего убеждались в завершении реакции с помощью тонкослойной хроматографии (толуол/уксусная кислота, 5:1). Эту реакционную смесь разбавляли изопропиловым эфиром (8 л),фильтровали через Celite и промывали 10% водным бикарбонатом натрия (1,5 л). Водный слой отделяли и экстрагировали изопропиловым эфиром (3 л). Объединенные органические слои промывали водой (6 л), сушили над сульфатом магния и обрабатывали посредством Darco G60 (1,0 кг) и силикагелем (1 кг, 70-230 меш) при температуре окружающей среды. Эту смесь фильтровали через слой силикагеля (70-230 меш) и концентрировали в вакууме до 922 г темного масла. Это масло разбавляли этилацетатом (1 л) и фильтровали через колонку с силикагелем (2 кг), элюируя этилацетатом, с получением светло-янтарного раствора, который концентрировали с получением 897 г (92%) этилового эфира(br), 3216 (br), 1734, 1339, 1298, 1247, 1191,1175, 1118, 1097, 1050 cm-1 Пример 9. (3S,4R)-2-(3-Бензил-4-гидроксихроман-7-ил)-4-трифторметилбензойная кислота. Смесь этилового эфира (3S,4R)-2-(3 бензил-4-гидроксихроман-7-ил)-4-трифторметилбензойной кислоты (897 г, 1,93 моль) и 10% водного гидроксида натрия (980 мл, 2,72 моль) в изопропиловом спирте (9 л) нагревали с обратным холодильником в течение 6 ч, охлаждали до температуры окружающей среды и перемешивали 12 ч. Реакционную смесь разбавляли водой (13,5 л), смесью гексанов (9 л) и изопропиловым эфиром (4,5 л). Водный слой отделяли и экстрагировали смесью гексанов (9 л) и изопропиловым эфиром (4,5 л), доводили до рН 2 с помощью 2 н. водной соляной кислоты и экстрагировали этилацетатом (8 л и 4 л). Объединенные этилацетатные экстракты промывали водой(6 л), сушили над сульфатом магния и концентрировали в вакууме до темно-янтарного масла,которое разбавляли толуолом (2 л) и снова концентрировали до масла. Это масло растворяли в толуоле (4,2 л) при 60 С и добавляли смесь гек 33 санов (8,8 л) со скоростью, позволявшей поддерживать температуру выше 50 С. Рыжеватокоричневые твердые вещества, которые осаждались при медленном охлаждении до температуры окружающей среды в течение нескольких часов, отфильтровывали и промывали смесью гексанов и толуола 2:1 (2 л). Эти твердые вещества растворяли в толуоле (5 л) при 60 С, обрабатывали посредством Darco G-60, фильтровали, промывали толуолом и концентрировали под вакуумом до примерно 4 л. Эту смесь нагревали до 50-60 С, по каплям обрабатывали смесью гексанов (8,6 л), охлаждали и гранулировали при 5 С в течение времени от 1 до 2 ч. Полученные твердые вещества отфильтровывали, промывали смесью гексанов с толуолом 2:1(2 л) и влажную массу перемешивали в смеси гексанов (4 л) при температуре образования флегмы в течение 30 мин. Эту смесь охлаждали до температуры окружающей среды, гранулировали в течение часа, фильтровали и полученные твердые вещества сушили под вакуумом в течение ночи с получением 450 г (55%) (3S,4R)-2-(3 бензил-4-гидроксихроман-7-ил)-4-трифторметилбензойной кислоты в виде беловатого твердого вещества: 1H-ЯМР (400 MHz, СDСl3)7.99(dd, J=4.6, 11.0 Hz, 1H), 2.74 (dd, J=6.1, 13.8 Hz,1H), 2.51 (dd, J=9.4, 13.8 Hz, 1H), 2.22 (m, 1H); ИК 3454, 3218 (br), 1699, 1431, 1337, 1299, 1275,1258, 1191, 1178, 135, 1123, 70 сm-1; т.пл. 142 С. Пример 10. 2,2-Диметилпропиловый эфир 4-трифторметилбензойной кислоты. К суспензии 4-трифторметилбензойной кислоты (75,0 г; 394 ммоль) и 2,2-диметилпропилового спирта (70,5 г; 800 ммоль) в толуоле (500 мл) добавляли концентрированную серную кислоту (3,0 мл). Смесь перемешивали при температуре образования флегмы 4 ч, охлаждали до комнатной температуры, вливали в насыщенный водный карбонат натрия (250 мл) и разделяли слои. Органический слой промывали насыщенным водным карбонатом натрия (250 мл) и рассолом (100 мл) и концентрировали с получением 2,2-диметилпропилового эфира 4 трифторметилбензойной кислоты (102 г, выход 99%) в виде желтой жидкости: Rf: 0,66 (смесь этилацетата и гексанов 25/75); IR 2932, 1727,1327, 1280, 1133, 1066, 862, 775, 704, cm-1; 1 НЯМР (400 MHz, CDCl3)8.16 (d, J=7.9 Hz, 2H),7.70 (d, J=8.1 Hz, 2H), 4.04 (s, 2H), 1.04 (s, 9); 13 С-ЯМР (100 MHz, CDCl3)26.51, 31.61, 74.72,123.63 (q, J=272.7 Hz), 125.4, 129.9, 133.7, 134.35 34 К раствору 2,2-диметилпропилового эфира 4-трифторметилбензойной кислоты (4.225 г,16,23 ммоль) в тетрагидрофуране (40 мл) добавляли триизопропилборат (9,00 мл; 39,0 ммоль). Этот раствор охлаждали до -78 С и на протяжении 5 мин добавляли по каплям диизопропиламид лития (12,0 мл 2,0 М раствора в тетрагидрофуране/гептане, 24,0 ммоль). Этот красный раствор перемешивали в течение 30 мин, нагревали до 0 С и гасили медленным добавлением 1 н. соляной кислоты (50 мл). Этой смеси давали нагреться до комнатной температуры, перемешивали ее 30 мин и добавляли к смеси гексанов(200 мл). Слои разделяли и органический слой промывали последовательно 2 н. соляной кислотой (дважды по 100 мл), водой (100 мл) и рассолом (50 мл). Органические экстракты сушили над сульфатом магния, фильтровали и концентрировали до масла. Неочищенный продукт кристаллизовали из гептана (40 мл) с получением 2-(2,2-диметилпропоксикарбонил)-5-трифторметилбензолбороновой кислоты (3,037 г; выход 62%) в виде белого твердого вещества: т.пл.=159-160 С; ИК 3377 (br), 2963, 1703, 1371,1308, 1171, 1131, 794, 709 сm-1; 1 Н-ЯМР (400(3S,4R)-2-(3-бензил-4-гидроксихроман-7-ил)-4 трифтор-метилбензойной кислоты. Двухфазный раствор 2-(2,2-диметилпропоксикарбонил)-5-трифторметилбензолбороновой кислоты (1,72 г; 5,66 ммоль), (3S,4R)-3 бензил-7-бромхроман-4-ола (1,80 г; 5,63 ммоль),карбоната натрия (1,82 г; 17,2 ммоль) и тетракис(трифенилфосфин)палладия (0) (12 мг; 0,19 моль%) в толуоле (15 мл) и воде (9 мл) перемешивали при температуре образования флегмы в течение 100 мин. Эту реакционную смесь охлаждали до комнатной температуры, выливали в воду (40 мл) и экстрагировали диизопропиловым эфиром (75 мл). Органические экстракты промывали рассолом (50 мл), обрабатывали посредством Darco G-50, сушили над сульфатом магния, фильтровали через Celite и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле (смесь этилацетата и гексанов 20/80) с получением 2,2 диметилпропилового эфира (3S,4R)-2-(3-бензил 4-гидроксихроман-7-ил)-4-трифторметилбензойной кислоты в виде белой пены (2,25 г; выход 84%): Rf: 0,32 (смесь этилацетата и гексанов 25/75); ИК 3407 (br), 2961, 1721, 1336, 1292,1172, 1134, 1110, 1022, 848, 749 cm-1; 1 Н-ЯМР(3S,4R)-2-(3-бензил-4-гидроксихроман-7-ил)-4 трифторметилбензойной кислоты (2,34 г; 4,69 ммоль) в изопропиловом спирте (23 мл) обрабатывали 10% водным гидроксидом натрия (2,3 мл; 6,4 ммоль) и нагревали с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали до температуры окружающей среды,вливали в воду (34 мл) и экстрагировали смесью гексанов (23 мл) и изопропиловым эфиром (13 мл). Водный слой отделяли и экстрагировали смесью гексанов (23 мл) и изопропиловым эфиром (13 мл), доводили до рН 2 с помощью 6 н. водной соляной кислоты и экстрагировали этилацетатом (дважды по 40 мл). Объединенные этилацетатные экстракты промывали рассолом(40 мл), сушили над сульфатом магния, фильтровали и концентрировали до белой пены, которую перекристаллизовывали из смеси толуола и гексанов. Полученные твердые вещества отфильтровывали и промывали смесью гексанов,и влажную плотную массу перемешивали со смесью гексанов (20 мл) в течение 1 ч. Эту смесь фильтровали и полученные твердые вещества сушили под вакуумом с получением 1,01 г(3S,4R)-2-(3-бензил-4 гидроксихроман-7-ил)-4-трифторметилбензойной кислоты в виде белого твердого вещества: 1Hz, 1H), 2.24-2.26 (m, 1H). Пример 14. 2,2-Диметилпропиловый эфир 2-[1,3,6,2]-диоксазаборокан-2-ил-4-трифторметилбензойной кислоты. К раствору 2,2-диметилпропилового эфира 4-трифторметилбензойной кислоты (35,8 г; 138 ммоль) в тетрагидрофуране (250 мл) добавляли триизопропилборат (73,0 мл; 316 ммоль). Этот раствор охлаждали до 0 С, к нему по каплям в течение 20 мин добавляли диизопропиламид лития (73,0 мл 2,0 М раствора в тетрагидрофуране/гептане, 146 ммоль), и красный раствор перемешивали еще 30 мин. Добавляли смесь гексанов (200 мл), а затем 1 н. соляную кислоту(200 мл). Эту смесь перемешивали 10 мин и выливали в смесь гексанов (200 мл). Органический 36 слой промывали 1 н. соляной кислотой (дважды по 150 мл) и рассолом (100 мл). Органические экстракты сушили над сульфатом магния,фильтровали и концентрировали до примерно 200 мл. Добавляли изопропиловый спирт (100 мл) и диэтаноламин (15,95 г; 151,7 ммоль) и перемешивали эту смесь при комнатной температуре 10 ч. Твердые вещества отфильтровывали и промывали смесью изопропилового спирта(15 мл) и гексанов (30 мл) с получением 2,2 диметилпропилового эфира 2-[1,3,6,2]диоксазаборокан-2-ил-4-трифторметилбензойной кислоты (37,83 г; выход 74%) в виде белого твердого вещества. Т.пл.=233-234 С; ИК 3077,2963, 2862, 1722, 1480, 1467, 1371, 1331, 1298,1290, 1279, 1254, 1161, 1117, 1108, 1087, 1074,995, 952, 862 cm-1; 1H-ЯМР (400 MHz, СDСl3)8.23 (s, 1H), 7.72 (d, J=7.9 Hz, 1H), 7.52 (dd,J=7.9, 1.3 Hz, 1H), 6.33 (brs, 1H), 4.08-4.14 (m,2H), 3.98 (s, 2H), 3.93-3.98 (m, 2H), 3.42-3.50 (m,2H), 2.88-2.94 (m, 2H), 1.02 (s, 9H); 13C NMR(100 MHz, CDCl3) 26.51, 31.69, 50.92, 63.33,74.72, 123.94, 128,59, 132.06, 139.61, 171.56. Пример 15. (3S,4R)-Дициклогексиламмоний-2-(3-бензил-4-гидроксихроман-7-ил)-4 трифторметилбензоат. Смесь 2,2-диметилпропилового эфира 2[1,3,6,2]-диоксазаборокан-2-ил-4-трифторметилбензойной кислоты (7,04 г; 18,9 ммоль) в толуоле (45 мл) и 1,5 н. соляной кислоты (45 мл) перемешивали при комнатной температуре 45 мин. Водный слой удаляли и добавляли карбонат натрия (2,73 г; 25,8 ммоль), (3S,4R)-3 бензил-7-бромхроман-4-ол (5,47 г; 17,1 ммоль),тетракис(трифенилфосфин)палладий (0) (24,0 мг, 20,8 мкмоль) и воду (20 мл). Двухфазовый раствор перемешивали при температуре образования флегмы в течение 100 мин, охлаждали до комнатной температуры и выливали в воду (50 мл). Слои разделяли и органический слой обрабатывали Darco G-60, фильтровали и концентрировали. Неочищенный эфир растворяли в изопропиловом спирте (80 мл) и добавляли 10% водный гидроксид натрия (8,0 мл). Этот раствор нагревали с обратным холодильником 3 ч, охлаждали до комнатной температуры, выливали в воду (120 мл) и экстрагировали смесью гексанов(80 мл) и изопропиловым эфиром (40 мл). Водный слой промывали смесью гексанов (80 мл) и изопропиловым эфиром (40 мл), доводили до рН 2 с помощью 6 н. соляной кислоты и экстрагировали метил-трет-тертбутиловым эфиром (дважды по 75 мл). Органические экстракты сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт растворяли в метил-трет-бутиловом эфире (40 мл) и добавляли дициклогексиламин (4,10 мл; 20,6 ммоль). Эту смесь перемешивали в течение ночи и твердые вещества отфильтровывали и промывали метил-трет-бутиловым эфиром (20 мл) с получением(25 мл) и 1 н. соляной кислоты (25 мл) перемешивали при комнатной температуре в течение 1 ч. Эту смесь вливали в этилацетат (20 мл) и удаляли водный слой. Органический слой промывали водой (шесть раз по 50 мл), сушили над сульфатом магния, фильтровали и концентрировали с получением (3S,4R)-2-(3-бензил-4 гидроксихроман-7-ил)-4-трифторметилбензойной кислоты (1,66 г; выход 100%): 1H-ЯМР (400Hz, 1H), 3.97 (dd, J=11.0, 4.0 Hz, 1H), 2.76 (dd,J=13.9, 6.4 Hz, 1H), 2.53 (dd, J=13.7, 9.3 Hz, 1H),2.24-2.26 (m, 1H). Пример 17. 3-(2R,3R)]-4R,5S]-3-[2 Бензил-3-(4-бром-2-фторфенил)-3-гидроксипропионил]-4-метил-5-фенилоксазолидин-2-он. К раствору (4R,5S)-4-метил-5-фенил-3-(3 фенилпропионил)-оксазолидин-2-она (1,50 г; 4,8 ммоль) в дихлорметане (23 мл) при -70 С добавляли тетрахлорид титана (0,6 мл; 5,3 ммоль) с получением желто-оранжевого раствора, который перемешивали 15 мин при -70 С. На протяжении 10 мин добавляли N,N,N',N'тетраметилэтилендиамин (2,2 мл; 15 моль) с получением темно-красной реакционной смеси,которую перемешивали 70 мин при -78 С. По каплям добавляли 1-метил-2-пирролидинон(0,90 мл; 9,7 ммоль) и перемешивали реакционную смесь 30 мин при -70 С. По каплям добавляли раствор 4-бром-2-фторбензальдегида(0,990 г; 4,9 ммоль) в дихлорметане (5 л), поддерживая температуру реакционной смеси ниже или равной -68 С. Реакционную смесь перемешивали при -70 С в течение 60 мин, а затем на протяжении 90 мин давали ей нагреваться до температуры 0 С, по достижении которой реак 002204 38 цию гасили с помощью 15 мл насыщенного водного хлорида аммония и 1,2 г Celite. Эту смесь перемешивали в течение ночи при комнатной температуре и фильтровали. Фазы разделяли и органическую фазу промывали три раза водой и один раз рассолом, сушили над сульфатом магния и концентрировали под вакуумом до получения 2,76 г масла, содержащего соединение, указанное в заголовке, и 1,2 эквивалента 1-метил-2-пирролидинона: 1 Н-ЯМР (400(m, 2H), 2.81 (s, 3H), 2.34 (dd, J=8.1, 8.1 Hz, 2H),1.95-2.03 (m, 2H), 0.40 (d, J=6.6 Hz, 3H). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы или энантиомера указанного соединения, где в указанном соединении формулы Х группировкаR3-замещенной бензойной кислоты присоединена по атомам углерода 6 или 7 хроманового кольца;q является числом от 0 до 4; каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро,(С 1-С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил,фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; при котором соединение формулы или энантиомер указанного соединения формулы IX в случае получения энантиомера указанного соединения формулы X, где R1, R2 и R3 39 такие, как определено выше, R4 представляет собой (С 1-С 6)алкил, а бензоатная группировка присоединена в положении 6 или 7 хроманового кольца, обрабатывают основанием. 2. Способ по п.1, при котором соединение формулы IX или энантиомер указанного соединения получают обработкой соединения формулы или энантиомера указанного соединения формулы VII в случае получения энантиомера указанного соединения формулы IX, где R1 и R2 такие, как определено в п.1, а группировка бороновой кислоты присоединена в положении 6 или 7 хроманового кольца, соединением формулы где R3 и R4 такие, как определено в п.1, a Z представляет собой галогено или (С 1 С 4)перфторалкилсульфонат, в присутствии основания или соли фтороводородной кислоты и палладиевого катализатора. 3. Способ по п.2, при котором соединение формулы VII или энантиомер указанного соединения, где R1 и R2 такие, как определено в п.2,получают обработкой соединения формулы или энантиомера указанного соединения формулы VI в случае получения энантиомера указанного соединения формулы VII, где R1 и R2 такие, как определено в п.2, а Х представляет собой галогенид и присоединен в положении 6 или 7 хроманового кольца, (1) (С 1-С 4)алкиллитием и (2) борирующим реагентом. 4. Способ по п.3, при котором соединение формулы VI или энантиомер указанного соединения, где R1, R2 и Х такие, как определено в п.3, получают обработкой соединения формулы или энантиомера указанного соединения формулы V в случае получения энантиомера указанного соединения формулы VI, где R1, R2 и Х такие, как определено в п.3, и Х присоединен в положении 4 или 5 фенильного кольца, а Y представляет собой галогено или нитро, основанием, возможно в присутствии добавленных солей меди. 40 5. Способ по п.4, при котором соединение формулы V или энантиомер указанного соединения, где R1, R2, Х и Y такие, как определено в п.4, получают обработкой соединения формулы или энантиомера указанного соединения формулы IV в случае получения энантиомера указанного соединения формулы V, где R1, R2, Х иY такие, как определено в п.4, и Х присоединен в положении 4 или 5 фенильного кольца, а Хc представляет собой (R)-4-бензил-2-оксазолидинон, (S)-4-бензил-2-оксазолидинон, (4R,5S)-4 метил-5-фенилоксазолидин-2-он или (4S,5R)-4 метил-5-фенилоксазолидин-2-он, присоединенный по атому азота оксазолидин-2-онового кольца, гидридным восстанавливающим агентом. 6. Способ по п.5, при котором соединение формулы IV или энантиомер указанного соединения, где R1, R2, X, Xc и Y такие, как определено в п.5, получают обработкой соединения формулы R1-CH2C(O)-Xc, где R1 и Хc такие, как определено выше, (1) кислотой Льюиса, (2) основанием и (3) соединением формулы где R2, Х и Y такие, как определено в п.5, и Х присоединен в положении 4 или 5 фенильного кольца. 7. Способ по п.5, при котором соединение формулы IV или энантиомер указанного соединения формулы IV, где R1, R2, X, Хc и Y такие,как определено в п.5, получают обработкой соединения формулы R1-CH2C(O)-Xc, где R1 и Хc такие, как определено в п.5, (1) галогенидом титана (IV), (2) основанием, возможно с последующей обработкой донорным лигандом, и (3) соединением формулы где R2, Х и Y такие, как определено в п.5, и Х присоединен в положении 4 или 5 фенильного кольца. 8. Способ по п.1, при котором соединение формулы IX или энантиомер указанного соединения, где R1, R2, R3 и R4 такие, как определено в п.1, получают сочетанием соединения формулы 42 12. Способ по п.11, при котором соединение формулы XIII, где R3, R4 и R7 такие, как определено в п.11, получают обработкой соединения формулы или энантиомера указанного соединения формулы VI в случае получения энантиомера указанного соединения формулы IX, где R1 и R2 такие, как определено в п.1, а X', который присоединен в положении 6 или 7 хроманового кольца, представляет собой галогено или (С 1 С 4)перфторалкилсульфонат, с соединением формулы где R3 и R4 такие, как определено в п.1, в присутствии основания или соли фтороводородной кислоты и палладиевого катализатора. 9. Способ по п.8, при котором соединение формулы XIV, где R3 и R4 такие, как определено в п.8, получают гидролизом соединения формулы где R3 и R4 такие, как определено в п.8, пунктирная линия обозначает связь или отсутствие связи между атомами В и N, n и m независимо являются числом от 2 до 5, а R8 представляет собой Н или (С 1-С 6)алкил. 10. Способ по п.9, при котором соединение формулы XVI, где R3, R4 и R8 такие, как определено в п.9, получают взаимодействием соединения формулы где R3 и R4 такие, как определено в п.9, с соединением формулы H(O)(CH2)m-N(R8)-(CH2)nOH,где n, m и R8 такие, как определено в п.9. 11. Способ по п.8, при котором соединение формулы XIV, где R4 и R3 такие, как определено в п.8, получают гидролизом соединения формулы где R3 и R4 такие, как определено в п.11, металламидным основанием в присутствии триС 1 С 6)алкил)бората. 13. Способ по п.1, дополнительно включающий в себя взаимодействие соединения формулы Х или энантиомера указанного соединения, где R1, R2 и R3 такие, как определено в п.1, со вторичным амином формулы NHR5R6,где R5 и R6 такие, как определено в п.1, с образованием карбоксилата аммония формулы или энантиомера указанного соединения формулы XVII, если его получают из энантиомера указанного соединения формулы X, где R1, R2,R3, R5 и R6 такие, как определено в п.1. 14. Способ получения соединения формулы или энантиомера указанного соединения,где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4; каждый R2 независимо выбран из группы,которую составляют Н, фторо, хлоро, (С 1 С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nC1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; Хс представляет собой (R)-4-бензил-2 оксазолидинон, (S)-4-бензил-2-оксазолидинон,(4R,5S)-4-метил-5-фенилоксазолидин-2-он или(4S,5R)-4-метил-5-фенилоксазолидин-2-он, при 43 соединенный по атому азота оксазолидин-2 онового кольца; иR11 представляет собой (С 1-С 9)алкил, (С 2 С 9)алкенил или фенил, замещенный группой Y в положении 2, Х в положении 4 или 5 и R2 в одном из остальных положений фенильной группировки, где Y представляет собой галогено,нитро или (С 1-С 4)алкокси, а Х представляет собой галогенид,при котором соединение формулы R1CH2C(O)-Xc, где R1 и Хс такие, как определено выше, обрабатывают (1) галогенидом титана(IV), (2) основанием, возможно с последующей обработкой донорным лигандом и (3) менее чем двумя эквивалентами соединения формулыR11C(O)H, где R11 такой, как определено выше,относительно количества указанного соединения формулы R1-CH2C(O)-Xc. 15. Соединение формулы или энантиомер указанного соединения,где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4; каждый R2 независимо выбран из группы,которую составляют Н, фторо, хлоро, (С 1 С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nC1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; Х представляет собой галогеногруппу и присоединен по положению 4 или 5 фенильного кольца; иY представляет собой галогено или нитро. 16. Соединение формулы или энантиомер указанного соединения,где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4; каждый R2 независимо выбран из группы,которую составляют Н, фторо, хлоро, (С 1 002204 44 С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2;X' представляет собой галогено или (С 1 С 4)перфторалкилсульфонат и присоединен в положении 6 или 7 хроманового кольца. 17. Соединение формулы или энантиомер указанного соединения,где R1 представляет собой -(CH2)qCHR5R6, где q является числом от 0 до 4; каждый R2 независимо выбран из группы,которую составляют Н, фторо, хлоро, (С 1 С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nC1-С 6)алкил) и фенильные группировки указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; и группировка бороновой кислоты присоединена в положении 6 или 7 хроманового кольца. 18. Соединение формулы или энантиомер указанного соединения, где бензоатная группировка присоединена по атому углерода 6 или 7 хроманового кольца;q является числом от 0 до 4; каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро,(С 1-С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил,фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка групп алкокси и -S(O)nС 1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;R6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2. 19. Соединение формулы где R3 выбран из группы, которую составляют Н, фторо, хлоро, (С 1-С 6)алкил, (С 1-С 6)алкокси,фенилсульфинил, фенилсульфонил и -S(O)nС 1 С 6)алкил), где n является числом от 0 до 2, и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1 С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3; где R3 выбран из группы, которую составляют Н, фторо, хлоро, (С 1-С 6)алкил, (С 1-С 6)алкокси,фенилсульфинил, фенилсульфонил и -S(O)nС 1 С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1 С 6)алкил) и фенильные группировки указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3; и где пунктирная линия обозначает связь или отсутствие связи между атомами В и N;n и m независимо являются числом от 2 до 5;R3 выбран из группы, которую составляют Н, фторо, хлоро, (С 1-С 6)алкил, (С 1-С 6)алкокси,фенилсульфинил, фенилсульфонил и -S(O)nС 1 С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1 С 6)алкил) и фенильные группировки указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3; или энантиомер указанного соединения, где в указанном карбоксилате формулы XVII R3 замещенная фенильная группировка присоединена по атому углерода 6 или 7 хроманового кольца;q является числом от 0 до 4; каждый R2 и R3 независимо выбран из группы, которую составляют Н, фторо, хлоро,(С 1-С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил,фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3; каждый R5 независимо представляет собой Н, (С 1-С 6)алкил или R2-замещенный фенил; каждый R6 независимо представляет собой Н, (С 1-С 6)алкил, (С 3-С 8)циклоалкил, фенил, нафтил, пиридил, фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2. 23. Соединение формулыR6 представляет собой Н, (С 1-С 6)алкил,(С 3-С 8)циклоалкил, фенил, нафтил, пиридил,фурил, тиенил, изохинолил, пиримидинил или пиразинил, где последние восемь групп возможно замещены одним или двумя заместителями, независимо выбранными из фенила, R2 и фенила, замещенного одним или двумя R2; Х представляет собой галогено;Y представляет собой галогено или нитро; и Хс представляет собой (R)-4-бензил-2 оксазолидинон, (S)-4-бензил-2-оксазолидинон,(4R,5S)-4-метил-5-фенилоксазолидин-2-он или(4S,5R)-4-метил-5-фенилоксазолидин-2-он, присоединенный по атому азота оксазолидин-2 онового кольца. 2 или энантиомер указанного соединения, где Х присоединен в положении 4 или 5 фенильной группировки;q является числом от 0 до 4; каждый R2 независимо выбран из группы,которую составляют Н, фторо, хлоро, (С 1 С 6)алкил, (С 1-С 6)алкокси, фенилсульфинил, фенилсульфонил и -S(O)nС 1-С 6)алкил), где n является числом от 0 до 2 и где указанная алкильная группа, алкильная группировка указанных групп алкокси и -S(O)nС 1-С 6)алкил) и фенильная группировка указанных фенилсульфинильной и фенилсульфонильной групп возможно замещены фторгруппами в количестве от 1 до 3;
МПК / Метки
МПК: C07C 49/245, C07D 311/22, C07F 5/04
Метки: хроманола, производных, соединения, получения, способы, замещенных, промежуточные
Код ссылки
<a href="https://eas.patents.su/25-2204-sposoby-i-promezhutochnye-soedineniya-dlya-polucheniya-zameshhennyh-proizvodnyh-hromanola.html" rel="bookmark" title="База патентов Евразийского Союза">Способы и промежуточные соединения для получения замещенных производных хроманола</a>
Предыдущий патент: Меченные 19фтором производные антрациклинона и антрациклина, фармацевтическая композиция на их основе и их применение для лечения или диагностики амилоидоза
Следующий патент: Способ электролитического получения металлов
Случайный патент: Покрытие из сохраняющих форму частей, в частности, для пола, покрывные части для использования в нем и способ соединения покрывных частей