Способ получения 3-фенилурацилов
Номер патента: 12035
Опубликовано: 30.06.2009
Авторы: Лёр Зандра, Кайл Михаэль, Вольф Бернд, Майер Гуидо, Гебхардт Йоахим, Шмидт Томас
Формула / Реферат
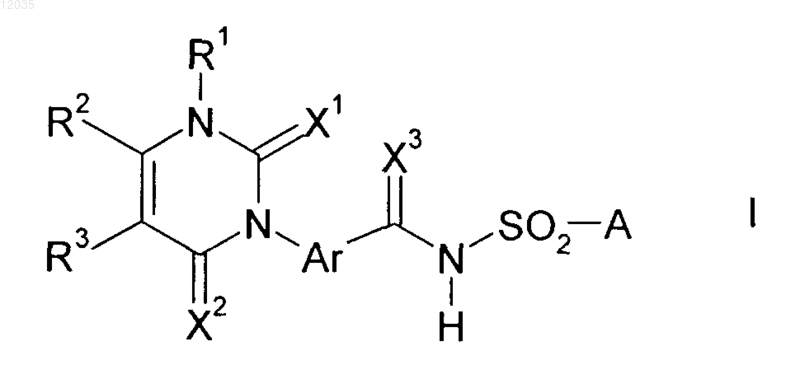
1. Способ получения 3-фенилурацилов формулы I

в которой заместители имеют приведенные ниже значения:
R1 означает водород, C1-С6-алкил, С1-С4-цианоалкил, C1-С6-галоалкил, С3-C8-циклоалкил, С2-С6-алкенил, С2-С6-галоалкенил, С3-С6-алкинил или С3-С6-галоалкинил;
R2 и R3, каждый независимо означает водород, C1-С6-алкил, С1-С6-галоалкил, С3-C8-циклоалкил, С2-С6-алкенил, С2-С6-галоалкенил, С3-С6-алкинил или С3-С6-галоалкинил;
X1, X2 и X3, каждый независимо означает кислород;
Ar означает фенил, который может быть частично или полностью галогенирован; и
А означает NR4R5, где R4 и R5, каждый независимо означает водород или C1-С6-алкил,
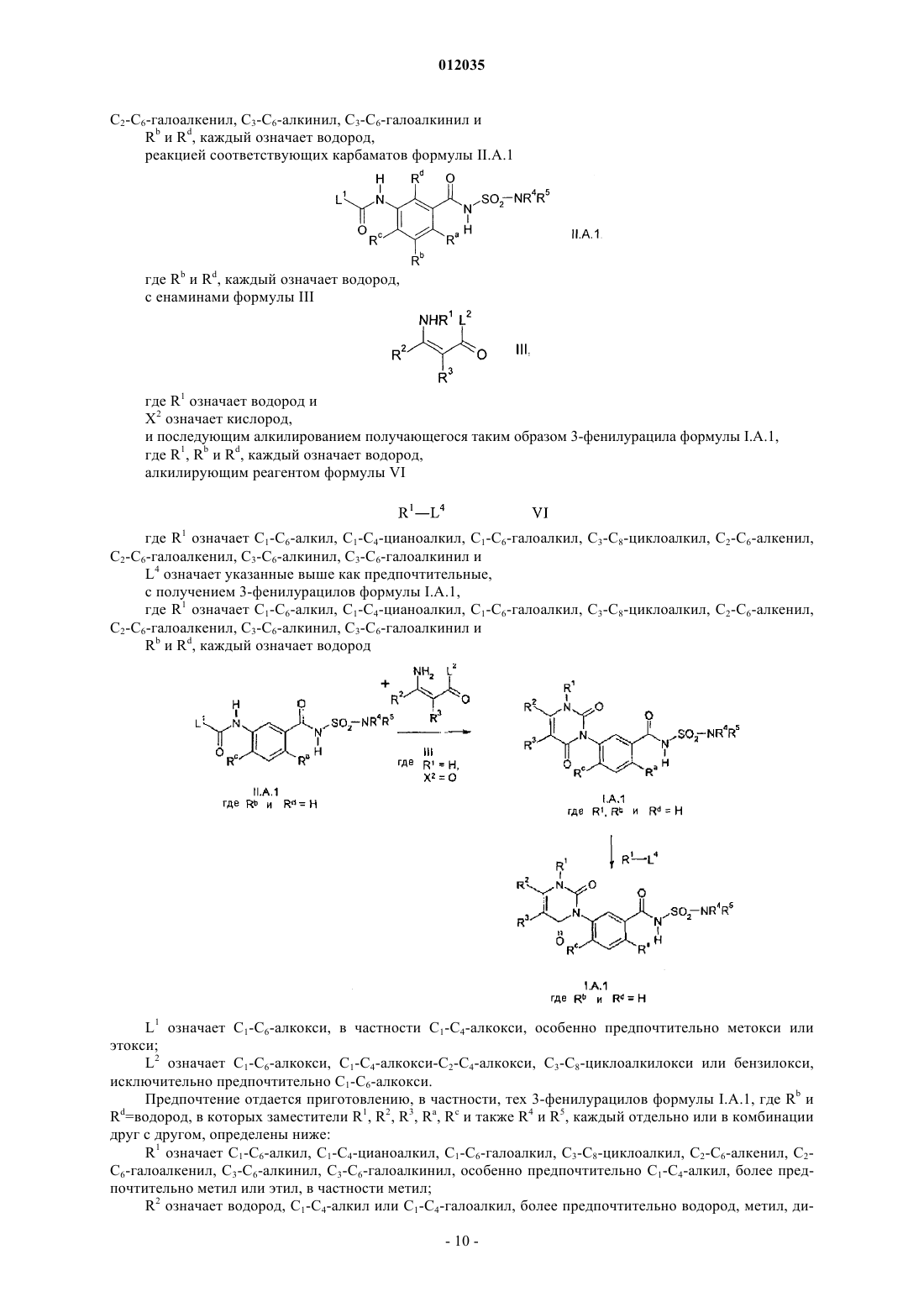
который включает взаимодействие карбаматов формулы II

где заместители X1, X3, Ar и А имеют значения приведенные выше; и
L1 означает C1-С6-алкокси,
с енаминами формулы III
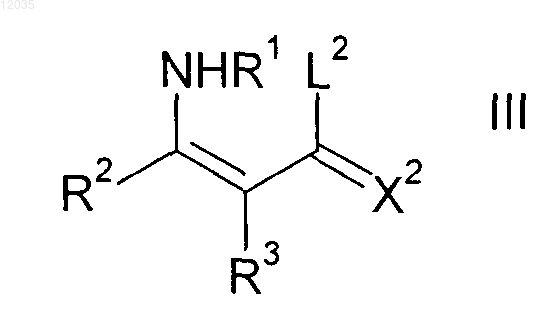
где заместители X2, R1, R2 и R3 имеют значения, приведенные выше; и
L2 означает C1-С6-алкокси, С1-С4-алкокси-С2-С4-алкокси, С3-С8-циклоалкилокси или бензилокси,
в присутствии избытка основания, исходя из карбамата формулы II.
2. Способ получения 3-фенилурацилов формулы I в соответствии с п.1, где R1 означает водород или С1-С4-алкил.
3. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1 и 2, где R2 означает водород, С1-С4-алкил или С1-С4-галоалкил.
4. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1-3, где R3 означает водород или С1-С4-алкил.
5. Способ по пп.1-4, где Ar означает группу общей формулы Ar-1
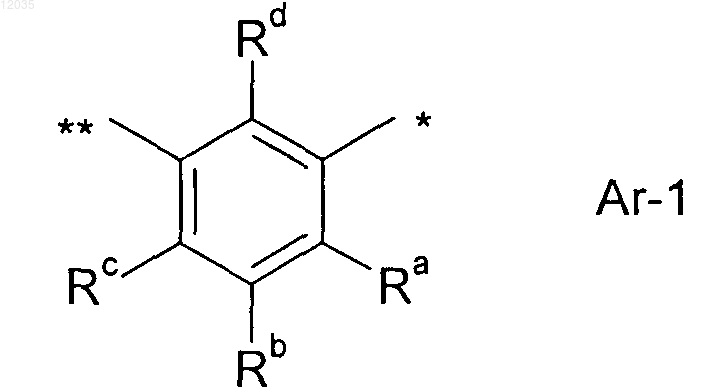
где * означает место связывания Ar к С(Х3) группе;
** означает место связывания Ar к непосредственно прилежащему атому азота; и
Ra и Rc, каждый независимо означает водород или галоген; и
Rb и Rd, каждый означает водород.
6. Способ по пп.1-5, где А означает -NR4R5-группу, где заместители R4 и R5, каждый независимо, означают водород или C1-С6-алкил.
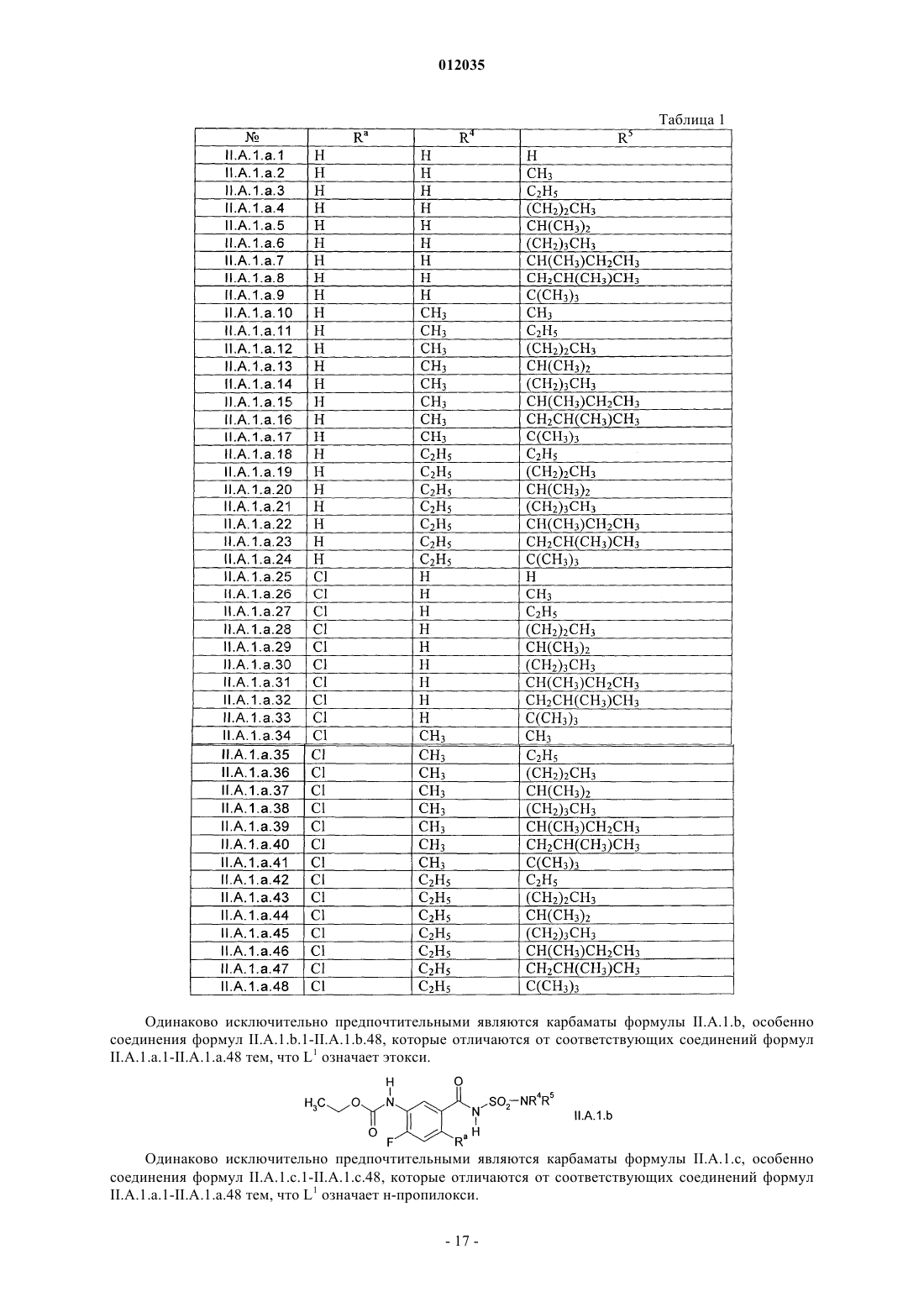
7. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1-6, где карбаматы формулы II получены путем взаимодействия аминов формулы IV
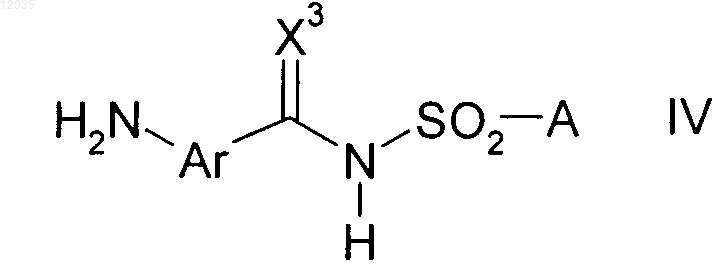
где X3, Ar и А имеют значения, определенные в п.1,
с соединениями формулы V

где X1 и L1 имеют значения, определенные в п.1; и
L3 означает хлор или C1-С6-алкокси.
8. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1-7, где карбаматы формулы II на промежуточной стадии галогенируют по Ar радикалу галогенирующим реагентом.
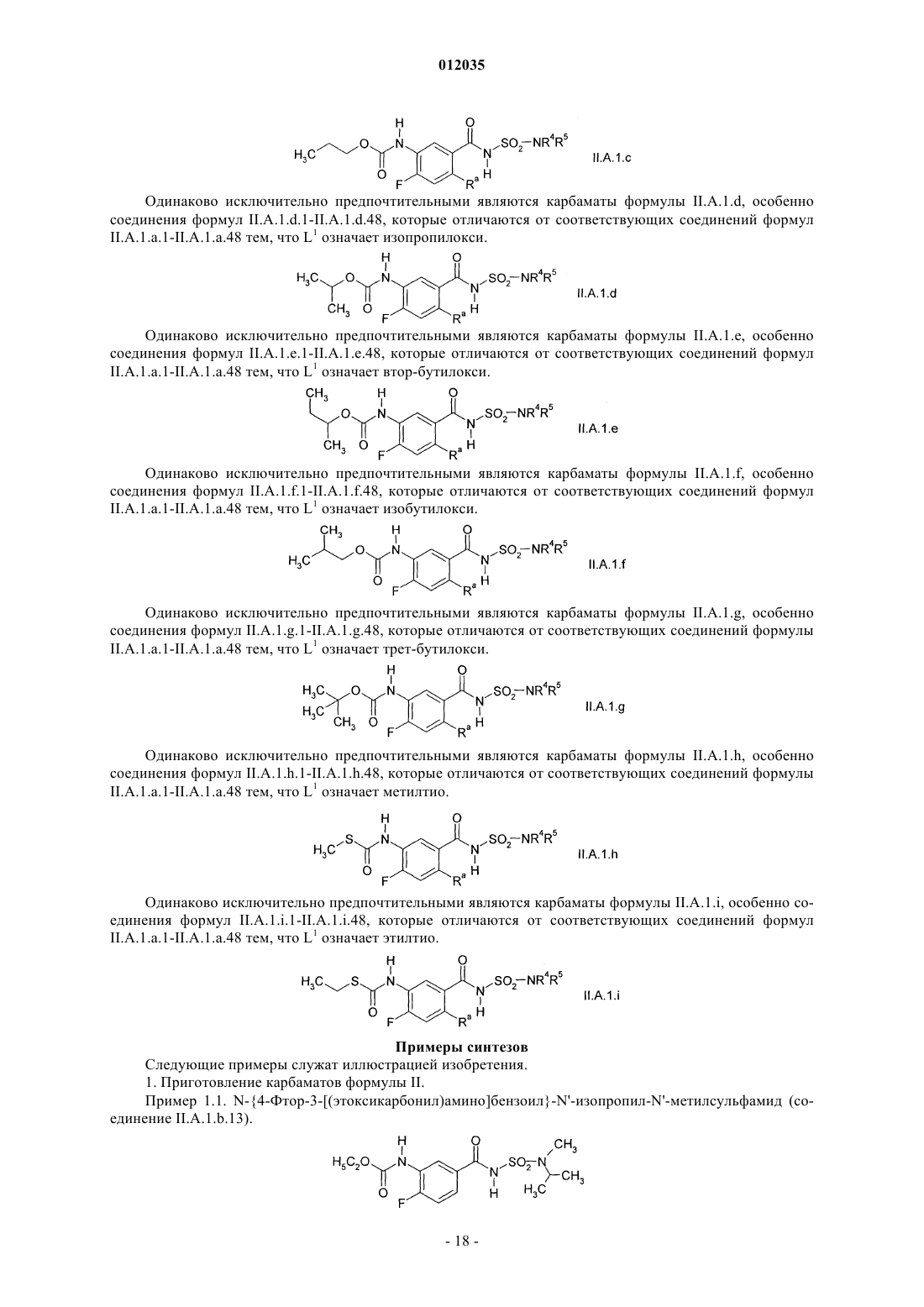
9. Карбамат формулы II
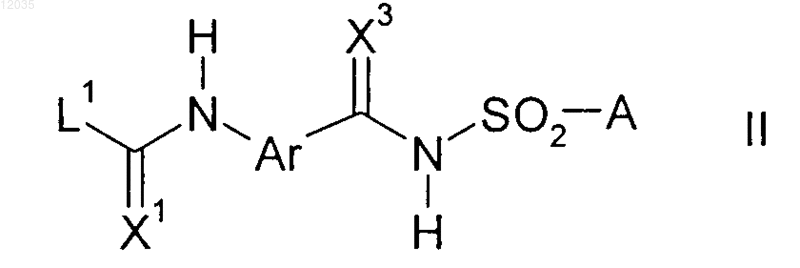
где X1, X3, Ar, A и L1 имеют значения, определенные в п.1.
10. Способ получения 3-фенилурацилов формулы I в соответствии с п.1
где R1 имеет значения, указанные ниже:
R1 означает C1-С6-алкил, С1-С4-цианоалкил, C1-С6-галоалкил, С3-C8-циклоалкил, С2-С6-алкенил, С2-С6-галоалкенил, С3-С6-алкинил или С3-С6-галоалкинил; и
заместители R2, R3, X1, X2, X3, Ar и А имеют значения, указанные в пп.1-6,
который включает взаимодействие карбаматов формулы II
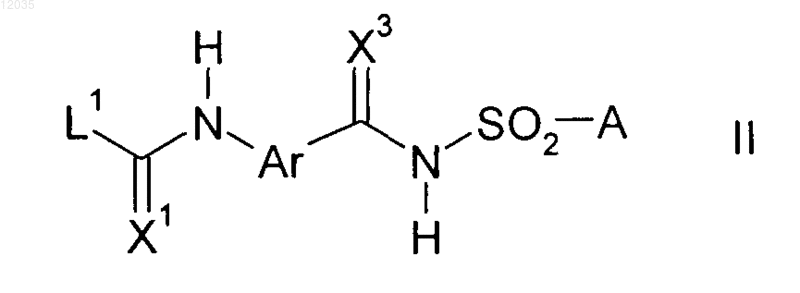
где заместители X1, X3, Ar и А имеют значения, приведенные выше; и
L1 означает C1-С6-алкокси,
с енаминами формулы III
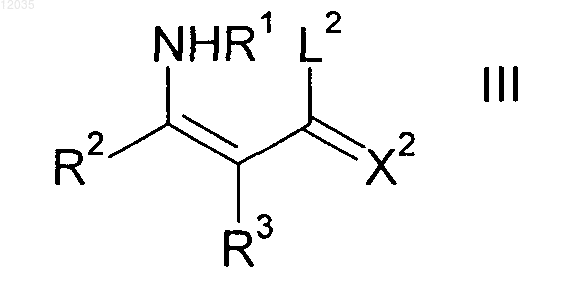
где R1 означает водород;
заместители X2, R2 и R3 имеют значения, приведенные выше; и
L2 означает C1-С6-алкокси, С1-С4-алкокси-С2-С4-алкокси, С3-C8-циклоалкокси и бензилокси,
и последующее взаимодействие получающихся 3-фенилурацила формулы I, где R1 означает водород, с алкилирующим реагентом формулы VI

где R1 означает C1-С6-алкил, С1-С4-цианоалкил, C1-С6-галоалкил, С3-С8-циклоалкил, С2-С6-алкенил, С2-С6-галоалкенил, С3-С6-алкинил или С3-С6-галоалкинил; и
L4 означает галоген, C1-С6-алкилсульфат и сульфат,
приводящее к 3-фенилурацилам формулы I, где R1 означает C1-С6-алкил, С1-С4-цианоалкил, C1-С6-галоалкил, С3-C8-циклоалкил, С2-С6-алкенил, С2-С6-галоалкенил, С3-С6-алкинил или С3-С6-галоалкинил.
11. Способ получения 3-фенилурацилов формулы I в соответствии с п.10, где R1 означает C1-С6-алкил.
Текст
012035 Настоящее изобретение касается способа получения 3-фенилурацилов формулы I в которой заместители имеют приведенные значения:R2 и R3, каждый независимо означает водород, C1-С 6-алкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2 С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил или С 3-С 6-галоалкинил;X1, X2 и X3, каждый независимо означает кислород;Ar означает фенил, который может быть частично или полностью галогенирован; и А означает NR4R5, где R4 и R5, каждый независимо означает водород или C1-С 6-алкил. Фенилурацилы, которые в мета-положении к урацильному кольцу на фенильном кольце несут гетероциклический или ненасыщенный сложноэфирный, тиоэфирный или амидный радикал, который присоединен к фенильному кольцу через атом кислорода или серы, известны из WO 04/056785. 3-Фенилурацилы общей формулы I и соответствующие тио- и дитиоурацилы известны, в принципе,из WO 01/83459. Их получают согласно методам, раскрытым в WO 01/83459, в соответствии с нижеприведенными способами A-C. В нижеследующих схемах A-C заместители Ar и А имеют, среди прочего, указанные выше определения, Hal означает галоген и Q означает необязательно замещенный гетероцикл. Способ А. Конденсация замещенной бензойной кислоты с замещенным диамидом серной кислоты в присутствии N,N-карбонилдиимидазола (CDI) или превращение карбоновой кислоты в ее хлорангидрид и последующая реакция хлорангидрида с диамидом серной кислоты в соответствии со следующей схемой А: Недостаток этого метода состоит в том, что применяемая бензойная кислота доступна только из предшественника сложного эфира путем его разложения с использованием трибромида бора с соответствующим солеобразованием. К тому же выход конденсации с диамидом серной кислоты составляет только между 16 и 45%. Другой путь через предварительное приготовление хлорангидрида также приводит только к 26% выходу целевого диамида бензоилсерной кислоты. Способ В. Замещение атома галогена урациловым, тиоурациловым или дитиоурациловым радикалом в соответствии со следующей схемой В: Способ В имеет недостаток, связанный с тем, что исходное галоароматическое соединение получают сложным путем посредством реакции Сандмейера. Кроме того, когда другие галогеновые заместители присутствуют в Ar, селективность реакции относительно остатка галогена является неудовлетворительной. Способ С. Реакция анилинового соединения с оксазиноном и последующее алкилирование получающегося 3 фенилурацила в присутствии основания в соответствии со следующей схемой С:-1 012035 Недостатком является то, что исходный оксазинон получают сложным путем, взаимодействием аминокротонового сложного эфира с диалкилкарбамоилхлоридом и последующей циклизацей оксихлоридом фосфора, пентахлористым фосфором или оксалилхлоридом. Более того, этот способ не достаточно рентабелен из-за стоимости применяемого исходного материала и сложности стадий реакции. Поэтому задачей данного изобретения является предложить способ получения 3-фенилурацилов формулы I, который позволяет получить 3-фенилурацилы формулы I с высокими выходами и высокой чистотой и, кроме того, преодолеть указанные неудобства известного уровня техники. Другой задачей данного изобретения является предложить несложный и удобный способ получения карбаматов формулы II, который позволяет получить карбаматы формулы II с высокими выходами и высокой чистотой. Еще одной задачей данного изобретения является предложить способ получения 3-фенилурацилов формулы I, который дополнительно включает способ получения карбаматов формулы II. Неожиданно обнаружено, что поставленной цели можно достичь посредством способа, в котором карбаматы формулы IIL2 означает C1-С 6-алкокси, С 1-С 4-алкокси-С 2-С 4-алкокси, С 3-С 8-циклоалкилокси или бензилокси,в присутствии избытка основания, исходя из карбамата формулы II. Настоящее изобретение, следовательно, предлагает способ получения вышеопределенных 3-фенилурацилов формулы I, включающий взаимодействие карбаматов формулы II с енаминами формулы III. Сами карбаматы формулы II могут быть приготовлены в соответствии с известными из уровня техники методами (например, Houben-Weyl, Methoden der organischen Chemie, Е 5, 1985, р. 972-980, и также VIII,р. 655 и XI part 2, р. 10; J.В. Press et al., J. Het. Chem., 23, 6, 1986, р. 1821-1828; I. Vanthey et al., TetrahedronLett. 41, 33, 2000, р. 6347-6350; M. Belley et al., Synlett., 2, 2001, р. 222-225) из аминов формулы IVL3 означает хлор или С 1-С 6-алкокси. Таким образом, способ в соответствии с настоящим изобретением предпочтительно включает приготовление карбаматов формулы II этим путем. Карбаматы формулы II являются новыми и также составляют часть предмета настоящего изобретения в качестве исходного материала или промежуточных продуктов в способе в соответствии с настоящим изобретением. Органические молекулярные остатки, указанные в определениях заместителей R1-R3, Ar и А или остатках фенильного кольца, как, например, значение галоген, являются сборными терминами для индивидуальных перечней индивидуальных членов групп, причем выражение Cn-Cm означает возможное число атомов углерода в молекулярном остатке. Все углеводородные цепи, то есть все остатки, выбранные из группы, включающей алкил, галоалкил, цианоалкил, цианоалкокси, алкокси, галоалкокси, алкилтио, алкилсульфинил, алкилсульфонил, диалкиламино, алкилкарбонил, алкоксикарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкенил, галоалкенил, алкенилокси, галоалкенилокси, алкинил, галоалкинил, алкинилокси, галоалкинилокси, алкоксиалкокси и алкилтиоалкокси, могут быть неразветвленными или разветвленными. Если не указано иное, галогенированные заместители несут предпочтительно от 1 до 5 одина-2 012035 ковых или разных атомов галогена. Термин галоген в каждом случае означает фтор, хлор, бром или йод. Например, определения означают: С 1-С 4-алкил: например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил, 2-метилпропил и 1,1-диметилэтил;C1-С 6-алкил: С 1-С 4-алкил, как указано выше, и также, например, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-3-метилпропил; С 3-С 8-циклоалкил и циклоалкильные остатки С 3-C8-циклоалкокси: например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил; С 3-С 6-алкенил: например, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил,1-метил-1-пропенил, 2-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1 -метил- 1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2 бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1 этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3 метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4 метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил,1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил,3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил 2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1 пропенил и 1-этил-2-метил-2-пропенил; С 2-С 6-алкенил: С 3-С 6-алкенил, как указано выше, и также этенил; С 3-С 6-алкинил: например, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2 пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2 метил-3-бутинил, 3-метил-1-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1-метил-2-пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил,2-метил-3-пентинил, 2-метил-4-пентинил, 3-метил-1-пентинил, 3-метил-4-пентинил, 4-метил-1-пентинил,4-метил-2-пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 3,3-диметил-1-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил и 1-этил 1-метил-2-пропинил; С 2-С 6-алкинил: С 3-С 6-алкинил, как указано выше, и также этинил; С 1-С 4-галоалкил: С 1-С 4-алкильный радикал, как указано выше, который частично или полностью замещен посредством фтора, хлора, брома и/или йода, то есть, например, хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-йодэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил, 2-фторпропил,3-фторпропил, 2,2-дифторпропил, 2,3-дифторпропил, 2-хлорпропил, 3-хлорпропил, 2,3-дихлорпропил, 2 бромпропил, 3-бромпропил, 3,3,3-трифторпропил, 3,3,3-трихлорпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1-(хлорметил)-2-хлорэтил, 1-(бромметил)-2-бромэтил, 4-фторбутил, 4-хлорбутил, 4-бромбутил и нонафторбутил;C1-С 6-галоалкил: С 1-С 4-галоалкил, как указано выше, и также, например, 5-фторпентил, 5-хлорпентил, 5-бромпентил, 5-йодпентил, ундекафторпентил, 6-фторгексил, 6-хлоргексил, 6-бромгексил, 6-йодгексил и додекафторгексил; С 2-С 6-галоалкенил и также галоалкенильные остатки С 2-С 6-галоалкенилокси: С 2-С 6-алкенильный радикал, как указано выше, который частично или полностью замещен посредством фтора, хлор, брома и/или йода, например 2-хлорвинил, 2-хлораллил, 3-хлораллил, 2,3-дихлораллил, 3,3-дихлораллил, 2,3,3 трихлораллил, 2,3-дихлорбут-2-енил, 2-бромвинил, 2-бромаллил, 3-бромаллил, 2,3-дибромаллил, 3,3-дибромаллил, 2,3,3-трибромаллил или 2,3-дибромбут-2-енил; С 3-С 6-галоалкинил и галоалкинильные остатки С 3-С 6-галоалкинилокси: С 3-С 6-алкинильный радикал, как указано выше, который частично или полностью замещен посредством фтора, хлор, брома и/или йода, например 1,1-дифторпроп-2-ин-1-ил, 3-йодпроп-2-ин-1-ил, 4-фторбут-2-ин-1-ил, 4-хлорбут-2-ин-1 ил, 1,1-дифторбут-2-ин-1-ил, 4-йодбут-3-ин-1-ил, 5-фторпент-3-ин-1-ил, 5-йодпент-4-ин-1-ил, 6-фторгекс-4-ин-1-ил или 6-йодгекс-5-ин-1-ил; С 1-С 4-цианоалкил: например, цианометил, 1-цианоэт-1-ил, 2-цианоэт-1-ил, 1-цианопроп-1-ил, 2-цианопроп-1-ил, 3-цианопроп-1-ил, 1-цианопроп-2-ил, 2-цианопроп-2-ил, 1-цианобут-1-ил, 2-цианобут-1 ил, 3-цианобут-1-ил, 4-цианобут-1-ил, 1-цианобут-2-ил, 2-цианобут-2-ил, 1-цианобут-3-ил, 2-цианобут-3 ил, 1-циано-2-метилпроп-3-ил, 2-циано-2-метилпроп-3-ил, 3-циано-2-метилпроп-3-ил и 2-цианометил-3 012035 проп-2-ил; С 1-С 6-цианоалкил и цианоалкильные остатки С 1-С 6-цианоалкокси: С 1-С 4-цианоалкил, как указано выше, и также 5-цианопентил, 6-цианогексил; С 1-С 4-алкокси: например, метокси, этокси, пропокси, 1-метилэтокси, бутокси, 1-метилпропокси, 2 метилпропокси и 1,1-диметилэтокси;C1-С 6-алкокси: С 1-С 4-алкокси, как указано выше, и также, например, пентокси, 1-метилбутокси, 2 метилбутокси, 3-метоксибутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1 этилпропокси, гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3 диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1 этил-1-метилпропокси и 1-этил-2-метилпропокси; С 1-С 4-алкокси-С 2-С 4-алкокси: С 2-С 4-алкоксизамещенный посредством С 1-С 4-алкокси, как указано выше, то есть, например, 2-(метокси)этокси, 2-(этокси)этокси, 2-(пропокси)этокси, 2-(1-метилэтокси) этокси, 2-(бутокси)этокси, 2-(1-метилпропокси)этокси, 2-(2-метилпропокси)этокси, 2-(1,1-диметилэтокси)этокси, 2-(метокси)пропокси, 2-(этокси)пропокси, 2-(пропокси)пропокси, 2-(1-метилэтокси)пропокси,2-(бутокси)пропокси, 2-(1-метилпропокси)пропокси, 2-(2-метилпропокси)пропокси, 2-(1,1-диметилэтокси)пропокси, 3-(метокси)пропокси, 3-(этокси)пропокси, 3-(пропокси)пропокси, 3-(1-метилэтокси)пропокси, 3-(бутокси)пропокси, 3-(1-метилпропокси)пропокси, 3-(2-метилпропокси)пропокси, 3-(1,1-диметилэтокси)пропокси, 2-(метокси)бутокси, 2-(этокси)бутокси, 2-(пропокси)бутокси, 2-(1-метилэтокси)бутокси, 2-(бутокси)бутокси, 2-(1-метилпропокси)бутокси, 2-(2-метилпропокси)бутокси, 2-(1,1-диметилэтокси)бутокси, 3-(метокси)бутокси, 3-(этокси)бутокси, 3-(пропокси)бутокси, 3-(1-метилэтокси)бутокси,3-(бутокси)бутокси, 3-(1-метилпропокси)бутокси, 3-(2-метилпропокси)бутокси, 3-(1,1-диметилэтокси)бутокси, 4-(метокси)бутокси, 4-(этокси)бутокси, 4-(пропокси)бутокси, 4-(1-метилэтокси)бутокси, 4-(бутокси)бутокси, 4-(1-метилпропокси)бутокси, 4-(2-метилпропокси)бутокси и 4-(1,1-диметилэтокси)бутокси. Все фенильные кольца являются предпочтительно незамещенными или несут от 1 до 3 атомов галогена. В особенно предпочтительном варианте осуществления способа в соответствии с настоящим изобретением заместители R1, R2 и R3, каждый отдельно или в комбинации, определены ниже:R1 означает водород, C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил, особенно предпочтительно водород или С 1-С 4-алкил, более предпочтительно водород, метил или этил, в частности метил, также предпочтительно водород, С 1-С 4-алкил, более предпочтительно водород, метил или этил, в частности метил, также предпочтительно водород, С 1-С 4-алкил, более предпочтительно водород;R3 означает водород или С 1-С 4-алкил, более предпочтительно водород. В способе в соответствии с настоящим изобретением X1, X2 и X3, каждый означает кислород. Группа Ar означает предпочтительно группу общей формулы Ar-1 в которойозначает место связывания Ar к C(X3) группе;означает место связывания Ar к непосредственно прилежащему атому азота иRa и Rc, каждый независимо означает водород или галоген;Rb и Rd, каждый означает водород. Указанный радикал А означает группу формулы -NR4R5, где заместители, каждый независимо означает водород или C1-С 6-алкил. Стадии способа согласно изобретению могут быть выполнены или периодически, или непрерывно в пригодной для этого реакционной посуде. При периодическом осуществлении используют обычные смесительные баки и реакторы с мешалками. Емкости обычно оснащают пригодными теплообменниками или охлаждающей рубашкой для отвода теплоты реакции. Стадии способа согласно изобретению, осуществляемого непрерывно, также проводят в пригодных для этого реакторах, например в смесительных баках, батареях смесительных баков и трубчатых реакторах, из которых предпочтение отдается реакторам, имеющим низкое обратное смешивание. Количество растворителя или разбавителя, в общем, выбирают из условия, чтобы реакционные смеси оставались свободнотекучими во время реакции. Приготовление 3-фенилурацилов формулы I осуществляется путем взаимодействия карбамата формулы II с енамином формулы IIIL2 означает C1-С 6-алкокси, С 1-С 4-алкокси-С 2-С 4-алкокси, С 3-С 8-циклоалкилокси или бензилокси. Реакцию карбаматов формулы II с енаминами формулы III обычно осуществляют при температуре выше комнатной, например от 25 до 200C, предпочтительно от 90 до 190C, более предпочтительно от 100 до 140C в инертном органическом растворителе в присутствии основания (см., например, WO 99/31091). Реакционное давление особенно не влияет на возможность осуществления способа в соответствии с настоящим изобретением и может, например, находиться в диапазоне от 500 мбар до 10 бар. Предпочтительно реакцию проводят при давлении, близком к обычному, то есть в диапазоне от 0,9 до 1,2 бар. Время, необходимое для осуществления реакции, находится обычно в диапазоне от 1 до 24 ч, и в частности в диапазоне от 2 до 8 ч. Реакция, в принципе, может проводиться "в веществе". Впрочем, предпочтение отдается взаимодействию карбаматов формулы II с енаминами формулы III в органическом растворителе. Пригодными, в принципе, являются все растворители, которые способны растворять карбаматы формулы II и енамины формулы III, по крайней мере, частично и предпочтительно полностью при реакционных условиях. Предпочтительно растворители являются полярными протоносодержащими растворителями. Пригодными растворителями являются алифатические углеводороды, такие как пентан, гексан,циклогексан и смеси C5-C8-алканов, ароматические углеводороды, такие как толуол, о-, м- и п-ксилол,галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол, простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, диоксан, диметиловый эфир диэтиленгликоля, анизол и тетрагидрофуран, нитрилы, такие как ацетонитрил и пропионитрил, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол и трет-бутанол, сложные эфиры карбоновых кислот, такие как бутилацетат, и также диметилсульфоксид, диметилформамид, диметилацетамид иN-метилпирролидон; более предпочтительно диметилформамид, диметилацетамид и N-метилпирролидон. Также возможно применение смесей указанных растворителей. Пригодными основаниями являются обычно неорганические соединения, такие как гидроксиды щелочных и щелочно-земельных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид кальция, оксиды щелочных и щелочно-земельных металлов, такие как оксид лития, оксид натрия, оксид кальция и оксид магния, гидриды щелочных и щелочно-земельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция, амиды щелочных металлов, такие как амид лития, амид натрия и амид калия, карбонаты щелочных и щелочно-земельных металлов, такие как карбонат лития, карбонат натрия, карбонат калия, карбонат кальция и карбонат цезия, и также бикарбонаты щелочных металлов, такие как бикарбонат натрия, металлоорганические соединения, особенно щелочные металлалкильные соединения, такие как метиллитий, бутиллитий и фениллитий, алкоксиды щелочных и щелочно-земельных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия, этоксид калия, трет-бутоксид калия, трет-пентоксид калия и диметоксимагний, и также органические основания, например третичные амины, такие как триметиламин, триэтиламин, диизопропилэтиламин и N-метилпиперидин, пиридин, замещенные пиридины, такие как коллидин, лутидин и 4-диметиламинопиридин, и также бициклические амины. Особенное предпочтение отдается гидроксидам щелочных и щелочно-земельных металлов, карбонатам щелочных и щелочно-земельных металлов и также алкоксидам щелочных и щелочно-земельных металлов. Основания обычно применяются в избытке, более предпочтительно в диапазоне от 1,1 до 3 экв. основания на карбамат формулы II, и они могут также использоваться в качестве растворителя. Может быть полезным добавление основания на протяжении некоторого интервала времени. Основания применяются предпочтительно в диапазоне от 1,1 до 2,4 экв., особенно предпочтительно от 2,2 до 2,4 экв., более предпочтительно при 2,3 экв., на карбамат II. Реагенты обычно вводят в взаимодействие друг с другом в эквимолярных количествах. Может быть полезным применение одного компонента в избытке по отношению к другим компонентам. Предпочтение отдается применению соединений в молярном соотношении II:III в диапазоне от 1,5:1 до 1:1,5, более предпочтительно от 1:1 до 1:1,2, в частности 1:1. Предпочтение отдается частичному удалению соединений L1-H и L2-H образующихся в ходе реакции карбаматов формулы II с енаминами формулы III во время реакции, особенно когда соединения L1-H-5 012035 и L2-H представляют собой С 1-С 4-алканол, такой как метанол или этанол. Для этого реакцию проводят известным способом при температуре и давлении, при которых соединения L1-H и L2-H, при необходимости, отгоняются из реакционной смеси как азеотроп с растворителем. При необходимости, для возмещения количества растворителя его свежая порция может быть введена в смесь, или растворитель, отогнанный совместно с соединениями L1-H и L2-H, может быть использован в реакции повторно после необязательного дистилляционного извлечения соединений L1-H и L2-H. В этом смысле, полезно, когда применяемый растворитель имеет температуру кипения по меньшей мере на 10C, в частности по меньшей мере на 30C, выше температуры кипения соединений L1-H и L2H, образующихся в реакции (при атмосферном давлении). Соответственно, реакция карбаматов формулы II с енаминами формулы III проводится в аппаратах,которые оснащены по меньшей мере одним дистилляционным или ректификационным аппаратом, например дистилляционной колонной, которая, во-первых, позволяет отгонять соединения L1-H и L2-H, при необходимости, вместе с растворителем и одновременно позволяет удалять и повторно использовать какой-либо растворитель, отогнанный с соединениями L1-H и L2-H. Для осуществления взаимодействия соединения II и III можно ввести в контакт друг с другом любым способом, то есть реагенты и основание могут вводиться в реакционный сосуд отдельно, совместно или друг за другом и вводиться в реакцию. Например, соединения II и III могут быть изначально загружены в реакционный сосуд, при необходимости, с требуемым растворителем и затем могут быть установлены желаемые реакционные условия. Впрочем, также возможно введение большей части или всех количеств соединений II и III, при необходимости, в растворителе при реакционных условиях в реакционный сосуд. В предпочтительном варианте изобретения большую часть, в частности по меньшей мере 80%, и более предпочтительно все количество или, практически, все количество (95%) карбаматов формулы II загружают изначально, и большую часть, в частности по меньшей мере 80%, и более предпочтительно все количество или, практически, все количество (95%) енамина формулы III добавляют туда же при реакционных условиях по ходу реакции, например, на протяжении от 0,5 до 20 ч, и в частности от 1 до 10 ч. Для этого енамины формулы III можно предпочтительно растворить в растворителе. В дальнейшем предпочтительном варианте изобретения загружают изначально соединения II и III и затем добавляют туда же большую часть, в частности по меньшей мере 80%, и более предпочтительно все количество или, практически, все количество (95%), основания. Реакцию можно при необходимости завершить путем дозирования дополнительного основания. 3-Фенилурацилы формулы I можно выделять из реакционной смеси известным способом. Когда реакция проводится в растворителе, реакционную смесь обычно концентрируют, и/или охлаждают, и/или добавляют осаждающее вещество. Пригодные осаждающие вещества являются растворителями, в которых 3-фенилурацилы формулы I если и растворяются, то только в малой степени, по меньшей мере при температурах ниже 25C. Осаждающие вещества являют собой, в частности, алифатические и циклоалифатические углеводороды, такие как пентан, гексан, циклогексан, гептан, петролейный эфир, толуол и подобные. Дополнительная очистка может быть проведена осаждением или кристаллизацией. Когда взаимодействие проводят, что предпочтительно, в спирте, в частности в метаноле, или этаноле, или алкилбензоле, обычно добавление осаждающих веществ излишне. Для обработки также полезно устанавливать значение рН реакционной смеси 7, применяя кислоту,предпочтительно применяя неорганические кислоты, например соляную кислоту или серную кислоту. В частности, полезно, когда рН реакционной смеси в конце составляет 2. Енамины формулы III, необходимые для приготовления 3-фенилурацилов формулы I, раскрыты в литературе (например, A. Lutz, A. and S. Trotto, J. of Heterocyclic Chem. 1972, 9, 3, 513-522) и могут быть приготовлены в соответствии с цитированной литературой. В частности, этим путем возможно получение 3-фенилурацилов формулы I.А.1 где Rb и Rd, каждый означает водород,путем взаимодействия соответствующих карбаматов формулы II.А.1L2 означает C1-С 6-алкокси, С 1-С 4-алкокси-С 2-С 4-алкокси, С 3-С 8-циклоалкилокси или бензилокси. Предпочтение отдается приготовлению особенно тех 3-фенилурацилов формулы LA.1, где Rb иR =водород, в которых заместители R1, R2, R3, Ra, Rc и также R4 и R5, каждый отдельно или в комбинации друг с другом, определены ниже:R1 означает водород, C1-С 6-алкил, С 1-С 4-цианоалкил, С 1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил, особенно предпочтительно водород или С 1-С 4-алкил, более предпочтительно водород, метил или этил, в частности метил, также предпочтительно водород или С 1-С 4-алкил, более предпочтительно водород;R3 означает водород или С 1-С 4-алкил, более предпочтительно водород;Ra означает водород или галоген, в частности водород, фтор, хлор, особенно предпочтительно водород, хлор, чрезвычайно предпочтительно водород;Rc означает водород или галоген, в частности водород, фтор или хлор, особенно предпочтительно водород или фтор, исключительно предпочтительно фтор;R4 и R5, каждый независимо означает водород или С 1-С 6-алкил, в частности R4 означает водород,С 1-С 6-алкил, более предпочтительно С 1-С 4-алкил, исключительно предпочтительно метил; иR1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2 С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил,могут быть приготовлены путем взаимодействия карбаматов формулы IIL2 означает C1-С 6-алкокси, С 1-С 4-алкокси-С 2-С 4-алкокси, С 3-C8-циклоалкилокси или бензилокси,и затем взаимодействием образующегося 3-фенилурацила формулы I, гдеR1 означает водород,с алкилирующим реагентом формулы VI где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил,-7 012035 С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил иR1 означает С 1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-С 8-циклоалкил, С 2-С 6-алкенил, С 2 С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил; или приготовление 3-фенилурацилов формулы I, где R1 означает водород, ведут при указанных выше условиях реакции, особенно при указанных выше в качестве предпочтительных.L4 в алкилирующем реагенте формулы VI означает галоген, C1-С 6-алкилсульфат, сульфат. Способ алкилирования соединения I, где R1=водород, является неожиданным в том, что нельзя предположить возможность образования соответствующих N-алкилсульфаниламидов или смеси N-алкилсульфаниламидов или N-алкилзамещенных урацилов. Известно, что диамиды серной кислоты алкилируются простым путем посредством сложных диэфиров серной кислоты или сложных эфиров аренсерной кислоты в присутствии основания; см., например, R. Sowada, J. Prakt. Chem. 25, 88 (1964). Известно образование тетразамещенных диамидов серной кислоты, исходя из тризамещенных диамидов серной кислоты; см. В. Unterhalt, E. Seebach, Arch. Pharm. 314, 51 (1981). Также возможно алкилирование диамидов серной кислоты, в которых амидная функция уже несет ацильный радикал; см. K.C.C. Bancroft et al.,J. Heterocycl. Chem. 15, 1521 (1978); A. Martinex et al., Bioorg. Med. Chem. Lett. 9 (21), 3133 (1999). Специалист в данной области техники, в силу вышесказанного, из-за легкости протекания алкилирования сульфамидной боковой цепи, должен ожидать предпочтительно алкилирования сульфаниламидного атома азота или, по меньшей мере, образования диалкилированных продуктов. Провести N-алкилирование соединения I по свободному урацильному атому азота возможно известным для урацилов способом, путем взаимодействия соединения I, где R1=водород, с алкилирующим реагентом R1-L4 (VI), как описано, например, в US 4943309, который в части алкилирования полностью включен в качестве ссылки в данное описание. Предпочтительные алкилирующие реагенты представляют собой C1-C4-алкилгалогениды, ди-С 1-С 4 алкилсульфаты, С 1-С 4-алкилфенилсульфонаты, в которых фенильный радикал является необязательно моно- или полизамещенным посредством галогена, нитро- или C1-С 6-алкила. Очень предпочтительны алкилирующие реагенты, являющиеся метилирующими реагентами или этилирующими реагентами, такими как диметилсульфат, диэтилсульфат, метилйодид, этилйодид, метилбромид, метилхлорид, этилбромид, этилхлорид, метил- или этил-С 1-С 6-алкилсульфонат или метиловые или этиловые сложные эфиры вышеуказанных фенилсульфоновых кислот. Чрезвычайно предпочтительным метилирующим реагентом является диметилсульфат. В способе в соответствии с настоящим изобретением алкилирующий реагент может быть применен или в эквимолярном количестве к соединению I, или в субстехиометрических количествах, или в сверхстехиометрических количествах. Обычно алкилирующий реагент VI к соединению I применяется, по меньшей мере, в эквимолярном количестве. Молярное отношение, при котором соединение I, гдеR1=водород, применяется относительно алкилирующего реагента VI, находится в диапазоне от 1:1 до 1:3,предпочтительно молярное отношение соединения I к алкилирующему реагенту VI находится в диапазоне от 1:1 до 1:1,3. Обычно алкилирование осуществляется в присутствии основания. Пригодными основаниями, в принципе, являются все соединения, которые допускают депротонирование атома азота лактама. Пригодными основаниями являются, например, основания, упомянутые в связи с приготовлением соединения I путем взаимодействия соединений II с III. Основания предпочтительно выбирают из гидроксидов щелочных и щелочно-земельных металлов, таких как гидроксид натрия, гидроксид калия и гидроксид лития, оксидов щелочных и щелочно-земельных металлов, таких как оксид кальция, карбонатов щелочных и щелочно-земельных металлов, таких как карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, карбонат магния, карбонат кальция, карбонат цинка или карбонат бария. В особенно предпочтительном варианте осуществления способа в соответствии с настоящим изобретением в качестве основания применяют гидроксид натрия или карбонат калия. Основание может применяться в субстехиометрическом, сверхстехиометрическом или эквимолярном количестве к соединению I. Предпочтение отдается применению основания к соединению I, по меньшей мере, в эквимолярном количестве. Количество основания обычно составляет не более чем 1,3 к 1 моль соединения I. Реакцию соединения I, где R1=водород, с алкилирующим реагентом формулы VI полезно осуществлять в присутствии растворителя. В зависимости от диапазона температур, применяемых в случае данного превращения, в качестве растворителей применяют алифатические, циклоалифатические или ароматические углеводороды, такие как пентан, гексан, циклопентан, циклогексан, толуол, ксилол, хлорированные алифатические и ароматические углеводороды, такие как дихлорметан, трихлорметан, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан, хлорбензол, 1,2-, 1,3- или 1,4-дихлорбензол, хлортолуолы, дихлортолуолы, диалкиловые простые эфиры с открытой цепью, такие как диэтиловый эфир, ди-н-пропиловый эфир,ди-н-изопропиловый эфир, метил-трет-бутиловый эфир, циклические простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, анизол, гликолевые простые эфиры, такие как диметиловый эфир гликоля, ди-8 012035 этиловый эфир гликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтилгликоля, С 1-С 4 спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, кетоны, такие как ацетон, метилэтилкетон, метилизопропилкетон, метилизобутилкетон, бутанон, карбонаты, такие как диэтилкарбонат и этилкарбонат, N,N-диалкиламиды, такие как N,N-диметилформамид или N,N-диметилацетамид, Nалкиллактамы, такие как N-метилпирролидон, сульфоксиды такие как диметилсульфоксид, тетраалкилмочевины, такие как тетраметилмочевина, тетраэтилмочевина, тетрабутилмочевина, диметилэтиленмочевина, диметилпропиленмочевина, или смеси этих растворителей. Лучшими растворителями являютсяN,N-диметилформамид, N-метилпирролидон, ацетон, дихлорметан, тетрагидрофуран, толуол или смеси этих растворителей. Алкилирование соединения I можно предпочтительно осуществлять при температурах между -5 и 100C, предпочтительно при температурах между 0 и 80C и особенно при температурах между 20 и 50C. Время взаимодействия может быть определено специалистом в данной области техники известными, распространенными методами, такими как тонкослойная хроматография или ЖХВР. Соединение I, алкилирующий реагент VI и основание прибавляют отдельно, совместно или друг за другом. Предпочтительно, многостадийный способ получения соединений I, где R1 водород, также можно осуществлять в одном реакторе. При взаимодействии карбаматов формулы II с енаминами формулы III,где R1=водород, в присутствии избытка основания изначально образуется соль урацила, которую затем без отделения или очистки вводят в реакцию с алкилирующим реагентом формулы VI. Затем эта реакция проводится до завершения в определенном диапазоне температур. В другом варианте осуществления способа в соответствии с настоящим изобретением взаимодействие может также осуществляться в водной многофазной системе, предпочтительно в присутствии катализаторов межфазного переноса, таких как четвертичные аммониевые соли или соли фосфония. Пригодными четвертичными аммониевыми солями являются хлориды, бромиды, фториды или тетрафторбораты тетраалкил(С 1-С 18)аммония, такие как хлорид тетраэтиламмония, бромид тетрабутиламмония, йодид тетрабутиламмония, тетрафторборат тетрабутиламмония, хлориды, бромиды или фториды н-бензилтриалкил(С 1-С 18)аммония, такие как хлорид бензилтриэтиламмония, предпочтительно бромид тетрабутиламмония или йодид тетрабутиламмония. Пригодными солями фосфония являются, например, хлорид или бромид тетрафенилфосфония, хлорид или бромид тетраалкил(С 1-С 18)фосфония, такой как бромид тетрабутилфосфония. В общем, катализатор межфазного переноса относительно соединения формулы I, гдеR1=водород, применяется в количестве вплоть до 20 мол.%, предпочтительно между 1 и 15 мол.%, и в частности между 2 и 12 мол.%. Многофазная система включает водную фазу и по меньшей мере одну органическую жидкую фазу. К тому же могут также образовываться по ходу реакции и твердые фазы. Водная фаза предпочтительно представляет собой раствор гидроксидов или карбонатов щелочных или щелочно-земельных металлов в воде. В отношении пригодных гидроксидов или карбонатов щелочных или щелочно-земельных металлов, можно сослаться на изложенное выше. В частности, предпочтение отдается применению гидроксидов щелочных металлов или щелочно-земельных металлов, особенно гидроксида натрия. Пригодными растворителями для органической фазы являются предпочтительно алифатические, циклоалифатические или ароматические, необязательно галогенированные углеводороды, простые эфиры - циклические или с открытой цепью, или их смеси, можно сослаться на изложенное выше в отношении алифатических, циклоалифатических или ароматических, необязательно галогенированных углеводородов, простых эфиров циклических или с открытой цепью. В предпочтительном варианте осуществления способа в соответствии с настоящим изобретением многофазная система состоит из водного раствора гидроксида натрия в качестве водной фазы и толуола и тетрагидрофурана или дихлорметана и тетрагидрофурана в качестве органической фазы. Когда применяется многофазная система, можно, например, вначале загрузить соединение I в одном из вышеуказанных органических растворителей или смесях растворителей. Затем прибавляют водный раствор основания, алкилирующего реагента VI и катализатора межфазного переноса при перемешивании и реакцию доводят до завершения в определенном температурном диапазоне. Взаимодействие может осуществляться при нормальном давлении, пониженном давлении или при повышенном давлении, при необходимости под инертным газом, непрерывно или периодически. В частности, этим путем возможно приготовление 3-фенилурацилов формулы I.A.1Rb и Rd, каждый означает водород,реакцией соответствующих карбаматов формулы II.A.1X2 означает кислород,и последующим алкилированием получающегося таким образом 3-фенилурацила формулы I.A.1,где R1, Rb и Rd, каждый означает водород,алкилирующим реагентом формулы VIL4 означает указанные выше как предпочтительные,с получением 3-фенилурацилов формулы I.A.1,где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-С 8-циклоалкил, С 2-С 6-алкенил,С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил иL1 означает C1-С 6-алкокси, в частности С 1-С 4-алкокси, особенно предпочтительно метокси или этокси;R =водород, в которых заместители R1, R2, R3, Ra, Rc и также R4 и R5, каждый отдельно или в комбинации друг с другом, определены ниже:R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2 С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил, особенно предпочтительно С 1-С 4-алкил, более предпочтительно метил или этил, в частности метил;R3 означает водород или С 1-С 4-алкил, более предпочтительно водород;Ra означает водород или галоген, в частности водород, фтор, хлор, особенно предпочтительно водород, хлор, чрезвычайно предпочтительно водород;Rc означает водород или галоген, в частности водород, фтор или хлор, особенно предпочтительно водород или фтор, исключительно предпочтительно фтор;R4 и R5, каждый независимо означает водород или C1-С 6-алкил; в частностиR4 означает водород или C1-С 6-алкил, более предпочтительно С 1-С 4-алкил, исключительно предпочтительно метил иR5 означает С 1-С 6-алкил, более предпочтительно С 1-С 4-алкил. Карбаматы формулы II, необходимые для приготовления 3-фенилурацилов формулы I, можно получить путем взаимодействия амина формулы IV с соединением формулы V Заместители X1, X3, Ar, А и L1 имеют приведенные выше значения, и в частности значения, указанные в описании в качестве предпочтительных.L3 означает хлор или C1-С 6-алкокси; более предпочтительно хлор. Амины формулы IV вводят в реакцию с соединения формулы V обычно при температуре от -10 до 160C, предпочтительно от 0 до 130C, особенно предпочтительно от 25 до 130C, в инертном органическом растворителе, при необходимости в присутствии основания (например, Houben-Weyl, Methoden derorganischen Chemie, Е 5, 1985, р. 972-980, и также VIII, р. 655 и XI Part 2, р. 10). Реакционное давление особенно не влияет на возможность осуществления способа в соответствии с настоящим изобретением и может, например, находиться в диапазоне от 500 мбар до 10 бар. Предпочтительно реакцию проводят при давлении, близком к обычному, то есть в диапазоне от 0,9 до 1,2 бар. Время, необходимое для осуществления реакции, находится обычно в диапазоне от 1 до 24 ч, и в частности в диапазоне от 2 до 8 ч. Реакция, в принципе, может проводиться "в веществе". Впрочем, предпочтение отдается взаимодействию аминов формулы IV с соединениями формулы V в органическом растворителе. Пригодными, в принципе, являются все растворители, которые способны растворять соединения IV и V, по крайней мере, частично и предпочтительно полностью при реакционных условиях. Пригодными растворителями являются алифатические углеводороды, такие как пентан, гексан,циклогексан и смеси С 5-С 8-алканов, ароматические углеводороды, такие как толуол, о-, м- и п-ксилол,галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол, простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран, сложные эфиры карбоновых кислот, такие как бутилацетат, более предпочтительно галогенированные углеводороды и простые эфиры. Также возможно применение смеси указанных растворителей. Взаимодействие аминов формулы IV с соединениями формулы V может быть проведено в присутствии основания, но применение основания не является неизбежным. Пригодными основаниями являются обычно неорганические соединения, такие как гидроксиды щелочных и щелочно-земельных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид кальция, амиды щелочных металлов, такие как амид лития, амид натрия и амид калия,карбонаты щелочных и щелочно-земельных металлов, такие как карбонат лития, калия карбонат и карбонат кальция, и также бикарбонаты щелочных металлов, такие как бикарбонат натрия, и также алкоксиды щелочных и щелочно-земельных металлов, такие как метоксид натрия, этоксид натрия, этоксид калия, трет-бутоксид калия, трет-пентоксид калия и диметоксимагний, и также органические основания,например третичные амины, такие как триметиламин, триэтиламин, диизопропилэтиламин, N-метилпиперидин и N-метилморфолин, пиридин, замещенные пиридины, такие как пиколин, коллидин, лутидин и 4-диметиламинопиридин, и также бициклические амины. Особенное предпочтение отдается органическим основаниям, таким как триэтиламин, пиридин и пиколин. Основания обычно применяются в эквимолярных количествах, но они также могут применяться в каталитических количествах, в избытке или, при необходимости, в качестве растворителя. В предпочтительном варианте осуществления способа в соответствии с настоящим изобретением амины формулы IV вводят в реакцию с соединения формулы V в отсутствие основания. Преимущество этого предпочтительного варианта реакции состоит в отсутствии необходимости сложной обработки после окончания реакции и дальнейшей реакции карбаматов II, приготовленных та- 11012035 ким образом, с получением 3-фенилурацилов I, предпочтительно 3-фенилурацилов I.A.1, в этом случае вышеуказанное хлорирование карбамата II также может осуществляться, при необходимости, в одном реакторе или требовать только одной замены растворителя. Реагенты обычно вводят в реакцию друг с другом в эквимолярных количествах. Может быть полезным применение V в избытке к IV. Предпочтение отдается применению соединений в молярном отношении IV:V в диапазоне от 1,6:1 до 1:1,6, в частности от 1:1,4 до 1:1. Предпочтение отдается удалению соединений L3-H, образующихся при реакции аминов формулыIV с соединениями формулы V, из реакционной смеси во время реакции в пределах по меньшей мере 80% особенно когда соединение L3-H представляет собой С 1-С 4-алканол, такой как метанол или этанол. При необходимости, для возмещения количества растворителя его свежая порция может быть введена в смесь или растворитель, отогнанный совместно с соединением L3-H, может быть использован в реакции повторно после необязательного дистилляционного извлечения соединения L3-H. В этом смысле, полезно, когда применяемый растворитель имеет температуру кипения по меньшей мере на 10C, в частности по меньшей мере на 30C, выше температуры кипения соединения L3-H, образующегося в реакции (при атмосферном давлении). Соответственно, взаимодействие аминов формулы IV с соединениями формулы V проводится в аппаратах, которые оснащены по меньшей мере одним дистилляционным или ректификационным аппаратом, например дистилляционной колонной, которая, во-первых, позволяет отгонять соединение L3-H, при необходимости, вместе с растворителем и одновременно позволяет удалять и повторно использовать какой-либо растворитель, отогнанный вместе с соединением L3-H. Для осуществления взаимодействия амины формулы IV можно ввести в контакт с соединениями формулы V и, при необходимости, основанием любым способом, то есть реагенты и, при необходимости,основание могут вводиться в реакционный сосуд отдельно, совместно или друг за другом и вводиться в реакцию. Например, амины IV и соединения V могут быть изначально загружены в реакционный сосуд,при необходимости, с требуемым растворителем и затем могут быть установлены желаемые реакционные условия. Впрочем, также возможно введение в реакционный сосуд большей части или всего количества амина IV и соединения V, при необходимости, в растворителе при реакционных условиях. В особенно предпочтительном варианте сначала загружают амин IV и затем, при необходимости,основание и, соответственно, добавляют соединение V. В особенно предпочтительном варианте изобретения сначала загружают большую часть, в частности по меньшей мере 80%, и более предпочтительно все количество или, практически, все количество(95%) аминов формулы IV и большую часть, в частности по меньшей мере 80%, и более предпочтительно все количество или, практически, все количество (95%) соединения формулы V добавляют туда же при реакционных условиях по ходу реакции, например, на протяжении от 0,5 до 20 ч, и в частности от 1 до 10 ч. Для этого соединения формулы V предпочтительно растворяют в растворителе. При необходимости, после добавления соединений формулы V определенное время, например от 1 до 10 ч, в частности от 2 до 5 ч, отводят для завершения взаимодействия. Карбаматы формулы II могут быть обработаны и выделены известными способами. В частности, этим путем возможно приготовление карбаматов формулы II.А.1 где Rb и Rd, каждый означает водород,реакцией соответствующих аминов формулы IV.А.1L3 означает хлор или С 1-С 6-алкокси, более предпочтительно хлор. Предпочтение отдается приготовлению, в частности, тех карбаматов формулы II.А.1, где Rb иL1 означает C1-С 6-алкокси, в частности С 1-С 4-алкокси, особенно предпочтительно метокси или этокси;Rc означает водород или галоген, в частности водород, фтор или хлор, особенно предпочтительно водород или фтор, исключительно предпочтительно фтор;R4 и R5, каждый независимо означает водород или C1-С 6-алкил;R4 означает водород или C1-С 6-алкил иR5 означает C1-С 6-алкил, более предпочтительно С 1-С 4-алкил. Амины формулы IV, необходимые для приготовления карбаматов формулы II, описаны в литературе (например, WO 04/039768) или могут быть приготовлены в соответствии с цитированной литературой. Соединения формулы V, необходимые для приготовления карбаматов формулы II, описаны в литературе (например, Houben-Weyl, Methoden der organischen Chemie, E4, 1983, р. 6-17) и могут быть приобретены или приготовлены в соответствии с цитированной литературой. Карбаматы формулы II, приготовленные этим путем, затем, если необходимо, можно галогенировать по Ar радикалу на промежуточной стадии перед реакцией с енаминами формулы III. Карбаматы формулы II, приготовленные этим путем, предпочтительно можно хлорировать или бромировать, особенно предпочтительно хлорировать, по Ar радикалу на дополнительной стадии. Галогенирование осуществляется обычно при температуре от 0 до 100C, предпочтительно от 20 до 70C, в инертном органическом растворителе, при необходимости, в присутствии катализатора (например, Buehler, Peason, Survey of Organic Synthesis, Interscience Publishers 1970, p. 392-404). Реакционное давление особенно не влияет на возможность осуществления способа в соответствии с настоящим изобретением и может, например, находиться в диапазоне от 500 мбар до 10 бар. Предпочтительно реакцию проводят при давлении, близком к обычному, то есть в диапазоне от 0,9 до 1,2 бар. Время, необходимое для осуществления реакции, находится обычно в диапазоне от 1 до 24 ч, и в частности в диапазоне от 3 до 12 ч. Реакция, в принципе, может проводиться "в веществе". Впрочем, предпочтение отдается взаимодействию карбаматов формулы V с галогенирующим реагентом в органическом растворителе. Пригодными, в принципе, являются все растворители, которые способны растворять соединение V, по крайней мере, частично и предпочтительно полностью при реакционных условиях. Пригодными растворителями являются алифатические углеводороды, такие как пентан, гексан,циклогексан и смеси С 5-С 8-алканов, галогенированные углеводороды, такие как метиленхлорид, хлороформ, бутилхлорид и хлорбензол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир,трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и трет-бутилметилкетон, карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, сложные эфиры, такие как бутилацетат или диметилкарбонат, и также сульфурилхлорид, более предпочтительно галогенированные углеводороды и сульфурилхлорид. Также возможно применение смеси указанных растворителей. Галогенирующие реагенты, необходимые для галогенирования, описаны в литературе (например,Buehler, Peason, Survey of Organic Synthesis, Interscience Publishers 1970, p. 392-404) или могут быть приготовлены в соответствии с цитированной литературой. Примерами нашедших применение галогенирующих реагентов являются хлор, N-хлорсукцинимид,SO2Cl2, HCl/H2O2, 1,3-дихлор-5,5-диметилгидантоин, бром, N-бромсукцинимид, HBr/Н 2 О 2 или 1,3-дибром-5,5-диметилгидантоин. Галогенирование карбаматов формулы II, в зависимости от выбранного галогенирующего реагента,может проводиться в присутствии катализатора. Примерами нашедших применение катализаторов явля- 13012035 ются Льюисовские кислоты, такие как трифторид бора, трихлорид алюминия, хлорид железа(III), хлорид олова(IV), хлорид титана(IV) и хлорид цинка(II). Галогенирующий реагент обычно применяется в эквимолярном количестве, но он также может применяться в недостатке, в избытке или, при необходимости, в качестве растворителя. Галогенированые карбаматы формулы II могут быть обработаны и выделены известным способом. Может быть полезной частичная или полная очистка от побочный продуктов, образующихся при реакции из галогенирующего реагента, путем прибавления пригодного основания. В частности, возможно приготовление этим путем парахлорированных карбаматов формулы II.А.1,где Ra=хлор и Rb и Rd=водород,хлорированием соответствующих карбаматов формулы II.A.1 где Ra, Rb и Rd=водород Предпочтение отдается хлорированию особенно тех карбаматов формулы II.А.1, где Ra, Rb иL1 означает C1-С 6-алкокси, в частности С 1-С 4-алкокси, особенно предпочтительно метокси или этокси;Rc означает водород или галоген, в частности водород, фтор или хлор, особенно предпочтительно водород или фтор, исключительно предпочтительно фтор;R4 и R5, каждый независимо означает водород или C1-С 6-алкил, в частностиR4 означает водород или C1-С 6-алкил, более предпочтительно С 1-С 4-алкил, исключительно предпочтительно метил; иR5 означает C1-С 6-алкил, более предпочтительно С 1-С 4-алкил. Взаимодействие описанных тут аминов формулы IV с соединениями формулы V приводит к карбаматам формулы II с высоким выходом. Далее, предпочтительный вариант, следовательно, касается способа, в котором амины формулы IV вводят в реакцию на первой стадии с соединениями формулы V с получением карбаматов формулы II и карбаматы формулы II затем без выделения вводят в реакцию с енаминами формулы III с получением 3 фенилурацилов формулы I. Причем может быть полезным удаление и замещение другим растворителем части или всего растворителя, применяемого для приготовления карбамата формулы II. Впрочем, реакция карбаматов формулы II с енаминами формулы III, в частности, осуществима и в растворителе, применяемом при приготовление карбамата формулы II. Следующие стадии способа в соответствии с настоящим изобретением определены как особенно предпочтительные, преимущество имеет как каждая отдельная стадия, так и способ в целом. Предпочтительные варианты следующих стадий определены выше. В соответствии с одним вариантом осуществления способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4 цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3 С 6-галоалкинил и Rb и Rd, каждый означает водород, путем взаимодействия соответствующих карбаматов формулы II.A.1, где Ra означает хлор и Rb и Rd, каждый означает водород, с енаминами формулы III,где R1 означает водород и X2 означает кислород, и затем алкилирования таким образом получающегося 3-фенилурацила формулы I.A.1, где Ra означает хлор и R1, Rb и Rd, каждый означает водород, алкилирующим реагентом формулы VI, где R1 означает C1-С 6-алкил, C1-C4-цианоалкил, C1-С 6-галоалкил, С 3-С 8 циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и L4 означает галоген,С 1-С 6-алкилсульфат и сульфат, с получением 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd, каждый означает водород. Согласно другому варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, С 1-С 6-галоалкил, С 3-С 8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем взаимодействия соответствующих карбаматов формулы II.A.1, где Ra означает хлор и Rb и Rd, каждый означает водород, с енаминами формулы III, где R1 означает C1-С 6-алкил, C1-C4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и X2 означает кислород.- 14012035 Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, C1-C4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем хлорирования карбаматов формулы II.А.1, где Ra, Rb и Rd=водород, с получением парахлорированных карбаматов формулы ILA.1, где Ra=хлор и Rb и Rd=водород, затем взаимодействия их с енаминами формулы III, где R1 означает водород и X2 означает кислород, и затем алкилирования 3-фенилурацила формулы I.A.1, образующегося таким образом, где Ra означает хлор и R1, Rb и Rd, каждый означает водород, алкилирующим реагентом формулы VI, где R1 означает C1-С 6-алкил, C1C4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил,С 3-С 6-галоалкинил и L4 означает галоген, С 1-С 6-алкилсульфат и сульфат, с получением 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2 С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd, каждый означает водород. Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем хлорирования карбаматов формулы II.А.1, где Ra, Rb и Rd=водород, с получением парахлорированных карбаматов формулы II.A.1, где Ra=хлор и Rb и Rd=водород, и затем взаимодействия их с енаминами формулы III, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и X2 означает кислород. Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем взаимодействия соответствующих аминов формулы IV.A.1, где Ra, Rb иRd, каждый означает водород, с соединением V, где X1 означает кислород, затем хлорирования полученных таким образом карбаматов формулы II.A.1, где Ra, Rb и Rd=водород, с получением парахлорированных карбаматов формулы II.A.1, где Ra=хлор и Rb и Rd=водород, и затем взаимодействия их с енаминами формулы III, где R1 означает водород и X2 означает кислород, и затем алкилирования 3-фенилурацилов формулы I.A.1, получающихся таким образом, где Ra означает хлор и R1, Rb и Rd, каждый означает водород, алкилирующим реагентом формулы VI, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, C2-C6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и L4 означает галоген, C1-С 6-алкилсульфат и сульфат, с получением 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2-С 1-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd, каждый означает водород. Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, C2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем взаимодействия соответствующих аминов формулы IV.А.1, где Ra, Rb иRd, каждый означает водород, с соединением V, где X1 означает кислород, затем хлорирования получающихся таким образом карбаматов формулы II.A.1, где Ra, Rb и Rd=водород, с получением парахлорированных карбаматов формулы II.A.1, где Ra=хлор и Rb и Rd=водород, и затем взаимодействия их с енаминами формулы III, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил,С 2-С 6-алкенил, C2-C6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и X2 означает кислород. Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-С 8-циклоалкил, C2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем взаимодействия соответствующих аминов формулы IV.A.1, где Ra=хлор и Rb и Rd, каждый означает водород, с соединением V, где X1 означает кислород, затем взаимодействия карбаматов формулы II.A.1, получающихся таким образом, где Ra=хлор и Rb и Rd=водород, с енаминами формулы III, где R1 означает водород и X2 означает кислород, и затем алкилирования получающегося таким образом 3-фенилурацила формулы I.A.1, где Ra означает хлор и R1, Rb и Rd, каждый означает водород, алкилирующим реагентом формулы VI, где R1 означает C1-С 6-алкил, C1-C4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и L4 означает галоген, С 1-С 6-алкилсульфат и сульфат, с получением 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd, каждый означает водород. Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и Rb и Rd,каждый означает водород, путем взаимодействия соответствующих аминов формулы IV.A.1, где Ra=хлор и Rb и Rd, каждый означает водород, с соединением V, где X1 означает кислород, и затем взаимодействия карбаматов формулы II.A.1, получающихся таким образом, где Ra=хлор и Rb и Rd=водород, с енаминами- 15012035 формулы III, где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6 алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил, С 3-С 6-галоалкинил и X2 означает кислород. Согласно следующему варианту способа в соответствии с настоящим изобретением возможно приготовление 3-фенилурацилов формулы I.A.1, где R1, Rb и Rd, каждый означает водород, путем взаимодействия соответствующих аминов формулы IV.A.1, где Ra=хлор и Rb и Rd, каждый означает водород, с соединением V, где X означает кислород, и затем взаимодействия полученных карбаматов формулыII.A.1, где Ra означает хлор и Rb и Rd, каждый означает водород, с енаминами формулы III, где R1 означает водород. Способ в соответствии с настоящим изобретением впервые предусматривает приготовление карбаматов формулы IIL1 означает C1-С 6-алкокси. Указанные соединения являются новыми и также представляют часть объекта настоящего изобретения. Из числа карбаматов формулы II предпочтение отдают имеющим структурную формулу II.А(=карбаматы формулы II, где X1 и X3, каждый означает кислород и Ar означает Ar-1) где заместители Ra, Rb, Rc и Rd и также А и L1 имеют значения, приведенные выше. Особое предпочтение отдается карбаматам формулы II.А.1 (=карбаматы формулы II, где X1 и X3,каждый означает кислород, Ar означает Ar-1 и А означает NR4R5) где заместители Ra, Rb, Rc и Rd и также R4, R5 и L1 имеют значения, приведенные выше. Из числа карбаматов формулы II.А.1 предпочтение отдают, в частности, тем, в которых заместителиL1, Ra, Rb, Rc и Rd и также R4 и R5, каждый отдельно или в комбинации, определены ниже:L1 означает C1-С 6-алкокси, в частности С 1-С 4-алкокси, особенно предпочтительно метокси или этокси;Ra означает водород или галоген, в частности водород, фтор, хлор, исключительно предпочтительно водород или хлор;Rc - водород или галоген, в частности водород, фтор, или хлор, особенно предпочтительно водород или фтор, исключительно предпочтительно фтор;R4 и R5, каждый независимо означает водород или C1-С 6-алкил, в частностиR4 означает водород или C1-С 6-алкил, более предпочтительно C1-C4-алкил, исключительно предпочтительно метил; иR5 означает C1-С 6-алкил, более предпочтительно С 1-С 4-алкил. Особое предпочтение отдают карбаматам формулы II.А.1.а (соответствуют карбаматам формулы II,где L1=метокси, X1, X3=кислород, Ar=Ar-1, где Rb и Rd=водород, и Rc=фтор, и А=NR4R5), особенно карбаматам формул II.A.1.a.1 II.A.1.a.60, представленным в табл. 1, значения заместителей Ra, R4 и R5 играют ту или иную роль для соединений согласно изобретению не только в комбинации друг с другом, но и в каждом случае отдельно. Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.b, особенно соединения формул II.A.1.b.1-II.A.1.b.48, которые отличаются от соответствующих соединений формул Одинаково исключительно предпочтительными являются карбаматы формулы II.А.1.с, особенно соединения формул II.A.1.c.1-II.A.1.c.48, которые отличаются от соответствующих соединений формул Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.d, особенно соединения формул II.A.1.d.1-II.А.1.d.48, которые отличаются от соответствующих соединений формул Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.e, особенно соединения формул II.A.1.e.1-II.A.1.e.48, которые отличаются от соответствующих соединений формул Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.f, особенно соединения формул II.A.1.f.1-II.A.1.f.48, которые отличаются от соответствующих соединений формул Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.g, особенно соединения формул II.A.1.g.1-II.A.1.g.48, которые отличаются от соответствующих соединений формулы Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.h, особенно соединения формул II.A.1.h.1-II.A.1.h.48, которые отличаются от соответствующих соединений формулы Одинаково исключительно предпочтительными являются карбаматы формулы II.A.1.i, особенно соединения формул II.A.1.i.1-II.A.1.i.48, которые отличаются от соответствующих соединений формул Примеры синтезов Следующие примеры служат иллюстрацией изобретения. 1. Приготовление карбаматов формулы II. Пример 1.1. N-4-Фтор-3-[(этоксикарбонил)амино]бензоил-N'-изопропил-N'-метилсульфамид (соединение II.A.1.b.13).- 18012035 Пример 1.1.а. 14,13 г (0,179 моль) пиридина прибавляли по каплям при комнатной температуре к раствору 41,0 г(0,138 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида в метиленхлориде и смесь затем охлаждали до 0-5C. При этой температуре прибавляли частями 19,83 г (0,183 моль) этилхлорформиата в метиленхлориде и смесь затем перемешивали в течение 60 мин. Реакционную смесь гидролизировали и отделенную органическую фазу экстрагировали Н 2 О и 10% соляной кислоты. Затем органическую фазу промывали, сушили и удаляли растворитель. Было получено 47,9 г (96% от теории) указанного в заглавии соединения (т.пл.: 142-144C). 1H ЯМР (500 МГц, d-ДМСО):[м.д.] 11,9 (s, 1H), 9,50 (s, 1H), 8,30 (d, 1H), 7,65-7,70 (m, 1H), 7,35 (t,1H), 4,10-4,25 (m, 3H), 2,90 (s, 3H), 1,28 (t, 3H), 1,10 (d, 6H). Аналогично примеру 1.1.а были проведены следующие примеры 1.1.b-1.1.е. Пример 1.1.b. 6,10 г (0,020 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида. 3,87 г (0,041 моль) пиколина. 2,97 г (0,027 моль) этилхлорформиата. Было получено 6,1 г (95% от теории) указанного в заглавии соединения. Пример 1.1.с. 6,00 г (0,020 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида. 2,47 г (0,062 моль) NaOH. 2,97 г (0,027 моль) этилхлорформиата. Было получено 6,4 г (95% от теории) указанного в заглавии соединения. Пример 1.1.d. 6,00 г (0,020 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида. 3,72 г (0,027 моль) K2CO3. 3,00 г (0,027 моль) этилхлорформиата. Было получено 6,0 г (76% от теории) указанного в заглавии соединения. Пример 1.1.е. 5,90 г (0,020 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида. 2,47 г (0,062 моль) триэтиламина. 0,24 г (0,062 моль) диметиламинопиридина (DMAP). 2,89 г (0,027 моль) этилхлорформиата. Было получено 6,1 г (52% от теории) указанного в заглавии соединения. Пример 1.1.f. 134,7 г (1,22 моль) этилхлорформиата прибавляли частями при 115-125 С к раствору 300,0 г (0,897 моль)N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида в хлорбензоле и смесь затем перемешивали при 125C в течение 2 ч. Затем удаляли растворитель и избыток этилхлорформиата. Было получено 312,8 г (96% от теории) указанного в заглавии соединения. Пример 1.2. N-6-Хлор-4-фтор-3-[(этоксикарбонил)амино]бензоил)-N'-изопропил-N'-метилсульфамид 57,7 г (0,729 моль) пиридина прибавляли по каплям при комнатной температуре к раствору 200,0 г(0,565 моль) N-(6-хлор-4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида в метиленхлориде и смесь затем охлаждали до 0-5C. Затем прибавляли частями 80,99 г (0,746 моль) этилхлорформиата в метиленхлориде и смесь взбалтывали на протяжении 60 мин. Реакционную смесь затем гидролизировали и отделенную органическую фазу экстрагировали H2O и 10% соляной кислоты. Затем органическую фазу промывали, сушили и удаляли растворитель. Было получено 156,4 г (86% от теории) указанного в заглавии соединения. 1 5,52 г (0,057 моль) метилхлорформиата прибавляли частями при 115-125 С к раствору 12,50 г (0,042 моль)N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида в хлорбензоле и смесь затем перемешивали при 125 С на протяжении 2 ч. Растворитель и избыток метилхлорформиата затем удаляли. Было получено 14,9 г (99% от теории) указанного в заглавии соединения. 1 6,69 г (0,057 моль) фенилхлорформиата прибавляли частями при 115-125C к раствору 12,50 г(0,042 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида в хлорбензоле и смесь затем перемешивали при 125 С на протяжении 2 ч. Растворитель и избыток фенилхлорформиата затем удаляли. Было получено 17,7 г (98% от теории) указанного в заглавии соединения. 1 7,36 г (0,053 моль) н-бутилхлорформиата прибавляли частями при 115-125 С к раствору 12,50 г(0,042 моль) N-(4-фтор-3-аминобензоил)-N'-изопропил-N'-метилсульфамида в хлорбензоле и смесь затем перемешивали при 125 С на протяжении 2 ч. Растворитель и избыток н-бутилхлорформиата затем удаляли. Было получено 18,0 г (93% от теории) указанного в заглавии соединения. 1 83 г 1M раствора изопропилхлорформиата в толуоле (соответствует 0,097 моль изопропилхлорформиата) прибавляли частями при 115-125 С к раствору 12,50 г (0,042 моль) N-(4-фтор-3-аминобензоил)N'-изопропил-N'-метилсульфамида в толуоле и затем смесь перемешивали при 125 С на протяжении 2 ч. Растворитель и избыток изопропилхлорформиата затем удаляли. Было получено 16,1 г (97% от теории) указанного в заглавии соединения. 1H ЯМР (500 МГц, CDCl3):9,10 (s, 1H), 8,55 (d, 1H), 7,55-7,60 (m, 1H), 7,10 (t, 1H), 6,90 (s, 1H),4,95-5,10 (m, 1H), 4,20-4,30 (m, 1H), 2,95 (s, 3H), 1,35 (d, 6H), 1,18 м.д. (d, 6H). 2. Приготовление хлорированных карбаматов формулы II. Пример 2.1. N-2-Хлор-4-фтор-5-[(этоксикарбонил)амино]бензоил-N'-изопропил-N'-метилсульфамид Пример 2.1.a. 150 г (0,407 моль) N-(3-[(этоксикарбонил)амино]-4-фторбензоил)-N'-изопропил-N'-метилсульфамида,суспендированного в хлорбензоле, концентрировали в реакционном сосуде при пониженном давлении(внутренняя температура 100C). Затем сбрасывали вакуум и суспензию охлаждали до 65 С. Затем 760 г(5,517 моль) сульфурилхлорида прибавляли частями, при этом температура поддерживалась на уровне 50C. Затем смесь перемешивали на протяжении следующих 16 ч. Избыток сульфурилхлорида затем удаляли путем дистилляции. Остаток перегонки смешивали с хлорбензолом и водой и охлаждали до комнатной температуры и значение рН получившейся таким образом суспензии устанавливали на 5, применяя 2 Н раствор гидроксида натрия. Затем продукт отфильтровывали, промывали и сушили. Было получено 126,5 г (75% от теории) указанного в заглавии соединения (т.пл.: 98-100C).- 20012035 Пример 2.1.b. 40 г (0,11 моль) N-3-[(этоксикарбонил)амино]-4-фторбензоил-N'-изопропил-N'-метилсульфамида добавляли к 179,3 г (1,33 моль) сульфурилхлорида и перемешивали при 40C на протяжении 10 ч. Избыток сульфурилхлорида и хлорбензола затем удаляли путем дистилляции. Остаток смешивали при 75 С при перемешивании сначала с толуолом, затем с водой. При температуре 80-85 С значение рН устанавливали на 4 посредством 2 Н раствора гидроксида натрия и смесь охлаждали до 20C при перемешивании. Осажденный продукт отфильтровывали, промывали и сушили. Было получено 33 г (71% от теории) указанного в заглавии соединения (т.пл.: 98-100C). Пример 2.2. N-2-Хлор-4-фтор-5-[(метоксикарбонил)амино]бензоил-N'-изопропил-N'-метилсульфамид 40 г (0,112 моль) N-(3-[(метоксикарбонил)амино]-4-фторбензоил-N'-изопропил-N'-метилсульфамида,суспендированного в хлорбензоле, концентрировали в реакционном сосуде при пониженном давлении. Вакуум затем сбрасывали и суспензию охлаждали до 65C. Затем прибавляли частями 197 г (1,430 моль) сульфурилхлорида, при этом температуру поддерживали на уровне 50C. Затем смесь перемешивали на протяжении последующих 16 ч. Избыток сульфурилхлорида удаляли путем дистилляции. Остаток перегонки смешивали с хлорбензолом и водой, охлаждали до комнатной температуры и значение рН получившейся таким образом суспензии устанавливали на 5, применяя 2 Н раствор гидроксида натрия. Затем продукт отфильтровывали, промывали и сушили. Было получено 14,6 г (34% от теории) указанного в заглавии соединения. 1 Н ЯМР (500 МГц, d-ДМСО):11,1 (s, 1H), 9,80 (s, 1H), 7,90-7,95 (m, 1H), 7,60-7,70 (m, 1H), 4,254,30 (m, 1H), 3,80 (s, 3H), 2,85 (s, 3H), 1,15 (d, 6H). 3. Приготовление фенил(тио)урацилов и -дитиоурацилов формулы I. Пример 3.1. 2-Хлор-5-[3,6-дигидро-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-4-фтор-N[метил(1-метилэтил)амино]сульфонилбензамид. Пример 3.1.а. 9,13 г (0,049 моль) этил-3-амино-4,4,4-трифтор-2-бутеноата сначала загружали в ДМФ при комнатной температуре. Прибавляли 12,84 г (0,059 моль) раствора метоксида калия (32% в метаноле) и смесь взбалтывали в течение следующих 30 мин. Затем прибавляли 20 г (0,049 моль) N-(2-хлор-4-фтор-5[(этоксикарбонил)амино]бензоил)-N'-изопропил-N'-метилсульфамида. Реакционную смесь нагревали и достаточное количество спирта отгоняли до достижения 119 С. В то время, как отгоняли спирт, 11,75 г(0,054 моль) раствора метоксида калия (32% в метаноле) прибавляли частями на протяжении нескольких часов. Для обработки реакционную смесь прибавляли по каплям с охлаждением к разбавленной соляной кислоте, причем значение рН в конце прибавления имело значение 2. Осажденный продукт отфильтровывали, промывали и сушили. Было получено 22,5 г (92,7% от теории) указанного в заглавии соединения [т.пл.: 238 С (разложение)]. Пример 3.1.b. 1,2 г (6,8 ммоль) этил-3-амино-4,4,4-трифтор-2-бутеноата сначала загружали в ДМФ при комнатной температуре. Прибавляли 1,9 г (13,7 ммоль) карбоната калия и смесь взбалтывали при 50C на протяжении 1 ч. Затем прибавляли 2,4 г (5,7 ммоль) N-(2-хлор-4-фтор-5-[(этоксикарбонил)амино]бензоил)-N'изопропил-N'-метилсульфамида, температуру увеличивали до 120C и смесь перемешивали на протяжении следующих 4,5 ч. Для обработки реакционную смесь прибавляли по каплям с охлаждением к разбавленной соляной кислоте, причем значение рН в конце прибавления имело значение 2. Осажденный продукт отфильтровывали, промывали и сушили. Было получено 2,3 г (73% от теории) указанного в заглавии соединения. Пример 3.2. 2-Хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2 Н)пиримидинил]-4 фтор-N-метил-(1-метилэтил)амино]сульфонил]бензамид.- 21012035 1,14 г (9,04 ммоль) диметилсульфата и 0,283 г (2,055 ммоль) K2CO3 добавляли к 2,0 г (4,11 ммоль) 2-хлор-5-[3,6-дигидро-2,6-диоксо-4-(трифторметил)-1(2 Н)пиримидинил]-4-фтор-N-метил(1-метилэтил) амино]сульфонил]бензамида из примера 1 в 80 мл N,N-диметилформамида и смесь затем перемешивали при 25 С на протяжении 16 ч. Затем при 30C и пониженном давлении отгоняли N,N-диметилформамид и остаток извлекали приблизительно из 250 мл этилацетата. Реакционную смесь подкисляли 10% HCl и затем экстрагировали дважды водой. Органическую фазу сушили над MgSO4 и отгоняли растворитель,получая 1,95 г сырого продукта. В соответствии с 1H ЯМР и ЖХВР чистота продукта составляла 77%(соответствует выходу 73%). Для очистки 0,92 г этого сырого продукта хроматографировали на силикагеле (284,5 см колонка), используя смесь циклогексан/этилацетат в соотношении от 9/1 до 1/1, получая четыре фракции. Третья фракция (0,58 г; соответствует 59% выходу) содержит целевой продукт в очищенном виде. 1(s, 3H), 3,3 (s, 3H), 2,9 (s, 3H), 1,2 (d, 6H). Пример 3.3. 2-Хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2 Н)пиримидинил]-4-фторN-метил-(1-метилэтил)амино]сульфонил]бензамид. 12,45 г (0,024 моль) 2-хлор-5-[3,6-дигидро-2,6-диоксо-4-(трифторметил)-1(2 Н)пиримидинил]-4-фторN-метил(1-метилэтил)амино]сульфонил]бензамида (93,9% чистоты) из примера 1 прибавляли при 25 С к смеси растворителей, состоящей из 135 г толуола и 27 г тетрагидрофурана, и затем смесь смешивали с раствором 2,3 г (0,0288 моль) гидроксида натрия (50%) в 57,5 г воды. К реакционной смеси добавляли 0,77 г (0,0024 моль) бромида тетрабутиламмония и 3,69 г (0,0293 моль) диметилсульфата. Двухфазную реакционную смесь интенсивно перемешивали при 25 С на протяжении 23 ч. Водную фазу затем удаляли и органическую фазу промывали дважды, каждый раз по 100 мл, водой. Затем объединенную органическую фазу сушили, растворитель отгоняли при пониженном давлении, получая 13,8 г неочищенного продукта, который согласно количественной ЖХВР содержит 77,5% указанного в заглавии соединения(10,3 ммоль) NaOH в 375 мл воды. К реакционной смеси добавляли 0,38 г (1,03 ммоль) йодида тетрабутиламмония и 1,36 г (10,8 ммоль) диметилсульфата и двухфазную смесь перемешивали при скорости вращения мешалки 1000 об./мин на протяжении 14 ч. Водную фазу удаляли и органическую фазу выпаривали досуха при пониженном давлении. Очисткой посредством хроматографии на силикагеле, осуществляемой методом, описанным в примере 5, получали 4 фракции. Затем растворитель удаляли, первая фракция включала 0,54 г смеси, которая в соответствии с 1H ЯМР содержала 90% целевого продукта, и вторая фракция включала 2,4 г продукта, имеющего чистоту 95% (выход исходя из двух фракций: 56%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 3-фенилурацилов формулы I в которой заместители имеют приведенные ниже значения:R2 и R3, каждый независимо означает водород, C1-С 6-алкил, С 1-С 6-галоалкил, С 3-C8-циклоалкил, С 2 С 6-алкенил, С 2-С 6-галоалкенил, С 3-С 6-алкинил или С 3-С 6-галоалкинил;X1, X2 и X3, каждый независимо означает кислород;Ar означает фенил, который может быть частично или полностью галогенирован; и А означает NR4R5, где R4 и R5, каждый независимо означает водород или C1-С 6-алкил,- 22012035 который включает взаимодействие карбаматов формулы II где заместители X1, X3, Ar и А имеют значения приведенные выше; иL2 означает C1-С 6-алкокси, С 1-С 4-алкокси-С 2-С 4-алкокси, С 3-С 8-циклоалкилокси или бензилокси,в присутствии избытка основания, исходя из карбамата формулы II. 2. Способ получения 3-фенилурацилов формулы I в соответствии с п.1, где R1 означает водород или С 1-С 4-алкил. 3. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1 и 2, где R2 означает водород, С 1-С 4-алкил или С 1-С 4-галоалкил. 4. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1-3, где R3 означает водород или С 1-С 4-алкил. 5. Способ по пп.1-4, где Ar означает группу общей формулы Ar-1 гдеозначает место связывания Ar к С(Х 3) группе;означает место связывания Ar к непосредственно прилежащему атому азота; иRa и Rc, каждый независимо означает водород или галоген; иII получены путем взаимодействия аминов формулы IVL3 означает хлор или C1-С 6-алкокси. 8. Способ получения 3-фенилурацилов формулы I в соответствии с пп.1-7, где карбаматы формулыII на промежуточной стадии галогенируют по Ar радикалу галогенирующим реагентом. 9. Карбамат формулы IIR1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-C8-циклоалкил, С 2-С 6-алкенил, С 2 С 6-галоалкенил, С 3-С 6-алкинил или С 3-С 6-галоалкинил; и заместители R2, R3, X1, X2, X3, Ar и А имеют значения, указанные в пп.1-6,который включает взаимодействие карбаматов формулы IIL2 означает C1-С 6-алкокси, С 1-С 4-алкокси-С 2-С 4-алкокси, С 3-C8-циклоалкокси и бензилокси,и последующее взаимодействие получающихся 3-фенилурацила формулы I, где R1 означает водород, с алкилирующим реагентом формулы VI где R1 означает C1-С 6-алкил, С 1-С 4-цианоалкил, C1-С 6-галоалкил, С 3-С 8-циклоалкил, С 2-С 6-алкенил,С 2-С 6-галоалкенил, С 3-С 6-алкинил или С 3-С 6-галоалкинил; и
МПК / Метки
МПК: C07C 307/06, C07D 239/54
Метки: 3-фенилурацилов, получения, способ
Код ссылки
<a href="https://eas.patents.su/25-12035-sposob-polucheniya-3-feniluracilov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 3-фенилурацилов</a>
Предыдущий патент: Новый способ синтеза периндоприла и его фармацевтически приемлемых солей
Следующий патент: Мемантин для лечения расстройств поведения детского возраста
Случайный патент: Производные пиридазинона