Тиофен-и тиазолсульфонамиды в качестве противоопухолевых средств
Номер патента: 6081
Опубликовано: 25.08.2005
Авторы: Хипскинд Филип Артур, Лобб Карен Линн, Де Диос Альфонсо, Мэйдер Мэри Маргарет, Ших Чаун, Ричетт Майкл Энрико, Лопес Де Уральде Гармендиа Беатрис, Лин Хо-Шен, Лопес Хосе Эдуардо, Гроссмэн Кара Сью
Формула / Реферат
1. Соединение формулы I
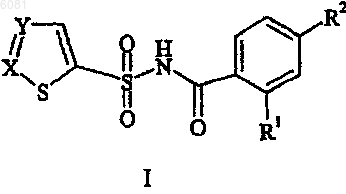
где -X=Y- представляет собой
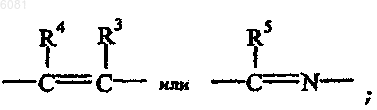
R1 выбран из группы, состоящей из галогена, C1-C6алкила и CF3;
R2 выбран из группы, состоящей из галогена, -NO2, C1-C6алкила и CF3;
R3 представляет собой водород, C1-C6алкил, C1-C4алкокси, C1-C6алкилтио или галоген;
R4 выбран из группы, состоящей из водорода, галогена, C1-C4алкокси, C1-C6алкила, -COO(C1-C6алкила), C1-C6алкила, необязательно замещенного C1-C4алкокси, циано, C1-C6алкилтио, CF3, S-фенила и пиридинила;
R5 представляет собой галоген, C1-C6алкил или C1-C4алкокси;
или его фармацевтически приемлемая основно-аддитивная соль.
2. Соединение по п.1, где R1 и R2 представляют собой независимо галоген или C1-C6алкил.
3. Соединение по любому из пп.1 или 2, где R1 и R2, оба, представляют собой хлор или бром или R1 представляет собой метил и R2 представляет собой хлор.
4. Соединение по любому из пп.1-3, где -X=Y- представляет собой

5. Соединение по п.4, где R3 выбран из H, хлора, брома, метила, метокси и метилтио.
6. Соединение по любому из пп.4 или 5, где R4 выбран из H, хлора, брома, метила, этила, пропила, метилтио, CH2OCH3, метокси, циано, S-фенила и пиридинила.
7. Соединение по п.1, которое представляет собой N-[2,4-дихлорбензоил]-5-бромтиофен-2-сульфонамид или его фармацевтически приемлемую основно-аддитивную соль.
8. Соединение по п.1, которое представляет собой N-[4-хлор-2-метилбензоил]-5-хлортиофен-2-сульфонамид или его основно-аддитивную соль.
9. Соединение по любому из пп.1-8, где фармацевтически приемлемая основно-аддитивная соль представляет собой натриевую соль.
10. Соединение по п.1, которое представляет собой натриевую соль N-[2,4-дихлорбензоил]-5-бромтиофен-2-сульфонамида.
11. Фармацевтическая композиция, содержащая соединение формулы I
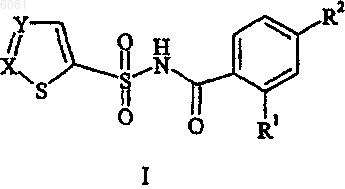
где -X=Y- представляет собой
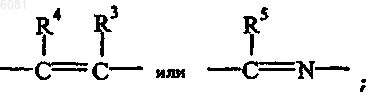
R1 выбран из группы, состоящей из галогена, C1-C6алкила и CF3;
R2 выбран из группы, состоящей из галогена, -NO2, C1-C6алкила и CF3;
R3 представляет собой водород, C1-C6алкил, C1-C4алкокси, C1-C6алкилтио или галоген;
R4 выбран из группы, состоящей из водорода, галогена, C1-C4алкокси, C1-C6алкила, -COO(C1-C6алкила), C1-C6алкила, необязательно замещенного C1-C4алкокси, циано, C1-C6алкилтио, CF3, S-фенила и пиридинила;
R5 представляет собой галоген, C1-C6алкил или C1-C4алкокси;
или его фармацевтически приемлемую основно-аддитивную соль в смеси с фармацевтически приемлемым носителем или эксципиентом.
12. Фармацевтическая композиция по п.11, содержащая N-[2,4-дихлорбензоил]-5-бромтиофен-2-сульфонамид или его фармацевтически приемлемую основно-аддитивную соль.
13. Фармацевтическая композиция по п.12, содержащая натриевую соль N-[2,4-дихлорбензоил]-5-бромтиофен-2-сульфонамида.
14. Применение соединения по любому из пп.1-10 в качестве фармацевтического средства.
15. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для использования при лечении чувствительных новообразований.
16. Применение по п.15, где чувствительное новообразование представляет собой опухоль толстой кишки или прямой кишки.
Текст
006081 За последние годы был достигнут существенный прогресс в развитии химических средств и схем лечения для борьбы с опухолевыми заболеваниями. Несмотря на такое продолжающееся продвижение вперед, злокачественные опухоли продолжают причинять людям невыносимую боль и страдания. Поскольку существует необходимость в новых и более совершенных методах лечения злокачественных опухолей и лейкозов, продолжаются попытки создания новых классов соединений, особенно в области неоперабельных или метастатических солидных опухолей. Огромный поток новой информации, относящейся к основным биологическим процессам, включенным в новообразования, приводит к более глубокому пониманию неоднородности опухолей. По причине такой сильной разнородности популяций опухолевых клеток новые химиотерапевтические средства должны обладать широким спектром активности и приемлемым терапевтическим индексом. Кроме того, такие средства должны быть химически устойчивыми и совместимыми с другими средствами. Также важно, чтобы любой химиотерапевтический курс,насколько это возможно, был удобным и безболезненным для пациента. Химиотерапия и радиационная терапия часто применяются для лечения рака и, хотя они часто вызывают некоторую ответную реакцию при злокачественном заболевании, они редко являются целительными. Большинство солидных опухолей увеличиваются в массе путем пролиферации злокачественных клеток и клеток, относящихся к строме, включая клетки эндотелия. Для того, чтобы опухоли вырасти более чем на 2-3 мм в диаметре, она должна образовать сосудистую сеть, процесс, известный как ангиогенез. Подавление ангиогенеза, вызванного опухолью, с помощью ангиостатина и эндостатина описано,как результат противоопухолевой активности (O'Reilly, et al., Cell, 88, 277-285 (1997. Поскольку ангиогенез является критическим компонентом увеличения массы большинства солидных опухолей, разработка новых средств для подавления этого процесса представляет собой перспективный подход к противоопухолевой терапии. При таком подходе к противоопухолевой терапии возможно отсутствие токсических побочных эффектов или свойств, вызывающих резистенцию к лекарственным средствам, что характерно для традиционной химиотерапии (Judah Folkman, Endogenous Ingibitors of Angiogenesis, The Harvey Lectures, Series 92, pages 65-82, Wiley-Liss Inc., (1998. Данное изобретение предлагает новые соединения N-[бензоил]гетероарилсульфонамида, полезные при лечении чувствительных новообразований. Данное изобретение представляет соединения формулы IR5 представляет собой галоген, C1-C6 алкил или C1-C4 алкокси; или их фармацевтически приемлемые основно-аддитивные соли. Данное изобретение также предлагает способ лечения чувствительных новообразований у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении, онколитически эффективного количества соединения формулы I или его фармацевтически приемлемой основноаддитивной соли. Данное изобретение также предлагает способ подавления ангиогенеза опухоли у млекопитающего,включающий введение млекопитающему, нуждающемуся в таком лечении, количества соединения формулы I, достаточного для подавления ангиогенеза, или его фармацевтически приемлемой основноаддитивной соли. Данное изобретение также предлагает фармацевтическую композицию, содержащую соединение формулы I или его фармацевтически приемлемую основно-аддитивную соль и один или несколько фармацевтически приемлемых эксципиентов. Данное изобретение также предлагает применение соединения формулы I для изготовления лекарственного средства для лечения чувствительных новообразований. Кроме того, данное изобретение предлагает фармацевтическую композицию для лечения чувствительных новообразований, содержащую соединение формулы I с фармацевтически приемлемым носителем или эксципиентом. Более того, данное-1 006081 изобретение включает способ лечения чувствительных новообразований, который заключается во введении эффективного количества соединения формулы I. Основные химические термины, используемые в приведенных выше формулах, имеют свои обычные значения. Например, термин C1-C6 алкил включает группы метил, этил, пропил, изопропил, бутил,изобутил, втор-бутил, трет-бутил, пентил и гексил. Термин C1-C4 лкил входит в значение C1-C6 алкила и может означать метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил. Термин C1C4 алкокси относится к C1-C4 алкильной группе, связанной с исходной молекулой через атом кислорода,и включает группы метокси, этокси, изопропокси и т.п. Термин галоген относится к хлору, брому,фтору или йоду. Термин млекопитающее означает любое из различных теплокровных позвоночных животных класса млекопитающих, наиболее предпочтительно людей, характеризующихся волосяным покровом кожи и, у женских особей, выработкой молока молочными железами для питания потомства. Несмотря на то, что все соединения формулы I являются полезными противоопухолевыми средствами, некоторые соединения являются предпочтительными. Следующие разделы описывают такие предпочтительные группыc) R1 представляет собой галоген или C1-C6 алкил;j) R2 представляет собой галоген или C1-C6 алкил;rr) R4 представляет собой СН 2 ОСН 3;ddd) R1 и R2 представляют собой хлор, бром, или R1 представляет собой метил и R2 представляет собой хлор;fff) R1 представляет собой метил и R2 представляет собой хлор; Должно быть понятно, что вышеприведенные группы можно объединять с образованием дополнительных предпочтительных групп. Соединения формулы I являются противоопухолевыми средствами. Таким образом, настоящее изобретение также предлагает способ лечения чувствительных новообразований у млекопитающего, который включает введение млекопитающему, нуждающемуся в таком лечении, онколитического количества соединения формулы I. Считают, что соединения настоящего изобретения являются полезными при лечения чувствительных новообразований, включая опухоли и карциномы, такие как опухоли центральной нервной системы: мультиформная глиобластома, астроцитома, олигодендроглиальные опухоли, эпендимальные опухоли и опухоли сосудистой оболочки, шишковидные опухоли, опухоли нервных клеток,медуллобластома, шваннома, менингиома, менингеальная саркома; глазные новообразования: базальноклеточная карцинома, сквамозноклеточная карцинома, меланома, рабдомиосаркома, ретинобластома; новообразования эндокринных желез: опухоли гипофиза, опухоли щитовидной железы, опухоли надпочечников, опухоли нейроэндокринной системы, опухоли гастроэнетеропанкреатической эндокринной системы, опухоли половых желез; опухоли головы и шеи: рак головы и шеи, полости рта, горла, глотки,одонтогенные опухоли; новообразования в области грудной клетки: крупноклеточная карцинома легких,мелкоклеточная карцинома легких, немелкоклеточная карцинома легких, злокачественная мезотелиома,тимомы, первичные опухоли зародышевых клеток грудной клетки; новообразования пищеварительного тракта: опухоли пищевода, опухоли желудка, опухоли печени, опухоли желчного пузыря, опухоли поджелудочной железы, опухоли тонкого кишечника, червеобразного отростка и брюшины, аденокарцинома толстой кишки и прямой кишки, анальные опухоли; новообразования мочеполовых путей: ренальноклеточная карцинома, опухоли почечных лоханок и мочеточников, опухоли мочевого пузыря, опухоли уретры, опухоли предстательной железы, опухоли полового члена, опухоли яичек; новообразования женских репродуктивных органов: опухоли вульвы и влагалища, опухоли шейки матки, аденокарцинома матки,рак яичников, саркомы женских половых органов; опухоли молочной железы; кожные новообразования: базальноклеточная карцинома, сквамозноклеточная карцинома, дерматофибромаркома, опухоль клетокMerkel; злокачественная меланома; новообразования костей и мягких тканей: остеогенная саркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Ewing, первичная нейроэктодермальная опухоль, ангиосаркома; новообразования гемопоэтической системы: миелодиспластические синдромы,острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфоцитарный лейкоз, HTLV-1 и Т-клеточный лейкоз/лимфома, хронический лимфоцитарный лейкоз, лейкоз волосистых клеток, заболевание Ходжкина, неходскинские лимфомы, лейкоз тучных клеток; и новообразования у детей: острый лимфобластный лейкоз, острые миелоцитарные лейкозы, нейробластома, опухоли костей, рабдомиосаркома, лимфомы, почечные опухоли. В частности, соединения настоящего изобретения, как полагают,являются полезными при лечении солидных опухолей, в частности, опухолей толстой и прямой кишки. Предпочтительно, когда млекопитающим, подлежащим лечению путем введения соединений формулы I,является человек. Соединения настоящего изобретения являются по природе кислотными и, следовательно, могут взаимодействовать с любым из большого количества неорганических и органических оснований, например аминами и четвертичными аммониевыми основаниями, с образованием фармацевтически приемлемых основно-аддитивных солей. Для удобства введения, когда требуются водные растворы соединений настоящего изобретения, предпочтительно превращение соединений формулы I в их фармацевтически-3 006081 приемлемые основно-аддитивные соли. Соединения формулы I могут взаимодействовать с основными веществами, такими как гидроксиды, карбонаты и бикарбонаты щелочных и щелочно-земельных металлов, включая, но, не ограничиваясь этим, гидроксид натрия, карбонат натрия, гидроксид калия, гидроксид кальция и гидроксид лития, с образованием фармацевтически приемлемых солей, таких как соответствующая соль натрия, калия, лития или кальция. Особенно предпочтительными являются соли натрия и калия. Примерами аминов, подходящих для образования солей, являются первичные, вторичные, третичные алифатические и ароматические амины, такие как метиламин, этиламин, пропиламин, изопропиламин, четыре изомерных бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, в частности, этил-, пропил-, диэтил- или триэтиламин, но особенно изопропиламин и диэтаноламин. Примерами четвертичных аммониевых оснований являются в основном катионы гидроксиаммониевых солей, например катион тетраметиламмония, катион триметилбензиламмония, катион триэтилбензиламмония, катион тетраэтиламмония или катион триметилэтиламмония, но также катион аммония. Специалисту в данной области должно быть понятно, что введение некоторых заместителей может создавать асимметрию в соединениях формулы I. Настоящее изобретение охватывает все энантиомеры и смеси энантиомеров, включая рацематы. Предпочтительно, когда соединения настоящего изобретения,содержащие хиральные центры, представляют собой отдельные энантиомеры. Настоящее изобретение,кроме того, охватывает все диастереомеры. Соединения настоящего изобретения могут быть получены различными путями, некоторые из них продемонстрированы на схемах ниже. Специалисту должно быть понятно, что отдельные стадии на приведенных ниже схемах могут меняться для получения соединения формулы I. Некоторые из этих вариантов обсуждаются ниже. Конкретная очередность стадий, необходимых для получения соединений формулы I, зависит от конкретного синтезируемого соединения, исходного соединения и относительной лабильности замещенных групп. Соединения настоящего изобретения можно получить способами, хорошо известными специалистам в данной области. Как правило, соединения формулы I можно получить путем сочетания подходяще замещенного тиенил- или тиазолилсульфонамида с подходяще замещенной бензойной кислотой, как это показано на схемах ниже. Переменные R1, R2, X и Y определены выше. Схема синтеза I Необязательно замещенную бензойную кислоту подвергают взаимодействию с подходяще замещенным сульфонамидом в стандартных условиях сочетания пептидов, хорошо известных специалистам. Конкретно, осуществляют взаимодействие тиенил- или тиазолилсульфонамида и бензойной кислоты в присутствии агента сочетания пептидов, необязательно в присутствии катализатора. Подходящие агенты сочетания пептидов включают N,N'-карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (DCC), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида TDC) и 1-(3-(1-пирролидинил)пропил)-3-этиларбодиимид(РЕРС). Формы EDC (Tetrahedron Letters, 34(48), 7685(1993 и РЕРС (патент США 5792763) на полимерной подложке описаны, и они являются весьма полезными для получения соединений настоящего изобретения. Подходящие катализаторы для реакций сочетания включают N, N-[диметил]-4-аминопиридин (DMAP). Все реагенты объединяют в подходящем растворителе, типичными представителями которого являются дихлорметан,хлороформ, тетрагидрофуран, диоксан или диэтиловый эфир, и перемешивают в течение от 1 до 72 ч при температуре от комнатной до примерно температуры дефлегмации растворителя. Когда в реакционной смеси остается избыточное количество или некоторое количество непрореагировавшего сульфонамида или бензойной кислоты,его можно удалить добавлением подходящей кислотной или основной смолы с последующим фильтрованием. Альтернативно, такие реагенты можно удалить методами экстракции. Желаемый продукт может быть выделен стандартными методами экстракции или кристаллизации и очищен методом хроматографии или кристаллизации, если это необходимо или желательно. Когда используют связанные с полимером реагенты, их удобно удалять из реакционной смеси фильтрованием. Необходимые для указанной реакции бензойные кислоты или сульфонамиды могут быть коммерчески доступными, либо их можно получить способами, известными специалистам в данной области, такими как показано на приведенных ниже схемах синтеза. Переменные R1, R2, X и Y определены выше иZ представляет собой цианогруппу или галогенид. На схеме синтеза II представлено сульфонилирование тиофенов и тиазолов формулы (3) в способе получения сульфонамидов формулы (1). Условия синтеза для реакций сульфонилирования зависят от функциональных групп исходного соединения тиофена. Например, на (стадии а), литиевое основание, такое как н-бутиллитий,используют для образования аниона формулы (4) In situ, при температуре от -78 С до комнатной температуры. Анион гасят агентом сульфонилирования, таким как диоксид серы, (стадия b), с получением соединений формулы (5). Соединения формулы (5) затем могут быть подвергнуты взаимодействию с N-хлорсукцинимидом, (стадия с), с получением сульфонилхлоридов формулы (6). Альтернативно, соединение формулы (4) может быть обработано сульфонилхлоридом, (стадия е), с непосредственным получением сульфонилхлоридов формулы (6)(Howbert, J.J.; Mohamadi, F.; Spees, M.M. Европейский патент 0467613 A1). Специалисту в данной области также должно быть понятно, что сульфонилхлорид формулы (6) можно получить взаимодействием соединения формулы (3) с хлорсульфоновой кислотой (стадия д). Сульфонилхлориды формулы (6) могут быть подвергнуты контактированию с гидроксидом аммония, (стадия d), с получением сульфонамидов формулы (1) (Cremlyn, R.J.; Bassin, J.P. Farouk, S.; Potteron, M.; Mattu, T. Phosphorus, Sulfur Silicon Relat.Elem. 1992, 73(1-4), 107-120); Besterman, J.M.; Delorme, D.; Rahil, J. WO 0102411, 2001). Альтернативно, соединения формулы (5) могут быть обработаны гидроксиламин-О-сульфоновой кислотой, (стадия f),с непосредственным получением сульфонамидов формулы (1) (Mohamadi, F.; Spees, M.M. патент США 5169860). Условия синтеза для реакций, показанных на Схеме синтеза II, хорошо известны и используются в данной области (J.Med.Chem., Graham, S.L., et al., 1989, 32, 2548-2554; J.Med.Chem., Barnish, I.T. et al.,1981, 24, 959; J.Chem.Soc, Cymerman-Craig, J., et al., 1956, 4115). Схема синтеза III Получение необходимых бензойных кислот (2) можно осуществить путем функциональных преобразований, хорошо известных специалистам и проиллюстрированных на схеме синтеза III. Например,когда Z представляет собой цианогруппу, преобразование в карбоновую кислоту осуществляют в кислотных условиях (Larock, R.C., Comprehensive Organic Transformations, 2nd Ed., copyright 1999, JohnWileySons, pp 1986-1987). Когда Z представляет собой галогенид, осуществляют промотируемое металлом карбонилирование с использованием ацетата палладия и оксида углерода в метаноле с получением метилбензоата (там же, стр. 1685-1687), с последующим гидролизом с получением бензойных кислот формулы (2) (там же, стр. 1959-1968). Специалисту в данной области должно быть понятно, что последующее манипулирование R-группами исходных соединений формулы (3) и (8) можно осуществить известными синтетическими методами взаимопревращений, например превращением аминопроизводного в соответствующий галогенид (там же, стр. 677-679), обменом галогенида с алкоксидом металла (там же,стр. 893-894) или нуклеофильным присоединением соответствующих серных или азотных нуклеофилов(там же, стр. 779-780). Специалисту также должно быть понятно, что не все заместители в соединениях формулы I являются толерантными к определенным реакционным условиям, используемым для синтеза указанных соединений. Такие группы могут быть введены в удобный момент в ходе синтеза или могут быть защищены с последующим снятием защиты, если это необходимо или желательно. Кроме того, специалисту должно быть понятно, что во многих случаях порядок введения таких групп не является критическим. Приведенные ниже примеры получения и примеры более подробно иллюстрируют получение соединений настоящего изобретения и никоим образом не должны рассматриваться как ограничивающие объем настоящего изобретения. Специалисту должно быть понятно, что можно осуществлять различные модификации, не отступая от сути и объема настоящего изобретения. Все указанные в описании изобретения публикации являются показателем известного уровня техники, к которому данное изобретение имеет отношение.-5 006081 Термины и сокращения, используемые ниже в примерах получения и в примерах, имеют свои обычные значения, если не указано иное. Например, "С", "н", "ммоль", "г", "мл", "М", "ВЭЖХ", "ИК","MC(FD)", "MC(ID)", "MC(FIA)", "MC(FAB)", "MC(EI)", "MC(ES)", "УФ", "TCX" и "1 Н-ЯМР" означают,соответственно, миллимоль или миллимоли, грамм или граммы, миллилитр или миллилитры, молярный или молярность, градусы Цельсия, нормальный или нормальность, высокоэффективную жидкостную хроматографию, инфракрасную спектрометрию, десорбционную масс-спектрометрию, массспектрометрию с ионным распылением, масс-спектрометрический анализ инжектируемого потока, массспектрометрию с бомбардировкой быстрыми атомами, электронно-импульсную масс-спектрометрию,масс-спектрометрию с электронным распылением, УФ масс-спектрометрию, тонкослойную хроматографию и спектрометрический метод протонного ядерного магнитного резонанса. Кроме того, для ИКспектров указаны только пики поглощения, представляющие интерес, а не все наблюдаемые пики. Получение 1. 5-(Метилтио)тиофен-2-сульфонамид К охлажденному раствору (-78 С) 2-(метилтио)тиофена (10,0 ммоль; Aldrich) в безводном тетрагидрофуране (5,0 мл/ммоль) добавляют 1,3 М н-бутиллитий в тетрагидрофуране (10 мл, 12,5 ммоль; Aldrich). Смесь оставляют для взаимодействия на 90 мин в атмосфере азота. Через раствор в течение 30 мин при -78 С барботируют диоксид серы. Смесь нагревают до комнатной температуры и концентрируют на роторном испарителе. Остаток обрабатывают раствором ацетата натрия (8 экв) и гидроксиламин-О-сульфоновой кислоты (2,5 экв) в воде (4 мл/моль) и перемешивают при 25 С в течение 1 ч. Реакционную смесь делают основной добавлением 1,0 н гидроксида натрия до рН 10 и экстрагируют диэтиловым эфиром (2 х 50 мл) . Водную фазу подкисляют до рН 2 концентрированной хлористо-водородной кислотой и экстрагируют метиленхлоридом (2x50 мл). Объединенные органические фазы промывают насыщенным бикарбонатом натрия (3x25 мл) и насыщенным раствором соли (50 мл), сушат (сульфат натрия), фильтруют и концентрируют на роторном испарителе. Неочищенное твердое вещество очищают колоночной хроматографией, элюируя смесью гексан/этилацетат (2:1). 1 Н ЯМР (300 МГц, CDCl3) : 7,52 (д, 1 Н), 6,94 (д, 1 Н), 5,10 (шир с, 2 Н), 2,58 (с, 3H) . Получение 2. 5-(Этил)тиофен-2-сульфонамид К охлажденному раствору (0 С) хлорсульфоновой кислоты (0,35 мл, 5,35 ммоль) в хлороформе (1,3 мл/ммоль) добавляют раствор 2-этилтиофена (1,78 ммоль), растворенный в хлороформе (1 мл/ммоль). Смесь перемешивают в течение 3 ч при комнатной температуре с подсоединенной осушительной трубкой. Затем реакционную смесь выливают в охлажденную смесь хлороформ/вода и перемешивают 10 мин. Органический слой промывают водой, сушат над сульфатом натрия и концентрируют в вакууме. К неочищенному маслу добавляют 2 мл водного раствора гидроксида аммония и смесь перемешивают в течение 30 мин. Растворитель концентрируют в вакууме. Остаток используют без дополнительной очистки. 1 Н ЯМР (200 МГц, CDCl3) : 7,48 (д, 1 Н, J=3,6 Гц), 6,74 (дд, 1 Н, J=3,7 Гц, 0,8 Гц), 5,2 (шир с, 2 Н),2,9 (кв, 2 Н, J=7,5 Гц), 1,32 (т, 3H, J=7,5 Гц). Получение 3. 5-(Пропил)тиофен-2-сульфонамид Аналогично методике получения 2, за исключением того, что используют 2-н-пропилтиофен. 1 Н ЯМР (200 МГц, CDCl3) : 7,46 (д, 1 Н, J=3,8 Гц), 6,72 (дд, 1 Н, J=3,8 Гц, 0,8 Гц), 5,30 (шир с, 2 Н) ,2,79 (т, 2 Н, J=7,4 Гц), 1,69 (кв, 2H, J=7,4 Гц), 0,97 (т, 3H, J=7,4 Гц). Получение 4. 5-(Метокси)тиофен-2-сульфонамид(2,6 мл/ммоль) добавляют 1,6 М н-бутиллитий (1 мл, 1,75 ммоль). Смесь оставляют для взаимодействия на 45 мин в атмосфере азота. Затем раствор нагревают до 0 С и через раствор барботируют диоксид серы-6 006081 в течение 15 мин, затем смесь продувают азотом. Растворитель удаляют в вакууме, неочищенное масло растворяют в безводном метиленхлориде (1 мл/ммоль) и добавляют N-хлорсукцинимид (1,75 ммоль). Смесь перемешивают в течение 2 ч при комнатной температуре в атмосфере азота. Полученную смесь фильтруют и затем концентрируют в вакууме. Неочищенное масло растворяют в ацетоне (3 мл/ммоль) и добавляют 2 мл водного раствора гидроксида аммония. Раствор перемешивают в течение ночи. Растворитель концентрируют в вакууме. Остаток растворяют в этилацетате и промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают колоночной хроматографией, элюируя смесью гексан/этилацетат (7:3). 1 Н ЯМР (200 МГц, CDCl3) : 7,37 (д, 1 Н, J=4,3 Гц), 6,17 (д, 1 Н, J=4,3 Гц), 4,9 (шир с, 2 Н), 3,94 (с,3H). Получение 5. 5-(Метил)тиофен-2-сульфонамид Аналогично методике получения 2, за исключением того, что используют 2-(метил)тиофен. 1 Н ЯМР (200 МГц, CDCl3) : 7,44 (д, 1 Н, J=3,7 Гц), 6,71 (шир д, 1 Н, J=3,7 Гц), 4,92 (шир с, 2 Н), 2,51 2-(Гидроксиметил)тиофен (4,4 ммоль; Aldrich), оксид серебра (I) (6,6 ммоль, 1,5 экв; Aldrich) и метилйодид (2,2 ммоль, 5 экв; Aldrich) растворяют в метиленхлориде (2 мл/ммоль) и перемешивают при комнатной температуре в течение 48 ч. Смесь фильтруют через целит и растворитель выпаривают в вакууме. Остаток очищают колоночной хроматографией, элюируя смесью гексан/этилацетат (75:25). К охлажденному раствору (-78 С) полученного выше продукта - 2-(метоксиметил)тиофена (0,87 ммоль) в безводном тетрагидрофуране (1,3 мл/ммоль) добавляют 1,6 М н-бутиллитий в тетрагидрофуране(0,6 мл, 0,9 ммоль; Aldrich). Смесь оставляют для взаимодействия на 30 мин в атмосфере азота и через канюлю переносят в раствор сульфурилхлорида (0,1 мл, 1,7 ммоль; Aldrich) в гексане (2,5 мл/ммоль). Раствор перемешивают в атмосфере азота в течение 2 ч и нагревают до комнатной температуры. Смесь разбавляют этилацетатом и промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и концентрируют в вакууме. Остаток растворяют в ацетоне (3 мл/ммоль) и добавляют 2 мл водного раствора гидроксида аммония, полученный раствор перемешивают в течение ночи. Растворитель концентрируют в вакууме. Остаток растворяют в этилацетате и промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают колоночной хроматографией, элюируя смесью гексан/этилацетат (7:3). 1 К хлорсульфоновой кислоте (0,14 г, 1,2 ммоль) при перемешивании добавляют пентахлорид фосфора (0,16 г, 0,8 ммоль) и полученный раствор охлаждают до 0 С в атмосфере азота. При перемешивании добавляют 2,3-дибромтиофен (0,24 г, 0,8 ммоль) и полученную смесь нагревают до 50 С в течение 1 ч. К реакционной смеси добавляют ледяную воду и затем экстрагируют этилацетатом (20 мл). Органический слой концентрируют и повторно растворяют в ацетоне (5 мл). Добавляют гидроксид аммония (5 мл, концентрированный) и полученную смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют насыщенный раствор соли (10 мл) и этилацетат (20 мл), органический слой отделяют и водный слой снова экстрагируют этилацетатом (10 мл). Объединенные органические слои сушат над сульфатом натрия, концентрируют в вакууме и затем хроматографируют на силикагеле (0,5%-ный метиловый спирт в метиленхлориде) с получением указанного в заголовке соединения (выход 58%) в виде коричневого твердого вещества. ES(-) MC m/z 318, (М-Н)- соответствует 2 Br. Смесь 5-бромтиофен-2-сульфонамида (0,50 г, 2,1 ммоль), цианида цинка (0,25 г, 2,1 ммоль), тетракис(трифенилфосфин)палладия(0) (0,072 г, 0,05 ммоль) в диметилформамиде (5 мл, безводный) помещают под микроволновое излучение (в атмосфере азота, 160 С). Тонкослойная хроматография (5%-ный метиловый спирт в метиленхлориде) указывает на то, что реакция не завершена. К реакционной смеси добавляют дополнительное количество тетракис(трифенилфосфин)палладия(0) (0,24 г, 0,2 ммоль) и диметил- формамида (10 мл) и помещают под микроволновое излучение (в атмосфере азота, 160 С) на 37 мин. К реакционной смеси добавляют 10 мл воды и 20 мл этилацетата. Органический слой отделяют и водный слой экстрагируют 20 мл этилацетата. Объединенные органические слои сушат над сульфатом натрия, концентрируют в вакууме и затем хроматографируют на силикагеле (0-5%-ный метиловый спирт в метиленхлориде) с получением указанного в заголовке соединения в виде белого твердого вещества Смесь 5-бромтиофен-2-сульфонамида (0,50 г, 2,1 ммоль), триэтиламина (1 мл), метанола (1 мл),ацетата палладия (0,046 г, 2,1 ммоль) и 1,3-бис(дифенилфосфино)пропана (0,085 г, 2,1 ммоль) (добавленных в указанном порядке) в диметилформамиде (5 мл, безводный) насыщают газообразным монооксидом углерода при комнатной температуре. Реакционную смесь нагревают до 100 С и перемешивают в течение ночи в атмосфере монооксида углерода. К реакционной смеси добавляют 10 мл насыщенного раствора соли и 10 мл этилацетата. Органическую фазу отделяют и водный слой экстрагируют 10 мл этилацетата. Объединенные органические слои сушат над сульфатом натрия, концентрируют в вакууме и затем хроматографируют на силикагеле (0-1%-ный метиловый спирт в метиленхлориде) с получением указанного в заголовке соединения в виде желтого твердого вещества (0,15 г, выход 34%). ES(-)MC m/z 220, (М-Н)-. Получение 10. 2-Хлортиазол-5-сульфонамид Аналогично методике получения 4, за исключением того, что используют 2-хлортиазол. Получение 11. 2-Метокситиазол-5-сульфонамид Аналогично методике получения 1, за исключением того, что используют 2-метокситиазол. Получение 12. 2-Изопропил-2,5-дигидротиазол Раствор 1,4-дитиан-2,5-диола (20 г, 131 ммоль) суспендируют в Et2O (80 мл) в круглодонной колбе,снабженной холодильником и трубкой для ввода газа. Добавляют изобутиральдегид (40 мл) и Na2SO4 (12 г), затем через реакционную смесь барботируют аммиак в течение 20 мин при комнатной температуре и 10 мин при температуре кипения с обратным холодильником. Затем реакционную смесь охлаждают до комнатной температуры, отфильтровывают Na2SO4 и растворитель отгоняют дистилляцией при атмосферном давлении. Остаток перегоняют с помощью колонки Вигре при 130 С при 7 дюйм/Hg до получения указанного в заголовке соединения (13,4 г, 40%). ES(+)MC m/z 130, (М+Н)+. Получение 13. 2-Изопропилтиазол(12,4 г, 95,9 ммоль) в бензоле (125 мл). Реакционную смесь кипятят с обратным холодильником в течение 2 ч и охлаждают до комнатной температуры. Добавляют раствор 2 М NaOH (200 мл) и реакционную смесь перемешивают в течение 5 мин, затем выливают в делительную воронку. Органический слой отделяют и промывают 2 М NaOH (200 мл) и Н 2 О (2x100 мл) . Водные слои повторно экстрагируют бензолом и органические слои объединяют. Бензол отгоняют дистилляцией при атмосферном давлении с получением маслянистого остатка, который перегоняют на колонке Вигре при 130 С при 8 дюйм/Hg до получе-8 006081 ния указанного в заголовке соединения (6,13 г, 48%) в виде бесцветного масла. ES(+) MC m/z 128,(М+Н)+. Получение 14. 2-Изопролилтиазол-5-сульфонамид К раствору 2-изопропилтиазола (2 г, 15,7 ммоль) в Et2O (75 мл) при -78 С по каплям добавляют нBuLi (12,8 мл 1,6 М в гексане, 20,4 ммоль) (наблюдается образование розового осадка). Через 40 мин реакционную смесь нагревают до 0 С в течение 10 мин, затем повторно охлаждают до -78 С. Над поверхностью реакционной смеси в течение 5 мин барботируют диоксид серы. Реакционную смесь нагревают до комнатной температуре и перемешивают в течение дополнительных 2,5 ч. Реакционную смесь охлаждают до 0 С, добавляют N-хлорсукцинимид (4,20 г, 32,4 ммоль) и реакционную смесь перемешивают в течение 1,5 ч. Затем реакционную смесь фильтруют и осадок промывают Et2O. Фильтрат концентрируют в вакууме до получения неочищенного сульфонилхлорида, который растворяют в ацетоне (20 мл), и добавляют к перемешиваемому раствору концентрированного NH4OH (20 мл) в ацетоне (50 мл) при 0 С. Реакционную смесь перемешивают в течение 5 мин и затем распределяют между EtOAc и Н 2 О. Водный слой отделяют и экстрагируют EtOAc (2x). Органические слои объединяют, сушат (MgSO4), фильтруют и выпаривают при пониженном давлении. Неочищенный продукт перекристаллизовывают из смеси СН 2 Сl2/ацетон/гексан с получением указанного в заголовке соединения (1,89 г, 58%). К перемешиваемому раствору 2-бромтиазола (5,0 г, 30,5 ммоль) в Et2O (60 мл) при -78 С в атмосфере азота по каплям добавляют н-BuLi (14,6 мл 1,6 М в гексане, 36,6 ммоль). Реакционную смесь перемешивают в течение 40 мин, затем по каплям добавляют диметилсульфат (4,75 мл, 50,3 ммоль), реакционную смесь нагревают до -10 С (помещают в холодильник) и оставляют стоять в течение ночи. Реакционную смесь нагревают до 0 С и осторожно гасят 2 М HCl (40 мл). Органический слой отделяют и экстрагируют HCl (2 х). Кислотные экстракты объединяют, делают сильно щелочными с помощью 2 М NaOH и экстрагируют Et2O (4x). Объединенные органические экстракты сушат над КОН и растворитель отгоняют при атмосферном давлении, затем указанное в заголовке соединение отгоняют при 128-130 С (1,5 г, 49%). К перемешиваемому раствору н-BuLi (12,1 мл 1,6 М в гексане, 19,4 ммоль) в Et2O (70 мл) при -78 С в атмосфере азота по каплям добавляют раствор 2-метилтиазола (1,48 г, 14,9 ммоль) в Et2O (70 мл). Реакционную смесь перемешивают при -78 С в течение 40 мин, затем нагревают до -20 С. Через раствор в течение 5 мин барботируют диоксид серы, затем реакционную смесь оставляют нагреваться до комнатной температуры в течение ночи. Добавляют N-хлорсукцинимид (3,99 г, 29,9 ммоль) и реакционную смесь оставляют перемешиваться в течение 1 ч. Реакционную смесь фильтруют и фильтрат концентрируют в вакууме с получением неочищенного продукта. Неочищенный продукт растворяют в ацетоне (30 мл) и добавляют концентрированный NH4OH (20 мл), затем смесь перемешивают в течение 15 мин. Реакционную смесь распределяют между EtOAc и Н 2 О. Водный слой экстрагируют EtOAc (2 х), органические слои объединяют, сушат (MgSO4), фильтруют и концентрируют в вакууме. Флэш-хроматография на силикагеле с градиентным элюированием [Hex (гексан) до Hex:EtOAc (1:1)] дает указанное в заголовке соединение (282 мг, 11%) в виде желто-коричневого твердого вещества. ES(-) MC m/z 177, [М-Н]-. Получение 17. 2 -Бром-3-хлортиофен К раствору 3-хлортиофена (5,0 г, 42 ммоль) в смеси СНСl3 (50 мл) и АсОН (50 мл) добавляют Nбромсукцинимид (8,3 г, 46 ммоль). Раствор нагревают до 50 С. Через 1,5 ч реакционную смесь охлаждают до комнатной температуры. К реакционной смеси добавляют насыщенный раствор соли (100 мл) иEt2O (200 мл) и водный слой экстрагируют Et2O (100 мл). Объединенные органические экстракты промывают насыщенным NaHCO3, затем сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения (5,4 г, 65%). К пентахлориду фосфора (4,6 г, 22,2 ммоль) в атмосфере азота добавляют хлорсульфоновую кислоту (2,2 мл, 33,3 ммоль). Раствор охлаждают до 0 С и добавляют 2-бром-3-хлортиофен (1,0 г, 5,0 ммоль). Смесь нагревают до 50 С в течение 1 ч. Реакционную смесь охлаждают, затем гасят смесью лед/вода и полученный раствор экстрагируют СН 2 Сl2 (200 мл) с последующим удалением СН 2 Сl2 при пониженном давлении. Остаток растворяют в ацетоне (30 мл) и к полученному раствору добавляют 29% NH4OH (40 мл) в ацетоне (100 мл) при 0 С. Реакционную смесь перемешивают в течение 0,5 ч, затем ацетон удаляют при пониженном давлении. Остаток экстрагируют EtOAc (200 мл). Органический слой промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения (8,1 г, 100%), которое используют без дополнительной очистки. К перемешиваемому раствору 5-бром-4-хлортиофен-2-сульфонамида (2,4 г, 8,7 ммоль) в АсОН (20 мл) добавляют цинковую пыль (1,7 г, 26,0 ммоль). Реакционную смесь нагревают до 120 С в течение 6 ч. Через 6 ч смесь фильтруют и нейтрализуют 1 М NaOH. Водный слой экстрагируют EtOAc (2x100 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя СН 2 Сl2 с получением указанного в заголовке соединения (0,88 г, 52%). 1 3-Метилтиофен (5,0 г, 50,9 ммоль) растворяют в растворе СНСl3 (50 мл) и АсОН (50 мл). К раствору добавляют N-бромсукцинимид (9,5 г, 53,5 ммоль) и смесь нагревают до 50 С. Через 1,5 ч реакционную смесь охлаждают до комнатной температуры. К реакционной смеси добавляют насыщенный раствор соли (100 мл) и Et2O (200 мл). Органический слой отделяют и промывают 1 М NaOH и насыщенным, раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения (6,4 г, 71%) в виде прозрачного масла. 1 Н ЯМР (300 МГц, CD3OD) : 2,14 (с, 3H), 6,81 (д, J=5,6 Гц, 1 Н), 7,28 (д, J=5,6 Гц, 1 Н). Получение 21. 5-Бром-4-метилтиофен-2-сульфонамид К пентахлориду фосфора (6,5 г, 31 ммоль) добавляют хлорсульфоновую кислоту (3,1 мл, 46,4 ммоль). Смесь охлаждают до 0 С и добавляют 2-бром-3-метилтиофен (5,4 г, 31 ммоль). Реакционную смесь нагревают до 50 С в течение 1 ч. Реакцию охлаждают/гасят смесью лед/вода и раствор экстрагируют CH2Cl2 (200 мл). Органический слой промывают насыщенным раствором соли, сушат (Na2SO4),фильтруют и концентрируют в вакууме. Остаток растворяют в ацетоне (20 мл) и добавляют к раствору 29% NH4OH (54 мл) в ацетоне (250 мл). Реакционную смесь перемешивают в течение 0,5 ч, затем при пониженном давлении удаляют ацетон. Остаток экстрагируют EtOAc (2 х 100 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя СН 2 Сl2 с получением указанного в заголовке соединения (5,3 г, 58%). 1(30 мл) добавляют цинковую пыль (2,4 г, 36,2 ммоль). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 8 ч. Через 8 ч реакционную смесь охлаждают и фильтруют. Фильтрат нейтрализуют 1 М NaOH. Водный слой экстрагируют EtOAc (300 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя CH2Cl2 с получением указанного в заголовке соединения (0,90 г, 43%). 1 Н ЯМР (300 МГц, CD3OD) : 2,26 (с, 3H), 7,27 (с, 1 Н), 7,41 (с, 1 Н). Получение 23. 2-Триметилсилил-3-метокситиофен К раствору 3-метокситиофена (3,0 г, 2 6,3 ммоль) в безводном Et2O (20 мл) в атмосфере азота при -70 С по каплям добавляют раствор н-BuLi (19,7 мл 1,6 М в гексане, 31,5 ммоль). Смесь перемешивают при -70 С в течение 2 ч. К раствору медленно добавляют хлортриметилсилан (4,5 мл, 35,4 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Реакцию гасят водой (50 мл) и гексаном (100 мл). Водный слой экстрагируют гексаном (50 мл). Объединенные органические экстракты сушат (Na2SO4),фильтруют и концентрируют. Неочищенный продукт хроматографируют на силикагеле, элюируя гексаном с получением указанного в заголовке соединения (4,0 г, 82%) в виде бесцветной жидкости. 1 К раствору 2-триметилсилил-3-метокситиофена (2,19 г, 11,8 ммоль) в безводном ТГФ (40 мл) в атмосфере азота при -70 С добавляют раствор H-BuLi (11,8 мл 2,5 М в гексане, 29,4 ммоль). Смесь перемешивают при -70 С в течение 4 ч, затем в течение 5 мин через раствор барботируют диоксид серы. После перемешивания в течение 2,5 ч к суспензии добавляют N-хлорсукцинимид (3,15 г, 23,6 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 1 ч, затем реакционную смесь фильтруют и твердые вещества промывают CH2Cl2. Фильтрат концентрируют и остаток растворяют в СН 2 Сl2(200 мл). Органический слой промывают насыщенным раствором соли, затем сушат (Na2SO4, фильтруют и концентрируют. Остаток растворяют в ацетоне (20 мл) и добавляют к раствору 29% NH4OH (20 мл) в ацетоне (30 мл) при 0 С. Смесь перемешивают при 0 С в течение 30 мин, затем ацетон удаляют при пониженном давлении и остаток экстрагируют EtOAc (2x100 мл). Органические экстракты промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт хроматографируют на силикагеле, элюируя Hex:EtOAc (3:1) с получением указанного в заголовке соединения (0,77 г, 25%). 1 К раствору 5-триметилсилил-4-метокситиофен-2-сульфонамида (770 мг, 2,90 ммоль) в ТГФ (10 мл) добавляют раствор фторида тетрабутиламмония (17,4 мл 1M в ТГФ, 17,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. ТГФ удаляют при пониженном давлении. Остаток растворяют в EtOAc (200 мл). Органический слой промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя Hex:EtOAc (3:1) с получением указанного в заголовке соединения (480 мг, 86%). 1 К раствору 4-метокситиофен-2-сульфонамида (240 мг, 1,24 ммоль) в СН 2 Сl2 (40 мл) добавляют Nбромсукцинимид (287 мг, 1,61 ммоль). Реакционную смесь перемешивают при 0 С в течение 7 ч. Через 7 ч реакционную смесь разбавляют CH2Cl2 (150 мл). Органический слой промывают насыщенным раствором соли, за- 11006081 тем сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя Hex:EtOAc (2:1) с получением указанного в заголовке соединения (277 мг, 82%). 1 Н ЯМР (300 МГц, CD3OD) : 3,30 (с, 3H), 7,40 (с, 1 Н). Получение 27. 2-Триметилсилил-3-метилсульфанилтиофен К раствору 3-метилсульфанилтиофена (1,0 г, 7,7 ммоль) в безводном Et2O (8 мл) в атмосфере азота при -70 С добавляют раствор H-BuLi (5,3 мл 1,6 М в гексане, 8,5 ммоль). Смесь перемешивают при -70 С в течение 2 ч. К реакционной смеси медленно добавляют хлортриметилсилан (1,5 мл). Смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Реакцию гасят водой (50 мл) и Et2O (50 мл). Водный слой экстрагируют Et2O (50 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт хроматографируют на силикагеле, элюируя гексаном с получением указанного в заголовке соединения (0,75 г, 48%) в виде бесцветной жидкости. 1 Н ЯМР (300 МГц, CD3OD) : 0,38 (с, 9 Н), 2,42 (с, 3H), 7,17 (д, J=3,7 Гц, 1 Н), 7,51 (д, =3,7 Гц, 1 Н). Получение 28. 5-Триметилсилил-4-метилсульфанилтиофен-2-сульфонамид К раствору 2-триметилсилил-3-метилсульфанилтиофена (1,5 г, 7,4 ммоль) в безводном ТГФ (25 мл) в атмосфере азота при -70 С по каплям добавляют раствор н-BuLi (7,4 мл 2,5 М в гексане, 18,4 ммоль). Смесь перемешивают при -70 С в течение 4 ч. Через раствор в течение 5 мин при -70 С барботируют диоксид серы. Через 2,5 ч к суспензии добавляют N-хлорсукцинимид (1,98 г, 14,8 ммоль). Смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь фильтруют и твердые вещества промывают CH2Cl2. Фильтрат концентрируют и остаток растворяют в CH2Cl2 (200 мл). Органический слой промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют. Остаток растворяют в ацетоне (20 мл) и добавляют к раствору 29% NH4OH (13 мл) в ацетоне (30 мл) при 0 С. Смесь перемешивают при 0 С в течение 30 мин. Ацетон удаляют при пониженном давлении и остаток экстрагируют EtOAc (2x100 мл). Органические экстракты промывают насыщенным раствором соли,затем сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт хроматографируют на силикагеле, элюируя Hex:EtOAc (3:1) с получением указанного в заголовке соединения (0,65 г, 34%). 1 Н ЯМР (300 МГц, CD3OD) : 0,39 (с, 9 Н), 2,45 (с, 3H), 7,65 (с, 1 Н). Получение 29. 4-Метилсульфанилтиофен-2-сульфонамид(10 мл) добавляют раствор фторида тетрабутиламмония (14,0 мл 1 М в ТГФ, 14,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. ТГФ удаляют при пониженном давлении и остаток растворяют в EtOAc (200 мл). Органический слой промывают насыщенным раствором соли,затем сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя Hex:EtOAc (2:1) с получением указанного в заголовке соединения (400 мг,82%). 1 Н ЯМР (300 МГц, CD3OD) : 2,49 (с, 3H), 7,35 (с, 1 Н), 7,47 (с, 1 Н). Получение 30. 5-Бром-4-метилсульфанилтиофен-2-сульфонамид(10 мл) добавляют N-бромсукцинимид (231 мг, 1,30 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 7 ч. Через 7 ч реакционную смесь нейтрализуют 1 М NaOH и раствор экстрагируют EtOAc (200 мл). Органический слой промывают насыщенным раствором соли, затем сушат(Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт хроматографируют на силикагеле, элюируя Hex:EtOAc (3:1) с получением указанного в заголовке соединения (200 мг, 70%). 1 Н ЯМР (300 МГц, CD3OD) : 2,49 (с, 3H), 7,45 (с, 1 Н).- 12006081 Получение 31. 2,4-Дибромбензонитрил К перемешиваемому безводному диметилсульфоксиду (50 мл) при 60 С добавляют цианид меди(2,32 г, 25,9 ммоль) до образования прозрачного раствора с последующим немедленным добавлением трет-бутилнитрита (7,1 мл, 59,7 ммоль). К смеси через канюлю по каплям добавляют раствор 2,4 диброманилина (5,0 г, 19,9 ммоль) в безводном диметилсульфоксиде (30 мл). После завершения добавления реакционную смесь оставляют для перемешивания на 1 ч. После охлаждения до 45 С смесь медленно обрабатывают 5 н хлористо-водородной кислотой (50 мл). Через 5 мин реакционную смесь охлаждают до температуры окружающей среды и затем экстрагируют смесью этилацетат/гексан (1:1, 2x300 мл). Объединенные органические слои промывают водой (100 мл) и насыщенным раствором соли (100 мл), сушат, концентрируют в вакууме и затем хроматографируют на силикагеле (0-5%-ный этилацетат в гексане) с получением указанного в заголовке соединения (1,61 г, выход 31%). FD( + )MC m/z 259, (М+) соответствует 2Br. Получение 32. 2,4-Дибромбензойная кислота Перемешиваемую суспензию 2,4-дибромбензонитрила (1,57 г, 6,0 ммоль) в серной кислоте (6 М, 150 мл) нагревают при кипячении с обратным холодильником в течение 3 дней. Реакционную смесь охлаждают до температуры окружающей среды и затем экстрагируют этилацетатом (2x75 мл). Объединенные органические слои промывают водой (100 мл) и насыщенным раствором соли (100 мл), сушат, концентрируют и затем хроматографируют на силикагеле (уксусная кислота/метиловый спирт/хлороформ,0,1:0,5:99,4) с получением указанного в заголовке соединения (0,81 г, выход 48%). Т.пл. 171-172 С; ES(-) К перемешиваемой, охлажденной на льду смеси 2-амино-4-хлорбензойной кислоты (5,00 г, 29,1 ммоль) и 48% бромисто-водородной кислоте (150 мл) в воде (150 мл) по каплям добавляют водный раствор нитрата натрия (2,21 г) в воде (15 мл). Полученную смесь перемешивают в течение 2 ч при 0 С. Затем смесь по каплям обрабатывают водным раствором бромида меди (7,81 г) в воде (20 мл). После завершения добавления реакционную смесь оставляют нагреваться до температуры окружающей среды, при которой смесь перемешивают в течение ночи. Затем экстрагируют смесью этилацетат/гексан (3:1; 2x400 мл), объединенные органические слои промывают насыщенным раствором соли (200 мл), сушат, концентрируют и хроматографируют на силикагеле К 4-бром-3-хлортолуолу (4,97 г, 24,2 ммоль) в диметилформамиде (25 мл) добавляют ацетат палладия (0,54 г, 2,42 ммоль), 1,3-бис(дифенилфосфино)пропан (0,998 г, 2,42 ммоль), триэтиламин (12,5 мл) и метанол (12,5 мл). В реакционном сосуде создают вакуум и три раза продувают газообразным монооксидом углерода. Для поддержания атмосферы монооксида углерода используют баллон, наполненный газообразным монооксидом углерода. Реакционную смесь нагревают при 80 С в течение 8 ч. Смесь промывают водой и экстрагируют гексаном (2x50 мл). Объединенные органические слои сушат над сульфатом натрия, концентрируют и хроматографируют 0-3%-ным этилацетатом в гексане. Выделяют 1,24 г,(28%) метил 2-хлор-4-метилбензоата в виде бесцветного масла. ES(+) MC m/z 184,(М+Н)+ соответствует 1Cl. К метил 2-хлор-4-метилбензоату (1,00 г, 5,42 ммоль) в тетрагидрофуране (10 мл), метиловом спирте(5 мл) и воде (2,5 мл) добавляют 2 н гидроксид лития (8,12 мл, 16,2 ммоль). Реакционную смесь нагревают при 50 С в течение 2,5 ч, охлаждают до комнатной температуры и затем гасят 5 н хлористоводородной кислотой (3,24 мл). Для удаления тетрагидрофурана и метилового спирта смесь концентрируют. Образовавшийся белый осадок отфильтровывают. После сушки выделяют 0,922 г (100%) 2-хлор-4 метилбензойной кислоты. ES(-) MC m/z 169,(М-Н)- соответствует 1Cl. Получение 35. Этиловый эфир 4,4,4-трифтор-3-метоксибут-2-еновой кислоты К раствору этил 4,4,4-трифторацетата (12 мл, 82 ммоль) в ДМФ (80 мл) добавляют карбонат цезия(26,4 г, 82 ммоль). Реакционную смесь нагревают до 70 С. Затем по каплям в течение 30 мин добавляют раствор метил п-толуолсульфоната (13,5 мл, 90 ммоль) в ДМФ (30 мл) и реакционную смесь перемешивают в течение еще одного часа. После охлаждения до комнатной температуры реакционную смесь разбавляют H2O (150 мл) и экстрагируют Et2O (2x150 мл). Органические экстракты объединяют, промывают Н 2O и насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют с получением- 13006081 указанного в заголовке соединения (9,0 г, 56%) в виде масла, которое используют без дополнительной очистки. 1 Н ЯМР (300 МГц, CDCl3) : 1,28 (т, J=7,l Гц, 3H) , 4,01 (с, 3H), 4,19 (кв, J=7,1 Гц, 2 Н), 5,75 (с, 1 Н). Получение 36. Метиловый эфир 3-гидрокиси-5-трифторметилтиофен-2-карбоновой кислоты Раствор этилового эфира 4,4,4-трифтор-3-метоксибут-2-еновой кислоты (9,6 г, 48,5 ммоль) и метилтиогликолята (4,3 мл, 48,5 ммоль) в МеОН (75 мл) охлаждают до 5 С. Затем в течение 30 мин добавляют раствор КОН (3,3 г, 58,2 ммоль) в МеОН (75 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь затем выливают в перемешиваемую смесь льда (75 г), Н 2 О(75 мл) и концентрированной H2SO4 (4,5 мл). Смесь экстрагируют EtOAc (2x250 мл). Объединенные экстракты промывают насыщенным NaHCO3. Промывки повторно экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (10 г, 91%) в виде коричневого масла, которое используют без дополнительной очистки. 1 Н ЯМР (300 МГц, CDCl3) : 3,92 (с, 3H), 7,06 (с, 1 Н), 9,48 (шир с, 1 Н). Получение 37. 3-Гидрокиси-5-трифторметилтиофен-2-карбоновая кислота К перемешиваемому раствору NaOH (8,0 г, 200 ммоль) в Н 2 О (25 мл) добавляют раствор метилового эфира 3-гидрокиси-5-трифторметилтиофен-2-карбоновой кислоты (11,4 г, 50 ммоль) в МеОН (25 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 3 ч и затем охлаждают до комнатной температуры. Реакционную смесь концентрируют до приблизительно половины объема и охлаждают до 5 С. Подкисление до рН 1 концентрированной HCl (17 мл) приводит к образованию суспензии. После перемешивания суспензии в течение 30 мин при 5 С твердые вещества собирают фильтрованием, промывают H2O и сушат в вакууме до получения указанного в подзаголовке соединения(8,5 г, 79%) в виде не совсем белого твердого вещества, которое используют без дополнительной очистки. 1 Н ЯМР (300 МГц, CDCl3) : 7,30 (с, 1 Н), 11,7 (шир с, 2 Н). Получение 38. 5-Трифторметилтиофен-3-ол 3-Гидрокиси-5-трифторметилтиофен-2-карбоновую кислоту (8,0 г, 37,8 ммоль) помещают в колбу и нагревают до 105 С в атмосфере аргона. Нагревание продолжают в течение 2 ч до завершения декарбоксилирования. При охлаждении получают указанное в заголовке соединение (6,8 г, 85%) в виде коричневого масла, которое используют без дополнительной очистки. 1 Н ЯМР (300 МГц, CDCl3) энол (основной) : 5,01 (шир с, 1 Н), 6,52 (д, J=l,7 Гц), 7,06 (м, 1 Н). 1 Н ЯМР (300 МГц, CDCl3) кето (второстепенный) : 3,86 (с, 2 Н), 6,59 (шир с, 1 Н). Получение 39. 1-Фенил-5-(5-трифторметилтиофен-3-илокси)-1 Н-тетразол Раствор 5-трифторметилтиофен-3-ола (2,0 г, 11,9 ммоль) в безводном ацетоне (480 мл), содержащий 5-хлор-1-фенил-1 Н-тетразол (2,1 г, 11,9 ммоль) и К 2 СО 3 (3,3 г, 23,8 ммоль), поддерживают при кипении с обратным холодильником с осторожным удалением влаги в течение ночи. Ацетон удаляют при пониженном давлении и остаток распределяют между CH2Cl2 (500 мл) и Н 2O (50 мл). Органические экстракты промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют. Неочищенный, продукт хроматографируют на силикагеле, элюируя смесью EtOAc:Hex (1:80) с получением указанного в заголовке соединения (2,5 г, выход 68%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3) : 7,52-7,61 (м, 4 Н), 7,73 (д, J=7,7 Гц, 2 Н), 7,79 (с, 1 Н). Получения 40 и 41. 3-(1-Фенил-1 Н-тетразол-5-илокси)-5-трифторметилтиофен-2-сульфонамид и 3[1-(4-сульфамоилфенил)-1 Н-тетразол-5-илокси]-5-трифторметилтиофен-2-сульфонамид. Раствор хлорсульфоновой кислоты (2 мл, 30 ммоль) помещают в колбу и к раствору в атмосфере азота добавляют 1-фенил-5-(5-трифторметилтиофен-3-илокси)-1 Н-тетразол (100 мг, 0,30 ммоль). Раствор нагревают до 100 С в течение 2 ч. Раствор охлаждают до 70 С и добавляют тионилхлорид (0,1 мл, 0,33 ммоль), затем реакционную смесь повторно нагревают до 100 С и перемешивают в течение дополнительных 2 ч. Реакционную смесь выливают по каплям на лед и раствор экстрагируют СН 2 Сl2 (100 мл). Органические слои промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют. Остаток растворяют в ацетоне (5 мл) и добавляют к раствору 29% NH4OH (5 мл) и ацетона(10 мл) при 0 С. Реакционную смесь перемешивают при 0 С в течение 30 мин. Ацетон удаляют при пониженном давлении и остаток экстрагируют EtOAc (2x50 мл) . Органические экстракты промывают насыщенным раствором соли, затем сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт хроматографируют на силикагеле, элюируя смесью EtOAc:Hex (1:3), с получением смеси указанных в заголовке соединений (91 мг, 65%) в виде белого твердого вещества. В другой реакции компоненты разделяют хроматографией на силикагеле, элюируя смесью EtOAc.Hex (1:5), и индивидуально характеризуют. 1(2 мл) и 10% палладий на угле (350 мг). Смесь нагревают до 80 С в течение ночи. Реакционную смесь охлаждают до комнатной температуры и разбавляют бензолом (50 мл). Реакционную смесь фильтруют. Бензольный слой сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт хроматографируют на силикагеле, элюируя смесью EtOAc:Hex (1:10), с получением указанного в заголовке соединения(18 мг, 17%) в виде белого твердого вещества. Аналогичную методику применяют к амиду 3-(1-фенил-1 Н-тетразол-5-илокси)-5-трифторметилтиофен-2-сульфоновой кислоты, также с получением указанного в заголовке соединения. 1 Н ЯМР (300 МГц, CD3OD) : 7,56 (д, J=4,0 Гц, 1 Н) , 7,60 (д, J=4,0 Гц, 1 Н). EC(-) MC m/z 230, (M-H)-. Общая методика реакции сочетания К перемешиваемому раствору бензойной кислоты (1,25 экв) в сухом дихлорметане (10 мл/ммоль) одной порцией добавляют сульфонамид (1,0 экв) с последующим добавлением EDC (1,25-1,5 экв) и, в последнюю очередь, N,N-[диметил]-4-аминопиридина (1,2 экв.). Смесь тщательно перемешивают в атмосфере азота в течение 16 ч, концентрируют при пониженном давлении и остаток распределяют между этилацетатом и водой. Органический слой промывают 1 н хлористо-водородной кислотой (4 раза, 20 мл/ммоль), затем объединенные водные фазы экстрагируют этилацетатом (дважды, 20 мл/ммоль). Объединенные органические слои окончательно промывают водой и насыщенным водным хлоридом натрия,сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток может быть очищен хроматографией на силикагеле, хроматографией с обращенной фазой или кристаллизацией, если это необходимо или желательно. Соединения примеров 1-53 получают, по существу, как описано в общей методике сочетания. В реакционный сосуд емкостью 8 мл загружают 4-бром-2-хлорбензойную кислоту (0,39 ммоль, 1,5 экв) и 2,0 мл дихлорметана. Добавляют исходный раствор (4,0 мл), содержащий 5-бромтиофен-2 сульфонамид (0,26 ммоль, 1 экв) и N,N-[диметил]-4-аминопиридин (48 мг, 0,39 ммоль, 1,5 экв) в дихлорметане, с последующим добавлением 0,261 г карбодиимидполистирольной смолы (2,0 ммоль/г, 0,52 ммоль, 2,0 экв, Novabiochem), сосуд закрывают и встряхивают. Через 72 ч добавляют 0,77 г сульфированной полистирольной смолы (MP-TsOH) (1,53 ммоль/г, 1,17 ммоль, Argonaut). Приблизительно через 18 ч реакционную смесь фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии и фракции, содержащие продукт, объединяют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. К реакционной смеси дихлорбензойной кислоты (28,4 г, 148,7 ммоль), 5-бром-2-сульфонамида (30,0 г, 123,9 ммоль) и EtOAc (200,0 мл) при комнатной температуре в течение 13 мин добавляют горячий раствор CDI (24,1 г, 148,7 ммоль) в ТГФ (100,0 мл). Для ускорения реакции и смывки остаточного CDI в реакционный сосуд добавляют избыточное количество ТГФ (50,0 мл). Во время добавления раствора/суспензии CDI наблюдают выделение газа. Это контролируют регулированием скорости добавления. По завершении добавления CDI светло-желтый раствор перемешивают в течение 10 мин и затем нагревают при кипячении с обратным холодильником в течение 90 мин или до тех пор, пока не прекратится выделение газа (промежуточный продукт реакции отслеживают при помощи ЖХ и реакцию считают завершенной, когда не наблюдается никакого кислотного пика). Затем реакционную смесь оставляют для уравновешивания до 40 С, после чего сразу добавляют чистый DBU (22,3 мл, 148,7 ммоль)(максимальная температура, достигаемая к концу добавления составляла 45 С) и перемешивают до достижения комнатной температуры в течение ночи, для удобства. Реакцию считают завершенной, по данным ВЭЖХ, с исчезновением исходного сульфонамидного вещества. Затем добавляют деионизированную воду (250,0 мл) и верхний органический слой отделяют. Водный слой повторно экстрагируютEtOAc (50,0 мл). Объединенные органические слои тщательно промывают 1 н раствором HCl (500,0 мл),сушат безводным MgSO4, фильтруют и фильтровальную лепешку промывают EtOAc (20,0 мл). Фильтрат затем концентрируют при пониженном давлении (темп, водяной бани 50 С) с получением 70,4 г густого раствора. К раствору добавляют гептан (200,0 мл) при тщательном перемешивании, пока приблизительно через час не образовывался не совсем белый осадок. Осадок отфильтровывают и фильтровальную лепешку промывают гептаном (25,0 мл). Осадок затем сушат в вакууме при 55 С в течение 18 ч (45,4 г,выход 88,2 мас.%). ES(-) MC m/z 412,(М-Н)- соответствует 1Br и 2Cl. Пример 64. Натриевая соль N-[2,4-дихлорбензоил]-5-бромтиофен-2-сульфонамида К раствору соединения примера 63 (25,0 г, 60,2 ммоль) и МТВЕ (208,0 мл) при комнатной температуре одной порцией добавляют метоксид натрия (3,3 г, 60,2 ммоль). Реакционную смесь затем перемешивают в течение 24 ч, после чего добавляют гептан (426,0 мл) с последующим тщательным перемешиванием в течение 60 мин. Образовавшийся белый осадок затем отфильтровывают при положительном давлении азота и фильтровальную лепешку затем промывают гептаном (150,0 мл). Осадок затем отжимают до полусухого состояния с последующей сушкой в вакуумной печи при 100 С в течение 18 ч (мас- 19006081 са 22,1 г, выход 84 мас.%. 1 Н ЯМР (ДMCO-d6) : 7,13-7,14 (д, J=3, 9 Гц, 1 Н), 7,30-7,35 (м, 2 Н), 7,47-7,52(м, 2 Н. Все соединения настоящего изобретения являются перорально доступными и, как правило, их вводят перорально, и таким образом, пероральное введение является предпочтительным. Однако пероральное введение не является единственным предпочтительным путем. Например, для пациентов, забывающих принять перорально лекарственное средство или которые испытывают связанное с этим неудобство,часто желательно чрескожное введение, а внутривенное введение может быть предпочтительным по причине удобства или для избежания возможных осложнений, связанных с пероральным введением. Соединения формулы I в некоторых обстоятельствах также можно вводить подкожным, внутримышечным,интраназальным или интраректальным путем. Путь ведения, в любом случае, может меняться и ограничен физическими свойствами лекарства, удобством для пациента и для лица, осуществляющего уход за пациентом, и другими соответствующими обстоятельствами (Remington's Pharmaceutical Sciences, 18thEdition, Mack Publishing Co. (1990. Фармацевтические композиции получают способом, хорошо известным в фармацевтической области. Носитель или эксципиент может быть твердым, полутвердым или жидким веществом и может служить в качестве наполнителя или среды для активного ингредиента. Подходящие носители или эксципиенты хорошо известны из уровня техники. Фармацевтические композиции могут быть приспособлены для перорального, путем ингаляции, парентерального или местного применения, и их можно вводить пациенту в форме таблеток, капсул, аэрозолей, препаратов для ингаляции, суппозиториев, растворов,суспензий и т.п. Соединения настоящего изобретения можно вводить перорально, например, с инертным разбавителем, в виде капсул или спрессованными в таблетки. В целях перорального терапевтического применения,соединения можно включать в эксципиенты и применять в форме таблеток, драже, капсул, эликсиров,суспензий, сиропов, облаток, жвачек и т.п. Такие препараты предпочтительно содержат по меньшей мере 4% соединения настоящего изобретения в виде активного ингредиента, но это количество может варьироваться в зависимости от конкретной формы и удобно, когда оно составляет от 4 до около 70% от массы препарата. Количество присутствующего в композиции соединения должно быть таким, чтобы обеспечивать подходящую дозу. Предпочтительные композиции и препараты настоящего изобретения можно получить способами, хорошо известными специалистам. Таблетки, пилюли, капсулы, драже и т.п. также могут содержать один или несколько из следующих адъювантов: связующие, такие как повидон, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза или желатин; эксципиенты или разбавители, такие как крахмал, лактоза, микрокристаллическая целлюлоза или дикальцийфосфат, дезинтегранты, такие как кроскармелоза, кросповидон, натрийкрахмалгликолят, кукурузный крахмал и т.п.; лубриканты, такие как стеарат магния, стеариновая кислота,тальк или гидрированное растительное масло; глиданты, такие как коллоидный диоксид кремния; смачивающие вещества, такие как лаурилсульфат натрия и полисорбат 80; и подсластители, такие как сахароза, аспартам или сахарин, или могут быть добавлены отдушки, такие как перечная мята, метилсалицилат или апельсиновая отдушка. Когда дозированная единичная форма представляет собой капсулы, они могут содержать, в дополнение к перечисленному выше, жидкий носитель, такой как полиэтиленгликоль или жирное масло. Другие дозированные единичные формы могут содержать различные вещества, модифицирующие их физическую форму, например покрытие. Так, таблетки и пилюли могут быть покрыты сахаром, гидроксипропилметилцеллюлозой, полиметакрилатами или другими веществами для покрытий. Сиропы могут содержать, в дополнение к соединениям настоящего изобретения, сахарозу в качестве подсластителя и некоторые консерванты, красители и окрашивающие вещества и отдушки. Вещества,используемые для получения таких различных композиций, должны быть фармацевтически чистыми и нетоксичными в используемых количествах. Инъекции для парентерального введения включают стерильные водные или неводные растворы,суспензии и эмульсии. Водные растворы и суспензии могут включать дистиллированную воду для инъекций или физиологический солевой раствор. Неводные растворы и суспензии могут включать пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, спирт, такой как этанол или POLYSORBATE 80 (зарегистрированная торговая марка). Инъекции могут включать дополнительные ингредиенты, отличные от инертных разбавителей, например консерванты, смачивающие вещества,эмульгаторы, диспергирующие вещества, стабилизаторы (такие как лактоза), вспомогательные вещества,такие как вещества, способствующие растворению (например глутаминовая кислота или аспарагиновая кислота). Такие композиции можно стерилизовать, например, фильтрованием через удерживающий бактерии фильтр, включением в композиции стерилизующих веществ или путем облучения. Препараты для инъекций также можно получать в виде стерильных твердых композиций, которые можно растворять в стерильной воде или каком-либо другом(их) стерильном(ых) растворителе(ях) для инъекций непосредственно перед применением. Соединения формулы I, как правило, эффективны в широком диапазоне доз. Например, суточная доза обычно находится в пределах от около 10 до около 300 мг/кг массы тела. В некоторых случаях дозы ниже нижнего указанного предела могут быть более чем достаточными, тогда как в других случаях мо- 20006081 гут применяться значительно более высокие дозы, не вызывая при этом неблагоприятных побочных эффектов, и поэтому указанный выше диапазон доз не должен рассматриваться как каким-либо образом ограничивающий объем настоящего изобретения. Должно быть понятно, что действительное количество вводимого соединения определяет лечащий врач с учетом соответствующих обстоятельств, включая подлежащее лечению состояние, избранный путь введения, конкретное вводимое соединение или соединения, возраст, массу и ответную реакцию конкретного пациента, а также тяжесть симптомов у пациента. Ингибирование пролиферации HUVEC Эндотелиальные клетки пупочной вены человека (HUVEC; BioWhittaker/Clonetics, Walkersville,MD) поддерживали в среде для роста эндотелиальных клеток (EGM), содержащей основную среду(ЕВМ) с экстрактом мозга коровы, эпидермальный фактор роста человека, гидрокортизон, гентамицин,амфотерицин В и 2% фетальную телячью сыворотку, для анализа HUVEC (5x103) в ЕВМ (200 мкл) с 0,5% фетальной телячьей сывороткой добавляли в лунки 96-луночного планшета и инкубировали при 37 С в течение 24 ч в увлажненной среде 5% диоксида углерода/воздух. Испытываемые соединения серийно разводили в диметилсульфоксиде (ДМСО) в концентрациях от 0,0013 до 40 мкМ и добавляли в лунки в количестве 20 мкл. Затем в лунки добавляли фактор роста эндотелия сосудов человека (VEGF)(20 нг/мл в лунках; RD Systems, Minneapolis, MN), полученный из исходного раствора 100 мкг/мл в забуференном фосфатом нормальном физиологическом растворе, содержащем 0,1% бычий сывороточный альбумин. HUVEC инкубировали при 37 С в течение 72 ч в увлажненной среде 5% диоксида углерода/воздух. В лунки добавляли агент клеточной пролиферации WST-1 (20 мкл; Boehringer Mannheim,Indianapolis, IN) и планшеты возвращали в инкубатор на 1 ч. Измеряли поглощение в каждой лунке при 440 нм. Фракцию роста определяли, исходя из поглощения обработанных лунок с или без VEGF, деленного на поглощение, полученное для контрольных лунок, с установленным значением ноль или 1,0. Взятые в качестве примеров соединения испытывали в таком анализе, и все они показали ИК 501,0 мкМ. Ингибирование роста клеток карциномы толстой кишки НСТ 116 Клетки карциномы толстой кишки человека НСТ 116 выращивали в монослойной культуре в средеRPMI 1640, дополненной 10%-ной фетальной сывороткой теленка и 1%-ным пенициллинстрептомицином (GibcoBRL, Grand Island, NY). Клетки НСТ 116 в экспоненциальной фазе роста подвергали воздействию различных концентраций испытуемых соединений при 37 С в течение 72 ч в условиях 5% диоксида углерода/воздух. После воздействия средства клетки промывали 0,9% забуференным фосфатом физиологическим раствором. Ингибирование роста определяли при помощи агента клеточной пролиферации WST-1, как описано выше. Результаты выражали в виде фракции роста обработанных клеток в сравнении с контрольными культурами. Репрезентативные соединения настоящего изобретения испытывали на эффективность против опухолевых клеток толстой кишки человека НСТ 116. Данные этого эксперимента обобщены в табл. I. Таблица I. Опухолевые клетки толстой кишки человека НСТ 116 Традиционный анализ мышиной опухоли и ксенотрансплантата опухоли человека Ингибирование опухолей, трансплантированных мыши, представляет собой общепринятую методику для исследования эффективности противоопухолевых средств (Corbett, et al., In vivo Methods forGuide: Preclinical Screening, Clinical Trials, and Approval, B.Teicher (ed), Humana Press Inc., Totowa, NJ,Chapter 5, pages 75-99 (1997); (Corbett, et al., Int.J.Pharmacog., 33, Supplement, 102-122 (1995. Мышиные опухоли или ксенотрансплантаты человека имплантировали, по существу, как описано Corbett, et al., Invivo Methods for Screening and Preclinical Testing; Use of rodent solid tumors for drug discovery. Кратко,мышиную опухоль или ксенотрансплантат человека имплантировали подкожно, используя либо троакар имплантаты размера 12, либо рассчитанное количество клеток. Троакар вводили в месте, расположенном посередине между подмышечной и паховой областью бока мыши. Троакар вводили примерно на 3/4 дюйма подкожно в направлении подмышечной области до введения фрагмента опухоли, сжимая при этом кожу для удаления троакара. Альтернативно, клетки опухоли человека из культуры клеток (1 х 107),- 21006081 смешанные с равным объемом Martigel (Becton-Dickinson), имплантировали подкожно в заднюю ногу самцов и самок "голых" мышей (Charles River). Испытываемое соединение в носителе или только носитель вводили путем внутривенной болюсной инъекции (iv), интраперитонеальной инъекции (ip) или перорально (ро). Каждая группа обработки, также как и группа необработанных контрольных животных,состояла из восьми-десяти животных для каждого эксперимента. Ответную реакцию на подкожную опухоль отслеживали путем измерения объема опухоли, которое осуществляли дважды в неделю в течение всего курса эксперимента (60-120 дней). Массу тела брали в качестве общего измерения токсичности. Данные подкожной опухоли анализировали путем определения средней массы опухоли для каждой группы обработки в течение всего курса эксперимента и подсчитывая замедление роста опухоли в виде разницы в днях для обработки против контрольных опухолей до достижения объема либо 500, либо 1000 мм 3. Соединение примера 64 испытывали в двух разных лабораториях против различных мышиных и человеческих опухолей, по существу, как описано выше. Данные испытаний обобщены в табл. II. Параметры, измеряемые в каждом эксперименте, указаны ниже. Вес опухоли (мг) = (а х b2)/2, где а = длина опухоли (мм) и b = ширина опухоли (мм). Замедление роста опухоли = Т-С, где Т представляет среднее время (дни), необходимое для достижения предварительно установленного размера опухоли у группы обработки, а С представляет среднее время (дни), необходимое для достижения того же размера опухоли у контрольной группы. Таблица II. Карцинома толстой кишки человека НТ-29 После того, как можно было прощупывать опухоли, лекарственное средство вводили (iv) в течение 5 последовательных дней, делали перерыв на 2 дня, и затем соединение снова вводили (iv) в течение 5 последовательных дней. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR5 представляет собой галоген, C1-C6 алкил или C1-C4 алкокси; или его фармацевтически приемлемая основно-аддитивная соль. 2. Соединение по п.1, где R1 и R2 представляют собой независимо галоген или C1-C6 алкил. 3. Соединение по любому из пп.1 или 2, где R1 и R2, оба, представляют собой хлор или бром или R1 представляет собой метил и R2 представляет собой хлор. 4. Соединение по любому из пп.1-3, где X=Y- представляет собой- 22006081 6. Соединение по любому из пп.4 или 5, где R4 выбран из Н, хлора, брома, метила, этила, пропила,метилтио, СН 2 ОСН 3, метокси, циано, S-фенила и пиридинила. 7. Соединение по п.1, которое представляет собой N-[2,4-дихлорбензоил]-5-бромтиофен-2 сульфонамид или его фармацевтически приемлемую основно-аддитивную соль. 8. Соединение по п.1, которое представляет собой N-[4-хлор-2-метилбензоил]-5-хлортиофен-2 сульфонамид или его основно-аддитивную соль. 9. Соединение по любому из пп.1-8, где фармацевтически приемлемая основно-аддитивная соль представляет собой натриевую соль. 10. Соединение по п.1, которое представляет собой натриевую соль N-[2,4-дихлорбензоил]-5 бромтиофен-2-сульфонамида. 11. Фармацевтическая композиция, содержащая соединение формулы IR5 представляет собой галоген, C1-C6 алкил или C1-C4 алкокси; или его фармацевтически приемлемую основно-аддитивную соль в смеси с фармацевтически приемлемым носителем или эксципиентом. 12. Фармацевтическая композиция по п.11, содержащая N-[2,4-дихлорбензоил]-5-бромтиофен-2 сульфонамид или его фармацевтически приемлемую основно-аддитивную соль. 13. Фармацевтическая композиция по п.12, содержащая натриевую соль N-[2,4-дихлорбензоил]-5 бромтиофен-2-сульфонамида. 14. Применение соединения по любому из пп.1-10 в качестве фармацевтического средства. 15. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для использования при лечении чувствительных новообразований. 16. Применение по п.15, где чувствительное новообразование представляет собой опухоль толстой кишки или прямой кишки.
МПК / Метки
МПК: A61P 25/00, A61K 31/38, C07D 277/36
Метки: противоопухолевых, качестве, тиофен-и, средств, тиазолсульфонамиды
Код ссылки
<a href="https://eas.patents.su/24-6081-tiofen-i-tiazolsulfonamidy-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Тиофен-и тиазолсульфонамиды в качестве противоопухолевых средств</a>
Предыдущий патент: Замещенные в положении 6 индолиноны, их получение и их применение в качестве лекарственных средств
Следующий патент: Производные 3, 4-дигидро-1н-изохинолин-2-ила
Случайный патент: Способ мониторинга начала аномальных сейсмических процессов












