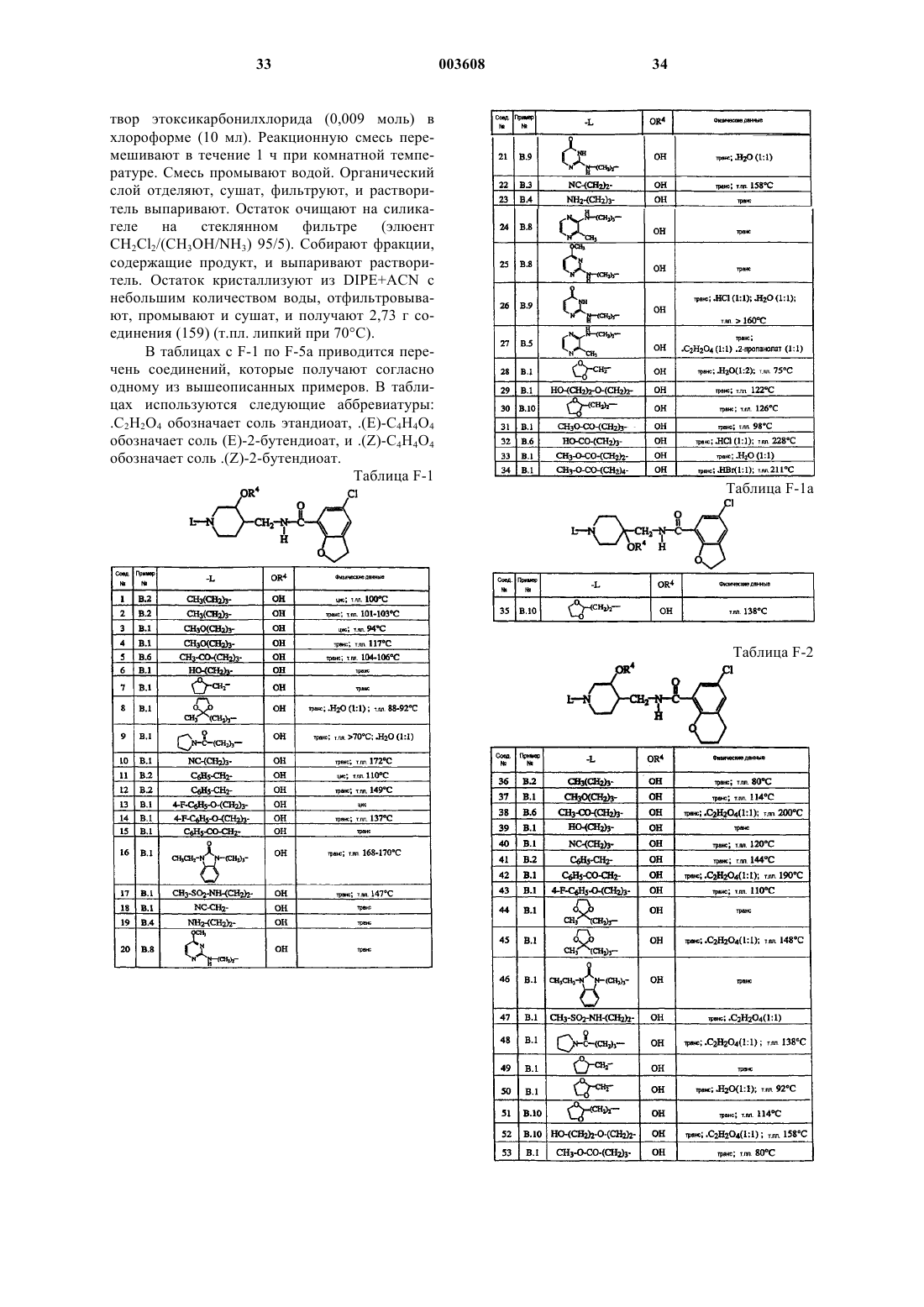
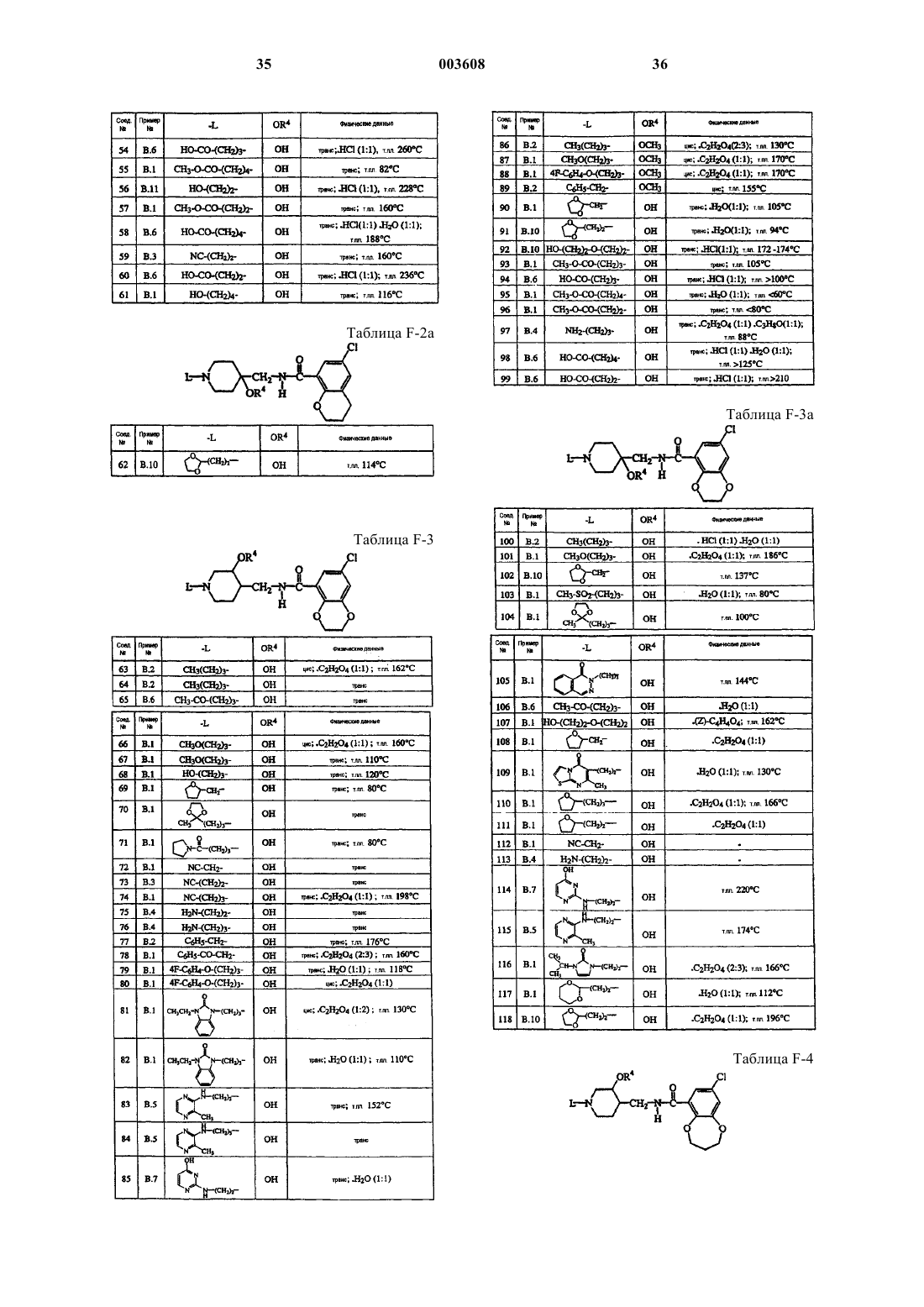
4-(аминометил)пиперидинбензамиды для лечения желудочно-кишечных расстройств
Номер патента: 3608
Опубликовано: 26.06.2003
Авторы: Гейсен Хенрикус Якобус Мария, Де Клейн Мишель Анна Йозеф, Мелеманс Анн Луиз Габриелль, Босманс Жан-Поль Рене Мари Андре
Формула / Реферат
1. Соединение формулы (I)
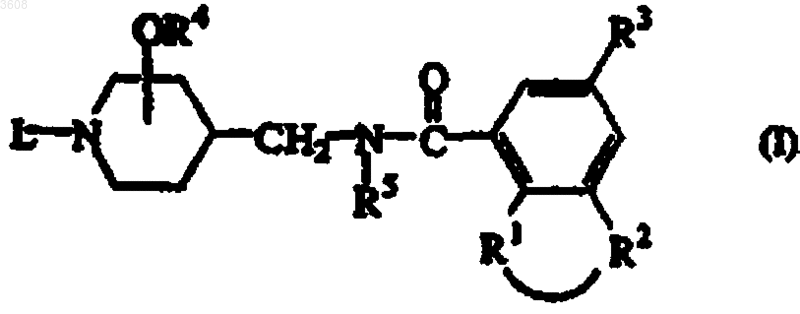
его стереохимически изомерная форма, его N-оксид, его пролекарство или его фармацевтически приемлемая аддитивная соль кислоты или основания,
где в указанной формуле
-R1-R2- представляет собой двухвалентный радикал формулы
| -O-CH2-O- | (a-1), |
| -O-CH 2-CH2- | (a-2), |
| -O-CH2-CH2-O- | (a-3), |
| -O-CH 2-CH2-CH2- | (a-4), |
| -O-CH 2-CH2-CH2-O- | (a-5), |
| -O-CH 2-CH2-CH2-CH2- | (a-6), |
| -O-CH2-CH2-CH2-CH2-O- | (a-7), |
| -O-CH2-CH2-CH2-CH2-CH2- | (a-8), |
где в указанном двухвалентном радикале один или два атома водорода у одного и того же или у разных атомов углерода необязательно могут быть заменены C1-6-алкилом или гидрокси, R3 представляет собой водород или галоген;
R4 представляет собой водород или C1-6-алкил;
R5 представляет собой водород или C1-6-алкил;
L представляет собой C3-6-циклоалкил, оксо-C5-6-циклоалкил или C2-6-алкенил,
или L представляет собой радикал формулы
| -Alk-R6 | (b-1), |
| -Alk-X-R7 | (b-2), |
| -Alk-Y-C(=O)-R9 | (b-3) |
или
| -Alk-Y-C(=O)-NR11R12 | (b-4), |
где каждый Alk представляет собой C1-12-алкандиил; и
R6 представляет собой водород, циано, амино, C1-6-алкилсульфониламино, C3-6-циклоалкил, оксо-C5-6-циклоалкил, арил или Het1;
R7 представляет собой водород, C1-6-алкил, гидрокси-C1-6-алкил, C3-6-циклоалкил, арил или Het2;
X представляет собой O, S, SO2 или NR8; причем указанный R8 представляет собой водород или C1-6-алкил;
R9 представляет собой водород, C1-6-алкил, C3-6-циклоалкил, C1-6-алкилокси, гидрокси или арил;
Y представляет собой прямую связь, NR10, O, S, -O-(CH2)n-, -S-(CH2)n- или -NR10-(CH2)n-, где n равен целому числу от 1 до 6, и R10 представляет собой водород или C1-6-алкил;
R11 и R12, каждый независимо, представляют собой водород, C1-6-алкил, C3-6-циклоалкил, или R11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пирролидинильное или пиперидинильное кольцо, причем оба они, необязательно, замещены C1-6-алкилом, амино или моно- или ди(C1-6-алкил)амино, или указанные R11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба они, необязательно, замещены C1-6-алкилом; и
каждый арил представляет незамещенный фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6-алкила, C1-6-алкилокси, аминосульфонила, C1-6-алкилкарбонила, нитро, трифторметила, амино или аминокарбонила; и
Het1 и Het2, каждый независимо, выбраны из фурана; фурана, замещенного C1-6-алкилом или галогеном;
тетрагидрофурана; тетрагидрофурана, замещенного C1-6-алкилом; диоксолана; диоксолана, замещенного C1-6-алкилом; диоксана; диоксана, замещенного C1-6-алкилом; тетрагидропирана; тетрагидропирана, замещенного C1-6-алкилом; пирролидинила; пирролидинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано или C1-6-алкила; пиридинила; пиридинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6-алкила; пиримидинила; пиримидинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6-алкила, C1-6-алкилокси, амино и моно- и ди(C1-6-алкил)амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6-алкилокси, C1-6-алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6-алкила, C1-6-алкилокси, амино, моно- и ди(C1-6-алкил)амино и C1-6-алкилоксикарбонила;
Het1 также может представлять собой радикал формулы
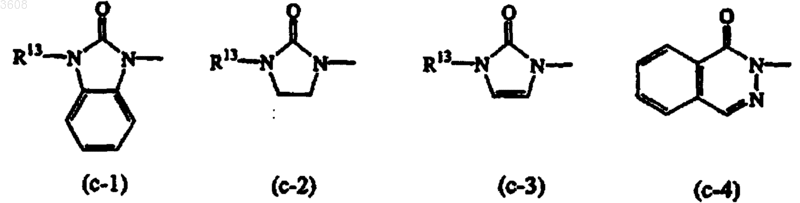
Het1 и Het2, каждый независимо, также могут быть выбраны из радикалов формул
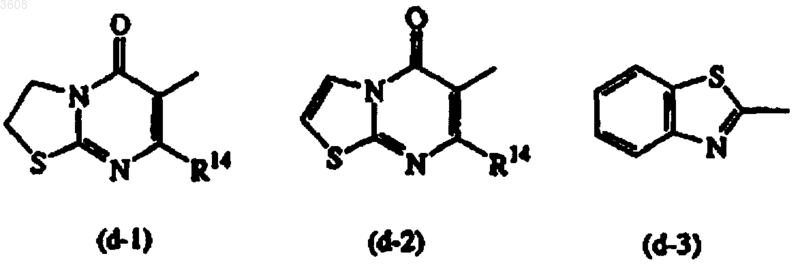
R13 и R14, каждый независимо, представляют собой водород или C1-4-алкил.
2. Соединение по п.1, где радикал -OR4 находится в положении 3 пиперидиновой группы, имеющей трансконфигурацию .
3. Соединение по п.1, где радикал -OR4 находится в положении 4 пиперидиновой группы.
4. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-3.
5. Способ получения фармацевтической композиции по п.4, где терапевтически активное количество соединения по любому из пп.1-3 тщательно смешивают с фармацевтически приемлемым носителем.
6. Применение соединения по любому из пп.1-3 в качестве лечебного средства.
7. Соединение формулы (III)
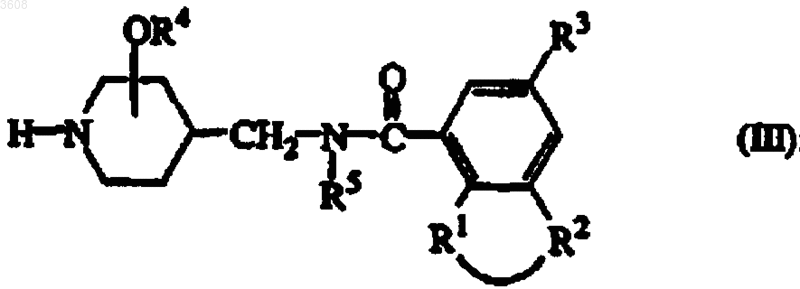
его фармацевтически приемлемая аддитивная соль кислоты или его стереохимически изомерная форма, где R1, R2, R3, R4 и R5 имеют значения, указанные в п.1.
8. Способ получения соединения формулы (I), заключающийся в том, что промежуточное соединение формулы (II) N-алкилируют промежуточным соединением формулы (III) в растворителе, инертном по отношению к реакции, и, необязательно, в присутствии подходящего основания
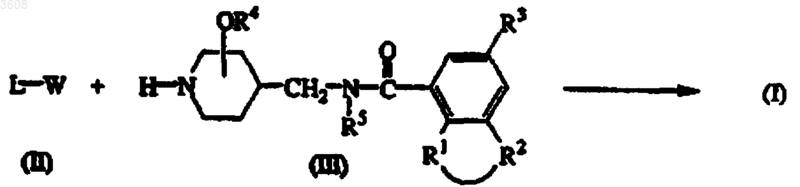
где L, R1, R2, R3, R4 и R5 имеют значения, указанные в п.1, и
W представляет собой подходящую удаляемую группу,
с последующшь, если необходимо, преобразованием одного соединения формулы (I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы.
9. Способ получения соединения формулы (I), заключающийся в том, что соответствующий промежуточный кетон или альдегид формулы L'=O (IV), причем указанный L'=O представляет собой соединение формулы L-H, где два геминальных атома водорода в C1-12-алкандиильной группе заменены на =O, подвергают взаимодействию с промежуточным соединением формулы (III)
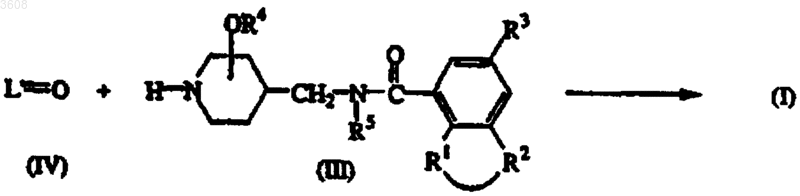
где L, R1, R2, R3, R4 и R5 имеют значения, указанные в п.1, с последующим, если необходимо, преобразованием одного соединения формулы (I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы.
10. Способ получения соединения формулы (I), заключающийся в том, что промежуточное соединение формулы (V) подвергают взаимодействию с карбоновой кислотой формулы (VI) или ее реакционноспособным функциональным производным
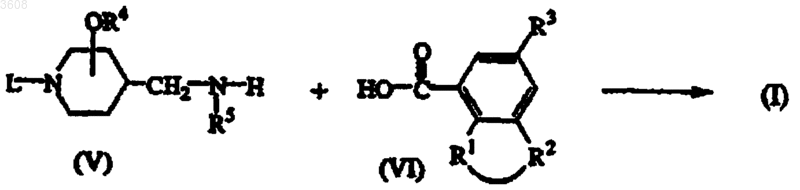
где L, R1, R2, R3, R4 и R5 имеют значения, указанные в п.1, с последующим, если необходимо, преобразованием одного соединения формулы (I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы.
11. Способ получения соединения формулы (I), заключающийся в том, что промежуточное соединение формулы (VII), где X представляет собой бром или йод, карбонилируют в присутствии промежуточного соединения формулы (V) в инертном по отношению к реакции растворителе в присутствии подходящего катализатора и третичного амина при температуре в интервале от комнатной температуры до температуры кипения реакционной смеси
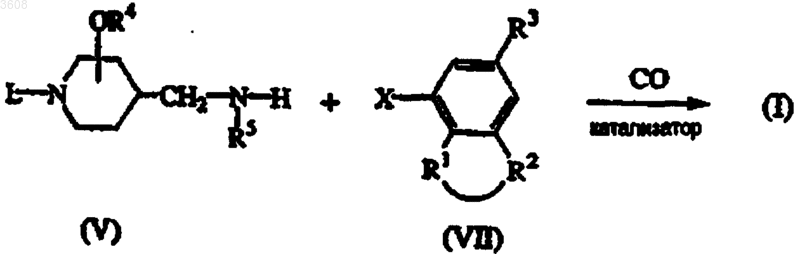
где L, R1, R2, R3, R4 и R5 имеют значения, указанные в п.1, с последующим, если необходимо, преобразованием одного соединения формулы (I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы.
12. Способ получения соединения формулы (III), заключающийся в том, что промежуточное соединение формулы (VIII), где PG представляет подходящую защитную группу, подвергают взаимодействию с кислотой формулы (VI) или ее подходящим реакционноспособным функциональным производным в растворителе, инертном по отношению к реакции, с последующим отщеплением защитной группы PG с образованием соединений формулы (III)
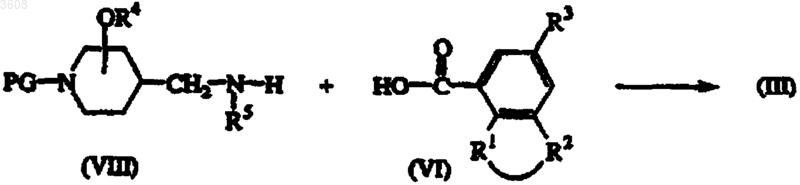
где L, R1, R2, R3, R4 и R5 имеют значения, указанные в п.1, с последующим, если необходимо, преобразованием одного соединения формулы (I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы.
13. Соединение формулы (XXXIV)
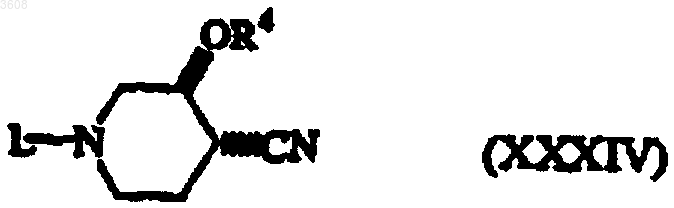
где L и R4 имеют значения, указанные в п.1.
Текст
1 Настоящее изобретение относится к новым соединениям формулы (I), обладающим благоприятными для желудочно-кишечного тракта свойствами. Изобретение также относится к способам получения таких новых соединений,фармацевтическим композициям, содержащим указанные новые соединения, а также к применению указанных соединений в качестве лечебных средств. В WO 93/05038, опубликованной 18 марта 1993 (SmithKline Beecham PLC), описывается ряд замещенных 4-пиперидинилметил-8-амино 7-хлор-1,4-бензодиоксан-5-карбоксамидов, обладающих антагонистической активностью в отношении 5 НТ 4-рецепторов. В WO 94/10714, опубликованной 11 мая 1994 (SmithKline Beecham PLC), описывается ряд замещенных 4-пиридинилметилоксазино[3,2-а]индолкарбоксамидов, обладающих антагонистической активностью в отношении 5 НТ 4 рецепторов. В WO 93/16072, опубликованной 19 августа 1993, описывается N-[(1-бутил-4-пиперидинил)метил]-6-хлор-3,4-дигидро-2 Н-1-бензопиран-8-карбоксамид, обладающий антагонистической активностью в отношении 5 НТ 4 рецепторов. Соединения настоящего изобретения отличаются по строению от указанных известных в технике соединений наличием гидрокси- или C1-6 алкоксигруппы в положении 3 или 4 пиперидиновой группы, наличием метиленовой группы между карбамоильной группой и пиперидиновым кольцом и отсутствием аминогруппы в положении 4 бензамидной группы. Неожиданно оказалось, что соединения формулы (I) обладают свойствами, благоприятными для желудочно-кишечного тракта. Настоящее изобретение относится к соединению формулы (I) его стереохимически изомерной форме, его Nоксиду, его пролекарству или его фармацевтически приемлемой аддитивной соли кислоты или основания,где в указанной формуле-R1-R2- представляет собой двухвалентный радикал формулы-О-СН 2-О(а-1),-O-СН 2-СН 2(а-2),-O-СН 2-СН 2-O(а-3),-O-СН 2-СН 2-СН 2(а-4),-O-СН 2-СН 2-СН 2-O(а-5),-O-СН 2-СН 2-СН 2-СН 2(а-6),-O-СН 2-СН 2-СН 2-СН 2-O(а-7),-O-СН 2-СН 2-СН 2-СН 2-СН 2(а-8),где в указанном двухвалентном радикале, необязательно, один или два атома водорода у 2 одного и того же или у разных атомов углерода могут быть заменены C1-6-алкилом или гидрокси,R3 представляет собой водород или галоген;R4 представляет собой водород или C1-6 алкил;R5 представляет собой водород или C1-6 алкил;L представляет собой С 3-6-циклоалкил, оксо-С 5-6-циклоалкил или С 2-6-алкенил, или L представляет собой радикал формулыHet2; Х представляет собой О, S, SO2 или NR8; причем указанный R8 представляет собой водород или C1-6-алкил;Y представляет собой прямую связь, NR10,О, S, O-(СН 2)n-, S-(CH2)n- или NR10-(CH2)n-, где n равен целому числу от 1 до 6, и R10 представляет собой водород или C1-6-алкил;R11 и R12, каждый независимо, представляют собой водород,C1-6-алкил,С 3-6 циклоалкил, или R11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12,могут образовывать пирролидинильное или пиперидинильное кольцо, причем оба они, необязательно, замещены C1-6-алкилом, амино или моно- или ди(С 1-6-алкил)амино, или указанныеR11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба они, необязательно, замещены C1-6-алкилом и каждый арил представляет незамещенный фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых выбирают независимо среди галогена, гидрокси, C1-6-алкила,C1-6-алкилокси, аминосульфонила, C1-6-алкилкарбонила, нитро, трифторметила, амино или аминокарбонила и Het1 и Het2, каждый, независимо, выбирают среди фурана; фурана, замещенного C1-6-алкилом или галогеном; тетрагидрофурана; тетрагидрофурана,замещенногоC1-6-алкилом; тетрагидропирана; тетрагидропи 3 рана, замещенного C1-6-алкилом; пирролидинила; пирролидинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо, среди галогена, гидрокси,циано или C1-6-алкила; пиридинила; пиридинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо,среди галогена, гидрокси, циано, C1-6-алкила; пиримидинила; пиримидинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо, среди галогена,гидрокси, циано, C1-6-алкила, C1-6-алкилокси,амино и моно- и ди(С 1-6-алкил)амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо, среди гидрокси, C1-6 алкилокси, C1-6-алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых выбирают,независимо, среди галогена, гидрокси, циано,C1-6-алкила, C1-6-алкилокси, амино, моно- и ди(С 1-6-алкил)амино и C1-6-алкилоксикарбонила;Het1 также может представлять собой радикал формулыHet1 и Het2, каждый независимо, также можно выбрать среди радикалов формулR13 и R14, каждый независимо, представляют собой водород или C1-4-алкил. Используемый здесь в приведенных выше определениях термин "галоген" является общим для фтора, хлора, брома и йода; "C1-4-алкил" обозначает углеводородный радикал с линейной или разветвленной цепью с 1-4 атомами углерода, такой как, например, метил, этил, пропил,бутил, 1-метилэтил, 2-метилпропил и т.п.; "C1-6 алкил" включает C1-4-алкил и его высшие гомологи с 5 или 6 атомами углерода, такие как, например, 2-метилбутил, пентил, гексил и т.п.; термин "С 3-6-циклоалкил" является общим для циклопропила, циклобутила, циклопентила и циклогексила; "С 2-6-алкенил" определяет ненасыщенные углеводородные радикалы с линейной или разветвленной цепью с 2-6 атомами углерода, такие как этенил, пропенил, бутенил,пентенил или гексенил; "C1-12-алкандиил" определяет двухвалентные углеводородные радикалы с линейной или разветвленной цепью, содержащие 1-12 атомов углерода, такие как, например, 1,2-этандиил, 1,3-пропандиил, 1,4 бутандиил, 1,5-пентандиил, 1,6-гександиил, 1,7 003608 4 гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10 декандиил, 1,11-ундекандиил, 1,12-додекандиил и их разветвленные изомеры. Термин "C1-6 алкандиил" определяется аналогично C1-12 алкандиилу. Радикал -OR4, предпочтительно, располагается в положении 3 или 4 пиперидиновой группы. Термин "стереохимически изомерные формы", используемый здесь, определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если нет других указаний, химическое обозначение соединений относится к смеси всех стереохимически возможных изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Конкретнее, центры стереозомерии могут иметь Rили S-конфигурацию; заместители двухвалентных циклических (частично) насыщенных радикалов могут иметь цис- или трансконфигурацию. Соединения, содержащие двойные связи, стереохимически могут быть Е или Z относительно указанной двойной связи. Очевидно, подразумевается, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Термин "пролекарство", используемый в данном тексте, обозначает фармакологически приемлемые производные, например, сложные эфиры или амиды, такие что продукт, образовавшийся в результате биотрансформации указанного производного, является активным лекарственным средством, как при определении соединений формулы (I). Работа Goodman andGilman (The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p.13-15), где дается общее описание пролекарственных средств, включена в настоящее описание в качестве ссылки. К фармацевтически приемлемым аддитивным солям кислот и оснований, упомянутым выше, относятся терапевтически активные нетоксичные формы аддитивных солей кислот и оснований, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые аддитивные соли кислот можно, как правило, получить путем обработки формы основания подходящей кислотой. К подходящим кислотам относятся, например, неорганические кислоты,такие как галогеноводородные кислоты, например хлороводородная или бромоводородная кислота, серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как,например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая(т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая,яблочная, винная, лимонная, метансульфоновая,этансульфоновая,бензолсульфоновая,птолуолсульфоновая, цикламовая, салициловая, 5 п-аминосалициловая, памовая и подобные кислоты. И наоборот, указанные солевые формы обработкой подходящим основанием можно превратить в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, также можно превратить в их нетоксичные аддитивные соли металлов или аминов путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы аддитивных солей оснований включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например, литиевые, натриевые, калиевые, магниевые, кальциевые соли, и подобные соли, соли органических оснований, например, соли бензатина, N-метил-D-глюкамина, гидрабамина,и соли аминокислот, таких как, например, аргинин, лизин и т.п. Термин "аддитивная соль", используемый выше, также охватывает сольваты, которые соединения формулы (I), а также их соли, могут образовывать. Такими сольватами являются,например, гидраты, алкоголяты и т.п. Некоторые соединения формулы (I) могут также существовать в своей таутомерной форме. Подразумевается, что такие формы, хотя они точно не указываются в приведенной выше формуле, входят в объем настоящего изобретения. Например, когда ароматическое гетероциклическое кольцо замещено гидрокси, основным таутомером может быть кетоформа. Формы N-оксидов соединений формулы(I), которые можно получить способами, известными в технике, включают соединения формулы (I), в которых один или несколько атомов азота окислены до N-оксида. В частности, к таким N-оксидам относятся соединения,где окислен азот пиперидина. Первую группу соединений, представляющих интерес, составляют соединения формулы (I), их стереоизомерные формы, их Nоксиды или их фармацевтически приемлемые аддитивные соли кислот или оснований, где-R1-R2- представляет собой двухвалентный радикал формулы-O-CH2-O(а-1),-O-СН 2-СН 2(а-2),-O-СН 2-СН 2-O(а-3),-O-СН 2-СН 2-СН 2(а-4),-O-СН 2-СН 2-СН 2-O(а-5),-O-СН 2-СН 2-СН 2-СН 2(а-6),-O-СН 2-СН 2-СН 2-СН 2-O(а-7),-O-СН 2-СН 2-СН 2-СН 2-СН 2(а-8),где в указанном двухвалентном радикале, необязательно, один или два атома водорода у одного и того же или у разных атомов углерода могут быть заменены C1-6-алкилом или гидрокси,R3 представляет собой водород или галоген;R4 представляет собой водород или C1-6 алкил;R5 представляет собой водород или C1-6 алкил;L представляет собой С 3-6-циклоалкил, оксо-С 5-6-циклоалкил или С 2-6-алкенил, или L представляет собой радикал формулыHet2; Х представляет собой О, S, SО 2 или NR8; причем указанный R3 представляет собой водород или C1-6-алкил;Y представляет собой прямую связь илиNR10; причем указанный R10 представляет собой водород или C1-6-алкил;R11 и R12, каждый независимо, представляют собой водород,C1-6-алкил,С 3-6 циклоалкил, или R11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12,могут образовывать пирролидинильное или пиперидинильное кольцо, причем оба они, необязательно, замещены C1-6-алкилом, амино или моно- или ди(С 1-6-алкил)амино, или указанныеR11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба они, необязательно, замещены C1-6-алкилом и каждый арил представляет незамещенный фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых выбирают независимо среди галогена, гидрокси, C1-6-алкила,C1-6-алкилокси,аминосульфонила,C1-6 алкилкарбонила, нитро, трифторметила, амино или аминокарбонила; и Het1 и Het2, каждый,независимо, выбирают среди фурана; фурана,замещенного C1-6-алкилом или галогеном; тетрагидрофурана; тетрагидрофурана,замещенногоC1-6-алкилом; тетрагидропирана; тетрагидропирана, замещенного C1-6-алкилом; пирролидинила; пирролидинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо, среди галогена, гидрокси,циано или C1-6-алкила; пиридинила; пиридинила, замещенного одним или двумя заместителя 7 ми, каждый из которых выбирают, независимо,среди галогена, гидрокси, циано, C1-6-алкила; пиримидинила; пиримидинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо, среди галогена,гидрокси, циано, C1-6-алкила, C1-6-алкилокси,амино и моно- и ди(С 1-6-алкил)амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых выбирают, независимо, среди гидрокси, C1-6 алкилокси, C1-6-алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых выбирают,независимо, среди галогена, гидрокси, циано,C1-6-алкила, C1-6-алкилокси, амино, моно- и ди(С 1-6-алкил)амино и C1-6-алкилоксикарбонила;Het1 также может представлять собой радикал формулыHet1 и Het2, каждый независимо, также можно выбрать среди радикалов формулR13 и R14, каждый, независимо, представляют собой водород или C1-4-алкил. Другая группа соединений, представляющих интерес, состоит из соединений формулы(I), где используются одно или несколько следующих ограничений:a) -R1-R2- представляет собой радикал формулы (а-1), (а-2), (а-3), (а-4), (а-5), (а-6) или(а-7), где, необязательно, один или два атома водорода замещены C1-4-алкилом;d) R5 представляет собой водород. Более интересными соединениями являются соединения формулы (I), где двухвалентный радикал -R1-R2- имеет формулу (а-2) или (а-4),при этом в указанных двухвалентных радикалах, необязательно, один или два атома водорода у одного и того же или у разных атомов углерода заменены на метил. Другими более интересными соединениями являются соединения формулы (I), где двухвалентный радикал -R1-R2- имеет формулу (а-3),(а-5) или (а-7), при этом в указанных двухвалентных радикалах, необязательно, один или два атома водорода у одного и того же или у разных атомов углерода заменены на метил. 8 Другими более интересными соединениями также являются соединения формулы (I), гдеR4 представляет собой водород или метил. Специальными соединениями являются соединения формулы (I), где радикал L представляет собой -Alk-R6 (b-1), где R6 представляет собой водород, циано или Het1, и Het1 представляет собой фуран; фуран, замещенный C1-6 алкилом или галогеном; тетрагидрофуран; тетрагидрофуран, замещенный C1-6-алкилом; диоксолан; диоксолан, замещенный C1-6-алкилом; диоксан; диоксан, замещенный C1-6-алкилом; тетрагидропиран; тетрагидропиран, замещенный C1-6-алкилом. Другими специальными соединениями являются соединения формулы (I), где радикал L представляет собой -Alk-X-R7 (b-2), где Х представляет собой О, и R7 представляет собой водород, C1-6-алкил или гидрокси-С 1-4-алкил. Специальными соединениями также являются соединения формулы (I), где радикал L представляет собой -Alk-Y-C(=O)-R9 (b-3), где Y представляет собой прямую связь, и R9 представляет собой C1-6-алкил, C1-6-алкилокси или гидрокси. Особыми соединениями являются более интересные соединения формулы (I), где радикал -OR4, представляющий, предпочтительно,гидрокси, находится в положении 3 пиперидиновой группы, имеющей транс-конфигурацию,т.е. радикал -OR4 находится в трансположении относительно метилена у пиперидиновой группы. Другими особыми соединениями являются более интересные соединения, где радикал -OR4 находится в положении 4 пиперидиновой группы. Предпочтительными соединениями являются соединения формулы (I), где двухвалентный радикал -R1-R2- представляет собой радикал формулы (а-3) или (а-5), радикал -OR4 находится в положении 3 пиперидиновой группы,имеющей транс-конфигурацию, и L представляет собой радикал формулы -Alk-Y-C(=O)-R9 (b3), где Y представляет собой прямую связь, и R9 представляет собой C1-6-алкилокси или гидрокси. Соединения настоящего изобретения, как правило, можно получить N-алкилированием промежуточного соединения формулы (III) промежуточным соединением формулы (II), гдеW представляет собой подходящую отщепляемую группу, такую как, например, галоген, например, фтор, бром, йод, или в некоторых случаях W также может представлять собой сульфонилоксигруппу, например, метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси, и подобные реакционноспособные отщепляемые группы. Взаимодействие можно осуществить в растворителе, инертном по отношению к реакции, таком как, например,ацетонитрил, и, необязательно, в присутствии 9 подходящего основания, такого как, например,карбонат натрия, карбонат калия или триэтиламин. Перемешивание может увеличить скорость реакции. Взаимодействие можно удобно осуществить при температуре в интервале от комнатной температуры до температуры кипения реакционной смеси. С другой стороны, соединения формулы (I) также можно получить посредством восстановительного N-алкилирования промежуточного соединения формулы (III) промежуточным соединением формулы L'=O (IV), где L'=O представляет производное соединения формулы L-H,где два геминальных атома водорода заменены на кислород, согласно известному в технике методу восстановительного N-алкилирования.Nалкилирование можно осуществить в растворителе, инертном к реакции, таком как, например,дихлорметан, этанол, толуол или их смесь, и в присутствии восстановителя, такого как, например, борогидрид, например, борогидрид натрия,цианоборогидрид натрия или триацетоксиборогидрид натрия. Также может быть удобным применение в качестве восстановителя водорода в сочетании с подходящим катализатором, таким как, например, палладий-на-угле или платина-на-угле. В случае, когда в качестве восстановителя используют водород, может быть выгодным добавление к реакционной смеси дегидратирующего агента, такого как, например,трет-бутоксид алюминия. Для того, чтобы также предотвратить нежелательное гидрирование некоторых функциональных групп в реагентах и продуктах восстановления, также может быть выгодным добавление к реакционной смеси подходящего каталитического яда, например,тиофена или хинолин-серы. Для того, чтобы увеличить скорость реакции, можно повышать температуру в интервале от комнатной температуры до температуры кипения реакционной смеси, и, необязательно, можно повышать давление водорода. Соединения формулы (I) можно получить при взаимодействии промежуточного соединения формулы (V) с производным карбоновой кислоты формулы (VI) или его реакционноспособным функциональным производным, таким как, например, карбонилимидазольные производные или смешанные ангидриды. Образование указанной амидной связи можно осуществить, перемешивая реагенты в подходящем растворителе, необязательно, в присутствии осно 003608 10 вания, такого как имидазолид натрия или триэтиламин. Соединения формулы (I) также можно получить карбонилированием промежуточного соединения формулы (VII), где Х представляет собой бром или йод, в присутствии промежуточного соединения формулы (V). Указанную реакцию карбонилирования можно осуществить в растворителе, инертном в отношении реакции, таком как, например, ацетонитрил или тетрагидрофуран, в присутствии подходящего катализатора и подходящего основания, такого как третичный амин, например,триэтиламина, и при температуре в интервале от комнатной температуры до температуры кипения реакционной смеси. Подходящими катализаторами являются, например, палладийтрифенилфосфиновые комплексы. Монооксид углерода вводят при атмосферном давлении или при повышенном давлении. Аналогичные реакции карбонилирования описаны в главе 8 "Palladium reagents in organic syntheses", AcademicHeck; и в ссылках, цитированных в указанной работе. Соединения формулы (I) также можно получить путем превращения соединений формулы (I) друг в друга согласно известным в технике реакциям превращения групп. Например, в соединениях формулы (I), где L представляет собой радикал формулы -Alk-R6, и R6 представляет собой циано, указанный циано можно превратить в амино с использованием известных в технике методов гидрирования, таких как, например, гидрирование с использованием никеля Ренея в качестве катализатора. Исходные вещества и некоторые промежуточные соединения являются известными соединениями и доступны коммерчески, или их можно легко получить в соответствии с обычными реакционными процедурами, как правило,известными в технике. Например, ряд промежуточных соединений формулы (VI) можно получить в соответствии с известными в технике методологиями, описанными в ЕР-0389037. Промежуточное соединение формулы (III) можно получить взаимодействием промежуточного соединения формулы (VIII), где PG представляет подходящую защитную группу, такую как, например, трет-бутоксикарбонильная или бензильная группа, или фотохимически удаляемая группа, с кислотой формулы (VI) или ее 11 подходящим реакционноспособным функциональным производным, таким как, например,карбонилимидазольные производные, и последующим отщеплением защитной группы от полученного таким образом промежуточного соединения, т.е., удалением PG способами, известными в технике. Промежуточное соединение формулы (V) можно получить взаимодействием промежуточного соединения формулы (X) с промежуточным соединением формулы (II). Указанное промежуточное соединение формулы (X) можно получить отщеплением защитной группы от промежуточного соединения формулы (VIII). В некоторых случаях может подойти защита функциональной аминогруппы, содержащей радикал R5, в формулах в приведенной выше реакции. Защитные группы для функциональной аминогруппы известны в технике. Затем в процессе дальнейшего синтеза указанные защитные группы можно удалить в подходящий момент. Промежуточные соединения формулы(VIII-a), представляющие собой промежуточные соединения формулы (VIII), где PG1 является защитной группой, которую нельзя удалить гидрированием, такую как, например, третбутоксикарбонил, можно получить согласно схеме 1. Схема 1 По схеме 1 промежуточное соединение формулы (ХI-а) превращают в промежуточное соединение формулы (XII), где W1 представляет собой отщепляемую группу, такую как галоген или сульфонилокси. Затем промежуточное соединение (XII) обрабатывают промежуточным соединением формулы (XIII), где PG2 представляет собой защитную группу, которую можно удалить гидрированием, такую как, например,бензил. Удаление защитной группы PG2 из промежуточного соединения (XIV) дает промежуточные соединения формулы (VIII-a). Промежуточные соединения формулы(VIII-a-1), определяемые как промежуточные соединения формулы (VIII-a), где R4 представляет собой метил, можно получить так, как описано на схеме 2. По схеме 2 промежуточное соединение формулы (ХI-а), где R4a представляет собой водород, превращают в промежуточное соединение формулы (XII-1), где W2 представляет собой подходящую отщепляемую группу, такую как,например, тозилатная группа. Затем вторичный гидрокси промежуточного соединения (XII-1),т.е. группу -OR4a, превращают в метокси с использованием подходящих условий метилирования, таких как, например, обработка гидридом натрия в тетрагидрофуране и добавление метилйодида. Конверсию промежуточного соединения (XX) в промежуточное соединение (VIIIa-1) можно осуществить с использованием реакционных процедур, известных в технике. В одном из своих аспектов настоящее изобретение относится к новым соединениям формулы (IX), где R15 и R16 выбирают, каждый, независимо, из водорода или защитной группыPG, и R4 и R5 имеют значения, указанные выше. Подходящими защитными группами PG являются, например, C1-4-алкилкарбонил, C1-4 алкилоксикарбонил, тригалогенметилкарбонил,дифенилметил, трифенилметил или арилметил,где арил представляет собой фенил, необязательно замещенный заместителями числом до двух, выбранными среди C1-4-алкилокси или галогена. Указанные новые соединения формулы (IX) включают промежуточные соединения формул (VIII), (X) и (XIV). Промежуточные соединения формулы (ХIа), где PG1 представляет собой защитную группу, которую нельзя удалить гидрированием,такую как, например, трет-бутоксикарбонил,можно превратить в промежуточные соединения формулы (XI-b), где PG2 представляет собой защитную группу, которую можно удалить гидрированием, такую как, например, бензил, с использованием соответствующей последовательности реакций удаления-введения защитной группы. И наоборот, промежуточные соединения формулы (XI-b) также можно превратить в промежуточные соединения формулы (XI-a). 13 Промежуточное соединение формулы (XIb), где группа -OR4 располагается в положении 3 пиперидиновой группы, R4 представляет собой водород, и где PG2 представляет собой бензильную группу, и имеющее транс-конфигурацию,известно из J. Med. Chem., 16, pp. 156-159(1973). В указанной статье также описывается имеющее транс-конфигурацию промежуточное соединение формулы (XIX), где группа -OR4 располагается в положении 3 пиперидиновой группы, и R4 представляет собой водород. Промежуточные соединения формулы (XI1-a) определяются как промежуточные соединения формулы (XI-a), где группа -OR4 располагается в положении 3 пиперидиновой группы. Такие промежуточные соединения формулы (XI-1-a), где R4 представляет собой C1-6 алкил, и которые имеют цис-конфигурацию,можно получить гидрированием промежуточного соединения формулы (XVI) согласно способам, известным в технике. Промежуточное соединение (XVI), где PG1 и PG2 имеют указанные выше значения, можно получить взаимодействием пиперидона с защитной группой формулы[(арил)3 Р-СH2-О-РG2]+-галогенид- в условиях,подходящих для осуществления реакции типа реакции Виттига. Последующее удаление PG2 дает промежуточное соединение формулы (XI1-a), имеющее цис-конфигурацию. Найден способ получения промежуточного соединения формулы (XI-1-b), имеющего трансконфигурацию. При указанном новом способе получения исходят из промежуточного соединения формулы (XI-1-b), имеющего цисконфигурацию, или из промежуточного соединения формулы (XVII), имеющего цисконфигурацию. В указанных промежуточных соединениях формул (XI-1-b) и (XVII) PG2 имеет значения, указанные выше, и R4a представляет собой водород, C1-6-алкил или защитную группу, такую как, например, бензил, третбутоксикарбонил и т.п. Указанную инверсию осуществляют в подходящем растворителе, таком как, например,простой эфир, например, в тетрагидрофуране, в 14 присутствии СuО.Сr2 О 3, в атмосфере водорода и в присутствии подходящего основания, такого как, например, оксид кальция. Предпочтительные давление водорода и температура реакции зависят от исходного вещества. Если исходят из цис-(XI-1-b), давление водорода, предпочтительно, колеблется от 900 до 2000 кПа (измеренное при комнатной температуре), а температура реакции колеблется от комнатной температуры до 200 С, предпочтительно, температура реакции составляет примерно 120 С. Когда исходят из цис-(XVII), предпочтительное давление водорода составляет от 1500 до 2200 кПа, предпочтительно от 1800 до 2000 кПа. Температура реакции составляет от 100 до 200 С, предпочтительно примерно 125 С. Повидимому, равновесие достигается, как правило,с соотношением диастереомеров примерно 65:35 (транс:цис), что определяют методом газовой хроматографии. Однако, нужный трансизомер можно выделить в чистом виде через перекристаллизацию. Подходящим растворителем для перекристаллизации является простой эфир, например, диизопропиловый эфир. Чистое промежуточное соединение формулы транс-(XI-1-b),имеющее трансконфигурацию, также можно получить методами хроматографии, такими как, например, гравитационная хроматография или (В)ЭЖХ, исходя из цис/транс-смеси промежуточного соединения (XI-1-b). Промежуточные соединения формулы(XXXV), где PG2 имеет значения, указанные выше, и Х представляет собой ОН, NH-PG, NH2,можно получить путем взаимодействия промежуточного соединения формулы (XVIII) с бораном или производным борана. Сам боран доступен коммерчески, например, в виде борантетрагидрофуранового комплекса. Производные борана, в особенности, хиральные производные борана, также доступны коммерчески. Взаимодействие с бораном осуществляют в растворителе, инертном для реакции, предпочтительно в простом эфире, например в тетрагидрофуране. Во время добавления борана или производного борана реакционную смесь выдерживают при температуре ниже 0 С, особенно интересно при температуре ниже -30 С. После добавления к реакционной смеси борана или производного борана смесь греют, и в это же время продолжают перемешивание. Смесь перемешивают в течение нескольких часов. Затем добавляют гидроксид, например гидроксид натрия, а также пероксид, например пероксид водорода, и реакционную смесь перемешивают при повышенной температуре в течение нескольких часов. После такой обработки продукт реакции извлекают известными в технике способами. В некоторых случаях может подойти защита функционального гидрокси или амино в промежуточных соединениях формулы (XVIII) при описанной выше последовательности реакций. Защитные группы для функциональных гидрокси- или аминогрупп известны в технике. Затем в процессе дальнейшего синтеза указанные защитные группы можно удалить в подходящий момент. Промежуточные соединения формулы(XVIII) можно получить при взаимодействии промежуточного соединения формулы (XXI),где PG2 имеет значения, указанные выше, и W представляет собой отщепляемую группу,имеющею указанные выше значения, с промежуточным соединением формулы (XXII), где Х представляет ОН, NH2, и последующем восстановлении полученного таким образом промежуточного соединения (XXIII) борогидридом натрия, с образованием промежуточных соединений формулы (XVIII). Указанную процедуру взаимодействия можно также использовать для получения промежуточных соединений формулы (V). Следовательно, промежуточное соединение формулы(II) вводят во взаимодействие с промежуточным соединением формулы (XXII), и полученное таким образом промежуточное соединение формулы (XXIV) восстанавливают до промежуточного соединения формулы (XXV) с использованием борогидрида натрия. Затем промежуточные соединения формулы (XXV) превращают в промежуточные соединения формулы(XXVI) с использованием описанной выше реакционной процедуры для конверсии промежуточных соединений формулы (XVIII) в промежуточные соединения формулы транс-(XI-b). В некоторых случаях при описанной выше последовательности реакций может подойти защита радиального X, т.е. функциональной гидрокси- или аминогруппы, в промежуточных соединениях формул (XVII), (XXIV), (XXV) или(XXVI). Защитные группы для функциональных гидрокси- или аминогрупп известны в технике. Затем в процессе дальнейшего синтеза такие защитные группы можно удалить в подходящий момент.(XXVI) можно превратить в промежуточные соединения формулы (V), имеющие трансконфигурацию, с использованием реакционной процедуры, описанной выше на схеме 1 или схеме 2. Промежуточные соединения формулы(VIII-a) определяются как промежуточные соединения формулы (VIII), где группа -OR4 располагается в положении 4 пиперидиновой группы, и R4 представляет собой водород. Указанные промежуточные соединения формулы (VIII-a) можно получить при взаимодействии промежуточного соединения формулы(XXVII) с нитрометаном в подходящих условиях реакции, таких как, например, присутствие метоксида натрия в метаноле, и последующем превращении нитрогруппы в аминогруппу, причем посредством этого получают промежуточные соединения формулы (VIII-a). Промежуточные соединения формулы (V-a),определяемые как промежуточные соединения формулы (V), где R5 представляет собой водород,и группа -OR4 представляет собой ОН-группу,расположенную в положении 3 пиперидиновой группы, имеющие транс-конфигурацию, можно получить, как показано далее. Промежуточное соединение формулы (II) вводят во взаимодействие с промежуточным соединением формулы (XXIX), где PG3 представляет собой подходящую защитную группу,такую как п-толуолсульфонил, и полученное таким образом промежуточное соединение формулы (XXX) восстанавливают до промежуточного соединения формулы (XXXI) с использованием борогидрида натрия. Затем промежуточные соединения формулы (XXXI) превращают в промежуточные соединения формулы(XXXII) с использованием описанной выше реакционной процедуры для конверсии промежуточных соединений формулы (XVIII) в промежуточные соединения формулы транс-(XI-b). Затем, удаляя защитную группу PG3 из промежуточных соединений (XXXII), получают промежуточные соединения формулы (V-a). Промежуточные соединения формулы (Vb), определяемые как промежуточные соединения формулы (V), где R5 представляет собой водород, и группа -OR4 располагается в положении 3 пиперидиновой группы, имеющие транс-конфигурацию, можно получить при(XXXIII) с цианидом лития и последующем восстановлении промежуточных соединений формулы (XXXIV). Когда конверсию промежуточных соединений (XXXIII) в промежуточные соединения (XXXIV) осуществляют в присутствии подходящего агента алкилирования, такого как, например, диметилсульфат или диэтилсульфат (см., например, пример А.10.а), радикал-OR4 превращается из гидроксигруппы в алкилоксигруппу. В отсутствие подходящего агента алкилирования группа -OR4 представляет гидроксигруппу. Конверсию промежуточных соединений (XXXIV) в промежуточные соединения (V-b) можно осуществить с использованием известных в технике процедур превращения цианогруппы в аминогруппу (см., например,пример A.10.b). Описанное выше взаимодействие также можно использовать для получения промежуточных соединений, где радикал L заменен подходящей защитной группой. Соединения формулы (I), их N-оксиды,пролекарства, фармацевтически приемлемые соли и стереоизомерные формы обладают свойствами, благоприятными для желудочнокишечного тракта. Показано, что большинство промежуточных соединений формулы (III) обладают активностью, аналогичной активности конечных соединений формулы (I). Свойства соединений настоящего изобретения,благоприятные для желудочнокишечного тракта, демонстрируются их 5 НТ 4 антагонистической активностью, как описано в примере C.1. Действие 5 НТ 4-антагонистических соединений настоящего изобретения на растяжимость желудка можно показать в эксперименте, где растяжимость желудка ухудшается или снижается путем предварительной обработки ингибитором 5-НТ-переносчика (например,флувоксамином), а затем нормализуется при введении 5 НТ 4-антагонистического соединения настоящего изобретения. Такой эксперимент invivo подробно описан в WO-97/29739 на cc. 810. Ввиду свойств соединений настоящего изобретения, благоприятных для желудочнокишечного тракта, обсуждаемые соединения можно, как правило, использовать при лечении или профилактике таких желудочно-кишечных состояний, как гипермотильность, синдром раздраженной толстой кишки (IBS), IBS с доминирующим запором или диареей, IBS с доминирующей болью или без боли, гиперчувствительность толстой кишки, и для ослабления боли,связанной с желудочно-кишечной гиперчувствительностью и/или гиперреактивностью. 18 Также предполагается, что соединения формулы (I) полезны при предупреждении или профилактике диспепсии. Диспептическими симптомами являются, например, эпигастральное давление, потеря аппетита, ощущение переполненности, быстрое насыщение, тошнота,рвота, метеоризм и отрыжка воздухом. В силу полезности соединений формулы(I) следует, что настоящее изобретение также относится к способу лечения теплокровных животных, включая человека (как правило, называемых здесь пациентами), страдающих от желудочно-кишечных состояний, таких как синдром раздраженной толстой кишки (IBS). Следовательно, метод лечения предусматривается для облегчения пациентов, страдающих от состояний, таких как гипермотильность, синдром раздраженной толстой кишки (IBS), IBS с доминирующим запором или диареей, IBS с доминирующей болью или без боли, гиперчувствительность толстой кишки, и для ослабления боли,связанной с желудочно-кишечной гиперчувствительностью и/или гиперреактивностью. Возможно, что соединения формулы (I) также можно применять при других желудочнокишечных расстройствах, таких как расстройства, связанные с перильстатикой передней части кишечника. В частности, они, возможно,найдут применение при лечении желудочных симптомов желудочно-пищеводного рефлюкса,таких как изжога (в том числе, приступы изжоги, ночная изжога и изжога, вызванная пищей). Итак, настоящее изобретение относится к соединениям формулы (I) для применения в качестве лечебного средства, и в частности, к применению соединений формулы (I) для изготовления лечебного средства для лечения желудочно-кишечных состояний, таких как гипермотильность, IBS, IBS с доминирующим запором или диареей, IBS с доминирующей болью или без боли, гиперчувствительность толстой кишки, и для ослабления боли, связанной с желудочно-кишечной гиперчувствительностью и/или гиперреактивностью. Имеются в виду как профилактика, так и лечение. Для того, чтобы получить фармацевтические композиции данного изобретения, эффективное количество определенного соединения в форме основания или аддитивной соли как активного ингредиента соединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может принимать самые разные формы в зависимости от формы препарата, нужного для введения. Такие фармацевтические композиции находятся, желательно, в форме однократной дозы, походящей,предпочтительно, для введения перорально,ректально или путем парентеральной инъекции. Например, при получении композиций в лекарственной форме для перорального введения можно использовать любые обычные фармацевтические среды, такие как, например, вода, гли 19 коли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, вещества, способствующие рассыпанию, и т.п., в случае порошков, пилюль,капсул и таблеток. Вследствие легкости введения таблетки и капсулы представляют наиболее выгодные дозированные лекарственные формы,в которых, очевидно, используют твердые фармацевтические носители. В случае парентеральных композиций носитель, как правило, будет включать стерильную воду, по меньшей мере большей частью, хотя можно включать и другие ингредиенты, например, способствующие растворению. Например, можно получить растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, в которых можно использовать подходящие жидкие носители, суспендирующие агенты и т.п. В композиции, подходящей для чрескожного введения, носитель содержит, необязательно, вещество, усиливающее проницание, и/или подходящий смачивающий агент,необязательно, в сочетании с подходящими добавками любой природы в небольших количествах, которые не оказывают существенного вредного действия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезны для получения нужных композиций. Такие композиции можно вводить различными способами, например, в виде трансдермального пэтча, в виде пятен, в виде мази. Аддитивные соли кислот (I) из-за своей повышенной растворимости в воде, по сравнению с соответствующей формой основания, очевидно, являются более подходящими при получении водных композиций. Особенно выгодно получать вышеуказанные фармацевтические композиции в дозированной лекарственной форме для облегчения введения и равномерности дозировки. Дозированная лекарственная форма в данном описании и формуле изобретения означает физически дискретные единицы, подходящие для однократных доз, причем каждая единица содержит заранее установленное количество активного ингредиента, рассчитанное на получение нужного лечебного действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных лекарственных форм являются таблетки (в том числе, с насечками или с покрытием), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, чайная ложка, столовая ложка и т.п.,и их отдельные множества. Фармацевтические композиции для перорального введения могут принимать твердые лекарственные формы, например, таблеток (как 20 форм, которые можно только глотать, так и форм, которые можно жевать), капсул или желатиновых упаковок (gelcaps), полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие вещества (например, предварительно желированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); вещества,способствующие рассыпанию (например, картофельный крахмал или натрийкрахмалгликолят) или смачивающие вещества (например,лаурилсульфат натрия). На таблетки можно нанести покрытия способами, хорошо известными в технике. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут представляться в виде сухого продукта для соединения с водой или другим подходящим носителем перед применением. Такие жидкие препараты можно получить обычными способами,необязательно, с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные съедобные жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, сложные эфиры масел или этиловый спирт) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащиватели включают, предпочтительно, по меньшей мере один сильный подслащиватель, такой как сахарин, натрий- или кальцийсахарин, аспартам,ацесульфамкалий, цикламат натрия, алитам, подслащиватель на основе дигидрохалькона, монеллин, стевиозид или сахаралоза (4,1',6'-трихлор 4,1',6'-тридезоксигалактосахароза),предпочтительно - сахарин, натрий- или кальцийсахарин, и,необязательно, объемный подслащиватель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза,изомальт, глюкоза, сироп гидрированной глюкозы, ксилит, жженый сахар или мед. Сильные подслащиватели обычно используют в небольших концентрациях. Например, в случае натрийсахарина концентрация может колебаться от 0,04 до 0,1% (маc./об.) относительно общего объема конечной композиции и,предпочтительно, составляет примерно 0,06% в композициях для низкой дозировки и примерно 0,08% в композициях для высокой дозировки. Объемный подслащиватель можно эффективно использовать в больших количествах в интервале от примерно 10 до примерно 35%, предпочтительно от примерно 10 до 15% (маc./об.). 21 Фармацевтически приемлемые корригенты, которые могут маскировать ингредиенты с горьким вкусом, в композициях для низкой дозировки представляют собой, предпочтительно,фруктовые корригенты, такие как вишневый,малиновый, черносмородиновый или клубничный корригент. Очень хорошие результаты может дать сочетание двух корригентов. В композициях для высокой дозировки могут потребоваться сильные корригенты, такие как карамельно-шоколадный корригент, мятный корригент, фантазийный корригент и подобные фармацевтически приемлемые сильные корригенты. Каждый корригент может присутствовать в конечной композиции в концентрации в интервале от 0,05 до 1% (маc./об.). Выгодно использовать сочетания указанных сильных корригентов. Предпочтительно, используют корригент, который не претерпевает каких-либо изменений или потери вкуса и цвета в композициях с кислой средой. Композиции настоящего изобретения могут, необязательно, содержать ветрогонное средство, такое как симетикон, альфа-D-галактозидаза и т.п. Соединения изобретения также можно ввести в композиции как депо-препараты. Такие композиции длительного действия можно вводить посредством имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения можно ввести в композиции с подходящими полимерными или гидрофобными веществами(например, в виде эмульсии в подходящем масле) или ионно-обменными смолами, или в виде умеренно растворимых производных, например,умеренно растворимой соли. Соединения изобретения можно включить в композиции для парентерального введения путем инъекции, обычно внутривенной, внутримышечной или подкожной инъекции, например болюс-инъекции или непрерывной внутривенной инфузии. Композиции для инъекций можно представить в дозированной лекарственной форме, например в ампулах, или в многодозовых емкостях с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать вещества для приготовления композиций, такие как вещества, придающие изотоничность, суспендирующие, стабилизирующие и/или диспергирующие вещества. С другой стороны, активный ингредиент может находиться в форме порошка для соединения с подходящим носителем, например, стерильной апирогенной водой, перед применением. Соединения изобретения также можно ввести в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суп 003608 22 позиториев, такие как масло какао или другие глицериды. Для интраназального введения соединения изобретения можно использовать, например, в виде жидкого спрея, в виде порошка или в форме капель. Вообще, предполагается, что терапевтически эффективное количество может составлять от примерно 0,001 мг на кг массы тела до примерно 2 мг на кг массы тела, предпочтительно от примерно 0,02 мг/кг до примерно 0,5 мг на кг массы тела. Способ лечения также может включать введение активного ингредиента в режиме от 2 до 4 приемов в сутки. Экспериментальная часть В процедурах, описанных здесь далее, используются следующие аббревиатуры; "ACN" обозначает ацетонирил; "ТГФ" обозначает тетрагидрофуран; "DCM" обозначает дихлорметан;"EtOAc" обозначает этилацетат; "NH4OAc" обозначает ацетат аммония; "НОАс" обозначает уксуcную кислоту; "MIK" обозначает метилизобутилкетон. Для некоторых химикалиев используются химические формулы, например NaOH - гидроксид натрия, Nа 2 СО 3 - карбонат натрия, K2 СО 3 карбонат калия, H2 - газ водород, MgSO4 - сульфат магния, СuО.Сr2 О 3 - хромит меди, N2 - газ азот, CH2Cl2 - дихлорметан, СН 3 ОН - метанол,NН 3 - аммиак, НСl - хлороводородная кислота,NaH - гидрид натрия, СаСО 3 - карбонат кальция,СО - монооксид углерода, и KОН - гидроксид калия. А. Получение промежуточных соединений. Пример A.1.a) Раствор 4-пиридинметанола (1,84 моль) в ACN (1000 мл) добавляют к раствору бензилхлорида (2,2 моль) в ACN (1000 мл), и реакционную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают до комнатной температуры и упаривают. Остаток суспендируют в диэтиловом эфире, фильтруют и сушат,и получают 1-(фенилметил)-4-(гидроксиметил) пиридинилхлорид (411 г, 97%).(2200 мл) и охлаждают до -20 С. В атмосфере азота добавляют порциями борогидрид натрия(1,75 моль). Реакционную смесь перемешивают в течение 30 мин и добавляют по каплям воду(200 мл). Реакционную смесь частично упаривают, добавляют воду, и реакционную смесь экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и упаривают. Остаток очищают на силикагеле (элюент DCM) и получают 155 г 1,2,3,6-тетрагидро-1-(фенилметил)-4 пиридинметанола. Пример А.2. а) Раствор 1,2,3,6-тетрагидро-1-(фенилметил)-4-пиридинметанола (0,5 моль) в ТГФ 23 азота добавляют по каплям раствор борана в ТГФ (1 М, 1000 мл), в то время как реакционную смесь выдерживают при температуре от -20 до -30 С. По окончании добавления реакционную смесь перемешивают в течение 4 ч, нагревают до комнатной температуры и перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь охлаждают до -10 С, и добавляют по каплям воду (25 мл). Затем одновременно добавляют по каплям раствор NaOH(3 М в воде, 70 мл) и пероксид водорода (30% раствор в воде, 63,3 мл), выдерживая в это время реакционную смесь при температуре -10 С. Снова добавляют раствор NaOH (50%, в воде,140 мл). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают и фильтруют. Фильтрат упаривают. Полученный осадок растворяют в воде (500 мл) и насыщаютK2 СО 3. Продукт реакции экстрагируют DCM. Полученный раствор сушат над МgSO4 и упаривают. Остаток кристаллизуют из DIPE/СН 3 СN. После нескольких кристаллизации получаютb) Смесь -транс-1-(фенилметил)-3-гидрокси-4-пиперидин-метанола (17,8 г, 0,085 моль) (уже описанного в J. Med. Chem., 16, pp. 156-159 (1973 и метанола (250 мл) гидрируют при 50 С с палладием на активированном угле(10%, 2 г) в качестве катализатора. После поглощения Н 2 (1 эквивалент) катализатор отфильтровывают, и фильтрат упаривают, и получают 12 г -транс-3-гидрокси-4-пиперидинметанола (промеж. соед. 1-а) (используемое в последующей реакции без дополнительной очистки). Соответствующий цис-изомер известен из J.c) Смесь промежуточного соединения (1-а)(0,086 моль) и DCM (250 мл) перемешивают при комнатной температуре. Добавляют по каплям раствор ди-трет-бутилдикарбоната(ВОСангидрид) (0,086 моль) в DCM (50 мл), и полученную реакционную смесь перемешивают при комнатной температуре. В осадок выпадает масло. Добавляют метанол (60 мл), и полученный реакционный раствор перемешивают в течение 60 мин при комнатной температуре. Растворитель выпаривают. Остаток кристаллизуют из DIPE. Выпавший осадок отфильтровывают и сушат, и получают 13,7 г (68,8%) 1,1-диметилэтил-(транс)-3-гидрокси-4-(гидроксиметил)1-пиперидинкарбоксилат (промежуточное соединение 1-b).d) Промежуточное соединение (1-b) (0,087 моль) растворяют в хлороформе (400 мл) и пиридине (7,51 мл). Раствор охлаждают до 0 С. Добавляют порциями в течение 20 мин 4 метилбензолсульфонилхлорид (0,091 моль). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 16 ч. Добавляют еще 4-метилбензолсульфонилхлорид(1,7 г) и пиридин (1,4 мл), и полученную реакционную смесь перемешивают и кипятят с обратным холодильником в течение 6 ч, затем охлаждают, промывают лимонной кислотой (10% маc./маc. в воде), промывают рассолом, сушат,фильтруют и выпаривают растворитель. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюент DCM). Нужные фракции собирают, и выпаривают растворитель, и получают 9 г бесцветного масла (промежуточное соединение 1-с). Промежуточное соединение (1-с) (0,13 моль) разделяют на его энантиомеры хиральной колоночной хроматографией на колонке с динамичным осевым сжатием с хирацелем AD (20 мкм, 100 , код 061347) (комнатная температура, диаметр колонки 11 см; элюент гексан/этанол 80/20; 50 г продукта в 5 л элюента). Собирают две фракции, выпаривают из них растворитель, и получают 26,2 г фракции (I), элюированной первой,и 26 г фракции (II), элюированной второй. Фракцию (I) кристаллизуют из DIPE, отфильтровывают и сушат, и получают 12,5 г (+)-1,1 диметилэтил-(транс)-3-гидрокси-4-(4-метилфенил)сульфонил]оксиметил]-1-пиперидинкарбоксилата [промежуточное соединение (1-c-I);e) Смесь промежуточного соединения (1-с)f) Смесь промежуточного соединения (1-d)(10%, 1 г) в качестве катализатора. После поглощeния Н 2 (1 эквивалент) катализатор отфильтровывают, и фильтрат упаривают. Остаток отвеждают в DIPE+ACN, отфильтровывают и сушат (вакуум, 40 С), и получают 4 г (76%) 1,1 диметилэтил-(транс)-4-(аминометил)-3-гидрокси-4-пиперидинкарбоксилата (промежуточное соединение 1-е, т.пл. 178 С). Аналогичным способом, но исходя из цис 3-гидрокси-4-пиперидинметанола (описанного в(А) при 10 С добавляют к смеси (В). Реакционную смесь перемешивают в течение 30 мин,промывают 5% раствором NaOH, водой, затем сушат, фильтруют и выпаривают растворитель. Остаток кристаллизуют из ACN, затем охлаждают до 0 С, и выпавший осадок отфильтровывают и сушат, и получают 26 г -1,1 диметилэтил-(цис)-4-(5-хлор-2,3-дигидро-7 бензофуранил)карбонил]амино]метил]-3-гидрокси-1-пиперидинкарбоксилата (промеж. соед. 2). Пример А.4. Смесь промежуточного соединения (2)(0,068 моль) и смеси HCl/2-пропанол (80 мл) и 2-пропанола (800 мл) перемешивают и кипятят с обратным холодильником в течение 45 мин,затем охлаждают и выпаривают растворитель. Остаток кристаллизуют из смеси 2-пропанола и воды, затем охлаждают до 0 С, и выпавший осадок отфильтровывают и сушат, и получают 16 г (76%) моногидрохлорида -(цис)-5-хлор 2,3-дигидро-N-[(3-гидрокси-4-пиперидинил)метил]-7-бензофуранкарбоксамида (промеж. соед. 3-а, т.пл. 230 С). Пример А.5. Смесь этил-4-(7-хлор-2,3-дигидро-1,4 бензодиоксин-5-ил)карбонил]амино]метил]-3 метокси-1-пиперидинкарбоксилата (0,051 моль) и гидроксида калия (0,5 моль) в этаноле (200 мл) перемешивают и кипятят с обратным холодильником в течение 30 ч и затем охлаждают. Растворитель выпаривают. Остаток растворяют в воде, и снова выпаривают растворитель. Остаток обрабатывают DCM и водой. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагелеCH2Cl2/(СН 3 ОН/NН 3) 93/7). Чистые фракции собирают, выпаривают растворитель, и получают 9 г (цис)-7-хлор-2,3-дигидро-N-[(3-метокси 4-пиперидинил)метил]-1,4-бензодиоксин-5-карбоксамида (промеж. соед. 3-i). Часть промеж. соед. (3-i) растворяют в 2-пропаноле и превращают в соль этандиовой кислоты (1:1). Выпавший осадок отфильтровывают, сушат и получают 1,2 г этандиоата (цис)-7-хлор-2,3-дигидро-N[(3-метокси-4-пиперидинил)метил]-1,4-бензодиоксин-5-карбоксамида (1:1) (промеж. соед. 3-j,т.пл. 208 С). Пример А.6. 26 ксида калия (1,25 моль) в 2-пропаноле (700 мл) перемешивают и кипятят с обратным холодильником в течение 6 ч. Реакционную смесь охлаждают, и растворитель выпаривают. Остаток растворяют в воде и затем экстрагируют DCM с небольшим количеством метанола. Смесь высаливают NaCl. Отделенный органический слой сушат, фильтруют, и выпаривают растворитель,и получают 11,2 г промежуточного соединенияb) Смесь промежуточного соединения (4)(0,1 моль), 2-(бромметил)-1,3-диоксолана (0,1 моль) и Nа 2 СО 3 (0,2 моль) в ACN (1000 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают. Выпавший осадок отфильтровывают,промывают, и фильтрат упаривают. Остаток очищают на силикагеле на стеклянном фильтре(промежуточное соединение 5, т.пл. 137 С). Пример А.7. а) Смесь промежуточного соединения (1-d)(0,33 моль) и смеси НСl в 2-пропаноле (500 мл) и 2-пропанол (2500 мл) перемешивают и кипятят с обратным холодильником в течение 30 мин. Реакционную смесь охлаждают и растворитель выпаривают. Остаток растворяют в СН 2 Сl2/СН 3 ОН (H2 О/NН 3). Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/ СН 3 ОН 90/10, и СН 2 Сl2/(СН 3 ОН/NН 3) 90/10). Чистые фракции собирают, выпаривают растворитель и получают 49 г промежуточного соединения (транс)-4-(фенилметил)амино]метил]-3 пиперидинола (промежуточное соединение 6).(400 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч и затем охлаждают. Выпаривают растворитель. Остаток растворяют в DCM и воде. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле(элюент СН 2 Сl2/(СН 3 ОН/NН 3) 96/4). Чистые фракции собирают и выпаривают растворитель. Добавляют толуол и снова выпаривают, и получают 6 г (транс)-1-[2-(1,3-диоксолан-2-ил)этил]-4-(фенилметил)амино]метил]-3-пиперидинола (промежуточное соединение 7). с) Смесь промежуточного соединения (7)(0,019 моль) и метанола (150 мл) гидрируют с палладием-на-угле (10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают, фильтрат упаривают и получают 4 г (транс)-4-(ами 27 нометил)-1-[2-(1,3-диоксолан-2-ил)этил]-3-пиперидинола (промежуточное соединение 8). Пример А.8.a) Смесь метанола (60 мл) и серной кислоты (5,2 мл) перемешивают при комнатной температуре. Добавляют 5-хлор-2,3 дигидроксибензойную кислоту (0,11 моль). Реакционную смесь перемешивают, и кипятят с обратным холодильником в течение 20 ч, и затем выливают на лед. Выпавший осадок отфильтровывают, промывают водой, и сушат, и получают 18,48 г метил-5-хлор-2,3-дигидроксибензоата (промежуточное соединение 9, т.пл. 102 С).b) Смесь промежуточного соединения (9)K2 СО 3 (0,66 моль) в 2-пропаноле (500 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч, затем фильтруют в горячем состоянии и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент DCM). Нужные фракции собирают и выпаривают растворитель. Добавляют толуол, и осуществляют азеотропную отгонку на роторном испарителе, и получают 69 г метил-8-xлор 3,4-дигидро-2 Н-1,5-дибензодиоксепин-6 карбоксилата (промежуточное соединение 10).c) Смесь промежуточного соединения (10)(промежуточное соединение 11). Пример А.9. а) Промежуточное соединение (11) (0,1 моль), триэтиламин (0,1 моль) и DCM (500 мл) перемешивают при температуре ниже 10 С. При температуре ниже 10 С добавляют по каплям этилхлорформиат (0,1 моль). Смесь перемешивают в течение 30 мин при температуре ниже 10 С. При температуре ниже 10 С добавляют раствор 1,1-диметилэтил-(3S-транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилата(0,1 моль) в триэтиламине (250 мл). Реакционную смесь перемешивают в течение одного часа при комнатной температуре. Смесь концентрируют до половины первоначального объема. Концентрат промывают водой, Н 2O/50% NaOH и снова водой. Органический слой отделяют,сушат, фильтруют, и выпаривают растворитель,и получают 44 г моногидрата 1,1-диметилэтил(3S-транс)-4-(8-хлор-3,4-дигидро-2 Н-1,5-дибензодиоксепин-6-ил)карбонил]амино]метил]-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 12) (т.пл. 88 С; липкий), []20D=b) Смесь промежуточного соединения (12)NH3/H2O. Органический слой отделяют, сушат,фильтруют, и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/(СН 3 ОН/NН 3) 90/10). Фракции продукта собирают, и выпаривают растворитель. Образец (2 г) такой фракции кристаллизуют из DIPE с небольшим количеством(с=24,41 мг/5 мл в СН 3 ОН). Пример А.10. а) Взаимодействие осуществляют в атмосфере азота. Гидрид лития (95%) (0,036 моль) суспендируют в ТГФ (30 мл). Добавляют по каплям раствор 2-гидрокси-2-метилпропаннитрила (0,036 моль) в ТГФ (10 мл) (выделяется газ водород). Смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют раствор этилового эфира 7-окса-3-азабицикло[4.1.0]гептан-3-карбоновой кислоты (0,03 моль) в ТГФ (15 моль) в течение 90 мин. Реакционную смесь охлаждают до 15 С. Добавляют диэтилсульфат (0,039 моль) (реакция экзотермическая, температура повышается до 25 С). Реакционную смесь перемешивают в течение одного часа при комнатной температуре, затем перемешивают и кипятят с обратным холодильником в течение 6 ч, охлаждают, и добавляют каплю воды. Выпаривают растворитель. Остаток обрабатывают водой и DCM. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагелеb) Смесь промежуточного соединения (13)(0,19 моль) и метанола, насыщенного NН 3 (500 мл), гидрируют при 14 С с никелем Ренея в качестве катализатора. После поглощения водорода (2 эквивалента) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагелеc) При температуре ниже 10 С триэтиламин (0,01 моль) добавляют к 7-хлор-2,3 дигидро-1,4-бензодиоксин-5-карбоновой кислоте (0,01 моль) в хлороформе (40 мл). При температуре ниже 10 С добавляют этилхлорформиат 29 мин при температуре ниже 10 С. Полученную смесь при температуре ниже 10 С добавляют к раствору промежуточного соединения (14) (0,01 моль) в хлороформе (20 мл). Реакционную смесь перемешивают в течение 30 мин, затем промывают 5% соляной кислотой и водой, сушат, фильтруют, и выпаривают растворитель, и получают 4 г (транс)-этил-4-(7-хлор-2,3 дигидро-1,4-бензодиоксин-5-ил)карбонил]амино]метил]-3-этокси-1-пиперидинкарбоксилатаd) Промежуточное соединение (15) превращают в промежуточное соединение (3-р) с использованием процедуры, описанной в примере А.5. Таким же и подобным способом получают соединения, указанные в табл. I-1. Таблица I-1.С 2 Н 2O4 обозначает соль этандиоат Таблица I-1a:(0,01 моль) и Nа 2 СО 3 (0,02 моль) в метилизобутилкетоне (100 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч и затем охлаждают. Растворитель выпаривают. Остаток обрабатывают DCM и Н 2 О. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают,и выпаривают растворитель. Остаток суспендируют в DIPE, отфильтровывают и сушат, и получают 0,8 г (21%) -(транс)-7-xлор-2,3 дигидро-N-3-гидрокси-1-(3-метоксипропил)-4 пиперидинил]метил]-1,4-бензодиоксин-5-карбоксамида (соед. 67, т.пл. 110 С). Пример В.2. Смесь промежуточного соединения (3-с)(5%, 1 г) в качестве катализатора в присутствии тиофена (4%, 2 мл). После поглощения водорода (газ) (1 эквивалент) катализатор отфильтровывают, и фильтрат упаривают. Остаток обрабатывают DCM и Н 2 О. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле(элюент СН 2 Сl2/(СН 3 ОН/NH3) 95/5). Чистые фракции собирают и выпаривают растворитель. Остаток суспендируют в DIPE, отфильтровывают и сушат, и получают 1,4 г (37%) -(транс)-N-[(1 бутил-3-гидрокси-4-пиперидинил)метил]-7 хлор-2,3-дигидро-1,4-бензодиоксин-5-карбоксамида (соед. 64, т.пл. 112 С). Пример В.3. Смесь промежуточного соединения (3-с)(0,04 моль) и акрилонитрила (0,05 моль) в 2 пропаноле (80 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают, и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/DIPE, отфильтровывают и сушат, и получают 7,1 г -(транс)-7-хлор-N-1-(2-цианоэтил)-3 гидрокси-4-пиперидинил]метил]-2,3-дигидро 1,4-бензодиоксин-5-карбоксамида (соед. 73). Пример В.4. Смесь соединения (73) (0,019 моль) и смеси NН 3/СН 3 ОН (300 мл) гидрируют с никелем Ренея (3 г) в качестве катализатора. После поглощения водорода (газ) (2 эквивалента) катализатор отфильтровывают, и фильтрат упаривают,и получают 6 г -(транс)-N-1-(3-аминопропил)-3-гидрокси-4-пиперидинил]метил]-7-хлор 2,3-дигидро-1,4-бензодиоксин-5-карбоксамида(соединение 76). Пример В.5. Смесь 2-хлор-3-метилпиразина (0,011 моль), соединения (76) и оксида кальция (0,011 моль) перемешивают в течение 6 ч при 120 С и затем охлаждают. Остаток растворяют в не 31 большом количестве DCM. Выпавший осадок отфильтровывают, и фильтрат очищают колоночной хроматографией на силикагеле (элюентCH2Cl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из ACN, отфильтровывают и сушат, и получают 0,6 г (16%) -(транс)-7 хлор-2,3-дигидро-N-3-гидрокси-1-[3-[(3-метил-2-пиразинил)амино]пропил]-4-пиперидинил]метил]-1,4-бензодиоксин-5-карбоксамида(8 мл) в ТГФ (80 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч, охлаждают, выливают в NН 3/Н 2 О, и смесь экстрагируют DCM. Органический слой отделяют, сушат, и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(СН 3 ОН/NН 3) 95/5). Нужные фракции собирают, и выпаривают растворитель. Остаток отверждают в DIPE с каплей ACN, охлаждают до 0 С, отфильтровывают и сушат, и получают 1,7 г (60%) -(транс)-7-хлор-2,3 дигидро-N-3-гидрокси-1-(4-оксопентил)-4 пиперидинил]метил]-1,4-бензодиоксин-5 карбоксамида (соед. 65). Пример В.7. Смесь соединения (75) (0,012 моль) и 4 гидрокси-2-метилтиопиримидина (0,017 моль) в диметилацетамиде (DMA) (6 мл) перемешивают в течение 3 ч при 130 С, затем охлаждают и обрабатывают CH2Cl2/H2O. Органический слой отделяют, сушат, фильтруют, и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/ СН 3 ОН 90/10). Чистые фракции собирают, и выпаривают растворитель. Остаток суспендируют в DIPE, отфильтровывают и сушат. Полученную фракцию перемешивают в кипящемK2 СО 3 (0,017 моль) в 1-бутаноле (25 мл) перемешивают и кипятят с обратным холодильником в течение 14 ч. Реакционную смесь охлаждают. Добавляют воду (100 мл). Полученную смесь экстрагируют DCM (3 х 80 мл). Отделенный органический слой сушат, фильтруют, и выпаривают растворитель. Остаток очищают хроматографией на короткой колонке на силикагеле (элюент CH2Cl2/(СН 3 ОН/NН 3) от 97/3 до 95/5). Чистые фракции собирают, и выпаривают растворитель, и получают 3,60 г (90%) соединения (25).(36%, 0,075 ммоль) в воде (35 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают. Добавляют DCM (35 мл). Добавляют по каплям водный раствор NН 3 до рН 9. В результате, выпадает осадок. Растворители декантируют. Осадок растворяют в метаноле, раствор фильтруют через стеклянный фильтр и концентрируют. Остаток кристаллизуют из СН 3 СN/СН 3 ОН, отфильтровывают, сушат, перекристаллизовывают из СН 3 СN/СН 3 ОН, отфильтровывают и сушат, и получают 1,63 г соединения (26) (т.пл. 160 С) . Пример В.10. Смесь 7-хлор-2,3-дигидро-1,4-бензодиоксин-5-карбоновой кислоты (0,009 моль) и триэтиламина (0,009 моль) в DCM (50 мл) перемешивают при 5 С. При 5 С добавляют по каплям этилхлорформиат (0,009 моль). Смесь перемешивают в течение 30 мин при 5 С. При 5 С добавляют раствор промежуточного соединения(5) (0,009 моль) в DCM (20 мл). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь промывают водой, 5% водным раствором NaOH и снова водой. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/(СН 3 ОН/NH3) 96/4). Нужные фракции собирают,и выпаривают растворитель. Остаток кристаллизуют из DIPE+ACN, отфильтровывают, промывают и сушат, и получают 1,84 г соединения(102) (т.пл. 137 С). Пример В.11. Через смесь промежуточного соединения(3-f) (0,01 моль) и метанола (100 мл) в течение 1 ч барботируют этиленоксид (газ). Растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагелеCH2Cl2/CH3OH 92/8). Чистые фракции собирают, и выпаривают растворитель. Остаток отверждают в DIPE с каплей ACN и каплей воды. Выпавший осадок отфильтровывают и сушат при 40 С, и получают 1,3 г соединения (147)(ОН-) (60 г) перемешивают в течение 22 ч при комнатной температуре. Растворитель удаляют фильтрацией. Остаток промывают водой, ТГФ,снова водой, затем перемешивают в течение 30 мин в НСl (1 N, 75 мл) (3 х; каждый раз отфильтровывают амберлит). Растворитель декантируют. Остаток кристаллизуют из ACN, отфильтровывают, промывают и сушат, и получают 3,25 г соединения (156) (т.пл. 142 С). Пример В.13. Соединение (158) (0,0088 моль), триэтиламин (0,01 моль) и хлороформ (100 мл) перемешивают при температуре ниже 10 С. При температуре ниже 10 С добавляют по каплям рас 33 твор этоксикарбонилхлорида (0,009 моль) в хлороформе (10 мл). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Смесь промывают водой. Органический слой отделяют, сушат, фильтруют, и растворитель выпаривают. Остаток очищают на силикагеле на стеклянном фильтреCH2Cl2/(СН 3 ОН/NН 3) 95/5). Собирают фракции,содержащие продукт, и выпаривают растворитель. Остаток кристаллизуют из DIPE+ACN с небольшим количеством воды, отфильтровывают, промывают и сушат, и получают 2,73 г соединения (159) (т.пл. липкий при 70 С). В таблицах с F-1 по F-5a приводится перечень соединений, которые получают согласно одному из вышеописанных примеров. В таблицах используются следующие аббревиатуры: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) Фармакологические примеры Пример C.1. 5 НТ 4-антагонизм на слизистой мышечной оболочки пищевода крысы. Антагонистическую эффективность в отношении 5 НТ 4 определяют так, как описано вPharmacol., 343, 439-446 (191). Величину рА 2 вычисляют следующим образом: Таблица C.1 Результаты испытаний на 5 НТ 4-антагонизм его стереохимически изомерная форма, его Nоксид, его пролекарство или его фармацевтически приемлемая аддитивная соль кислоты или основания,где в указанной формуле-R1-R2- представляет собой двухвалентный радикал формулы-O-СН 2-O(а-1),-O-СН 2-СН 2(а-2),-O-СН 2-СН 2-O(а-3),-O-СН 2-СН 2-СН 2(а-4),-O-СН 2-СН 2-СН 2-O(а-5),-O-СН 2-СН 2-СН 2-СН 2(а-6),-O-СН 2-СН 2-СН 2-СН 2-O(а-7),-O-СН 2-СН 2-СН 2-СН 2-СН 2(а-8),где в указанном двухвалентном радикале один или два атома водорода у одного и того же или у разных атомов углерода необязательно могут быть заменены C1-6-алкилом или гидрокси,R3 представляет собой водород или галоген;R4 представляет собой водород или C1-6 алкил;R5 представляет собой водород или C1-6 алкил;L представляет собой С 3-6-циклоалкил, оксо-С 5-6-циклоалкил или С 2-6-алкенил,или L представляет собой радикал формулыHet2; Х представляет собой О, S, SO2 или NR8; причем указанный R8 представляет собой водород или C1-6-алкил;Y представляет собой прямую связь, NR10,О, S, -O-(СН 2)n-, -S-(CH2)n- или -NR10-(СН 2)n-,где n равен целому числу от 1 до 6, и R10 представляет собой водород или C1-6-алкил;R11 и R12, каждый независимо, представляют собой водород,C1-6-алкил,С 3-6 циклоалкил, или R11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12,могут образовывать пирролидинильное или пиперидинильное кольцо, причем оба они, необязательно, замещены C1-6-алкилом, амино или моно- или ди(C1-6-алкил)амино, или указанныеR11 и R12, соединенные с атомом азота, к которому присоединены R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба они, необязательно, замещены C1-6-алкилом; и каждый арил представляет незамещенный фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6-алкила, C1-6 алкилокси,аминосульфонила,C1-6-алкилкарбонила, нитро, трифторметила, амино или аминокарбонила; иC1-6-алкилом; пирролидинила; пирролидинила,замещенного одним или двумя заместителями,каждый из которых независимо выбран из галогена, гидрокси, циано или C1-6-алкила; пиридинила; пиридинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6-алкила; пиримидинила; пиримидинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6-алкила, C1-6-алкилокси, амино и моно- и ди(C1-6-алкил)амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6 алкилокси, C1-6-алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6 алкила, C1-6-алкилокси, амино, моно- и ди(С 1-6 алкил)амино и C1-6-алкилоксикарбонила;Het1 также может представлять собой радикал формулыHet1 и Het2, каждый независимо, также могут быть выбраны из радикалов формулR13 и R14, каждый независимо, представляют собой водород или C1-4-алкил. 2. Соединение по п.1, где радикал -OR4 находится в положении 3 пиперидиновой группы,имеющей транс-конфигурацию . 3. Соединение по п.1, где радикал -OR4 находится в положении 4 пиперидиновой группы. 4. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-3. 5. Способ получения фармацевтической композиции по п.4, где терапевтически активное количество соединения по любому из пп.1-3 тщательно смешивают с фармацевтически приемлемым носителем. 6. Применение соединения по любому из пп.1-3 в качестве лечебного средства. 7. Соединение формулы (III) его фармацевтически приемлемая аддитивная соль кислоты или его стереохимически изомерная форма, где R1, R2, R3, R4 и R5 имеют значения, указанные в п.1. 8. Способ получения соединения формулы(I), заключающийся в том, что промежуточное соединение формулы (II) N-алкилируют промежуточным соединением формулы (III) в растворителе, инертном по отношению к реакции, и,необязательно, в присутствии подходящего основанияW представляет собой подходящую удаляемую группу,с последующим, если необходимо, преобразованием одного соединения формулы (I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы. 9. Способ получения соединения формулы(I), заключающийся в том, что соответствующий промежуточный кетон или альдегид формулы L'=O (IV), причем указанный L'=O представляет собой соединение формулы L-H, где два геминальных атома водорода в C1-12 алкандиильной группе заменены на =O, подвергают взаимодействию с промежуточным соединением формулы (III)(I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы. 10. Способ получения соединения формулы (I), заключающийся в том, что промежуточное соединение формулы (V) подвергают взаимодействию с карбоновой кислотой формулы(VI) или ее реакционноспособным функциональным производным(I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы. 11. Способ получения соединения формулы (I), заключающийся в том, что промежуточное соединение формулы (VII), где Х представляет собой бром или йод, карбонилируют в присутствии промежуточного соединения формулы(V) в инертном по отношению к реакции растворителе в присутствии подходящего катализатора и третичного амина при температуре в ин 44 тервале от комнатной температуры до температуры кипения реакционной смеси(I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы. 12. Способ получения соединения формулы (III), заключающийся в том, что промежуточное соединение формулы (VIII), где PG представляет подходящую защитную группу,подвергают взаимодействию с кислотой формулы (VI) или ее подходящим реакционноспособным функциональным производным в растворителе, инертном по отношению к реакции, с последующим отщеплением защитной группы PG с образованием соединений формулы (III)(I) в другое известными методами; или, если желательно, соединение формулы (I) переводят в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) переводят с помощью щелочи в форму свободного основания; и, если желательно, получают их стереохимически изомерные формы. 13. Соединение формулы (XXXIV)
МПК / Метки
МПК: A61P 1/00, C07D 405/12, A61K 31/445
Метки: желудочно-кишечных, 4-(аминометил)пиперидинбензамиды, лечения, расстройств
Код ссылки
<a href="https://eas.patents.su/23-3608-4-aminometilpiperidinbenzamidy-dlya-lecheniya-zheludochno-kishechnyh-rasstrojjstv.html" rel="bookmark" title="База патентов Евразийского Союза">4-(аминометил)пиперидинбензамиды для лечения желудочно-кишечных расстройств</a>
Предыдущий патент: 4-оксо-4,7-дигидротиено [2,3-b]пиридин-5-карбоксамиды в качестве антивирусных средств
Следующий патент: Способ получения замещенных 4-фенил-4-цианоциклогексановых кислот
Случайный патент: Устройство для аспирационного способа обнаружения и катетеризации устья крупных лимфатических коллекторов