Медицинское устройство, содержащее композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, и композиция сухого остатка, содержащая арипипразол в качестве активного ингредиента
Формула / Реферат
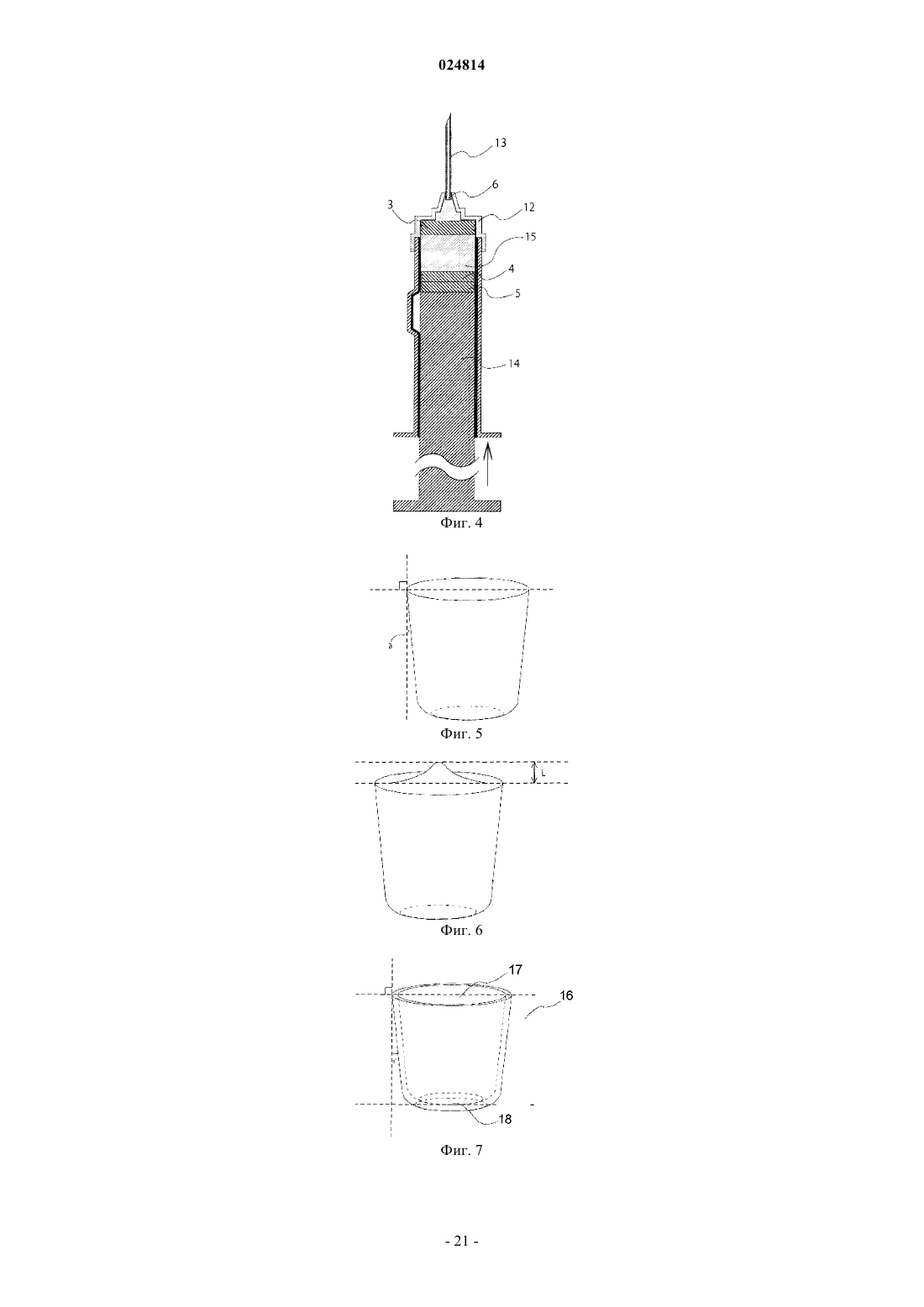
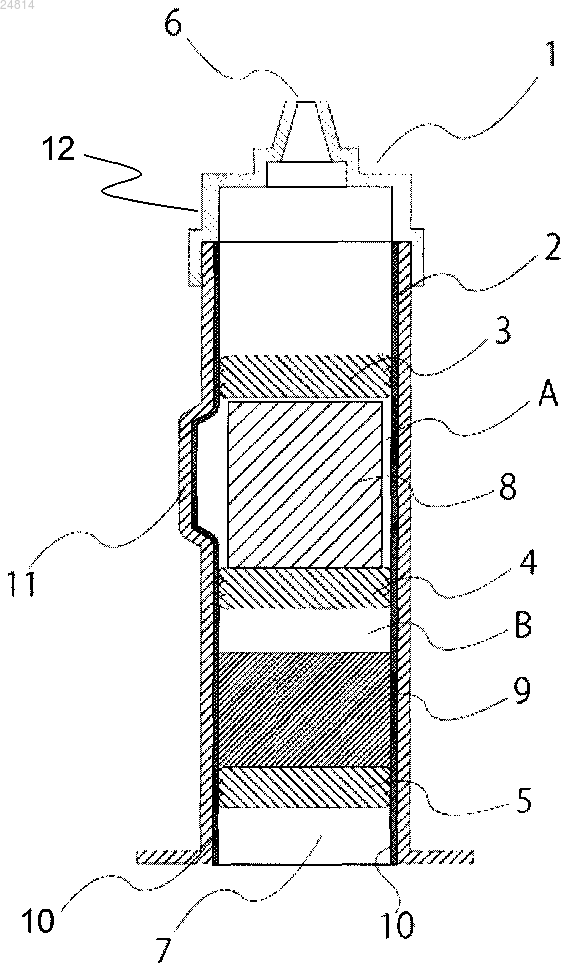
1. Медицинское устройство для применения для подкожного или внутримышечного введения, которое содержит отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, в контейнере для хранения, внутренняя стенка которого обработана силиконом;
композиция сухого остатка представляет собой композицию сухого остатка, которую лиофилизировали в контейнере, отдельном от контейнера для хранения;
композиция сухого остатка имеет цилиндрическую форму и прочность от 5 до 100 Н, и боковая поверхность композиции цилиндрического сухого остатка выполнена скошенной для образования пространства между внутренней стенкой контейнера для хранения и композицией сухого остатка.
2. Медицинское устройство по п.1, где кажущийся объем композиции сухого остатка составляет от 30 до 99% объема контейнера для хранения.
3. Медицинское устройство по п.1 или 2, где верхняя поверхность композиции цилиндрического сухого остатка выполнена выпуклой.
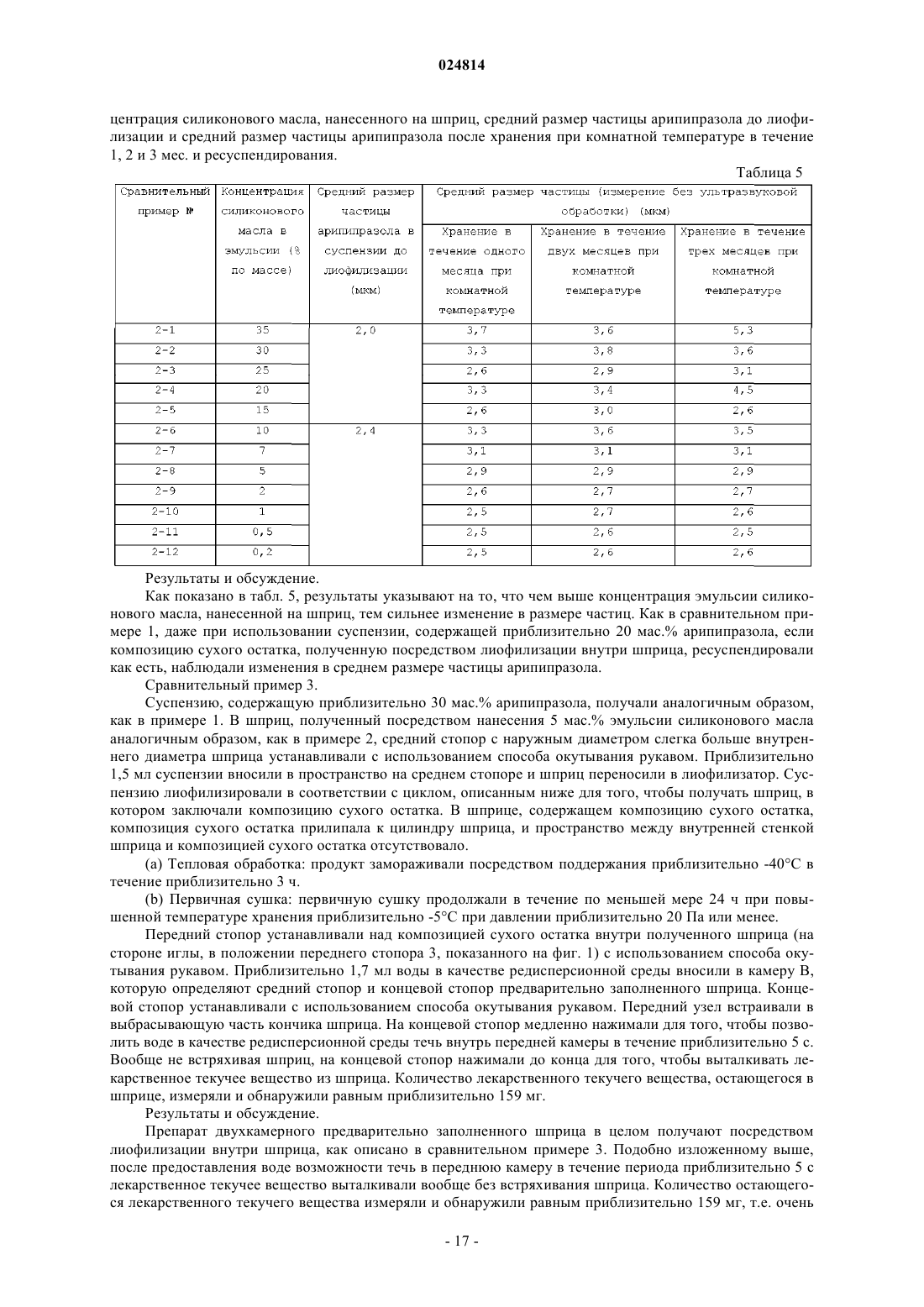
4. Медицинское устройство по любому из пп.1-3, где контейнер для хранения, обработанный силиконом, представляет собой шприц.
5. Медицинское устройство по п.4, где шприц имеет множество камер и композиция сухого остатка содержится по меньшей мере в одной камере.
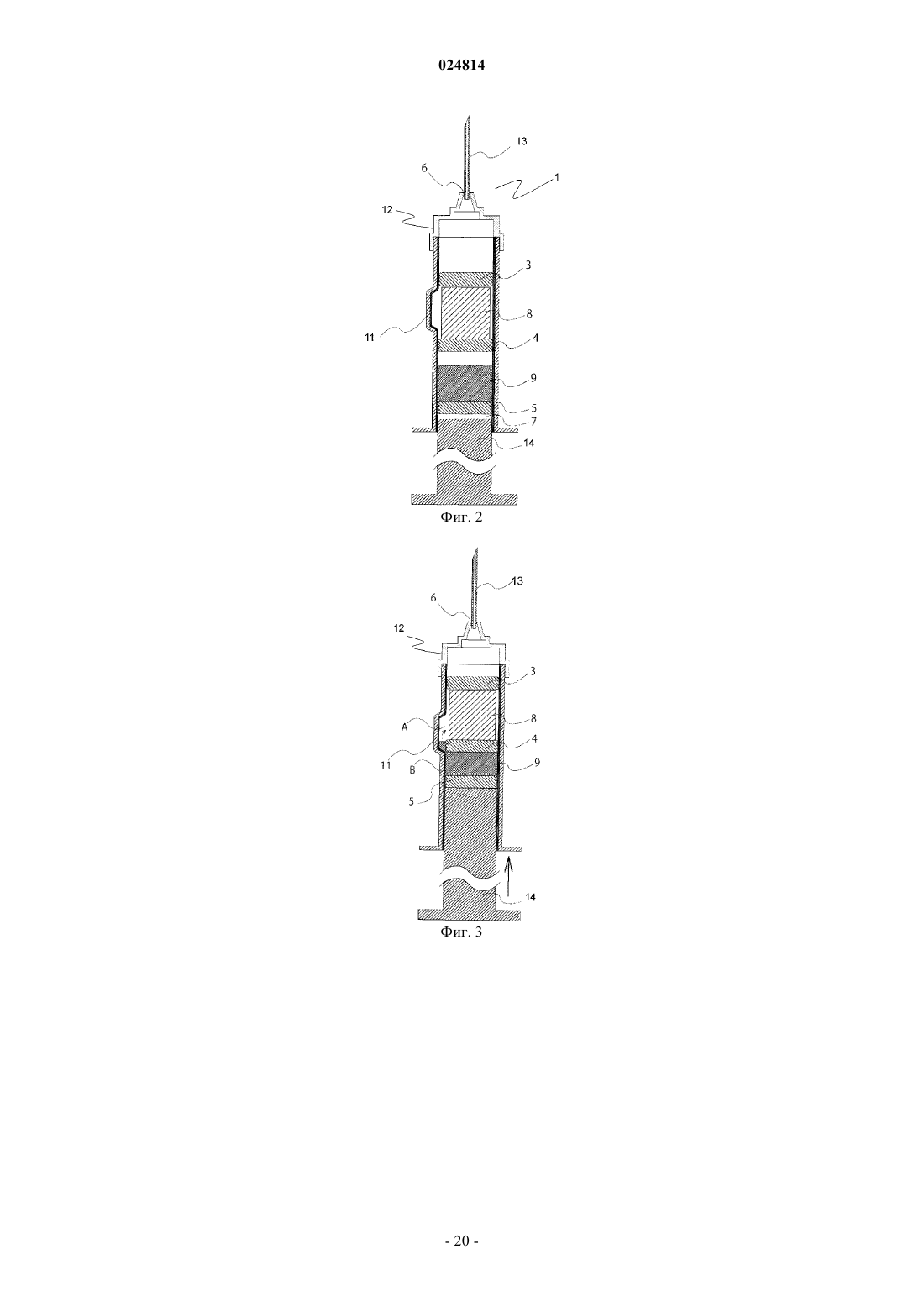
6. Медицинское устройство по п.4, где шприц имеет камеру (А) для вмещения композиции сухого остатка и камеру (В) для вмещения инъекционной жидкости;
камера (А) расположена на стороне, где размещена игла, а камера (В) расположена на стороне, где размещен поршень;
композиция сухого остатка содержится в камере (А), а инъекционная жидкость содержится в камере (В).
7. Композиция сухого остатка для использования в устройстве по пп.1-6, которая содержит арипипразол в качестве активного ингредиента и имеет прочность от 5 до 100 Н, причем композиция сухого остатка имеет цилиндрическую форму и боковая поверхность композиции цилиндрического сухого остатка выполнена скошенной.
8. Композиция по п.7, где процентная доля арипипразола в композиции сухого остатка составляет от 60 до 95 мас.%.
9. Композиция по п.7 или 8, где количество арипипразола в композиции сухого остатка составляет от 0,1 до 0,6 г.
10. Композиция по любому из пп.7-9, получаемая посредством лиофилизации от 0,25 до 12 г суспензии, обладающей содержанием твердых частиц арипипразола от 5 до 45 мас.%.
11. Композиция по любому из пп.7-10, где верхняя поверхность композиции цилиндрического сухого остатка выполнена выпуклой.
12. Композиция по п.7, где композиция сухого остатка представляет собой массу, которую лиофилизировали в контейнере, отдельном от контейнера для хранения в медицинском устройстве.
13. Способ получения медицинского устройства по п.1, в котором заключают отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, в контейнер для хранения, внутренняя стенка которого обработана силиконом;
причем композиция сухого остатка представляет собой композицию сухого остатка, которую предварительно лиофилизируют в контейнере, отдельном от контейнера для хранения;
причем композицию сухого остатка выполняют цилиндрической формы с прочностью от 5 до 100 Н и боковую поверхность композиции цилиндрического сухого остатка выполняют скошенной для образования пространства между внутренней стенкой контейнера для хранения и композицией сухого остатка.
14. Способ по п.13, где контейнер для хранения, обработанный силиконом, представляет собой шприц.
15. Способ по п.14, где шприц имеет множество камер, а композицию сухого остатка помещают по меньшей мере в одну камеру.
16. Способ по п.15, где шприц имеет камеру (А) для вмещения композиции сухого остатка и камеру (В) для вмещения инъекционной жидкости;
камеру (А) располагают на стороне, где размещена игла, а камеру (В) располагают на стороне, где размещен поршень;
композицию сухого остатка помещают в камеру (А), а инъекционную жидкость помещают в камеру (В).
17. Способ получения композиции сухого остатка по п.7, в котором
лиофилизируют суспензию, содержащую арипипразол в качестве активного ингредиента, причем
композицию сухого остатка выполняют цилиндрической формы, имеющей прочность от 5 до 100 Н, и боковую поверхность композиции цилиндрического сухого остатка выполняют скошенной для образования пространства между внутренней стенкой контейнера для хранения, обработанной силиконом, и композицией сухого остатка, когда она помещена в устройство по п.1.
Текст
МЕДИЦИНСКОЕ УСТРОЙСТВО, СОДЕРЖАЩЕЕ КОМПОЗИЦИЮ СУХОГО ОСТАТКА, СОДЕРЖАЩУЮ АРИПИПРАЗОЛ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА, И КОМПОЗИЦИЯ СУХОГО ОСТАТКА, СОДЕРЖАЩАЯ АРИПИПРАЗОЛ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА Настоящее изобретение относится к медицинскому устройству, содержащему композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, и способному сдерживать агломерацию арипипразола в суспензии, получаемой посредством ресуспендирования лиофилизированного вещества; и к композиции сухого остатка, содержащей арипипразол в качестве активного ингредиента. Настоящее изобретение относится к медицинскому устройству,содержащему в контейнере для хранения, внутренняя стенка которого обработана силиконом,лиофилизированную композицию сухого остатка, содержащую отдельно полученный арипипразол в качестве активного ингредиента, где имеет место пространство между внутренней стенкой и композицией сухого остатка; и композиция сухого остатка содержит арипипразол в качестве активного ингредиента и имеет прочность от 5 до 100 Н. Область техники Настоящее изобретение относится к медицинскому устройству, оборудованному контейнером для хранения, содержащим отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, где между внутренней стенкой контейнера для хранения и композицией сухого остатка существует пространство, и к композиции сухого остатка, содержащей арипипразол в качестве активного ингредиента и имеющей определенную удельную прочность. Уровень техники Арипипразол, который используют в качестве активного ингредиента в фармацевтических композициях, известен как нетипичный антипсихотик, который можно использовать для лечения шизофрении,и представлен следующей структурной формулой: Фармацевтическую композицию, содержащую арипипразол в качестве активного ингредиента, используют, например, следующим способом: фармацевтическую композицию суспендируют в дисперсионной среде и полученную таким образом суспензию лиофилизируют, тем самым получая композицию сухого остатка. Композицию сухого остатка смешивают с желаемой дисперсионной средой (инъекционной жидкостью) и тем самым ресуспендируют в момент использования. Затем ресуспендированное средство инъецируют внутримышечно или подкожно (например, см. патентную литературу 1 и 2). Такую композицию сухого остатка получают посредством лиофилизации медицинского текучего вещества в медицинском устройстве, таком как шприц, который также служит в качестве контейнера для хранения (например, см. патентную литературу 3). Дополнительно, в патентной литературе 3 используют форму, так называемый двухкамерный шприц, в котором после лиофилизации раствора, для того чтобы получать лиофилизированное вещество в шприце, шприц закупоривают стопором и, кроме того, инъекционную жидкость заключают в отдельную камеру в шприце. Медицинское устройство, имеющее форму шприца, имеет цилиндр шприца, внутренняя стенка которого обработана силиконом с тем, чтобы позволять уплотнительной пробке, такой как стопор, гладко скользить в цилиндре шприца. Однако, когда лиофилизированное вещество получают в контейнере для хранения посредством заключения медицинского текучего вещества фармацевтической композиции и лиофилизации медицинского текучего вещества в контейнере для хранения, лиофилизированное вещество вступает в контакт с обработанной силиконом внутренней стенкой контейнера для хранения, а силикон, используемый для обработки внутренней стенки контейнера для хранения, можно смешивать с лиофилизированным веществом в связи с длительным периодом хранения (несколько месяцев). Список цитируемой литературы Патентная литература:PTL 2: публикация нерассмотренного японского патента 2007-509148;PTL 3: публикация нерассмотренного японского патентаН 8-112333. Сущность изобретения Техническая проблема. Когда лиофилизированное вещество получали в контейнере для хранения, внутреннюю стенку которого обрабатывали силиконом, посредством заключения суспензии (дисперсии) фармацевтической композиции, содержащей арипипразол в качестве активного ингредиента, и лиофилизации суспензии(дисперсии) в контейнере для хранения, и когда силикон смешивали с лиофилизированным веществом в связи с длительным периодом хранения (несколько месяцев) и смесь ресуспендировали в дисперсионной среде, наблюдали феномен агломерации арипипразола в суспензии. В частности, стало ясно, что существует проблема в отношении того, что присутствие силикона вызывает увеличение среднего размера частицы арипипразола в ресуспендированном средстве. Такая агломерация арипипразола ведет к пониженной скорости растворения, поскольку площадь контакта частиц не вносит вклад в растворение частиц. Когда скорость растворения меняется, как описано выше, это ведет к профилю растворения, в котором уровни в крови различаются между дисперсией арипипразола в суспензии до лиофилизации и дисперсией арипипразола в суспензии, полученной посредством ресуспендирования лиофилизированного вещества. Это значительно влияет на эффективность лекарственного средства, и создает серьезные проблемы следующим образом: лекарственные свойства арипипразола неспособны в достаточной мере проявить свою эффективность; происходит закупорка,когда лекарственное средство используют в форме инъекции; и физический стимул возникает в месте инъекции в связи с увеличенным размером частиц. Цель настоящего изобретения состоит в получении с учетом вышеуказанных проблем, медицинского устройства, содержащего композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, и способного суспендировать агломерацию арипипразола в суспензии, получаемой посредством ресуспендирования лиофилизированного вещества; и композиции сухого остатка, содержащей арипипразол в качестве активного ингредиента. Решение проблемы. Авторы настоящего изобретения проводили обширные исследования для того, чтобы решить вышеуказанную проблему и, как результат, обнаружили, что предоставление пространства между обработанной силиконом внутренней стенкой контейнера для хранения и композицией сухого остатка позволяет снижать частоту контактов между силиконом и композицией сухого остатка, и подавлять смешивание силикона с суспензией, когда ресуспендируют композицию сухого остатка. Авторы настоящего изобретения также нашли композицию сухого остатка, которая может ингибировать разлом композиции сухого остатка в контейнере для хранения, который обусловлен посредством внешних физических воздействий; снизить частоту контактов с силиконом, используемым для обработки внутренней стенки; и быстро ресуспендироваться в дисперсионной среде. Настоящее изобретение выполнено посредством дополнительных исследований, основанных на следующих открытиях: 1. медицинское устройство для применения для подкожного или внутримышечного введения, которое содержит отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, в контейнере для хранения, внутренняя стенка которого обработана силиконом,композиция сухого остатка представляет собой композицию сухого остатка, которую лиофилизировали в контейнере, отдельном от контейнера для хранения,композиция сухого остатка имеет цилиндрическую форму и прочность от 5 до 100 Н, и боковая поверхность композиции цилиндрического сухого остатка выполнена скошенной для образования пространства между внутренней стенкой контейнера для хранения и композицией сухого остатка; 2. медицинское устройство по п.1, где кажущийся объем композиции сухого остатка составляет от 30 до 99% объема контейнера для хранения; 3. медицинское устройство по п.1 или 2, где верхняя поверхность композиции цилиндрического сухого остатка выполнена выпуклой; 4. медицинское устройство по любому из пп.1-3, где контейнер для хранения, обработанный силиконом, представляет собой шприц; 5. медицинское устройство по п.4, где шприц имеет множество камер и композиция сухого остатка содержится по меньшей мере в одной камере; 6. медицинское устройство по п.4, где шприц имеет камеру (А) для вмещения композиции сухого остатка и камеру (В) для вмещения инъекционной жидкости,камера (А) расположена на стороне, где размещена игла, а камера (В) расположена на стороне, где размещен поршень,композиция сухого остатка содержится в камере (А), а инъекционная жидкость содержится в камере (В); 7. композиция сухого остатка для использования в устройстве по пп.1-6, которая содержит арипипразол в качестве активного ингредиента и имеет прочность от 5 до 100 Н, причем композиция сухого остатка имеет цилиндрическую форму, и боковая поверхность композиции цилиндрического сухого остатка выполнена скошенной; 8. композиция по п.7, где процентная доля арипипразола в композиции сухого остатка составляет от 60 до 95 мас.%; 9. композиция по п.7 или 8, где количество арипипразола в композиции сухого остатка составляет от 0,1 до 0,6 г; 10. композиция по любому из пп.7-9, получаемая посредством лиофилизации от 0,25 до 12 г суспензии, обладающей содержанием твердых частиц арипипразола от 5 до 45 мас.%; 11. композиция по любому из пп.7-10, где верхняя поверхность композиции цилиндрического сухого остатка выполнена выпуклой; 12. композиция по п.7, где композиция сухого остатка представляет собой массу, которую лиофилизировали в контейнере, отдельном от контейнера для хранения в медицинском устройстве; 13. способ получения медицинского устройства по п.1, в котором заключают отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, в контейнер для хранения, внутренняя стенка которого обработана силиконом,Причем композиция сухого остатка представляет собой композицию сухого остатка, которую предварительно лиофилизируют в контейнере, отдельном от контейнера для хранения,причем композицию сухого остатка выполняют цилиндрической формы с прочностью от 5 до 100 Н, и боковую поверхность композиции цилиндрического сухого остатка выполняют скошенной для образования пространства между внутренней стенкой контейнера для хранения и композицией сухого остатка; 14. способ по п.13, где контейнер для хранения, обработанный силиконом, представляет собой шприц; 15. способ по п.14, где шприц имеет множество камер, а композицию сухого остатка помещают по меньшей мере в одну камеру; 16. Способ по п.15, где шприц имеет камеру (А) для вмещения композиции сухого остатка и камеру(В) для вмещения инъекционной жидкости,камеру (А) располагают на стороне, где размещена игла, а камеру (В) располагают на стороне, где размещен поршень,композицию сухого остатка помещают в камеру (А), а инъекционную жидкость помещают в камеру(В); 17. способ получения композиции сухого остатка по п.7, в котором лиофилизируют суспензию, содержащую арипипразол в качестве активного ингредиента, причем композицию сухого остатка выполняют цилиндрической формы, имеющей прочность от 5 до 100 Н, и боковую поверхность композиции цилиндрического сухого остатка выполняют скошенной для образования пространства между внутренней стенкой контейнера для хранения, обработанной силиконом, и композицией сухого остатка, когда она помещена в устройство по п.1. Медицинское устройство, содержащее композицию сухого остатка и композицию сухого остатка по настоящему изобретению, описано подробно ниже. Настоящее изобретение относится к медицинскому устройству, содержащему отдельно полученную лиофилизированную композицию сухого остатка, которая содержит арипипразол в качестве активного ингредиента, в контейнере для хранения, внутренняя стенка которого обработана силиконом. Как используют в настоящем документе, "сухой остаток" в композиции сухого остатка обозначает высушенное твердое вещество, которое сохраняет форму жидкости до сушки. Например, когда используют сосуд, который имеет столбчатую внутреннюю форму, сухой остаток представляет собой высушенное твердое вещество, которое сохраняет столбчатую форму. Композицию сухого остатка по настоящему изобретению, содержащую арипипразол в качестве активного ингредиента, можно получать посредством лиофилизации суспензии, содержащей арипипразол в качестве активного ингредиента. Композицию сухого остатка заключают в контейнер для хранения, внутренняя стенка которого обработана силиконом, тем самым позволяя обеспечить пространство между контейнером для хранения и композицией сухого остатка. Обеспечение пространства между обработанной силиконом внутренней стенкой контейнера для хранения и композицией сухого остатка, как описано выше, делает возможным сдерживать увеличение среднего размера частицы арипипразола, которое обусловлено смешиванием силикона с композицией сухого остатка, когда композицию сухого остатка, которую хранили в течение длительного периода времени, ресуспендируют в дисперсионной среде. Другими словами, обеспечение пространства может сдерживать агломерацию частиц арипипразола. Когда композицию сухого остатка получают посредством размещения суспензии в стандартном контейнере для хранения и лиофилизации суспензии в нем, композиция сухого остатка прилипает к внутренней стенке контейнера для хранения, обработанной силиконом. Следовательно, когда композицию сухого остатка ресуспендируют, большое количество силикона смешивают с суспензией. Это вызывает нежелательное увеличение среднего размера частицы арипипразола, который представляет собой активный ингредиент. Обработку силиконом осуществляют на внутренней стенке контейнера для хранения. Когда контейнер для хранения представляет собой сосуд, например внутренняя стенка контейнера для хранения обозначает внутреннюю боковую поверхность сосуда. Когда контейнер для хранения представляет собой шприц, внутренняя стенка обозначает внутреннюю поверхность цилиндра шприца. В сосуде, обработка внутренней стенки силиконом обеспечивает функции для того, чтобы снижать количество медицинского текучего вещества, остающегося на внутренней поверхности сосуда и для того, чтобы минимизировать количество медицинского текучего вещества, помещенного в него. Кроме того, в шприце обработка внутренней стенки силиконом обеспечивает функцию в качестве смазывающего средства для скольжения поршня и стопоров (уплотнительные пробки), предоставленных в цилиндре шприца. Обработка силиконом обозначает нанесение и прилипание силикона к внутренней стенке контейнера для хранения и, в случае необходимости, сушку поверхности, на которую силикон наносят. Сосуд, шприц или т.п. используют в качестве контейнера для хранения, который обрабатывают силиконом. В случае шприца используют предварительно заполненный шприц, в котором заключают композицию сухого остатка. Следовательно, сам шприц также служит в качестве контейнера для хранения. Кроме того, в качестве шприца используют однокамерный шприц или шприц, имеющий множество камер, в котором композиция сухого остатка содержится в одной из камер (далее в настоящем документе также обозначаемый как двухкамерный шприц). Двухкамерный шприц содержит камеру (А) для того, чтобы вмещать композицию сухого остатка, и камеру (В) для того, чтобы вмещать инъекционную жидкость (жидкость для инъекции), и имеет структу-3 024814 ру, в которой камера (А) расположена на стороне, где расположена игла, и камера (В) расположена на стороне, где размещен поршень. Двухкамерный шприц описан ниже со ссылкой на фигуры. На фиг. 1 представлен вид в продольном сечении, показывающий вариант осуществления двухкамерного шприца. Двухкамерный шприц 1 содержит следующие стопоры (уплотнительные пробки) в цилиндре 2 шприца, в описанном порядке от стороны, где размещена игла (т.е. стороны конца 6, где размещена игла): передний стопор 3, средний стопор 4 и концевой стопор 5. Камеру А определяют передний стопор 3 и средний стопор 4, а камеру В определяют средний стопор 4 и концевой стопор 5. Можно обходиться без переднего стопора 3. Передний узел 12, который вмещает передний стопор 3, когда используют шприц, предусмотрен на стороне конца 6. Когда передний стопор 3 не предусмотрен, шприц 1 может иметь обыкновенную форму, в которой конец шприца 1, но не передний узел, отлит в форме, в которой иглу прикрепляют. Когда предусмотрен передний стопор 3, передний стопор 3 размещен в переднем узле 12, и пространство создают между передним стопором 3 и передним узлом 12, тем самым формируя проход для того, чтобы выпускать суспензию, получаемую посредством ресуспендирования композиции сухого остатка 8 в инъекционной жидкости 9, через конец 6. Композиция сухого остатка 8 заключена в камере (А), а инъекционная жидкость 9 для ресуспендирования композиции сухого остатка 8 заключена в камере (В). Дополнительно, внутреннюю стенку цилиндра 2 шприца обрабатывают силиконом 10. Кроме того, обходной путь 11, им:еющий форму, которая выступает наружу изнутри боковой поверхности цилиндра шприца, предоставлен для того, чтобы переносить инъекционную жидкость 9 в камеру (А), в которой заключена композиция сухого остатка 8. Обходной путь 11 предусмотрен в направлении стороны конца 6 от среднего стопора 4. Во время хранения предотвращено течение инъекционной жидкости 9 в сторону камеры (А). Двухкамерный шприц 1 может содержать один обходной путь 11 или множество обходных путей 11. Используемая форма двухкамерного шприца 1, когда его используют в качестве медицинского устройства по настоящему изобретению, объяснена со ссылкой на приложенные фиг. 2-4. Иглу 13 вставляют в конец 6 двухкамерного шприца 1 и поршень 14 вставляют в отверстие 7(см. фиг. 2). На поршень 14 нажимают в направлении стороны конца 6 от отверстия 7, и концевой стопор 5 тем самым скользит к стороне конца 6. За счет дополнительного нажатия на поршень 14 средний стопор 4 и передний стопор 3 скользят так же, как скользит концевой стопор 5. Когда средний стопор 4 достигает обходного пути 11, инъекционная жидкость 9 течет через обходной путь 11 в камеру (А), в которой заключена композиция сухого остатка 8 (см. фиг. 3). Композицию сухого остатка в камере (А) ресуспендируют с помощью инъекционной жидкости 9,которая втекает в нее, тем самым получая суспензию 15. Кроме того, передний стопор 3 размещают в переднем узле 12, когда поршень 14 вталкивают, и ресуспендированное средство 15 выпускают из конца б, в который вставляют иглу 13, через пространство, создаваемое между передним стопором 3 и передним узлом 12 (см. фиг. 4). Длина цилиндра шприца в шприце (длина, в которой можно располагать стопор) предпочтительно составляет приблизительно от 50 до 200 мм и более предпочтительно приблизительно от 70 до 110 мм. Кроме того, расстояние от центра переднего стопора до центра среднего стопора предпочтительно составляет приблизительно от 5 до 40 мм и более предпочтительно приблизительно от 15 до 35 мм. Расстояние между центром среднего стопора и центром концевого стопора предпочтительно составляет приблизительно от 2 до 50 мм и более предпочтительно приблизительно от 10 до 30 мм. Кроме того, внутренний диаметр цилиндра шприца предпочтительно составляет приблизительно от 5 до 30 мм и более предпочтительно приблизительно от 10 до 20 мм. Сконфигурированный таким образом двухкамерный шприц предпочтителен с той точки зрения, что композицию сухого остатка и дисперсионную среду (инъекционную жидкость) для ресуспендирования композиции сухого остатка можно одновременно заключать в такой двухкамерный шприц и, следовательно, стадия инъецирования дисперсионной среды (инъекционной жидкости) в момент использования может быть опущена. Когда однокамерный шприц используют в качестве контейнера для хранения, инъекционную жидкость вводят в шприц снаружи в момент использования и тем самым композицию сухого остатка ресуспендируют для использования. Форма композиции сухого остатка, заключенной в контейнер для хранения, конкретно не ограничена, поскольку создают пространство между внутренней стенкой контейнера для хранения и композицией сухого остатка. Когда контейнер для хранения является цилиндрическим, наподобие цилиндра шприца, например предпочтительно формируют композицию сухого остатка цилиндрической формы. Когда композиция сухого остатка является цилиндрической, предпочтительно, что контейнер (который отделен от контейнера для хранения), который используют для лиофилизации композиции сухого остатка отливают с использованием пластмассы с тем, чтобы композицию сухого остатка можно было легко удалить из контейнера, и что бок контейнера дополнительно скошен, как показано на фиг. 5, для простоты отливки части, которая будет в контакте с текучим веществом. Когда композицию сухого ос-4 024814 татка формируют с тем, чтобы она имела описанный выше скос, угол ("а" на фиг. 5) скоса предпочтительно составляет приблизительно от 0,1 до 10 и более предпочтительно приблизительно от 0,5 до 3. Скос можно формировать частично или полностью по окружности. Кроме того, как показано на фиг. 6, верхняя поверхность композиции цилиндрического сухого остатка поднята. Это обеспечивает эффект уменьшения площади контакта с контейнером для хранения(например, в случае двухкамерного шприца, контакт с передним стопором или средним стопором уменьшен). Расстояние ("L" на фиг. 6) между верхушкой поднятой части и верхнеповерхностью предпочтительно составляет приблизительно от 0,5 до 5 мм и более предпочтительно приблизительно от 1 до 3 мм. Композиция цилиндрического сухого остатка может иметь поднятую периферию для того, чтобы позволить уменьшить площадь контакта с контейнером для хранения (например, в случае двухкамерного шприца, для того, чтобы уменьшать контакт с передним стопором или средним стопором). Кажущийся объем композиции сухого остатка предпочтительно составляет приблизительно 30% или более, более предпочтительно приблизительно 40% или более и еще более предпочтительно 50% или более от объема контейнера для хранения, с точки зрения препятствия разлому композиции сухого остатка в связи с воздействием внутренней стенкой контейнера для хранения во время изготовления и транспортировки медицинского устройства по настоящему изобретению, и уменьшения общей длины шприца. Кроме того, кажущийся объем композиции сухого остатка предпочтительно составляет приблизительно 99% или менее, более предпочтительно приблизительно 90% или менее и еще более предпочтительно 80% или менее, с точки зрения снижения частоты прилипания композиции сухого остатка к силикону, используемому для обработки внутренней стенки контейнера для хранения. Термин "кажущийся объем" обозначает объем композиции сухого остатка, когда композицию сухого остатка рассматривают в качестве массы без микроскопических пор, пространств, трещин и т.п. Кроме того, объем контейнера для хранения относится к объему, занимаемому частью, в которой заключена композиция сухого остатка. Например, в случае описанного ниже двухкамерного шприца,имеющего множество камер, объем контейнера для хранения обозначает объем части камеры (камеры(А, в котором заключена композиция сухого остатка. Удельный кажущийся объем композиции сухого остатка предпочтительно составляет приблизительно от 250 до 12000 мм 3, более предпочтительно приблизительно от 500 до 5000 мм 3 и еще более предпочтительно от 800 до 1600 мм 3. Кроме того, объем контейнера для хранения предпочтительно составляет приблизительно от 250 до 40000 мм 3, более предпочтительно приблизительно от 500 до 17000 мм 3 и еще более предпочтительно от 800 до 5300 мм 3. Композицию сухого остатка получают следующим образом: композицию сухого остатка отдельно получают посредством получения суспензионной композиции, содержащей арипипразол в качестве активного ингредиента, и последующей лиофилизации суспензионной композиции, и отдельно получаемую композицию сухого остатка переносят в контейнер для хранения. Следовательно, предпочтительно лиофилизировать суспензию в контейнере, отдельном от контейнера для хранения, получать массу композиции сухого остатка и переносить массу в контейнер для хранения. Пластмасса предпочтительна в качестве материала для отдельного контейнера, с использованием смолы на основе олефинов и т.п., например более предпочтительна со следующих точек зрения: несмотря на то, что получаемая композиция сухого остатка слегка расширяется, когда ее лиофилизируют при получении композиции сухого остатка, расширение не ведет к сильному прилипанию между композицией сухого остатка и контейнером, или даже если прилипание возникает между композицией сухого остатка и контейнером, композицию сухого остатка можно легко удалять из контейнера посредством деформации контейнера; когда нужно получить асептическую суспензию, контейнер можно легко отливать в асептической атмосфере и легко стерилизовать излучением; и такие материалы имеют низкую стоимость и являются одноразовыми. Неограничивающие примеры олефиновой смолы включают смолу на основе полиэтилена, смолу на основе полипропилена и т.п. Форма контейнера (который отделен от контейнера для хранения), который используют для получения композиции сухого остатка, соответственно определяют в зависимости от формы композиции сухого остатка. Ниже в настоящем документе способ получения композиции цилиндрического сухого остатка описан со ссылкой на фигуры, на основе формы контейнера. На фиг. 7 представлен схематический вид, показывающий форму контейнера (который отделен от контейнера для хранения), используемую для получения композиции цилиндрического сухого остатка. Контейнер 16 имеет отверстие 17 наверху. Суспензию выливают через отверстие 17 и лиофилизируют,тем самым формуя композицию сухого остатка в контейнере 16. Формованную композицию сухого остатка можно легко удалять из контейнера 16 посредством нажатия на нижнюю поверхность 18. Внутренняя поверхность контейнера предпочтительно скошена для того, чтобы содействовать удалению композиции сухого остатка. Угол (а' на фиг. 7) равен углу получаемой композиции сухого остатка. Угол предпочтительно составляет приблизительно от 0,1 до 10 и более предпочтительно приблизительно от 0,5 до 3. Скос можно формировать частично или полностью по периферии. Кроме того, нижняя поверхность контейнера (который отделен от контейнера для хранения) предпочтительно поднята с тем, чтобы можно было снизить площадь контакта с контейнером для хранения(например, в случае двухкамерного шприца, уменьшают контакт с передним стопором или средним стопором) и лиофилизированный сухой остаток можно было легко удалять из контейнера (который отделен от контейнера для хранения). Кроме того, чтобы позволить получаемую композицию сухого остатка легко удалять посредством нажатия на нижнюю поверхность 18, в контейнере может быть предусмотрена внешняя рамка 19, как показано на схематическом виде на фиг. 8 и в виде в поперечном сечении на фиг. 9. Примеры силикона, наносимого на внутреннюю поверхность контейнера для хранения, включают силиконовое масло или производное силикона, которое используют в известных медицинских применениях. В частности, силикон представляет собой линейный полимер, который имеет силоксановую связь в качестве скелета с C1-6-алкильной группой на боковой цепи. Более конкретно, силикон может представлять собой соединение с повторяющимся звеном, представленным следующей формулой (1): В формуле (1) R1 и R2 являются одинаковыми или различными, и каждый представляет атом водорода или C1-6-углеводородную группу, где Н представляет собой целое число от 1 до 1000. Конкретные примеры углеводородных групп, представленных R1 и R2, включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу, и гексильную группу. Когда n равно 2 или более, повторяющиеся звенья могут быть одинаковыми или различными. Конкретные примеры силиконового масла включают диметилполисилоксан. Производное силиконового масла может представлять собой соединение, в котором заместитель на боковой цепи силикона,и/или некоторые из заместителей концевого Si замещены, например, на полиоксиалкиленовую группу или виниловую группу. Силиконовое масло и производное силиконового масла можно получать из коммерчески доступных продуктов, например Shin-Etsu Silicone KM72 и Shin-Etsu Silicone KF96ADF, оба производства компании Shin-Etsu Chemical Co., Ltd., и Dow Corning (производства компании Dow Corning Corporation). В качестве силиконового масла также можно использовать эмульсию (Dow Corning 365, 35% DimethiconeNF Emulsion (производства компании Dow Corning Corporation, которая содержит поверхностноактивное вещество и воду. Средняя молекулярная масса силикона конкретно не ограничена, и предпочтительно составляет от 10 до 100000000, более предпочтительно от 100 до 10000000 и еще более предпочтительно от 200 до 10000. Средний размер частицы арипипразола, содержащегося в композиции сухого остатка, которую хранят в контейнере для хранения, предпочтительно составляет 0,1 мкм или более, более предпочтительно 0,5 мкм или более и еще более предпочтительно 1,5 мкм или более, когда его используют в качестве инъекционного препарата с замедленным высвобождением, поскольку замедленное высвобождение, длящееся до 1 мес., может быть по желанию получено с использованием этих диапазонов. С точки зрения замедления осаждения, увеличения легкости производства и предотвращения засорения иглы во время инъекции, например когда предварительно заполненный шприц используют в качестве контейнера для хранения, средний размер частицы арипипразола в композиции сухого остатка предпочтительно меньше,чем 200 мкм, более предпочтительно меньше 10 мкм и еще более предпочтительно приблизительно 4 мкм или меньше. Здесь "средний размер частицы" относится к среднеобъемному диаметру, как измеряют способом лазерного дифракционного рассеивания. Распределение частиц измеряют с использованием способа лазерного дифракционного рассеивания, а средний размер частицы вычисляют, основываясь на распределении частиц. С точки зрения достижения достаточной прочности для того, чтобы сделать возможным удаление композиции сухого остатка из контейнера, используемого для лиофилизации, который отделен от контейнера для хранения, содержание арипипразола в композиции сухого остатка предпочтительно составляет приблизительно 60 мас.% или более, более предпочтительно приблизительно 65 мас.% или более и еще более предпочтительно приблизительно 70 мас.% или более. Кроме того, содержание арипипразола в композиции сухого остатка предпочтительно составляет приблизительно 95 мас.% или менее, более предпочтительно приблизительно 90 мас.% или менее и еще более предпочтительно приблизительно 80 мас.% или менее для того, чтобы стабилизировать дисперсию арипипразола в жидкости, содержащей суспендирующее средство и т.п. Количество арипипразола, содержащегося в композиции сухого остатка, предпочтительно составляет приблизительно 0,1 г или более и более предпочтительно приблизительно 0,15 г или более и еще более предпочтительно приблизительно 0,2 г или более с точки зрения дозы, которая необходима для того, чтобы поддерживать эффективную концентрацию в крови, необходимую при лечении, после введения в организм. Кроме того, количество арипипразола, содержащегося в композиции сухого остатка,предпочтительно составляет приблизительно 0,6 г или менее, более предпочтительно приблизительно 0,55 г или менее и еще более предпочтительно приблизительно 0,5 г или менее с точки зрения безопасности в отношении физического стимула для организма, когда вводят за один раз. Известно, что арипипразол, содержащийся в композиции сухого остатка, существует в различных кристаллических формах, включая моногидраты (гидрата арипипразола А) и многие безводные формы, в частности такие как безводный кристалл В, безводный кристалл С, безводный кристалл D, безводный кристалл Е, безводный кристалл F и безводный кристалл G. Все эти формы можно использовать в композиции сухого остатка по настоящему изобретению. Композиция сухого остатка по настоящему изобретению также может соответствующим образом содержать другие компоненты, такие как суспендирующее средство, наполнитель, буфер, регулятор рН,эксципиент, смазывающее средство, флюидизирующее средство, разрыхлитель, связующее средство,поверхностно-активное вещество, консервант, ароматизатор, улучшитель запаха и регулирующее тоничность средство, в дополнение к арипипразолу, который используют в качестве активного ингредиента. Добавки могут представлять собой те, что раскрыты в публикации нерассмотренного японского патента 2007509148 (перевод WO 2005/041937). Содержание суспендирующего средства в композиции сухого остатка предпочтительно составляет приблизительно от 0,1 до 10 мас.% и более предпочтительно приблизительно от 1 до 5 мас.%. Предпочтительные примеры суспендирующих средств включают карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилметилцеллюлозу натрия и поливинилпирролидон, или смесь из двух или более из них. Однако, суспендирующее средство не ограничено ими, и предпочтительно можно использовать карбоксиметилцеллюлозу натрия и поливинилпирролидон. Примеры других суспендирующих средств, подходящих для применения в качестве наполнителя для арипипразола включают различные полимеры, низкомолекулярные олигомеры, натуральные продукты и поверхностно-активные вещества (как неионные, так и ионные). Конкретные примеры включают хлорид цетилпиридина, желатин, казеин, лецитин (фосфатид), декстран, глицерин, аравийскую камедь,холестерин, трагакант, стеариновую кислоту, хлорид бензалкония, стеарат кальция, глицерилмоностеарат, цетостеариловый спирт, цетомакроголовый эмульгирующий воск, сложный эфир сорбитана, простой эфир полиоксиэтиленалкила (например, простой эфир макрогола, такой как цетомакрогол 1000), полиоксиэтиленовое производное касторового масла и полиоксиэтиленсорбитановый сложный эфир жирной кислоты (например, коммерчески доступные Tweens, включая Tween20 и Tween80 (производства компании ICI Specialty Chemicals. Другие примеры включают полиэтиленгликоли (например, Carbowaxes 3350 и 1450 и Carbopol 934 (производства компании Union Carbide, бромид додецилтриметиламмония, полиоксиэтиленстеарат, коллоидный диоксид кремния, фосфат, додецилсульфат натрия,карбоксиметилцеллюлозу кальция, гидроксипропилцеллюлозу (например, НРС, HPC-SL и HPC-L), метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, фталат гидроксипропилметилцеллюлозы, некристаллическую целлюлозу, силикат магния алюминия, триэтаноламин, поливиниловый спирт (PVA), этиленоксид-формальдегид 4-(1,1,3,3-тетраметилбутил)феноловые полимеры (также известные как тилоксапол, суперион и тритон), полоксамеры (например, Pluronic F68 и F108, которые представляют собой блок-сополимеры этиленоксида и пропиленоксида); полоксамин (также известный,например, как Tetronic 908 и Poloxamine 908, которые представляют собой тетрафункциональные блок-сополимеры, полученные непрерывным добавлением пропиленоксида и этиленоксида в этилендиамин (производства компании BASF Wyandotte Corporation, Parsippany, H.J.); заряженные фосфолипиды,такие как димиристоилфосфатидилглицерин и диоктилсульфосукцинат (DOSS); Tetronic 1508 (Т-1508; производства компании BASF Wyandotte Corporation), диалкиловые сложные эфиры сульфосукцината натрия (например, Aerosol ОТ, который представляет собой диоктиловый сложный эфир сульфосукцината натрия (производства компании American Cyanamid; Duponol P (лаурилсульфат натрия; производства компании DuPont); Triton X-200 (алкиларилполиэфирсульфонат; производства компании Rohm тиоглюкопиранозид. Большинство этих суспендирующих средств представляют собой известные фармацевтические эксципиенты и подробно описаны в Handbook of Pharmaceutical Excipients, совместно опубликованнойAmerican Pharmaceutical Association и Pharmaceutical Society of Great Britain (Pharmaceutical Press, 1986),которая конкретно включена в настоящий документ посредством ссылки. Суспендирующие средства коммерчески доступны и их можно получать способами, известными в данной области. Содержание наполнителя (также называемого криогенным/лиофилизирующим защитным средством) в композиции сухого остатка предпочтительно составляет приблизительно от 5 до 40 мас.%, более предпочтительно приблизительно от 10 до 30 мас.% и еще более предпочтительно приблизительно от 15 до 25 мас.%. Наполнитель можно выбирать, например, из маннита, сахарозы, мальтозы, ксилита, глюкозы, крахмала и сорбита или смеси из двух или более из них. Однако, наполнитель не ограничен ими, и предпочтительно можно использовать маннит. Предпочтительные примеры буферов включают фосфат натрия, вторичный кислый фосфат натрия,первичный кислый фосфат натрия, фосфат калия и TRIS буфер или смесь из двух или более из них. Однако, буфер не ограничен ими и предпочтительно используют фосфат натрия, вторичный кислый фосфат натрия и первичный кислый фосфат натрия. Когда композицию сухого остатка превращают в суспензию посредством диспергирования в дисперсионной среде в момент использования, регулятор рН используют для того, чтобы регулировать рН суспензии арипипразола приблизительно до 6-7,5, предпочтительно приблизительно 7. Когда рН суспензии, получаемой посредством диспергирования композиции сухого остатка в дисперсионной среде, выше желаемого значения, т.е. приблизительно 7, используют кислый регулятор рН. Когда рН суспензии ниже желаемого значения, т.е. приблизительно 7, используют основной регулятор рН. В качестве кислого регулятора рН используют соляную кислоту или уксусную кислоту, предпочтительно соляную кислоту. Примеры основных регуляторов включают гидроксид натрия, гидроксид калия, карбонат кальция, оксид магния и гидроксид магния. Среди них предпочтительно используют гидроксид натрия. Суспензию, содержащую арипипразол до лиофилизации в качестве активного ингредиента, которая представляет собой суспензию, используемую для получения композиции сухого остатка, можно получать посредством смешивания дисперсионной среды с композицией, соответственно содержащей арипипразол (т.е. активный ингредиент), указанное выше суспендирующее средство, наполнитель, буфер,регулятор рН, эксципиент, смазывающее средство, флюидизирующее средстве, разрыхлитель, связующее средство, поверхностно-активное вещество, консервант, ароматизатор, улучшитель запаха, регулирующее тоничность средство и т.п. таким образом, чтобы их содержания находились в желаемых диапазонах, описанных выше. В качестве дисперсионных сред используют воду или водный растворитель, содержащий воду и органический растворитель. Органический растворитель представляет собой растворитель, который смешивается с водой. Их примеры включают спирты, такие как метанол, этанол, пропанол и изопропанол; кетоны, такие как ацетон; простые эфиры, такие как тетрагидрофуран; диметилформамид; и их смеси. Среди них этанол является особенно предпочтительным. Количество воды, используемое для водного растворителя конкретно не ограничено и составляет, например, предпочтительно по меньшей мере 10 мас.% растворителя. Предпочтительно используют способ влажного измельчения и диспергированные частицы арипипразола подвергают измельчению в присутствии среды для измельчения, чтобы получать желаемый средний размер частицы. Предпочтительно используют способ антисептического влажного измельчения, такой как влажное измельчение в шаровой мельнице, гомогенизация высокого давления или гомогенизация с большим сдвиговым усилием. В дополнение к этим способам измельчения также можно использовать низкоэнергетическую или высокоэнергетическую мельницу (например, вальцовая мельница). Также возможно использование, например, управляемой кристаллизации. Гомогенную суспензию арипипразола, имеющего желаемый средний размер частицы, можно получать с использованием указанных выше способов. Средний размер первичных частиц арипипразола в суспензии предпочтительно составляет 0,1 мкм или более, более предпочтительно 0,5 мкм или более и еще более предпочтительно 1,5 мкм или более в инъекционном препарате с замедленным высвобождением, поскольку с этими диапазонами по желанию можно добиться замедленного высвобождения, длящегося до 1 мес. С точки зрения замедления осаждения, повышения легкости производства и предотвращения засорения иглы во время инъекций, средний размер частицы арипипразола в суспензии предпочтительно меньше 200 мкм, более предпочтительно меньше 10 мкм и еще более предпочтительно приблизительно 4 мкм или меньше."Средний размер частицы" можно измерять, используя тот же способ, который используют для того, чтобы измерять композицию сухого остатка. Термин "размер первичных частиц" относится к размеру частицы для каждой отдельной частицы, а не к размеру частицы у агломерированных частиц."Средний размер частицы" относится к среднеобъемному диаметру, как измеряют способом рассеяния лазерного света (LLS). Распределение частиц измеряют посредством LLS, и средний размер час-8 024814 тицы вычисляют, основываясь на распределении частиц. Арипипразол с желаемым средним размером первичных частиц можно получать посредством использования предпочтительно, например, способом кристаллизации сталкивающихся струй (см. публикацию нерассмотренного японского патента 2007509153 (перевод WO 2005/041970), поданную отBristol-Myers Squibb), или способом влажного измельчения, в котором используют гомогенизатор высокого давления (см. японскую патентную заявку 2007200088, поданную от Otsuka Pharmaceutical Co.,Ltd.). Кристаллические формы арипипразола, который содержится в суспензии, могут быть теми же, что и у арипипразола, содержащегося в композиции сухого остатка. Содержание твердых частиц арипипразола в суспензии предпочтительно составляет приблизительно 5 мас.% или более, более предпочтительно приблизительно 10 мас.% или более и еще более предпочтительно приблизительно 20 мас.% или более, поскольку наличие содержания таких твердых частиц уменьшает размер шприца посредством уменьшения объема сухого остатка после лиофилизации, придает прочность сухому остатку для того, чтобы препятствовать образованию мелких частиц, и делает возможным введение с использованием меньшей дозы. Кроме того, содержание твердых частиц арипипразола в суспензии предпочтительно составляет приблизительно 45 мас.% или менее, более предпочтительно приблизительно 40 мас.% или менее и еще более предпочтительно приблизительно 35 мас.% или менее, поскольку наличие таких твердых частиц позволяет достичь превосходной производственной эффективности в связи с хорошей текучестью жидкости во время получения, и снижает нагрузку на производственное оборудование в связи с низкой вязкостью. Количество арипипразола, содержащегося в суспензии предпочтительно составляет приблизительно 0,1 г или более, более предпочтительно приблизительно 0,15 г или более и еще более предпочтительно приблизительно 0,2 г или более, с точки зрения дозы, которая необходима для того, чтобы поддерживать эффективную концентрацию в крови, необходимую при лечении, после введения в организм. Кроме того, количество арипипразола, содержащегося в суспензии, предпочтительно составляет приблизительно 0,6 г или менее, более предпочтительно приблизительно 0,55 г или менее и еще более предпочтительно приблизительно 0,5 г или менее с точки зрения безопасности в отношении физического стимула для организма, когда вводят за один раз. Композицию сухого остатка можно получать посредством лиофилизации суспензии. Условия лиофилизации можно выбирать соответствующим образом. Например, лиофилизацию можно осуществлять посредством заморозки суспензии при от -50 до -30 С с последующей сушкой в течение 12 ч при пониженном давлении предпочтительно приблизительно от 5 до 40 Па и более предпочтительно приблизительно от 5 до 20 Па при температуре предпочтительно приблизительно от -15 до 10 С и более предпочтительно приблизительно от -10 до 5 С. Композиция сухого остатка, получаемая посредством лиофилизации суспензии, не разламывается,даже если к ней прикладывают внешние физические воздействия, и способна сохранять свою форму, как и массу. Прочность композиции сухого остатка предпочтительно составляет приблизительно 5 Н или более,более предпочтительно приблизительно 10 Н или более, и еще более предпочтительно приблизительно 20 Н или более, исходя из следующей точки зрения. А именно, композиция сухого остатка не разламывается во время получения, транспортировки или т.п. в связи с внешними вибрациями и т.д.; композицию сухого остатка можно легко удалять из контейнера, используемого для лиофилизации, который отделен от контейнера для хранения; и т.д. Кроме того, прочность композиции сухого остатка предпочтительно составляет приблизительно 100 Н или менее, более предпочтительно приблизительно 80 Н или менее и еще более предпочтительно приблизительно 50 Н или менее, например с такой точки зрения, что композицию сухого остатка можно быстро суспендировать с помощью дисперсионной среды при использовании. Прочность композиции сухого остатка можно измерять с использованием аппарата для измерения напряжения, такого как Autograph AG-I Universal Testing Instruments (Shimazu Corporation). Прочность композиции сухого остатка измеряют, например, посредством сжимания и давления на композицию сухого остатка в вертикальном направлении (т.е. сверху и снизу) и измерения напряжения, прикладываемого до тех пор, пока она не сломается. Когда композицию сухого остатка хранят в контейнере, внутреннюю стенку которого обрабатывают силиконом, чтобы уменьшить контакт с силиконом, необходимо предотвращать образование мелких частиц, обусловленных влияниями, оказываемыми во время транспортировки, и т.д. Учитывая это, количество мелких частиц, образуемых посредством разламывания композиции сухого остатка предпочтительно составляет приблизительно 100 мг или менее, более предпочтительно приблизительно 30 мг или менее, и еще более предпочтительно приблизительно 10 мг или менее. Также с точки зрения внешнего вида предпочтительно уменьшать образование мелких частиц. Масса образуемых мелких частиц предпочтительно составляет приблизительно 25% или менее, более предпочтительно приблизительно 10% или менее и еще более предпочтительно приблизительно 3% или менее относительно общей массы композиции сухого остатка. Разлом композиции сухого остатка оценивают следующим образом. Композицию сухого остатка помещают на сито диаметром 80 мм и отверстиями по 2 мм и закрывают крышкой, располагая ее в 22 мм над ситом, и сито, содержащее композицию сухого остатка, закрепляют в Bioshaker V-BR-36 производства компании TAITEC Co., Ltd. После встряхивания на 300 об./мин в течение 10 мин измеряют массу порошка, который прошел через сито. Композицию сухого остатка по настоящему изобретению можно ресуспендировать посредством добавления дисперсионной среды, используемой для того, чтобы получать суспензию, которую использовали до лиофилизации. Примеры дисперсионных сред, используемых с этой целью, включают воду(предпочтительно дистиллированную воду), водный раствор полимера и водный раствор поверхностноактивного вещества. Получаемый ресуспендированный раствор используют в качестве инъекционной жидкости. Количество дисперсионной среды, используемой для ресуспендирования композиции сухого остатка, конкретно не ограничено до тех пор, пока его можно вводить подкожно или внутримышечно. Ее количество предпочтительно составляет от 0,5 до 3 мл и более предпочтительно от 1 до 2 мл. Последовательность процессов для получения медицинского устройства, содержащего композицию сухого остатка по настоящему изобретению, предпочтительно проводят в стерильном помещении. Медицинское устройство, содержащее композицию сухого остатка по настоящему изобретению,имеет пространство между композицией сухого остатка и контейнером для хранения, внутренняя стенка которого обработана силиконом. Это предотвращает непосредственный контакт композиции сухого остатка с силиконом. Соответственно, возможно сдерживать агломерацию арипипразола, обусловленную силиконом, наносимым на внутреннюю стенку контейнера для хранения, когда лиофилизированную композицию сухого остатка ресуспендируют после длительного хранения. Композиция сухого остатка по настоящему изобретению, которая содержит арипипразол в качестве активного ингредиента, имеет удельную прочность, которая препятствует разламыванию композиции сухого остатка, когда прикладывают внешние физические воздействия, и делает возможным быстрое ресуспендирование композиции сухого остатка при смешивании с дисперсионной средой в момент использования. Следовательно, композицию сухого остатка по настоящему изобретению соответственно используют в качестве композиции сухого остатка, заключенной в медицинское устройство. Полезные эффекты изобретения Медицинское устройство, содержащее композицию сухого остатка по настоящему изобретению,имеет пространство между композицией сухого остатка и обработанной силиконом внутренней стенкой контейнера для хранения. Это уменьшает частоту того, что композиция сухого остатка будет контактировать с силиконом, и снижает риск того, что силикон будет загрязнять суспензию, когда ресуспендируют композицию сухого остатка. Это позволяет после ресуспендирования без агломерации удовлетворительно ресуспендировать арипипразол, который представляет собой активный ингредиент, содержащийся в суспензии. Кроме того, поскольку композиция сухого остатка по настоящему изобретению, содержащая арипипразол в качестве активного ингредиента, имеет определенную удельную прочность, она не будет разламываться даже когда прикладывают внешние физические воздействия во время получения и транспортировки. Кроме того, композицию сухого остатка можно быстро диспергировать без агломерации при ресуспендировании в дисперсионной среде в момент использования. Краткое описание чертежей На фиг. 1 представлен вид в разрезе, который иллюстрирует один из вариантов осуществления двухкамерного шприца. На фиг. 2 представлен вид в разрезе, показывающий двухкамерный шприц в момент использования. На фиг. 3 представлен вид в разрезе, показывающий двухкамерный шприц в момент использования. На фиг. 4 представлен вид в разрезе, показывающий двухкамерный шприц в момент использования. На фиг. 5 представлено схематическое изображение, которое иллюстрирует композицию цилиндрического сухого остатка, которая имеет скошенную боковую поверхность. На фиг. 6 представлено схематическое изображение, которое иллюстрирует композицию цилиндрического сухого остатка, которая имеет скошенную боковую поверхность и поднятую верхнюю поверхность. На фиг. 7 представлено схематическое изображение, которое иллюстрирует один из вариантов осуществления формы контейнера, который отделен от контейнера для хранения, используемого для получения композиции цилиндрического сухого остатка. На фиг. 8 представлено схематическое изображение, которое иллюстрирует один из вариантов осуществления формы контейнера, который отделен от контейнера для хранения, используемого для получения композиции цилиндрического сухого остатка. На фиг. 9 представлено схематическое изображение вида в разрезе, которое иллюстрирует один из вариантов осуществления формы контейнера, который отделен от контейнера для хранения, используемого для получения композиции цилиндрического сухого остатка. На фиг. 10 представлена фотография боковой поверхности композиции сухого остатка, полученной в примере 1. На фиг. 11 представлена фотография боковой поверхности композиции сухого остатка, полученного в примере 6. Описание вариантов осуществления Примеры. Настоящее изобретение описано ниже более подробно со ссылкой на примеры и сравнительные примеры. Однако, следует понимать, что настоящее изобретение не ограничено следующими вариантами осуществления. Пример 1. Компоненты, представленные ниже, индивидуально растворяли или суспендировали в воде для того, чтобы получать дисперсию, содержащую компоненты в следующих количествах на 1 мл конечной дисперсии: 12,48 мг карбоксиметилцеллюлозы, 62,4 мг маннита, 1,11 мг моногидрата первичного кислого фосфата натрия и 312,0 мг гидрата арипипразола. рН корректировали приблизительно до 7 с использованием гидроксида натрия. Эту суспензию предварительно измельчали с использованием ротационного гомогенизатора с большим сдвиговым усилием (Clearmix, производства компании М Technique Co., Ltd.), и затем повторно осуществляли влажное измельчение с использованием гомогенизатора высокого давления (производства компании Niro) при 550 бар до среднего размера частицы 3 мкм или менее, чтобы тем самым получить суспензию приблизительно 30% арипипразола. Приблизительно 1,7 мл суспензии, полученной выше (содержащей приблизительно 510 мг арипипразола), помещали в формованный из полиэтилена пластмассовый контейнер, который имеет скошенную внутреннюю боковую поверхность под углом 2 и имеет нижнюю поверхность толщиной 1 мм или менее, контейнер можно деформировать с тем, чтобы сделать возможным выталкивание лиофилизированного продукта из него, когда на нижнюю поверхность нажимают снаружи. Контейнер, содержащий суспензию, переносили в лиофилизатор, и лиофилизировали в соответствии с описанным ниже циклом, чтобы получать композицию сухого остатка. Теоретическое содержание арипипразола в композиции сухого остатка составляло приблизительно 77 мас.%. Получаемая композиция сухого остатка имела кажущийся объем, который был, по существу, равен исходно внесенному объему, только с небольшим наблюдаемым увеличением. Таким образом, кажущийся объем составлял приблизительно 1700 мм 3. На фиг. 10 представлена фотография композиции сухого остатка.(a) Тепловая обработка: продукт замораживали посредством поддержания приблизительно -40 С в течение по меньшей мере 3 ч.(b) Первичная сушка: первичную сушку продолжали в течение по меньшей мере 24 ч при повышенной температуре хранения приблизительно -5 С при давлении приблизительно 20 Па или менее. Получаемую композицию сухого остатка удаляли из пластмассового контейнера. Композиция сухого остатка имела такую форму, что верхняя поверхность была поднята на 2 мм от уровня внесенной жидкости, а боковая поверхность была скошена под углом 1 или более. Также одновременно измеряли другую полученную композицию сухого остатка. Результаты показывали, что все композиции сухого остатка были подняты на 0,5 мм или более. Прочность получаемой композиции сухого остатка измеряли с использованием Autograph AG-IUniversal Testing Instruments (Shimadzu Corporation), зажимая композицию сухого остатка с фиг. 6 и нажимая на нее сверху и снизу. Композиция сухого остатка имела прочность 49 Н. Результаты и обсуждение. Композиция сухого остатка, полученная в примере 1, имела относительно высокую прочность 49 Н. Следовательно, лиофилизированную композицию сухого остатка было легко удалять из контейнера без разламывания, когда ее выталкивали из контейнера. Композиция сухого остатка, полученная в примере 1, отличалась легким набуханием при лиофилизации. В примере 1 внутренняя боковая поверхность пластмассового контейнера была скошена. Следовательно, используя контейнер, который можно деформировать, нажимая на нижнюю поверхность, лиофилизированную композицию сухого остатка легко удаляли из контейнера без необходимости использовать другие перемещаемые части для выталкивания композиции сухого остатка из контейнера или нанесения разделительного средства на внутреннюю поверхность контейнера, при этом поддерживая ее лиофилизированную форму изнутри контейнера. Примеры с 2-1 до 2-9. 1. Получение силиконизированного шприца.Dow Corning365, 35% Dimethicone NF Emulsion (производства компании Dow Corning Corporation) разводили в различных концентрациях очищенной водой. Эмульсию силиконового масла, полученную таким образом, наносили на стеклянный шприц (внутренний диаметр 14,0 длина 106 мм; внутренняя площадь 4660 мм 2, объем 16309 мм 3), и воду испаряли досуха приблизительно при 300 С. Силиконовое масло, нанесенное на внутреннюю поверхность стекла, количественно определяли посредством промывания внутренней поверхности стеклянной трубки метилизобутилкетоном и затем из- 11024814 мерения раствора с использованием атомно-абсорбционного спектрометра с Si измерительной лампой при следующих условиях: длина волны измерения: 2 51,6 нм; сушка: от 50 до 80 С, 40 с; озоление: 1000 С, 20 с; атомизация: 2700 С, 5 с; очистка: 2800 С, 15 с; охлаждение: 17 с. 2. Ресуспендирование композиции сухого остатка. Суспензию, содержащую приблизительно 30% арипипразола со средним размером частицы 2,1 мкм, получали и лиофилизировали аналогичным образом, как в примере 1, чтобы получать композицию сухого остатка. Композицию сухого остатка переносили из пластмассового контейнера в силиконизированный шприц, полученный как описано выше в 1. Стопор располагали внутри шприца. Чтобы сохранить воздухонепроницаемость во время хранения, стопор отличался слегка увеличенным размером относительно внутреннего диаметра шприца и способностью скользить из-за силиконового масла, нанесенного на внутреннюю боковую поверхность шприца. Композицию сухого остатка переносили в шприц и затем хранили при комнатной температуре приблизительно в течение 1 мес. Количество силиконового масла в композиции сухого остатка определяли посредством экстрагирования ресуспендированной композиции сухого остатка в воде метилизобутилкетоном и последующего измерения раствора в метилизобутилкетоне с использованием атомно-абсорбционного спектрометра. После хранения в течение приблизительно 1 мес. композицию сухого остатка ресуспендировали приблизительно в 2 мл воды и измеряли размер частиц в суспензии с использованием лазерного дифракционного анализатора размера частиц производства компании Shimadzu Corporation (SALD-3000J илиSALD-3100). Измерение выполняли при показателе преломления от 2,00 до 0,20, используя воду в качестве среды измерения в ячейке с циркуляцией. Отдельно суспензию обрабатывали звуком в течение 1 мин с использованием генератора ультразвуковых волн, прикрепленного к анализатору размера частиц,и средний размер частицы обработанной звуком суспензии измеряли аналогичным образом, как описано выше. В табл. 1 представлен средний размер частицы арипипразола до лиофилизации, концентрация силиконового масла, нанесенного на шприц, количество силиконового масла на шприце, количество силиконового масла после 1 мес. хранения шприца, содержащего композицию сухого остатка при комнатной температуре, и ресуспендирования композиции сухого остатка и средний размер частицы арипипразола после ресуспендирования. Таблица 1 Результаты и обсуждение. Как показано в табл. 1, количество силиконового масла в ресуспендированной композиции сухого остатка варьировало в соответствии с концентрацией силиконового масла в нанесенной эмульсии. Кроме того, даже когда концентрация силиконового масла в нанесенной эмульсии составляла 0%,- 12024814 силиконовое масло обнаруживали в композиции сухого остатка (ссылочный пример). Вероятно, это обусловлено тем, что происходил перенос силиконового масла, исходно содержавшегося в стопоре, в композицию сухого остатка. Однако, поскольку композиция сухого остатка имела выпуклую, т.е. поднятую,верхнюю поверхность, как описано в примере 1, что минимизировало контакт композиции сухого остатка со стопором, количество силиконового масла, смешанного с композицией сухого остатка, было чрезвычайно мало. Изменение среднего размера частицы арипипразола не наблюдали в каком-либо из шприцов, полученных с использованием различных концентраций эмульсии силиконового масла в примерах с 2-1 до 2-9. Агломерацию частиц из-за силиконового масла можно подтвердить с помощью уменьшения размера частиц в измерении под облучением ультразвуком. Размер частиц измеряли до и после облучения ультразвуком, и между ними не наблюдали измерений в размере частиц. Соответственно, определяли, что агломерация не возникала. Пример 3. Суспензию, содержащую приблизительно 30 мас.% арипипразола, получали аналогичным образом,как в примере 1, и лиофилизировали для того, чтобы получать композицию сухого остатка. Двухкамерный шприц с внутренним диаметром 14 мм, как показано на фиг. 1 (объем камеры, в которой заключали композицию сухого остатка: приблизительно 3000 мм 3), использовали в качестве шприца, и средний стопор 4, как показано на фиг. 1, устанавливали с использованием способа окутывания рукавом. После внесения приблизительно 1,7 мл воды в шприц концевой стопор 5 устанавливали с использованием способа окутывания рукавом. Содержащую арипипразол композицию сухого остатка, полученную посредством лиофилизации в пластмассовом контейнере, удаляли из пластмассового контейнера посредством нажатия на нижнюю поверхность пластмассового контейнера и непосредственно переносили в пространство на среднем стопоре 4, как показано на фиг. 1, в шприц, в который вносили воду. Передний стопор 3, как показано на фиг. 1, устанавливали с использованием способа окутывания рукавом. Передний узел 12, как показано на фиг. 1, подгоняли к шприцу для того, чтобы получать предварительно заполненный шприц, содержащий композицию сухого остатка с арипипразолом в качестве активного ингредиента. Кажущийся объем композиции сухого остатка составлял приблизительно 60% от объема контейнера для хранения предварительно заполненного шприца (объем камеры, в которой заключали композицию сухого остатка). На концевой стопор нажимали поршнем для того, чтобы позволить воде в качестве редисперсионной среды течь в камеру, в которой заключали композицию сухого остатка. После смешивания шприц энергично встряхивали для того, чтобы добиться полного ресуспендирования. На концевой стопор нажимали до конца для того, чтобы выталкивать лекарственное текучее вещество из шприца. Количество лекарственного текучего вещества, остающегося в шприце, измеряли и обнаруживали равным приблизительно от 36 до 40 мг (приблизительно 38 мг в среднем). Это представляет собой количество лекарственного текучего вещества, остающегося в пропусках стопора и переднем узле, т.е. так называемое мертвое пространство выпуска. Расценили, что предварительно заполненный шприц, полученный этим способом, полностью выполнял функции, требуемые для введения. Аналогичным образом, используя предварительно заполненный шприц, в котором заключали композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, на концевой стопор медленно нажимали для того, чтобы позволить воде в качестве редисперсионной среды течь в переднюю камеру в течение приблизительно 5 с. Вообще не встряхивая шприц, на концевой стопор нажимали до конца для того, чтобы выталкивать суспензию из шприца. Количество лекарственного текучего вещества, оставшегося в шприце, измеряли и обнаружили равным приблизительно от 74 до 95 мг (приблизительно 85 мг в среднем). Количество лекарственного текучего вещества, оставшегося в пропусках стопора и переднем узле, т.е. так называемом мертвом пространстве выпуска, составляло приблизительно 38 мг в среднем. Поскольку шприц не встряхивали, приблизительно 47 мг, которые получали вычитанием 38 мг из 85 мг, оставались в шприце. Однако, расценили, что предварительно заполненный шприц, полученный этим способом, оказался удовлетворительным для того, чтобы осуществлять функции, требуемые для введения. Пример 4. Компоненты, представленные ниже, индивидуально растворяли или суспендировали в воде для того, чтобы получать дисперсию, содержащую компоненты в следующих количествах на 1 мл конечной дисперсии: 8,32 мг карбоксиметилцеллюлозы, 4,16 мг маннита, 0,74 мг моногидрата первичного кислого фосфата натрия и 208,0 мг гидрата арипипразола. рН корректировали приблизительно до 7 с использованием гидроксида натрия. Эту суспензию предварительно измельчали с использованием ротационного гомогенизатора с большим сдвиговым усилием (Clearmix, производства компании М Technique Co., Ltd.), и затем повторно осуществляли влажное измельчение с использованием гомогенизатора высокого давления (производства компании Niro) при 550 бар до среднего размера частицы 3 мкм или менее, чтобы тем самым получить суспензию приблизительно 20 мас.% арипипразола. Приблизительно 2 мл суспензии, полученной выше (содержащей приблизительно 400 мг арипипразола), вносили в формованный из полиэтилена пластмассовый контейнер, имеющий скошенную внутреннюю боковую поверхность под углом 2 и имеющий нижнюю поверхность толщиной 1 мм или менее,контейнер можно деформировать с тем, чтобы позволить выталкивать из него лиофилизированный продукт, когда нажимали на нижнюю поверхность снаружи. Контейнер, содержащий суспензию, переносили в лиофилизатор и лиофилизировали в соответствии с циклом, описанным ниже для того, чтобы получать композицию сухого остатка. Теоретическое содержание арипипразола в композиции сухого остатка составляло приблизительно 77 мас.%. Получаемая композиция сухого остатка имела кажущийся объем,который был, по существу, равен исходно внесенному объему, только с небольшим наблюдаемым увеличением. Таким образом, кажущийся объем составлял приблизительно 2000 мм 3.(a) Тепловая обработка: продукт замораживали посредством поддерживания приблизительно -40 С в течение по меньшей мере 3 ч.(b) Первичная сушка: первичную сушку продолжали в течение по меньшей мере 24 ч при повышенной температуре хранения приблизительно -5 С при давлении приблизительно 20 Па или менее. Получаемую композицию сухого остатка удаляли из пластмассового контейнера посредством нажатия на нижнюю поверхность пластмассового контейнера. Композицию сухого остатка легко удаляли из контейнера, при этом поддерживая его лиофилизированную форму изнутри контейнера, без необходимости использования других перемещаемых частей для выталкивания композиции сухого остатка из контейнера или нанесения разделительного средства на внутреннюю поверхность контейнера. Примеры с 5-1 до 5-3. Суспензию, содержащую приблизительно 30 мас.% арипипразола, получали аналогичным образом,как в примере 1. Эту суспензию разводили очищенной водой до суспензий, содержащих приблизительно 10, 20 и 30 мас.% арипипразола. Эти суспензии лиофилизировали аналогичным образом, как в примере 1,чтобы получать композиции сухого остатка. В табл. 2 представлена легкость удаления получаемых композиций сухого остатка из контейнеров. Таблица 2 Результаты и обсуждение. Каждую из содержащих арипипразол композиций сухого остатка, полученных лиофилизацией в пластмассовом контейнере, удаляли из пластмассового контейнера, нажимая на нижнюю поверхность пластмассового контейнера. Все композиции сухого остатка, полученные в примерах с 5-1 до 5-3, легко удаляли из контейнеров. Прочность композиции сухого остатка, полученной посредством лиофилизации,измеряли с использованием Autograph AG-I Universal Testing Instruments (Shimadzu Corporation) аналогичным образом, как в примере 1. Композиция сухого остатка, полученная с использованием суспензии,содержащей приблизительно 10 мас.% арипипразола, полученная в примере 5-1, имела прочность приблизительно 7 Н. Даже когда контейнер выполнен с возможностью легкого удаления, композиция сухого остатка должна иметь некоторую прочность. Пример 6. Контейнер, как описано в примере 1, получали с использованием полипропилена, и композицию сухого остатка получали аналогичным образом, как в примере 1. Композицию сухого остатка, полученную посредством лиофилизации в пластмассовом контейнере,удаляли из пластмассового контейнера посредством нажатия на нижнюю поверхность пластмассового контейнера, и непосредственно переносили в шприц. Композицию сухого остатка легко удаляли из контейнера, при этом поддерживая его лиофилизированную форму изнутри контейнера, без необходимости использовать другие перемещаемые части для выталкивания композиции сухого остатка из контейнера или нанесения разделительного средства на внутреннюю поверхность контейнера. На фиг. 11 представлена фотография полученной композиции сухого остатка. Подтверждено, что получаемая композиция сухого остатка имела поднятую часть по периферии верхней поверхности. Получаемая композиция сухого остатка была поднята на 0,5 мм или более по периферии верхней поверхности, хотя форма и отличалась от формы композиции сухого остатка, полученной с использованием полиэтиленового контейнера, описанного выше в примере 1. Композицию сухого остатка заключали в шприц для того, чтобы получить предварительно заполненный шприц (объем камеры, в которую заключали композицию сухого остатка: приблизительно 3500 мм 3). Кажущийся объем композиции сухого остатка составлял приблизительно 50% от объема контейнера для хранения предварительно заполненного шприца (объема камеры, в которой заключали композицию сухого остатка). Используемый шприц относился к так называемому однокамерному типу, который имеет только одно пространство для того, чтобы вмещать лекарственное средство. Лиофилизированную композицию сухого остатка легко ресуспендировали посредством всасывания воды в качестве редисперсионной среды в шприц во время ресуспендирования. Пример 7. Суспензию, содержащую приблизительно 30 мас.% арипипразола, получали аналогичным образом,как в примере 1. Приблизительно от 1,5 мл приблизительно до 1,7 мл этой суспензии вносили в формованный из полиэтилена пластмассовый контейнер и лиофилизировали для того, чтобы получать композицию сухого остатка. Взвешивали приблизительно 600 мг получаемой композиции сухого остатка. Эту композицию сухого остатка помещали на сито с отверстиями по 2 мм и диаметром 80 мм, и закрывали крышкой, которая находилась на 22 мм выше сита. Сито закрепляли в Bioshaker V-BR-36 производства компании TAITEC Co., Ltd. и встряхивали на 300 об./мин в течение 10 мин. Количество порошка, прошедшего через отверстия сита, составляло приблизительно от 1 до 9 мг. Результаты и обсуждение. Результаты примера 7 показывают, что несмотря на получение лиофилизацией, эта композиция сухого остатка не была хрупкой и менее вероятно разламывалась и образовывала мелкий порошок из-за воздействий во время транспортировки и т.д. Лиофилизированные композиции сухого остатка в целом хрупки и часто разламываются из-за сильных воздействий в приведенном выше тесте. Если мелкий порошок образуется из этого фармацевтического препарата, он может вступить в контакт с силиконом на внутренней поверхности на фиг. 1 и тем самым увеличить размер частиц и т.д.; кроме того, образование мелкого порошка будет служить причиной нежелательного внешнего вида. Приведенные выше результаты показывают, что этот способ получения позволяет получать композицию сухого остатка, поверхность которой не является хрупкой и из которой маловероятно образуется мелкий порошок. Примеры с 8-1 до 8-3. Суспензию, содержащую приблизительно 30% арипипразола, получали аналогичным образом, как в примере 1, за исключением того, что сахарозу использовали вместо маннита. Суспензию разводили очищенной водой аналогичным образом, как в примере 5, до суспензий, содержащих приблизительно 10, 20 и 30 мас.% арипипразола. Используя пластмассовые контейнеры, суспензии лиофилизировали. Как в примере 1, без необходимости использовать другие перемещаемые части для выталкивания композиции сухого остатка из контейнера или нанесения разделительного средства на внутреннюю поверхность контейнера, каждую композицию сухого остатка легко удаляли из контейнера, при этом поддерживая ее лиофилизированную форму изнутри контейнера. В табл. 3 показана легкость удаления получаемых композиций сухого остатка из контейнеров. Таблица 3 Результаты и обсуждение. Даже когда маннит использовали вместо сахарозы, композиция сухого остатка, полученная с использованием суспензии, содержащей приблизительно 10 мас.% арипипразола, имела прочность приблизительно 11 Н. Сравнительные примеры с 1-1 до 1-9. Суспензию, содержащую приблизительно 30 мас.% арипипразола со средним размером частицы 2,2 мкм получали аналогичным образом, как в примере 1. В шприцы, полученные посредством нанесения эмульсий силиконового масла с различными концентрациями, полученных в примере 2, и сушки,средний стопор с наружным диаметром слегка больше внутреннего диаметра шприца устанавливали с использованием способа окутывания рукавом. Приблизительно 1,5 мл суспензии вносили в пространство на среднем стопоре и лиофилизировали как есть внутри шприца. После лиофилизации передний стопор устанавливали с использованием способа окутывания рукавом. После лиофилизации шприцы хранили при комнатной температуре в течение приблизительно 1 мес. и количество силиконового масла в композиции сухого остатка измеряли аналогичным образом,как в примере 2. В каждом из шприцов, содержащих композицию сухого остатка, композиция сухого остатка прилипала к цилиндру шприца, и пространство между внутренней стенкой шприца и композицией сухого остатка отсутствовало. В табл. 4 представлен средний размер частицы арипипразола до лиофилизации, концентрация силиконового масла, нанесенного на шприц, количество силиконового масла на шприце, количество силиконового масла после 1 мес. хранения шприца, содержащего композицию сухого остатка, при комнатной температуре и ресуспендирования композиции сухого остатка и средний размер частицы арипипразола после ресуспендирования. Таблица 4 Результаты и обсуждение. Результаты, представленные в табл. 4, указывают на то, что чем выше концентрация эмульсии силиконового масла, наносимой на шприц, тем выше содержание силиконового масла в композиции сухого остатка; и чем выше концентрация силиконового масла, нанесенного на шприц, тем сильнее изменение среднего размера частицы. По сравнению с получением предварительно заполненного шприца с использованием композиции сухого остатка, получаемой лиофилизацией в контейнере для хранения, отличном от описанного в примере 2, отличающиеся результаты получали даже при такой же концентрации нанесенной эмульсии силиконового масла. Даже когда концентрация силиконового масла в нанесенной эмульсии составляла 0%, силиконовое масло обнаруживали в композиции сухого остатка. Вероятно, это обусловлено тем, что происходил перенос силиконового масла, исходно содержавшегося в стопоре, в композицию сухого остатка. Когда агломерированные частицы измеряют под облучением ультразвуком, происходит изменение размера свободных частиц. Когда размер частиц измеряли при облучении ультразвуком в этом сравнительном примере, наблюдали уменьшение размера частиц. Этот результат показывает, что в соответствии со способом, включающим лиофилизацию в шприце, силиконовое масло вызывает агломерацию. Сравнительные примеры с 2-1 до 2-12. Суспензии, содержащие приблизительно 20 мас.% арипипразола со средним размером частицы 2,0 мкм и 2,4 мкм, отдельно получали аналогичным образом, как в примере 4. В шприцы, полученные посредством нанесения эмульсий силиконового масла с различными концентрациями, полученных в примере 2, средний стопор с наружным диаметром слегка больше внутреннего диаметра шприц устанавливали с использованием способа окутывания рукавом. Приблизительно 2 мл суспензии вносили в пространство на среднем стопоре и лиофилизировали как есть внутри шприца. В каждом из шприцов, содержащих композицию сухого остатка, композиция сухого остатка прилипала к цилиндру шприца, и пространство между внутренней стенкой шприца и композицией сухого остатка отсутствовало. После лиофилизации шприцы хранили при комнатной температуре в течение 1, 2 и 3 мес. После хранения композицию сухого остатка внутри шприцов ресуспендировали приблизительно в 2 мл воды и измеряли средний размер частицы аналогичным образом, как в примере 2. В табл. 5 представлены кон- 16024814 центрация силиконового масла, нанесенного на шприц, средний размер частицы арипипразола до лиофилизации и средний размер частицы арипипразола после хранения при комнатной температуре в течение 1, 2 и 3 мес. и ресуспендирования. Таблица 5 Результаты и обсуждение. Как показано в табл. 5, результаты указывают на то, что чем выше концентрация эмульсии силиконового масла, нанесенной на шприц, тем сильнее изменение в размере частиц. Как в сравнительном примере 1, даже при использовании суспензии, содержащей приблизительно 20 мас.% арипипразола, если композицию сухого остатка, полученную посредством лиофилизации внутри шприца, ресуспендировали как есть, наблюдали изменения в среднем размере частицы арипипразола. Сравнительный пример 3. Суспензию, содержащую приблизительно 30 мас.% арипипразола, получали аналогичным образом,как в примере 1. В шприц, полученный посредством нанесения 5 мас.% эмульсии силиконового масла аналогичным образом, как в примере 2, средний стопор с наружным диаметром слегка больше внутреннего диаметра шприца устанавливали с использованием способа окутывания рукавом. Приблизительно 1,5 мл суспензии вносили в пространство на среднем стопоре и шприц переносили в лиофилизатор. Суспензию лиофилизировали в соответствии с циклом, описанным ниже для того, чтобы получать шприц, в котором заключали композицию сухого остатка. В шприце, содержащем композицию сухого остатка,композиция сухого остатка прилипала к цилиндру шприца, и пространство между внутренней стенкой шприца и композицией сухого остатка отсутствовало.(a) Тепловая обработка: продукт замораживали посредством поддержания приблизительно -40 С в течение приблизительно 3 ч.(b) Первичная сушка: первичную сушку продолжали в течение по меньшей мере 24 ч при повышенной температуре хранения приблизительно -5 С при давлении приблизительно 20 Па или менее. Передний стопор устанавливали над композицией сухого остатка внутри полученного шприца (на стороне иглы, в положении переднего стопора 3, показанного на фиг. 1) с использованием способа окутывания рукавом. Приблизительно 1,7 мл воды в качестве редисперсионной среды вносили в камеру В,которую определяют средний стопор и концевой стопор предварительно заполненного шприца. Концевой стопор устанавливали с использованием способа окутывания рукавом. Передний узел встраивали в выбрасывающую часть кончика шприца. На концевой стопор медленно нажимали для того, чтобы позволить воде в качестве редисперсионной среды течь внутрь передней камеры в течение приблизительно 5 с. Вообще не встряхивая шприц, на концевой стопор нажимали до конца для того, чтобы выталкивать лекарственное текучее вещество из шприца. Количество лекарственного текучего вещества, остающегося в шприце, измеряли и обнаружили равным приблизительно 159 мг. Результаты и обсуждение. Препарат двухкамерного предварительно заполненного шприца в целом получают посредством лиофилизации внутри шприца, как описано в сравнительном примере 3. Подобно изложенному выше,после предоставления воде возможности течь в переднюю камеру в течение периода приблизительно 5 с лекарственное текучее вещество выталкивали вообще без встряхивания шприца. Количество остающегося лекарственного текучего вещества измеряли и обнаружили равным приблизительно 159 мг, т.е. очень большое количество. Таким образом, результаты показывают, что по сравнению со способом из примера 3, в котором оставалось приблизительно 85 мг лекарственного текучего вещества, общий способ, описанный в сравнительном примере 3, проявлял плохую способность к повторному диспергированию. Список ссылочных позицийL - длина от поднятой верхней точки до верхней поверхности; 16 - контейнер; 17 - отверстие; 18 - нижняя поверхность; 19 - внешняя рамка. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Медицинское устройство для применения для подкожного или внутримышечного введения, которое содержит отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, в контейнере для хранения, внутренняя стенка которого обработана силиконом; композиция сухого остатка представляет собой композицию сухого остатка, которую лиофилизировали в контейнере, отдельном от контейнера для хранения; композиция сухого остатка имеет цилиндрическую форму и прочность от 5 до 100 Н, и боковая поверхность композиции цилиндрического сухого остатка выполнена скошенной для образования пространства между внутренней стенкой контейнера для хранения и композицией сухого остатка. 2. Медицинское устройство по п.1, где кажущийся объем композиции сухого остатка составляет от 30 до 99% объема контейнера для хранения. 3. Медицинское устройство по п.1 или 2, где верхняя поверхность композиции цилиндрического сухого остатка выполнена выпуклой. 4. Медицинское устройство по любому из пп.1-3, где контейнер для хранения, обработанный силиконом, представляет собой шприц. 5. Медицинское устройство по п.4, где шприц имеет множество камер и композиция сухого остатка содержится по меньшей мере в одной камере. 6. Медицинское устройство по п.4, где шприц имеет камеру (А) для вмещения композиции сухого остатка и камеру (В) для вмещения инъекционной жидкости; камера (А) расположена на стороне, где размещена игла, а камера (В) расположена на стороне, где размещен поршень; композиция сухого остатка содержится в камере (А), а инъекционная жидкость содержится в камере (В). 7. Композиция сухого остатка для использования в устройстве по пп.1-6, которая содержит арипипразол в качестве активного ингредиента и имеет прочность от 5 до 100 Н, причем композиция сухого остатка имеет цилиндрическую форму и боковая поверхность композиции цилиндрического сухого остатка выполнена скошенной. 8. Композиция по п.7, где процентная доля арипипразола в композиции сухого остатка составляет от 60 до 95 мас.%. 9. Композиция по п.7 или 8, где количество арипипразола в композиции сухого остатка составляет от 0,1 до 0,6 г. 10. Композиция по любому из пп.7-9, получаемая посредством лиофилизации от 0,25 до 12 г суспензии, обладающей содержанием твердых частиц арипипразола от 5 до 45 мас.%. 11. Композиция по любому из пп.7-10, где верхняя поверхность композиции цилиндрического сухого остатка выполнена выпуклой. 12. Композиция по п.7, где композиция сухого остатка представляет собой массу, которую лиофилизировали в контейнере, отдельном от контейнера для хранения в медицинском устройстве. 13. Способ получения медицинского устройства по п.1, в котором заключают отдельно полученную лиофилизированную композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, в контейнер для хранения, внутренняя стенка которого обработана силиконом; причем композиция сухого остатка представляет собой композицию сухого остатка, которую предварительно лиофилизируют в контейнере, отдельном от контейнера для хранения; причем композицию сухого остатка выполняют цилиндрической формы с прочностью от 5 до 100 Н и боковую поверхность композиции цилиндрического сухого остатка выполняют скошенной для образования пространства между внутренней стенкой контейнера для хранения и композицией сухого остатка. 14. Способ по п.13, где контейнер для хранения, обработанный силиконом, представляет собой шприц. 15. Способ по п.14, где шприц имеет множество камер, а композицию сухого остатка помещают по меньшей мере в одну камеру. 16. Способ по п.15, где шприц имеет камеру (А) для вмещения композиции сухого остатка и камеру(В) для вмещения инъекционной жидкости; камеру (А) располагают на стороне, где размещена игла, а камеру (В) располагают на стороне, где размещен поршень; композицию сухого остатка помещают в камеру (А), а инъекционную жидкость помещают в камеру(В). 17. Способ получения композиции сухого остатка по п.7, в котором лиофилизируют суспензию, содержащую арипипразол в качестве активного ингредиента, причем композицию сухого остатка выполняют цилиндрической формы, имеющей прочность от 5 до 100 Н,и боковую поверхность композиции цилиндрического сухого остатка выполняют скошенной для образования пространства между внутренней стенкой контейнера для хранения, обработанной силиконом, и композицией сухого остатка, когда она помещена в устройство по п.1.
МПК / Метки
МПК: A61K 9/19, A61M 5/00, A61K 31/496
Метки: остатка, композиция, устройство, арипипразол, композицию, ингредиента, содержащая, содержащее, качестве, медицинское, содержащую, активного, сухого
Код ссылки
<a href="https://eas.patents.su/23-24814-medicinskoe-ustrojjstvo-soderzhashhee-kompoziciyu-suhogo-ostatka-soderzhashhuyu-aripiprazol-v-kachestve-aktivnogo-ingredienta-i-kompoziciya-suhogo-ostatka-soderzhashhaya-aripiprazo.html" rel="bookmark" title="База патентов Евразийского Союза">Медицинское устройство, содержащее композицию сухого остатка, содержащую арипипразол в качестве активного ингредиента, и композиция сухого остатка, содержащая арипипразол в качестве активного ингредиента</a>
Предыдущий патент: Уплотнение вывода катодных стержней алюминиевого электролизера
Следующий патент: Способ формования листа термопластичного материала
Случайный патент: Способ и устройство определения характеристик коллектора с использованием фотоакустической спектроскопии