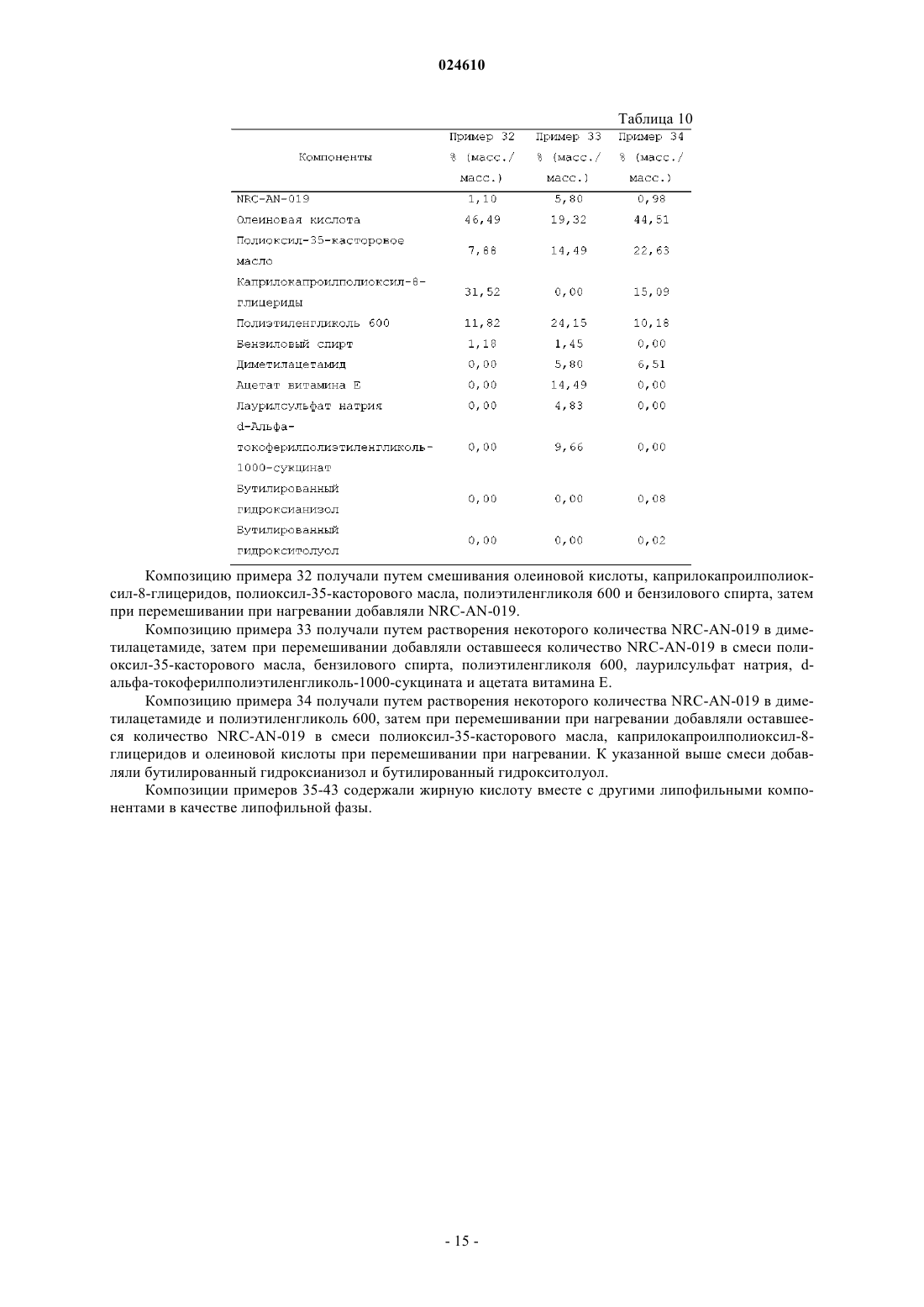
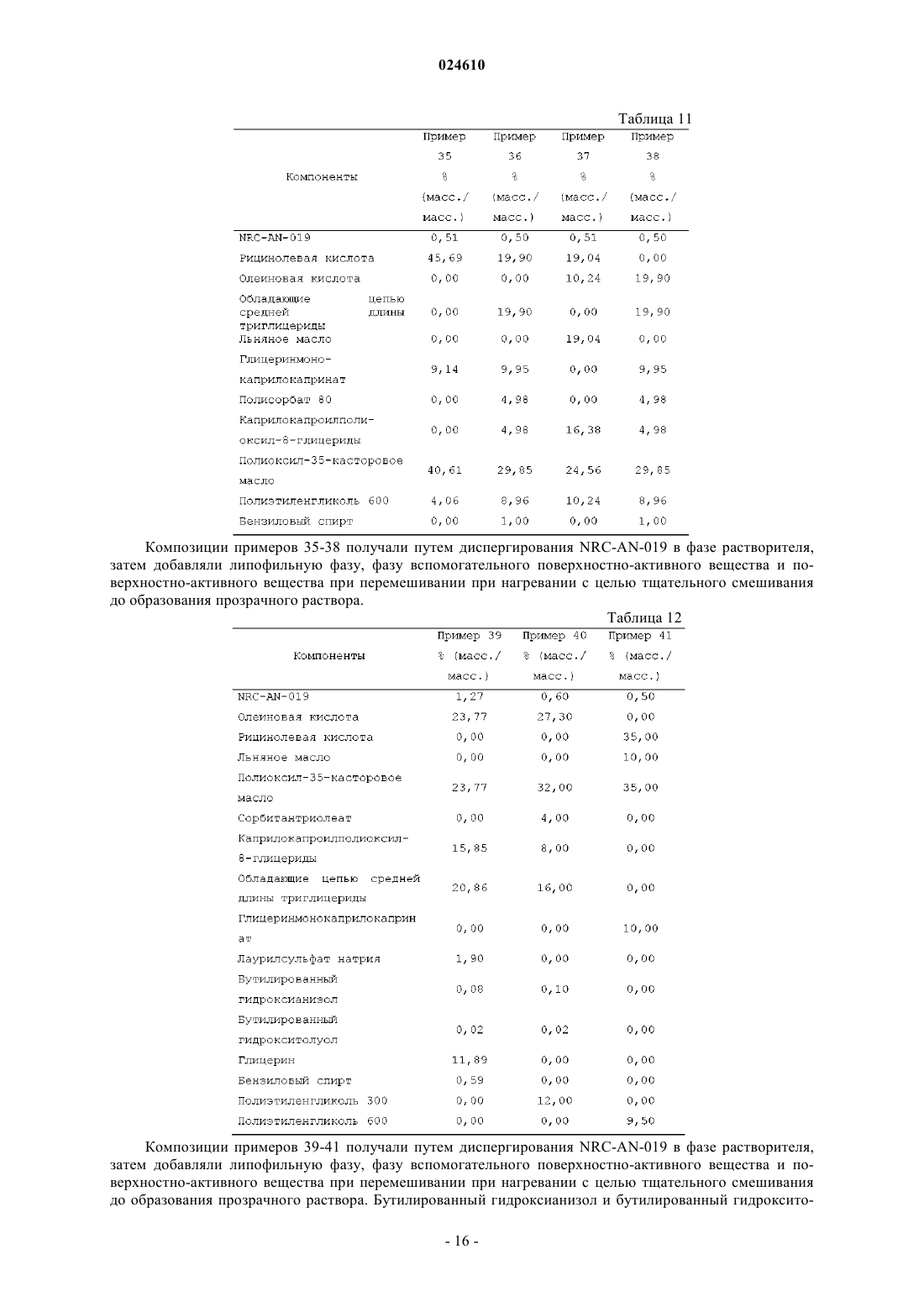
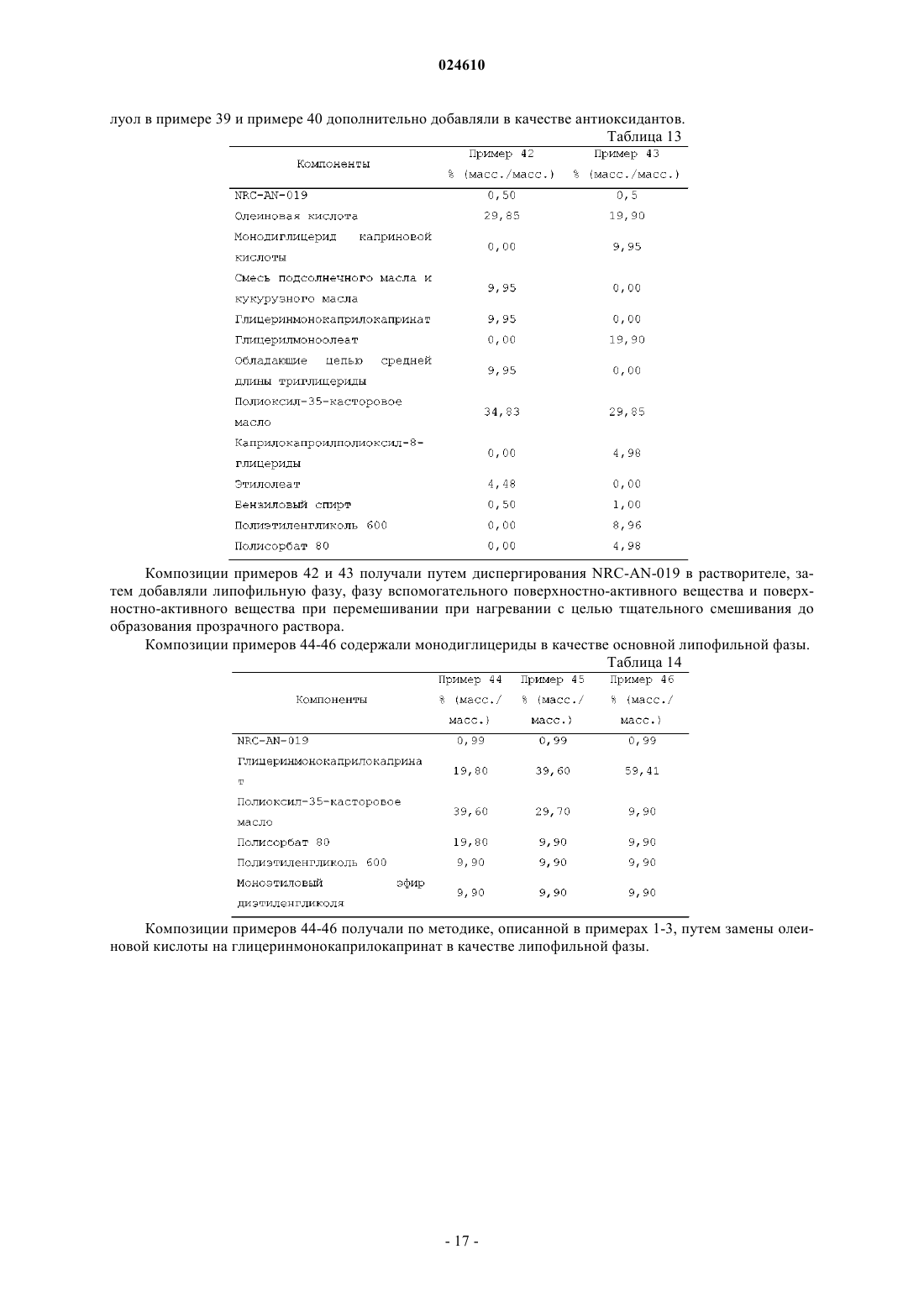
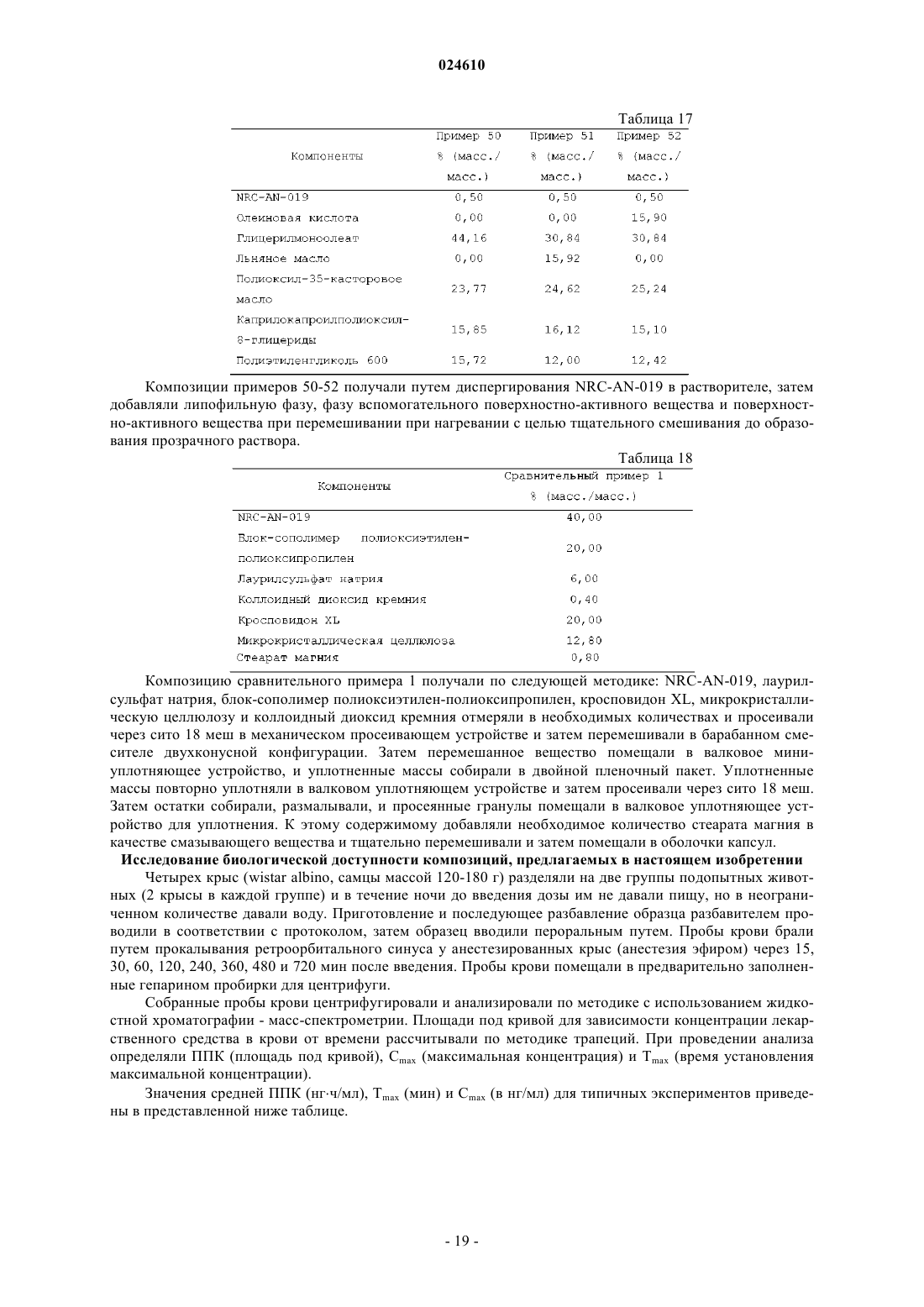
Препарат, содержащий производное фениламинопиримидина в качестве активного средства
Номер патента: 24610
Опубликовано: 31.10.2016
Авторы: Парватанени Дурга Махесвари, Адибхатла Кали Сатья Бхуджанга Рао, Йедлури Сиддхартха, Наннапанени Венкайах Човдари, Аппадведула Венката Сатьянараяна
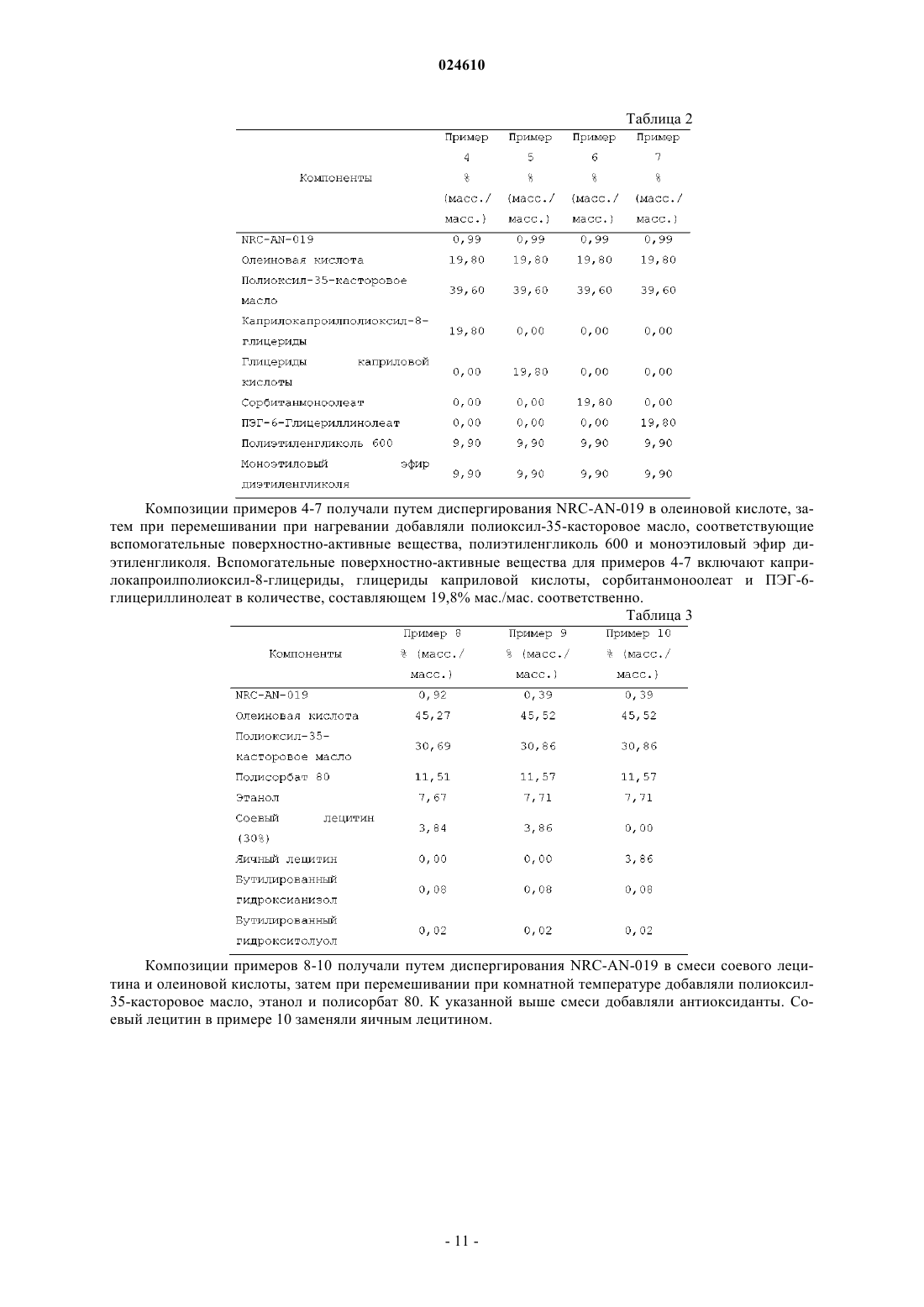
Формула / Реферат
1. Фармацевтическая композиция, предназначенная для перорального введения для лечения рака у пациента, включающая:
(a) терапевтически эффективное количество (3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида (NRC-AN-019) или его фармацевтически приемлемой соли;
(b) липофильную фазу;
(c) по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество и
(d) фармацевтически приемлемый смешивающийся с водой растворитель,
где липофильная фаза включает триглицерид, диглицерид, моноглицерид, C12-C22 жирную кислоту или их смесь и триглицерид, диглицерид или моноглицерид включают остатки C12-С22-жирной кислоты, присоединенные по меньшей мере к одной гидроксигруппе глицеридного фрагмента;
по меньшей мере одно поверхностно-активное вещество содержит полиоксиэтиленгликолированное растительное масло и
смешивающийся с водой растворитель представляет собой полиэтиленгликоль 600, полиоксиэтилен, пропиленкарбонат, тетрагидрофурфуриловый спирт, простой эфир полиэтиленгликоля, глицерин, пропиленгликоль, полиэтиленгликоль, С1-С8-алканол, этанол и бензиловый спирт.
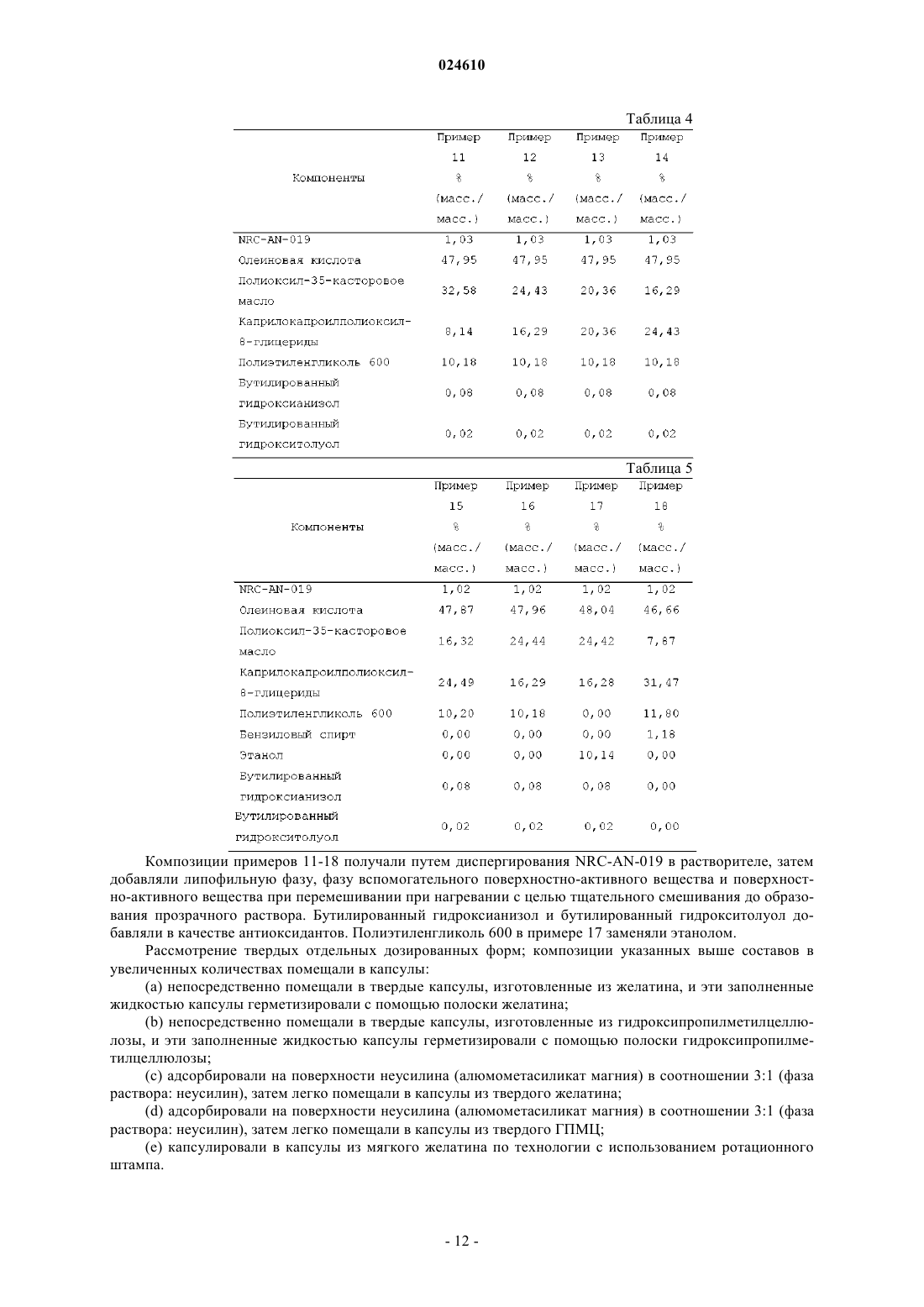
2. Фармацевтическая композиция по п.1, в которой
компонент (а) содержится в количестве, составляющем от 0,1 до 20 мас.% в пересчете на полную массу композиции, предпочтительно от 0,25 до 10 мас.% в пересчете на полную массу композиции;
компонент (b) содержится в количестве, составляющем от 10 до 75 мас.% в пересчете на полную массу композиции, предпочтительно от 12,5 до 65 мас.% в пересчете на полную массу композиции;
компонент (с) содержится в количестве, составляющем от 4 до 70 мас.% в пересчете на полную массу композиции, предпочтительно от 8 до 60 мас.% в пересчете на полную массу композиции;
компонент (d) содержится в количестве, составляющем от 5 до 30 мас.% в пересчете на полную массу композиции, предпочтительно от 5,5 до 25 мас.% в пересчете на полную массу композиции.
3. Фармацевтическая композиция по п.1 или 2, которая включает форму I, форму II или форму III полиморфных форм NRC-AN-019.
4. Фармацевтическая композиция по любому предыдущему пункту, в которой C12-C22-жирная кислота представляет собой мононенасыщенную C12-C20-жирную кислоту, которая является жидкой при комнатной температуре, предпочтительно (Z)-9-октадеценовую кислоту.
5. Фармацевтическая композиция по любому из предыдущих пунктов, в которой остатки С18-ненасыщенной жирной кислоты содержатся в липофильной фазе в количестве, составляющем не менее 20 мас.%, предпочтительно не менее 40 мас.% в пересчете на полную массу липофильной фазы.
6. Фармацевтическая композиция по любому предыдущему пункту, в которой остатки насыщенной жирной кислоты содержатся в липофильной фазе в количестве, составляющем 50 мас.% или менее в пересчете на полную массу липофильной фазы.
7. Фармацевтическая композиция по любому предыдущему пункту, в которой по меньшей мере одно поверхностно-активное вещество включает основное поверхностно-активное вещество и одно или большее количество вспомогательных поверхностно-активных веществ.
8. Фармацевтическая композиция по любому предыдущему пункту, в которой по меньшей мере одно поверхностно-активное вещество - полиоксиэтиленгликолированное касторовое масло, более предпочтительно полиоксил-35-касторовое масло.
9. Фармацевтическая композиция по п.7 или 8, в которой вспомогательное поверхностно-активное вещество содержится в количестве, составляющем от 2 до 60 мас.% в пересчете на полную массу композиции, предпочтительно от 5 до 45 мас.% в пересчете на полную массу композиции.
10. Фармацевтическая композиция по пп.7, 8 или 9, в которой вспомогательное поверхностно-активное вещество включает полиоксилглицерид, предпочтительно каприлокапроилполиоксилглицерид.
11. Фармацевтическая композиция по любому предыдущему пункту, в которой смешивающийся с водой растворитель выступает в качестве среды-носителя для NRC-AN-019.
12. Фармацевтическая композиция по любому предыдущему пункту, которая дополнительно включает антиоксидант, и этот антиоксидант предпочтительно выбран из группы, включающей бутилгидроксианизол, бутилгидрокситолуол и их смесь, более предпочтительно представляет собой смесь бутилгидроксианизола и бутилгидрокситолуола в отношении, составляющем от 6:4 до 9:1, наиболее предпочтительно представляет собой смесь бутилгидроксианизола и бутилгидрокситолуола в отношении, составляющем от 7:3 до 8:2.
13. Фармацевтическая композиция по любому предыдущему пункту, которая дополнительно включает подсластитель, и этим подсластителем предпочтительно является сахарин, более предпочтительно сахарин в количестве, составляющем от 0,1 до 10 мас.% в пересчете на полную массу композиции, наиболее предпочтительно сахарин в количестве, составляющем от 0,25 до примерно 5 мас.% в пересчете на полную массу композиции.
14. Фармацевтическая композиция по любому предыдущему пункту, которая дополнительно включает вкусовое вещество, и это вкусовое вещество предпочтительно выбрано из числа вкусовых веществ на масляной основе, взятых по отдельности или в комбинации, где вкусовое вещество предпочтительно содержится в количестве, составляющем от 0,1 до примерно 10 мас.% в пересчете на полную массу композиции, более предпочтительно от 0,25 до 1 мас.% в пересчете на полную массу композиции.
15. Фармацевтическая композиция по любому предыдущему пункту, которая находится в форме раствора, мягкого геля или препарата в виде капсулы с твердой оболочкой.
16. Фармацевтическая композиция по любому предыдущему пункту, предназначенная для лечения организма человека или животного путем терапии.
17. Применение фармацевтической композиции по любому из пп.1-15 для приготовления лекарственного средства, предназначенного для лечения рака.
18. Способ получения фармацевтической композиции по любому из пп.1-15, который включает смешивание NRC-AN-019 со смешивающимся с водой растворителем, добавление липофильной фазы, добавление поверхностно-активного вещества и перемешивание при нагревании.
19. Способ по п.18, в котором вспомогательное поверхностно-активное вещество добавляют к поверхностно-активному веществу.
20. Способ лечения рака у пациента, который включает введение указанному пациенту терапевтически эффективного количества фармацевтической композиции по любому из пп.1-15.
Текст
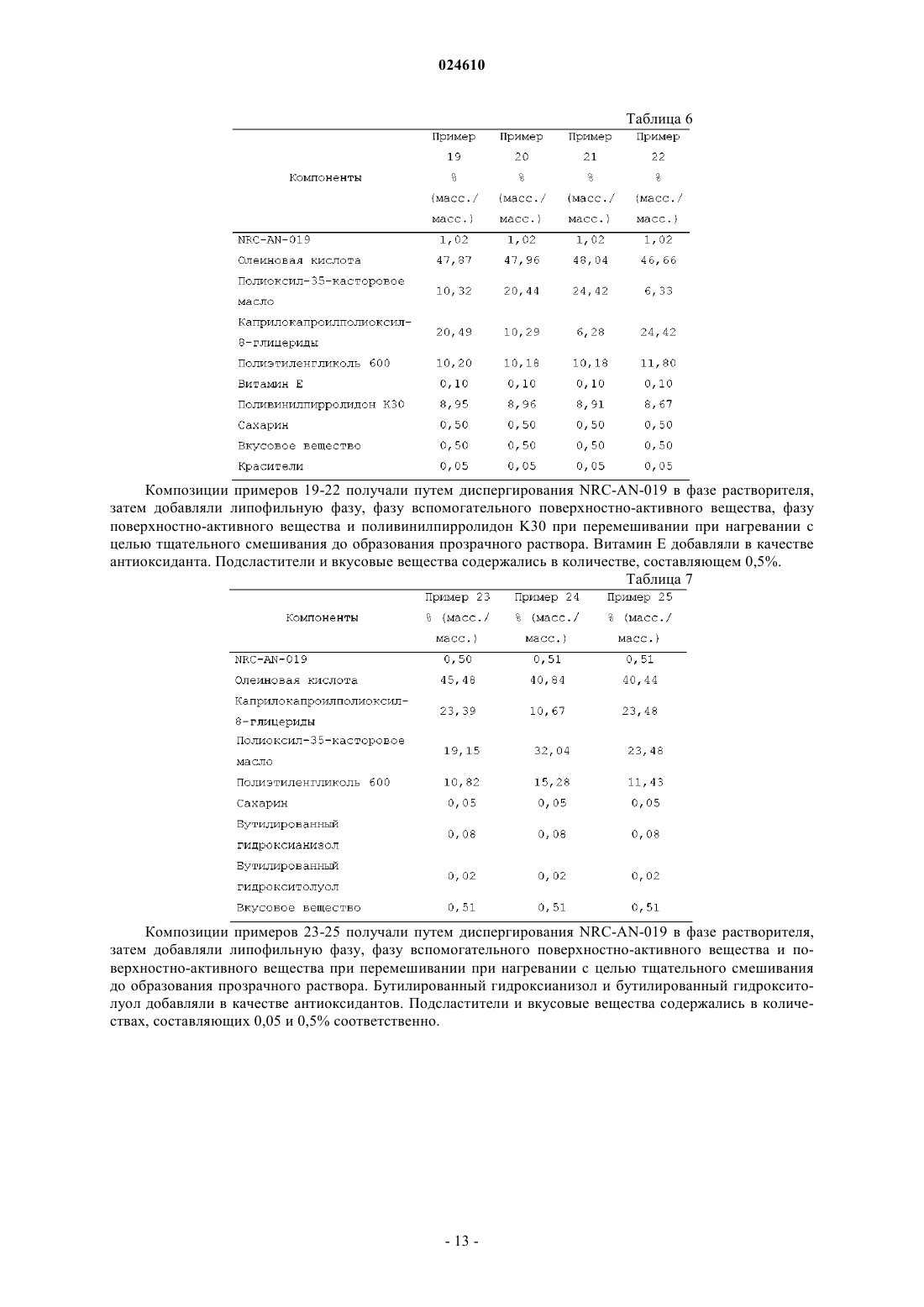
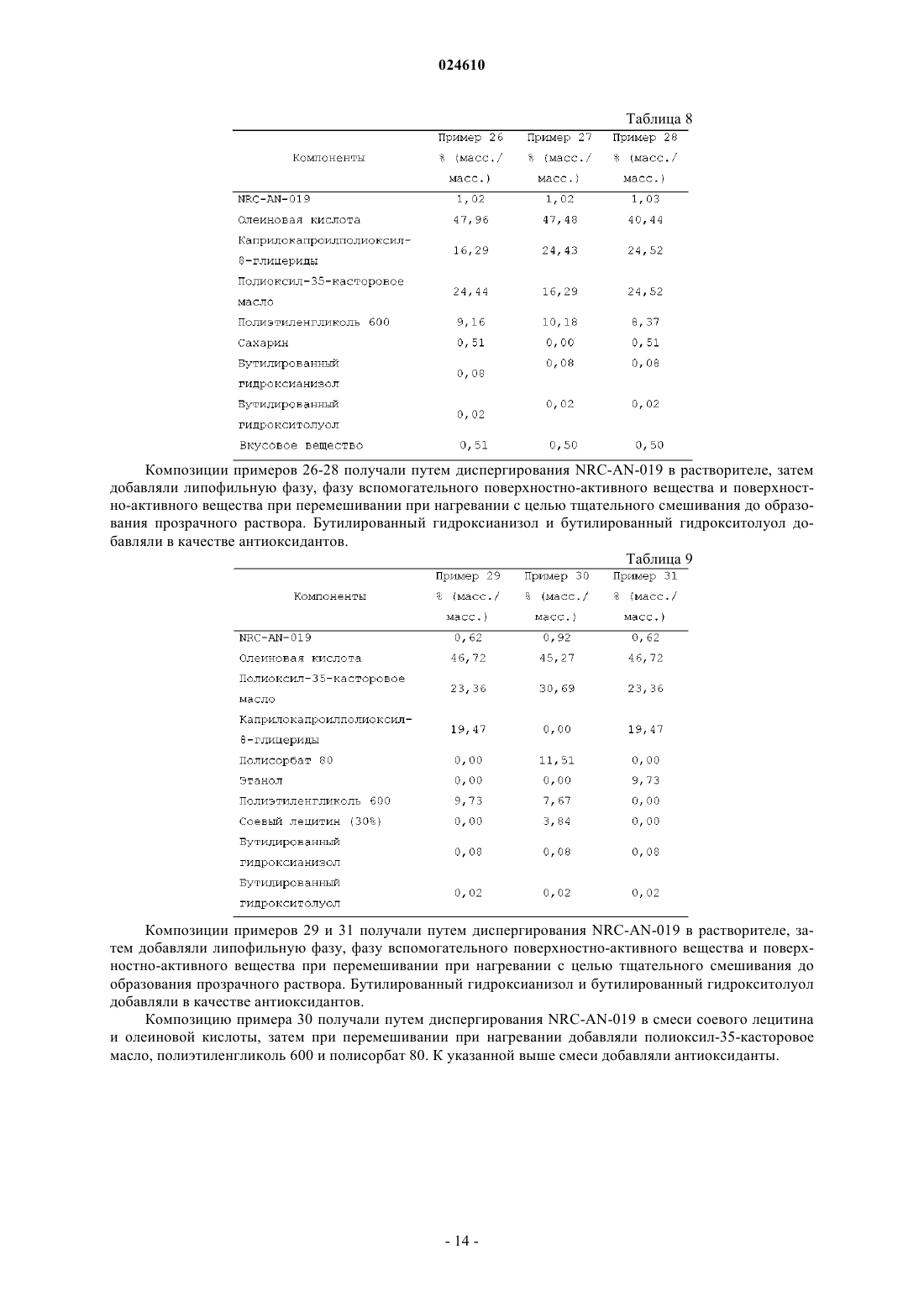
ПРЕПАРАТ, СОДЕРЖАЩИЙ ПРОИЗВОДНОЕ ФЕНИЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ АКТИВНОГО СРЕДСТВА Изобретение относится к фармацевтической композиции, предназначенной для перорального введения для лечения рака у пациента, включающей терапевтически эффективное количество (3,5 бис-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида (NRCAN-019) или его фармацевтически приемлемой соли; липофильную фазу и наполнители. Также описывается применение указанной композиции и способ лечения рака с ее помощью. Парватанени Дурга Махесвари,Йедлури Сиддхартха, Аппадведула Венката Сатьянараяна, Адибхатла Кали Сатья Бхуджанга Рао,Наннапанени Венкайах Човдари (IN) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: НАТКО ФАРМА ЛИМИТЕД (IN) Введение Настоящее изобретение относится к препарату перорального раствора, предназначенного для самопроизвольного эмульгирования, содержащему производное фениламинопиридина, обладающего научноисследовательским кодом NRC-AN-019, включая его фармацевтически приемлемые соли и полиморфные формы, такие как его форма I, форма II и форма III, предназначенному для перорального введения.NRC-AN-019 обладает химическим названием (3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамид, который является производным фениламинопиримидина, и установлено, что он является ингибитором тирозинкиназы BCR-ABL, применимым для лечения хронического миелолейкоза. Также установлено, что NRC-AN-019 является эффективным соединением, воздействующим на другие опухоли, такие как рак головы и шеи, рак предстательной железы и т.п. Его структурная формула имеет видNRC-AN-019 является кристаллическим или аморфным порошкообразным веществом цветом от бледно-желтого до светло-коричневого. Его молекулярная формула имеет вид C25H17F6N5O и его относительная молекулярная масса равна 517,44. NRC-AN-019 практически нерастворим в воде, очень мало растворим в водном буфере при рН 1,2 и нерастворим в нейтральных/щелочных водных буферах. Это лекарственное вещество растворимо в диметилформамиде и диметилсульфоксиде. Настоящее изобретение относится к пероральной дозированной форме, содержащей терапевтически эффективное количество NRC-AN-019, включая его фармацевтически приемлемые соли и полиморфные формы, такие как его форма I, форма II и форма III. Настоящее изобретение, в частности, относится к самопроизвольно эмульгирующемуся препарату для доставки лекарственного средства, содержащемуNRC-AN-019 в растворе, пригодному для перорального введения. Препарат, предлагаемый в настоящем изобретении, применим в качестве противоопухолевого средства для лечения хронического миелолейкоза и некоторых других опухолей, таких как рак головы и шеи, рак предстательной железы и т.п. Настоящее изобретение также относится к способу приготовления указанного препарата. Уровень техники и область техники, к которой относится изобретениеNRC-AN-019 является ингибитором протеинтирозинкиназы; он ингибирует аномальную функцию тирозинкиназы BCR-ABL, которая продуцируется вследствие аномальности филадельфийской хромосомы и обнаруживается при хроническом миелолейкозе (ХМЛ). NRC-AN-019 подавляет пролиферацию клеток и индуцирует апоптоз (запрограммированную гибель клеток) линии клеток BCR-ABL и лейкозных клеток, генерируемых при ХМЛ. Он также эффективно действует на другие опухоли, такие как рак головы и шеи, рак предстательной железы и т.п. С момента первоначального обнаружения тирозинспецифических протеинкиназ, кодируемых трансформированными вирусами и их нормальными клеточными гомологами, проявился значительный интерес к установлению их роли при раке и изучению возможности их применения в качестве мишеней для лекарственных средств. Ингибиторы тирозинкиназы BCR-ABL открыли эпоху молекулярно направленной терапии и стали важным этапом в разработке противоракового лекарственного средства. Пероральное введение лекарственного средства является самым общепринятым путем введения для лечения заболеваний. Липофильные лекарственные средства обладают худшей растворимостью и скоростью высвобождения при введении в виде обычных таблеток или капсул и поэтому обладают меньшей биологической доступностью. Поэтому для решения задачи низкой биологической доступности плохо растворимого лекарственного средства основным фактором является улучшение всасывания перорально введенного лекарственного средства. Применительно к биологической доступности лекарственного средства и различий в ответах пациента на дозу для NRC-AN-019 характерны особые затруднения, связанные с растворимостью и разработкой композиции. Авторы настоящей заявки неожиданно установили,что технология приготовления, основанная на липидах, обеспечивает терапевтически эффективный путь доставки NRC-AN-019 по характеристикам биологической доступности и фармакологического ответа. Новые производные фениламинопиридина предложены как ингибиторы киназы BCR-ABL для лечения хронического миелолейкоза в заявке на патент U.S.20070232633, соответствующей заявке РСТPCT/IN05/000243. В указанной заявке на патент также раскрыты новые промежуточные продукты,которые применимы для получения новых производных фениламинопиридина. В указанной заявке на патент U.S., в частности, описаны новые производные фениламинопиридина общей формулы I, которые можно использовать для лечения хронического миелолейкоза (ХМЛ) вместе с фармацевтически приемлемыми носителями, которые являются подходящими для местного, энтерального, например перорального или ректального, или парентерального введения, и могут быть неорганиче-1 024610 скими или органическими, твердыми или жидкими. В дополнение к активному ингредиенту (ингредиентам) фармацевтические композиции, предлагаемые в указанном изобретении, могут содержать один или большее количество инертных наполнителей или вспомогательных веществ. В примере 14 указанной заявки РСТPCT/IN05/000243 раскрыты препараты в виде капсул, включающие активные соединения, которые получены по методике, описанной в примере 1: (3 трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид и примере 3: (3,5 бис-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид, включая лактозу, поливинилпирролидон, кросповидон и стеарат магния в качестве инертных наполнителей. Особая форма (3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида раскрыта в заявке на патент U.S.20080306100, соответствующей заявке РСТPCT/IN05/000243, и это соединение обозначено как AN-019. Также раскрыты способ его получения и фармацевтические композиции, содержащие эту кристаллическую форму, и их применение в качестве противоопухолевых средств для людей. Раскрытие различных полиморфных форм - формы I, формы II и формы III - подробно описано в заявке на патент U.S.20090227611, соответствующей заявке РСТPCT/IB09/005421. Раскрыто, что,несмотря на наличие ценных фармакологических характеристик, таких как противоопухолевая активность всех указанных форм, установлено, что форма III обладает более высокой термодинамической стабильностью. При использовании в настоящем изобретении указание на полиморфные формы - форму I,форму II и форму III является указанием на соответствующие полиморфные формы, описанные вPCT/IB09/005421, раскрытие которой включено в настоящее изобретение в качестве ссылки. Очень хорошо известно, что производные фениламинопиридина являются весьма полезными для лечения BCR-ABL позитивных раковых и опухолевых заболеваний, таких как лейкозы [в особенности хронического миелолейкоза (ХМЛ) и острого лимфобластного лейкоза, для которых обнаружены особые механизмы апоптического действия]. Поэтому проявлен особый интерес и внимание к разработке новых молекул с последующим применением содержащих их композиций для эффективной терапии. Поскольку(3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид, который является новым производным фениламинопиридина, обозначенным как NRCAN-019, отмечен в предшествующем уровне техники и установлено, что он является ингибитором BCRABL тирозинкиназы, применимым для лечения хронического миелолейкоза, необходима разработка дозированной формы, подходящей для перорального введения теплокровным животным, таким как люди. Применение NRC-AN-019 в качестве активного фармацевтического ингредиента в препарате, предлагаемом в настоящем изобретении, не описано в предшествующем уровне техники. Установлено, что препарат в форме капсулы, раскрытый в одном варианте осуществления в заявке на патент U.S.20070232633, соответствующей заявке РСТPCT/IN05/000243, обладает очень плохими характеристиками всасывания; поэтому необходима разработка лучших дозированных форм, способных обеспечить хорошую биологическую доступность и оптимальные терапевтические концентрации в крови для проявления воздействия лекарственного средства. Разработка этого нового производного фениламинопиридина использована исследователями для создания перорально вводимой дозированной формы, обеспечивающей лучшее соблюдение пациентами режима лечения. По указанным выше причинам возникла необходимость в разработке перорально вводимого препарата для улучшения биологической доступности этого нового производного фениламинопиридина. Одним объектом настоящего изобретения, в частности, являются препараты, включающие NRCAN-019 в качестве активного ингредиента, которые находятся в форме раствора. Препарат, предлагаемый в настоящем изобретении, обеспечивает систему, способную при взаимодействии с желудочным соком самопроизвольно образовать эмульсию. Необходима разработка препаратов и способов их получения, которые обеспечивают лучшую терапевтическую эффективность, легкость перорального введения и экономичность при крупномасштабном производстве. Задачи изобретения В соответствии с этим, главной задачей настоящего изобретения является разработка и получение перорально вводимой фармацевтической композиции NRC-AN-019, включая его фармацевтически приемлемые соли и полиморфные формы, такие как его форма I, форма II и форма III, которые являются ингибиторами BCR-ABL тирозинкиназы и поэтому могут эффективно применяться для лечения хронического миелолейкоза (ХМЛ) и некоторых других опухолей, таких как рак головы и шеи, рак предстательной железы и т.п. Другой задачей настоящего изобретения является получение перорально вводимой фармацевтической композиции в форме перорального раствора, поскольку при пероральном введении NRC-AN-019 наблюдаются затруднения, связанные с его растворимостью, биологической доступностью и изменчивостью ответа пациента на дозу пациента. В соответствии с этим, другой задачей настоящего изобретения является получение фармацевтической композиции перорального раствора в форме препарата на основе липида и обеспечение увеличен-2 024610 ных терапевтических концентраций для лечения указанных выше заболеваний. Точнее, настоящее изобретение относится к разработке способа получения перорального раствора,включающего NRC-AN-019, липидную фазу, поверхностно-активное вещество (вещества) и смешивающийся с водой растворитель. Еще одной задачей настоящего изобретения является разработка способа увеличения биологической доступности липофильного лекарственного средства для пациента, подвергающегося лечению,включающего пероральное введение указанному пациенту фармацевтической композиции, предлагаемой в настоящем изобретении. Еще одной задачей настоящего изобретения является самопроизвольное эмульгирование препарата при пероральном введении после взаимодействия с желудочным соком с последующим увеличением биологической доступности фармацевтического ингредиента. Еще одной задачей настоящего изобретения является тщательное смешивание липофильной фазы,фазы поверхностно-активного вещества (веществ) и растворителя и добавление активного средства с образованием раствора. Еще одной задачей настоящего изобретения является необязательное внесение препарата, предлагаемого в настоящем изобретении, в капсулы или его адсорбция на поверхности любого адсорбирующего материала с последующим приготовлением отдельных дозированных форм в виде таблеток или капсул. Описание изобретения В соответствии с этим, настоящее изобретение относится к фармацевтическому препарату, предназначенному для перорального введения, содержащему NRC-AN-019, включая его фармацевтически приемлемые соли и полиморфные формы, такие как его форма I, форма II и форма III, и к способу его получения для увеличения биологической доступности, так чтобы обеспечить эффективное лечение хронического миелолейкоза и других опухолей, таких как рак головы и шеи, рак предстательной железы и т.п. Настоящее изобретение также относится к способу лечения рака, включающему введение нуждающемуся в нем пациенту фармацевтической композиции, предлагаемой в настоящем изобретении. Настоящее изобретение также относится к фармацевтической композиции, предназначенной для применения для лечения организма человека или животного. Настоящее изобретение также относится к применению препарата, предлагаемого в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения рака. Подробное описание изобретения Настоящее изобретение относится к фармацевтической композиции в виде самопроизвольно эмульгирующейся системы, которая способна in situ образовать эмульсию после перорального введения, когда она вступает во взаимодействие с желудочным соком, включающей NRC-AN-019 в качестве активного ингредиента, применимой для лечения ХМЛ и других опухолей, таких как рак головы и шеи, рак предстательной железы и т.п. Настоящее изобретение относится к фармацевтической композиции, предназначенной для перорального введения, включающей:(а) терапевтически эффективное количество (3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамида (NRC-AN-019) или его фармацевтически приемлемой соли;(c) по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество;(d) фармацевтически приемлемый смешивающийся с водой растворитель. Настоящее изобретение относится к разработке препарата NRC-AN-019, обладающего химическим названием(3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид, который применим в терапии, например, в качестве ингибитора тирозинкиназы для лечения хронического миелолейкоза, рака головы и шеи и рака предстательной железы и для которого установлено, что он обладает полезной противоопухолевой активностью. NRC-AN-019 воздействует на BCR-ABL (протеинтирозинкиназу), которая является важной мишенью для лечения хронического миелолейкоза. Специфические ингибиторы киназы BCR-ABL, например указанное соединение, являются привлекательными лекарственными средствами, поскольку эти киназы регулируют многие клеточные процессы, включая рост и жизнеспособность, и дерегулированная активность этих ферментов участвует в злокачественном преобразовании при различных неоплазиях. Разработка этого соединения является следствием значительных научно-исследовательских работ, которые начинают демонстрировать хорошие клинические перспективы.NRC-AN-019 является сильно гидрофобным и поэтому биологическая доступность, обеспечивающаяся при использовании других пероральных дозированных форм, таких как капсулы, таблетки, является низкой, и значительно меняются концентрации в организме. Для обеспечения эффективной противораковой терапии содержание активного соединения в сыворотке крови необходимо поддерживать в заданном диапазоне и обеспечивать оптимальный диапазон доз. Основным затруднением, приводящим к проблеме низкой биологической доступности, является характерная нерастворимость NRC-AN-019, например, в водных средах и, следовательно, трудность полу-3 024610 чения дозированной формы, которая может содержать лекарственное средство в концентрации, достаточно эффективной для удобного использования и одновременного обеспечения биологической доступности, например, обеспечивающей эффективное всасывание в желудке или просвете кишечника и постоянные и достаточно эффективные содержания в сыворотке крови. Основными механизмами, по которым препараты на основе липидов увеличивают биологическую доступность, считается солюбилизация лекарственного средства, и они включают уменьшение обусловленного п-гликопротеином оттока, уменьшение пресистемного метаболизма в печени путем усиленного переноса с лимфой, увеличение времени транзита пищи по желудочно-кишечному тракту или защита от разложения в желудочно-кишечном тракте. Это способствует быстрому и менее непостоянному всасыванию. Обычно в препарате, предлагаемом в настоящем изобретении, NRC-AN-019, включая его фармацевтически приемлемые соли и полиморфные формы, такие как его форма I, форма II и форма III, используют в количестве, составляющем от примерно 0,05 до примерно 50 мас.%, предпочтительно от примерно 0,1 до примерно 20 мас.% и более предпочтительно от примерно 0,25 до примерно 10 мас.% в пересчете на полную массу композиции. Липофильная фаза в композиции, предлагаемой в настоящем изобретении, обычно включает фармацевтически приемлемую липофильную среду, такую как триглицерид, диглицерид, моноглицерид,жирную кислоту или производное жирной кислоты, или их смесь. Обычно жирные кислоты содержат карбоксильный фрагмент, присоединенный к линейному или разветвленному, насыщенному или ненасыщенному С 1-С 21-алифатическому фрагменту. Обладающие длинной цепью жирные кислоты, включая С 12-С 22-жирные кислоты, в которых указанный алифатический фрагмент содержит от 11 до 21 атомов углерода; обладающие цепью средней длины жирные кислоты, включая С 6-С 11-жирные кислоты, в которых указанный алифатический фрагмент содержит от 5 до 10 атомов углерода; и обладающие короткой цепью жирные кислоты, включая С 2-С 5-жирные кислоты, в которых указанный алифатический фрагмент содержит от 1 до 4 атомов углерода, являются подходящими, и обладающие длинной цепью и цепью средней длины жирные кислоты или их триглицериды являются особенно предпочтительными. Примеры жирных кислот, которые могут содержаться в липофильной фазе в форме свободной кислоты или в виде триглицеридных, диглицеридных или моноглицеридных эфиров, включают уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, капроновую кислоту, энантовую кислоту, каприловую кислоту, пеларгоновую кислоту, каприновую кислоту, ундециловую кислоту,лауриновую кислоту, тридециловую кислоту, миристиновую кислоту, пентадециловую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, нонадециловую кислоту, арахиновую кислоту, генэйкозановую кислоту, бегеновую кислоту, -линоленовую кислоту, стеаридоновую кислоту,эйкозапентаеновую кислоту, докозагексаеновую кислоту, линолевую кислоту, -линоленовую кислоту,лигомолиноленовую кислоту, арахидоновую кислоту, олеиновую кислоту, элаидиновую кислоту, эйкозеновую кислоту, эруковую кислоту, нервоновую кислоту и рицинолевую кислоту. Чаще липофильная фаза включает смеси моно-, ди- и триглицеридов, где моно-, ди- и триглицериды содержат остатки С 12-С 20-жирной кислоты, присоединенные по меньшей мере к одной гидроксигруппе глицеридного фрагмента. Предпочтительно, если указанные остатки С 12-С 20-жирной кислоты присоединены к каждой гидроксигруппе глицеридного фрагмента. Предпочтительно, если указанные остатки С 12-С 22-жирной кислоты представляют собой остатки С 16-С 18-жирной кислоты. Указанные смешанные моно-, ди- и триглицериды могут содержать остатки и насыщенной, и ненасыщенной жирной кислоты. В предпочтительном варианте осуществления липофильная фаза в препарате, предлагаемом в настоящем изобретении, включает остатки ненасыщенной жирной кислоты, обычно остатки C18 ненасыщенной жирной кислоты, такой как рицинолевая кислота, линоленовая кислота, линолевая кислота и олеиновая кислота. Обычно указанные остатки ненасыщенной жирной кислоты содержатся в количестве, составляющем не менее 20 мас.%, более предпочтительно не менее 40 мас.% или более в пересчете на полную массу липофильной фазы. Предпочтительно, если остатки насыщенных жирных кислот,таких как остатки стеариновой кислоты, миристиновой кислоты и пальмитиновой кислоты, содержатся в количестве, составляющем 50 мас.% или менее в пересчете на полную массу липофильной фазы. Липофильную фазу в фармацевтической композиции, предлагаемой в настоящем изобретении,можно получить путем гидролиза различных животных и растительных жиров и масел, например оливкового масла с последующим разделением жидких кислот. Предпочтительной жидкой кислотой, получаемой таким образом, является (Z)-9-октадеценовая кислота, также известная, как олеиновая кислота. Олеиновая кислота является мононенасыщенной омега-9 жирной кислотой (это означает, что только одна двойная углерод-углеродная связь находится у девятого от свободного конца алифатического фрагмента атома углерода), обнаруживаемой в различных животных и растительных источниках. Олеиновую кислоту можно охарактеризовать удельным весом, равным 0,889-0,895, кислотным числом, равным 196204, йодным числом, равным 85-95, плотностью, равной 0,895 г/см 3, и температурой плавления, равной 4 С. Обычно липофильная фаза фармацевтической композиции, предлагаемой в настоящем изобрете-4 024610 нии, содержится в количестве, составляющем от примерно 5 до примерно 85 мас.%, предпочтительно от примерно 10 до примерно 75 мас.% и более предпочтительно от примерно 12,5 до примерно 65 мас.% в пересчете на полную массу композиции. В предпочтительном варианте осуществления липофильная фаза препарата, предлагаемого в настоящем изобретении, включает эфиры спирта с С 8-С 10-жирными кислотами, такие как моно-, ди- и моно/диглицериды, обладающих цепью средней длины жирных кислот, например каприловой и каприновой кислот и их смеси, нейтральные масла, такие как нейтральные растительные масла, в частности частично фракционированные кокосовые масла, известные под торговым названием Миглиол, выпускающиеся под названиями Миглиол 810 и Миглиол 812 (фракционированное кокосовое масло, включающее триглицериды каприловой-каприновой кислоты) и Миглиол 818 (триглицерид каприловой-каприновойлинолевой кислоты), Captex 355 (триглицериды каприловой-каприновой кислоты) и т.п. Другие подходящие триглицериды каприловой-каприновой кислоты известны и имеются в продаже под торговым названием Myritol, включая продукт Myritol 318. Другими подходящими продуктами этого класса являютсяCaptex 300 (триглицериды каприловой/каприновой кислоты) и Captex 800 (пропиленгликольдиэтилгексаноат), Neobee M 5 (триглицерид каприловой/каприновой кислоты) и т.п. В другом предпочтительном варианте осуществления липофильная фаза препарата, предлагаемого в настоящем изобретении, включает фармацевтически приемлемое масло, предпочтительно с ненасыщенным компонентом, такое как растительное масло или рыбий жир. Липофильная фаза также может включать подходящие переэтерифицированные этоксилированные растительные масла, такие как получаемые по реакции различных натуральных растительных масел (например, маисового масла, ядрового масла, миндального масла, арахисового масла, оливкового масла, соевого масла, подсолнечного масла,кукурузного масла, сафлорового масла и пальмового масла или их смеси) с полиэтиленгликолями, которые обладают молекулярной массой, равной 200-800, в присутствии подходящего катализатора. Переэтерифицированные этоксилированные растительные масла известны и имеются в продаже под торговым названием Лабрафил (например, Лабрафил М 2125CS, Лабрафил М 1944 CS, Лабрафил М 2130 CS) и т.п. Препарат, предлагаемый в настоящем изобретении, также включает одно или большее количество фармацевтически приемлемых поверхностно-активных веществ. Поверхностно-активные вещества способствуют установлению значения показателя гидрофильно-липофильного баланса (ГЛБ), необходимого для эмульгирования. Компонент - поверхностно-активное вещество может включать гидрофильные или липофильные поверхностно-активные вещества или их смесь. При использовании в настоящем изобретении гидрофильное поверхностно-активное вещество обладает значением показателя ГЛБ, превышающим 10, и липофильное поверхностно-активное вещество обладает значением показателя ГЛБ, меньшим чем 10. Особенно предпочтительными являются неионогенные гидрофильные и неионогенные липофильные поверхностно-активные вещества. Обычно указанное гидрофильное поверхностно-активное вещество представляет собой поверхностно-активное вещество, которое обладает относительно большим значением показателя ГЛБ, обычно равным от 11 до 15, чаще от 12 до 14, включающее, но не ограниченное только ими, продукты реакции натуральных или гидрированных растительных масел и этиленгликоля, и этими продуктами реакции являются полиоксиэтиленгликолированные натуральные или гидрированные растительные масла, например полиоксиэтиленгликолированные натуральные или гидрированные касторовые масла. Такие продукты также можно получить по реакции натурального или гидрированного касторового масла с этиленоксидом, например, при молярном отношении, составляющем от 1:5 до примерно 1:200 с последующей необязательной очисткой. Продукт кремофор EL является особенно предпочтительным и его можно получить по реакции 1 моля касторового масла с 35-40 молями этиленоксида и он обладает химическим названием полиоксил-35-касторовое масло. Кремофор EL обладает числом омыления, равным 65-70, кислотным числом, равным 2,0, йодным числом, равным 25-35, значением показателя ГЛБ, равным 12-14, гидроксильным числом, равным 65-78,содержанием воды (%), равным 2,8 (определено по методике Карла Фишера), и температурой плавления,равной 19-20 С. Другие гидрофильные поверхностно-активные вещества, подходящие для применения в настоящем изобретении, включают тензиды, такие как выпускающиеся под торговым названием Nikkol НСО-60,который является продуктом реакции гидрированного касторового масла и этиленоксида. Другие примеры указанного гидрофильного поверхностно-активного вещества включают полиоксиэтилированные эфиры сорбитана и жирных кислот, например полиоксиэтиленпроизводные моно- и трилауриловые, -пальмитиловые, -стеариловые или олеиловые эфиры сорбитана, такие как известные и имеющиеся в продаже под торговым названием Tween, включая продукты: Tween 20 [полиоксиэтилен(20)-сорбитанмонолаурат], Tween 21 [полиоксиэтилен-(4)-сорбитанмонолаурат], Tween 40 [полиоксиэтилен-(20)-сорбитанмонопальмитат], Tween 60 [полиоксиэтилен-(20)-сорбитанмоностеарат], Tween 61 [полиоксиэтилен-(4)-сорбитанмоностеарат], Tween 65 [полиоксиэтилен-(20)-сорбитантристеарат], Tween 80[полиоксиэтилен-(20)-сорбитантриолеат], Tween 120 [полиоксиэтилен-(20)-сорбитанмоноизостеарат]. Предпочтительно, если полиоксиэтиленсорбитановый эфир жирной кислоты, использующийся в компо-5 024610 зициях, предлагаемых в настоящем изобретении, представляет собой Tween 80 [полиоксиэтилен-(20)сорбитанмоноолеат], который обладает гидроксильным числом, равным 65-80, кислотным числом, равным 2%, и числом омыления, равным 45-55. Другими гидрофильными поверхностно-активными веществами, которые можно использовать, являются полиоксиэтиленовые эфиры жирных кислот, полиоксиглицериды, сополимеры полиоксиэтиленполиоксипропилен, диоктилсукцинат, диоктилсульфосукцинат натрия или лаурилсульфат натрия, фосфолипиды (в частности, лецитин), пропиленгликолевые эфиры одноосновных и двухосновных жирных кислот, соли желчных кислот и т.п. Количество использующегося гидрофильного поверхностно-активного вещества обычно находится в диапазоне от примерно 5 до примерно 60 мас.%, предпочтительно от примерно 10 до примерно 50 мас.% в пересчете на полную массу композиции. Обычно в другом варианте осуществления настоящего изобретения липофильное поверхностноактивное вещество представляет собой поверхностно-активное вещество, обладающее относительно низким значением показателя ГЛБ, обычно равным от 5 до 7, чаще от 4 до 8, такое как, но не ограничиваясь только ими, эфиры жирных кислот и сорбитана, например, известного типа и имеющиеся в продаже под торговым названием Span, например, включая монолауриловый, монопальмитиловый, моностеариловый, тристеариловый, моноолеиловый и триолеиловый эфиры сорбитана. Другие примеры липофильных поверхностно-активных веществ, которые можно использовать в настоящем изобретении, включают переэтерификации триглицеридов натурального растительного масла и полиалкиленполиолы, моно-, ди- и моно/диглицериды (в особенности продукты этерификации каприловой или каприновой кислоты глицерином), эфиры жирных кислот и сорбитана, пентаэритритовые эфиры жирных кислот и простые эфиры полиалкиленгликолей, моноглицериды, глицеринтриацетат или триацетин, стерины, их производные и т.п. Количество использующегося липофильного поверхностно-активного вещества обычно находится в диапазоне от примерно 5 до примерно 60 мас.%, предпочтительно от примерно 10 до примерно 50 мас.% в пересчете на полную массу композиции. Обычно указанное по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество представляет собой указанное по меньшей мере одно липофильное поверхностно-активное вещество. В другом варианте осуществления указанное по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество представляет собой по меньшей мере одно гидрофильное поверхностно-активное вещество. В другом варианте осуществления указанное по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество представляет собой по меньшей мере одно поверхностно-активное вещество, выбранное из числа гидрофильных и липофильных поверхностно-активных веществ. В другом варианте осуществления указанное по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество представляет собой по меньшей мере одно поверхностно-активное вещество, выбранное из числа гидрофильных и липофильных поверхностно-активных веществ. В одном варианте осуществления препарат, предлагаемый в настоящем изобретении, включает по меньшей мере одно из указанных выше поверхностно-активных веществ. Обычно фармацевтическая композиция, предлагаемая в настоящем изобретении, включает липофильное или гидрофильное поверхностно-активное вещество, определенное выше, в качестве основного поверхностно-активного вещества и одно или большее количество вспомогательных поверхностноактивных веществ. Если содержится вспомогательное поверхностно-активное вещество, его можно выбрать из числа любых типов поверхностно-активных веществ, указанных в приведенных выше типах поверхностно-активных веществ. Фаза вспомогательного поверхностно-активного вещества увеличивает эффективность основного поверхностно-активного вещества. Предпочтительным вспомогательным поверхностно-активным веществом является полиоксиглицерид, который можно получить (i) путем частичного алкоголиза растительных масел с помощью макроголов, (ii) путем этерификации глицерина и макроголов ненасыщенными жирными кислотами и (iii) путем смешивания сложных эфиров глицерина и продуктов конденсации этиленоксида с жирными кислотами растительных масел. Обычно полиоксиглицериды, использующиеся в качестве вспомогательных поверхностно-активных веществ, включают смесь сложных моноэфиров, диэфиров и триэфиров глицерина и сложных моноэфиров и диэфиров полиэтиленгликоля (ПЭГ), предпочтительно обладающих средней относительной молекулярной массой, равной 200-400. Такие полиоксиглицериды можно получить в виде продукта частичного алкоголиза обладающих цепью средней длины триглицеридов полиэтиленгликолем, каприловой (октановой) кислотой и каприновой (декановой) кислотой или можно получить путем смешивания сложных эфиров глицерина и продуктов конденсации этиленоксида с каприловой кислотой и каприновой кислотой. Предпочтительными полиоксиглицеридными вспомогательными поверхностно-активными веществами, предназначенными для использования в настоящем изобретении, являются каприлокапроилполиоксиглицериды, такие как имеющиеся в продаже под торговым названием лабразол, которые обладают кислотным числом, равным 2,0, йодным числом, равным 2,0, числом омыления, равным 85-105, и гид-6 024610 роксильным числом, равным 170-205. Необязательными другими вспомогательными поверхностно-активными веществами, которые можно использовать, являются лауроилполиоксилглицериды, имеющиеся в продаже под торговым названием гелюцир 44/14, линолеоилполиоксилглицериды, имеющиеся в продаже под торговым названием лабрафил M2125CS, олеоилполиоксилглицериды, имеющиеся в продаже под торговым названием лабрафил M1944CS, стеароилполиоксилглицериды, имеющиеся в продаже под торговым названием гелюцир 50/13. Если содержится вспомогательное поверхностно-активное вещество, то его обычно используют в количестве, находящемся в диапазоне от примерно 2 до примерно 60 мас.% и предпочтительно от примерно 5 до примерно 45 мас.% в пересчете на полную массу композиции. В одном особенно предпочтительном варианте осуществления указанное основное поверхностноактивное вещество представляет собой полиоксил-35-касторовое масло и указанное одно или большее количество вспомогательных поверхностно-активных веществ представляет собой каприлокапроилполиоксил-8-глицерид. В другом особенно предпочтительном варианте осуществления указанное основное поверхностноактивное вещество представляет собой полиоксил-35-касторовое масло и указанное одно или большее количество вспомогательных поверхностно-активных веществ представляет собой каприлокапроилполиоксил-8-глицерид и полисорбат 80. В еще одном особенно предпочтительном варианте осуществления указанное основное поверхностно-активное вещество представляет собой полиоксил-35-касторовое масло и указанное одно или большее количество вспомогательных поверхностно-активных веществ представляет собой глицеринмонокаприлокапринат. В еще одном особенно предпочтительном варианте осуществления указанное основное поверхностно-активное вещество представляет собой полиоксил-35-касторовое масло и указанное одно или большее количество вспомогательных поверхностно-активных веществ представляет собой этилолеат. Полное количество использующейся фазы поверхностно-активного вещества обычно находится в диапазоне от примерно 4 до примерно 70 мас.% и предпочтительно от примерно 8 до примерно 60 мас.% в пересчете на полную массу композиции. Препарат, предлагаемый в настоящем изобретении, дополнительно включает фармацевтически приемлемый смешивающийся с водой растворитель. Смешивающийся с водой растворитель, использующийся в настоящем изобретении, выступает в качестве среды-носителя для NRC-AN-019, способствует солюбилизации содержащегося в большой концентрации лекарственного средства, а также облегчает поступление воды в препарат. В настоящем изобретении особенно предпочтительный растворитель включает фармацевтически приемлемый смешивающийся с водой растворитель, которым является производное -гидрогидроксиполи (окси-1,2-этандиила), которое обладает средней молекулярной массой, равной 570-613, температурой вспышки, равной 250 С, плотностью, равной 1,080 г/см 3, гидроксильным числом, равным 178-197, и вязкостью, равной 9,9-11,3 мм 2/с (при 98,9 С 0,3 С). Особенно предпочтительным является полиэтиленгликоль, обладающий средней молекулярной массой, равной 600, выпускающийся под торговым названием POGOL 600. Другие примеры включают моноэтиловый эфир диэтиленгликоля, обладающий средней молекулярной массой, равной от 134,2; плотностью, равной 0,988 г/см 3; гидроксильным числом, равным 300-400, и температурой кипения, равной 197-205 С. В частности, установлено, что использование определенных выше компонентов дает композиции, в которых смешивающийся с водой растворитель является особенно подходящим в качестве средыносителя для NRC-AN-019. Композиции указанного состава, включающие компоненты, указанные как смешивающийся с водой растворитель, разумеется, могут дополнительно или альтернативно включать один или большее количество других ингредиентов в качестве фазы растворителя. Другие примеры подходящих смешивающихся с водой растворителей включают полиоксиэтилен,пропиленкарбонат, тетрагидрофурфуриловый спирт, простой эфир полиэтиленгликоля, глицерин, пропиленгликоль, полиэтиленгликоли и низшие алканолы, предпочтительно C1-C8-алканолы, такие как этанол и бензиловый спирт. Хотя использование алканолов, например этанола и/или бензилового спирта, в качестве компонентов фазы растворителя по определенным причинам предусматривается авторами настоящего изобретения, они обычно являются менее предпочтительным. Указанный фармацевтически приемлемый смешивающийся с водой растворитель, разумеется, может представлять собой смесь двух или большего количества разных растворителей. Однако NRC-AN019 обычно обладает достаточной растворимостью в любом содержащемся растворителе, таком как смесь, так что эффективность системы носителя существенно не ухудшается. Количество содержащегося смешивающегося с водой растворителя обычно составляет от примерно 2 до примерно 60 мас.%, предпочтительно от примерно 5 до примерно 30 мас.% и более предпочтительно от примерно 5,5 до примерно 25 мас.% в пересчете на полную массу композиции. Препарат, предлагаемый в настоящем изобретении, необязательно может включать один или боль-7 024610 шее количество антиоксидантов в подходящем диапазоне концентраций для предотвращения окислительного прогоркания липидной фазы, использующейся в указанной композиции. Подходящие антиоксиданты включают -токоферол, пальмитат аскорбиновой кислоты, бутилированный гидроксианизол(БГА), бутилированный гидрокситолуол (БГТ), алкилгаллаты, такие как пропилгаллат, лаурилгаллат или октилгаллат, каротины, карнозиновую кислоту и т.п. Предпочтительно, если антиоксидантом является поглощающий свободные радикалы антиоксидант. Более предпочтительно, если антиоксидант выбран из группы, включающей бутилированный гидрокситолуол, бутилированный гидроксианизол и их смеси. Один или большее количество антиоксидантов, если это необходимо, содержатся в композициях, предлагаемых в настоящем изобретении, в определенном количестве, обеспечивающем стабильность фармацевтической композиции. Бутилгидроксианизол и бутилгидрокситолуол можно использовать в качестве антиоксидантов по отдельности или в комбинации. При использовании в комбинации их предпочтительно используют в соотношении, составляющем от 6:4 до 9:1, более предпочтительно в соотношении, составляющем от 7:3 до 8:2. Антиоксидант бутилгидроксианизол обычно используют в количестве, находящемся в диапазоне от примерно 0,01 до примерно 5 мас.%, предпочтительно от примерно 0,02 до примерно 3 мас.% и более предпочтительно от примерно 0,05 до примерно 2 мас.% в пересчете на полную массу композиции. Количество использующегося бутилгидрокситолуола обычно находится в диапазоне от примерно 0,001 до примерно 4 мас.%, предпочтительно от примерно 0,002 до примерно 3 мас.% и более предпочтительно от примерно 0,01 до примерно 0,5 мас.% в пересчете на полную массу композиции. Композиции, предлагаемые в настоящем изобретении, необязательно включают один или большее количество приемлемых с пищевой точки зрения растворимых в масле подсластителей. Подсластитель можно использовать для улучшения приемлемости дозированной формы для пациента. Обычно подсластитель выбран из группы, включающей маннит, натриевую соль сахарина, пропиленгликоль, ацесульфам К, сукралозу, неотам, аспартам и сахарин. Подсластитель также может усиливать вкус системы. Количество использующегося подсластителя обычно находится в диапазоне от примерно 0,1 до примерно 10 мас.% и предпочтительно от примерно 0,25 до примерно 5 мас.% в пересчете на полную массу композиции. Композиции, предлагаемые в настоящем изобретении, необязательно включают один или большее количество приемлемых с пищевой точки зрения вкусовых веществ. Вкусовые вещества могут обеспечить лучшее соблюдение пациентами режима лечения, делая композицию вкуснее. Вкусовые вещества, которые растворимы в масле, известны специалистам в данной области техники и включают масло мяты, лишенное ментола масло мяты перечной, лимонное масло, масло из листьев коричного дерева, масло из коры коричного дерева, кардамонное масло, тминное масло, масло из семян кориандра, тимьянное масло, коричное масло, апельсиновое масло, бадьяновое масло, масло из семян укропа, фенхельное масло, мускатное масло бензальдегид, коричный альдегид, сульфоксилат натриевой соли формальдегида, ванилин, этилванилин и этилацетат. Такие вкусовые вещества дают прозрачные и гомогенные препараты, которые с эстетической точки зрения приятны для потребителя. Количество использующегося вкусового вещества обычно находится в диапазоне от примерно 0,1 до примерно 10 мас.% и предпочтительно от примерно 0,25 до примерно 5 мас.% или более предпочтительно от 0,25 до 1 мас.% в пересчете на полную массу композиции. Композиции, предлагаемые в настоящем изобретении, необязательно включают один или большее количество красящих веществ. Красящие вещества можно добавлять для получения продукта, обладающего более привлекательным и/или характерным внешним видом. Подходящие красящие вещества включают экстракционное эфирное масло куркумы, экстракционное эфирное масло красного перца, экстракционное эфирное масло календулы и т.п. Красящие вещества можно использовать в количестве, находящемся в диапазоне от примерно 0,025 до примерно 0,25 мас.%, предпочтительно от примерно 0,05 мас.% до примерно 0,2 мас.% и более предпочтительно от примерно 0,01 до примерно 0,1 мас.% в пересчете на полную массу композиции. Композиции, предлагаемые в настоящем изобретении, необязательно включают один или большее количество приемлемых с пищевой точки зрения консервантов. Неограничивающие примеры таких консервантов включают бензойную кислоту, бензоат натрия, бензэтонийхлорид, бензиловый спирт, хлорбутанол, фенилэтиловый спирт, метилпарабен, пропилпарабен и т.п. Композиции, предлагаемые в настоящем изобретении, необязательно включают стабилизаторы, такие как подкислители, которые могут быть растворимы в липиде и/или растворимы в этаноле. Подкислителем может быть, например, жирная кислота или карбоновая кислота, обычно моно-, ди- или трикарбоновая кислота, предпочтительно моно- или дикарбоновая кислота. Подкислитель может включать одну или большее количество гидрофильных групп, например гидроксигруппы, предпочтительно одну или две гидрофильные группы. Кислоты, подходящие для использования в настоящем изобретении, включают олеиновую кислоту, малоновую кислоту, фумаровую кислоту, фамоновую кислоту, малеиновую кислоту, D-яблочную кислоту, L-яблочную кислоту, лимонную кислоту, янтарную кислоту, щавелевую кислоту, бензойную кислоту или молочную кислоту или кислоту, обладающую близким значением pKa,-8 024610 например, равным 2-7. Предпочтительные подкислители включают малоновую кислоту, щавелевую кислоту, лимонную кислоту и молочную кислоту, предназначенные для улучшения стабильности в период хранения и использования. Композиции, предлагаемые в настоящем изобретении, необязательно включают один или большее количество загущающих агентов. Подходящие загущающие агенты включают известные и использующиеся в данной области техники, включая, например, фармацевтически приемлемые полимерные материалы. Примеры загущающих агентов включают полиакрилатные и сополимерные полиакрилатные смолы, поливинилпирролидон, поливиниловые смолы, неорганические загущающие агенты и т.п., целлюлозы и их производные, например метил-, этил- и пропилцеллюлозы; гидроксиалкилцеллюлозы, например гидроксипропилцеллюлозы и гидроксипропилалкилцеллюлозы и т.п., включая их соли, предпочтительно гидроксипропилметилцеллюлозу. Загущающий агент может действовать, как ингибитор осаждения, так что в случае пересыщения он может увеличить период времени, в течение которого можно добавлять дополнительные эффективные средства. Для композиций, соответствующих конкретным вариантам осуществления настоящего изобретения, раскрыты содержания каждого компонента, который после добавления к определенному объему воды или желудочного сока образует самопроизвольно эмульгирующуюся систему доставки лекарственного средства. Этот препарат, предлагаемый в настоящем изобретении, предназначен для самопроизвольного эмульгирования in vivo, когда он взаимодействует с желудочными соками, и после этого обеспечивается повышение скорости всасывания и увеличение биологической доступности. Он может находиться в форме раствора, мягкого геля или препарата в виде капсулы с твердой оболочкой. Композиции, предлагаемые в настоящем изобретении, можно использовать для введения любым подходящим путем, например перорально вместе с водой, фруктовыми соками и/или молоком, эти пути описаны в настоящей заявке. Другие подходящие перорально вводимые дозированные формы включают раздельные дозированные формы, например мягкий гель и препараты в виде капсул с твердой оболочкой. Можно использовать материал, подходящий для капсулирования, например капсулы из желатина или из ГПМЦ (гидроксипропилметилцеллюлоза). Поэтому другим вариантом осуществления настоящего изобретения является концентрированная композиция, представляющая собой раствор или раствор/суспензию, где композицию готовят в виде разовой дозированной формы или форм, например мягкого геля и препаратов в виде капсул с твердой оболочкой. Можно использовать материал, подходящий для капсулирования, например можно использовать капсулы из желатина или из ГПМЦ. Для капсулирования в капсулы из твердого желатина можно использовать технологию заливки и непрерывной ленточной сварки, методику капсулирования жидкости путем микрораспыления или методику Quali-Seal. Полученный раствор необязательно можно непосредственно залить в капсулу из твердого желатина или капсулу из мягкого желатина или даже можно адсорбировать на поверхности любого адсорбирующего материала с последующим прессованием в компактную массу или капсулированием. Концентрированные растворы или обычные растворы можно капсулировать по любой методике,известной в данной области техники, включая листовую технологию, вакуумную технологию или технологию с использованием ротационного штампа. В технологии с использованием ротационного штампа жидкий капсулирующий материал, например желатин, текущий из верхнего бака, с помощью ротационного штампа формуют в две непрерывные ленты и их сближают с помощью двух ротационных штампов. Одновременно отмеренный заливаемый материал вводят между лентами в тот же момент времени, когда штампы образуют карманы в лентах. Затем эти карманы из капсулирующего материала, содержащие введенный материал, герметизируют путем приложения давления и нагревания, и капсулы выгружают из машины. Можно изготовить капсулы с мягким гелем разной формы, включая, в частности, круглые,овальные, удлиненные и трубчатой формы. Кроме того, при использовании двух лент разного цвета можно изготовить двухцветные капсулы. Токсикологическое исследование NRC-AN-019 показало, что максимальная переносимая пероральная доза для крыс равна 5000 мг/кг массы тела и что для препарата, предлагаемого в настоящем изобретении, для собак породы бигль она равна 60 мг/кг массы тела. Исследование МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолийбромид) проводили для сопоставления активности активного фармацевтического ингредиента NRC-AN-019 с активностью препарата, предлагаемого в настоящем изобретении, с использованием клеток линии CAL-27 (плоскоклеточная карцинома языка) при концентрации, равной 1,75104 клеток/мл, с использованием разведений от 10 мкМ и до 0,0156 мкМ/мл в течение 72 ч. Значения IC50 для NRC-AN-019, использующегося в качестве активного фармацевтического ингредиента, и препарата, предлагаемого в настоящем изобретении, равны 1441 и 864 нМ соответственно, и это указывает на значительно более высокую активность препарата,предлагаемого в настоящем изобретении. Дополнительное исследование МТТ с использованием клеток линии РС 3 М (рак предстательной железы), проведенное для сопоставления активности активного фармацевтического ингредиента NRCAN-019 с активностью препарата, предлагаемого в настоящем изобретении, при концентрации, равной-9 024610 0,312105 клеток/мл в течение 72 ч, показало, что значения IC50 для NRC-AN-019 в качестве активного фармацевтического ингредиента и для препарата, предлагаемого в настоящем изобретении, равны 4381 и 938 нМ соответственно, и это подтвердило, что препарат обладает примерно в четыре раза большей активностью. Установлено, что препарат, предлагаемый в настоящем изобретении, являлся стабильным в течение всего периода исследования стабильности при хранении. Настоящее изобретение можно использовать в других специальных формах без отклонения от его сущности или существенных характеристик. Описанные варианты осуществления во всех отношениях следует считать только иллюстративными и неограничивающими. Поэтому объем настоящего изобретения определяется прилагаемой формулой изобретения, а не предшествующим описанием. В объем настоящего изобретения входят все изменения, входящие в значения и диапазон эквивалентности формулы изобретения. Настоящее изобретение описано с помощью различных конкретных и предпочтительных вариантов осуществления и методик. Однако следует понимать, что при сохранении сущности и объема настоящего изобретения в него могут быть внесены многочисленные изменения и модификации. На чертеже приведены результаты исследования биологической доступности препарата, предлагаемого в настоящем изобретении, применительно к дозированным формам в виде капсул, раскрытых в предшествующих патентах, и активного фармацевтического ингредиента. В исследовании продемонстрированы лучшие характеристики биологической доступности NRC-AN-019 в препарате, предлагаемом в настоящем изобретении, чем в других формах, таких как активный фармацевтический ингредиент и дозированная форма в виде капсулы, таким образом можно обеспечить оптимальную биологическую доступность для обеспечения терапевтической эффективности NRC-AN-019. Эти данные показывают, что время, необходимое для создания максимальной концентрации лекарственного средства, для препарата,предлагаемого в настоящем изобретении, меньше, чем для активного фармацевтического ингредиента, и что максимальные значения концентрации и ППК для препарата, предлагаемого в настоящем изобретении, существенно больше, чем для препарата в виде капсулы и активного фармацевтического ингредиента. Подробное описание способа, предлагаемого в настоящем изобретении, приведено в примерах,представленных ниже, которые представлены только для иллюстрации и поэтому их не следует рассматривать в качестве ограничивающих объем настоящего изобретения. Препарат, предлагаемый в настоящем изобретении, который можно вводить пероральным путем, получают по приведенным ниже методикам. Примеры Содержания компонентов, приведенные в примерах 1-52 и сравнительном примере 1, выражены в мас.% в пересчете на полную массу каждой композиции. В предпочтительном варианте осуществления настоящее изобретение относится к способу получения композиции, который включает тщательное смешивание NRC-AN-019 с фазой растворителя с последующим добавлением липофильной фазы, фазы вспомогательного поверхностно-активного вещества и поверхностно-активного вещества, проводимым при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора, или как указано в отдельных примерах. Композиции примеров 1-34 содержат жирную кислоту в качестве липофильной фазы. Таблица 1 Композиции примеров 1-3 получали путем диспергирования NRC-AN-019 в олеиновой кислоте, затем при перемешивании при нагревании добавляли полиоксил-35-касторовое масло, полисорбат 80, полиэтиленгликоль 600 и моноэтиловый эфир диэтиленгликоля. Композиции примеров 4-7 получали путем диспергирования NRC-AN-019 в олеиновой кислоте, затем при перемешивании при нагревании добавляли полиоксил-35-касторовое масло, соответствующие вспомогательные поверхностно-активные вещества, полиэтиленгликоль 600 и моноэтиловый эфир диэтиленгликоля. Вспомогательные поверхностно-активные вещества для примеров 4-7 включают каприлокапроилполиоксил-8-глицериды, глицериды каприловой кислоты, сорбитанмоноолеат и ПЭГ-6 глицериллинолеат в количестве, составляющем 19,8% мас./мас. соответственно. Таблица 3 Композиции примеров 8-10 получали путем диспергирования NRC-AN-019 в смеси соевого лецитина и олеиновой кислоты, затем при перемешивании при комнатной температуре добавляли полиоксил 35-касторовое масло, этанол и полисорбат 80. К указанной выше смеси добавляли антиоксиданты. Соевый лецитин в примере 10 заменяли яичным лецитином. Композиции примеров 11-18 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Бутилированный гидроксианизол и бутилированный гидрокситолуол добавляли в качестве антиоксидантов. Полиэтиленгликоль 600 в примере 17 заменяли этанолом. Рассмотрение твердых отдельных дозированных форм; композиции указанных выше составов в увеличенных количествах помещали в капсулы:(a) непосредственно помещали в твердые капсулы, изготовленные из желатина, и эти заполненные жидкостью капсулы герметизировали с помощью полоски желатина;(b) непосредственно помещали в твердые капсулы, изготовленные из гидроксипропилметилцеллюлозы, и эти заполненные жидкостью капсулы герметизировали с помощью полоски гидроксипропилметилцеллюлозы;(c) адсорбировали на поверхности неусилина (алюмометасиликат магния) в соотношении 3:1 (фаза раствора: неусилин), затем легко помещали в капсулы из твердого желатина;(d) адсорбировали на поверхности неусилина (алюмометасиликат магния) в соотношении 3:1 (фаза раствора: неусилин), затем легко помещали в капсулы из твердого ГПМЦ;(e) капсулировали в капсулы из мягкого желатина по технологии с использованием ротационного штампа. Композиции примеров 19-22 получали путем диспергирования NRC-AN-019 в фазе растворителя,затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества, фазу поверхностно-активного вещества и поливинилпирролидон K30 при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Витамин Е добавляли в качестве антиоксиданта. Подсластители и вкусовые вещества содержались в количестве, составляющем 0,5%. Таблица 7 Композиции примеров 23-25 получали путем диспергирования NRC-AN-019 в фазе растворителя,затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Бутилированный гидроксианизол и бутилированный гидрокситолуол добавляли в качестве антиоксидантов. Подсластители и вкусовые вещества содержались в количествах, составляющих 0,05 и 0,5% соответственно. Композиции примеров 26-28 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Бутилированный гидроксианизол и бутилированный гидрокситолуол добавляли в качестве антиоксидантов. Таблица 9 Композиции примеров 29 и 31 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Бутилированный гидроксианизол и бутилированный гидрокситолуол добавляли в качестве антиоксидантов. Композицию примера 30 получали путем диспергирования NRC-AN-019 в смеси соевого лецитина и олеиновой кислоты, затем при перемешивании при нагревании добавляли полиоксил-35-касторовое масло, полиэтиленгликоль 600 и полисорбат 80. К указанной выше смеси добавляли антиоксиданты. Композицию примера 32 получали путем смешивания олеиновой кислоты, каприлокапроилполиоксил-8-глицеридов, полиоксил-35-касторового масла, полиэтиленгликоля 600 и бензилового спирта, затем при перемешивании при нагревании добавляли NRC-AN-019. Композицию примера 33 получали путем растворения некоторого количества NRC-AN-019 в диметилацетамиде, затем при перемешивании добавляли оставшееся количество NRC-AN-019 в смеси полиоксил-35-касторового масла, бензилового спирта, полиэтиленгликоля 600, лаурилсульфат натрия, dальфа-токоферилполиэтиленгликоль-1000-сукцината и ацетата витамина Е. Композицию примера 34 получали путем растворения некоторого количества NRC-AN-019 в диметилацетамиде и полиэтиленгликоль 600, затем при перемешивании при нагревании добавляли оставшееся количество NRC-AN-019 в смеси полиоксил-35-касторового масла, каприлокапроилполиоксил-8 глицеридов и олеиновой кислоты при перемешивании при нагревании. К указанной выше смеси добавляли бутилированный гидроксианизол и бутилированный гидрокситолуол. Композиции примеров 35-43 содержали жирную кислоту вместе с другими липофильными компонентами в качестве липофильной фазы. Композиции примеров 35-38 получали путем диспергирования NRC-AN-019 в фазе растворителя,затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Таблица 12 Композиции примеров 39-41 получали путем диспергирования NRC-AN-019 в фазе растворителя,затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Бутилированный гидроксианизол и бутилированный гидроксито- 16024610 Композиции примеров 42 и 43 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Композиции примеров 44-46 содержали монодиглицериды в качестве основной липофильной фазы. Таблица 14 Композиции примеров 44-46 получали по методике, описанной в примерах 1-3, путем замены олеиновой кислоты на глицеринмонокаприлокапринат в качестве липофильной фазы. Композицию примера 47 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностноактивного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Бутилированный гидроксианизол и бутилированный гидрокситолуол добавляли в качестве антиоксидантов. Молочная кислота в композиции примера 47 содержалась в количестве,составляющем 4,4% мас./мас. Композицию примера 48 получали путем смешивания NRC-AN-019 с диметилацетамидом, затем при перемешивании добавляли расплавленный d-альфа-токоферилполиэтиленгликоль-1000-сукцинат,полиэтиленгликоль 600, каприлокапроилполиоксил-8-глицериды, ацетат витамина Е и этанол. Композиция примера 49 содержала растительные масла в качестве основной липофильной фазы. Таблица 16 Композицию примера 49 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностноактивного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Композиции примеров 50-52 содержали моноглицериды в качестве основной липофильной фазы. Композиции примеров 50-52 получали путем диспергирования NRC-AN-019 в растворителе, затем добавляли липофильную фазу, фазу вспомогательного поверхностно-активного вещества и поверхностно-активного вещества при перемешивании при нагревании с целью тщательного смешивания до образования прозрачного раствора. Таблица 18 Композицию сравнительного примера 1 получали по следующей методике: NRC-AN-019, лаурилсульфат натрия, блок-сополимер полиоксиэтилен-полиоксипропилен, кросповидон XL, микрокристаллическую целлюлозу и коллоидный диоксид кремния отмеряли в необходимых количествах и просеивали через сито 18 меш в механическом просеивающем устройстве и затем перемешивали в барабанном смесителе двухконусной конфигурации. Затем перемешанное вещество помещали в валковое миниуплотняющее устройство, и уплотненные массы собирали в двойной пленочный пакет. Уплотненные массы повторно уплотняли в валковом уплотняющем устройстве и затем просеивали через сито 18 меш. Затем остатки собирали, размалывали, и просеянные гранулы помещали в валковое уплотняющее устройство для уплотнения. К этому содержимому добавляли необходимое количество стеарата магния в качестве смазывающего вещества и тщательно перемешивали и затем помещали в оболочки капсул. Исследование биологической доступности композиций, предлагаемых в настоящем изобретении Четырех крыс (wistar albino, самцы массой 120-180 г) разделяли на две группы подопытных животных (2 крысы в каждой группе) и в течение ночи до введения дозы им не давали пищу, но в неограниченном количестве давали воду. Приготовление и последующее разбавление образца разбавителем проводили в соответствии с протоколом, затем образец вводили пероральным путем. Пробы крови брали путем прокалывания ретроорбитального синуса у анестезированных крыс (анестезия эфиром) через 15,30, 60, 120, 240, 360, 480 и 720 мин после введения. Пробы крови помещали в предварительно заполненные гепарином пробирки для центрифуги. Собранные пробы крови центрифугировали и анализировали по методике с использованием жидкостной хроматографии - масс-спектрометрии. Площади под кривой для зависимости концентрации лекарственного средства в крови от времени рассчитывали по методике трапеций. При проведении анализа определяли ППК (площадь под кривой), Cmax (максимальная концентрация) и Tmax (время установления максимальной концентрации). Значения средней ППК (нгч/мл), Tmax (мин) и Cmax (в нг/мл) для типичных экспериментов приведены в представленной ниже таблице. Как можно видеть из приведенной выше таблицы, композиции, предлагаемые в настоящем изобретении, обладают высокой биологической доступностью (ППК и Cmax). В указанной выше таблице приведены данные о биологической доступности предлагаемого в настоящем изобретении препарата, которая лучше, чем для дозированной формы в виде капсулы и АФИ (активный фармацевтический ингредиент). Преимущества изобретенияa. Получен пероральный раствор производного фениламинопиридина на основе липида, напримерNRC-AN-019, который используют в качестве ингибитора тирозинкиназы BCR-ABL для лечения хронического миелолейкоза и других опухолей, таких как рак головы и шеи и рак предстательной железы.b. Преимущество также обусловлено обеспечением лучшей биологической доступности, чем у дозированных форм в виде таблетки и капсулы.c. Преимущество также включает характеристики стабильности и установлено, что препарат является стабильным в течение всего периода исследования стабильности при хранении.d. Соблюдение пациентом режима лечения можно обеспечить с помощью перорального раствора,поскольку его легко вводить, что особенно предпочтительно для детей и пожилых пациентов.e. Применение в промышленности: столь же легкая технология изготовления увеличенных партий.f. До настоящего времени в литературе не описано использование этого указанного производного в перорально вводимом пероральном растворе, что относится к новизне настоящего изобретения.g. Препарат обеспечивает терапевтически эффективную концентрацию совершенно нерастворимого в воде активного ингредиента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, предназначенная для перорального введения для лечения рака у пациента, включающая:(a) терапевтически эффективное количество (3,5-бис-трифторметил)-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамида (NRC-AN-019) или его фармацевтически приемлемой соли;(c) по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество и(d) фармацевтически приемлемый смешивающийся с водой растворитель,где липофильная фаза включает триглицерид, диглицерид, моноглицерид, C12-C22 жирную кислоту или их смесь и триглицерид, диглицерид или моноглицерид включают остатки C12-С 22-жирной кислоты,присоединенные по меньшей мере к одной гидроксигруппе глицеридного фрагмента; по меньшей мере одно поверхностно-активное вещество содержит полиоксиэтиленгликолированное растительное масло и смешивающийся с водой растворитель представляет собой полиэтиленгликоль 600, полиоксиэтилен, пропиленкарбонат, тетрагидрофурфуриловый спирт, простой эфир полиэтиленгликоля, глицерин,пропиленгликоль, полиэтиленгликоль, С 1-С 8-алканол, этанол и бензиловый спирт. 2. Фармацевтическая композиция по п.1, в которой компонент (а) содержится в количестве, составляющем от 0,1 до 20 мас.% в пересчете на полную массу композиции, предпочтительно от 0,25 до 10 мас.% в пересчете на полную массу композиции; компонент (b) содержится в количестве, составляющем от 10 до 75 мас.% в пересчете на полную массу композиции, предпочтительно от 12,5 до 65 мас.% в пересчете на полную массу композиции; компонент (с) содержится в количестве, составляющем от 4 до 70 мас.% в пересчете на полную массу композиции, предпочтительно от 8 до 60 мас.% в пересчете на полную массу композиции; компонент (d) содержится в количестве, составляющем от 5 до 30 мас.% в пересчете на полную массу композиции, предпочтительно от 5,5 до 25 мас.% в пересчете на полную массу композиции. 3. Фармацевтическая композиция по п.1 или 2, которая включает форму I, форму II или форму III полиморфных форм NRC-AN-019. 4. Фармацевтическая композиция по любому предыдущему пункту, в которой C12-C22-жирная кислота представляет собой мононенасыщенную C12-C20-жирную кислоту, которая является жидкой при комнатной температуре, предпочтительно (Z)-9-октадеценовую кислоту. 5. Фармацевтическая композиция по любому из предыдущих пунктов, в которой остатки С 18 ненасыщенной жирной кислоты содержатся в липофильной фазе в количестве, составляющем не менее 20 мас.%, предпочтительно не менее 40 мас.% в пересчете на полную массу липофильной фазы. 6. Фармацевтическая композиция по любому предыдущему пункту, в которой остатки насыщенной жирной кислоты содержатся в липофильной фазе в количестве, составляющем 50 мас.% или менее в пересчете на полную массу липофильной фазы. 7. Фармацевтическая композиция по любому предыдущему пункту, в которой по меньшей мере одно поверхностно-активное вещество включает основное поверхностно-активное вещество и одно или большее количество вспомогательных поверхностно-активных веществ. 8. Фармацевтическая композиция по любому предыдущему пункту, в которой по меньшей мере одно поверхностно-активное вещество - полиоксиэтиленгликолированное касторовое масло, более предпочтительно полиоксил-35-касторовое масло. 9. Фармацевтическая композиция по п.7 или 8, в которой вспомогательное поверхностно-активное вещество содержится в количестве, составляющем от 2 до 60 мас.% в пересчете на полную массу композиции, предпочтительно от 5 до 45 мас.% в пересчете на полную массу композиции. 10. Фармацевтическая композиция по пп.7, 8 или 9, в которой вспомогательное поверхностноактивное вещество включает полиоксилглицерид, предпочтительно каприлокапроилполиоксилглицерид. 11. Фармацевтическая композиция по любому предыдущему пункту, в которой смешивающийся с водой растворитель выступает в качестве среды-носителя для NRC-AN-019. 12. Фармацевтическая композиция по любому предыдущему пункту, которая дополнительно включает антиоксидант, и этот антиоксидант предпочтительно выбран из группы, включающей бутилгидроксианизол, бутилгидрокситолуол и их смесь, более предпочтительно представляет собой смесь бутилгидроксианизола и бутилгидрокситолуола в отношении, составляющем от 6:4 до 9:1, наиболее предпочтительно представляет собой смесь бутилгидроксианизола и бутилгидрокситолуола в отношении, составляющем от 7:3 до 8:2. 13. Фармацевтическая композиция по любому предыдущему пункту, которая дополнительно включает подсластитель, и этим подсластителем предпочтительно является сахарин, более предпочтительно сахарин в количестве, составляющем от 0,1 до 10 мас.% в пересчете на полную массу композиции, наиболее предпочтительно сахарин в количестве, составляющем от 0,25 до примерно 5 мас.% в пересчете на полную массу композиции. 14. Фармацевтическая композиция по любому предыдущему пункту, которая дополнительно включает вкусовое вещество, и это вкусовое вещество предпочтительно выбрано из числа вкусовых веществ на масляной основе, взятых по отдельности или в комбинации, где вкусовое вещество предпочтительно содержится в количестве, составляющем от 0,1 до примерно 10 мас.% в пересчете на полную массу композиции, более предпочтительно от 0,25 до 1 мас.% в пересчете на полную массу композиции. 15. Фармацевтическая композиция по любому предыдущему пункту, которая находится в форме раствора, мягкого геля или препарата в виде капсулы с твердой оболочкой. 16. Фармацевтическая композиция по любому предыдущему пункту, предназначенная для лечения организма человека или животного путем терапии. 17. Применение фармацевтической композиции по любому из пп.1-15 для приготовления лекарственного средства, предназначенного для лечения рака. 18. Способ получения фармацевтической композиции по любому из пп.1-15, который включает смешивание NRC-AN-019 со смешивающимся с водой растворителем, добавление липофильной фазы,добавление поверхностно-активного вещества и перемешивание при нагревании. 19. Способ по п.18, в котором вспомогательное поверхностно-активное вещество добавляют к поверхностно-активному веществу. 20. Способ лечения рака у пациента, который включает введение указанному пациенту терапевтически эффективного количества фармацевтической композиции по любому из пп.1-15.
МПК / Метки
МПК: A61K 9/48, A61K 9/14, A61K 31/444, A61K 9/08, A61K 9/107
Метки: производное, содержащий, фениламинопиримидина, средства, препарат, активного, качестве
Код ссылки
<a href="https://eas.patents.su/23-24610-preparat-soderzhashhijj-proizvodnoe-fenilaminopirimidina-v-kachestve-aktivnogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Препарат, содержащий производное фениламинопиримидина в качестве активного средства</a>
Предыдущий патент: Лечение боли, обусловленной дислокацией базального слоя эндометрия
Следующий патент: Установка для извлечения серы и способ извлечения серы
Случайный патент: Мутанты fgf21 и их применение