Производные пиразолопиридина и их применение в качестве фармацевтического препарата
Номер патента: 1899
Опубликовано: 22.10.2001
Авторы: Симизу Ясуйо, Акахане Ацуси, Итани Хиромити, Курода Сатору
Формула / Реферат
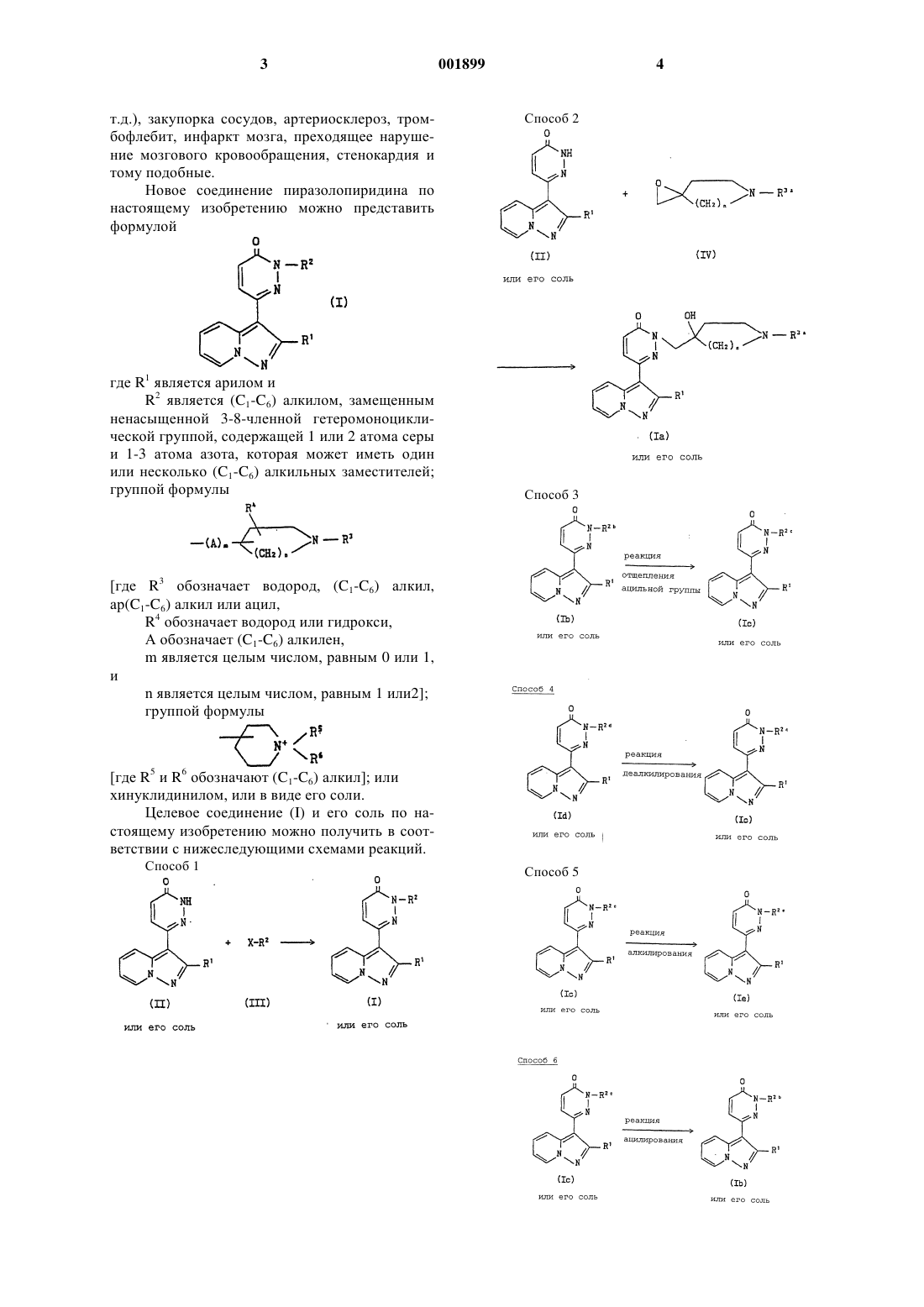
1. Производные пиразолопиридина формулы
где R1 является арилом и
R2 является (C1-C6) алкилом, замещенным ненасыщенной 3-8-членной гетеромоноциклической группой, содержащей 1 или 2 атома серы и 1-3 атома азота, которая может иметь один или несколько (C1-C6) алкильных заместителей;
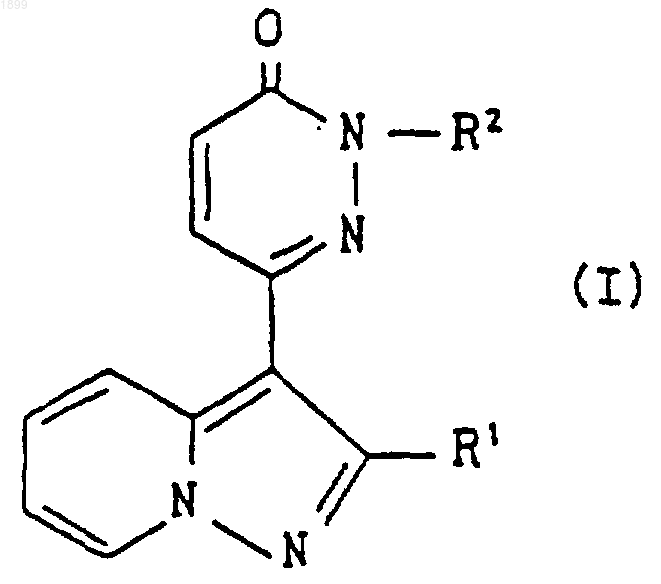
группой формулы
[где R3 обозначает водород, (C1-C6) алкил, ар(C1-C6) алкил или ацил,
R4 обозначает водород или гидрокси,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 0 или 1, и
n является целым числом, равным 1 или 2];
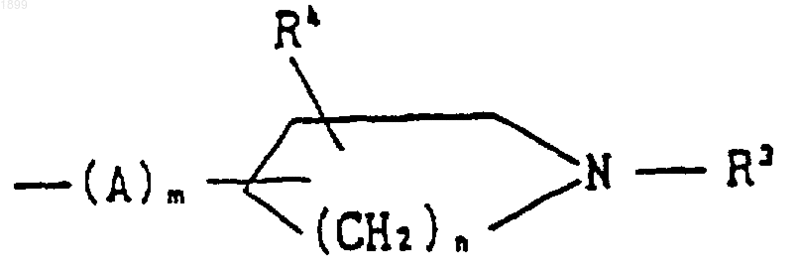
группой формулы
[где R5 и R6 обозначают (C1-C6) алкил]; или хинуклидинилом, либо его соль.
2. Соединение по п.1, в котором R1 является фенилом и R2 является (C1-C6) алкилом, замещенным тиазолилом, который может иметь 1-3 (C1-C6) алкилов; группой формулы
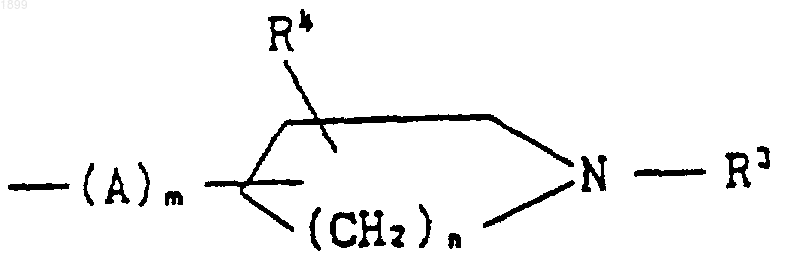
[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил, (C1-C6) алкоксикарбонил или фенил (C1-C6) алкоксикарбонил,
R4 обозначает водород или гидрокси,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 0 или 1, и
n является целым числом, равным 1 или 2];
группой формулы
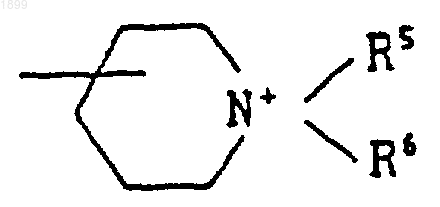
[где R5 и R6 обозначают (C1-C6) алкил]; или хинуклидинилом, либо его соль.
3. Соединение по п.2, в котором R2 является (C1-C6) алкилом, замешенным тиазолилом, который может иметь 1-3 (C1-C6) алкилов, или его соль.
4. Соединение по п.2, в котором R2 является группой формулы
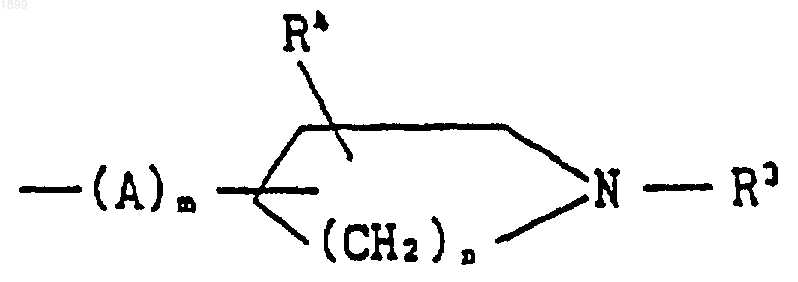
[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил, (C1-C6) алкоксикарбонил или фенил (C1-C6) алкоксикарбонил,
R4 обозначает водород или гидрокси,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 0 или 1, и
n является целым числом, равным 1 или 2], или его соль.
5. Соединение по п.4, в котором R2 является группой формулы
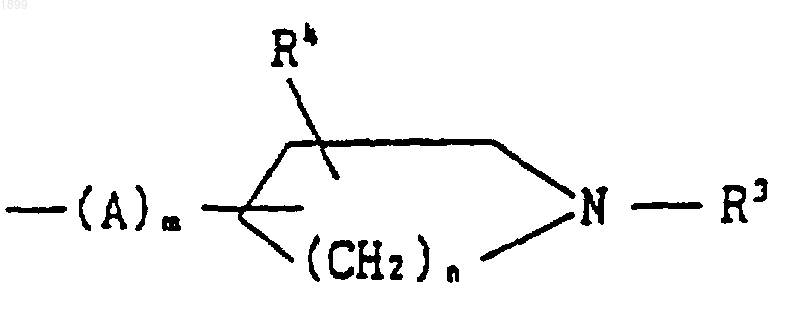
[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил или (C1-C6) алкоксикарбонил,
R4 обозначает водород,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 0, и
n является целым числом, равным 1 или 2], или его соль.
6. Соединение по п.5, в котором R2 является группой формулы
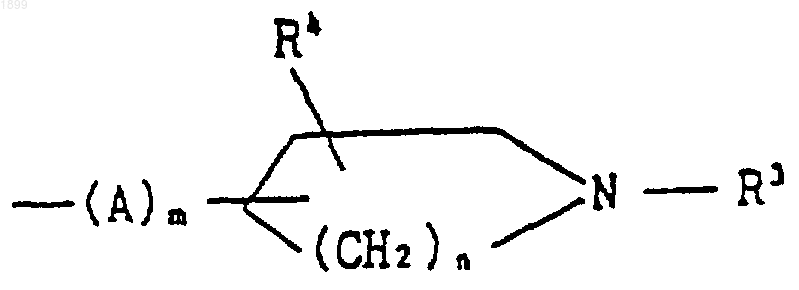
[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил или (C1-C6) алкоксикарбонил,
R4 обозначает водород,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 0, и
n является целым числом, равным 2], или его соль.
7. Соединение по п.6, в котором R2 является группой формулы
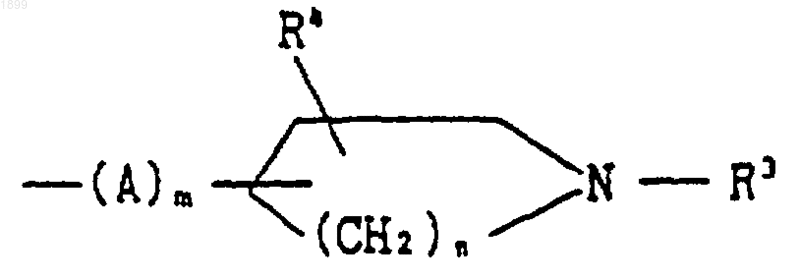
[где R3 обозначает (C1-C6) алкил,
R4 обозначает водород,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 0, и
n является целым числом, равным 2], или его соль.
8. Соединение по п.4, в котором R2 является группой формулы
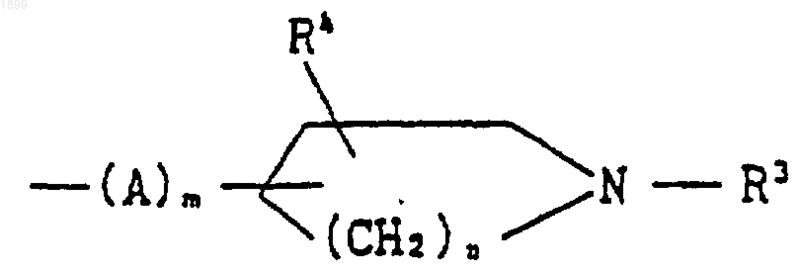
[где R3 обозначает водород, (C1-C6) алкил, (C1-C6) алканоил или фенил (C1-C6) алкоксикарбонил,
R4 обозначает водород или гидрокси,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 1, и
n является целым числом, равным 1 или 2], или его соль.
9. Соединение по п.8, в котором R2 является группой формулы
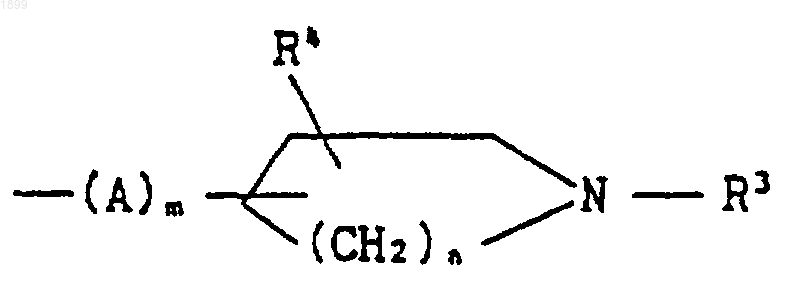
[где R3 обозначает водород или (C1-C6) алкил,
R4 обозначает водород,
А обозначает (C1-C6) алкилен,
m является целым числом, равным 1, и
n является целым числом, равным 1 или 2], или его соль.
10. Способ получения соединения пиразолопиридина по п.1 или его соли, включающий взаимодействие соединения формулы
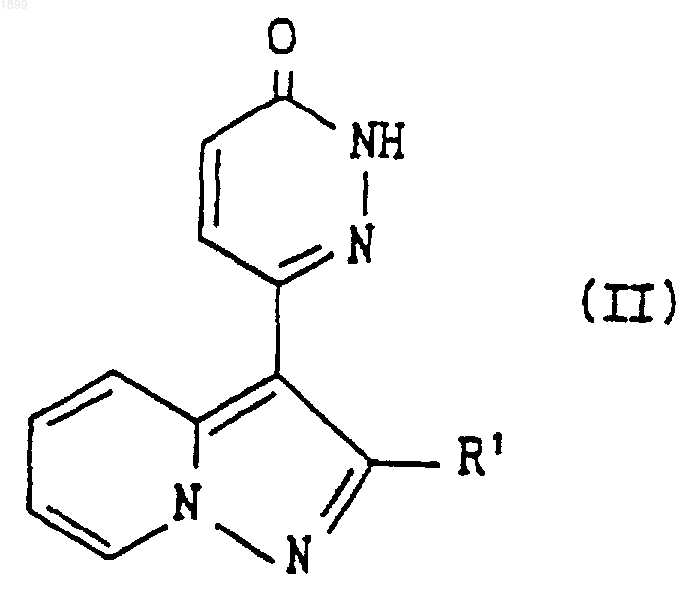
где R1 имеет значения, указанные в п.1, или его соли с соединением формулы
X-R2 (III)
где R2 имеет значения, указанные в п.1, и Х является отщепляемой группой, с получением соединения формулы
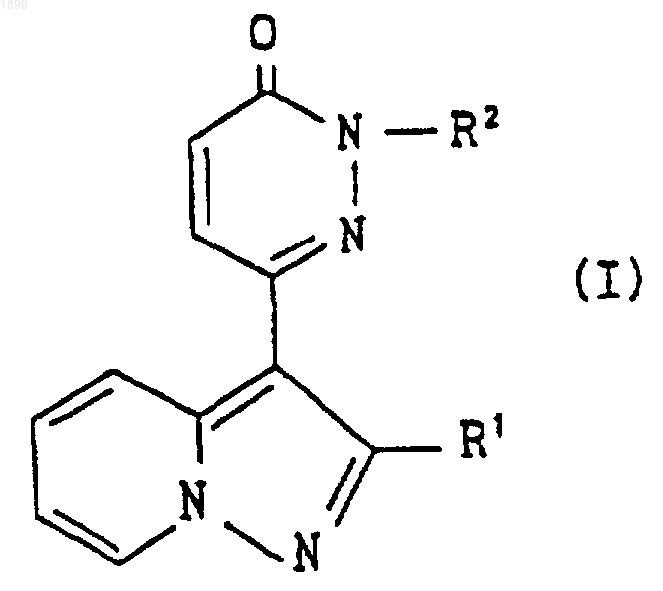
где R1 и R2 имеют значения, указанные в п.1, или его соли, и, если желательно, соединение формулы (I), которое представляет собой соединение формулы
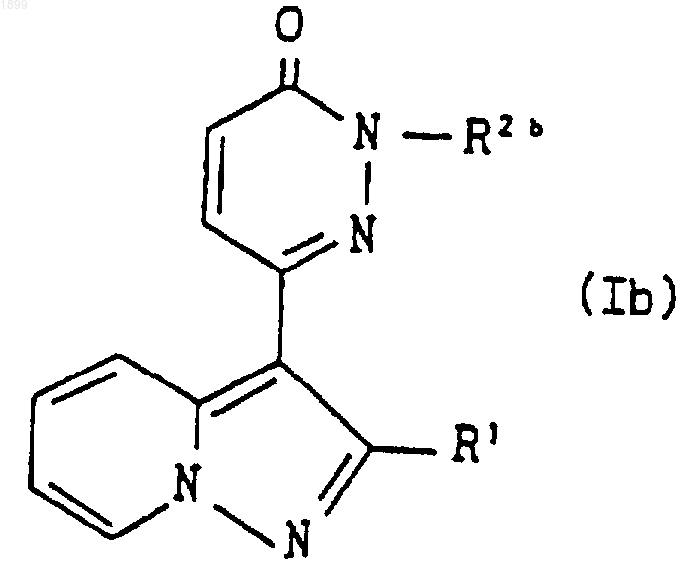
где R1 имеет значения, указанные в п.1, и R2b является группой формулы

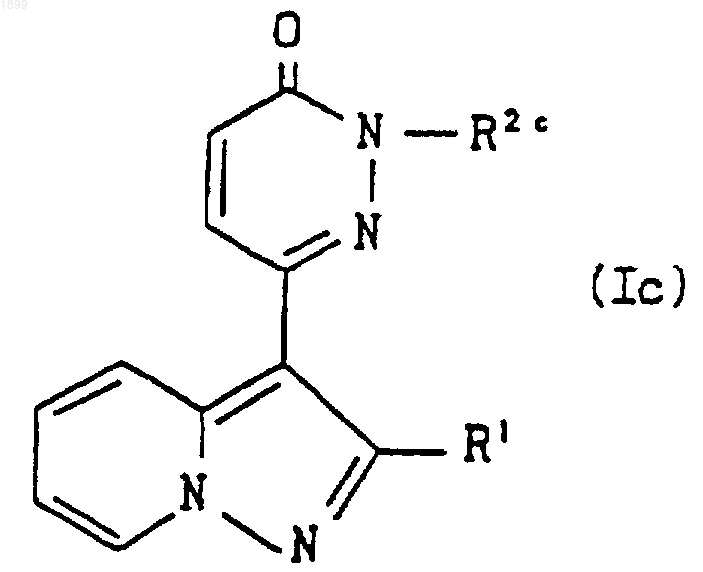
где A, m, n и R4 имеют значения, указанные в п.1, и R3a обозначает ацил, или его соль подвергают реакции отщепления ацильной группы, что дает соединение формулы
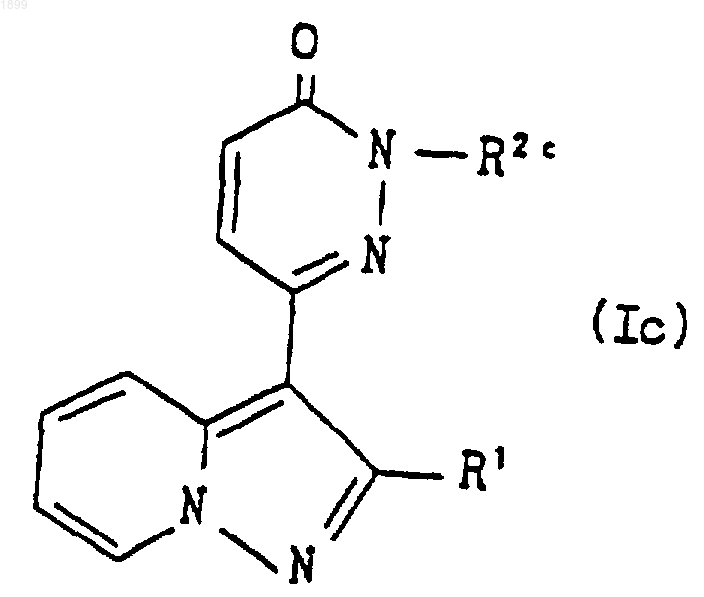
где R1 имеет значения, указанные в п.1, и R2c является группой формулы
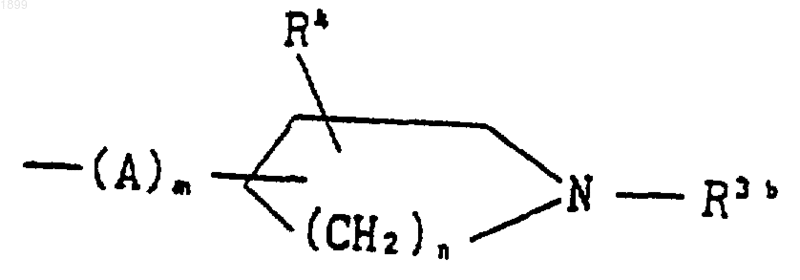
где A, m, n и R4 имеют указанные выше значения, и R3b обозначает водород, или его соль; или соединение формулы (I), которое представляет собой соединение формулы
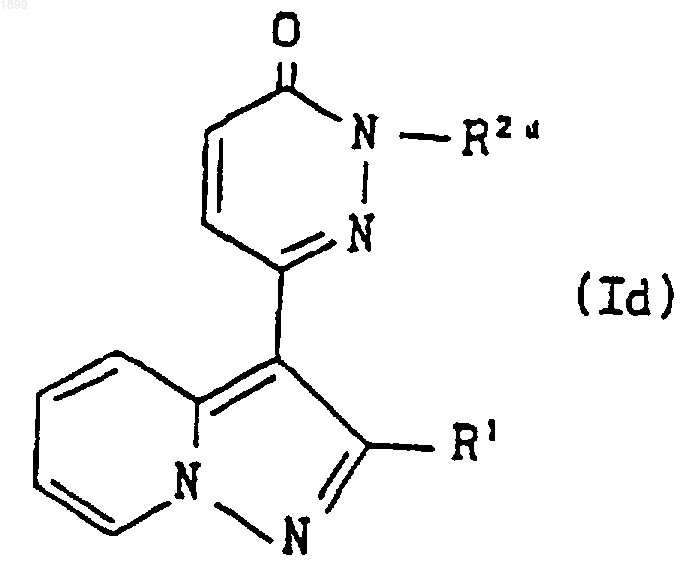
где R1 имеет значения, указанные в п.1, и R2d является группой формулы
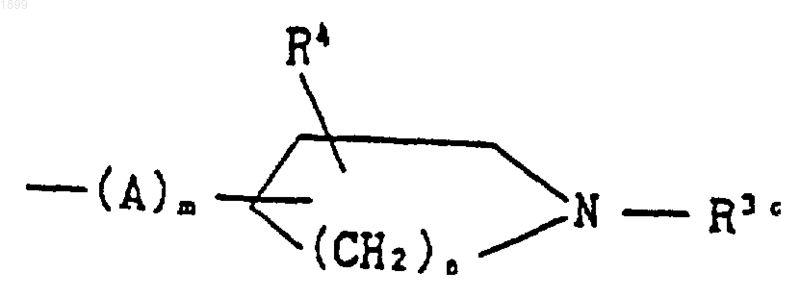
где A, m, n и R4 имеют указанные выше значения, и R3c обозначает (C1-C6) алкил, или его соль подвергают реакции деалкилирования, что дает соединение формулы
где R1 и R2c имеют указанные выше значения, или его соль; или соединение формулы (I), которое представляет собой соединение формулы

где R1 и R2c имеют указанные выше значения, или его соль подвергают реакции алкилирования, что дрхт соединение формулы
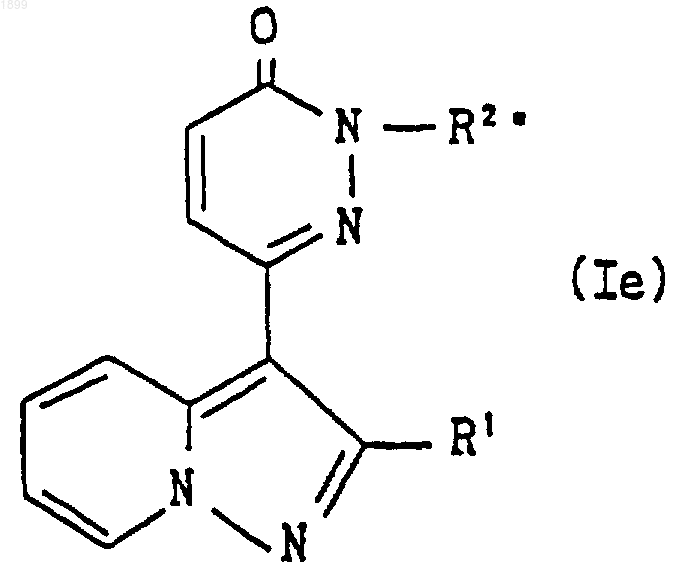
где R1 имеет значения, указанные в п.1, и R2e является группой формулы
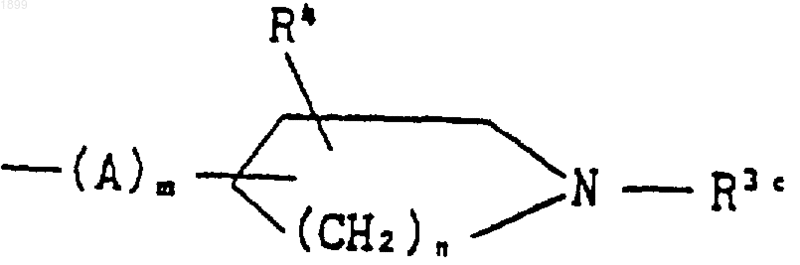
где A, m, n, Rзc и R4 имеют указанные выше значения, или группой формулы
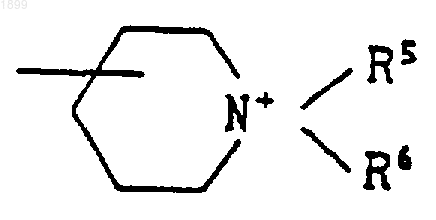
где R5 и R6 имеют значения, указанные в п.1, или его соль; или соединение формулы (I), которое представляет собой соединение формулы
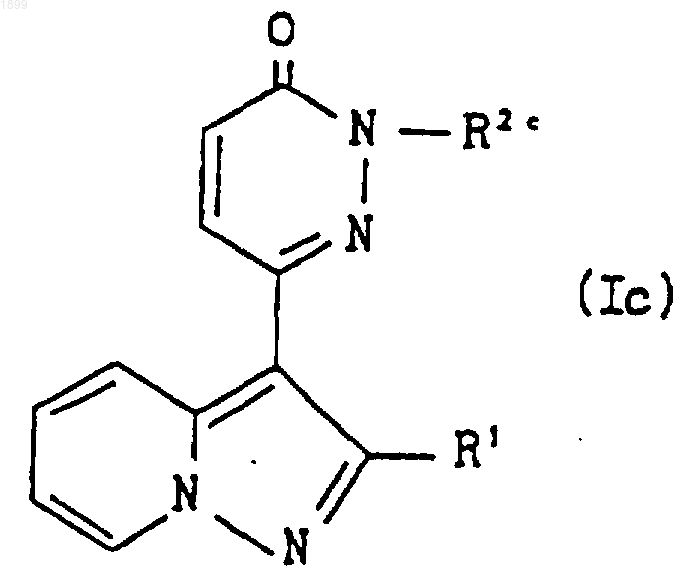
где R1 и R2c имеют указанные выше значения, или его соль подвергают реакции ацилирования, что дает соединение формулы
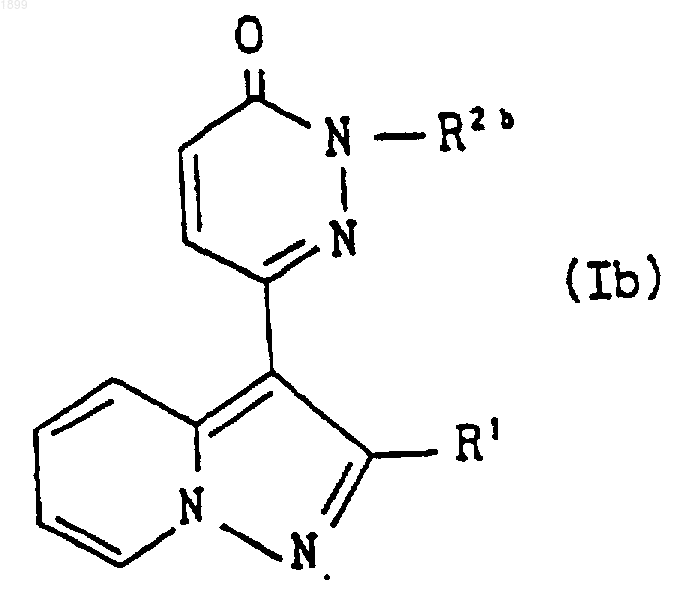
где R1 и R2b имеют указанные выше значения, или его соль.
11. Способ получения соединения пиразолопиридина по п.1 или его соли, включающий взаимодействие соединения формулы
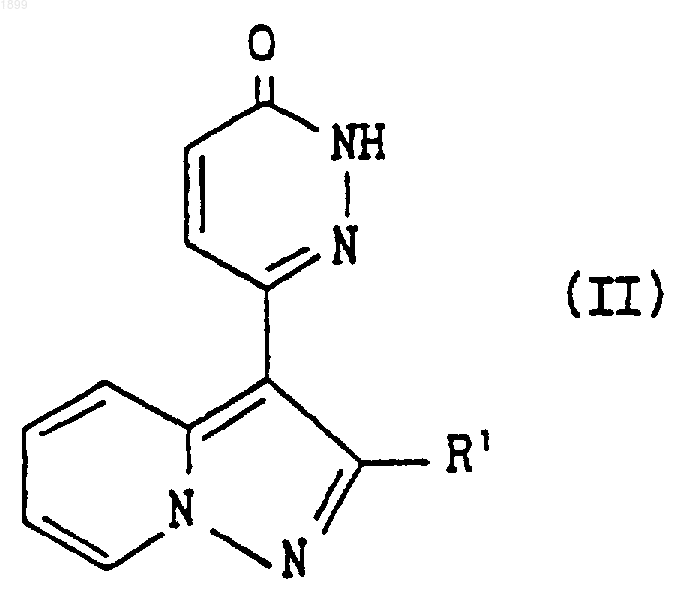
где R1 имеет значения, указанные в п.1, или его соли с соединением формулы
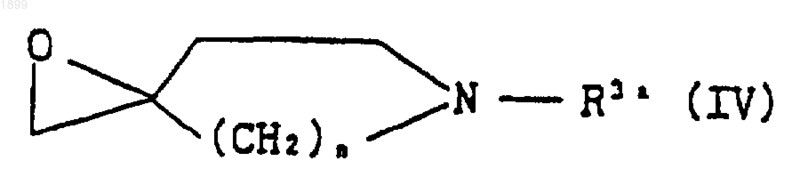
где n имеет значения, указанные в п.1, и R3a обозначает ацил, с получением соединения формулы
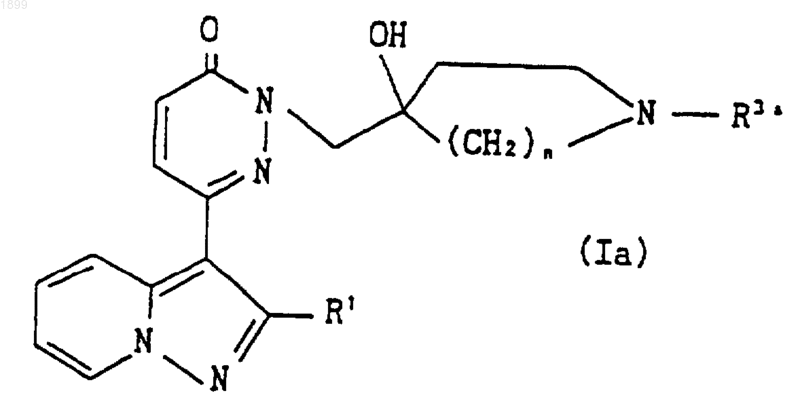
где R1 и R3а имеют указанные выше значения, или его соли.
12. Способ получения соединения пиразолопиридина по п.1 или его соли, отличающийся тем, что соединение формулы
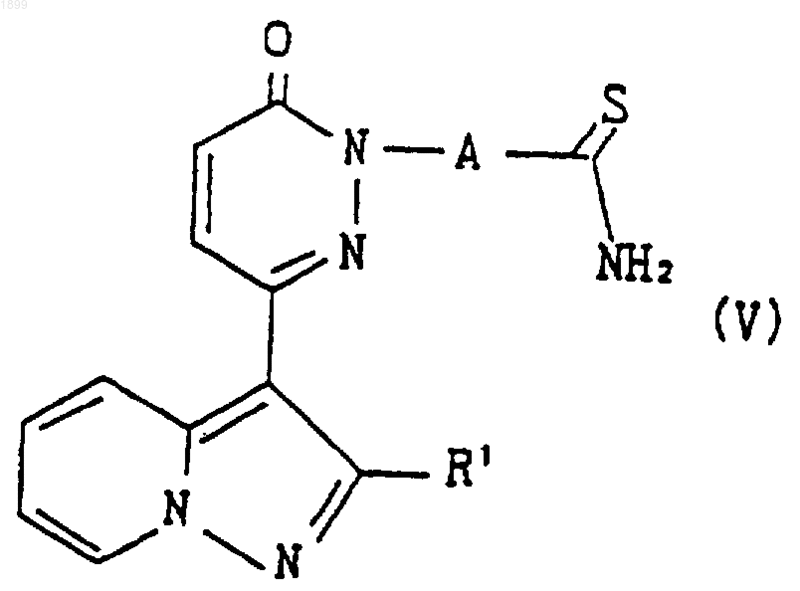
где R1 и А имеют значения, указанные в п.1, или его соль подвергают реакции образования тиазольного кольца, что дает соединение формулы
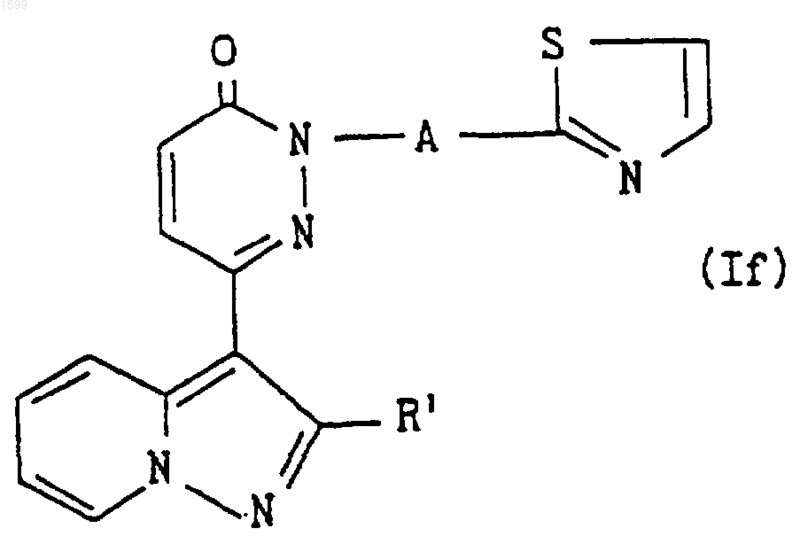
где R1 и А имеют указанные выше значения, или его соль.
13. Фармацевтическая композиция, содержащая соединение по п.1 или его соль в сочетании с фармацевтически приемлемыми носителями или наполнителями.
14. Способ лечения болезней или профилактики болезней, в отношении которых эффективно действует антагонист аденозина, путем введения пациенту эффективного количества соединения по п.1 или его соли.
15. Применение соединения по п.1 или его соли в качестве лекарственного средства.
16. Применение соединения по п.1 или его соли в качестве антагониста аденозина.
17. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 или его соли с фармацевтически приемлемыми носителями или наполнителями.
18. Применение соединения по п.1 или его соли для получения фармацевтической композиции, предназначенной для лечения болезней, в отношении которых эффективно действует антагонист аденозина.
Текст
1 Область техники Настоящее изобретение относится к новому соединению пиразолопиридина и его соли,которые являются эффективными лекарственными средствами. Предпосылки изобретения Известны соединения пиразолопиридина,применяемые в качестве психостимуляторов, а также для лечения почечной недостаточности и подобных заболеваний (например, европейские патенты 0299209 и 0379979 и т.д.). Описание изобретения Настоящее изобретение относится к новому соединению пиразолопиридина и его соли,которые являются эффективными лекарственными средствами; к способам получения указанного соединения пиразолопиридина и его соли; к фармацевтической композиции, содержащей указанное соединение пиразолопиридина или его фармацевтически приемлемую соль в качестве активного ингредиента; к применению указанного соединения пиразолопиридина или его фармацевтически приемлемой соли в качестве лекарственного средства; и к способу применения указанного соединения пиразолопиридина или его фармацевтически приемлемой соли в лечебных целях, который заключается в том, что человеку или животному вводят указанное соединение пиразолопиридина или его фармацевтически приемлемую соль. Указанное соединение пиразолопиридина и его соль являются антагонистами аденозина (в частности, антагонистами рецепторов A1) и обладают широким фармакологическим действием, в частности, они усиливают познавательную способность, оказывают болеутоляющее, локомоторное, антидепрессивное, мочегонное, кардиозащитное, кардиотоническое и сосудорасширяющее действие (например, расширение сосудов головного мозга и т.д.), активизируют почечный кровоток, защищают и улучшают функцию почек, усиливают липолиз, подавляют анафилактический бронхостеноз, ускоряют процесс выделения инсулина, увеличивают образование эритропоэтина, ингибируют агрегацию тромбоцитов и т.д. Соединения по настоящему изобретению являются эффективными средствами, усиливающими познавательную способность, средствами против слабоумия, психостимуляторами,аналгезирующими и кардиозащитными средствами, антидепрессантами, средствами, усиливающими мозговое кровообращение, транквилизаторами, средствами против сердечной недостаточности, кардиотоническими и гипотензивными средствами, средствами против почечной недостаточности и токсичности, средствами, защищающими и улучшающими функцию почек, мочегонными и противоотечными средствами, средствами против ожирения, противоастматическими и бронхолитическими средствами, средствами против удушья, подагры, ги 001899 2 перурикемии и синдрома внезапной смерти внешне здорового ребенка, средствами, ослабляющими иммуносупрессивное действие аденозина, антидиабетическими средствами, средствами для лечения язвенной болезни, панкреатита, синдрома Меньера и анемии, а также тромбоза, инфаркта миокарда, закупорки сосудов,артериосклеротической облитерации, тромбофлебита, инфаркта мозга, преходящего нарушения мозгового кровообращения, стенокардии и тому подобных заболеваний. Указанные средства пригодны для профилактики и/или лечения таких болезней, как депрессия, слабоумие (например, болезнь Альцгеймера, цереброваскулярное слабоумие, болезнь Паркинсона и т.д.), состояние страха, болевой синдром, цереброваскулярные заболевания (например, инсульт и т.д.), сердечная недостаточность; гипертензия (например, первичная артериальная гипертензия, нефрогенная гипертензия и т.д.); сосудистая недостаточность (острая сосудистая недостаточность), вызванная, в частности, ишемией или нарушением кровоснабжения (например, ишемией или нарушением кровоснабжения миокарда, ишемией или нарушением кровоснабжения мозга, ишемией или нарушением периферического кровоснабжения и т.д.), шок (например, эндотоксиновый шок, геморрагический шок и т.д.), хирургическое вмешательство или тому подобные; постреанимационная остановка сердца; электромеханическая диссоциация; острая сосудистая недостаточность, обусловленная снижением давления; брадиаритмия; синдром системной воспалительной реакции (SIRS); нарушение функции нескольких органов; почечная недостаточность (например, острая почечная недостаточность и т.д.), почечная токсичность [например, почечная токсичность, вызванная лекарственными средствами, такими как цисплатины,гентамицин, FR-900506 (рассматриваемые в европейском патенте 0184162), циклоспорин(например, циклоспорин А) или тому подобные; глицерином и т.д.], нефроз, нефрит, отек (например, сердечный отек, нефротический отек,печеночный отек, идиопатический отек, лекарственный отек, острый ангионевротический отек, наследственный ангионевротический отек,карциноматозный асцит, гестационный отек и т.д.); ожирение, бронхиальная астма, подагра,гиперурикемия, синдром внезапной смерти внешне здорового ребенка, иммуносупрессия,диабеты, язвенная болезнь, в частности, пептическая язва (например, язва желудка, язва двенадцатиперстной кишки и т.д.), панкреатит,синдром Меньера, анемия, гипотензия, вызванная диализом, запор, ишемическая болезнь кишечника, непроходимость кишечника (например, механическая непроходимость кишечника,паралитическая непроходимость кишечника и т.д.); инфаркт миокарда, тромбоз (например,артериальный тромбоз, церебральный тромбоз и 3 т.д.), закупорка сосудов, артериосклероз, тромбофлебит, инфаркт мозга, преходящее нарушение мозгового кровообращения, стенокардия и тому подобные. Новое соединение пиразолопиридина по настоящему изобретению можно представить формулойR2 является (C1-C6) алкилом, замещенным ненасыщенной 3-8-членной гетеромоноциклической группой, содержащей 1 или 2 атома серы и 1-3 атома азота, которая может иметь один или несколько (C1-C6) алкильных заместителей; группой формулы[где R3 обозначает водород, (C1-C6) алкил,ар(C1-C6) алкил или ацил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен,m является целым числом, равным 0 или 1,и[где R5 и R6 обозначают (C1-C6) алкил]; или хинуклидинилом, или в виде его соли. Целевое соединение (I) и его соль по настоящему изобретению можно получить в соответствии с нижеследующими схемами реакций. Способ 1 где R1 и R2 имеют указанные выше значения,R3a обозначает ацил,R2b является группой формулы где A, m, n, R3a и R4 имеют указанные выше значения,R2c является группой формулы где A, m, n и R4 имеют указанные выше значения и R3b обозначает водород; где A, m, n и R4 имеют указанные выше значения и R3c обозначает низший алкил; где А, m, n, R3c и R4 имеют указанные выше значения, или группой формулы где R5 и R6 имеют указанные выше значения; и Х является отщепляемой группой. Помимо описанных выше способов целевое соединение (I) и его соль можно получить, 001899 6 например, в соответствии со способами, рассмотренными в примерах, приведенных в настоящем описании изобретения, или аналогично указанным способам. Исходные соединения можно получить,например, при помощи способов, проиллюстрированных в препаративных примерах настоящего описания изобретения, или аналогично указанным способам. Целевое соединение (I) или его соль можно получить в соответствии со способами, приведенными в препаративных или основных примерах, либо аналогично указанным способам. Необходимо отметить, что целевое соединение (I) может иметь геометрические изомеры из-за наличия одной или нескольких двойных связей и/или стереоизомеры из-за наличия одного или нескольких асимметричных атомов углерода. Причем один изомер можно превратить в другой по методу, хорошо известному в этой области. Кроме того, следует отметить, что в объем настоящего изобретения входит сольватированная форма соединения (I) (например, гидрат и т.д.) и любая кристаллическая форма указанного соединения. Подходящими солями целевого соединения (I) являются фармацевтически приемлемые соли, к которым относятся соли металлов, в частности, соли щелочных металлов (например,соль натрия, соль калия и т.д.) и соли щелочноземельных металлов (например, соль кальция,соль магния и т.д.), соли аммония, соли органических оснований (например, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N'дибензилэтилендиамина и т.д.), соли органических кислот (например, ацетат, трифторацетат,малеат, тартрат, фумарат, метансульфонат, бензолсульфонат, формиат, толуолсульфонат и т.д.), соли неорганических кислот (например,гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат и т.д.), соли с аминокислотами (например, с аргинином, аспарагиновой кислотой,глутаминовой кислотой) и тому подобные. Ниже подробно рассмотрены и проиллюстрированы примерами определения, которые использованы в данном описании изобретения и входят в объем изобретения. Термин "низший" означает 1-6 атомов углерода за исключением особо оговоренных случаев. Подходящий "низший алкил" может включать алкил с прямой или разветвленной цепью,такой как метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, гексил или тому подобный, среди которых предпочтительным является(C1-C4) алкил и более предпочтительным является метил. Подходящая "ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая 1 или 2 атома серы и 1-3 атома азота", которая 7 может иметь 1-3 заместителя (например, низший алкил и т.д.), может включать тиазолил,изотиазолил, тиадиазолил (например, 1,2,3 тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил и т.д.), дигидротиазинил и тому подобные, причем предпочтение отдается 5- или 6-членным группам и наиболее предпочтительной группой является тиазолил. Подходящий "ацил" может включать низший алканоил (например, формил, ацетил, пропионил, бутирил, изобутирил, пивалоил, гексаноил и т.д.); карбокси; защищенный карбокси; гидроксисульфонил; и тому подобные. Подходящий "защищенный карбокси" означает(1) этерифицированный карбокси, конкретными примерами которого могут быть такие группы, как низший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил,пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил,изобутоксикарбонил,третбутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил, 1-циклопропилэтоксикарбонил и т.д.), которые могут иметь один или несколько заместителей, например, низший алканоилокси(низший)алкоксикарбонил [например, ацетоксиметоксикарбонил, пропионилоксиметоксикарбонил, бутирилоксиметоксикарбонил, валерилоксиметоксикарбонил, пивалоилоксиметоксикарбонил, 1-ацетоксиэтоксикарбонил, 1 пропионилоксиэтоксикарбонил, пивалоилоксиметоксикарбонил, 2-пропионилоксиэтоксикарбонил, гексаноилоксиметоксикарбонил и т.д.]; низший алкансульфонил(низший)алкоксикарбонил [например, 2-мезилэтоксикарбонил и т.д.]; моно-(или ди- или три-)галоген(низший) алкоксикарбонил [например, 2-иодэтоксикарбонил, 2,2,2-трихлорэтоксикарбонил и т.д.]; низший алкенилоксикарбонил [например,винилоксикарбонил, аллилоксикарбонил и т.д.]; низший алкинилоксикарбонил [например,этинилоксикарбонил, пропинилоксикарбонил и т.д.]; ар(низший)алкоксикарбонил [предпочтительно моно-(или ди- или три-)фенил(низший) алкоксикарбонил], который может иметь один или несколько заместителей [например, бензилоксикарбонил, 4-метоксибензилоксикарбонил,4-нитробензилоксикарбонил, фенетилоксикарбонил, тритилоксикарбонил, бензгидрилоксикарбонил, бис(метоксифенил)метоксикарбонил,3,4-диметоксибензилоксикарбонил, 4-гидрокси 3,5-ди-трет-бутилбензилоксикарбонил и т.д.]; арилоксикарбонил, который может иметь один или несколько заместителей [например,феноксикарбонил, 4-хлорфеноксикарбонил, толилоксикарбонил, 4-трет-бутилфеноксикарбонил, ксилилоксикарбонил, мезитилоксикарбонил, куменилоксикарбонил и т.д.] или тому подобные;(2) амидированный карбокси, конкретными примерами которого могут быть такие группы, как карбамоил;N-защищенный карбокси(низший)алкилкарбамоил, причем предпочтительной группой такого типа является N-этерифицированный карбокси(низший)алкилкарбамоил и более предпочтительной группой является N-низший алкоксикарбонил(низший)алкилкарбамоил [например, N-(метоксикарбонилметил)карбамоил,N-(этоксикарбонилметил)карбамоил,N-(2 этоксикарбонилэтил)карбамоил,N-(2-третбутоксикарбонилэтил)карбамоил, N-(3-метоксикарбонилпропил)карбамоил, N-(1-пропоксикарбонилпропил)карбамоил,N-(1-изопропоксикарбонилметилэтил)карбамоил, N-(бутоксикарбонилметил)карбамоил, N-(трет-бутоксикарбонилметил)карбамоил,N-(4-изобутоксикарбонилбутил)карбамоил, N-(2-трет-бутоксикарбонилметил-2-метилэтил)карбамоил, N-(3-пентилоксикарбонилпентил)карбамоил, N-(6-гексилоксикарбонилгексил)карбамоил,N-[(1-циклопропилэтокси)карбонилметил]карбамоил и т.д.];N-низший алкил-N-защищенный карбокси(низший)алкилкарбамоил, причем предпочтительной группой такого типа является Nнизший алкил-N-этерифицированный карбокси(низший)алкилкарбамоил и более предпочтительной группой является N-низший алкил-Nнизший алкоксикарбонил(низший)алкилкарбамоил [например, N-метил-N-(метоксикарбонилметил)карбамоил, N-метил-N-(этоксикарбонилметил)карбамоил, N-метил-N-(2-этоксикарбонилэтил)карбамоил, N-этил-N-(2-трет-бутоксикарбонилэтил)карбамоил, N-пропил-N-(3-метоксикарбонилпропил)карбамоил, N-изопропил-N(1-пропоксикарбонилпропил)карбамоил,Nпропил-N-(1-изопропоксикарбонилметилэтил) карбамоил, N-бутил-N-(бутоксикарбонилметил) карбамоил, N-изобутил-N-(трет-бутоксикарбонилметил)карбамоил, N-бутил-N-(4-изобутоксикарбонилбутил)карбамоил, N-метил-N-(2-третбутоксикарбонилметил-2-метилэтил)карбамоил,N-пентил-N-(3-пентилоксикарбонилпентил) карбамоил, N-гексил-N-(6-гексилоксикарбонилгексил)карбамоил, N-этил-N-[(1-циклопропилэтокси)карбонилметил]карбамоил и т.д.]; является N-содержащей гетероциклической группой, которая может иметь один или несколько заместителей и один или несколько гетероатомов, таких как N, О или S, в кольце; или тому подобные. Подходящие примеры вышеуказанной "Nсодержащей гетероциклической группы" могут включать насыщенные или ненасыщенные, моноциклические или полициклические гетероциклические группы, такие как ненасыщенные 3-8-членные (более предпочтительно 5-7-членные) гетеромоноциклические группы, содержащие 1-4 атома азота, такие как азепинил (например, 1H-азепинил и т.д.),пирролил, пирролинил, имидазолил, пиразолил,пиридил и его N-оксид, дигидропиридил, пиримидинил, пиразинил, пиридазинил, триазолил 10 лил (например, 1H-тетразолил, 2 Н-тетразолил и т.д.) и тому подобные; насыщенные 3-8-членные (более предпочтительно 5-7-членные) гетеромоноциклические группы, содержащие 1-4 атома азота, такие как пергидроазепинил (например, пергидро-1 Назепинил и т.д.), пирролидинил, имидазолидинил, пиперидино, пиперазинил и т.д.; ненасыщенные конденсированные гетероциклические группы, содержащие 1-4 атома азота, такие как индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил,индазолил, бензотриазолил и т.д.; насыщенные конденсированные гетероциклические группы, содержащие 1-4 атома азота, такие как 7-азабицикло[2.2.1]гептил, 3 азабицикло[3.2.2]нонанил и т.д.; ненасыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1 или 2 атома кислорода и 1-3 атома азота, такие как дигидрооксазинил (например, 5,6-дигидро-4 Н-дигидро 1,3-оксазинил и т.д.), оксазолил, изоксазолил,оксадиазолил (например, 1,2,4-оксадиазолил,1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.) и тому подобные; насыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1 или 2 атома кислорода и 1-3 атома азота, такие как морфолинил, сиднонил и т.д.; ненасыщенные конденсированные гетероциклические группы, содержащие 1 или 2 атома кислорода и 1-3 атома азота, такие как бензоксазолил, бензоксадиазолил и т.д.; ненасыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1 или 2 атома серы и 1-3 атома азота, такие как тиазолил, изотиазолил, тиадиазолил (например, 1,2,3 тиадиазолил,1,2,4-тиадиазолил,1,3,4 тиадиазолил, 1,2,5-тиадиазолил и т.д.), дигидротиазинил и т.д.; насыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1 или 2 атома серы и 1-3 атома азота, такие как тиазолидинил, тиоморфолинил и т.д.; ненасыщенные конденсированные гетероциклические группы, содержащие 1 или 2 атома серы и 1-3 атома азота, такие как бензотиазолил,бензотиадиазолил и т.д. Среди указанных групп предпочтение отдается насыщенным 3-8-членным гетеромоноциклическим группам, содержащим 1-4 атома азота; насыщенным 3-8-членным гетеромоноциклическим группам, содержащим 1 или 2 атома кислорода и 1-3 атома азота; и насыщенным 3-8-членным гетеромоноциклическим группам, содержащим 1 или 2 атома серы и 1-3 атома азота. 11 Указанная "N-содержащая гетероциклическая группа" может иметь один или несколько(предпочтительно 1-3) заместителей, таких как вышеуказанный низший алкил; гидрокси(низший)алкил (например, гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 3 гидроксипропил, 2-гидроксибутил, 1-метил-1 гидроксиметилэтил,4-гидроксипентил,3 гидроксигексил и т.д.); низший алкокси(низший)алкил (например,метоксиметил, 2-метоксиэтил, 1-этоксиэтил, 3 пропоксипропил, 2-(трет-бутокси)бутил, 5 пентилоксипентил, 3-гексилоксигексил и т.д.); ацилокси(низший)алкил, такой как низший алканоилокси(низший)алкил (например, ацетоксиметил, 1-ацетоксиэтил, 2-ацетоксиэтил, 2 пропионилоксиэтил, 3-пропионилоксипропил,2-бутирилоксибутил, 4-пивалоилоксипентил, 6 гексаноилоксигексил и т.д.) или тому подобные; защищенный карбокси, такой как вышеуказанный низший алкоксикарбонил; карбокси; ар(низший)алкил, такой как фенил(низший) алкил (например, бензил, фенетил и т.д.), дифенил(низший)алкил (например, бензгидрил и т.д.) или трифенил(низший)алкил (например, тритил и т.д.); низший алкиламино (например, метиламино, этиламино, пропиламино, бутиламино, третбутиламино, пентиламино, гексиламино и т.д.); ацил, такой как вышеуказанный низший алканоил; или тому подобные. Подходящий "арил" может включать фенил, нафтил, антрил и тому подобные, среди которых предпочтительным является (С 6-С 10) арил и более предпочтительным является фенил. Указанный "арил" может иметь один или несколько (предпочтительно 1-3) заместителей,которые выбирают из группы, включающей галоген (например, фтор, хлор, бром, иод), вышеуказанный низший алкил, низший алкокси (например, метокси, этокси, пропокси, бутокси,трет-бутокси, пентилокси, гексилокси и т.д.),гидрокси, низший алкилсилилокси (например,триметилсилилокси, трет-бутилдиметилсилилокси и т.д.), фенил(низший)алкокси (например,фенилметокси, фенилэтокси, фенилпропокси,фенилбутокси, фенилпентилокси, фенилгексилокси и т.д.), фенил, имеющий галоген(низший)алкил (например, трифторметилфенил и т.д.), и тому подобные. Подходящий "ар(низший)алкил" может включать фенил(низший)алкил (например, бензил, фенетил и т.д.), дифенил(низший)алкил(например, бензгидрил и т.д.) или трифенил(низший)алкил (например, тритил и т.д.) и тому подобные, среди которых предпочтительным является фенил(низший)алкил и более предпочтительным является фенил (C1-C4) алкил. Указанный "ар(низший)алкил" может иметь один или несколько (предпочтительно 1 001899 12 3) заместителей, таких как вышеуказанный низший алкокси и тому подобные. Подходящий "низший алкилен" может включать алкилен с прямой или разветвленной цепью, такой как метилен, этилен, триметилен,пропилен, тетраметилен, пентаметилен, гексаметилен и тому подобные, среди которых предпочтительным является (C1-C4) алкилен и более предпочтительными являются метилен и этилен. Подходящая "отщепляемая группа" может включать вышеуказанный галоген, гидрокси,ацилокси, такой как алканоилокси (например,ацетокси, пропионилокси и т.д.), сульфонилокси(например, мезилокси, тозилокси и т.д.) и тому подобные. Среди соединений пиразолпиридина по настоящему изобретению:(1) предпочтительным соединением формулы (I) является соединение,где R1 является фенилом и[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил, (C1-C6) алкоксикарбонил или фенил(C1-С 6) алкоксикарбонил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен,m является целым числом, равным 0 или 1,и(2) бoлее предпочтительным соединением формулы (I) является соединение,где R1 является фенилом иR2 является (C1-C6) алкилом, замещенным тиазолилом, который может иметь 1-3 (C1-C6) алкила, и(3) наиболее предпочтительным соединением формулы (I) является соединение,где R1 является фенилом и[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил или (C1-C6) алкоксикарбонил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен, 13(4) особенно предпочтительным соединением формулы (I) является соединение, гдеn является целым числом, равным 2]. Ниже подробно рассмотрены способы получения целевого соединения (I) и его соли(способы 1-7). Способ 1. Соединение формулы (I) и его соль можно получить в результате взаимодействия соединения формулы (II) или его соли с соединением формулы (III) или его солью. Подходящими солями соединения формулы (III) являются соли, указанные для соединения формулы (I). Эту реакцию можно осуществлять в растворителе, таком как вода, фосфатный буфер,ацетон, хлороформ, ацетонитрил, нитробензол,толуол, метиленхлорид, этиленхлорид, формамид, N,N-диметилформамид, метанол, этанол,втор-бутанол, амиловый спирт, диэтиловый эфир, диметоксиэтан, диоксан, тетрагидрофуран, диметилсульфоксид, или в любом другом органическом растворителе, который не оказывает вредного влияния на данную реакцию,предпочтительно в высокополярных растворителях. Гидрофильные растворители можно использовать в смеси с водой. В качестве растворителя можно также использовать соединение формулы (III) в жидкой форме. Указанную реакцию предпочтительно осуществляют в присутствии основания, например, неорганического основания, такого как гидроксид щелочного металла, алкоксид щелочного металла, карбонат щелочного металла, бикарбонат щелочного металла, гидрид щелочного металла, или органического основания, такого как гидроксид бензилтриметиламмония, триметиламин и тому подобные. Температура реакции не имеет критического значения, и рассматриваемую реакцию обычно осуществляют в условиях охлаждения,при комнатной температуре, в условиях подогрева или нагревания. Данную реакцию предпочтительно осуществляют в присутствии галогенида щелочного металла (например, иодида натрия, иодида калия и т.д.), тиоцианата щелочного металла (например, тиоцианата натрия, тиоцианата калия и т.д.), ди(низший)алкилазодикарбоксилата (на 001899 14 пример, диэтилазодикарбоксилата, диизопропилазодикарбоксилата и т.д.) или тому подобных. Когда Х является -ОН, может потребоваться активация ОН трифенилфосфином и подобными веществами. Способ 2. Соединение формулы (Iа) и его соль можно получить в результате взаимодействия соединения формулы (II) или его соли с соединением формулы (IV). Реакцию по этому способу осуществляют аналогично способу 1. Способ 3. Соединение формулы (Iс) и его соль можно получить из соединения формулы (Ib) или его соли путем отщепления ацила. Подходящими солями соединения формулы (Ib) и (Iс) являются соли, указанные для соединения формулы (I). Эту реакцию осуществляют известным методом, таким как гидролиз. Гидролиз предпочтительно выполняют в присутствии основания или кислоты, включая кислоту Льюиса. Подходящим основанием может быть неорганическое или органическое основание, в частности, щелочной металл (например, натрий, калий и т.д.), щелочно-земельный металл (например, магний, кальций и т.д.), их гидроксид, карбонат или бикарбонат, триалкиламин (например, триметиламин, триэтиламин и т.д.), пиколин, 1,5-диазабицикло[4.3.0]нон-5-ен,1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]ундец-7-ен или тому подобные. Подходящей кислотой может быть органическая кислота (например, муравьиная кислота,уксусная кислота, пропионовая кислота, трихлоруксусная кислота, трифторуксусная кислота и т.д.) и неорганическая кислота (например,хлористо-водородная кислота,бромистоводородная кислота, серная кислота, хлороводород, бромоводород и т.д.). Реакцию отщепления с использованием кислоты Льюиса, такой как тригалогенуксусная кислота (например,трихлоруксусная кислота, трифторуксусная кислота и т.д.) или тому подобная, предпочтительно осуществляют в присутствии катионоулавливающих агентов (например, анизола, фенола и т.д.). Данную реакцию обычно осуществляют в растворителе, таком как вода, спирт (например,метанол, этанол и т.д.), метиленхлорид, тетрагидрофуран, диоксан и их смеси, или в любом другом растворителе, который не оказывает вредного влияния на эту реакцию. В качестве растворителя можно также использовать жидкое основание или кислоту. Температура реакции не имеет критического значения, и рассматриваемую реакцию обычно осуществляют в условиях от охлаждения до нагревания. Реакцию по этому способу можно также осуществлять известным методом восстановле 15 ния, применяемым в этой области, таким как химическое восстановление, каталитическое восстановление и т.д. Способ 4. Соединение формулы (Iс) и его соль можно получить из соединения формулы (Id) или его соли путем деалкилирования. Подходящими солями соединения формулы (Iс) и (Id) являются соли, указанные для соединения формулы (I). Эту реакцию осуществляют в результате взаимодействия соединения формулы (Id) или его соли с деалкилирующим агентом. Деалкилирующим агентом может быть галоген(низший)алкилгалогенформиат и подобные вещества. Указанную реакцию обычно осуществляют в таком растворителе, как вода, спирт (например, метанол, этанол и т.д.), ацетон, диоксан,ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,Nдиметилформамид и пиридин, или в любом другом органическом растворителе, который не оказывает вредного влияния на эту реакцию. Эти растворители можно также использовать в смеси с водой. Температура реакции не имеет критического значения, и рассматриваемую реакцию обычно осуществляют при комнатной температуре и в условиях подогрева или нагревания. Способ 5. Соединение формулы (Iе) и его соль можно получить из соединения формулы (Iс) или его соли путем алкилирования. Подходящими солями соединения формулы (Iс) и (Iе) являются соли, указанные для соединения формулы (I). Эту реакцию осуществляют в результате взаимодействия соединения формулы (Iс) или его соли с алкилирующим агентом. Алкилирующим агентом может быть низший алкилгалогенид и подобные вещества. Указанную реакцию обычно осуществляют в таком растворителе, как вода, спирт (например, метанол, этанол и т.д.), ацетон, диоксан,ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,Nдиметилформамид и пиридин, или в любом другом органическом растворителе, который не оказывает вредного виляния на эту реакцию. Эти растворители можно также использовать в смеси с водой. Температура реакции не имеет критического значения, и рассматриваемую реакцию обычно осуществляют при комнатной температуре, в условиях подогрева или нагревания. Данную реакцию предпочтительно осуществляют в присутствии галогенида щелочного металла (например, иодида натрия, иодида калия и т.д.), тиоцианата щелочного металла (например, тиоцианата натрия, тиоцианата калия и т.д.) или тому подобного. 16 Способ 6. Соединение формулы (Ib) и его соль можно получить из соединения формулы (Iс) или его соли путем ацилирования. Подходящими солями соединения формулы (Ib) и (Iс) являются соли, указанные для соединения формулы (I). Эту реакцию осуществляют в результате взаимодействия соединения формулы (Iс) или его соли с ацилирующим агентом. Ацилирующим агентом может быть ацилгалогенид, соответствующий вводимому ацилу,ацилангидрид, соответствующий вводимому ацилу, и тому подобные. Указанную реакцию обычно осуществляют в таком растворителе, как вода, спирт (например, метанол, этанол и т.д.), ацетон, диоксан,ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,Nдиметилформамид и пиридин, или в любом другом органическом растворителе, который не оказывает вредного виляния на эту реакцию. Эти растворители можно также использовать в смеси с водой. Температура реакции не имеет критического значения, и рассматриваемую реакцию обычно осуществляют при комнатной температуре, в условиях подогрева или нагревания. Способ 7. Соединение формулы (If) и его соль можно получить из соединения формулы (V) или его соли путем образования тиазольного кольца. Подходящими солями соединения формулы (V) и (If) являются соли, указанные для соединения формулы (I). Эту реакцию осуществляют в результате взаимодействия соединения формулы (V) или его соли с галогенацетальдегидом или его реакционноспособным производным. Галогенацетальдегидом или его реакционноспособным производным является диэтилацеталь бромацетальдегида и тому подобные. Указанную реакцию обычно осуществляют в таком растворителе, как вода, спирт (например, метанол, этанол и т.д.), ацетон, диоксан,ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,Nдиметилформамид и пиридин, или в любом другом органическом растворителе, который не оказывает вредного виляния на эту реакцию. Эти растворители можно также использовать в смеси с водой. Температура реакции не имеет критического значения, и рассматриваемую реакцию обычно осуществляют при комнатной температуре, в условиях подогрева или нагревания. Целевое соединение формулы (I) по настоящему изобретению является антагонистом аденозина и обладает широким фармакологическим действием, как это было описано выше. Для проверки эффективности соединения формулы (I) по настоящему изобретению было 17 произведено фармакологическое испытание типичного соединения по данному изобретению, результаты которого приведены ниже. Испытание: Антагонистическое действие на аденозин.[I] Метод испытания. Антагонистическое действие испытуемого соединения на аденозин исследовали методом связывания меченого лиганда при использовании 8-циклопентил-1,3-дипропилксантина, [дипропил-2,3-3H(N)] (3H-DPCPX, 210-9 М) для рецепторов А 1 человека.(I) и его соль по данному изобретению являются эффективными антагонистами аденозина, и их можно использовать для профилактики и/или лечения депрессии, слабоумия (например, болезни Альцгеймера, цереброваскулярного слабоумия, болезни Паркинсона и т.д.), состояния страха, болевого синдрома, цереброваскулярных заболеваний (например, инсульта и т.д.), сердечной недостаточности и подобных заболеваний. Фармацевтическую композицию по данному изобретению можно использовать в виде фармацевтического препарата, например, в твердой, полутвердой или жидкой форме, содержащего соединение пиразолопиридина формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента в смеси с органическим или неорганическим носителем или наполнителем, приемлемым для ректального, легочного (носовая или ротовая ингаляция),носового, глазного, наружного (местного), перорального или парентерального (включая подкожное, внутривенное и внутримышечное введение) применения или инсуффляции. Активный ингредиент может быть смешан, например,с обычными нетоксичными, фармацевтически приемлемыми носителями, используемыми для приготовления таблеток, пилюль, пастилок,капсул, суппозиториев, кремов, мазей, аэрозолей, порошков для инсуффляции, растворов,эмульсий, суспензий и любых других приемлемых лекарственных форм. Кроме того, при необходимости можно использовать вспомогательные средства, стабилизаторы, загустители,красители и ароматизаторы. Соединение пиразолопиридина формулы (I) или его фармацевтически приемлемую соль вводят в фармацевтическую композицию в количестве, достаточном для достижения желаемого терапевтического эффекта при лечении вышеуказанных болезней. 18 Указанную композицию, предназначенную для лечения людей или животных, предпочтительно вводят внутривенным, внутримышечным, легочным или пероральным способом либо посредством инсуффляции. Хотя доза терапевтически эффективного количества соединения пиразолопиридина формулы (I), используемого для профилактики и/или лечения вышеуказанных болезней, может быть различной в зависимости от возраста и состояния нуждающегося субъекта, в случае внутривенного введения суточная доза составляет 0,01-100 мг соединения пиразолопиридина формулы (I) на кг массы тела человека или животного, в случае внутримышечного введения суточная доза составляет 0,1100 мг соединения пиразолопиридина формулы(I) на кг массы тела человека или животного и в случае перорального введения суточная доза составляет 0,5-100 мг соединения пиразолопиридина формулы (I) на кг массы тела человека или животного. Настоящее изобретение более подробно иллюстрируется нижеследующими препаративными и основными примерами. Условные обозначения.(нуджол); FT-IR инфракрасный спектр с фурьепреобразованием; NMR - спектр ЯМР; (s) синглет, (d) - дублет, (t) - триплет, (q) - квартет,(m) -мультиплет, (ddd) - двойной дублет дублетов, (dt) - дублет триплетов, (br s) - широкий синглет, (br d) - широкий дублет; DMSO - диметилсульфоксид (ДМСО); (+)-APCI/MS - массспектрометрия с применением химической ионизации при атмосферном давлении в режиме положительно заряженного иона; (+)FAB-MS масс-спектрометрия с бомбардировкой ускоренными атомами в режиме положительно заряженного иона. Препаративный пример 1. В смесь 3-(2-цианометил-3-оксо-2,3-дигидропиридазин-6-ил)-2-фенилпиразоло[1,5-а] пиридина (2,0 г) и триэтиламина (1,02 мл) в пиридине (10 мл) при температуре 50 С в течение 6 ч вводят сероводород. Смесь выливают в воду. Полученное твердое вещество собирают фильтрованием, что дает 3-(3-оксо-2-тиокарбамоилметил-2,3-дигидропиридазин-6-ил)-2-фенилпиразоло[1,5-а]пиридин (2,18 г). Т.пл.: 220,0-221,0 С (EtOH)(+)-APCI/MS (m/z): 36.2 (M+H)+ Элементный анализ для C19H15N5OS1/2 H2O: Вычислено: C 61.61, Н 4.35, N 18.91(200 мл) и тетрагидрофурана (200 мл) при температуре 0-10 С по каплям добавляют бензилхлорформиат (29 мл) и доводят показатель рН до 8,5-9,5 30% водным раствором гидроксида натрия. К реакционной смеси добавляют этилацетат (250 мл), органическую фазу отделяют, дважды промывают 200 мл насыщенного раствора хлорида натрия в воде и сушат над сульфатом магния. Растворитель выпаривают с получением 1 бензилоксикарбонил-4-пиперидона (42,5 г, выход 98,8%).(+)-APCI/MS: 234 (M1) Препаративный пример 3. К суспензии гидрида натрия (7,92 г, 60% дисперсия в минеральном масле) в диметилсульфоксиде (250 мл) при комнатной температуре в атмосфере азота порциями добавляют иодид триметилсульфоксония (41,63 г). Реакционную смесь перемешивают в течение 1 ч, по каплям добавляют 1-бензилоксикарбонил-4-пиперидон (42 г), нагревают смесь до 55 С и продолжают перемешивать еще 4 ч. Реакционную смесь выливают в смесь воды со льдом (800 мл) и трижды экстрагируют 800 мл этилацетата. Органическую фазу объединяют, промывают водой (500 мл 3) и насыщенным раствором хлорида натрия в воде и сушат над сульфатом магния. Растворитель выпаривают и полученный остаток хроматографируют на силикагеле, элюируя раствором 20% этилацетата в нгексане, что дает 1-бензилоксикарбонилпиперидин-4-спиро-2'-оксиран (23,25 г, выход 52,2%).(200 мл) и воды (200 мл) при 0 С последовательно добавляют триэтиламин (60 мл) и дитрет-бутилдикарбонат (48,2 г). Полученную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают, полученный остаток растворяют в этилацетате (400 мл), последовательно промывают 1N водным раствором хлористо-водородной кислоты (200 мл), насыщенным раствором бикарбоната натрия в воде(200 мл) и насыщенным раствором хлорида на 001899 20 трия в воде (200 мл 2) и сушат над сульфатом магния. Нерастворимое вещество отфильтровывают и фильтрат концентрируют в вакууме, что дает (3R)-1-трет-бутоксикарбонил-3-гидроксипирролидин (27,17 г).(+)-APCI/MS (m/z): 188 (M1) Препаративный пример 5. 1-трет-Бутоксикарбонил-4-пиперидинол получают с выходом 91,2% аналогично препаративному примеру 4.(9 Н, s), 1.60-1.74 (2 Н, m), 2.87-3.01 (2 Н, m), 3.553.71 (3 Н, m), 4.67 (1 Н, d, J=4.1 Hz) Препаративный пример 6. 1-трет-Бутоксикарбонил-2-(2-гидроксиэтил)пиперидин получают аналогично препаративному примеру 4.(9 Н, s), 2.60-2.80 (1 Н, m), 3.25-3.72 (2 Н, m), 3.754.05 (2 Н, m), 4.35-4.50 (1 Н, m) Препаративный пример 7. К суспензии алюмогидрида лития (2,0 г) в тетрагидрофуране (100 мл) при комнатной температуре в атмосфере азота по каплям добавляют раствор 1-трет-бутоксикарбонил-2-(2 гидроксиэтил)пиперидина (8,0 г) в тетрагидрофуране (50 мл). Полученную смесь перемешивают в течение 6 ч и нагревают с обратным холодильником в течение 3,5 ч. Реакционную смесь оставляют охлаждаться до 5 С, после чего осторожно последовательно добавляют воду (2 мл), 4N водный раствор гидроксида натрия (2 мл) и воду (6 мл). Нерастворимое вещество отфильтровывают, фильтрат концентрируют в вакууме и полученный остаток хроматографируют на силикагеле, элюируя последовательно хлороформом,смесью хлороформ:метанол (10:1) и метанолом. Содержащие требуемый продукт фракции собирают и растворитель удаляют при пониженном давлении, что дает 2-(2-гидроксиэтил)1-метилпиперидин (2,47 г).-70 до -60 С в атмосфере азота по каплям добавляют пропионилхлорид (4,5 мл). Реакционную смесь перемешивают в течение 1 ч, нерастворимое вещество отфильтровывают и фильтрат концентрируют в вакууме. К полученному остатку добавляют этилацетат(200 мл) и перемешивают смесь в течение 30 мин. Нерастворимое вещество отфильтровывают и фильтрат концентрируют в вакууме, что дает 4-гидрокси-1-пропионилпиперидин (7,70 г).(+)-APCI/MS (m/z): 158 (M1) Препаративный пример 9. К суспензии алюмогидрида лития (1,81 г) в тетрагидрофуране (100 мл) при комнатной температуре в атмосфере азота по каплям добавляют раствор 4-гидрокси-1-пропионилпиперидина(5,0 г) в тетрагидрофуране (30 мл). Реакционную смесь перемешивают в течение 1 ч, нагревают с обратным холодильником в течение 4 ч и оставляют охлаждаться до 4 С. К полученной смеси осторожно последовательно добавляют воду (1,81 мл), 4N водный раствор гидроксида натрия (1,81 мл) и воду(5,43 мл) и перемешивают смесь еще 1 ч. Нерастворимое вещество отфильтровывают и фильтрат концентрируют в вакууме, что дает 4-гидрокси-1-пропилпиперидин (4,37 г).(+)-APCI/MS (m/z): 144 (М 1) Препаративный пример 10. 1-Бутирил-4-гидроксипиперидин получают с выходом 98,7% аналогично препаративному примеру 8.(+)-APCI/MS (m/z): 172 (М 1) Препаративный пример 11. 1-Бутил-4-гидроксипиперидин получают с выходом 98,0% аналогично препаративному примеру 9.(+)-APCI/MS (m/z): 158 (М 1) Препаративный пример 12. 4-Гидрокси-1-пентаноилпиперидин получают с выходом 98,3% аналогично препаративному примеру 8.(+)-APCI/MS (m/z): 186 (M1) Препаративный пример 13. 4-Гидрокси-1-пентилпиперидин получают с выходом 99,4% аналогично препаративному примеру 9.(+)-APCI/MS (m/z): 172 (M1) Препаративный пример 14. 1-Гексаноил-4-гидроксипиперидин получают с выходом 96,7% аналогично препаративному примеру 8.(+)-APCI/MS (m/z): 200 (M1) Препаративный пример 15. 1-Гексил-4-гидроксипиперидин получают с выходом 97,2% аналогично препаративному примеру 9.(+)-APCI/MS (m/z): 186 (M1) Препаративный пример 16. 1-Ацетилпиперидин-4-ол получают с выходом 95,6% аналогично препаративному примеру 8.(+)-APCI/MS (m/z): 144 (M1) Препаративный пример 17. 1-Этилпиперидин-4-ол получают с выходом 87,0% аналогично препаративному примеру 9.(+)-APCI/MS (m/z): 130 (M1) Препаративный пример 18. К раствору изонипекотиновой кислоты (5 г) в смеси диоксана (50 мл) и воды (25 мл) при 0 С последовательно добавляют 38 мл 1N водного раствора гидроксида натрия и ди-третбутилдикарбонат (8,87 г), оставляют смесь нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают и полученный остаток растворяют в этилацетате (2,00 мл) и воде (100 мл). Показатель рН доводят до 2, добавляя 2N водный раствор хлористо-водородной кислоты. Органическую фазу отделяют и сушат над сульфатом магния. Растворитель выпаривают с получением 1 трет-бутоксикарбонил-4-пиперидинкарбоновой кислоты (8,4 г). 23 Препаративный пример 19. К суспензии алюмогидрида лития (350 мг) в тетрагидрофуране (20 мл) при комнатной температуре в атмосфере азота по каплям добавляют раствор 1-трет-бутоксикарбонил-4-пиперидинкарбоновой кислоты (1 г). Реакционную смесь перемешивают в течение 24 ч и оставляют охлаждаться до 0 С, затем осторожно последовательно добавляют воду(0,35 мл), 4N водный раствор гидроксида натрия(0,35 мл) и воду (1,05 мл). Нерастворимое вещество отфильтровывают и фильтрат концентрируют в вакууме, что дает 1-метил-4-пиперидинметанол (600 мг).(+)-APCI/MS (m/z): 144 (M1) Препаративный пример 20. К перемешанной суспензии гидрида натрия (238 мг) в тетрагидрофуране (50 мл) при комнатной температуре в атмосфере азота по каплям добавляют триэтилфосфоноацетат (1,2 мл). Реакционную смесь перемешивают в течение 30 мин, добавляют по каплям 1-третбутоксикарбонил-4-пиперидон (1 г) и продолжают перемешивать смесь в течение ночи. К перемешанной реакционной смеси добавляют воду (1 мл). Растворитель выпаривают, полученный остаток растворяют в этилацетате, последовательно промывают водой (100 мл) и насыщенным раствором соли (100 мл) и сушат над сульфатом магния. Растворитель выпаривают и полученный остаток хроматографируют на силикагеле,элюируя смесью н-гексан : этилацетат (4:1), что дает 1-трет-бутоксикарбонил-4-этоксикарбонилметиленпиперидин (1,19 г).(1H, s) Препаративный пример 21. Смесь 1-трет-бутоксикарбонил-4-этоксикарбонилметиленпиперидина (3 г) и 10% палладия на угле (50% влажность, 600 мг) в метаноле 24 Препаративный пример 22. 1-Метил-4-пиперидинэтанол получают с выходом 82,0% аналогично препаративному примеру 19.[1,5-а]пиридина (0,50 г) и диэтилацеталь бромацет альдегида (0,54 мл) в смеси метанола (2,5 мл) и хлороформа (5 мл) нагревают с обратным холодильником в течение 54 ч. Растворитель выпаривают и остаток хроматографируют на силикагеле(40 мл),элюируя смесью хлороформ:этилацетат (20:1). Требуемые фракции собирают и упаривают в вакууме. Остаток перекристаллизовывают из смеси этилацетат нгексан с получением 3-[3-оксо-2-(2-тиазолилметил)-2,3-дигидропиридазин-6-ил]-2 фенилпиразоло[1,5-а]пиридина (0,23 г) в виде желтых игл. Т.пл.: 130,0-132,0 С (EtOAc-н-гексан)(+)-APCI/MS (m/z) : 386 (M+H)+ Элементный анализ для С 21H15N5OS1/4 H2O: Вычислено: С 64.44, Н 4.03, N 17.89 Найдено: С 64.05, Н 3.85, N 17.57 Пример 2. Перемешанную смесь 3-(3-оксо-2,3 дигидропиридазин-6-ил)-2-фенилпиразоло[1,5-а]пиридина (2,0 г), гидрохлорида 4-хлор-1 метилпиперидина (1,24 г) и гидрида натрия (610 мг, 60% дисперсия в минеральном масле) в N,Nдиметилформамиде (20 мл) нагревают при температуре 115 С и перемешивают в течение 1 дня. Реакционную смесь охлаждают до комнатной температуры и добавляют воду. Растворитель выпаривают, полученный остаток растворяют в хлороформе (300 мл), последовательно промывают водой (20 мл 2),насыщенным раствором бикарбоната натрия в воде (20 мл) и насыщенным раствором хлорида натрия в воде (20 мл) и сушат над сульфатом магния. Растворитель выпаривают и полученный остаток хроматографируют на силикагеле (100 мл), элюируя последовательно хлороформом и смесью хлороформ:метанол (50:140:110:1). Содержащие требуемый продукт фракции собирают, растворитель удаляют в вакууме и полу 25 ченный продукт перекристаллизовывают из 50% водного этанола, что дает 3-[2-(1-метилпиперидин-4-ил)-3-оксо-2,3-дигидропиридазин 6-ил]-2-фенилпиразоло[1,5-а]пиридин (471 мг). Т.пл.: 139,0-140,0 С (водн. EtOH)(+)-APCI/MS (m/z): 386 (M+1) Элементный анализ для С 23 Н 23N5OН 2 О: Вычислено: С 68.47, Н 6.25, N 17.36 Найдено: C 68.71, Н 6.08, N 17.37 Пример 3. К перемешанной смеси 3-(3-оксо-2,3 дигидропиридазин-6-ил)-2-фенилпиразоло[1,5-а]пиридина (30 г), 1-метил-4-гидроксипиперидина (15,58 г) и трифенилфосфина (40,94 г) в тетрагидрофуране (1,2 л) при температуре от -5 до 0 С в атмосфере азота по каплям добавляют диэтилазодикарбоксилат (24,58 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают, полученный остаток растворяют в этилацетате (2 л) и дважды экстрагируют 300 мл 2N водного раствора хлористо-водородной кислоты. Водные фазы объединяют и показатель рН доводят до 10,7 30% водным раствором гидроксида натрия, поддерживая температуру в интервале от 5 до 15 С. Нерастворимое вещество собирают фильтрованием, промывают 500 мл воды и сушат с получением сырого продукта. Сырой продукт растворяют в хлороформе и хроматографируют на силикагеле (800 г),элюируя последовательно этилацетатом, хлороформом и смесью хлороформ:метанол (40:1). Содержащие требуемый продукт фракции собирают, растворитель удаляют в вакууме и полученные сырые кристаллы перекристаллизовывают из 50% водного этанола, что дает 3-[2(1-метилпиперидин-4-ил)-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а] пиридин (19,36 г). Пример 4. К перемешанному раствору 3-(3-оксо-2,3 дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина (1,0 г), 1-метил-4-гидроксипиперидина (520 мг) и трифенилфосфина (1,37 г) в тетрагидрофуране (40 мл) при температуре от -5 до 0 С в атмосфере азота по каплям добавляют диизопропилазодикарбоксилат (1,03 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают, полученный остаток растворяют в этилацетате (100 мл) и два 001899 26 жды экстрагируют 50 мл 6N водного раствора хлористо-водородной кислоты. Водные фазы объединяют и показатель рН доводят до 10,0 30% водным раствором гидроксида натрия,поддерживая температуру в интервале от 5 до 15 С. Нерастворимое вещество собирают фильтрованием, промывают водой и сушат при пониженном давлении с получением сырого продукта. Сырой продукт растворяют в хлороформе и хроматографируют на силикагеле (75 г),элюируя смесью хлороформ:метанол (40:1). Содержащие требуемый продукт фракции собирают, растворитель удаляют в вакууме и полученные сырые кристаллы перекристаллизовывают из 50% водного этанола, что дает 3-[2(1-метилпиперидин-4-ил)-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридин(30 мл) добавляют 25% раствор хлористоводородной кислоты в этаноле (5 мл) и перемешивают смесь в течение ночи при комнатной температуре. Полученный осадок собирают фильтрованием, промывают этанолом и сушат при пониженном давлении, что дает гидрохлорид 3-[2-(1 метилпиперидин-4-ил)-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина(+)FAB-MS (m/z): 386 (M1) Элементный анализ для C23H25ClN5O3/2(1 Н, d, J=8.9 Hz), 8.83 (1 Н, d, J=6.9 Hz) Элементный анализ для С 27 Н 29N5O3 Н 2 О Вычислено: С: 66.24, Н: 6.38, N: 14.30 Найдено: C: 66.66, Н: 6.26, N: 14.24 Пример 7. Смесь 3-[2-3S)-1-трет-бутоксикарбонилпирролидин-3-ил)-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина (2,4 г) в 6N водном растворе хлористо-водородной кислоты (50 мл) нагревают с обратным холодильником в течение 4,5 ч. Реакционную смесь охлаждают и растворитель удаляют в вакууме. К полученному остатку добавляют этанол(15 мл) и 25% раствор хлористо-водородной кислоты в этаноле (5 мл) и перемешивают смесь в течение ночи при комнатной температуре. Полученный осадок собирают фильтрованием, промывают этанолом и сушат при пониженном давлении, что дает гидрохлорид 3-[3 оксо-2-3S)-пирролидин-3-ил)-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина(+)-FAB/MS (m/z): 358 (M1) Элементный анализ для С 21 Н 20ClN5O1 Н 2 О Вычислено: C 60.58, Н 5.45, N 16.82 Найдено: C 60.31, Н 5.47, N 16.62 Пример 8. Гидрохлорид 3-[3-оксо-2-(пиперидин-4 ил)-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина получают с выходом 79,5% аналогично примеру 1. Т.пл. 290 С (EtOH)(+)-FAB/MS (m/z): 372 (M1) Элементный анализ для C22H22ClN5O3/4 H2O Вычислено: С: 62.70, Н: 5.62, N: 16.62 Найдено: С: 62.76, Н: 5.72, N: 16.53 Пример 9. К перемешанной смеси 3-(3 оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина (3,34 г), (3R)-1-третбутоксикарбонил-3-гидроксипирролидина (2,6 28 г) и трифенилфосфина (4,55 г) в тетрагидрофуране (100 мл) при температуре 0-5 С в атмосфере азота по каплям добавляют диэтилазодикарбоксилат (2,73 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают, к полученному остатку добавляют 6N водный раствор хлористо-водородной кислоты (100 мл) и нагревают смесь с обратным холодильником в течение 8 ч. Реакционную смесь охлаждают и промывают этилацетатом (200 мл 2). Показатель рН водной фазы доводят до 12 30% водным раствором гидроксида натрия,поддерживая температуру в интервале от 5 до 15 С. Полученный продукт экстрагируют хлороформом (200 мл 2), органические фазы объединяют и сушат над сульфатом магния. Растворитель выпаривают и полученный остаток хроматографируют на силикагеле,элюируя последовательно хлороформом и смесью хлороформ:метанол (40:120:110:1). Содержащие требуемый продукт фракции собирают, растворитель удаляют в вакууме и полученный сырой продукт перекристаллизовывают из этанола, что дает 3-[3-оксо-2-3S)пирролидин-3-ил)-2,3-дигидропиридазин-6-ил]2-фенилпиразоло[1,5-а]пиридин (2,84 г). Т.пл.: 144,0-145,5 С (EtOH)(+)-APCI/MS (m/z): 358 (M1) Элементный анализ для C21H19N5O2/3 Н 2 О Вычислено: C 68.28, Н 5.55, N 18.96 Найдено: C 68.47, Н 5.28, N 18.90 Пример 10. 3-[3-Оксо-2-(пиперидин-4-ил)-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а] пиридин получают с выходом 62,2% аналогично примеру 9. Т.пл.: 115,0-117,0 С (водн. EtOH)(+)-APCI/MS (m/z): 372 (M1) Элементный анализ для С 22 Н 21N5O2 1/4(+)-APCI/MS (m/z): 400 (M1) Элементный анализ для C24H25N5O1/2 Н 2 О Вычислено: C: 70.57, Н: 6.42, N: 17.14(+)-APCI/MS (m/z): 414 (M1) Элементный анализ для C25H27N5O1/10 Н 2O Вычислено: С 72.58, Н 6.60, N 16.86 Найдено: C 72.61, Н 6.58, N 16.94 Пример 13. 3-[2-(1-Бутилпиперидин-4-ил)-3-оксо-2,3 дигидропиридазин-6-ил]-2-фенилпиразоло(+)-APCI/MS (m/z): 428 (M1) Элементный анализ для С 26 Н 29N5O1/2(+)-APCI/MS (m/z): 442 (М 1) Элементный анализ для С 27 Н 31N5O1/4 Н 2 О Вычислено: C 72.70, Н 7.12, N 15.70 Найдено: C 72.73, Н 7.10, N 15.72 Пример 15. 3-[2-(1-Гексилпиперидин-4-ил)-3-оксо-2,3 дигидропиридазин-6-ил]-2-фенилпиразоло(+)-APCI/MS (m/z): 456 (М 1) Элементный анализ для C28H33N5O1/8H2O Вычислено: С 73.45, Н 7.32, N 15.30 Найдено: С 73.35, Н 7.39, N 15.28 Пример 16. К суспензии гидрида натрия (65 мг, 60% дисперсия в минеральном масле) в N,N'диметилформамиде (20 мл) при температуре 25 С в атмосфере азота по каплям добавляют 3[2-(пиперидин-4-ил)-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридин (500 мг) и полученную смесь перемешивают в течение 30 мин. К реакционной смеси добавляют изопропилиодид (940 мг) и перемешивают смесь еще 18 ч. К полученной смеси добавляют избыток триэтиламина и воды. Растворитель выпаривают, полученный остаток растворяют в этилацетате (100 мл) и промывают 1N водным раствором хлористо-водородной кислоты. Водный слой доводят до рН 10-12 4N водным раствором гидроксида натрия и экстрагируют этилацетатом (100 мл). Органический слой отделяют,промывают водой (100 мл) и сушат над сульфатом магния. Растворитель выпаривают и полученный остаток перекристаллизовывают из 50% водного этанола, что дает 3-[2-(1-изопропилпиперидин 4-ил)-3-оксо-2,3-дигидропиридазин-6-ил]-2 фенилпиразоло[1,5-а]пиридин (350 мг). Т.пл.: 157,5-158,3 С (50% водн. EtOH)(+)-APCI/MS (m/z): 386.1 (M1) Элементный анализ для C23H23N5O2H2O Вычислено: С 65.54, Н 6.46, N 16.61 Найдено: С 65.75, Н 6.39, N 16.56 Пример 18. 3-[2-(1-Бензилпиперидин-4-ил)-3-оксо-2,3 дигидропиридазин-6-ил]-2-фенилпиразоло(+)-APCI/MS (m/z): 462 (M1) Элементный анализ для C29H27N5O1/2H 2O Вычислено: C 74.02, Н 6.00, N 14.88 Найдено: C 74.37, Н 6.08, N 15.36 Пример 19. К перемешанному раствору 3-(3-оксо-2(пиперидин-4-ил)-2,3-дигидропиридазин-6-ил]2-фенилпиразоло[1,5-а]пиридина (0,5 г) в пиридине (30 мл) при комнатной температуре по каплям добавляют уксусный ангидрид (1,28 мл). Реакционную смесь перемешивают в течение ночи. Растворитель выпаривают, полученный остаток растворяют в этилацетате (100 мл), последовательно промывают 2N водным раствором хлористо-водородной кислоты (100 мл) и насыщенным раствором хлорида натрия в воде (100 мл) и сушат над сульфатом магния. Нерастворимое вещество отфильтровывают. Фильтрат концентрируют в вакууме с получением 3-[2-(1-ацетилпиперидин-4-ил)-3-оксо 001899(+)-APCI/MS (m/z): 414 (М 1) Пример 20. К перемешанной смеси 3-[3-оксо-2(пиперидин-4-ил)-2,3-дигидропиридазин-6-ил]2-фенилпиразоло[1,5-а]пиридина (500 мг), третбутоксида калия (182 мг) и 18-крон-6-эфира (34 мг) в тетрагидрофуране (20 мл) при комнатной температуре добавляют метилиодид (0,17 мл) и полученную смесь перемешивают в течение ночи при той же температуре. Нерастворимое вещество собирают фильтрованием. Сырое твердое вещество перекристаллизовывают из этанола с получением иодида 3-[2-(1,1-диметил-4-пиперидинио)-3-оксо 2,3-дигидропиридазин-6-ил]-2-фенилпиразоло(1H, d, J=8.9 Hz), 8.82 (1H, d, J=6.9 Hz) Элементный анализ для С 24H25N5O3/10 Н 2O Вычислено: C 71.19, Н 6.37, N 17.30 Найдено: С 71.40, Н 6.34, N 17.30(+)-APCI/MS (m/z): 400.2 (M1) Элементный анализ для С 24 Н 25N5O Вычислено: С 72.16, Н 6.31, N 17.53 Найдено: С 72.30, Н 6.41, N 17.53 Пример 25. 3-[2-2-(1-Метилпиперидин-2-ил)этил-3 оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридин получают с выходом 91,0% аналогично примеру 3. Т.пл.: 113,5-116,0 С (EtOH-н-гексан)(+)-APCI/MS (m/z): 414 (M1) Элементный анализ для C25H27N5O1/8 Н 2 О Вычислено: С 72.22, Н 6.61, N 16.84 Найдено: C 72.03, Н 6.55, N 16.81[1,5-а]пиридина (2,7 г), 1-метил-4-пиперидинэтанола (1,41 г) и трифенилфосфина (3,19 г) в тетрагидрофуране (60 мл) при температуре 05 С в атмосфере азота по каплям добавляют диэтилазодикарбоксилат (1,92 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают, к полученному остатку добавляют 2N водный раствор хлористо-водородной кислоты и перемешивают смесь в течение 1 ч. Реакционную смесь промывают этилацетатом. Водную фазу отделяют. Показатель рН водной фазы доводят до 12 15% водным раствором гидроксида натрия, поддерживая температуру в интервале от 5 до 15 С. Полученный раствор экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой и сушат над сульфатом магния. Растворитель выпаривают, полученный остаток вводят в этанол (2 мл), добавляют 25% раствор хлористо-водородной кислоты в этаноле (1 мл) и перемешивают смесь в течение ночи. 35 Нерастворимое вещество собирают и промывают этанолом, что дает гидрохлорид 3-[2-(1 метилпиперидин-4-ил)этил-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридина (2,93 г). Т.пл.: 250 С (50% водн. EtOH)(+)-APCI/MS (m/z): 414 (M1) Элементный анализ для C25H28ClN5O1/10H 2O Вычислено: С 66.46, Н 6.29, N 15.50 Найдено: С 66.18, Н 6.34, N 15.34 Пример 29. К перемешанному раствору 3-[2-(1 метилпиперидин-3-ил)метил)-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а] пиридина (300 мг) в 1,2-дихлорэтане (50 мл) по каплям добавляют 1-хлорэтилхлорформиат (324 мкл). Перемешиваемую реакционную смесь нагревают с обратным холодильником в течение 16 ч. Растворитель выпаривают, полученный остаток растворяют в этилацетате (100 мл) и экстрагируют 100 мл 2N водного раствора хлористоводородной кислоты. Водную фазу отделяют и показатель рН доводят до 12 30% водным раствором гидроксида натрия, поддерживая температуру в интервале от 5 до 15 С. Водную фазу экстрагируют этилацетатом(100 мл). Органическую фазу промывают насыщенным раствором хлорида натрия в воде (100 мл) и сушат над сульфатом магния. Растворитель выпаривают с получением сырого продукта. Сырой продукт растворяют в хлороформе и полученный раствор хроматографируют на силикагеле, элюируя смесью хлороформ:метанол (40:1). Содержащие требуемый продукт фракции собирают, растворитель удаляют в вакууме и полученное сырое вещество перекристаллизовывают из 50% водного этанола, что дает 3-[3 оксо-2-(пиперидин-3-ил)метил-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридин(+)-APCI/MS (m/z): 386 (M1) Элементный анализ для С 23 Н 23N5 О 1/2 Н 2 О Вычислено: С 70.03, Н 6.13, N 17.75 Найдено: С 70.06, Н 5.97, N 17.67 Пример 32. 3-[3-Оксо-2-2S)-пирролидин-2-ил)метил 2,3-дигидропиридазин-6-ил]-2-фенилпиразоло(+)-APCI/MS (m/z): 372 (M1) Элементный анализ для C22H21N5OH2O Вычислено: C 67.85, Н 5.95, N 17.98 Найдено: C 68.21, Н 5.73, N 17.64 Пример 33. К раствору гидроксида натрия (300 мг) в смеси воды (20 мл) и толуола (20 мл) последовательно добавляют 3-(3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридин(1,94 г), хлорид бензилтриэтиламмония (155 мг) и 1-бензилоксикарбонилпиперидин-4-спиро-2' 37 оксиран (5 г) и нагревают смесь с обратным холодильником в течение 5 ч. Реакционную смесь охлаждают и экстрагируют хлороформом (200 мл). Органическую фазу отделяют, последовательно промывают 1N водным раствором гидроксида натрия (20 мл) и насыщенным раствором хлорида натрия в воде и сушат над сульфатом магния. Растворитель выпаривают и полученный остаток хроматографируют на силикагеле (250 мл), элюируя последовательно раствором 20% этилацетата в н-гексане и этилацетатом. Содержащие требуемый продукт фракции собирают, растворитель удаляют при пониженном давлении и полученный сырой продукт перекристаллизовывают из этанола, что дает 3-[2(1-бензилоксикарбонил-4-гидроксипиперидин 4-ил)метил-3-оксо-2,3-дигидропиридазин-6-ил]2-фенилпиразоло[1,5-а]пиридин (2,8 г, выход 79,8%). Т.пл.: 175,5-177,0 С (EtOH)(+)-APCI/MS: 536 (M1) Элементный анализ для С 31H29N5O4 Вычислено: С 69.52, Н 5.46, N 13.08 Найдено: C 69.32, Н 5.40, N 13.01 Пример 34. Смесь 3-[2-(1-бензилоксикарбонил-4 гидроксипиперидин-4-ил)метил-3-оксо-2,3 дигидропиридазин-6-ил]-2-фенилпиразоло(500 мг, 50% влажность) и концентрированной хлористо-водородной кислоты (100 мкл) в N,Nдиметилформамиде (100 мл) перемешивают в атмосфере водорода. Реакционную смесь анализируют посредством тонкослойной хроматографии и, когда результаты этого анализа подтверждают отсутствие в ней исходного вещества, катализатор отфильтровывают и к фильтрату добавляют триэтиламин. Растворитель удаляют при пониженном давлении и полученный остаток хроматографируют на силикагеле (100 мл), элюируя последовательно хлороформом и растворами 9 и 20% метанола в хлороформе. Содержащие требуемый продукт фракции собирают и концентрируют в вакууме, затем полученный сырой продукт перекристаллизовывают из этанола с получением 3-[2-(4 гидроксипиперидин-4-ил)метил-3-оксо-2,3 дигидропиридазин-6-ил]-2-фенилпиразоло(650 мг) и уксусного ангидрида (1,53 мл) в пиридине (30 мл) перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают, полученный остаток растворяют в хлороформе (150 мл) и последовательно промывают 1N водным раствором хлористо-водородной кислоты, насыщенным раствором бикарбоната натрия в воде и насыщенным раствором хлорида натрия в воде и сушат над сульфатом магния. Растворитель выпаривают и полученный сырой продукт перекристаллизовывают из этанола, что дает 3-[2-(1-ацетил-4-гидроксипиперидин-4-ил)метил-3-оксо-2,3-дигидропиридазин-6-ил]-2-фенилпиразоло[1,5-а]пиридин (284 мг, выход 39,6%). Т.пл.: 163,0-165,0 С (EtOH)(+)-APCI/MS (m/z): 444 (М'+1) Элементный анализ для C25H25N5O3 Н 2 О Вычислено: C 65.06, Н 5.90, N 15.17 Найдено: C 65.26, Н 5.80, N 15.15 Пример 36. 3-[2-(2-Метилтиазол-4-ил)метил-3-оксо 2,3-дигидропиридазин-6-ил]-2-фенилпиразоло(+)-APCI/MS (m/z): 400 (M1) Элементный анализ для C22H17N5OS1/4R2 является (C1-C6) алкилом, замещенным ненасыщенной 3-8-членной гетеромоноциклической группой, содержащей 1 или 2 атома серы и 1-3 атома азота, которая может иметь один или несколько (C1-C6) алкильных заместителей; группой формулы[где R3 обозначает водород, (C1-C6) алкил,ар(C1-C6) алкил или ацил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен,m является целым числом, равным 0 или 1,и[где R5 и R6 обозначают (C1-C6) алкил]; или хинуклидинилом, либо его соль. 2. Соединение по п.1, в котором R1 является фенилом и R2 является (C1-C6) алкилом, замещенным тиазолилом, который может иметь 13 (C1-C6) алкилов; группой формулы[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил, (C1-C6) алкоксикарбонил или фенил (C1-C6) алкоксикарбонил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен,m является целым числом, равным 0 или 1,и[где R3 обозначает водород, (C1-C6) алкил, фенил (C1-C6) алкил, (C1-C6) алканоил, (C1-C6) алкоксикарбонил или фенил (C1-C6) алкоксикарбонил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен,m является целым числом, равным 0 или 1,и[где R3 обозначает водород, (C1-C6) алкил, (C1C6) алканоил или фенил (C1-C6) алкоксикарбонил,R4 обозначает водород или гидрокси,А обозначает (C1-C6) алкилен,m является целым числом, равным 1, и 42 где A, m, n и R4 имеют значения, указанные в п.1, и R3a обозначает ацил, или его соль подвергают реакции отщепления ацильной группы, что дает соединение формулы[где R3 обозначает водород или (C1-C6) алкил,R4 обозначает водород,А обозначает (C1-C6) алкилен,m является целым числом, равным 1, иn является целым числом, равным 1 или 2],или его соль. 10. Способ получения соединения пиразолопиридина по п.1 или его соли, включающий взаимодействие соединения формулы где R1 имеет значения, указанные в п.1, или его соли с соединением формулы где R1 и R2 имеют значения, указанные в п.1,или его соли, и, если желательно, соединение формулы (I), которое представляет собой соединение формулы где A, m, n и R4 имеют указанные выше значения, и R3b обозначает водород, или его соль; или соединение формулы (I), которое представляет собой соединение формулы где A, m, n и R4 имеют указанные выше значения, и R3c обозначает (C1-C6) алкил, или его соль подвергают реакции деалкилирования, что дает соединение формулы где R1 и R2c имеют указанные выше значения,или его соль; или соединение формулы (I), которое представляет собой соединение формулы где R1 и R2c имеют указанные выше значения,или его соль подвергают реакции алкилирования, что дает соединение формулы где A, m, n, Rзc и R4 имеют указанные выше значения, или группой формулы где R5 и R6 имеют значения, указанные в п.1,или его соль; или соединение формулы (I), которое представляет собой соединение формулы где R1 и R3 а имеют указанные выше значения,или его соли. 12. Способ получения соединения пиразолопиридина по п.1 или его соли, отличающийся тем, что соединение формулы где R1 и А имеют значения, указанные в п.1, или его соль подвергают реакции образования тиазольного кольца, что дает соединение формулы где R1 и R2c имеют указанные выше значения,или его соль подвергают реакции ацилирования,что дает соединение формулы где R1 и R2b имеют указанные выше значения,или его соль. 11. Способ получения соединения пиразолопиридина по п.1 или его соли, включающий взаимодействие соединения формулы где R1 имеет значения, указанные в п.1, или его соли с соединением формулы где R1 и А имеют указанные выше значения, или его соль. 13. Фармацевтическая композиция, содержащая соединение по п.1 или его соль в сочетании с фармацевтически приемлемыми носителями или наполнителями. 14. Способ лечения болезней или профилактики болезней, в отношении которых эффективно действует антагонист аденозина, путем введения пациенту эффективного количества соединения по п.1 или его соли. 15. Применение соединения по п.1 или его соли в качестве лекарственного средства. 16. Применение соединения по п.1 или его соли в качестве антагониста аденозина. 17. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 или его соли с фармацевтически приемлемыми носителями или наполнителями. 18. Применение соединения по п.1 или его соли для получения фармацевтической композиции, предназначенной для лечения болезней, в отношении которых эффективно действует антагонист аденозина.
МПК / Метки
МПК: A61K 31/501, C07D 471/04
Метки: применение, производные, фармацевтического, препарата, качестве, пиразолопиридина
Код ссылки
<a href="https://eas.patents.su/23-1899-proizvodnye-pirazolopiridina-i-ih-primenenie-v-kachestve-farmacevticheskogo-preparata.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразолопиридина и их применение в качестве фармацевтического препарата</a>
Предыдущий патент: Быстроразлагаемая внутрибуккально таблетка
Следующий патент: Теплообменный аппарат и способ его использования
Случайный патент: Ветродвигатель многороторный и способ его работы