3-индазолил-4-пиридилизотиазолы
Номер патента: 18001
Опубликовано: 30.04.2013
Авторы: Файвуш Адам Майкл, Делэнже Вероник, Бриттон Томас Чарльз, Холлиншед Шон Патрик, Вокитс Бенджамин Пол
Формула / Реферат
1. Соединение следующей формулы или фармацевтически приемлемая соль указанного соединения
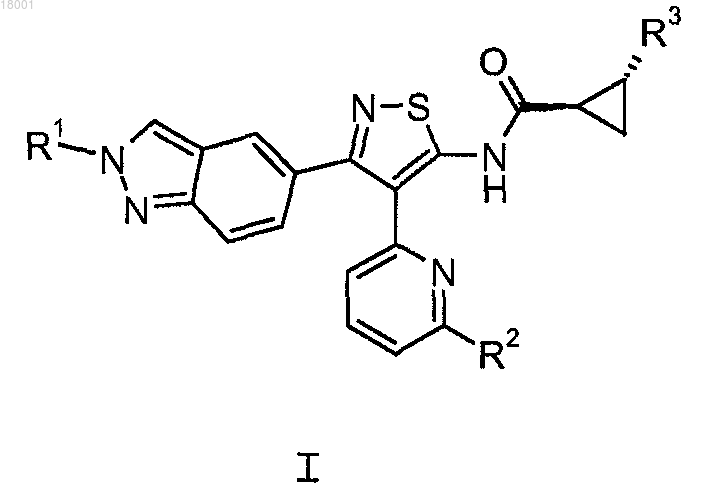
где R1 представляет собой Н или C1-С3-алкил;
R2 представляет собой Н, С1-С3-алкил, С3-С5-циклоалкил, C1-С3-фторалкил, NR4R5, C1-С3-алкокси или C1-С3-алкоксиметил;
R3 представляет собой Н или метил и
R4 и R5 независимо представляют собой Н или C1-С3-алкил.
2. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где
R1 представляет собой C1-С3-алкил;
R2 представляет собой C1-С3-алкил, С3-С5-циклоалкил или C1-С3-фторалкил и
R3 представляет собой метил.
3. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где
R1 представляет собой C1-С3-алкил;
R2 представляет собой C1-С3-алкил и
R3 представляет собой метил.
4. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где R1 представляет собой C1-С3-алкил.
5. Соединение по п.1 или 4 или фармацевтически приемлемая соль указанного соединения, где R2 представляет собой C1-С3-алкил.
6. Соединение по пп.1, 4 или 5 или фармацевтически приемлемая соль указанного соединения, где R3 представляет собой метил.
7. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где
R1 представляет собой Н, метил или этил;
R2 представляет собой Н, метил, этил, пропил, изопропил, циклопропил, циклобутил, циклопентил, фторметил, дифторметил, 1-фтор-1-метилэтил, метиламино, диметиламино, метокси или метоксиметил;
R3 представляет собой Н или метил.
8. Соединение по любому из пп.1-7, представляющее собой [4-(6-этилпиридин-2-ил)-3-(2-метил-2Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
9. Соединение по любому из пп.1-7, представляющее собой [4-(6-изопропилпиридин-2-ил)-3-(2-метил-2Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
10. Соединение по п.9, представляющее собой [4-(6-изопропилпиридин-2-ил)-3-(2-метил-2Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты.
11. Фармацевтическая композиция, обладающая активностью селективного антагониста mGluR5, содержащая соединение по любому из пп.1-10 или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель, разбавитель или наполнитель.
12. Применение соединения по любому из пп.1-10 или фармацевтически приемлемой соли указанного соединения в качестве лекарственного средства для лечения тревожности.
13. Применение соединения по любому из пп.1-10 или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства для лечения тревожности.
Текст
В настоящем изобретении предложены 3-индазоил-4-пиридилизотиазолы указанной ниже формулы или фармацевтически приемлемые соли указанных соединений, представляющие собой селективные антагонисты рецептора mGluR5, фармацевтические композиции на основе указанных соединений, способы их применения для лечения тревожности. Бриттон Томас Чарльз (US), Делэнже Вероник (GB), Файвуш Адам Майкл,Холлиншед Шон Патрик, Вокитс Бенджамин Пол (US) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) В настоящем изобретении предложены некоторые 3-индазоил-4-пиридилизотиазолы, в частности некоторые N-ацилированные производные 5-амино-3-индазоил-4-пиридилизотиазола, фармацевтические композиции на их основе, способы их применения, способы их получения и соответствующие промежуточные соединения.L-глутамат представляет собой основной возбуждающий нейротрансмиттер центральной нервной системы, называемый также возбуждающей аминокислотой. Глутаматные рецепторы включают два основных подтипа: ионотропные рецепторы, связанные с лигандзависимыми ионными каналами, и сопряженные с G-белком метаботропные рецепторы, состоящие из семи трансмембранных доменов (mGluR). Семейство метаботропных рецепторов включает восемь членов и подразделяется на три группы на основании сходства последовательностей, типа передачи сигнала и фармакологических свойств. Рецепторы группы I (mGluR1 и mGluR5 и их сплайс-варианты) положительно связаны с гидролизом инозитолфосфата и выработкой внутриклеточного кальциевого сигнала. Рецепторы группы II (mGluR2 и mGluR3) и рецепторы группы III (mGluR4, mGluR6, mGluR7 и mGluR8) отрицательно связаны с аденилатциклазой и регулируют уровни циклического аденозинмонофосфата путем непрямого ингибирования активности аденилатциклазы. Подтипы рецептора mGlu имеют уникальный характер экспрессии в центральной нервной системе, который может являться объектом для направленного воздействия с помощью новых и селективных агентов. См., например, работу Slassi, A. et al., Current Topics in Medicinal Chemistry (2005),5, 897-911, в которой описано применение антагонистов mGluR5 в качестве анксиолитических агентов в моделях заболеваний, связанных со стрессом, на животных. Кроме того, было показано, что антагонистыmGluR5 можно применять в моделях зависимости от психоактивных средств и синдрома отмены, включая употребление алкоголя, а также в моделях боли воспалительной и невропатической природы. Соединения согласно настоящему изобретению представляют собой селективные антагонисты метаботропных рецепторов группы I, в частности рецептора mGluR5 (mGluR5), в особенности по отношению к mGluR2, mGluR3 и mGluR4; указанные соединения также могут быть селективны по отношению кmGluR1. Полагают, что указанные соединения как таковые подходят для лечения состояний, связанных с этими метаботропными глутаматными рецепторами, например тревожности, включая генерализованное тревожное расстройство, депрессии, включая большое депрессивное расстройство, а также тревожности,сопровождаемой депрессией (тревожно-депрессивное расстройство смешанного типа), включая генерализованное тревожное расстройство, сопровождаемое большим депрессивным расстройством. Таким образом, в настоящем изобретении предложены новые соединения, которые представляют собой антагонисты mGluR5 и которые, как полагают, как таковые можно применять для лечения нарушений, указанных выше. Такие новые соединения могут удовлетворять потребность в безопасных и эффективных лекарственных средствах для лечения состояний, связанных с указанными выше рецепторами, не вызывая побочных эффектов. В настоящем изобретении предложено соединение формулы I или фармацевтически приемлемая соль указанного соединенияR4 и R5 независимо представляют собой Н или C1-С 3-алкил. Также в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы I или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель, разбавитель или наполнитель. Также в настоящем изобретении предложено соединение формулы I или фармацевтически приемлемая соль указанного соединения для терапевтического применения. Также в настоящем изобретении предложено применение соединения формулы I или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства для лечения тревожности. Также в настоящем изобретении предложен способ лечения тревожности, включающий введение пациенту, который в этом нуждается, эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения. Также в настоящем изобретении предложено соединение формулы I или фармацевтически приемлемая соль указанного соединения для применения для лечения тревожности. Термин C1-С 3-фторалкил" означает линейную или разветвленную алкильную цепь, содержащую от одного до трех атомов углерода, замещенную атомами фтора в количестве от одного до трех, и включает фторметил, дифторметил и 1-фтор-1-метилэтил. Конкретное соединение формулы I представляет собой соединение, в котором R1 представляет собой C1-С 3-алкил. Конкретное соединение формулы I представляет собой соединение, в котором R2 представляет собой C1-С 3-алкил. Конкретное соединение формулы I представляет собой соединение, в котором R1 представляет собой C1-С 3-алкил; R2 представляет собой C1-С 3-алкил, С 3-С 5-циклоалкил или C1-С 3-фторалкил и R3 представляет собой метил. Конкретное соединение формулы I представляет собой соединение, в котором R1 представляет собой C1-С 3-алкил; R2 представляет собой C1-С 3-алкил и R3 представляет собой метил. Конкретное соединение формулы I представляет собой соединение, в котором R1 представляет собой Н, метил или этил; R2 представляет собой Н, метил, этил, пропил, изопропил, циклопропил, циклобутил, циклопентил, фторметил, дифторметил, 1-фтор-1-метилэтил, метиламино, диметиламино, метокси или метоксиметил и R3 представляет собой Н или метил. Более конкретное соединение формулы I представляет собой соединение, в котором R1 представляет собой метил. Более конкретное соединение формулы I представляет собой соединение, в котором R2 представляет собой этил. Более конкретное соединение формулы I представляет собой соединение, в котором R2 представляет собой изопропил. Более конкретное соединение формулы I представляет собой соединение, в котором R3 представляет собой метил. Предпочтительное соединение формулы I представляет собой [4-(6-этилпиридин-2-ил)-3-(2-метил 2 Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты или фармацевтически приемлемую соль указанного соединения. Предпочтительное соединение формулы I представляет собой гидрохлорид [4-(6-этилпиридин-2 ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты. Более предпочтительное соединение формулы I представляет собой [4-(6-изопропилпиридин-2-ил)3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты или фармацевтически приемлемую соль указанного соединения. Еще более предпочтительное соединение формулы I представляет собой [4-(6-изопропилпиридин-2 ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты. Другой вариант реализации настоящего изобретения включает способ получения соединения формулы I или фармацевтически приемлемой соли указанного соединения, включающий: А) для соединения формулы I где R1 представляет собой C1-С 3-алкил,реакцию сочетания соединения формулы II или В) для соединения формулы I где Р представляет собой трет-бутилоксикарбонил; при этом в случае, если требуется получение фармацевтически приемлемой соли соединения формулы I,ее получают по реакции основного соединения формулы I с физиологически приемлемой кислотой или с помощью любого другого традиционного метода. В другом варианте реализации настоящего изобретения предложены промежуточные соединения,подходящие для получения соединения формулы I. Более конкретно, в настоящем изобретении предложено соединение формулы IIR3 представляет собой Н или метил. Конкретное соединение формулы II представляет собой соединение, в котором R1 представляет собой метил. Конкретное соединение формулы II представляет собой соединение, в котором R3 представляет собой метил. Предпочтительное соединение формулы II представляет собой [4-бром-3-(2-метил-2 Н-индазол-5 ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты. Следует понимать, что соединения согласно настоящему изобретению могут существовать в виде стереоизомеров. В то время как настоящее изобретение включает все энантиомеры, диастереомеры и их смеси, предпочтительные варианты реализации представляют собой индивидуальные диастереомеры, а более предпочтительные варианты реализации представляют собой индивидуальные энантиомеры. Следует понимать, что в соединениях согласно настоящему изобретению, где R3 представляет собой Н,амидная группа циклопропанкарбоновой кислоты, присоединенная по положению 5 изотиазола, является ахиральной. Конкретный энантиомер соединений согласно настоящему изобретению представляет собой соединение, в котором группа, присоединенная по положению 5 изотиазола, представляет собой амид (1R,2R)2-метилциклопропанкарбоновой кислоты. Следует понимать, что соединения согласно настоящему изобретению могут существовать в виде таутомерных форм. Если существуют таутомерные формы, то каждая из форм, а также их смеси находятся в рамках настоящего изобретения. Например, если группа R1 представляет собой водород, то соединение формулы I может существовать в таутомерных формах I и II. В этом случае следует понимать,что любое упоминание соединения формулы I, в котором группа R1 представляет собой водород, как таутомерной формы I включает таутомерную форму II, а также смеси форм I и II. Термин "фармацевтически приемлемая соль" включает соли присоединения кислот, которые существуют в ассоциации с той частью соединения формулы I, которая представляет собой основание. Такие соли включают фармацевтически приемлемые соли, перечисленные в руководстве Handbook of Pharmaceutical Salts: PROPERTIES, Selection and Use, P.H. Stahl and С.G. Wermuth (Eds.), Wiley-VCH, New York,2002, которые известны специалистам в данной области техники. Кроме фармацевтически приемлемых солей изобретение включает и другие соли. Они могут выступать в качестве промежуточных соединений в ходе очистки соединений или получения других фармацевтически приемлемых солей или подходить для целей идентификации, характеризации или очистки. Полагают, что соединение согласно изобретению можно применять в тех случаях, когда необходим антагонизм к рецептору rnGluR5. В частности, полагают, что соединение согласно изобретению можно применять для лечения тревожности, включая генерализованное тревожное расстройство, депрессии,включая большое депрессивное расстройство, а также тревожности, сопровождаемой депрессией (смешанного тревожно-депрессивного расстройства). Соответственно один из конкретных аспектов изобретения относится к лечению смешанного тревожно-депрессивного расстройства, включая генерализованное тревожное расстройство, сопровождаемое большим депрессивным расстройством. В настоящем описании термин "пациент" означает теплокровное животное, например млекопитающее, и включает человека. Также представляется очевидным, что специалист в данной области техники может воздействовать на тревожное расстройство путем лечения пациента, у которого в настоящее время наблюдаются симптомы, с применением эффективного количества соединения формулы I. Таким образом, термины "лечение" и "лечить" включают все способы, при которых возможно замедление, прерывание, купирование,контролирование или остановка прогрессирования нарушения и/или его симптомов, но не обязательно означают полное устранение всех симптомов. Также представляется очевидным, что специалист в данной области техники может воздействовать на тревожное расстройство путем лечения пациента, для которого существует риск развития симптомов в будущем, с применением эффективного количества соединения формулы I, при этом настоящее изобретение также включает профилактическое лечение такого нарушения. В настоящем описании термин "эффективное количество" соединения формулы I означает количество, т.е. дозировку, которая эффективна для лечения тревожного расстройства, указанного в настоящем описании. Лечащий врач-диагност, как специалист в данной области техники, может легко определить эффективное количество с помощью традиционных методик и анализа результатов, полученных при аналогичных обстоятельствах. При определении эффективного количества, т.е. дозы соединения формулы I, лечащий врач-диагност должен учитывать ряд факторов, неограничивающие примеры которых включают вводимое соединение формулы I; совместное введение других средств, если таковые применяют; вид млекопитающего; его размер, возраст и общее состояние здоровья; степень вовлеченности в патологический процесс или тяжесть тревожного состояния; ответную реакцию конкретного пациента; способ введения; характеристики биодоступности вводимого препарата; выбранный режим дозирования; применение других сопутствующих лекарственных средств и другие имеющие значение обстоятельства. Предположительно, эффективное количество соединения формулы I варьируется от примерно 0,01 мг на 1 кг массы тела в сутки (мг/кг/сутки) до примерно 5 мг/кг/сутки. Предпочтительные количества могут быть определены специалистом в данной области техники. Соединения согласно настоящему изобретению могут быть введены в отдельности или в виде фармацевтической композиции, т.е. в сочетании с фармацевтически приемлемыми носителями или наполнителями, соотношение и природа которых определяются растворимостью и химическими свойствами,включая стабильность выбранного соединения, выбранным способом введения и принятой фармацевтической практикой. Для более легкого протекания кристаллизации, повышения растворимости и т.д. соединения согласно настоящему изобретению, несмотря на их собственную эффективность, могут быть приготовлены и введены в виде их фармацевтически приемлемых солей. Таким образом, в настоящем изобретении предложены фармацевтические композиции, содержащие соединение формулы I и фармацевтически приемлемый носитель, разбавитель или наполнитель. Специалист в области приготовления составов без труда сможет выбрать нужную форму и способ введения в зависимости от конкретных характеристик выбранного соединения, нарушения или состояния, подвергаемого лечению, стадии указанного нарушения или состояния и других имеющих значение обстоятельств (Remington: The Science and Practice of Pharmacy, 19-th Edition, Mack Publishing Co. (1995. Пример А. Функциональная активность in vitro по отношению к рецепторам человека mGluR5 и mGluR1. Активация рецепторов, сопряженных с G-белком (GPCR), которые связаны с GTP-связывающим белком альфа q (Gq белки), приводит к изменению внутриклеточной концентрации кальция. Такая функциональная ответная реакция может быть определена количественно в ходе кинетического исследования с применением красителей, чувствительных к кальцию, с помощью флуоресцентного считывателя планшетов в соответствии со стандартной методикой, известной как FLIPR (MDS Analytical Technologies,Sunnyvale, СА). Методики получения и исследования стабильных клеточных линий были заимствованы из публикации Kingston, A.E., et al. (1995), Neuropharmacology 34: 887-894. В общих чертах, клональные клеточные линии, экспрессирующие рекомбинантные рецепторы человека mGluR5a и mGluR1, были трансфицированы в клетки AV-12 (American Type Culture Collection,Manassas, VA), содержащие транспортер глутамата ЕААТ 1 крысы. Клетки выращивали в модифицированной по Иглу среде Дульбекко с добавлением 5% эмбриональный бычьей сыворотки, 1 мМ Lглютамина, 1 мМ пирувата натрия, 10 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты), 0,75 мг/мл генетицина и 0,3 мг/мл гигромицина В в инкубаторе при 37 С и 95% относительной влажности и 5% СО 2. Сливающиеся культуры пересевали раз в две недели. Для проведения функционального анализа клетки высевали в питательную среду, не содержащую селективных антибиотиков, в 96-луночные микропланшеты с черным/прозрачным дном, покрытые полиD-лизином, при плотности 65 К на лунку и инкубировали в течение 18-20 ч до начала эксперимента. После удаления среды клетки обрабатывали 8 мкМ красителя Fluo-3 в буфере для анализа, содержащем сбалансированный солевой раствор Хенкса с добавлением 20 мМ HEPES, и выдерживали 1,5 ч при 25 С. Соединения серийно разбавляли ДМСО и затем один раз разбавляли буфером, применяемым для анализа; конечная концентрация в ДМСО в данном исследовании составляла 0,625%. Для оценки количества агониста, необходимого для получения ответной реакции ЕС 90, перед каждым экспериментом проводили анализ FLIPR с однократным добавлением, в ходе которого для глутамата-агониста получали кривую доза-ответ по 11 точкам. Антагонистическое действие соединений количественно оценивали при помощиFLIPR-прибора по кривым дозовой зависимости, содержащим по 10 точек, сравнивая пики флуоресцентной ответной реакции на глутамат-агонист в присутствии и в отсутствие соединения. В частности, действие соединения определяли как разность между максимальной и минимальной высотами пиков, выраженных в относительных единицах флуоресценции, нормированных по базовому значению флуоресценции, полученному в отсутствие глутамата. Значения активности в отношении рецепторов человекаmGluR5 и mGluR1 вычисляли в виде относительных значений IC50 при помощи четырехпараметрической программы построения логистических кривых (ActivityBase V5.3.1.22). В приведенном выше исследовании значения IC50, полученные для соединений, примеры которых приведены в настоящем описании, составляли менее 75 нМ для mGluR5. Например, IC50 для соединения согласно примеру 2, измеренное по отношению к mGluR5, составляло 9,5 нМ. Это показывает, что соединения согласно настоящему изобретению представляют собой высокоактивные антагонисты mGluR5. Пример В. Снижение обусловленной стрессом гипертермии у крыс. Гипертермия, т.е. повышение внутренней температуры тела, представляет собой общее явление, которое, как было убедительно показано для множества млекопитающих, включая человека, развивается в ответ на стресс. Многие тревожные расстройства сопровождаются гипертермией, которая возникает как часть патологического процесса и считается симптомом заболевания. Полагают, что соединения, снижающие обусловленную стрессом гипертермию у животных, можно применять для лечения тревожных расстройств у человека. Традиционный и требующий минимального вмешательства способ анализа обусловленной стрессом гипертермии состоит в измерении температуры тела и ее повышения, вызванного стрессом, при помощи ректального термометра. Опыты проводили на самцах крыс породы Fischer F-344 (Harlan, Indianapolis, IN, USA) массой 275-350 г. Всех животных содержали по одному с автоматической подачей воды и свободным доступом к пище и воде при 12-часовом световом дне (свет включали в 06:00). Животных не кормили примерно в течение 12-18 ч до начала эксперимента, который проводили во время дневной фазы цикла. Крысам перорально вводили объем, равный 1 мл/кг, содержащий испытуемые соединения в дозировках 0,3, 1, 3 и 10 мг/кг (суспендированные в 1% карбоксиметилцеллюлозе с добавлением 0,25% полисорбата 80 и 0,05% антивспенивателя). В качестве положительного контроля применяли антагонистmGluR5 MTEP (3-[(2-метил-1,3-тиазол-4-ил)этинил]пиридин), который проявлял устойчивую анксиолитически подобную активность в преклинических исследованиях (10 мг/кг, перорально, растворенный в воде). Сразу после введения доз крыс возвращали в свои клетки, и экспериментатор выключал свет и выходил из комнаты. Комната, в которой происходило введение доз, оставалась затемненной в течение оставшегося времени от 60-минутного периода предварительной обработки. После проведения предварительной обработки крыс на короткое время выносили поодиночке в яр-5 018001 ко освещенную соседнюю комнату, в которой измеряли базовую температуру тела введением ректального зонда, смазанного минеральным маслом. Температуру тела измеряли с помощью микротермометраPHYSITEMP ВАТ-12, снабженного ректальным зондом для крыс PHYSITEMP RET-2 (Physitemp Instruments Inc., Clifton, NJ, USA). Зонд вводили примерно на 2 см в задний проход, измеряя внутреннюю температуру тела (это базовая температура тела, Т 1, в градусах Цельсия). Спустя 10 мин измеряли вторую температуру тела (Т 2). Разность температур тела (Т 2-Т 1) представляла собой обусловленную стрессом гипертермическую ответную реакцию. Доза, при которой соединение вызывало 35% снижение обусловленной стрессом гипертермической ответной реакции по сравнению с реакцией при введении носителя, была обозначена как доза Т 35. В приведенном выше исследовании соединение согласно примеру 2 вызывало снижение обусловленной стрессом гипертермии при дозе Т 35=3,0 мг/кг. Это показывает, что соединения согласно настоящему изобретению подходят для лечения тревожности in vivo. Соединение формулы I может быть получено по способам, включающим способы, известные в области химии в качестве подходящих для получения структурно аналогичных соединений, или в соответствии с новым способом, приведенным в настоящем описании. Новый способ, приведенный в настоящем описании, представляет собой еще один аспект настоящего изобретения. Способ получения соединения формулы I или фармацевтически приемлемой соли указанного соединения и новых промежуточных соединений для получения соединения формулы I обеспечивает дополнительные признаки настоящего изобретения и проиллюстрирован приведенными ниже методиками, в которых значения родовых радикалов являются такими, как определено выше, если не указано иное. В общем случае соединение формулы I может быть получено из соединения формулы III (схема 1). Более конкретно, соединение формулы II, где R1 представляет собой C1-С 3-алкил, подвергают реакции сочетания с 2-Q'-пиридилом, где Q' представляет собой группу, подходящую для реакции сочетания, в присутствии катализатора реакции сочетания, с получением соединения формулы I, где R1 представляет собой C1-С 3-алкил. Пригодность группы Q' для реакции сочетания определяется используемыми условиями проведения реакции. Для реакций, проводимых с применением условий реакции Сузуки, значенияQ' включают производные бороновой кислоты и ее сложных эфиров, в то время как при применении условий реакции Стилла значения Q' включают производные триалкилстаннанила. Другие реакции сочетания включают реакции с использованием условий реакции Негиши, в которых значения Q' включают галогениды цинка, например бромид цинка. Катализаторы реакции сочетания включают соединения переходных металлов, например производные палладия. Соединение формулы II может быть получено из соединения формулы III. Более конкретно, соединение формулы III подвергают реакции сочетания с 5-Q-индазолилом, где R1 представляет собой C1-С 3 алкил, a Q представляет собой группу, подходящую для реакции сочетания, в присутствии катализатора реакции сочетания, с получением соединения формулы II, где R1 представляет собой C1-С 3-алкил. Пригодность группы Q для реакции сочетания определяется используемыми условиями проведения реакции. Для реакций, проводимых с применением условий реакции Сузуки, значения Q" включают производные бороновой кислоты и ее эфиров, в то время как при применении условий реакции Стилла значения Q" включают производные триалкилстаннанила. Катализаторы реакции сочетания включают соединения переходных металлов, например производные палладия. Схема 1 В общем случае соединение формулы I, где R1 представляет собой Н, может быть получено из со-6 018001 единения формулы III (схема 2). Более конкретно, соединение формулы IV, где Р представляет собой подходящую защитную группу для амина, например трет-бутилоксикарбонил, вводят в реакцию с кислотой, например соляной кислотой, с получением соединения формулы I, где R1 представляет собой Н. Соединение формулы IV, где Р представляет собой защитную группу для амина, может быть получено из соединения формулы V. Более конкретно, соединение формулы V подвергают реакции сочетания с 2-Q'пиридилом, где Q' представляет собой группу, подходящую для реакции сочетания, в присутствии катализатора реакции сочетания с получением соединения формулы IV, где Р представляет собой защитную группу для амина. Пригодность группы Q' для реакции сочетания определяется используемыми условиями проведения реакции. Для реакций, проводимых с применением условий реакции Сузуки, значенияQ' включают производные бороновой кислоты и ее эфиров, в то время как при применении условий реакции Стилла значения Q' включают производные триалкилстаннанила. Катализаторы реакции сочетания включают соединения переходных металлов, например производные палладия. Соединение формулы V может быть получено по реакции сочетания соединения формулы III с 5-Q-индазолилом, где Р представляет собой защитную группу для амина, a Q представляет собой группу, подходящую для реакции сочетания, в присутствии катализатора реакции сочетания с получением соединения формулы V, где Р представляет собой защитную группу для амина. Пригодность группы Q для реакции сочетания определяется используемыми условиями проведения реакции. Для реакций, проводимых с применением условий реакции Сузуки, значения Q" включают производные бороновой кислоты и ее эфиров, в то время как при применении условий реакции Стилла значения Q" включают производные триалкилстаннанила. Катализаторы реакции сочетания включают соединения переходных металлов, например производные палладия. Схема 2 В следующих иллюстративных примерах получения и примерах используют следующие значения и аббревиатуры: ДМСО, диметилсульфоксид (полностью дейтерированный [-d6] в случае применения для ЯМР); МС, масс-спектр; EtOAc, этилацетат; ТГФ, тетрагидрофуран; мин, минуты; ВЭЖХ, высокоэффективная жидкостная хроматография; ЖХ-МС, ВЭЖХ-масс-спектрография; ГХ, газовая хроматография; МеОН, метанол; МТВЕ, метил-трет-бутиловый эфир; SCX-2, катионообменная смола; т.пл., температура плавления; и ЯМР, ядерная магнитно-резонансная спектроскопия или спектр. Реагенты были получены из ряда коммерческих источников. Растворители в общем случае удаляли под разрежением (выпаривали). В некоторых примерах получения указанные выходы представляют собой репрезентативные значения выхода для неочищенных продуктов, выделенных испарением или фильтрованием и используемых непосредственно без дополнительной очистки. Пример получения 1. Синтез 5-бром-2-метил-2 Н-индазола. К смеси 5-бром-1 Н-индазола (199,6 г, 1,01 моль) в этилацетате (3,04 л, 31,06 моль) при комнатной температуре в атмосфере азота добавляют порциями тетрафторборат триметилоксония (229,34 г,1,52 моль), перемешивают 2,5 ч и отфильтровывают, получая белое твердое вещество. Полученное твердое вещество дважды промывают этилацетатом (500 мл) и затем добавляют его порциями к охлажденному водному раствору 2 М гидроксида натрия (3,80 л, 7,60 моль) на ледяной бане. Смесь перемешивают в течение 1 ч, подвергают действию ультразвука в течение 15 мин, отфильтровывают и полученное твердое вещество дважды промывают водой (200 мл). Твердое вещество сушат в течение ночи в вакууме,суспендируют в дихлорметане (1 л) и отфильтровывают. Фильтрат концентрируют и очищают хромато-7 018001 графией на силикагеле, элюируя дихлорметаном, с получением указанного в заглавии соединения в виде желтого твердого вещества (149,77 г, 70%). МС (m/z): 211, 213 (М+1). Следующее соединение было получено, по существу, в соответствии с примером получения 1. Пример получения 3. Синтез 2-метил-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2 Н-индазола. Ацетат калия (207,16 г, 2,11 моль) добавляют одной порцией к перемешиваемому раствору 5-бром 2-метил-2 Н-индазола (148,5 г, 0,703 моль) и бис-(пинаколято)дибора (196,54 г, 0,77 моль) в 1,4-диоксане(1,62 л). Через суспензию в течение 20 мин барботируют азот, добавляют одной порцией хлорид (1,1'бис-(дифенилфосфино)ферроцен)палладия(II) в дихлорметане (17,24 г, 21,11 ммоль) и нагревают при 100 С в течение 1,5 ч. Охлаждают, отфильтровывают через целит (Celite), применяя этилацетат (1 л), и концентрируют. Остаток очищают хроматографией на силикагеле, элюируя с градиентом от 50:50 до 20:80 смеси н-гексан:метил-трет-бутиловый эфир, получая указанное в заглавии соединение в виде желтого твердого вещества (124,79 г, 64%), которое используют без дополнительной очистки. Фракции, содержащие примеси, концентрируют и выделенное твердое вещество растирают с н-гептаном, получая дополнительные количества указанного в заглавии соединения в виде белого твердого вещества (32,36 г,12%). 1 Н ЯМР (ДМСО-d6):1,30 (с, 12 Н), 4,17 (с, 3 Н), 7,43 (дд, 1 Н), 7,53 (дд, 1 Н), 8,14 (т, 1 Н), 8,39 (с,1 Н). Пример получения 4. Синтез 2-метил-5-триметилстаннанил-2 Н-индазола. Тетракис-(трифенилфосфин)палладий (0,26 г, 0,22 ммоль) добавляют к смеси 5-бром-2-метил-2 Ниндазола (0,94 г, 4,43 ммоль) и гексаметилдиолова (1,02 мл, 4,88 ммоль) в 1,4-диоксане (5 мл). Смесь продувают азотом и нагревают в микроволновой печи при 110 С в течение 15 мин. Еще две партии готовят аналогично соответственно из тетракис-(трифенилфосфин)палладия (0,29 г, 0,25 ммоль), 5-бром-2 метил-2 Н-индазола (1,07 г, 5,07 ммоль), гексаметилдиолова (1,16 мл, 5,58 ммоль) в 1,4-диоксане (5 мл) и тетракис-(трифенилфосфин)палладия (0,25 г, 0,22 ммоль), 5-бром-2-метил-2 Н-индазола (0,92 г,4,36 ммоль), гексаметилдиолова (1,00 мл, 4,80 ммоль) в 1,4-диоксане (5 мл). Эти три партии объединяют и очищают хроматографией на силикагеле, элюируя с градиентом от 15:85 до 80:20 смесью этилацетат:изогексан, а затем очищают повторно хроматографией на силикагеле, элюируя с градиентом от 15:85 до 30:70 смесью этилацетат:изогексан, получая указанное в заглавии соединение в виде масла, которое кристаллизуется при стоянии (1,68 г, 41%). МС (m/z): 293-301 кластер (М+1). Следующее соединение было получено, по существу, в соответствии с примером получения 4. Пример получения 6. Синтез трет-бутилового эфира 5-бром-индазол-1-карбоновой кислоты. К раствору 5-бром-1 Н-индазола (10 г, 50,75 ммоль) в ацетонитриле (170 мл) последовательно добавляют триэтиламин (7,1 мл, 50,75 ммоль), ди-трет-бутилдикарбонат (17,12 г, 76,13 ммоль) и диметиламинопиридин (0,62 г, 5,08 ммоль) и перемешивают 3 ч. Концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 10:90 до 20:80 смесью этилацетат:гексаны, получая указанное в заглавии соединение (14,93 г, 99%). МС (m/z): 243 (M+1-tBu). Пример получения 7. Синтез трет-бутилового эфира 5-триметилстаннанилиндазол-1-карбоновой кислоты. трет-Бутиловый эфир 5-броминдазол-1-карбоновой кислоты (6,5 г, 21,87 ммоль) растворяют в толуоле (43,7 мл) и в атмосфере азота добавляют гексаметилдиолово (10 г, 30,6 ммоль). Добавляют тетракис-(трифенилфосфин)палладий (1,26 г, 1,09 ммоль), нагревают при 80 С в течение 18 ч, концентрируют и очищают остаток хроматографией на силикагеле, элюируя с градиентом от 10:90 до 20:80 смесью этилацетат:гексаны, получая указанное в заглавии соединение (9,33 г, 94%). МС (m/z): 327 (M+1-tBu). Пример получения 8. Синтез 2-циано-3-оксотиобутирамида. К перемешиваемому раствору 2-цианотиоацетамида (1016 г, 9,84 моль) в пиридине (2,60 л), охлажденному до 0 С, добавляют в течение 2 ч ацетилхлорид (785 мл, 11,03 моль), поддерживая температуру реакции ниже 20 С. Нагревают до комнатной температуры в течение 1 ч, добавляют воду (4 л) и перемешивают до полного растворения всех твердых веществ. Добавляют водный 12 М раствор соляной кислоты (HCl, 250 мл) до кислой реакции среды (рН 1) с получением красно-коричневого осадка. Перемешивают в течение 1 ч при 0 С, отфильтровывают, сушат собранное твердое вещество в вакууме, получая указанное в заглавии соединение в виде оранжевого твердого вещества (926 г, 66%). Вторая порция продукта может быть получена из маточного раствора при добавлении 12 М водного раствора HCl (500 мл),приводящем к получению указанного в заглавии соединения (353 г, 25%). Пример получения 9. Синтез 1-(5-амино-3-бромизотиазол-4-ил)этанона. Бром (195 мл, 3,81 моль) добавляют в течение 10 мин к нагреваемому раствору 2-циано-3 оксотиобутирамида (550 г, 3,86 моль) в ледяной уксусной кислоте (5,80 л) при 40 С и перемешивают при комнатной температуре в течение 15 ч. Реакционную смесь отфильтровывают, промывают собранное твердое вещество водой и сушат в течение ночи в вакууме, получая темно-красное твердое вещество(1151 г). Полученное твердое вещество суспендируют при перемешивании в насыщенном водном растворе бикарбоната натрия (8 л) в течение 30 мин и отфильтровывают. Собранное твердое вещество промывают водой и сушат в течение ночи в вакууме, получая темно-красное твердое вещество (1022 г). Твердое вещество суспендируют при перемешивании с метил-трет-бутиловым эфиром (5,90 л) в течение 1 ч, отфильтровывают и оставляют фильтрат. Вышеописанную экстракцию полученного твердого вещества метил-трет-бутиловым эфиром повторяют дважды, оставляя фильтрат после каждой экстракции. Фильтраты объединяют и концентрируют, получая указанное в заглавии соединение в виде желтого твердого вещества, которое используют без дополнительной очистки (598 г, 72%). МС (m/z): 221, 223 (М+1). Пример получения 10. Синтез (1R,2R)-2-метилциклопропанкарбоновой кислоты(1R,2R)-2-метилциклопропанкарбоновой кислоты, (1,65 кг, 5,86 моль), полученной как описано в OrganicProcess ResearchDevelopment (2007) 11, 689-692, в воде (6,60 л) и энергично перемешивают в течение 5 мин, получая двухфазный раствор. К нему по каплям в течение 10 мин добавляют серную кислоту(200 мл), энергично перемешивают в течение 15 мин и слои разделяют. Водную фазу экстрагируют метил-трет-бутиловым эфиром. Органические фазы объединяют, сушат над сульфатом магния, отфильтровывают и концентрируют, получая указанное в заглавии соединение в виде бледно-желтого масла (560 г,95%), которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):0,77-0,73 (м, 1 Н), 1,12 (д, 3 Н), 1,25-1,21 (м, 1 Н), 1,34-1,30 (м, 1 Н), 1,49-1,43 (м,1 Н). Пример получения 11. Синтез (1R,2R)-2-метилциклопропанкарбонилхлорида. Оксалилхлорид (490,23 мл, 5,54 моль) добавляют по каплям в течение 20 мин к охлажденному раствору (1R,2R)-2-метилциклопропанкарбоновой кислоты (560 г, 5,59 моль) в дихлорметане (2,80 л) и диметилформамиде (2,16 мл, 28,0 ммоль) при 0 С. Нагревают до комнатной температуры в течение 30 мин,нагревают при 40 С в течение 30 мин и охлаждают до комнатной температуры, получая бледнооранжевый раствор, который используют непосредственно на следующем этапе синтеза. Пример получения 12. Синтез (4-ацетил-3-бромизотиазол-5-ил)амида (1R,2R)-2-метилциклопропанкарбоновой кислоты. Свежеприготовленный 1,93 М раствор (1R, 2R)-2-метилциклопропанкарбонилхлорида (5,52 моль) в дихлорметане добавляют при комнатной температуре в течение 15 мин к суспензии 1-(5-амино-3 бромизотиазол-4-ил)этанона (1,17 кг, 4,93 моль) и триэтиламина (859 мл, 6,16 моль) в дихлорметане (5,86 л) и перемешивают 4 ч. Реакцию гасят водой (1 л), и слои разделяют. Органический слой сушат над сульфатом магния, отфильтровывают, концентрируют и очищают остаток хроматографией на короткой колонке с силикагелем (3500 г SiO2), элюируя с градиентом от 100:0 до 40:60 смесью н-гексана и этилацетата, получая указанное в заглавии соединение в виде белого твердого вещества (1230 г, 82%). МС (m/z): 303, 305 (М+1). Пример получения 13. Синтез (4-ацетил-3-бромизотиазол-5-ил)амида циклопропанкарбоновой кислоты. Триэтиламин (234,5 мл, 1,68 моль) добавляют при 0 С в атмосфере азота к охлажденной суспензии 1-(5-амино-3-бромизотиазол-4-ил)этанона (310 г, 1,40 моль) в дихлорметане (2,79 л, 43,53 моль) и затем медленно при 0 С в течение 1 ч добавляют раствор циклопропанкарбонилхлорида (137,5 мл, 1,47 моль) в дихлорметане (310 мл, 4,84 моль). Нагревают до 16 С в течение 2 ч и затем охлаждают до 10 С, добавляют воду (1 л) и слои разделяют. Водный слой один раз экстрагируют дихлорметаном (500 мл). Органические слои объединяют, концентрируют и очищают хроматографией на силикагеле, элюируя смесью нгексан:дихлорметан 30:70. Растирают выделенное твердое вещество с гексанами, получая указанное в заглавии соединение в виде белого твердого вещества (256,1 г, 60%). МС (m/z): 289, 291 (М+1). Пример получения 14. Синтез (3,4-дибромизотиазол-5-ил)амида (1R,2R)-2-метилциклопропанкарбоновой кислоты. Бром (114 мл, 2,2 моль) добавляют по каплям в течение 45 мин при -10 С к охлажденному водному раствору гидроксида натрия (4,6 М, 3,84 л, 17,8 моль) и перемешивают в течение 0,5 ч, получая желтый раствор. Этот раствор добавляют по каплям к предварительно охлажденному до -5 С раствору (4-ацетил 3-бромизотиазол-5-ил)амида (1R,2R)-2-метилциклопропанкарбоновой кислоты (150 г, 495 ммоль) в 1,4 диоксане (2 л) и перемешивают 45 мин при 5-10 С. Поддерживая температуру равной 10 С, добавляют в течение 5 мин 40% (мас./мас.) водный раствор бисульфита натрия (47,5 мл), перемешивают 5 мин и медленно в течение 15 мин добавляют 12 М соляную кислоту (примерно 500 мл) до получения кислой среды(рН 2). Разбавляют этилацетатом (2 л) и слои разделяют. Водный слой дважды экстрагируют этилацетатом (1 л). Органические фазы объединяют, сушат над сульфатом магния, отфильтровывают и концентрируют. Остаток растворяют в дихлорметане (600 мл), разбавляют н-гексаном (3 л) и охлаждают до 5 С в течение ночи. Отфильтровывают и полученное твердое вещество промывают четырьмя порциями нгексана (125 мл), получая указанное в заглавии соединение в виде белого твердого вещества (92,6 г,55%). При необходимости из маточного раствора может быть выделена вторая порция указанного в заглавии соединения (50,97 г, 30%). МС (m/z): 339, 341, 343 (М+1). Пример получения 15. Синтез (3,4-дибромизотиазол-5-ил)амида циклопропанкарбоновой кислоты. Бром (118,3 мл, 2,30 моль) добавляют при 0 С в течение 1 ч к охлажденному водному раствору гидроксида натрия (3,77 М, 2,44 л, 9,21 моль) и перемешивают 15 мин. К этому раствору в течение 100 мин добавляют раствор (4-ацетил-3-бромизотиазол-5-ил)амида циклопропанкарбоновой кислоты (155,7 г,0,51 моль) в 1,4-диоксане (856,3 мл, 10,03 моль), поддерживая температуру ниже 5 С. Перемешивают в течение 1,5 ч, поддерживая температуру реакционной смеси ниже 10 С. Добавляют водный раствор бисульфита натрия (77,8 мл, 0,377 моль), перемешивают в течение 5 мин и в течение 15 мин, поддерживая температуру ниже 25 С, добавляют 12 М соляную кислоту (390,1 мл, 4,60 моль). Смесь выдерживают без перемешивания в течение 10 мин, затем удаляют жидкость над осадком, отфильтровывают оставшуюся суспензию и полученное твердое вещество дважды промывают водой (200 мл) и сушат в вакууме, получая указанное в заглавии соединение в виде желтого твердого вещества (91,21 г, 55%). МС (m/z): 325, 327, 329 (М+1). Пример получения 16. Синтез(1R,2R)-2 метилциклопропанкарбоновой кислоты. 2 М водный раствор карбоната натрия (606,3 мл, 1,21 моль) добавляют к перемешиваемой смеси(3,4-дибромизотиазол-5-ил)амида (1R,2R)-2-метилциклопропанкарбоновой кислоты (148,1 г, 0,404 моль) и 2-метил-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2 Н-индазола (123,40 г, 0,444 моль) в 1,2 диметоксиэтане со степенью чистоты, подходящей для ВЭЖХ (1,21 л), и дегазируют с применением вакуума и азота. Добавляют одной порцией дихлорид бис-(трифенилфосфин)палладия(II) (56,77 г, 80,84 ммоль), нагревают при 83 С в течение 10 ч, охлаждают до комнатной температуры и отфильтровывают через слой целита (Celite) с добавлением этилацетата, получая двухфазный раствор. Слои разделяют, и водный слой три раза экстрагируют дихлорметаном (200 мл). Объединяют все органические слои, промывают солевым раствором (200 мл) и концентрируют до объема примерно 400 мл. Разделяют на две порции, и каждую очищают хроматографией на силикагеле с градиентом от 50:50 до 10:90, элюируя нгексаном:этилацетатом, с получением указанного в заглавии соединения в виде светло-коричневого твердого вещества (107,32 г, 51%). МС (m/z): 391,393 (М+1). Альтернативный способ синтеза [4-бром-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида(2,21 г, 7,49 ммоль) и хлорид лития (0,95 г, 22,48 ммоль) в 1,4-диоксане (19,2 мл). Продувают азотом в течение 20 мин, добавляют тетракис-(трифенилфосфин)палладий (1,31 г, 1,12 ммоль) и нагревают при 105 С в течение 48 ч. Реакционную смесь непосредственно загружают на колонку с силикагелем и очищают, элюируя с градиентом от 0:100 до 100:0 смесью этилацетат:изогексан, получая указанное в заглавии соединение (1,25 г, 43%). МС (m/z): 391, 393 (М+1). Следующее соединение было получено, по существу, так, как описано в альтернативном способе получения 16, с использованием 2-этил-5-триметилстаннанил-2 Н-индазола.(3,4-Дибромизотиазол-5-ил)амид (1R,2R)-2-метилциклопропанкарбоновой кислоты (3,0 г, 8,82 ммоль) растворяют в безводном 1,4-диоксане (88 мл) и добавляют трет-бутиловый эфир 5 триметилстаннанилиндазол-1-карбоновой кислоты (4,11 г, 9,70 ммоль). В атмосфере азота добавляют хлорид бис-(трифенилфосфин)палладия(II) (0,62 г, 0,88 ммоль) и нагревают до 85 С в течение 4 суток. Концентрируют и остаток очищают хроматографией на силикагеле, элюируя с градиентом от 20:80 до 40:60 смесью этилацетат:гексаны, получая указанное в заглавии соединение (1,04 г, 70% чистоты мас./мас., 17%) которое используют без дополнительной очистки. МС (m/z): 477, 479 (М+1). Пример получения 19. Синтез [4-бром-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида циклопропанкарбоновой кислоты. Смесь (3,4-дибромизотиазол-5-ил)амида циклопропанкарбоновой кислоты (1,04 г, 3,19 ммоль) и 2 метил-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2 Н-индазола (1,29 г, 3,51 ммоль) в 1,4-диоксане(16 мл) и 2 М водного раствора карбоната натрия (7,98 мл) дегазируют, продувая азотом в течение 10 мин. Добавляют хлорид бис-(трифенилфосфин)палладия(II) (448 мг, 0,64 ммоль) и нагревают при 80 С в течение 12 ч. Охлаждают, разбавляют солевым раствором и этилацетатом и слои разделяют. Водную фазу дважды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 40:60 до 100:0 смесью этилацетат:гексаны, получая указанное в заглавии соединение в виде твердого вещества (0,6 г, 1,59 ммоль, 50%). МС (m/z): 377, 379 (М+1). Пример получения 20. Синтез 2-бром-6-циклопентилпиридина. Через раствор йодида меди(I) (1,48 г, 7,77 ммоль), 2,6-дибромпиридина (8 г, 33,77 ммоль) и хлорида(40 мл) в течение 5 мин барботируют азот. Добавляют одной порцией 0,5 М раствор бромида циклопентилцинка в тетрагидрофуране (79,70 мл, 39,85 ммоль) и перемешивают в течение ночи. Разбавляют гексанами (800 мл) и отфильтровывают через слой силикагеля, добавляя раствор этилацетат:гексаны (10:90),с получением прозрачного раствора. Концентрируют, очищают обращенно-фазовой хроматографией с использованием градиента воды (мас./1% трифторуксусной кислоты):ацетонитрила, и объединяют фракции, содержащие чистый продукт. К объединенным фракциям добавляют насыщенный водный раствор бикарбоната натрия до получения щелочной реакции и экстрагируют шестью порциями гексана (150 мл). Гексановые слои сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в заглавии соединение в виде прозрачной жидкости (3,75 г, 49%). МС (m/z): 226, 228 (М+1). Следующие соединения были получены, по существу, в соответствии с примером получения 20 с использованием бромида циклобутилцинка или бромида циклопропилцинка соответственно. Пример получения 23. Синтез 2-бром-6-этилпиридина. Раствор 2,5 М н-бутиллития в гексанах (186,74 мл, 0,467 моль) добавляют в течение 41 мин в атмосфере азота к раствору диизопропиламина (68,7 мл, 0,488 моль) в тетрагидрофуране (745 мл, 9,16 моль) при -78 С (баня: сухой лед/ацетон). Перемешивают в течение 15 мин и по каплям в течение 22 мин добавляют 2-бром-6-метилпиридин (49,3 мл, 0,424 моль). Перемешивают 15 мин и по каплям в течение 1 ч добавляют метилйодид (52,87 мл, 0,848 моль) и затем нагревают до комнатной температуры в течение 1,5 ч. Добавляют воду (250 мл), охлаждая на бане с сухим льдом/ацетоном, и слои разделяют. Водную фазу дважды экстрагируют этилацетатом (300 мл). Органические фазы объединяют, концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 100:0 до 80:20 с использованием смеси гексаны:этилацетат, с получением указанного в заглавии соединения в виде желтого масла (59,74 г,75%). 1H ЯМР (CDCl3):1,28 (т, 3 Н), 2,80 (кв., 2 Н), 7,11 (д, 1 Н), 7,27 (д, 1 Н), 7,45 (т, 1 Н). Следующие соединения были получены, по существу, в соответствии с примером получения 23. Пример получения 26. Синтез 2-бром-6-метоксиметилпиридина. Раствор (6-бромпиридин-2-ил)метанола (9,6 г, 51 ммоль) в безводном тетрагидрофуране (29 мл) добавляют по каплям в атмосфере азота к перемешиваемой суспензии гидрида натрия (60% дисперсия в масле, 2,45 г, 61 ммоль) в безводном тетрагидрофуране (96 мл), охлажденном до 0-5 С. После прекращения выделения газа добавляют по каплям метилйодид (10,9 мл, 77 ммоль) и нагревают до комнатной температуры в течение 1 ч. Добавляют ледяную воду (100 мл), разбавляют солевым раствором (100 мл) и этилацетатом (200 мл). Слои разделяют. Органический слой один раз экстрагируют солевым раствором (100 мл), сушат над сульфатом натрия и жидкость декантируют. Концентрируют до бледно-желтого масла (11,1 г) и перегоняют с использованием аппарата Кюгельрора (Kugelrohr apparatus), получая указанный в заглавии продукт в виде бесцветной жидкости (10,1 г, т.кип.=140-150 С при 2,4 мбар, 93%). МС (m/z): 202, 204 (М+1). Пример получения 27. Синтез (6-бромпиридин-2-ил)диметиламина. Перемешиваемую смесь 2,6-дибромпиридина (15 г, 63 ммоль) и диметиламина (40% водный раствор, 21,4 мл, 190 ммоль, 3 эквив.) в этаноле (75 мл) нагревают в течение 3 суток при 70 С. Желтый раствор упаривают до меньшего объема и разбавляют этилацетатом (100 мл). Промывают водой (40 мл),рассолом (40 мл) и сушат над сульфатом натрия. Жидкость декантируют и испаряют, получая бледножелтое масло (13,8 г). Перегоняют с использованием аппарата Кюгельрора, получая указанный в заглавии продукт в виде бесцветной жидкости (12,4 г, т.кип.=100-140 С при 0,1 мбар). МС (m/z): 201, 203 (М+1). Пример получения 28. Синтез (6-бромпиридин-2-ил)метиламина. 2 М раствор метиламина в тетрагидрофуране (33,6 мл, 67,12 ммоль) добавляют к 2,6 дибромпиридину (5,3 г, 22,37 ммоль) и нагревают в течение ночи при 110 С в запаянной пробирке. Концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 0:100 до 20:80 смесью этилацетат:изогексан, получая указанное в заглавии соединение (0,345 г, 8%) в виде бледно-желтого масла, которое кристаллизуется при стоянии. МС (m/z): 185, 187 (М+1). Пример получения 29. Синтез 2-бром-6-дифторметилпиридина. Трифторид диэтиламиносеры (31,5 мл, 0,238 моль) добавляют по каплям в течение 20 мин при 0 С к перемешиваемому охлажденному раствору 6-бромпиридин-2-карбальдегида (30,40 г, 0,158 моль) в дихлорметане (600 мл) и нагревают до комнатной температуры в течение ночи. Реакционную смесь разделяют на две порции равного объема для облегчения обработки. Медленно и крайне осторожно в течение 30 мин добавляют насыщенный водный раствор бикарбоната натрия. Водный слой один раз промывают дихлорметаном. Объединенные органические слои сушат над сульфатом натрия, отфильтровывают и концентрируют. Полученный неочищенный продукт очищают хроматографией на силикагеле, элюируя с градиентом от 1:99 до 10:90 смесью этилацетат:изогексан, получая указанное в заглавии соединение(22,60 г, 68%) и вторую фракцию (9,4 г, 90% чистоты мас./мас., 26%), которые используют без дополнительной очистки. 1H ЯМР (CDCl3):6,59 (т, 1 Н), 7,61 (м, 2 Н), 7,73 (т, 1 Н). Следующее соединение было получено, по существу, в соответствии с примером получения 29. Пример получения 31. Синтез 2-(6-бромпиридин-2-ил)пропан-2-ола. Раствор метилмагнийбромида (3,0 М, 9,7 мл, 29,09 ммоль) в тетрагидрофуране добавляют при 0 С по каплям в течение 20 мин к охлажденному раствору 1-(6-бромпиридин-2-ил)этанона (5 г, 24,25 ммоль) в безводном тетрагидрофуране (48,5 мл). По завершении реакции добавляют воду (выделение тепла),разбавляют этилацетатом (50 мл) и слои разделяют. Водный слой один раз экстрагируют этилацетатом(50 мл). Объединенные органические слои сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в заглавии соединение в виде бледно-желтой жидкости (5,69 г, 98%), которую используют без дополнительной очистки. 1H ЯМР (CDCl3):1,55 (с, 6 Н), 4,07 (с, 1 Н), 6,59 (т, 1 Н), 7,37 (т, 2 Н), 7,55 (т, 1 Н). Пример получения 32. Синтез 2-бром-6-(1-фтор-1-метилэтил)пиридина. Трифторид (бис-(2-метоксиэтил)амино)серы (2,05 мл, 11,11 ммоль) добавляют по каплям при -78 С к охлажденному раствору 2-(6-бромпиридин-2-ил)пропан-2-ола (2 г, 9,26 ммоль) в дихлорметане(46,3 мл). По завершении добавления нагревают до комнатной температуры и перемешивают в течение ночи. Добавляют насыщенный водный раствор бикарбоната натрия и перемешивают до прекращения выделения газа. Отфильтровывают через 50 мл гидрофобного IST Phase Separator Frit, концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 3:97 до 5:95 и затем до 10:90 смесью дихлорметан:изогексан, получая указанное в заглавии соединение в виде бесцветной жидкости (5,13 г,71%). 1 Н ЯМР (CDCl3):1,66 (с, 3 Н), 1,73 (с, 3 Н), 7,37 (дд, 2 Н), 7,53 (м, 2 Н). 19F ЯМР (CDCl3):-143,37 (с, 1F). Пример получения 33. Синтез 2-этил-6-трибутилстаннанилпиридина. Раствор трет-бутиллития в пентане (1,5 М, 80,3 мл, 120,5 ммоль) добавляют по каплям в атмосфере азота в течение 1 ч к охлажденному раствору 2-бром-6-этилпиридина (10,19 г, 54,77 ммоль) в безводном диэтиловом эфире (101,9 мл) при -78 С с такой скоростью, чтобы температура реакционной смеси не превышала -75 С. Перемешивают 15 мин и добавляют по каплям хлорид три-н-бутилолова (16,25 мл,57,51 ммоль) с такой скоростью, чтобы температура реакционной смеси не превышала -70 С. Нагревают до комнатной температуры, добавляют воду и слои разделяют. Водную фазу один раз экстрагируют диэтиловым эфиром. Объединенные органические слои сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в заглавии соединение в виде бледно-желтой жидкости (24,05 г,94%), которую затем используют без дополнительной очистки. 1 Н ЯМР (CDCl3):0,88 (т, 9 Н), 1,09 (м, 6 Н), 1,32 (м, 9 Н), 1,56 (м, 6 Н), 1,57 (м, 6 Н), 2,80 (кв., 2 Н),6,95 (м, 1 Н), 7,17 (д, 1 Н), 7,38 (т, 1 Н). Следующие соединения были получены, по существу, в соответствии с примером получения 33 с использованием 2-бром-6-изопропилпиридина и 2-бром-6-дифторметилпиридина.(10 мл) добавляют по каплям в атмосфере азота при -75 С к перемешиваемому охлажденному раствору н-бутиллития в гексанах (2,5 М, 19,1 мл, 47,7 ммоль) в безводном тетрагидрофуране (160 мл) с такой скоростью, чтобы температура реакционной смеси не превышала -70 С. Спустя 1 ч при -75 С, добавляют по каплям хлорид три-н-бутилолова (13 г, 39,8 ммоль), перемешивают в течение 30 мин и нагревают до 0 С. Добавляют воду (200 мл) и затем разбавляют насыщенным водным раствором бикарбоната натрия(50 мл) и диэтиловым эфиром (200 мл) и слои разделяют. Органические фазы один раз экстрагируют рассолом (200 мл), сушат над сульфатом натрия, фильтруют и концентрируют, получая жидкость (25,4 г). Очищают хроматографией на силикагеле, элюируя изогексаном:этилацетатом:триэтиламином 90:9:1, с получением титульного продукта в виде бесцветной жидкости (8,16 г, 50%). МС (m/z): 409-414 кластер (М+1). Пример 1. Синтез(1R,2R)-2-метилциклопропанкарбоновой кислоты (288 г, 0,736 моль) растворяют в ТГФ (2,9 л), добавляют 2-этил-6(трибутилстаннил)пиридин (498,8 г, 1,10 моль) и барботируют под поверхность раствора азот в течение 10 мин. Добавляют хлорид бис-(трифенилфосфин)палладия(II) (26,4 г, 36,8 ммоль) и продолжают барботирование в течение 5 мин. Барботирование переключают в режим продувки азотом и смесь нагревают до кипения с обратным холодильником. Спустя 56,5 ч содержимое колбы охлаждают до комнатной температуры и раствор концентрируют под разрежением. Полученную суспензию растворяют в толуоле(6 л) и добавляют 1 н. HCl (3 л). Двухфазную смесь отфильтровывают через бумагу ватман (WhatmanGFF) и фильтрат переносят в колбу с нижним сливом. Слои разделяют и вновь экстрагируют органические фазы 1 н. HCl (3 л). Водные слои объединяют и промывают толуолом (6 л). К водному слою добавляют 5 н. NaOH до рН 9. Слои разделяют и органические фазы промывают солевым раствором (3 л). Органические фазы сушат над MgSO4, отфильтровывают через бумагу Whatman GFF и концентрируют под разрежением с получением остатка. Остаток очищают хроматографией через слой силикагеля, элюируя смесью ацетонитрил:гептан:метиленхлорид (20:30:50). Соответствующие фракции объединяют и концентрируют под разрежением, получая указанное в заглавии соединение в виде аморфной пены. 1 Н ЯМР (CDCl3, 400,0 МГц):0,85 (м, 1 Н), 1,19 (д, 3 Н), 1,33 (м, 3 Н), 1,45 (т, 3 Н), 2,96 (кв., 2 Н), 4,24(1R,2R)-2 метилциклопропанкарбоновой кислоты (113 мг, 270,6 мкмоль) растворяют при перемешивании и осторожном нагревании в этилацетате (226 мкл). К теплому раствору добавляют гексаны (339 мкл) и полученную смесь оставляют охлаждаться до комнатной температуры. Полученные кристаллы отфильтровывают и промывают гексанами (0,5 мл). Продукт сушат в вакууме при 35 С, получая указанное в заглавии соединение в виде белого кристаллического твердого вещества. 1 Н ЯМР (CDCl3, 400,0 МГц):0,85 (м, 1 Н), 1,19 (д, 3 Н), 1,33 (м, 3 Н), 1,45 (т, 3 Н), 2,96 (кв., 2 Н), 4,24(с, 1 Н), 6,19 (д, 1 Н, J=8 Гц), 7,01 (д, 1 Н, J=8 Гц), 7,28 (дд, 1 Н, J=12 Гц), 7,33 (т, 1 Н, J=8 Гц), 7,66 (д, 1 Н,J=12 Гц), 7,89 (с, 1 Н), 7,94 (с, 1 Н), 13,0 (с, 1 Н). Альтернативный способ синтеза [4-(6-этилпиридин-2-ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5 ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты. Раствор(9,28 г, 19,91 ммоль) в безводном 1,2-диметоксиэтане (52 мл) продувают азотом в течение 30 мин, добавляют бис-(три-трет-бутилфосфин)палладий(0) (0,35 г, 0,66 ммоль) и нагревают при 100 С в атмосфере азота в течение 4 суток. Концентрируют, остаток растворяют в этилацетате и отфильтровывают через влажную пластинку из целита (Celite), добавляя этилацетат. Концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 60:40 до 70:30 и затем до 90:10 этилацетатом:изогексаном и затем чистым этилацетатом. Концентрируют, растворяют в этилацетате (50 мл) и отфильтровывают. К фильтрату по каплям в атмосфере азота добавляют 2 М раствор хлористого водорода в диэтиловом эфире(6 мл) и перемешивают в течение 30 мин. Отфильтровывают, промывают полученное твердое вещество этилацетатом (10 мл) и сушат в течение ночи. Растворяют в метаноле (100 мл), разделяют на 3 фракции равного объема и загружают каждую фракцию на колонку Isolute SCX-2 (20 г, Biotage AB) предварительно промытую метанолом. Промывают метанолом (3 объема колонки), элюируют 2 М раствором аммиака в метаноле (1 объем колонки), объединяют и концентрируют. Далее очищают при помощи SFC[колонка с 2-этилпиридином (Princeton Chromatography Inc.), 60 А, размер частиц 7 мкм, подвижная фаза 15% метанол (мас./0,2% диэтилметиламин): 85% диоксида углерода, давление на выходе 100 бар (10 Мпа)] с использованием метанола в качестве впрыскиваемого растворителя [18 мл, с разбиением объема впрыска по 1,5 мл/впрыск (230 мг вещества за один впрыск), впрыскивая каждые 4 мин с обеспечением расхода 3,5 г/час], получая указанное в заглавии соединение (1,77 г, 32%). МС (m/z): 418 (М+1). Следовые количества тяжелых металлов могут быть удалены из вышеуказанного очищенного соединения в соответствии со следующим протоколом. К раствору указанного в заглавии соединения(14,62 г, 34,56 ммоль) в толуоле (577,2 мл) при перемешивании добавляют смолу CR20 Diaion (28,86 г,Resindion-Mitsubichi Chemical) и нагревают при 60 С в течение 15 ч. Охлаждают до комнатной температуры, отфильтровывают и промывают выделенную смолу толуолом. К фильтрату добавляют свежую смолу CR20 Diaion (28,86 г) и перемешивают при 60 С в течение 7 ч. Охлаждают до комнатной температуры, отфильтровывают, промывают выделенную смолу толуолом и концентрируют, получая желтое твердое вещество (14,7 г). Твердое вещество растворяют в метил-трет-бутиловом эфире (735 мл), дважды промывают насыщенным водным раствором фторида калия (43% мас./мас. раствор) в течение 10 мин,сушат над сульфатом магния, отфильтровывают и концентрируют. Остаток дважды растирают с гексанами (294 мл), отфильтровывают и сушат в вакууме, получая указанное в заглавии соединение в виде белого твердого вещества. МС (m/z): 418 (М+1). Пример 2. Синтез гидрохлорида [4-(6-этилпиридин-2-ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида К перемешиваемому раствору [4-(6-этилпиридин-2-ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5 ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты (11 г, 25,92 ммоль) в этилацетате (135,30 мл) при комнатной температуре медленно добавляют с помощью шприца раствор 1 М хлористого водорода в диэтиловом эфире (25,92 мл, 25,92 ммоль) с получением суспензии. Спустя 10 мин концентрируют и далее сушат в глубоком вакууме в течение 3 суток, получая указанное в заглавии соединение в виде белого твердого вещества (11,92 г, 99%). МС (m/z): 418 (М-HCl +1). 1(6,31 г,12,26 ммоль) и 2-изопропил-6 трибутилстаннанилпиридина (15,08 г, 18,38 ммоль) в безводном 1,2-диметоксиэтане (50 мл) продувают азотом в течение 60 мин и добавляют бис-(три-трет-бутилфосфин)палладий(0) (0,32 г, 0,61 ммоль). Перемешивают при 100 С в атмосфере азота в течение 3 суток, концентрируют до меньшего объема и раз- 15018001 бавляют этилацетатом (50 мл). Отфильтровывают через пластинку из целита (Celite), концентрируют до темно-коричневого масла и очищают хроматографией на силикагеле, элюируя с градиентом от 60:40 до 90:10 смесью этилацетат:изогексан, получая светло-коричневое масло (7,3 г). Растворяют в этилацетате (40 мл) и добавляют 2 М раствор хлористого водорода в диэтиловом эфире (4,5 мл, 9 ммоль), получая осадок. Отфильтровывают с получением твердого вещества кремового цвета (4,14 г). Растворяют в метаноле (15 мл), разделяют на три порции и загружают каждую порцию на колонку Isolute SCX-2 (20 г,Biotage AB). Промывают метанолом (120 мл на колонку) и элюируют из колонки 2 М раствором аммиака в метаноле (100 мл на колонку). Концентрируют с получением желтой пены и очищают хроматографией на силикагеле, элюируя с градиентом от 70:30 до 80:20 смесью этилацетат:изогексан, получая свободное основание титульного продукта в виде желтого масла. Растворяют в этилацетате (40 мл) и добавляют 2 М раствор хлористого водорода в диэтиловом эфире (4,5 мл, 9 ммоль), при этом сразу же выпадает осадок. Осадок отстаивают в течение 1 ч, затем отфильтровывают, получая указанное в заглавии соединение в виде белого порошкообразного твердого вещества (3,85 г, 65%). МС (m/z): 432 (М-HCl +1). Следующее соединение было получено, по существу, как описано в примере 3. Смесь трибутил-2-пиридинилолова (244 мкл, 0,70 ммоль) и [4-бром-3-(2-метил-2 Н-индазол-5 ил)изотиазол-5-ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты (0,25 г, 0,64 ммоль) в безводном 1,2-диметоксиэтане (5,00 мл) дегазируют, барботируя через смесь азот в течение 10 мин, затем добавляют бис-(три-трет-бутилфосфин)палладий(0) (0,02 г, 31,95 мкмоль) и перемешивают при 100 С в атмосфере азота в течение ночи. Реакционную смесь охлаждают до комнатной температуры, добавляют 10% водный раствор фторида калия (3 мл), перемешивают 10 мин и экстрагируют этилацетатом. Органические слои промывают солевым раствором, сушат над сульфатом магния, отфильтровывают и упаривают досуха. Остаток очищают хроматографией на силикагеле, элюируя с градиентом от 0:100 до 100:0 смесью этилацетат:изогексан, и затем дополнительно очищают обращенно-фазовой ВЭЖХ (вода/бикарбонат аммония (рН 9)/ацетонитрил), получая свободное основание в виде бесцветного масла. Растворяют в этилацетате (1 мл), добавляют 1 М раствор хлористого водорода в диэтиловом эфире(250 мкл) и концентрируют в вакууме, получая указанное в заглавии соединение в виде белого твердого вещества (111 мг). МС (m/z): 390 (М-HCl+1). Следующие соединения были получены, по существу, как описано в примере 5, с использованием(1R,2R)-2-метилциклопропанкарбоновой кислоты, либо [4-бром-3-(2-метил-2 Н-индазол-5-ил)изотиазол 5-ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты. Пример 7 был получен в виде свободного основания без обработки хлористым водородом.(2,4 мл) в атмосфере азота добавляют бис-(три-трет-бутилфосфин)палладий(0) (7,4 мг, 0,01 ммоль) и нагревают при 80 С в течение 18 ч. Реакционный раствор непосредственно очищают хроматографией на силикагеле, элюируя с градиентом от 20:80 до 60:40 смесью этилацетат:гексаны, получая свободное основание указанного в заглавии соединения (78 мг, 34%) и трет-бутиловый эфир 5-4-6 изопропилпиридин-2-ил)-5-[1R,2R)-2-метилциклопропанкарбонил)амино]изотиазол-3-илиндазол-1 карбоновой кислоты (85 мг, 29%). МС (m/z): 518 (М+1). Выделенный трет-бутиловый эфир 5-4-(6-изопропилпиридин-2-ил)-5-[1R,2R)-2 метилциклопропанкарбонил)амино]изотиазол-3-илиндазол-1-карбоновой кислоты (83 мг, 0,16 ммоль) растворяют в дихлорметане (2 мл), добавляют трифторуксусную кислоту (2 мл) и перемешивают в течение 2 ч. Концентрируют и очищают хроматографией на силикагеле, элюируя с градиентом от 20:80 до 30:70 смесью этилацетат: (50:50 дихлорметан/гексаны), получая свободное основание указанного в заглавии соединения (47 мг). МС (m/z): 418 (М+1). Объединяют две порции свободного основания указанного в заглавии соединения (125 мг, 0,3 ммоль), суспендируют в диэтиловом эфире (4 мл) и добавляют метанол до растворения. Добавляют 1 н. раствор хлористого водорода в диэтиловом эфире (0,3 мл, 0,3 ммоль) и концентрируют. Сушат в вакууме, получая указанное в заглавии соединение (92 мг, 42% после двух стадий). МС (m/z): 418 (М-HCl+1). Пример 9. Синтез гидрохлорида [4-(6-циклобутилпиридин-2-ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5 ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты В сосуд для применения в микроволновой установке загружают 2-бром-6-циклобутилпиридин (0,18 г, 0,84 ммоль), гексаметилдиолово (0,18 мл, 0,84 ммоль), хлорид лития (97,5 мг, 2,30 ммоль) и безводный 1,4-диоксан (2,5 мл) и дегазируют, барботируя азот. Добавляют тетракис-(трифенилфосфин)палладий(44,3 мг, 38,33 мкмоль) и нагревают в микроволновой печи при перемешивании при 110 С в течение 5 мин, получая раствор 2-циклобутил-6-трибутилстаннанилпиридина. К полученному раствору последовательно добавляют дегазированный раствор [4-бром-3-(2-метил 2 Н-индазол-5-ил)изотиазол-5-ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты (0,30 г, 0,77 ммоль) в безводном 1,2-диметоксиэтане (2,5 мл) и бис-(три-трет-бутилфосфин)палладий(0) (0,05 г, 0,98 ммоль). Нагревают в микроволновой печи при 100 С при перемешивании в течение 2 ч. Реакционную смесь очищают непосредственно хроматографией на силикагеле, элюируя с градиентом от 60:40 до 100:0 смесью этилацетат:изогексан, и затем дополнительно очищают второй раз хроматографией на силикагеле, элюируя с градиентом от 100:0 до 97:3 смесью дихлорметан:метанол, получая свободное основание указанного в заглавии соединения. Растворяют в минимальном количество дихлорметана, добавляют 2 М раствор хлористого водорода (0,11 мл, 0,22 ммоль) в диэтиловом эфире и упаривают досуха, получая указанное в заглавии соединение (88,80 мг, 24%) в виде белого твердого вещества. МС (m/z): 444 (М-HCl+1). Следующие соединения были получены, по существу, как описано в примере 9, из [4-бром-3-(2 метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты и соответствующего 2-бром-6-замещенного пиридина. Следующие соединения были получены, по существу, как описано в примере 9, из [4-бром-3-(2 метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида (1R,2R)-2-метилциклопропанкарбоновой кислоты и соответствующего 2-бром-6-замещенного пиридина и выделены в виде соответствующих свободных оснований. Смесь диметил(6-трибутилстаннанилпиридин-2-ил)амина (0,34 г, 0,84 ммоль) и циклопропанкарбоновой кислоты [4-бром-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида (0,24 г, 0,64 ммоль) в 1,2 диметоксиэтане (3 мл) дегазируют, барботируя в течение 10 мин азот, добавляют бис-(три-третбутилфосфин)палладий(0) (0,02 г, 32,21 мкмоль) и перемешивают при 100 С в атмосфере азота в течение ночи. Охлаждают до комнатной температуры, добавляют 10% водный раствор фторида калия (3 мл), перемешивают 40 мин и экстрагируют этилацетатом. Органический слой промывают солевым раствором,сушат над сульфатом магния, отфильтровывают и концентрируют. Очищают ионообменной хроматографией на колонке Isolute SCX-2 (10 г, Biotage AB), как описано в примере 3, и затем дополнительно очищают хроматографией на силикагеле, элюируя с градиентом от 0:100 до 0:20 смесью этилацетат:изогексан, и далее очищают обращенно-фазовой ВЭЖХ (вода/бикарбонат аммония (рН 9)/ацетонитрил), получая свободное основание указанного в заглавии соединения. Растворяют в метаноле, добавляют 1 М раствор хлористого водорода в диэтиловом эфире(0,3 г, 0,79 ммоль) и 2-этил-6-трибутилстаннанилпиридина (2,0 г, 5,05 ммоль) в безводном 1,2 диметоксиэтане (4 мл) дегазируют, барботируя азот в течение 10 мин. Добавляют бис-(три-третбутилфосфин)палладий(0) (41 мг, 0,79 ммоль), нагревают до 80 С и перемешивают в течение 20 ч. Оставляют охлаждаться до комнатной температуры и очищают непосредственно хроматографией на силикагеле, элюируя с градиентом от 50:50 до 100:0 смесью гексаны:этилацетат, и затем дополнительно очищают обращенно-фазовой ВЭЖХ (Kromasil KR100-10C18-250P2, 50,8 мм 25 см, расход 60 мл/мин),элюируя с градиентом от 15:85 до 80:20 воды (мас./0,1% трифторуксусной кислоты)/ацетонитрила(мас./0,1% трифторуксусной кислоты) в течение 60 мин. Фракции объединяют, подщелачивают насыщенным водным раствором бикарбоната натрия, дважды экстрагируют дихлорметаном, сушат над безводным сульфатом натрия, отфильтровывают и концентрируют, получая твердое вещество (0,132 г, 0,33 ммоль). Растворяют в дихлорметане (1,6 мл), охлаждают до 0 С и при перемешивании добавляют 1 М раствор хлористого водорода в диэтиловом эфире (0,327 мл, 0,33 ммоль). Спустя 10 мин концентрируют в вакууме, дважды растирают остаток с диэтиловым эфиром и сушат в вакууме, получая указанное в заглавии соединение в виде твердого вещества (0,111 г, 0,25 ммоль). МС (m/z): 404 (М-HCl+1). Следующее соединение было получено, по существу, как описано в примере 19, с использованием 2-изопропил-6-трибутилстаннанилпиридина.(1R,2R)-2 метилциклопропанкарбоновой кислоты (0,24 г, 0,61 ммоль) в безводном 1,2-диметоксиэтане (3,1 мл) и дегазируют, барботируя азот в течение 20 мин. Добавляют бис-(три-трет-бутилфосфин)палладий(0) (0,01 г, 12,27 мкмоль), перемешивают при комнатной температуре в атмосфере азота в течение ночи и затем нагревают при 55 С в течение 48 ч. Разбавляют солевым раствором и экстрагируют этилацетатом. Слои этилацетата сушат над сульфатом магния, фильтруют и концентрируют. Очищают хроматографией на силикагеле, элюируя с градиентом от 0:100 до 30:70 смесью этилацетат:хлороформ, и затем дополнительно очищают обращенно-фазовой ВЭЖХ (вода/бикарбонат аммония (рН 9)/ацетонитрил), получая указанное в заглавии соединение (29,6 мг). 1 Н ЯМР (CD3OD):0,85 (м, 1 Н), 1,18 (д, 3 Н), 1,35 (м, 1 Н), 1,44 (м, 1 Н), 1,62 (м, 1 Н), 4,11 (с, 3 Н),4,24 (с, 3 Н), 6,57 (д, 1 Н), 6,62 (д, 1 Н), 7,27 (м, 1 Н), 7,34 (т, 1 Н), 7,65 (д, 1 Н), 7,91 (д, 2 Н), 12,17 (ушир.с,1 Н). Пример 22. Кристаллизация(1R,2R)-2 метилциклопропанкарбоновой кислоты (185 г, 0,44 моль) растворяют при перемешивании в этилацетате(555 мл). Добавляют затравку кристаллов, полученных в примере 1 (200 мг), и затем гексаны (800 мл). Полученную смесь перемешивают при температуре окружающей среды в течение 30 мин. Полученные кристаллы отфильтровывают и промывают гексанами (50 мл). Твердые вещества сушат в вакуумном шкафу при 35 С, получая указанное в заглавии соединение в виде белого кристаллического твердого вещества. МС (m/z): 418 (М+1); ДСК (начало) т.пл.=159,4 С. Пример 23. Синтез [4-(6-изопропилпиридин-2-ил)-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амида (1R,2R)-2 метилциклопропанкарбоновой кислоты. Трехгорлую круглодонную колбу емкостью 3 л снабжали подвесной мешалкой, термопарой, обратным холодильником, нагревательной рубашкой и устройством для продувки азотом. В колбу загружают[4-бром-3-(2-метил-2 Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты (96 г, 0,25 моль) и ТГФ (1 л). Добавляют 2-изопропил-6-(трибутилстаннил)пиридин (182 г, 0,44 моль) и перемешивают. Барботируют под поверхность жидкости азот в течение 20 мин. Добавляют хлорид бис-(трифенилфосфин)палладия(II) (8,62 г, 0,012 моль) и продолжают барботирование азота в течение 5 мин. Барботирование заменяют на продувку азотом и содержимое сосуда нагревают до кипения с обратным холодильником. Реакционную смесь перемешивают в течение 3 суток при кипячении с обратным холодильником(по данным ЖХ/МС остается примерно 37% исходного вещества). Реакционную смесь охлаждают до 35 С, дегазируют в течение 15 мин и добавляют дополнительное количество палладиевого катализатора(1 мол.%). Реакционную смесь перемешивают в течение 2 суток при кипячении с обратным холодильником (по данным ЖХ/МС остается 22% исходного вещества). Реакционную смесь охлаждают до 35 С,дегазируют в течение 15 мин и добавляют дополнительное количество палладиевого катализатора (4 мол.%). Реакционную смесь перемешивают в течение 2 суток при кипячении с обратным холодильником(по данным ЖХ/МС остается 13% исходного вещества). Реакционную смесь охлаждают до 35 С, дегазируют в течение 15 мин и добавляют дополнительное количество палладиевого катализатора (5 мол.%). Реакционную смесь перемешивают в течение 4,5 ч при кипячении (по данным ЖХ/МС остается 11% исходного вещества). Реакционную смесь охлаждают до 35 С, дегазируют в течение 15 мин и добавляют дополнительное количество палладиевого катализатора (5 мол.%). Еще один раз перемешивают в течение 15 ч при кипячении с обратным холодильником (по данным ЖХ/МС остается примерно 6% исходного вещества). Раствор концентрируют в вакууме для удаления растворителя. Полученную суспензию обрабатывают толуолом (2 л) и 1 н. HCl (1 л). Двухфазную смесь отфильтровывают через целит (Celite). Слои разделяют и органический слой вновь экстрагируют 1 н. HCl (1 л 3). Водные слои объединяют и экстрагируют толуолом (1 л). Затем водный слой обрабатывают толуолом (2 л) и 5 н. NaOH до рН 11. Слои разделяют и водный слой экстрагируют толуолом (1 л 2). Объединенные органические слои промывают солевым раствором (700 мл), сушат над сульфатом натрия и отфильтровывают. Фильтрат выпаривают под вакуумом, получая неочищенный продукт в виде желтого масла (78 г, 63% чистоты). Неочищенный продукт очищают флэш-хроматографией (силикагель, этилацетат/гексан), получая указанный в заглавии продукт. Дополнительно очищают с помощью кристаллизации из этилацетата и гексанов. Полученные порции объединяют и обрабатывают толуолом (500 мл) и 1 н. HCl (250 мл). Слои разделяют и вновь проводят экстракцию 1 н. HCl (3250 мл). Водные слои объединяют и экстрагируют толуолом(300 мл). Водный слой обрабатывают толуолом (500 мл) и 5 н. NaOH до рН 11. Слои разделяют и экстрагируют водный слой толуолом (2500 мл). Объединенные органические слои промывают солевым раствором (200 мл), сушат над сульфатом натрия и фильтруют. Фильтрат концентрируют в вакууме. Полученный остаток кристаллизуют из этилацетата и гексанов, получая 40 г указанного в заглавии соединения в виде белого твердого вещества. Т.пл.=142-144 С. МС (ES) (m/z): 432 (М+1). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение следующей формулы или фармацевтически приемлемая соль указанного соединенияR4 и R5 независимо представляют собой Н или C1-С 3-алкил. 2. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, гдеR3 представляет собой метил. 3. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, гдеR3 представляет собой метил. 4. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где R1 представляет собой C1-С 3-алкил. 5. Соединение по п.1 или 4 или фармацевтически приемлемая соль указанного соединения, где R2 представляет собой C1-С 3-алкил. 6. Соединение по пп.1, 4 или 5 или фармацевтически приемлемая соль указанного соединения, гдеR3 представляет собой метил. 7. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, гдеR3 представляет собой Н или метил. 8. Соединение по любому из пп.1-7, представляющее собой [4-(6-этилпиридин-2-ил)-3-(2-метил-2 Ниндазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 9. Соединение по любому из пп.1-7, представляющее собой [4-(6-изопропилпиридин-2-ил)-3-(2 метил-2 Н-индазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 10. Соединение по п.9, представляющее собой [4-(6-изопропилпиридин-2-ил)-3-(2-метил-2 Ниндазол-5-ил)изотиазол-5-ил]амид (1R,2R)-2-метилциклопропанкарбоновой кислоты. 11. Фармацевтическая композиция, обладающая активностью селективного антагониста mGluR5,содержащая соединение по любому из пп.1-10 или фармацевтически приемлемую соль указанного со- 21018001 единения и фармацевтически приемлемый носитель, разбавитель или наполнитель. 12. Применение соединения по любому из пп.1-10 или фармацевтически приемлемой соли указанного соединения в качестве лекарственного средства для лечения тревожности. 13. Применение соединения по любому из пп.1-10 или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства для лечения тревожности.
МПК / Метки
МПК: A61K 31/4439, C07D 417/14, A61P 25/22
Метки: 3-индазолил-4-пиридилизотиазолы
Код ссылки
<a href="https://eas.patents.su/23-18001-3-indazolil-4-piridilizotiazoly.html" rel="bookmark" title="База патентов Евразийского Союза">3-индазолил-4-пиридилизотиазолы</a>























