Способ лечения и предупреждения артрита
Номер патента: 17183
Опубликовано: 30.10.2012
Авторы: Секрист Джон А., Ку Жикан, Вауд Вильям Р., Куи Ксянгмин
Формула / Реферат
1. Способ лечения или предупреждения артрита, включающий введение нуждающемуся реципиенту 1-(4-тио-β-D-арабинофуранозил)цитозина в количестве, эффективном для лечения или предупреждения артрита.
2. Способ по п.1, отличающийся тем, что указанный реципиент представляет собой млекопитающее.
3. Способ по п.1, отличающийся тем, что указанный реципиент представляет собой человека.
4. Способ по п.1, отличающийся тем, что указанный реципиент представляет собой домашнее животное.
5. Способ по п.1, отличающийся тем, что указанный артрит представляет собой ревматоидный артрит.
Текст
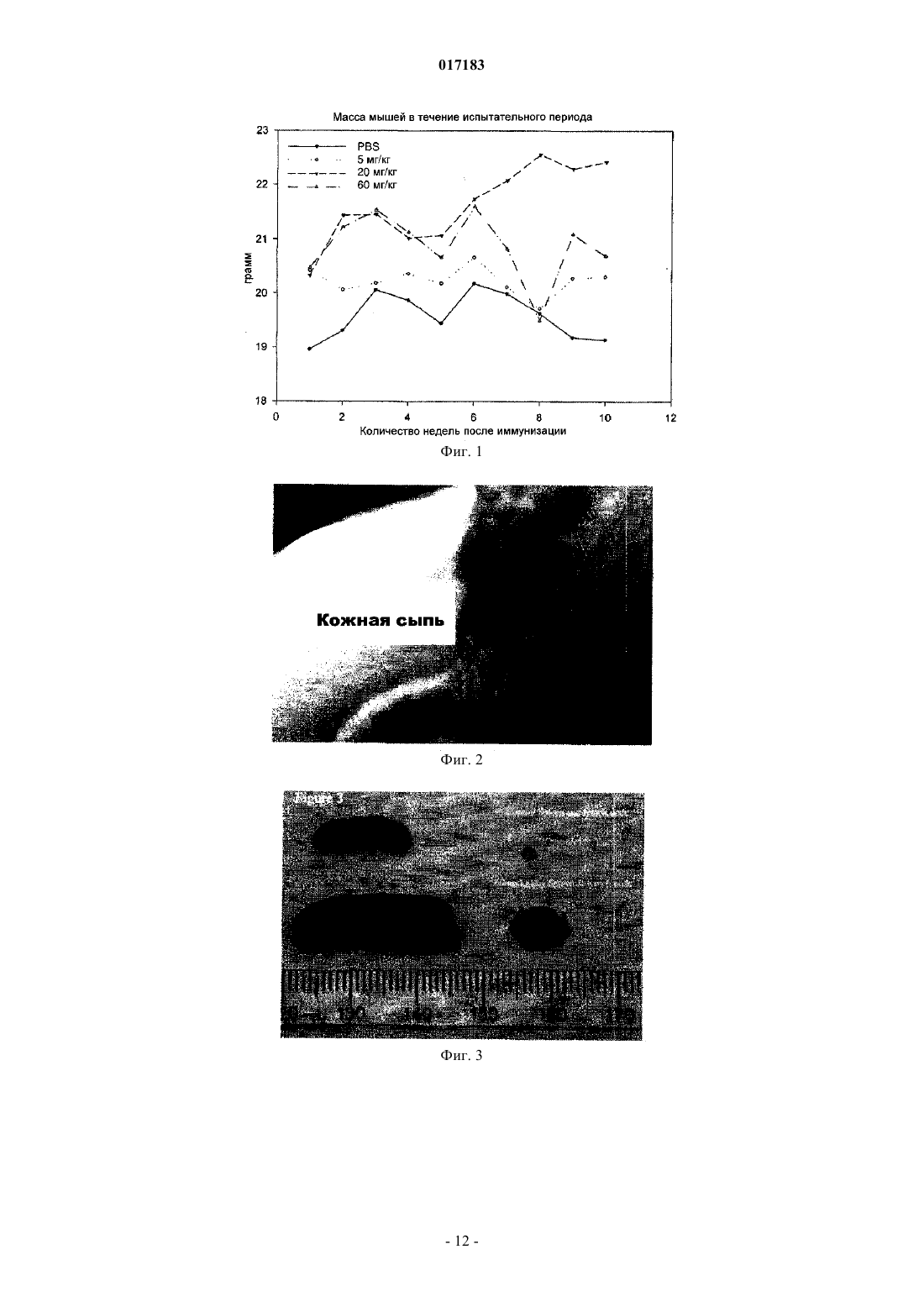
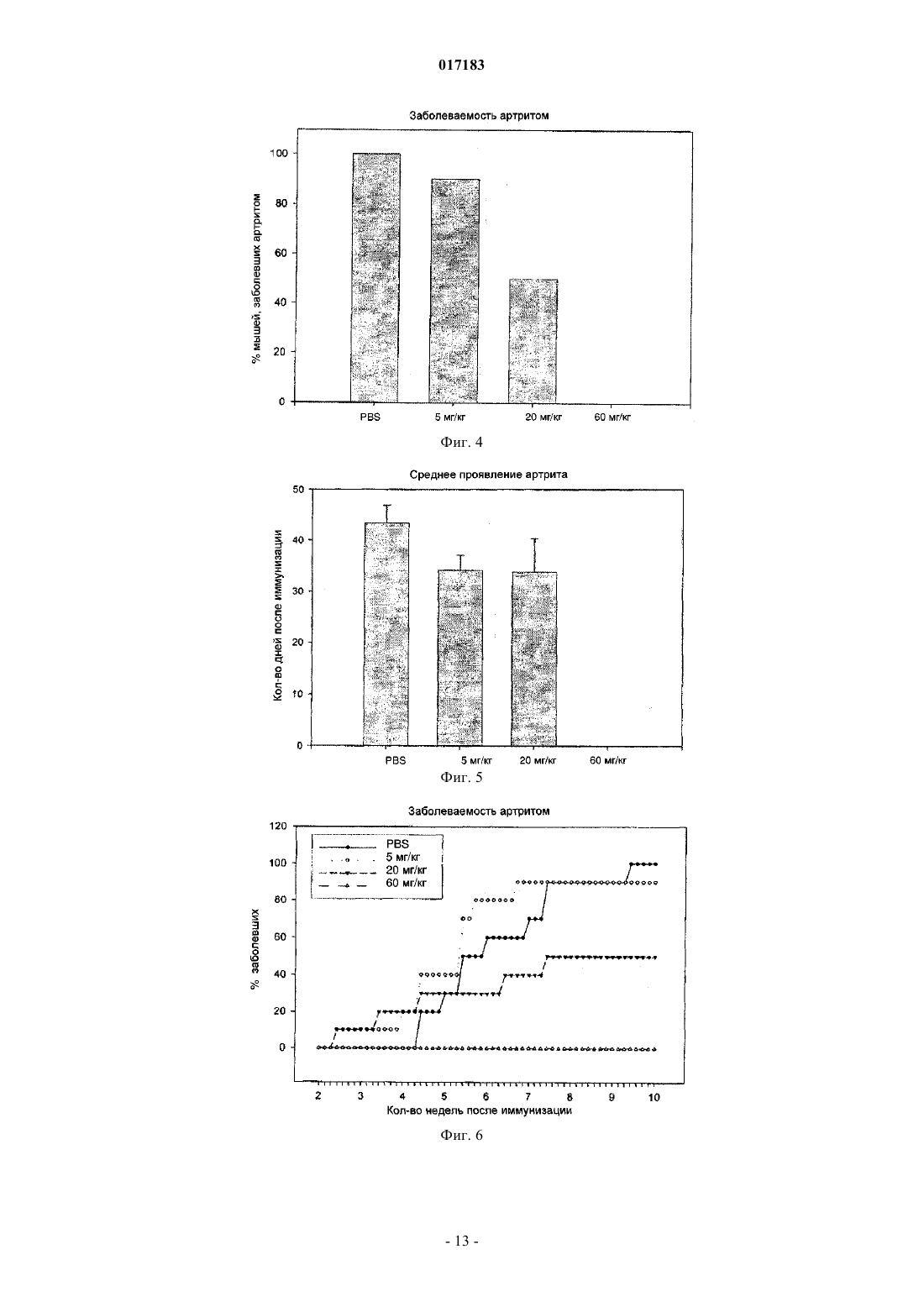
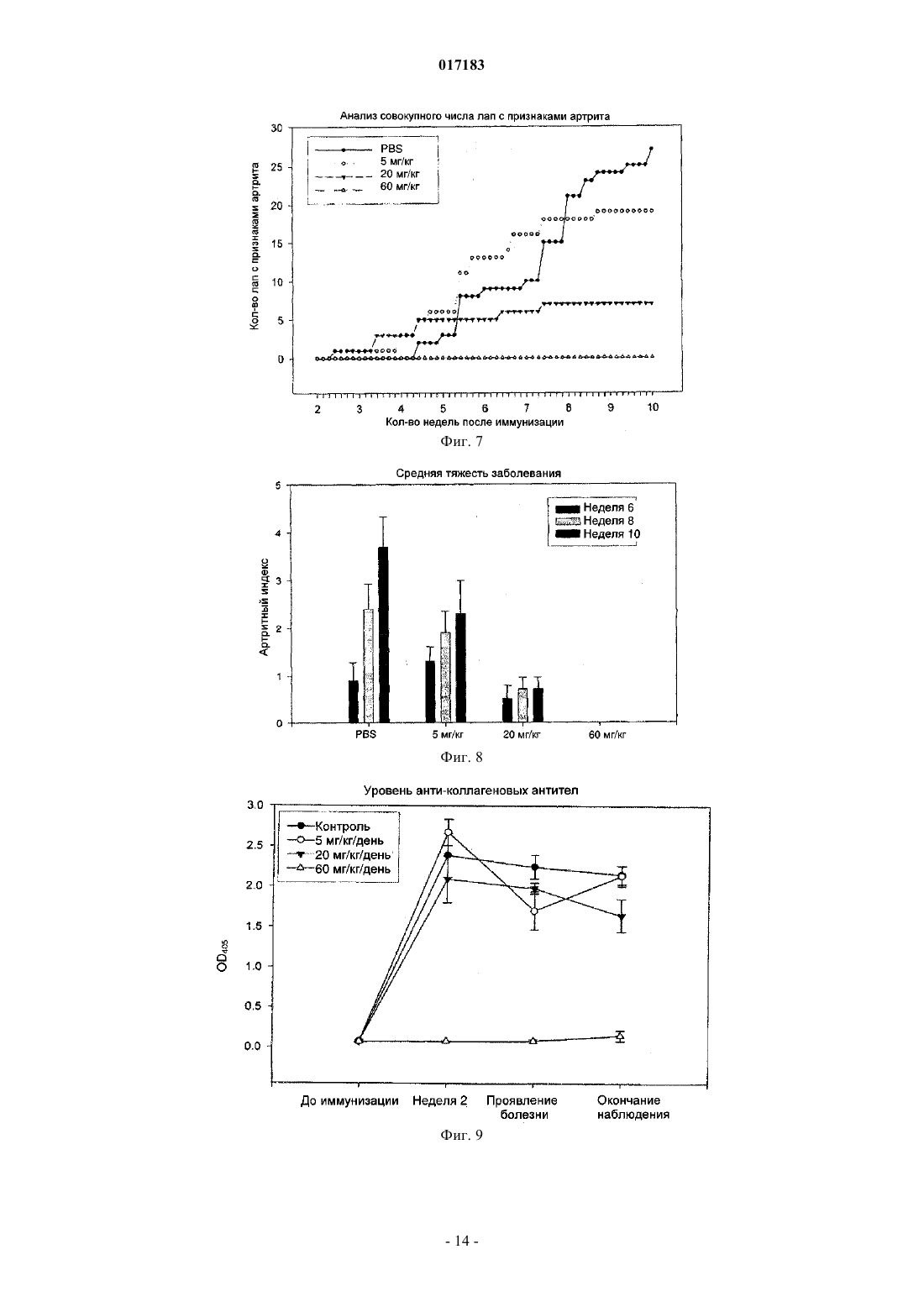
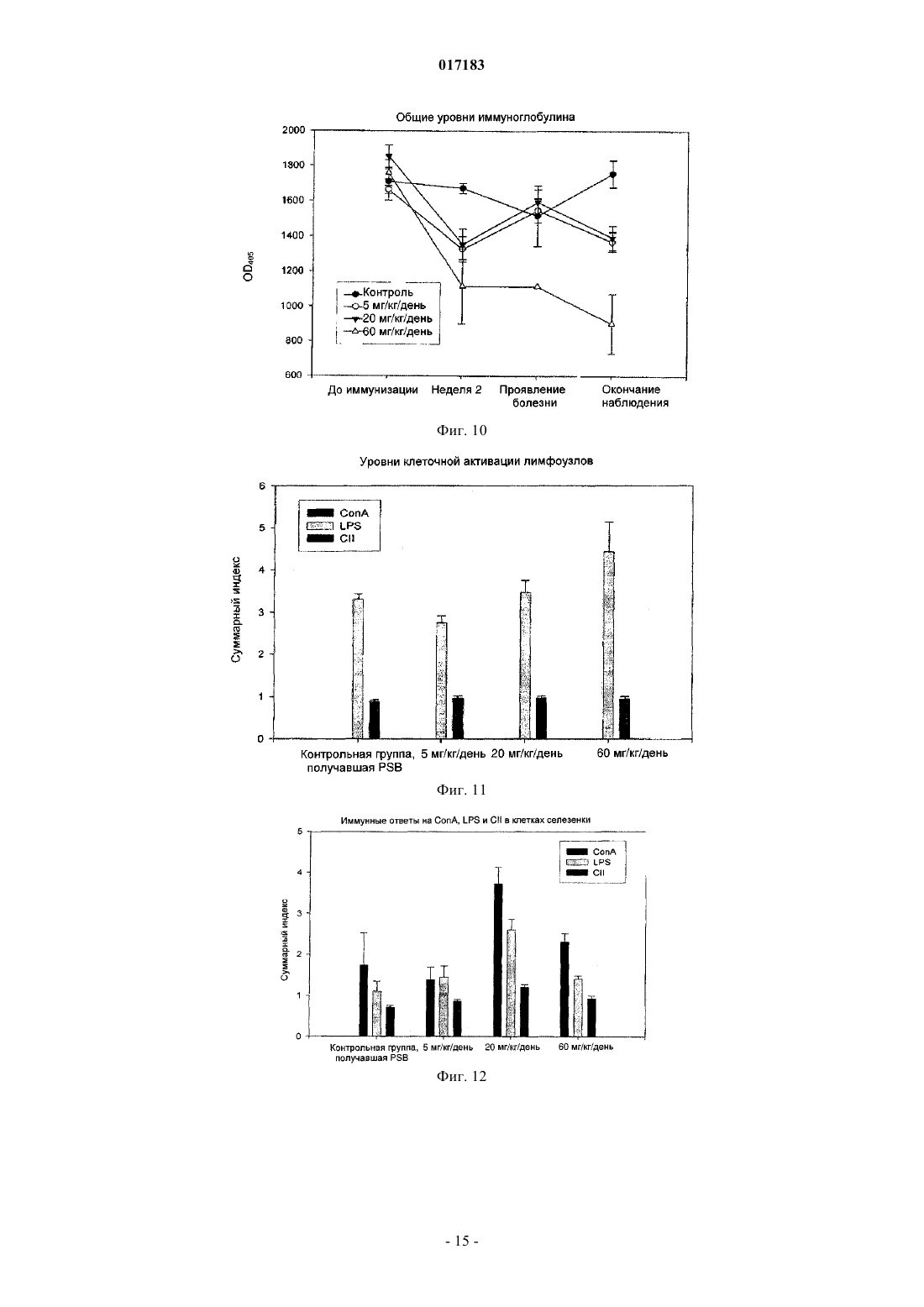
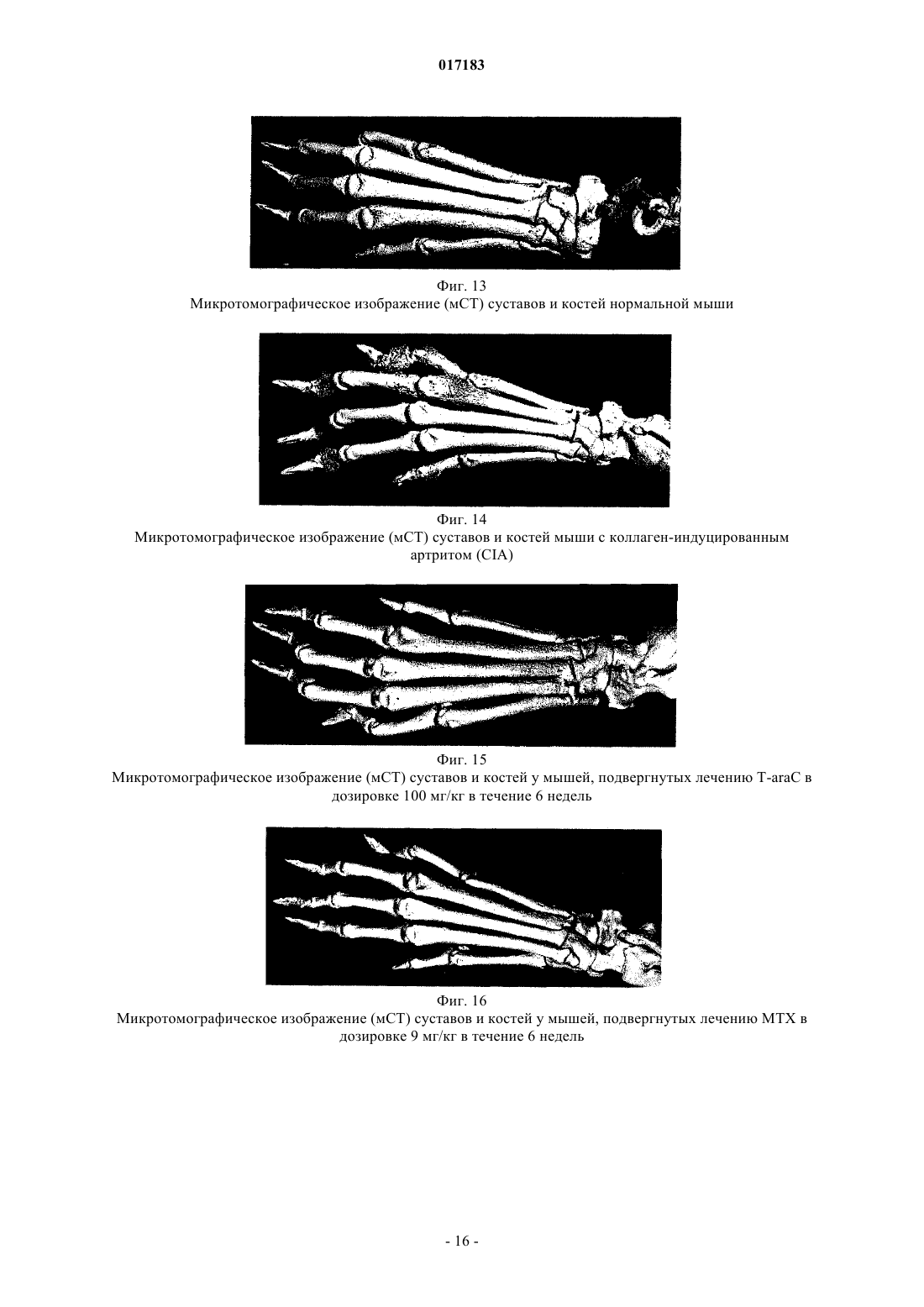
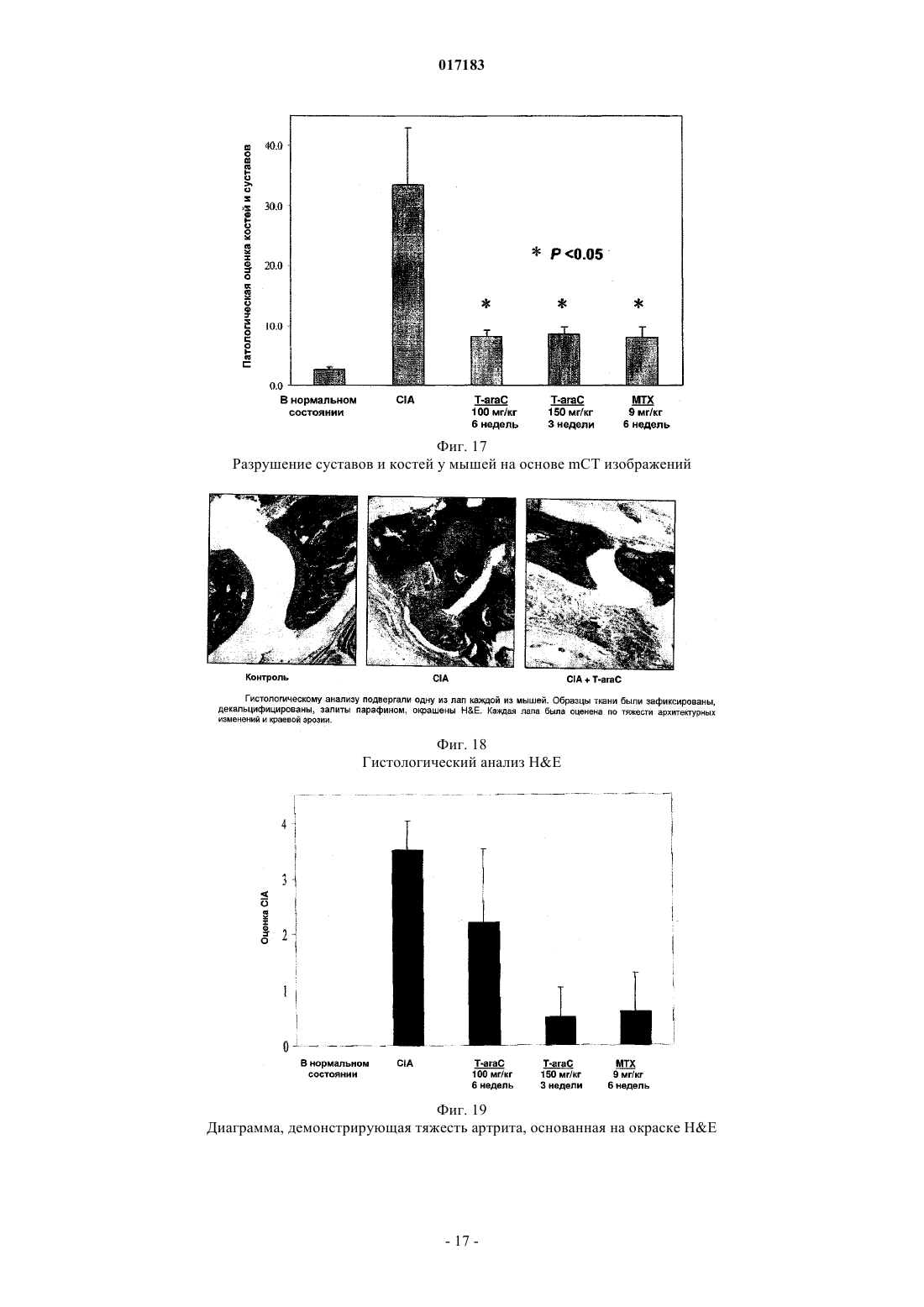
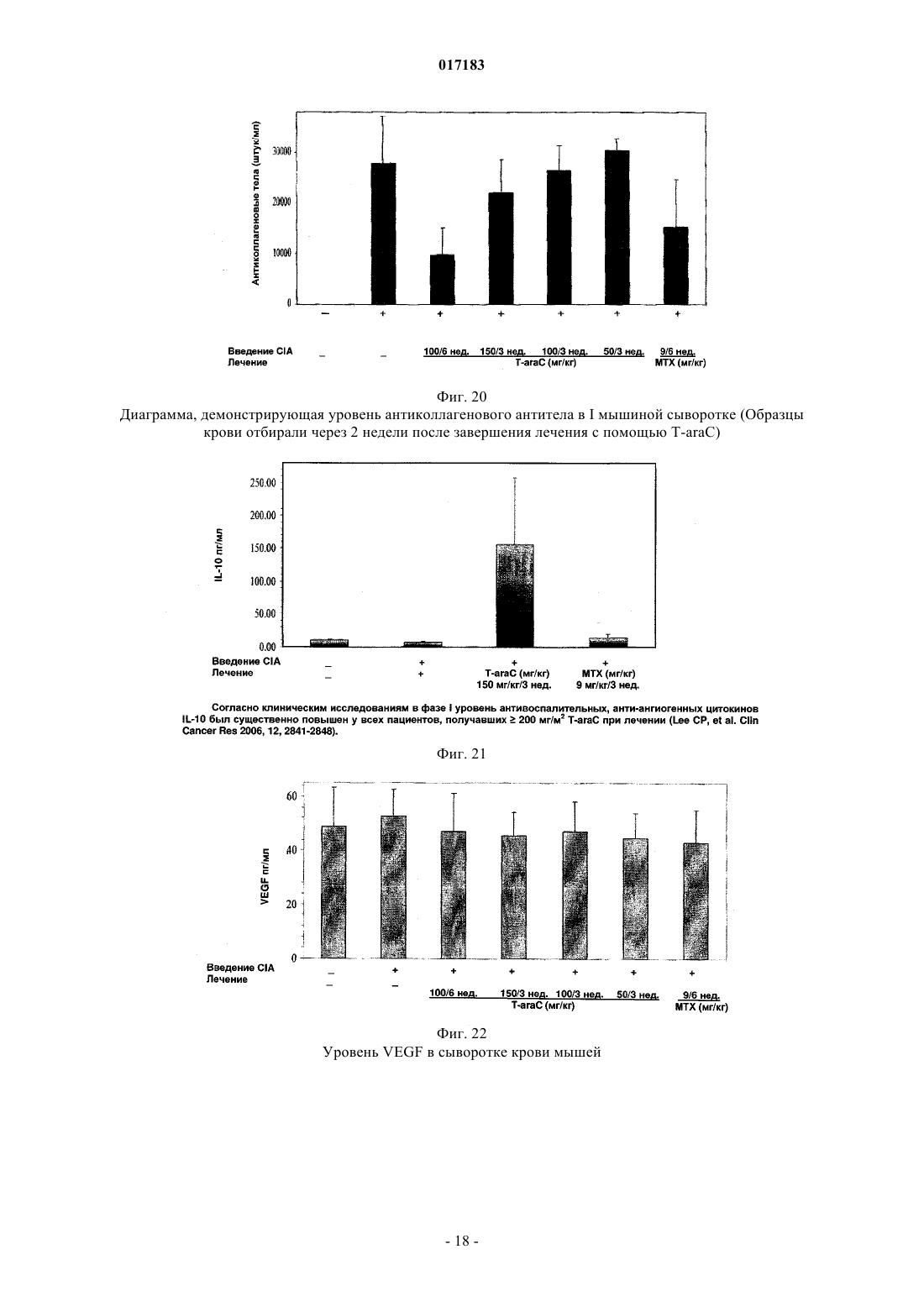
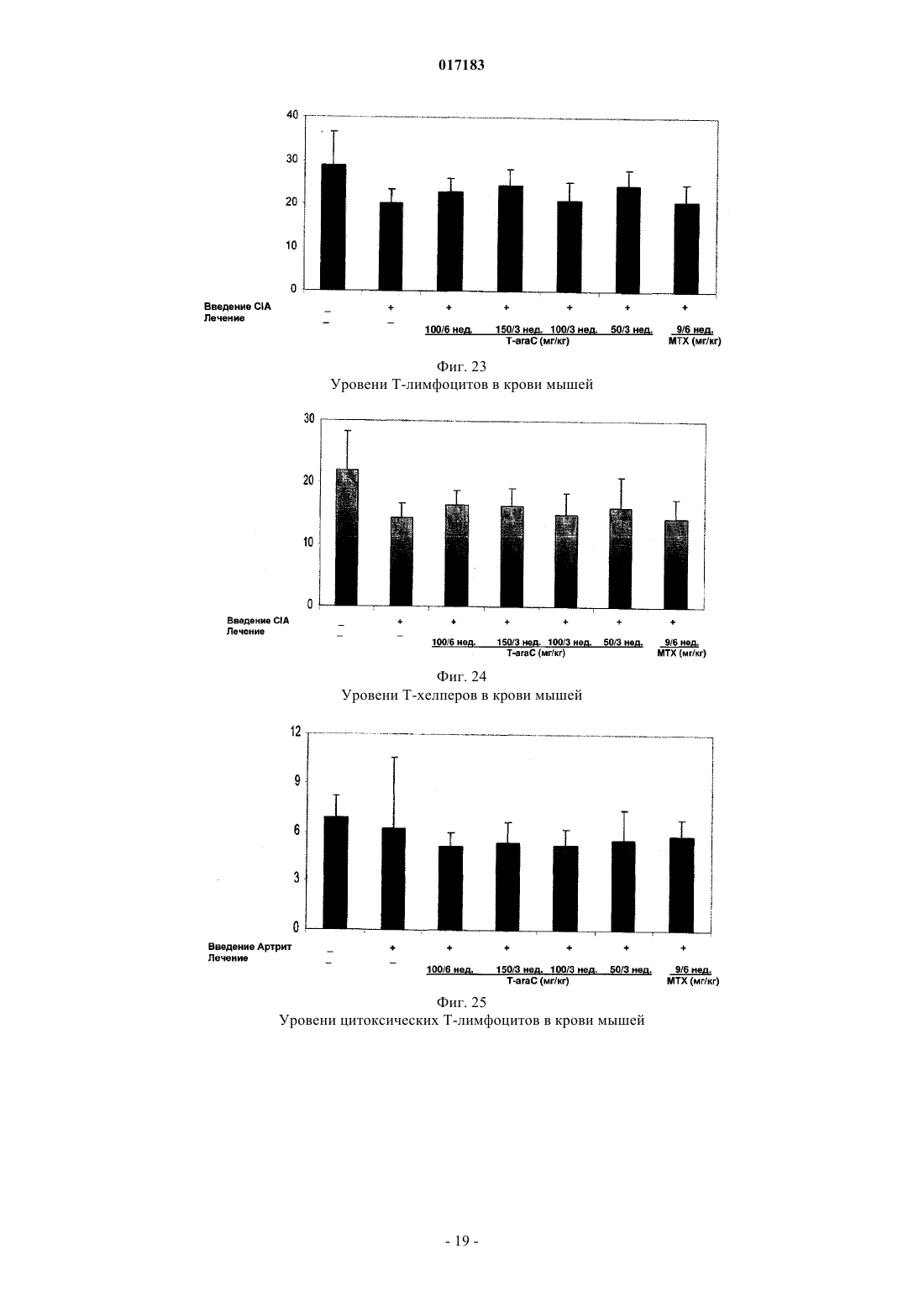
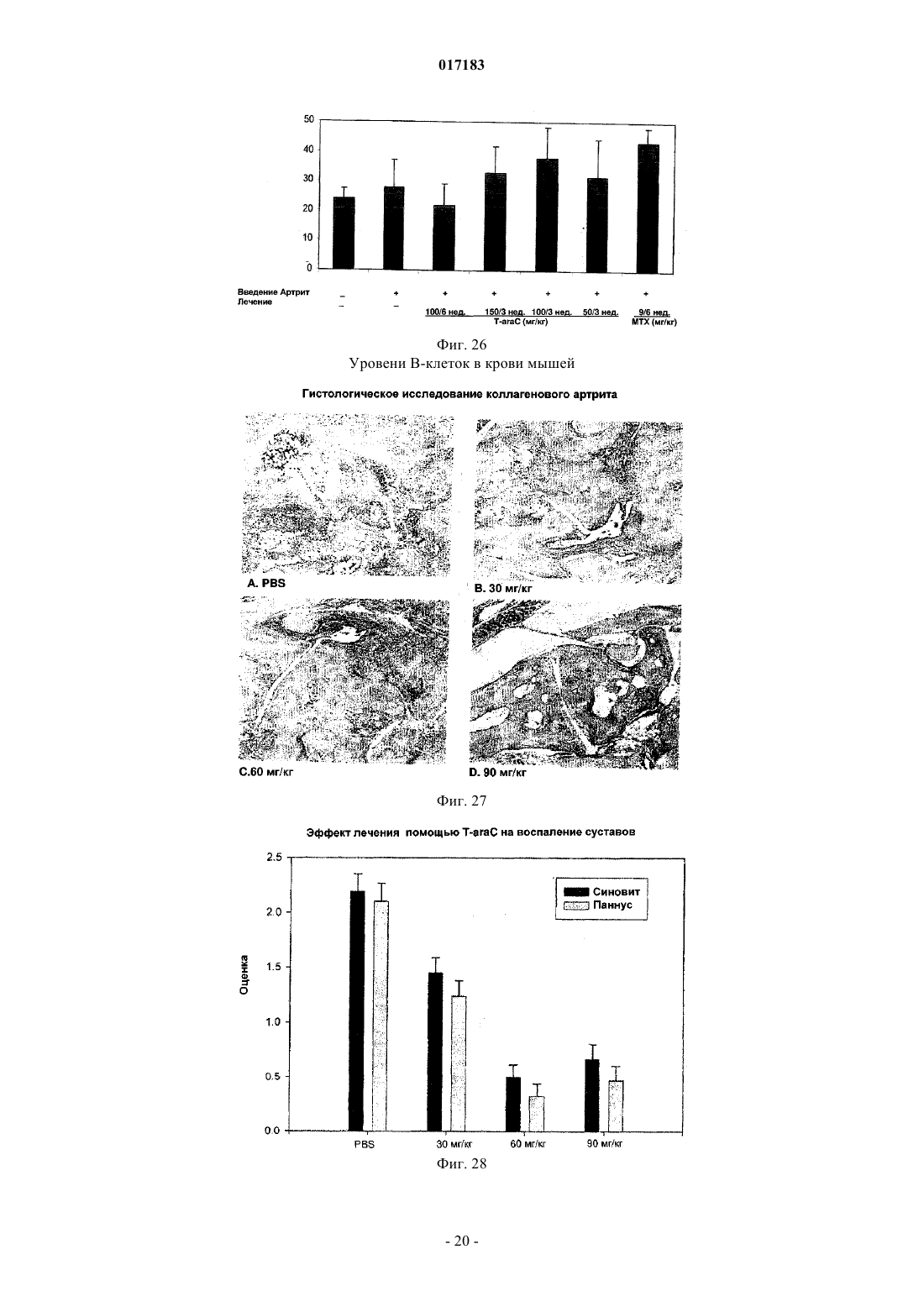
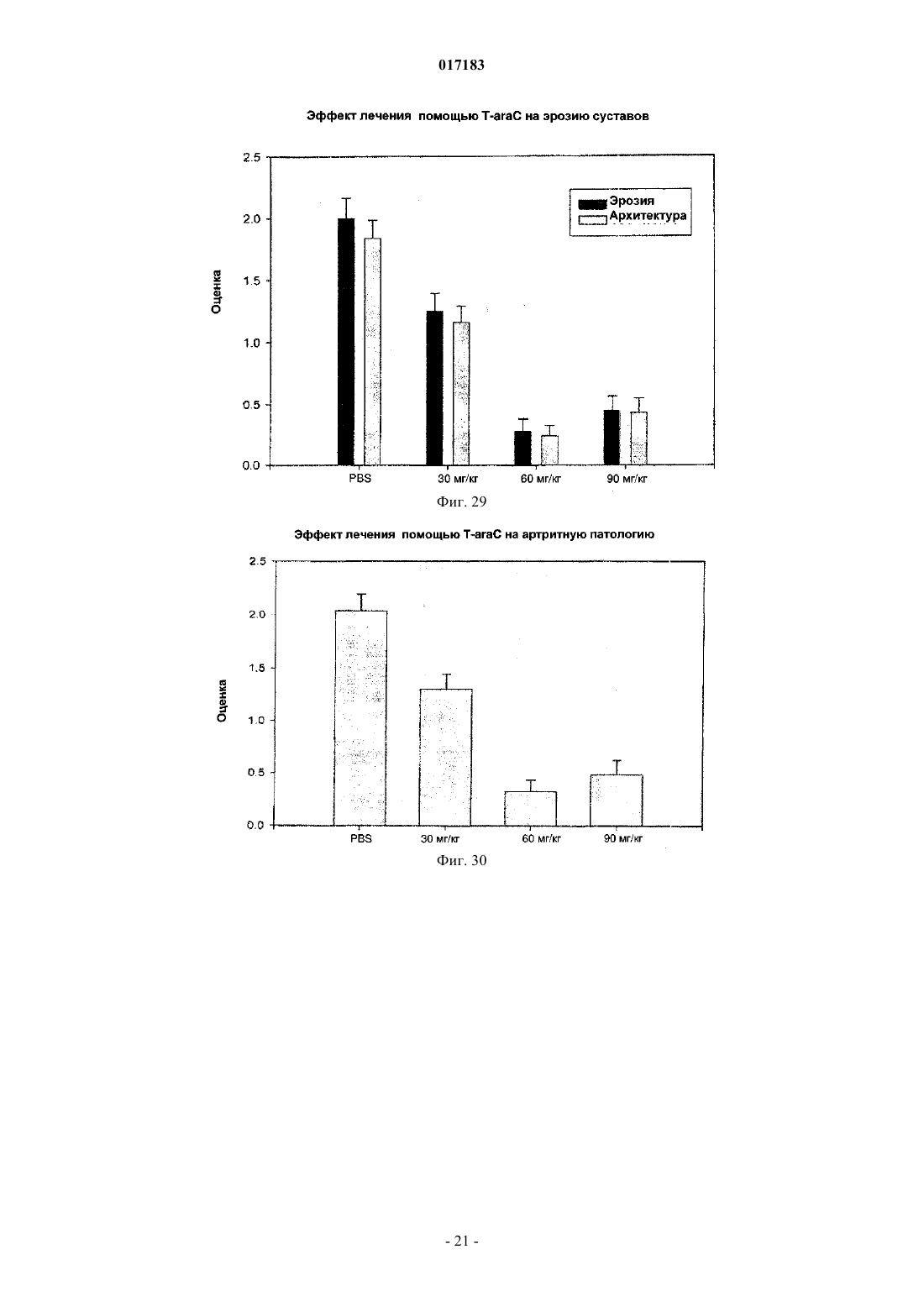
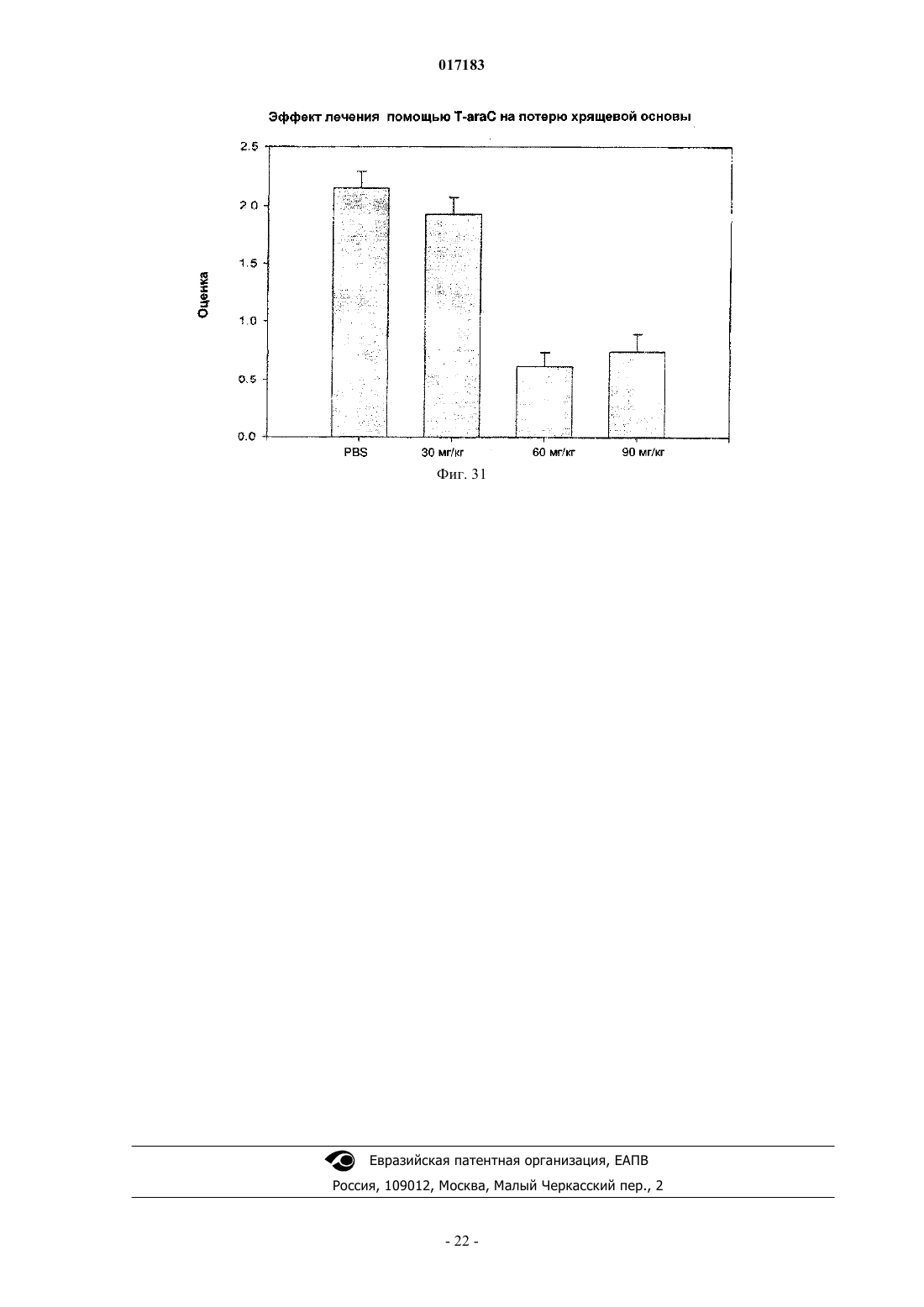
Настоящее изобретение относится к способу лечения и предупреждения артрита, в том числе ревматоидного артрита, который включает введение нуждающемуся в этом реципиенту эффективного для указанных лечения и предупреждения количества 1-(4-тиоDарабинофуранозил)цитозина. 017183 Область техники Настоящее изобретение относится к лечению или предупреждению артрита, в том числе ревматоидного артрита, у нуждающегося в этом пациента путем введения пациенту 1-(4-тиоDарабинофуранозил)цитозина. Соединение, применяемое согласно настоящему изобретению, проявляет хорошую противоартритную активность, а также демонстрирует профилактический эффект полного или,по меньшей мере, частичного предупреждения артрита. Соединение, применяемое в соответствии с настоящим изобретением, имеет бета-конфигурацию, противоположную альфа-конфигурации. Уровень техники Несмотря на то, что разработано большое количество лекарственных средств от артрита, артрит остается широко распространенным серьезным заболеванием в связи с увеличением численности пожилого населения. Даже несмотря на то, что уровень смертности от артрита низок, у индивида, страдающего от этого заболевания, ухудшается качество жизни как следствие низкого уровня активности и производительности. Среди многих видов артрита наиболее важным является ревматоидный артрит. Ревматоидный артрит - это аутоиммунное заболевание, провоцируемое аутореактивными Т лимфоцитами. Т лимфоциты вызывают ревматоидный артрит через гиперчувствительность (аллергию) замедленного типа. До конца еще не понятно, какой антиген распознается Т лимфоцитами, вызывая данное заболевание. Коллаген II типа считается наиболее вероятным, но другие возможности не могут быть исключены. Было обнаружено антигистонное аутоантитело, хотя и нет полной уверенности, что это антитело является причиной заболевания. Многие лекарства, применяемые для лечения ревматоидного артрита, не снимают симптомы полностью. К традиционным лекарствам относятся нестероидные противовоспалительные лекарства (NSAIDs,аспирин, ибупрофен), соли золота, пеницилламин и стероидные гормоны. Стероидные гормоны, которые являются наиболее сильнодействующими и эффективными, при длительном приеме дают побочные эффекты. Недавно начал проходить испытания в качестве нового лечебного средства от ревматоидного артрита рекомбинантый растворимый рецептор фактора некроза опухолей (TNF), играющий основную роль в воспалительном процессе. Тем не менее, для лечения симптомов ревматоидного артрита, таких как воспаление, желательно обеспечение усовершенствованного лекарственного средства. В качестве модели Т-лимфоидального ревматоидного артрита использовали коллагениндуцируемый артрит (CIA) у подопытных животных (Autoimmunity to Type II collagen: Experimentalmodel of arthritis, J. Exp.Med. 1977, 146,857-868). При введении коллагена II типа мышам, склонным к развитию артрита, артрит развивался в течение 2 недель с такими симптомами как образование паннуса, эрозия хрящей и кости. Как и ревматоидный артрит, CIA также дает гуморальный и клеточный иммунные ответы на коллаген. Краткое описание изобретения Настоящее изобретение относится к способу лечения и предупреждения артрита, включающему введение нуждающемуся реципиенту эффективного для указанных лечения и предупреждения количества 1-(4-тиоD-арабинофуранозил)цитозина. Другие задачи и преимущества настоящего изобретения будут очевидны для специалистов в данной области техники из последующего подробного описания, в котором показаны и описаны предпочтительные варианты реализации изобретения путем иллюстрации наилучшего способа реализации. Следует понимать, что изобретение может иметь различные другие варианты реализации, и некоторые частные случаи могут быть изменены очевидным образом без отклонения от сущности настоящего изобретения. В соответствии с этим описание следует рассматривать как иллюстративное, а не ограничительное. На фиг. 1 представлены значения средней массы мышей в течение испытательного периода. На фиг. 2 - распространение кожной сыпи у одной из мышей из группы, получавшей дозу 20 мг/кг/сут. На фиг. 3 - спленомегалия у всех мышей из группы, получавших высокую дозу (60 мг/кг/сут). На фиг. 4 - заболеваемость артритом у мышей, подверженных лечению тестируемым соединением согласно настоящему изобретению в различных дозах. На фиг. 5 - среднее проявление коллаген-индуцированного артрита в различных лечебных группах. На фиг. 6 - заболеваемость артритом как функция времени. На фиг. 7 - анализ совокупного числа лап с признаками артрита у подвергнутых обработке и контрольных животных. На фиг. 8 - анализ средней тяжести заболевания. На фиг. 9 - уровни анти-CII антитела в сыворотке, определенные до эксперимента, через 14 дней после иммунизации, после проявления артрита (в применимых случаях) и после окончания. На фиг. 10 - общие уровни Ig у мышей. На фиг. 11 - уровни клеточной активации лимфоузлов в ответ на митогены Concanavalin А и LPS, и антиген коллагена II типа. На фиг. 12 - иммунный ответ на Con A, LPS и CII в клетках селезенки.-1 017183 На фиг. 13 представлено mCT (микротомографическое) изображение суставов и кости нормальной мыши. На фиг. 14 - mСТ изображение суставов и кости мыши, пораженной CIA. На фиг. 15 - mCT изображение суставов и кости мыши, пораженной CIA и получавшей Т-ara С 100 мг/кг в течение 6 недель. На фиг. 16 - mСТ изображение суставов и кости мыши, пораженной CIA и получавшей метотрексат 9 мг/кг в течение 6 недель. На фиг. 17 - диаграмма, демонстрирующая разрушение суставов и кости у мышей, основанная наmCT изображениях. На фиг. 18 - микрофотографии гистологического анализа НЕ (окраска гематоксилином и эозином). Гистологическому анализу подвергали одну из лап каждой из мышей. Образцы ткани были зафиксированы, декальцифицированы, залиты парафином, окрашены НЕ. Каждая лапа была оценена по тяжести архитектурных изменений и краевой эрозии. На фиг. 19 - диаграмма, демонстрирующая тяжесть артрита, основанная на окраске НЕ . На фиг. 20 - диаграмма, демонстрирующая уровень антиколлагенового антитела в мышиной сыворотке (образцы крови отбирали через 2 недели после завершения лечения с помощью Т-araC). На фиг. 21 - диаграмма, демонстрирующая уровень IL-10 в сыворотке мышей. На фиг. 22 - диаграмма, демонстрирующая уровень VEGF в сыворотке мышей. На фиг. 23 - диаграмма, демонстрирующая уровень Т-лимфоцитов в крови мышей. На фиг. 24 - диаграмма, демонстрирующая уровень Т-хелперов в крови мышей. На фиг. 25 - диаграмма, демонстрирующая уровень цитоксических Т-лимфоцитов в крови мышей. На фиг. 26 - диаграмма, демонстрирующая уровень В-клеток в крови мышей. Фиг. 27A-27D демонстрируют данные гистологических исследований каллоген-индуцированного артрита и способов лечения согласно настоящему изобретению. На фиг. 28 - график, показывающий эффект лечения согласно настоящему изобретению на воспаление сустава. На фиг. 29 - график, показывающий эффект лечения согласно настоящему изобретению на эрозию сустава. На фиг. 30 - график, показывающий эффект лечения согласно настоящему изобретению на артритную патологию. На фиг. 31 - график, показывающий эффект лечения согласно настоящему изобретению на потерю хрящевой основы. Настоящее изобретение относится к способу лечения или предупреждения артрита, включающему введение нуждающемуся реципиенту эффективного для указанных лечения и предупреждения количества 1-(4-тиоD-арабинофуранозил)цитозина Соединением, применяемым в способе согласно настоящему изобретению, является 1-(4-тиоDарабинофуранозил)цитозин, также упоминаемые как Т AraC. Соединение, применяемое согласно настоящему изобретению может быть получено при помощи усовершенствованного способа, раскрытого в патенте США 6576621, содержание которого включено в настоящее описание посредством ссылки. Примерами типов артрита согласно настоящему изобретению являются ревматоидный артрит и остеоартрит. Реципиентами, подвергаемыми лечению согласно настоящему изобретению, являются млекопитающие, в частности человек, и домашние животные (например, собаки и кошки). Следующие неограничивающие примеры объясняют настоящее изобретение и демонстрируют эффективность соединения, применяемого согласно данному изобретению для лечения и предупреждения артрита. Представленные ниже данные показывают заметное антиартритное действие исследуемого соединения (т.е.1-(4-тиоD-арабинофуранозил)цитозина) при профилактике коллаген-индуцированного артрита. Указанное лекарственное средство оказывает сильное дозозависимое действие, начиная от полного предотвращения начала заболевания при введении 60 мг/кг/сут и до значительного снижения заболеваемости у мышей при введении 20 мг/кг/сут. Несмотря на то, что точный механизм действия лекарственного средства не может быть определен из текущего эксперимента, отмечено, что лекарственное средство оказывает действие на развитие артрита, снижая количество пораженных лап у крыс с развившимся артритом, а также снижает тяжесть артрита при поражении суставов лап. Возможно также, что выраженное снижение титров анти-CII антител является ключевым фактором, определяющим противоартритное действие, наблюдаемое в данном исследовании. Тем не менее, необходимо отметить, что общий уровень иммуноглобулина также снижался, что свидетельствало об общем иммунодепрессивном эффекте. Значительное снижение эффекта ответа на Т-лимфоцитный митоген ConA наблюдали в клетках лимфоузлов, а об общем снижении лимфоцитной активности судили по активации ответов клеточной среды. Некоторый уровень токсичности лекарственного средства наблюдали как при дозе 20 мг/кг/сут (проявление не-2 017183 летальной кожной сыпи у 20% мышей), так и при дозе 60 мг/кг/сут (20%-ая кожная сыпь с одним смертельным исходом и выраженная спленомегалия). В целом, исследования продемонстрировали многообещающие предклинические результаты, свидетельствующие о сильно выраженной противоартритной активности указанного соединения. Коллагенный артрит вызывали иммунизацией восприимчивой линии мышей II типом коллагена,основного компонента суставного хряща (1). При этом наблюдали развитие прогрессирующего воспалительного артрита у большинства иммунизованных животных, который клинически характеровался эритемой и отеком с увеличением размера пораженных лап, как правило на 100%. Для оценки развития болезни до разрушения сустава и спондилеза был разработан клинический оценочный индекс (2). Гистопатология пораженных суставов выявила синовит, образование паннуса и разрушение хряща и кости, которые также могут быть выражены индексом. Иммунологические лабораторные данные включают высокий уровень антител на коллаген II типа и гипергаммаглобулинемию. Указанная модель сейчас широко используется для исследований иммунотерапевтических подходов к заболеваниям суставов (3) и успешно применяется для изучения и биологических и фармакологических агентов для лечения ревматоидного артрита (RA) (4; 5). Этот эксперимент оценивает влияние исследуемого соединения на CIA с использованием прафилактического протокола при введении трех доз после иммунизации коллагеном II типа. При исследованиях использовали следующие материалы и методы. Исследуемые животные и протокол введения соединения 40 DBA/1 LacJ мышей в возрасте 8-10 недель были получены из Jackon Labs, акклиматизированы в испытательной установке в течение 10 дней перед проводимым исследованием. Все животные перед началом исследования весили 16 г. Дозируемый раствор готовили еженедельно и хранили при 4C. Мышей распределили по 4 экспериментальным группам: Группа 1. 100 мкл стерильного раствора (физиологический раствор, содержащий 0,05% Tween 60) для ежедневного интраперитониального введения. Группа 2. 100 мкл стерильного раствора, содержащего соединение в дозировке 5 мг/кг/сут для интраперитониального введения. Группа 3. 100 мкл стерильного раствора, содержащего соединение в дозировке 20 мг/кг/сут для интраперитониального введения. Группа 4. 100 мкл стерильного раствора, содержащего соединение в дозировке 60 мг/кг/сут для интраперитониального введения. Через 3 дня после получения начальной дозы всем мышам ввели 100 мкл раствора бычьего коллагена II типа в полном адъюванте Фрейнда (FCA = Freund's complete adjuvant) интрадермально в основание хвоста. Проводили ежедневный осмотр мышей для регистрации начала болезни. Еженедельно проводили взвешивание мышей и отмечали общее состояние их здоровья. Пораженных артритом животных клинически обследовали 5 раз в неделю до наступления 10 недель после иммунизации, при этом обследование лап проводили три раза в неделю. Мыши без признаков артрита через 10 недель после иммунизации были признаны не подверженными заболеванию. Иммунологическое исследование: У всех мышей брали кровь перед началом исследования, затем через 2 недели после иммунизации,сразу после начала артрита (в применимых случаях) и в конце исследования. Сыворотку отделяли и хранили при -80 С. Проводили ELISA анализ для определения (1) уровня антител на коллаген II типа и (2) уровня общего иммуноглобулина. После умерщвления удаляли селезенку и лимфоузлы и готовили отдельные клеточные суспензии. По стандартным методикам определяли митогенные ответы на ConA иLPS и пролиферативные ответы на коллаген II типа. Анализы: Проводили надлежащее статистическое сравнение, чтобы выявить влияние соединения на (I) заболеваемость, (II) время начала болезни, (III) распухание лап и (IV) развитие болезни, основанное на совокупном артритном показателе. Иммунологические данные анализировали для исследования влияния соединения на (I) ответ антител на коллаген II типа, (II) общий уровень иммуноглобуина, (III) Тлимфоцитный митогенный ответ, (IV) В-клеточный митогенный ответ и (V) аутогенный специфический(коллаген) пролиферативный ответ. Результаты Побочные эффекты и токсичность Средний вес мышей после исследования представлен на фиг. 1. Несмотря на случайную выборку по группам мыши в контрольной группе весили незначительно меньше мышей в лечебных группах в начале опыта, и их вес последовательно снижался по мере появления заболевания, что типично для коллагенового артрита. Сходное изменение веса наблюдали у мышей, получавших исследуемое соединение в дозе 5 мг/кг/сут. С другой стороны, мыши, получавшие исследуемое соединение в дозе 20 мг/кг/сут, набирали вес в течение исследования с такой же скоростью, что и нормальные животные. Это привело к значительной разнице между контрольными мышами и мышами данной лечебной группы, начиная с 5 недели. Мыши, получавшие 60 мг/кг/сут, набирали вес с нормальной скоростью вплоть до недели 6, но затем быстро теряли вес между неделями 6 и 8, после чего их вес снова восстанавливался почти до нормально-3 017183 го уровня. Одно из животных из группы, получавшей высокую дозу (60 мг/кг/сут), было подвернгнуто эвтаназии, поскольку у него развилась заметная язвенная кожная сыпь с проявлением признаков вторичной инфекции. Легкая кожная сыпь была отмечена у другой мыши из группы с дозой 60 мг/кг/сут и у 2 животных в группе с дозой 20 мг/кг/сут (фиг. 2). Эти проявления болезни регулировали приостановкой терапии на 3-4 дня, после чего кожа становилась менее воспаленной и терапию продолжали без ухудшения состояния. После завершения исследования сыпь обычно рассасывалась с остаточными явлениями легкого фиброза. С пораженных участков проводили кожную биопсию, и данные патологического исследования изучаются в настоящий момент. Вскрытие выявило выраженную спленомегалию у всех мышей в группе с высокой дозой (60 мг/кг/сут) (фиг. 3), а взвешивание селезенки перед гомогенизацией ткани выявило примерно пятикратное повышение веса по сравнению с контрольной группой, получавшей фосфатный буферный раствор (PBS). У некоторых мышей наблюдали также лимфоденопатию, но с меньшей заболеваемостью и интенсивностью, чем в случае обследования селезенки. Эффект не наблюдали в группах с более низкой дозой. В целом, при 20 и 5 мг/кг/сут лекарственное средство достаточно хорошо усваивалось и все мыши из этих групп пережили период исследования. Заболеваемость артритом и проявление артрита Заболеваемость артритом у мышей, получавших исследуемое соединение согласно данному изобретению, в различных дозах представлена на фиг. 4. Наиболее заметной характерной чертой исследования была полная защита мышей, получавших дозировку 60 мг/кг/сут, при этом заболело 0 животных из 10 (0/10) по сравнению с контрольной группой PBS со 100%-ой заболеваемостью (10/10) (р 0,001). Статистически высокозначимое понижение заболеваемости (р 0,01) наблюдали также у мышей, получавших исследуемое соединение в дозе 20 мг/кг/сут, в то время как заболеваемость (9/10) у мышей, получавших 5 мг/кг/сут, незначительно отличалась от контрольной. Эти данные свидетельствуют о явной зависимости заболеваемости коллаген-индуцированным артритом от дозы. Среднее проявление коллаген-индуцированного артрита в различных лечебных группах представлено на фиг. 5. Не наблюдали никакой существенной разницы между группами в сроках проявления артрита. Хотя у мышей контрольной группы в среднем проявление артрита наступало несколько медленнее с таковым для мышей, подвергаемых лечению (43 дня против 34 дней), эта разница не была статистически значимой. Заболеваемость артритом во времени представлена на фиг. 6. Скорость проявления заболевания у подвергаемых лечению мышей и животных контрольной группы примерно одинакова в течение первых 5 недель исследования. С этого момента скорость проявления заболевания значительно замедляется в группе 20 мг/кг/сут (но не в группе 5 мг/кг/сут). Значительное снижение заболевания наблюдалось в группе 20 мг/кг/сут со дня 50 до окончания лечения и конечная степень заболевания после окончания опыта существенно отличалось (р 0,01) от контрольной группы. Тяжесть заболевания и прогрессивный анализ совокупного числа артритных лап (фиг. 7) у подвергаемых лечению и контрольных животных выявили значительное влияние терапии с исследуемым соединением на развитие коллаген-индуцируемого артрита. У контрольных мышей, получавших PBS, всего 27 из 40 лап проявляли признаки артрита, что статистически очень значимо (р 0,001) отличается от мышей, получавших 60 мг/кг/сут (0/40) или 20 мг/кг/сут ( 7/40). Число пораженных лап у мышей, получавших 5 мг/кг/сут, было понижено (19/40) по сравнению с мышами контрольной группы, но это не являлось статистически значимой разницей. Сходные данные наблюдали при анализе средней тяжести заболевания, представленной на фиг. 8. Выраженное ухудшение заболевания, наблюдаемое у контрольных мышей с недели 6 до окончания исследования, типично для коллагенного артрита. Прогрессирование тяжести заболевания было отчетливо зафиксировано у мышей, получавших 20 мг/кг/сут со значительным понижением ( р 0,04), наблюдаемым на неделе 6, при этом указанная разница становилась высокозначимой (р 0,001) с недели 8 до конца исследования. Снижение тяжести заболевания было менее очевидным у мышей, получавших 5 мг/кг/сут,но оно достигло значительного уровня ( р 0,05) к концу исследования (неделя 10). Уровни антител на коллаген II типа Уровни анти CII-антител в сыворотке, взятой перед опытом, 14 дней после иммунизации, после проявления артрита (в применяемых случаях) и после окончания представлены на фиг. 9. Активность анти-СII была полностью подавлена у мышей, получавших Т-araC в дозе 60 мг/кг/сут,что обеспечивало выявление механизма действия антиартритной активности. Антиколлагеновые антитела также были значительно понижены (р 0,02) у мышей, получавших 20 мг/кг/сут, ниже уровня, наблюдавшиеся у контрольных мышей в конце опыта, и существенное понижение (р 0,01) наблюдали у мышей, получавших 5 мг/кг/сут во время проявления заболевания. Общие уровни иммуноглобулина Общие уровни Ig у мышей представлены на фиг. 10. Не наблюдалось существенной разницы в данном показателе между группами перед началом опыта (по показаниям предварительного анализа крови).-4 017183 Уровни Ig во всех лечебных группах опустились ниже контрольных уровней через 2 недели после начала обработки, достигнув статистического снижения при дозах 5 мг/кг/сут (р 0,05), 20 мг/кг/сут (р 0,05), 60 мг/кг/сут (р 0,005). Тем не менее, не было значительной разницы между мышами в каждой из групп при проявлении заболевания. В конце исследования уровни Ig у мышей, получавших дозу 60 мг/кг/сут, были очень низкими, а уровни у мышей, получавших 5 или 20 мг/кг/сут, были значительно (р 0,02) ниже уровней у контрольных мышей. Митогенные и антигенные пролиферативные ответы Уровни клеточной активации лимофоузлов в ответ на митогены Concanavalin А и LPS и антиген на коллаген II типа представлены на фиг. 11. Ответ на Т-лимфоцитный митоген конкавалин А был значительно понижен в группах, получавших Т-araC в дозах 5 мг/кг/сут (р 0,04) и 60 мг/кг/сут (р 0,001), а у мышей, получавших 20 мг/кг/сут, понижение приближалось к статистической значимости (р=0,08). Интересно, что ответ на LPS (главным образом В клеточный митоген) не подвергался значительному влиянию. Ответ на стимулирующий антиген (коллаген II типа) также не поддавался воздействию при лечении. Ответ на ConA, LPS и CII в клетках селезенки представлен на фиг. 12. В отличие от подавления, наблюдаемого в клетках лимфоузлов, в данном случае клеточная стимуляция оказалась значительно повышенной ( р 0,005) у мышей, получавших исследуемое соединение в дозе 20 мг/кг/сут. Однако анализ данных показал, что уровни клеточной активации среды (нестимулированной) у мышей, получавших 20 мг/кг/сут (0,53) и 60 мг/кг/сут (0,8) ниже уровня клеточной активации у контрольных мышей (0,77) и эта разница статистически значима (р 0,001 и р 0,05 соответственно). Следовательно, это значительное увеличение индекса стимуляции является математическим, происходящим скорее из-за понижения базовой линии клеточной активности, чем из-за возрастания пролиферации. Приведенные выше результаты показывают выраженное антиартритное действие исследуемого соединения согласно настоящему изобретению на коллаген-индуцируемый артрит при использовании профлактического протокола. Указанное лекарственное средство проявляет сильный дозозависимый эффект с полным предотвращением проявления заболевания при дозе 60 мг/кг/сут и значительным снижением заболеваемости у мышей при приеме 20 мг/кг/сут. Лекарственное средство проявляет выраженный эффект на развитие болезни, значительно понижая число пораженных лап у мышей с развитым артритом, а также понижает тяжесть артрита пораженных суставов лап. Поскольку точный механизм действия не может быть определен из текущего эксперимента, заметное снижение титров анти-СН антител возможно является ключом к антиартритной активности, наблюдаемой в настоящем исследовании. Тем не менее, следует отметить, что общие уровни иммуноглобулина также снижаются, что указывает скорее на генерализованный иммунодепрессивный эффект, чем на специфическое понижение аутоиммунной активности. Выраженное снижение ответа на Т лимфоцитный митоген ConA наблюдали в клетках лимфоузлов, а о генерализованном понижении лимфоцитной активности свидетельствовала активация ответов клеток среды. Определенный уровень токсичности лекарственного средства наблюдали в группах с дозой 20 мг/кг/сут (с нелетальной кожной сыпью у 20% мышей) и в группе с дозой 60 мг/кг/сут (20% кожной сыпи с одной смертью и выраженной спленомегалией). В целом, лекарственное средство показало многообещающие преклинические результаты, убедительно подтверждающие антиартритную активность. В дальнейших исследованиях мышам вводили коллаген II в полном адъюванте Фрейнда (CFA) в день 0 в качестве первичной иммунизации и коллаген II без CFA в день 21 в качестве бустер-инъекции. Шестинедельное лечение начали на 2 день, а трехнедельное - на 19 день. Лечение в каждом случае закончили на 40 день. Образцы тканей и крови для патологического и иммунологического анализа отобраны на 54 день. План исследования определения Т-araC активности на модели CIA мышей Рентгеновская микротомография (mCT) обеспечивает проведение неразрушительной трехмерной внутренней микроскопии для выявления разрушения и эрозии костей и суставов у мышей. Эту методику использовали для исследования эффективности Т-araC (1-(4-тиоD-арабинофуранозил)цитозин) при лечении артрита. Для примера см. фиг. 13-16, на которых соответственно представлены mCT изображения суставов и костей у нормальных мышей, CIA мышей, CIA мышей, получавших Т-araC и CIA мышей,получавших метотрексат. Указанные mCT изображения с трехмерной внутренней микроскопией и коли-5 017183 чественный анализ эрозии суставов и костей (фиг. 17) показали значительную антиартритрную активность Т-araC с двумя лечебными дозировками и схемами. T-araC показал активность в CIA модели,сходную с метотрексатом, который является признанным препаратом в лечении ревматоидного артрита. Гистологический анализ лап мышей проводили для оценки воспалительных и эрозионных изменений вокруг мышиных суставов. Данные mCT анализа также показали значительную антиартритную активность Т-araC (фиг. 18 и 19). При этом согласно клиническим исследованиям в фазе I, в сыворотке крови мышей после приема Т-araC значительно повышается уровень антивоспалительного и антиантигенного цитокина IL-10 (фиг. 21). Фактор роста эндотелия сосудов (VEGF), содержавшийся в сыворотке мышей,исследовали методом твердофазного иммуноферментного анализа ELISA и не обнаружили никакой существенной разницы между различными лечебными группами.(фиг. 22). Через 2 недели после приема ТaraC определили количество Т-лимфоцитов и В-клеток в образцах крови мышей и не обнаружили уменьшения количества ни одного из типов клеток, что указывало бы на какое-либо иммунодепрессивное воздействие на Т-лимфоциты или В-клетки, которое могло быть поставлено в зависимость от приема Т-araC. В заключение, это преклиническое исследование с моделью CIA мышей совместно с лечебным планом, представленным в таблице, показало, что антиартритная активность Т-araC является статистически значимой в то время как никакой заведомой токсичности, связанной с приемом Т-araC, обнаружено не было. В еще одном исследовании были отобраны шестьдесят DBA/1 LacJ мышей в возрасте 8-10 недель и акклиматизированы в опытной установке минимум в течение 10 дней перед началом исследования. Перед началом исследования все животные весили 16 г, мышам вводили по 100 мкг бычьего коллагена II типа в полном адъюванте Фрейнда (FCA) интрадермально в основание хвоста и проводили ежедневное обследование для выявления начала заболевания, которое протоколировалось. При первом проявлении клинических симптомов артрита мыши были распределены по 4 лечебным группам: Группа 1. 100 мкл стерильного растворителя для орального введения 3 раза в неделю. Группа 2. 100 мкл стерильного растворителя, содержащего Т-araC в дозировке 30 мг/кг/сут для орального введения. Группа 3. 100 мкл стерильного растворителя, содержащего Т-araC в дозировке 60 мг/кг/сут для орального введения. Группа 4. 100 мкл стерильного растворителя, содержащего Т-araC в дозировке 90 мг/кг/сут для орального введения. Мышей ежедневно взвешивали и отмечали общее состояние их здоровья. Животных клинически обследовали 5 раз в неделю в течение 10 недель после начала заболевания, при этом 3 раза в неделю проводили обследование лап . Гистологическое обследование После завершения клинического обследования у всех мышей удаляли конечности и хранили в нейтральном буференом растворе формалина. Суставы декальцифицировали в течение 18 дней в 10% муравьиной кислоте, дегидратировали и залили в парафиновые блоки. Сделали срезы вдоль продольной оси, подготовили к исследованию и окрасили гематоксилином и эозином или толуидиновым голубым. Отдельные экземпляры разрезали приблизительно по средней линии и затем сагитальные центральные пробы подготовили для обследования. Это обеспечивало полную географическую оценку. Готовили от 5 до 10 проб (обычно от 4 до 6 проб на образец). После окрашивания образцы намертво закрывали покровными стеклами. Минимум 3 отдельных среза на экземпляр оценивали слепым образом при заведомо неизвестном распределении по группам. На передних конечностях оценивали все локтевые, лучезапястные и пястные суставы, в то время как все коленные, голеностопные и метатарзальные (плюсневые) суставы оценивали на задних конечностях. Пальцы не оценивали, поскольку при изготовлении срезов была удалена большая часть проксимальных межфаланговых суставов. Образцы оценивали на наличие синовита, образование паннуса, краевой эрозии, архитектурных изменений (в основном неполный вывих) и разрушения. Затем каждому срезу давали общую оценку, основанную на этих коллективных пунктах. Система оценки была следующей: Синовит оценивали по толщине синовиальных мембран со счетом: 0 - при толщине меньше 3 клеток 1 - при толщине в 3-5 клеток 2 - при толщине в 6-10 клеток 3 - при толщине в 10-20 клеток 4 - при толщине 20-30 клеток Образование паннуса оценивали следующим образом: 0 - нет паннуса 1 - наличие микроворсин 2 - отчетливое проявление паннуса 3 - выраженное проявление паннуса 4 - суставная щель заполнения паннусом-6 017183 Краевую эрозию оценивали следующим образом: 0 - нет видимой эрозии 1 - незначительная впадина в области капсулярного соединения 2 - отчетливая эрозия хряща 3 - эрозия, распространившаяся на субхондральную кость 4 - обширная эрозия кости и хряща Изменения в строении оценивали следующим образом: 0 - нормальное строение сустава 1 - отечные изменения 2 - незначительное смещение сочлененных поверхностей 3 - обширное смещение сочлененных поверхностей 4 - полный фиброз и образование коллагеновой сшивки Общая оценка отражала: 0 - классический нормальный вид сустава 1 - незначительные изменения, совместимые с ремиссией, что может считаться клинической нормой 2 - выраженный воспалительный артрит 3 - обширное воспаление, эрозионное заболевание 4 - деструктивный, эрозионный артрит Окрашенные толуидиновым синим срезы оценили на потерю протеогликана. Окраску на сочлененной поверхности сравнивали с окраской в зоне роста и оценивали следующим образом: 0 - нет потерь протеогликана. Нормальное окрашивание толуидиновым синим 1 - незначительная потеря протеогликана, некоторая потеря окраски поверхностью хряща. 2 - умеренная потеря протеогликана. Слабая окраска поверхности хряща. 3 - значительная потеря протеогликана. Отсутствие окраски поверхности хряща толуидиновым синим. 4 - обширная потеря протегликана. Отсутствие окраски толуидиновым синим в глубине хряща. Полученные гистологические данные коллаген-индуцированного артрита Срезы исследовали на воспалительные и эрозионные показатели заболевания. Проявление артрита(фиг. 27 А) проявляется тяжелой воспалительной эрозионной паталогией в контрольной группе, получавшей PBS, с типичными артритными признаками синовиальной гипертрофии и гиперплазии, с выраженным проявлением паннуса и краевой эрозией. Лечение с помощью соединения Т-araC в дозировке 30 мг/кг/сут (фиг. 27 В) привело к значительным изменениями в артритных показателях с уменьшением как воспалительных, так и эрозионных изменений суставов. Лечение с помощью Т-araC в дозировке 60 мг/кг/сут (фиг. 27 С) привело к более выраженному уменьшению паннуса и эрозий по сравнению с контролем, а прием Т-araC в дозировке 90 мг/кг/сут привел к незначительным изменениям или к нормальному состоянию суставов с тонкими синовиальными мембранами, гладкими сочлененными поверхностями и нормальными костями. Кроме того, в ходе этих исследований с разными лечебными дозами Т-araC зоотехниками не сообщалось о проявлении кожной сыпи. Исследование оценок воспаления (фиг. 28) выявило зависимое от дозы уменьшение воспаления у мышей, получавших Т-araC по сравнению с контрольными животными, получавшими физиологический раствор. Синовит был значительно понижен (р 0,01), а также наблюдалось сходное уменьшение в образовании паннуса (р 0,01) у мышей, получавших Т-araC в дозировке 30 мг/кг. Эти показатели имели значительное снижение (р 0,001) у мышей, получавших 60 и 90 мг/кг, при этом группы с повышенными дозами значительно отличались от мышей, получавших Т-araC в дозе 30 мг/кг. Оценка изменений в эрозионных проявлениях (эрозии и изменения в строении суставов) коллагениндуцированного артрита выявила сходный характер эффектов. Высокозначимое снижение (р 0,001) эрозии суставов наблюдали у групп, получавших Т-araC в дозировке 30 и 90 мг/кг/сут, по сравнению с контрольными животными, получавшими физиологический раствор (фиг. 29), а также значительное снижение (р 0,01) наблюдали у мышей, получивших соединение Т-araC в дозе 20 мг/кг/сут. Объединение гистопатологических признаков в общую гистологическую оценку артрита (фиг. 30) отражает данные, полученные о параметрах индивидуальных заболеваний. Наблюдали значительную,зависящую от дозы разницу между мышами, получавшими Т-araC, и контрольными (получавшими PBS) животными. Уменьшение общей заболеваемости у мышей, получавших дозу 60 и 90 мг/кг/сут, было высокозначимым (р 0,001). Срезы, окрашенные толуидиновым синим, обследовали, чтобы определить, влияет ли Т-araC на потерю матриксных протеинов в артритных суставах. Данные (фиг. 31) показывают, что Т-araC в дозах 60 и-7 017183 90 мг/кг/сут предотвращает потери протеогликана, и этот эффект является статистически высокозначимым. Гистологические данные подтверждают клинические данные, которые указывают на то, что лечение установленного коллаген-индуцированного артрита соединением согласно настоящему изобретению с применением терапевтического протокола вызывает облегчение болезни, которое имеет выраженную зависимость от дозы. Снижение всех гистологических показателей артрита достигало высоких уровней статистической значимости у мышей, получавших как 60, так и 90 мг/кг/сут. Однако статистическое ослабление заболевания наблюдали при всех дозах. При высоких дозах Т-araC происходило заметное восстановление структуры сустава. В общем, Т-araC обеспечивало до некоторой степени излечение заболеваний суставов у мышей, получавших высокие дозы. В целом, эти данные согласуются с проведенными клиническими исследованиями и являются очень обнадеживающими. Результаты дают возможность предположить, что соединение согласно настоящему изобретению может оказывать антиартритное действие при терапевтическом приеме в случае установленного артрита. Подводя итог терапевтическому испытанию, выявившему выраженные антиартритрные эффекты,можно сказать, что 100% мышей, получавших 90 мг/кг/сут, вступили в стадию ремиссии заболевания во время испытания, а 60% животных поддерживалось в клинически стабильном состоянии при завершении испытания. К тому же наблюдали высокозначимое снижение артритного индекса и числа пораженных лап. Значительное ослабление артрита наблюдали также у мышей, получавших 60 мг/кг/сут: 70%, вступивших в стадию ремиссии заболевания, и 40%, сохранивших ремиссию при завершении испытания. Опять было отмечено значительное снижение оценки заболевания и числа пораженных конечностей. У мышей, получивших 30 мг/кг/сут, не наблюдали значительного воздействия на симптомы заболевания. Эти гистологические исследования подтвердили клинические данные и показали, что лечение установленного коллаген-индуцированного артрита с помощью Т-araC-соединения, согласно настоящему изобретению, приводит к уменьшению интенсивности заболевания, имеющему выраженную зависимость от дозы. Снижение гистологических признаков артрита достигло высоких уровней статистической значимости, а при высоких дозах Т-araC наблюдали значительное восстановление структуры суставов. Изучение спленомегалии (которая имела место у всех мышей, получавших Т-araC, независимо от силы воздействия артрита) выявило, что наиболее выраженным изменением являлась клеточная гиперпролиферация при отсутствии тканевых некрозов или фиброзов. Этот выраженный клеточный рост, повидимому, объяснялся увеличением размеров селезенки. Лекарственные составы Соединение согласно настоящему изобретению можно вводить любыми обычными средствами, известными для применения в сочетании с фармацевтическими препаратами, как в качестве отдельных терапевтических агентов, так и в сочетании с терапевтическими агентами. Оно может вводиться отдельно, однако обычно его вводят с фармацевтическим носителем, который выбирают на основе соответствующего способа применения и стандартной фармацевтической практики. Соединение также может вводиться в сочетании с другими терапевтическими агентами, такими как интерферон (IFN), интерферон 2 а, интерферон -2b, консенсусный интерферон (CIFN), рибавирин, амантадин, римантадин, интерлейкин-12, урсодеоксихолевая кислота (UDCA), глицирризин. Описанные здесь фармацевтически допустимые носители, например связующие, адъюванты, наполнители или разбавители, хорошо известны специалистам. Обычно фармацевтически допустимый носитель является химически инертным по отношению к активным соединениям и не имеет вредных побочных эффектов или токсичности в условиях применения. Фармацевтически допустимые носители могут включать полимеры и полимерные матрицы. Соединение согласно настоящему изобретению можно вводить любым известным способом, предназначенным для применения в сочетании с фармацевтическими препаратами, в качестве отдельных терапевтических агентов или в комбинации с терапевтическими агентами. Вводимая доза будет, естественно, зависеть от известных факторов, в частности, от фармакодинамических характеристик конкретного агента, режима и способа введения, возраста, состояния здоровья и массы реципиента, природы и интенсивности симптомов, типа совмещенного лечения, частоты лечения и желаемого эффекта. Суточная доза активного ингредиента может составлять примерно от 0,001 до 1000 миллиграмм (мг) на килограмм (кг) массы тела, при этом предпочтительная доза составляет от 0,1 до примерно 30 мг/кг. Лекарственные формы (композиции, пригодные для введения) содержат примерно от 1 до примерно 500 мг активного ингредиента на единицу. В этих фармацевтических композициях активный ингредиент обычно присутствует в количестве примерно 0,5-95 мас.% относительно общей массы композиции. Активный ингредиент можно вводить перорально в твердых лекарственных формах, в частности, в капсулах, таблетках и порошках, или в жидких лекарственных формах, например в эликсирах, сиропах и суспензиях. Его можно вводить также парентерально в стерильных жидких лекарственных формах. Активный ингредиент можно также вводить интраназально (капли в нос) или путем ингаляции аэрозоля лекарственного порошка. Потенциально возможны и другие лекарственные формы, в частности, для трансдермального введения с помощью пластыря или притирания.-8 017183 Составы, пригодные для перорального введения, могут представлять собой: (а) жидкие растворы,например, эффективное количество соединения, растворенного в разбавителях, в частности, в воде, физиологическом растворе или в апельсиновом соке, (b) капсулы, саше, таблетки, лепешки и пилюли, содержащие соответствующее количество активного ингредиента в форме порошка или гранул, (с) порошки, (d) суспензии в соответствующей жидкости и (е) пригодные эмульсии. Жидкие составы могут включать растворители, в частности, воду и спирты, например этанол, бензиловый спирт, пропиленгликоль,глицерин и полиэтиленовые спирты, с добавлением или без добавления фармацевтически приемлемого поверхностно-активного агента, суспендирующего агента или эмульгатора. Капсульные формы могут иметь обычную твердую или мягкую желатиновую оболочку и содержать, например, поверхностноактивные вещества, лубриканты и инертные наполнители, в частности лактозу, сахарозу, форсфат кальция и кукурузный крахмал. Таблетированные формы могут включать один или несколько следующих компонентов: лактозу, сахарозу, маннитол, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, микрокристаллическую целлюлозу, гуммиарабик, желатин, гуаровую камедь, коллоидный диоксид кремния, кроскармеллозу натрия, тальк, стеарат магния, стеарат кальция, стеарат цинка, стеариновую кислоту и другие наполнители, красители, разбавители, буферные агенты, разлагающие агенты, увлажнители, консерванты, вкусовые добавки и фармацевтически совместимые носители. Лекарственные лепешки могут содержать активный ингредиент во вкусовом веществе, обычно - в сахарозе и гуммиарабике или трагаканте, а также могут представлять собой пастилки, содержащие активный ингрединет в инертной основе, в частности в желатине и глицерине или сахарозе и гуммиарабике, эмульсиях и гелях,которые кроме активного ингредиента содержат носители, известные специалистам. Соединение согласно настоящему изобретению может быть приготовлено отдельно или в сочетании с другими пригодными компонентами в форме аэрозольных составов, вводимых путем ингаляции. Такие аэрозольные составы можно помещать в допустимый сжатый газ-вытеснитель, в частности, дихлордифторметан, пропан и азот. Их можно также приготовить в форме фармацевтических препаратов,не подвергаемых сжатию, например, в распылителе или пульверизаторе. Составы, пригодные для парентерального введения, включают водные и неводные изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые придают составу изотоничность с кровью соответствующего реципиента, а также водные и неводные стерильные суспензии, которые включают суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Соединение можно вводить в физиологически допустимом растворителе в фармацевтическом носителе, в частности в стерильной жидкости или смеси жидкостей, включая воду, физиологический раствор, водные растворы декстрозы и похожих сахаров, спирт, в частности этанол, изопропанол или гексадециловый спирт, гликоли, например пропиленгликоль или полиэтиленгликоль, в частности, поли(этиленгликоль) 400, кетали глицерина, в частности,2,2-диметил-1,3-диоксолан-4-метанол, простые эфиры, масло, жирную кислоту, сложный эфир или глицерид жирной кислоты, с добавлением или без добавления фармацевтически допустимого поверхностноактивного агента, в частности мыла или детергента, суспендирующего агента, в частности пектина, карбомеров, метилцеллюлозы, гидроксипропилметилцеллюлозы или карбоксиметилцеллюлозы, или эмульгаторов и других фармацевтических адъювантов. Масла, которые можно использовать в парентеральных составах, включают минеральные, животные, растительные или синтетические масла. Специфические примеры масел включают арахисовое, соевое, кунжутное, хлопковое, кукурузное, оливковое, вазелиновое и минеральное масло. Жирные кислоты, пригодные для применения в парентеральных составах, включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Этилолеат и изопропилмиристат представляют собой примеры пригодных сложных эфиров жирных кислот. Мыла, пригодные для применения в парентеральных составах,включают соли жирных кислот щелочных металлов, аммония и триэтаноламина, а пригодные детергенты включают (а) катионные детергенты, например, галогениды диметилдиалкиламмония и галогениды алкилпиридиния, (b) анионные детергенты, например, алкильные, арильные и олефиновые сульфонаты,алкильные, олефиновые, простые эфирные и моноглицеридные сульфаты и сульфосукцинаты, (с) неионные детергенты, например, оксиды аминов жирных кислот, алканоламиды жирных кислот, и сополимеры полиоксиэтилена и полипропилена, (d) амфотерные детергенты, например алкил-6-аминопропионаты и 2-алкилимидозолиновые соли четвертичного аммония и (е) их смеси. Парентеральные составы обычно содержат примерно от 0,5 до примерно 25 мас.% активного ингредиента в растворе. В таких составах можно использовать пригодные консерванты и буферы. Для минимизации или устранения раздражения в месте инъекции такие составы могут содержать один или несколько неионных поверхностно-активных веществ, имеющих гидрофильно-липофильный баланс (HLB) примерно от 12 до примерно 17. Содержание поверхностно-активного вещества в таких составах изменяется примерно от 5 до примерно 15 мас.%. Пригодные поверхностно-активные вещества включают сложные эфиры полиэтиленсорбита и жирных кислот, в частности сорбитмоноолеат, и аддукты оксиси этилена с высокой молекулярной массой и гидрофобным основанием, образованным конденсацией оксиси пропилена с пропиленгликолем. Фармацевтически приемлемые наполнители также хорошо известны специалистам в данной облас-9 017183 ти техники. Выбор наполнителя частично определяется конкретным составом, а также конкретным способом введения соединения. В соответствии с этим существует широкий спектр пригодных составов фармацевтической композиции согласно настоящему изобретению. Описанные ниже способы и наполнители являются только иллюстративными, но не ограничительными в какой-либо степени. Фармацевтически приемлемые наполнители предпочтительно не влияют на действие активных ингредиентов и не вызывают вредных побочных эффектов. Пригодные носители и наполнители включают растворители, в частности воду, спирт и пропиленгликоль, твердые абсорбенты и разбавители, поверхностно-активные вещества, суспендирующие агенты, связующие для таблетирования, лубриканты, вкусовые добавки и окрашивающие агенты. Составы можно поставлять в герметичных контейнерах, например в ампулах или флаконах с одной или несколькими дозами, и можно хранить в сублимированном (лиофилизированном) состоянии, требующем добавления стерильного жидкого наполнителя, например воды для инъекции, непосредственно перед употреблением. Растворы и суспензии для незамедлительного приема можно приготовить из стерильных порошков, гранул и таблеток. Требования к эффективным фармацевтическим носителям в растворах для инъекций хорошо известны специалистам. См. Pharmaceutics и Pharmacy Practice, J.B. Lippincott Co., Philadelphia, P.A., Banker и Chalmers, Eds., 238-250 (1982) и ASHP Handbook on Injectable Drugs,Toissel, 4th ed., 622-630 (1986). Составы, пригодные для местного введения, включают лепешки, содержащие активный ингредиент во вкусовом веществе, обычно - в сахарозе и гуммиарабике или трагаканте, пастилки, содержащие активный ингредиент в инертном основании, в частности в желатине и глицерине или в в сахарозе и гуммиарабике, и растворы для полоскания полости рта, содержащие активный ингредиент в пригодном жидком носителе, а также кремы, эмульсии и гели, содержащие кроме активного ингредиента носители,известные специалистам. Кроме того, составы пригодные для ректального введения, могут быть получены в форме суппозиториев путем смешивания с различными основами, в частности с эмульгирующими основами или водорастворимыми основами. Составы, пригодные для вагинального введения, могут быть получены в форме пессариев, тампонов, кремов, гелей, паст, вспененных веществ или спреев, содержащих кроме активного ингредиента носители, известные специалистам. Пригодные фармацевтические носители описаны в работе Remington's Pharmaceutical Sciences,Mack Publishing Company, которая является стандартным справочником в данной области. Доза, вводимая в организм, в частности в организм человека, в контексте настоящего изобретения,должна быть достаточной, чтобы вызвать терапевтический эффект в организме в течение разумного периода времени. Для специалистов очевидно, что дозировка зависит от множества факторов, в том числе от состояния организма и массы тела пациента, так же как и от тяжести и продолжительности заболевания. Пригодной является доза, которая обеспечивает в организме пациента концентрацию активного агента, достаточную, чтобы вызвать желаемую реакцию. Предпочтительная дозировка - это величина дозы, которая вызывает максимальное ингибирование заболевания, без трудно контролируемых побочных эффектов. Кроме того, величина дозы определяется способом, временным интервалом и частотой введения соединения, а также наличием, природой и интенсивностью вредных побочных эффектов, которые могут сопровождать введение соединения и желаемый физиологический эффект. Пригодные фармацевтические лекарственные формы для введения соединения согласно настоящему изобретению можно иллюстрировать следующим образом: Капсулы в твердой оболочке Большое количество единичных капсул получают заполнением стандартных двухэлементных твердых желатиновых капсул 100 мг порошкообразного активного ингредиента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы Приготавливают смесь активного ингредиента в перевариваемом масле, в частности соевом, хлопковом или оливковом масле, и с помощью поршневого насоса впрыскивают в расплавленный желатин, с получением мягких желатиновых капсул, содержащих 100 мг активного ингредиента. Капсулы промывают и сушат. Активный ингредиент можно растворить в смеси полиэтиленгликоля, глицерина и сорбитола, чтобы получить смешивающуюся с водой лекарственную смесь. Таблетки Большое количество таблеток получают обычными способами, при этом лекарственная форма содержит 100 мг активного ингредиента, 0,2 мг коллоидного диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Подходящие водные и неводные покрытия можно нанести для повышения вкусовых качеств, улучшения внешнего вида и стабильности или для задержки поглощения. Таблетки/капсулы с быстрым высвобождением Это твердые лекарственные формы для перорального приема, которые изготавливают традицион- 10017183 ными и новыми способами. Эти формы принимают перорально без использования воды для незамедлительного растворения и доставки лекарства. Активный ингредиент смешивают в жидкости, содержащей определенный ингредиент, в частности, сахар, желатин, пектин и подсластители. Эти жидкости отверждают, получая твердые таблетки или таблетки в форме капсул способами сублимации и твердофазной экстракции. Лекарственные соединения можно прессовать с вязкоэластичными и термоэластичными сахарами и полимерами или вспенивающимися компонентами, чтобы получить пористые матрицы, предназначенные для незамедлительного выделения без применения воды. Кроме того, соединение согласно настоящему изобретению можно вводить в форме капель в нос или в форме мерной дозы с помощью назального или буккального ингалятора. Препарат доставляется из назального раствора в форме тонкодисперсного распыления или из порошка в форме аэрозоля. Термин содержащий и его грамматические вариации используется здесь в смысле имеющий или включающий, а не в ограничивающем смысле состоящий только из. Термин состоящий главным образом из здесь относится к включающему то, что однозначно перечислено наряду с тем, что существенно не влияет на характеристики того, что перечислено или указано. Термины а и the в оригинальной версии заявки на настоящее изобретение относятся как к множественному, так и к единственному числу. Вышеприведенное описание изобретения иллюстрирует и описывает настоящее изобретение. При этом описание показывает и описывает только предпочтительные варианты реализации изобретения,однако, как указано выше, следует понимать, что изобретение может быть использовано в различных других комбинациях, модификациях и окружающих средах и может содержать изменения и модификации в пределах выраженной здесь концепции изобретения в соответствии с вышеприведенными положениями и/или навыками или знаниями специалистов. Вышеописанные варианты реализации изобретения приведены для того, чтобы пояснить наилучшие способы практического использования изобретения и дать возможность другим специалистам применять изобретение в этих или иных вариантах реализации изобретения с различными модификациями,которые требуются в конкретных случаях приложения или применения изобретения. В соответствии с этим не предполагается ограничивать изобретение в том виде как оно описано. Кроме того, предполагается, что прилагаемая формула изобретения включает альтернативные варианты реализации изобретения. Все публикации, патенты и патентные заявки, цитируемые в описании данного изобретения, включены в настоящее описание посредством ссылок для любых и всех назначений, как если бы было упомянуто в каждом отдельном случае, что указанные индивидуальная публикация, патент или патентная заявка, включены в настоящее описание посредством ссылки. В случае несоответствия настоящее изобретение имеет приоритет. Ссылки(5) Wooley P.H., Dutcher J., Widmer M.B., Gillis S. Influence of a recombinant human soluble tumor necrosis factor receptor FC fusion protein on type II collagen-induced arthritis in mice. Journal of Immunology 1993; 151: 6602-6607. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения или предупреждения артрита, включающий введение нуждающемуся реципиенту 1-(4-тиоD-арабинофуранозил)цитозина в количестве, эффективном для лечения или предупреждения артрита. 2. Способ по п.1, отличающийся тем, что указанный реципиент представляет собой млекопитающее. 3. Способ по п.1, отличающийся тем, что указанный реципиент представляет собой человека. 4. Способ по п.1, отличающийся тем, что указанный реципиент представляет собой домашнее животное. 5. Способ по п.1, отличающийся тем, что указанный артрит представляет собой ревматоидный артрит. Фиг. 16 Микротомографическое изображение (мСТ) суставов и костей у мышей, подвергнутых лечению МТХ в дозировке 9 мг/кг в течение 6 недель Фиг. 17 Разрушение суставов и костей у мышей на основе mCT изображений Фиг. 19 Диаграмма, демонстрирующая тяжесть артрита, основанная на окраске НЕ Фиг. 20 Диаграмма, демонстрирующая уровень антиколлагенового антитела в I мышиной сыворотке (Образцы крови отбирали через 2 недели после завершения лечения с помощью T-araC)
МПК / Метки
МПК: C12P 19/38, A61K 31/70, A01N 43/04
Метки: лечения, артрита, предупреждения, способ
Код ссылки
<a href="https://eas.patents.su/23-17183-sposob-lecheniya-i-preduprezhdeniya-artrita.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения и предупреждения артрита</a>