Лекарственное средство в виде множества частиц
Номер патента: 13424
Опубликовано: 30.04.2010
Авторы: Хейз Джофф, Тамбер Харджит, Мартинелли Винченцо, Вэлден Малькольм, Мохаммад Хассан, Уайтлок Стив
Формула / Реферат
1. Множество частиц с контролируемым высвобождением, полученных экструзией расплава, которые содержат (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) модификатор водопроницаемости, который представляет собой водопроницаемый сополимер метакрилата аммония или гидроксипропилметилцеллюлозу.
2. Множество частиц по п.1, где оксикодон присутствует в виде фармацевтически приемлемой соли.
3. Множество частиц по п.2, где оксикодон присутствует в виде гидрохлорида оксикодона.
4. Множество частиц по любому из пп.1-3, где пластификатор выбран из цетилового спирта, стеарилового спирта, цетостеарилового спирта, сорбита, сахарозы, полиэтиленгликоля высокой молекулярной массы, дибутилсебацината, трибутилцитрата, триэтилцитрата, пропиленгликоля и полиэтиленгликоля низкой молекулярной массы.
5. Множество частиц по п.4, где пластификатор представляет собой стеариловый спирт.
6. Множество частиц по п.4, где пластификатор представляет собой полиэтиленгликоль высокой молекулярной массы.
7. Множество частиц по любому из пп.1-6, где смазывающее вещество выбрано из глицерилбегената, талька и диоксида кремния.
8. Множество частиц по п.7, где смазывающее вещество представляет собой глицерилбегенат.
9. Множество частиц по любому из пп.1-6, где смазывающее вещество представляет собой стеариновую кислоту или соль стеарат.
10. Множество частиц по любому из пп.1-9, где модификатор водопроницаемости представляет собой водопроницаемый сополимер метакрилата аммония.
11. Множество частиц по любому из пп.1-10, где модификатор водопроницаемости представляет собой эудрагит RL РО.
12. Множество частиц по любому из пп.1-11, где процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице:

13. Множество частиц по п.12, где процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице:

14. Множество частиц по п.12, где процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице:

15. Множество частиц по п.1, которые содержат оксикодон, эудрагит RS PO, стеариловый спирт, глицерилбегенат и эудрагит RL РО.
16. Лекарственная форма со стандартной дозой, содержащая множество частиц по любому из предшествующих пунктов.
17. Лекарственная форма со стандартной дозой по п.16, в которой стандартная доза содержит дозу оксикодона, достаточную для обеспечения обезболивания у человека.
18. Лекарственная форма со стандартной дозой по п.17, которая биоэквивалентна таблеткам
OxyContinÒ.
19. Лекарственная форма со стандартной дозой по п.17 или 18, в которой достаточная доза оксикодона составляет от 5 до 400 мг.
20. Лекарственная форма со стандартной дозой по п.19, в которой стандартная доза оксикодона составляет 5, 10, 20, 40, 80 или 160 мг.
21. Лекарственная форма со стандартной дозой по любому из пп.16-20 в виде капсулы, заполненной указанным множеством частиц.
22. Лекарственная форма со стандартной дозой по п.21, в которой множество частиц помещены в твердые желатиновые капсулы, каждая из которых содержит стандартную дозу.
23. Лекарственная форма со стандартной дозой по п.22, в которой масса наполнения капсулы находится в пределах 120-500 мг.
24. Способ получения множества частиц по п.1, который включает приготовление смеси, которая содержит (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) модификатор водопроницаемости, который представляет собой водопроницаемый сополимер метакрилата аммония или гидроксипропилметилцеллюлозу, и экструзию смеси.
25. Лекарственная форма со стандартной дозой, содержащая множество частиц по любому из пп.1-15 и множество частиц антагониста оксикодона.
26. Применение лекарственной формы со стандартной дозой по любому из пп.16-23 для купирования боли.
27. Применение лекарственной формы со стандартной дозой по любому из пп.16-23 для обезболивания.
Текст
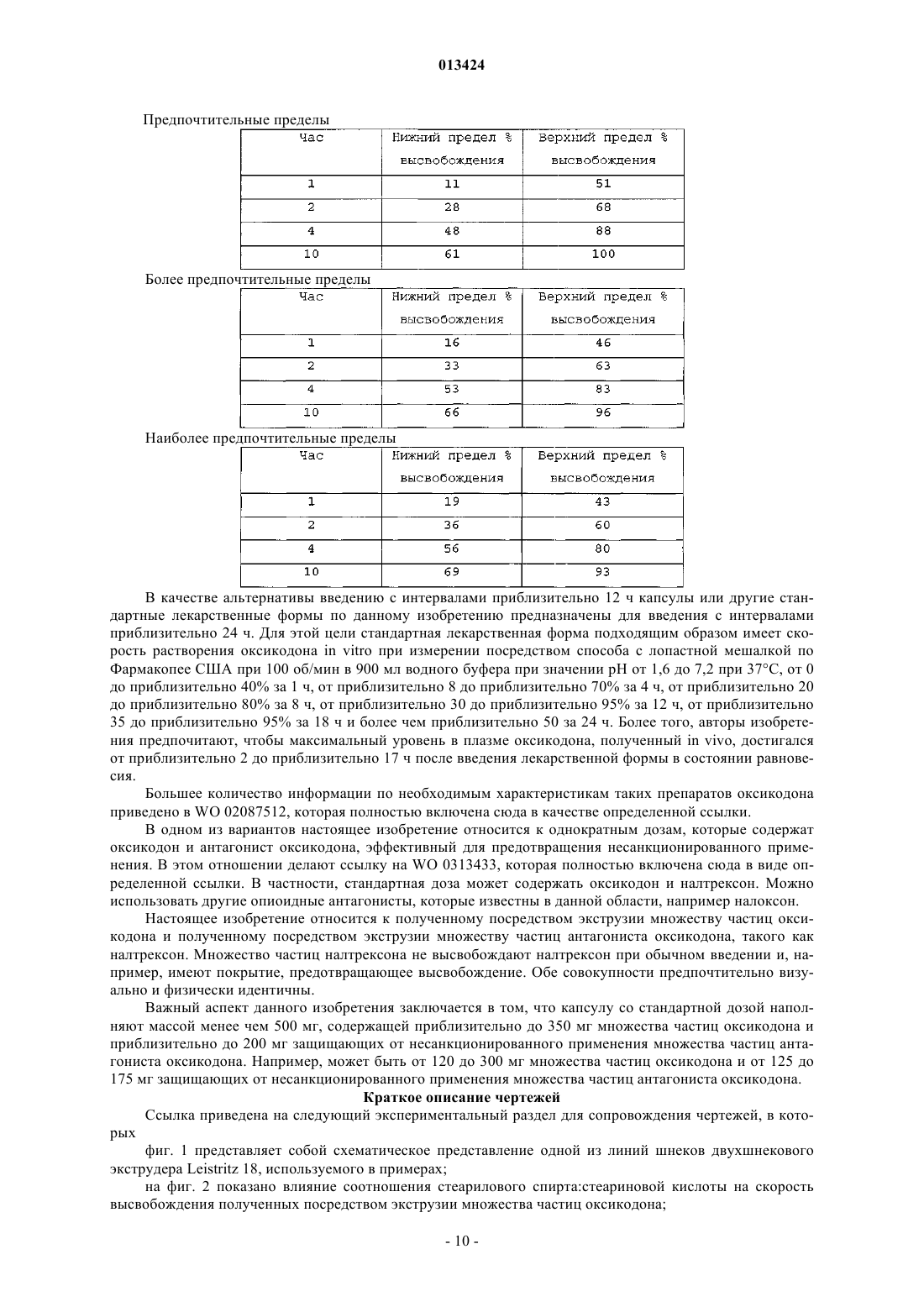
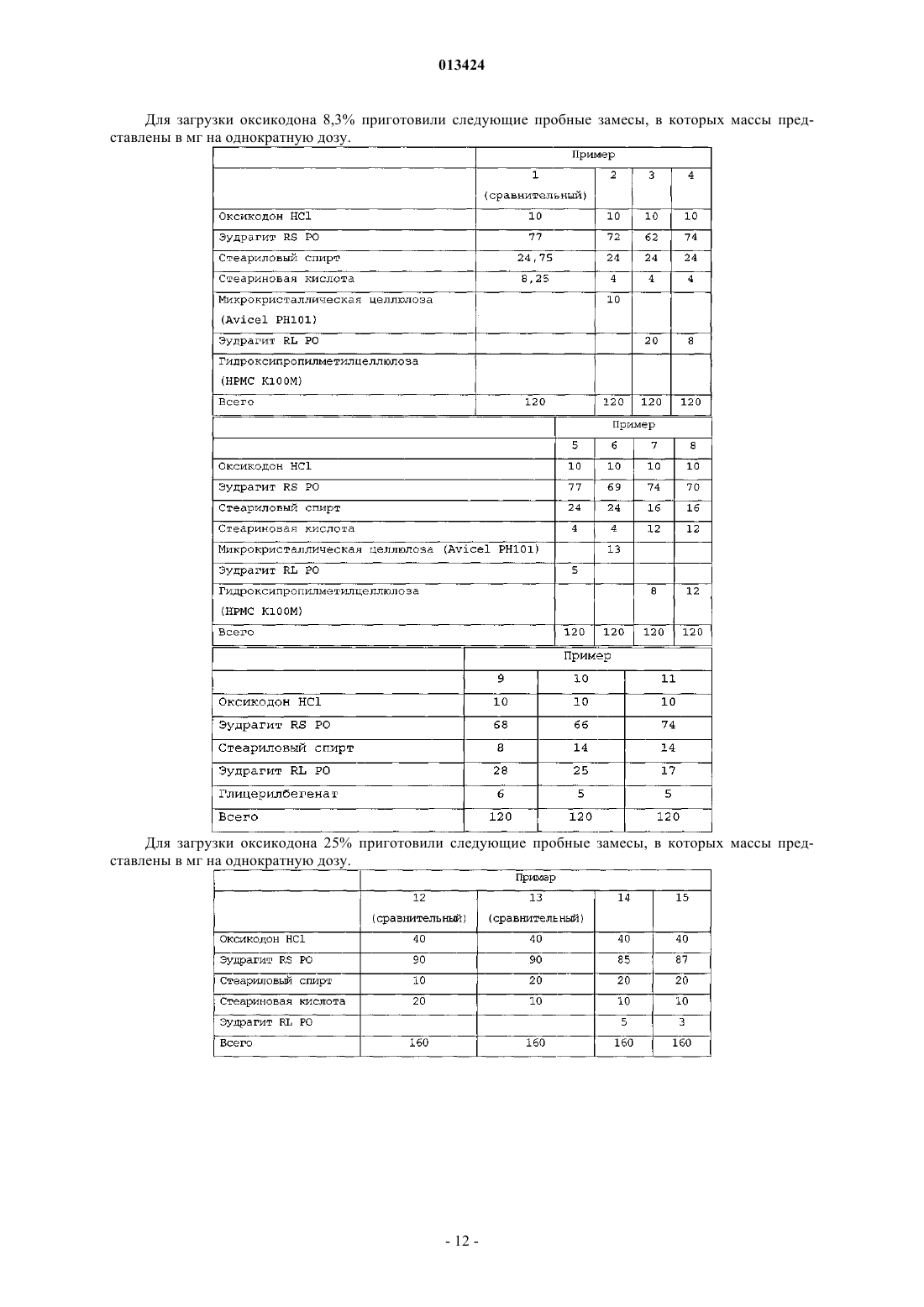
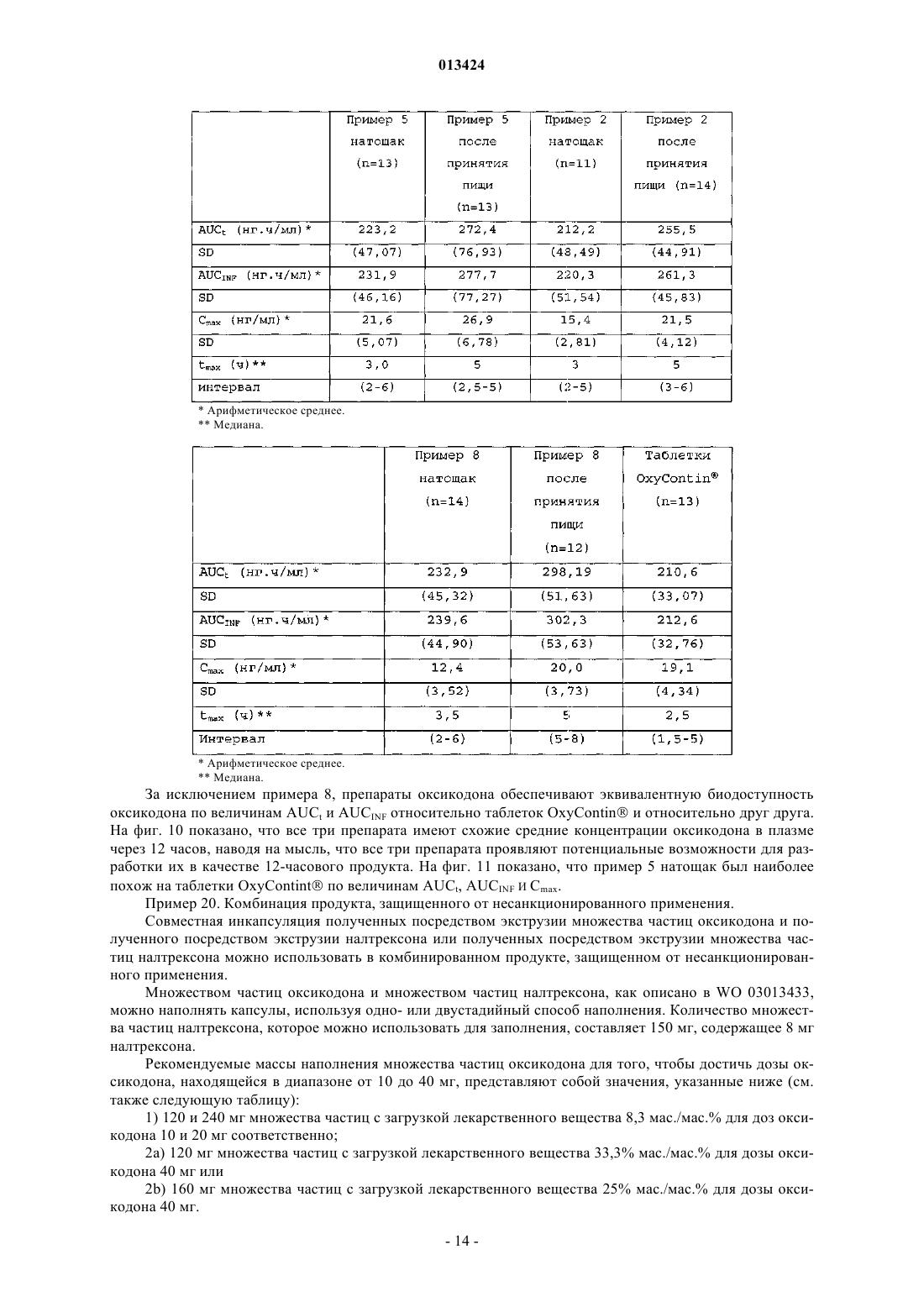
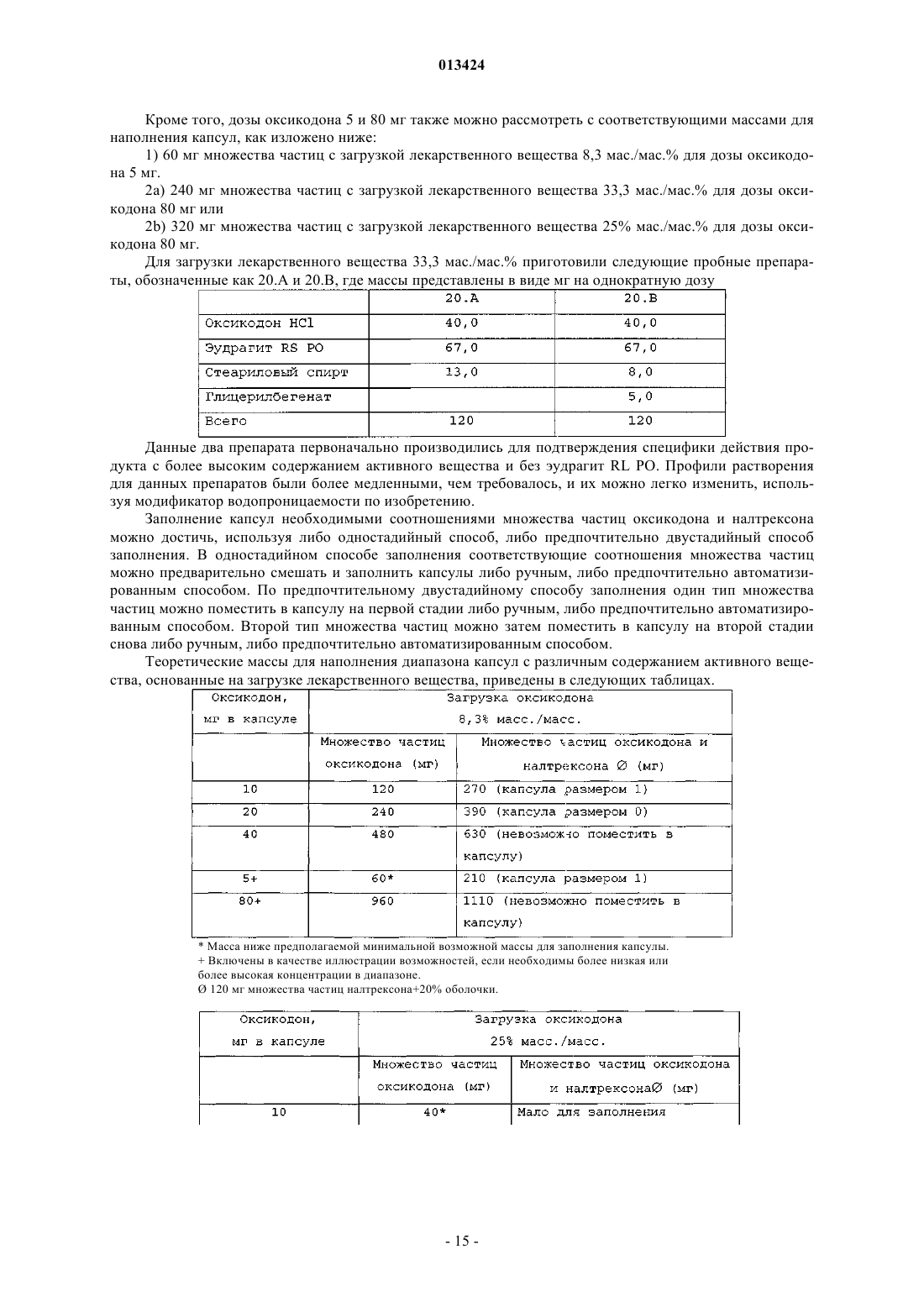
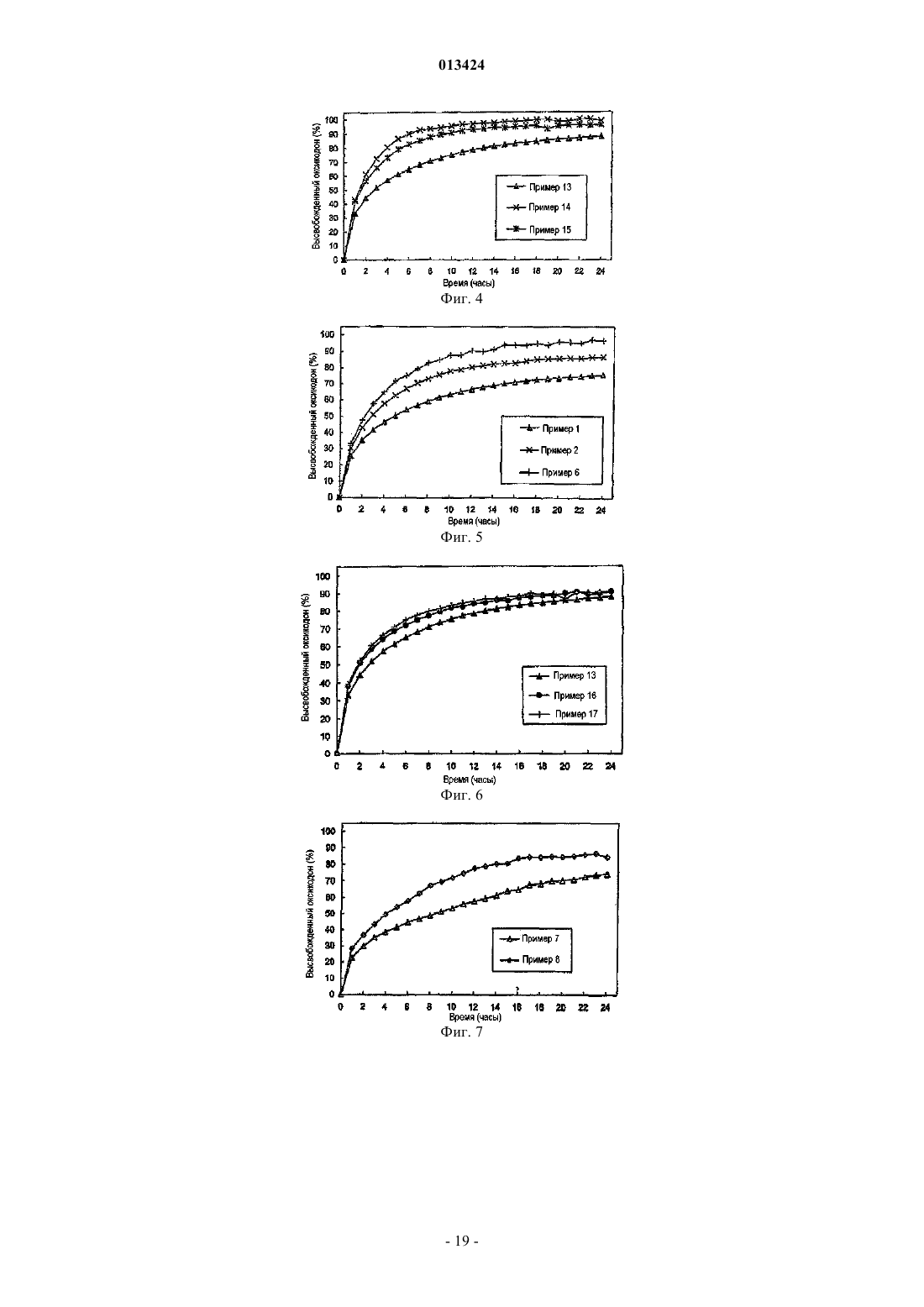
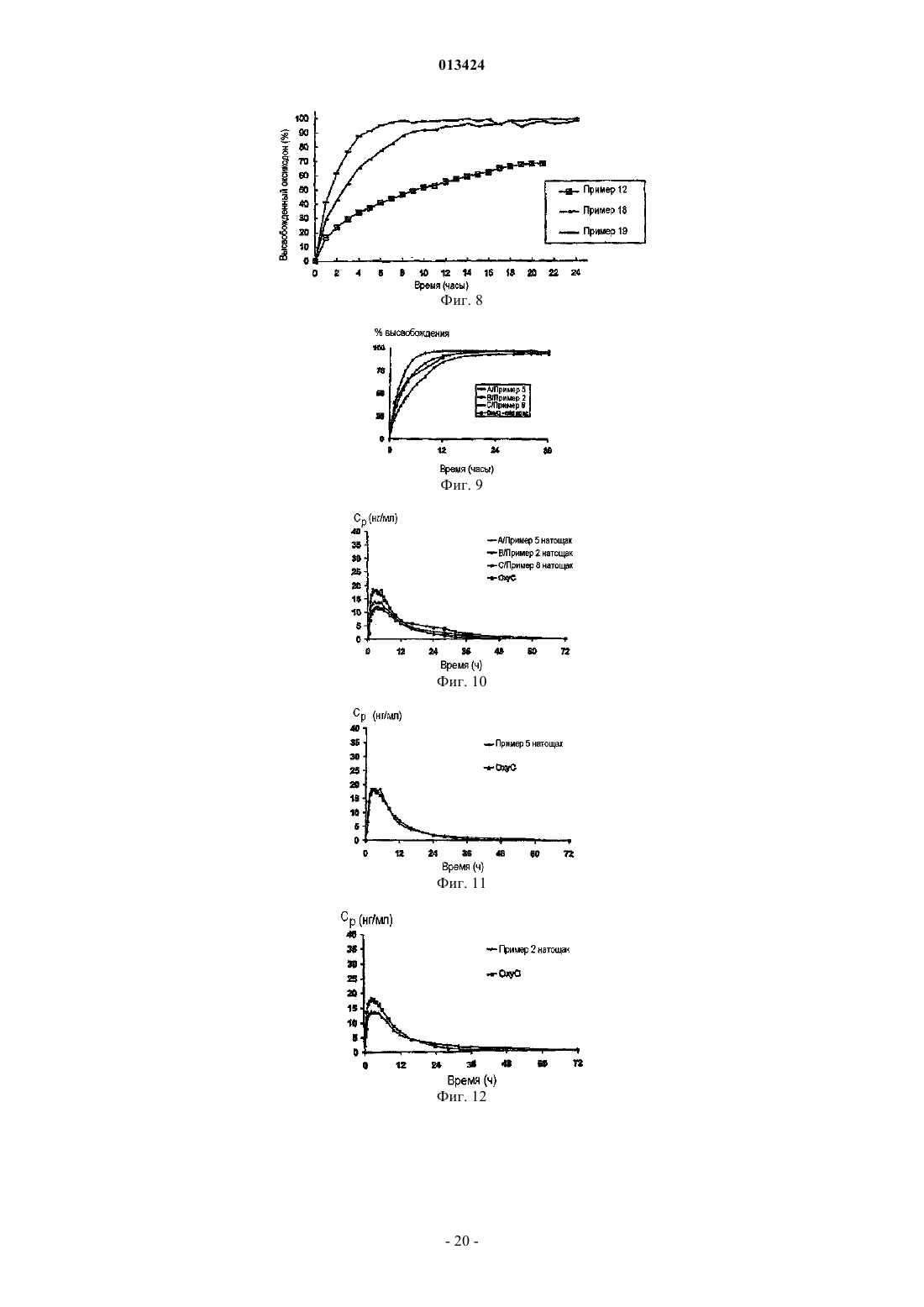
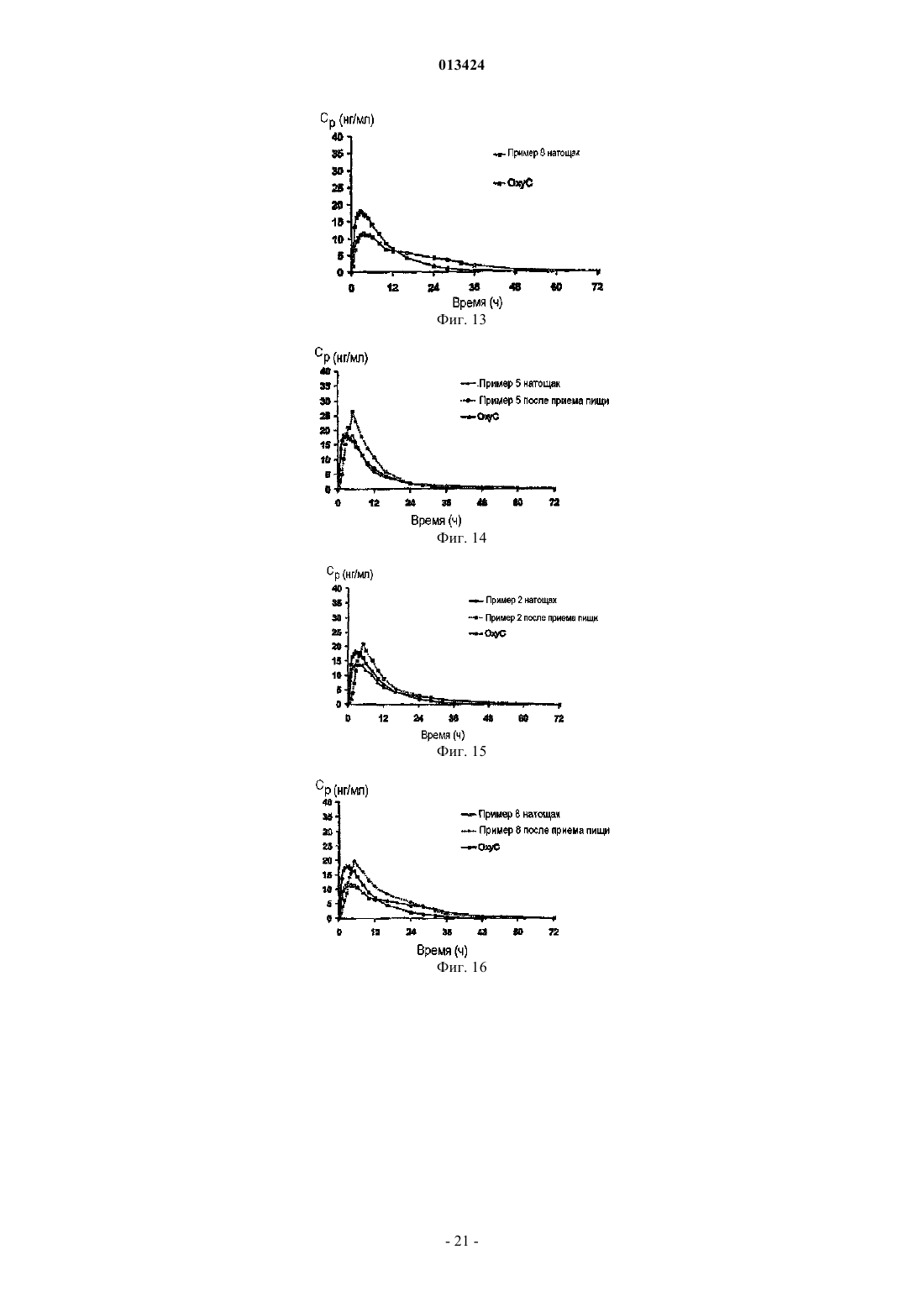
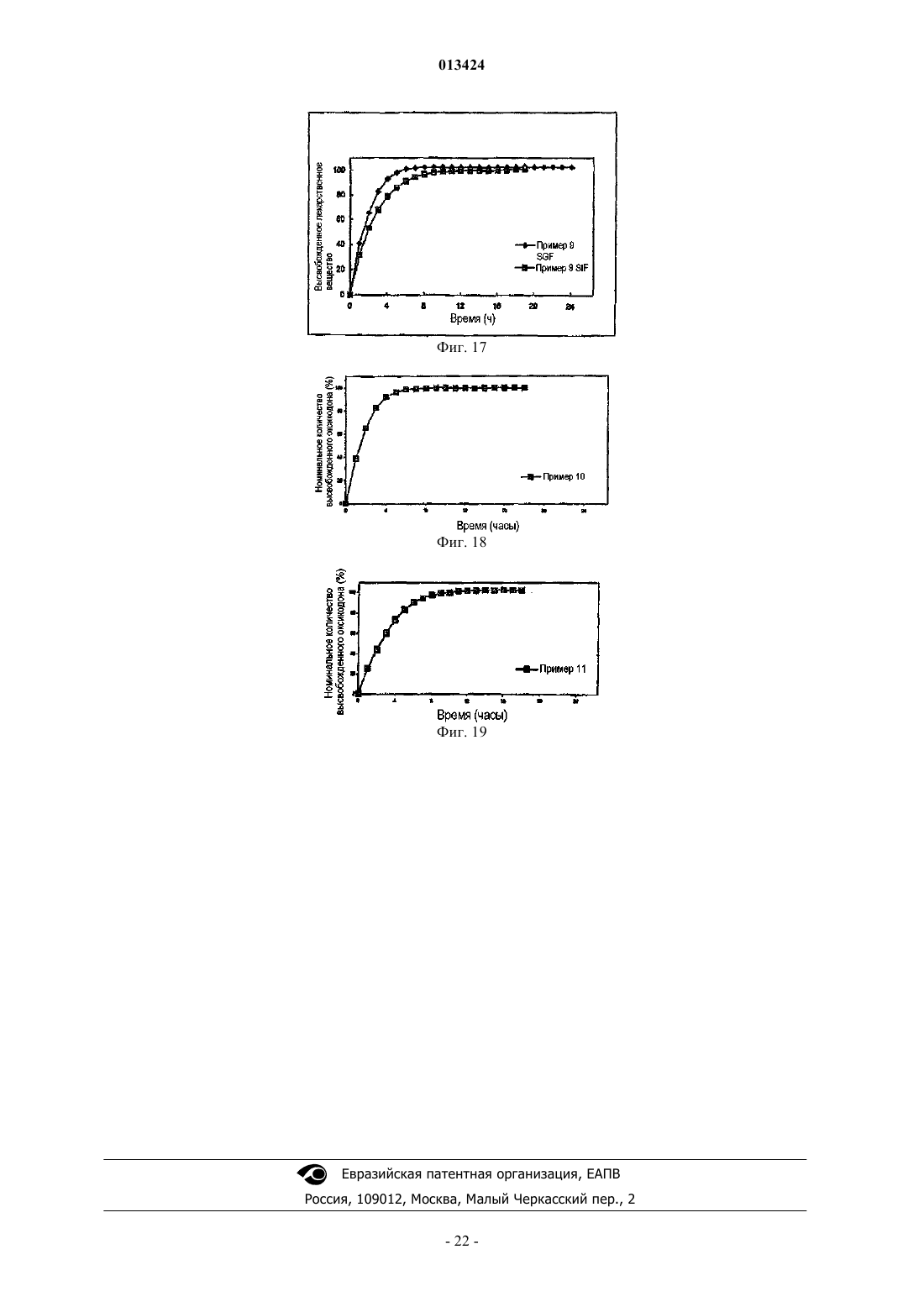
013424 Настоящее изобретение относится к лекарственному средству в виде множества частиц и, в частности, к лекарственному средству в виде множества частиц, полученному посредством экструзии и обеспечивающему контролируемое высвобождение оксикодона. Предшествующий уровень техники Оксикодон представляет собой 4,5-эпокси-14-гидрокси-3-метокси-17-метилморфинан-6-он, и его получают из алкалоида опия тебаина. Он представляет собой очищенный опиоидный агонист, принципиальное действие которого заключается в обезболивании, и его обычно вводят в качестве гидрохлорида оксикодона. Соль гидрохлорид оксикодона представляет собой белый кристаллический порошок без запаха, который легко растворяется в воде (1 г в объеме от 6 до 7 мл). Оксикодон показан при лечении умеренной или сильной боли. Контролируемое высвобождение продуктов оксикодона позволяет справиться с болью, когда необходимо продолжительное и круглосуточное применение анальгетика в течение длительного периода времени. Препараты оксикодона, которые обеспечивают контролируемое высвобождение оксикодона, описаны, например, в WO 9310765. Типично применяют процедуру гранулирования. В примере 3 таблетку,содержащую 10 мг гидрохлорида оксикодона, получают из смеси гидрохлорида оксикодона, лактозы,повидона, эудрагита RS 30 D, триацетина, стеарилового спирта, талька и стеарата магния. Такие же ингредиенты в установленных количествах используют в примере 4, чтобы получить таблетки, содержащие 20 мг гидрохлорида оксикодона. Получившиеся в результате продукты проявляют различные фармакокинетические и фармакодинамические свойства. Иллюстративно, скорости высвобождения in vitro 10 и 20 мг оксикодона в таблетках приведены в Таблетки такого типа и с такими скоростями высвобождения формируют основу для коммерческого продукта. Таблетки с контролируемым высвобождением оксикодона доступны в качестве таблетокOxyContin (зарегистрированный товарный знак), которые предназначены для того, чтобы обеспечить контролируемую доставку оксикодона в течение 12 ч. Оксикодон хорошо всасывается из таблеток OxyContin биодоступностью при пероральном применении от 60 до 87%. Относительная биодоступность таблеток OxyContin в лекарственной форме быстрого высвобождения для перорального применения составляет 100%. При повторном введении дозы в фармакокинетических исследованиях у нормальных добровольцев равновесные концентрации достигались через 24-36 ч. Пропорциональность дозы установили для таблеток с содержанием активного вещества 10, 20, 40,80 и 160 мг как по максимальным уровням в плазме (Cmax), так и по степени всасывания (биодоступности), AUC, как показано при помощи следующих данных. Среднее значение [% коэффициента вариаций] При однократной дозе AUC=AUCO-inf, для многократных доз AUC=AUCO-T.Данные получены, когда добровольцы получали налтрексон, который может увеличивать всасывание. Оксикодон быстро метаболизируется и выделяется, главным образом, с мочой в качестве как конъюгированных, так и неконъюгированных метаболитов. Выраженный период полувыведения оксикодона после введения таблеток OxyContin составлял 4,5 ч по сравнению с 3,2 ч для быстровысвобождаемого оксикодона. Приблизительно от 60 до 87% пероральной дозы оксикодона достигает центральных отделов по сравнению с парентеральной дозой. Такая высокая биодоступность при пероральном применении является следствием низкого уровня пресистемного метаболизма и/или метаболизма при первом прохождении (через печень). У здоровых добровольцев t1/2 всасывания составляет 0,4 ч для быстровысвобождаемого оксикодона для перорального применения. В отличие от этого, таблетки OxyContin проявляют двухфазный профиль всасывания с двумя видимыми периодами полувсасывания 0,6 и 6,9 ч, который описывает первоначальное высвобождение оксикодона из таблетки, за которым следует пролонгированное высвобождение. Существуют альтернативные методики промышленного производства препаратов оксикодона, кроме грануляции, используемой в примерах WO 9310765. Таким образом, множество частиц равномерной размерности с измененными свойствами высвобождения лекарственного вещества можно получить способом, обозначаемым как технология экструзии расплава. Экструзия расплава представляет собой одностадийный способ производства множества частиц посредством экструзии размягченной смеси без применения растворителей, и он особенно применим для изменения высвобождения лекарственного вещества. Выбирая подходящие полимеры и добавки, технологию экструзии расплава можно использовать как для увеличения растворимости и, следовательно, биодоступности плохо растворимых в воде лекарственных веществ, так и для замедления высвобождения лекарственного вещества средне или хорошо растворимых в воде лекарственных веществ для контролируемого высвобождения продуктов. Суть технологии экструзии расплава заключается в применении термопластичных материалов, которые действуют в качестве связующих материалов для лекарственных веществ, находящихся в растворе или дисперсионной форме внутри матрицы. Термопластичные полимеры с низкими температурами стеклования (Tg) предпочтительны для обработки посредством экструзии расплава. Более низкие температуры обработки также предпочтительны по отношению к стабильности чувствительных к нагреванию лекарственных веществ и других необходимых наполнителей. Температуры стеклования полимеров можно также дополнительно уменьшать для того, чтобы способствовать обработке при более низких температурах с необязательным добавлением пластификаторов. Для иллюстрации, в WO 9614058 описан фармацевтический препарат с замедленным высвобождением, содержащий полученную посредством экструзии расплава смесь терапевтически активного средства, одного или более веществ, выбранных из группы, состоящей из алкилцеллюлозы, полимеров и сополимеров акриловой и метакриловой кислот, шеллака, зеина, гидрогенизированного касторового масла,гидрогенизированного растительного масла и их смесей; и одного или более гидрофобных легкоплавких носителей, которые обеспечивают дополнительное замедляющее действие и выбраны из группы, состоящей из натуральных и синтетических восков, жирных кислот, жирных спиртов и их смесей, причем легкоплавкие носители имеют температуру плавления от 30 до 200 С. Полученную при помощи экструзии расплава смесь разделяют на стандартные дозы, содержащие эффективное количество указанного терапевтически активного средства, чтобы привести к появлению необходимого терапевтического эф-2 013424 фекта и обеспечить замедленное высвобождение указанного терапевтически активного средства в течение периода времени от приблизительно 8 до приблизительно 24 ч. Более того, в патенте WO 9614058 описан способ приготовления фармацевтического экструдата с замедленным высвобождением, подходящим для перорального введения. Способ включает смешивание терапевтически активного средства совместно с (1) веществом, выбранным из группы,состоящей из алкилцеллюлозы, полимеров и сополимеров акриловой и метакриловой кислот, шеллака,зеина, гидрогенизированного касторового масла, гидрогенизированного растительного масла и их смесей, и (2) легкоплавкого носителя, выбранного из группы, состоящей из натуральных или синтетических восков, жирных кислот, жирных спиртов и их смесей; причем указанное замедляющее вещество имеет температуру плавления в диапазоне между 30-200 С и содержится в количестве, достаточном для дальнейшего медленного высвобождения терапевтически активного средства; нагревание указанной смеси до температуры, достаточной для размягчения смеси в достаточной мере для ее экструзии; экструзию указанной подогретой смеси в виде тяжа, имеющего диаметр от 0,1-3 мм; охлаждение указанного тяжа и разделение указанного тяжа, чтобы получить множество нешаровидных частиц указанного экструдата, имеющих длину от 0,1-5 мм, и разделение указанного множества нешаровидных частиц на стандартные дозы, содержащие эффективное количество указанного терапевтически активного средства, причем указанная стандартная доза обеспечивает замедленное высвобождение указанного терапевтически активного средства в течение периода времени от приблизительно 8 до приблизительно 24 ч. Данный способ можно применить для оксикодона, опиоидного анальгетика, и типично применяют полиметакрилат эудрагит в качестве средства, задерживающего полимер в матрице. Полиметакрилаты эудрагита широко используются в фармацевтических композициях, особенно для контроля за высвобождением активного компонента. Таким образом, в некоторых примерах WO 9614058 капсулы или таблетки с контролируемым высвобождением с 20 мг гидрохлорида оксикодона получают посредством экструзии смеси. В примерах 11 и 13 гидрохлорид оксикодона смешивают с эудрагит RS РО, эудрагит L 100 и стеариновой кислотой. Смесь в примере 12 дополнительно содержит тальк. Остается необходимость в предоставлении способа получения множества частиц оксикодона, которые можно использовать для наполнения капсул, которые могут соответствовать некоторым или всем фармакокинетическим и фармакодинамическим характеристикам таблеток OxyContin. В связи с этим,задачей данного изобретения является предоставление способа приготовления фармацевтической композиции оксикодона, которая обеспечивает профиль высвобождения оксикодона in vitro, который соответствует профилю высвобождения в примерах 3 и 4 WO 9310765. Сущность изобретения Согласно настоящему изобретению авторы изобретения получили множество частиц оксикодона,обозначаемых как оксикодон в виде множества частиц, которые содержат (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) модификатор водопроницаемости. В одном аспекте авторы изобретения обеспечивают получение оксикодона в виде указанного множества частиц с высокой степенью первоначального высвобождения оксикодона и с высокой степенью суммарного высвобождения оксикодона. Свойства высвобождения можно выразить исходя из высвобождения оксикодона при контролируемых in vitro условиях, которые, например, моделируют желудочную жидкую среду человека или жидкую среду кишечника человека. Можно исследовать высвобождение при физиологическом значении рН, например отразить переход из желудка в кишечник во время прохождения внутри организма. В частности, авторы изобретения обнаружили, что добавление модификатора водопроницаемости(что в контексте данного изобретения эквивалентно веществу, увеличивающему водопроницаемость) может позволить осуществить экструзию множества частиц оксикодона, которые проявляют некоторую биоэквивалентность таблеткам OxyContin. Множество частиц может обладать фармакокинетическими и/или фармакодинамическими свойствами, приближающимися к свойствам таблеток OxyContin. В частности, множество частиц может обладать скоростью высвобождения in vitro, которая приближается к скорости высвобождения в таблетках OxyContin. Типично модификатор водопроницаемости служит для изменения водопроницаемости и увеличения высвобождения лекарственного вещества, особенно на последних стадиях растворения. Модификатор водопроницаемости может также служить для корректировки скорости выделения лекарственного вещества. Лекарственное средство в виде множества частиц предпочтительно получают посредством экструзии, пригодной для экструзии смеси. Такая экструзия может представлять собой тип экструзии, описанной в WO 9614058, и обозначается как экструзия расплава. Практически полимер размягчается, так как практически он не мог бы плавиться. Таким образом, изобретение относится к множеству частиц с контролируемым высвобождением,-3 013424 полученных экструзией расплава, которые содержат (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) вещество, увеличивающее водопроницаемость. Предпочтительно оксикодон присутствует в виде фармацевтически приемлемой соли, в частности гидрохлорида оксикодона. Дополнительно пластификатор выбран из цетилового спирта, стеарилового спирта, цетостеарилового спирта, сорбита, сахарозы, полиэтиленгликоля высокой молекулярной массы, дибутилсебацината,трибутилцитрата, триэтилцитрата, пропиленгликоля и полиэтиленгликоля низкой молекулярной массы; смазывающее вещество выбрано из глицерилбегената, талька, диоксида кремния, стеариновой кислоты и соли стеарата. В предпочтительном варианте осуществления изобретения вещество, усиливающее водопроницаемость, выбрано из нерастворимого гидрофильного впитывающего средства, гелеобразующего средства,которое гидратируется до образования геля, чтобы контролировать перемещение воды, полиэтиленгликоля высокой молекулярной массы или водопроницаемого сополимера метакрилата аммония. Предпочтительно вещество, усиливающее водопроницаемость, выбрано из микрокристаллической целлюлозы, кроскармеллозы натрия, кросповидона, натрия крахмала гликолята, гидрогеля высокой молекулярной массы, поли(этиленоксида) высокой степени вязкости и водопроницаемого сополимера метакрилата аммония. Конкретные процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: Более частные процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: Более частные процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: В конкретном варианте осуществления множество частиц по изобретению содержат оксикодон,эудрагит RS РО, стеариловый спирт, глицерилбегенат и эудрагит RL РО. Далее, изобретение относится к лекарственной форме со стандартной дозой, содержащей множество частиц, как описано выше. Предпочтительно стандартная доза содержит дозу оксикодона, достаточную для обеспечения обезболивания у человека, и может быть биоэквивалентной таблеткам OxyContin. Достаточная доза оксикодона составляет от 5 до 400 мг, в частности 5, 10, 20, 40, 80 или 160 мг. Лекарственная форма со стандартной дозой по изобретению может быть представлена в виде капсулы, заполненной указанным множеством частиц. Множество частиц может быть помещено в твердые желатиновые капсулы, каждая из которых содержит стандартную дозу, где масса наполнения капсулы находится в пределах 120-500 мг. Данное изобретение относится также к способу получения множества частиц, как описано выше,который включает приготовление смеси, содержащей (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) вещество, увеличивающее водопроницаемость, и экструзию смеси. В предпочтительном варианте лекарственная форма со стандартной дозой содержит множество частиц по изобретению и множество частиц антагониста оксикодона. Изобретение включает также применение лекарственной формы со стандартной дозой, как описано выше, для купирования боли. Альтернативное изобретение включает применение лекарственной формы со стандартной дозой,как описано выше, для обезболивания.-4 013424 Подробное описание изобретения Оксикодон в виде множества частиц по данному изобретению предпочтительно имеет скорости высвобождения in vitro, которые приближаются к скоростям высвобождения для таблеток OxyContin. Скорости высвобождения таблеток OxyContin отличаются высокой степенью первоначального высвобождения и высокой степенью суммарного высвобождения. Предпочтительно высвобождение оксикодона, по существу, не зависит от величины рН в диапазоне рН от приблизительно 1 до приблизительно 7. Для этого, по существу, независимое от значения рН высвобождение может означать, что для данного препарата при тестировании в среде, моделирующей жидкую среду кишечника при значении рН 6,8, в любой данной точке времени количество высвобождаемого оксикодона в качестве процентного соотношения к первоначальному количеству оксикодона в препарате, по существу, равно процентному количеству высвобождаемого оксикодона, основанному на первоначальном количестве оксикодона в препарате при тестировании в среде, моделирующей жидкую среду желудка при значении рН 1,2. Высвобождение,по существу, одинаково, когда соответствующие количества отличаются на 30%, более предпочтительно на 20% и наиболее предпочтительно на 15%. Если не указано иного способа, авторы изобретения измеряли скорости высвобождения при помощи определенного способа, который включает использование барабанного аппарата для растворения по Европейской Фармакопее при 37 С, 100 об/мин в 900 мл среды, моделирующей жидкую среду желудка согласно Американской Фармакопее (USP) при значении рН 1,2 без фермента. В одном варианте среда растворения представляет собой среду, моделирующую жидкую среду кишечника при значении рН 6,8 без фермента. Для среды, моделирующей жидкую среду желудка при значении рН 1,2, множество частиц оксикодона по данному изобретению типично высвобождает по меньшей мере 15% оксикодона через 1 ч, отражая высокую степень первоначального высвобождения. Предпочтительно они высвобождают по меньшей мере 20%, более предпочтительно по меньшей мере 25% и наиболее предпочтительно по меньшей мере 35% оксикодона через 1 ч. Множество частиц оксикодона по данному изобретению типично высвобождают по меньшей мере 30% оксикодона через 2 ч, отражая высокую степень первоначального высвобождения. Предпочтительно высвобождается по меньшей мере 40%, более предпочтительно по меньшей мере 50% и наиболее предпочтительно по меньшей мере 55% оксикодона через 2 ч. Множество частиц оксикодона по данному изобретению типично высвобождают по меньшей мере 60% оксикодона через 4 ч, отражая высокую степень первоначального высвобождения. Предпочтительно высвобождается по меньшей мере 70%, более предпочтительно по меньшей мере 75% и наиболее предпочтительно по меньшей мере 80% оксикодона через 4 ч. Множество частиц оксикодона по данному изобретению типично высвобождают по меньшей мере 75% оксикодона через 10 ч, отражая высокую степень суммарного высвобождения. Предпочтительно высвобождается по меньшей мере 80%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% оксикодона через 10 ч. Более того, предпочтительно по меньшей мере 85% высвобождения оксикодона через 8 ч. Множество частиц оксикодона по данному изобретению может высвободить 100% оксикодона через 12 ч, отражая высокую степень суммарного высвобождения. Предпочтительное множество частиц по данному изобретению содержит (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) модификатор водопроницаемости. При таком выборе компонентов становится возможным получение множества частиц и, соответственно, капсул, содержащих оксикодон, и которые имитируют характеристики высвобождения in vitro и предпочтительно in vivo таблеток OxyContin. В частности, комбинация,включающая в себя модификатор водопроницаемости, позволяет получить соответствующее первоначальное высвобождение оксикодона (первые часы), при этом сохраняя высокую степень суммарного высвобождения активного компонента в более поздние часы растворения. Гидрохлорид оксикодона представляет собой предпочтительную форму оксикодона, хотя можно использовать другие фармацевтически приемлемые соли. Нерастворимый в воде сополимер метакрилата аммония, также обозначаемый как нерастворимый в воде сополимер аммония метакрилата, подходящим образом представляет собой эудрагит RS РО. Он обладает следующими свойствами: нерастворим или слабо растворим в воде,низкая пористость или проницаемость для воды,совместим с лекарственным веществом и другими добавками,пригоден для экструзии при средних температурах или при более низких температурах в присутствии подходящего пластификатора,стабилен в течение установленного срока хранения и при установленных условиях хранения,температурная устойчивость. В частности, эудрагит RS PO представляет собой термопластичный полимер с низкой водопрони-5 013424 цаемостью, который может значительно задержать высвобождение заключенного в его матрицу оксикодона. Он описан в качестве независимого от значения рН полимерного порошка с низкой проницаемостью для матричных препаратов. Он представляет собой сополимер сложных эфиров акриловой и метакриловой кислот с низким содержанием групп четвертичного аммония, чтобы контролировать проницаемость, и имеет среднюю молекулярную массу приблизительно 150000. Пластификатор служит для размягчения нерастворимого сополимера метакрилата аммония, чтобы сделать его более удобным для экструзии полимера. Для этой цели, типичный пластификатор представляет собой смешиваемое вещество с нерастворимым сополимером метакрилата аммония, чтобы получить уменьшенную прочность на растяжение, более низкую температуру размягчения и уменьшить температуру стеклования, Tg, полимера. Он служит для уменьшения когезии, обеспечивая внутреннее смазывание полимера. Пластификатор в норме выбирают из нерастворимых в воде твердых веществ, таких как цетиловый спирт, стеариловый спирт и цетостеариловый спирт; растворимых в воде твердых веществ, таких как сорбит, и сахароза, и полиэтиленглиголь высокой молекулярной массы; нерастворимых в воде жидкостей, таких как дибутилсебацинат и трибутилцитрат, и растворимых в воде жидкостей, таких как триэтилцитрат, пропиленгликоль и полиэтиленглиголь низкой молекулярной массы. Стеариловый спирт является предпочтительным пластификатором. Другой предпочтительный пластификатор представляет собой полиэтиленгликоль высокой молекулярной массы, предпочтительно с молекулярной массой в диапазоне от 4000 до 10000, такой как PEG 6000. Смазывающее вещество представляет собой технологическую добавку, которая уменьшает трение между смесью пластифицированного полимера и внутренней поверхностью экструдера. Он является в норме твердым веществом и соответствующим образом выбран из стеариновой кислоты, глицерилбегената (преимущественно глицерилдибегената), стеарата магния, стеарата кальция, талька и диоксида кремния (плавленного кварца). Наличие смазывающего вещества в препарате для экструзии улучшает смешивание, перемешивание и конвейерную подачу и уменьшает силы адгезионного взаимодействия. Смягченная смазывающим веществом экструзия при низких или средних температурах улучшает воспроизводимость от партии к партии и уменьшает механическое напряжение как продукта, так и оборудования. Стеариновая кислота, возможно в виде соли, является предпочтительным смазывающим веществом. Другое предпочтительное смазывающее вещество представляет собой глицерилбегенат, который обладает меньшей чувствительностью к значению рН при высвобождении оксикодона in vitro. Пластификаторы могут часто действовать в качестве смазывающего вещества, и смазывающие вещества могут часто действовать в качестве пластификатора. Выбор пластификатора и смазывающего вещества обычно влияет на характеристики полученных в результате посредством экструзии множества частиц. Например, когда пластификатор представляет собой стеариловый спирт и смазывающее вещество представляет собой стеариновую кислоту, количества и соотношения относительно друг друга и относительно сополимера метакрилата аммония могут значительно изменять скорость высвобождения лекарственного вещества. Авторы изобретения обнаружили,что более высокие уровни стеарилового спирта уменьшают Tg полимера, и полагают, что такое уменьшение влияет на скорость высвобождения лекарственного вещества. Однако более высокие уровни стеариновой кислоты могут также улучшить смешивание, перемешивание и экструзию, а также изменять скорость высвобождения оксикодона. Авторы изобретения обнаружили, что более высокие соотношения стеариновой кислоты исключительно за счет стеарилового спирта показывают значительное уменьшение скорости высвобождения и суммарного процента высвобождения оксикодона. Модификаторы водопроницаемости корректируют выделение лекарственного вещества из лекарственной формы. Типично модификаторы водопроницаемости служат для увеличения высвобождения лекарственного вещества, особенно на поздних стадиях растворения, хотя авторы изобретения также рассматривают, что модификаторы водопроницаемости могли бы в некоторых случаях играть роль в замедлении высвобождения. Примеры средств, используемых для изменения водопроницаемости полученных экструзией множества частиц, включают в себя нерастворимое гидрофобное впитывающее средство,гелеобразующее средство, которое гидратируется до образования геля для контроля перемещения воды,полиэтиленгликоль высокой молекулярной массы, такой как ПЭГ 6000, или водопроницаемый сополимер метакрилата аммония, такой как эудрагит RL РО, также обозначаемый как сополимер аммония метакрилата. Эудрагит RL PO описан в качестве высокопроницаемого независимого от значения рН полимерного порошка для матричных препаратов. Он представляет собой сополимер сложных эфиров акриловой и метакриловой кислот с содержанием групп четвертичного аммония, чтобы обеспечить проницаемость, и имеет среднюю молекулярную массу приблизительно 150000. Например, микрокристаллическая целлюлоза, гидрогели высокой молекулярной массы, такие как гидроксипропилцеллюлоза высокой вязкости и поли(этиленоксид) высокой вязкости, и водопроницаемые сополимеры метакрилата аммония можно использовать для увеличения суммарного высвобождения активного компонента. В данном последнем отношении сополимер метакрилата аммония, используемый в качестве средства (е) для изменения водопроницаемости, не является тем же самым полимером, что и нерастворимый в воде сополимер метакрилата аммония, используемый в качестве ингредиента (b), более водопроницаем вследствие различных степеней замещения группами четвертичного аммония.-6 013424 Микрокристаллическая целлюлоза улучшает диффузию воды и обмен и, таким образом, увеличивает высвобождение лекарственного вещества. Микрокристаллическая целлюлоза действует в качестве нерастворимого, но гидрофильного впитывающего средства. Альтернативами для микрокристаллической целлюлозы являются кроскармелоза натрия, кросповидон или эфир крахмала натрия и гликолевой кислоты. Гидроксипропилметилцеллюлоза (НРМС) высокой молекулярной массы (высокой степени вязкости) сначала гидратируется до образования плотного геля для контроля за перемещением воды. Гидратированный гель затем ступенчато растворяют и/или размывают в течение некоторого времени, сохраняя поры и высокопроницаемую структуру. Согласно данной гипотезе полагают, что НРМС высокой вязкости незначительно увеличивает высвобождение лекарственного вещества в течение первых часов, но увеличивает высвобождение в более поздние моменты времени. Другие гелеобразующие средства являются кандидатами, включающими полиоксиэтиленоксид, пектин, смолу плодов рожкового дерева или ксантановую смолу. Эудрагит RL PO представляет собой аналог с высокой водопроницаемостью и может значительно увеличивать скорость высвобождения и суммарное высвобождение лекарственного вещества. Подходящие количества процентного содержания ингредиентов с (а) по (е), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: Другие добавки можно также применять для получения множества частиц с рядом предварительно определенных характеристик. Наполнители, например лактоза, микрокристаллическая целлюлоза и фосфат кальция, являются широко используемыми фармацевтическими наполнителями, и их можно использовать в настоящем изобретении для изменения скоростей высвобождения и/или суммарного высвобождения. Для целей модификации скорости высвобождения и увеличения суммарного высвобождения могут рассматриваться другие средства, модифицирующие высвобождение. Предпочтительные препараты содержат оксикодон предпочтительно в виде соли гидрохлорида,эудрагит RS PO в качестве нерастворимого в воде сополимера метакрилата аммония, стеариловый спирт в качестве пластификатора, глицерилбегенат в качестве смазывающего вещества и эудрагит RL PO в качестве модификатора водопроницаемости. Для производства множества частиц по данному изобретению ингредиенты смешивают и подвергают экструзии. Подробные описания подобных процедур приведены в WO 9614058, которая полностью включена сюда в качестве определенной ссылки. Для настоящего изобретения авторы изобретения используют двухшнековый экструдер, который может содержать шнеки одностороннего вращения или противоположного вращения. Существенно, что смесь в качестве порошка подается подающим механизмом в первый сегмент цилиндра обычно при относительно низкой температуре, например 10-20 С, чтобы обеспечить постоянный ток порошка в цилиндрах с высокой температурой. Подающий механизм обеспечивает единообразный поток смеси в экструдер. Постоянная подвижность необходима, поскольку неравномерные и изменяющиеся скорости подачи могут привести к получению множества частиц с различными физическими свойствами, такими как плотность и пористость. Предпочтительные экструдеры спроектированы с двойными шнеками, предпочтительно шнеками противоположного вращения, для задачи перемещения, смешивания, прессования, нагревания и размягчения смеси. В зависимости от выбора компонентов смеси и условий экструзии возможно, что смесь будут расплавлять так же, как и размягчать. Шнеки, которые выполняют значительную часть данного процесса экструзии, изготовлены из различных более мелких элементов, выбранных из множества винтовых элементов и элементов мешалки. Время смешивания и перемешивания может значительно изменяться при изменении типа, длины и конфигурации винтовых элементов и, возможно, элементов мешалки. Ко-7 013424 роткие продолжительности обработки и средние или низкие поперечные силы вносят вклад в безопасность процесса обработки и стабильность продукта даже для чувствительных к нагреванию лекарственных веществ. Примеры доступных экструдеров включают экструдеры, производимые Leistritz, Brabender,Randcastle и Kurimoto Co. Ltd. Скорости вращения шнеков могут вносить вклад в качество получаемого лекарственного средства в виде множества частиц. Высокие скорости вращения без соответствующего выравнивания скорости подачи смеси могут привести к получению множества частиц высокой степени пористости с различной скоростью высвобождения лекарственного вещества. С другой стороны, слабое вращение шнеков будет приводить к излишне продолжительному времени обработки. Вакуум, подведенный к цилиндру экструдера, необходим, чтобы удалить захваченный размягченной смесью воздух и, таким образом, получить плотные непористые множества частиц. Экструзионная головка типично сконструирована так, чтобы получить множество тяжей фиксированного диаметра. Количество, форма и диаметр отверстий можно менять так, чтобы они подходили предварительно определенным характеристикам. В дополнение к винтовой скорости другими основными имеющими влияние параметрами являются момент затяжки винта, температура в отдельном цилиндре и давление и температура в экструзионной головке. Согласно одному процессу резания по данному изобретению полученные посредством экструзии тяжи выходят из экструзионной головки на конвейер. На диаметр тяжа влияет скорость подачи смеси,диаметр отверстия в экструзионной головке, винтовая скорость, температура в цилиндре, быстродействие захватывающих роликов и скорость передачи по конвейеру. Передача по конвейеру подходит для того, чтобы перенести полученный посредством экструзии тяж к лазерному датчику или другому измерительному прибору, чтобы достичь необходимого диаметра, такого как 1,0 мм. Во время данного процесса передачи по конвейеру тяжи постепенно охлаждаются, но в существенной степени сохраняют гибкость. Гибкие тяжи сохраняют целостность в измерительном лазерном устройстве между подающими захватывающими роликами гранулятора и во время вхождения в гранулятор. Быстро охлаждаемые тяжи,в зависимости от препарата, могут потерять свою целостность и разрушиться во время прохождения через захватывающие ролики и гранулятор до множества разноформенных и неравномерных по размеру частиц. Тяжи подают в гранулятор посредством захватывающих роликов. В грануляторе поданные тяжи разрезают, например, с использованием режущего инструмента с дисковым ножом до предварительно определенной длины, например 1,0 мм. Скорость подачи тяжей и скорость нарезания в грануляторе определяют длину множества частиц. В общем, координация/взаимодействие между устройством для подачи порошка, экструдером, конвейером, лазерным измерителем и гранулятором является важным параметром, влияющим на количество, качество и воспроизводимость готовых продуктов из множества частиц. Лекарственное средство в виде множества частиц, полученных при такой процедуре нарезания, где полученные посредством экструзии тяжи поступают из экструзионной головки, типично принимает форму цилиндров. В другой предпочтительной процедуре нарезания режущее устройство разрезает полученную посредством экструзии смесь, поскольку она появляется под давлением и по-прежнему размягченной из отверстий пластины экструзионной головки. Режущее устройство подходящим образом представляет собой вращающееся режущее устройство с одним или более лезвиями, которые располагаются по поверхности экструзионной головки для прохождения над отверстиями. Два диаметрально противоположных лезвия предпочтительны. В идеале, границы внутренней и внешней поверхности экструзионных отверстий покрыты непригораемым материалом, например политетрафторэтиленом (PTFE). Поскольку нарезанные частицы экструдата расширяются и охлаждаются, они имеют тенденцию образовывать закругленные поверхности. При соответствующем выравнивании экструзионного давления скорости экструзии и быстродействия лезвий режущего устройства возможно наладить получение сферических или близких к сферическим множества частиц. Альтернативно, такой способ можно задействовать для получения палочек, если необходимо. В одном осуществлении струю воздуха направляют на поверхность экструзионной головки, причем подается воздух при пониженной температуре для охлаждения экструдата и быстроты затвердевания. Лекарственное средство в виде множества частиц сферической формы, полученных посредством такого способа, обладают некоторым количеством возможных преимуществ лучшая воспроизводимость от партии к партии,более простое покрытие и необходимость меньшей массы покрытия,лучшее заполнение капсулы и более высокий выход продукта,более стабильны при повышенной температуре,в большей степени защищены от несанкционированного применения,сокращенная технология производства и выделения целевого продукта,уменьшают или удаляют некоторые проблемы, которые возникают во время передачи по конвейеру-8 013424 и гранулирования тяжей, таких как разрушение тяжей до гранул разной длины и электростатический заряд. Множество частиц можно разделить на такие стандартные дозы, что каждая отдельная стандартная доза включает в себя дозу оксикодона, достаточную для обеспечения обезболивания у млекопитающих,предпочтительно человека. Подходящая доза оксикодона составляет от 5 до 400 мг, в частности стандартные дозы по 5, 10, 20, 40, 80 или 160 мг. В данном отношении, стандартная доза содержит эффективное количество терапевтически активного средства для того, чтобы обеспечить купирование боли и/или обезболивание у пациента. Доза оксикодона, вводимая пациенту, будет изменяться вследствие множества факторов, включающих в себя массу пациента, тяжесть болевых ощущений, метаболический статус и природу каких-либо других терапевтических средств, которые будут вводиться. В одном предпочтительном осуществлении лекарственным средством в виде множества частиц заполняют твердые желатиновые капсулы, каждая из которых содержит стандартную дозу. Масса наполнения в капсуле предпочтительно находится в диапазоне от 80 до 500 мг, более предпочтительно от 120 до 500 мг. В вариантах данного изобретения стандартные дозы лекарственного средства в виде множества частиц можно помещать в другие твердые фармацевтические препараты, например, используя прессование и придание формы таблеток или преобразуя полученный посредством экструзии продукт в форму суппозитория. Капсулы и другие формы стандартных доз по данному изобретению предназначены для введения с интервалами приблизительно 12 ч. Для этой цели, лекарственная форма со стандартной дозой подходящим образом имеет скорость растворения оксикодона in vitro при измерении посредством способа с лопастной мешалкой согласно Американской Фармакопее (см. U.S. Pharmacopoeia XXII 1990) при 100 об/мин в 900 мл водного буфера (значение рН от 1,6 до 7,2) при 37 С, в диапазоне от 12,5 до 42,5 мас.% высвобожденного оксикодона через 1 ч, от 25 до 56 мас.% высвобожденного оксикодона через 2 ч, от 45 до 75 мас.% высвобожденного оксикодона через 4 ч и от 55 до 85 мас.% высвобожденного оксикодона через 6 ч. Более того, авторы изобретения предпочитают, чтобы максимальный уровень в плазме оксикодона, полученный in vivo, имел место в диапазоне от 2 до 4,5 ч после введения лекарственной формы. Большее количество информации по необходимым характеристикам таких препаратов оксикодона приведено в WO 9310765, которая полностью включена сюда посредством определенной ссылки. Используя определенный способ при значении рН 1,2, моделирующий жидкую среду желудка, скорости высвобождения подходящим образом являются следующими. Предпочтительные пределы При использовании определенного способа авторов изобретения при значении рН 6,8 среды, моделирующей жидкую среду кишечника, скорости высвобождения подходящим образом являются следующими. В качестве альтернативы введению с интервалами приблизительно 12 ч капсулы или другие стандартные лекарственные формы по данному изобретению предназначены для введения с интервалами приблизительно 24 ч. Для этой цели стандартная лекарственная форма подходящим образом имеет скорость растворения оксикодона in vitro при измерении посредством способа с лопастной мешалкой по Фармакопее США при 100 об/мин в 900 мл водного буфера при значении рН от 1,6 до 7,2 при 37 С, от 0 до приблизительно 40% за 1 ч, от приблизительно 8 до приблизительно 70% за 4 ч, от приблизительно 20 до приблизительно 80% за 8 ч, от приблизительно 30 до приблизительно 95% за 12 ч, от приблизительно 35 до приблизительно 95% за 18 ч и более чем приблизительно 50 за 24 ч. Более того, авторы изобретения предпочитают, чтобы максимальный уровень в плазме оксикодона, полученный in vivo, достигался от приблизительно 2 до приблизительно 17 ч после введения лекарственной формы в состоянии равновесия. Большее количество информации по необходимым характеристикам таких препаратов оксикодона приведено в WO 02087512, которая полностью включена сюда в качестве определенной ссылки. В одном из вариантов настоящее изобретение относится к однократным дозам, которые содержат оксикодон и антагонист оксикодона, эффективный для предотвращения несанкционированного применения. В этом отношении делают ссылку на WO 0313433, которая полностью включена сюда в виде определенной ссылки. В частности, стандартная доза может содержать оксикодон и налтрексон. Можно использовать другие опиоидные антагонисты, которые известны в данной области, например налоксон. Настоящее изобретение относится к полученному посредством экструзии множеству частиц оксикодона и полученному посредством экструзии множеству частиц антагониста оксикодона, такого как налтрексон. Множество частиц налтрексона не высвобождают налтрексон при обычном введении и, например, имеют покрытие, предотвращающее высвобождение. Обе совокупности предпочтительно визуально и физически идентичны. Важный аспект данного изобретения заключается в том, что капсулу со стандартной дозой наполняют массой менее чем 500 мг, содержащей приблизительно до 350 мг множества частиц оксикодона и приблизительно до 200 мг защищающих от несанкционированного применения множества частиц антагониста оксикодона. Например, может быть от 120 до 300 мг множества частиц оксикодона и от 125 до 175 мг защищающих от несанкционированного применения множества частиц антагониста оксикодона. Краткое описание чертежей Ссылка приведена на следующий экспериментальный раздел для сопровождения чертежей, в которых фиг. 1 представляет собой схематическое представление одной из линий шнеков двухшнекового экструдера Leistritz 18, используемого в примерах; на фиг. 2 показано влияние соотношения стеарилового спирта:стеариновой кислоты на скорость высвобождения полученных посредством экструзии множества частиц оксикодона;- 10013424 на фиг. 3 показано влияние эудрагит RL РО на скорость высвобождения гидрохлорида оксикодона из полученных посредством экструзии множества частиц, содержащих 8,3 мас./мас.% оксикодона; на фиг. 4 показано влияние эудрагит RL РО на скорость высвобождения гидрохлорида оксикодона из полученных посредством экструзии множества частиц, содержащих 25 мас./мас.% оксикодона; на фиг. 5 показано влияние микрокристаллической целлюлозы на скорость высвобождения гидрохлорида оксикодона из полученных посредством экструзии множества частиц, содержащих 8,3 мас./мас.% оксикодона; на фиг. 6 показано влияние микрокристаллической целлюлозы на скорость высвобождения гидрохлорида оксикодона из полученных посредством экструзии множества частиц, содержащих 25 мас./мас.% оксикодона; на фиг. 7 показано влияние НРМС высокой степени вязкости на скорость высвобождения гидрохлорида оксикодона из полученных посредством экструзии множества частиц, содержащих 8,3 мас./мас.% оксикодона; на фиг. 8 показано влияние НРМС высокой степени вязкости на скорость высвобождения гидрохлорида оксикодона из полученных посредством экструзии множества частиц, содержащих 25 мас./мас.% оксикодона; на фиг. 9 описаны некоторые данные по растворению in vitro для трех партий множества частиц по данному изобретению и для коммерческого продукта таблеток OxyContin; на фиг. 10-16 описаны данные in vivo для трех партий множества частиц на фиг. 9 и для коммерческого продукта таблеток OxyContin; на фиг. 17-19 приведены некоторые дополнительные кривые растворения. Примеры изобретения Стандартизованные условия. Для последующей экспериментальной работы были установлены стандартизованные условия для экструзии смесей гидрохлорида оксикодона. Экструдер представлял собой Leistritz 18 при 140 об/мин со скоростью подачи 2,6 кг/ч, производящий гранулы диаметром 1 мм и длиной 1 мм. Конструкция шнека показана на фиг. 1 с использованием компонентов, обозначенных производственными кодами дистрибьютера Leistritz USA. Цель заключается в оптимизации смеси при добавлении дополнительных смешивающих компонентов GGC2 или ZS, чтобы избежать проблем при смешивании, и в увеличении времени обработки, добавляя элементы FD, чтобы избежать проблем при смачивании. Экструдер содержит десять зон, причем зона 1 располагается от 0 до 5D на фиг. 1; зона 2 располагается от 5D до 10D на фиг. 1 и так до зоны 8, располагающейся от 35D до 40D, и затем зоны 9 и 10 находятся в экструзионной головке. Типичные температуры варочной зоны были следующими (С): Для примеров 9-11 температуры значительно возрастали. Скорость подачи и быстродействие шнека, в основном, сохраняли постоянной, хотя скорость передачи по конвейеру, быстродействие захватывающих роликов и быстродействие гранулятора изменяли согласно свойствам экструдата, когда он появлялся из пластины экструзионной головки (это сильно зависит от способа, по которому вытягивается экструдат, и, следовательно, трудно соотносить с предыдущими партиями). Две загрузки лекарственного вещества (8,3 и 25 мас.%) для препаратов с полученным посредством экструзии множеством частиц оксикодона (см. таблицы) были предназначены для получения доз по 10 и 40 мг.- 11013424 Для загрузки оксикодона 8,3% приготовили следующие пробные замесы, в которых массы представлены в мг на однократную дозу. Для загрузки оксикодона 25% приготовили следующие пробные замесы, в которых массы представлены в мг на однократную дозу. Исследование скорости высвобождения. Полученное посредством экструзии множество частиц оксикодона из примеров 1-19 исследовали на растворение с использованием барабанного аппарата для растворения по Европейской Фармакопее при 37 С, 100 об/мин в 900 мл среды, моделирующей жидкую среду желудка согласно Американской Фармакопее (USP) со значением рН 1,2 без фермента. Для анализа использовали стандартные процедуры ВЭЖХ. Дополнительно, полученное посредством экструзии множество частиц оксикодона из примера 9 исследовали на растворение с использованием барабанного аппарата для растворения по Европейской Фармакопее при 37 С, 100 об/мин в 900 мл USP, моделирующего жидкую среду кишечника со значением рН 6,8 без фермента. Для анализа снова использовали стандартные процедуры ВЭЖХ. Измеряли скорости высвобождения in vitro и приводили результаты, показанные на прилагаемых фиг. 2-9 и 17-19. Эудрагит RL РО. При загрузке гидрохлорида оксикодона 8,3% присутствие в полученном посредством экструзии множестве частиц 5, 8 или 20 мг эудрагита RL PO/120 мг значительно увеличивало скорость высвобождения (см. фиг. 3). Схожим образом, для множества частиц с загрузкой оксикодона 25% 3 и 5 мг эудрагита RL PO/160 мг показывали сравнимое влияние на скорость высвобождения (см. фиг. 4). Микрокристаллическая целлюлоза. Микрокристаллическую целлюлозу в количестве 10 и 13 мг/120 мг, полученных посредством экструзии множества частиц оксикодона, и 8 и 12 мг/160 мг, полученных посредством экструзии множества частиц оксикодона, использовали в препаратах с загрузкой гидрохлорида оксикодона 8,3 и 25% соответственно. Влияние микрокристаллической целлюлозы на скорость высвобождения и суммарное высвобождение гидрохлорида оксикодона представлено на фиг. 5 и 6 для загрузки лекарственного вещества 8,3 и 25% соответственно. Гидроксипропилметилцеллюлоза. НРМС высокой степени вязкости (НРМС K100 М) в количествах 8 и 12 мг/120 мг и 8 и 12 мг/160 мг использовали для полученного посредством экструзии множества частиц с загрузкой лекарственного вещества 8,3 и 25% соответственно. Исследование высвобождения при растворении показывает, что более выраженное суммарное высвобождение гидрохлорида оксикодона достигали в более поздние моменты времени (см. фиг. 7 и 8). Глицерилбегенат. Данные по растворению для препаратов из примеров 9-11 приведены на фиг. 17-19, и они демонстрируют, что добавление глицерилбегената может привести к необходимой высокой степени первоначального высвобождения, сопоставимого с высокой степенью суммарного высвобождения. На фиг. 17SGF обозначает результаты для смоделированной жидкой среды желудка и SIF обозначает результаты для смоделированной жидкой среды кишечника. Можно увидеть, что высвобождение оксикодона, по существу, не зависит от рН. В настоящее время предпочтительными продуктами являются примеры 9, 10 и 11, причем примеры 10 и 11 наиболее предпочтительны. Исследование биодоступности. Препараты из примеров 2, 5 и 8 исследовали совместно с таблетками OxyContin в исследовании фазы I биодоступности, где их определяли как В, А и С соответственно. Исследование представляло собой четырехпериодное перекрестное исследование рандомизированного неполного блока, охватывающее 24 здоровых субъекта мужского и женского пола. Капсулы с однократной дозой 210 мг (всего 20 мг) из примеров 2, 5, 8 или 20 мг таблетки OxyContin давали субъектам. Каждый исследуемый препарат вводили после голодания в течение ночи или после всасывания обильного завтрака. Усредненные профили плазмы in vivo из данного исследования показаны на фиг. 10-16, и средние значения параметров сведены в следующей таблице. Данные по растворению in vitro для данных препаратов и таблеток OxyContin показаны на фиг. 9. За исключением примера 8, препараты оксикодона обеспечивают эквивалентную биодоступность оксикодона по величинам AUCt и AUCINF относительно таблеток OxyContin и относительно друг друга. На фиг. 10 показано, что все три препарата имеют схожие средние концентрации оксикодона в плазме через 12 часов, наводя на мысль, что все три препарата проявляют потенциальные возможности для разработки их в качестве 12-часового продукта. На фиг. 11 показано, что пример 5 натощак был наиболее похож на таблетки OxyContint по величинам AUCt, AUCINF И Cmax. Пример 20. Комбинация продукта, защищенного от несанкционированного применения. Совместная инкапсуляция полученных посредством экструзии множества частиц оксикодона и полученного посредством экструзии налтрексона или полученных посредством экструзии множества частиц налтрексона можно использовать в комбинированном продукте, защищенном от несанкционированного применения. Множеством частиц оксикодона и множеством частиц налтрексона, как описано в WO 03013433,можно наполнять капсулы, используя одно- или двустадийный способ наполнения. Количество множества частиц налтрексона, которое можно использовать для заполнения, составляет 150 мг, содержащее 8 мг налтрексона. Рекомендуемые массы наполнения множества частиц оксикодона для того, чтобы достичь дозы оксикодона, находящейся в диапазоне от 10 до 40 мг, представляют собой значения, указанные ниже (см. также следующую таблицу): 1) 120 и 240 мг множества частиц с загрузкой лекарственного вещества 8,3 мас./мас.% для доз оксикодона 10 и 20 мг соответственно; 2 а) 120 мг множества частиц с загрузкой лекарственного вещества 33,3% мас./мас.% для дозы оксикодона 40 мг или 2b) 160 мг множества частиц с загрузкой лекарственного вещества 25% мас./мас.% для дозы оксикодона 40 мг.- 14013424 Кроме того, дозы оксикодона 5 и 80 мг также можно рассмотреть с соответствующими массами для наполнения капсул, как изложено ниже: 1) 60 мг множества частиц с загрузкой лекарственного вещества 8,3 мас./мас.% для дозы оксикодона 5 мг. 2 а) 240 мг множества частиц с загрузкой лекарственного вещества 33,3 мас./мас.% для дозы оксикодона 80 мг или 2b) 320 мг множества частиц с загрузкой лекарственного вещества 25% мас./мас.% для дозы оксикодона 80 мг. Для загрузки лекарственного вещества 33,3 мас./мас.% приготовили следующие пробные препараты, обозначенные как 20.А и 20.В, где массы представлены в виде мг на однократную дозу Данные два препарата первоначально производились для подтверждения специфики действия продукта с более высоким содержанием активного вещества и без эудрагит RL РО. Профили растворения для данных препаратов были более медленными, чем требовалось, и их можно легко изменить, используя модификатор водопроницаемости по изобретению. Заполнение капсул необходимыми соотношениями множества частиц оксикодона и налтрексона можно достичь, используя либо одностадийный способ, либо предпочтительно двустадийный способ заполнения. В одностадийном способе заполнения соответствующие соотношения множества частиц можно предварительно смешать и заполнить капсулы либо ручным, либо предпочтительно автоматизированным способом. По предпочтительному двустадийному способу заполнения один тип множества частиц можно поместить в капсулу на первой стадии либо ручным, либо предпочтительно автоматизированным способом. Второй тип множества частиц можно затем поместить в капсулу на второй стадии снова либо ручным, либо предпочтительно автоматизированным способом. Теоретические массы для наполнения диапазона капсул с различным содержанием активного вещества, основанные на загрузке лекарственного вещества, приведены в следующих таблицах. Масса ниже предполагаемой минимальной возможной массы для заполнения капсулы.+ Включены в качестве иллюстрации возможностей, если необходимы более низкая или более высокая концентрации в диапазоне.120 мг множества частиц налтрексона+20% оболочки. Масса, ниже предполагаемой минимальной возможной массы для заполнения капсулы.+ Включены в качестве иллюстрации возможностей, если необходимы более низкая или более высокая концентрации в диапазоне.120 мг множества частиц налтрексона+20% оболочки. Пример 21. Альтернативная процедура нарезания. В данном примере использовали альтернативную процедуру нарезания. Экструдат появляется из двенадцати отверстий экструзионной головки, показанной на фиг. 8 экструдера Leistritz 18. Ротационный режущий аппарат с двумя лезвиями использовали для того, чтобы нарезать полученную посредством экструзии смесь, поскольку она появляется под давлением и, кроме того, горячей из отверстий пластины экструзионной головки. Лезвия охватывают всю поверхность головки-насадки, чтобы пройти над отверстиями. Отрезанные частицы экструдата, поскольку они растягиваются и охлаждаются, имеют тенденцию принимать вид с закругленными поверхностями. Использовали следующий препарат. При соответствующем выборе параметров экструзии, включающих в себя температуры и скорости охлаждения, можно получить множество сферических или, по существу, сферических частиц. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Множество частиц с контролируемым высвобождением, полученных экструзией расплава, которые содержат (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор, (d) смазывающее вещество и (е) модификатор водопроницаемости, который представляет собой водопроницаемый сополимер метакрилата аммония или гидроксипропилметилцеллюлозу. 2. Множество частиц по п.1, где оксикодон присутствует в виде фармацевтически приемлемой соли. 3. Множество частиц по п.2, где оксикодон присутствует в виде гидрохлорида оксикодона. 4. Множество частиц по любому из пп.1-3, где пластификатор выбран из цетилового спирта, стеарилового спирта, цетостеарилового спирта, сорбита, сахарозы, полиэтиленгликоля высокой молекулярной массы, дибутилсебацината, трибутилцитрата, триэтилцитрата, пропиленгликоля и полиэтиленгликоля низкой молекулярной массы. 5. Множество частиц по п.4, где пластификатор представляет собой стеариловый спирт. 6. Множество частиц по п.4, где пластификатор представляет собой полиэтиленгликоль высокой молекулярной массы. 7. Множество частиц по любому из пп.1-6, где смазывающее вещество выбрано из глицерилбегената, талька и диоксида кремния. 8. Множество частиц по п.7, где смазывающее вещество представляет собой глицерилбегенат. 9. Множество частиц по любому из пп.1-6, где смазывающее вещество представляет собой стеариновую кислоту или соль стеарат. 10. Множество частиц по любому из пп.1-9, где модификатор водопроницаемости представляет собой водопроницаемый сополимер метакрилата аммония. 11. Множество частиц по любому из пп.1-10, где модификатор водопроницаемости представляет собой эудрагит RL РО. 12. Множество частиц по любому из пп.1-11, где процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: 13. Множество частиц по п.12, где процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: 14. Множество частиц по п.12, где процентные количества ингредиентов (a)-(e), основанные на общей массе пяти ингредиентов, приведены в следующей таблице: 15. Множество частиц по п.1, которые содержат оксикодон, эудрагит RS PO, стеариловый спирт,глицерилбегенат и эудрагит RL РО. 16. Лекарственная форма со стандартной дозой, содержащая множество частиц по любому из предшествующих пунктов. 17. Лекарственная форма со стандартной дозой по п.16, в которой стандартная доза содержит дозу оксикодона, достаточную для обеспечения обезболивания у человека. 18. Лекарственная форма со стандартной дозой по п.17, которая биоэквивалентна таблеткамOxyContin. 19. Лекарственная форма со стандартной дозой по п.17 или 18, в которой достаточная доза оксикодона составляет от 5 до 400 мг. 20. Лекарственная форма со стандартной дозой по п.19, в которой стандартная доза оксикодона составляет 5, 10, 20, 40, 80 или 160 мг. 21. Лекарственная форма со стандартной дозой по любому из пп.16-20 в виде капсулы, заполненной указанным множеством частиц. 22. Лекарственная форма со стандартной дозой по п.21, в которой множество частиц помещены в твердые желатиновые капсулы, каждая из которых содержит стандартную дозу. 23. Лекарственная форма со стандартной дозой по п.22, в которой масса наполнения капсулы находится в пределах 120-500 мг. 24. Способ получения множества частиц по п.1, который включает приготовление смеси, которая содержит (а) оксикодон, (b) нерастворимый в воде сополимер метакрилата аммония, (с) пластификатор,(d) смазывающее вещество и (е) модификатор водопроницаемости, который представляет собой водопроницаемый сополимер метакрилата аммония или гидроксипропилметилцеллюлозу, и экструзию смеси. 25. Лекарственная форма со стандартной дозой, содержащая множество частиц по любому из пп.115 и множество частиц антагониста оксикодона. 26. Применение лекарственной формы со стандартной дозой по любому из пп.16-23 для купирования боли. 27. Применение лекарственной формы со стандартной дозой по любому из пп.16-23 для обезболивания.
МПК / Метки
МПК: A61P 29/00, A61K 31/485
Метки: множества, лекарственное, средство, частиц, виде
Код ссылки
<a href="https://eas.patents.su/23-13424-lekarstvennoe-sredstvo-v-vide-mnozhestva-chastic.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственное средство в виде множества частиц</a>
Предыдущий патент: Способ и система извлечения этана
Следующий патент: Быстрорастворимая лекарственная форма соединения, действующего на кальциевый рецептор
Случайный патент: Устройство связи и способ связи