Композиции комплексов эстроген-циклодекстрин
Формула / Реферат
1. Композиция, содержащая
I) комплекс эстрогена циклодекстирина в гранулированном препарате, где если гранулированный препарат содержит поливинилпирролидон, то он присутствует в концентрации не более 2 мас.%; и необязательно
II) один или несколько эксципиентов,
причем композиция обладает такой стабильностью, что после хранения в течение 12 месяцев при 40оС относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена.
2. Композиция по п.1, где эстроген выбирают из группы, включающей этинилэстрадиол (ЭЭ), эстрадиол, сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон и сульфат эстрона или их смеси.
3. Композиция по п.1 или 2, где эстроген выбирают из группы, включающей этинилэстрадиол (ЭЭ), сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон и сульфат эстрона или их смеси.
4. Композиция по п.3, где эстроген представляет собой этинилэстрадиол (ЭЭ).
5. Композиция по любому из предыдущих пунктов, где циклодекстрин выбирают из группы, включающей a-циклодекстрин, b-циклодекстрин, d-циклодекстрин и их производные.
6. Композиция по п.5, где циклодекстрин представляет собой b-циклодекстрин или его производные.
7. Композиция по любому из предыдущих пунктов, где эстроген присутствует в количестве, которое соответствует терапевтически эквивалентному количеству этинилэстрадиола, составляющему примерно 0,002-2 мас.%.
8. Композиция по любому из пп.1-6, где эстроген присутствует в количестве примерно 0,002-2 мас.%.
9. Композиция по любому из предыдущих пунктов, где эстроген представляет собой этинилэстрадиол и циклодекстрин представляет собой b-циклодекстрин, причем этинилэстрадиол присутствует в количестве примерно 5-20 мас.% относительно массы комплекса этинилэстрадиол- b-циклодекстрин.
10. Композиция по любому из предыдущих пунктов, где эстроген присутствует в таком количестве относительно циклодекстрина, что молярное соотношение эстрогена и циклодекстрина составляет примерно от 2:1 до 1:10.
11. Композиция по любому из предыдущих пунктов, дополнительно содержащая одно или несколько терапевтических действующих веществ.
12. Композиция по п.11, где одно или несколько терапевтических действующих веществ представляет собой прогестоген.
13. Композиция по п.12, где прогестоген выбирают из группы, включающей дроспиренон, левоноргестрел, норгестрел, гестоден, диеногест, ацетат ципротерона, норэтистерон, ацетат норэтистерона, десоргестрел и 3-кетодесоргестрел.
14. Композиция по п.13, где прогестоген представляет собой дроспиренон.
15. Композиция по п.14, где дроспиренон является тонкоизмельченным.
16. Композиция по п.14 или 15, где дроспиренон присутствует в количестве примерно 0,4-20 мас.%.
17. Композиция по любому из предыдущих пунктов, где гранулированный препарат имеет относительную влажность не более 55% при определении при температуре 20-40шС.
18. Композиция по любому из предыдущих пунктов, содержащая не более 1 мас.% поливинилпирролидона.
19. Композиция по любому из предыдущих пунктов, где один или несколько эксципиентов выбирают из группы, включающей крахмал, целлюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и мальтодекстрин.
20. Композиция по любому из предыдущих пунктов, где комплекс является тонкоизмельченным.
21. Композиция по любому из предыдущих пунктов, дополнительно содержащая антиоксидант.
22. Стандартная дозируемая форма, включающая композицию по пп.1-21.
23. Стандартная дозируемая форма по п.22, представляющая собой таблетку, капсулу или саше.
24. Способ приготовления композиции, содержащей комплекс эстроген-циклодекстрин, который предусматривает следующие стадии:
I) получение комплекса эстрогена и циклодекстрина;
II) загрузку комплекса и одного или нескольких эксципиентов в гранулятор;
III) нанесение жидкости на загруженный комплекс и один или несколько эксципиентов в таких условиях грануляции, чтобы получать гранулы, относительная влажность которых не превышает 60% при определении при температуре 20-40oС, причем, если один или несколько эксципиентов представляет(ют) собой поливинилпирролидон, то он присутствует в композиции в концентрации не выше 2 мас.%.
25. Способ по п.24, где гранулированный препарат имеет относительную влажность не более 55% при определении при температуре 20-40шС.
26. Способ по п.24 или 25, где эстроген выбирают из группы, включающей этинилэстрадиол (ЭЭ), эстрадиол, сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон и сульфат эстрона или их смеси.
27. Способ по п.26, где эстроген представляет собой этинилэстрадиол (ЭЭ).
28. Способ по любому из пп.24-27, где содержание поливинилпирролидона не превышает 1 мас.%.
29. Композиция, полученная согласно способу по любому из пп.24-28.
30. Способ повышения стабильности эстрогена в композиции, который предусматривает следующие стадии:
I) получение комплекса эстрогена и циклодекстрина; и
II) смешение в условиях грануляции указанного комплекса с одним или несколькими эксципиентами таким образом, чтобы относительная влажность конечного гранулята не превышала 60% при ее определении при температуре 20-40шС, причем, если один или несколько эксципиентов представляет(ют) собой поливинилпирролидон, то он присутствует в композиции в концентрации не выше 2 мас.%.
31. Способ по п.30, в котором поливинилпирролидон присуствует в композиции в количестве не более 1 мас.%.
32. Применение комплекса эстрогена и циклодекстрина для женской контрацепции, причем комплекс находится в форме композиции, которая содержит гранулированный препарат указанного комплекса, причем, если композиция содержит поливинилпирролидон, то он присутствует в концентрации не выше 2 мас.%, композиция обладает такой стабильностью, что после хранения в течение 12 месяцев при 40шС относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена.
33. Применение по п.32, где композиция представляет собой композицию по любому из пп.2-21 или 29.
34. Применение комплекса эстрогена и циклодекстрина для приготовления лекарственного средства, предназначенного для женской гормонзаместительной терапии, где лекарственное средство включает композицию, представляющую собой комплекс гранулированного препарата, причем, если гранулированный препарат содержит поливинилпирролидон, то он присутствует в концентрации не выше 2 мас.%, лекарственное средство обладает такой стабильностью, что после хранения в течение 12 месяцев при 40шС относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена.
35. Применение по п.34, где композиция представляет собой композицию по любому из пп.2-21 или п.29.
Текст
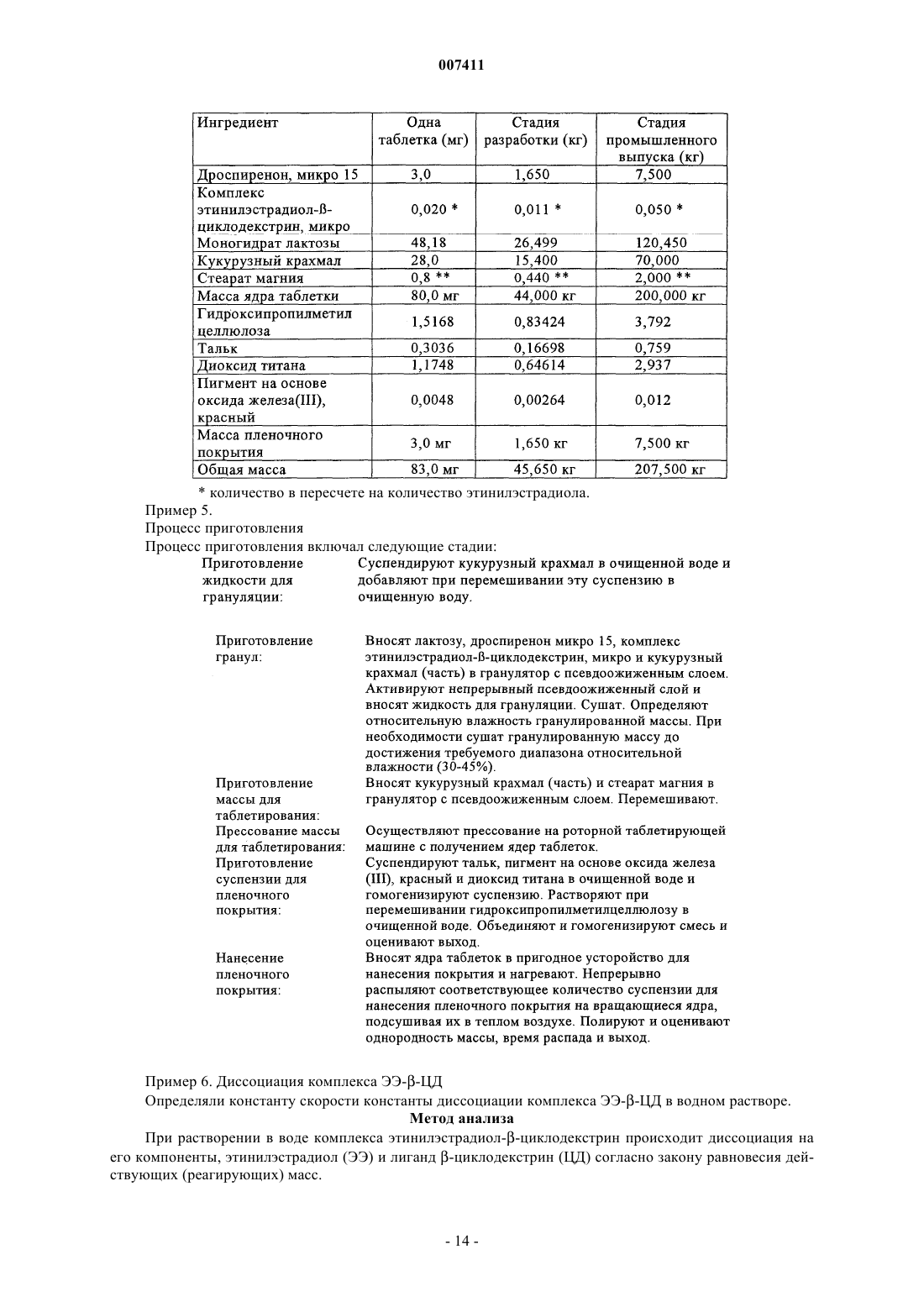
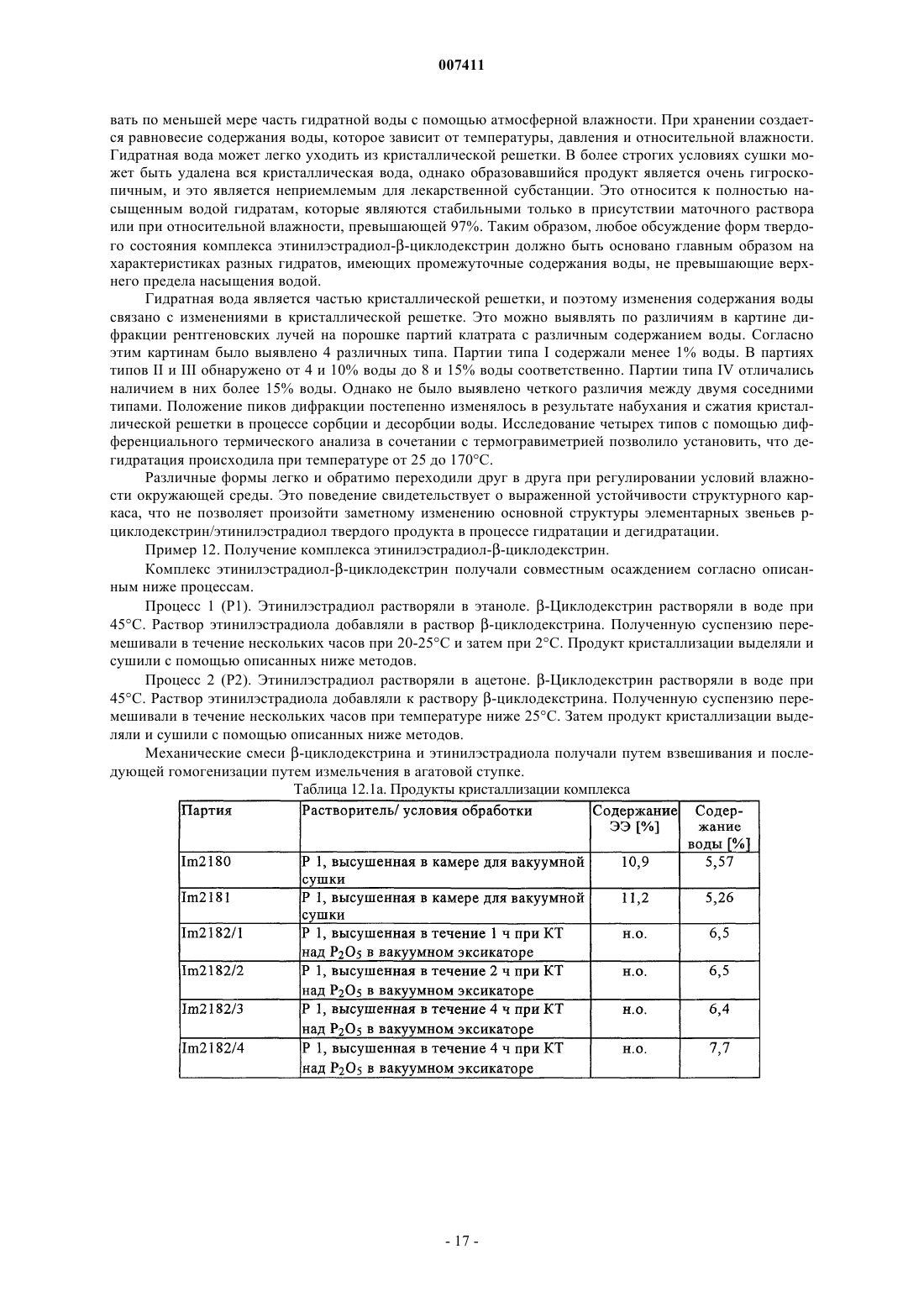
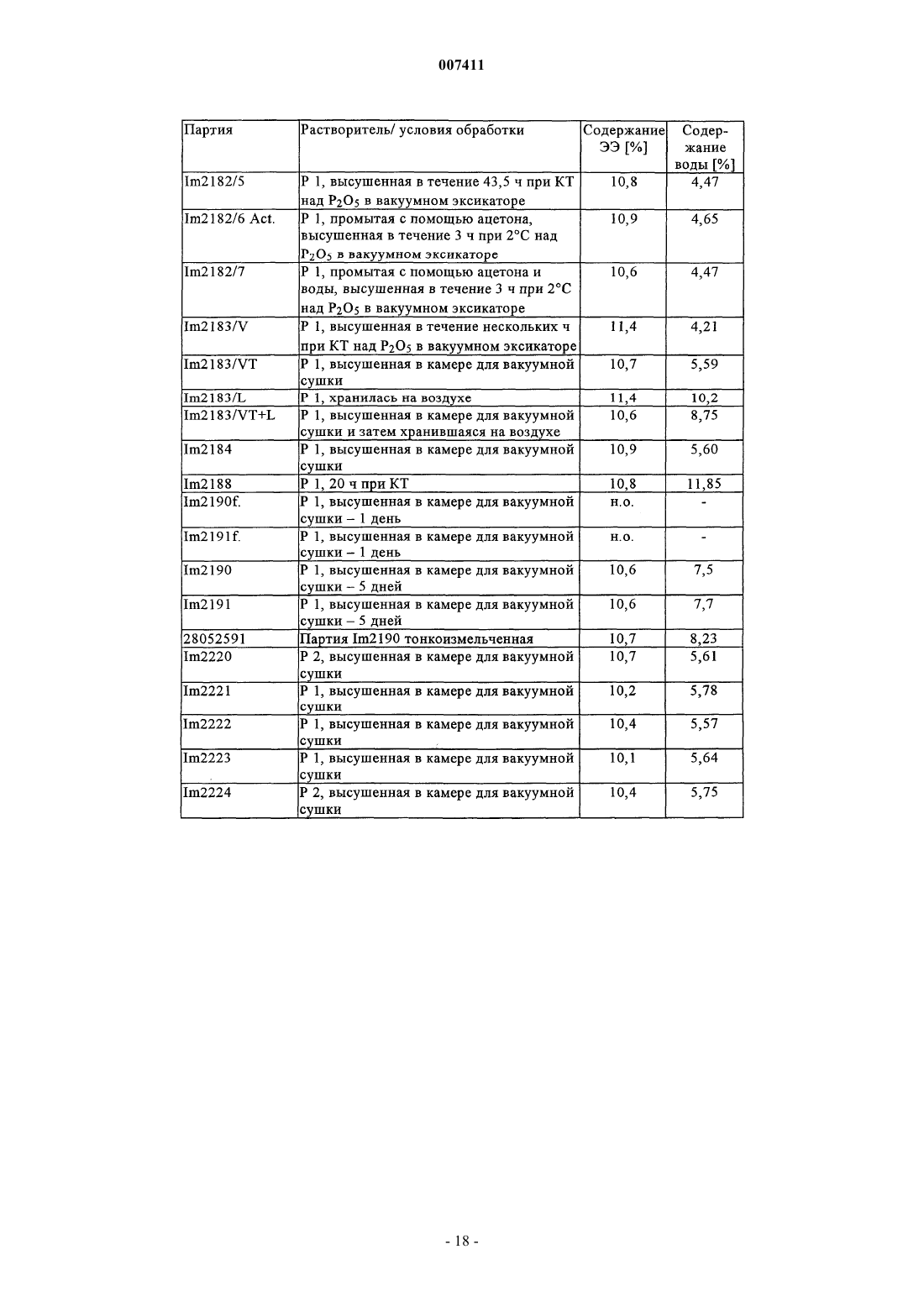
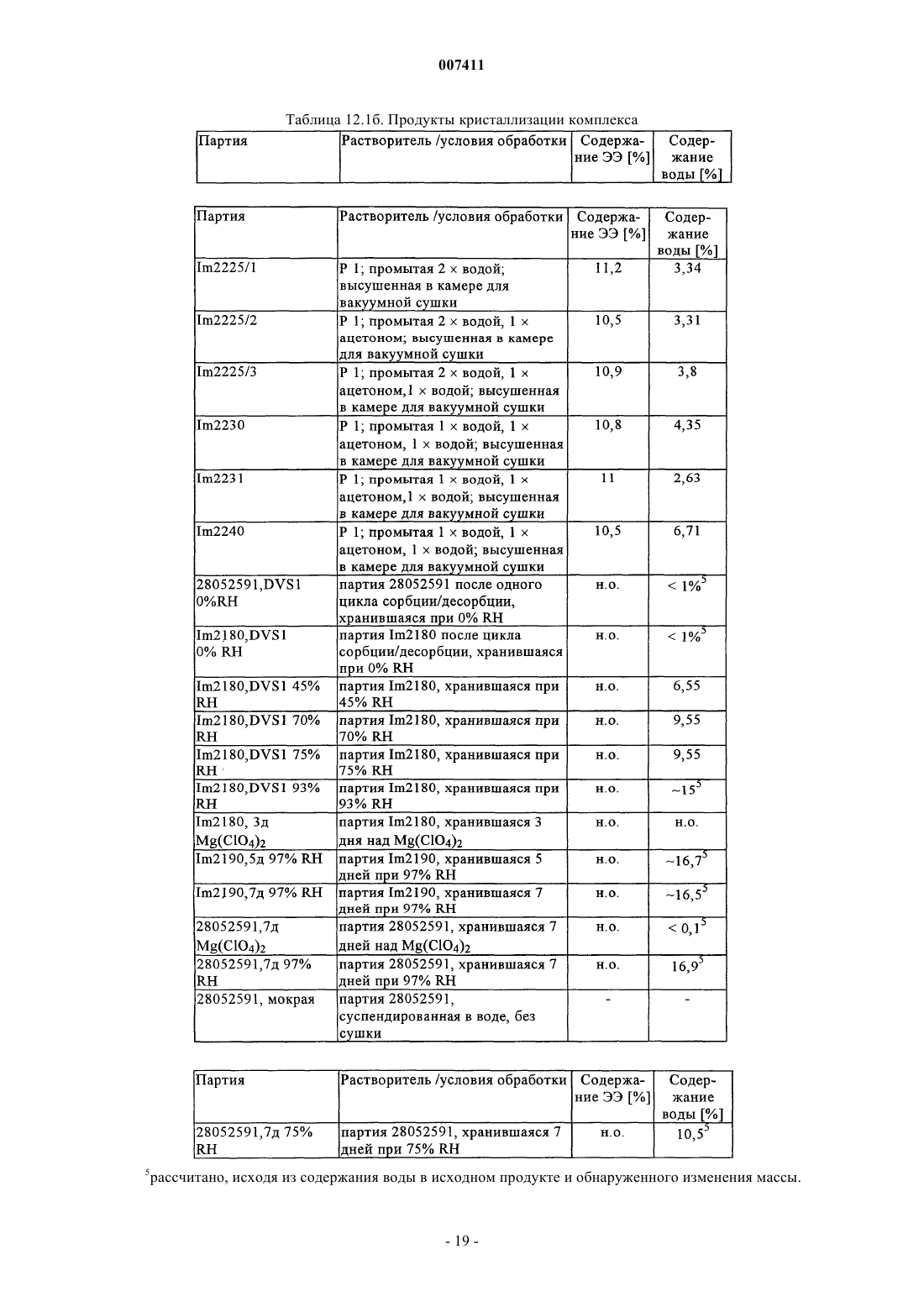
007411 Настоящее изобретение относится к фармацевтическим композициям и препаратам, содержащим комплекс циклодекстрин-эстроген, которые характеризуются очень высокой химической стабильностью эстрогена. Изобретение позволяет улучшать физическую стабильность комплексов циклодекстринэстроген и химическую стабильность эстрогенов, таких как этинилэстрадиол, при хранении. Предпосылки создания изобретения Разложение эстрогенов, таких как этинилэстрадиол, в стандартных фармацевтических продуктах является одним из имеющих решающих значение факторов, обуславливающих срок годности продукта. Стабилизация эстрогена может достигаться либо путем упаковки продукта в герметичные контейнеры,либо, что является более эффективным и используется в настоящем изобретении, путем фактической стабилизации фармацевтического продукта. Фармацевтические продукты, содержащие природные или полученные синтетическим путем половые гормоны, часто включают низкие дозы этих действующих веществ. С учетом небольших количеств действующего вещества, необходимого для однократной дозы, часто составляющих 0,1-500 мкг, изготовление композиций стандартных доз с относительно постоянными количествами действующих веществ, которые бы не изменялись в каждой партии и от партии к партии, является сложным. Поэтому эти продукты могут не удовлетворять требованиям органов здравоохранения, касающихся однородности содержимого. Кроме того, разложение столь небольших количеств действующего вещества приводит к дополнительным изменениям количества действующего вещества в композициях с низкими дозами. В целом, приготовление, хранение и применение этих композиций с низкими дозами, которые содержат нестабильные действующие вещества, связано с рядом проблем, и поэтому существует потребность в стабилизации таких композиций. Получение комплексов эстрогенов с циклодекстринами широко применяется для повышения стабильности, растворимости или биологической доступности. Например, в ЕР 0349091 описаны композиции, содержащие комплексы 17 эстрадиола и диметилциклодекстрина, которые предназначены для улучшения назального введения, Fridriksdottir и др. (Die Pharmazie, том 51, 1996, сс. 39-42) описали комплексы циклодекстрина и 17 эстрадиола, предназначенные для повышения растворимости в водном растворе, а также для улучшения подъязычного применения. Повышенная растворимость также является объектом патента US 4596795, в котором описан комплекс -, - и -циклодекстринов и их производных с тестостероном, прогестероном и эстрадиолом В патенте US 4383992 описано водорастворимое соединение включения, которое получено путем образования комплекса стероидного соединения, такого как эстроген, с -циклодекстрином. Кроме того, в патенте US 5798338 описано, что окислительное расщепление 17 этинилэстрадиола снижается при образовании клатратов (комплексов) -циклодекстрина и 17 этинилэстрадиола. Однако хотя образование комплексов эстрогенов и циклодекстринов может иметь решающее значение для растворимости, биологической доступности и стабильности, но при этом все еще сохраняются проблемы, которые необходимо решать перед тем, как комплексы действующих веществ, таких как эстрогены, и циклодекстринов можно применять в фармацевтических продуктах. Так, комплексы подвержены диссоциации с образованием свободного эстрогена и циклодекстрина, прежде всего, при контакте с водой. Отсутствие физической стабильности комплексов циклодекстрин-эстроген приводит к тому, что значительные количества свободного эстрогена присутствуют в композициях вследствие, например, воздействия водных сред в процессе приготовления, в частности, в процессе грануляции. Как следствие,срок годности композиции может снижаться из-за разложения свободного эстрогена. Кроме того, требуемая улучшенная биологическая доступность в результате образования комплекса эстрогена и циклодекстрина не достигается из-за отсутствия физической стабильности комплекса циклодекстрин-эстроген и химической нестабильности свободного эстрогена. Были предприняты различные попытки стабилизации композиций, содержащих комплексы циклодекстрина и эстрогена. Например, композицию можно стабилизировать путем стабилизации самого комплекса. Так, в патенте US 4727064 описаны попытки стабилизации комплексов с помощью аморфных форм комплекса. В другом варианте комплексы можно стабилизировать и повышать их растворимость,добавляя полимеры в реакционную среду в процессе при комплексообразовании, как описано у Loftsson и др. (Int. J. Pharmaceutics,том 110, 1994, сс. 169-177). В ЕР 0579435 описаны также комплексы эстрадиола и циклодекстринов, в которых добавление полимеров в реакционную среду повышало константу устойчивости комплекса. Композиции можно также стабилизировать путем отказа от стадии грануляции в процессе приготовления композиции, как описано в WO 00/21570. Таким образом, в данной области существует необходимость в разработке методов получения физически стабильных комплексов циклодекстрина и эстрогена и композиций, отличающихся повышенной стабильностью как комплекса, так и свободного эстрогена. Кроме того, в данной области существует необходимость в создании композиций в виде гранул, характеризующихся физически стабильными комплексами циклодекстрин-эстроген.-1 007411 Краткое изложение сущности изобретения Объектом настоящего изобретения является стабильный и гомогенный фармацевтический продукт,который содержит эстроген, причем стабильность эстрогена в значительной степени повышена по сравнению обычными продуктами, которые содержат комплексы, включающие эстрогены или чувствительные комплексы циклодекстрина и эстрогена. Разложение эстрогенов, таких как этинилэстрадиол, в обычных продуктах является одним из имеющих наиболее важное значение факторов, определяющих срок годности продукта. При создании изобретения неожиданно было установлено, что продукты с повышенной стабильностью эстрогена можно получать путем образования комплексов эстрогена и циклодекстринов, целенаправленного выбора эксципиентов и/или продуманной адаптации процесса приготовления. В результате срок годности содержащего эстроген продукта повышается. Таким образом, важным объектом изобретения являются препараты и композиции, содержащие комплексы эстрогена и циклодекстрина, которые являются стабильными при их получении с помощью грануляции. Так, первым объектом изобретения является композиция, содержащая комплекс эстрогена и циклодекстрина, где композиция представляет собой гранулированный препарат, этот гранулированный препарат имеет относительную влажность не более 60% при определении при температуре от 20 до 40 С. Следующим объектом изобретения являются композиции, которые содержат I) комплекс эстрогена и циклодекстрина; и II) один или несколько эксципиентов, причем композиция обладает такой стабильностью, что после хранения в течение 12 месяцев при 40 С и относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена. Согласно предпочтительному варианту осуществления изобретения композиция представляет собой гранулированный препарат, содержащий указанный комплекс. Согласно другому предпочтительному варианту осуществления изобретения композицию прессуют непосредственно с получением таблетки или эквивалентных форм стандартных доз. Таким образом, в отличие от известных прототипов становится возможным получать стабильные композиции, которые содержат комплекс эстроген-циклодекстрин в гранулированном препарате. Композиции по настоящему изобретению можно использовать в качестве лекарственных средств. Таким образом, следующим объектом настоящего изобретения является применение описанной выше композиции для приготовления лекарственного средства для женской контрацепции, гормонзаместительной терапии или для лечения угрей или ПМДН (нарушения, связанные с предменструальной дисфункцией). В широком смысле настоящее изобретение относится к способу повышения стабильности эстрогена в фармацевтической композиции, которая содержит комплекс эстроген-циклодекстрин и один или несколько эксципиентов в гранулированном препарате, способ предусматривает стадии:I) получения комплекса эстрогена и циклодекстрина; иII) смешения в условиях грануляции указанного комплекса с одним или несколькими эксципиентами таким образом, чтобы относительная влажность конечного гранулята не превышала 60% при ее определении при температуре от 20 до 40 С. И, наконец, изобретение относится к способу приготовления композиции, которая представляет собой гранулированный препарат, содержащий комплекс эстрогена и циклодекстрина, где получение гранулированного препарата предусматривает следующие стадии:I) загрузку комплекса, одного или нескольких эксципиентов и необязательно одного или нескольких терапевтических действующих веществ в гранулятор;II) нанесение жидкости на загруженный комплекс и один или несколько эксципиентов в условиях грануляции так, чтобы получать гранулы, которые имеют относительную влажность не более 60% при ее определении при температуре от 20 до 40 С. Подробное описание изобретения Понятие комплекс относится к комплексу эстрогена и циклодекстрина, где молекула указанного эстрогена, по меньшей мере, частично встроена в полость одной молекулы циклодекстрина. Кроме того,молекула указанного эстрогена может быть, по меньшей мере, частично встроена в полость нескольких молекул циклодекстрина, и два фрагмента одной молекулы эстрогена могут быть встроены в одну молекулу циклодекстрина с получением соотношения циклодекстрина и эстрогена 1:2. Таким образом, комплекс можно рассматривать как комплекс включения (клатрат) эстрогена и циклодекстрина. Аналогично этому комплекс может содержать более одной молекулы эстрогена, которые, по меньшей мере, частично встроены в одну или несколько молекул циклодекстрина, например 2 молекулы эстрогена, которые, по меньшей мере, частично встроены в одну молекулу циклодекстрина, с получением соотношения циклодекстрина и эстрогена 1:2. К комплексам, в которых одна молекула эстрогена образует комплекс с одной или несколькими молекулами циклодекстрина, обычно относят комплексы, содержащие 1 молекулу эстрогена и 2 молекулы циклодекстрина или 3 молекулы циклодекстрина. Как правило, комплекс этинилэстрадиолциклодекстрин, полученный согласно настоящему изобретению, предпочтительно представляет собой комплекс, содержащий 1 молекулу этинилэстрадиола и 2 молекулы -циклодекстрина.-2 007411 Понятие комплекс этинилэстрадиолциклодекстрин или "ЭЭЦД относится к комплексу,имеющему любое соотношение этинилэстрадиола и -циклодекстрина. Понятие гранулированный препарат относится к порошкообразному препарату, в котором размер частиц порошка увеличен либо в результате обработки жидкостью, либо с помощью прессования. Жидкость может представлять собой водные или органические растворители любого типа или их смеси и необязательно дополнительно включать связующее вещество, такое как крахмал. Таким образом, в широком смысле понятие гранулированный препарат относится к гранулам, пеллетам и спрессованному порошку или любым частицам, полученным с помощью грануляция, таблетирования или прессования порошка таким образом, чтобы получать частицы, средний размер которых составляет по меньшей мере примерно 100 мкм. Понятие циклодекстрин относится к циклодекстрину или его производному, а также к смесям различных циклодекстринов, смесям различных производных циклодекстринов и смесям различных циклодекстринов и их производных. Понятие циклодекстрин будет дополнительно расшифровано в контексте изобретения. При создании изобретения были разработаны продукты, в которых существенное повышение стабильности эстрогена было достигнуто с помощью сочетания различных путей. Одним из таких путей является защита эстрогена посредством образования комплекса с циклодекстрином. Другой путь предусматривает продуманную адаптацию процесса грануляции, например, в процессе приготовления гранул можно ограничивать диссоциацию комплекса на свободный эстроген и циклодекстрин. При создании изобретения были получены данные о том, что комплекс этинилэстрадиола и -циклодекстрина обладает плохой стабильностью при воздействии воды. Фактически в случае растворения комплекса в воде примерно 50% комплекса разлагается на свободный этинилэстрадиол и циклодекстрин в течение 3 мин (см. пример 6 настоящего описания). Таким образом, не вдаваясь в конкретную теорию, стабильность продуктов, по крайней мере, частично можно повышать путем ограничения диссоциации комплекса, приводящей к образованию свободного эстрогена, во время процесса приготовления, тем самым ограничивая содержание свободного эстрогена в конечном продукте. Таким образом, первым объектом изобретения является композиция, которая содержит комплекс эстрогена и циклодекстрина, где композиция представляет собой гранулированный препарат, причем этот гранулированный препарат имеет относительную влажность не более 60% при ее определении при температуре от 20 до 40 С. Предпочтительно относительная влажность составляет не более 55%, более предпочтительно не более 45%, наиболее предпочтительно не более 40% при ее определении при температуре от 20 до 40 С. Установлено, что согласно настоящему изобретению можно получать стабильные продукты, которые содержат чувствительные комплексы эстрогена и циклодекстрина. Таким образом, вторым объектом изобретения является композиция, содержащая:II) один или несколько эксципиентов, причем композиция имеет такую стабильность, что после хранения в течение 12 месяцев при 40 С и относительной влажности (RH) 75% эстроген присутствует в ней в количестве по меньшей мере 85 мас.% относительно начального содержания эстрогена. Под начальным содержанием эстрогена понимают массовое содержание эстрогена, включенного в композицию при приготовлении конечной композиции. Согласно одному из вариантов осуществления изобретения композиция имеет форму таблетки,приготовленной путем непосредственного прессования композиции. Предпочтительно композиция содержит ограниченное количество поливинилпирролидона, как это описано ниже. Согласно другому варианту осуществления изобретения комплекс эстрогена и циклодекстрина имеет форму гранулированного препарата, как он определен в настоящем описании. Согласно предпочтительным вариантам осуществления изобретения композиция имеет такую стабильность, что после хранения в течение 12 месяцев при 40 С и относительной влажности (RH) 75% эстроген присутствует в ней в количестве по меньшей мере 90 мас.%, предпочтительно по меньшей мере 95 мас.%, более предпочтительно по меньшей мере 97 мас.%, наиболее предпочтительно по меньшей мере 98 мас.% относительно начального содержания эстрогена. Другие пути повышения стабильности эстрогена в таких препаратах и композициях предусматривают продуманный выбор эксципиентов с тем, чтобы минимизировать содержание эксципиентов, которые обладают способностью индуцировать разложение этинилэстрадиола, или исключить их из композиций. Одним из таких имеющих решающее значение эксципиентов является поливинилпирролидон,который обычно используют в качестве связующего вещества при грануляции в псевдоожиженном слое. Как отмечалось в настоящем описании, этинилэстрадиол чувствителен к действию поливинилпирролидона, и большие количества этинилэстрадиола разлагаются в препаратах и композициях, если этинилэстрадиол не защищен путем образования клатрата. Например, в композициях, которые содержат поливинилпирролидон и получены согласно примеру 3 патента US 5798338 с помощью грануляции в псевдоожиженном слое, стабильность этинилэстрадиола является низкой. При создании настоящего изобрете-3 007411 ния было установлено, что в такой композиции после хранения в течение 12 месяцев при 40 С и относительной влажности 75% содержание этинилэстрадиола снижается на 25% относительно исходного содержания этинилэстрадиола (см. табл. 1.4, пример 1, табл. А). Таким образом, одним из объектов изобретения являются композиции/препараты с низким содержанием соединений, которые обладают высокой окислительной способностью, таких, у которых окислительная способность выше, чем у поливинилпирролидона, или близка к ней. Например, в композициях/препаратах по настоящему изобретению содержание поливинилпирролидона предпочтительно является более низким, чем в композициях из примера 3 патента US 5798338. Более предпочтительно согласно приемлемым вариантам осуществления изобретения композиции/препараты содержат не более 2 мас.% поливинилпирролидона, предпочтительно не более 1 мас.%, более предпочтительно не более 0,5 мас.%, наиболее предпочтительно не более 0,2 мас.% поливинилпирролидона. Кроме того, согласно особенно предпочтительным вариантам осуществления изобретения композиции/препараты практически не содержат поливинилпирролидон. Индивидуально или в сочетании друг с другом вышеизложенные пути позволяют получать композиции, в которых эстроген является более стабильным, чем в традиционных композициях, содержащих поливинилпирролидон, которые приготавливают непосредственным прессованием или с помощью несовершенного процесса грануляции в псевдоожиженном слое. Полученные таким образом стабильные композиции отличаются тем, что в них содержание эстрогена после хранения в течение 3 месяцев при 40 С и относительной влажности (RH) 75% составляет по меньшей мере 90 мас.% относительно начального содержания эстрогена. Предпочтительно содержание эстрогена после хранения в течение 3 месяцев при 40 С и относительной влажности (RH) 75% составляет по меньшей мере 92 мас.%, более предпочтительно по меньшей мере 94 мас.%, еще более предпочтительно по меньшей мере 96 мас.% и наиболее предпочтительно по меньшей мере 98 мас.% относительно начального содержания эстрогена. Кроме того, композиции обладают также стабильностью при более высоких температурах, например при 60 С, и относительной влажности 75%, причем композиция имеет такую стабильность, что после хранения в течение 3 месяцев при 60 С и относительной влажности (RH) 75% эстроген присутствует в количестве по меньшей мере 85 мас.% относительно начального содержания эстрогена, предпочтительно по меньшей мере 90 мас.% , более предпочтительно по меньшей мере 92 мас.% и еще более предпочтительно по меньшей мере 94 мас.% , наиболее предпочтительно по меньшей мере 96 мас.% относительно начального содержания эстрогена. Важно, что композиции по изобретению являются более стабильными в условиях окружающей среды, чем традиционные композиции. Таким образом, композиции по настоящему изобретению обладают повышенной стабильностью при хранении в течение 12 месяцев при 25 С и относительной влажности(RH) 60%, при этом эстроген присутствует в количестве по меньшей мере 95 мас.% относительно начального содержания эстрогена. Предпочтительно после хранения в течение 12 месяцев при 25 С и относительной влажности (RH) 60% содержание эстрогена составляет по меньшей мере 96 мас.%, более предпочтительно по меньшей мере 97 мас.%, наиболее предпочтительно по меньшей мере 98 мас.% относительно начального содержания эстрогена. Как должно быть очевидно специалисту в данной области, эстроген можно выбирать из группы,включающей этинилэстрадиол (ЭЭ), эстрадиол, сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон, эстриол, сукцинат эстриола и конъюгированные эстрогены, включая конъюгированные конские эстрогены, такие как сульфат эстрона, сульфат 17-эстрадиола, сульфат 17-эстрадиола,эквилинсульфат, 17-дигидроэквилинсульфат, 17-дигидроэквилинсульфат, эквиленинсульфат, 17 дигидроэквиленинсульфат и 17-дигидроэквиленинсульфат или их смеси. Особенно предпочтительными являются эстрогены, выбранные из группы, включающей этинилэстрадиол (ЭЭ), сульфаматы эстрадиола,валерат эстрадиола, бензоат эстрадиола, эстрон и сулфаты эстрона или их смеси, в частности, этинилэстрадиол (ЭЭ), валерат эстрадиола, бензоат эстрадиола и сульфаматы эстрадиола. Наиболее предпочтительным является этинилэстрадиол (ЭЭ). В предпочтительном варианте осуществления изобретения, когда эстроген представляет собой этинилэстрадиол (ЭЭ), некоторые продукты разложения хорошо известны. Так, в нестабильных композициях, например, содержащих чувствительный комплекс этинилэстрадиола и циклодекстрина, которые приготавливают с помощью общепринятых методов грануляции, присутствуют продукты разложения этинилэстрадиола, прежде всего, после хранения в течение определенного промежутка времени. Кроме того,поскольку в этих традиционных композициях расщепляется большее количество этинилэстрадиола по сравнению с композициями по изобретению (см. пример 2,табл. 1.3), то традиционные композиции могут включать более высокие количества этих продуктов разложения. Таким образом, согласно одному из вариантов осуществления настоящего изобретения стабильность является такой, что молярная сумма продукта, для которого известно, что он представляет собой известные продукты разложения этинилэстрадиола, составляет не более 0,8% относительно начального содержания этинилэстрадиола. Так, в случае, когда эстроген представляет собой этинилэстрадиол, молярная сумма 6 гидроксиэтинилэстрадиола, 6 гидроксиэтинилэстрадиола, 6-кетоэтинилэстрадиола,-6,7-этинилэстрадиола и -9,11-этинилэстрадиола в целом составляет не более 0,8% относительно ис-4 007411 ходного молярного содержания этинилэстрадиола при определении после хранения в течение 12 месяцев при 25 С и относительной влажности (RH) 60%. Предпочтительно молярная сумма всех продуктов составляет не более 0,7% и более предпочтительно не более 0,6% при хранении в указанных условиях. Кроме того, стабильность является такой, что молярная сумма 6 гидроксиэтинилэстрадиола, 6-гидроксиэтинилэстрадиола, 6-кетоэтинилэстрадиола, -6,7-этинилэстрадиола и -9,11-этинилэстрадиола в целом составляет не более 3% относительно начального молярного содержания этинилэстрадиола при определении после хранения в течение 12 месяцев при 40 С и относительной влажности (RH) 75%. Предпочтительно молярная сумма всех продуктов составляет не более 2% и более предпочтительно не более 0,6% при хранении в указанных условиях. Таким образом, объектом настоящего изобретения является фармацевтическая композиция/фармацевтический препарат, содержащие комплекс эстрогена и циклодекстрина, в которых стабильность эстрогена в значительной степени повышена по сравнению с традиционными композициями/препаратами. Так, для дополнительного повышения стабильности или для обеспечения стабильности согласно другим вариантам осуществления изобретения композиции/препараты также содержат антиоксидант. Антиоксидант можно либо включать в гранулированный препарат, либо добавлять в композицию в качестве дополнительного эксципиента. Циклодекстрин можно выбирать из ряда, включающего -циклодекстрин, -циклодекстрин, циклодекстрин и их производные. Циклодекстрин можно модифицировать таким образом, что некоторые или все первичные или вторичные гидроксилы макроцикла или и первичные и вторичные гидроксилы,являются алкилированными или ацилированными. Методы модификации этих спиртов хорошо известны специалисту в данной области и многие такие циклодекстрины имеются в продаже. Так, некоторые или все гидроксилы циклодекстрина в модифицированных циклодекстринах можно замещать O-R-группой или O-C(O)-R, где R обозначает необязательно замещенный C1-С 6 алкил, необязательно замещенный С 2 С 6 алкенил, необязательно замещенный С 2-С 6 алкинил, необязательно замещенный арил или гетероарил. Так, R может обозначать метильную, этильную, пропильную, бутильную, пентильную или гексильную группу. Следовательно, O-C(O)-R может обозначать ацетат. Кроме того, когда R обозначает широко применяемую для этой цели 2-гидроксиэтильную группу или 2-гидроксипропильную группу, то R можно использовать для получения производных циклодекстрина. Кроме того, циклодекстриновые спирты могут быть пербензилированными, пербензоилированными, или бензилированными или бензоилированными на одной и той же грани макроцикла или у них только 1, 2, 3, 4, 5 или 6 гидроксилов могут быть бензилированными или бензоилированными. Естественно, циклодекстриновые спирты могут быть пералкилированы или перацилированы, например, перметилированы, или перацетилированы, или алкилированы,или ацилированы, например метилированы или ацетилированы на одной и той же грани макроцикла или у них только 1, 2, 3, 4, 5 или 6 гидроксилов являются алкилированными или ацилированными, например,метилированными или ацетилированными. Комплекс эстроген-циклодекстрин можно получать с помощью методов, хорошо известных специалистам в данной области (см., например, патент US 5798338). Комплекс этинилэстрадиолциклодекстрин можно получать также совместным осаждением следующим образом: этинилэстрадиол растворяют в этаноле; -циклодекстрин растворяют в воде при 45 С; раствор этинилэстрадиола добавляют в раствор -циклодекстрина; полученную суспензию перемешивают в течение нескольких часов при 20-25 С, а затем при 2 С; продукт кристаллизации выделяют и сушат. В другом варианте комплекс этинилэстрадиол-(-циклодекстрин можно получать следующим образом: этинилэстрадиол растворяют в ацетоне; -циклодекстрин растворяют в воде при 45 С; раствор этинилэстрадиола добавляют в раствор -циклодекстрина; полученную суспензию перемешивают в течение нескольких часов при температуре ниже 25 С; затем продукт кристаллизации выделяют и сушат. Предпочтительно комплекс циклодекстрина и эстрогена имеет требуемую липофильность (гидрофобность). Так, предпочтительными вариантами осуществления изобретения являются такие варианты,согласно которым коэффициент распределения комплекса в системе н-октанол/вода при рН 7 составляет примерно 2-5, предпочтительно примерно 3-4. Другие предпочтительные варианты осуществления изобретения относятся к комплексу в кристаллической форме. Так, ограниченный объект изобретения относится к кристаллическим комплексам эстрогена и циклодекстрина. Понятие кристаллический относится к различным модификациям физического строения соединения, причем часть соединения может находиться в аморфной форме. Кристаллические соединения могут иметь гидратированную форму или содержать кристаллизационную воду. И, наконец, комплексы могут представлять собой приведенные в настоящем описании в примерах комплексы, например гидратированные комплексы из примера 12. Кроме того, кристаллический комплекс может содержать фрагменты свободного этинилэстрадиола и свободного циклодекстрина. Предпочтительно комплекс содержит -циклодекстрин или его производное, наиболее предпочтительно -циклодекстрин. Таким образом, согласно наиболее предпочтительному варианту осуществления изобретения, который представляет собой комбинацию предпочтительных вариантов осуществле-5 007411 ния, эстроген представляет собой этинилэстрадиол, а циклодекстрин представляет собой циклодекстрин. Согласно другому варианту осуществления изобретения композиция дополнительно содержит одно или несколько терапевтических действующих веществ. Так, согласно этому варианту осуществления композиция дополнительно содержит прогестоген. Прогестоген можно выбирать из ряда, включающего дроспиренон, левоноргестрел, норгестрел, гестоден, диеногест, ацетат ципротерона, норэтистерон, ацетат норэтистерона, десоргестрел, 3-кетодесоргестрел. Однако предпочтительный прогестоген представляет собой дроспиренон. Согласно предпочтительному варианту осуществления изобретения терапевтическое действующее вещество представляет собой дроспиренон, причем дроспиренон необязательно может быть тонкоизмельченным. Согласно предпочтительному варианту осуществления изобретения терапевтическое действующее вещество представляет собой дроспиренон, причем весь или практически весь дроспиренон может присутствовать в виде комплекса с циклодекстрином. Как должно быть очевидно специалисту в данной области, диссоциация комплекса дроспиренон/циклодекстрин может приводить к образованию смеси дроспиренонона в виде комплекса с циклодекстрином и не входящего в комплекс (свободного) дроспиренона. Также как и свободный дроспиренон, входящий в комплекс дроспиренон может быть тонкоизмельченным. Таким образом, предпочтительным вариантом осуществления изобретения является композиция/препарат, в которых эстроген представляет собой этинилэстрадиол и одним или несколькими терапевтическим(ими) действующим(ими) веществом(ами) является дроспиренон. В связи с этим согласно другому предпочтительному варианту осуществления изобретения и комплекс эстроген-циклодекстрин и дроспиренон являются тонко измельченными. Таким образом, композиции и препараты содержат низкие дозы действующего вещества, например,согласно репрезентативным вариантам осуществления изобретения, они содержат количество эстрогена,соответствующее терапевтически эквивалентному количеству этинилэстрадиола, составляющему примерно 0,002-2 мас.%. Согласно другим репрезентативным вариантам осуществления изобретения композиция/препараты содержат эстроген, такой как этинилэстрадиол, в количестве примерно 0,002-2 мас.%. Предпочтительно количество составляет примерно 0,004-0,2 мас.%, более предпочтительно примерно 0,008-0,1 мас.%,наиболее предпочтительно примерно 0,02-0,05 мас.%. С учетом количества циклодекстрина в предпочтительных вариантах осуществления изобретения,согласно которым эстроген представляет собой этинилэстрадиол и циклодекстрин представляет собой циклодекстрин, этинилэстрадиол присутствует в количестве относительно комплекса этинилэстрадиол-циклодекстрин примерно 5-20 мас.%, предпочтительно примерно 8-15 мас.%, наиболее предпочтительно примерно 9-13 мас.%. Кроме того, согласно изобретению можно регулировать соотношение эстрогена и циклодекстрина. Таким образом, согласно предпочтительным вариантам осуществления изобретения эстроген присутствует в таком количестве относительно циклодекстрина, что молярное соотношение эстрогена и циклодекстрина составляет примерно от 2:1 до 1:10, предпочтительно примерно от 1:1 до 1:5, наиболее предпочтительно примерно от 1:1 до 1:3, например 1:1 и 1:2. В вариантах, согласно которым композиция дополнительно содержит терапевтическое действующее вещество и это вещество представляет собой дроспиренон, дроспиренон присутствует в количестве примерно 0,4-20 мас.%, предпочтительно 0,8-10 мас.%, более предпочтительно примерно 1,5-5 мас.%. Следующим объектом изобретения является композиция или препарат по изобретению, которые дополнительно имеют форму стандартой дозы, предпочтительно такую как таблетка, капсула или саше. Репрезентативным вариантом осуществления изобретения является композиция или препарат в форме гранул, пеллетов или сухих спрессованных смесей, которыми можно заполнять твердые желатиновые капсулы или саше или прессовать с получением ядер таблеток. В этом случае композиция или препарат содержат (мас.%):IV) 0-5 мас.% способствующих скольжению веществ, таких как коллоидный диоксид кремния и/или др.;VI) 0-5 мас.% стабилизаторов/антиоксидантов, таких как ацетат токоферола, пропилгаллат, аскорбиновая кислота, пальмитат аскорбиновой кислоты и/или др.; иVII) 0-5 мас.% замасливателей, таких как стеарат магния и/или др. В варианте, согласно которому композиция/препарат дополнительно содержат обладающее тера-6 007411 певтической активностью соединение, такое как прогестоген, предпочтительно дроспиренон, репрезентативная композиция дополнительно может содержать 0,1-15 мас.% дроспиренона. Наиболее предпочтительным вариантом осуществления изобретения является стандартная дозируемая форма, которая содержит: дроспиренон (тонкоизмельченный) 3,00 мг этинилэстрадиол в виде клатрата с-циклодекстрином (тонкоизмельченный) 0,02 мг лактозу 48,18 мг кукурузный крахмал 28,00 мг стеарат магния 0,8 мг воду (для обработки)0,02 мг обозначает концентрацию этинилэстрадиола (без учета -циклодекстрина). Количество этинилэстрадиола в клатрате с -циклодекстрином составляет 9,5-12,5%.Количество лактозы требуется регулировать в зависимости от количества -циклодекстрина. Еще одним объектом изобретения является способ повышения стабильности эстрогена в фармацевтической композиции, содержащей эстроген и один или несколько эксципиентов в гранулированном препарате, способ предусматривает следующие стадии:I) получение комплекса эстрогена и циклодекстрина; иII) смешение в условиях грануляции указанного комплекса с одним или несколькими эксципиентами так, чтобы относительная влажность конечного гранулята не превышала 60% при определении при температуре от 20 до 40 С. Как отмечалось выше, этот способ стабилизации позволяет получать композиции, стабильность которых является более высокой по сравнению со стабильностью, известной для традиционных композиций. Эти улучшенные характеристики обеспечивают повышенную стабильность, которая связана, по меньшей мере, частично с процессом грануляции и с правильно выбранными эксципиентами. Так, путь повышения стабильности связан с правильным регулированием относительной влажности гранулированного препарата. Очень важно, чтобы относительная влажность не превышала 60%-ную относительную влажность при определении при температуре от 20 до 40 С. Предпочтительно относительная влажность не должна превышать 55%, более предпочтительно не должна превышать 45%, наиболее предпочтительно не должна превышать 40% при определении при температуре от 20 до 40 С. Дополнительным, связанным с вышеуказанным объектом изобретения является способ повышения стабильности эстрогена в фармацевтической композиции, которая содержит эстроген и один или несколько эксципиентов, причем способ предусматривает следующие стадии:I) получение комплекса эстрогена и циклодекстрина; иII) добавление эксципиентов в таком количестве, чтобы минимизировать общее количество эксципиентов, которые обладают окислительным потенциалом более высоким или аналогичным окислительному потенциалу поливинилпирролидона. Задача состоит в ограничении или минимизации количества эксципиентов, которые обладают окислительным потенциалом более высоким или аналогичным окислительному потенциалу поливинилпирролидона. Таким образом, способ стабилизации предусматривает также ограничение содержания эксципиентов, которые обладают окислительным потенциалом более высоким или аналогичным окислительному потенциалу поливинилпирролидона, включая ограничение содержания поливинилпирролидона в композициях/препаратах. Так, согласно предпочтительным вариантам осуществления изобретения в композициях присутствует один или несколько эксципиентов, содержащих поливинилпирролидон в количестве не более 2 мас.%. Предпочтительно это количество не превышает 1 мас.%, более предпочтительно не превышает 0,5 мас.%, наиболее предпочтительно не превышает 0,2 мас.%. Согласно наиболее предпочтительному варианту осуществления изобретения способ повышения стабильности предусматривает исключение поливинилпирролидона из фармацевтической композиции. Так, способ стабилизации эстрогена в фармацевтической композиции предусматривает создание композиции/препарата, которые практически не содержат поливинилпирролидона. И еще одним объектом изобретения является способ получения описанных выше композиций и препаратов, которые являются стабильными и гомогенными. Приемлемые условия осуществления способа включают стадии получения жидкости для грануляции, индивидуального введения действующих веществ и одного или нескольких эксципиентов в устройство, пригодное для грануляции, процесс грануляции и сушку. Согласно предпочтительному варианту полученные таким образом гранулы имеют относительную влажность не более 60%. Таким образом, изобретение относится к способу получения гранулированного препарата, содержащего комплекс эстрогена и циклодекстрина, где получение гранулированного препарата предусматривает следующие стадии:I) загрузку комплекса и одного или нескольких эксципиентов в гранулятор;II) нанесение жидкости на загруженные комплекс и один или несколько эксципиентов в условиях-7 007411 грануляции так, чтобы полученные гранулы имели относительную влажность не выше 60% при определении при температуре от 20 до 40 С. Способ позволяет получать новые композиции, которые содержат меньшее количество расщепленного эстрогена и меньшее количество продуктов разложения по сравнению с композициями, полученными с помощью традиционных процессов, таких как процессы грануляции с использованием поливинилпирролидона и/или процессов, при которых относительная влажность не регулируется соответствующим образом. Таким образом, для предпочтительных вариантов осуществления изобретения условия грануляции являются еще более ограниченными, например относительная влажность гранулированного препарата не превышает 55%, предпочтительно не превышает 45%, еще более предпочтительно не превышает 40% при определении при температуре от 20 до 40 С. Кроме того, ограничено количество поливинилпирролидона в композиции. Таким образом, препарат содержит низкие дозы действующих веществ, в частности комплекса этинилэстрадиол-циклодекстрин. Этот параметр является важным для достижения гомогенности препаратов и для удовлетворения требованиям однородности состава. Так, важным фактом, который следует учитывать при приготовлении композиций/препаратов, которые содержат низкие дозы действующего вещества, является гомогенность гранулированного препарата. Обычная практика приготовления препаратов с низким содержанием веществ предусматривает применение премиксов (предварительно приготовленных смесей) действующего вещества с эксципиентом, например лактозой. Премикс, как правило, получают на отдельной стадии смешения. Однако при создании изобретения был разработан способ приготовления препаратов с низким содержанием веществ без стадии предварительного смешения действующего вещества с пригодным эксципиентом. Таким образом, важным вариантом осуществления изобретения является описанный выше способ,согласно которому комплекс и необязательно дополнительное(ые) одно или несколько терапевтических действующих веществ используют индивидуально без предварительного смешения с эксципиентами. Согласно дополнительному, связанному с вышеуказанным варианту в гранулятор вводят одно или несколько терапевтических действующих веществ, такие как дроспиренон. Таким образом, адаптированный соответствующим образом способ по изобретению позволяет приготавливать гомогенные партии гранулированного препарата. Кроме того, в том случае, когда способ направлен на получение стандартных дозируемых форм лекарственного средства, таких как таблетки, он позволяет достигать однородности состава. Так, согласно наиболее предпочтительным вариантам осуществления изобретения партии конечного гранулята и/или конечные стандартные дозируемые формы лекарственного средства в отношении однородности состава удовлетворяют требованиям, согласно которым однородность состава должна составлять 85-115%, предпочтительно 90-110%, более предпочтительно 95-105%. Однородность состава определяют путем отбора 10 случайных образцов гранулированного препарата или путем случайного отбора 10 таблеток из партии таблеток, количественной оценки содержания эстрогена в каждом образце или таблетке и, наконец, путем расчета коэффициента вариации на основе количества эстрогена в каждом образце или таблетке. Понятие с низкими дозами в контексте настоящего описания относится к композициям/препаратам, которые содержат комплекс в количестве примерно 0,005-20 мас.%, предпочтительно примерно 0,01-2 мас.%, более предпочтительно примерно 0,05-1 мас.%, еще более предпочтительно примерно 0,1-0,7 мас.%, наиболее предпочтительно примерно 0,15-0,5 мас.%. Грануляцию можно осуществлять с помощью любого оборудования, которое позволяет получать стабильный и гомогенный гранулят по изобретению. Другими словами, можно применять любое оборудование, которое обеспечивает получение гранул, которые имеют относительную влажность не более 60% при температуре от 20 до 40 С. Однако согласно предпочтительному варианту осуществления изобретения условия грануляции представляют собой условия грануляции в псевдоожиженном слое. Еще одним объектом изобретения является применение представленных в настоящем описании и в примерах композиций для получения лекарственного средства, предназначенного для женской контрацепции, для гормонзаместительной терапии или для лечения угрей или ПМДН (нарушение, связанное с предменструальной дисфункцией). Применение соединения по настоящему изобретению для гормонзаместительной терапии подразумевает лечение менопаузальных, предменопаузальных или постменопаузальных симптомов у женщин. Лекарственное средство может иметь форму, хорошо известную специалисту в области фармацевтики,как правило, форму для перорального введения. Согласно предпочтительному варианту осуществления изобретения лекарственное средство можно применять для ингибирования овуляции у женщин. Обнаружено, что помимо способности ингибировать овуляцию, обнаружено, композиция по изобретению может обладать выраженными антиандрогенными свойствами и ее поэтому можно применять для предупреждения или лечения индуцированных андрогеном нарушений, в частности угрей. Такое применение может не зависеть от применения для описанной выше контрацепции или может сопутствовать ей. Кроме того, поскольку дроспиренон является антагонистом альдостерона, он обладает свойствами диуретика и поэтому его можно применять для противо-8 007411 действия водозадерживающим свойствам этинилэстрадиола. Таким образом, объектом изобретения является применение композиций для приготовления лекарственного средства, предназначенного для перорального введения, предпочтительно применение композиций, которые содержат комплекс этинилэстрадиола и -циклодекстрина и дополнительно содержат терапевтическое действующее вещество. Наиболее предпочтительно агент представляет собой дроспиренон. Согласно различным предпочтительным вариантам осуществления изобретения доза этинилэстрадиола составляет 0,015 -0,04 мг, в частности примерно 0,015-0,03 мг, и доза дроспиренона составляет примерно 2,5-3,5 мг, в частности примерно 3 мг на стандартную суточную дозу. Более конкретно композиции по изобретению содержат количество дроспиренона, соответствующее суточной дозе примерно 3,0-3,5 мг, и количество этинилэстрадиола, соответствующее дозе примерно 0,015-0,03 мг. Лекарственное средство для ингибирования овуляции может представлять однофазную композицию, т.е. препарат, в котором количество любого действующего вещества сохраняется на постоянном уровне в течение по меньшей мере 21 дня, или количество любого или обоих действующих веществ может варьироваться в течение по меньшей мере 21 дня, предназначенный для приготовления многофазного препарата, например двух- или трехфазного препарата, практически идентичного препаратам, описанным, например, в ЕР 148724. Важным вариантом осуществления настоящего изобретения является применение лекарственного средства для ингибирования овуляции, причем, лекарственное средство вводят каждый день по меньшей мере в течение 21 последовательного дня, суточная стандартная доза содержит комбинацию дроспиренона в количестве от примерно 2 до примерно 4 мг и этинилэстрадиол в количестве от примерно 0,01 до примерно 0,05 мг, с последующим введением в каждый из семи или менее последовательных дней суточной дозы без действующего вещества, или в другом варианте без последующего введения никаких лекарственных средств в течение семи или менее дней. Согласно еще одному предпочтительному варианту осуществления изобретения каждая из суточных стандартных доз содержит комбинацию дроспиренона и этинилэстрадиола, и их необходимо вводить в течение 21, 22, 23 или 24 последовательных дней, и каждую из суточных стандартных доз без действующего вещества можно вводить при необходимости в течение 7, 6, 5 или 4 последовательных дней. Кроме того, суточные стандартные дозы, содержащие комбинацию дроспиренона и этинилэстрадиола,можно вводить в течение 28 последовательных дней или 30 или 31 последовательных дней. Предпочтительно применение такого лекарственного средства предусматривает введение каждый день в течение по меньшей мере 21 последовательного дня суточной стандартной дозы, которая содержит комбинацию дроспиренона в количестве от примерно 2 до примерно 4 мг и этинилэстрадиола в количестве от примерно 0,01 до примерно 0,05 мг, с последующим ведением каждый день в течение семи или менее последовательных дней суточной стандартной дозы, которая содержит только этинилэстрадиол в количестве от примерно 0,01 до примерно 0,05 мг. Согласно этому альтернативному способу суточные стандартные дозы, которые содержат комбинацию дроспиренона и этинилэстрадиола, можно вводить в течение 21, 22, 23 или 24 последовательных дней, а суточные стандартные дозы, которые содержат только этинилэстрадиол, можно вводить при необходимости в течение 7, 6, 5 или 4 последовательных дней. Согласно дополнительному варианту способа суточные стандартные дозы, которые содержат комбинацию дроспиренона и этинилэстрадиола, вводят 2-4, предпочтительно 2 или 3 раза в течение 28 последовательных дней, с последующим введением суточных стандартных доз, которые содержат комбинацию дроспиренон и этинилэстрадиол, в течение 21 последовательного дня, а затем вводят суточные стандартные дозы, которые содержат только этинилэстрадиол, в течение 7 последовательных дней. Ниже настоящее изобретение более подробно проиллюстрировано на примерах. Краткое описание примеров В примере 1 описан фармацевтический продукт, соответствующий некоторым вариантам осуществления настоящего изобретения, наряду с фармацевтическими продуктами, хорошо известными специалисту в данной области. В табл. 1.3 проиллюстрирована характеристика стабильности в сравнении с известными препаратами после хранения в течение фиксированного периода времени в контролируемых условиях окружающей среды. Данные свидетельствуют о том, что непосредственное прессование порошкообразной смеси приводит к получению хорошей стабильности этинилэстрадиола, применяемого в виде комплекса с циклодекстрином (продукт Г). Продукт Д приготавливали согласно настоящему изобретению без использования поливинилпирролидона. Этот продукт также отличался хорошей стабильностью этинилэстрадиола, несмотря на то, что его приготавливали с помощью грануляции. Однако в том случае, если продукт включал поливинилпирролидон и его приготавливали согласно примеру 3 патентаUS 5798338 (таблица А), стабильность продукта была низкой. В примере 2 проиллюстрирована стабильность ЭЭ в композициях Г и Д в сравнении с другими композициями с точки зрения продуктов разложения, выделившихся из образцов, после хранения в течение фиксированного периода времени в контролируемых условиях окружающей среды. В примере 3 описан один из вариантов осуществления настоящего изобретения, где композиция дополнительно содержит дроспиренон.-9 007411 В примере 4 описана морфология или некоторые физические характеристики стандартной дозируемой формы композиции по настоящему изобретению. В примере 5 описан типичный процесс приготовления таблетки. В примере 6 описан метод, с помощью которого изучали некоторые физические свойства, такие как константу скорости диссоциации комплекса, содержащего ЭЭ и ЦД. Установлено, что время полужизни комплекса 1:1 составляло 155,8 с и значение константы диссоциации составляло 4,45 х 10-3 с-1. В примере 7 описан метод, с помощью которого оценивали равновесную константу устойчивости(константа образования) комплекса, содержащего ЭЭ и ЦД. Установлено, что константа устойчивости комплекса 1:1 составляла 9,5 х 10-4 М-1. Установлено, что растворимость входящего в комплекс этинилэстрадиола повышена по сравнению со свободным стероидом. В примере 8 описан метод, с помощью которого оценивали равновесную константу устойчивости(константа образования) комплекса, содержащего ЭЭ и ЦД, в кислой среде. Приведены данные о величинах константы устойчивости комплексов 1:1 и 1:2 в кислой среде. Установлено, что в кислой среде растворимость входящего в комплекс этинилэстрадиола повышена по сравнению со свободным стероидом. В примере 9 описан метод, с помощью которого установлено, что величина кислотной константы диссоциации (рКа) комплекса ЭЭ-ЦД в водных средах составляет примерно 10,51 по сравнению с рКа свободного стероида, составляющей примерно 10,25. В примере 10 описан метод, с помощью которого определяли значение коэффициента распределения в системе н-октанол/вода (Рo/w) комплекса ЭЭ-ЦД и его зависимость от значения рН. Значение log P находится в диапазоне от 3,20 до 3,53. В примере 11 обсуждается вопрос о возможности существования комплекса этинилэстрадиол-циклодекстрин в виде множества находящихся в твердом состоянии форм, и описаны методы анализа, с помощью которых можно обнаружить и различить такие формы. В примере 12 описаны типичные процессы получения комплекса ЭЭ-ЦД. Примеры Пример 1. Разложение этинилэстрадиола в различных композициях Были получены сравнительные данные о стабильности пяти композиций таблеток, которые содержали этинилэстрадиол. Различные композиции отличались друг от друга методом получения, применением этинилэстрадиола в форме комплекса с циклодекстрином и применением поливинилпирролидона 25000 (ПВП). Таблетку А получали согласно методу, описанному в патенте US 5798338, пример 3, с помощью грануляции в псевдоожиженном слое на основе премикса, содержащего действующее вещество и лактозу, и без регулирования относительной влажности гранул. Таблетки Б, В и Д получали согласно приведенному в описании способу. Таблица 1.1 Грануляцию в псевдоожиженном слое осуществляли согласно примеру 3 патента US 5798338. Грануляцию в псевдоожиженном слое осуществляли согласно методу, описанному в примере 5 настоя- 10007411 щего описания, ПВП = поливинилпирролидон. Таблица 1.2 Результаты Содержание этинилэстрадиола определяли с помощью ЖХВР непосредственно после приготовления (начало) и после хранения в различных условиях в течение 3 и 12 месяцев. Содержание этинилэстрадиола выражали относительно исходного содержания этинилэстрадиола, которое вносили в каждую композицию. Таблица 1.3 Пример 2. Образования продуктов окислительного разложения этинилэстрадиола Содержание известных продуктов окислительного разложения этинилэстрадиола определяли с помощью ЖХВР после хранения в течение 12 месяцев при 25 С и относительной влажности (RH) 60%. Молярное содержание каждого продукта разложения выражали относительно исходного молярного содержания этинилэстрадиола, которое добавляли в каждую композицию. Были изучены 4 композиции, а также чистый этинилэстрадиол и комплекс этинилэстрадиолциклодекстрин. Таблица 2.1. Данные о стабильности после хранения в течение 12 месяцев, 25 С, 60% RH- 11007411 н.о=невозможно определить; 6 ОН-ЭЭ=6 гидроксиэтинилэстрадиол; 6 ОН-ЭЭ=6-гидроксиэтинилэстрадиол; 6-кето-ЭЭ = 6-кетоэтинилэстрадиол; -9,11-ЭЭ = -9,11-этинилэстрадиол. Таблица 2.2. Данные о стабильности после хранения в течение 12 месяцев, 40 С, 75% RH н.о.=невозможно определить; 6 ОН-ЭЭ=6 гидроксиэтинилэстрадиол; 6 ОН-ЭЭ=6-гидроксиэтинилэстрадиол; 6-кето-ЭЭ = 6-кетоэтинилэстрадиол; -9,11-ЭЭ = -9,11-этинилэстрадиол. Пример 3. Описаны репрезентативные композиции ядра таблетки. На ядро таблетки необязательно можно наносить пленочное или сахарное покрытие с использованием указанных ингредиентов. Специфические ингредиенты, как правило, представляют собой ингредиенты, которые можно применять согласно изобретению (но не ограничиваясь ими). Таблица 3 Пример 4. Предпочтительные композиции Предпочтительные композиции состоят из перечисленных ниже компонентов. Размер партии составлял 200000-550000 таблеток (стадия разработки) и 2,5 млн таблеток вплоть до 5 млн таблеток (стадия промышленного выпуска) соответственно. Воду использовали в целях обработки для приготовления массы для таблетирования (грануляция в псевдоожиженном слое) и для нанесения пленочного покрытия. количество в пересчете на количество этинилэстрадиола. Пример 5. Процесс приготовления Процесс приготовления включал следующие стадии: Пример 6. Диссоциация комплекса ЭЭЦД Определяли константу скорости константы диссоциации комплекса ЭЭЦД в водном растворе. Метод анализа При растворении в воде комплекса этинилэстрадиолциклодекстрин происходит диссоциация на его компоненты, этинилэстрадиол (ЭЭ) и лиганд -циклодекстрин (ЦД) согласно закону равновесия действующих (реагирующих) масс. В этом опыте скорость диссоциации комплекса 1:1 оценивали с помощью релаксационного метода остановленной струи с кондуктометрическим обнаружением. Косвенный метод был основан на конкурентной реакции с использованием додецилсульфата натрия (ДСН), который также образует комплекс. Поскольку ДСН является солью, то в водном растворе происходит его диссоциация, что оказывает выраженное воздействие на проводимость. Когда анион ДС- связывается с -циклодекстрином, образуется комплекс, который является менее подвижным в воде, чем свободный ион ДС и электрическая проводимость раствора должна снижаться. Различие в проводимости свободного аниона ДС- и входящего в комплекс аниона использовали для оценки кинетики высвобождения этинилэстрадиола из клатратного комплекса с помощью устройства для измерения кинетики методом остановленной струи, снабженного детектором проводимости. Обобщение результатов Было установлено, что константа скорости диссоциации комплекса 1:1 этинилэстрадиол-циклодекстрин составляет Kd = 4,45 х 10-3 с-1. Рассчитано, что в условиях первого порядка время полуреакции диссоциации комплекса 1:1 этинилэстрадиолциклодекстрин составляет t1/2 = 155,8 с (2,6 мин). Пример 7. Константа устойчивости комплекса ЭЭЦД в водном растворе. Определяли равновесную константу устойчивости (константа образования) комплекса ЭЭЦД в водном растворе. Сущность метода Лекарственная субстанция в виде комплекса этинилэстрадиолциклодекстрин представляет собой клатратный комплекс, содержащий одну молекулу этинилэстрадиола и две молекулы -циклодекстрина. Образование клатрата этинилэстрадиолциклодекстрин в водном растворе из его компонентов этинилэстрадиола (S) и лиганда -циклодекстрина (L) оценивали с помощью приведенных ниже уравнений согласно закону действующих масс. Равновесную константу устойчивости (константа образования) К 11 определяли с помощью метода растворимости фаз. Для величины K12 была получена лишь грубая оценка. Обобщение результатов С помощью метода на основе фазовой диаграммы растворимости (ФДР) в водных растворах при 20 С были получены следующие результаты. Константа устойчивости комплекса 1:1 К 11 = 9,5 х 104 М-1 Растворимость этинилэстрадиола SЭЭ = 2,17 х 10-5 мол./л (6,43 х 10-3 г/л) Растворимость комплекса 1:1 S11 = 1,92 х 10-3 мол./л (2,75 г/л) Растворимость комплекса 1:2 S12 = 1,44 х 10-3 мол./л (3,7 г/л) Пример 8. Константа устойчивости комплекса ЭЭЦД в 0,1 М НСl Равновесную константу устойчивости (константа образования) комплекса ЭЭЦД в 0,1 М НСl определяли согласно методу, описанному в примере 7. Обобщение результатов С помощью метода на основе фазовой диаграммы растворимости (ФДР) в 0,1 М НСl при 20 С были получены следующие результаты. Константа устойчивости комплекса 1:1: К 11 = 1,56104 М-1 Полная константа устойчивости комплекса 1:2 (K11 x K12 = К 12 = примерно 1,6 х 104 М-1 Растворимость этинилэстрадиола: SЭЭ = 1,68 х 10-4 мол./л (0,05 г/л) Растворимость комплекса 1:1: S11 = 2 х 10-3 мол./л (2,9 г/л) Растворимость комплекса 1:2: S12 = 5 х 10-4 мол./л (1,3 г/л)- 15007411 Пример 9. Константа диссоциации комплекса ЭЭЦД в водном растворе Определяли кислотную константу диссоциации комплекса ЭЭЦД комплекс в водных средах. Сущность метода Лекарственная субстанция в виде комплекса этинилэстрадиолциклодекстрин представляет собой клатратный комплекс, содержащий одну молекулу этинилэстрадиола и две молекулы -циклодекстрина. В водном растворе происходит диссоциация комплекса этинилэстрадиолциклодекстрин на его компоненты согласно закону действующих масс. Для ограничения диссоциации комплекса этинилэстрадиолциклодекстрин для измерений использовали примерно 300-кратный (0,0114 молярный) избыток-циклодекстрина относительно этинилэстрадиола. Значение рКа определяли методом фотометрического титрования согласно руководству, приведенному в Environmental Assessment Technical Handbook. Обобщение результатов Кислотная константа диссоциации комплекса этинилэстрадиолциклодекстрин при определении при 20 С составляла рКа = 10,510,03. Для сравнения: рКа этинилэстрадиола в отсутствии -циклодекстрина составляет рКа = 10,250,04. Пример 10. Значение log P комплекса ЭЭЦД Сущность метода Лекарственная субстанция в виде комплекса этинилэстрадиолциклодекстрин представляет собой клатратный комплекс, содержащий одну молекулу этинилэстрадиола и две молекулы -циклодекстрина. Распределение комплекса этинилэстрадиолциклодекстрин определяли в условиях равновесия в двухфазной системе, н-октанол/вода. Определяли только общее количество этинилэстрадиола в водной и октанольной фазе. Результат представлял собой кажущийся коэффициент распределения этинилэстрадиола в системе н-октанол/вода. Для определения зависимости от значения рН кажущегося коэффициента распределения этинилэстрадиола в системе н-октанол/вода измерения осуществляли при рН 5, 7 и 9 с помощью метода встряхивания в колбе согласно руководству OECD 1071). Измерения проводили в водных растворах, забуференных до рН 5, 7 и 9. Концентрацию этинилэстрадиола в каждой фазе после уравновешивания при 25 С определяли с помощью ЖХВР. Обобщение результатов Пример 11. Формы твердого состояния комплекса этинилэстрадиолциклодекстрин Определяли множество форм твердого состояния комплекса этинилэстрадиолциклодекстрин, для этого использовали методы, которые позволяют выявить и различить такие формы. Сущность метода Были изучены различные продукты кристаллизации, полученные в различных условиях кристаллизации, сушки и хранения, в отношении их формы твердого состояния. В качестве соответствующих и возможных для применения были отобраны следующие аналитические методы для идентификации и характеризации форм твердого состояния: диффракция рентгеновских лучей на порошке (XRPD),дифференциальный термический анализ (DTA) в сочетании с термогравиметрией (TG),дифференциальная сканирующая калориметрия (DSC) в сочетании с термогравиметрией (TG). Обобщение результатов Данные об образовании комплекса получали посредством изучения чистых этинилэстрадиола и циклодекстрина, механических смесей обеих субстанций, а также образцов комплекса этинилэстрадиол-циклодекстрин с помощью диффракции рентгеновских лучей на порошке и термического анализа. Согласно полученным при создании изобретения данным по меньшей мере примерно 90% этинилэстрадиола должно быть связано в комплекс. Превалирующей формой комплекса этинилэстрадиолциклодекстрин является гидрат, содержащий различные количества воды. Вариабельность содержания воды зависит от свойства, присущего свободному циклодекстрину, а также его соединениям включения (комплексы или клатраты) уравновеши- 16007411 вать по меньшей мере часть гидратной воды с помощью атмосферной влажности. При хранении создается равновесие содержания воды, которое зависит от температуры, давления и относительной влажности. Гидратная вода может легко уходить из кристаллической решетки. В более строгих условиях сушки может быть удалена вся кристаллическая вода, однако образовавшийся продукт является очень гигроскопичным, и это является неприемлемым для лекарственной субстанции. Это относится к полностью насыщенным водой гидратам, которые являются стабильными только в присутствии маточного раствора или при относительной влажности, превышающей 97%. Таким образом, любое обсуждение форм твердого состояния комплекса этинилэстрадиолциклодекстрин должно быть основано главным образом на характеристиках разных гидратов, имеющих промежуточные содержания воды, не превышающие верхнего предела насыщения водой. Гидратная вода является частью кристаллической решетки, и поэтому изменения содержания воды связано с изменениями в кристаллической решетке. Это можно выявлять по различиям в картине дифракции рентгеновских лучей на порошке партий клатрата с различным содержанием воды. Согласно этим картинам было выявлено 4 различных типа. Партии типа I содержали менее 1% воды. В партиях типов II и III обнаружено от 4 и 10% воды до 8 и 15% воды соответственно. Партии типа IV отличались наличием в них более 15% воды. Однако не было выявлено четкого различия между двумя соседними типами. Положение пиков дифракции постепенно изменялось в результате набухания и сжатия кристаллической решетки в процессе сорбции и десорбции воды. Исследование четырех типов с помощью дифференциального термического анализа в сочетании с термогравиметрией позволило установить, что дегидратация происходила при температуре от 25 до 170 С. Различные формы легко и обратимо переходили друг в друга при регулировании условий влажности окружающей среды. Это поведение свидетельствует о выраженной устойчивости структурного каркаса, что не позволяет произойти заметному изменению основной структуры элементарных звеньев рциклодекстрин/этинилэстрадиол твердого продукта в процессе гидратации и дегидратации. Пример 12. Получение комплекса этинилэстрадиолциклодекстрин. Комплекс этинилэстрадиолциклодекстрин получали совместным осаждением согласно описанным ниже процессам. Процесс 1 (Р 1). Этинилэстрадиол растворяли в этаноле. -Циклодекстрин растворяли в воде при 45 С. Раствор этинилэстрадиола добавляли в раствор -циклодекстрина. Полученную суспензию перемешивали в течение нескольких часов при 20-25 С и затем при 2 С. Продукт кристаллизации выделяли и сушили с помощью описанных ниже методов. Процесс 2 (Р 2). Этинилэстрадиол растворяли в ацетоне. -Циклодекстрин растворяли в воде при 45 С. Раствор этинилэстрадиола добавляли к раствору -циклодекстрина. Полученную суспензию перемешивали в течение нескольких часов при температуре ниже 25 С. Затем продукт кристаллизации выделяли и сушили с помощью описанных ниже методов. Механические смеси -циклодекстрина и этинилэстрадиола получали путем взвешивания и последующей гомогенизации путем измельчения в агатовой ступке. Таблица 12.1 а. Продукты кристаллизации комплекса рассчитано, исходя из содержания воды в исходном продукте и обнаруженного изменения массы.I) комплекс эстрогена циклодекстирина в гранулированном препарате, где если гранулированный препарат содержит поливинилпирролидон, то он присутствует в концентрации не более 2 мас.%; и необязательноII) один или несколько эксципиентов,причем композиция обладает такой стабильностью, что после хранения в течение 12 месяцев при 40 оС относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена. 2. Композиция по п.1, где эстроген выбирают из группы, включающей этинилэстрадиол (ЭЭ), эстрадиол, сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон и сульфат эстрона или их смеси. 3. Композиция по п.1 или 2, где эстроген выбирают из группы, включающей этинилэстрадиол (ЭЭ),сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон и сульфат эстрона или их смеси. 4. Композиция по п.3, где эстроген представляет собой этинилэстрадиол (ЭЭ). 5. Композиция по любому из предыдущих пунктов, где циклодекстрин выбирают из группы, включающей -циклодекстрин, -циклодекстрин, -циклодекстрин и их производные. 6. Композиция по п.5, где циклодекстрин представляет собой -циклодекстрин или его производные. 7. Композиция по любому из предыдущих пунктов, где эстроген присутствует в количестве, которое соответствует терапевтически эквивалентному количеству этинилэстрадиола, составляющему примерно 0,002-2 мас.%. 8. Композиция по любому из пп.1-6, где эстроген присутствует в количестве примерно 0,002-2 мас.%. 9. Композиция по любому из предыдущих пунктов, где эстроген представляет собой этинилэстрадиол и циклодекстрин представляет собой -циклодекстрин, причем этинилэстрадиол присутствует в количестве примерно 5-20 мас.% относительно массы комплекса этинилэстрадиолциклодекстрин. 10. Композиция по любому из предыдущих пунктов, где эстроген присутствует в таком количестве относительно циклодекстрина, что молярное соотношение эстрогена и циклодекстрина составляет примерно от 2:1 до 1:10. 11. Композиция по любому из предыдущих пунктов, дополнительно содержащая одно или несколько терапевтических действующих веществ. 12. Композиция по п.11, где одно или несколько терапевтических действующих веществ представляет собой прогестоген. 13. Композиция по п.12, где прогестоген выбирают из группы, включающей дроспиренон, левоноргестрел, норгестрел, гестоден, диеногест, ацетат ципротерона, норэтистерон, ацетат норэтистерона, десоргестрел и 3-кетодесоргестрел. 14. Композиция по п.13, где прогестоген представляет собой дроспиренон. 15. Композиция по п.14, где дроспиренон является тонкоизмельченным. 16. Композиция по п.14 или 15, где дроспиренон присутствует в количестве примерно 0,4-20 мас.%. 17. Композиция по любому из предыдущих пунктов, где гранулированный препарат имеет относительную влажность не более 55% при определении при температуре 20-40 С. 18. Композиция по любому из предыдущих пунктов, содержащая не более 1 мас.% поливинилпирролидона. 19. Композиция по любому из предыдущих пунктов, где один или несколько эксципиентов выбирают из группы, включающей крахмал, целлюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и мальтодекстрин. 20. Композиция по любому из предыдущих пунктов, где комплекс является тонкоизмельченным. 21. Композиция по любому из предыдущих пунктов, дополнительно содержащая антиоксидант. 22. Стандартная дозируемая форма, включающая композицию по пп.1-21. 23. Стандартная дозируемая форма по п.22, представляющая собой таблетку, капсулу или саше. 24. Способ приготовления композиции, содержащей комплекс эстроген-циклодекстрин, который предусматривает следующие стадии:I) получение комплекса эстрогена и циклодекстрина;II) загрузку комплекса и одного или нескольких эксципиентов в гранулятор;III) нанесение жидкости на загруженный комплекс и один или несколько эксципиентов в таких условиях грануляции, чтобы получать гранулы, относительная влажность которых не превышает 60% при определении при температуре 20-40oС, причем, если один или несколько эксципиентов представляет(ют) собой поливинилпирролидон, то он присутствует в композиции в концентрации не выше 2 мас.%. 25. Способ по п.24, где гранулированный препарат имеет относительную влажность не более 55% при определении при температуре 20-40 С.- 20007411 26. Способ по п.24 или 25, где эстроген выбирают из группы, включающей этинилэстрадиол (ЭЭ),эстрадиол, сульфаматы эстрадиола, валерат эстрадиола, бензоат эстрадиола, эстрон и сульфат эстрона или их смеси. 27. Способ по п.26, где эстроген представляет собой этинилэстрадиол (ЭЭ). 28. Способ по любому из пп.24-27, где содержание поливинилпирролидона не превышает 1 мас.%. 29. Композиция, полученная согласно способу по любому из пп.24-28. 30. Способ повышения стабильности эстрогена в композиции, который предусматривает следующие стадии:I) получение комплекса эстрогена и циклодекстрина; иII) смешение в условиях грануляции указанного комплекса с одним или несколькими эксципиентами таким образом, чтобы относительная влажность конечного гранулята не превышала 60% при ее определении при температуре 20-40 С, причем, если один или несколько эксципиентов представляет(ют) собой поливинилпирролидон, то он присутствует в композиции в концентрации не выше 2 мас.%. 31. Способ по п.30, в котором поливинилпирролидон присуствует в композиции в количестве не более 1 мас.%. 32. Применение комплекса эстрогена и циклодекстрина для женской контрацепции, причем комплекс находится в форме композиции, которая содержит гранулированный препарат указанного комплекса, причем, если композиция содержит поливинилпирролидон, то он присутствует в концентрации не выше 2 мас.%, композиция обладает такой стабильностью, что после хранения в течение 12 месяцев при 40 С относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена. 33. Применение по п.32, где композиция представляет собой композицию по любому из пп.2-21 или 29. 34. Применение комплекса эстрогена и циклодекстрина для приготовления лекарственного средства, предназначенного для женской гормонзаместительной терапии, где лекарственное средство включает композицию, представляющую собой комплекс гранулированного препарата, причем, если гранулированный препарат содержит поливинилпирролидон, то он присутствует в концентрации не выше 2 мас.%,лекарственное средство обладает такой стабильностью, что после хранения в течение 12 месяцев при 40 С относительной влажности (RH) 75% эстроген присутствует по меньшей мере в количестве 85 мас.% относительно начального содержания эстрогена. 35. Применение по п.34, где композиция представляет собой композицию по любому из пп.2-21 или п.29.
МПК / Метки
МПК: A61K 31/565, A61K 9/16, A61P 15/18, A61K 47/40, A61P 5/30
Метки: композиции, эстроген-циклодекстрин, комплексов
Код ссылки
<a href="https://eas.patents.su/22-7411-kompozicii-kompleksov-estrogen-ciklodekstrin.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции комплексов эстроген-циклодекстрин</a>
Предыдущий патент: N-аминоацетилпирролидин-2-карбонитрилы и их применение в качестве ингибиторов ddp-iv
Следующий патент: Соли е-2-метокси-n-(3- (4- (3- метилпиридин -3- илокси) фениламино) хиназолин -6- ил-аллил)ацетамида, их получение и их применение против рака
Случайный патент: Тгф-содержащие сульфонамидные ингибиторы аспартил-протеазы