Дифенилкарбоновые кислоты и их производные
Формула / Реферат
1. Соединение формулы I
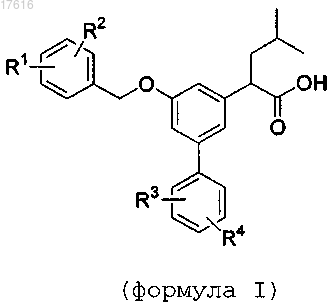
где R1 представляет собой F, Cl или CF3;
R2 представляет собой F, Cl или CF3;
R3 представляет собой F, Cl или CF3;
R4 представляет собой Н, F, Cl или CF3;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, где
R1 представляет собой F;
R3 представляет собой CF3;
или его фармацевтически приемлемые соли.
3. Соединение по п.2, выбранное из группы, состоящей из
(R)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,
(S)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,
2-[5-(4-фтор-2-трифторметилбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,
2-[4'-хлор-5-(3,5-дифторбензилокси)-3'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,
а также их фармацевтически приемлемых солей.
4. Применение соединения по любому из пп.1-3 в качестве лекарственного средства.
5. Применение соединения по любому из пп.1-3 для приготовления лекарственного средства, модулирующего активность γ-секретазы.
6. Применение соединения по любому из пп.1-3 для приготовления лекарственного средства, предназначенного для лечения заболевания, связанного с повышенным уровнем образования Аβ42-пептидов.
7. Применение соединения по любому из пп.1-3 для приготовления лекарственного средства, предназначенного для лечения болезни Альцгеймера.
8. Фармацевтическая композиция, включающая соединение по любому из пп.1-3 и инертный носитель.
9. Способ лечения млекопитающего путем модулирования активности γ-секретазы, включающий введение данному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3.
10. Способ лечения млекопитающего от заболевания, связанного с повышенным уровнем образования Aβ42-пептидов у млекопитающего, включающий введение данному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3.
11. Способ лечения болезни Альцгеймера у млекопитающего, включающий введение данному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3.
Текст
Изобретение относится к соединениям с общей формулой I, где R1, R2, R3 и R4 являются описанными здесь веществами и/или их солями, либо сложными эфирами. Изобретение также относится к применению указанных соединений для лечения болезни Альцгеймера и модулирования активности -секретазы. Хо Чих Юнг (US) Медведев В.Н. (RU) 017616 Заявка имеет приоритетное право на преимущества, предоставляемые предварительной заявкой на патент США, серийный 60/980587, поданной 17 октября 2007 г. Вся приведенная в вышеуказанной заявке на патент США информация считается включенной в текст настоящего документа путем отсылки для любых целей. Область изобретения Настоящее изобретение относится к соединениям с общей формулой I, где R1-R4 являются описанными далее веществами и/или их солями, либо сложными эфирами. Изобретение также относится к применению указанных соединений для лечения болезни Альцгеймера и модулирования активности -секретазы. Настоящая заявка касается рассматриваемого в данный момент подмножества соединений, описанного в заявке WO 2006/04555 А 1. Предпосылки создания изобретения Болезнь Альцгеймера (БА) - прогрессирующее нейродегенеративное заболевание, сопровождающееся потерей памяти, когнитивными нарушениями и отклонениями в поведении. БА поражает 6-10% популяции в возрасте старше 65 лет и до 50% старше 85 лет, является ведущей причиной деменции и третьей по частоте причиной смерти после сердечно-сосудистых и раковых заболеваний. В настоящее время способы эффективного лечения БА медицине не известны. Общая сумма средств, ежегодно затрачиваемых США в связи с БА, превышает 100 млрд . Полного понимания этиологии БА в настоящее время не достигнуто, однако известны факторы риска: 1) возраст, 2) семейный анамнез, 3) травмы головы; к числу прочих факторов также относят встречающиеся в окружающей среде токсины и низкий уровень образованности. Специфические нейропатологические поражения, обнаруживаемые в лимбической и остальной коре головного мозга, представляют собой внутриклеточные нейрофибриллярные клубки слипшегося избыточно фосфорилированного тау-белка и внеклеточные отложения фибриллярных скоплений бета-амилоидных пептидов (амилоидных бляшек). Главным компонентом амилоидных бляшек являются бета-амилоидные пептиды (А-бета или А) разной длины. Одна из разновидностей данных пептидов, А 1-42-пептид (А-42), считается основной причиной возникновения амилоидных образований. Другой разновидностью является А 1-40-пептид (А-40). Бета-амилоид образуется в результате расщепления белка-предшественника - бета-АРР или АРР. Наследственные, рано проявляющиеся аутосомно-доминантные формы БА связывают с нонсенсмутациями белка - предшественника -амилоида (-АРР или АРР) и двух других белков - пресенилина-1 и пресенилина-2. У ряда пациентов поздно проявляющиеся формы БА связывают со специфическим аллелем гена аполипопротеина Е (АроЕ) и в последнее время с мутацией альфа-2-макроглобулина, которая может быть причиной БА по меньшей мере у 30% больных. Несмотря на неоднородность причин, все формы БА имеют схожие патологические проявления. Наиболее эффективным средством для выработки подхода к лечению БА считается генетический анализ. Все известные на данный момент мутации влияют количественно или качественно на образование амилоидогенных пептидов, именуемых А-пептидами(А), в частности А 42, и в значительной степени подтверждают гипотезу "амилоидного каскада" (Tanziand Bertram, 2005, Cell 120, 545). Предполагаемая связь между образованием А-пептидов и патологией БА требует дальнейшего изучения механизмов образования А и позволяет с высокой долей уверенности считать ключевой терапевтической задачей снижение уровня А. Высвобождение А-пептидов достигается модулированием по меньшей мере двух видов протеолитической активности, именуемых расщеплением - и -секретазы в N-конце (связь "мет-асп") и С-конце(остатки 37-42) А-пептида соответственно. Исследования механизма секреции показывают, что секретаза расщепляется первой, вызывая секрецию s-APP (s) и удержание связанного с мембраной карбоксил-терминального фрагмента (КТФ) массой 11 кДа. Последний считают ответственным за образование A-пептидов в результате расщепления -секретазой. Количество более длинной изоформы А 42 избирательно увеличивается у пациентов с определенными мутациями конкретного белка (пресенилина), причем эти мутации связывают с рано проявляющимися наследственными формами болезни Альцгеймера. Поэтому многие исследователи считают A42 главной причиной патогенеза болезни Альцгеймера. В настоящее время достоверно известно, что активность -секретазы обусловлена не одним конкретным белком, но совокупностью нескольких белков. В основе активности гамма-секретазы лежит мультибелковый комплекс, содержащий не менее четырех компонентов: пресенилин-гетеродимер (ПС), никастрин, aph-1 и pen-2. ПС-гетеродимер состоит из амино- и карбоксил-терминальных фрагментов ПС, образующихся в результате эндопротеолиза белкапредшественника. Два аспартата каталитического центра находятся на границе данного гетеродимера. Недавно было высказано предположение, что никастрин выступает рецептором субстрата гаммасекретазы. Функции остальных компонентов гамма-секретазы неизвестны, однако все они необходимы для ее активности (Steiner, 2004. Curr. Alzheimer Research 1(3): 175-181). Таким образом, несмотря на то что молекулярный механизм второй стадии расщепления до сих пор остается неясным, комплекс -секретазы в настоящее время является одной из основных мишеней разра-1 017616 батываемых для лечения болезни Альцгеймера соединений. Исследователями предложены различные способы фармацевтического воздействия на гаммасекретазу при болезни Альцгеймера: от прямого воздействия на каталитический центр до разработки ингибиторов, связывающихся непосредственно с субстратом, и модуляторов активности гаммасекретазы (Marjaux et al., 2004. Drug Discovery Today: Therapeutic Strategies, Volume 1, 1-6). Соответственно, в литературе описаны многочисленные соединения, мишенью которых являются секретазыPatents 14, 1403-1420). Недавно данное наблюдение было действительно подтверждено биохимическими исследованиями,показавшими эффективность воздействия некоторых НПВС на -секретазу (Weggen et al (2001) Nature 414, 6860, 212 и WO 01/78721 и US 2002/0128319; Morihara et al. (2002) J. Neurochem. 83, 1009; Eriksen(2003) J. Clin. Invest. 112, 440). Препятствиями для применения НПВС в профилактике или лечении БА могут быть ингибирование ими ферментативной активности циклооксигеназы, потенциально чреватое неблагоприятными побочными эффектами, и недостаточное проникновение в ЦНС (Peretto et al., 2005, J.Med. Chem. 48, 5705-5720). Таким образом, существует насущная необходимость в новых соединениях, модулирующих активность -секретазы и открывающих новые перспективы в лечении болезни Альцгеймера. Целью настоящего изобретения является создание таких соединений. Краткое описание изобретения Изобретение относится к соединениям, показанным в формуле IR4 представляет собой Н, F, Cl или CF3; а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. Данное подмножество соединений проявляет непредвиденно высокую активность и эффективностьin vivo. В частности, активность и эффективность повышаются, когда R1 и R2 являются электроноакцепторными группами, например F, Cl или CF3, и углероду карбоксилата замещается втор-бутилом. Подробное описание изобретения Изобретение относится к соединениям, показанным в формуле IR4 представляет собой Н, F, Cl или CF3; а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. Вариантом осуществления изобретения является соединение, гдеR4 представляет собой Н, F, Cl или CF3; а также его сольваты, гидраты, сложные эфиры и фармацевтически приемлемые соли. Другим вариантом осуществления изобретения является соединение, выбранное из группы, состоящей из(R)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,(S)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,2-[5-(4-фтор-2-трифторметилбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,2-[4'-хлор-5-(3,5-дифторбензилокси)-3'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,-2 017616 а также их сольватов, гидратов, сложных эфиров и фармацевтически приемлемых солей. Специалист в этой области заметит, что соединения по формуле I могут иметь один или несколько асимметричных атомов углерода в своей структуре. Настоящее изобретение включает в себя формы соединений с одним энантиомером, рацемические смеси и смеси энантиомеров с энантиомерным избытком. Некоторые соединения по изобретению и/или их соли, либо сложные эфиры могут существовать в различных стереоизомерных формах. Все эти формы включены в объем изобретения. Ниже приведены примеры солей соединений по изобретению, которые включены в его объем. Список приведенных ниже различных солей не является исчерпывающим и окончательным. Соединения по изобретению, содержащие одну или несколько кислотных групп, могут быть использованы согласно изобретению, например как их соли щелочных металлов, соли щелочно-земельных металлов или соли аммония. Более частными примерами таких солей являются соли натрия, соли калия,соли кальция, соли магния или соли аммония либо органических аминов, например этиламин, этаноламин, триэтаноламин или аминокислоты. Термин "фармацевтически приемлемый" означает разрешенный регулятивными органами, в частности ЕМЕА (Европа) и/или FDA (США), и/или любым другим национальным регулирующим органом,для применения у животных, предпочтительно у человека. Соответствующие соли соединений по изобретению могут быть получены стандартными способами, известными специалистам в этой области, например путем их сочетания с органическим или неорганическим основанием в растворителе или диспергаторе либо путем катионного обмена с другими солями. Кроме того, изобретение включает в себя все соли соединений по изобретению, которые в связи с низкой физиологической совместимостью не подходят для непосредственного использования в лекарственных средствах, но могут быть применены, например, в качестве промежуточных компонентов химических реакций, для получения фармацевтически приемлемых солей или изучения возможностей модулирования активности -секретазы соединением по изобретению любым доступным способом, в частности анализом in vitro. Настоящее изобретение также включает в себя все сольваты соединений по изобретению. Настоящее изобретение также включает в себя производные/пролекарства (в том числе их соли) соединений по изобретению, содержащие физиологически допустимые расщепляемые группы, метаболизируемые в соединение по изобретению организмом животных, предпочтительно млекопитающих и наиболее предпочтительно человека. Настоящее изобретение также включает в себя метаболиты соединений по изобретению. Термин "метаболиты" означает все молекулы, происходящие из соединений по изобретению в клетке или организме, предпочтительно у млекопитающих. Предпочтительно термин "метаболиты" означает молекулы, которые в физиологических условиях отличаются от других молекул, присутствующих в данной клетке или организме. Структура метаболитов соединений по изобретению будет ясна специалистам в этой области, использующим различные подходящие способы. Соединения по общей формуле (I) могут быть получены описанными в литературе или аналогичными способами. В зависимости от обстоятельств каждого отдельного случая для исключения побочных реакций в ходе синтеза соединения, имеющего общую формулу (I), может быть необходима или полезна временная блокировка функциональных групп путем добавления защитных групп с последующей разблокировкой на более позднем этапе синтеза. Возможно также добавление функциональных групп в виде групппредшественников с последующим преобразованием в требуемые функциональные группы на более позднем этапе. Приемлемые методы синтеза, защитные группы и группы-предшественники известны специалистам в этой области. При необходимости соединения по формуле (I) могут быть очищены стандартными способами очистки, в частности перекристаллизацией или хроматографией. Исходные материалы для получения соединений по формуле (I) имеются в продаже либо могут быть получены описанными в литературе или аналогичными способами. Они могут быть взяты за основу для получения других соединений по изобретению несколькими способами, хорошо известными специалистам в этой области. Изобретение также относится к соединениям, предназначенным для использования в качестве лекарственного средства. Данные соединения соответствуют вышеуказанным. Кроме того, при использовании в качестве ЛС изобретение также включает в себя все нижеуказанные варианты его осуществления для этой цели, в частности формулу, применение и комбинацию. В частности, соединения по изобретению подходят для лечения болезни Альцгеймера. Применение с этой целью подробно рассматривается далее. Соединения могут использоваться для модулирования активности -секретазы.-3 017616 В настоящем документе термин "модулирование активности -секретазы" означает воздействие комплекса -секретазы на процесс превращения белка АРР. Предпочтительно он означает такое воздействие, при котором общая скорость превращения АРР остается в целом такой же, как если бы вышеуказанные соединения не применялись, однако относительное количество продуктов превращения изменяется, наиболее предпочтительно таким образом, при котором уровень A42-пептидов сокращается. В частности, могут быть образованы другие разновидности А-пептидов (А-38 и другие разновидности А-пептидов с меньшим количеством аминокислот вместо А-42) или относительное количество продуктов превращения может отличаться (например, изменяется соотношение А-40 и А-42, предпочтительно увеличивается). Активность гамма-секретазы может быть измерена, например, путем отслеживания превращения АРР, в частности уровней образующихся разновидностей A-пептидов, в особенности уровней A-42(см. раздел "Примеры" ниже). В литературе также описано участие комплекса -секретазы в превращении белка семейства Notch. Белок семейства Notch - это сигнальный белок, играющий важную роль в процессах развития (см., например, Schweisguth F (2004) Curr. Biol. 14, R129). Применительно к использованию указанных соединений для модулирования активности секретазы в терапевтических целях особенно важным представляется обеспечение их невмешательства в превращение белка семейства Notch -секретазой, чтобы исключить потенциальные неблагоприятные побочные эффекты. Таким образом, предпочтительными являются соединения, не воздействующие на превращение белка семейства Notch комплексом -секретазы. Применительно к настоящему изобретению термин "воздействие на превращение белка семействаNotch" означает как ингибирование, так и катализ превращения белка семейства Notch с той или иной степенью эффективности. Соединение считается не оказывающим воздействия на превращение белка семейства Notch, если вышеуказанная степень меньше 20, предпочтительно меньше 10, более предпочтительно меньше 5 и наиболее предпочтительно меньше 2 согласно результатам соответствующего анализа, описанного вShimizu et al. (2000) Mol. Cell. Biol, 20: 6913, при концентрации 30 М. Подобное модулирование активности -секретазы может быть выполнено, в частности, у животных,например млекопитающих. К ним относятся мыши, крысы, морские свинки, обезьяны, собаки, кошки и т.д. Модулирование может быть также выполнено у человека. В одном из вариантов осуществления изобретения модулирование выполняется in vitro или в культуре клеток. Специалистам в этой области известны несколько способов анализа in vitro и в культуре клеток. Примеры анализов, подходящих для измерения образования С-терминальных фрагментов белка АРР в линиях клеток или у трансгенных животных путем вестерн-блоттинга, приведены, в частности, вYan et al., 1999, Nature 402, 533-537. Пример анализа -секретазы in vitro описан в WO-03/008635. В данном анализе приемлемый субстрат пептида сочетают с препаратом -секретазы и измеряют способность расщепления субстрата. Концентрации разных продуктов расщепления -секретазы (A-пептидов) могут быть определены различными способами, известными специалистам в этой области. Примерами подобных способов качественного и количественного определения пептидов являются масс-спектрометрия и анализ с помощью антител. Примеры анализов, подходящих для исследования растворимых A-пептидов в питательной среде для культивирования клеток и биологических жидкостях, приведены, в частности, в Wang et al., 1996, J.Biol. Chem. 271, 31894-31902. В данном анализе иммунопреципитацию A-пептидов специфическими к ним антителами с последующим качественным и количественным определением разновидностей пептидов сочетали с время-пролетной масс-спектрометрией путем матрично-активированной лазерной десорбции/ионизации. Примеры способов, подходящих для количественного анализа образования пептидов А-40 и А-42 путем ИФА, приведены, в частности, в Vassar et al., 1999, Science 286, 735-741. Дополнительные наблюдения представлены, например, в N. Ida et al. (1996) J. Biol. Chem. 271, 22908, и М. Jensen et al. (2000)Mol. Med. 6, 291. Подходящие тела поставляются, в частности, компанией The Genetics Company, Inc.,Швейцария. Наборы антител также поставляются компанией Innogenetics, Бельгия. Для данного анализа могут быть, в частности, использованы клетки, эндогенно экспрессирующие комплекс -секретазы, и трансфицированные клетки, кратковременно или постоянно экспрессирующие некоторые либо все взаимодействующие компоненты комплекса -секретазы. В продаже имеются многочисленные линии клеток, подходящие для подобного анализа; они должны быть известны специалистам в этой области. Особенно эффективны клетки и линии клеток нейронного или глиального происхождения. Кроме того, могут быть использованы клетки и ткани мозга, а также соответствующие гомогенаты и мембранные препараты (Xia et al., 1998, Biochemistry 37, 16465-16471).-4 017616 Подобные анализы могут быть выполнены, в частности, для изучения эффективности соединений по изобретению в различных экспериментальных условиях и конфигурациях. Кроме того, подобные анализы могут осуществляться в рамках функциональных исследований комплекса -секретазы. Например, один или несколько взаимодействующих компонентов (либо немутантного типа, либо с рядом мутаций и/или модификаций) комплекса -секретазы животного, предпочтительно млекопитающего, более предпочтительно человека, могут быть экспрессированы в линиях клеток с последующим анализом эффективности соединения по изобретению. Мутантные формы одного или нескольких используемых взаимодействующих компонентов комплекса могут являться мутантными формами, описанными в литературе для некоторых животных, предпочтительно млекопитающих, более предпочтительно человека, или мутантными формами, ранее не описанными для указанных животных. Модификации взаимодействующих компонентов комплекса -секретазы подразумевают как физиологическую модификацию указанных взаимодействующих компонентов, так и другие модификации,описанные в литературе как модификации белков в биологической системе. Примерами таких модификаций являются гликозилирование, фосфорилирование, пренилирование,миристилирование, фарнезилирование и т.д. Кроме того, соединения по изобретению могут быть использованы для получения лекарственного средства, модулирующего активность -секретазы. Изобретение также относится к использованию указанных соединений для получения лекарственного средства, модулирующего активность -секретазы. Активность -секретазы может быть модулирована разными способами с образованием различающихся качественно и количественно А-пептидов. Предпочтительно использование соединения для модулирования активности -секретазы таким образом, при котором относительное количество образующихся А 42-пептидов снижается. Соответствующие дозировки, способы введения, формулы и т.д. описаны далее. Изобретение также относится к использованию указанных соединений по изобретению для лечения заболевания, связанного с повышенным уровнем образования А 42-пептидов. К основным заболеваниям, при которых наблюдается повышенный уровень образования и отложения в мозге A-пептидов, относятся болезнь Альцгеймера (БА), церебральная амилоидная ангиопатия, мультиинфарктная деменция,деменция боксеров или болезнь Дауна, предпочтительно БА. В настоящем документе термин "лечение" означает все процессы, направленные на замедление,прерывание, приостановку или остановку прогрессирования заболевания, однако необязательно подразумевает полное устранение всех симптомов. В настоящем документе термин "повышенный уровень образования А 42-пептидов" означает состояние, при котором скорость образования А 42-пептидов увеличивается в связи с общей интенсификацией превращения белка АРР или предпочтительно означает состояние, в котором образование A42 пептидов увеличивается в связи с изменением процесса превращения АРР по сравнению с АРР немутантного типа и здоровым организмом. Как указывалось выше, подобный повышенный уровень образования А 42-пептидов характерен для начальной и поздней стадий болезни Альцгеймера. Одним из преимуществ соединений или части соединений по настоящему изобретению может являться более эффективное проникновение в ЦНС. Изобретение также относится к фармацевтическим композициям, содержащим соединение по изобретению вместе с инертным носителем. В предпочтительном варианте осуществления изобретение относится к фармацевтическим композициям, содержащим соединение по изобретению вместе с инертным носителем, где указанный инертный носитель является фармацевтическим носителем. Термин "носитель" означает растворитель, формообразующее вещество, вспомогательное вещество или систему доставки, в сочетании с которыми вводится соединение. В качестве подобных фармацевтических носителей могут быть использованы стерильные жидкости, например вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, в частности арахисовое, соевое, минеральное, кунжутное масло и т.п. При пероральном введении фармацевтической композиции предпочтительным носителем является вода. При в/в введении фармацевтической композиции предпочтительными носителями являются физиологический раствор и водный раствор декстрозы. При инъекционном введении предпочтительными жидкими носителями являются физиологический раствор, водный раствор декстрозы и раствор глицерина. К фармацевтически приемлемым вспомогательным веществам относятся крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, натрия стеарат, глицеролмоностеарат, тальк, натрия хлорид, молоко сухое обезжиренное, глицерин, пропилен, гликоль, вода, этанол и т.п. При необходимости композиция может также содержать небольшое количество увлажняющих, эмульгирующих или рН-буферных агентов. Данная композиция может иметь форму рас-5 017616 творов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, формул замедленного высвобождения и т.п. Композиция может иметь форму суппозиториев, содержащих традиционные связующие вещества и носители, в частности триглицериды. Пероральные формы могут содержать стандартные носители, в частности фармацевтического качества маннит, лактозу, крахмал, магния стеарат, натрия сахарин, целлюлозу, магния карбонат и т.д. Примеры фармацевтически приемлемых носителей приведены в E.W.Martin. Remington's Pharmaceutical Sciences. Подобные композиции должны содержать терапевтически эффективное количество соединения, предпочтительно в очищенной форме, в сочетании с пропорциональным количеством носителя, чем обеспечивается подходящая для надлежащего введения пациенту форма. Формула должна соответствовать способу введения. Соединения по изобретению и их фармацевтически приемлемые соли, в том числе в сочетании с другими фармацевтически активными соединениями, подходят для лечения или профилактики болезни Альцгеймера и ее симптомов. К подобным дополнительным соединениям относятся ноотропные лекарственные средства, в частности ингибиторы ацетилхолинэстеразы (донепезил, такрин, галантамин, ривастигмин и т.д.), NMDA-антагонисты (мемантин и т.д.), ингибиторы PDE4 (Арифло и т.д.) и прочие известные специалистам в этой области препараты, подходящие для лечения или профилактики болезни Альцгеймера. В число подобных соединений также входят снижающие уровень холестерина препараты,в частности статины (симвастатин и т.д.). Данные соединения могут быть введены животным, предпочтительно млекопитающим и особенно человеку, непосредственно в виде отдельных фармацевтических препаратов, в сочетании друг с другом или в виде комбинированных фармацевтических составов. Известны и могут быть использованы различные системы доставки соединения по изобретению с целью лечения болезни Альцгеймера либо модулирования активности -секретазы, в частности инкапсуляция в липосомах, микрочастицах и микрокапсулах. Если доставка ЛС осуществляется не напрямую в центральную нервную систему, предпочтительно мозг, то предпочтительным является выбор и/или изменение способа введения таким образом, который позволит фармацевтическому соединению эффективно преодолеть гематоэнцефалический барьер. Способы введения включают, в частности, внутрикожный, внутримышечный, внутрибрюшинный,внутривенный, подкожный, интраназальный, эпидуральный и пероральный. Соединения могут быть введены любым удобным способом, включая вливание, болюсное введение,всасывание через эпителий или слизисто-кожные оболочки, а также в сочетании с другими биологически активными веществами. Введение может быть общим или местным. Кроме того, при необходимости фармацевтические композиции по изобретению могут быть введены в центральную нервную систему любым подходящим способом, включая внутрижелудочковую и интратекальную инъекции; при внутрижелудочковой инъекции может быть дополнительно использован внутрижелудочковый катетер, в том числе подсоединенный к резервуару, например резервуару Оммайя. Возможно также введение ЛС через легочные пути, в частности посредством ингалятора или небулайзера, при этом ЛС должно содержать аэрозолеобразующий агент. В другом варианте осуществления изобретения соединение может доставляться в везикулах, в частности в липосомах (Langer (1990) Science 249, 1527). Другим вариантом осуществления изобретения является доставка соединения с помощью системы контролируемого высвобождения. Один из вариантов предусматривает применение помпы (Sefton (1987)Med. 321, 574). Другой вариант предполагает применение полимерных материалов (Ranger and PeppasAnn. Neurol. 25, 351; Howard et al. (1989) J. Neurosurg. 71, 858). Еще одним вариантом является размещение системы контролируемого высвобождения вблизи терапевтической мишени, т.е. мозга, в результате чего требуется лишь малая часть от объема системной дозы (напр., Goodson, 1984, в Medical Applicationsof Controlled Release, supra, Vol. 2, 115). Другие системы контролируемого высвобождения рассмотрены в обзорной публикации Langer (1990, Science 249, 1527). При выборе оптимального способа введения специалист в этой области должен также учесть способы, используемые для других известных ЛС, предназначенных для лечения болезни Альцгеймера. К примеру, арисепт/донепезил и когнекс/такрин (все являются ингибиторами ацетилхолинэстеразы) применяют перорально, аксура/мемантин (NMDA-антагонист) выпускаются как в таблетированной/жидкой форме, так и в виде раствора для в/в ведения. Кроме того, специалист в этой области должен принимать во внимание имеющиеся данные относительно способов введения препаратов группы НПВС, использованных в клинических исследованиях и других испытаниях, направленных на изучение их эффективности при болезни Альцгеймера. При выборе дозировки специалист в этой области должен принимать во внимание дозировки, которые были признаны нетоксичными по результатам доклинических и/или клинических исследований и которые могут соответствовать приведенным ранее значениям или отличаться от них. Конкретная дозировка соединения в формуле будет также зависеть от способа введения, стадии заболевания или нарушения и определяться по усмотрению врача с учетом индивидуальных особенностей-6 017616 каждого пациента. Однако для в/в введения оптимальной дозировкой в целом считается 20-500 мкг действующего вещества на кг веса тела. Для интраназального введения в целом оптимальной дозировкой является 0,01-1 мг/кг веса тела. Эффективная дозировка может быть подобрана на основании данных о соотношении дозировки и эффективности, полученных при испытаниях in vitro или на животных моделях. Примером животной модели является трансгенный штамм мыши Tg2576, содержащий разновидность белка АРР 695, подвергнутую двойной мутации (KM670/671NL). См., например, патент US5877399 и Hsiao et al. (1996) Science 274, 99, а также Kawarabayahsi T (2001) J. Neurosci. 21, 372; Frautschy et al.Neurobiol. Aging 24, 645. Для подбора дозировки, соответствующей выбранному курсу лечения, специалисты в этой области могут использовать существенные данные нескольких проведенных ранее исследований. Исследования воздействия молекул на активность -секретазы описаны в многочисленных публикациях. Примерами подобных исследований являются Lim et al. (2001) Neurobiol. Aging 22, 983; Lim et al.Yan et al. (2003) J Neurosci. 23, 7504. Общее описание синтеза Следующее общее описание имеет строго информативный характер и ни в коей мере не ограничивает изобретение. Соединение по формуле I, компоненты R1, R2, R3 и R4 которого соответствуют формуле I, может быть получено путем гидролиза сложного эфира II в стандартной кислой или щелочной среде, включая реакцию с NaOH, в комбинации с соответствующим растворителем, в частности водой, тетрагидрофураном (ТГФ) и метанолом, при комнатной температуре в течение нескольких часов. Соединение II, где алкил содержит метил и этил, может быть получено алкилированием соединенияIII с бензил бромидами, бензил хлоридами, бензил тозилатами или бензил мезилатами в типовых условиях бензилирования, в частности в ДМФ или ТГФ в присутствии основания, например калия карбоната или цезия карбоната при температуре 25-120 С. Соединение II может быть также получено сочетанием соединения III с бензиловым спиртом в условиях реакции Мицунобу, в частности в ТГФ или толуоле в присутствии диэтилового эфира азодикарбоновой кислоты и трифенилфосфина. Соединение III может быть получено дебензилированием соединения IV при гидрировании в спирте, в частности МеОН или EtOH, в присутствии Pd-C. Возможны также другие способы дебензилирования, в том числе BBr3 в ДХМ, NaCN в ДМСО при 120-200 С или LiCN в ДМФ при 120-200 С. Соединение IV может быть получено алкилированием соединения V с втор-бутил бромидом или втор-бутенил бромидом. Воздействие на соединение V в ТГФ или другом апротонном растворителе основанием, в частности лития бис(трисметилсилил) амидом, натрия бис(трисметилсилил) амидом или лития диизопропиламидом при -78 С, с последующим добавлением втор-бутил бромида или втор-бутенил бромида позволяет получить алкилированное соединение IV. Соединение V может быть получено из соединения VI путем сочетания с арилбороновой кислотой в условиях реакции Судзуки (водный раствор натрия карбоната в ДМЭ в присутствии Pd(PPh3)4). Промежуточное соединение VI может быть получено из соединения VII с помощью трифторметансульфонового ангидрида в ДХМ в присутствии одного эквивалента пиридина при 0 С. Промежуточный фенольный эфир VII может быть получен монодебензилированием соединенияVIII. Селективное монодебензилирование соединения VIII может достигаться воздействием 1,1 эквивалента основания, в частности натрия гидроксида или калия гидроксида, в растворе этанола или метанола в присутствии катализатора Pd-C в водородной атмосфере (413,7 кПа (60 фунтов/кв. дюйм в качалке Парра. Реакция продолжается до расходования одного эквивалента водорода. Промежуточное соединение VIII может быть легко получено путем реакции 3,5-дигидроксифенилуксусной кислоты метилового эфира (имеется в продаже) с бензил бромидом и калия карбонатом в ДМФ при комнатной температуре. Соединение I имеет хиральный центру карбоновой группы и может существовать в виде одного из двух энантиомеров (или их соединения, содержащего либо не содержащего энантиомерный избыток). Показаны энантиомеры Ia (R-энантиомер) и Ib (S-энантиомер). Чистые энантиомеры Ia и Ib могут быть получены хиральным разделением с помощью хиральной колонки. Энантиомеры Ia и Ib могут быть также разделены за счет образования хиральных солей аминов путем фракциональной перекристаллизации. Энантиомеры Ia и Ib могут быть также получены кинетическим разделением рацемата соответствующих сложных эфиров с помощью липазных ферментов, в частности AmanoAk, Amano lipase PS, Amano lipaseA, Amano lipase M, Amano lipase F-15, Amano lipase G (Biocatalytics Inc) в водных органических растворителях, в том числе водных растворах ДМФ, ДМСО, трет-бутил-этиловом эфире или водных растворахTriton X-100. Оба энантиомера соединения I могут быть получены хиральным синтезом. Соединения Ia и Ib могут быть получены удалением вспомогательных хиральных групп из соединений IXa и IXb соответственно с помощью лития гидроксида в водном растворе ТГФ в присутствии пероксида водорода. Соединения IXa и IXb могут быть получены сочетанием соединений Ха и Xb с бензил бромидами,хлоридами, тозилатами или мезилатами в типовой щелочной среде, в частности в ДМФ или ТГФ в присутствии основания, например калия карбоната либо цезия карбоната, при температуре 25-120 С. Соединения IXa и IXb могут быть также получены сочетанием соединений Ха и Xb с бензиловыми спиртами в условиях реакции Мицунобу, в частности в ТГФ или толуоле в присутствии диэтилового эфира азодикарбоновой кислоты и трифенилфосфина. Соединения Ха и Xb могут быть получены дебензилированием соединений XIa и XIb соответственно при гидрировании в спиртовом растворителе, в частности МеОН или EtOH, в присутствии Pd-C. Соединения XIa и XIb могут быть получены алкилированием соединений XIIa и XIIb соответственно с втор-бутил бромидом или втор-бутенил бромидом. Воздействие на соединения XIIa и XIIb в ТГФ или других апротонных растворителях основаниями, в частности лития бис(трисметилсилил) амидом,натрия бис(трисметилсилил) амидом или лития диизопропиламидом при -78 С, с последующим добавлением электрофилов, втор-бутил бромида или втор-бутенил бромида позволяет получить алкилированные соединения XIa и XIb соответственно. Соединения XIIa и XIIb могут быть получены из общего промежуточного соединения XIII сочетанием либо с R-изомером 4-бензил-оксазолидин-она XIVa или S-изомером 4-бензил-оксазолидин-онаXIVb по методу Эванса. Промежуточное соединение XIII может сочетаться с пивалоил хлоридом, оксалил хлоридом или изопропил хлормуравьиной кислотой в ТГФ в присутствии основания, в частности триэтиламина или N-метилморфолина, в результате чего получают смешанные ангидриды либо хлориды кислот, которые затем сочетают с солью лития XIVa или XIVb в ТГФ. В хиральном синтезе могут быть также использованы другие вспомогательные хиральные группы, в частности псевдоэфедрин в условиях реакции А. Г. Майерса (J. Am. Chem.Soc. 1994, 116, 9361-9362). Воздействие на любой из энантиомеров псевдоэфедрина хлоридами карбоновой кислоты или ангидридами позволяет получить амидопроизводное соединение XV. Амиды обрабатывают сильным основанием, например лития диизопропиламидом, в присутствии лития хлорида с последующим добавлением алкилирующего агента, в результате чего получают соответствующие алкилированные продукты. Затем вспомогательная хиральная группа может быть удалена кислотным гидролизом для получения требуемых хиральных соединений.-9 017616 Промежуточное соединение XIII может быть получено эфирным гидролизом соединения V с основанием в водно-спиртовом растворе, например LiOH или NaOH в водно-метаноловом растворе. Процедуры синтеза Все реакции проводили в инертной атмосфере, если не указано иного. ЯМР-спектры определяли на аппарате Bruker dp400. ЖХ/МС проводили на аппарате Agilent 1100 с использованием колонки ZORBAX SB-C18, 4,675 мм, 3,5 микрона по методу А. Скорость потока в колонке устанавливали равной 1 мл/мин, в качестве растворителей использовали воду и ацетонитрил (0,1% ТФУ) при объеме введения 10 мкл. Длины волн составляли 254 и 210 нм. Анализ хиральной чистоты проводили с помощью хиральных колонок. Сокращения Смесь (3,5-дигидроксифенил)уксусной кислоты метилового эфира (Aldrich, 70 г, 0,385 моль), бензил бромида (137 мл, 1,16 моль), калия карбоната (160 г, 1,16 моль) и ДМФ (1,5 л) в атмосфере N2 оставляли на ночь при механическом перемешивании и комнатной температуре. Полученную реакционную смесь выливали в ледяную воду объемом 1,5 л при перемешивании. Осадок отделяли фильтрацией и далее промывали гептаном для удаления бензил бромида, в результате чего получали заявленные соединения (123,7 г) в виде бурого твердого остатка, который оставляли высохнуть при комнатной температуре для следующей реакции. 1 Н-ЯМР (CDCl3):3,60 (с, 2 Н), 3,71 (с, 3H), 5,05 (с, 4 Н), 6,60 (с, 3H), 7,35-7,50 Раствор 3,5-(бис-бензилоксифенил)уксусной кислоты метилового эфира (50 г, 1,38 моль) и NaOH(6,6 г, 1,65 моль) в 1 л EtOH в присутствии 10% Pd-C гидрировали в качалке Парра до расходования одного эквивалента водорода. Смесь окисляли концентрированной HCl, затем удаляли катализатор и растворитель, в результате чего получали масляный осадок. Неочищенный продукт очищали колоночной хроматографией с силикагелем (ISCO), используя EtOAC-гептан в качестве элюента (градиент 10-75%EtOAc), в результате чего получали 25 г (65%-ный выход) заявленного соединения (1b). 1 Н-ЯМР (CDCl3):1,15-1,20 (т, 3H), 3,4 (с, 2 Н), 4,05-4,1 (кв., 2 Н), 4,9 (с, 2 Н), 5,5 (С, 1 Н), 6,4 (с, 2 Н), 6,5 (с, 1 Н), 7,20-7,35 В раствор 3-(бензилокси-5-гидроксифенил)уксусной кислоты этилового эфира (74,4 г, 0,26 моль) в дихлорметане (700 мл) добавляли пиридин (62,5 мл, 0,78 моль). Смесь охлаждали до 0 С. В данный охлажденный раствор добавляли трифторметансульфоновый ангидрид (65,6 мл, 0,39 моль) в течение 1,5 ч,при этом поддерживали внутреннюю температуру ниже 5 С и перемешивали дополнительные 0,5 ч при 0 С. Данную реакционную смесь выливали в смесь 1N HCl (420 мл) и льда с водой (105 г) и перемешивали 0,5 ч. Водный слой экстрагировали дихлорметаном (2100 мл). Объединенные фракции промывали водой (2100 мл), насыщенным водным раствором NaHCO3 (2100 мл) и солевым раствором (2100 мл). Органическую фракцию (MgSO4) высушивали и концентрировали in vacuo, в результате чего получали красноватую жидкость (108 г), которую передавали на следующую стадию процесса без дополнительной очистки. Рассчитано для C18H17F3O6S (М+Н) 419,07, обнаружено 419,1. Смесь (3-бензилокси-5-трифторметансульфонилоксифенил)уксусной кислоты этилового эфира (108 г, 0,26 моль), 4-(трифторметил)фенилбороновой кислоты (55,6 г, 0,29 моль), 1,2-диметоксиэтана (1,1 л) и водного раствора Na2CO3 (2 М, 129 мл, 0,26 моль) механически перемешивали в атмосфере N2 при комнатной температуре 10 мин. В данную систему добавляли Pd(Ph3)4 (480 мг, 0,42 ммоль) и нагревали до- 11017616 рефлюкса (95 С) в течение 2,5 ч. Красно-бурую смесь разбавляли EtOAc (0,5 л) и промывали насыщенным водным раствором NaHCO3 (3200 мл) и солевым раствором (2200 мл). Органическую фракцию высушивали (Na2SO4) и концентрировали под вакуумом. Неочищенную смесь очищали колоночной хроматографией ISCO, в результате чего получали (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты этиловый эфир (107 г, 100%). 1H-ЯМР (CDCl3):1,26 (т, 3H), 3,66 (с, 2 Н), 4,17 (кв., 2 Н), 5,12 (с,2 Н), 6,99 (с, 1 Н), 7,12 (с, 2 Н), 7,34-7,49 (м, 5 Н), 7,67 (с, 4 Н); рассчитано для C24H21F3O3 (M+H) 415,14,обнаружено 415,2. е) 2-(5-Бензилокси-4'-трифторметилбифенил-3-ил)-4-метилпента-4-еновой кислоты этиловый эфирLi[N(SiMe3)2] (1N в ТГФ, 14,2 мл, 14,2 ммоль). Реакционную смесь перемешивали 1 ч при -78 С, затем по капле добавляли 3-бром-2-метилпропен (1,25 мл, 12,4 ммоль). Раствор медленно нагревали до -35 С и перемешивали при -35 С в течение 0,5 ч. Реакцию гасили насыщенным раствором NH4Cl и экстрагировали EtOAc. Органические экстракты высушивали (Na2SO4), концентрировали и очищали колоночной хроматографией, в результате чего получали соединение 1 е (5,1 г, 92%) в виде прозрачного масла. 1 НЯМР (400 МГц, хлороформ-D)частей на миллион 1,19-1,29 (м, 3H), 1,74 (с, 3H), 2,47 (м, 1 Н), 2,85 (м,1 Н), 3,83 (м, 1 Н), 4,11 (м, 2 Н), 4,72 (с, 1 Н), 4,77 (с, 1 Н), 5,12 (с, 2 Н), 7,03 (с, 1 Н), 7,10 (с, 1 Н), 7,15 (с, 1 Н),7,35-7,48 (м, 5 Н), 7,67 (с, 4 Н); рассчитано для C28H27F3O3 (M+H) 469,19, обнаружено 469. Смесь соединения 1 е (5,1 г, 10,9 ммоль), 10% Pd-C (500 мг) в EtOH (50 мл) гидрировали в атмосфере Н 2 (275,8 кПа (40 фунтов на кв. дюйм в качалке Парра в течение 20 ч. Полученную реакционную смесь фильтровали через целит, фильтрат концентрировали, в результате чего получали соединение 1fg) 2-[5-(3,5-Дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановая кислота. В раствор соединения 1f (4 г, 10 ммоль) в ДМФ добавляли цезия карбонат (г, 15 ммоль) и затем 3,5 дифторбензилбромид. Полученный раствор перемешивали при комнатной температуре 18 ч, затем гасили водой. Водный раствор экстрагировали EtOAc. Органический слой промывали, высушивали и испаряли, в результате чего получали осадок (5 г). Затем неочищенный продукт оставляли в 1N КОН в МеОН (3 экв.) при комнатной температуре на ночь. Раствор окисляли конц. HCl, затем экстрагировали EtOAc. Далее органический слой промывали водой, высушивали над Na2SO4 и испаряли в роторном испарителе, в результате чего получали неочищенный продукт. Неочищенный продукт растирали с гептаном, в результате чего получали 4,3 г (91%-ный выход) продукта (R) и (S). Рацемическую смесь подвергали хиральному разделению в колонке Chiralpak AD с применением метанола и ацетонитрила, а также 0,1% муравьиной кислоты в качестве элюента, в результате чего получали (R)-энантиомер, соединение 1, и (S)-энантиомер, соединение 2, соответственно. При этом обнаружили, что (R)-энантиомер повернут на -27,29 градуса в МеОН, a (S)-энантиомер повернут на +25,2 градуса в МеОН. Абсолютные стереохимические центры были определены путем корреляции с нижеописанными синтетическими материалами. Хиральный синтез (R) 2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты.- 12017616 В раствор (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты этилового эфира (120 г,0,29 моль) в ТГФ (1,2 л) добавляли воду (240 мл), LiOHH2O (16 г, 0,32 моль) и полученную реакционную смесь перемешивали при комнатной температуре 16 ч. Раствор фильтровали и концентрировали под вакуумом для удаления ТГФ. Полученную густую жидкость окисляли до рН 2 добавлением 2N водного раствора HCl и белую суспензию механически перемешивали 1 ч при комнатной температуре. Влажный белый продукт восстанавливали после фильтрации и растворяли в EtOAc (500 мл). Органический слой отделяли от воды, высушивали (MgSO4) и концентрировали под вакуумом, в результате чего получали В механически перемешанный раствор (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (20 г, 52 ммоль) в ТГФ (104 мл) при -78 С добавляли N-метила морфолин (NMM) (6,3 мл, 57 ммоль) и триметилацетила хлорид (7,0 мл, 57 ммоль), при этом внутреннюю температуру поддерживали ниже -70 С. Данную смесь перемешивали при -78 С 15 мин и при 0 С 1 ч. Белый твердый остаток фильтровали, в результате чего получали ангидрид в фильтрате, который снова охлаждали до -78 С. В помещенный в отдельную колбу раствор (R)-(+)-4-бензил-2-оксазолидин-она (9,6 г, 54,4 ммоль) в ТГФ(109 мл) при -78 С добавляли nBuLi (1,6 М в гексанах, 34 мл, 54,4 моль) по капле, при этом внутреннюю температуру поддерживали ниже -70 С и перемешивали при -78 С 45 мин. Данную обогащенную металлом хиральную вспомогательную смесь через канюлю сочетали с ангидридом при -78 С и нагревали до 0 С 1,5 ч. Полученную смесь далее перемешивали при 0 С 30 минут и гасили добавлением избыточного насыщенного водного раствора NH4Cl. Раствор разбавляли EtOAc (200 мл) и органическую фазу промывали насыщенным водным раствором NaHCO3 (3100 мл) и солевым раствором (2100 мл). Раствор высушивали над MgSO4 и растворитель отсасывали. Неочищенный продукт очищали колоночной хроматографией с силикагелем ISCO, в результате чего получали 20,3 г (72%) 4-бензил-3-[2-(5-бензилокси-4'трифторметилбифенил-3-ил)ацетил]оксазолидин-2-она в виде белого твердого остатка. 1 Н-ЯМР (CDCl3):2,76 (дд, 1 Н), 3,26 (дд, 1 Н), 4,19 (м, 2 Н), 4,35 (кв., 2 Н), 4,69 (м, 1 Н), 5,13 (с, 2 Н), 7,04-7,46 (м, 13 Н), 7,67(NaHMDS) (1M в растворе ТГФ, 12,11 мл, 12,11 ммоль) по капле, при этом внутреннюю температуру поддерживали ниже -75 С. Полученный красный раствор перемешивали при -78 С 30 мин. Далее в него добавляли 3-бром-2-метилпропен (4,44 мл, 44 ммоль), при этом температуру поддерживали ниже -75 С. Незадолго до завершения добавления реакционная смесь приобретала зеленый цвет. В этот момент ванну с сухим льдом быстро заменяли на ванну с ледяной водой и завершали добавление. Реакционную смесь перемешивали при 0 С дополнительные 30 мин и гасили насыщенным водным раствором NH4Cl. Систему разбавляли EtOAC (100 мл), органическую фазу промывали насыщенным водным раствором NaHCO3(350 мл) и высушивали (MgSO4). Растворитель отсасывали и неочищенную смесь очищали колоночной хроматографией с силикагелем ISCO, в результате чего получали 4-бензил-3-[2-(5-бензилокси-4'трифторметилбифенил-3-ил)-4-метилпента-4-еноил]оксазолидин-2-он (6,3 г, 95%). 1 Н-ЯМР (CDCl3):1,80 (с, 3H), 2,46 (дд, 1 Н), 2,75 (дд, 1 Н), 3,05 (дд, 1 Н), 3,32 (дд, 1 Н), 4,08 (м, 2 Н), 4,59 (м, 1 Н), 4,80 (д, 2 Н),5,13 (с, 2 Н), 5,48 (дд, 1 Н), 7,11 (д, 2 Н), 7,21-7,49 (м, 11 Н), 7,67 (с, 4 Н); рассчитано для C36H32F3NO4 (M+H) 600,23, обнаружено 600,3. В раствор 4-бензил-3-[2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-4-метилпента-4-еноил]оксазолидин-2-она (6,7 г, 11,2 ммоль) в МеОН (150 мл) добавляли 10% Pd-C (670 мг, 10 об.%). Черную суспензию гидрировали при 310,3-310,3 кПа (45-45 фунтов на кв. дюйм) в течение ночи. Смесь фильтровали через целит и растворитель отсасывали, в результате чего получали относительно чистый 4-бензил-3-[2(5-гидрокси-4'-трифторметилбифенил-3-ил)-4-метилпентаноил]оксазолидин-2-он (5,4 г, 93%). 1 В раствор 4-бензил-3-[2-(5-гидрокси-4'-трифторметилбифенил-3-ил)-4-метилпентаноил]оксазолидин-2-она (18,77 г, 36,73 ммоль) в ацетонитриле (184 мл) при 0 С добавляли 1-бромметил-3,5-дифторбензол (7,13 мл, 55,10 ммоль) и Cs2CO3 (23,94 г, 73,46 ммоль) частями в течение 5 мин. Полученную белую суспензию перемешивали при комнатной температуре 2 ч. Белый твердый остаток фильтровали и растворитель отсасывали, в результате чего получали относительно чистый 4-бензил-3-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентаноилоксазолидин-2-он. В раствор 4-бензил-3-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентаноилоксазолидин-2-она (23,40 г, 36,73 ммоль) в ТГФ (180 мл) добавляли воду (60 мл). Систему охлаждали до 0 С. В данный охлажденный раствор добавляли LiOHH2O (1,54 г, 36,73 ммоль) и 30% Н 2 О 2(16,65 мл, 146,92 ммоль) по капле, при этом внутреннюю температуру поддерживали ниже 5 С. Полученный мутноватый раствор перемешивали при 0 С 20 мин. Избыток Н 2 О 2 гасили 1,5 М водного раствора Na2SO3 (97,9 мл, 146,92 ммоль) и перемешивали при комнатной температуре 15 мин. Органический растворитель отсасывали. Полученную жидкость окисляли до рН 2 добавлением 1 N водного раствораHCl. Водный слой экстрагировали EtOAc (3 200 мл), высушивали над MgSO4 и концентрировали под вакуумом, в результате чего получали неочищенную смесь, которую затем очищали колоночной хроматографией с силикагелем ISCO, в результате чего получали (R)-2-[5-(3,5-дифторбензилокси)-4'трифторметилбифенил-3-ил]-4-метилпентановую кислоту (12,25 г, 70%). 1 Н-ЯМР (CDCl3):0,93 (д, 6 Н),1,51 (м, 1 Н), 1,72 (м, 1 Н), 1,98 (м, 1 Н), 3,72 (т, 1 Н), 5,09 (с, 2 Н), 6,76 (м, 1 Н), 6,98 (м, 3H), 7,07 (т, 1 Н), 7,17 Заявленное соединение получали из 4-бензил-3-[2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-4 метилпента-4-ноил]оксазолидин-2-она методом синтеза, описанным в примере 1, части k). 1 Н-ЯМР В раствор 4-бензил-3-[2-(5-гидрокси-4'-трифторметилбифенил-3-ил)-4-метилпентаноил]оксазолидин-2-она (0,400 г, 0,78 ммоль) в ацетонитриле (3 мл) при комнатной температуре добавляли 1 бромметил-3,5-дифтор-бензол (0,243 г, 1,17 ммоль) и Cs2CO3 (0,508 г, 1,56 ммоль). Полученную белую суспензию перемешивали 1 ч. Белый твердый остаток фильтровали и растворитель отсасывали, в результате чего получали относительно чистый 4-бензил-3-2-[5-(3,5-дифтор-бензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентаноилоксазолидин-2-он. с) 2-[5-(3,5-Дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановая кислота В раствор 4-бензил-3-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентаноилоксазолидин-2-она (0,425 г, 0,67 ммоль) в ТГФ (10 мл) добавляли воду (3,5 мл). Систему охлаждали до 0 С. В данный охлажденный раствор добавляли LiOHH2O (0,028 г, 0,67 ммоль) и 30% Н 2 О 2 (304 мл, 2,68 ммоль) по капле, при этом внутреннюю температуру поддерживали ниже 5 С. Полученный мутноватый раствор перемешивали при 0 С 20 мин. Избыток Н 2 О 2 гасили 1,5 М водного раствора Na2SO3(1,79 мл, 2,68 ммоль) и перемешивали при комнатной температуре 5 мин. Органический растворитель отсасывали. Полученную жидкость окисляли до рН 2 добавлением 1N водного раствора HCl. Водный слой экстрагировали EtOAc (3 25 мл) и высушивали (MgSO4). Смесь концентрировали под вакуумом, в результате чего получали неочищенную смесь, которую далее очищали колоночной хроматографией с силикагелем ISCO, в результате чего получали (S)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановую кислоту (0,295 г, 92%). 1H-ЯМР (CDCl3):0,93 (д, 6 Н), 1,51 (м, 1 Н),1,72 (м, 1 Н), 1,98 (м, 1 Н), 3,72 (т, 1 Н), 5,09 (с, 2 Н), 6,76 (м, 1 Н), 6,98 (м, 3H), 7,07 (т, 1 Н), 7,17 (с, 1 Н), 7,66(3,9 мл) добавляли 1-бромметил-4-фтор-2-трифторметилбензол (0,181 мл, 1,17 ммоль) и Cs2CO3 (0,508 г,1,56 ммоль). Полученную белую суспензию перемешивали при комнатной температуре 1 ч. Белый твердый остаток фильтровали и растворитель отсасывали, в результате чего получали относительно чистый 4-бензил-3-2-[5-(4-фтор-2-трифторметилбензилокси)-4'-трифторметил-бифенил-3-ил]-4-метилпентаноилоксазолидин-2-он. В раствор 4-бензил-3-2-[5-(4-фтор-2-трифторметилбензилокси)-4'-трифторметилбифенил-3-ил]-4 метилпентаноилоксазолидин-2-она (0,535 г, 0,78 ммоль) в ТГФ (9 мл) добавляли воду (3 мл). Систему охлаждали до 0 С. В данный охлажденный раствор добавляли LiOHH2O (33 мг, 0,78 ммоль) и 30% Н 2 О 2(0,354 мл, 3,12 ммоль), затем перемешивали при 0 С 20 мин. Избыток Н 2 О 2 гасили 1,5 М водного раствора Na2SO3 (2,08 мл, 3,12 ммоль) и перемешивали при комнатной температуре 5 мин. Органический растворитель отсасывали. Полученную жидкость окисляли до рН 2 добавлением 1N водного раствора HCl. Водный слой экстрагировали EtOAc (350 мл) и высушивали (MgSO4). Смесь концентрировали под вакуумом, в результате чего получали неочищенную смесь, которую далее очищали колоночной хроматографией с силикагелем ISCO, в результате чего получали (R)-2-[5-(4-фтор-2-трифторметилбензилокси)4'-трифторметилбифенил-3-ил]-4-метилпентановую кислоту (310 мг). 1H-ЯМР (CDCl3):0,92 (д, 6 Н),1,52 (м, 1 Н), 1,71 (м, 1 Н), 1,99 (м, 1 Н), 3,73 (т, 1 Н), 5,27 (с, 2 Н), 6,98 (ушир.с, 1 Н), 7,06 (ушир.с, 1 Н), 7,17 Раствор 2 М ЛДА в ТГФ-гептанэтилбензоле (21,5 мл, 43,0 ммоль) добавляли по капле в течение 12 мин в перемешанный раствор (3,5-бис-бензилоксифенил)уксусной кислоты метилового эфира (полученный способом, описанным в примере 1, части а) (13,0 г, 35,9 ммоль) в ТГФ (80 мл) при -78 С в азотной атмосфере. Температуру поддерживали ниже -70 С дополнительные 50 мин, затем за один раз добавляли 3-бром-2-метилпропен (4,0 мл, 39,7 ммоль) и реакционную смесь нагревали до 0 С. Через 2 ч смесь концентрировали под вакуумом, разбавляли насыщенным водным раствором NH4Cl (100 мл) и экстрагиро- 16017616 вали EtOAc (100 мл). Органический слой промывали солевым раствором (100 мл), высушивали (MgSO4),концентрировали под вакуумом и очищали флеш-хроматографией (двуокись кремния, 0-10% EtOAc в петролейном эфире), в результате чего получали заявленное соединение в виде желтого масла (14,1 г,94%). 1 Н-ЯМР (400 МГц, CDCl3):7,42-7,25 (м, 10H), 6,58 (с, 2 Н), 6,52 (с, 1 Н), 5,02 (с, 4 Н), 4,74 (с, 1 Н),4,66 (с, 1 Н), 3,74 (т, 1 Н), 3,64 (с, 3H), 2,79 (дд, 1 Н), 2,38 (дд, 1 Н), 1,70 (с, 3H). В смесь промежуточного соединения 4 а (20 г, 48 ммоль), NaOH (2,3 г, 57 ммоль) в EtOH (500 мл) добавляли 10% Pd-C (0,5 г) на активированном угле в атмосфере N2, смесь гидрировали при 275,8 кПа(40 фунтов на кв. дюйм) 30 мин - при этом ЖК/МС показывала, что исходный материал израсходован. Катализатор фильтровали, EtOH испаряли. Колоночная хроматография (0-40% EtOAc/гептан) показывала 11,8 г (75%-ный выход) бесцветного масла, состоящего из метилового и этилового эфиров и сложного эфира с неослабленными двойными связями. МН+ 341 (этиловый эфир с неослабленными двойными связями); 343 (этиловый эфир с ослабленной изопропиловой частью); 327 (метиловый эфир с неослабленными двойными связями). с) 2-[3-Бензилокси-5-(3,5-дифторбензилокси)фенил]-4-метилпентановой кислоты этиловый эфир Раствор этилового эфира (смешанного с метиловым эфиром) 4b (5 г, 15 ммоль), K2CO3 (4,1 г, 30 ммоль) и 3,5-дифторбензилбромида (2,9 мл, 22 ммоль) в ДМФ (70 мл) нагревали до 80 С один час. ДМФ отсасывали и неочищенный продукт очищали колоночной хроматографией (0-30% EtOAc/гептан), в результате чего получали 4,5 г продукта (66%-ный выход). МН+ 453,1 и другие молекулярные ионы (метиловый эфир и соответствующие олефины). В раствор промежуточного соединения 4 с (4,5 г, 10 ммоль) в МеОН (100 мл) добавляли 10% Pd-C(0,45 г) на активированном угле в атмосфере N2; смесь гидрировали при 137,9 кПа (20 фунтов на кв. дюйм) два часа. Катализатор фильтровали, МеОН испаряли. Колоночная хроматография (0-50%(2 мл, 12 ммоль). Раствор перемешивали при 0 С один час перед выливанием в раствор 1N HCl (20 мл), экстрагировали ДХМ (200 мл) и промывали водным раствором NaHCO3/NaCl. Слой ДХМ высушивали над Mg2SO4 и испаряли, в результате чего получали 4,0 г желтого масла (78% за две стадии). МН+ 511,2. е) 2-[4'-хлор-5-(3,5-дифторбензилокси)-3'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты этиловый эфир Раствор 3-CF3-4-Cl-бензолбороновой кислоты (3,6 г, 16 ммоль), триафлата 4d (4 г, 7,8 ммоль),(PPh3)4Pd (0,5 г, 0,4 ммоль), K2CO3 (2,2 г, 16 ммоль), в толуоле/EtOH/H2O (20/10/5 мл) помещали в герме- 17017616 тичную реакционную пробирку и нагревали до 80 С один час. Затем добавляли EtOAc (200 мл) и промывали солевым раствором. Слой EtOAc высушивали над Mg2SO4 и испаряли. Колоночная хроматографияf) 2-[4'-Хлор-5-(3,5-дифтор-2-бензилокси)-3'-трифторметилбифенил-3-ил]-4-метилпентановая кислота. Раствор промежуточного соединения 4 е (3 г, 5,5 ммоль), 1N NaOH (16 мл) в ТГФ/МеОН (50/50 мл) перемешивали при комнатной температуре один день. Раствор концентрировали и добавляли EtOAc (500 мл). После промывания 1N HCl и солевым раствором слой EtOAc высушивали над Mg2SO4 и испаряли. Колоночная хроматография (0-30%/EtOAc/гексан) показывала 2,7 г белого твердого остатка (71%). Затем твердый остаток растворяли в EtOAc (100 мл), добавляли в 1N NaOH (5,26 мл, 5 ммоль) и перемешивали при комнатной температуре 10 мин. Далее растворитель отсасывали и получали соединение в виде его соли натрия. МН+ 513,2 (вершина со слабой связью). 1 Н ЯМР (300 МГц, CD3OD):0,94 (д, 6 Н, J=6,51 Гц),1,5-1,67 (м, 2 Н),1,9-2,0 (м, 1 Н),3,67 (т, 1 Н, J=7,85 Гц), 5,2 (с, 2 Н),6,89 (м, 1 Н), 7,1 (м, 4 Н),7,27 (с, 1 Н),7,68 (д, 1 Н, J=8,42 Гц),7,85 (м, 1 Н), 7,97 (д, 1 Н, J=2,0 Гц). Определение воздействия соединений по изобретению на циклооксигеназу-1 и циклооксигеназу-2(Сох-1, Сох-2) Ингибирование циклооксигеназы-1 и циклооксигеназы-2 определяли с помощью набора для анализа ингибитора Colorimetric Сох, выпускаемого компанией Cayman Chemical Company, Анн-Арбор, штат Мичиган, США ( по кат. 760111), в соответствии с инструкциями производителя. Пример 1. Изобретения показывает ингибирование 50% при 100 мкМ. Скрининг соединений по изобретению для модулирования активности -секретазы Скрининг проводили с использованием культуры клеток SKNBE2, содержащих белок АРР 695 немутантного типа, выращенной в DMEM/NUT-смеси F12 (НАМ), выпускаемой компанией Gibco ( по кат. 31330-38) и содержащей 5% сыворотки/Fe и 1% неосновных аминокислот. Клетки культивировали практически до конфлюентности. Скрининг проводили по способу, описанному в Citron et al. (1997) Nature Medicine 3: 67.- 18017616 не содержащее ни выбранных значений R1 и R2, ни втор-бутиловой группы, в вышеуказанном анализе клеток WTAPP показало IC50 2,5 мкМ. Демонстрация эффективности in vivo Снижающие уровень А 42 агенты по изобретению могут быть использованы для лечения БА у млекопитающих, в частности человека, а также эффективны в животных моделях, в частности у мыши,крысы и морской свинки. При этом наличие диагноза БА или генетической предрасположенности к БА у млекопитающего не является обязательным условием - его гены могут быть модифицированы таким образом, при котором в его организме вырабатывается и со временем накапливается избыток А по аналогии с пораженным БА мозгом человека. Снижающие уровень 42 агенты могут быть введены в любой стандартной форме любым стандартным способом. В частности, снижающие уровень А 42 агенты могут иметь форму жидкости, таблетки или капсулы, вводимые перорально либо в инъекциях. Снижающие уровень 42 агенты могут быть введены в любой дозировке, достаточной для существенного уменьшения уровней А 42 в крови, плазме крови, сыворотке, спинномозговой жидкости (СМЖ) или мозге. Для определения эффективности введения значительного количества снижающего уровень А 42 агента in vivo используют нетрансгенных грызунов, в частности мышей или крыс. Кроме того, могут быть использованы мыши Tg2576 двух-трехмесячного возраста с экспрессированным белком АРР 6 95"шведского" варианта или разработанная д-ром Фредом ван Лейвеном (K.U. Leuven, Бельгия) и коллегами модель трансгенной мыши с нейрон-специфической экспрессией клинически мутантного человеческого белка -предшественника амилоида [V717I] (Moechars et al., 1999 J. Biol. Chem. 274, 6483). Молодые трансгенные мыши имеют высокие уровни А в мозге, однако заметные отложения A у них отсутствуют. В возрасте приблизительно 6-8 месяцев у трансгенных мышей начинает проявляться спонтанное прогрессирующее накопление -амилоида (A) в мозге, в итоге приводящее к образованию амилоидных бляшек в основании гиппокампа, гиппокампе и коре головного мозга. Получающих снижающий уровень А 42 агент животных обследуют и сравнивают с особями, не получающими агент или получающими только вспомогательное вещество, при этом уровень растворимого А 42 и общий уровень А в мозге определяют стандартными способами, например ИФА. Периоды лечения могут продолжаться несколько часов или дней и корректируются по результатам уменьшения уровня А 42, после того как установлена временная шкала проявления эффекта. Предложенный в настоящем документе типовой протокол для измерения уменьшения уровня А 42in vivo является лишь одной из многочисленных разновидностей методики, предназначенной для эффективного количественного определения А. Например, снижающие уровень А 42 соединения в виде свободных кислот или солей натрия могут быть смешаны с 5% Solutol в воде или 20% гидроксипропилциклодекстрина. В данной композиции снижающие уровень А 42 агенты вводят в виде однократной пероральной дозы либо любым другим приемлемым способом, например за три-четыре часа до забоя(время определяется эмпирически) и анализа, или же вводятся курсом на протяжении нескольких дней,при этом животных забивают через три-четыре часа после ввода последней дозы. Мышей подвергают анестезии смесью кеталара (кетамина), ромпуна (2%-ного ксилазина) и атропина (2:1:1) и транскардиальной инфузией физиологического раствора при 4 С вымывают кровь. При заборе собирают кровь. Сбор крови осуществляют через сделанное под анестезией отверстие в сердце в обработанные ЭДТА сосуды. Кровь центрифугируют при 4000 г и 4 С 5 мин, собирают плазму и сверхбыстро замораживают для последующего анализа. Мозг удаляют из черепа, задний мозг отделяют от переднего разрезом в коронарной/фронтальной плоскости. Мозжечок удаляют и сохраняют для количественного анализа уровней испытываемых соединений. Передний мозг разделяют на равные левое и правое полушария сагиттальным разрезом по центру. Оба полушария немедленно погружают в жидкий азот и хранят при -70 С до гомогенизации для биохимического анализа. Мозги мышей ресуспендируют в 10 объемах 0,4%-ного ДЭА (диэтиламина)/50 мМ NaCl pH 10 (для нетрансгенных животных) или 0,1%-ного CHAPS в трис-солевом буферном растворе (для трансгенных животных), содержащем ингибиторы протеазы (Roche-11948699) на грамм ткани, например на 0,158 г мозга добавляют 1,58 мл 0,4%-ного ДЭА. Все образцы разрушают ультразвуком в течение 30 секунд на льду при 30%-ном уровне мощности. Гомогенаты центрифугируют при 355000 г 30 мин. Полученный в результате центрифугирования верхний слой переливают в свежие пробирки для последующей очистки или немедленного анализа. Полученный верхний слой очищают в колонках обратной фазы ГЛБ Water Oasis (Waters Corp.,Милфорд, штат Массачусетс), чтобы удалить неспецифический иммунореактивный материал из лизатов мозга перед последующим качественным определением А. С помощью вакуумной камеры все растворы пропускают через колонки с приблизительной скоростью 1 мл в минуту, при этом вакуумметрическое давление в течение процедуры поддерживают на соответствующем уровне. Колонки предварительно обрабатывают 1 мл 100%-ного МеОН, затем уравновешивают 1 мл H2O. Не подвергнутые нейтрализации- 19017616 лизаты мозга загружают в колонки. Затем загруженные образцы дважды промывают: первый раз 1 мл 5%-ного МеОН, второй - 1 мл 30%-ного МеОН. В завершение А экстрагируют из колонок в стеклянные пробирки 10030 мм с раствором 90%-ного МеОН с 2% NH4OH. Далее элюат перемещают в пробирки 1,5 мл и концентрируют в концентраторе Speed Vac при высокой температуре 2 ч. Затем концентрированный A ресуспендируют в питательной среде UltraCULTURE General Purpose Serum-Free Medium(Cambrex Corp., Уокерсвилл, штат Мэриленд) с добавлением ингибиторов протеазы в соответствии с рекомендацией производителя. Для количественного определения А 42 в растворенной фракции гомогенатов мозга используют имеющиеся в продаже наборы для иммуноферментного анализа (ИФА) (Innotest -амилоид(1-42) производства компании Innogenetics N.V., Гент, Бельгия). ИФА A42 в целом проводят в соответствии с протоколом производителя. В течение короткого времени эталон (раствор синтетического A1-42) и образцы подготавливают на 96-луночном планшете с полипропиленовым покрытием, входящим в набор(Nunc-Immuno MaxiSorp, A/S Nunc, Дания). Эталонные растворы с окончательными концентрациями 1000, 500, 250, 125, 62,5, 31,3 и 15,6 пг/мл и образцы подготавливают во входящем в комплект ИФА растворителе для образцов до окончательного объема 60 мкл. Образцы, эталоны и заготовки (50 мкл) добавляют на планшет с антителами к А 42 (антитело избирательно распознает С-терминальный конец антигена). Планшет инкубируют в течение ночи при 4 С, в результате чего получают комплекс "антитело амилоид". После инкубирования и последующей промывки добавляют селективное антитело к А (биотинилированное антитело, например биотинилированный 4G8 (Covance Research Products, Дедхэм, штат Массачусетс) и инкубируют не менее 1 ч, в результате чего получают комплекс "антитело - амилоид антитело". После инкубирования и соответствующей промывки добавляют конъюгат "стрептавидин пероксидаза", затем спустя 30 мин добавляют смесь ТМБ/пероксида, в результате чего субстрат преобразовывают в окрашенное вещество. Данную реакцию останавливают добавлением серной кислоты (1 М) и измеряют интенсивность цвета путем фотометрии с помощью ИФА-анализатора с 450-нм фильтром. Количество А в образцах определяют сравнением поглощательной способности со стандартной кривой,полученной с синтетическим A1-42. Для анализа также могут быть использованы реагенты PierceQuantBlu Fluorogenic Peroxidase Substrate и Detection при соблюдении инструкций производителя (PierceCorp., Рокфорд, штат Иллинойс). В данной модели успешным считается снижение уровня А 42 хотя бы на 20% по сравнению с животными, не получавшими агент. Данные in vivo Пероральная доза 30 мг/кг во временной точке 4 ч потребовалось введение в дозировке 100 мг/кг 2 р/сут для снижения уровня А 42 в плазме у мыши на 40%. Вышеуказанная спецификация разъясняет лишь общие принципы настоящего изобретения и содержит примеры для иллюстрации, при этом следует понимать, что изобретение включает в себя все типовые вариации, адаптации и/или модификации, включенные в следующие формулы изобретения и их эквиваленты. Все указанные в вышеприведенной спецификации публикации полностью включаются в настоящий документ путем отсылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR4 представляет собой Н, F, Cl или CF3; или его фармацевтически приемлемые соли. 2. Соединение по п.1, гдеR3 представляет собой CF3; или его фармацевтически приемлемые соли. 3. Соединение по п.2, выбранное из группы, состоящей из(R)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,(S)-2-[5-(3,5-дифторбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,2-[5-(4-фтор-2-трифторметилбензилокси)-4'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,2-[4'-хлор-5-(3,5-дифторбензилокси)-3'-трифторметилбифенил-3-ил]-4-метилпентановой кислоты,а также их фармацевтически приемлемых солей. 4. Применение соединения по любому из пп.1-3 в качестве лекарственного средства. 5. Применение соединения по любому из пп.1-3 для приготовления лекарственного средства, модулирующего активность -секретазы. 6. Применение соединения по любому из пп.1-3 для приготовления лекарственного средства, предназначенного для лечения заболевания, связанного с повышенным уровнем образования А 42-пептидов. 7. Применение соединения по любому из пп.1-3 для приготовления лекарственного средства, предназначенного для лечения болезни Альцгеймера. 8. Фармацевтическая композиция, включающая соединение по любому из пп.1-3 и инертный носитель. 9. Способ лечения млекопитающего путем модулирования активности -секретазы, включающий введение данному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3. 10. Способ лечения млекопитающего от заболевания, связанного с повышенным уровнем образования A42-пептидов у млекопитающего, включающий введение данному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3. 11. Способ лечения болезни Альцгеймера у млекопитающего, включающий введение данному млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61P 25/28, C07C 59/68, A61K 31/192
Метки: производные, дифенилкарбоновые, кислоты
Код ссылки
<a href="https://eas.patents.su/22-17616-difenilkarbonovye-kisloty-i-ih-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Дифенилкарбоновые кислоты и их производные</a>
Предыдущий патент: Способ, технологическая линия изготовления сетчатого полимерного материала и сетчатый полимерный материал по этому способу
Следующий патент: Способ получения сыворотки для диагностики сибирской язвы и диагностический набор
Случайный патент: Адгезионная композиция на основе привитого полиэтилена