5-[(3,3,3-трифтор-2-гидрокси-1-арилпропил)амино]-1h-хинолин-2-оны, способ их получения и их применения в качестве противовоспалительных средств
Номер патента: 17459
Опубликовано: 28.12.2012
Авторы: Шэкке Хайке, Май Эккехард, Хассфельд Йорма, Ревинкель Хартмут, Цолльнер Томас, Бергер Маркус
Формула / Реферат
1. Соединения общей формулы I

где R4 означает 7-фтор-заместитель,
R1, R2 и R3 независимо друг от друга выбраны из хлора, фтора, метоксигруппы,
R5 выбран из S-CH2-CH3, -O-CH2-CH3, -S-CH3, -О-СН3, -ОН и -Cl,
и их соли.
2. Соединения общей формулы I по п.1, выбранные из списка, включающего
5-{[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(2-хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(2-хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(5-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(5-хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(4-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(4-хлор-3-фтор-2-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[1-(2-хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он
и их соли.
3. Энантиомерно чистые соединения по п.1, выбранные из списка, включающего
5-{(1S,2R)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{(1S,2R)[1-(2-хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{(1S,2S)[1-(5-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он,
5-{(1S,2R)[1-(5-хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино}-7-фтор-1H-хинолин-2-он,
5-{[(1S,2S)[1-(2-хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино}-7-фтор-1H-хинолин-2-он
и их соли.
4. Применение соединений формулы I по крайней мере одного из пп.1-3 для производства фармацевтических агентов.
5. Применение соединений формулы I по крайней мере одного из пп.1-3 для производства фармацевтических агентов для лечения воспалительных заболеваний.
6. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как определено в пп.1-3, и фармацевтически приемлемый адъювант, разбавитель или носитель.
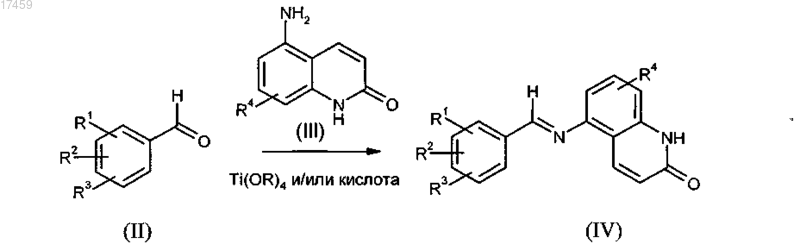
7. Способ получения соединений общей формулы I по п.1, в котором осуществляются следующие стадии:
стадия а)
стадия b)
стадия c)
где все остатки имеют определения, данные в п.1, R означает С1-С4-алкил и Met означает щелочные металлы, щелочно-земельные металлы, алюминий, медь, кремний или олово.
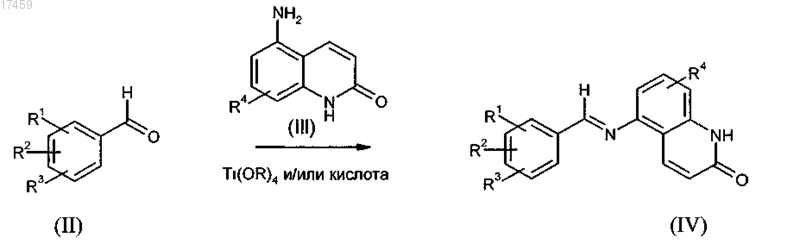
8. Способ по п.7, отличающийся тем, что на стадии а) получения промежуточного соединения общей формулы IV бензальдегиды общей формулы II реагируют с замещенными хинолоновыми аминами формулы III, образуя имины общей формулы IV в присутствии кислот Льюиса и/или в кислотных условиях
где R1, R2, R3 и R4 имеют значения, определенные в п.1, и R означает С1-С4-алкил.
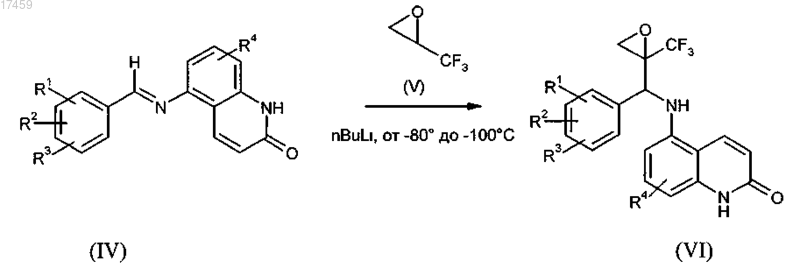
9. Способ по п.7, отличающийся тем, что на стадии b) получения промежуточного соединения общей формулы VI металлированный трифторэпоксипропан V, необязательно в его энантиомерно чистой форме, реагирует с иминами формулы IV при низких температурах с получением эпоксидов общей формулы VI
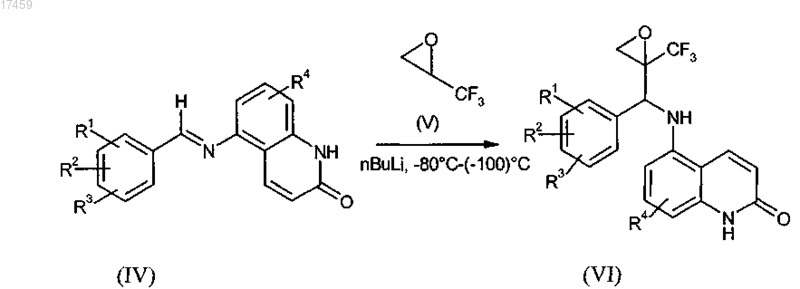
где R1, R2, R3 и R4 имеют значения, определенные в п.1, и необязательно в дальнейшем осуществление разделения диастереоизомеров.
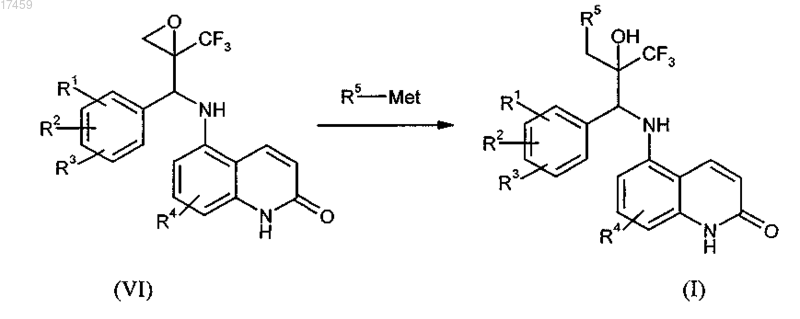
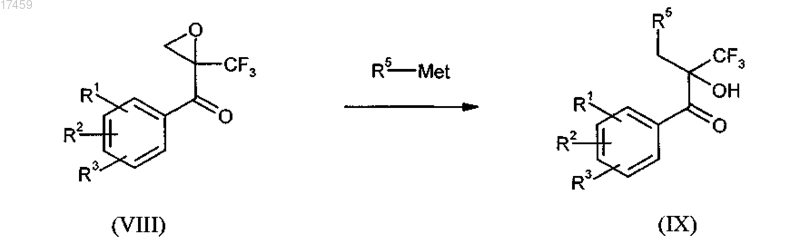
10. Способ по п.7, отличающийся тем, что на стадии с) получения соединения общей формулы I эпоксиды общей формулы VI, необязательно в их энантиомерно чистой форме, реагируют с соединениями общей формулы R5-Met, при этом Met означает щелочные металлы, щелочно-земельные металлы, алюминий, медь, кремний или олово, и R5 имеет определения, как определено в п.1, в присутствии кислот Льюиса, или раскрываются непосредственно цианидами, аминами, спиртами, тиоспиртами, галогенидами и/или водой в присутствии оснований или сильных протонных кислот с получением соединения общей формулы I

где R1, R2, R3, R4 и R5 имеют значения, определенные в п.1, и необязательно в дальнейшем осуществление разделения диастереоизомеров.
11. Соединения общей формулы VI по п.9

в виде рацемической смеси или как энантиомерно чистый изомер.
12. Способ получения соединений общей формулы I по п.1, где осуществляются следующие стадии:
стадия а)
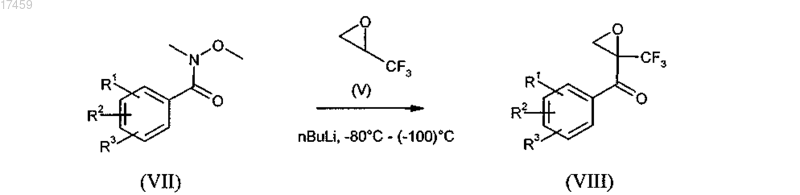
стадия b)
стадия с)
где все остатки имеют значения, как определено в п.1, Met означает щелочные металлы, щелочно-земельные металлы, алюминий, медь, кремний или олово и R означает C1-C4-алкил.
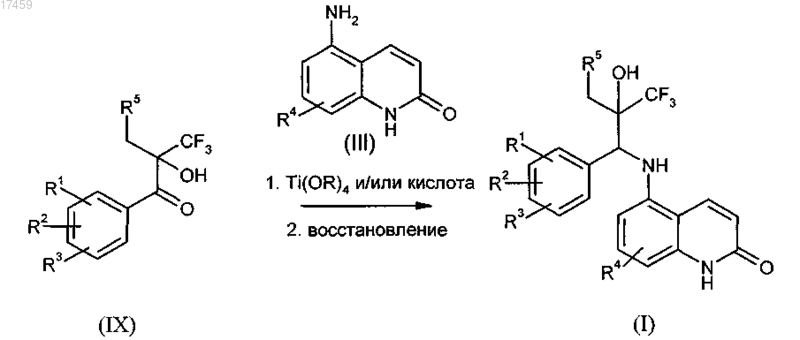
13. Способ по п.12, отличающийся тем, что на стадии с) получения соединения общей формулы I кетоны типа (IX), необязательно в их энантиомерно чистой форме, могут конденсироваться с замещенными аминохинолонами типа (III), образуя имины, и в дальнейшем или в то же самое время восстанавливаться с получением соединения формулы I
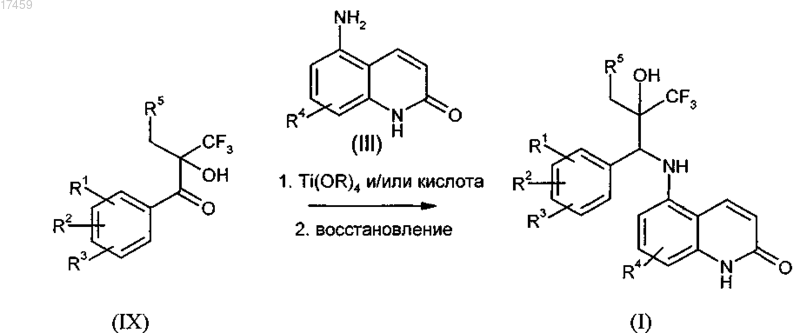
где R1, R2, R3, R4 и R5 имеют значения, как указано в п.1, и R, как определено в п.8, и необязательно в дальнейшем осуществление разделения диастереоизомеров.
14. Комбинация соединения формулы (I) или его фармацевтически приемлемой соли и одного и более агента, выбранного из списка, включающего
ингибитор PDE4, включая ингибитор изоформы PDE4D;
селективный β.sub2. адреномиметик, такой как метапротеренол, изопротеренол, изопреналин, альбутерол, сальбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерол, мезилат, пирбутерол или индакатерол;
антагонист мускаринового рецептора (например, M1, M2 или М3 антагонист, такой как селективный М3 антагонист), такой как ипратропия бромид, тиотропия бромид, окситропия бромид, пирензепин или телензепин;
модулятор функции хемокинового рецептора (такой как антагонист CCR1 рецептора) или
ингибитор функции киназы р38.
Текст
5-[(3,3,3-ТРИФТОР-2-ГИДРОКСИ-1-АРИЛПРОПИЛ)АМИНО]-1H-ХИНОЛИН-2 ОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ Настоящее изобретение относится к соединениям формулы I способам их получения и их применению в качестве противовоспалительных средств.(71)(73) Заявитель и патентовладелец: БАЙЕР ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE); АСТРАЗЕНЕКА АБ (SE) 017459 Настоящее изобретение относится к соединениям формулы I, способу их получения и их применению в качестве противовоспалительных средств. Наиболее распространенными противовоспалительными средствами все еще являются глюкокортикоиды (GC), которые представляют собой маленькие молекулы, имеющие стероидное строение, которые взаимодействуют с глюкокортикоидным рецептором (GR), либо эндогенным, как кортизол, либо синтетическим, как дексаметазон и другие. Однако применение высокоэффективных GC, особенно в течение длительного периода обработки, приводит к проявлению нежелательных эффектов. Некоторые их этих эффектов являются тяжелыми и иногда необратимыми, такие как, например, диабеты, остеопороз, кожная и мускульная атрофии, глаукома (Schacke et al., 2002, PharmacolTherapeutics (2002) 96(l): 23-43,Miner et al., 2005, Expert Opin Investig. Drugs (2005) 14(12): 1527-1545). GC существенно ингибируют провоспалительные цитокины и хемокины в месте введения, при этом они выявляют только ограниченное системное действие (O'Connell, 2003, Clin. Ther. (2003) 25(Suppl. C):C42-60; Welker et al. Int. Arch.(1998) 11(l): 35-42). Хотя локально активные GC, по-видимому, являются идеальными противовоспалительными лекарственными средствами, их применение ограничено вследствие локальных побочных эффектов и вследствие недостаточной эффективности при тяжелых состояниях заболевания. Вследствие этого, существует значительная медицинская потребность в новых соединениях, которые имеют противовоспалительную/иммуномодулирующую активность подобно рыночным GC и менее вероятно вызывают нежелательные эффекты. Из предыдущего уровня техники DE 10038639 и WO 02/10143 известны противовоспалительные средства следующей общей формулы: где Ar радикал включает фталиды, тиофталиды, бензоксазиноны или фталазиноны. Во время эксперимента эти соединения показывают разобщение действия между противовоспалительными и нежелательными метаболическими действиями и превосходят ранее описанные нестероидные глюкокортикоиды или показывают, по крайней мере, такое же хорошее действие. Соединения, структурно родственные описанным в настоящей патентной заявке, раскрыты в WO 2005/035518 Вследствие способа производства эти соединения всегда содержат группу где связь между а и b или между b и с может быть ненасыщенной, и которая, таким образом, должна содержать группу, выбранную из -СН 2-СН(CH3)2, -СН-С(CH3)2 или -СН 2-С(CH3)=СН 2. Соединения такого состава в особенности отвергаются в настоящей заявке. Несмотря на все попытки, селективность соединений известного уровня техники по отношению к глюкокортикоидному рецептору (GR) по сравнению с другими стероидными рецепторами, так же как их эффективности или эффективность, все еще требуют улучшения. Вследствие этого, цель настоящего изобретения создать соединения, способные показать признаки улучшения по крайней мере в одном вышеупомянутом аспекте. Эта задача была достигнута при помощи соединений согласно пунктам формулы изобретения. Настоящее изобретение, таким образом, относится к соединениям общей формулы I где R4 означает 7-фтор-заместитель,R1, R2 и R3 независимо друг от друга выбраны из хлора, фтора, метоксигруппы,R5 выбран из S-CH2-CH3, -О-СН 2-СН 3, -S-CH3, -О-СН 3, -ОН и -Cl и их соли. Другим аспектом изобретения являются соединения согласно п.1, выбранные из списка, включающего 5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил)пропил]амино-7-фтор-1H-хинолин-2-он; 5-[1-(2-хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он; 5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино 7-фтор-1H-хинолин-2-он; 5-[1-(2-хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино-7 фтор-1H-хинолин-2-он; 5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино 7-фтор-1H-хинолин-2-он; 5-[1-(5-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино 7-фтор-1H-хинолин-2-он; 5-[1-(5-хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино-7 фтор-1H-хинолин-2-он; 5-[1-(4-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино 7-фтор-1H-хинолин-2-он; 5-[1-(4-хлор-3-фтор-2-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино-7 фтор-1H-хинолин-2-он; 5-[1-(2-хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино-7-фтор-1H-хинолин-2-он,и их соли. Еще другим аспектом изобретения являются энантиомерно чистые соединения согласно п.1, выбранные из списка, включающего 5-(1S,2R)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил)пропил]амино-7-фтор-1H-хинолин-2-он; 5-(1S,2R)[1-(2-хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он; 5-(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил] амино-7-фтор-1H-хинолин-2-он; 5-(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил] амино-7-фтор-1H-хинолин-2-он; 5-(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил] амино-7-фтор-1H-хинолин-2-он; 5-(1S,2S)[1-(5-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил] амино-7-фтор-1H-хинолин-2-он; 5-(1S,2R)[1-(5-хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он; 5-[(1S,2S)[1-(2-хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино-7-фтор-1H-хинолин-2-он,и их соли. К тому же, изобретение относится к применению соединений общей формулы I для изготовления фармацевтических агентов, так же как к их применению для изготовления фармацевтических агентов для лечения воспалительных заболеваний. Определения Если не заявлено иначе, термин "алкил" относится к неразветвленной или разветвленной, замещенной или незамещенной цепи. Например, термин пропил включает н-пропил и изопропил, термин бутил включает н-бутил, изобутил и трет-бутил.-2 017459 Алкильные группы могут быть неразветвленными или разветвленными и означают, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил или н-пентильную группу или 2,2 диметилпропил, 2-метилбутил или 3-метилбутильную группу. Метильная или этильная группа являются предпочтительными. Соединения настоящего изобретения могут существовать в стереоизомерных формах, таких как энантиомеры диастереоизомеров в зависимости от их структуры и заместителей, как определено в формуле I. В одном аспекте изобретения поэтому охвачены все эти энантиомеры, диастереоизомеры или их смеси. Выделение энантиомерно или диастереомерно чистых изомеров может быть осуществлено способами существующего уровня техники, например использованием колоночной хроматографии с хиральной неподвижной фазой. Если возможно, что соединения изобретения также существуют в таутомерных формах, они также являются аспектом настоящего изобретения. В одном аспекте изобретения охвачены все соединения, определенные в формуле I, так же как их соли, раскрытые в примерах, являются одним аспектом изобретения при условии, что раскрытые соединения сами уже не являются солями. Соли в соответствии с настоящим изобретением означают не только физиологически приемлемые соли, но также соли, которые могут быть неприемлемыми для фармацевтического применения, но которые являются полезными, например, при способе выделения или очистки. Термин "физиологически приемлемые соли" включает соли присоединения минеральных кислот,карбоновых кислот, сульфоновых кислот, например соли хлористо-водородной кислоты, бромистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты, метансульфоновой кислота, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, нафталинсульфоновой кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, пивалевой кислоты, малеиновой кислоты, янтарной кислоты и бензойной кислоты. Кроме того, термин "физиологически приемлемые соли" включает соли обычных подходящих оснований, например соли щелочных металлов (например, соли натрия и калия), щелочно-земельные соли(например, соли кальция и магния) и аммониевые соли, полученные из NH3 или органических аминов с от 1 до 16 атомами углерода, например этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метилморфолин, аргинин, лизин, этилендиамин и N-метилпиперидин. Соединения могут быть получены двумя способами, которые описаны ниже (a-b). Способ a). Стадия а) Бензальдегиды типа (II) могут конденсироваться с замещенными аминохинолонами типа (III) с образованием иминов типа (IV) с применением кислот Льюиса, предпочтительно алкоголятов титана Ti(OR)4,где R означает С 1-С 4 алкил, такой как, например, тетраэтилортотитанат или тетра-трет-бутилортотитанат,и/или кислотных условий, например органических кислот, таких как уксусная кислота, как реагенты. Подходящими растворителями являются, например, толуол, 1,4-диоксан или их смеси. Стадия b) Имины типа (IV) обрабатывали при низких температурах от -80 до -100C литерованным эпоксидом(V) с получением соединения типа (VI). Подходящими растворителями являются, например, тетрагидрофуран, гексан, диэтиловый эфир или их смеси. Эпоксиды (VI) могут быть раскрыты нуклеофилами типаR5-Met, давая соединение (I). Met означает металл и включает щелочные металлы, например натрий или литий, щелочно-земельные металлы, такие как, например, магний, кальций; алюминий, медь, кремний или олово (Sn), который связан с нуклеофильным остатком R5 в R5-Met в зависимости от валентности и согласно тому, как это известно специалисту в данной области техники. Получаемыми возможными нуклеофильными реагентами R5-Met являются, например, алкилкупраты, винилкупраты, тиолы, аллилсиланы, винилсиланы, винилстаннаны, магнийорганические соединения, при этом R5 определяется, как в п.1,который реагирует в присутствии кислот Льюиса, как, например, BF3 или AlMe3, AlCl3. Подходящими растворителями являются, например, диэтиловый эфир, диметилформамид, тетрагидрофуран. Эпоксиды(VI) также могут быть раскрыты непосредственно цианидами, аминами, алкоголятами, тиоалкоголятами,галогенидами и даже водой или Cs2CO3/H2O в присутствии оснований или сильных протонных кислот. Подходящими основаниями в сенсе изобретения являются, например, Cs2CO3, K2CO3 или NaOH. Подходящими сильными протонными кислотами являются, например, HClO4, HCl или HBr. Способ b). Стадия а) Метоксиметиламиды типа (VII) обрабатывали при низких температурах от -80 до -100C литерованным эпоксидом (V) с получением соединения типа (VIII). Соединения формулы (VII) являются коммерчески доступными или могут быть синтезированы согласно Branca et al., Chimia 49, 10; 1995, 381-385. Стадия b) Эпоксиды (VIII) могут быть раскрыты нуклеофилами типа R5-Met, давая соединение (IX). Возможными нуклеофилами являются алкилкупраты, винилкупраты, тиолы, аллилсиланы, винилсиланы, винилстаннаны, магнийорганические соединения в присутствии кислот Льюиса, как BF3 или AlCl3, или непосредственно цианиды, амины, спирты, тиоспирты, галогениды и вода в присутствии оснований или сильных протонных кислот. Кетоны типа (IX) могут конденсироваться с замещенными аминохинолонами типа (III), давая имины и в дальнейшем или в то же самое время восстанавливаться до аминоспиртов I при помощи восстановительного аминирования, используя комплексные гидриды, например NaBH4 или LiAlH4 (Katritzky et al.J. Org. Chem. 1995, 60, 7631-7640), или водород в присутствии каталитических количеств палладия или платины или применяя асимметричное органокатализируемое гидрирование (List et al. Angew. Chem. 2005, 117, 7590-7593). Эти описанные выше способы могут быть осуществлены энантиоселективно путем использования энантиомерно чистого эпоксида формулы (V) с получением энантиомерно чистых соединений формулы(VI), (VIII), (IX) и (I). Последняя стадия восстановления b) может быть осуществлена диастереоселективным способом с получением энантиомерно чистого соединения I, тогда как исходные материалы используют энантиомерно чистое соединение IX. Альтернативно, во время способа получения соединений формулы I на разных стадиях может быть совершена очистка для получения энантиомерно или диастереомерно чистых интермедиатов, например,интермедиаты формул VI, VIII, IX могут быть очищены на стадии, когда они получаются или могут быть очищены соединениями формулы I с получением энантиомерно или диастереомерно чистых конечных продуктов после завершения каскада реакций. Примеры способов для получения энантиомерно чистого(энантиомерно чистых) соединения описаны ниже. Разделение оптических изомеров может быть осуществлено разделением одного или более интермедиатов и/или разделением конечных продуктов. Как правило, разделение интермедиатов и разделение конечных продуктов являются альтернативными вариантами, поскольку во время способа получения не происходит рацемизации. Если соединения согласно изобретению находятся в виде рацемической смеси, они могут быть разделены на чистые, оптически активные формы согласно способам разделения рацематов, которые известны специалисту в данной области техники. Например, рацемические смеси могут быть разделены при помощи хроматографии на вплоть до оптически активном носителе (CHIRALPAK AD) до чистых изомеров. Также возможно использование хиральных вспомогательных агентов как оптически чистые кислоты. Для этих целей свободную гидроксигруппу эстерифицируют с получением рацемического соединения общей формулы I при помощи оптически активной кислоты, чтобы разделить диастереоизомерные эфиры, которые получают фракционной кристаллизацией или при помощи хроматографии, и омылить разделенные эфиры в каждом случае до оптически чистых изомеров. Как оптически активная кислота может использоваться, например, миндальная кислота, камфорсульфоновая кислота или винная кислота. Таким образом, одним аспектом изобретения является способ получения соединения формулы I в диастереомерно чистой форме, необязательно используя хроматографию с колонками, содержащими хиральный материал или используя хиральные вспомогательные агенты. Каждый из интермедиатов синтеза соединений формулы I является одним аспектом настоящего изобретения, так же как особенно их применение для синтеза соединений формулы I. Особым аспектом изобретения являются конкретные интермедиаты в качестве применяемых для синтеза соединений примеров, или в виде рацемической смеси, или в их энантиомерно (имеет один хиральный центр) или диастереомерно (имеет два хиральных центра) чистых формах. Связывание веществ с глюкокортикоидным рецептором (GR) и другими гормональными стероидными рецепторами (минеральный кортикоидный рецептор (MR), рецептор прогестерона (PR) и рецептор андрогена (AR исследовано при помощи рекомбинантно продуцированных рецепторов. Цитозольные препараты клеток Sf9, которые были заражены рекомбинантными бациловирусами, которые кодируютсяGR, использовались для исследований связывания. По сравнению с эталонным веществом [3 Н]дексаметазоном вещества показывают от высокой до очень высокой аффинность к GR. Таким образом,были измерены IC50 (GR) = 6,8 нМ, IC50 (GR) = 5,7 нМ и IC50 (GR) = 3,1 нМ и IC50 (GR) = 7,1 нМ для соединения из примеров 1, 4, 5 и 7 соответственно. Как существенный рассматривался молекулярный механизм для противовоспалительного действия глюкокортикоидов, GR-опосредованное ингибирование транскрипции цитокинов, адгезивных молекул,-5 017459 ферментов и других провоспалительных факторов. Это ингибирование произведено взаимодействиемWade, E., BioEssays 18, 371-378, 1996). Соединения общей формулы I соответственно изобретению ингибируют секрецию цитокина IL-8 в человеческой клеточной моноцитарной линии ТНР-1, который инициирован липополисахаридом (LPS). Концентрация цитокинов была определена в супернатанте посредством коммерчески доступных комплектов ELISA. Соединение из примеров 4, 5, 7 и 8 показало ингибирование IC50 (IL8) = 0,61 нмоль, IC50(IL8) = 0,19 нмоль, IC50 (IL8) = 0,44 нмоль и IC50 (IL8) = 3,1 нмоль с эффективностью 97, 98, 98 и 80% соответственно по сравнению с дексаметазоном как эталоном. Противовоспалительное действие соединений общей формулы I было проверено в эксперименте с животными при помощи тестов с воспалением, вызванным кротоновым маслом у крыс и мышей (J. Exp.Med. 1995, 182, 99-108). С этой целью кротоновое масло в этанольном растворе было применено местно на ушах животных. Тестируемые вещества были также применены местно или систематически в то же самое время или за 2 ч до кротонового масла. После 16-24 ч измеряли вес уха как критерий для воспалительного отка, активность пероксидазы как критерий для инвазии гранулоцитов и активность эластазы как критерий для инвазии нейтрофильных гранулоцитов. В этом тесте соединения общей формулы I ингибируют три вышеупомянутых параметра воспаления и после местного введения, и после общего введения. Одним из самых частых нежелательных действий глюкокортикоидной терапии является так называемый "стероидный диабет" [см. Hatz, H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologieund Therapierichtlinien [Glucocorticoids: Immunological Bases, Pharmacology and Therapy Guidelines], Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998]. Причиной для него является стимуляция глюконеогенеза в печени индукцией ферментов, ответственных в этом отношении, и свободными аминокислотами, которые генерируются из расщепления белков (катаболическое действие глюкокортикоидов). Ключевым ферментом катаболического метаболизма в печени является тирозинаминотрансфераза (ТАТ). Активность этого фермента может быть определена из печеночных гомогенатов фотометрией и представляет хорошую оценку нежелательных метаболических действий глюкокортикоидов. Чтобы измерить индукцию ТАТ, животных убивали спустя 8 ч после того, как ввели тестируемые вещества, печень удаляли и активность ТАТ измеряли в гомогенате. В этом тесте при дозах, в которых они имели противовоспалительную активность, соединения общей формулы I индуцируют немного или не индуцируют тирозинаминотрансферазу. Вследствие своего противовоспалительного и, кроме того, антиаллергического, иммунодепрессивного и антипролиферативного действия, соединения общей формулы I соответственно изобретению могут применяться в качестве лекарственных средств для лечения или профилактики следующих патологических состояний у млекопитающих и людей. В этом случае термин "заболевание" устанавливается за следующими признаками.(i) Заболевания легких, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: хронические обструктивные заболевания легких любого происхождения, преимущественно бронхиальная астма,бронхиты различного происхождения,синдром расстройства дыхания у взрослых (СРДВ), синдром острой дыхательной недостаточности,бронхоэктазия,все формы рестриктивных заболеваний легких,все формы отека легких, преимущественно токсический отек легкого, например радиогенный пневмонит,саркоидозы и гранулематозы, особенно болезнь Бека.(ii) Ревматизмы/аутоиммунные заболевания/заболевания суставов, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматизмов, особенно ревматоидный артрит, ревматическая атака, ревматическая полимиалгия, болезнь Бехчета,реактивный артрит,воспалительные заболевания мягкой ткани других происхождений,симптомы артрита в случае дегенеративных заболеваний сустава (артрозы),травматические артриты,витилиго,коллагенозы любого происхождения, например системные красные волчанки, склеродермия, полимиозит, дерматомиозит, синдром Шегрена, синдром Стилла, синдром Фелти,саркоидозы и грануломатозы,ревматизм мягкой ткани.(iii) Аллергии или псевдоаллергические заболевания, которые сопровождаются воспалительными,аллергическими и/или пролиферативными процессами:-6 017459 все формы аллергических реакций, например отек Квинке, сенная лихорадка, укусы насекомого,аллергические реакции на фармацевтические препараты, производные крови, контрастное вещество и т.д., анафилактический шок, уртикария, аллергический и раздражающий контактный дерматит, аллергические сосудистые заболевания,аллергический васкулит.(v) Дерматологические заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: атопические дерматиты (преимущественно у детей),все формы экзем, такие как, например, атопическая экзема (преимущественно у детей),высыпания любого происхождения или дерматозы,группы псориаза и парапсориаза,красный волосистый питириаз,эритематозные заболевания, вызванные разными пагубными для здоровья факторами, например радиация, химикаты, ожоги и т.д.,буллезные дерматозы, такие как, например, аутоиммунная обыкновенная пузырчатка, буллзный пемфигоид,заболевания лихеноидной группы,прурит (например, аллергического происхождения),себорейная экзема,группа розацеа,эритема многоформная экссудативная,баланит,вульвит,проявление васкулярных заболеваний,облысение, такое как гнездная алопеция,кожная лимфома.(vii) Печеночные заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: острое разложение печеночных клеток,острый гепатит различных происхождений, например вирусного, токсического, вызванного фармацевтическим препаратом,хронический агрессивный гепатит и/или хронический интермиттирующий гепатит.(viii) Желудочно-кишечные заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: регионарный энтерит (болезнь Крона),язвенный колит,гастрит,рефлюксный эзофагит,язвенный колит другого происхождения, например природные язвенные афты.(xii) Неврологические заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: отек мозга, преимущественно отек мозга, вызванный опухолью,множественный склероз,острый энцефаломиелит,менингит,различные формы конвульсий, например детские кивательные судороги,острое повреждение спинного мозга,апоплексический удар.(xiii) Заболевания крови, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами, такие как, например, м. ходжкинская или неходжкинская лимфома, тромбоцитемия, эритроцитозы,приобретнная гемолитическая анемия,идиопатическая тромбоцитопения.(xvii) Тяжелые шоковые состояния, например анафилактический шок, синдром системной воспалительной реакции (SIRS).(xviii) Заместительная терапия при: врожденной преимущественно надпочечной недостаточности, например врожденном адреногенитальном синдроме,приобретенной преимущественно надпочечной недостаточности, например болезни Аддисона, аутоиммунном адреналите, постинфекционных опухолях, метастазах и т.д.,врожденной вторичной надпочечной недостаточности, например врожденном гипопитуитаризме,приобретенной вторичной надпочечной недостаточности, например постинфекционных опухолях и т.д.(xxi) Другие различные стадии заболевания, включая диабет I типа (инсулинзависимый диабет), остеоартрит, синдром Гийена-Барре, рестенозы после чрескожной транслюминальной ангиопластики, болезнь Альцгеймера, острая и хроническая боль, артериосклероз, реперфузионное повреждение, застойная сердечная недостаточность, инфаркт миокарда, термическое повреждение, множественное поражение органов на фоне травмы, острый гнойный менингит, некротический энтероколит и синдромы, связанные с гемодиализом, лейкаферезом и гранулоцитарной трансфузией. Кроме того, соединения общей формулы I, соответствующие изобретению, могут применяться для лечения и профилактики дополнительных патологических состояний, которые не упомянуты выше, для которых сейчас применяются синтетические глюкокортикоиды (см. в этом отношении Hatz, H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998). Все ранее упомянутые признаки (i) - (хх) описаны более подробно в Hatz, H. J., Glucocorticoide: Im-8 017459munologische Grundlagen, Pharmakologie und Therapierichtlinien, Wissenschaftliche Verlagsgesellschaft mbH,Stuttgart, 1998. Все упомянутые выше заболевания действительно имеют общим то, что они, как предполагается,возникают в результате воспалительных, аллергических, иммунодепрессивных или антипролиферативных процессов. Таким образом, изобретение также относится к способам лечения воспалительных, аллергических, иммунодепрессивных или антипролиферативных заболеваний и применению соединений формулы I или их фармацевтически приемлемой соли для изготовления лекарственного средства для их лечения. Одним специальным объектом является лечение воспалительных заболеваний. Глюкокортикоидный рецептор, как известно, вовлечен в процесс воспаления. Таким образом, другим объектом изобретения является способ лечения болезненного состояния, опосредуемого глюкокортикоидным рецептором у млекопитающего, который включает введение млекопитающему, которое нуждается в таком лечении, эффективной дозы соединения формулы (I) или его фармацевтически приемлемой соли и применение соединения формулы (I) или его фармацевтически приемлемой соли по пп.1-6 для изготовления лекарственного средства для применения в лечении болезненного состояния, опосредуемого глюкокортикоидным рецептором. Другим объектом изобретения являются соединения формулы (I) или их фармацевтически приемлемая соль по пп.1-6 для применения в терапии. Для терапевтических действий при вышеупомянутых патологических состояниях подходящая доза изменяется и зависит, например, от силы активности соединения общей формулы I, хозяина, типа введения и типа и серьезности состояний, которые нужно лечить, так же как применение в качестве профилактического агента или в качестве терапевтического агента. В дополнение, изобретение обеспечивает:(i) применение одного из соединений формулы I соответственно изобретению или их смеси для производства лекарственного средства для лечения заболевания;(ii) способ лечения заболевания, указанный способ включает введение количества соединения соответственно изобретению, где количество подавляет заболевание и где количество соединения дается пациенту, который нуждается в таком медикаменте;(iii) фармацевтическую композицию для лечения болезни, указанное лечение включает одно из соединений соответственно изобретению или его смесь и по крайней мере один фармацевтический адъювант и/или среду. В общем, удовлетворительные результаты могут ожидаться у животных, когда ежедневные дозы содержат диапазон 1-100000 мкг соединения соответственно изобретению на 1 кг массы тела. В случае больших млекопитающих, например человека, рекомендуемая ежедневная доза находится в диапазоне 1100000 мкг на 1 кг массы тела. Предпочтительная доза 10-30000 мкг на 1 кг массы тела и более предпочтительная доза 10-10000 мкг на 1 кг массы тела. Например, эту дозу соответственно вводят несколько раз ежедневно. Для лечения острого шока (например, анафилактического шока) могут быть даны отдельные дозы, которые значительно выше упомянутых доз. Составление рецептур фармацевтических препаратов, основанных на новых соединениях, осуществляется путем, который известен в области техники, при помощи переработки активного компонента с средами, которые обычно применяются в галеновых препаратах, наполнителями, веществами, которые влияют на разложение, связывающими агентами, увлажняющими веществами, смазками, абсорбентами,разбавителями, ароматическими корригентами, красителями и т.д. и преобразования в желательную форму введения. В этом случае ссылка сделана на Remington's Pharmaceutical Science, 15-е изд., MackPublishing Company, East Pennsylvania (1980). Для перорального введения пригодны, в особенности, таблетки, таблетки с покрытием, капсулы,пилюли, порошки, гранулы, таблетки для рассасывания, суспензии, эмульсии или растворы. Для парентерального введения возможны инъекционные и инфузионные препараты. Для внутрисуставной инъекции могут быть использованы приготовленные соответствующим образом кристаллические суспензии. Для внутримышечной инъекции могут быть использованы водные и масляные инъекционные растворы или суспензии и соответствующие накопительные препараты. Для ректального введения новые соединения могут быть использованы в форме суппозиториев,капсул, растворов (например, в форме клизмы) и мазей, и то, и другое для системного и для местного лечения. Для пульмонального введения новых соединений, последние могут применяться в форме аэрозолей и ингаляторов. Для местного применения к глазам, внешнему уху, среднему уху, носовым впадинам и параносовым пазухам новые соединения могут применяться как капли, мази и настойки в соответствующих фармацевтических препаратах. Для наружного применения являются возможными составы в гелях, мазях, жирных мазях, кремах,пастах, порошках, молочке и настойках. Дозировка соединений общей формулы I в этих препаратах может быть 0,01-20%, чтобы достигнуть достаточного фармакологического действия.-9 017459 Изобретение также включает соединения общей формулы I соответственно изобретению как терапевтические активные компоненты. Кроме того, соединения общей формулы I соответственно изобретению являются частью изобретения как терапевтические активные компоненты вместе с фармацевтически совместимыми и приемлемыми адъювантами и средами. Изобретение также включает фармацевтическую композицию, которая содержит одно из фармацевтически активных соединений соответственно изобретению или их смесь или их фармацевтически совместимые соли и фармацевтически совместимые соли или фармацевтически совместимые адъюванты и среды. Соединения общей формулы (I) соответственно изобретению могут произвольно также быть включены в составы и/или вводиться в комбинации с другими активными компонентами. Изобретение поэтому также относится к комбинированному лечению или комбинированным композициям, в которых соединение общей формулы (I), или его фармацевтически приемлемая соль, или фармацевтическая композиция, которая содержит соединение общей формулы (I) или его фармацевтически приемлемую соль, вводятся либо одновременно (необязательно в той же самой композиции) или по очереди вместе с одним или более фармацевтическими агентами для лечения одного из вышеупомянутых патологических состояний. Например, для лечения ревматического артрита, остеоартрита, ХОЗЛ(хроническое обструктивное заболевание легких), астмы или аллергического ринита, соединение общей формулы (I) этого изобретения может быть скомбинировано с одним или более фармацевтическими агентами для лечения такого состояния. Когда такая комбинация вводится ингаляцией, фармацевтический агент, с которым комбинируют, может быть выбран из следующего списка: ингибитор PDE4, включая ингибитор изоформы PDE4D,селективный .sub2. адреномиметик, такой как метапротеренол, изопротеренол, изопреналин, альбутерол, сальбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерол, мезилат, пирбутерол или индакатерол; антагонист мускаринового рецептора (например, M1, M2 или М 3 антагонист, такой как более селективный М 3 антагонист), такой как ипратропия бромид, тиотропия бромид, окситропия бромид, пирензепин или телензепин; модулятор функции хемокинового рецептора (такой как антагонист CCR1 рецептора) или ингибитор функции р 38 киназы. Для другого объекта этого изобретения такая комбинация с соединением общей формулы (I) или его фармацевтически приемлемой солью применяется для лечения ХОЗЛ, астмы или аллергического ринита и может вводиться ингаляцией или перорально в комбинации с ксантином (таким как, например,аминофиллин или теофиллин), который также может вводиться ингаляцией или перорально. Экспериментальная часть Различные аспекты изобретения, описанные в настоящей заявке, иллюстрируются следующими примерами, которые в любом случае не подразумевают ограничения изобретения. Пример 1. 5-[1-(2-Фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил) пропил]амино-1H-хинолин-2-он. 5-[(2-Фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-1 Н-хинолин-2-он. К 600 мг (3,9 ммоль) 5-амино-1H-хинолин-2-она и 624 мг (3,9 ммоль) 2-фтор-4 метоксибензальдегида в 12 мл толуола прибавляли 18 мкл уксусной кислоты и 2 г молекулярных сит. Смесь нагревали в течение 25 ч при кипении и после охлаждения фильтровали через подушку целлита. Растворитель выпаривали и остаток дважды азеотропно выпаривали с небольшими порциями толуола с получением 5-[1-(2-фтор-4-метоксифенил)метилиден]амино-1H-хинолин-2-она количественно. 0,81 мл(11,6 ммоль) 1,1,1-трифторэпоксипропана в 12 мл THF и 3,5 мл гексана охлаждали до -100C и прибавляли в течение 10 мин 3,75 мл 2,5 М раствора н-бутиллития (9,4 ммоль) в гексане, тогда как температура не превышала -95C. Через 10 мин после окончания прибавления в течение 15 мин прибавляли 1,11 г (12 ммоль) 5-[1-(2-фтор-4-метоксифенил)метилиден]амино-1H-хинолин-2-она в 10 мл THF, тогда как температура не превышала -95C. Через 3 ч при -100C прибавляли 3,75 мл диэтилового эфира и реакционную смесь нагревали до -10C в течение 1 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония. Фазы разделяли и водный слой дважды экстрагировали этилацетатом, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали. Флэш- 10017459 хроматография на силикагеле (ацетон в гексане от 0 до 80%) дает 410 мг 5-[(2-фтор-4-метоксифенил)(2 трифторметилоксиранил)метил]амино-1H-хинолин-2-она. 1 Н-ЯМР (CDCl3);= 2.59 (dq, 1H), 3.15 (d, 1H), 3.78 (s, 3H), 4.93 (d, 1H), 5.53 (d, 1H), 6.21 (d, 1H),6.67 (m, 3H), 6.77 (d, 1H), 7.13 (t, 1H), 7.22 (t, 1H), 7.96 (d, 1H). К 50 мг (0,12 ммоль) 5-[(2-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-1Hхинолин-2-она и 80 мг Cs2CO3 в 0,5 мл DMF прибавляли 0,18 мл 1M раствора метилмеркаптана в DMF. Смесь интенсивно перемешивали в течение 4 ч и прибавляли воду. Водный слой экстрагировали этилацетатом, органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя тонкослойная хроматография на силикагеле (ацетон в гексане 50%) дает 27 мг названного соединения. 1 Н-ЯМР (CDCl3);= 2.09 (s, 3 Н), 2.87 (d, 1 Н), 3.06 (d, 1H), 3.81 (s, 3H), 5.24 (d, 1H), 5.88 (d, 1H), 6.22 К 50 мг (0,12 ммоль) 5-[(2-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-1Hхинолин-2-она и 80 мг CS2CO3 в 0,5 мл DMF прибавляли 14 мкл (0,18 ммоль) этилмеркаптана в DMF. Смесь интенсивно перемешивали в течение 4 ч и прибавляли воду. Водный слой экстрагировали этилацетатом, органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя тонкослойная хроматография на силикагеле (ацетон в гексане 50%) дает 20 мг названного соединения. 1 Н-ЯМР (CDCl3);= 1.18 (t, 3 Н), 2.45 (dq, 2 Н), 2.85 (d, 1 Н), 3.09 (d, 1H), 3.81 (s, 3H), 5.19 (d, 1H),5.82 (d, 1H), 6.21 (d, 1H), 6.68 (m, 4H), 7.23 (t, 1H), 7.38 (t, 1H), 7.98 (d, 1H). Пример 3. 5-[1-(2-Хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил] метил)пролил]амино-7-фтор-1H-хинолин-2-он. 2-Хлор-3-фтор-4-метоксибензальдегид. 1 г (6,2 ммоль) 3-хлор-2-фторанизола в 20 мл THF охлаждали до -70C и прибавляли 2,7 мл 2,5 М раствора н-бутиллития в гексане. Через 1 ч при -70 прибавляли при -70C 3,93 мл DMF в 7 мл THF и смесь перемешивали еще 1 ч при -70C. Прибавляли 15 мл 1 М водного HCl и реакцию нагревали до комнатной температуры в течение 18 ч. Реакционную смесь разделяли между диэтиловым эфиром и водой. Водную фазу экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и выпаривали. Сырой продукт очищали при помощи хроматографии на силикагеле с получением 0,25 г 2-хлор-3-фтор-4-метоксибензальдегида. 1 Н-ЯМР (CDCl3);= 3.98 (s, 3 Н), 6.98 (dd, 1H), 7.75 (dd, 1H), 10.30 (s, 1H). 5-Амино-7-фтор-1 Н-хинолин-2-он. К раствору 2-бром-3-фторанилина (6,5 г, 34,17 ммоль) и пиридина (2,7 г, 34,17 ммоль) в 20 млCH2Cl2 по каплям прибавляли циннамоил хлорид (5,95 г, 35,88 моль) в 10 мл CH2Cl2 и смесь кипятили в течение 30 мин. Реакционную смесь разводили CH2Cl2, органический слой промывали разбавленой HCl,насыщенным раствором Na2CO3, водой и сушили (Na2SO4). Растворитель удаляли в вакууме с получением 10,5 г N-(2-бром-3-фторфенил)-3-фенилакриламида. К раствору N-(2-бром-3-фторфенил)-3-фенилакриламида (10,5 г, 32,8 ммоль) в 70 мл хлорбензола при 130C частями прибавляли AlCl3 (21,9 г, 0,164 моль), смесь перемешивали при этой температуре 2 ч и выливали в ледяную воду. Осадок отфильтровывали и сушили. Выход 6,05 г (76%). 6 г (24,8 ммоль) 8-бром-7-фтор-1H-хинолин-2-она кипятили в 30 млPOCl3 в течение 2 ч, затем выливали на лед, экстрагировали бензолом. Бензольный экстракт сушили(Na2SO4) с получением 6,1 г 8-бром-2-хлор-7-фторхинолина после удаления растворителя. К смеси 10 мл 10%-олеума и 1,4 г (22,2 ммоль) дымящей HNO3 частями прибавляли 8-бром-2-хлор-7-фторхинолин (4,8 г 18,5 ммоль). Смесь нагревали при 100C в течение 2 ч, дополнительно прибавляли HNO3 (0,17 г) и перемешивали дополнительно в течение 1 ч. Реакционную смесь выливали в ледяную воду, экстрагировалиEtOAc, фильтровали через силикагель и кристаллизовали из смеси гептан-толуол с получением 2,3 гHCl. Смесь выливали в воду, полученный осадок отфильтровывали, перемешивали в EtOAc и фильтровали с получением 1,71 г 8-бром-7-фтор-5-нитро-1H-хинолин-2-она. К суспензии 1,7 г (5,92 ммоль) 8 бром-7-фтор-5-нитро-1H-хинолин-2-она и 2,3 г (35,5 ммоль) HCOONH4 в 10 мл этанола прибавляли 0,1 г 10% Pd-C и перемешивали в течение 2 ч при 60C. Осадок исчезает и затем образуется снова. Осадок отфильтровывали, растворяли в 3 мл DMSO и фильтровали через силикагель. К элюату прибавляли 15 мл воды, осадок отфильтровывали и сушили с получением 0,5 г (47%) 5-амино-7-фтор-1H-хинолин-2-она. 1 Н-ЯМР (DMSO-d6);= 6.14 (dd, 1H), 6.20 (dd, 1H), 6.23 (d, 1H), 6.27 (br, 2H), 8.06 (d, 1H), 11.50 (br,1H). 5-[(2-Хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-7-фтор-1Hхинолин-2-он. К 1,6 г (9 ммоль) 5-амино-7-фтор-1H-хинолин-2-она и 1,69 г (9 ммоль) 2-хлор-3-фтор-4 метоксибензальдегида в 27 мл толуола и 8 мл 1,4-диоксана прибавляли 1,96 мл уксусной кислоты и 7 мл тетрабутилортотитаната. Смесь нагревали в течение 20 ч до 110C, охлаждали до комнатной температуры и выливали в водный раствор фторида аммония. Прибавляли этилацетат и смесь интенсивно перемешивали в течение 1 ч. Фазы разделяли и прибавление этилацетата повторяли дважды с перемешиванием при кипении и фазы разделяли, пока они еще горячие. Объединенные органические фазы концентрировали и остаток очищали флэш-хроматографией на силикагеле (этилацетат, затем метанол в дихлорметане от 15 до 20%) с получением 2,17 г 5-[1-(2-хлор-3-фтор-4-метоксифенил)метилиден]амино-7-фтор-1Hхинолин-2-она. 465 мг NaH (55% в масле, 9,7 ммоль) промывали сухим THF и суспендировали вместе с 2,6 г (7,5 ммоль) 5-[1-(2-хлор-3-фтор-4-метоксифенил)метилиден]амино-7-фтор-1H-хинолин-2-оном в 90 мл THF. Прибавляли трет-бутилдиметилсилилхлорид в твердом виде и смесь перемешивали в течение 3,5 ч до образования прозрачного раствора. Параллельно 0,96 мл 1,1,1-трифтор-2,3-эпоксипропана в 24 мл THF и 7 мл гексана охлаждали до -100C и прибавляли в течение 10 мин. 4,5 мл 2,5 М раствора нбутиллития в гексане, тогда как температура не превышала -95C. Через 10 мин после окончания прибавления предварительно приготовленный раствор 1-трет-бутилдиметилсилил-5-[1-(2-хлор-3-фтор-4 метоксифенил)метилиден]амино-7-фторхинолин-2-она в THF прибавляли в течение 30 мин, тогда как температура не превышала -95C. Через 3 ч при -100C прибавляли 7,5 мл диэтилового эфира и реакционную смесь нагревали до комнатной температуры в течение 1 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония. После перемешивания в течение 30 мин фазы разделяли и водный слой экстрагировали дихлорметаном, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали. Флэш-хроматография на силикагеле (этилацетат в гексане от 50 до 100%) дает 2,14 г 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-7 фтор-1H-хинолин-2-она, который использовали в нескольких следующих примерах для раскрытия оксиранового кольца различными нуклеофилами. 1H-ЯМР (DMSO-d6);= 2.62 (m, 1 Н), 3.29 (d, 1H), 3.87 (s, 3 Н), 5.49 (d, 1H), 5.83 (d, 1H), 6.34 (d, 1H),6.37 (d, 1H), 7.04 (d, 1H), 7.22 (dd, 1H), 7.44 (d, 1H), 8.31 (d, 1H), 11.63 (s, 1H). К 65 мг (0,14 ммоль) 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-7-фтор-1H-хинолин-2-она и 92 мг (0,28 ммоль) Cs2CO3 в 0,5 мл DMF прибавляли 0,21 мл 1 М раствора метилмеркаптана в DMF. Смесь интенсивно перемешивали в течение 20 ч и прибавляли воду. Водный слой экстрагировали этилацетатом, органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя тонкослойная хроматография на силикагеле (этилацетат) дает 22 мг названного соединения. 1 Н-ЯМР (CDCl3);= 1.91 (s, 3 Н), 2.68 (d, 1 Н), 3.04 (d, 1H), 3.87 (s, 3H), 5.21 (d, 1H), 5.80 (dd, 1H),5.94 (d, 1H), 6.38 (dd, 1H), 6.57 (d, 1H), 6.87 (dd, 1H), 7.24 (dd, 1H), 7.84 (d, 1H). Пример 4. 5-[1-(2-Хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2 гидроксипропил]амино-7-фтор-1H-хинолин-2-он. К 66 мг (0,14 ммоль) 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино-7-фтор-1H-хинолин-2-она, полученного в примере 3, и 93 мг (0,29 ммоль) Cs2CO3 в 0,6 мл DMF прибавляли 16 мкл (0,22 ммоль) этилмеркаптана в DMF. Смесь интенсивно перемешивали в течение 20 ч и прибавляли воду. Водный слой экстрагировали этилацетатом, органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя тонкослойная хроматография на силикагеле 2,14 г (4,64 ммоль) 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино 7-фтор-1H-хинолин-2-она, полученного в примере 3, перемешивали с 2,57 г (7,9 ммоль) карбоната кальция в 37 мл метанола. Через 3 дня прибавляли воду и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя флэш-хроматография на силикагеле (метанол в дихлорметане от 0 до 5%) дает 0,98 г названного соединения. 1 Н-ЯМР (CD3OD);= 3.07 (d, 1 Н), 3.23 (s, 3 Н), 3.50 (d, 1H), 3.84 (s, 3H), 5.33 (s, 1H), 6.02 (dd, 1H),6.29 (dd, 1H), 6.43 (d, 1H), 7.05 (dd, 1H), 7.47 (dd, 1H), 8.04 (d, 1H). Пример 6. 5-[1-(2-Хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он. 70 мг (0,15 ммоль) 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино 7-фтор-1H-хинолин-2-он, полученного в примере 3, перемешивали с 84 мг (0,26 ммоль) карбоната кальция в 0,67 мл этанола. Через 40 ч прибавляли воду и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя препаративная тонкослойная хроматография на силикагеле (этилацетат) дает 22 мг названного соединения. 1 Н-ЯМР (CDCl3);= 1.15 (t, 3 Н), 3.39 (dq, 1H), 3.42 (d, 1H), 3.51 (dq, 1H), 3.69 (d, 1H), 3.87 (s, 3H),5.26 (d, 1H), 5.86 (dd, 1H), 6.18 (d, 1H), 6.33 (dd, 1H), 6.54 (d, 1H), 6.87 (dd, 1H), 7.25 (dd, 1H), 7.80 (d, 1H). Пример 7. 5-[1-(2-Хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил) пропил]амино-7-фтор-1H-хинолин-2-он. 250 мг (0,54 ммоль) 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино 7-фтор-1H-хинолин-2-она перемешивали с 353 мг (1,1 ммоль) карбоната кальция в 3 мл DMF, 1,9 мл воды и 0,5 мл DMSO. Прибавляли воду и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя флэш-хроматография на силикагеле (метанол в дихлорметане от 0 до 5%) дает 0,98 г названного соединения. 1 Н-ЯМР (CD3OD);= 3.60 (d, 1 Н), 3.71 (d, 1H), 3.85 (s, 3H), 5.34 (s, 1H), 5.96 (dd, 1H), 6.29 (dd, 1H),6.45 (d, 1H), 7.06 (dd, 1H), 7.51 (dd, 1H), 8.04 (d, 1H). Пример 8. 5-[1-(5-Хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил) пропил]амино-7-фтор-1H-хинолин-2-он. 5-Хлор-3-фтор-2-метоксибензалъдегид. К 5 г (34 ммоль) 4-хлор-2-фторфенола и 416 мг (3,41 ммоль) 4-диметиламинопиридина в 18 мл THF прибавляли 3,7 мл (37,5 ммоль) изопропилизоцианата и смесь нагревали в течение 20 ч при 60C. После охлаждения до комнатной температуры прибавляли 2 М HCl и водную фазу экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и выпаривали с получением 7,2 г 4-хлор-2-фторфенилового эфира изопропилкарбаминовой кислоты как сырой продукт. К 7,2 г (31 ммоль) 4-хлор-2-фторфенилового эфира изопропилкарбаминовой кислоты и 5,1 мл тетраметилендиамина в 300 мл диэтилового эфира прибавляли 5,9 мл (32,5 ммоль) (триметилсилил)(трифторметан)сульфоната при комнатной температуре. Через 30 мин смесь охлаждали до -70C,последовательно прибавляли 10,2 мл тетраметилендиамина и 27 мл 2,5 М раствора н-BuLi. Через 1 ч при-70 прибавляли 24 мл DMF и смесь перемешивали еще 1 ч при -70C. Прибавляли 130 мл этанола и 36 мл 2 М водного NaOH и реакцию нагревали до комнатной температуры в течение 18 ч. Реакционную смесь подкисляли прибавлением 100 мл 2 М водной HCl и разделяли между диэтиловым эфиром и водой. Водную фазу экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и выпаривали. Сырой продукт очищали при помощи хроматографии на силикагеле с получением 1,1 г 5-хлор-3-фтор-2-гидроксибензальдегида. 1,1 г (6,1 ммоль) 5-хлор-3 фтор-2-гидроксибензальдегида и 1,56 г (11,3 ммоль) карбоната калия интенсивно перемешивали в 11 млDMF и в то же время прибавляли 0,7 мл метилйодида. Перемешивание продолжали в течение 18 ч и прибавляли воду. Водную фазу экстрагировали диэтиловым эфиром, объединенные органические фазы сушили над сульфатом натрия и выпаривали. Сырой продукт очищали при помощи хроматографии на силикагеле (этилацетат в гексане от 0 до 10%) с получением 570 мг 5-хлор-3-фтор-2-метоксибензальдегида. 1 Н-ЯМР (CDCl3);= 4.10 (d, 3 Н), 7.35 (dd, 1 Н), 7.59 (m, 1H), 10.35 (s, 1H). 5-[(5-Хлор-3-фтор-2-метоксифенил)(2-трифторметилоксиранил)метил]амино-7-фтор-1Hхинолин-2-он. К 0,54 г (3 ммоль) 5-амино-7-фтор-1H-хинолин-2-она и 0,57 г (3 ммоль) 5-хлор-3-фтор-2 метоксибензальдегида в 9 мл толуола и 2,6 мл 1,4-диоксана прибавляли 0,65 мл уксусной кислоты и 2,4 мл тетрабутилортотитаната. Смесь нагревали в течение 17 ч до 110C, охлаждали до комнатной температуры и выливали в водный раствор фторида аммония. Прибавляли этилацетат и смесь интенсивно перемешивали в течение 1 ч. Фазы разделяли и прибавление этилацетата повторяли дважды с перемешиванием при кипении и фазы разделяли, пока они еще горячие. Объединенные органические фазы концентрировали и остаток очищали флэш-хроматографией на силикагеле (этилацетат, затем метанол в дихлорметане от 10 до 20%) с получением 0,63 г 5-[1-(5-хлор-3-фтор-2-метоксифенил)метилиден]амино-7-фтор 1H-хинолин-2-она. 57 мг NaH (55% в масле, 1,4 ммоль) промывали сухим THF и суспендировали вместе с 0,63 г (1,8 ммоль) 5-[1-(5-хлор-3-фтор-2-метоксифенил)метилиден]амино-7-фтор-1H-хинолин-2-она в 22 мл THF. трет-Бутилдиметилсилилхлорид прибавляли в твердом виде и смесь перемешивали в течение- 14017459 2.5 ч до образования прозрачного раствора. Параллельно 0,24 мл 1,1,1-трифтор-2,3-эпоксипропана в 6 млTHF и 2 мл гексана охлаждали до -100C и в течение 10 мин прибавляли 1,1 мл 2,5 М раствора нбутиллития в гексане, тогда как температура не превышала -95C. Через 10 мин после окончания прибавления в течение 20 мин прибавляли предварительно приготовленный раствор 1-третбутилдиметилсилил-5-[1-(5-хлор-3-фтор-2-метоксифенил)метилиден]амино-7-фторхинолин-2-она вTHF, тогда как температура не превышала -95C. Через 3,5 ч при -100C прибавляли 2 мл диэтилового эфира и реакционную смесь нагревали до комнатной температуры в течение 1 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония. После перемешивания в течение 30 мин фазы разделяли и водный слой экстрагировали дихлорметаном, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали. Флэш-хроматография на силикагеле (этилацетат в гексане от 0 до 100%) дает 152 мг 5-[(5-хлор-3-фтор-2-метоксифенил)(2-трифторметилоксиранил) метил]амино-7-фтор-1H-хинолин-2-она. 1 Н-ЯМР (CDCl3);= 2.48 (m, 1 Н), 3.18 (d, 1H), 4.11 (s, 3H), 5,13 (d, 1H), 5.54 (d, 1H), 5.86 (dd, 1H),6.53 (dd, 1H), 6.64 (d, 1H), 6.94 (m, 1H), 7.14 (d, 1H), 7.88 (d, 1H) и 87 мг 5-[1-(5-хлор-3-фтор-2 метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-она. 50 мг (0,11 ммоль) 5-[(5-хлор-3-фтор-2-метоксифенил)(2-трифторметилоксиранил)метил]амино 7-фтор-1H-хинолин-2-она перемешивали с 67 мкл перхлорной кислоты (70%) в 0,55 мл DMF в течение 24 ч при 40C. Дополнительно прибавляли 67 мкл перхлорной кислоты (70%) и смесь перемешивали дополнительно в течение 48 ч при 40C. Прибавляли насыщенный водный раствор NH4Cl и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя тонкослойная хроматография на силикагеле (этилацетат) дает 39 мг названного соединения. 1 Н-ЯМР (CD3OD);= 3.49 (d, 1 Н), 3.78 (d, 1H), 4.14 (d, 3H), 5.48 (s, 1H), 6.12 (dd, 1H), 6.34 (d, 1H),6.47 (d, 1H), 7.20 (dd, 1H), 7.52 (m, 1H), 8.10 (d, 1H). Пример 9. 5-[1-(5-Хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил] амино-7-фтор-1H-хинолин-2-он. Может быть выделен как продукт в синтезе эпоксида примера 8 после обработки водным раствором хлорида аммония. 1 Н-ЯМР (DMSO-d6);= 3.88 (d, 1 Н), 4.00 (d, 3 Н), 4.19 (d, 1H), 5.49 (d, 1H), 6.12 (d, 1H), 6.37 (d, 2H),6.51 (d, 1H), 7.42 (d, 1H), 7.66 (s, 1H), 8.24 (d, 1H). Пример 10. 5-[3,3,3-Трифтор-2-гидрокси-2-(метоксиметил)-1-фенилпропил]-амино-1H-хинолин 1-он. 3,3,3-Трифтор-2-гидрокси-2-метоксиметилпропан-1-он. 2,3 мл (26 ммоль) 1,1,1-трифтор-2,3-эпоксипропана в 30 мл THF и 8 мл гексана охлаждали до-100C и прибавляли 6,3 мл 2,5 М раствора н-бутиллития (16 ммоль) в гексане в течение 15 мин, тогда как температура не превышала -95C. Через 10 мин после окончания прибавления в течение 15 мин прибавляли 2,0 (12 ммоль) г N-метокси-N-метилбензамида в 38 мл THF, тогда как температура не превышала-95C. Через 5 ч при -100C прибавляли 12 мл диэтилового эфира и реакционную смесь нагревали до комнатной температуры в течение 14 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония. Фазы разделяли и водный слой дважды экстрагировали этилацетатом, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали с получением 2,59 г фенил-[2-(трифторметил)оксиранил]метанона. Н-ЯМР (CDCl3);= 3.07 (dq, 1H), 3.38 (d, 1H), 7.50 (t, 2H), 7.65 (tt, 1H), 8.07 (d, 2H). 2,59 г (12 ммоль) фенил-[2-(трифторметил)оксиранил]метанона перемешивали с 8,8 г (27 ммоль) карбоната кальция в 94 мл метанола. Реакцию гасили прибавлением воды через 3 дня. Водный слой экстрагировали этилацетатом, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали с получением 2,87 г 3,3,3-трифтор-2-гидрокси-2-метоксиметилпропан-1 она. 1 Н-ЯМР (CDCl3);= 3.42 (s, 3 Н), 3.89 (d, 1 Н), 4.23 (d, 1H), 4.55 (s, 1H), 7.47 (t, 2H), 7.60 (t, 1H), 8.01(d,2H). К 194 мг (1,2 ммоль) 5-амино-1H-хинолин-2-она и 300 мг (1,2 ммоль) 3,3,3-трифтор-2-гидрокси-2 метоксиметилпропан-1-она в 4 мл толуола и 1 мл 1,4-диоксана прибавляли 0,26 мл уксусной кислоты и 1 мл тетрабутилортотитаната. Смесь нагревали в течение 20 ч до 110C, охлаждали до комнатной температуры и выливали в водный раствор фторида аммония. Прибавляли этилацетат и смесь интенсивно перемешивали в течение 30 мин. Фазы разделяли и дважды экстрагировали этилацетатом. Объединенные органические фазы концентрировали с получением количественно 5-[(3,3,3-трифтор-2-гидрокси-2 метоксиметил-1-фенилпропилиден)амино]-1H-хинолин-2-она. 396 мг (1 ммоль) имина в 22 мл метанола охлаждали до 5C и прибавляли 700 мг борогидрида натрия в несколько порций в течение периода 24 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония и разводили водой и этилацетатом. Фазы разделяли, водный слой экстрагировали этилацетатом, объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя флэш-хроматография на силикагеле (этилацетат в гексане от 0 до 80%) дает 53 мг названного соединения. 1 Н-ЯМР (CD3OD);= 3.45 (s, 3 Н), 3.47 (d, 1 Н), 3.64 (d, 1H), 4.97 (s, 1H), 6.19 (d, 1H), 6.58 (t, 2H),7.16 (t, 1H), 7.30 (m, 3H), 7.50 (d, 2H), 8.05 (d, 1H). Пример 11. 5-[1-(2-Хлор-3-фтор-4-метоксифенил)-2-(диаминометил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он. 150 мг (0,33 ммоль) 5-[(2-хлор-3-фтор-4-метоксифенил)(2-трифторметилоксиранил)метил]амино 7-фтор-1H-хинолин-2-она, полученного в примере 3, перемешивали с 69 мг перхлората лития и молекулярными ситами в 3,25 мл (6,5 ммоль) 2 М раствора диметиламина в THF в автоклаве при 60C. Через 20 ч реакционную смесь фильтровали от осадка, который промывали этилацетатом. После удаления растворителя флэш-хроматография на силикагеле (этилацетат в гексане от 0 до 100%) дает 129 мг названного соединения. 1 Н-ЯМР (CDCl3);= 1.68 (br, 3 Н), 2.30 (d, 1H), 2.36 (br, 3 Н), 2.77 (br, 1H), 3.87 (s, 3H), 5.09 (d, 1H),5.81 (d, 1H), 5.98 (d, 1H), 6.35 (d, 1H), 6.56 (d, 1H), 6.88 (dd, 1H), 7.32 (d, 1H), 7.85 (d, 1H). Пример 12. 5-[1-(4-Хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил) пропил]амино-7-фтор-1H-хинолин-2-он.(4-Хлор-3-фтор-2-метоксифенил)[2-(трифторметил)оксиранил]метанон. 1 г (6,2 ммоль) 3-хлор-2-фторанизола в 10 мл THF охлаждали до -70C и прибавляли 2,7 мл 2,5 М раствора н-бутиллития в гексане. Через 1,5 ч при -70 прибавляли 1 г (6,9 ммоль) N,N'-диметокси-N,N'диметилмочевины в 6 мл THF при -70C и смесь перемешивали еще 1 ч при -70C, прибавляли 7,5 мл 2 М водной HCl и реакцию нагревали до комнатной температуры в течение 18 ч. Реакционную смесь разделяли между диэтиловым эфиром и водой. Водную фазу экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и выпаривали. Сырой продукт очищали при помощи хроматографии на силикагеле (этилацетат в гексане от 0 до 30%) с получением 0,59 г 4-хлор-3-фтор-2N-диметокси-N-метилбензамида. 1 Н-ЯМР (CDCl3);= 3.35 (br, 3 Н), 3.49 (br, 3 Н), 3.98 (s, 3 Н), 6.99 (dd, 1H), 7.13 (dd, 1H).- 16017459 0,44 мл (5,1 ммоль) 1,1,1-трифтор-2,3-эпоксипропана в 7,5 мл THF и 2,2 мл гексана охлаждали до-100C и в течение 15 мин прибавляли 2,03 мл 2,5 М раствора н-бутиллития (5,1 ммоль) в гексане, тогда как температура не превышала -95C. Через 10 мин после окончания прибавления в течение 15 мин прибавляли 0,57 г (2,3 ммоль) 4-хлор-3-фтор-2N-диметокси-N-метилбензамида в 10 мл THF, тогда как температура не превышала -95C. Через 3 ч при -100C прибавляли 2,3 мл диэтилового эфира и реакционную смесь нагревали до комнатной температуры в течение 14 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония. Фазы разделяли и водный слой дважды экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали с получением 570 мг (4-хлор-3-фтор-2-метоксифенил)[2-(трифторметил)оксиранил]метанона. 1 Н-ЯМР (CDCl3);= 2.99 (dq, 1 Н), 3.37 (d, 1H), 4.14 (d, 3H), 7.18 (m, 1H), 7.19 (m, 1H). 285 мг (0,95 ммоль) (4-хлор-3-фтор-2-метоксифенил)[2-(трифторметил)оксиранил]метанона перемешивали с 622 мг (1,9 ммоль) карбоната кальция в 6,7 мл метаноле. Реакцию гасили прибавлением через один день воды. Водный слой экстрагировали этилацетатом, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали с получением 262 мг 1-(4-хлор-3 фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-метоксиметилпропан-1-она. К 27 мг (0,15 ммоль) 5 амино-7-фтор-1 Н-хинолин-2-она и 50 мг (0,15 ммоль) 1-(4-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор 2-гидрокси-2-метоксиметилпропан-1-она в 0,45 мл толуола и 0,13 мл 1,4-диоксана прибавляли 33 мкл уксусной кислоты и 0,12 мл тетрабутилортотитаната. Смесь нагревали в течение 20 ч при 110 С, охлаждали до комнатной температуры и выливали в водный раствор фторида аммония. Прибавляли этилацетат и смесь интенсивно перемешивали в течение 30 мин. Фазы разделяли и дважды экстрагировали этилацетатом. Объединенные органические фазы концентрировали с получением количественно 5-[1-(4-хлор-3 фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-метоксиметилпропилиден]амино-7-фтор-1 Нхинолин-2-она. Сырой имин в 4,2 мл метанола охлаждали до 5C и прибавляли 120 мг борогидрида натрия в несколько порций в течение периода 72 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония и разводили водой и этилацетатом. Фазы разделяли, водный слой экстрагировали этилацетатом, объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя препаративная тонкослойная хроматография на силикагеле (ацетон в хлористом метилене, 30%) дает 9,5 мг названного соединения. 1 Н-ЯМР (CD3OD);= 3.44 (s, 3 Н), 3.65 (m, 1 Н), 3.69 (d, 1H), 4.05 (d, 3H), 5.44 (s, 1H), 6.03 (dd, 1H),6.30 (dd, 1H), 6.45 (d, 1H), 7.12 (dd, 1H), 7.35 (dd, 1H), 7.94 (d, 1H). Пример 13. 5-[1-(4-Хлор-3-фтор-2-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он. 1-(4-Хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-этоксиметил-2-гидроксипропан-1-он. 285 мг (0,95 ммоль) (4-хлор-3-фтор-2-метоксифенил)[2-(трифторметил)оксиранил]метанона, полученного в примере 12, перемешивали с 622 мг (1,9 ммоль) карбоната кальция в 8 мл этанола. Реакцию гасили прибавлением через 1 день воды. Водный слой экстрагировали этилацетатом, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем выпаривали с получением 173 мг 1-(4-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-этоксиметил-2-гидроксипропан-1-она. 1 Н-ЯМР (CDCl3);= 1.20 (t, 3 Н), 3.60 (dq, 1H), 3.62 (dq, 1H), 3.79 (d, 1H), 3.97 (d, 3H), 4.09(d, 1H),4.72 (s, 1H), 7.11 (dd, 1H), 7.18 (dd, 1H). К 26 мг (0,15 ммоль) 5-амино-7-фтор-1 Н-хинолин-2-она и 50 мг (0,15 ммоль) 1-(4-хлор-3-фтор-2 метоксифенил)-3,3,3-трифтор-2-этоксиметил-2-гидроксипропан-1-она в 0,44 мл толуола и 0,13 мл 1,4 диоксана прибавляли 30 мкл уксусной кислоты и 0,11 мл тетрабутилортотитаната. Смесь нагревали в течение 20 ч до 110 С, охлаждали до комнатной температуры и выливали в водный раствор фторида аммония. Прибавляли этилацетат и смесь интенсивно перемешивали в течение 30 мин. Фазы разделяли и дважды экстрагировали этилацетатом. Объединенные органические фазы концентрировали с получением количественно 5-[1-(4-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-этоксиметил-2-гидроксипропилиден]амино-7-фтор-1H-хинолин-2-он. Сырой имин в 4,7 мл метанола охлаждали до 5C и прибавляли 180 мг борогидрида натрия в несколько порций в течение периода 72 ч. Реакцию гасили прибавлением насыщенного раствора хлорида аммония и разводили водой и этилацетатом. Фазы разделяли, водный слой экстрагировали этилацетатом, объединенные органические фазы промывали рассолом и сушили над сульфатом натрия. После удаления растворителя препаративная тонкослойная хроматография на силика- 17017459 геле (ацетон в хлористом метилене 30%) дает 3,2 мг названного соединения. 1 Н-ЯМР (CD3OD);= 1.25 (t, 3 Н), 3.58 (dq, 1 Н), 3.59 (dq, 1H), 3.68 (dq, 1H), 3.74 (d, 1H), 4.05 (d, 3H),5.47 (s, 1H), 6.02 (dd, 1H), 6.30 (dd, 1H), 6.43 (d, 1H), 7.13 (dd, 1H), 7.34 (dd, 1H), 7.93 (d, 1H). Пример 14. 5-[1-(2-Хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил) пропил]амино-7-фтор-1H-хинолин-2-он. К 100 мг (0,20 ммоль) 5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2(метоксиметил)пропил]амино-7-фтор-1H-хинолин-2-она примера 5 в 8,6 мл дихлорметана при -30C под аргоном прибавляли 1,6 мл 1 М раствора трехбромистого бора в дихлорметане. Реакционную смесь перемешивали в течение 16 ч в температурном интервале между 0 и 25C. Реакционную смесь смешивали при 0C с насыщенным раствором бикарбоната натрия. После разведения этилацетатом загрузке дали нагреться до комнатной температуры, перемешивали в течение 10 мин и фазы разделяли. Водную фазу подкисляли 4 М HCl и экстрагировали 10% метанола в дихлорметане. После удаления растворителя препаративная тонкослойная хроматография на силикагеле (этилацетат/метанол 4:1) дает 16 мг названного соединения. 1 Н-ЯМР (CD3OD);= 3.62 (d, 1 Н), 3.71 (d, 1H), 5.32 (s, 1H), 5.99 (dd, 1H), 6.30 (dd, 1H), 6.45 (d, 1H),6.87 (dd, 1H), 7.38 (dd, 1H), 8.05 (d, 1H). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы I где R4 означает 7-фтор-заместитель,R1, R2 и R3 независимо друг от друга выбраны из хлора, фтора, метоксигруппы,R5 выбран из S-CH2-CH3, -O-CH2-CH3, -S-CH3, -О-СН 3, -ОН и -Cl,и их соли. 2. Соединения общей формулы I по п.1, выбранные из списка, включающего 5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил)пропил]амино-7-фтор-1H-хинолин-2-он,5-[1-(2-хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2-гидроксипропил] амино-7-фтор-1H-хинолин-2-он,5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино 7-фтор-1H-хинолин-2-он,5-[1-(2-хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино-7 фтор-1H-хинолин-2-он,5-[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино 7-фтор-1H-хинолин-2-он,5-[1-(5-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино 7-фтор-1H-хинолин-2-он,5-[1-(5-хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино-7 фтор-1H-хинолин-2-он,5-[1-(4-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил]амино 7-фтор-1H-хинолин-2-он,5-[1-(4-хлор-3-фтор-2-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил]амино-7 фтор-1H-хинолин-2-он,5-[1-(2-хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]ами- 18017459 но-7-фтор-1H-хинолин-2-он и их соли. 3. Энантиомерно чистые соединения по п.1, выбранные из списка, включающего 5-(1S,2R)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-([метилсульфанил]метил)пропил]амино-7-фтор-1H-хинолин-2-он,5-(1S,2R)[1-(2-хлор-3-фтор-4-метоксифенил)-2-([этилсульфанил]метил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он,5-(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(метоксиметил)пропил] амино-7-фтор-1H-хинолин-2-он,5-(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-2-(этоксиметил)-3,3,3-трифтор-2-гидроксипропил] амино-7-фтор-1H-хинолин-2-он,5-(1S,2S)[1-(2-хлор-3-фтор-4-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил] амино-7-фтор-1H-хинолин-2-он,5-(1S,2S)[1-(5-хлор-3-фтор-2-метоксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил] амино-7-фтор-1H-хинолин-2-он,5-(1S,2R)[1-(5-хлор-3-фтор-2-метоксифенил)-2-(хлорметил)-3,3,3-трифтор-2-гидроксипропил]амино-7-фтор-1H-хинолин-2-он,5-[(1S,2S)[1-(2-хлор-3-фтор-4-гидроксифенил)-3,3,3-трифтор-2-гидрокси-2-(гидроксиметил)пропил]амино-7-фтор-1H-хинолин-2-он и их соли. 4. Применение соединений формулы I по крайней мере одного из пп.1-3 для производства фармацевтических агентов. 5. Применение соединений формулы I по крайней мере одного из пп.1-3 для производства фармацевтических агентов для лечения воспалительных заболеваний. 6. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как определено в пп.1-3, и фармацевтически приемлемый адъювант, разбавитель или носитель. 7. Способ получения соединений общей формулы I по п.1, в котором осуществляются следующие стадии: стадия а) где все остатки имеют определения, данные в п.1, R означает С 1-С 4-алкил и Met означает щелочные металлы, щелочно-земельные металлы, алюминий, медь, кремний или олово. 8. Способ по п.7, отличающийся тем, что на стадии а) получения промежуточного соединения об- 19017459 щей формулы IV бензальдегиды общей формулы II реагируют с замещенными хинолоновыми аминами формулы III, образуя имины общей формулы IV в присутствии кислот Льюиса и/или в кислотных условиях где R1, R2, R3 и R4 имеют значения, определенные в п.1, и R означает С 1-С 4-алкил. 9. Способ по п.7, отличающийся тем, что на стадии b) получения промежуточного соединения общей формулы VI металлированный трифторэпоксипропан V, необязательно в его энантиомерно чистой форме, реагирует с иминами формулы IV при низких температурах с получением эпоксидов общей формулы VI где R1, R2, R3 и R4 имеют значения, определенные в п.1, и необязательно в дальнейшем осуществление разделения диастереоизомеров. 10. Способ по п.7, отличающийся тем, что на стадии с) получения соединения общей формулы I эпоксиды общей формулы VI, необязательно в их энантиомерно чистой форме, реагируют с соединениями общей формулы R5-Met, при этом Met означает щелочные металлы, щелочно-земельные металлы,алюминий, медь, кремний или олово, и R5 имеет определения, как определено в п.1, в присутствии кислот Льюиса, или раскрываются непосредственно цианидами, аминами, спиртами, тиоспиртами, галогенидами и/или водой в присутствии оснований или сильных протонных кислот с получением соединения общей формулы I где R1, R2, R3, R4 и R5 имеют значения, определенные в п.1, и необязательно в дальнейшем осуществление разделения диастереоизомеров. 11. Соединения общей формулы VI по п.9 в виде рацемической смеси или как энантиомерно чистый изомер. 12. Способ получения соединений общей формулы I по п.1, где осуществляются следующие стадии: стадия а) где все остатки имеют значения, как определено в п.1, Met означает щелочные металлы, щелочноземельные металлы, алюминий, медь, кремний или олово и R означает C1-C4-алкил. 13. Способ по п.12, отличающийся тем, что на стадии с) получения соединения общей формулы I кетоны типа (IX), необязательно в их энантиомерно чистой форме, могут конденсироваться с замещенными аминохинолонами типа (III), образуя имины, и в дальнейшем или в то же самое время восстанавливаться с получением соединения формулы I где R1, R2, R3, R4 и R5 имеют значения, как указано в п.1, и R, как определено в п.8, и необязательно в дальнейшем осуществление разделения диастереоизомеров. 14. Комбинация соединения формулы (I) или его фармацевтически приемлемой соли и одного и более агента, выбранного из списка, включающего ингибитор PDE4, включая ингибитор изоформы PDE4D; селективный .sub2. адреномиметик, такой как метапротеренол, изопротеренол, изопреналин, альбутерол, сальбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерол, мезилат, пирбутерол или индакатерол; антагонист мускаринового рецептора (например, M1, M2 или М 3 антагонист, такой как селективный М 3 антагонист), такой как ипратропия бромид, тиотропия бромид, окситропия бромид, пирензепин или телензепин; модулятор функции хемокинового рецептора (такой как антагонист CCR1 рецептора) или ингибитор функции киназы р 38.
МПК / Метки
МПК: C07C 49/233, C07D 405/12, C07D 303/32, A61P 29/00, A61K 31/4704, C07D 215/38
Метки: средств, применения, качестве, противовоспалительных, способ, получения, 5-[(3,3,3-трифтор-2-гидрокси-1-арилпропил)амино]-1h-хинолин-2-оны
Код ссылки
<a href="https://eas.patents.su/22-17459-5-333-triftor-2-gidroksi-1-arilpropilamino-1h-hinolin-2-ony-sposob-ih-polucheniya-i-ih-primeneniya-v-kachestve-protivovospalitelnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">5-[(3,3,3-трифтор-2-гидрокси-1-арилпропил)амино]-1h-хинолин-2-оны, способ их получения и их применения в качестве противовоспалительных средств</a>
Предыдущий патент: Контейнер с деформируемым внутренним контейнером и способ его изготовления
Следующий патент: Способ скважинной комплексной разработки металлоугольного пласта
Случайный патент: Фармацевтически активные производные пирролидина












