Штаммы дрожжей, лишенные ацетил-соа-прегненолон-ацетилтрансферазной активности, и способы окисления стеринов и стероидов при их использовании
Формула / Реферат
1. Штамм дрожжей, лишенный ацетил-CoA-прегненолон-ацетилтрансферазной активности (APAT) за счет модификации гена ATF2 или YGR 177c, или его гомолога, что приводит к стабилизации 3b-гидроксистероидов.
2. Штамм по п.1, представляющий собой S.cerevisiae.
3. Штамм по п.2, в котором ген ATF2 модифицирован путем вставки последовательности ДНК, включающей по крайней мере один нуклеотид.
4. Штамм по п.3, в котором ген ATF2 модифицирован путем вставки селекционного гена URA3.
5. Штамм по п.3, в котором ген ATF2 модифицирован путем вставки блока экспрессии TEF1prom/PGKterm.
6. Штамм по п.4, представляющий собой штамм S.cerevisiae TGY156.
7. Штамм по п.4, представляющий собой штамм S.cerevisiae TGY158.
8. Штамм по п.5, представляющий собой штамм S. cerevisiae TGY186.
9. Штамм по любому из пп.1-5 формулы, дополнительно экспрессирующий по крайней мере один из ферментов пути биосинтеза гидрокортизона из холестерина, выбираемый из группы, включающей
фермент расщепления боковой цепи холестерина (P450SCC);
3b-гидрокси-дельта5-стероид-дегидрогеназу/дельта5-дельта4-стероид-изомеразу (3b-HSD); и
17a-стероид-гидроксилазу (P45017a).
10. Штамм по п.9, дополнительно экспрессирующий 3b-HSD.
11. Штамм S.cerevisiae по пп.4 и 10, представляющий собой штамм S.cerevisiae TGY158/pTGY10862.
12. Штамм по п.9, дополнительно экспрессирующий P45017a.
13. Штамм по пп.5 и 12, представляющий собой штамм S.cerevisiae TGY186/pTG10435.
14. Штамм по п.9, дополнительно экспрессирующий 3b -HSD и P45017a.
15. Штамм по пп.5 и 14, представляющий собой штамм S.cerevisiae TGY186/pTG10417.
16. Способ получения окисленного стерина, согласно которому культивируют трансформированный штамм дрожжей по любому из пп.9-15 и выделяют окисленный эндогенный стерин.
17. Способ получения окисленного стерина или стероида, согласно которому культивируют трансформированный штамм дрожжей по любому из пп.9-15, который инкубируют с экзогенным стерином или стероидом и выделяют полученное окисленное соединение.
18. Способ по п.17, согласно которому субстратом является 3b-гидроксистероид и в котором используют трансформированный штамм дрожжей по п.10 и выделяют полученный 3-оксо-дельта4-стероид.
19. Способ по п.18, согласно которому 3b-гидроксистероид выбирают среди прегненолона или 17a-гидроксипрегненолона.
20. Способ по п.17, согласно которому субстратом является стероид и в котором используют трансформированный штамм дрожжей по п.12 и выделяют полученный 17a-гидроксилированный стероид.
21. Способ по п.20, согласно которому стероидным субстратом является прегненолон или прогестерон.
22. Способ по п.17, согласно которому субстратом является 3b -гидроксистероид и в котором используют трансформированный штамм дрожжей по п.14 и выделяют полученный 17a-гидроксилированный 3-оксо-дельта4-стероид.
23. Способ по п.22, согласно которому стероидным субстратом является прегненолон.
Текст
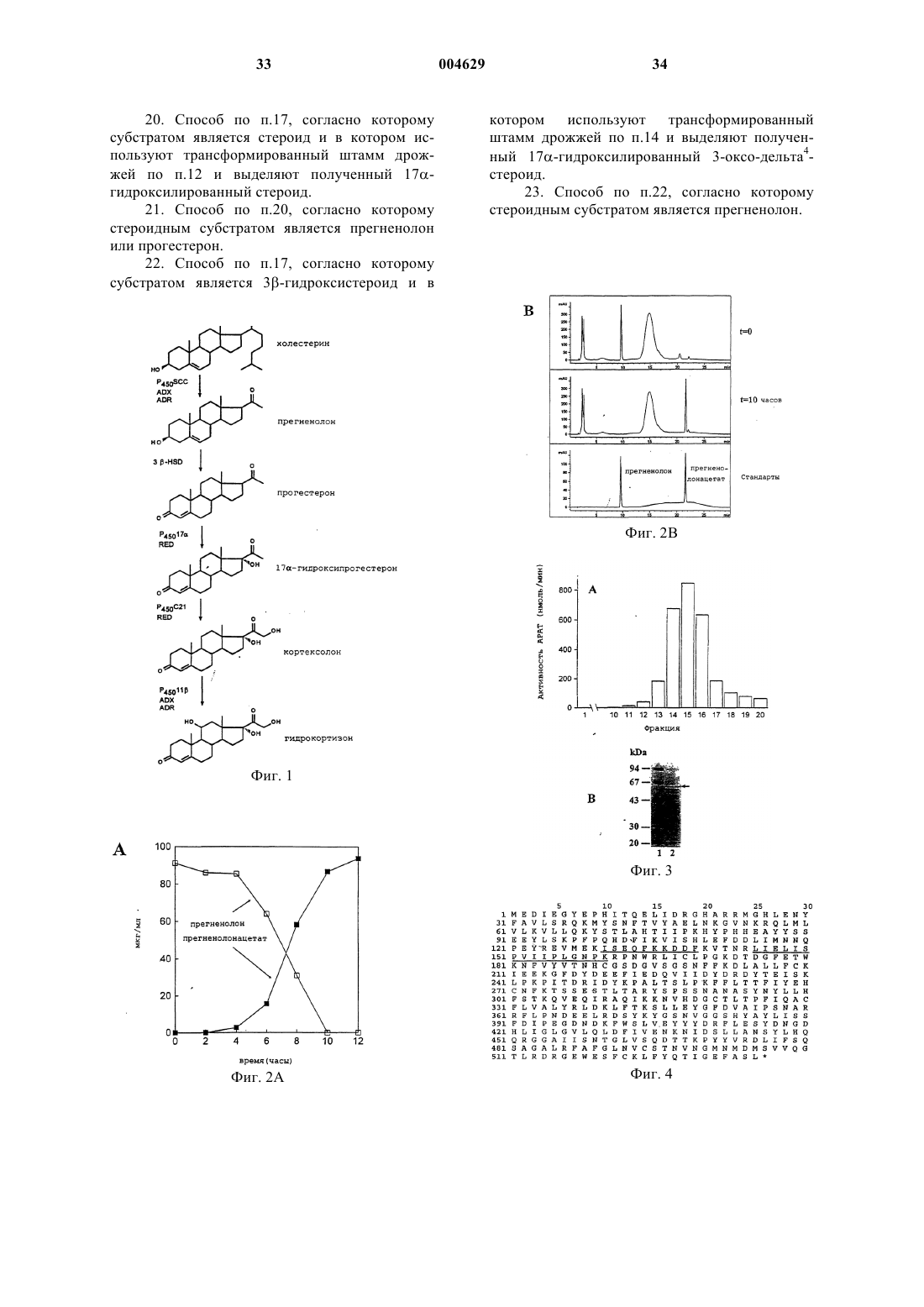
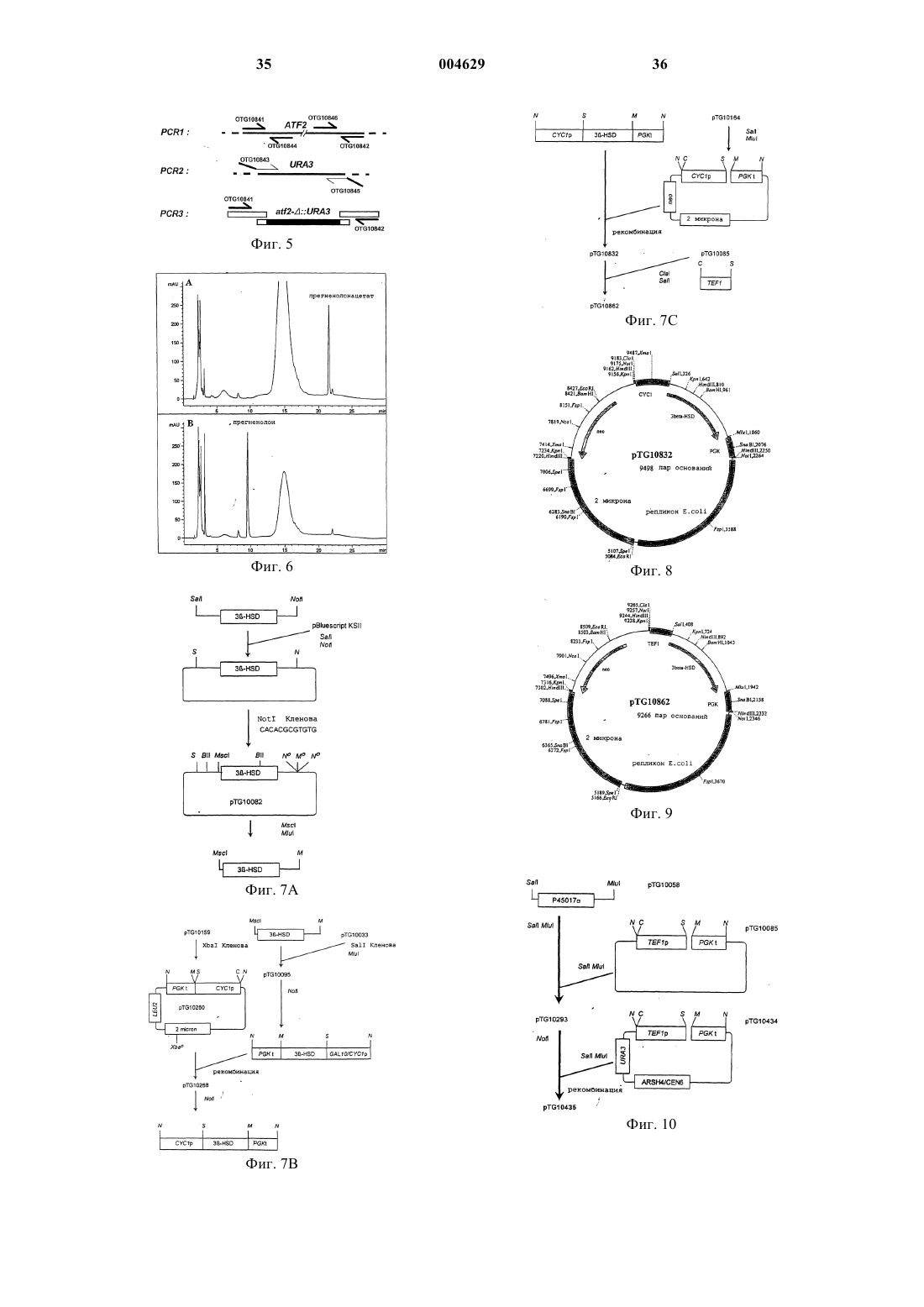
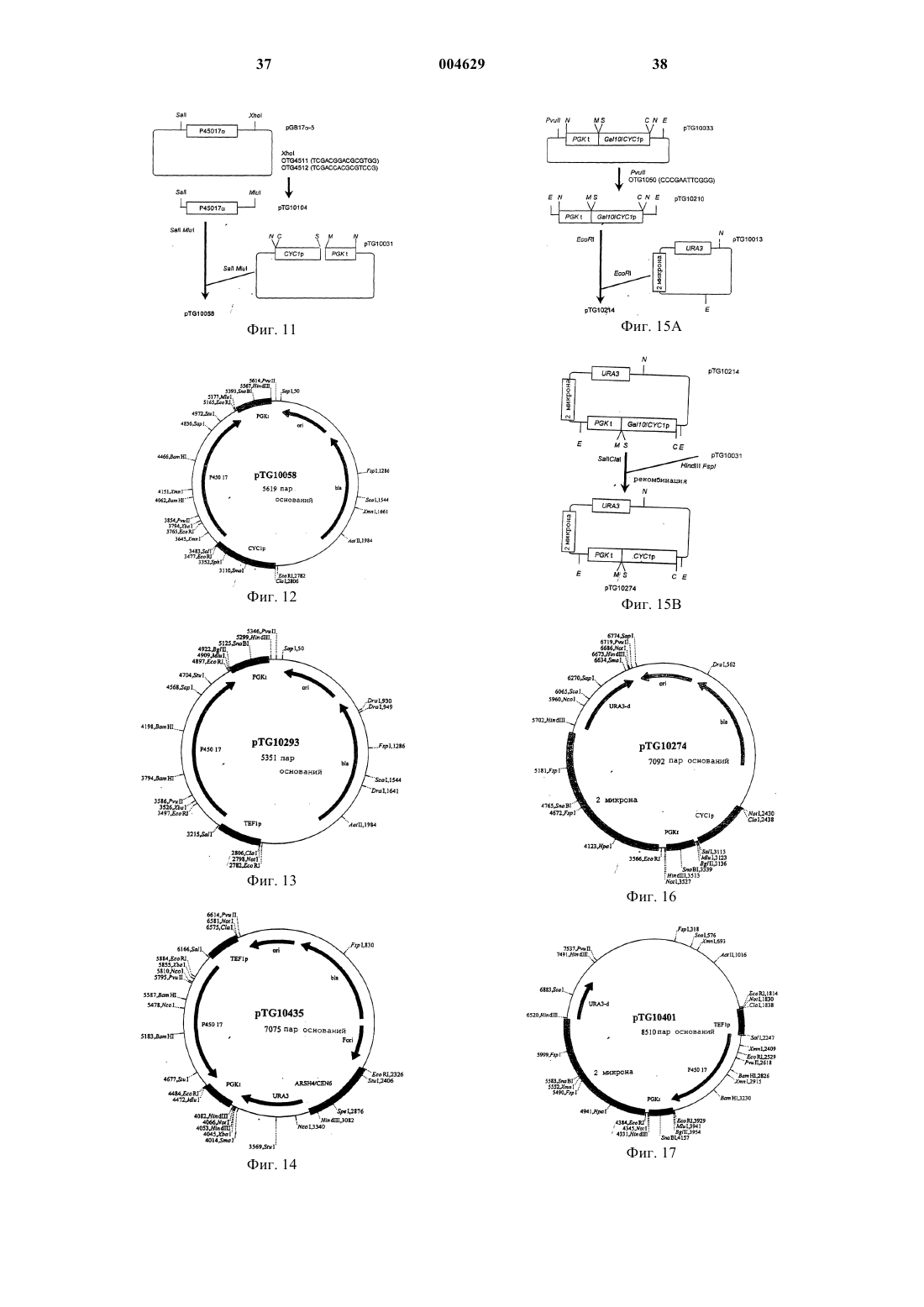
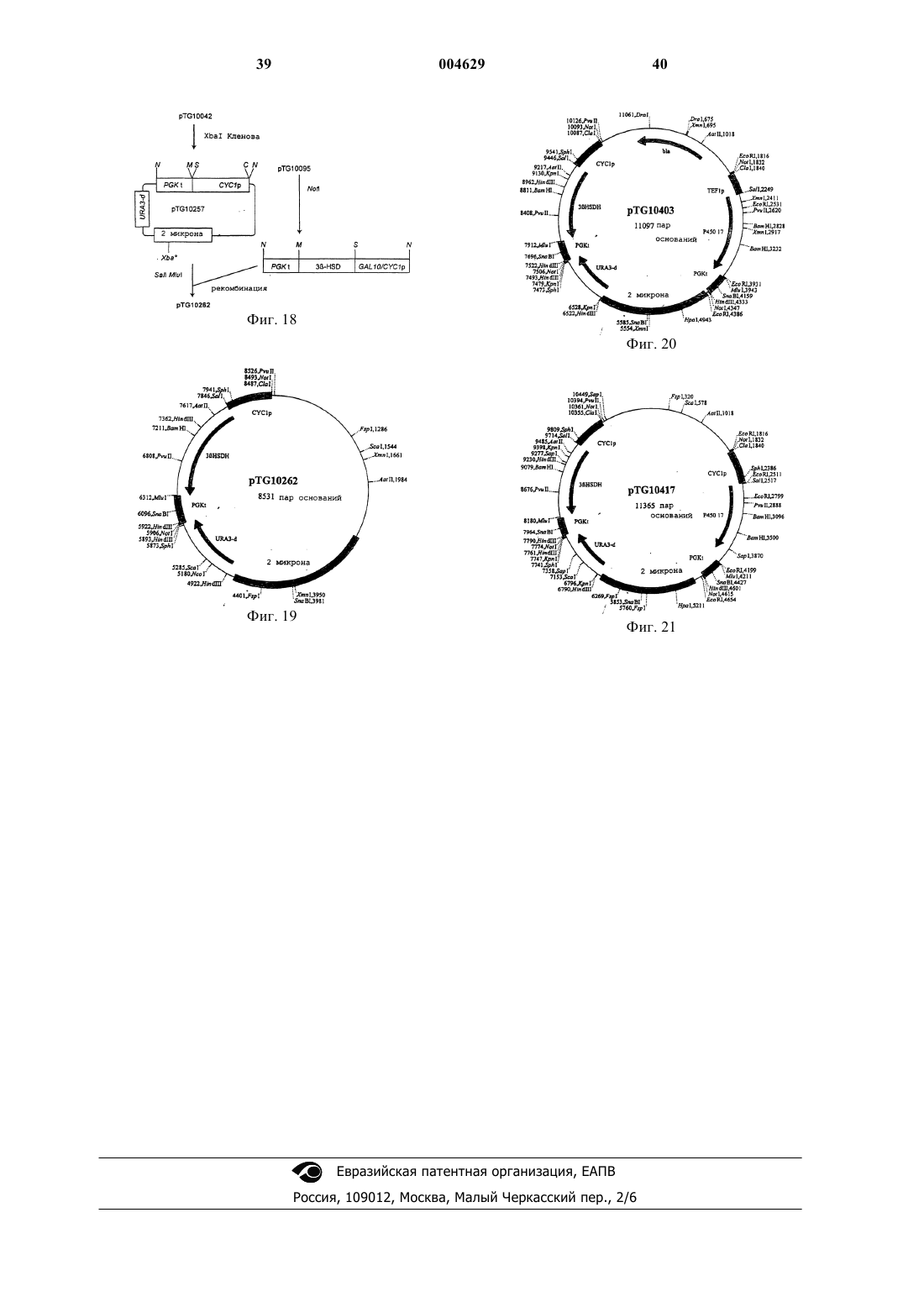
1 Образование 3-оксо-дельта 4-стероидов из 3-гидрокси-дельта 5-предшественников в биосинтезе всех классов стероидных гормонов у млекопитающих катализируется ферментативной системой 3-гидрокси-дельта 5-стероиддегидрогеназа (ЕС 1.1.1.145) и дельта 5-дельта 4 стероид-изомераза (ЕС 5.3.3.1), называемой 3HSD. 3-HSD катализирует, например, трансформацию прегненолона в прогестерон, 17 гидроксипрегненолона в 17-гидроксипрогестерон, дегидроэпиандростерона в дельта 4 андростендион или 5-андростен-3-17-диола в тестостерон (Simard и др., 1996). Следовательно, 3-HSD представляет собой один из ключевых ферментов пути биосинтеза гидрокортизона из холестерина в коре надпочечников млекопитающих (фиг. 1). Использование рекомбинантных микроорганизмов, в частности, трансформированных дрожжей, позволяющих осуществлять гетерологичную экспрессию одного или нескольких ферментов млекопитающих этого пути биосинтеза для продуцирования гидрокортизона или промежуточных продуктов этого биосинтеза,описывается, например, в заявке на европейский патент 340878, в патенте США 5137822, Dumas и др., 1994, и Cauet и др., 1994. В случае экспрессии функциональной системы 3-HSD в дрожжах, трансформированные клетки дрожжей не превращают полностью 3 гидроксистероиды в соответствующие 3-оксостероиды, например прегненолон в прогестерон,но аккумулируют соединение, обнаруживаемое также в случае клеток нетрансформированных дрожжей. Идентификация аккумулированного соединения со сложным 3-уксусным эфиром исходного стероида и характеристика фермента,обладающего ацилтрансферазной активностью и ответственного за эту этерификацию (далее обозначается АРАТ: ацетил-кофермент-Апрегненолонацетилтрансфераза) описываются в настоящей заявке. С другой стороны, аккумуляция прегненолонацетата трансформированным штаммом дрожжей, продуцирующим прегненолон, описывается в заявке на европейский патент 727489. Эти данные позволяют считать,что осуществляемая дрожжами этерификация 3-гидроксистероидов является нежелательной,так как она ответственна за вторичные реакции и побочные продукты, приводящие к снижению выхода аккумулируемых 3-гидроксистероидов,например, прегненолона, или к снижению выхода от биоконверсии 3-гидрокси-дельта 5 стероидов в 3-оксо-дельта 4-стероиды, особенно при продуцировании прогестерона или 17 гидроксипрогестерона, что приводит к уменьшению дальнейшей продукции гидрокортизона уже описанным путем биосинтеза. В связи с полученными вышеуказанными результатами, настоящее изобретение относится к конструированию штаммов дрожжей, лишен 004629 2 ных нежелательной активности АРАТ, путем изменения гена, кодирующего эту активность,что приводит к стабилизации 3-гидроксистероидов в их присутствии. Эти штаммы, следовательно, используются как исходные штаммы для конструирования рекомбинантных штаммов, способных трансформировать 3 гидроксистероиды в последующие продукты с улучшенным выходом. Изобретение также относится к конструированию штаммов дрожжей, лишенных активности АРАТ, путем изменения гена, кодирующего эту активность, и либо экспрессирующих 3-HSD или цито-хром Р 45017, либо коэкспрессирующих 3-HSD и цитохром Р 45017 пути биосинтеза гидрокортизона из холестерина. Штаммы, экспрессирующие, например, 3-HSD,позволяют улучшать выход от биоконверсии 3 гидрокси-дельта 5-стероидов в 3-оксо-дельта 4 стероиды и, следовательно, используются в усовершенствованных способах получения гидрокортизона или промежуточных продуктов в дрожжах. Таким образом, объектом настоящего изобретения является модифицированный штамм дрожжей, лишенный ацетил-СоА-прегненолонацетилтрансферазной активности (АРАТ) за счет изменения гена, кодирующего эту активность, что приводит к стабилизации 3 гидроксистероидов. Изменение кодирующего активность АРАТ гена можно осуществлять, например, путем вставки, делеции или замены последовательности ДНК в функциональных элементах гена, например, промоторе или последовательности, кодирующей протеин с активностью АРАТ. Затем может быть осуществлена интеграция измененной таким образом последовательности ДНК в дрожжевой штамм-хозяин,например, методом гомологичной рекомбинации, что приводит к генерации хромосомных мутантов дрожжей, соответствующих модифицированным штаммам согласно изобретению, в которых исчезновение активности АРАТ и стабилизация 3-гидроксистероидов выявляются,например, путем культивирования клеток в присутствии прегненолона и определения содержания прегненолона в зависимости от времени согласно рабочим условиям, описанным далее в экспериментальной части. В качестве используемых согласно изобретению дрожжевых штаммов-хозяев можно, в частности, назвать штаммы Saccharomyces, такие как S.cerevisiae, штаммы Candida, такие какC.maltosa, штаммы Kluyveromyces, такие как,K.lactis, или штаммы Pichia, такие как P.pastoris. Объектом изобретения в частности является вышеуказанный модифицированный штамм дрожжей, в котором измененным геном является ген ATF2 S.cerevisiae или его гомолог.S.cerevisiae, идентифицированный в геноме дрожжей под локусом ATF2 или YGR177c базы данных геномов Saccharomyces (SGD);Saccharomyces/), открытая рамка считывания которого, обозначаемая YGR177c, выражается в виде аминокислотной последовательности в банке данных Mips, находящейся под присвоенным номером по каталогу S64491 (Hebling U.,Hofmann В. и Delius Н. (май 1996), и последовательность которого представлена на фиг. 4. Этот ген кодирует протеин с активностью АРАТ, как это показано далее в экспериментальной части. Под геном, гомологичным гену ATF2, понимают ген, который кодирует протеин, обладающий активностью АРАТ и имеющий идентичность последовательности примерно на 60% и более с последовательностью протеинаYGR177c. В особенности, объектом изобретения является вышеуказанный модифицированный штамм дрожжей, в котором измененным геном является ген ATF2 S.cerevisiae и который далее называется мутантным штаммом atf2. Особенно объектом изобретения является вышеуказанный модифицированный штамм дрожжей, в котором ген ATF2 изменен путем вставки последовательности ДНК, включающей по крайней мере один нуклеотид. Последовательность ДНК, которая встроена в ген ATF2 так, чтобы исчезла активность АРАТ, может представлять собой, например,ауксотрофный селекционный ген, дополняющий питательную потребность штамма-хозяина, такой, как ген URA3, ген LEU2, ген TRP1, генHIS3 или ген ADE2, например, доминантный селекционный ген, такой как ген устойчивости к антибиотику, как G418, флеомицин или гигромицин В, или, например, репортерный ген, такой как ген GAL. Последовательность ДНК,которую встраивают в ген ATF2, может представлять собой также блок экспрессии дрожжей, образованный промотором и терминальной последовательностью транскрипции, например, промотором дрожжей, таким как PGK, TDH3, CYC1 илиTEF1, например, терминальной последовательностью дрожжей, такой как CYC1, TDH3, TEF1 или PGK. Блок экспрессии может представлять собой сочетание вышеуказанных элементов,например, как блок TEF1prom/PGKterm. Объектом изобретения более конкретно является вышеуказанный модифицированный штамм дрожжей, в котором ген ATF2 изменен путем вставки селекционного гена URA3 или блока экспрессии TEF1prom/PGKterm. Объектом изобретения, в частности, является вышеуказанный модифицированный штамм дрожжей, в котором ген ATF2 изменен путем вставки селекционного гена URA3. 4 Мутантные штаммы atf2 согласно изобретению, лишенные активности АРАТ и в которые встроен ген URA3, называемые далее atf2URA3, также могут быть селекционированы путем прототрофии с урацилом. В особенности, объектом изобретения являются модифицированные штаммыS.cerevisiae, называемые TGY156 и TGY158,конструкция которых детально приводится далее в экспериментальной части. Частным объектом изобретения также является вышеуказанный модифицированный штамм дрожжей, в котором ген ATF2 изменен путем вставки блока экспрессии TEF1prom/PGKterm. Мутантные штаммы atf2 согласно изобретению, лишенные активности АРАТ и в которые встроен блок экспрессии TEF1prom/PGKterm, могут быть селекционированы в направлении отсутствия функционального генаURA3, замещенного блоком экспрессии, по их устойчивости к 5-фтороротовой кислоте. В особенности, объектом изобретения является модифицированный штамм S.cerevisiae,называемый TGY186, подробное конструирование которого представлено далее в экспериментальной части. Объектом изобретения также является трансформированный штамм дрожжей, лишенный ацетил-СоА-прегненолонацетилтрансферазной активности (АРАТ) за счет изменения гена, кодирующего эту активность, и экспрессирующий по крайней мере один из ферментов млекопитающих пути биосинтеза гидрокортизона из холестерина, выбираемый среди следующих ферментов: фермент расщепления боковой цепи холестерина (P450SCC) 3-гидрокси-дельта 5-стероид-дегидрогеназа/дельта 5-дельта 4-стероид-изомераза(3HSD); и 17-стероид-гидроксилаза (P45017). Трансформированные штаммы дрожжей согласно изобретению можно получить, например, путем трансформации мутантных штаммовatf2 согласно изобретению с помощью известных способов, например, путем трансформации с помощью вектора экспрессии P450SCC, a такжеADX и ADR, вектора экспрессии 3-HSD или вектора экспрессии Р 45017. Мутантные штаммы atf2 также могут быть, в случае необходимости, котрансформированы, например, с помощью вектора экспрессии 3-HSD и вектора экспрессии Р 45017, или могут быть трансформированы с помощью вектора коэкспрессии 3-HSD и Р 45017 и могут быть использованы, например,в способе биоконверсии прегненолона в 17 гидроксипрогестерон. Сконструированные векторы экспрессииP450SCC, а также ADX и ADR, 3-HSD или Р 45017 бычьего или человеческого происхож 5 дения в штаммах дрожжей описываются, например, Dumas и др., 1994, в заявке на европейский патент 340878 или в патенте США 5137822. Изобретение относится, в частности, к вышеуказанному трансформированному штамму дрожжей, в котором измененным геном является ген ATF2 S.cerevisiae или его гомолог. В особенности объектом изобретения является вышеуказанный трансформированный штамм дрожжей, в котором измененный ген представляет собой ген ATF2 S.cerevisiae и который соответствует трансформированному штамму atf2. В особенности, объектом изобретения является вышеуказанный трансформированный штамм дрожжей, в котором ген ATF2 изменен за счет вставки последовательности ДНК, включающей по крайней мере один нуклеотид, и,конкретно, объектом является трансформированный штамм дрожжей, в котором ген ATF2 изменен за счет вставки селекционного генаURA3 и который соответствует трансформированному штамму atf2-URA3. Изменение гена с целью ликвидации активности АРАТ, ген ATF2 или его гомолог, а также штаммы-хозяева имеют вышеуказанные значения. Изобретение преимущественно относится к вышеуказанному трансформированному штамму дрожжей atf2-URA3, экспрессирующему 3-HSD, и в особенности к трансформированному штамму S.cerevisiae, называемомуTGY158/pTG10862, подробное конструирование которого описывается далее в экспериментальной части. Объектом изобретения также в особенности является вышеуказанный трансформированный штамм дрожжей, в котором ген ATF2 изменен за счет вставки блока экспрессииTEF1prom/PGKterm и который соответствует трансформированному штаммуatf2TEF1prom/ PGKterm Изобретение также преимущественно относится к вышеуказанному трансформированному штамму atf2- TEF1prom/PGKterm, экспрессирующему P45017, в особенности к трансформированному штамму S.cerevisiae, называемомуTGY186/pTG10435. Изобретение относится в частности к вышеуказанному трансформированному штамму дрожжей atf2- TEF1prom/PGKterm, коэкспрессирующему 3-HSD и P45017, и преимущественно к трансформированному штаммуS.cerevisiae, называемому TGY186/pTG10417. Объектом изобретения также является способ окисления ин виво субстрата, выбираемого среди эндогенного стерина, экзогенного стерина или экзогенного стероида, согласно которому используют вышеуказанный трансформированный штамм дрожжей, который либо культивируют индивидуально, когда штамм 6 генерирует эндогенный стерин, либо инкубируют с экзогенным стерином или стероидом, и, в случае необходимости, выделяют полученное окисленное соединение. Под эндогенным стерином понимают стерин, аккумулируемый в штамме дрожжей и который представляет собой субстрат фермента расщепления боковой цепи (P450SCC), когда дрожжи, после трансформации, например, с помощью вектора экспрессии P450SCC, ADX иADR, культивируют в отсутствие экзогенного стерина. Эндогенными стеринами, используемыми для осуществления способа согласно изобретению, могут быть, например, эргоста-5-ен 3-ол, эргоста-5,24 (28)-диен-3-ол или эргоста 5,22-диен-3-ол. В заявке на европейский патент 727489 описывается аккумуляция таких стеролов в штамме дрожжей и расщепление их боковой цепи в культуре штамма после трансформации с помощью вектора экспрессии P450SCC,ADX и ADR. Такой штамм дрожжей, который также обладает активностью АРАТ, может быть предварительно модифицирован для получения мутантного штамма atf2 согласно изобретению,затем его можно трансформировать с помощью вектора экспрессии P450SCC, ADX и ADR для получения трансформированного мутантного штамма atf2 согласно изобретению. Под экзогенным стерином понимают стерин, который представляет собой субстрат фермента расщепления P450SCC, получаемый путем инкубации со штаммом дрожжей, трансформированным с помощью вектора экспрессииP450SCC, ADX и ADR, например, холестерин или ситостерин. Таким штаммом может быть,например, мутантный штамм atf2, трансформированный с помощью вектора экспрессииP450SCC, ADX и ADR. 3-Гидроксистероид, полученный путем расщепления боковой цепи эндогенного или экзогенного стерина, используемого в качестве субстрата, находится полностью в свободной форме, то есть не сопровождается соответствующим сложным 3-уксусным эфиром, в культурах трансформированных штаммов atf2, экспрессирующих P450SCC, ADX и ADR. Под стероидом понимают стероид, который представляет собой субстрат фермента 3HSD при инкубации со штаммом дрожжей,трансформированным, например, с помощью вектора экспрессии 3-HSD, как прегненолон,17-гидроксипрегненолон или дегидроэпиандростерон, или стероид, который представляет собой субстрат фермента Р 45017 при инкубации со штаммом дрожжей, трансформированным, например, с помощью вектора экспрессии Р 45017, как прогестерон или прегненолон. Таким штаммом может быть, например, мутантный штамм atf2, трансформированный с помощью вектора экспрессии 3-HSD или с помо 7 щью вектора экспрессии Р 45017 согласно изобретению. Объектом изобретения в особенности является вышеуказанный способ окисления ин виво, согласно которому субстратом является 3-гидроксистероид и в котором используют трансформированный штамм дрожжей atf2URA3, экспрессирующий 3-HSD, и в случае необходимости, выделяют полученный 3-оксодельта 4-стероид, и особенно объектом изобретения является способ, согласно которому 3 гидроксистероид выбирают из прегненолона или 17-гидроксипрегненолона. Используемый в качестве субстрата 3 гидроксистероид является стабильным, когда его инкубируют со штаммом atf2-URA3 согласно изобретению, трансформированным с помощью вектора экспрессии 3-HSD. Таким образом, изобретение относится к улучшенному способу получения 3-оксодельта 4-стероида в дрожжах, поскольку все количество 3-гидроксисубстрата может быть окислено до 3-оксо-дельта 4-стероида, как это показано дальше в экспериментальной части. Также в особенности объектом изобретения является вышеуказанный способ окисления ин виво, согласно которому субстратом является стероид и в котором используют трансформированный штамм дрожжей atf2- TEF1prom/PGKterm, экспрессирующий Р 45017, и, в случае необходимости, выделяют полученный 17 гидроксилированный стероид, и особенно объектом изобретения является способ, согласно которому стероидным субстратом является прегненолон или прогестерон. Используемый в качестве субстрата прегненолон является стабильным, когда его инкубируют со штаммом atf2-А TEF1prom/PGKterm,трансформированным с помощью вектора экспрессии Р 45017. Следовательно, изобретение также относится к улучшенному способу получения 17 гидроксистероидов из 3-гидроксистероидов,поскольку все количество 3-гидроксисубстрата может быть 17-гидроксилировано. Также в особенности объектом изобретения является вышеуказанный способ окисления ин виво, согласно которому субстратом является 3-гидроксистероид и в котором используют трансформированный штамм дрожжей atf2TEF1prom/PGKterm, коэкспрессирующий 3-HSD и Р 45017, и, в случае необходимости, выделяют полученный 17-гидроксилированный 3-оксодельта 4-стероид. Особенно объектом изобретения является вышеуказанный способ, согласно которому субстратом является прегненолон. Трансформированные мутантные штаммы дрожжей atf2 и способ согласно изобретению позволяют предусматривать их предпочтительное использование для улучшенного продуци 004629 8 рования гидрокортизона или его промежуточных продуктов в дрожжах. Примеры конструирования штаммов согласно изобретению и осуществление предлагаемого в изобретении способа описываются далее в экспериментальной части. Материалы и общие методы 1. Штаммы и среды. Штаммы S. cerevisiae, используемые для осуществления изобретения, представляют собой штамм TGY73.4 (МАТа, URA3-A5, pra-1-1,prb-1-1, prcl-1, cpsl-3, his), изогенный производный Leu+ C13ABYS86, описанный Achstetter и др., 1992, и штамм Fy1679 (МАТа, URA3-52,trp1-63, leu2-1, his3-200, fen1, GAL), описанный Thierry и др., 1990. Культивирование штаммов осуществляют в полной среде YPD(Difco Laboratories), содержащей 2% глюкозы,при температуре 28 С, согласно условиям, описанным F.Sherman, 1991. Для трансформации S.cerevisiae, клеткам придают компетентность по способу с использованием ацетата лития (Ito и др., 1983). Дрожжи обычно культивируют в минимальной синтетической среде SD, содержащей 2 % глюкозы(F.Sherman, 1991) с добавкой необходимых питательных веществ в концентрации 100 мкг/мл. Штамм E.coli BJ5183 (D.Hanahan, 1983) используют для рекомбинации ин виво и штаммE.coli C600, hsdR (Hubacek и др., 1970) используют в качестве штамма-реципиента для классических реакций лигирования. 2. Манипулирование с ДНК и рекомбинация ин виво в E.coli. Используемые общие методы молекулярной биологии описываются Sambrook и др.,1989. Метод рекомбинации ин виво описывается E.Degryse, 1995, и E.Degryse, 1996. 3. Тестирование ферментной активности АРАТ. Ацетилтрансферазную активность АРАТ устанавливают путем определения включения(New England Nuclear). Реакционная среда (500 мкл) содержит [3 Н]-ацетил-СоА (20 ммоль; 25 Ки/моль) и прегненолон (30 ммоль; Sigma). Прегненолон добавляют в виде раствора в 2 мкл смеси тилоксапола (Sigma) с этанолом в соотношении 1:1 в буфер на основе фосфата калия(20 мкмоль) с рН = 7,0. После инкубации в течение 15 мин при температуре 30 С реакцию прекращают путем добавления 2 мл дихлорметана. Стероиды экстрагируют дихлорметаном,затем разделяют путем высокоэффективной жидкостной хроматографии с обращенной фазой (далее называется ВЭЖХ с обращенной фазой) в изократических условиях элюирования с помощью ацетонитрила при использовании колонки Ultrasphere ODS (Beckman) при температуре 45 С на хроматографе HP 1090 (HewlettFLO-One 500 (Packard), который позволяет определять количество образовавшегося [3 Н]ацетата прегненолона. Единицу АРАТ определяют как количество фермента, которое продуцирует 1 нмоль ацетата прегненолона в минуту при температуре 30 С в вышеуказанных условиях. 4. Определение концентрации протеина. Концентрацию протеина определяют путем использования набора набор для количественного анализа протеина (Bio-Rad) с бычьим сывороточным альбумином в качестве стандарта. На прилагаемых к данному описанию фигурах иллюстрируются некоторые аспекты изобретения. На фиг. 1 представлен путь биосинтеза гидрокортизона из холестерина у млекопитающих. Фиг. 2 А и 2 В иллюстрируют биоконверсию прегненолона в ацетат прегненолона вS.cerevisiae. Анализ осуществляется путем высокоэффективной жидкостной хроматографии с обращенной фазой при 205 нм: На фиг. 2 А представлена кинетика образования ацетата прегненолона и исчезновение прегненолона в отдельные интервалы времени в течение 12 ч инкубации. На фиг. 2 В представлен профиль стероидов во время 0 (t = 0) и 10 ч (t = 10 ч) по отношению к профилю стандартов прегненолона и ацетата прегненолона. Фиг. 3 иллюстрирует очистку АРАТ путем хроматографии на MonoP HR 5/20: на (А) представлен профиль активности АРАТ, имеющейся во фракциях 10-20; на (В) представлен анализ путем электрофореза в полиакриламидном геле с додецилсульфатом натрия очищенных и концентрированных фракций 14, 15 и 16 путем окрашивания с помощью кумасси-голубого (линия 2) в присутствии маркеров молекулярной массы(линия 1). Стрелка указывает на полосу с кажущейся молекулярной массой 62 кДа. На фиг. 4 представлена аминокислотная последовательность в виде рамки считывания протеина YGR177c. Секвенированные пептиды из очищенного и гидролизованного трипсином протеина АРАТ подчеркнуты. На фиг. 5 представлена стратегия прерывания гена ATF2 путем ассоциации с геномURA3 согласно методу двойного слияния полимеразной цепной реакции (ПЦР). Пустые бруски и заполненные бруски означают, соответственно, последовательности ATF2 и URA3. Фиг. 6 иллюстрирует влияние прерывания гена ATF2 в S.cerevisiae на ацетилирование прегненолона. Присутствие прегненолонацетата выявляется с помощью высокоэффективной жидкостной хроматографии с обращенной фазой при 205 нм из шестнадцатичасовых культур родительского штамма TGY73,4 (А) или мутантного штамма TGY158(В). 10 На фиг. 7 А, 7 В и 7 С представлена схема конструирования плазмид экспрессии человеческого 3-HSD в дрожжах pTG10832 иpTG10862. На фиг. 7 А описывается получение фрагмента MscI-MluI, содержащего последовательность, кодирующую человеческий 3-HSD. На фиг. 7 В представлено получение фрагментаNotI, содержащего блок экспрессии CYClp/3HSD/PGKt. На фиг. 7 С описывается получение плазмиды pTG10832 и плазмиды pTG10862. На фиг. 8 представлена рестрикционная карта плазмиды PTG10832. На фиг. 9 представлена рестрикционная карта плазмиды PTG10862. На фиг. 10 представлена схема конструирования плазмиды экспрессии pTG10435. На фиг. 11 представлена схема конструирования плазмиды PTG10058. На фиг. 12 представлена рестрикционная карта плазмиды PTG10058. На фиг. 13 представлена рестрикционная карта плазмиды PTG10293. На фиг. 14 представлена рестрикционная карта плазмиды PTG10435. На фиг. 15 А и 15 В представлена схема конструирования плазмиды pTG10274: на фиг. 15 А описывается получение плазмидыpTG10214; на фиг. 15 В описывается получение плазмиды PTG10274. На фиг. 16 представлена рестрикционная карта плазмиды PTG10274. На фиг. 17 представлена рестрикционная карта плазмиды PTG10401. На фиг. 18 представлена схема конструирования вектора экспрессии pTG10262. На фиг. 19 представлена рестрикционная карта плазмиды PTG10262. На фиг. 20 представлена рестрикционная карта плазмиды PTG10403. На фиг. 21 представлена рестрикционная карта плазмиды PTG10417.XbaI/ E=EcoRI). Пример 1. Идентификация активности АРАТ дрожжей. А-Ацетилирование ин виво прегненолона с помощью дрожжей. Штамм TGY73.4 культивируют при температуре 28 С в 10 мл среды YPD (Difco), инокулированной из расчета А 600=0,1, исходя из двадцатичетырехчасовой исходной культуры, и в которые добавляют 100 мкл раствора прегненолона с концентрацией 10 мг/мл в смеси тергитола (Sigma) с этанолом в соотношении 1:1. Образовавшиеся стероиды идентифицируют при использовании аликвот объемом 250 мкл бульона,отобранных в различные интервалы времени в течение 10 ч. После экстракции с помощью 2 мл дихлорметана органические фазы выпаривают в 11 атмосфере азота, затем полученные остатки снова растворяют в ацетонитриле. Стероиды анализируют с помощью ВЭЖХ с обращенной фазой на колонке Ul-trasphere ODS (Beckman),используя последовательно в качестве элюирующего средства: 60%-ный раствор ацетонитрила в воде в течение 10 мин, затем 60-80%-ный раствор ацетонитрила в воде в течение 5 мин,после этого 80%-ный раствор ацетонитрила в воде в течение 5 мин, с расходом 1 мл/мин, при температуре 45 С и с детекцией при 205 нм. Полученные хроматограммы (фиг. 2 В) показывают, что прегненолон метаболизирован в более аполярный продукт, который имеет время удерживания, идентичное таковому стандартного прегненолонацетата. На фиг. 2 А показано,что прегненолон быстро превращается дрожжами в его метаболит. После щелочной обработки (6%-ный раствор КОН в метаноле) обнаруженный метаболит высвобождает продукт с временем удерживания, идентичным таковому прегненолона. Идентификацию метаболита с прегненолонацетатом затем подтверждают методом массспектрометрии. Б - Очистка фермента, обладающего активностью АРАТ. Штамм TGY73.4 культивируют в ферментере емкостью 10 л в среде Кэппели (Fiechter и др., 1981), дополненной глюкозой в количестве 160 г/л, при температуре 30 С вплоть до А 600=30. Клетки отделяют путем центрифугирования, промывают водой, затем снова суспендируют в 4 л буфера на основе 20 ммоль ТрисHCl, рН =8,0, при температуре 4 С (буфер А),содержащего 1 ммоль фенилметилсульфонилфторида. Клетки подвергают дроблению в гомогенизаторе Manton Gaulin под давлением 69 бар. Полученный клеточный лизат центрифугируют с ускорением 12000 g в течение 15 мин при температуре 4 С, затем к супернатанту добавляют хлорид цинка до конечной концентрации 40 ммоль. Значение рН доводят до 5,5 с помощью 1 н. соляной кислоты и преципитацию осуществляют в течение 30 мин при температуре 4 С. После центрифугирования с ускорением 10000 g в течение 10 мин при температуре 4 С, выделенный преципитат снова суспендируют в 3 л буфера А, содержащего 100 ммоль этилендиаминтетрауксусной кислоты (ЭДТУ) и 1 ммоль фенилметилсульфонилфторида. После удаления ЭДТУ путем диафильтрации через фильтрующий элемент Y10S10 (Amicon) против 30 л буфера А, ретентат загружают со скоростью 35 мл/мин и при температуре 4 С в колонку объемом 1,5 л с диэтиламиноэтилсефацелем (Pharmacia), предварительно уравновешенную буфером А. После промывки колонки буфером А,затем буфером А, содержащим 0,15 моль хлорида натрия, фермент с активностью АРАТ элюируют с помощью буфера А, содержащего 0,4 моль хлорида натрия. Фракции диэтилами 004629 12 ноэтилсефацеля, содержащие фермент с активностью АРАТ, которую определяют как указано выше в разделе Материалы и общие методы,объединяют, дополняют хлоридом натрия до конечной концентрации 2 моль, затем со скоростью 15 мл/мин и при температуре 4 С загружают в колонку объемом 500 мл с фенилсефарозой (Pharmacia), предварительно уравновешенную буфером А, содержащим 2 моль хлорида натрия. После промывки колонки с помощью буфера А, содержащего 0,5 моль хлорида натрия, фермент с активностью АРАТ элюируют с помощью 1,5 л линейного градиента холята натрия, изменяющегося от 0 до 1%, в буфере А. Фракции, содержащие фермент с активностью АРАТ, объединяют, затем концентрируют путем ультрафильтрации через мембрану YM10 (Amicon), затем хранят при температуре -80 С вплоть до использования. Всю совокупность операций способа повторяют один раз, чтобы получить материал в количестве, достаточном для продолжения очистки. Очищенный материал из двух вышеуказанных приготовлений размораживают, затем со скоростью 4 мл/мин и при температуре 4 С загружают в колонку объемом 100 мл с Qсефарозой Fast Flow (Pharmacia), предварительно уравновешенную буфером А. После промывки колонки тем же самым буфером, фермент с активностью АРАТ элюируют с помощью 500 мл линейного градиента хлорида натрия, изменяющегося от 0 до 1 моль, в том же самом буфере. Фракции Q-сефарозы, содержащие фермент с активностью АРАТ, объединяют, затем со скоростью 2,5 мл/мин и при температуре 4 С загружают непосредственно в колонку объемом 7 мл с холятом натрия, иммобилизированным на шариках сефарозы (Pharmacia), предварительно уравновешенной буфером А, содержащим 0,5 моль хлорида натрия. После промывки колонки тем же самым буфером, фермент с активностью АРАТ элюируют с помощью 100 мл линейного градиента холята натрия, изменяющегося от 0 до 1%, в том же самом буфере. Фракции, содержащие фермент с активностью АРАТ, объединяют, концентрируют путем ультрафильтрации через мембрану YM10 (Amicon) вплоть до концентрации протеина 1,8 мг/мл, затем хранят при температуре -80 С. Фермент, обладающий активностью АРАТ,таким образом очищают примерно 500 раз на основании удельной активности и с выходом около 16%, как показано в следующей таблице 1: Стадия Супернатант,12000 g Преципитация с цинком Таблица 1 Активн. ПроУд. Очи- Выход АРАТ теин активн. стка Половину вышеполученного полуочищенного материала (около 6 мг протеина) затем размораживают, после чего добавляют ПЭГ 4000 (Prolabo) до конечной концентрации 20%(масса/объем) для удаления холята и хлорида натрия. После перемешивания в течение 30 мин при температуре 4 С преципитат собирают путем центрифугирования с ускорением 12000 g в течение 30 мин при температуре 4 С, затем снова растворяют в 4 мл буфера А. Таким образом полученный раствор затем со скоростью 1 мл/мин загружают в колонку MonoP HR5/20(Pharmacia), предварительно уравновешенную 25 мМ бис-Трис-буфером, рН = 6,3. Фермент с активностью АРАТ элюируют с помощью буфера Polybuffer 74, рН = 4,0 (Pharmacia). Фракции по 1 мл собирают, каждую, в присутствии 50 мкл 2 М буфера Трис-НСl, рН = 8,0, чтобы ограничить инактивацию фермента при кислом значении рН. Фракции 14, 15 и 16 (фиг. 3(А,содержащие фермент с более высокой активностью АРАТ, которую определяют как указано выше, объединяют, концентрируют путем ультрафильтрации через мембрану YM10, затем хранят при температуре -80 С до использования. Полученную таким образом активную фракцию подвергают электрофорезу в 10%-ном полиакриламидном геле с додецилсульфатом натрия. Несколько полос обнаруживают путем окрашивания кумасси-голубым с преобладающей полосой кажущейся молекулярной массы 62 кДа (фиг. 3(В, которая идентична молекулярной массе, определенной путем фильтрации через гель Superose 6 (Pharmacia) и соответствующей ферменту с активностью АРАТ. В-Свойства АРАТ. а) Специфичность субстрата. Согласно вышеуказанному методу для ацетил-СоА и прегненолона, используя различные ацильные доноры или различные стероидные субстраты, полуочищенная АРАТ переносит ацетат в 3-ол, дельта 4- или дельта 5 стероиды со сравнимой эффективностью, тогда как перенос является незначительным в случае эстрогенов и недектируемым в случае стеролов и с заметным предпочтением для ацетил-СоА в качестве ацильного донора. В следующей табл. 2, в которой в случае а) опыты осуществляют с 30 мкмоль каждого испытуемого стероида и 100 мкмоль [3 Н]-ацетилСоА, а для б) опыты осуществляют со 100 мкмоль каждого ацильного донора и 30 мкмоль б) Ингибирование. Активность АРАТ сильно ингибируется реагентами сульфгидрильных групп, такими какN-этилмалеимид и 5,5'-дитиобис (2-нитробензойная кислота). Ингибирование является полным в присутствии хлорида цинка (1 ммоль). Г - Частичная аминокислотная последовательность. Частичную аминокислотную последовательность определяют после гидролиза трипсином на срезах геля согласно методу, описанномуRosenfeld и др. (1992). Из двух третей концентрата, полученного выше, затем подвергнутого разделению путем электрофореза в полиакриламидном геле с додецилсульфатом натрия, вырезают полосу с молекулярной массой 62 кДа, затем инкубируют с трипсином (Promega). Полученные пептиды после этого разделяют путем ВЭЖХ с обращенной фазой на колонке Vydac 218 ТР (1.5 х 125 мм) со скоростью 100 мкл/мин, используя линейный градиент ацетонитрила, изменяющийся от 0 до 60% в течение 80 мин, затем от 60 до 100% в течение 20 мин, в 0,1%-ном растворе трифторуксусной кислоты (ТФУК) в воде, затем проводят секвенирование аминокислот.ISEQFKKDDF; для пика у: LIELISPVIIPLGNPK. Обе таким образом полученные пептидные последовательности используют для просеивания базы данных генома S.cerevisiae. Протеин с молекулярной массой 62 кДа, последовательность которого содержит точные последовательности двух вышеуказанных пептидов, может быть идентифицирован (Mips, номер по каталогу S64491, Hebling и др., май 1996). Этот протеин, последовательность которого представлена на фиг. 4 и функция которого не описана, кодирует ген в локусе YGR177c. На основании идентичности примерно на 37% аминокислотной последовательности между протеи 15 ном согласно изобретению, обладающим активностью ацилтрансферазы, и генным продуктомATF1 в случае S.cerevisiae, описанным Fujii и др. (1994) и для которого обнаружена спиртацетилтрансферазная активность, авторы используют обозначение ATF2 для гена, кодирующего протеин, ответственный за активность АРАТ у S.cerevisiae. Пример 2. Конструирование штаммов дрожжей, содержащих ген ATF2, прерванный геном URA3, и лишенных активности АРАТ(atf2-URA3). А) Ген-мишень ATF2. Ген URA3 S.cerevisiae вводят путем замены выбранной части гена ATF2 S.cerevisiae, что позволяет осуществлять дальнейшую селекцию мутантных штаммов путем протографии с урацилом. Селекционный маркер URA3 объединяют с геном ATF2 путем двойного слияния за счет полимеразной цепной реакции (ПЦР) согласно способу, описанному Amberg и др., 1995. Следующая стратегия, представленная на фиг. 5,включает в целом 4 полимеразные цепные реакции. Две первые реакции (обозначаемые ПЦР 1) позволяют, соответственно, амплифицировать участки 5' и 3', фланкирующие инсерционный сайт маркера URA3 в прерванном гене-мишениATF2, и третья реакция (обозначаемая ПЦР 2) позволяет амплифицировать ген-маркер URA3. В результате двойного слияния (обозначаемого ПЦР 3), наконец, участки 5' и 3' гена-мишени(обозначается 5'ATF2-URA3-3'ATF2) . Сначала образец целых клеток штаммаFy1679, используемого в качестве источника ДНК гена-мишени ATF2, амплифицируют в ПЦР-буфере, содержащем 2 ммоль dNTP (Pharmacia), в следующих условиях: 25 циклов; 93 С- 30 с; 54 С - 2 мин; 68 С - 3 мин; с последующим удлинением на 5 мин при 72 С; полимераза(SGD:YGR177c), и с добавлением сайта рестрикции Sall для OTG10841. С другой стороны, область 3' гена ATF2 амплифицируют путем ПЦР, используя в качестве прямого и непрямого праймеров олиго 004629(SGD:YGR177c), и с добавлением сайта рестрикции MluI для OTG10842. Затем, ген URA3 S.cerevisiae амплифицируют путем ПЦР, используя в качестве прямого праймера олигонуклеотид, имеющий последовательность:(последовательность 5), который содержит последовательность, гомологичную участку 5' опубликованной последовательности гена URA3 (Rose и др.,1984; банк генов: YSCODCD; номер по каталогу: КО 2207; SGD: YELO21w), объединенную с последовательностью, которая гомологична участку 5' гена ATF2 (комплементарнаяOTG10844), и в качестве непрямого праймера олигонуклеотид, имеющий последовательность:TC (последовательность 6),который содержит последовательность,гомологичную участку 3' гена URA3, объединенную с последовательностью, которая гомологична участку 3' гена ATF2 (комплементарнаяURA3, выделенный из шаттл-вектора E.coliдрожжи pTG10021 (Degryse и др., 1995) путем гидролиза с помощью рестрикционного фермента HindIII, амплифицируют в вышеуказанных условиях. Полученные, соответственно, продукты ПЦР очищают, используя набор под названием Набор для очистки генов (Bio 101 Inc., LaJolla, США), затем подвергают реакции двойного слияния, используя в качестве праймеров вышеуказанные олигонуклеотиды OTG10841 иOTG10842, в условиях амплификации, используемых для предварительных полимеразных цепных реакций с программой 20 циклов. После очистки конечного продукта слияния, который содержит фланкирующие участки гена ATF2, слитые с функциональным геномURA3, наличие гена URA3 подтверждают путем гидролиза с помощью рестрикционного фермента EcoRV, который показывает присутствие этого сайта в амплифицированном материале. 17 Б) Генерация штаммов дрожжей atf2URA3. Вышеполученный продукт слияния трансформируют непосредственно в компетентных клетках штамма Fyl679 или штамма TGY73.4 и трансформанты селекционируют путем культивирования в среде SD (F. Sherman, 1991) в присутствии необходимых питательных веществ штамма и в отсутствие урацила. В выделенных клонах обнаруживают новое соединение между участком 5' гена ATF2 и гена URAS (5'ATF2-URA3-3'ATF2) путем амплификации с помощью ПЦР в целых клетках,используя вышеуказанные праймеры OTG10841 и OTG10845. Отсутствие активности АРАТ затем определяют ин витро согласно описанному тесту, исходя из клеточного гомогената, в сравнении с родственным штаммом, который имеет ярко выраженную активность АРАТ. Штаммы, отвечающие этим критериям, таким образом были охарактеризованы как мутантные штаммы atf2, обозначаемые atf2URA3. Мутантный штамм, полученный таким образом из родственного штамма Fy1679,обозначают TGY156, а мутантный штамм, полученный из родственного штамма TGY73.4,обозначают TGY158. Образец штамма TGY156 депонирован в Национальной коллекции культур микроорганизмов, Институт Пастера, 25, улица DocteurRoux. 75724, PARIS CEDEX 15, Франция, 2 февраля 1998 г. под номером 1-1977. Образец штамма TGY158 депонирован в Национальной коллекции культур микроорганизмов, Институт Пастера, 25, улица DocteurRoux, 75724, PARIS CEDEX 15, Франция, 2 февраля 1998 г. под номером I-1976. В) Стабилизация прегненолона ин виво в культурах штаммов дрожжей atf2-URA3. Клетки полученного штамма TGY158 вносят, из расчета А 600=0,1, в среду YPD (Difсо),содержащую 100 мкг/мл прегненолона. После инкубации в течение 16 ч при температуре 28 С стероиды экстрагируют дихлорметаном и анализируют с помощью ВЭЖХ с обращенной фазой, как указано выше. Из фиг. 6(В) видно, что мутант TGY158 лишен способности этерифицировать прегненолон, тогда как в тех же условиях культивирования родственный штамм TGY73.4 превращает прегненолон в прегненолонацетат(фиг. 6 (А. Эти результаты позволяют сделать вывод о том, что генный продукт ATF2 является ответственным за этерификацию прегненолона дрожжами, тогда как прерывание гена ATF2 не приводит к заметным изменениям роста клеток в нормальных условиях. Пример 3. Конструирование штамма дрожжей, содержащего ген ATF2, прерванный геном URA3, и экспрессирующего 3-HSD. Плазмиды 2, содержащие последовательность кДНК, кодирующую человеческий 3HSD под контролем промотора CYC1S.cerevisiae или промотора TEF1 S.cerevisiae и включающие ген устойчивости к G418, конструируют согласно представленной на фиг. 7 А 7 С схеме, затем трансформируют в мутантных штаммах дрожжей atf2-URA3. Сначала вектор переноса pTG10095, содержащий последовательность ДНК, кодирующую человеческий 3-HSD типа II, описаннуюE.Rheaume и др., 1991, фланкированную сайтами SalI и MluI и расположенную ниже промотора дрожжей GAL10/CYC1, получают следующим образом: Кодирующую 3-HSD последовательность субклонируют согласно E.Rheaume и др., 1991,как рестрикционный фрагмент SalI-NotI в тех же сайтах вектора Bluescript II (Stratagene). Полученный вектор, описанный E.Rheaume и др.,1991, содержит сайт NotI, локализованный у конца 3' последовательности, кодирующей 3HSD. Этот вектор затем гидролизуют с помощью рестрикционного фермента NotI, после чего обрабатывают фрагментом Кленова в присутствии dNTP, чтобы заполнить липкие концы, затем снова подвергают лигатуре в присутствии олигонуклеотида, имеющего следующую последовательность:CACACGCGTGTG (последовательность 7),предварительно фосфорилированного и гибридизованного с самим собой, чтобы ввести сайт MluI. Полученный таким образом векторpTG10082 (фиг. 7 А) содержит последовательность, кодирующую 3-HSD, содержащую сайт Вg1II и окаймленную сайтами SalI и MluI,тогда как сайт NotI утрачен. Этот вектор содержит также природный некодирующий участок 5', идентифицируемый по наличию сайта Вg1II. Для того, чтобы приблизить сайт SalI кATG (антитимоцитарный глобулин) - инициатору, выше которого хотят ввести промоторGAL10/CYC1, вектор pTG10082 гидролизуют с помощью рестрикционного фермента MscI, сайт которого находится в некодирующей области 5' и непосредственно перед ATG-инициатором, и с помощью рестрикционного фермента MluI. Фрагмент MscI-MluI длиной 1,8 т.н., содержащий последовательность, кодирующую 3-HSD(фиг. 7 А), выделяют, затем лигируют в плазмиде pTG10033 (E. Degryse и др., 1995), содержащей промотор GAL10/CYC1, предварительно гидролизованный с помощью рестрикционного фермента SalI, после чего обрабатывают фрагментом Кленова в присутствии dNTP и потом гидролизуют с помощью рестрикционного фермента MluI. Таким образом получают векторpTG10095. Затем конструируют рекомбинационный вектор pTG10268, содержащий плазмиду 2 19 дрожжей, репликон E.coli, полигенный экспрессирующий кластер CYC1prom - PGKterm и селекционный маркер LEU2. Этот вектор идентичен вектору pTG10159, описанному E.Degryse и др.(1995), за исключением сайта XbaI, содержащегося в области 2, который заменен маркеромXbaIo, получаемым путем заполнения природного сайта XbaI в присутствии фрагмента Кленова,затем путем повторной лигатуры. Затем получают плазмиду экспрессииpTG10268 путем гомологичной рекомбинации за счет введения блока экспрессии, содержащего промотор GALl0/CYClp, который получен из сконструированной выше плазмиды pTG10095,затем гидролизованной с помощью рестрикционного фермента NotI, в плазмиду pTG10260,предварительно гидролизованную с помощью рестрикционных ферментов SalI и MluI. Плазмида pTG10268 (фиг. 7 В) содержит последовательность, кодирующую человеческий зр-HSD типа II под контролем промотора CYCI. Затем плазмиду экспрессии pTG10862, содержащую последовательность, которая кодирует 3-HSD под контролем промотора TEF1,конструируют следующим образом (фиг. 7 С). Сначала конструируют плазмидуpTG10832 (фиг. 8) путем гомологичной рекомбинации между фрагментом NotI, полученным из сконструированной выше плазмидыpTG10268, затем гидролизованной с помощью рестрикционного фермента NotI, и рекомбинационной плазмидой pTG10164 (E. Degryse и др.,1995), предварительно гидролизованной с помощью рестрикционных ферментов SalI и MluI. Затем получают плазмиду экспрессииpTG10862 путем введения промотора TEFl, содержащегося в фрагменте ClaI-SalI, выделенном из плазмиды pTG10085 (E.Degryse и др., 1995),вместо промотора CYC1, удаленного путем гидролиза сконструированной выше плазмидыpTG10832 с помощью рестрикционных ферментов ClaI и SalI. Таким образом полученную плазмидуpTG10862 (фиг. 9), которая содержит последовательность кДНК, кодирующую человеческий 3-HSD типа II, трансформируют, соответственно, в родственном штамме TGY73/4 или в его мутанте atf2-URA3, соответствующем полученному в примере 2 штамму TGY158,также, как в родственном штамме FY1679 или в его мутанте atf2-URA3, соответствующем полученному в примере 2 штамму TGY156. Трансформанты выделяют как указано выше в среде YPD(Difco), содержащей 250 мкг/млG418. Далее полученные таким образом колониикандидаты предварительно культивируют в среде SD, содержащей необходимые для каждого штамма питательные элементы (гистидин и урацил для штамма TGY73,4; гистидин для 20 для штамма FY1679; триптофан, гистидин и лейцин для штамма TGY156; в концентрации по 100 мкг/мл каждого), затем вносят в среду, содержащую 100 мкг/мл прегненолона. После культивирования и биоконверсии в течение 24-х ч при температуре 28 С, стероиды экстрагируют и анализируют с помощью ВЭЖХ с обращенной фазой, как указано выше. Полученные результаты, определенные в случае трех клонов каждого штамма, представлены в следующей таблице 3: Штамм Эти результаты показывают, что прегненолоновый субстрат практически полностью рекуперируют в случае мутантных штаммовTGY156 или TGY158, в которых наблюдают начало биоконверсии прегненолона в прогестерон, тогда как исчезновение прегненолона является полным в родственных штаммах TGY73.4 или FY1679, которые не продуцируют или очень мало продуцируют прогестерон, но аккумулируют ацетат прегненолона, как это показано в примере 2. Образец трансформированного штаммаTGY158/pTG10862 депонирован в Национальной коллекции культур микроорганизмов, Институт Пастера, 25, улица Docteur Roux 75724,PARIS CEDEX 15, Франция, 2 февраля 1998 г,под номером I-1978. Пример 4. Конструирование штамма дрожжей, содержащего ген ATF2, прерванный с помощью TEF1prom/PGKterm (atf2- TEF1/PGK). Штамм TGY186, который представляет собой штамм, происходящий от штаммаTGY156 (atf2-URA3), описанного в примере 2, в котором ген URA3 в локусе ATF2 заменен блоком экспрессии TEF1prom/PGKterm, конструируют cледующим образом: Сначала блок экспрессии TEF1prom/PGKterm объединяют с геном ATF2 путем двойного слияния с помощью ПЦР согласно условиям,описанным в примере 2, но используя блок экспрессии TEFlprom/PGKterm S.cerevisiae, описанныйE.Degryse и др. (1995), вместо селекционного маркера URA3. Две первые полимеразные цепные реакции(ПЦР 1), позволяющие, соответственно, амплифицировать кодирующие участки 5' и 3' генаATF2, фланкирующего инсерционный сайт блока TEF1prom/PGKterm в прерванном гене-мишениATF2, осуществляют при использовании, соответственно, в качестве прямого и непрямого праймеров для участка 5', олигонуклеотиды,имеющие следующие последовательности:CAAATTCGCCGATGCTTTGG (последовательность 11). Праймеры OTG11049 и OTG11050 предназначены для введения, соответственно, сайтов рестрикции SalI и MluI. Третью полимеразную цепную реакциюGCTTCGAAACGCAGAATTTTCGAGTTАТTА ААСТТАА (последовательность 13), которые вводят сайты рестрикции ClaI и HindIII. Наконец, объединение осуществляют путем двойного слияния вышеполученных продуктов ПЦР, используя в качестве праймеров олигонуклеотиды, имеющие последовательности OTG11049 (последовательность 8) иOTG11050 (последовательность 11), которые вводят сайты рестрикции SalI и MluI в сайты связывания ATF2. Затем, после очистки, конечный продукт слияния рекомбинируют с геном ATF2, содержащимся в плазмиде pTG10885, сконструированной как указано выше и предварительно гидролизованной с помощью рестрикционных ферментов BstI и StuI. Таким образом получают плазмиду pTG10888, содержащую сигналTEF1prom/PGKterm в сайтах ClaI и HindIII,"окаймленный" фланкирующими участками гена ATF2. Получение плазмиды pTG10885 включает амплификацию гена ATF2 из штамма FY1679 согласно описанным в примере 2 условиям, но при использовании, соответственно, в качестве прямого и непрямого праймеров вышеуказанные олигонуклеотиды, имеющие последовательности OTG11049 (последовательность 8) и OTG11050 (последовательность 11), которые вводят сайты рестрикции SalI и MluI. В полученном продукте ПЦР эти сайты затем удаляют путем гидролиза с помощью рестрикционных ферментов SalI и MluI, затем путем обра 004629 22 ботки с помощью фрагмента Кленова полимеразы I E.coli, чтобы заполнить липкие концы. Полученный фрагмент затем лигируют в экспрессионном векторе pTG10031, описанномE.Degryse и др. (1995), предварительно гидролизованном с помощью ферментов ClaI и HindIII,затем обработанном с помощью фрагмента Кленова. Путем трансформации в E.coli таким образом получают плазмиду pTG10885 в результате лигирования сайта SalI продукта ПЦР, дополненного за счет использования фрагмента Кленова, чтобы получить последовательностьGTCGA, с сайтом HindIII вектора, который дополнен за счет использования фрагмента Кленова, чтобы получить последовательность AGCTT,так, чтобы реконструировать сайт HindIII(GTCGAAGCTT) (последовательность 14) и исключить сайт ClaI. Сайт ClaI вектора, дополненный за счет использования фрагмента Кленова, чтобы получить последовательностьATCG, исчезает после лигирования с продуктом ПЦР. Сигнал TEF1prom/PGKterm затем удаляют из плазмиды pTG10888 в виде фрагмента NotI длиной 1,8 т.н., затем заменяют маркером URA3 в штамме TGY156 (atf2-URA3). Полученный в примере 2 и используемый в качестве штамма-хозяина штамм TGY156 котрансформируют с ДНК, удаленной из плазмиды pTG10888, и с вектором дрожжей, содержащим источник ARS (СПИД-ассоциированный комплекс), называемый YRp7, описанный Struhl и др. (1979), который позволяет выполнить потребность в триптофане штамма TGY156 и осуществлять селективную детекцию колоний по их устойчивости к 5-фтороротовой кислоте. 2-5 мкг ДНК, удаленной из плазмидыpTG10888 путем гидролиза с помощью рестрикционного фермента NotI, и плазмиды YRp7 вводят в штамм TGY156 по методу с ацетатом лития (Ito и др., 1983). Затем осуществляют селекцию по выполнению потребности штамма в триптофане после образования монослоев в чашках с агаром в среде YNGB (Difco), дополненной гистидином и лейцином (по 100 мкг/мл каждого). Колонии-кандидаты, отобранные с помощью зубочистки, затем помещают в среду,содержащую 5-фтороротовую кислоту, получаемую согласно Воеке и др. (1984), затем устойчивость к 5-фтороротовой кислоте подтверждают при использовании той же самой среды,причем возможная потеря вектора YRp7 в устойчивых к 5-фтороротовой кислоте колониях указывает на потребность в триптофане. Среди отобранных таким образом клонов объединение гена ATF2 с TEF1prom/PGKterm контролируется с помощью ПЦР. Таким образом получают штамм TGY186. Пример 5. Конструирование штамма дрожжей, содержащего ген ATF2, прерванный с 23 помощью TEF1prom/PGKterm, и экспрессирующего Р 45017. Плазмиду (pTG10435), содержащую участок инициации репликации дрожжей ARSH4/CEN6, селекционный маркер URA3 и включающую последовательность кДНК, кодирующую бычий цитохром Р 45017 под контролем промотора TEF1 S.cerevisiae, конструируют согласно приведенной на фиг. 10 схеме, затем трансфомируют в мутантном штамме дрожжейpTG10058, содержащую последовательность кДНК, кодирующую бычий цитохром Р 45017,описанный Zuber и др. (1986), фланкированную сайтами SalI и MluI и расположенную ниже промотора дрожжей CYC1, получают согласно представленной на фиг. 11 схеме: ПлазмидуpGB17-5, описанную в международной заявке на патент 89/10963 и содержащую последовательность, кодирующую бычий цитохром Р 45017, раскрывают путем гидролиза с помощью рестрикционного фермента XhoI, затем обрабатывают щелочной фосфатазой. После фосфорилирования и гибридизации,олигонуклеотиды, имеющие следующие последовательности:pTG10104. Плазмиду pTG10104 затем обрабатывают рестрикционными ферментами SalI иMluI, потом вводят в плазмиду pTG10031, описанную E.Degryse и др. (1995), содержащую промотор дрожжей CYC1, предварительно гидролизованную с помощью рестрикционных ферментов SalI и MluI и обработанную щелочной фосфатазой. Таким образом получают вектор pTG10058, содержащий кДНК, кодирующую бычий цитохром Р 45017 (фиг. 12). Плазмиду pTG10058 затем гидролизуют с помощью рестрикционных ферментов SalI и MluI и обрабатывают щелочной фосфатазой. Фрагмент SalIMluI длиной 1,7 т.н., содержащий последовательность, кодирующую бычий цитохром Р 45017, выделяют, затем лигируют в экспрессионном вектореE.Degryse и др. (1995) и содержащем промотор дрожжей TEF1, предварительно гидролизованном с помощью ферментов SalI и MluI. Таким образом получают плазмиду pTG10293 (фиг. 13), в которой кодирующая цитохром P45017 последовательность находится под контролем промотора TEF1. Затем плазмиду экспрессии pTG10435 получают путем гомологичной рекомбинации между рекомбинационной плазмидой pTG10434,описанной E.Degryse и др. (1995) и содержащейSalI и MluI, и фрагментом NotI длиной 2,8 т.н.,полученным из сконструированной выше плазмиды pTG10293. Полученную таким образом плазмидуpTG10435 (фиг. 14), которая содержит последовательность, кодирующую бычий цитохром Р 45017 под контролем промотора TEF1, затем трансформируют, соответственно, в родственном штамме FY1679 или в штамме TGY186(atf2-TEF1/PGK), полученном в примере 4. Трансформанты выделяют как указано выше в среде YNBG (Difco), дополненной триптофаном, гистидином и лейцином (по 100 мкг/мл каждого). Затем полученные таким образом колонии предварительно культивируют в течение 16 ч в среде YNB (Difco), содержащей 2% глюкозы и 0,5% cas-аминокислот, после чего разбавляют свежей средой до А 600=0,2. После культивирования в течение 6 ч добавляют 100 мкг/мл прегненолона или прогестерона. После инкубации и биоконверсии в течение 48 ч при температуре 28 С стероиды экстрагируют и анализируют с помощью ВЭЖХ с обращенной фазой, как указано в примере 1, используя, соответственно, стандарты прегненолона и 17 гидроксипрегненолона или прогестерона и 17 гидроксипрогестерона. Полученные результаты, выраженные в мкг/мл, представлены в следующей табл. 4: Штамм Субстрат: прегненолон прегненолон 17-гидроксипрегненолон Субстрат: прогестерон прогестерон 17-гидроксипрогестерон Эти результаты показывают, что способность к биоконверсии цитохрома Р 45017, экспрессия которого осуществляется векторомpTG10435, почти такая же в штамме дикого типа (FY) или его мутанте atf2 (TGY186) при использовании прогестерона в качестве субстрата. С другой стороны, при использовании прегненолона в качестве субстрата достигают такой же конверсии по сравнению с прогестероном, но только с мутантом atf2 (TGY186). В штамме дикого типа FY одновременно субстрат и продукт ацетилированы, и свободный гидроксипрогестерон не обнаруживается. Образец трансформированного штаммаTGY186/pTG10435 депонирован в Национальной коллекции культур микроорганизмов, Институт Пастера, 25, улица Docteur Roux 75724,PARIS CEDEX 15, Франция, 20 января 1999 г. под номером I-2119. Пример 6. Конструирование штамма дрожжей, содержащего ген ATF2, прерванный с 25 помощью TEF1prom/PGKterm, и коэкспрессирующего 3-HSD и Р 45017. Плазмиду pTG10417 (фиг. 21), содержащую репликон дрожжей 2 и два блока экспрессии, из которых один кодирует человеческий 3-HSD, а другой кодирует бычий цитохром Р 45017, причем оба находятся под контролем промотора CYC1 S.cerevisiae и содержат селекционный маркер URA3, конструируют последовательно согласно нижеописанным стадиям 1-3(фиг. 15 А и В), затем нижеописанным стадиям 4-6, после чего трансформируют в мутантном штамме дрожжей atf2- TEF1prom/ PGKtermpTG10210. Экспрессионный вектор pTG10033, описанный E.Degryse и др. (1995) и содержащий гибридный промотор дрожжей GAL10/CYC1,предварительно гидролизованный с помощью рестрикционного фермента PvuII, обрабатывают щелочной фосфатазой, затем снова лигируют в присутствии олигонуклеотида, имеющего следующую последовательность:OTG1050:CCCGAATTCGGG (последовательность 17), предварительно фосфорилированного и гибридизованного с самим собой,чтобы ввести сайты EcoRI в виде окаймления блока экспрессии, содержащего промоторGAL10/CYC1. Таким образом получают векторPTG10013, описанный E.Degryse и др. (1995) и содержащий селекционный маркер URA3-d. Вектор pTG10013, после гидролиза с помощью рестрикционного фермента EcoRI и обработки щелочной фосфатазой, лигируют с полученным в стадии 1 вектором pTG10210, предварительно гидролизованным с помощью фермента EcoRI. Полученный таким образом векторGAL10/CYC1 заменяют промотором СYС 1 путем гомологичной рекомбинации после удаления плазмиды за счет обработки рестрикционными ферментами ClaI и SalI. Экспрессионный вектор pTG10031, описанный E.Degryse и др.HindIII и FspI, затем рекомбинируют с плазмидой pTG10214, полученной в стадии 2 и предварительно гидролизованной с помощью рестрикционных ферментов ClaI и SalI, получая таким образом плазмиду pTG10274 (фиг. 16).pTG10401. Из плазмиды pTG10274, содержащей промотор CYC1, и плазмиды pTG10293, содержащей последовательность, кодирующую цитохром Р 45017 под контролем промотора TEF1,путем гомологичной рекомбинации получают новую плазмиду pTG10401, содержащую последовательность, кодирующую цитохром Р 45017 под контролем промотора TEF1. Промотор CYC1 и часть репликона E.coli удаляют из плазмиды pTG10274, полученной в стадии 3, путем гидролиза с помощью рестрикционных ферментов MluI и DraI. Полученную в примере 5 плазмиду pTG10293 гидролизуют с помощью рестрикционных ферментов HindIII иpTG10274, гидролизованной с помощью рестрикционных ферментов MluI и DraI, получая плазмиду pTG10401 (фиг. 17). Стадия 5. Конструирование плазмидыpTG10403. кДНК, кодирующую человеческий 3-HSD типа II, вводят в плазмиду pTG10401 под контролем промотора CYC1. Сначала вектор экспрессии pTG10262, содержащий кДНК, кодирующую человеческую 3-HSD типа II, конструируют согласно представленной на фиг. 18 схеме, из векторапереносчика pTG10095, полученного в примере 3, и рекомбинационного вектора pTG10257, содержащего репликон дрожжей 2, репликонE.coli, полигенный экспрессирующий кластер дрожжей СYС 1 рrom - PGKterm и селекционный маркер URA3-d. ЭТОТ вектор pTG10257 идентичен рекомбинационному вектору pTG10042,описанному E.Degryse и др. (1995), за исключением сайта XbaI, содержащегося в области 2,который заменен маркером XbaIo, полученным путем дополнения природного сайта XbaI фрагментом Кленова, затем повторной лигатуры. Блок экспрессии человеческого 3-HSD типа II удаляют из вектора-переносчикаpTG10095 путем гидролиза с помощью рестрикционного фермента NotI, затем вводят в рекомбинационный вектор pTG10257, предварительно гидролизованный с помощью рестрикционных ферментов SalI и MluI, получая вектор экспрессии pTG10262 (фиг. 19). Следует заметить, что в результате рекомбинации блока GAL10/CYC1 кДНК, происходящего из плазмиды pTG10095, в рекомбинационном векторе pTG10257, содержащем промотор CYC1, получают вектор экспрессии, содержащий блок CYC1-кДНК. Затем сконструированный выше вектор экспрессии pTG10262 гидролизуют с помощью рестрикционного фермента XmnI. Полученный фрагмент, содержащий кДНК, кодирующую 3HSD, рекомбинируют с фрагментом плазмиды очередь полученный путем гидролиза с помощью рестрикционного фермента ScalI. Полученная таким образом плазмида pTG10403 (фиг. 20) содержит два блока экспрессии, из которых один кодирует 3-HSD под контролем промотора CYC1, а другой кодирует цитохром Р 45017 под контролем промотора ТЕF1. Стадия 6. Конструирование плазмидыpTG10403 промотор TEF1 заменяют промотором CYC1. С одной стороны, описанную в примере 5 плазмиду pTG10058 гидролизуют с помощью рестрикционного фермента PvuII, что позволяет высвобождать часть последовательности, кодирующей цитохром Р 45017, ассоциированной с промотором СYС 1, также, как преобладающую часть репликона E.coli. С другой стороны, часть репликона E.coli удаляют из полученной в стадии 5 плазмиды pTG10403 путем гидролиза с помощью рестрикционного фермента DraI. Путем рекомбинации двух плазмид, предварительно гидролизованных таким образом, наконец,получают плазмиду pTG10417. ПлазмидаpTG10417 содержит репликон дрожжей 2, селекционный маркер URA3-d и два блока экспрессии, из которых один кодирует человеческий 3-HSD, а другой кодирует цитохром Р 45017 бычьего происхождения, причем оба находятся под контролем промотора дрожжейF1prom/PGtrem ), полученном в примере 4. Трансформанты выделяют в агаровой среде YNB (Difco), содержащей 0,5% глюкозы и дополненной триптофаном, гистидином и лейцином (по 100 мкг/мл каждого). Полученные таким образом колонии затем предварительно культивируют в течение 24-х ч при температуре 28 С в среде YNB (Difco), содержащей 0,5% глюкозы и 0,1% casаминокислот, затем разбавляют до А 600=0,1 и добавляют 100 мг/мл прегненолона, при использовании либо той же самой свежей среды (среда 1), либо среды YNB (Difco), содержащей 0,1% глюкозы, 2% глицерина и 0,2% cas-аминокислот(среда 2). После культивирования и биоконверсии в течение 48 ч стероиды экстрагируют и анализируют с помощью ВЭЖХ с обращенной фазой как указано в примере 1, используя стандарты прегненолона, 17-гидроксипрегненолона,прогестерона и 17-гидроксипрогестерона. Полученные результаты, выраженные в мкг/мл, представлены в следующих табл. 5 28 Прегненолонацетат 17-Гидроксипрегненолон 17-Гидроксипрегненолонацетат Прогестерон 17-Гидроксипрогестерон Штамм Прегненолон Прегненолонацетат 17-Гидроксипрегненолон 17-Гидроксипрегненолонацетат Прогестерон 17-Гидроксипрогестерон Эти результаты показывают, что биоконверсия в штамме дикого типа (FY), трансформированном плазмидой pTG10417, приводит к аккумуляции прегненолонацетата и 17-гидроксипрегненолонацетата, которые не трансформируются в дальнейшем ферментами 3-HSD или Р 45017, и баланс биоконверсии хуже такового, наблюдаемого при использовании трансформированного мутанта atf2 (TGY186). Образец трансформированного штаммаTGY186/pTG10417 депонирован в национальной коллекции культур микроорганизмов, Институт Пастера, 25, улица Docteur Roux 75724,PARIS CEDEX 15, 20 января 1999 г. под номером i-2118. Библиографические ссылки ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Штамм дрожжей, лишенный ацетилСоА-прегненолон-ацетилтрансферазной активности (АРАТ) за счет модификации гена ATF2 или YGR 177 с, или его гомолога, что приводит к стабилизации 3-гидроксистероидов.S.cerevisiae. 3. Штамм по п.2, в котором ген ATF2 модифицирован путем вставки последовательности ДНК, включающей по крайней мере один нуклеотид. 4. Штамм по п.3, в котором ген ATF2 модифицирован путем вставки селекционного генаURA3. 5. Штамм по п.3, в котором ген ATF2 модифицирован путем вставки блока экспрессииTEF1prom/PGKterm. 6. Штамм по п.4, представляющий собой штамм S.cerevisiae TGY156. 7. Штамм по п.4, представляющий собой штамм S.cerevisiae TGY158. 8. Штамм по п.5, представляющий собой штамм S. cerevisiae TGY186. 9. Штамм по любому из пп.1-5 формулы,дополнительно экспрессирующий по крайней мере один из ферментов пути биосинтеза гидрокортизона из холестерина, выбираемый из группы, включающей фермент расщепления боковой цепи холестерина (P450SCC); 3-гидрокси-дельта 5-стероид-дегидрогеназу/дельта 5-дельта 4-стероид-изомеразуTGY158/pTGY10862. 12. Штамм по п.9, дополнительно экспрессирующий Р 45017. 13. Штамм по пп.5 и 12, представляющий собой штамм S.cerevisiae TGY186/pTG10435. 14. Штамм по п.9, дополнительно экспрессирующий 3-HSD и Р 45017. 15. Штамм по пп.5 и 14, представляющий собой штамм S.cerevisiae TGY186/pTG10417. 16. Способ получения окисленного стерина, согласно которому культивируют трансформированный штамм дрожжей по любому из пп.9-15 и выделяют окисленный эндогенный стерин. 17. Способ получения окисленного стерина или стероида, согласно которому культивируют трансформированный штамм дрожжей по любому из пп.9-15, который инкубируют с экзогенным стерином или стероидом и выделяют полученное окисленное соединение. 18. Способ по п.17, согласно которому субстратом является 3-гидроксистероид и в котором используют трансформированный штамм дрожжей по п.10 и выделяют полученный 3-оксо-дельта 4-стероид. 19. Способ по п.18, согласно которому 3 гидроксистероид выбирают среди прегненолона или 17-гидроксипрегненолона. 33 20. Способ по п.17, согласно которому субстратом является стероид и в котором используют трансформированный штамм дрожжей по п.12 и выделяют полученный 17 гидроксилированный стероид. 21. Способ по п.20, согласно которому стероидным субстратом является прегненолон или прогестерон. 22. Способ по п.17, согласно которому субстратом является 3-гидроксистероид и в 34 котором используют трансформированный штамм дрожжей по п.14 и выделяют полученный 17-гидроксилированный 3-оксо-дельта 4 стероид. 23. Способ по п.22, согласно которому стероидным субстратом является прегненолон.
МПК / Метки
МПК: C12N 15/54, C12P 33/00
Метки: лишенные, стеринов, дрожжей, способы, использовании, активности, штаммы, стероидов, окисления, ацетил-соа-прегненолон-ацетилтрансферазной
Код ссылки
<a href="https://eas.patents.su/21-4629-shtammy-drozhzhejj-lishennye-acetil-soa-pregnenolon-acetiltransferaznojj-aktivnosti-i-sposoby-okisleniya-sterinov-i-steroidov-pri-ih-ispolzovanii.html" rel="bookmark" title="База патентов Евразийского Союза">Штаммы дрожжей, лишенные ацетил-соа-прегненолон-ацетилтрансферазной активности, и способы окисления стеринов и стероидов при их использовании</a>
Предыдущий патент: Новые производные 1,3-дигидро-2н-индол-2-она и их применение в качестве лигандов рецепторов аргинин-вазопрессина v1b и v1a
Следующий патент: Способ образования комплекса
Случайный патент: Водно-гликолевый раствор гербицидной композиции