Способ получения андрост-4-ен-3, 17-диона из стеринов растительного и животного происхождения и их производных
Формула / Реферат
1. Способ получения андрост-4-ен-3,17-диона путём микробиологической трансформации стерила или его производного общей формулы I
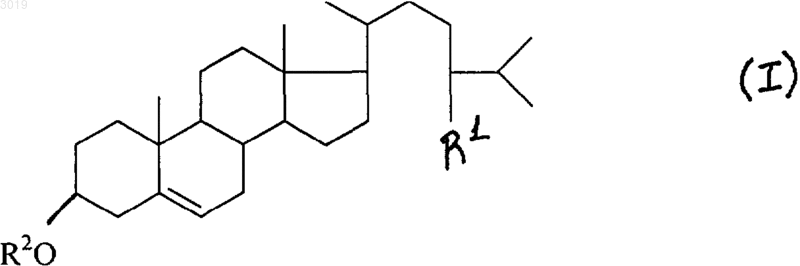
где R1 = Н или С2Н5; R2 = H или СО(СН2)2СООХ; Х = NН4, Na или К, и выделения продукта трансформации из реакционной среды, отличающийся тем, что в качестве микроорганизма-трансформатора используют штамм Mycobacterium smegmatis ВКПМ Ac-1552.
2. Способ по п.1, отличающийся тем, что трансформацию производного стерина общей формулы I, где R2 = СО(СН2)2СООХ, проводят в водном растворе сточника углерода, в качестве которого используют углевод класса С6-, С12-, C18-сахаров или С2-, С4-, С5-, С6-спиртов.
3. Способ по п.1 или 2, отличающийся тем, что трансформацию производного стерина общей формулы I, где Х = NH4, проводят в среде, не содержащей дополнительного источника азота.
4. Способ по п.1, отличающийся тем, что трансформацию cтерина проводят в присутствии неионогенного сорбента, в качестве которого используют модифицированные сополимеры этилстирола и дивинилбензола.
5. Способ по п.1, отличающийся тем, что выделение продукта трансформации проводят путем экстракции или с помощью неионогенного сорбента, в качестве которого используют модифицированные сополимеры этилстирола и дивинилбензола.
Текст
1 Изобретение относится к области биотехнологии и касается способа селективного расщепления боковой цепи стеринов животного или растительного происхождения с помощью микроорганизмов с образованием 3,17-дикетоандростанов, в частности андрост-4-ен-3,17 диона (далее в тексте упоминается как АД). АД представляет собой ценное стероидное соединение, которое может быть использовано как ключевой продукт в синтезе биологически активных соединений, применяемых в животноводстве, ветеринарии и медицине [1, 2, 3]. Микробиологические трансформации стеринов животного и растительного происхождения, а именно холестерина и ситостерина, в 3,17-дикетостероиды широко изучены и документированы. Известны способы получения АД из указанных выше стеринов с помощью различных штаммов бактерий родов Arthrobacter[4], Brevibacterium [5], Corynebacterium [6], Mycobacterium [7], Pseudonocardia [8]. Большинство известных способов получения АД из стеринов основано на использовании разных видов Mycobacterium, а именно Mycobacterium fortuitum[9], Mycobacterium parafortuitum [10], Mycobacterium phlei [11], Mycobacterium smegmatis [12],Mycobacterium vaccae [13]. Процессы трансформации осуществляют,культивируя указанные микроорганизмы в аэрируемых жидких питательных средах, содержащих доступные источники углерода и азота, минеральные соли фосфора, калия, магния, а также микроэлементы. Содержание в культуральной среде трансформируемого стероидного субстрата (холестерин, ситостерин) варьирует в пределах 0,01-3,0%. Для увеличения контакта частиц нерастворимых в воде гидрофобных стеринов в культуральную жидкость добавляют какой-либо смачивающий агент. В зависимости от нагрузки в среде исходного стерина ферментацию проводят в течение 2-14 суток при температуре 26-35 С в аэробных условиях и в присутствии пеногасителя. За трансформационный период 2-14 суток в культуральной жидкости накапливается АД в смеси с продуктом его более глубокого окисления - андроста - 1,4-диен 3,17-диона (далее сокращенно АДД). Наличие АДД в конечном продукте трансформации является недостатком указанных способов получения АД. Количество АДД может быть весьма значительным. Так, в вышеупомянутом способе получения АД [9] соотношение АД/АДД равно 8:1. Наиболее близким к предложенному является способ получения АД путем микробиологической трансформации холестерина с использованием в качестве микроорганизма - трансформатора штамма Mycobacterium smegmatisSG-99 и выделения продукта трансформации из реакционной среды [12]. АД образуется в смеси с АДД в соотношении 1:4. От АДД избавляются на второй стадии ферментации, которую прово 003019 2 дят в анаэробных условиях в течение 2 суток. За этот период АДД полностью восстанавливается в АД. Таким образом, во-первых, имеет место усложнение технологии получения АД, вовторых, в анаэробных условиях помимо восстановления АДД в АД может также протекать нежелательное восстановление 17-кетогруппы целевого продукта. Недостатком способов получения АД при высоком начальном содержании стерина (30 г/л) является также длительность периода трансформации - 14 суток, при которой возрастает риск появления посторонней микрофлоры. Указанные способы [4-11], в том числе и прототип [12], предусматривают выделение целевого продукта трансформации - также нерастворимого в воде - экстракцией АД из культуральной жидкости большими объемами несмешивающихся с водой органических растворителей. При этом экстракт содержит смесь стероидов, состоящую из непрореагировавшего исходного стерина, целевого продукта и побочных продуктов окисления стероидов. Экстракт упаривают. Целевой продукт отделяют от других стероидов кристаллизацией. Выход неочищенного АД составляет 31-65% (от теор.) [8-12]. Данные способы весьма трудоемки и обладают рядом недостатков, заключающихся в длительности и энергоемкости процесса, загрязнении окружающей среды вследствие необходимости использования в огромных количествах токсичных и пожароопасных растворителей. Техническим результатом предложенного способа является исключение примеси АДД за счет обеспечения селективного расщепления боковой цепи стеринов и сокращение вследствие этого длительности трансформации. Указанный технический результат достигается тем, что в способе получения андрост-4 ен-3,17-диона путем микробиологической трансформации стерина или его производного общей формулы I где R1 = Н или С 2 Н 5; R2 = Н или СО(CH2)2 СООХ; Х = NH4, Na или К, и выделения продукта трансформации из реакционной среды, в качестве микроорганизма-трансформатора используют штамм Mycobacterium smegmatis ВКПМ Ac - 1552. Данная культура селективно расщепляет боковую цепь стеринов при нагрузке 10-30 г/л с образованием АД без примеси АДД и способна проводить трансформацию в присутствии антибиотика без существенного уменьшения выхода АД и удлинения срока ферментации. Приведенные ниже примеры показывают, что стероидтрансформирующая активность культуры Mycobacterium smegmatis ВКПМ Ac - 1552 не уменьшается при переходе 3 от ферментаций в колбах к трансформациям в ферментерах. Кроме того трансформацию производных стеринов общей формулы I, где R2 = СО(СН 2)2 СООХ, можно проводить в водном растворе источника углерода, в качестве которого используют углевод класса С 6-, С 12-, C18 сахаров (предпочтительно глюкозы, фруктозы,ксилозы) или С 2-, С 4-, С 5-, С 6-спиртов, предпочтительно глицерина, сорбита, маннита. Преимуществом использования указанных выше модифицированных стеринов является существенное повышение удельной активности биомассы. Кроме того, трансформацию производного стерина общей формулы I, где R2 = СО(СН 2)2COONH4, можно проводить в среде, не содержащей дополнительного источника азота,кроме имеющегося в структуре исходного стерина, и других компонентов питательной среды,обязательных для трансформации немодифицированных стеринов. Кроме того, трансформацию стерина целесообразно проводить в присутствии неионогенного сорбента, в качестве которого можно использовать модифицированные сополимеры этилстирола и дивинилбензола. Это позволяет выводить целевой продукт из реакционной среды в процессе трансформации и тем самым предотвращать возможное ингибирование продуктом роста клеточной массы. Кроме того, выделение продукта трансформации можно проводить путем экстракции или с помощью неионогенного сорбента, в качестве которого могут быть использованы модифицированные сополимеры этилстирола и дивинилбензола. Извлечение целевого продукта из ферментационной среды методом сорбции позволяет дополнительно повысить его выход при сохранении высокого качества и, кроме того,- повысить экологическую безопасность процесса;- сократить число технологических операций и трудоемкость процесса;- значительно сократить количество органического растворителя, используемого для выделения целевого продукта;- исключить трудоемкую операцию отделения целевого продукта от остаточного исходного стерина;- упростить стадию выделения, а именно,исключить стадию отделения биомассы от культуральной жидкости;- извлекать целевой продукт без примеси исходного стерина вследствие избирательной сорбционной способности сорбента. Выделение продукта трансформации стеринов можно осуществлять сорбционным методом, используя минимальное эффективное количество неионогенных полярных или малопо 003019 4 лярных макропористых сорбентов. В качестве сорбентов могут быть использованы модифицированные сополимеры этилстирола и дивинилбензола, характеризующиеся большой удельной поверхностью (500-1000 м 2/г), объемом пор более 1 см 2/г, высокой механической прочностью и стабильностью. Указанные выше сорбенты могут быть использованы в циклах сорбциядесорбция многократно. Сорбент добавляют в среду для трансформации в процессе ферментации или после ее завершения. Пример 1.Mycobacterium smegmatis ВКПМ Ac - 1552 выращивают в течение 7-10 суток на твердой среде следующего состава, г/л: глюкоза - 10,соевая мука - 3,0, лимонная кислота - 2,2, мочевина - 0,5, аммоний хлористый - 1,0, калий фосфорнокислый однозамещенный - 0,5, магний сернокислый - 0,5, кальций углекислый - 1,5,железо сернокислое - 0,05, агар-агар - 2,5, рН 7,0-7,5. Биомассу переносят в жидкую среду того же состава (без агара), в которой культуру выращивают в течение 48-70 ч в аэробных условиях на качалке при температуре 30 С (питательную среду разливают по 100 мл в конические колбы объемом 750 мл). Полученный посевной материал в количестве 10 об./% переносят в среду для трансформации следующего состава, г/л: глюкоза - 10, соевая мука - 10, лимонная кислота - 2,2, мочевина - 0,5, аммоний фосфорнокислый двузамещенный - 1,5, магний сернокислый - 0,5, кальций углекислый - 1,5,железо сернокислое - 0,05, холестерин с размером частиц 3-10 мк - 10, сорбиталь - 3,2, рН 7,27,4. Среду для трансформации разливают по 50 мл в колбы Эрленмейера объемом 500 мл. Трансформацию проводят в аэробных условиях на качалке при температуре 30 С в течение 90100 ч. Накопление АД в культуральной жидкости контролируют, используя метод ВЭЖХ. Культуральную жидкость, содержащую АД и непрореагировавший стерин, подкисляют до рН 2-3. Биомассу отделяют и обрабатывают водным ацетоном. Ацетоновый экстракт упаривают и выделяют технический АД, который очищают с использованием хлористого метилена. Получают продукт с выходом 66,2% (от теор.) с содержанием основного вещества 97%,т.пл. 168-170 С. Дополнительно выделяют непрореагировавший холестерин и 4% С-22 спирта. Выход АД в пересчете на вступивший в реакцию стерин составляет 71%. Пример 2. Посевной материал, полученный аналогично примеру 1 (1-й инокулят), вносят в 500 мл свежей питательной среды того же состава, как для 1-го инокулята, инкубируют на качалке в условиях примера 1 в течение 24 ч и получают 2-й инокулят, который переносят в ферментер объемом 10 л, заполненный 5 л трансформационной среды состава, приведенного в примере 1, 5 но с добавлением пеногасителя. Трансформацию проводят в течение 96-100 ч при 30 С, перемешивании 700 об./мин и подаче воздуха с интенсивностью до 0,6 л/л среды/мин. Продукт выделяют аналогично примеру 1. Получают технический продукт с выходом АД 60,7% (от теор.) с содержанием основного вещества 95%,т.пл. 167-170 С. Пример 3. Проводят трансформацию аналогично примеру 1, но с заменой холестерина на ситостерин. Выделение осуществляют аналогично примеру 1. Получают продукт с выходом 54% (от теор.) с содержанием основного вещества 96%, т.пл.169-171 С. Дополнительно выделяют непрореагировавший ситостерин. Выход АД в пересчете на вступивший в реакцию стерин составляет 85%. Пример 4. Трансформацию -ситостерина при нагрузке 10 г/л проводят в ферментере аналогично примеру 2. Продукт выделяют аналогично примеру 1. Получают технический продукт с выходом 51% (от теор.), с содержанием основного вещества 94%, т.пл. 167-170 С. Выход АД в пересчете на вступивший в реакцию ситостерин составляет 82%. Пример 5. Посевной материал, полученный согласно примеру 1, вносят в количестве 10 об./% в трансформационную среду следующего состава,г/л: глицерин - 20, крахмал - 5,0, дрожжевой экстракт - 0,5, мочевина - 0,4, калий фосфорнокислый однозамещенный - 0,7, аммоний хлористый - 0,7, магний сернокислый - 0,5, железо хлорное - 0,05, холестерин 20 (в виде частиц 310 мк), сорбиталь - 6,5, рН 7,0-7,2. Среду разливают по 50 мл в конические колбы объемом 750 мл. Ферментацию проводят в условиях примера 1 в течение 230 ч. За этот период в культуральной жидкости согласно данным ВЭЖХ-анализа накапливается 10 г/л АД. По данным ВЭЖХ в продуктах трансформации отсутствует примесь АДД, а имеющаяся примесь в количестве 4% состоит из дельта-1,4- и дельта-4-С-22-спиртов. Культуральную жидкость, содержащую АД и непрореагировавший стерин, подкисляют до рН 2-3 и перемешивают с сорбентом в количестве 1/7 части от веса исходного субстрата. Суспензию выдерживают до завершения сорбции при температуре 20-25 С, контролируемой с помощью ТСХ. Сорбент отделяют, адсорбированный АД элюируют ацетоном. Раствор осветляют активированным углем. Растворитель упаривают, остаток растирают с водой, осадок отфильтровывают, промывают водой. Получают порошок белого цвета с содержанием АД 96%,т. пл. 169-171 С, выход 58,5% (от теор.). Культуральную жидкость после отделения сорбента центрифугируют. Биомассу обрабатывают ацетоном. Полученный раствор осветляют 6 активированным углем, растворитель упаривают. Остаток растирают с водой, осадок отфильтровывают. Получают порошок белого цвета, содержащий по данным ВЭЖХ 94% холестерина, пригодного для повторного использования. С учетом возвращенного стерина выход АД составляет 66,2%. Пример 6. Трансформацию холестерина при нагрузке 30 г/л проводят в условиях примера 1 в течение 330 ч. Культуральную жидкость делят на 2 части. Первую обрабатывают аналогично примеру 1. Выделяют продукт с выходом 52,6% (от теор.) и содержанием основного вещества 96%. Вторую часть обрабатывают аналогично примеру 5. Получают продукт с выходом 51,7%(от теор.) и содержанием основного вещества 97%. Пример 7. Трансформацию холестерина при нагрузке 30 г/л проводят в условиях примера 1 в течение 6 суток, после чего в культуральную жидкость добавляют стрептомицин и продолжают ферментацию в течение 8 суток. Выделение продукта проводят аналогично примеру 1. Получают продукт с выходом 49,5% (от теор.) с содержанием основного вещества 96%. Пример 8. Посевной материал и трансформационную среду готовят аналогично примеру 1 (10 г/л холестерина). Ферментацию проводят в течение 24 ч также в условиях примера 1, затем к культуральной жидкости добавляют простерилизованный отдельно сорбент в количестве 20% от объема среды. Ферментацию продолжают в тех же условиях еще 3 суток. Сорбент отделяют от культуральной жидкости и обрабатывают аналогично примеру 5. Получают АД с выходом 58,4% (от теор.). Пример 9. Непревращенный холестерин, возвращенный после трансформаций, описанных в примерах 1, 2, 5-8, трансформируют при нагрузке 10 г/л в условиях примера 1 в течение 96 ч. Получают АД в количестве 4 г/л (по данным ВЭЖХ),который выделяют согласно примеру 5. Пример 10. 7,53 г гемисукцината холестерина в 298,5 мл воды нагревают до 30 С. К суспензии в течение 15 мин добавляют концентрированный водный раствор аммиака, смесь нагревают при перемешивании до 80 С и выдерживают до получения однородной массы. Готовый гель аммонийной соли гемисукцината холестерина(концентрация по холестерину 20 г/л) смешивают с водным раствором глицерина в отношении 1:1, рН полученного раствора, содержание источника углерода в котором составляет 1%,доводят до 7,5-7,8 с помощью фосфорной кислоты. Раствор распределяют по 50 мл в конические колбы объемом 500 мл и стерилизуют 20 мин при 110 С. Аналогично готовят растворы, 7 содержащие в качестве источника углерода глюкозу, фруктозу, инвертный сахар, галактозу,ксилозу и др. Посевной материал, приготовленный согласно примеру 1, вносят в стерильные растворы в количестве 20 об./% и проводят трансформацию на качалке в условиях примера 1. Образование АД начинается через сутки ферментации, в течение которой рН поддерживают выше 7,0. Выделение АД проводят аналогично примеру 5. Источники информации 1. Машковский М.Д. Лекарственные средства, М., Медицина, 1993, т. 1, с. 690710; т. 2, с. 541-551 2. Пат. РФ 923 125 3. Хим.-фарм. журнал, 1987, т. 21, с. 14691471 4. Пат. Японии 71.16147 5. Пат. Японии 79.89087, Кл. С 12 Р 13/00 6. ЕР 0274147 7. ЕР 0008214 8. Пат. Японии 83.43796 9. Пат. США 4345033, Кл. 435-55 10. Пат. Японии 80.00010 11. Пат. ГДР 137 840 12. Пат. ГДР 137 661, C 07J 1/00 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения андрост-4-ен-3,17 диона путм микробиологической трансформации стерила или его производного общей формулы I где R1 = Н или С 2 Н 5; R2 = H или СО(СН 2)2 СООХ; Х = NН 4, Na или К, и выделения продукта трансформации из реакционной среды, отличающийся тем, что в качестве микроорганизма-трансформатора используют штамм Mycobacterium smegmatis ВКПМ Ac1552. 2. Способ по п.1, отличающийся тем, что трансформацию производного стерина общей формулы I, где R2 = СО(СН 2)2 СООХ, проводят в водном растворе сточника углерода, в качестве которого используют углевод класса С 6-, С 12-,C18-сахаров или С 2-, С 4-, С 5-, С 6-спиртов. 3. Способ по п.1 или 2, отличающийся тем,что трансформацию производного стерина общей формулы I, где Х = NH4, проводят в среде,не содержащей дополнительного источника азота. 4. Способ по п.1, отличающийся тем, что трансформацию cтерина проводят в присутствии неионогенного сорбента, в качестве которого используют модифицированные сополимеры этилстирола и дивинилбензола. 5. Способ по п.1, отличающийся тем, что выделение продукта трансформации проводят путем экстракции или с помощью неионогенного сорбента, в качестве которого используют модифицированные сополимеры этилстирола и дивинилбензола.
МПК / Метки
МПК: C12P 33/16, C12R 1/34, C07J 1/00
Метки: стеринов, 17-диона, происхождения, андрост-4-ен-3, растительного, животного, способ, производных, получения
Код ссылки
<a href="https://eas.patents.su/5-3019-sposob-polucheniya-androst-4-en-3-17-diona-iz-sterinov-rastitelnogo-i-zhivotnogo-proishozhdeniya-i-ih-proizvodnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения андрост-4-ен-3, 17-диона из стеринов растительного и животного происхождения и их производных</a>
Предыдущий патент: Зубная щетка
Следующий патент: Способ получения гидразингидрата
Случайный патент: Сеялка зернотуковая разноуровневая стерневая









