Нестероидные ингибиторы воспалений
Номер патента: 3299
Опубликовано: 24.04.2003
Авторы: Леманн Манфред, Шрельке Петер, Экердт Роланд, Кроликевич Конрад, Гизен Клаудиа, Скубалла Вернер, Калькбреннер Франк
Формула / Реферат
1. Применение, по меньшей мере, одного соединения общей формулы I для получения лекарственных средств, обладающих подавляющим воспаления действием,
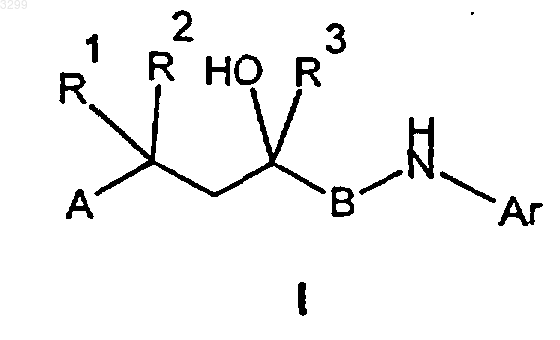
в которой
R1 и R2 имеют идентичные либо разные значения и представляют собой атом водорода, C1-C5алкильную группу или вместе с C-атомом цепи образуют кольцо в общей сложности с 3-7 членами,
R3 представляет собой C1-C5алкильную группу либо частично или полностью фторированную C1-C5алкильную группу,
A представляет собой группу
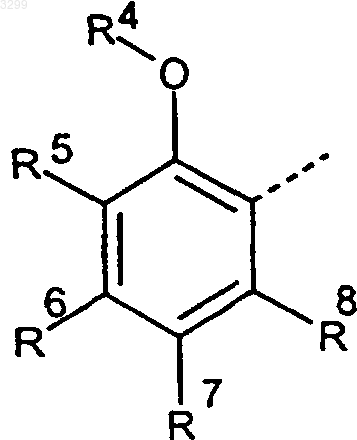
(прерывистая линия обозначает место присоединения), где
R4 обозначает атом водорода, C1-C5алкильную группу, C1-C10ацильную группу, C3-C10карбалкоксиалкильную группу, C2-C5цианалкильную группу, незамещенную либо замещенную C3-C10аллильную группу, незамещенную либо замещенную C3-C10пропаргильную группу, C2-C5алкоксиалкильную группу, частично либо полностью замещенную атомами фтора C1-C5алкильную группу,
R5-R8 имеют идентичные или отличные друг от друга значения и выбраны из группы, включающей атомы водорода либо галогена и C1-C5алкоксигруппы, и, кроме того,
R4 и R5 вместе образуют гетероциклическое кольцо, которое дополнительно к атому кислорода необязательно может содержать, по меньшей мере, еще один гетероатом из группы, включающей кислород, азот и серу, в общей сложности с 5-7 членами,
B представляет собой карбонильную или CH2-группу и
Ar представляет собой циклическую систему, выбранную из группы, представленной формулами 2-5,
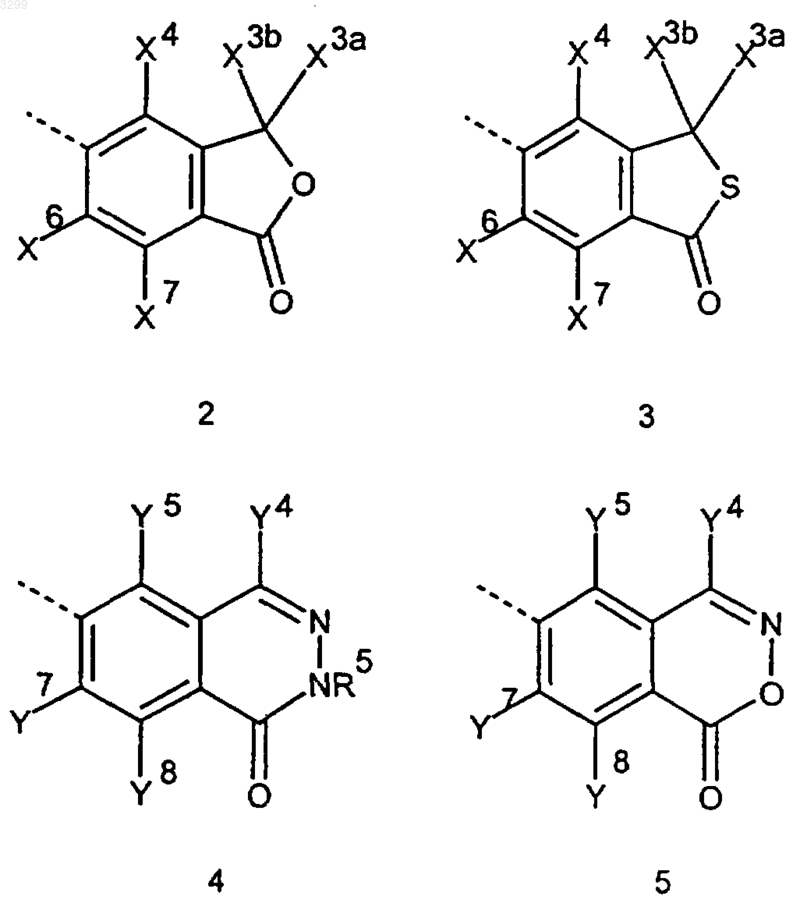
где остатки X3a, X3b, X4, X6, X7 (в формулах 2 и 3) и Y4, Y5, Y7, Y8 (в формулах 4 и 5) являются идентичными или разными и их значения выбраны из группы, включающей атомы водорода, C1-C5алкильные группы, частично либо полностью фторированные C1-C5алкилъные группы, и, кроме того, остатки X4, X6, X7 (в формулах 2 и 3) или Y5, Y7, Y8 (в формулах 4 и 5) имеют значения, выбранные из группы, включающей атомы галогенов, гидроксигруппы, C1-C5алкоксигруппы и C1-C5алканоильные группы,
а в случае, когда B представляет собой CH2-группу, также физиологически приемлемые соли соединений общей формулы I с кислотами.
2. Применение, по меньшей мере, одного соединения общей формулы I по п.1 для получения лекарственных средств, предназначенных для лечения, по меньшей мере, одного из следующих заболеваний, сопровождающихся в большинстве случаев воспалительными, аллергическими и/или пролиферативными процессами, к которым относятся:
1) заболевания легких,
2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов,
3) аллергии,
4) воспаления стенок сосудов (васкулиты),
5) кожные заболевания,
6) заболевания почек,
7) заболевания печени,
8) желудочно-кишечные заболевания,
9) проктологические заболевания,
10) заболевания глаз,
11) заболевания уха, горла, носа,
12) неврологические заболевания,
13) заболевания крови,
14) онкологические заболевания,
15) эндокринные заболевания,
16) заболевания, связанные с трансплантацией,
17) тяжелые шоковые состояния,
18) заболевания, связанные с применением заместительной терапии при недостаточности надпочечников,
19) рвота,
20) боли воспалительного генезиса (например, люмбаго).
3. Применение соединений общей формулы I по п.1 или 2 в форме рацемата, если соответствующее соединение может быть представлено в виде различных стереоизомеров.
4. Применение соединений общей формулы I по п.1 или 2 в форме разделенных стереоизомеров, если соответствующее соединение может быть представлено в виде различных стереоизомеров.
5. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-C5алкильная(ые) группа(ы) в соединении общей формулы I выбрана(ы) из группы, включающей метил, этил, н-пропил, изопропил, н-, изо-, трет-бутил, н-пентил, 2,2-диметилпропил и 3-метилбутил.
6. Применение по пп. 1, 2, 3 или 4, отличающееся тем, что атом галогена Y5, Y7, Y8 выбран из группы, включающей фтор, хлор и бром.
7. Применение по пп. 1, 2, 3 или 4, отличающееся тем, что R1 и R2 вместе с C-атомом цепи образуют циклопропильное, циклобутильное, циклопентильное или циклогексильное кольцо.
8. Применение по пп.1, 2, 3 или 4, отличающееся тем, что полностью фторированная C1-C5алкильная группа представляет собой метильную, этильную, н-пропильную, изопропильную, н-, изо-, трет-бутильную, н-пентильную, 2,2-диметилпропильную или 3-метилбутильную группу.
9. Применение по пп.1, 2, 3 или 4, отличающееся тем, что частично фторированная C1-C5алкильная группа представляет собой 5,5,5,4,4-пентафторпентильную или 5,5,5,4,4,3,3-гептафторпентильную группу.
10. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C3-C10карбалоксиалкильная группа представляет собой карбоксиметильную, трет-бутоксиметильную или этоксиметильную группу.
11. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C2-C5цианалкильная группа представляет собой цианметильную, 1- или 2-цианэтильную группу.
12. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C3-C10аллильная группа представляет собой незамещенную аллильную группу, 1-метилаллильную, 1,1-диметилаллильную, 2-метилаллильную, 3-метилаллильную, 2,3-диметилаллильную, 3,3-диметилаллильную, циннамильную или 3-циклогексилаллильную группу.
13. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C3-C10пропаргильная группа представляет собой незамещенную пропаргильную группу, метилпропаргильную, 3-метилпропаргильную, 3-фенилпропаргильную или 3-циклогексилпропаргильную группу.
14. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C2-C5алкоксиалкильная группа представляет собой метоксиметильную, этоксиметильную или 2-метоксиэтильную группу.
15. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-C5алкоксигруппа представляет собой метокси-, этокси-, н-пропокси-, изопропокси-, н-, изо-, трет-бутокси-, н-пентокси-, 2,2-диметилпропокси- или 3-метилбутоксигруппу.
16. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-C5перфторалкоксигруппа представляет собой перфорированную метокси-, этокси-, н-пропокси-, изопропокси-, н-, изо-, трет-бутокси-, н-пентокси-, 2,2-диметилпропокси- или 3-метилбутоксигруппу.
17. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-C5алканоильная группа представляет собой формильную, ацетильную, пропионильную, бутирильную, изобутирильную, валерильную, изовалерильную или пивалоильную группу.
18. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-C10ацильная группа представляет собой бензоильную, толуоильную, фенилацетильную, акрилоильную, циннамоильную или циклогексилкарбонильную группу.
19. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-C5алканоилоксигруппа, являющаяся одним из значений X4, X6, X7, Y4, Y5, Y7 или Y8, представляет собой формилокси-, ацетокси-, пропионилокси-, бутирилоксш-, изобутирилокси-, валерилокси- или изовалерилоксигруппу.
20. Применение по пп.1, 2, 3 или 4, отличающееся тем, что, если соединения общей формулы I (при B в значении -CH2-) представлены в форме солей, то они представлены в виде гидрохлорида, сульфата, нитрата, малеата, фумарата, тартрата или бензоата.
21. Применение по п.1 или 2, отличающееся тем, что используют соединение общей формулы I, в которой
R1 и R2 имеют идентичные либо разные значения и представляют собой атом водорода, метильную либо этильную группу или вместе с C-атомом цепи образуют циклопропильное кольцо, и/или
R3 представляет собой C1-C5перфторалкильную группу, и/или
A представляет собой группу
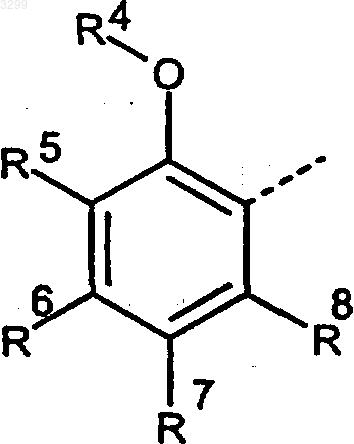
(прерывистая линия обозначает место присоединения), где
R4 обозначает атом водорода, метильную, этильную, пропильную либо 2-пропильную группу, ацетильную, метокси-, этокси- либо трет-бутоксикарбонильную группу, цианметильную либо 2-цианэтильную группу, аллильную группу, пропаргильную группу, метоксиметильную, метоксиэтильную либо этоксиэтильную группу, моно-, ди- либо трифторметильную группу, пентафторэтильную или нонафторбутильную группу,
R5-R8 в одном или двух положениях обозначают атомы фтора либо хлора, а в остальных положениях - атомы водорода, или
R4 и R5 оба вместе с атомами 2 и 3 фенильного кольца образуют фурановое, дигидрофурановое или 2,3-дигидро-1,4-диоксиновое кольцо, a R6, R7 и R8 обозначают атомы водорода,
X3a представляет собой атом водорода или метильную группу или
X3a и Х3b являются идентичными или разными и представляют собой атом водорода или метильную группу,
X4, X6 и X7 являются идентичными или разными и независимо друг от друга представляют собой атом водорода или атом фтора либо хлора, и/или
Y4 представляет собой метильную, этильную, пропильную, 2-пропильную либо трифторметильную группу, и/или
Y5, Y7 и Y8 являются идентичными или разными и независимо друг от друга представляют собой атом водорода или атом фтора либо хлора, а все другие заместители имеют значения, указанные в формуле I.
22. Применение по п.1 или 2, отличающееся тем, что используют соединение общей формулы I, в которой Ar представляет собой циклическую систему согласно формуле 2 или 5.
23. Применение, по меньшей мере, одного соединения по п.1 или 2, выбранного из группы, включающей
5-{2-гидрокси-3-[1-(2-метоксифенил)циклопропил]-2-трифторметилпропиониламино}фталид;
5-{3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино}фталид;
5-[2-гидрокси-4-(2-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-{ 3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино}фталид;
5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид;
5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
4-бром-5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
6-{3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино]-4-метил-2,3-бензоксазин-1-он;
6-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он;
6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он;
6-[2-гидрокси-4-(2-гидроксифенил)-4-метил-2-трифторметилвалероиламино]-4-этил-2,3-бензоксазин-1-он;
6-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он;
6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он;
6-[4-(4-бром-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он;
6-[4-(4-бром-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он,
а также все соединения, представленные в табл. 3-6 и в примерах 85 и 86.
24. Соединения общей формулы I по п.1, а именно:
5-{3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино}фталид;
5-{3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино]фталид;
4-бром-5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
6-{3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино}-4-метил-2,3-бензоксазин-1-он;
6-[2-гидрокси-4-(2-гидроксифенил)-4-метил-2-трифторметилвалероиламино]-4-этил-2,3-бензоксазин-1-он;
6-[4-(4-бром-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он;
5-{3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино]фталид;
6-[2-гидрокси-4-(5-фтор-2-метоксифенил)-4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он;
5-{3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино}фталид;
6-{3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино}-4-метил-2,3-бензоксазин-1-он;
(-)-4-бром-5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
(-)-4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид;
5-[2-гидрокси-4-(5-изопропил-2-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-[2-гидрокси-4-(2-метокси-5-пропилфенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-[2-гидрокси-4-(2-бензилокси-5-фторфенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-[2-гидрокси-4-(2-дифторметокси-5-фторфенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-[2-гидрокси-4-(5-фтор-2-метоксиметоксифенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-[2-гидрокси-4-(2-этоксиметокси-5-фторфенил)-4-метил-2-трифторметилвалероиламино]фталид;
5-{2-гидрокси-4-[5-фтор-2-(2-метоксиэтокси)фенил]-4-метил-2-трифторметилвалероиламино}фталид.
25. Фармацевтические препараты, содержащие в своем составе, по меньшей мере, одно соединение по п.24 и фармацевтически приемлемый носитель.
26. Применение, по меньшей мере, одного соединения по п.24 дляполучения соответствующих лекарственных средств.
Текст
1 Настоящее изобретение относится к применению нестероидных соединений для получения лекарственных средств, обладающих противовоспалительной активностью, а также к нестероидным соединениям как таковым. Наряду с большим числом стероидных соединений, эффективно связывающихся с глюкокордикоидным рецептором и обладающих противовоспалительным действием (глюкокортикоиды), известны и нестероидные соединения,которые хотя и связываются с глюкокортикоидным рецептором, но в отношении которых тем не менее до настоящего времени не удалось установить, способны ли они проявлять эффект по подавлению воспалений [ср. Nature Medicin 4,стр. 92 (1998), Mol. Pharmacol. 52, стр. 571(1997)]. Кроме того, имеются описания нестероидных соединений, дериватизированных из стероидных соединений, обладающих сродством к глюкокортикоидному рецептору и предположительно проявляющих опосредованно через рецептор противовоспалительную активность [см.Journ. Med. Chem. 36, стр. 3278-3285]. Следует,однако, отметить, что при экспериментах на животных не было обнаружено никаких преимуществ этих соединений в сравнении со стероидными глюкокортикоидами, иными словами,оказалось невозможным провести четкую границу между антивоспалительным действием и метаболическими эффектами, как, например,супрессия функции надпочечников. В последнее время были получены нестероидные соединения, которые эффективно связываются с глюкокортикоидным рецептором и,опосредованно через эту связь, способствуют подавлению воспалительных процессов. В экспериментах на животных эти соединения проявляют четкое различие между противовоспалительной эффективностью и метаболическим действием и превосходят в этом качестве как уже известные на сегодняшний день стероидные, так и нестероидные глюкокортикоиды. Пригодными согласно настоящему изобретению соединениями для получения лекарственных средств, обладающих противовоспалительной активностью, являются нестероидные соединения общей формулы IR1 и R2 имеют идентичные либо разные значения и представляют собой атом водорода,С 1-С 5 алкильную группу или вместе с С-атомом цепи образуют кольцо с в общей сложности 3-7 членами,R3 представляет собой С 1-С 5 алкильную группу либо частично или полностью фторированную С 1-С 5 алкильную группу,А представляет собой группу(прерывистая линия обозначает место присоединения), гдеR4 обозначает атом водорода, С 1 С 5 алкильную группу, С 1-С 10 ацильную группу,С 3-С 10 карбалкоксиалкильную группу, С 2-С 5 цианалкильную группу, незамещенную либо замещенную С 3-С 10 аллильную группу, незамещенную либо замещенную С 3-С 10 пропаргильную группу, С 2-С 5 алкоксиалкильную группу, частично либо полностью замещенную атомами фтора С 1-С 5 алкильную группу,R5-R8 имеют идентичные или отличные друг от друга значения и выбраны из группы,включающей атомы водорода либо галогена иC1-С 5 алкоксигруппы, и кроме того,R4 и R5 вместе образуют гетероциклическое кольцо, которое дополнительно к атому кислорода необязательно может содержать, по меньшей мере, еще один гетероатом из группы,включающей кислород, азот и серу, в общей сложности с 5-7 членами,В представляет собой карбонильную или СН 2-группу и Аr представляет собой циклическую систему, выбранную из группы, представленной субформулами 2-5, где остатки Х 3 а, Х 3b, X4, X6, X7 (в субформулах 2 и 3) и Y4, Y5, Y7, Y8 (в субформулах 4 и 5) являются идентичными или разными и их значения выбраны из группы, включающей атомы водорода, С 1-С 5 алкильные группы, частично 3 либо полностью фторированные С 1-С 5 алкильные группы, и кроме того, остатки X4, X6,X7 (в субформулах 2 и 3) или Y5, Y7, Y8 (в субформулах 4 и 5) имеют значения, выбранные из группы, включающей атомы галогенов, гидроксигруппы, С 1-С 5 алкоксигруппы и С 1-С 5 алканоилоксигруппы,а в случае, когда В представляет собой СН 2-группу, также физиологически приемлемые соли соединений общей формулы I с кислотами. Предлагаемые в изобретении соединения общей формулы I благодаря наличию асимметрических центров могут быть представлены в виде различных стереоизомеров. Как рацематы,так и выделенные стереоизомеры являются объектом настоящего изобретения. Представленные в виде групп заместители в соединениях общей формулы I могут иметь соответственно следующие значения. Под С 1-С 5 алкильными группами подразумеваются прежде всего метильная, этильная, нпропильная, изопропильная, н-, изо-, третбутильная или н-пентильная, 2,2-диметилпропильная либо 3-метилбутильная группа. Предпочтительна из них метильная или этильная группа. Под атомом галогена имеется в виду атом фтора, хлора, брома либо иода. Предпочтителен из них фтор, хлор или бром. Если R1 и R2 вместе с С-атомом цепи образуют 3-7-членное кольцо, то это может быть, например, циклопропильное, -бутильное, -пентильное или -гексильное кольцо. Предпочтительным является циклопропильное кольцо. В качестве частично либо полностью фторированной С 1-С 5 алкильной группы могут рассматриваться указанные выше перфторированные алкильные группы, из которых в свою очередь следует прежде всего назвать трифторметильную и пентафторэтильную группу, и кроме того, в качестве частично фторированных групп - 5,5,5,4,4 пентафторпентильная и 5,5,5,4,4,3,3-гептафторпентильная группа. Под С 3-С 10 карбалкоксиалкильной группой имеются в виду, например, карбоксиметильная,трет-бутоксиметильная или этоксиметилъная группа, предпочтительны из которых две названных первыми. Указанное число С-атомов относится к общему количеству С-атомов, содержащихся в карбалкоксиалкильной группе. В качестве представителей С 2-С 5 цианалкильной группы можно назвать цианметил,а также 1-и 2-цианэтил; предпочтителен из них цианметил. С 3-С 10 аллильная группа представляет собой предпочтительно незамещенную аллильную группу; в случае замещенной аллильной группы можно назвать, например, 1-метилаллил, 1,1 диметилаллил, 2-метилаллил, 3-метилаллил, 2,3 диметилаллил, 3,3-диметилаллил, циннамил и 3 циклогексилаллил. 4 В качестве примеров, представляющих С 3 С 10 пропаргильную группу, можно назвать незамещенную пропаргильную, метилпропаргильную, 3-метилпропаргильную, 3-фенилпропаргильную или 3-циклогексилпропаргильную группу; предпочтительна из них незамещенная пропаргильная группа. С 2-С 5 алкоксиалкил может представлять собой, например, метоксиметил, этоксиметил или 2-метоксиэтил. Группы, представляющие С 1-С 5 алкоксигруппу, выбраны из числа следующих: метокси,этокси, н-пропокси, изопропокси, н-, изо-, третбутокси, н-пентокси, 2,2-диметилпропокси и 3 метилбутокси. Предпочтительны из них метокси- и этоксигруппа. С 1-С 5 перфторалкоксигруппы представляют собой соответствующие перфорированные группы из числа вышеназванных С 1 С 5 алкоксигрупп. В качестве С 1-С 5 алкильной группы для этерификации гидпроксигрупп могут рассматриваться вышеназванные алкильные группы, в первую очередь метильная или этильная группа. В качестве С 1-С 5 алканоильной группы для этерификации гидроксигрупп могут рассматриваться формильная, ацетильная, пропионильная,бутирильная, изобутирильная, валерильная либо изовалерильная и пивалоильная группа; предпочтительна из них ацетильная группа. В качестве С 1-С 10 ацильной группы для этерификации гидроксигрупп можно назвать,например, вышеуказанные алканоильные группы, а из них предпочтительно ацетильную группу, а также бензоильную, толуоильную, фенилацетильную, акрилоильную, циннамоильную и циклогексилкарбонильную группу. В качестве С 1-С 5 алканоилоксигруппы дляX4, X6, X7, Y4, Y5, Y7 или Y8 могут использоваться формилокси-, ацетокси-, пропионилокси-, бутирилокси-, изобутирилокси-, валерилокси- либо изовалерилоксигруппа, предпочтительно ацетоксигруппа. Если соединения общей формулы I (где В обозначает -СН 2-) представлены в виде солей, то такими солями могут быть гидрохлориды,сульфаты, нитраты, малеаты, фумараты, тартраты или бензоаты. Если соединения по изобретению представлены в виде рацемических смесей, то с помощью известных специалистам методов разделения рацематов их можно разделять на чистые,оптически активные формы. Так, например, рацемические смеси посредством хроматографии на являющемся уже оптически активном носителе (CHIRALPAK AD) можно разделять на чистые изомеры. Другая возможность заключается в том, чтобы свободную гидроксигруппу в рацемическом соединении общей формулы I этерифицировать оптически активной кислотой до образования сложных эфиров и полученные диастереоизомерные эфиры разделять путем 5 фракционной кристаллизации либо посредством хроматографии, после чего разделенные эфиры омылять соответственно с получением в результате оптически чистых изомеров. В качестве оптически активной кислоты можно использовать, например, миндальную кислоту, камфорсульфоновую кислоту или винную кислоту. К предпочтительным согласно настоящему изобретению относятся такие соединения общей формулы I, в которойR1 и R2 имеют идентичные либо разные значения и представляют собой атом водорода,метильную либо этильную группу или вместе с С-атомом цепи образуют циклопропильное кольцо, и/или(прерывистая линия обозначает место присоединения), где R4 обозначает атом водорода, метильную, этильную, пропильную либо 2-пропильную группу, ацетильную, метокси-, этоксилибо трет-бутоксикарбонильную группу, цианметильную либо 2-цианэтильную группу, аллильную группу, пропаргильную группу, метоксиметильную, метоксиэтильную либо этоксиэтильную группу, моно-, ди- либо трифторметильную группу, пентафторэтильную или нонафторбутильную группу,R5-R8 в одном или двух положениях обозначают атомы фтора либо хлора, а в остальных положениях - атомы водорода, илиR4 и R5 оба вместе с атомами 2 и 3 фенильного кольца образуют фурановое, дигидрофурановое или 2,3-дигидро-1,4-диоксиновое кольцо,a R6, R7 и R8 обозначают атомы водорода,X3a представляет собой атом водорода или метальную группу илиX3a и X3b являются идентичными либо разными и представляют собой атом водорода или метальную группу,X4, X6 и X7 являются идентичными или разными и независимо друг от друга представляют собой атом водорода или атом фтора либо хлора, и/илиY5, Y7 и Y8 являются идентичными или разными и независимо друг от друга представляют собой атом водорода или атом фтора либо хлора, а все другие заместители имеют значения, указанные в формуле I. Предпочтительно далее использовать такие соединения общей формулы I, в которых Аr 6 обозначает кольцевую систему согласно субформуле 2 или 5. К наиболее предпочтительным для использования согласно изобретению соединениям относятся следующие: 5-2-гидрокси-3-[1-(2-метоксифенил)циклопропил]-2-трифторметилпропиониламино фталид; 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 5-[2-гидрокси-4-(2-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталид; 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилвалероиламино]фталид; 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид; 4-бром-5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилпентиламино] фталид; 4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид; 6-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[2-гидрокси-4-(2-гидроксифенил)-4 метил-2-трифторметилвалероиламино]-4-этил 2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилпентиламино]-4-метил 2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он. Помимо вышеприведенных предпочтительно использование соединений, указанных в табл. 3-6. Все названные соединения предпочтительно использовать в виде оптических антиподов или разделенных диастереомеров. Нестероидные соединения как таковые со смешанным спектром гестагенной и андрогенной активности в различном ее проявлении уже являются объектом поданной 2 июня 1998 г. 7 заявки РСТ/ЕР 98/03242 (приоритет 30 мая 1997 г., DE 19723722.3). Применяемые согласно настоящему изобретению для получения лекарственных средств с противовоспалительным действием соединения общей формулы I подпадают под объем общей формулы, представленной в заявке РСТ/ЕР 98/03242. Указанные ниже соединения общей формулы I, каждое конкретно,хотя и подпадают под объем общей формулы в не опубликованной заявке РСТ/ЕР 98/03242,конкретно в ней не рассматриваются и подробно не описываются. Тем самым они являются новыми и благодаря их противовоспалительному действию, отличному от метаболических эффектов, что впервые было установлено в отношении нестероидных соединений, они отвечают критерию патентоспособности в части, касающейся изобретательской деятельности. Поэтому данные соединения как таковые также являются объектом настоящего изобретения. Таковыми соединениями являются следующие: 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 4-бром-5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилпентиламино] фталид; 4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид; 6-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он; 6-[2-гидрокси-4-(2-гидроксифенил)-4-метил-2-трифторметилвалероиламино]-4-этил-2,3 бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилпентиламино]-4-метил 2,3-бензоксазин-1-он; 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 6-[2-гидрокси-4-(5-фтор-2-метоксифенил)4-метил-2-трифторметилпентиламино]-4-метил 2,3-бензоксазин-1-он; 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 6-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он; 8 5-[2-гидрокси-4-(5-изопропил-2-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-метокси-5-пропилфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-бензилокси-5-фторфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-дифторметокси-5 фторфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(5-фтор-2-метоксиметоксифенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-этоксиметокси-5-фторфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-2-гидрокси-4-[5-фтор-2-(2-метоксиэтокси)фенил]-4-метил-2-трифторметилвалероиламинофталид. Фармакологические характеристики В тесте на связывание с глюкокортикоидным рецептором (ГР) с использованием цитозольных препаратов из гомогенатов тимуса крысы и [3 Н]-дексаметазона в качестве эталонного вещества соединения формулы I проявляют высокое вплоть до очень высокого сродство к ГР. Наряду с этим указанные соединения в тесте на связывание с гестагенным рецептором с использованием цитозольных препаратов из гомогенатов матки кролика и [3 Н] -прогестерона в качестве эталонного вещества проявляют сродство к гестагенному рецептору. Кроме того, в тесте на связывание с минералокортикоидным рецептором (МР) с использованием цитозольных препаратов из гиппокампа крыс и [3H]-альдостерона в качестве эталонного вещества указанные соединения проявляют сродство к МР. В качестве существенного, молекулярного механизма противовоспалительного действия глюкортикоидов считают опосредованное ГР подавление транскрипции цитокинов, адгезионных молекул, ферментов и других провоспалительных факторов. Это подавление обусловливается взаимодействием ГР с другими факторами транскрипции, например АР-1 и NF-каппа-В(1996)]. Предлагаемые в изобретении соединения общей формулы I подавляют вызываемую липополисахаридом (ЛПС) секрецию цитокина IL-8 в моноцитарных клетках линии ТНР-1 человека. Концентрацию цитокинов определяли в надосадочной жидкости с помощью коммерчески доступных наборов для ELISA. Противовоспалительное действие соединений общей формулы I исследовали в экспериментах на животных (на крысах и мышах) 9 тестированием при воспалении, индуцированном кретоновым маслом. С этой целью раствор кротонового масла в этаноле наносили (местное применение) животным на уши. Одновременно или за два часа до обработки кротоновым маслом тестируемые субстанции также применяли для местного либо системного нанесения. По истечении 16-24 ч измеряли вес ушей в качестве меры определения воспалительного отека, выявляли активность пероксидазы в качестве меры определения миграции гранулоцитов и активность эластазы в качестве меры определения нейтрофильных гранулоцитов. Как было установлено при проведении указанных экспериментов, соединения общей формулы I способны подавлять все три вышеназванных фактора воспаления как при местном, так и при системном применении. Одним из наиболее часто проявляющихся нежелательных действий при терапии с использованием глюкокортикоидов является так называемый "стероидный диабет" [ср. Hatz, H.J.,Glucocorticoide: Immunologische Grundlagen,Pharmakologie und Therapierichtlinien, изд-воWissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998]. Причиной этого является стимулирование глюконеогенеза в печени в результате индукции ответственных за данный фактор ферментов и действия свободных аминокислот,образующихся вследствие разложения протеинов (катаболическое действие глюкокортикоидов). Ключевым ферментом катаболического обмена веществ в печени является тирозинаминотрансфераза (ТАТ). Активность этого фермента может быть определена фотометрическим путем на гомогенатах печени и представляет собой существенный показатель нежелательных метаболических эффектов глюкокортикоидов. Для выявления ТАТ-индукции подопытных животных по истечении 8 ч после введения тестируемых субстанций умерщвляют, затем извлекают печень и определяют активность ТАТ в гомогенате. В этом тесте соединения общей формулы I в дозировке, при которой они проявляют свою противовоспалительную эффективность, не индуцируют тиразинаминотрансферазу вовсе или индуцируют лишь в незначительной степени. Поскольку субстанции общей формулы I обладают также высокой степенью сродства к рецептору прогестерона, новые соединения тестировали на их гестагенное действие в экспериментах на животных. В этих целях проводили тест на сохранение беременности у подвергнутых овариэктомии крыс. Для этого женские особи крыс спаривали, на восьмой день беременности по истечении 2 ч после введения субстанций их подвергали под наркозом овариэктомии. В период с 8-го по 14-й день беременности животных ежедневно обрабатывали тестируемыми субстанциями, а на 15-ый день животных умерщвляли и у каждой особи выявляли 10 число живых и мертвых плодов. В матках без плода число мест имплантации определяли путем окрашивания 10%-ным раствором сульфида аммония. Было установлено, что новые соединения формулы I при дозировке 500 мкг на кг веса тела не приводят или приводят лишь крайне редко к сохранению беременности. Если же суточную дозу увеличить до порядка 10 мг на кг веса тела, то наблюдается ослабленное гестагенное действие. На этом основании можно сделать вывод о том, что предлагаемые субстанции не могут применяться в качестве гестагенов с типичным для последних спектром действия. Суммируя сказанное, следует отметить,что новые соединения общей формулы I в сравнении с применявшимися до настоящего времени стероидными глюкокортикоидами обладают следующими свойствами:- они имеют нестероидную структуру,иными словами, эти субстанции сохраняют эффективность у пациентов, в отношении которых вследствие их аллергической реакции на стероидные структуры обычных глюкокортикоидов более неприемлема терапия с использованием последних [ср. Lutz, M.E., el-Azhary R.A., Mayo- проявляют примерно такое же положительное противовоспалительное действие при незначительной метаболической эффективности;- проявляют слабое гестагенное действие несмотря на высокую степень сродства к рецептору прогестерона. Показания к применению Благодаря их противовоспалительному и в дополнение к этому противоаллергическому,иммуносупрессорному и антипролиферативному действию предлагаемые в изобретении соединения общей формулы I могут найти применение в качестве медикаментозных средств для лечения или профилактики следующих заболеваний и болезненных состояний у млекопитающих и человека. При этом под понятием "заболевания" подразумеваются показания к применению при таких заболеваниях, к которым относятся 1) заболевания легких, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами:- заболевания легких любого генезиса, вызываемые хронической обтурацией, прежде всего бронхиальная астма,- бронхиты различного происхождения,- все формы рестриктивных заболеваний легких, прежде всего аллергический альвеолит,- все формы отека легких, прежде всего токсический отек легких,- саркоидозы и гранулематозы, прежде всего болезнь Бека; 2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов, со 11 провождающиеся воспалительными, аллергическими и/или пролиферативными процессами:- все формы ревматических заболеваний,прежде всего ревматоидный артрит, острая ревматическая лихорадка, ревматическая полимиалгия,- реактивный артрит,- воспалительные заболевания мягких тканей другого происхождения,- артритные симптомы при дегенеративных заболеваниях суставов (артрозы),- травматические артриты,- коллагенозы любого происхождения, например системная красная волчанка, склеродермия, полимиозит, дерматомиозит-синдром Сьегрена, синдром Стилла, синдром Фелти; 3) аллергии, сопровождающиеся воспалительными и/или пролиферативными процессами:- все формы аллергических реакций, например отек Квинке (Quincke), сенной насморк,аллергия к укусам насекомых, аллергические реакции на лекарственные средства, препараты крови, контрастные вещества и т.п., анафилактический шок, крапивница, контактный дерматит; 4) воспаления стенок сосудов (васкулиты):- атопический дерматит (прежде всего у детей),- псориаз,- красный волосяной лишай,- эритематозные заболевания, вызываемые различными патогенными факторами, как, например, радиация, химикалии, ожоги и т.п.,- буллезный дерматит,- заболевания лихеноидного характера,- кожный зуд (например аллергического генезиса),- себорейная экзема,- розацеа (хронический дерматоз лица)- острый гепатит различного происхождения, например вирусный, токсический, вызванный определенными лекарственными средствами,- хронический агрессивный и/или хронический интермиттирующий (перемежающийся) гепатит; 8) желудочно-кишечные заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами:- отек головного мозга, прежде всего отек головного мозга, обусловленный опухолью,- множественный склероз,- острый энцефаломиелит,- менингит,- различные формы судорожных припадков, например BNS-судороги (молниеносные кивательные [салаамовы] судороги); 13) заболевания крови, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами:- обширное метастазирование, прежде всего при карциноме молочной железы, бронха и предстательной железы; 15) эндокринные заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами:- эндокринная орбитопатия,- тиреотоксический криз,- тироидит де Квервайна (de Quervain),- тироидит Хашимото,- базедова болезнь; 16) заболевания, связанные с трансплантацией органов и тканей, реакция "трансплантат против хозяина" (17):- тяжелые шоковые состояния, например анафилактический шок, синдром системного воспалительного ответа (SIRS); 18) заболевания, связанные с применением заместительной терапии в следующих случаях:- врожденная первичная недостаточность надпочечников, например врожденный андреногенитальный синдром,- приобретенная первичная недостаточность надпочечников, например болезнь Аддисона, аутоиммунный андреналитит, постинфекционная недостаточность, опухоли, метастазы и т.п.,- врожденная вторичная недостаточность надпочечников, например врожденный гипопитуитаризм,- приобретенная вторичная недостаточность надпочечников, например постинфекционная, опухоли и т.п.; 19) рвота, сопровождающаяся воспалительными, аллергическими и/или пролиферативными процессами:- например рвота, обусловленная применением цитостатиков в сочетании с 5-НТ 3 антагонистом; 20) боли воспалительного генезиса, например люмбаго. Кроме того, предлагаемые в изобретении соединения общей формулы I могут применяться для терапии и профилактики других, не указанных выше заболеваний и болезненных состояний, при которых в настоящее время используют синтетические глюкокортикоиды [см.Grundlagen, Pharmakologie und Therapierichtlinien, изд-во Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart (1998)]. Все вышеназванные показания к применению 1)-20) подробно описаны в публикацииGrundlagen, Pharmakologie und Therapierichtlinien, изд-во Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart (1998). Для достижения требуемого терапевтического эффекта при указанных выше заболеваниях и болезненных состояниях назначаемая доза может быть разной и зависит, в частности, от эффективности действия соединения общей 14 формулы I, от индивидуальных особенностей пациента, методики введения, типа и степени тяжести заболевания, а также от применения соединения в качестве соответствующего профилактического или терапевтического средства. Изобретение относится далее 1. к применению соединений формулы I по изобретению или их смеси для получения лекарственного средства, предназначенного для лечения соответствующего "заболевания"; 2. к способу лечения "заболевания", заключающемуся в использовании определенного количества соединения по изобретению, которое подавляет заболевание и которое вводят пациенту, нуждающемуся в таком лекарственном средстве; 3. к фармацевтической композиции для лечения соответствующего "заболевания", содержащей в своем составе одно из соединений по изобретению либо их смесь и, по меньшей мере,одно фармацевтическое вспомогательное вещество и/или один фармацевтический носитель. Для достижения удовлетворительных результатов суточная доза для животных, как правило, должна составлять от 1 до 100000 мкг соединения по изобретению на кг веса тела. Для крупных млекопитающих, в частности для человека, рекомендуется суточная доза в пределах от 1 до 100000 мкг на кг веса тела. Предпочтительна доза от 10 до 30000 мкг, более предпочтительно от 10 до 10000 мкг на кг веса тела. При определенных условиях эту дозу целесообразно вводить несколько раз в сутки. При лечении острого шока, например анафилактического шока, могут назначаться разовые дозы, значительно превышающие указанную выше дозировку. Фармацевтические препараты на основе новых соединений изготавливают по обычной технологии путем переработки активного вещества совместно с обычно используемыми в галенике носителями, наполнителями, средствами, способствующими распаду, связующими,смачивателями, замасливателями, абсорбентами, разбавителями, вкусовыми добавками, красителями и т.д. и переводят в соответствующую лекарственную форму. В этой связи можно сослаться на публикацию Remington's Pharmaceutical Science, 15 е издание, изд-во Mack PublishingCompany, East Pennsylvania (1980). Для орального применения могут назначаться прежде всего таблетки, драже, капсулы,пилюли, порошки, грануляты, пастилки, суспензии, эмульсии или растворы. Для парентерального введения возможно использование композиций для инъекций и инфузии. Для внутрисуставной инъекции могут применяться соответствующим образом приготовленные суспензии кристаллов. Для внутримышечной инъекции могут применяться водные и масляные растворы или суспензии и соответствующие препараты продленного действия. Для ректального вве 15 дения новые соединения могут применяться в виде суппозиториев, капсул, растворов (например для клизм) и мази как при системной, так и местной терапии. Новые соединения могут назначаться и для введения через дыхательные пути в форме аэрозолей и ингалятов. Для местного применения на глазах, а также для лечения слухового прохода, среднего уха, полости носа и околоносовых пазух новые соединения могут использоваться в виде капель, мазей и настоек в соответствующих фармацевтических композициях. Для местного нанесения могут применяться композиции в виде гелей, мазей, жирных мазей, кремов, паст, пудры, молочка и настоек. Для достижения требуемого фармакологического эффекта соединения общей формулы I в последнем случае рекомендуется назначать в дозировке от 0,01 до 20%. Изобретение относится также к предлагаемым соединениям общей формулы I в качестве терапевтического активного вещества. Изобретение относится далее к предлагаемым соединениям общей формулы I, используемым в качестве терапевтического активного вещества совместно с фармацевтически приемлемыми вспомогательными веществами и носителями. Объектом настоящего изобретения является также фармацевтическая композиция, содержащая в своем составе одно из фармацевтически активных предлагаемых соединений либо их смесь и фармацевтически приемлемую соль или фармацевтически приемлемые вспомогательные вещества и носители. Особенно эффективное фармацевтическое действие проявляют прежде всего соединения из представленной ниже группы, где наиболее предпочтительным является второе из них: 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид; 5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилпентиламино]фталид; 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он. Примеры Соединения общей формулы I по изобретению можно получать следующим образом. Способы получения(1) Карбонильное соединение общей формулы II 16 в которой А, В, Аr, R1 и R2 имеют значения, указанные в формуле I, подвергают взаимодействию с соединением общей формулы CnF2n+1-SiR3 гдеR3 имеет значения, указанные в общей формуле I, в присутствии катализатора либо с металлоорганическим соединением, например с реактивом Гриньяра или алкиллитием, с получением в результате соединения формулы I. В качестве катализатора могут использоваться фториды или основные соединения, такие как карбонаты щелочных металлов (см. Journ. Am.(2) Соединение общей формулы III в которой А, В, R1, R2 и R3 имеют значения, указанные в формуле I, a FG обозначает уходящую группу, подвергают взаимодействию с соединением формулы Ar-NH-R9, где R9 обозначает атом водорода или C1-C5 ацильную группу и Ar имеет значение, указанное в общей формуле I,при этом остаток R9 при определенных условиях затем отщепляют с целью получить соединение формулы I. Соединение общей формулы III при этом можно необязательно образовывать лишь как промежуточный продукт, который может представлять собой, например, хлорангидрид кислоты, образованный из соответствующей карбоновой кислоты. В качестве уходящей группы можно назвать, например, атом фтора, хлора либо брома или тозилат.(3) Соединение общей формулы IVAr имеют значения, указанные в разделе (2), в растворителе либо без растворителя, при этом остаток R9 при определенных условиях затем отщепляют с целью получить соединение формулы I, где B обозначает CH2-группу.(4) Соединение формулы I, в которой R4 обозначает атом водорода, подвергают взаимодействию с соответствующим реагентом с целью получить соединения, где R4 имеет другие значения, указанные для формулы I. Одной из возможностей этого является, например, этерификация соответствующего гидроксильного соединения с образованием простого или сложного эфира. Для получения всех соединений, подпадающих под общую формулу I, пригодными из представленных выше вариантов способа являются варианты (1) и (2). 17 С помощью варианта (3) могут быть получены соединения общей формулы I, где В представляет собой СН 2-группу. При необходимости соединения, которые получали по одному из вышеприведенных способов и в которых А представляет собой необязательно замещенное ароматическое кольцо, с помощью известных способов можно селективно замещать по этому ароматическому остатку. Примерами осуществления названного способа являются каталитическое гидрирование многократных связей, азотирование и галогенирование. Используемые в примерах исходные материалы получают следующим образом: Получение исходных материалов 3-[1-(2-метоксифенил)циклопропил]-2 оксопропионовая кислота В соответствии с технологией, описанной вJourn. Org. Chem. 40, стр. 3497 (1975), подвергают взаимодействию 16,7 г 2-метоксифенилацетонитрила, 158 мл триизопропиламида лития (2 молярный раствор) и 46,7 мл 1,2-дихлорэтана в 96 мл тетрагидрофурана и 58,6 мл триамида гексаметилфосфорной кислоты. Таким путем получают 5,6 г 1(2-метоксифенил)циклопропилкарбонитрила,tкип 104-115 С/0,1 мбар, продолжая реакцию далее аналогично описанной при получении (1-фенилциклобутил)-2-оксопропионовой кислоты. В результате получают 3-[1-(2-метоксифенил)циклопропил]2-оксопропионовую кислоту в виде масла. 4-(5-фтор-2-метоксифенил)-2-гидрокси-4 метил-2-трифторметилвалериановая кислота 1,3 г безводного хлорида цинка и 13,2 г зернистого марганца нагревают до кипения в 100 мл тетрагидрофурана и кипятят в течение 30 мин с 0,2 мл металлилбромида. Затем в течение 2 ч при температуре кипения добавляют по каплям раствор из 25 г металлилбромида и 17 г этилового эфира трифторпировиноградной кислоты в 80 мл тетрагидрофурана и продолжают кипятить еще в течение 1 ч. После этого при охлаждении льдом добавляют насыщенный раствор хлорида аммония и 300 мл этилацетата,перемешивают в течение 30 мин при 0 С и отделенную этилацетатную фазу промывают насыщенным раствором хлорида аммония и трижды водой. Растворитель сушат (Na2SO4) и выпаривают, а остаток перегоняют под вакуумом. В результате получают 17,6 г этилового эфира 2 гидрокси-4-метилен-2-трифторметилвалериановой кислоты, tкип 48 С/1 гПа. Далее к 5 мл 4-фторанизола и 0,9 г этилового эфира 2-гидрокси-4-метилен-2-трифторметилвалериановой кислоты добавляют 0,8 г безводного хлорида алюминия. После перемешивания в течение 40 ч при комнатной температуре сливают на охлажденную льдом 2 н. соляную кислоту и экстрагируют этилацетатом. Этилацетатную фазу промывают 1 н. соляной кислотой и водой, сушат (Na2SO4) и упаривают. После хроматографии на силикагеле с использованием 18 гексана/этилацетата (в соотношении 1:1) получают 1 г этилового эфира 4-(5-фтор-2 метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, tпл 38-39 С. 1,9 г этилового эфира 4-(5-фтор-2 метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты в течение 2 ч кипятят с обратным холодильником с 40 мл гидроксида калия в метаноле (10%-ного). После выпаривания растворителя под вакуумом добавляют воду, экстрагируют гексаном и отделенную водную фазу подкисляют 6 н. соляной кислотой. После экстракции этилацетатом этилацетатную фазу промывают водой, сушат(Na2SO4) и упаривают. Остаток кристаллизуют из гексана. Таким путем получают 1,55 г 4-(5 фтор-2-метоксифенил)-2-гидрокси-4-метил-2 трифторметилвалериановой кислоты, tпл 102104 С. Представленные в нижеследующей табл. 1 кислоты получали аналогичным образом. Таблица 1 Из представленных в таблице кислот либо их предварительных стадий путем соответствующего превращения с помощью стандартных методов получают также другие кислоты: 4-(4-циан-2-метоксифенил)-2-гидрокси-4 метил-2-трифторметилвалериановая кислота Указанную в заголовке кислоту получают из этилового эфира 4-(4-бром-2-метоксифенил)2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, цианида цинка и тетракистрифенилфосфинпалладия в диметилформамиде при 140 С. После омыления получают указанную в заголовке кислоту в виде аморфного порошка. 4-(4-иод-2-метоксифенил)-4-метил-2-оксовалериановая кислота К 24,2 ммоля метилмагнийбромида в 23 мл диэтилового эфира добавляют 3,2 г метилового эфира 4-иод-2-метоксибензойной кислоты в 10 мл диэтилового эфира. По истечении 20 ч добавляют раствор хлорида аммония, эфирную фазу отделяют, сушат и упаривают. 2,4 г образовавшегося остатка растворяют в 10 мл дихлорметана, смешивают с 714 мг этилового эфира 2-триметилсилилоксиакриловой кислоты,охлаждают до -70 С и примешивают 0,27 мл хлорида олова (IV). Через 15 мин раствор сливают на раствор карбоната калия. После экс 19 тракции диэтиловым эфиром органическую фазу промывают водой, сушат и упаривают. 500 мг полученного таким путем этилового эфира 4-(4 иод-2-метоксифенил)-4-метил-2-оксовалериановой кислоты перемешивают в течение 3 ч при комнатной температуре с 8,6 мл 1 М гидроксида натрия в этаноле/воде (объемное соотношение 2:1). После добавления воды экстрагируют диэтиловым эфиром, водную фазу подкисляют 1-молярной соляной кислотой и экстрагируют диэтиловым эфиром. После сушки и упаривания получают 410 мг 4-(4-иод-2 метоксифенил)-4-метил-2-оксовалериановой кислоты в виде масла желтоватого цвета. 4-(5-фтор-2-метоксифенил)-4-метил-2 оксовалериановая кислота Указанную в заголовке кислоту получают аналогично предыдущему примеру, tпл 58-60 С. 4-(4-бром-2-метоксифенил)-2-оксовалериановая кислота Указанную в заголовке кислоту получают аналогично предыдущему примеру в виде масла. 4-(2,3-дигидро-7-бензофуранил)-4-метил 2-оксовалериановая кислота Из 1,7 г метилового эфира 2,3 дигидробензофуран-7-карбоновой кислоты в 35 мл диэтилового эфира и 7 мл 3-молярного раствора метилмагнийхлорида в тетрагидрофуране по обычной технологии получают 1,69 г 1-(2,3 дигидро-7-бензофуранил)-1-метилэтанола. Этот продукт подвергают далее превращению аналогично описанному способу получения 4-(4-иод 2-метоксифенил)-4-метил-2-оксовалериановой кислоты. В результате получают 1,8 г указанного в заголовке соединения в виде желто-коричневого масла. 4-(3-хлор-2-метоксифенил)-2-оксовалериановая кислота К 10 г 3-хлорсалициловой кислоты и 18 г карбоната калия в 88 мл диметилформамида добавляют 8,2 мл метилиодида и смесь перемешивают в течение ночи. Затем разбавляют водой, экстрагируют этилацетатом, органическую фазу сушат (Na2SO4) и упаривают. Остаток перегоняют с помощью трубки с шаровым расширением. В результате получают 10 г метилового эфира 3-хлор-2-метоксибензойной кислоты, tпл 100 С/0,17 мбар. Этот эфир подвергают дальнейшему превращению аналогично описанному способу получения 4-(4-иод-2-метоксифенил)-4 метил-2-оксовалериановой кислоты. Таким путем получают 8 г указанного в заголовке соединения в виде светло-желтого масла. 4-(6-фтор-2-метоксифенил)-2-оксовалериановая кислота Из 18 г 6-фторсалициловой кислоты аналогично описанному способу получения 4-(3 хлор-2-метоксифенил)-2-оксовалериановой кислоты получают 18 г указанного в заголовке соединения в виде светло-желтого масла. 20 4-(5-фтор-2-метоксифенил)-2-гидрокси-4 метил-2-трифторметилпентиловый эфир 4-толуолсульфокислоты 810 мг 4-(5-фтор-2-метоксифенил)-2 гидрокси-4-метил-2-трифторметилвалериановой кислоты подвергают восстановительной реакции в 20 мл простого эфира, используя с этой целью 190 мг алюмогидрида лития. После добавления водного раствора гидрокарбоната натрия эфирную фазу отделяют, сушат (Na2SO4),упаривают и остаток перегоняют с помощью трубки с шаровым расширением. В результате получают 700 мг 2-гидрокси-4-(5-фтор-2 метоксифенил)-4-метил-2-трифторметилпентанола, который растворяют в 7 мл пиридина и при 0 С смешивают с 440 мг хлорангидрида 4 толуолсульфокислоты. По истечении 2 дней выдержки при 0 С концентрируют под вакуумом, распределяют между 1 М соляной кислотой и этилацетатом, этилацетатную фазу еще несколько раз промывают 1 М соляной кислотой,сушат (Na2S04) и упаривают. Таким путем получают соединение, указанное в заголовке, tпл 9394 С. 4-(5-фтор-2-метоксифенил)-2-гидрокси-2 трифторметилпентиловый эфир 4-толуолсульфокислоты Указанное в заголовке соединение получают аналогично предыдущему примеру, tпл 4850 С. 2-[2-(5-фтор-2-метоксифенил)-2-метилпропил]-2-трифторметилоксиран 3,5 г 2-гидрокси-4-(5-фтор-2-метоксифенил)-4-метил-2-трифторметилпентанола и 3,45 г трифенилфосфина растворяют в 50 мл тетрагидрофурана и при 0 С тремя порциями смешивают с 2,5 мл диэтилового эфира азодикарбоновой кислоты. По истечении 1 ч выдержки при 0 С продолжают перемешивание еще в течение 16 ч при комнатной температуре, затем в течение 7 ч кипятят с обратным холодильником и повторно в течение 48 ч перемешивают при комнатной температуре. После упаривания добавляют смесь из гексана и изопропилового эфира, фильтруют и фильтрат хроматографируют на силикагеле. Элюированный гексаном/этилацетатом продукт перегоняют с помощью трубки с шаровым расширением, tкип 100 С/0,5 мбара. 2-[2-(4-бром-2-метоксифенил)-2-метилпропил]-2-трифторметилоксиран Указанное в заголовке соединение получают аналогично предыдущему примеру, tкип 120 С/0,04 мбара. 4-бром-5-аминофталид 23 г 3-бром-4-нитро-1,2-ксилола суспендируют в 200 мл пиридина и 600 мл воды и при 60 С порциями смешивают с 260 г перманганата калия, при этом температура повышается до 90 С. Далее в течение 2 ч нагревают до 95 С,фильтруют, фильтрат подкисляют соляной кислотой и экстрагируют диэтиловым эфиром. 21 После выпаривания растворителя получают 27 г 3-бром-4-нитрофталевой кислоты. Затем 12 г этой кислоты в течение 15 мин нагревают до 220 С, после чего перегоняют с помощью трубки с шаровым расширением. В результате перегонки под давлением 0,03 гПа получают 10 г ангидрида 3-бром-4-нитрофталевой кислоты. Этот ангидрид растворяют в 120 мл диметилформамида и при 0 С медленно смешивают с 78,8 мл 0,5 М раствора борогидрида натрия в диметилформамиде. После 3-часовой выдержки при 0 С осторожно добавляют 2 н. соляную кислоту и экстрагируют этилацетатом. После промывки раствором бикарбоната натрия, сушки(Na2SO4) и упаривания этилацетатной фазы получают 6,6 г 4-бром-5-нитрофталида. Затем 6,6 г 4-бром-5-нитрофталида растворяют в 45 мл этанола и по каплям добавляют к нагретой до 60 С и тщательно перемешанной смеси из 65 г сульфата железа(II), 220 мл воды и 65 мл аммиака(33%-ного). После 2-часовой выдержки при 60 С смесь пять раз размешивают с 200 мл диэтилового эфира. Диэтилэфирные фазы упаривают и получают в виде остатка 4,1 г 4-бром-5 аминофталида с tпл 176-180 С. 6-бром-5-аминофталид Ангидрид 4-бром-5-нитрофталевой кислоты получают аналогично способу, описанному в предыдущем примере, из 4-бром-5-нитро-1,2 ксилола. Кипячением с этанолом из него получают смесь 2-бром-6-этоксикарбонил-3-нитробензойной кислоты и 3-бром-2-этоксикарбонил 4-нитробензойной кислоты. К 7,2 мл 0,66-молярного раствора диметилформамида в дихлорметане при 0 С осторожно добавляют по каплям 1,2 мл хлорангидрида щавелевой кислоты. Раствор перемешивают сначала в течение 1 ч при 0 С, а затем в течение 5 мин при комнатной температуре. После упаривания под вакуумом образовавшийся остаток суспендируют в 7 мл ацетонитрила, охлаждают до -35 С и по каплям смешивают с 1,5 г смеси сложных эфиров. После выдержки в течение одного часа при этой температуре охлаждают до -70 С и по каплям добавляют 2,4 мл 2 молярного раствора борогидрида натрия в диметилформамиде. Далее в течение 20 ч перемешивают при комнатной температуре, добавляют воду, подщелачивают карбонатом калия и экстрагируют диэтиловым эфиром. Диэтилэфирную фазу сушат (Na2SO4) и упаривают. В результате получают смесь из 5-бром-6-нитрофталида и 6 бром-5-нитрофталида, которую разделяют на силикагеле с использованием гексана/этилацетата (в соотношении 95:5). Восстановление до аминофталида осуществляют по описанной выше технологии. Таким путем получают 6 бром-5-аминофталид с tпл 235-241C. Аналогичным путем получают также фталиды, представленные в табл. 2. 5-ацетамидофталид 3 г 5-аминофталида, 10 мл ацетангидрида и 30 мл тетрагидрофурана кипятят в течение 1 ч с обратным холодильником. Выпавшие после охлаждения кристаллы отфильтровывают вакуум-фильтрацией и промывают изопропиловым эфиром. В результате получают 3,3 г указанного в заголовке соединения с tпл 300C. 6-амино-4-метил-2,3-бензоксазин-1-он 60 г 2-метил-5-нитроацетофенона, 38,5 г 2,2-диметил-1,3-пропандиола и 6 г п-толуолсульфокислоты кипятят в 1 л толуола с использованием водоотделителя до завершения образования воды. Затем раствор промывают карбонатом калия, сушат (Na2SO4) и упаривают. Из пентана получают 71,7 г кристаллического кеталя. Этот кеталь по технологии, описанной выше при получении 4-бром-5-аминофталида,окисляют в 1,5 л пиридина и 4,5 л воды, 350 г перманганата калия, получая в результате 56,4 г 4-нитро-2-(2,5,5-триметил-1,3-диоксан-2-ил)бензойной кислоты. 52 г этой кислоты гидрируют в 500 мл метанола и 500 мл этилацетата 10 граммами палладия на угле (10%-ного). Из пентана получают 45,5 г кристаллического аминосоединения. Далее 10 г амина в течение 2 ч кипятят с обратным холодильником со 100 мл концентрированной соляной кислоты. Растворитель выпаривают под вакуумом и остаток в течение 12 ч кипятят с обратным холодильником с 15,7 г гидрохлорида гидроксиламина, 8,4 г гидроксида калия, 120 мл этанола и 50 мл воды. Затем разбавляют водой и выпавшие кристаллы отфильтровывают вакуумфильтрацией. После сушки получают 3,5 г 6 амино-4-метил-2,3-бензоксазин-1-она с tпл 291296 С. 6-амино-4-этил-2,3-бензоксазин-1-он Это соединение получают аналогично получению 2-метил-5-нитропропиофенона, tпл 8993 С. 6-ацетамидо-4-метил-2,3-бензоксазин-1-он Это соединение получают аналогично получению 5-ацетамидофталида из 6-амино-4 метил-2,3-бензоксазин-1-она с тем, однако, отличием, что кипятят с обратным холодильником только в течение 6 дней, а затем добавляют воду и экстрагируют этилацетатом. После сушки и выпаривания растворителя получают указанное 23 в заголовке соединение в виде кристаллов с tпл 223-229 С. 5-[4-(4-иод-2-метоксифенил)-4-метил-2-оксовалероиламино]фталид 1,7 г 4-(4-иод-2-метоксифенил)-4-метил-2 оксовалериановой кислоты растворяют в 25 мл диметилацетамида и в атмосфере аргона при -8 С смешивают с 0,37 мл тионилхлорида. После 20 минутного перемешивания при температуре в интервале от -3 до +3 С добавляют 700 мг 5 аминофталида. Затем перемешивают в течение 1,5 ч при комнатной температуре, смешивают с водой, экстрагируют этилацетатом, органическую фазу промывают водой, сушат (Na2SO4) и после выпаривания растворителя и хроматографии сырого продукта на силикагеле с использованием гексана/этилацетата (в соотношении 80:20) получают 1,5 г 5-[4-(4-иод-2-метоксифенил)-4-метил-2-оксовалероиламино]фталида в виде пенистого вещества. 5-[4-(4-бром-2-метоксифенил)-4-метил-2 оксовалероиламино]фталид Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 5-аминофталида и 4-(4-бром-2 метоксифенил)-4-метил-2-оксовалериановой кислоты, tпл 136-140 С. 5-[4-(3-хлор-2-метоксифенил)-4-метил-2 оксовалероиламино]фталид Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 5-аминофталида и 4-(3-хлор-2 метоксифенил)-4-метил-2-оксовалериановой кислоты в виде пенистого вещества бежевого цвета. 5-[4-(6-фтор-2-метоксифенил)-4-метил-2 оксовалероиламино]фталид Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 5-аминофталида и 4-(6-фтор-2 метоксифенил)-4-метил-2-оксовалериановой кислоты, tпл 175-179 С. 5-3-[1-(2-метоксифенил)циклопропил]-2 оксопропиониламинофталид Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 5-аминофталида и 3-[1-(2 метоксифенил)циклопропил]-2-оксопропионовой кислоты, tпл 190-202 С. 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-оксопропиониламинофталид Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 5-аминофталида и 3-[1-(5-фтор-2 метоксифенил)циклопропил]-2-оксопропионовой кислоты, tпл 190-193 С. 24 5-[4-(2,3-дигидро-7-бензофуранил)-4 метил-2-оксовалероиламино]фталид Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 5-аминофталида и 4-(2,3 дигидро-7-бензофуранил)-4-метил-2-оксовалериановой кислоты в виде белого пенистого вещества. 6-[4-(5-фтор-2-метоксифенил)-4-метил-2 оксовалероиламино]-4-метил-2,3-бензоксазин-1-он Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 6-амино-4-метил-2,3-бензоксазин-1-она и 4-(5-фтор-2-метоксифенил)-4-метил-2-оксовалериановой кислоты, tпл 171-173 С. 4-этил-6-[4-(5-фтор-2-метоксифенил)-4 метил-2-оксовалероиламино]-2,3-бензоксазин-1-он Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 6-амино-4-этил-2,3-бензоксазин 1-она и 4-(5-фтор-2-метоксифенил)-4-метил-2 оксовалериановой кислоты, tпл 157-158 С. 6-[4-(6-фтор-2-метоксифенил)-4-метил-2 оксовалероиламино]-4-метил-2,3-бензоксазин-1-он Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод-2 метоксифенил)-4-метил-2-оксовалероиламино] фталида из 6-амино-4-метил-2,3-бензоксазин-1-она и 4-(6-фтор-2-метоксифенил)-4-метил-2 оксовалериановой кислоты, tпл 178-181 С. 6-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-оксопропиониламино-4-метил-2,3 бензоксазин-1-он Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 6-амино-4-метил-2,3-бензоксазин-1-она и 3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-оксопропионовой кислоты, tпл 222227 С. 6-[4-(2,3-дигидро-7-бензофуранил)-4-метил-2-оксовалероиламино]-4-метил-2,3-бензоксазин-1-он Это соединение получали аналогично вышеописанному способу получения 5-[4-(4-иод 2-метоксифенил)-4-метил-2-оксовалероиламино]фталида из 6-амино-4-метил-2,3-бензоксазин-1-она и 4-(2,3-дигидро-7-бензофуранил)-4 метил-2-оксовалериановой кислоты, tпл 171177 С. Ниже изобретение более подробно поясняется на примерах его выполнения. Другие соединения можно получать за счет использования гомологичных/аналогичных реагентов. Необходимые для их получения исходные соединения описаны выше в разделе "Исходные соединения". 25 Пример 1 (способ 1) 5-2-гидрокси-3-[1-(2-метоксифенил)циклопропил]-2-трифторметилпропиониламинофталид 500 мг 5-3-[1-(2-метоксифенил)циклопропил]-2-оксопропиониламинофталида растворяют в атмосфере аргона в 15 мл диметилформамида и при охлаждении льдом смешивают с 0,77 мл трифторметилтриметилсилана и 500 мг карбоната цезия. После 18-часового перемешивания при комнатной температуре добавляют 5 мл 1 М раствора фторида тетрабутиламмония в тетрагидрофуране и несколько капель воды и перемешивают в течение 1 ч при комнатной температуре. После добавления 100 мл воды экстрагируют этилацетатом, органическую фазу сушат (Na2SO4) и упаривают. Сырой продукт хроматографируют на силикагеле, используя с этой целью гексан/этилацетат (в соотношении 80:20) и в результате получают в чистом виде указанное в заголовке соединение. Энантиомерную смесь разделяют посредством хроматографии на хиральном носителе (CHIRALPAK AD, фирма DAICEL) с использованием гексана/2-пропанола/этанола (в объемном соотношении 900:25:25). Таким путем получают+106,9 (c=0,5, СНСl3),(-)-энантиомер с tпл 195-208 С, []D104,9 (с = 0,5, СНС 13). Пример 2. 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид Указанное в заголовке соединение получают аналогично примеру 1 из 5-3-[1-(5-фтор 2-метоксифенил)циклопропил]-2-оксопропиониламинофталида, tпл 170-179 С (рацемат). Пример 3 (способ 2) 5-[2-гидрокси-4-(2-метоксиметил)-4 метил-2-трифторметилвалероиламино]фталид 400 мг 2-гидрокси-4-(2-метоксифенил)-4 метил-2-трифторметилвалериановой кислоты смешивают в 5 мл диметилацетамида при 0 С с 0,23 мл тионилхлорида. После 30-минутного перемешивания при 0 С добавляют 390 мг 5 аминофталида в 2 мл диметилацетамида и при этой температуре смесь продолжают перемешивать еще в течение 4 ч. Затем добавляют ледяную воду, экстрагируют этилацетатом и после сушки (Na2SO4) сырой продукт хроматографируют на силикагеле, используя с этой целью гексан/этилацетат (в соотношении 50:50), и в результате получают указанное в заголовке соединение в виде кристаллов с tпл 134-135 С. После разделения рацематов получают 26 Аналогичным путем получают соединения, представленные в табл. 3. Таблица 3Z2 = OCH3, Z4 = CN 135-136 рацематПримечание: Представленные в таблице оптически активные соединения разделяли аналогично примеру 1. Если не указано иное, измерение проводили в метаноле. 4 5 6 7Z2 = OCH3, Z4 = Br CH3 196-198 -122,2 (СНСl3)Примечание: Представленные в таблице оптически активные соединения разделяли аналогично примеру 1. Если не указано иное, измерение проводили в метаноле. 27 Пример 42. 5-[2-гидрокси-4-(5-фтор-2-метоксифенил)4-метил-2-трифторметилпентиламино]фталид 688 мг ацамидофталида в 15 мл тетрагидрофурана смешивают в атмосфере аргона при 0 С с 108 мг 80%-ной гидрид натрия/масляной суспензии. После 10-минутного перемешивания при этой температуре добавляют 556 мг [2 гидрокси-4-(5-фтор-2-метоксифенил)-2-трифторметилпентилового]эфира 4-толуолсульфокислоты. После 16-часового перемешивания при 60 С сливают на 1 М соляную кислоту, нейтрализуют карбонатом калия и экстрагируют этилацетатом. После сушки (Na2SO4) сырой продукт хроматографируют на силикагеле, используя с этой целью гексан/этилацетат (в соотношении 60:40), и получают таким путем указанное в заголовке соединение в виде кристаллов с tпл 148-149 С. Пример 43. 6-[2-гидрокси-4-(5-фтор-2-метоксифенил)4-метил-2-трифторметилпентиламино]-4-метил-2,3-бензоксазин-1-он 584 мг 2-[2-(5-фтор-2-метоксифенил)-2 метилпропил]-2-трифторметилоксирана, 282 мг 6-амино-4-метил-2,3-бензоксазин-1-она и 1 мл 1,3-диметил-3,4,5,6-тетрагидро-2[1 Н]-пиримидинона нагревают в течение 6 ч до 120 С. После добавления 1 мл тетрагидрофурана хроматографируют на силикагеле и, используя гексан/этилацетат/тетрагидрофуран (в соотношении 55:40:5), элюируют указанное в заголовке соединение, tпл 178-179 С. Пример 44. 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид 225 мг 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталида смешивают в 4,5 мл дихлорметана при 0 С с 2,48 мл 1-молярного раствора трибромида бора в дихлорметане. После перемешивания в течение 3 ч при 0 С смесь сливают на воду, экстрагируют этилацетатом,органическую фазу сушат (Na2SO4) и упаривают. После растирания остатка с гексаном получают указанное в заголовке соединение в кристаллической форме, tпл 196-199 С. Пример 45. 6-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он Указанное в заголовке соединение получают аналогично 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталиду из 6-3-[1-(5-фтор-2 метоксифенил)циклопропил]-2-гидрокси-2 трифторметилпропиониламино-4-метил-2,3 бензоксазин-1-она, tпл 236-244 С. 28 Пример 46. 6-[2-гидрокси-4-(5-фтор-2-гидроксифенил)-4-метил-2-трифторметилвалероиламино]4-метил-2,3-бензоксазин-1-он Указанное в заголовке соединение получают аналогично 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталиду из 6-[2-гидрокси 4-(5-фтор-2-метоксифенил)-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин 1-она, tпл 234-236 С,(+)-энантиомер, tпл 230-234 С, []D +34(с = 0,5). Пример 47. 6-[2-гидрокси-4-(2-гидроксифенил)-4 метил-2-трифторметилвалероиламино]-4-этил 2,3-бензоксазин-1-он Указанное в заголовке соединение получают аналогично 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталиду из 6-[2-гидрокси-4(2-метоксифенил)-4-метил-2-трифторметилвалероиламино]-4-этил-2,3-бензоксазин-1-она,tпл 164 С,(+)-энантиомер с tпл 191-192 С, []D(с = 0,5, СНС 13). Аналогичным путем получают соединения, представленные в табл. 5 А и 5 Б согласно примерам, также указанным в таблицах. Таблица 5 АZ2 = OH, Z4 - Br 224-226 рацематПримечание: Представленные в таблице оптически активные соединения разделяли аналогично примеру 1. Если не указано иное, измерение проводили в метаноле.+ 34,5 С = 0 Z2 = ОН, Z6 = F 240-252 рацемат С = 0 Z2 = ОН, Z4 = Br 248-250 рацемат С = 0 Z2 = OH, Z4 = Br 249-251 + 20,0 (с = 0,5, ТГФ)Примечание: Представленные в таблице оптически активные соединения разделяли аналогично примеру 1. Если не указано иное, измерение проводили в метаноле. Пример 65 66 67 68 69 Пример 70 (способ 5) 5-[4-(2-этокси-5-фторфенил)-2-гидрокси-4 метил-2-трифторметилвалероиламино]фталид 44 мг 5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилвалероиламино]фталида в течение 24 ч перемешивают в 1 мл диметилформамида при комнатной температуре с 28 мг карбоната калия и 50 мг этилиодида. Затем смешивают с водой, экстрагируют этилацетатом, органическую фазу промывают водой, сушат (Na2SO4) и после выпаривания растворителя получают 35 мг 5-[4-(2-этокси-5 фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталида, tпл 108 С. Аналогично предыдущему примеру получали соединения, представленные в табл. 6. Таблица 6ClCH2OC2H5 113-114 рацемат 82 СН 2 СН 2 ОСН 3 ClCH2CH2OCH3 168-169 рацематПримечание: Представленные в таблице оптически активные соединения разделяли аналогично примеру 1. Если не указано иное, измерение проводили в метаноле. Пример(-)-4-бром-5-[4-(5-фтор-2-гидроксифенил)2-гидрокси-4-метил-2-трифторметилпентиламино]фталид 55 мг (-)-5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилпентиламино]фталида смешивают в атмосфере азота в 1 мл диметилформамида при 2 С с 18 мг N 30 бромсукцинимида. После выдержки в течение 2 ч при этой температуре разбавляют 20 мл этилацетата, экстрагируют водой и органическую фазу сушат (Na2SO4) и упаривают. Путем хроматографии на силикагеле с использованием гексана/этилацетата (в соотношении 4:1) элюируют указанное в заголовке соединение в кристаллической форме, tпл 228-232 С. Пример 84.(-)-4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид Если в предыдущем примере на 100 мг (-)5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4 метил-2-трифторметилпентиламино]фталида использовать 44 мг N-бромсукцинимида, то после хроматографии на силикагеле, используя с этой целью гексан/этилацетат (в соотношении 7:3), получают указанное в заголовке соединение в кристаллической форме, tпл 144-146 С. Пример 85. 5-[4-(2,3-дигидро-7-бензофуранил)-2 гидрокси-4-метил-2-трифторметилпентаноиламино]фталид Это соединение получают аналогично примеру 1 из 5-[4-(2,3-дигидро-7-бензофуранил)-4-метил-2 оксопентаноиламино]фталида, tпл 182-185 С. Пример 86. 6-[4-(2,3-дигидро-7-бензофуранил)-2 гидрокси-4-метил-2-трифторметилпентаноиламино]-4-метил-2,3-бензоксазин-1-он Это соединение получают аналогично примеру 1 из 6-[4-(2,3-дигидро-7-бензофуранил)-4-метил-2-оксопентаноиламино]-4-метил 2,3-бензоксазин-1-она, tпл 215-220 С. Примеры по исследованию фармакологических свойств В тесте на связывание с глюкокортикоидным рецептором (ГР) с использованием цитозольных препаратов из гомогенатов тимуса крысы и 10 нМ [3 Н]-дексаметазона в качестве эталонного вещества [ср. Lefebvre и др., Journ.Steroid. Biochem. 33, стр. 557-563 (1989)] соединения формулы I проявляют высокое вплоть до очень высокого сродство к ГР (см. таблицу). Таблица ГР-показателей СоединениеV 2,6 е-9 Дексаметазон 2,0 е-8 Примечание: "е" представляет собой основание натурального логарифма. Указанные в таблице соединения относятся к особенно предпочтительным. Таковыми являются следующие соединения: 31 2) 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид; 3) 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 4) 6-[4-(4-бром-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 5) 6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он. Предлагаемые в изобретении соединения общей формулы I подавляют вызываемую липополисахаридом (ЛПС) секрецию цитокина IL8 в моноцитарных клетках линии ТНР-1 человека. Концентрацию цитокинов определяли в надосадочной жидкости с помощью коммерчески доступных наборов для ELISA [ср. Welker и др.,Int. Arch. Allergy Immunol. 109, стр. 110-115(1996)]. Максимальную эффективность подавления секреции цитокинов порядка 50-80% соединения проявляют в концентрации 1 мкМ. Противовоспалительное действие соединений общей формулы I исследовали в экспериментах на животных (крысах и мышах) тестированием при воспалении, индуцированном кротоновым маслом [ср. Tubago и др., AgentsActions 17, стр. 347-349 (1985)]. С этой целью раствор кротонового масла в этаноле наносили(местное применение) животным на уши. Одновременно или за два часа до обработки кротоновым маслом тестируемые субстанции также применяли для местного либо системного нанесения. По истечении 16-24 ч измеряли вес ушей в качестве меры определения воспалительного отека, выявляли активность пероксидазы, в качестве меры определения миграции гранулоцитов и активность эластазы в качестве меры определения миграции нейтрофильных гранулоцитов. Как было установлено при проведении указанных экспериментов, соединения общей формулы I способны подавлять все три вышеназванных фактора воспаления как при местном,так и при системном применении. Для выявления ТAT-индукции (индукции тирозинаминотрансферазы) животных по истечении 6 ч после введения тестируемых субстанций умерщвляли, затем извлекали печень и определяли активность ТАТ в гомогенате [ср.Diamandstone и др., Anal. Biochemistry 16, стр. 395-401 (1966)]. В дозировке 10-30 мг/кг веса тела соединения подавляли ушной воспалительный процесс на приблизительно 50-80% и индуцировали при такой дозировке тирозинаминотрансферазу в печени животных в 1-4 раза выше исходного показателя. Поскольку субстанции общей формулы I обладают также высокой степенью сродства к рецептору прогестерона, новые соединения тестировали на их гестагенное действие в экспериментах на животных. В этих целях проводили 32 тест на сохранение беременности у подвергнутых овариэктомии крыс [ср. Neumann и др., Arzneimittel-Forschung (Drug Res.) 34, стр. 296-318(1984)]. Для этого женские особи крысы спаривали и на восьмой день беременности через 2 ч после введения субстанций их подвергали под наркозом овариэктомии. В период с 8-го по 14-й день животных ежедневно обрабатывали тестируемыми субстанциями, а на 15-й день животных умерщвляли и у каждой особи выявляли число живых и мертвых плодов. В матках без плода число мест имплантации определяли путем окрашивания 10%-ным раствором сульфида аммония. Было установлено, что новые соединения формулы I при дозировке 500 мкг на кг веса тела не приводят или приводят лишь крайне редко к сохранению беременности. При дозировках вплоть до 500 мкг на кг веса тела новые соединения общей формулы I не проявляли вовсе или проявляли лишь крайне слабое гестагенное действие, при увеличении же суточной дозы до 10 мг на кг веса тела наблюдалось ослабленное гестагенное действие. Наиболее эффективное фармацевтическое действие проявляют прежде всего следующие соединения: 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид; 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино] фталид; 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он. Благодаря их противовоспалительному и в дополнение к этому антиаллергическому, иммуносупрессорному и антипролиферативному действию предлагаемые в изобретении соединения общей формулы I могут найти применение в качестве лекарственных средств для лечения или профилактики следующих заболеваний и болезненных состояний у млекопитающих и человека. При этом, как указывалось выше, под понятием "заболевания" подразумеваются показания к применению при таких заболеваниях, к которым относятся: 1) заболевания легких,2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов,3) аллергии,4) воспаления стенок сосудов (васкулиты),5) кожные заболевания,6) заболевания почек,7) заболевания печени,8) желудочно-кишечные заболевания, 33 9) проктологические заболевания,10) заболевания глаз,11) заболевания уха, горла, носа,12) неврологические заболевания,13) заболевания крови,14) онкологические заболевания,15) эндокринные заболевания,16) заболевания, связанные с трансплантацией,17) тяжелые шоковые состояния,18) заболевания, связанные с применением заместительной терапии при недостаточности надпочечников,19) рвота,20) боли воспалительного генезиса (например люмбаго). Кроме того, соединения общей формулы I по изобретению могут применяться для терапии и профилактики других, не указанных выше заболеваний и болезненных состояний, при которых в настоящее время используют синтетические глюкокортикоиды [см. Hatz, H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, изд-во Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart,(1998)]. Для достижения требуемого терапевтического эффекта при вышеназванных заболеваниях и болезненных состояниях назначаемая доза может быть разной и зависит, например, от эффективности действия соединения общей формулы I, от индивидуальных особенностей пациента, методики введения, типа и степени тяжести заболевания, а также от применения соединения в качестве соответствующего профилактического или терапевтического средства.(прерывистая линия обозначает место присоединения), гдеR4 обозначает атом водорода, С 1-С 5 алкильную группу, C1-С 10 ацильную группу, С 3 С 10 карбалкоксиалкильную группу, С 2-С 5 цианалкильную группу, незамещенную либо замещенную С 3-С 10 аллильную группу, незамещенную либо замещенную С 3-С 10 пропаргильную группу, С 2-С 5 алкоксиалкильную группу, частично либо полностью замещенную атомами фтора С 1-С 5 алкильную группу,R5-R8 имеют идентичные или отличные друг от друга значения и выбраны из группы,включающей атомы водорода либо галогена иC1-С 5 алкоксигруппы, и, кроме того,R4 и R5 вместе образуют гетероциклическое кольцо, которое дополнительно к атому кислорода необязательно может содержать, по меньшей мере, еще один гетероатом из группы,включающей кислород, азот и серу, в общей сложности с 5-7 членами,В представляет собой карбонильную или СН 2-группу и Аr представляет собой циклическую систему, выбранную из группы, представленной формулами 2-5, ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение, по меньшей мере, одного соединения общей формулы I для получения лекарственных средств, обладающих подавляющим воспаления действием, в которойR1 и R2 имеют идентичные либо разные значения и представляют собой атом водорода,С 1-С 5 алкильную группу или вместе с С-атомом цепи образуют кольцо в общей сложности с 3-7 членами,R3 представляет собой С 1-С 5 алкильную группу либо частично или полностью фторированную С 1-С 5 алкильную группу,А представляет собой группу где остатки Х 3 а, Х 3b, X4, X6, X7 (в формулах 2 и 3) и Y4, Y5, Y7, Y8 (в формулах 4 и 5) являются идентичными или разными и их значения выбраны из группы, включающей атомы водорода,С 1-С 5 алкильные группы, частично либо полностью фторированные С 1-С 5 алкилъные группы,и, кроме того, остатки X4, X6, X7 (в формулах 2 и 3) или Y5, Y7, Y8 (в формулах 4 и 5) имеют значения, выбранные из группы, включающей атомы галогенов,гидроксигруппы,С 1 С 5 алкоксигруппы и С 1-С 5 алканоильные группы,а в случае, когда В представляет собой СН 2 группу, также физиологически приемлемые соли соединений общей формулы I с кислотами. 2. Применение, по меньшей мере, одного соединения общей формулы I по п.1 для получения лекарственных средств, предназначенных для лечения, по меньшей мере, одного из сле 35 дующих заболеваний, сопровождающихся в большинстве случаев воспалительными, аллергическими и/или пролиферативными процессами, к которым относятся: 1) заболевания легких,2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов,3) аллергии,4) воспаления стенок сосудов (васкулиты),5) кожные заболевания,6) заболевания почек,7) заболевания печени,8) желудочно-кишечные заболевания,9) проктологические заболевания,10) заболевания глаз,11) заболевания уха, горла, носа,12) неврологические заболевания,13) заболевания крови,14) онкологические заболевания,15) эндокринные заболевания,16) заболевания, связанные с трансплантацией,17) тяжелые шоковые состояния,18) заболевания, связанные с применением заместительной терапии при недостаточности надпочечников,19) рвота,20) боли воспалительного генезиса (например, люмбаго). 3. Применение соединений общей формулы I по п.1 или 2 в форме рацемата, если соответствующее соединение может быть представлено в виде различных стереоизомеров. 4. Применение соединений общей формулы I по п.1 или 2 в форме разделенных стереоизомеров, если соответствующее соединение может быть представлено в виде различных стереоизомеров. 5. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-С 5 алкильная(ые) группа(ы) в соединении общей формулы I выбрана(ы) из группы, включающей метил, этил, нпропил, изопропил, н-, изо-, трет-бутил, нпентил, 2,2-диметилпропил и 3-метилбутил. 6. Применение по пп. 1, 2, 3 или 4, отличающееся тем, что атом галогена Y5, Y7, Y8 выбран из группы, включающей фтор, хлор и бром. 7. Применение по пп. 1, 2, 3 или 4, отличающееся тем, что R1 и R2 вместе с С-атомом цепи образуют циклопропильное, циклобутильное, циклопентильное или циклогексильное кольцо. 8. Применение по пп.1, 2, 3 или 4, отличающееся тем, что полностью фторированная С 1-С 5 алкильная группа представляет собой метильную, этильную, н-пропильную, изопропильную, н-, изо-, трет-бутильную, нпентильную, 2,2-диметилпропильную или 3 метилбутильную группу. 9. Применение по пп.1, 2, 3 или 4, отличающееся тем, что частично фторированная С 1 003299 36 группа представляет собой С 5 алкильная 5,5,5,4,4-пентафторпентильную или 5,5,5,4,4,3,3-гептафторпентильную группу. 10. Применение по пп.1, 2, 3 или 4, отличающееся тем, что С 3-С 10 карбалоксиалкильная группа представляет собой карбоксиметильную, третбутоксиметильную или этоксиметильную группу. 11. Применение по пп.1, 2, 3 или 4, отличающееся тем, что С 2-С 5 цианалкильная группа представляет собой цианметильную, 1- или 2 цианэтильную группу. 12. Применение по пп.1, 2, 3 или 4, отличающееся тем, что С 3-С 10 аллильная группа представляет собой незамещенную аллильную группу, 1-метилаллильную, 1,1-диметилаллильную,2-метилаллильную,3-метилаллильную, 2,3-диметилаллильную, 3,3-диметилаллильную, циннамильную или 3-циклогексилаллильную группу. 13. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C3-С 10 пропаргильная группа представляет собой незамещенную пропаргильную группу,метилпропаргильную,3 метилпропаргильную, 3-фенилпропаргильную или 3-циклогексилпропаргильную группу. 14. Применение по пп.1, 2, 3 или 4, отличающееся тем, что С 2-С 5 алкоксиалкильная группа представляет собой метоксиметильную,этоксиметильную или 2-метоксиэтильную группу. 15. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-С 5 алкоксигруппа представляет собой метокси-, этокси-, н-пропокси-, изопропокси,- н-, изо-, трет-бутокси-, н-пентокси-, 2,2 диметилпропокси- или 3-метилбутоксигруппу. 16. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-С 5 перфторалкоксигруппа представляет собой перфорированную метокси-, этокси,- н-пропокси-, изопропокси-, н-, изо-, третбутокси-, н-пентокси-, 2,2-диметилпропокси- или 3 метилбутоксигруппу. 17. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-С 5 алканоильная группа представляет собой формильную, ацетильную,пропионильную, бутирильную, изобутирильную,валерильную,изовалерильную или пивалоильную группу. 18. Применение по пп.1, 2, 3 или 4, отличающееся тем, что C1-С 10 ацильная группа представляет собой бензоильную, толуоильную, фенилацетильную, акрилоильную, циннамоильную или циклогексилкарбонильную группу. 19. Применение по пп.1, 2, 3 или 4, отличающееся тем, что С 1-С 5 алканоилоксигруппа,являющаяся одним из значений X4, X6, X7, Y4,Y5, Y7 или Y8, представляет собой формилокси-,ацетокси-, пропионилокси-, бутирилокси-, изобутирилокси-, валерилокси- или изовалерилоксигруппу. 20. Применение по пп.1, 2, 3 или 4, отличающееся тем, что, если соединения общей формулы I (при B в значении -СН 2-) представ 37 лены в форме солей, то они представлены в виде гидрохлорида, сульфата, нитрата, малеата, фумарата, тартрата или бензоата. 21. Применение по п.1 или 2, отличающееся тем, что используют соединение общей формулы I, в которойR1 и R2 имеют идентичные либо разные значения и представляют собой атом водорода,метильную либо этильную группу или вместе с С-атомом цепи образуют циклопропильное кольцо, и/или(прерывистая линия обозначает место присоединения), гдеR4 обозначает атом водорода, метильную,этильную, пропильную либо 2-пропильную группу, ацетильную, метокси-, этокси- либо трет-бутоксикарбонильную группу, цианметильную либо 2-цианэтильную группу, аллильную группу, пропаргильную группу, метоксиметильную, метоксиэтильную либо этоксиэтильную группу, моно-, ди- либо трифторметильную группу, пентафторэтильную или нонафторбутильную группу,R5-R8 в одном или двух положениях обозначают атомы фтора либо хлора, а в остальных положениях - атомы водорода, илиR4 и R5 оба вместе с атомами 2 и 3 фенильного кольца образуют фурановое, дигидрофурановое или 2,3-дигидро-1,4-диоксиновое кольцо,a R6, R7 и R8 обозначают атомы водорода,Х 3 а представляет собой атом водорода или метильную группу или Х 3 а и Х 3b являются идентичными или разными и представляют собой атом водорода или метильную группу,X4, X6 и X7 являются идентичными или разными и независимо друг от друга представляют собой атом водорода или атом фтора либо хлора, и/илиY5, Y7 и Y8 являются идентичными или разными и независимо друг от друга представляют собой атом водорода или атом фтора либо хлора, а все другие заместители имеют значения, указанные в формуле I. 22. Применение по п.1 или 2, отличающееся тем, что используют соединение общей формулы I, в которой Аr представляет собой циклическую систему согласно формуле 2 или 5. 23. Применение, по меньшей мере, одного соединения по п.1 или 2, выбранного из группы,включающей 38 5-2-гидрокси-3-[1-(2-метоксифенил)циклопропил]-2-трифторметилпропиониламинофталид; 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 5-[2-гидрокси-4-(2-метоксифенил)-4-метил 2-трифторметилвалероиламино]фталид; 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид; 5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид; 4-бром-5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилпентиламино]фталид; 4-бром-5-[4-(3-бром-5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид; 6-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламино-4-метил-2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[2-гидрокси-4-(2-гидроксифенил)-4 метил-2-трифторметилвалероиламино]-4-этил 2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилпентиламино]-4-метил 2,3-бензоксазин-1-он; 6-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он; 6-[4-(4-бром-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилпентиламино]-4-метил 2,3-бензоксазин-1-он,а также все соединения, представленные в табл. 3-6 и в примерах 85 и 86. 24. Соединения общей формулы I по п.1, а именно: 5-3-[1-(5-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 5-3-[1-(5-фтор-2-гидроксифенил)циклопропил]-2-гидрокси-2-трифторметилпропиониламинофталид; 4-бром-5-[4-(5-фтор-2-гидроксифенил)-2 гидрокси-4-метил-2-трифторметилпентиламино]фталид; 40 5-[2-гидрокси-4-(5-изопропил-2-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-метокси-5-пропилфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-бензилокси-5-фторфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-дифторметокси-5 фторфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(5-фтор-2-метоксиметоксифенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-[2-гидрокси-4-(2-этоксиметокси-5 фторфенил)-4-метил-2-трифторметилвалероиламино]фталид; 5-2-гидрокси-4-[5-фтор-2-(2-метоксиэтокси)фенил]-4-метил-2-трифторметилвалероиламинофталид. 25. Фармацевтические препараты, содержащие в своем составе, по меньшей мере, одно соединение по п.24 и фармацевтически приемлемый носитель. 26. Применение, по меньшей мере, одного соединения по п.24 для получения соответствующих лекарственных средств.
МПК / Метки
МПК: C07D 307/88, A61K 31/16, A61P 29/00
Метки: воспалений, ингибиторы, нестероидные
Код ссылки
<a href="https://eas.patents.su/21-3299-nesteroidnye-ingibitory-vospalenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Нестероидные ингибиторы воспалений</a>
Предыдущий патент: Новые уретаны, их тио- и дитиоаналоги, их соли, содержащие эти соединения лекарственные средства и их применение, а также способ их получения
Следующий патент: Новые замещенные димерные соединения, способ их получения и содержащая их фармацевтическая композиция
Случайный патент: Система для защиты программного обеспечения на компакт-диске.

























