Ингибитор hcv сериновой протеазы, полученный из макроциклического пролина, и фармацевтическая композиция, предназначенная для лечения вирусной инфекции
Номер патента: 23009
Опубликовано: 29.04.2016
Авторы: Лун Цзян, Ван Гоцян, Ван Бинь, Ма Цзюнь, Ор Ят Сунь
Формула / Реферат
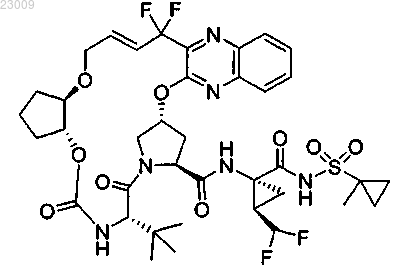
1. Соединение, представляющее собой
2. Фармацевтическая композиция, предназначенная для лечения вирусной инфекции у субъекта, содержащая ингибирующее количество соединения по п.1 или его фармацевтически приемлемой соли в комбинации с фармацевтически приемлемым носителем или вспомогательным веществом.
3. Фармацевтическая композиция по п.2, где вирусная инфекция представляет собой вирус гепатита С.
Текст
ИНГИБИТОР HCV СЕРИНОВОЙ ПРОТЕАЗЫ, ПОЛУЧЕННЫЙ ИЗ МАКРОЦИКЛИЧЕСКОГО ПРОЛИНА, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ,ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНОЙ ИНФЕКЦИИ Изобретение относится к соединению, ниже представленному формулой, которое ингибирует активность сериновой протеазы, в частности активность NS3-NS4A протеазы вируса гепатита С (HCV). Далее, соединение изобретения препятствует жизненному циклу вируса гепатита С и также является пригодным в качестве противовирусного агента. Изобретение также относится к фармацевтической композиции, содержащей указанное соединение, для введения субъекту, страдающему от HCV инфекции. Соединение изобретения предназначается для леченияHCV инфекции у субъекта введением фармацевтической композиции, содержащей соединение изобретения Родственные заявки По настоящей заявке испрашивается приоритет предварительной патентной заявки США 61/385058, поданной 21 сентября 2010 г., предварительной патентной заявки США 61/499994, поданной 22 июня 2011 г., и предварительной патентной заявки США 61/504616, поданной 5 июля 2011 г. Описание приведенных выше предварительных заявок включено в настоящее изобретение с помощью ссылки. Соглашение на совместные исследования Изобретения, описанные в настоящей заявке, осуществлены или проведены по поручению EnantaPharmaceuticals, Inc. и Abbott Laboratories, которые являются сторонами соглашения на совместные исследования, которое является действующим в или до даты, когда настоящие изобретения были получены или настоящие изобретения были осуществлены как результат действий, предпринятых в пределах объема соглашения на совместное исследование. Область техники, к которой относится настоящее изобретение Настоящее изобретение относится к новому соединению, ингибирующему протеазу вируса гепатита С (HCV) и фармацевтической композиции для лечения HCV инфекции. Уровень техники настоящего изобретенияHCV является главной причиной гепатита, отличного от гепатитов А и В, и все более возрастающей серьезной проблемой общественного здравоохранения и в развитых, и в развивающихся странах. Предполагается, что вирусом инфицировано более 200 миллионов людей по всему миру, что превосходит число индивидуумов, инфицированных вирусом иммунодефицита человека (HIV) приблизительно в пять раз. HCV инфицированные пациенты из-за большого процента индивидуумов, страдающих от хронических инфекций, подвержены высокому риску развития цирроза печени, последующей гепатоклеточной карциномы и заболевания печени, ведущего к смерти. HCV является самой распространенной на Западе причиной гепатоцеллюлярного рака и того, что пациентам требуется трансплантация печени. Существуют значительные препятствия для разработки анти-HCV терапевтических средств, которые включают, но без ограничения, жизнестойкость вируса, генетическую изменчивость вируса в процессе репликации в хозяине, высокую скорость возникновения мутантов, устойчивых к лекарственным средствам, и отсутствие репродуцируемых инфекционных культуральных систем и моделей небольших животных для HCV репликации и патогенеза. В большинстве случаев, принимая во внимание легкое протекание инфекции и сложные биологические процессы печени, должны быть тщательно рассмотрены противовирусные лекарственные средства, которые, вероятно, обладают значительными побочными эффектами. В настоящее время существуют только две одобренные терапии HCV инфекции. Первоначальный режим терапии обычно включает 3-12-месячный курс внутривенного введения интерферона- (IFN-),тогда как новый одобренный способ лечения второго поколения включает совместное лечение IFN- и обычными противовирусными нуклеозидными миметиками, подобными рибавирину. Оба данных способа лечения имеют побочные действия, связанные с интерфероном, а также низкую эффективность в отношении HCV инфекций. Существует необходимость в разработке эффективных противовирусных агентов для лечения HCV инфекции в случае низкой переносимости и неудовлетворительной эффективности существующих терапий. В популяции пациентов, где большинство индивидуумов являются хронически инфицированными и у которых отсутствуют симптомы, и невозможно предсказать дальнейшее течение болезни, эффективное лекарственное средство желательно должно обладать значительно меньшими побочными эффектами,чем при имеющихся в настоящее время способах лечения. Неструктурный белок-3 (NS3) гепатита С представляет собой протеолитический фермент, необходимый для процессинга вирусного полипротеина и затем вирусной репликации. Несмотря на огромное количество вариантов вирусов, связанных с HCV инфекцией, активный сайт NS3 протеазы остается высококонсервативным, таким образом делая его ингибирование привлекательным способом вмешательства. Недавний успех лечения ингибиторами HIV протеазы поддерживает концепцию, при которой ингибирование NS3 является ключевым способом для борьбы с HCV.HCV представляет собой РНК вирус семейства flaviridae. HCV геном имеет оболочку и содержит одноцепочечную молекулу РНК, состоящую из приблизительно 9600 пар оснований. Он кодирует полипептид, состоящий из приблизительно 3010 аминокислот.HCV полипротеин подвергается процессингу пептидазой вируса и хозяина до 10 небольших пептидов, которые выполняют ряд функций. Имеются три структурных белка: С, E1 и Е 2. Р 7 белок осуществляет известную функцию и состоит из высоковариабельной последовательности. Имеются шесть неструктурных белков. NS2 представляет собой цинкзависимую металлопротеиназу, которая функционирует в сочетании с частью NS3 белка. NS3 объединяет две каталитические функции (отличные от его ассоциата с NS2): сериновая протеаза на N-конце, которая требует NS4A в качестве кофактора, и АТФазазависимая геликазная функция на карбоксильном конце. NS4A представляет собой сильно связанный,но нековалентный кофактор сериновой протеазы.NS3/4A протеаза отвечает за расщепление четырех сайтов вирусного полипротеина. NS3-NS4A расщепление является автокаталитическим, происходящим в цис-положении. Все три оставшихся гидролиза, NS4A-NS4B, NS4B-NS5A и NS5A-NS5B, происходят в транс-положении. NS3 представляет собой сериновую протеазу, которую структурно классифицируют как химотрипсинподобную протеазу. Тогда как NS сериновая протеаза сама обладает протеолитической активностью, HCV протеазный белок не является эффективным ферментом с точки зрения катализирующего полипротеинового расщепления. Было показано, что для этого усиления требуется центральная гидрофобная область NS4A белка. Образование комплекса NS3 белка с NS4A, по-видимому, является необходимым для этапов процессинга,увеличивая протеолитическую активность во всех сайтах. Общая стратегия для разработки противовирусных агентов заключается в дезактивации кодируемых вирусом ферментов, включая NS3, которые являются важными для репликации вируса. Современные попытки, направленные на обнаружение NS3 протеазных ингибиторов, рассмотрены S. Tan, A.Drug Discov. 1, 867-881 (2002). Сущность настоящего изобретения В одном аспекте настоящее изобретение относится к соединению, представленному формулой В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение настоящего изобретения. Более конкретно, к фармацевтической композиции, содержащей терапевтически эффективное количество соединения настоящего изобретения в комбинации с фармацевтически приемлемым носителем или вспомогательным веществом. Соединения или фармацевтическая композиция настоящего изобретения предназначены для лечения вирусной инфекции,в частности инфекции гепатита С, у нуждающегося в данном лечении субъекта. Другие признаки, цели и преимущества настоящего изобретения будут ясны из подробного описания, которое последует далее. Понятно однако, что подробное описание при указании предпочтительных вариантов осуществления настоящего изобретения приведено только с целью иллюстрации, но не ограничения. Различные изменения и модификации в пределах объема настоящего изобретения станут ясны специалисту в данной области техники из подробного описания. Подробное описание настоящего изобретения Первый вариант осуществления настоящего изобретения представляет собой соединение, представленное формулой, как описано выше или в комбинации с фармацевтически приемлемым носителем или вспомогательным веществом. Неожиданно было обнаружено, что соединение настоящего изобретения может значительно ингибировать или подавлять определенные варианты HCV генотипа 1 и 3 (например, варианты генотипа 1aR155K, D168E или D168V, варианты генотипа 1b R155K или D168V или варианты генотипа 3 а S138T,А 166 Т или Q168R). Клинические испытания и анализы с применением клеток с репликонами обнаружили HCV варианты, которые являются устойчивыми ко многим известным ингибиторам протеаз. Например, показано, что R155K варианты обладают низкоуровневой устойчивостью к телапревиру и боцепревиру и обладают высокой степенью устойчивости к BILN 2061 и данопревиру (ITMN-191). См. Bartels etal., Journal of infectious diseases 198: 800-807 (2008). См. также Lu et al., Antimicrobial agents and chemotherapy, 48: 2260-2266 (2004); и Zhou et al., Journal of biological chemistry, 282: 22619-22628 (2007). Рост концентрации вируса в крови, который часто указывает на терапевтическую неудачу, наблюдался у пациентов, подвергаемых лечению данопревиром после появления R155K вариантов. См.of Liver Diseases, Boston, MA, October 30 - November 3, 2010). Аналогично, рост концентрации вируса в крови сообщался для пациентов, подвергаемых лечению ванипревиром (MK-7009). R155K или D168V варианты были обнаружены у данных пациентов, предполагая устойчивость или пониженную чувствительность данных вариантов к ванипревиру. См. www.natap.org/2009/EASL/EASL27.htm (EASL 44thAnnual Meeting, April 2009, Copenhagen, Denmark). Более того, HCV варианты, содержащие R155K, были обнаружены в качестве преобладающих квазивидов у некоторых ранее не лечимых пациентов. См. Salloum et al., Antiviral research 87: 272-275 (2010). Соответственно со значительно повышенной ингибирующей активностью относительно дикого типа, а также вариантов соединения настоящего изобретения дают возможность эффективного лечения инфекций широкого спектра HCV. Соединение настоящего изобретения может вводиться пациентам, инфицированным или содержащим данные варианты эффективного количества соединения настоящего изобретения. Данные пациенты могут быть ранее не подвергавшимися лечению пациентами или пациентами, подвергавшимися ранее лечению. В одном варианте осуществления пациент, подвергаемый лечению, содержит вариант, выбран-2 023009 ный из вариантов генотипа 1a R155K, D168E или D168V, вариантов генотипа 1b R155K или D168V или вариантов генотипа 3 а А 166 Т или Q168R. В другом варианте осуществления пациент содержит HCV вариант, выбранный из вариантов генотипа 1 R155K или D168V или вариантов генотипа 3 Q168R. Например, пациент может содержать вариант, выбранный из вариантов генотипа la R155K или D168V, вариантов генотипа 1b R155K или D168V или вариантов генотипа 3s Q168R. В еще одном варианте пациент содержит вариант, выбранный из вариантов генотипа 1 R155K или D168V, например вариантов генотипа 1 а R155K или D168V или вариантов генотипа lb R155K или D168V. В одном примере пациент содержит вариант генотипа 1 R155K (например, вариант генотипа 1 а или 1b R155K). В другом примере пациент содержит вариант генотипа 1 D168V (например, вариант генотипа 1 а или 1b D168V). Пациенты, подвергаемые лечению, могли ранее получать, но неудачно, лечение, включающее другой HCV протеазный ингибитор. Другой HCV протеазный ингибитор(ы), применяемый в предшествующем лечении, может быть выбран из, например и без ограничений, телапревира, боцепревира, данопревира, ванипревира, нарлапревира, ТМС-435 (Tibotec), BILN 2061 (Boehringer Ingelheim), BI-201335 (Boehringer Ingelheim), BMS-650032 (BMS) или их комбинации. Не ограничивая настоящее изобретение любой конкретной теорией, пациенты, подвергаемые ранее лечению, могут содержать устойчивые варианты или иметь склонность к HCV мутациям и, как результат, быть менее чувствительными к другим протеазным ингибиторам (например, телапревиру, боцепревиру, данопревиру, ванипревиру, нарлапревиру, ТМС-435 (Tibotec), BILN 2061 (Boehringer Ingelheim),BI-201335 (Boehringer Ingelheim), BMS-650032 (BMS) или их комбинации). Соединение настоящего изобретения может применяться для лечения HCV пациентов, инфицированных вирусами генотипа 3 HCV. Данные способы основаны на неожиданном результате, что соединение настоящего изобретения является эффективным при ингибировании HCV вирусов генотипа 3, включая определенные варианты (например, А 166 Т, Q168R или S138T варианты) и включает введение указанным пациентам эффективного количества соединения настоящего изобретения. Соединение настоящего изобретения может быть использовано для получения лекарственного средства для лечения HCV вариантов. Например, пациенты, подвергаемые лечению, могут быть инфицированы или содержать варианты, выбранные из вариантов генотипа 1a R155K, D168E или D 168V, вариантов генотипа 1b R155K или D168V или вариантов генотипа 3 а А 166 Т или Q168R. Соединение настоящего изобретения может быть полезным для получения лекарственного средства для лечения HCV пациентов, ранее подвергавшихся лечению, но неудачно, включающему другой HCV протеазный ингибитор (например, телапревир, боцепревир, данопревир, ванипревир,нарлапревир, ТМС-435 (Tibotec), BILN 2061 (Boehringer Ingelheim), BI-201335 (Boehringer Ingelheim),BMS-650032 (BMS) или его комбинацию). Кроме того, соединение настоящего изобретения может быть полезно для получения лекарственного средства для лечения HCV пациентов, инфицированных HCV генотипа 3 (включая варианты генотипа 3, такие как варианты генотипа 3s A166T, Q168R или S138T). Соединение настоящего изобретения можно вводить отдельно или в комбинации с одним или более другими анти-HCV агентами, такими как HCV полимеразные ингибиторы, HCV протеазные ингибиторы,HCV NS5A ингибиторы, CD81 ингибиторы, циклофилиновые ингибиторы, ингибиторы участка внутренней посадки рибосомы (IRES) или любой их комбинации. Интерферон, рибавирин или оба можно применять при данном лечении. Например, соединение настоящего изобретения может дополнительно вводиться пациенту вместе с пегинтерферон-альфа и рибавирином. Различные агенты можно вводить одновременно или последовательно. Частота дозирования каждого агента в режиме лечения может быть одинаковой или различной. Например, соединение настоящего изобретения можно вводить один раз в день и рибавирин можно вводить дважды в день. Соединение настоящего изобретения можно вводить в виде единственного активного фармацевтического агента или применять в комбинации с одним или более агентами для лечения или предотвращения инфекций гепатита С или симптомов, связанных с HCV инфекцией. Другие агенты, которые будут вводить в комбинации с соединением или комбинацией соединения настоящего изобретения, включают агенты для заболевания, вызванного HCV инфекцией, которые подавляют репликацию HCV вируса прямыми или опосредованными механизмами. Они включают агенты, такие как модуляторы иммунной системы хозяина (например, интерферон-альфа, пегилированный интерферон-альфа, интерферон-бета, интерферон-гамма, CpG олигонуклеотиды и подобные), циклофилины (например, Debio 025) или противовирусные соединения, которые ингибируют клеточные функции хозяина, такие как инозинмонофосфатдегидрогеназа (например, рибавирин и подобные). Также включены цитокины, которые модулируют иммунную функцию. Также включены вакцины, содержащие HCV антигены или комбинации антигена со вспомогательным веществом против HCV. Также включены агенты, которые взаимодействуют с клеточными компонентами хозяина, блокируя синтез вирусных белков ингибированием стадии трансляцииHCV вирусной репликации, инициированной участком внутренней посадки рибосомы (IRES), или блокируя созревание вирусных частиц и высвобождая агенты, направленные против виропоринового семейства мембранных белков, такие как, например, HCV P7 и подобные. Другие агенты, которые будут вводить в комбинации с соединением настоящего изобретения, включают любой агент или комбинацию агентов, которая ингибирует репликацию HCV воздействием на белки вирусного генома, участвующие в репликации вируса. Данные агенты включают, но без ограничения, другие ингибиторы HCV РНК зави-3 023009 симой РНК полимеразы, такие как, например, ингибиторы полимеразы нуклеозидного типа, описанные вWO0190121(А 2) или патенте США 6348587 В 1, или WO0160315, или WO0132153, или ненуклеозидные ингибиторы, такие как, например, бензимидазольные ингибиторы полимеразы, описанные в ЕР 1162196 А 1 или WO0204425, или ингибиторы HCV протеазы, такие как, например, ингибиторы пептидомиметического типа, такие как BILN2061 и подобные, или ингибиторы HCV хеликазы. Другие агенты, которые будут вводить в комбинации с соединением настоящего изобретения,включают любой агент или комбинацию агентов, которые ингибируют репликацию других вирусов у индивидуумов, инфицированных несколькими вирусами. Данные агенты включают, но без ограничения,агенты при заболевании, вызванном инфекцией гепатита В (HBV), или агенты при заболевании, вызванном инфекцией вируса иммунодефицита человека (HIV) Соответственно соединение настоящего изобретения может использоваться для лечения или предотвращения инфекции, вызванной РНК-содержащим вирусом, включающему совместное введение пациенту, нуждающемуся в данном лечении, одного или более агентов, выбранных из группы, состоящей из модулятора иммунитета хозяина и второго противовирусного агента или их комбинации, с терапевтически эффективным количеством соединения. Примеры модуляторов иммунитета хозяина представляют собой, но без ограничения, интерферон-альфа, пегилированный интерферон-альфа, интерферон-бета,интерферон-гамма, цитокин, вакцину и вакцину, содержащую антиген и вспомогательное вещество, и указанный второй противовирусный агент ингибирует репликацию HCV или ингибированием клеточных функций хозяина, связанных с вирусной репликацией, или воздействием на белки вирусного генома. Соединение настоящего изобретения, предназначенное для лечения или предотвращения инфекции,вызванной РНК-содержащим вирусом, может вводиться пациенту, нуждающемуся в данном лечении,совместно с агентом или в комбинации агентов, который лечит или облегчает симптомы HCV инфекции,включая цирроз и воспаление печени, в терапевтически эффективном количестве. Также соединение настоящего изобретения, предназначенное для лечения или предотвращения инфекции, вызванной РНКсодержащим вирусом, может вводиться пациенту, нуждающемуся в данном лечении, совместно одного или более агентов, которые лечат у пациента заболевание, вызванное инфекцией гепатита В (HBV), в терапевтически эффективном количестве. Агент, который лечит заболевание, вызванное инфекцией гепатита В (HBV), может представлять собой, например, но без ограничения, L-дезокситимидин, адефовир,ламивудин или тенфовир или любую их комбинацию. Пример РНК-содержащего вируса включает, но без ограничения, вирус гепатита С (HCV). Кроме того соединение настоящего изобретения, предназначенное для лечения или предотвращения инфекции, вызванной РНК-содержащим вирусом, совместно вводят пациенту, нуждающемуся в данном лечении, с одним или более агентов, которые лечат заболевание, вызванное инфекцией вируса иммунодефицита человека (HIV), в терапевтически эффективным количестве соединения. Пример РНКсодержащего вируса включает, но без ограничения, вирус гепатита С (HCV). Кроме того, настоящее изобретение относится к соединению одного или более агентов, выбранных из группы, состоящей из модуляторов иммунитета хозяина и второго противовирусного агента или их комбинации, используемого для получения лекарственного средства для лечения инфекции, вызванной РНК-содержащим вирусом, в частности вирусом гепатита С. Примеры модулятора иммунитета хозяина представляют собой, но без ограничения, интерферон-альфа, пегилированный интерферон-альфа, интерферон-бета, интерферон-гамма,цитокин, вакцину и вакцину, содержащую антиген и вспомогательное вещество, и указанный второй противовирусный агент ингибирует репликацию HCV или ингибированием клеточных функций хозяина,связанных с репликацией вируса, или воздействием на белки вирусного генома. Альтернативно, данную комбинацию терапевтических агентов можно вводить в виде фармацевтической композиции, содержащей терапевтически эффективное количество соединения в комбинации с одним или более агентами, как определено выше в настоящем изобретении, и фармацевтически приемлемого носителя. Данные фармацевтические композиции можно применять для ингибирования репликации РНК-содержащего вируса, в частности вируса гепатита С (HCV), контактом указанного вируса с указанной фармацевтической композицией. Кроме того, данные композиции являются пригодными для лечения или предотвращения инфекции, вызванной РНК-содержащим вирусом, в частности вирусом гепатита С (HCV). При введении в виде комбинации терапевтические агенты можно формулировать в виде отдельных композиций, которые вводятся одновременно или в интервалах заранее определенного времени, или терапевтические агенты можно вводить в виде единичной стандартной лекарственной формы. Противовирусные агенты, предусмотренные для применения в данной комбинационной терапии,включают агенты (соединения или биологические препараты), которые являются эффективными для ингибирования образования и/или репликации вируса у млекопитающего, включая, но без ограничения,агенты, которые препятствуют механизмам или хозяина, или вируса, необходимым для образования и/или репликации вируса у млекопитающего. Данные агенты можно выбрать из другого анти-HCV агента; HIV ингибитора; HAV ингибитора и HBV ингибитора. Другие анти-HCV агенты включают агенты, которые являются эффективными для замедления или предотвращения развития симптомов, связанных с гепатитом С, или заболевания. Данные агенты вклю-4 023009 чают, но без ограничения, иммуномодулирующие агенты, ингибиторы HCV NS3 протеазы, другие ингибиторы HCV полимеразы, ингибиторы другой мишени в HCV жизненном цикле и другие анти-HCV агенты, включая, но без ограничения, рибавирин, амантадин, левовирин и вирамидин. Иммуномодулирующие агенты включают агенты (соединения или биологические препараты), которые являются эффективными для усиления или потенциирования реакции иммунной системы у млекопитающего. Иммуномодулирующие агенты включают, но без ограничения, ингибиторы инозинмонофосфатдегидрогеназы, такие как VX-497 (меримеподиб, Vertex Pharmaceuticals), интерфероны класса I,интерфероны класса II, консенсусные интерфероны, асиало-интерфероны, пегилированные интерфероны и конъюгированные интерфероны, включая, но без ограничения, интерфероны, конъюгированные с другими белками, включая, но без ограничения, человеческий альбумин. Интерфероны класса I представляют собой группу интерферонов, все из которой связываются с рецепторным типом I, включая и природные, и синтетические полученные интерфероны класса I, тогда как все интерфероны класса II связываются с рецепторным типом II. Примеры интерферонов класса I включают, но без ограничения, [альфа]-,[бета]-, [дельта]-, [омега]- и [тау]-интерфероны, тогда как примеры интерферонов класса II включают, но без ограничения, [гамма]-интерфероны. Ингибиторы HCV NS3 протеазы включают агенты (соединения или биологические препараты), которые являются эффективными для ингибирования функционирования HCV NS3 протеазы у млекопитающих. Ингибиторы HCV NS3 протеазы включают, но без ограничения, соединения, описанные в WO 99/07733, WO 99/07734, WO 00/09558, WO 00/09543, WO 00/59929, WO 03/064416, WO 03/064455, WO 03/064456, WO 2004/030670, WO 2004/037855, WO 2004/039833, WO 2004/101602, WO 2004/101605, WO 2004/103996, WO 2005/028501, WO 2005/070955, WO 2006/000085, WO 2006/007700 и WO 2006/007708SCH 503034. Ингибиторы HCV полимеразы включают агенты (соединения или биологические препараты), которые являются эффективными для ингибирования функционирования HCV полимеразы. Данные ингибиторы включают, но без ограничения, ненуклеозидные и нуклеозидные ингибиторы HCV NS5B полимеразы. Примеры ингибиторов HCV полимеразы включают, но без ограничения, соединения, описанные вWO 02/04425, WO 03/007945, WO 03/010140, WO 03/010141, WO 2004/064925, WO 2004/065367, WO 2005/080388 и WO 2006/007693 (все Boehringer Ingelheim), WO 2005/049622 (Japan Tobacco), WO 2005/014543 (Japan Tobacco), WO 2005/012288 (Genelabs), WO 2004/087714 (IRBM), WO 03/101993 (Neogenesis), WO 03/026587 (BMS), WO 03/000254 (Japan Tobacco) и WO 01/47883 (Japan Tobacco) и клинические кандидаты XTL-2125, HCV 796, R-1626 и NM 283. Ингибиторы другой мишени в HCV жизненном цикле включают агенты (соединения или биологические препараты), которые являются эффективными для ингибирования образования и/или репликацииHCV, отличного от ингибирования функционирования HCV NS3 протеазы. Данные агенты могут препятствовать механизмам хозяина или HCV вируса, необходимым для образования и/или репликацииHCV. Ингибиторы другой мишени в HCV клеточном цикле включают, но без ограничения, ингибиторы проникновения в клетку, агенты, которые ингибируют мишень, выбранную из хеликазы, NS2/3 протеазы и участка внутренней посадки рибосомы (IRES), и агенты, которые препятствуют функционированию вирусных мишеней, включая, но без ограничения, NS5A белок и NS4B белок. Может случиться так, что пациент может быть инфицирован вирусом гепатита С и одним или более другими вирусами, включая, но без ограничения, вирус иммунодефицита человека (HIV), вирус гепатитаA (HAV) и вирус гепатита В (HBV). Таким образом, также предполагаемой является комбинационная терапия для лечения инфекций более чем одним вирусом совместным введением соединения согласно настоящему изобретению с по меньшей мере одним из HIV ингибитора, HAV ингибитора и HBV ингибитора. Фармацевтические композиции настоящего изобретения могут дополнительно содержать ингибитор(ы) других мишеней в HCV жизненном цикле, включая, но без ограничения, хеликазу, полимеразу,металлопротеазу и участок внутренней посадки рибосомы (IRES). Фармацевтические композиции настоящего изобретения могут дополнительно содержать другой противовирусный, антибактериальный, противогрибковый или противораковый агент, или модулятор иммунной системы, или другой терапевтический агент. Согласно еще одному варианту осуществления настоящее изобретение касается соединения, используемого для лечения вирусной инфекции, такие как, но без ограничения, инфекции гепатита С у субъекта, нуждающегося в данном лечении, введением указанному субъекту эффективного количества соединения настоящего изобретения. Фармацевтическая композиция настоящего изобретения для лечения инфекций гепатита С у субъекта, нуждающегося в данном лечении, вводится указанному субъекту в эффективном количестве или в ингибирующем количестве фармацевтической композиции настоящего изобретения. Кроме того соединение настоящего изобретения может быть использовано в способах обработки биологических образцов контактом биологических образцов с соединениями настоящего изобретения. Соединение настоящего изобретения может быть получено с применением любых способов получения, описанных в настоящем описании. Определения Ниже приведены определения различных терминов, применяемых при описании настоящего изобретения. Данные определения применяют относительно терминов, так как их применяют во всем описании и формуле изобретения, если иначе не указано в конкретных случаях, или индивидуально, или как часть большей группы. Термин "вирусная инфекция" относится к внедрению вируса в клетки или ткани, например вируса гепатита С (HCV). В общем, внедрение вируса также связано с репликацией. Вирусную инфекцию можно определить измерением титра вирусных антител в образцах биологических жидкостей, таких как кровь, применяя, например, иммуноферментный анализ. Другие подходящие диагностические способы включают молекулярные способы, такие как RT-PCR, прямой способ улавливания гибридов, амплификация, основанная на последовательности нуклеиновых кислот, и подобные. Вирус может инфицировать орган, например печень, и вызывать заболевание, например гепатит, цирроз, хроническую печеночную недостаточность и гепатоклеточную карциному. Термин "противораковый агент" относится к соединению или лекарственному средству, способному предотвращать или ингибировать развитие рака. Примеры данных агентов включают цис-платину,актиномицин D, доксорубицин, винкристин, винбластин, этопозид, амсакрин, митоксантрон, тенипазид,таксол, колхицин, циклоспорин А, фенотиазины или тиоксантены. Термин "противогрибковый агент" будут применять для описания соединения, которое можно применять для лечения грибковой инфекции, отличной от 3-АР, 3-АМР или пролекарств 3-АР и 3-АМР согласно настоящему изобретению. Противогрибковые агенты согласно настоящему изобретению включают, например, тербинафин, флуконазол, итраконазол, позаконазол, клотримазол, гризеофульвин, нистатин, толнафтат, каспофунгин, амфотерицин В, липосомальный амфотерицин В и липидный комплекс амфотерицина В. Термин "антибактериальный агент" относится и к природным антибиотикам, полученным микроорганизмами для подавления роста других микроорганизмов, и агентам, полученным или модифицированным в лаборатории, которые обладают или бактерицидной или бактериостатической активностью, например -лактамные антибактериальные агенты, гликопептиды, макролиды, хинолоны, тетрациклины и аминогликозиды. В общем, если антибактериальный агент является бактериостатическим, это означает,что агент, по существу, останавливает рост бактериальных клеток (но не уничтожает бактерии); если агент является бактерицидным, это означает, что агент уничтожает бактериальные клетки (и может останавливать рост перед уничтожением бактерий). Термин "иммунный модулятор" относится к любому веществу, направленному на изменение функционирования гуморальной или клеточной иммунной системы субъекта. Данные иммунные модуляторы включают ингибиторы воспаления, опосредованного тучными клетками, интерфероны, интерлейкины,простагландины, стероиды, кортикостероиды, колониестимулирующие факторы, хемотаксические факторы и т.п. Соединение, описанное в настоящем изобретении, содержит асимметрический центр и, таким образом, дает энантиомеры, диастереомеры и другие стереоизомерные формы, которые можно определить с точки зрения абсолютной конфигурации как (R) - или (S) - или как (D) - или (L) для аминокислот. Предполагается, что настоящее изобретение включает все данные возможные изомеры, а также их рацемические и оптически чистые формы. Оптические изомеры можно получить из их соответствующих оптически активных предшественников способами, описанными выше, или разделением рацемических смесей. Разделение можно осуществлять в присутствии разделяющего агента, хроматографией или повторяющейся кристаллизацией или некоторой комбинацией данных способов, которые являются известными специалисту в данной области техники. Дополнительные подробности, относящиеся к разделению, можно найти в Jacques, et al., Enantiomers, Racemates and Resolutions (John WileySons, 1981). Когда соединение, описанное в настоящем изобретении, содержит олефиновые двойные связи или другие центры геометрической асимметрии, и если не указано иначе, предполагается, что соединение включает и Е и Z геометрические изомеры. Аналогично, все таутомерные формы также предполагаются включенными. Конфигурация любой углерод-углерод двойной связи, встречающейся в настоящем изобретении, выбрана только для удобства и не предполагается, что она обозначает конкретную конфигурацию, если текст не утверждает этого; таким образом, углерод-углерод двойная связь, изображенная произвольно в настоящем изобретении, может представлять собой цис, транс или смесь двух в любом соотношении. Термин "субъект", как применяют в настоящем изобретении, относится к млекопитающему. Следовательно, субъект относится, например, к собакам, кошкам, лошадям, коровам, свиньям, морским свинкам и подобным. Предпочтительно субъект представляет собой человека. Когда субъект представляет собой человека, субъекта можно называть в настоящем изобретении пациентом. Термин "апротонный растворитель", как применяют в настоящем изобретении, относится к раство-6 023009 рителю, который является относительно инертным к протонной активности, т.е. не действует как донор протона. Примеры включают, но без ограничения, углеводороды, такие как, например, гексан и толуол,галогенированные углеводороды, такие как, например, хлористый метилен, этиленхлорид, хлороформ и подобные гетероциклические соединения, такие как, например, тетрагидрофуран и N-метилпирролидон,и эфиры, такие как диэтиловый эфир, бис-метоксиметиловый эфир. Данные растворители являются хорошо известными специалисту в данной области техники, и отдельные растворители или их смеси могут быть предпочтительными для конкретных соединений и условий реакции, в зависимости от таких факторов, как, например растворимость реагентов, реакционноспособность реагентов и предпочтительные температурные диапазоны. Дополнительное обсуждение апротонных растворителей можно найти в книгах по органической химии или в специализированных монографиях, например Organic Solvents PhysicalProperties and Methods of Purification, 4th ed., edited by John A. Riddick et al., Vol. II, в Techniques of Chemistry Series. John WileySons, NY, 1986. Термины "протогенный органический растворитель" или "протонный растворитель", как применяют в настоящем изобретении, относятся к растворителю, который стремится отдать протон, такому как спирт, например метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол и подобные. Данные растворители являются хорошо известными специалисту в данной области техники, и отдельные растворители или их смеси могут быть предпочтительными для конкретных соединений и условий реакции, в зависимости от таких факторов, как, например растворимость реагентов, реакционноспособность реагентов и предпочтительные температурные диапазоны. Дополнительное обсуждение апротонных растворителей можно найти в книгах по органической химии или в специализированных монографиях, напримерII, в Techniques of Chemistry Series, John WileySons, NY, 1986. Полученное соединение можно выделять из реакционной смеси и дополнительно очищать способом, таким как колоночная хроматография, высокоэффективная жидкостная хроматография или перекристаллизация. Кроме того, различные стадии получения можно проводить в чередующейся последовательности или порядке с получением требуемого соединения. Кроме того, растворители, температуры,продолжительность реакции и т.д., определенные в настоящем изобретении, приведены только для целей иллюстрации, и изменение условий реакций может давать требуемые мостиковые макроциклические продукты настоящего изобретения. Синтетические химические превращения и способы применения защитных групп (защиты и удаления), пригодные для получения соединения, описанные в настоящем изобретении, включают, например, те, что описаны в R. Larock, Comprehensive Organic Transformations, VCHSons (1994); и L. Paquette, ed. Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995). Соединение настоящего изобретения можно модифицировать введением различных функциональных групп синтетическими способами, определенными в настоящем изобретении, для улучшения выбранных биологических свойств. Данные модификации включают модификации, которые улучшают биологическое проникновение в указанную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), увеличивают пероральную доступность, увеличивают растворимость, обеспечивая введение инъекцией, изменяют метаболизм и изменяют скорость выведения. Фармацевтические композиции Фармацевтические композиции настоящего изобретения содержат терапевтически эффективное количество соединения настоящего изобретения, сформулированного вместе с одним или более фармацевтически приемлемыми носителями. Как применяют в настоящем изобретении, термин "фармацевтически приемлемый носитель" обозначает нетоксичный, инертный твердый, полутвердый или жидкий наполнитель, разбавитель, материал для инкапсулирования или вспомогательное вещество для состава любого типа. Некоторыми примерами веществ, которые могут служить в качестве фармацевтически приемлемых носителей, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; вспомогательные вещества, такие как масло какао и воск для свечей, масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферы, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт, и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, агенты, контролирующие высвобождение, агенты для нанесения покрытия, подсластители,ароматизаторы и отдушки, консерванты и антиоксиданты также могут присутствовать в композиции согласно решению составителя. Фармацевтические композиции настоящего изобретения можно вводить людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально,внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально или в виде орального или назального спрея. Фармацевтические композиции настоящего изобретения можно вводить перорально, парентерально, ингаляцией, местно, ректально, назально, буккально, вагинально или через имплантированную емкость, предпочтительно пероральным введением или введением инъекцией. Фармацевтические композиции настоящего изобретения могут содержать любые общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты или среды. В некоторых случаях рН состава можно регулировать фармацевтически приемлемыми кислотами, основаниями или буферами, увеличивая стабильность сформулированного соединения или его формы доставки. Термин "парентеральный", как применяют в настоящем изобретении, включает подкожный, внутрикожный, внутривенный, внутримышечный, внутримускульный, внутриартериальный, внутрисуставной, интрастернальный, интратекальный, внутриочаговый и внутричерепной способы инъекции или вливания. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В добавление к активному соединению жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, агенты, способствующие растворению, и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла(в частности, хлопковое, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. Помимо инертных разбавителей, пероральные композиции могут также содержать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, ароматизаторы и отдушки. Инъецируемые препараты, например стерильные инъецируемые водные или масляные суспензии,можно формулировать согласно известному уровню техники с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъецируемый препарат может также представлять собой стерильный раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Приемлемые среды и растворы, которые можно применять, включают воду, раствор Рингера, U.S.Р. и изотонический раствор хлористого натрия. Кроме того, стерильные нелетучие масла традиционно применяют в качестве растворителя или суспендирующей среды. Для данной цели можно применять любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, применяют при получении инъецируемых препаратов. Инъецируемые составы можно стерилизовать, например, фильтрованием через фильтр, удерживающий бактерии, или введением стерилизующего агента в виде стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной инъецируемой среде перед применением. Для того чтобы продлить эффект лекарственного средства, часто желательно замедлить поглощение лекарственного средства в результате подкожной или внутримышечной инъекции. Это можно осуществить применением жидкой суспензии кристаллического или аморфного вещества с низкой растворимостью в воде. Затем, скорость поглощения лекарственного средства зависит от скорости его растворения,которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленного поглощения введенного парентерально лекарственного средства можно достичь растворением или суспендированием лекарственного средства в масляной среде. Инъецируемые депоформы получают образованием матрикса для инкапсулирования лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения лекарственного средства к полимеру и свойств конкретного применяемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депоинъецируемые составы также получают захватом лекарственного средства в липосомы или микроэмульсии, которые являются соместимыми с тканями тела. Композиции для ректального или вагинального применения предпочтительно представляют собой суппозитории, которые можно получить смешиванием соединения настоящего изобретения с подходящими нераздражающими вспомогательными веществами или носителями, такими как масло какао, полиэтиленгликоль, или с восками для свечей, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и, следовательно, плавятся в прямой кишке или вагинальной полости и высвобождают активное соединение. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В данных твердых лекарственных формах активное соединение смешивают по меньшей мере с одним инертным фармацевтически приемлемым вспомогательным веществом или носителем, таким как цитрат натрия или фосфат дикальция и/или а) наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и камедь, с) увлажняющими агентами, такими как глицерин, d) разрыхлителями, такими как агар-агар,карбонат кальция, картофельный крахмал или маниоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, е) агентами, замедляющими растворение, такими как парафин, f) агентами,ускоряющими поглощение, такими как соединения четвертичного аммония, g) смачивающими агентами,такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими агентами, такими как тальк, стеарат кальция, стеарат магния,твердые полиэтиленгликоли, лаурилсульфат натрия и их смесями. В случае капсул, таблеток и пилюль лекарственная форма может также содержать буферы. Твердые составы аналогичного типа можно также применять в качестве наполнителей в мягких и твердых желатиновых капсулах, применяя такие вспомогательные вещества, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные. Активное соединение могут находиться также в микроинкапсулированной форме с одним или более вспомогательными веществами, как отмечалось выше. Твердые лекарственные формы таблеток,драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как кишечнорастворимые покрытия, покрытия, контролирующие высвобождение, и другими покрытиями, хорошо известными в области фармацевтического формулирования. В твердых лекарственных формах активное соединение можно смешивать по меньшей мере с одним инертным разбавителем, таким как сахароза,лактоза или крахмал. Данные лекарственные формы могут также содержать, в качестве нормальной практики, дополнительные вещества, отличные от инертных разбавителей, например смазывающие агенты для таблетирования и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферы. Они могут необязательно содержать затемняющие агенты и также могут высвобождать активный ингредиент(ы) только или предпочтительно в определенной части кишечника,необязательно, замедленным способом. Примеры композиций, которые можно применять, включают полимерные вещества и воски. Лекарственные формы для местного или трансдермального введения соединения настоящего изобретения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляторы или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми требуемыми консервантами или буферами, когда может потребоваться. Предполагается,что офтальмический состав, ушные капли, глазные мази, порошки и растворы также включены в объем настоящего изобретения. Мази, пасты, кремы и гели могут содержать дополнительно к активному соединению настоящего изобретения вспомогательные вещества, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, целлюлозные производные, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка, или их смеси. Порошки и спреи могут содержать дополнительно к соединениям настоящего изобретения вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок, или смеси данных веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды. Трансдермальные пластыри обладают дополнительным преимуществом обеспечения контролируемой доставки соединения к телу. Данные лекарственные формы можно получить растворением или диспергированием соединения в подходящей среде. Агенты, улучающие поглощение, можно применять для увеличения потока соединения через кожу. Скорость можно контролировать или обеспечением мембраны, контролирующей скорость, или диспергированием соединения в полимерном матриксе или геле. Противовирусная активность. Ингибирующее количество или доза соединения настоящего изобретения может находиться в диапазоне от приблизительно 0,01 до приблизительно 500 мг/кг, альтернативно от приблизительно 1 до приблизительно 50 мг/кг. Ингибирующие количества или дозы также могут изменяться в зависимости от пути введения и возможности совместного применения с другими агентами. Вирусные инфекции лечат или предотвращают у субъекта, такого как человек или низшее млекопитающее, введением субъекту эффективного количества или ингибирующего количества против вируса герпеса С соединения настоящего изобретения в таких количествах и в течение такого периода времени,которые требуются для достижения требуемого результата. Дополнительно биологические образцы могут быть обработаны ингибирующим количеством соединения композиции настоящего изобретения в таких количествах и в течение такого периода времени, которые требуются для достижения требуемого результата. Термин "эффективное количество против вируса гепатита С" соединения настоящего изобретения,как применяют здесь, обозначает количество соединения, достаточное для снижения концентрации вируса в крови в биологическом образце или у субъекта (например, приводя в результате по меньшей мере к 10%, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90 или 95% снижению концентрации вируса в крови). Как хорошо известно в медицинской области техники, эффективное количество соединения настоящего изобретения против вируса герпеса С будет иметь приемлемое соотношение польза/риск, применимое для любого медицинского лечения. Термин "ингибирующее количество" соединения настоящего изобретения обозначает количество,достаточное для снижения концентрации вируса гепатита С в биологическом образце или у субъекта(например, приводя в результате по меньшей мере к 10%, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90 или 95% снижению концентрации вируса в крови). Понятно, что когда вводят указанное ингибирующее количество соединения настоящего изобретения субъекту, оно должно иметь приемлемое соотношение польза/риск,применимое для любого медицинского лечения, как определено лечащим врачом. Термин "биологический образец(образцы)", как применяют в настоящем изобретении, обозначает биологическое вещество,предназначенное для введения субъекту. Примеры биологических образцов включают, но без ограничения, кровь и ее компоненты, такие как плазма, тромбоциты, субпопуляции кровяных клеток и подобные; органы, такие как почка, печень, сердце, легкое и подобные; сперма и яйцеклетка; костный мозг и его компоненты; или стволовые клетки. Таким образом, другой вариант осуществления настоящего изобретения представляет собой способ обработки биологического образца ингибирующим количеством соединения или фармацевтической композиции настоящего изобретения. После улучшения состояния субъекта можно при необходимости вводить поддерживающую дозу соединения, композиции или комбинации настоящего изобретения. Затем дозу или частоту ведения, или обе, можно снижать в зависимости от симптомов до степени, при которой поддерживается улучшенное состояние, когда симптомы облегчены до требуемой степени, лечение следует прекратить. Однако субъект может требовать интермиттирующую терапию на продолжительной основе при любом рецидиве симптомов заболевания. Понятно, что дневная доза соединения и композиции настоящего изобретения будет определяться лечащим врачом по результатам тщательной медицинской оценки. Конкретная ингибирующая доза для любого конкретного пациента будет зависеть от ряда факторов, включая заболевание, подвергаемое лечению, и тяжесть заболевания; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, вес тела, общее состояние здоровья, пол и рацион пациента; продолжительность введения, путь введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; применяемые лекарственные средства в комбинации с или совместно с конкретным применяемым соединением; и подобные факторы, известные в медицинской области техники. Суммарная дневная ингибирующая доза соединений настоящего изобретения, вводимая субъекту в виде одной или разделенных доз, может составлять, например, от 0,01 до 50 мг/кг веса тела или более обычно от 0,1 до 25 мг/кг веса тела. Однократная доза композиции может содержать данные количества или ее дольные величины, образуя дневную дозу. В общем режимы лечения включают введение пациенту, нуждающемуся в данном лечении, от приблизительно 10 до приблизительно 1000 мг соединения(й) настоящего изобретения в день в виде единичной или нескольких доз. Если не определено иначе, все технические и научные термины, применяемые в настоящем изобретении, соответствуют значению, обычно известному специалисту в данной области техники. Все публикации, патенты, опубликованные патентные заявки и другие ссылочные материалы, приведенные в настоящем изобретении, включены в настоящее изобретение с помощью ссылки во всей своей полноте. Сокращения. Сокращения, применяемые в описании схем и примеров, которые следуют далее, являются следующими:DMEM - модифицированная по способу Дульбекко среда Игла;RT-PCR - полимеразная цепная реакция с обратной транскриптазой; ТВМЕ - трет-бутилметиловый эфир;Xantphos - 4,5-бис-дифенилфосфанил-9,9-диметил-9 Н-ксантен. Способы получения Соединение настоящего изобретения будут лучше поняты в связи со следующими схемами получения, иллюстрирующими способы, с помощью которых можно получить соединение настоящего изобретения, которые предполагаются только для иллюстрации и не ограничивают объем настоящего изобретения. Различные изменения и модификации для описанных вариантов осуществления будут очевидны специалисту в данной области техники, и данные изменения и модификации, включая, без ограничения,относящиеся к химическим структурам, заместителям, производным и/или способам настоящего изобретения, можно осуществлять в соответствии с сущностью настоящего изобретения и не выходя за пределы объема прилагаемой формулы изобретения. Получение хиноксалинильных микроциклических соединений показано на схеме 1. Boc группу хиноксалинового производного 1-1 (см. схему 2 для получения) удаляют в кислых условиях при комнатной температуре (кислоту можно выбрать из, но без ограничения, HCl в диоксане или HCl в этилацетате илиTFA. Дополнительные детали по удалению Boc группы описаны T.W. Greene, Protective Groups in Organic Synthesis, Fourth Edition, John Wiley and Sons, 2006) с получением амина 1-2, который конденсируют с кислотой 1-3, применяя конденсирующий реагент для получения пептидной связи (конденсирующий агент можно выбрать из, но без ограничения, HATU/DIPEA, DCC/DMAP, дополнительные детали о конденсирующем реагенте для получения пептидной связи описаны Christian A. G. N. Montalbetti et al.,Tetrahedron 2005, 61, 10827) с получением диена 1-4. Метатезис с замыканием кольца диена 1-4 с катализатором на основе рутения дает требуемый макроциклический алкен 1-5 (дополнительная подробная информация относительно метатезиса с замыканием кольца приведена в недавних обзорах Grubbs et al.,Acc. Chem. Res., 1995, 28, 446; Shrock et al., Tetrahedron 1999, 55, 8141; Furstner, A. Angew. Chem. Int. Ed. 2000, 39, 3 012; Trnka et al., Acc. Chem. Res. 2001, 34, 18, и Hoveyda et al., Chem. Eur. J. 2001, 7, 945). Гидролиз макроциклического эфира 1-5 до соответствующей кислоты 1-6 можно осуществлять неорганическим основанием, таким как, но без ограничения, LiOH, NaOH, KOH. Полученную в результате кислоту 1-6 конденсируют с амином 1-7, применяя конденсирующий реагент для образования амидной связи (конденсирующий агент можно выбрать из, но без ограничения, HATU, DCC и НОВТ в присутствии органического основания, такого как, но без ограничения, DIEPA, TEA, DMAP; дополнительные подробности образования амидной связи описаны в недавнем обзоре Christian A. G. N. Montalbetti et al.,Tetrahedron 2005, 61, 10827) с получением амида 1-8 или 1-9. Альтернативно, амид 1-8 можно получить из кислоты 1-10, полученной в результате гидролиза сложного эфира 1-8. Кислоту 1-9 активируют CDI и затем конденсируют с сульфонамидом 1-11 в присутствии органического основания, такого как, но без ограничения, DBU с получением указанного в заголовке соединения 1-8. Схема 2 Получение хиноксалинового производного 1-1 показано на схеме 2. Бромид 2-2 конденсировали с альдегидом 2-1, применяя металл, такой как, но без ограничения, In, Zn, Mg или Cr, получая гидроксильный сложный эфир 2-3, который дополнительно окисляли, получая кетоновый сложный эфир 2-4, окисляющим агентом, таким как, но без ограничения, TPAP/NMO. Альтернативно, получение кетонового эфира 2-4 можно осуществить через литийгалогеновый обмен бромида 2-2 с последующей конденсацией со сложным эфиром 2-5 (данный способ можно также применять для хлорангидрида кислоты 2-6 или амида Вейнреба 2-7) с получением кетонового эфира 2-4. Еще один альтернативный способ заключается в том, что бромид 2-2 обрабатывали металлом, таким как, но без ограничения, In, Zn или Mg, и затем подвергали реакции с хлорангидридом кислоты 2-6, или сложным эфиром 2-5, или амидом Вейнреба 2-7 с получением кетонового эфира 2-4. Кетоновый эфир 2-4 конденсировали с диамином 2-8, получая хиноксалин 2-9. Гидроксилхиноксалин 2-9 превращали в хлорхиноксалин 3-3, применяя хлорирующий агент, такой как, но без ограничения, POCl3, который конденсировали с имеющимся в продаже N-Востранс-4-гидрокси-L-пролином 2-11, с последующей этерификацией, получая хиноксалиновое производное 1-1. Альтернативно, соединение 1-1 можно получить реакцией Мицунобу имеющегося в продаже спирта 2-12 с хиноксалином 2-9. Дополнительную подробную информацию относительно реакции Ми- 12023009 где определен выше. Получение кислоты 1-3 начинали с ацилирования рацемического диола 3-1 с получением диацетата 3-2 (ацилирование гидроксила описано также T.W. Greene, Protective Groups in Organic Synthesis, FourthEdition, John Wiley and Sons, 2006). Кинетическое расщепление диацетата 3-2 осуществляли частичным деацетилированием ферментом, таким как, но без ограничения, аманолипаза, получая моноацетат 3-3(М.Р. Schneider et al., J. Chem. Soc, Chem. Commun., 1991, 49; дополнительную информацию о кинетическом расщеплении см. Н. Pellissier, Tetrahedron, 2008, 64, 1563). Аллилирование моноацетатного соединения 3-3 давало аллиловый сложный эфир 3-4, который гидролизовали неорганическим основанием,таким как, но без ограничения, LiOH, NaOH с получением спирта 3-5. После хлорформилирования обработкой спирта 3-5 COCl2 последующая конденсация с аминокислотой 3-6 давала кислоту 1-3. Более того,аллиловый эфир 3-5 можно также получить, когда оптически чистый диол 3-1 депротонируют NaH, с последующей конденсацией с аллилбромидом. Схема 4 где определен выше. Альтернативные пути получения макроциклического сложного эфира 1-5 показаны на схеме 4. Существует много других способов получения данного промежуточного соединения 1-5, некоторые способы показаны на схеме 4. Например, макроциклический эфир 1-5 можно получить образованием амидной связи в кислоте 4-1 (дополнительную подробную информацию по образованию амидной связи см. в недавнем обзоре: Christian A. G. N. Montalbetti et al., Tetrahedron 2005, 61, 10827); катализируемым Pd внутримолекулярным аллилированием в аллиловом Boc производном 4-2 (Guoqiang Wang et al., Org. Lett.,2004, 6, 4455); удалением Boc группы (о деблокировании карбаматов см. T.W. Greene, Protective Groupsin Organic Synthesis, Fourth Edition, John Wiley and Sons, 2006) с последующим образованием карбамата в сукцинимидилкарбонате 4-3 (J.V. Eycken, J. Org. Chera., 2007, 72, 5514); образованием эфира, катализируемого основанием, в спирте 4-4 и образованием эфира по реакции Мицунобу в гидроксилхиноксалине 4-5 (дополнительно подробно о реакции Мицунобу см. О. Mitsunobu, Synthesis 1981, 1-28; D.L. Hughes,Org. React. 1983, 29, 1; D.L. Hughes, Organic Preparations and Procedures Int. 1996, 28, 127 и J.A. Dodge,S.A. Jones, Recent Res. Dev. Org. Chem. 1997, 1, 273; K.C. Kumara Swamy et. al., Chem. Rev. 2009, 109,2551). где определен выше. Получение кислоты 4-1 показано на схеме 5. Кросс-метатезис хиноксалинового производного 4-1 и аллилового эфира 3-5 приводит к спирту 5-1 (дополнительно подробно о кросс-метатезисе см. Grubbs etActa 2007, 40, 45). Данный спирт 5-1 обрабатывали фосгеном (или другим реагентом, таким как, но без ограничения, трифосген, дифосген, карбонилдиимидазол) с последующей конденсацией с аминокислотой 3-6 в присутствии основания, такого как, но без ограничения, LiOH или NaOH. Удаление Boc группы из кислоты 5-2 (об удалении карбаматов см. T.W. Greene, Protective Groups in Organic Synthesis,Fourth где R, R" и определены выше. Получение хиноксалинильного производного 4-3 показано на схеме 6. Удаление Boc группы (Т. W.Greene, Protective Groups in Organic Synthesis, Fourth Edition, John Wiley and Sons, 2006) из эфира 5-1 дает соответствующий амин, который конденсируют с аминокислотой 6-1, применяя конденсирующий реагент для образования пептидной связи, такой как, но без ограничения, HATU, или DCC, или ВОР (дополнительно подробно о пептидной конденсации см. Christian A. G. N. Montalbetti et al., Tetrahedron 2005,61, 10827) с получением спирта 6-2. Активацию гидроксильной группы в спирте 6-2 осуществляют при обработке DSC/TEA, получая сукцинимидинилкарбонат 4-3 (о применении DSC при получении карбаматов см. J.V. Eycken, J. Org. Chem., 2007, 72, 5514). Схема 7 где R, R" и определены выше. Получение хиноксалинильного производного 4-2 показано на схеме 7. Удаление Boc группы (Т. W.Greene, Protective Groups in Organic Synthesis, Fourth Edition, John Wiley and Sons, 2006) из эфирного соединения 1-1 дает соответствующую кислоту, которую конденсируют с аминокислотой 6-1, применяя конденсирующий реагент для образования пептидной связи, такой как, но без ограничения, HATU, илиal., Tetrahedron 2005, 61, 10827) с получением спирта 7-1. Boc группу из соединения 7-1 удаляли в кислых условиях и образовавшийся в результате амин обрабатывали фосгеном или другим реагентом, таким как,но без ограничения, трифосген, или дифосген, или карбонилдиимидазол, в присутствии основания, такого как, но без ограничения, пиридин или DMAP, получая изоцианат 7-2. Данный изоцианат 7-2 конденсировали с диолом 7-3 в присутствии органического основания, такого как, но без ограничения, DBU,получая моноспирт 7-4. Кросс-метатезис алкена 7-4 и защищенного диола 7-5 в присутствии катализатора дает спирт 4-2 (дополнительно подробно о кросс-метатезисе см. Grubbs et al. J. Am. Chem. Soc. 2003,125, 11360; R. Raju et al. Org. Lett. 2006, 8, 2139; Y. Schrodi et al. Aldrichimica Acta 2007, 40, 45). Схема 8 где R, R" и определены выше. Получение хиноксалинильного производного 4-4 показано на схеме 8. Спирт 3-5 обрабатывают фосгеном или другим реагентом, таким как, но без ограничения, трифосген, или дифосген, или карбонилдимидазол, и затем конденсируют с амином 8-1 в присутствии основания, такого как, но без ограничения, NaOH, с получением алкена 8-2, который будут подвергать кросс-метатезису с хиноксалинильным производным 2-10 с получением трет-бутилового эфира 8-3 (дополнительно подробно о кроссметатезисе см. Grubbs et al. J. Am. Chem. Soc. 2003, 125, 11360; R. Raju et al. Org. Lett. 2006, 8, 2139; Y.Schrodi et al. Aldrichimica Acta 2007, 40, 45). Трет-бутильную группу из соединения 8-3 удаляют в кислых условиях (кислота выбрана из, но без ограничения, HCl или TFA) и затем конденсируют его с амином 84, применяя конденсирующие реагенты для образования пептидной связи (дополнительно подробно о пептидной конденсации см. Christian A. G. N. Montalbetti et al., Tetrahedron 2005, 61, 10827), получая хиноксалинильное соединение 4-4. Схема 9 где R и определены выше. Получение хиноксалинильного производного 4-5 показано на схеме 9. Аналогично получению промежуточного соединения 8-3 кросс-метатезис трет-бутилового сложного эфира 8-2 и хиноксалинильного производного 2-9 дает трет-бутиловый сложный эфир 9-1. Удаление трет-бутильной группы из 9-1 можно осуществлять в кислых условиях (HCl) с получением кислоты 9-2, которую подвергают конденсации с амином 9-3, применяя конденсирующий реагент для образования пептидной связи, такой как, но без ограничения, HATU/DIPEA, с получением промежуточного соединения 4-5. Примеры Соединение и способы его получения будут лучше понятны в связи со следующими примерами, которые предполагаются в качестве только иллюстрации и не ограничивают объем настоящего изобретения. Различные изменения и модификации для описанных вариантов осуществления будут очевидны специалисту в данной области техники, и данные изменения и модификации, включая, без ограничения,те, что относятся к химическим структурам, заместителям, производным, композициям и/или способам настоящего изобретения, можно осуществлять в соответствии с сущностью настоящего изобретения и не выходя за пределы объема прилагаемой формулы изобретения. К раствору 3-бром-3,3-дифторпроп-1-ена 2-2 (5,61 г, 35,74 ммоль) и этилглиоксалата 2-1 (6,52 мл,42,9 ммоль, 50% в толуоле) в DMF (80 мл) и воде (20 мл) добавляли порошок индия. Полученную в результате смесь энергично перемешивали в течение 6 ч и затем разбавляли ТВМЕ, смесь фильтровали и промывали водой, соляным раствором, сушили и концентрировали в вакууме, получая неочищенный продукт 2-3 (6,21 г). Данное вещество применяли непосредственно на следующей стадии без дополнительной очистки. К неочищенному этил 3,3-дифтор-2-гидроксипент-4-еноату 2-3 (4,9 г, 27,20 ммоль) в DCM (150 мл) добавляли ТРАР (240 мг, 0,68 ммоль) и NMO (11,03 г, 81,61 ммоль). Суспензию перемешивали при комнатной температуре в течение 5 чзатем разбавляли DCM, промывали водой, соляным раствором, сушили и концентрировали в вакууме, получая неочищенный кетоновый эфир 2-4. Данное вещество применяли непосредственно на следующей стадии без дополнительной очистки. Стадия 1b К раствору неочищенного этил 3,3-дифтор-2-оксопент-4-еноата 2-4 (полученного из 35,74 ммоль 3 бром-3,3-дифторпроп-1-ена) в EtOH (200 мл) добавляли о-бензол-1,2-диамин 2-8 (4,64 г, 42,89 ммоль). Полученную в результате смесь кипятили с обратным холодильником в течение 14 ч и затем охлаждали до комнатной температуры, твердый остаток собирали фильтрацией и промывали холодным EtOH, получая хиноксалин 2-9 (2,81 г) после сушки. Фильтрат концентрировали в вакууме и остаток очищали флэшхроматографией на CombiFlash с гексан - 30% ацетона в гексане, получая другую порцию хиноксалина 29 (0,43 г). MS (ESI): m/z 223,09 [М+Н]. Стадия 1c(1,1 мл), полученную в результате смесь грели при 65 С в течение 2 ч. Смесь разбавляли этилацетатом и затем медленно выливали на лед. После распределения органический слой промывали водой, NaHCO3 раствором и соляным раствором с получением требуемого продукта 2-10 (2,45 г). Данное вещество применяли непосредственно на следующей стадии без дополнительной очистки. MS (ESI): m/z 241,01(60 мл) при 0 С добавляли порциями трет-BuONa (3,0 г, 31,189 ммоль). Реакционную смесь нагревали до комнатной температуры. После перемешивания в течение 1 ч смесь охлаждали до 0 С и добавляли 2 хлор-3-(1,1-дифтораллил)хиноксалин 2-10 (2,45 г, 10,396 ммоль) и нагревали до комнатной температуры. После перемешивания в течение 4 ч реакционную смесь гасили 1N HCl при 0 С. Водный слой экстрагировали EtOAc (3), и органический слой объединяли, промывали водой, соляным раствором, сушили и концентрировали в вакууме. К остатку в DCM (50 мл) и МеОН (10 мл) добавляли TMSCHN2 (10,4 мл,20,792 ммоль, 2,0 М в гексане). Раствор перемешивали при комнатной температуре в течение 30 мин,затем концентрировали в вакууме. Остаток очищали флэш-хроматографией на CombiFlash гексаном 30% этилацетата в гексане с получением требуемого продукта 1-1 (3,84 г, 82%). MS (ESI): m/z 450,24 К раствору -циклопентан-1,2-диола 3-1 а (10,02 г, 97,159 ммоль) в DCM (20 мл) и пиридине (150 мл) добавляли порциями уксусный ангидрид (36,7 мл, 388,63 ммоль) и DMAP (593 мг). Полученный в результате раствор перемешивали в течение 21 ч, и растворитель удаляли в вакууме. Остаток растворяли в EtOAc и полученный в результате раствор промывали IN HCl, водой, NaHCO3, водой и соляным раствором. Органический слой сушили и концентрировали в вакууме. Остаток очищали флэшхроматографией на CombiFlash гексаном - 15% ацетона в гексане с получением диацетата 3-2 а (17,1 г,94%). К суспензии -циклопентан-1,2-дидилдиацетата 3-2 а (17,0 г, 91,3 ммоль) в буфере (рН 7, 140 мл) добавляли аманолипазу PS (от Burkholderia cepacia, Aldrich, 1,81 г). Полученную в результате смесь энергично перемешивали и добавляли 1N NaOH (65 мл) через капельную воронку в течение 18 ч, поддерживая рН 7. Смесь разбавляли EtOAc и водой, фильтровали и водный слой экстрагировали EtOAc. Органический слой объединяли, промывали водой, соляным раствором, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали флэш-хроматографией на CombiFlash гексаном - 35% ацетона в гексане с получением требуемого продукта 3-3 а (4,6 г, 35%). К раствору (1R, 2R)-2-гидроксициклопентилацетата 3-3 а (3,42 г, 23,715 ммоль) в DMF (80 мл) при 0 С добавляли NaH (1,04 г, 26,087 ммоль, 60% дисперсия в минеральном масле). Полученную в результате смесь нагревали до комнатной температуры и перемешивали в течение 30 мин, и ее охлаждали до 0 С и добавляли аллилбромид (2,2 мл, 26,087 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 ч и гасили NH4Cl раствором при 0 С. Смесь экстрагировали EtOAc (3), и органический слой объединяли, промывали водой, соляным раствором, сушили (Na2SO4) и концентрировали в вакууме. К остатку в МеОН (47 мл) и THF (94 мл) добавляли 1N LiOH раствор (47,4 мл, 47,43 ммоль). Смесь перемешивали в течение 30 мин, и смесь экстрагировали EtOAc (3), и органический слой объединяли, промывали водой, соляным раствором, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали флэш-хроматографией на CombiFlash гексаном - 25% ацетона в гексане с получением спирта 3-5 а (1,36 г,40%, 95,8% ее ВЭЖХ). Стадия 1f К раствору (1R,2R)-2-(аллилокси)циклопентанола 3-5 а (2,20 г, 15,50 ммоль) в THF (150 мл) добавляли раствор фосгена (16,3 мл, 30,9 ммоль, 20% в толуоле). Полученный в результате раствор перемешивали в течение 14 ч и концентрировали в вакууме. К остатку в диоксане (50 мл) добавляли L-трет-лейцин 3-6 а (2,237 г, 17,05 ммоль) в диоксане (100 мл) и 1N NaOH (18,6 мл, 18,6 ммоль). Смесь перемешивали в течение 5 ч и подкисляли 1N HCl. Смесь экстрагировали EtOAc (3), и органический слой объединяли,промывали водой, соляным раствором, сушили и концентрировали в вакууме с получением кислоты 1-3 а(4,32 г). Данное вещество применяли непосредственно на следующей стадии без дополнительной очистки. Стадия 1g К раствору хиноксалинового производного 1-1 (3,02 г, 6,719 ммоль) в DCM (20 мл) добавляли 4NHCl (20 мл, в диоксане). Полученный в результате раствор перемешивали в течение 2 ч, и растворитель удаляли в вакууме. К остатку в DMF (67 мл) добавляли кислоту 1-3 а (1,849 г, 8,063 ммоль), HATU (3,321 г, 8,735 ммоль) и DIPEA (2,33 мл, 13,438 ммоль). Смесь перемешивали в течение 3 ч и концентрировали в вакууме. Остаток растворяли в EtOAc и промывали 1N HCl (2), водой, соляным раствором, сушили К раствору диена 1-4 а (1,38 г, 2,188 ммоль) в толуоле в атмосфере азота при 110 С добавляли Zhan 1B катализатор (128 мг, 0,140 ммоль), и полученный в результате раствор перемешивали при 110 С в течение 37 ч. Zhan 1B катализатор (70 мг 2) добавляли двумя порциями, и реакцию прекращали до исчезновения исходного соединения MS. Смесь концентрировали в вакууме и остаток очищали флэшхроматографией на CombiFlash гексаном - 40% EtOAc в гексане с получением алкена 1-5a (0,768 г, 59%).(22,9 мл, 1N). Полученную в результате смесь перемешивали в течение 16 ч и гасили 1N HCl. Смесь экстрагировали DCM (3) и органический слой объединяли, промывали соляным раствором, сушили(Na2SO4) и концентрировали в вакууме с получением кислоты 1-6 а. Кислоту применяли на следующей стадии без дополнительной очистки. Пример 6. Соединение по изобретению. Стадия 6 а Кислоту 1-6 а (21 мг, 0,0356 ммоль) растворяли в DCM (1,5 мл), и к данному раствору добавляли сульфонамид 1-7 е (13,0 мг, 0,0463 ммоль), HATU (17,6 мг, 0,0462 ммоль) и DIPEA (12,4 мкл, 0,0712 ммоль). Смесь перемешивали в течение 3 ч и затем разбавляли DCM. Органический слой промывали 1NHCl, водой, соляным раствором, сушили и концентрировали в вакууме. Остаток очищали ВЭЖХ с получением указанного в заголовке соединения. MS-ESI: m/z 839,41 (M+Н)+. Соединение настоящего изобретения обладает сильными ингибирующими свойствами относительно HCV NS3 протеазы. Следующие примеры описывают анализы, в которых соединение настоящего изобретения можно испытывать на анти-HCV эффекты. Пример 301. Биологические анализы. Анти-HCV активность соединения можно определить измерением активности люциферазного генарепортера в репликоне в присутствии 5% FBS. Люциферазный ген-репортер и ген селектируемого маркера для репликонов, стабильно сохраняющихся в клеточных линиях, помещали под контроль на уровне трансляции полиовируса IRES вместо HCV IRES, и HuH-7 клетки применяли для поддержания репликации репликона. Ингибирующие активности соединения настоящего изобретения можно оценить, применяя ряд анализов, известных в данной области техники. Например, клеточные линии, содержащие стабильный субгеномный репликон, можно применять для получения характеристик соединений в клеточной культуре,включая те, что получены из генотипов 1a-H77, 1b-N и 1b-Con1, полученных у University of Texas Medical Branch, Galveston, TX (1a-H77 и 1b-N) или Apath, LLC, St. Louis, MO (1b-Conl). Гибридные репликоны, применяя репликоны генотипа la или 1b со вставкой NS3 генов из изолятов от людей, инфицированных генотипами 1 а или 1b, можно применять для измерения ингибирующей активности против панели белков-мишеней из природных изолятов. Гибридные репликоны, применяя репликоны генотипа 1 а или 1b со вставкой NS3 генов из изолятов от людей, инфицированных генотипами 3 а, 4 или 6, можно применять для измерения ингибирующей активности против представителей данных генотипов. Репликоновый конструкт генотипа 1 а содержит NS3-NS5B кодирующую область, полученную из Н 77 штамма HCV (1 аН 77). Репликон также содержит репортер люциферазы светлячка и селектируемый маркер неомицинфосфотрансферазы (Neo). Данные две кодирующие области, разделенные FMDV 2 а протеазой, содержат первый цистрон бицистронного репликонового конструкта, со вторым цистроном, содержащим NS3NS5B кодирующую область с добавлением адаптивных мутаций E1202G, K1691R, K2040R и S2204I. 1bCon1 и 1b-N репликоновые конструкты являются идентичными 1 а-Н 77 репликону, за исключением того,- 18023009 что HCV 5' UTR, 3' UTR и NS3-NS5B кодирующие области получены из 1b-Con1 или 1b-N штамма, и адаптивными мутациями являются K1609 Е, K1846 Т и Y3005C для 1b-Con1 или А 1098 Т, E1202G иS2204I для 1b-N. Кроме того, 1b-Con1 репликоновый конструкт содержит полиовирус IRES между HCVIRES и люциферазным геном. Клеточные линии, содержащие репликон, можно хранить в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10 об./об.% фетальную бычью сыворотку (FBS), 100 IU/мл пенициллина, 100 мг/мл стрептомицина (Invitrogen) и 200 мг/мл G418 (Invitrogen). Ингибирующие эффекты соединения настоящего изобретения на HCV репликацию можно также определить измерением активности люциферазного гена-репортера, кодируемого субгеномными репликонами, не содержащими Neo селектируемого маркера, который временно экспрессируется в клетках. Адаптивные мутации, кодируемые 1a-H77, 1b-N и 1b-Con-1 репликонами, являются такими же, как приведено выше. 1b-Con1 репликон, применяемый для данных транзиторных анализов, содержит NS2-NS5B кодирующую область, отличную от NS3-5B кодирующей области. Данные репликоны могут кодироватьNS3 гены-мишени, как описано для стабильных субгеномных репликонов, или они могут кодировать аминокислотные варианты, которые придают различные степени чувствительности к лекарственному средству. Например, варианты могут содержать R155K, D168E или D168V в NS3 гене генотипа 1 а;R155K или D168V в NS3 гене генотипа 1b; S138T, А 166 Т или Q168R в NS3 гене генотипа 3 а. Например,клетки можно трансфицировать репликоном электропорацией и высевать в 96-луночные планшеты при плотности 5000 клеток на лунку в 100 мкл DMEM, содержащей 5% FBS. Затем соединение, разбавленное диметилсульфоксидом (DMSO) для получения 200 исходного раствора в серии восьми полу-log разбавлений, можно дополнительно разбавлять в 100 раз в среде, содержащей 5% FBS, и добавлять к планшетам с клеточными культурами, уже содержащим 100 мкл DMEM с 5% FBS. После периода выдерживания или 3, или 4 дня 30 мкл Passive лизирующего буфера (Promega) можно добавлять к каждой лунке с выдерживанием в течение 15 мин при качании для лизиса клеток. Раствор люциферина (100 мкл,Promega) можно добавлять к каждой лунке, и люциферазную активность можно измерить люминометром. Ингибирование в процентах HCV RNA репликации можно рассчитать для каждой концентрации соединения, и ЕС 50 величину можно рассчитать, применяя аппроксимацию кривой нелинейной регрессией до логистического уравнения с 4 параметрами и GraphPad Prism 4 программное обеспечение. При испытании, применяя анализы со стабильными репликонами генотипа 1a Huh-7, соединение настоящего изобретения показало ЕС 50 величины менее чем 1 нМ. При испытании с применением анализов со стабильными репликонами генотипа 1b Con1 соединение настоящего изобретения показало ЕС 50 величины от 1 до 10 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1 а дикого типа соединение настоящего изобретения показало ЕС 50 величины менее чем 0,1 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1a R155K соединение настоящего изобретения показало ЕС 50 величины менее чем 0,1 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1a D168E соединени показало ЕС 50 величины менее чем 1 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1a D168V соединени показало ЕС 50 величины менее чем 1 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1b дикого типа соединение показало ЕС 50 величины менее чем 1 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1b R155K соединение показало ЕС 50 величины менее чем 1 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 1b D168V соединение показало ЕС 50 величины менее чем 1 нМ. При испытании с применением анализов со стабильными репликонами генотипа 3 а дикого типа соединение показало ЕС 50 величины менее чем 10 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 3 а дикого типа соединение показало ЕС 50 величины менее чем 10 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 3 а А 166 Т соединение показало ЕС 50 величины менее чем 100 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 3 а Q 168R соединение показало ЕС 50 величины менее чем 100 нМ. При испытании с применением анализов с транзиентными репликонами генотипа 3 а S138T соединениепоказало ЕС 50 величины менее чем 100 нМ. Предшествующее описание настоящего изобретения является иллюстрацией и описанием, но не предполагается, что оно является исчерпывающим или ограничивает настоящее изобретение до точно описанного. Модификации и варианты являются возможными в свете приведенных выше идей или могут быть получены из практического осуществления настоящего изобретения. Таким образом, следует отметить, что объем настоящего изобретения определяется формулой изобретения и его эквивалентами. Настоящее изобретение частично показано и описано со ссылкой на его предпочтительные варианты осуществления, но специалисту в данной области техники понятно, что различные изменения в форме и деталях можно осуществлять, не выходя за пределы объема настоящего изобретения, охватываемого прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой 2. Фармацевтическая композиция, предназначенная для лечения вирусной инфекции у субъекта, содержащая ингибирующее количество соединения по п.1 или его фармацевтически приемлемой соли в комбинации с фармацевтически приемлемым носителем или вспомогательным веществом. 3. Фармацевтическая композиция по п.2, где вирусная инфекция представляет собой вирус гепатита С.
МПК / Метки
МПК: A61K 38/21
Метки: полученный, инфекции, пролина, ингибитор, вирусной, композиция, макроциклического, фармацевтическая, лечения, предназначенная, сериновой, протеазы
Код ссылки
<a href="https://eas.patents.su/21-23009-ingibitor-hcv-serinovojj-proteazy-poluchennyjj-iz-makrociklicheskogo-prolina-i-farmacevticheskaya-kompoziciya-prednaznachennaya-dlya-lecheniya-virusnojj-infekcii.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибитор hcv сериновой протеазы, полученный из макроциклического пролина, и фармацевтическая композиция, предназначенная для лечения вирусной инфекции</a>
Предыдущий патент: Солнцезащитная композиция
Следующий патент: Многофазные эмульсии для красителей
Случайный патент: Пентаспецифические антитела, способы их получения и применения