Способ подавления роста или метастазирования ангиогенез-зависимой опухоли
Номер патента: 19919
Опубликовано: 30.07.2014
Авторы: Ку Жикан, Анансан Субраманиам, Рой Эншу Миттал
Формула / Реферат
1. Способ подавления роста или метастазирования ангиогенез-зависимой опухоли у пациента, который в этом нуждается, включающий введение указанному пациенту эффективного количества битионола.
2. Способ по п.1, отличающийся тем, что указанный способ включает подавление роста ангиогенез-зависимой опухоли.
3. Способ по п.1, отличающийся тем, что указанный способ включает подавление метастазирования ангиогенез-зависимой опухоли.
Текст
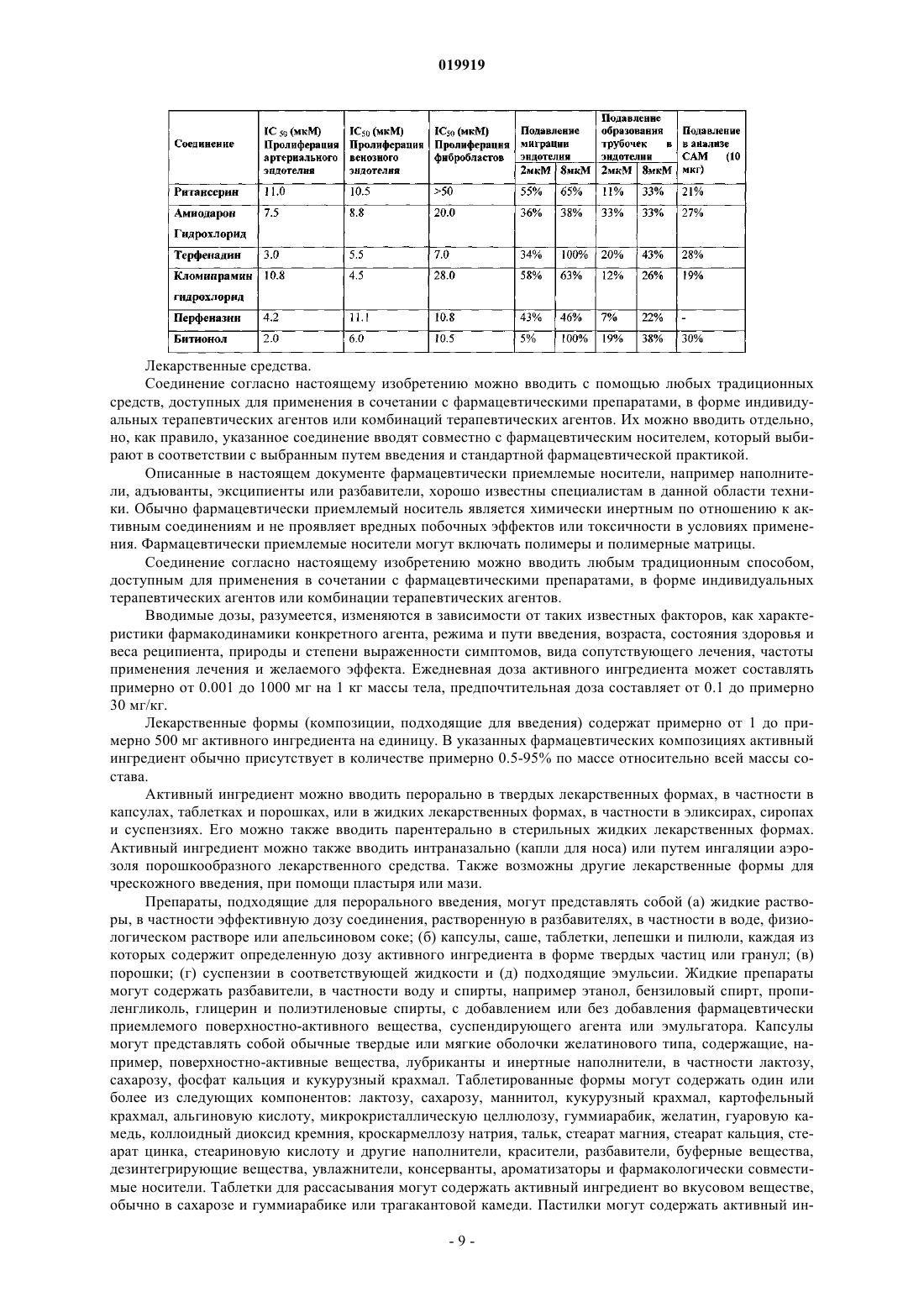
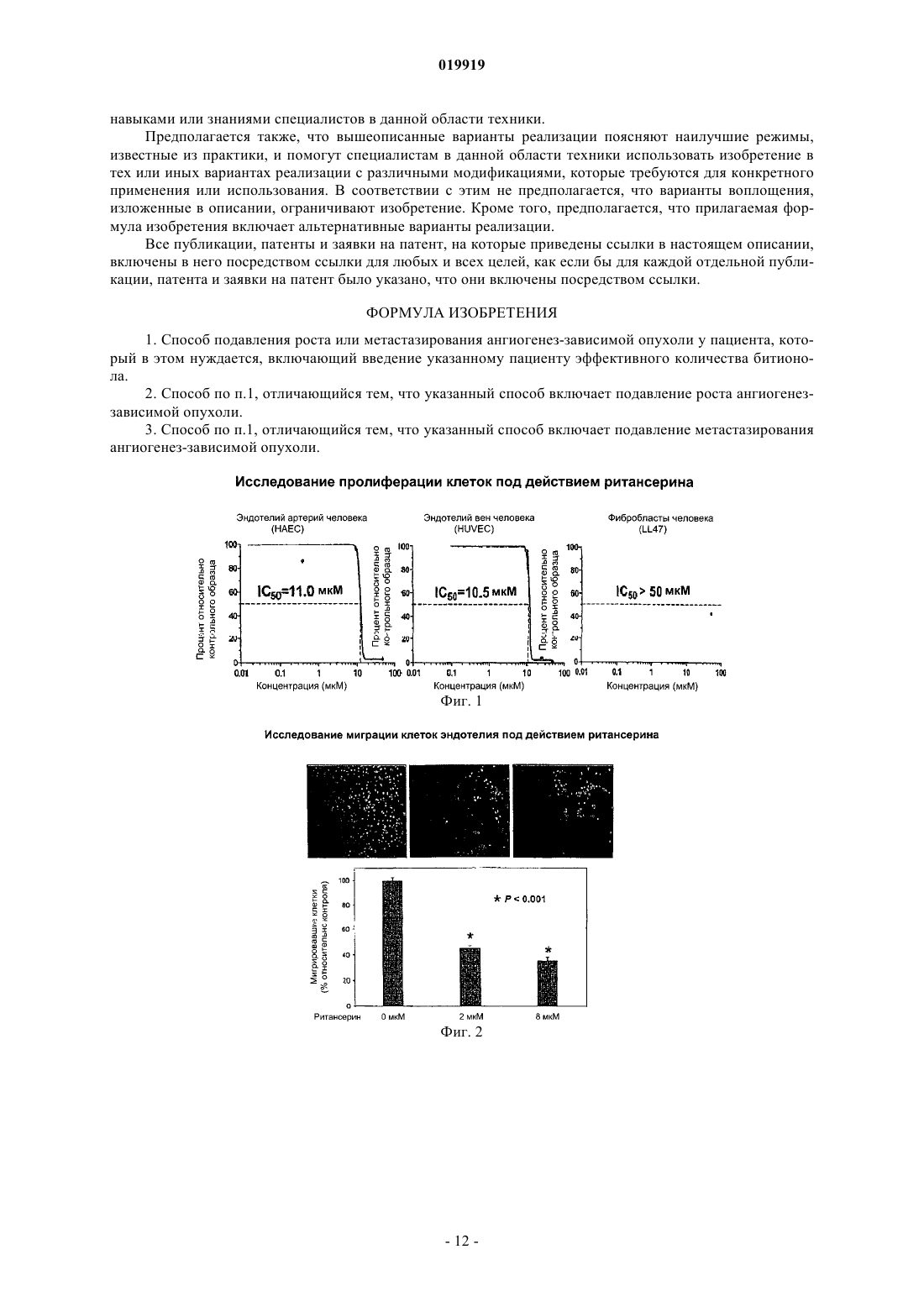
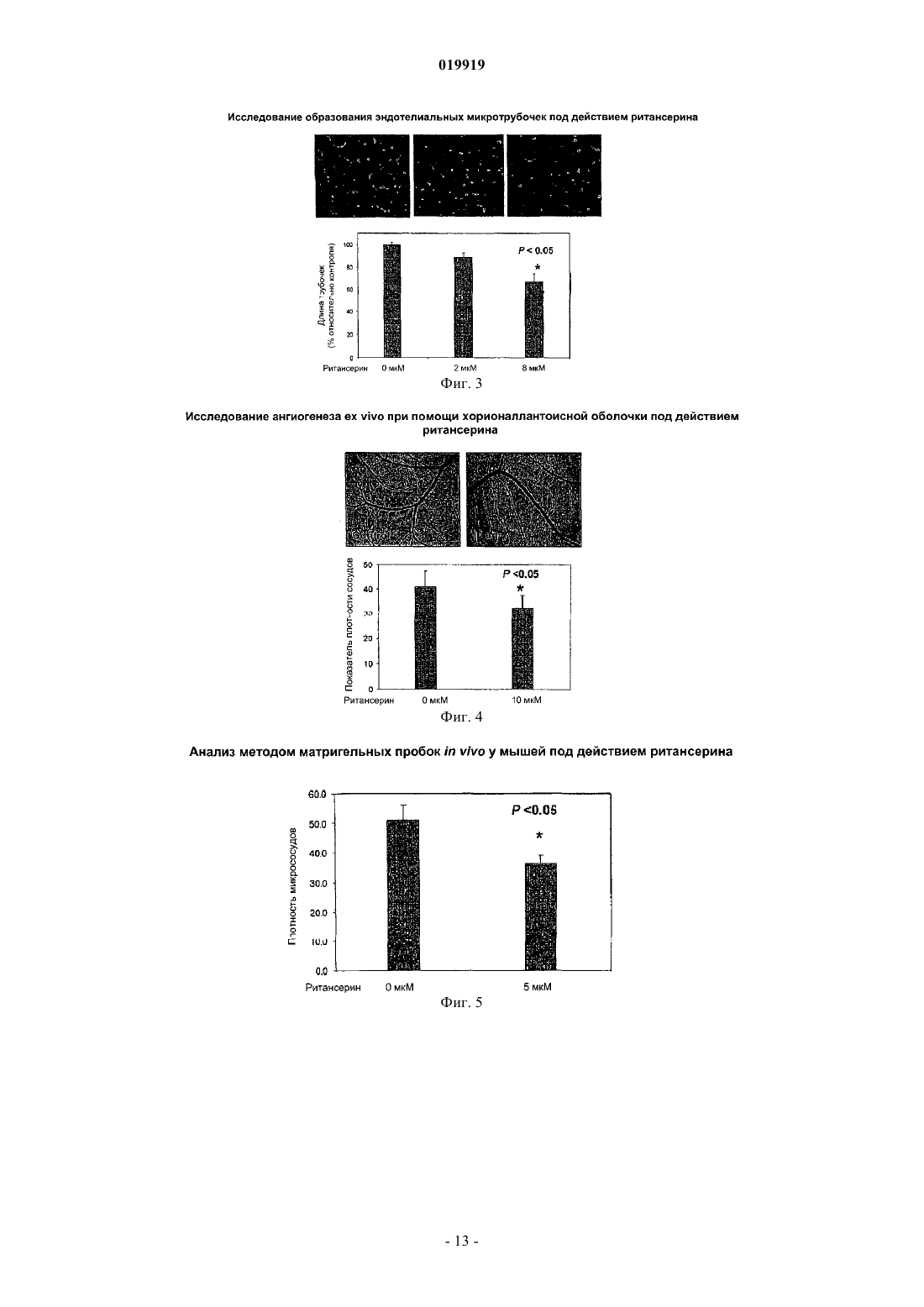
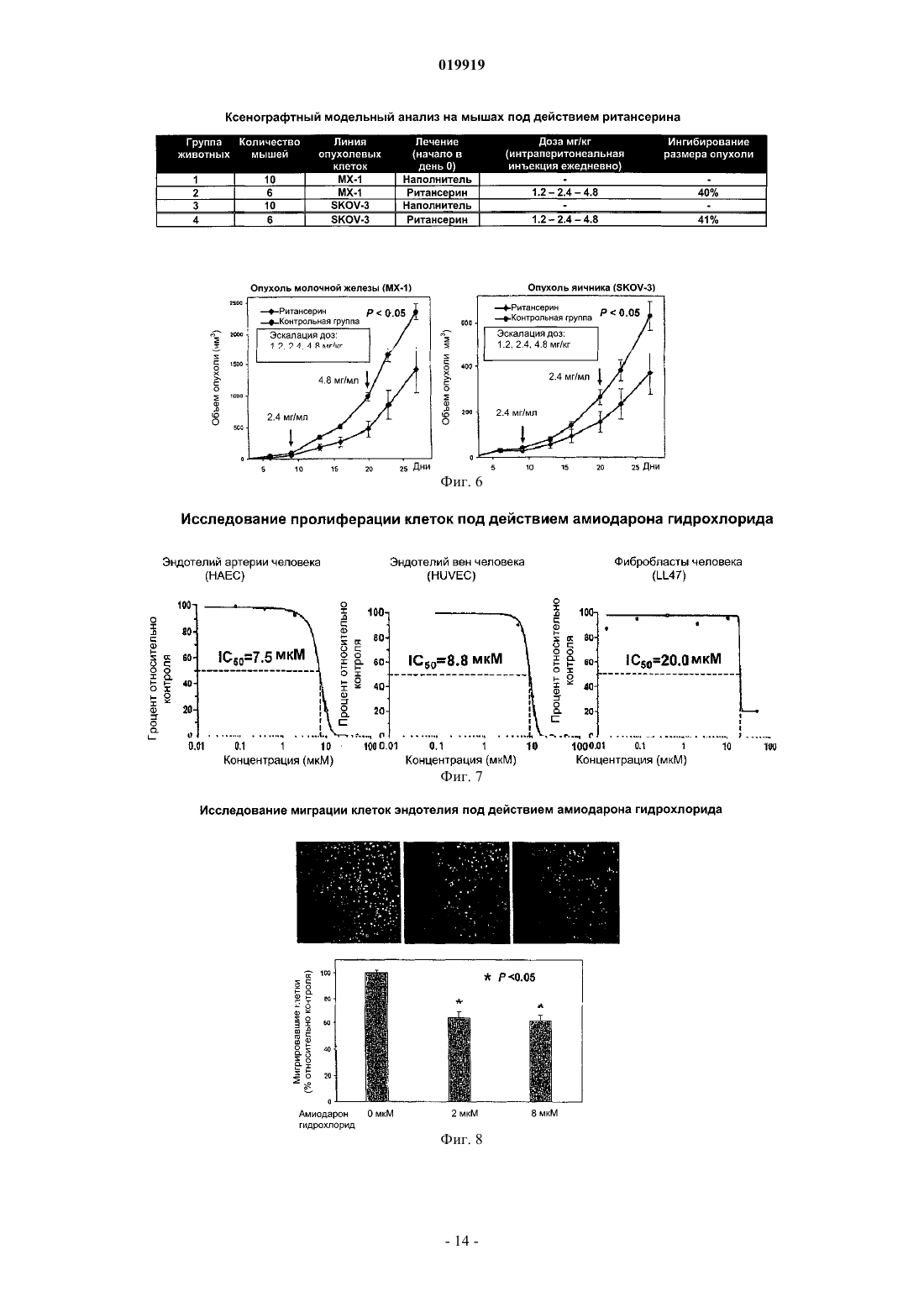
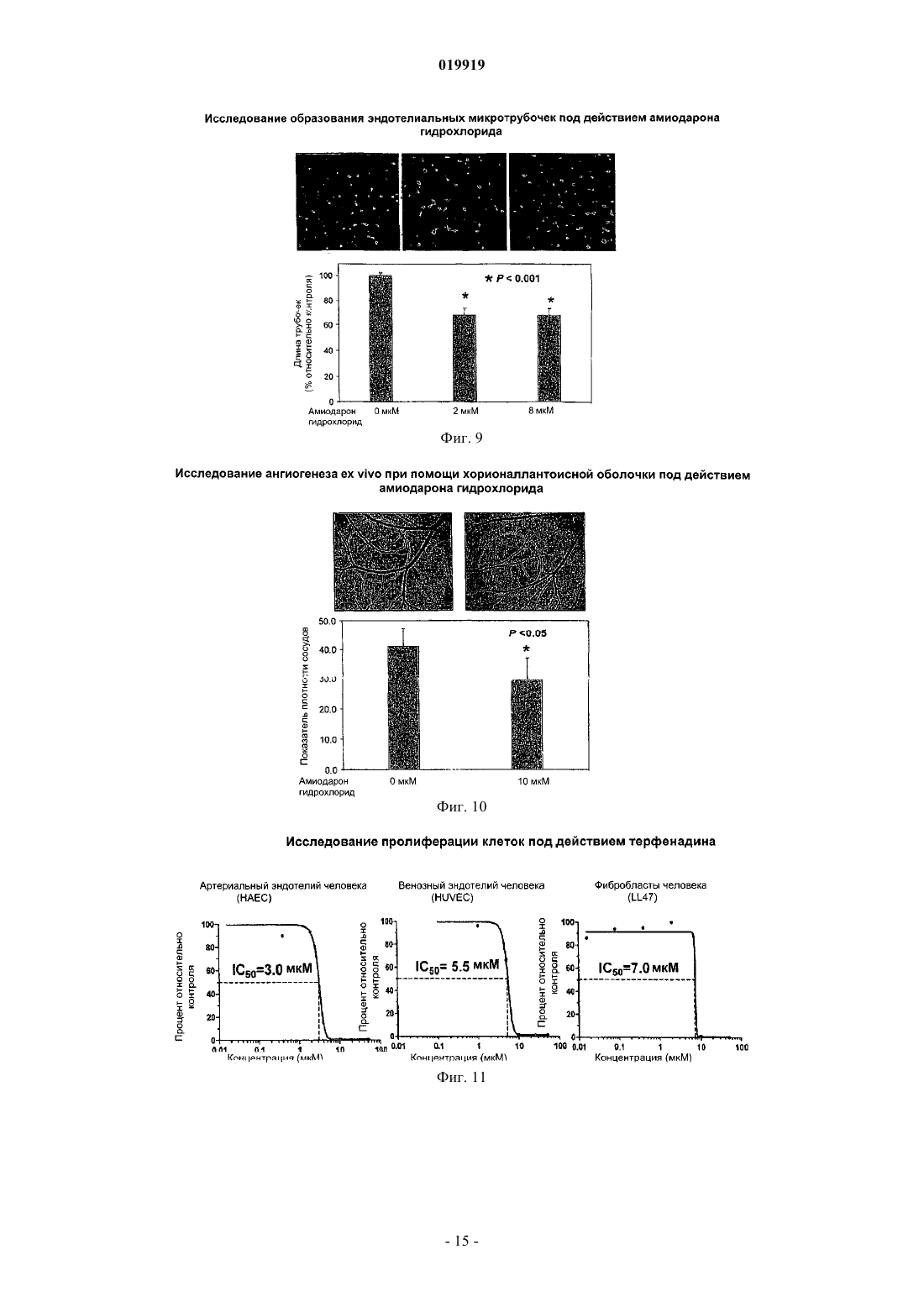
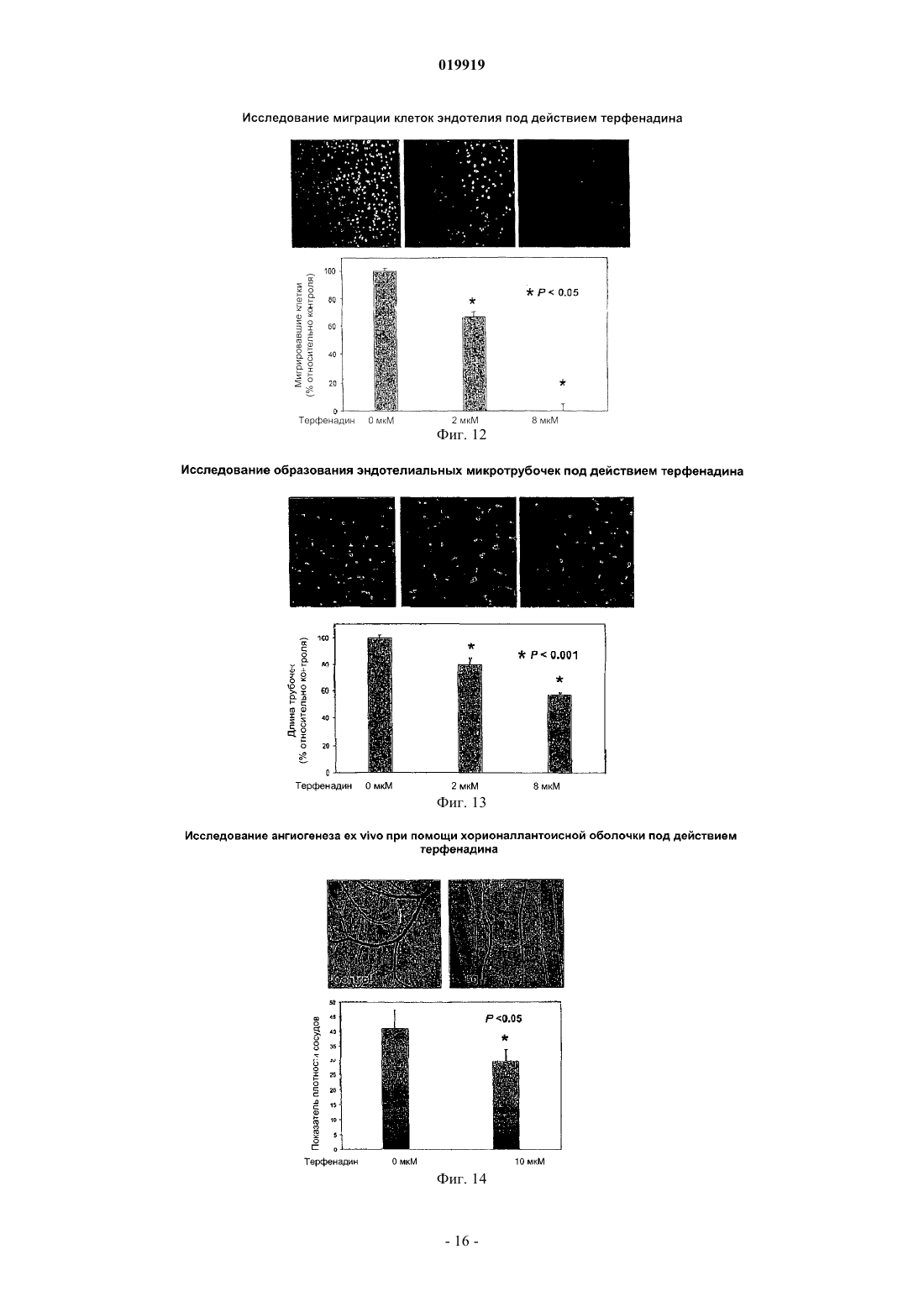
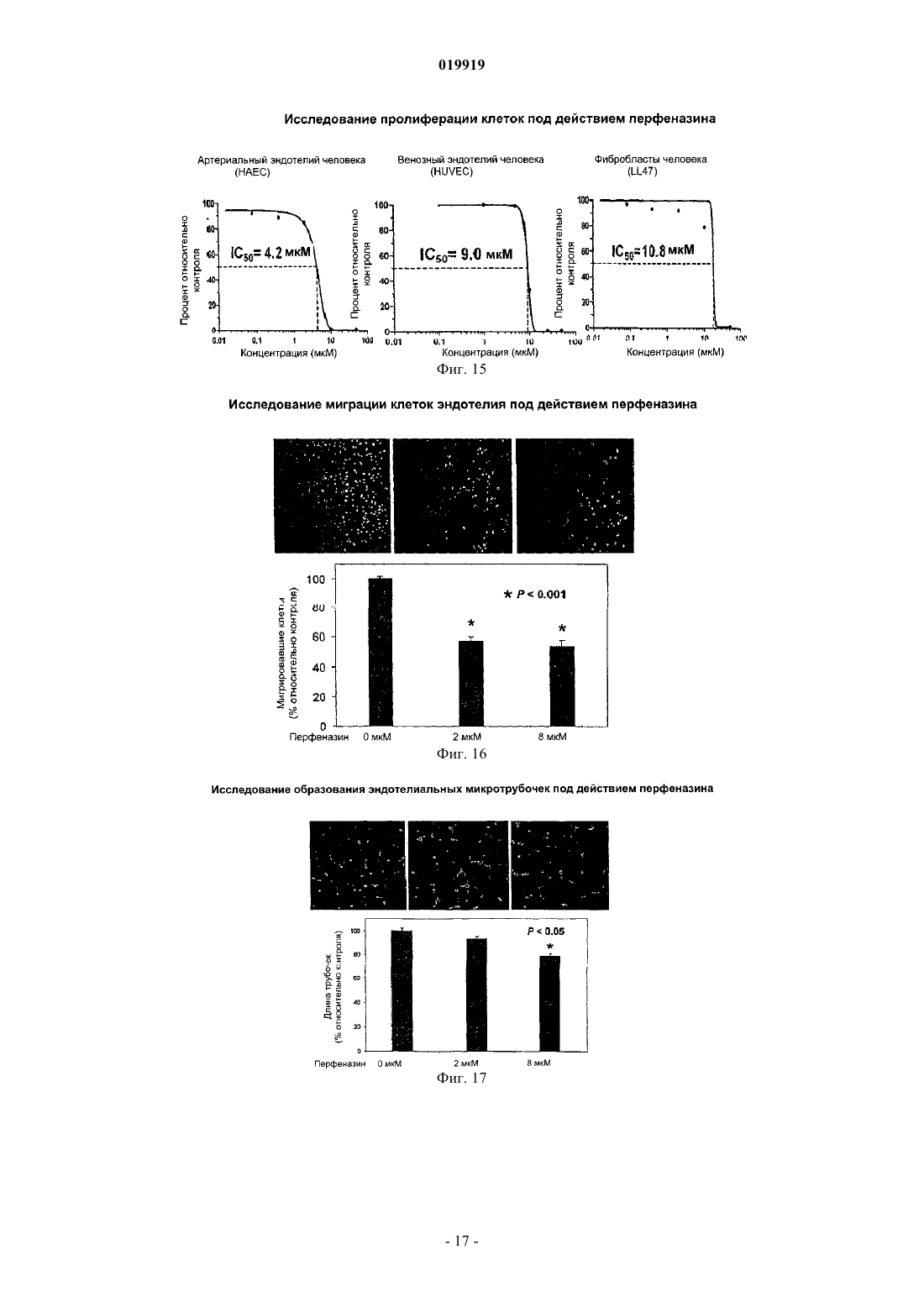
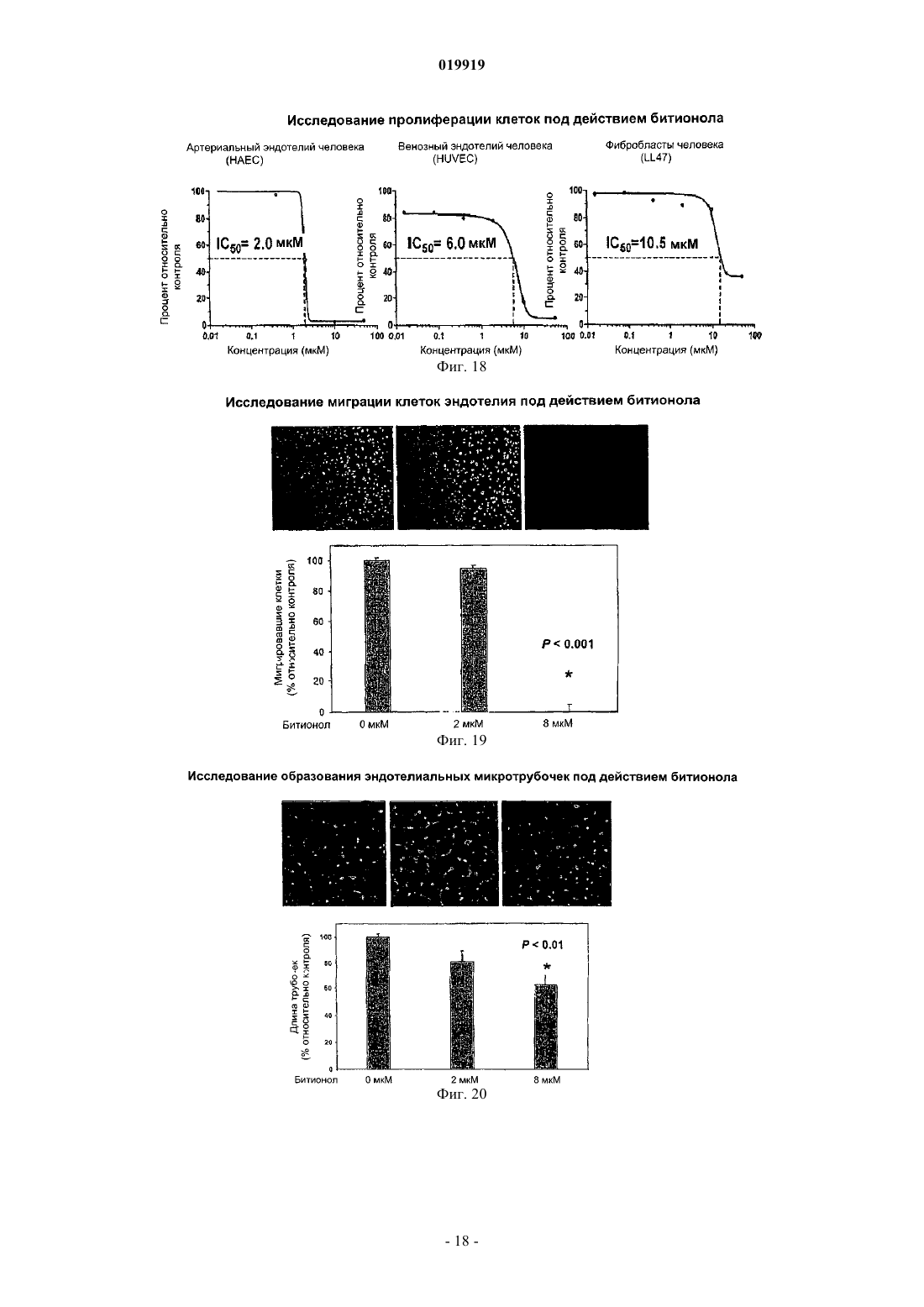
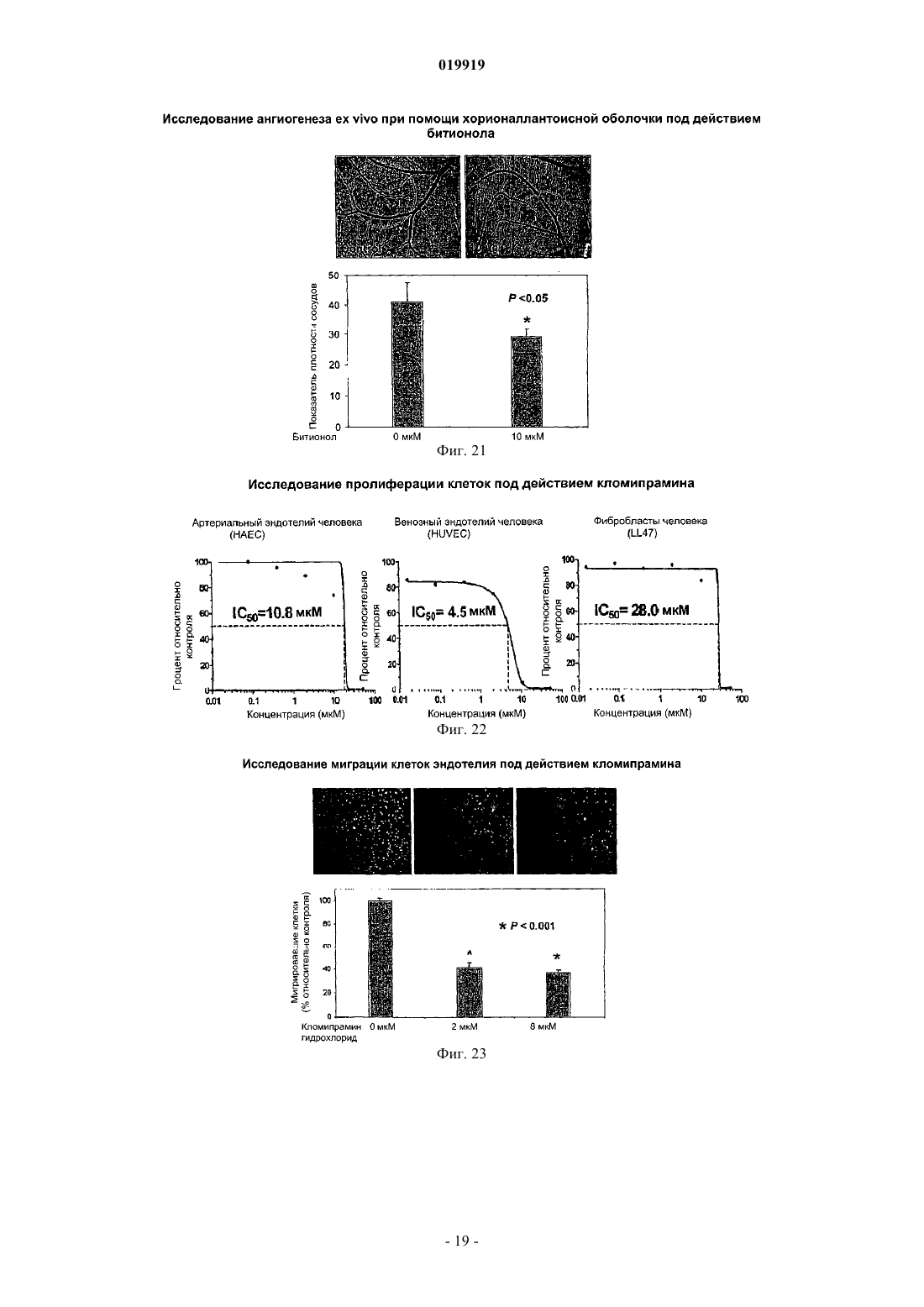
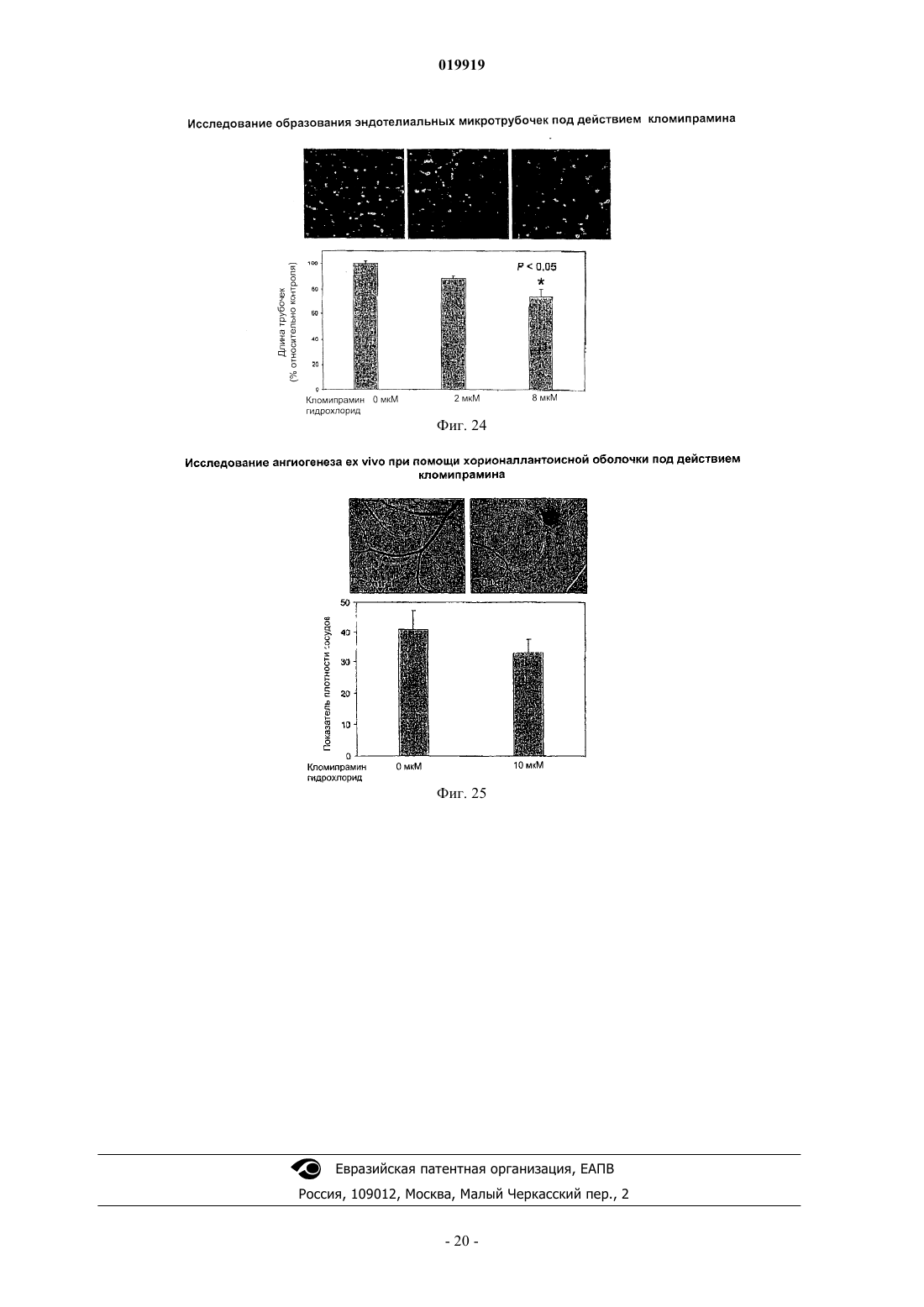
СПОСОБ ПОДАВЛЕНИЯ РОСТА ИЛИ МЕТАСТАЗИРОВАНИЯ АНГИОГЕНЕЗЗАВИСИМОЙ ОПУХОЛИ Изобретение в целом относится к лечению или профилактике заболеваний, связанных с ангиогенезом, путем введения указанному пациенту определенного соединения, подавляющего или существенно уменьшающего ангиогенез. Соединение, используемое согласно настоящему изобретению, проявляет хорошую антиангиогенную активность, а также демонстрирует профилактический эффект предотвращения и существенного уменьшения ангиогенеза. Примером такого соединения является битионол. Область техники Настоящее изобретение в целом относится к лечению или профилактике заболеваний, связанных с ангиогенезом, путем введения пациенту определенного соединения, ингибирующего или существенно уменьшающего ангиогенез. Соединение, применяемое согласно настоящему изобретению, проявляет хорошую антиангиогенную активность, а также демонстрирует профилактический эффект, обеспечивающий предотвращение и существенное уменьшение ангиогенеза. Примером такого соединения является битионол. Уровень техники Ангиогенез представляет собой образование новых кровеносных сосудов из уже существующих капилляров и является последовательностью событий, которые играют ключевую роль во многих физиологических и патологических процессах. Нормальный рост тканей, например, при эмбриональном развитии, заживлении ран и менструальном цикле, характеризуется зависимостью от образования новых сосудов для снабжения кислородом и питательными веществами, а также для удаления продуктов жизнедеятельности. Большое число различных и не связанных друг с другом заболеваний также ассоциировано с образованием новой сосудистой сети. Некоторые патологии включают состояния, при которых ангиогенез является низким и необходимо его усиление для облегчения болезненного состояния. Патологии с неадекватным образованием кровеносных сосудов включают ишемию периферических и коронарных артерий и инфаркт, хроническое незаживление ран и язвы. Однако чаще встречается избыточный ангиогенез, который является важной характеристикой различных патологий, включая патологии, характеризующиеся или связанные с аномальной или неконтролируемой пролиферацией клеток. К патологиям,включающим избыточный ангиогенез, относится, например, рак (как солидные, так и гематологические опухоли), сердечно-сосудистые заболевания (в частности, атеросклероз и рестеноз), хроническое воспаление (ревматоидный артрит, болезнь Крона), диабет (диабетическая ретинопатия), псориаз, эндометриоз, неоваскулярная глаукома и ожирение. См. GriffioenMolema, Angiogenesis: Potentials for Pharmacologic Intervention in the Treatment of Cancer, Cardiovascular Diseases, and Chronic Inflammation, Pharmacol. Rev. 52, 237-268 (2000). В целом процесс ангиогенеза влечет за собой пролиферацию и миграцию неподвижного в норме эндотелия, регулируемый протеолиз околоклеточного матрикса и синтез новых компонентов внеклеточного матрикса в результате развития капилляров. Установление новых внутри- и межклеточных контактов и морфологическая дифференцировка клеток эндотелия в сетях капилляроподобных трубочек создает основу для их последующего созревания, ветвления, ремоделирования и избирательной регрессии с образованием высокоорганизованной функциональной сети микрососудов. Аутокринные, паракринные и амфикринные взаимодействия эндотелия сосудов с компонентами окружающей его стромы, а также с проангиогенными и ангиостатическими цитокинами и факторами роста, управляющими физиологическим ангиогенезом, обычно жестко регулируются в пространстве и во времени. См. Gasparini, The Rationale and Future Potential of Angiogenesis Inhibitors in Neoplasia, DRUGS, 58(1): 17-38 (1999). Наиболее хорошо известные антиангиогенные агенты, действие которых направлено на подавление пролиферации клеток эндотелия, представляют собой ингибиторы фактора роста эндотелия сосудов(Vascular Endothelial Growth Factor, VEGF). Экспрессия VEGF, эффективного ангиогенного фактора роста, повышена в большинстве солидных опухолей человека и в сетчатке в случае глазных болезней. Количество рецепторов VEGF в основном повышено в клетках эндотелия, передающих сигналы VEGF во многих состояниях, связанных с патологическим ангиогенезом. Клетки эндотелия, подвергнутые стимуляции роста, чувствительны также к ингибиторам тирозинкиназы, мишенью которых являются рецеторыVEGF, в частности к недавно одобренным FDA (Управлением по контролю качества продовольствия и медикаментов США) противораковым лекарственным средствам сунитиниб (SU11248) и срафениб (BAY 43-9006). Анти-VEGF и VEGF рецепторные агенты могут блокировать пролиферацию клеток эндотелия и предотвращать рост новых кровеносных сосудов. Помимо VEGF, многие другие факторы роста, в частности факторы роста фибробластов (FGF) и факторы роста тромбоцитов (PDGF), также играют важную роль в активации эндотелия. В последнее время обнаружена устойчивость к антиангиогенным агентам, воздействующим только на передачу сигналов через VEGF, причиной которой, по-видимому, являются альтернативные сигнальные пути, медиаторами в которых являются другие факторы роста. Ангиогенез является ключевым явлением роста неопластических тканей. Наблюдения, проводимые в течение более 100 лет, показывают, что опухоли являются более васкуляризированными, чем нормальные ткани. Некоторые экспериментальные исследования указывают на то, что рост как первичной опухоли, так и метастазов требует образования новых сосудов. В отличие от хорошо регулируемого процесса, описанного выше для роста нормальной ткани, патологический ангиогенез, необходимый для активного роста опухоли, обычно является непрерывным и устойчивым, при этом начальное приобретение ангиогенного фенотипа представляет собой общий механизм развития различных типов солидных и гематопоэтических опухолей. См. Folkman, J., Cancer MEDICINE, 132-152 (5th Ed., B.C. Decker Inc.) (2000). Опухоли, которые не способны захватывать и удерживать сосудистую сеть, обычно остаются неактивными в форме бессимптомных очагов in situ. Метастазирование также зависит от ангиогенеза: для успешного образования метастазов опухолевой клеткой ей, как правило, необходимо получить доступ к сосудистой сети в первичной опухоли, выжить в циркулирующей крови, удержаться в микрососудистой сети целевого органа, выйти из этой сосудистой сети, врасти в целевой орган и вызвать ангиогенез в целевом участке. Таким образом, ангиогенез оказывается необходимым вначале и по окончании каскада метастазирования. Ангиогенез, оказывающий важное влияние на рост и метастазирование новообразований, представляет собой оптимальную потенциальную мишень для химиотерапевтического лечения. Соответствующие антиангиогенные агенты могут действовать прямо или косвенно, влияя на связанный с опухолью ангиогенез, задерживая его начало (т.е. блокируя "ангиогенный переключатель") или блокируя непрерывную очаговую неоваскуляризацию, которая характерна для многих типов опухолей. В настоящее время проводится активная оценка безопасности и эффективности антиангиогенной терапии, направленной против связанного с опухолью эндотелия, и множества молекулярных и клеточных процессов и мишеней, участвующих в устойчивом патологическом ангиогенезе, в многочисленных клинических исследованиях. См. DeplanqueHarris, Anti-angiogenic Агенты: Clinical Trial Design and Therapies in Development, Eur. J. Cancer, 36: 1713-1724 (2000). Однако до настоящего времени достигнут лишь ограниченный успех в нахождении и/или идентификации безопасных и/или эффективных антиангиогенных агентов. Краткое описание изобретения Настоящее изобретение в целом относится к лечению или предотвращению заболеваний, связанных с ангиогенезом. Согласно одному варианту реализации изобретения предложены способы подавления роста или метастазирования ангиогенез-зависимой опухоли у пациента, который в этом нуждается, включающий введение указанному пациенту эффективного количества битионола. Краткое описание чертежей На фиг. 1 показана кривая доза-ответ в зависимости от концентрации, полученная в тестах на пролиферацию клеток под действием ритансерина. На фиг. 2 показаны результаты исследования миграции клеток эндотелия при использовании ритансерина и процент мигрировавших клеток по отношению к контролю. На фиг. 3 показаны результаты исследования образования эндотелиальных трубочек с использованием ритансерина и процент образования трубочек по отношению к контролю. На фиг. 4 показаны результаты анализа ангиогенеза ex vivo при помощи хорионаллантоисной оболочки под действием ритансерина и показатель плотности сосудов. На фиг. 5 показана плотность микрососудов при анализе методом пробок из матригеля in vivo у мышей под действием ритансерина. На фиг. 6 показаны результаты исследования модели с ксенотрансплантатом на мышах с использованием ритансерина и изменение объема опухоли в зависимости от времени. На фиг. 7 показана кривая доза-ответ в зависимости от концентрации, полученная при исследовании пролиферации клеток под действием амиодарона гидрохлорида. На фиг. 8 показаны результаты исследования миграции клеток эндотелия при использовании амиодарона гидрохлорида и процент мигрировавших клеток по отношению к контролю. На фиг. 9 показаны результаты исследования образования эндотелиальных трубочек под действием амиодарона гидрохлорида и процент образования трубочек по отношению к контролю. На фиг. 10 показаны результаты исследования ангиогенеза ex vivo с использованием хорионаллантоисной оболочки под действием амиодарона и показатель плотности сосудов. На фиг. 11 показана кривая доза-эффект в зависимости от концентрации, полученная при исследовании пролиферации клеток под действием терфенадина. На фиг. 12 показаны результаты исследования миграции клеток эндотелия при использовании терфенадина и процент мигрировавших клеток по отношению к контролю. На фиг. 13 показаны результаты исследования образования эндотелиальных микротрубочек под действием терфенадина и процент образования трубочек по отношению к контролю. На фиг. 14 показаны результаты исследования ангиогенеза под действием терфенадина ex vivo с использованием хорионаллантоисной оболочки и показатель плотности сосудов. На фиг. 15 показана кривая зависимости эффекта дозы от концентрации для исследования пролиферации клеток при использовании перфеназина. На фиг. 16 показаны результаты анализа миграции клеток эндотелия под действием перфеназина и процент мигрировавших клеток по отношению к контролю. На фиг. 17 показаны результаты анализа образования эндотелиальных трубочек под действием перфеназина и процент образования трубочек по отношению к контролю. На фиг. 18 показана кривая доза-эффект в зависимости от концентрации, полученная при исследовании пролиферации клеток под действием битионола. На фиг. 19 показаны результаты исследования миграции клеток эндотелия под действием битионола и процент мигрировавших клеток по отношению к контролю. На фиг. 20 показаны результаты исследования образования эндотелиальных трубочек под действием битионола и процент образования трубочек по отношению к контролю. На фиг. 21 показаны результаты анализа ангиогенеза под действием битионола ех vivo при помощи хорионаллантоисной оболочки и показатель плотности сосудов. На фиг. 22 показана кривая доза-эффект в зависимости от концентрации, полученная при исследовании пролиферации клеток под действием кломипрамина. На фиг. 23 показаны результаты анализа миграции клеток эндотелия под действием кломипрамина и процент мигрировавших клеток по отношению к контролю. На фиг. 24 показаны результаты исследования образования эндотелиальных трубочек под действием кломипрамина и процент образования трубочек по отношению к контролю. На фиг. 25 показаны результаты анализа ангиогенеза под действием кломипрамина ex vivo с использованием хорионаллантоисной оболочки и показатель плотности сосудов. Подробное описание изобретения Настоящее изобретение в целом относится к лечению или предотвращению заболеваний, связанных с ангиогенезом, у пациента, который в этом нуждается, путем введения указанному пациенту конкретного соединения, подавляющего или существенно уменьшающего ангиогенез. Соответствующие термины, используемые выше и во всем тексте описания, если не указано иное,имеют следующие значения. Термин "алкил" относится к алифатической углеводородной группе, которая может быть линейной,разветвленной или циклической и содержит от 1 до примерно 10 атомов углерода в цепи, и ко всем комбинациям и подкомбинациям в указанных пределах. Термин "разветвленный" относится к алкильной группе, в которой низшая алкильная группа, в частности метил, этил или пропил, присоединена к линейной алкильной цепи. В некоторых вариантах реализации изобретения алкильная группа представляет собой С 1-С 4-алкильную группу, т.е. разветвленную или линейную алкильную группу, содержащую от 1 до примерно 4 атомов углерода. В других вариантах реализации изобретения алкильная группа представляет собой С 1-С 3-алкильную группу, т.е. разветвленную или линейную алкильную группу, содержащую от 1 до примерно 3 атомов углерода. Примеры алкильных групп включают метил, этил, н-пропил,изопропил, бутил, изобутил, вторичный бутил, третичный бутил, пентил, гексил, гептил, октил, нонил и децил. Термин "арил" относится к ароматическому карбоциклическому радикалу, содержащему примерно от 6 до примерно 10 атомов углерода, и ко всем комбинациям и подкомбинациям в указанных пределах. Арильная группа может содержать один, два или большее количество заместителей. Примеры арильных групп включают моноциклические группы, в частности фенил, и бициклические группы, в частности нафтил. Термин "гетероарил" относится к ароматическому карбоциклическому радикалу, содержащему примерно от 4 до примерно 10 членов, и ко всем комбинациям и подкомбинациям в указанных пределах,при этом один или более из указанных членов представляют собой элемент, отличный от углерода, например азот, кислород или серу. Примеры гетероарильных групп включают моноциклические группы, в частности пиридил, и бициклические группы, в частности индолил. Термин "арилалкил" относится к алкилу, содержащему в качестве заместителя арильную группу. Например, "C1-C4-арилалкильная группа" представляет собой C1-C4-алкильную группу, содержащую в качестве заместителя арильную группу. Термин "гетероарилалкил" относится к алкилу, содержащему в качестве заместителя гетероарильную группу. Так, например, "C1-C4-гетероарилалкильная группа" представляет собой C1-C4-алкильную группу, содержащую в качестве заместителя гетероарильную группу. Термин "циклоалкил", используемый отдельно или как часть более крупной группы, включает циклические C3-C10-углеводороды, которые являются полностью насыщенными или содержат одну или более единиц ненасыщения, но которые, однако, не являются ароматическими. Типичные циклоалифатические группы представляют собой C3-C10, более типичные - С 3-С 7. Термин "неароматический гетероцикл", используемый отдельно или как часть более крупной группы, как и "гетероциклоалкил", относится к неароматическим кольцевым системам, как правило, содержащим от пяти до четырнадцати членов, предпочтительно - от пяти до десяти, в которых один или более углеродных атомов в кольце, предпочтительно от одного до четырех атомов, замещены на гетероатом, в частности N, О или S. Термин "эффективное количество" относится к количеству соединения согласно настоящему изобретению, которое может быть терапевтически эффективным для лечения заболевания или нарушения,связанного с ангиогенезом. Точное необходимое количество таких соединений изменяется в зависимости от конкретного используемого соединения, возраста и состояния субъекта, подлежащего лечению, а также от природы и тяжести состояния. При этом указанное эффективное количество может быть определено средним специалистом в данной области техники в ходе обычных экспериментов. Термин "фармацевтически приемлемый" относится к соединениям, материалам, композициям и/или дозированным формам, которые в рамках обоснованного медицинского суждения являются подходящими для контакта с тканями организма человека и животного, не проявляя при этом чрезмерной токсичности, раздражения, аллергической реакции или иных осложнений, и характеризуются разумным соотно-3 019919 шением "риск/польза". Термин "фармацевтически приемлемые соли" относится к производным соединений согласно настоящему изобретению, при этом исходное соединение модифицируют, получая его кислые или основные соли. Соединения согласно настоящему изобретению образуют аддитивные соли с широким спектром органических и неорганических кислот и оснований и включают физиологически приемлемые соли,которые часто используют в фармацевтической химии. Такие соли также являются частью настоящего изобретения. Типичные неорганические кислоты, которые используют для получения таких солей, включают соляную, бромисто-водородную, йодисто-водородную, азотную, серную, фосфорную, фосфорноватую и т.п. Кроме того, можно использовать также соли, полученные из органических кислот, в частности алифатических моно- и дикарбоновых кислот, фенилзамещенных алкановых кислот, оксиалкановых и оксиалкандиовых кислот, ароматических кислот, алифатических и ароматических сульфокислот. Таким образом, фармацевтически приемлемые соли включают ацетат, фенилацетат, трифторацетат, акрилат,аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, оацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, -гидроксибутират, бутин-1,4 диоат, гексин-1,4-диоат, кабрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терафталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себацинат, сукцинат, суберат, сульфат,бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, р-бромбензолсульфонат,хлорбензолсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1 сульфонат, нафталин-2-сульфонат, р-толуолсульфонат, ксиленсульфонат, тартрат и т.п. Основания, которые обычно используют для получения солей, включают гидроксид аммония и гидроксиды щелочных и щелочно-земельных металлов, карбонаты, а также алифатические и первичные,вторичные и третичные амины, алифатические диамины. Основания, особенно подходящие для получения аддитивных солей, включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия, метиламин, диэтиламин и этилендиамин. Термин "пациент" относится к животным, включая млекопитающих, предпочтительно к человеку. Термин "метаболит" относится к любому веществу, которое образуется в результате химических превращений при протекании процессов роста и восстановления в живом организме, включая анаболические и катаболические процессы. Термин "пролекарство" относится к соединению, которое в организме превращается в активную форму, оказывающую лечебное действие. Пролекарства могут применяться в тех случаях, когда активный лекарственный препарат является слишком токсичным для системного введения, плохо поглощается желудочно-кишечным трактом или же разлагается в организме до того, как достигнет мишени. Способы получения пролекарств описаны в работе Hans Bundgaard, Design of Prodrugs (Elsevier Science PublishersB.V. 1985), содержание которой полностью включено в настоящее описание посредством ссылки. Термин "сольваты" относится к соединениям, которые образуются в результате взаимодействия растворителя и растворенного вещества и включают гидраты. Сольваты обычно представляют собой твердые кристаллические аддукты, содержащие молекулы растворителя в кристаллической структуре в стехиометрических или нестехиометрических соотношениях. Термин "содержащий" (и его грамматические формы) в данном описании имеет инклюзивный смысл "имеющий" или "включающий", а не эксклюзивный смысл "состоящий только из". Термин "состоящий, по существу, из", используемый в настоящем описании, относится к однозначно указанному компоненту, присутствующему в составе наряду с другими компонентами, которые не оказывают существенного влияния на основные и новые характеристики указанного или однозначно определенного материала. Термины, используемые в единственном числе, включают единственное и множественное число,если из контекста однозначно не следует иное. Некоторые кислотные или основные соединения согласно настоящему изобретению могут существовать в форме цвиттер-ионов. Все формы соединений, в том числе свободная кислота, свободное основание и цвиттер-ионы, находятся в рамках настоящего изобретения. В химических формулах, приведенных в настоящем описании и пунктах прилагаемой формулы изобретения, предполагается, что, если какой-либо символ встречается в конкретной формуле или заместителе более одного раза, значение указанного символа в каждом случае является независимым от других значений.X в каждом случае независимо представляет собой хлор или ОН;n представляет собой 3,при этом соединение формулы (V) или формулы (V-a) представляет собой битионолX в каждом случае независимо представляет собой хлор;n в каждом случае представляет собой независимо 2. Способы синтеза соединения формулы (V) и формулы (V-a) хорошо известны специалистам в данной области техники и описаны в патенте США 3506720, Basel et al., и патенте США 2849494, Cooper et al., содержание которых полностью включено в настоящее описание посредством ссылки. Согласно настоящему изобретению предложены способы подавления роста или метастазирования ангиогенез-зависимой опухоли соединением согласно настоящему изобретению. Термин "подавлять" в настоящем описании означает, что величина роста опухоли или метастазов и/или появление ангиогенеза у пациентов, которым вводят соединение согласно настоящему изобретению, могут быть в желательной степени уменьшены по сравнению с пациентами, которые не получали указанного соединения. Таким образом, в одной форме способы подавления согласно настоящему изобретению включают введение пациенту эффективной дозы антиангиогенного агента. Термин "антиангиогенный агент", используемый в данном описании, относится к соединениям, которые могут подавлять ангиогенез. Заболевания или нарушения, связанные с ангиогенезом, включают, например, состояния, при которых ангиогенез играет определенную роль в патологии или прогрессировании указанного состояния, при этом подавление ангиогенеза у пациента в таком состоянии может задерживать или предотвращать дальнейшее прогрессирование состояния или обеспечивать ремиссию или регрессию болезненного состояния. Такие патологические состояния часто характеризуются или ассоциируются с аномальной пролиферацией клеток и включают, например, неопластические заболевания. В данном описании термин "лечение заболевания или нарушения" относится к введению агентов, которые предназначены для ограничения степени, прогрессирования и/или тяжести патологического состояния пациента, по сравнению с пациентами, не получающими такого лечения. В данном описании термин "неопластическое заболевание" относится к любому патологическому состоянию, которое характеризуется наличием аберрантного роста аномальных клеток или ткани, включая, в частности, но без ограничения, все раковые заболевания и опухоли, в том числе доброкачественные или злокачественные. Термин "лечение неопластических заболеваний" относится к введению химиотерапевтического агента, подавляющего дальнейший рост или метастазирование неопластической ткани, которая может существовать в организме пациента, и/или стимулирующего регрессию таких новообразований, включая уменьшение размера и/или числа таких новообразований и/или индуцирование гибели неопластических клеток. Пролекарственные формы соединений, содержащих различные азотосодержащие функциональные группы (амино, гидроксиамино, амид и т. д.), могут включать следующие типы производных, где каждая группа R может отдельно представлять собой водород, замещенные или незамещенные алкильные,арильные, алкенильные, алкинильные, гетероциклические, алкиларильные, аралкильные, аралкенильные,аралкинильные, циклоалкильные или циклоалкенильные группы согласно приведенным выше определениям.(е) Основания Манниха (из карбоксимидных соединений), RCONHCH2NR2. Получение таких пролекарственных производных обсуждается в различных литературных источниках (например, Alexander et al., J. Med. Chem. 1988, 31, 318; Aligas-Martin et al., PCT WO pp/41531, p. 30). Азотсодержащие функциональные группы, подвергаемые превращениям при получении этих производных, представляют собой один (или более) атом азота в составе соединения согласно изобретению. Пролекарственные формы карбоксилсодержащих соединений включают сложные эфиры (-CO2R),где группа R соответствует спирту, выделение которого в организме в результате ферментных или гидролитических процессов происходит на фармацевтически приемлемых уровнях. Другое пролекарство,полученное из формы карбоновой кислоты, может представлять собой четвертичную соль вида структура которой описана в работе Bodor et al., J. Med. Chem. 1980, 23, 469. Разумеется, следует понимать, что соединение согласно настоящему изобретению относится ко всем оптическим изомерам и стереоизомерам по различным допустимым атомам в молекуле. Фармацевтически приемлемые соли соединения согласно настоящему изобретению включают соли,полученные из фармацевтически приемлемых неорганических или органических кислот. Примеры подходящих кислот включают соляную, бромисто-водородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2 сульфоновую, трифторуксусную и бензолсульфоновую кислоты. Соли, полученные из соответствующих оснований, включают соли щелочных металлов, в частности натрия, и соли аммония. Специалисты в данной области техники могут синтезировать соединение согласно настоящему изобретению с учетом сведений, приведенных в настоящем описании, без проведения излишних экспериментов. Соответствующие методики получения необходимых сахаров или нуклеозидов описаны в химической литературе. См., например, Choi, Jong-Ryoo; Kim, Jeong-Min; Roh, Kee-Yoon; Cho, Dong-Gyu;Holy, Antonin; Masojidkova, Milena. Collection of Czechoslovak Chemical Communications (1988), 53(11B),2753-77. Rosenberg, Ivan; Holy, Antonin; Masojidkova, Milena Collection of Czechoslovak Chemical Communications (1988), 53(11B), 2753-77. Приведенные далее неограничивающие примеры иллюстрируют и описывают аспекты настоящего изобретения. В указанных примерах приведены лишь некоторые варианты реализации настоящего изобретения. Однако следует понимать, что настоящее изобретение можно использовать в ряде других ком-6 019919 бинаций, модификаций и при других условиях, находящихся в рамках настоящего изобретения, с учетом приведенных выше положений и/или опыта или знаний специалистов в данной области техники. Пример 1. Исследование пролиферации клеток. Первичные линии клеток человека, эндотелий артерий, в частности НАЕС (клетки эндотелия артерий человека) и НРАЕС (клетки эндотелия легочной артерии человека), венозные клетки эндотелия HUVEC (клетки эндотелия пупочной вены человека) (полученные от Cambrex BioScience Rockland Inc.), и фибробласты легких LL47 (полученные из Американской коллекции типовых культур) культивировали в соответствии с инструкциями и использовали для оценки различных видов активности тестируемых соединений в отношения эндотелия человека и фибробластов при помощи анализа выживаемости клеток методом люминесценции CellTiter-Glo. Этот метод, включающий генерирование люминесцентных сигналов, основан на количественном определении уровней АТР (аденозинтрифосфорной кислоты) в культурах клеток. Содержание АТР, образующейся в клеточной культуре, отражает число жизнеспособных клеток. Поэтому данный анализ часто используют для определения пролиферации клеток и цитотоксических эффектов исследуемых соединений. Клетки посеяли в 96-луночные планшеты с питательной средой, в количестве примерно 5103 клеток на лунку. Через 24 ч в культуры добавили различные дозы исследуемых соединений. Тест с каждой дозой осуществляли в четырех повторностях. После обработки в течение 72 ч в культуры в соответствии с инструкцией изготовителя добавили реагент CellTiter-Glo и измерили люминесценцию. В контрольные группы добавили только наполнитель ДМСО (диметилсульфоксид). IC50 исследуемых соединений для пролиферации эндотелия и фибробластов в их питательной среде определили при помощи кривой доза-эффект в соответствующих диапазонах концентраций. Пример 2. Исследование миграции клеток эндотелия. Миграция клеток эндотелия представляет собой ключевой этап процесса ангиогенеза, который является критичным для локального образования кровеносных сосудов. Для исследования миграции клеток эндотелия использовали камеру с фильтрами/вставками Transwell системы Biocoat (BD Biosciences), которая представляет собой камерный планшет с 24 лунками и содержит вставки с размером пор 3 мкм,покрытые фибронектином человека. Вставки инкубировали в течение 1 ч при 37 С с 0.1% бычьим сывороточным альбумином, содержащим базальную среду клеток эндотелия. Клетки эндотелия (HUVEC) выдержали в режиме недостаточного питания с 0.1% бычьим сывороточным альбумином в базальной среде клеток эндотелия в течение 4-5 ч перед сбором клеток, а затем высевали (1105 на лунку) в верхних камерах планшета Transwell в 100 мкл 0.1% альбумина бычьей сыворотки в базальной среде клеток эндотелия. В нижние камеры добавили полную питательную среду, которая содержала различные хемоаттрактанты. Клетки оставляли для миграции на 221 ч при 37 С. Не мигрировавшие клетки тщательно удалили с внутренней стороны вставок при помощи ватной палочки. Мигрировавшие клетки в нижней части вставок Transwell фиклировали 4% параформальдегидом, окрасили красителем Hoechst 33342 и сфотографировали при помощи флуоресцентного микроскопа. Определили количество мигрировавших клеток в трех полях микроскопа для каждого фильтра/вставки. Для каждой концентрации исследуемого вещества и контрольной группы провели по три исследования культур в камере с фильтрами/вставками. Результаты выразили в форме среднего количества мигрировавших клеток на поле микроскопа при увеличении 10 и рассчитали IC50 на основании кривой зависимости от дозы. Пример 3. Исследование образования эндотелиальных трубочек. Клетки эндотелия человека культивировали in vitro на внеклеточном матриксе, который стимулирует прикрепление и дифференцировку клеток эндотелия с образованием трубочек. На этом являении основано исследование образования эндотелиальных трубочек. Клетки эндотелия (HUVEC) высевали(1.5104 на лунку) в 96-луночные планшеты, покрытые внеклеточным матриксом, и обработали различными концентрациями исследуемых соединений в полной питательной среде в трех повторах. Клетки выдерживали для образования эндотелиальных трубочек при 37 С в течение примерно 18 ч и фотографировали при помощи инвертированного микроскопа. Длину трубочек определяли при помощи программы анализа изображения Image-Pro Plus (Media Cybernetics, Inc., Siler Spring, MD). Результаты представлены в форме средней длины трубочки из трех полей обзора для каждой лунки и трех лунок для каждого режима обработки. Значения IC50 рассчитали на основании кривой зависимости от дозы. Пример 4. Анализ хорионаллантоисных оболочек куриных эмбрионов (Chick Chorioallantoic Membrane, CAM). Хорионаллантоисная оболочка куриного эмбриона представляет собой идеальную in vivo модель физиологического процесса ангиогенеза. Модуляторы ангиогенеза, нанесенные на диски из метилцеллюлозы, которые помещают поверх хорионаллантоисной оболочки куриного эмбриона, способны изменять развитие новой кровеносной сосудистой системы. См., например, Staton et al., Current Methods for Assaying Angiogenesis in vitro and in vivo, Int. J. Exp. Pathol., 85:233-48 (2004), содержание которой полностью включено в данное описание посредством ссылки. Исследование ангиогенеза при помощи хорионаллан-7 019919 тоисной оболочки используют для определения антиангиогенного потенциала синтетических соединений ex vivo. Оплодотворенные куриные яйца инкубировали при 37.5 С в инкубаторе для яиц с увлажненной атмосферой и принудительной циркуляцией воздуха. На 3 день развития эмбрионов яйца вскрыли и перенесли эмбрионы в чашки Петри объемом 100 мм 3, чтобы продолжить их развитие в инкубаторе для клеточных культур при 37.5 С. Предварительно изготовленные диски из метилцеллюлозы диаметром примерно 2 мм осторожно имплантировали в хорионаллантоисную оболочку эмбрионов на 5 день, а затем на диск из метилцеллюлозы наносили исследуемое соединение в растворе или контрольный наполнитель. В течение двух последующих дней эмбрионы инкубировали в инкубаторе для культур клеток. На 7 день хорионаллантоисные оболочки эмбрионов осматривали и измеряли образование новых кровеносных сосудов. Влияние препарата на ангиогенез оценивали путем определения показателя плотности сосудов (vascular density index, VDI) для каждой САМ всех жизнеспособных куриных эмбрионов. VDI представляет собой число пересечений, которые образуют кровеносные сосуды с тремя равноудаленными концентрическими окужностями на площади, покрытой дисками из метилцеллюлозы, его определяют при помощи программы Image Pro Plus. Результаты выражают в форме среднего значения VDI, которое получают в результате количественного анализа для каждой группы обработки (N5) со среднеквадратическим отклонением. Пример 5. Тест на мышах с пробками из матригеля. Тест с пробками из матригеля представляет собой тест на образование новых кровеносных сосудовin vivo, который широко используют для оценки антиангиогенной активности синтетических соединений и рекомбинантных белков. Для экспериментов с пробками из матригеля использовали самок мышейC57BL/6 в возрасте примерно 8-10 недель и матригельную матрицу высокой концентрации. Каждая участвующая в тесте группа включала четыре или пять мышей, при этом у каждой мыши создавали по две матригельные пробки. Матригель смешивали с 50 нг/мл VEGF (Vascular Endothelial Growth Factor, фактор роста эндотелия сосудов), 50 нг/мл FGFb (Basic Fibroblast Growth Factor, основной фактор роста фибробластов) и 3 нг/мл гепарина в качестве стимулятора ангиогенеза. Исследуемые соединения в различных концентрациях смешивали с матригелем или вводили интраперитонеально, внутривенно или перорально. Матригель инъецировали подкожно при 4 С, по 500 мкл матригеля для каждой пробки, в участки со сбритым волосяным покровом на обоих боках мыши. Инъецированный матригель быстро образовывал цельную твердую гелевую пробку. Пробки каждой группы собрали примерно через две недели после инокуляции матригеля. Мышей подвергли эвтаназии путем ингаляции CO2, и, сдвигая кожу, обнажали пробку. Интактные пробки вынули и зафиксировали в 10% формалине для гистологического анализа. Гистологические срезы (толщиной 5 мкм) залитых в парафин пробок окрасили с использованием иммунной метки специфичным антителом к CD31 и подвергли контрастному окрашиванию НЕ. ПодсчиталиCD31-положительные микрососуды на всей площади поперечного сечения каждой пробки из матригеля. Для каждой группы мышей провели количественный анализ примерно шести пробок из матригеля, чтобы определить статистическую значимость разности плотности микрососудов между контрольной и экспериментальной группами. Пример 6. Оценка противоопухолевой эффективности соединений при помощи ксенографтной модели на "бестимусных" мышах. Рост опухоли зависит от ангиогенеза. Подавление ангиогенеза опухоли стало эффективным способом лечения раковых заболеваний. Стандартные модели с ксенотрансплантатами у "голых" (бестимусных) мышей используют для оценки противоопухолевой активности потенциальных антиангиогенных агентов. Опухолевые клетки человека или их фрагменты имплантировали "голым" мышам в возрасте 5-7 недель. Исследуемые соединения вводили каждой группе мышей интраперитонеально, внутривенно или перорально. Размер опухоли и массу тела мышей контролировали два раза в неделю. Определяли средние объемы опухоли в каждый момент времени со стандартным отклонением относительно времени роста опухоли, которое представляло собой число дней после инокуляции трансплантата. Процедуры, описанные в приведенных выше примерах, использовали для получения данных, представленных на прилагаемых фигурах и в таблице. Лекарственные средства. Соединение согласно настоящему изобретению можно вводить с помощью любых традиционных средств, доступных для применения в сочетании с фармацевтическими препаратами, в форме индивидуальных терапевтических агентов или комбинаций терапевтических агентов. Их можно вводить отдельно,но, как правило, указанное соединение вводят совместно с фармацевтическим носителем, который выбирают в соответствии с выбранным путем введения и стандартной фармацевтической практикой. Описанные в настоящем документе фармацевтически приемлемые носители, например наполнители, адъюванты, эксципиенты или разбавители, хорошо известны специалистам в данной области техники. Обычно фармацевтически приемлемый носитель является химически инертным по отношению к активным соединениям и не проявляет вредных побочных эффектов или токсичности в условиях применения. Фармацевтически приемлемые носители могут включать полимеры и полимерные матрицы. Соединение согласно настоящему изобретению можно вводить любым традиционным способом,доступным для применения в сочетании с фармацевтическими препаратами, в форме индивидуальных терапевтических агентов или комбинации терапевтических агентов. Вводимые дозы, разумеется, изменяются в зависимости от таких известных факторов, как характеристики фармакодинамики конкретного агента, режима и пути введения, возраста, состояния здоровья и веса реципиента, природы и степени выраженности симптомов, вида сопутствующего лечения, частоты применения лечения и желаемого эффекта. Ежедневная доза активного ингредиента может составлять примерно от 0.001 до 1000 мг на 1 кг массы тела, предпочтительная доза составляет от 0.1 до примерно 30 мг/кг. Лекарственные формы (композиции, подходящие для введения) содержат примерно от 1 до примерно 500 мг активного ингредиента на единицу. В указанных фармацевтических композициях активный ингредиент обычно присутствует в количестве примерно 0.5-95% по массе относительно всей массы состава. Активный ингредиент можно вводить перорально в твердых лекарственных формах, в частности в капсулах, таблетках и порошках, или в жидких лекарственных формах, в частности в эликсирах, сиропах и суспензиях. Его можно также вводить парентерально в стерильных жидких лекарственных формах. Активный ингредиент можно также вводить интраназально (капли для носа) или путем ингаляции аэрозоля порошкообразного лекарственного средства. Также возможны другие лекарственные формы для чрескожного введения, при помощи пластыря или мази. Препараты, подходящие для перорального введения, могут представлять собой (а) жидкие растворы, в частности эффективную дозу соединения, растворенную в разбавителях, в частности в воде, физиологическом растворе или апельсиновом соке; (б) капсулы, саше, таблетки, лепешки и пилюли, каждая из которых содержит определенную дозу активного ингредиента в форме твердых частиц или гранул; (в) порошки; (г) суспензии в соответствующей жидкости и (д) подходящие эмульсии. Жидкие препараты могут содержать разбавители, в частности воду и спирты, например этанол, бензиловый спирт, пропиленгликоль, глицерин и полиэтиленовые спирты, с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, суспендирующего агента или эмульгатора. Капсулы могут представлять собой обычные твердые или мягкие оболочки желатинового типа, содержащие, например, поверхностно-активные вещества, лубриканты и инертные наполнители, в частности лактозу,сахарозу, фосфат кальция и кукурузный крахмал. Таблетированные формы могут содержать один или более из следующих компонентов: лактозу, сахарозу, маннитол, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, микрокристаллическую целлюлозу, гуммиарабик, желатин, гуаровую камедь, коллоидный диоксид кремния, кроскармеллозу натрия, тальк, стеарат магния, стеарат кальция, стеарат цинка, стеариновую кислоту и другие наполнители, красители, разбавители, буферные вещества,дезинтегрирующие вещества, увлажнители, консерванты, ароматизаторы и фармакологически совместимые носители. Таблетки для рассасывания могут содержать активный ингредиент во вкусовом веществе,обычно в сахарозе и гуммиарабике или трагакантовой камеди. Пастилки могут содержать активный ин-9 019919 гредиент в инертной основе, в частности в желатине и глицерине, или в сахарозе и гуммиарабике. Эмульсии и гели помимо активного ингредиента содержат носители, известные специалистам в данной области техники. Из соединения согласно настоящему изобретению, взятого в отдельности или в комбинации с другими подходящими компонентами, можно приготовить аэрозольные составы, которые вводят посредством ингаляции. Такие аэрозольные составы можно помещать в соответствующие сжатые пропелленты, в частности в дихлордифторметан, пропан и азот. Их также можно получать в форме фармацевтических средств для несжимаемых препаратов, которые используют, в частности, в ингаляторе или распылителе. Составы, подходящие для парентерального введения, включают водные и неводные изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические агенты и растворенные вещества, которые делают состав изотоничным по отношению к крови предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Соединение можно вводить в физиологически приемлемом разбавителе в фармацевтическом носителе, в частности в стерильных жидкостях или смеси жидкостей, включая воду, физиологический раствор, водную декстрозу и соответствующие растворы сахаров, спирт, в частности этанол, изопропанол или гексадециловый спирт, гликоли, в частности пропиленгликоль или полиэтиленгликоль, например поли(этиленгликоль) 400, кетали глицерина, в частности 2,2-диметил-1,3-диоксолан-4-метанол, сложные эфиры, масло, жирную кислоту, сложный эфир или глицерид жирной кислоты или глицерид ацетилированной жирной кислоты с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, в частности мыла или детергента, суспендирующего агента, в частности пектина, карбомеров, метилцеллюлозы, гидроксипропилметилцеллюлозы или карбоксиметил целлюлозы или эмульгаторов и других фармацевтических адъювантов. Масла, которые можно использовать в составах для парентерального введения, включают вазелин,животные, растительные или синтетические масла. Конкретные примеры масел включают арахисовое,соевое, кунжутное, хлопковое, кукурузное, оливковое, вазелиновое и минеральное масло. Жирные кислоты, пригодные для применения в составах для парентерального введения, включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Этилолеат и изопропилмиристат являются примерами пригодных сложных эфиров жирных кислот. Мыла, подходящие для применения в составах для парентерального введения, включают соли жирных кислот щелочных металлов, аммония и триэтаноламина, а пригодные детергенты включают (а) катионные детергенты, в частности галоиды диметилдиалкиламмония и галоиды алкилпиридиния, (б) анионные детергенты, в частности алкил-, арил- и олефинсульфонаты, алкил-, олефин-, эфир- и моноглицеридсульфаты и сульфосукцинаты, (в) неионные детергенты, в частности аминоксиды жирных кислот, алканоламиды жирных кислот и сополимеры полиоксиэтилена и полипропилена, (г) амфотерные детергенты, например алкиламинопропионаты и четвертичные аммониевые соли 2-алкилимидазолина и (д) их смеси. Составы для парентерального введения содержат примерно от 0.5 до примерно 25% по массе активного ингредиента в растворе.В таких составах можно использовать подходящие консерванты и буферы. Для минимизации или устранения раздражения в месте инъекции такие составы могут содержать один или более неионных поверхностно-активных веществ с гидрофильно-липофильным балансом(HLB), равным примерно от 12 до примерно 17. Содержание поверхностно-активных веществ в таких составах находится в пределах примерно от 5 до примерно 15% по массе. Подходящие поверхностноактивные вещества включают сложные полиэтиленсорбитановые эфиры жирных кислот, в частности сорбитанмоноолеат, и продукты присоединения этиленоксида с высокой молекулярной массой и гидрофобного основания, полученные путем конденсации пропиленоксида с пропиленгликолем. Фармацевтически приемлемые наполнители также хорошо известны специалистам в данной области. Выбор наполнителя частично определяется конкретным соединением, а также конкретным способом введения состава. В соответствии с этим существует большое многообразие пригодных препаратов фармацевтического состава согласно настоящему изобретению. Описанные далее способы и наполнители являются исключительно иллюстративными примерами и ни в коей мере не ограничивают настоящее изобретение. Фармацевтически приемлемые наполнители предпочтительно не оказывают влияния на действие активных ингредиентов и не имеют вредных побочных эффектов. Пригодные носители и наполнители включают растворители, в частности воду, спирт и пропиленгликоль, твердые поглотители и разбавители, поверхностно-активные агенты, суспендирующий агент, связующие для таблеток, лубриканты, ароматизаторы и красители. Составы могут содержаться в герметичных контейнерах на одну или несколько доз, в частности в ампулах и флаконах, могут храниться в сублимированном (лиофилизированном) состоянии, требующем только добавления стерильных жидких наполнителей, например воды для инъекций, непосредственно перед применением. Растворы для инъекций и суспензий, приготавливаемые для немедленного использования, можно получить из стерильных порошков, гранул и таблеток. Требования к эффективным фармацевтическим носителям, которые используют в составах для инъекций, хорошо известны специалистам в данной области техники (5, 6). См. Banker and Chalmers Pharmaceutics and Pharmacy Practice, 238- 10019919(4th ed. 1986), содержание которых полностью включено в данное описание посредством ссылки. Составы, подходящие для топического введения, включают таблетки для рассасывания, содержащие активный ингредиент во вкусовом веществе, обычно в сахарозе и гуммиарабике или трагаканте, пастилки, содержащие активный ингредиент в инертной основе, в частности в желатине и глицерине, или сахарозе и гуммиарабике, и полоскания для рта, содержащие активный ингредиент в подходящем жидком носителе, а также кремы, эмульсии и гели, содержащие кроме активного ингредиента носители, известные специалистам в данной области техники. Кроме того, составы, подходящие для ректального введения, можно получить в форме свечей, путем смешивания с различными основами, в частности с эмульгирующими или водорастворимыми основами. Составы, подходящие для вагинального введения, можно получить в форме пессариев, тампонов,кремов, гелей, паст, пен или спреев, которые кроме активного ингредиента содержит носители, известные специалистам как соответствующие. Подходящие фармацевтические носители описаны в Remington's Pharmaceutical Sciences, Mack Publishing Company, которая является стандартным справочником в данной области техники. Доза, которую вводят животному, в частности человеку, в контексте настоящего изобретения должна быть эффективной для того, чтобы вызывать терапевтическую реакцию у животного в течение разумного периода времени. Для специалистов в данной области очевидно, что режим дозирования зависит от различных факторов, включая состояние животного, массу тела животного, а также тяжесть и стадию патологического состояния, подвергаемого лечению. Подходящей является доза, которая обеспечивает концентрацию активного агента в организме пациента, вызывающую желаемую реакцию. Предпочтительной дозой является количество, которое обеспечивает максимальное подавление патологического состояния, подвергаемого лечению, без неуправляемых побочных эффектов. Величина дозы определяется также путем, временным режимом и частотой введения, а также наличием, природой и выраженностью вредных побочных эффектов, которые могут сопровождать введение соединений, и желаемым физиологическим эффектом. Подходящие фармацевтические лекарственные формы для введения соединения согласно настоящему изобретению можно иллюстрировать следующим образом. Капсулы с твердой оболочкой. Большое количество дозированных капсул получают путем заполнения стандартных двухэлементных твердых желатиновых капсул, каждая из которых содержит 100 мг порошкообразного активного ингредиента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы. Получают смесь активного ингредиента в перевариваемом масле, в частности в соевом масле, хлопковом масле или оливковом масле, и впрыскивают при помощи насоса вытесняющего действия в расплавленный желатин с получением мягких желатиновых капсул, содержащих 100 мг активного ингредиента. Капсулы промывают и сушат. Активный ингредиент можно растворить в смеси полиэтиленгликоля, глицерина и сорбита с получением смешивающейся с водой лекарственной смеси. Таблетки. Большое количество таблеток получают традиционными способами таким образом, чтобы лекарственная форма содержала 100 мг активного ингредиента, 0.2 мг коллоидного диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98.8 мг лактозы. Для увеличения вкусовой привлекательности, улучшения внешнего вида, стабильности и задержки всасывания можно нанести соответствующие растворимые и нерастворимые в воде покрытия. Таблетки/капсулы с немедленным высвобождением активного ингредиента. Представляют собой твердые лекарственные формы для перорального приема, которые получают традиционными и новыми способами. Эти препараты принимают перорально без воды для быстрого растворения и доставки лекарства. Активный ингредиент перемешивают в жидкости, содержащей такие ингредиенты, как сахар, желатин, пектин и подсластители. Эти жидкости отверждают с получением твердых таблеток или каплетов путем сублимационной сушки и твердофазной экстракции. Лекарственные соединения можно прессовать с высокоэластичными и термоупругими сахарами и полимерами или с компонентами, выделяющими газ, с получением пористых матриц, предназначенных для быстрого высвобождения активного ингредиента без использования воды. Кроме того, соединение согласно настоящему изобретению можно вводить в форме капель для носа или при помощи дозирующего назального или буккального ингалятора. Препарат доставляют в форме назального раствора в виде мелкодисперсного тумана или порошка в форме аэрозоля. В приведенном выше описании проиллюстрировано настоящее изобретение и изложена его сущность. При этом в описании показаны и изложены только предпочтительные варианты реализации. Однако, как указано выше, следует понимать, что изобретение можно использовать в различных других комбинациях, модификациях и условиях с возможными изменениями или модификациями в пределах изложенной в настоящем описании сущности, в соответствии с приведенными выше положениями и/или навыками или знаниями специалистов в данной области техники. Предполагается также, что вышеописанные варианты реализации поясняют наилучшие режимы,известные из практики, и помогут специалистам в данной области техники использовать изобретение в тех или иных вариантах реализации с различными модификациями, которые требуются для конкретного применения или использования. В соответствии с этим не предполагается, что варианты воплощения,изложенные в описании, ограничивают изобретение. Кроме того, предполагается, что прилагаемая формула изобретения включает альтернативные варианты реализации. Все публикации, патенты и заявки на патент, на которые приведены ссылки в настоящем описании,включены в него посредством ссылки для любых и всех целей, как если бы для каждой отдельной публикации, патента и заявки на патент было указано, что они включены посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ подавления роста или метастазирования ангиогенез-зависимой опухоли у пациента, который в этом нуждается, включающий введение указанному пациенту эффективного количества битионола. 2. Способ по п.1, отличающийся тем, что указанный способ включает подавление роста ангиогенеззависимой опухоли. 3. Способ по п.1, отличающийся тем, что указанный способ включает подавление метастазирования ангиогенез-зависимой опухоли.
МПК / Метки
МПК: C07D 471/04, A01N 43/54, C07D 239/42
Метки: ангиогенез-зависимой, подавления, метастазирования, опухоли, способ, роста
Код ссылки
<a href="https://eas.patents.su/21-19919-sposob-podavleniya-rosta-ili-metastazirovaniya-angiogenez-zavisimojj-opuholi.html" rel="bookmark" title="База патентов Евразийского Союза">Способ подавления роста или метастазирования ангиогенез-зависимой опухоли</a>
Предыдущий патент: Гербицидная композиция и способ борьбы с сорными растениями в посевах культурных растений
Следующий патент: Система и способ изготовления бусин
Случайный патент: Тепловой реактор