Конъюгированные цитокины, используемые для терапии опухолей
Формула / Реферат
1. Конъюгированный продукт, обладающий противоопухолевой активностью, включающий цитокин, выбранный из TNF или IFNg, и лиганд, содержащий NGR-мотив.
2. Конъюгированный продукт по п.1, где цитокин представляет собой TNFa или TNFb.
3. Конъюгированный продукт по пп.1-2, где лиганд представляет собой лиганд рецептора CD13, который выбирают из группы, включающей антитела или их активные фрагменты, пептиды или миметики пептидов.
4. Конъюгированный продукт по п.3, где лиганд представляет собой пептид.
5. Конъюгированный продукт по п.4, где пептид выбирают из группы, включающей CNGRCVSGCAGRC, NGRAHA, GNGRG, циклoCVLNGRMEC, линейный или циклический CNGRC.
6. Конъюгированный продукт по любому из пп.1-5, где цитокин дериватизирован полиэтиленгликольным или ацильным фрагментом.
7. Конъюгированный продукт по любому из пп.1-6, где цитокин дополнительно конъюгирован с антителом или его фрагментом, которые направлены к опухолевому антигену, опухолевому ангиогенному маркеру или компоненту внеклеточного матрикса, или с биотином.
8. Конъюгированный продукт по п.7, где цитокин представляет собой TNF, различные субъединицы которого конъюгированы как с лигандом рецептора CD13, так и либо с антителом или его фрагментом, либо с биотином.
9. кДНК, кодирующая конъюгированный продукт по п.1.
10. кДНК по п.9, кодирующая конъюгированный продукт по п.5.
11. Предназначенный для генной терапии вектор, включающий кДНК по любому из пп.9-10.
12. Фармацевтическая композиция, включающая эффективное количество конъюгированного продукта по любому из пп.1-8 в сочетании с фармацевтически приемлемыми носителями и наполнителями.
13. Композиция по п.12 в форме инъецируемого раствора или суспензии, или жидкости для инфузий.
14. Композиция по любому из пп.12-13 в форме липосом.
15. Применение конъюгированного продукта по любому из пп.1-8 для приготовления противоопухолевых лекарственных средств или диагностических агентов.
16. Применение конъюгированного продукта по любому из пп.1-8 в сочетании с другими противораковыми или диагностическими агентами, предназначенными для визуализации опухоли.
17. Применение кДНК по любому из пп.9-10 для приготовления лекарственных средств или диагностических агентов, предназначенных для применения в терапии рака.
18. Применение кДНК по п.17 в сочетании с другими противораковыми или диагностическими агентами, предназначенными для визуализации опухоли.
Текст
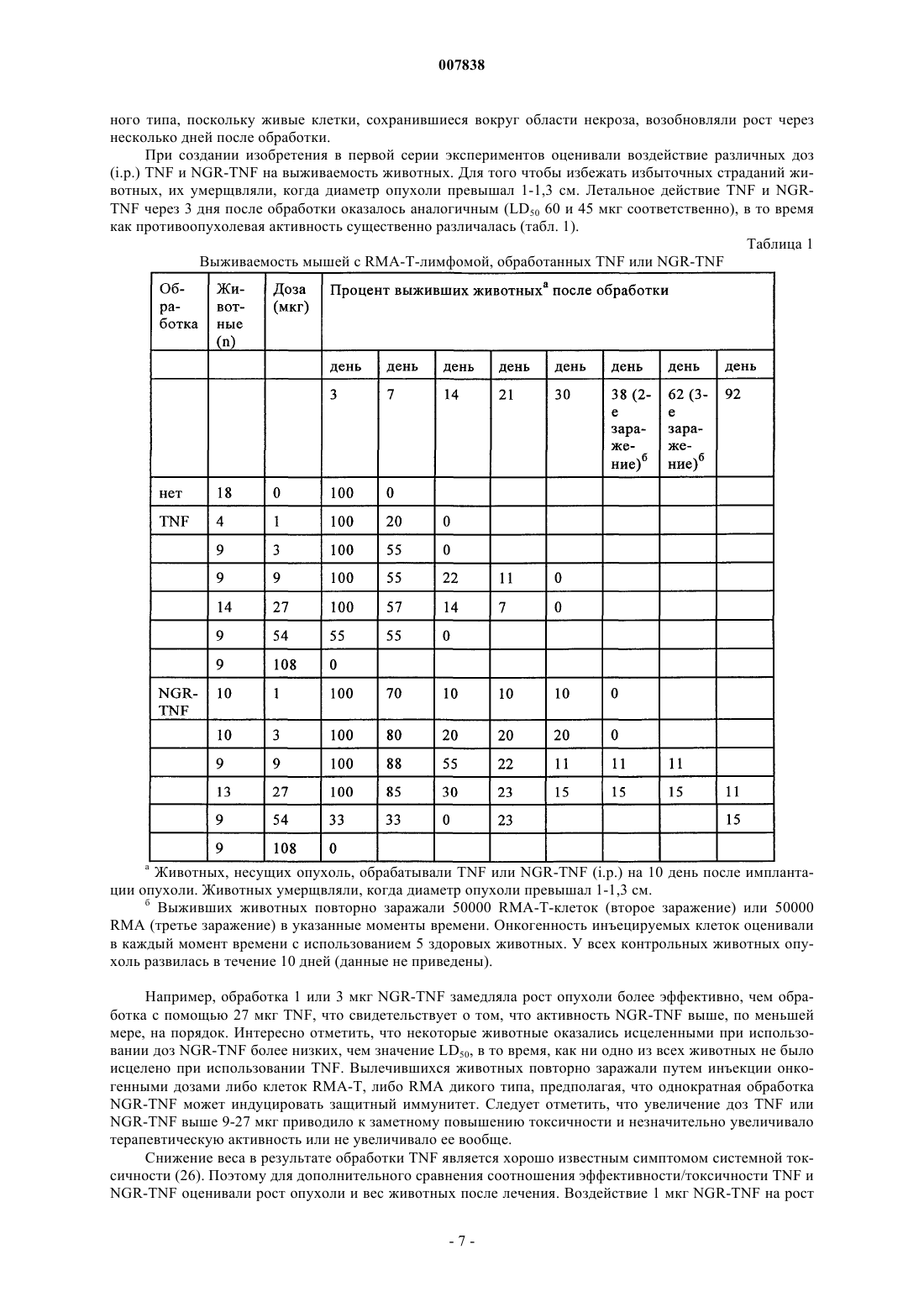
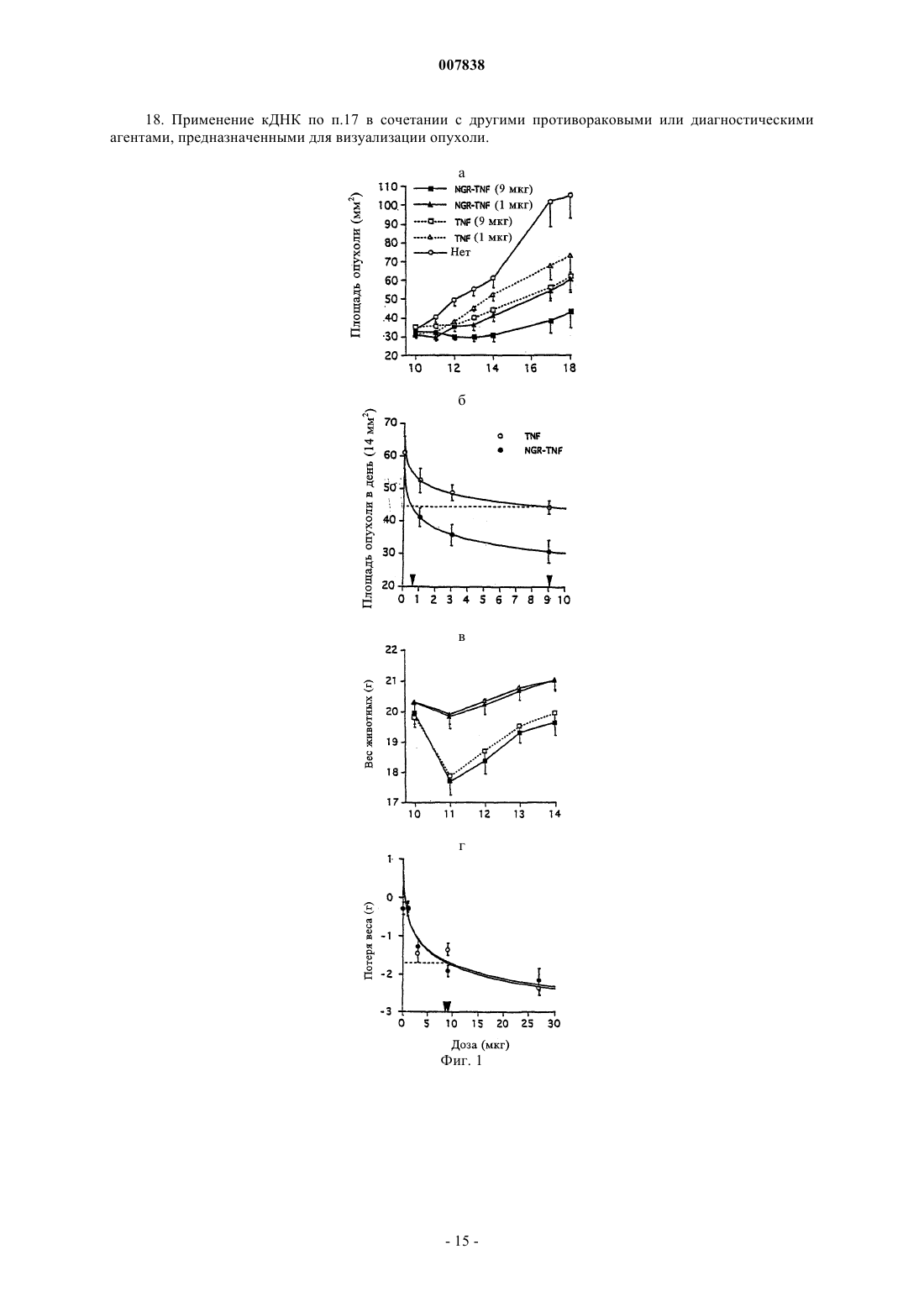
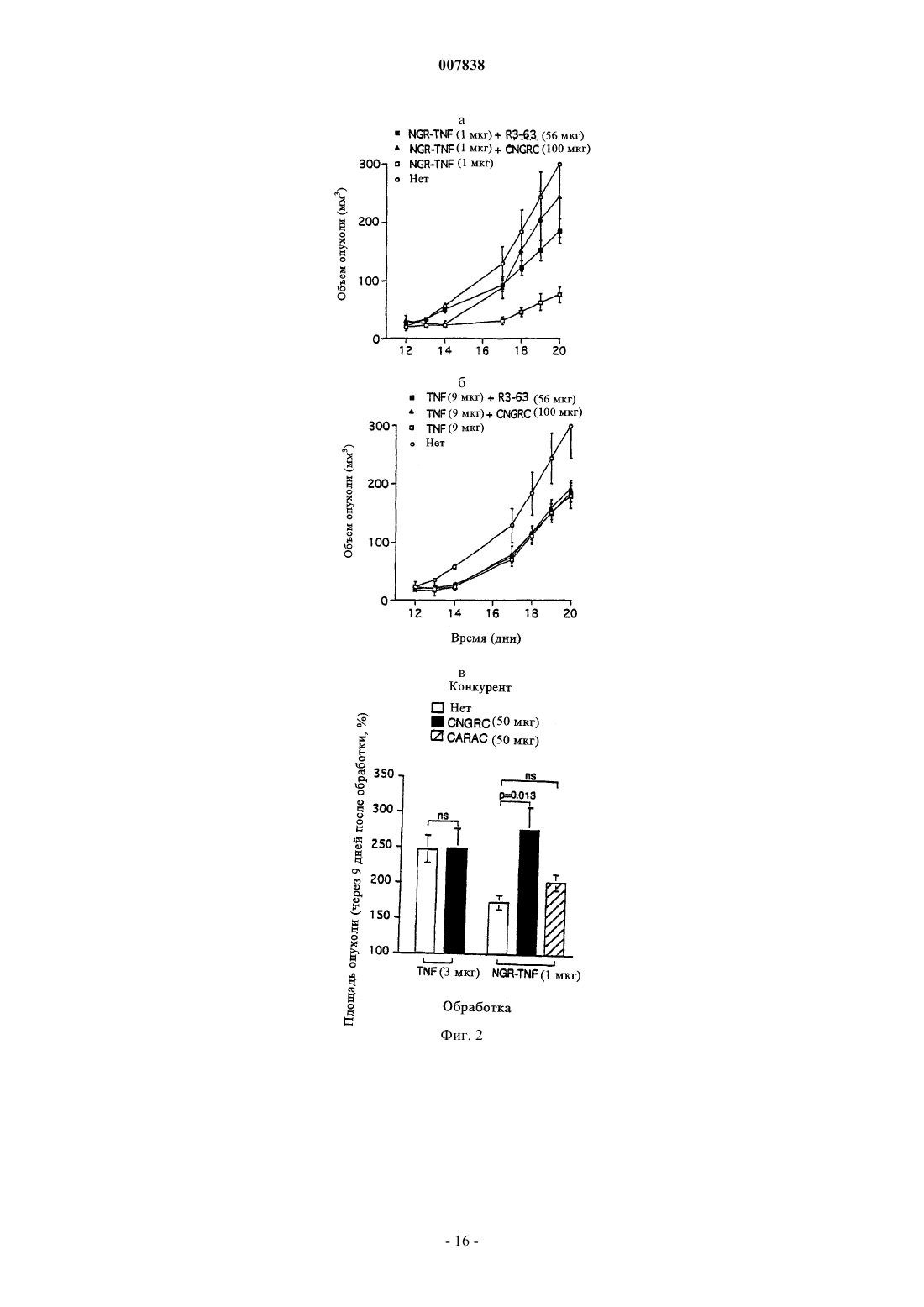
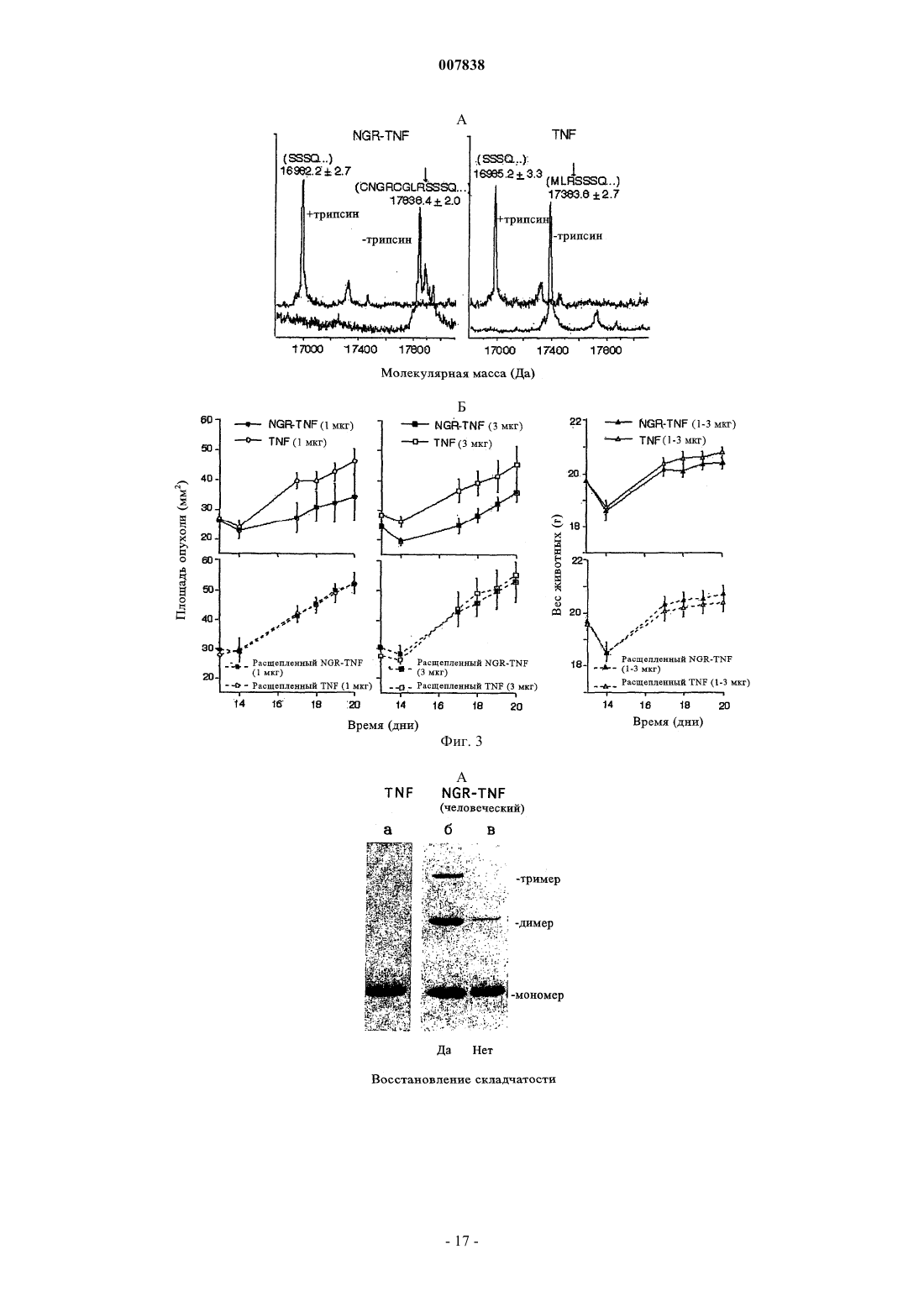
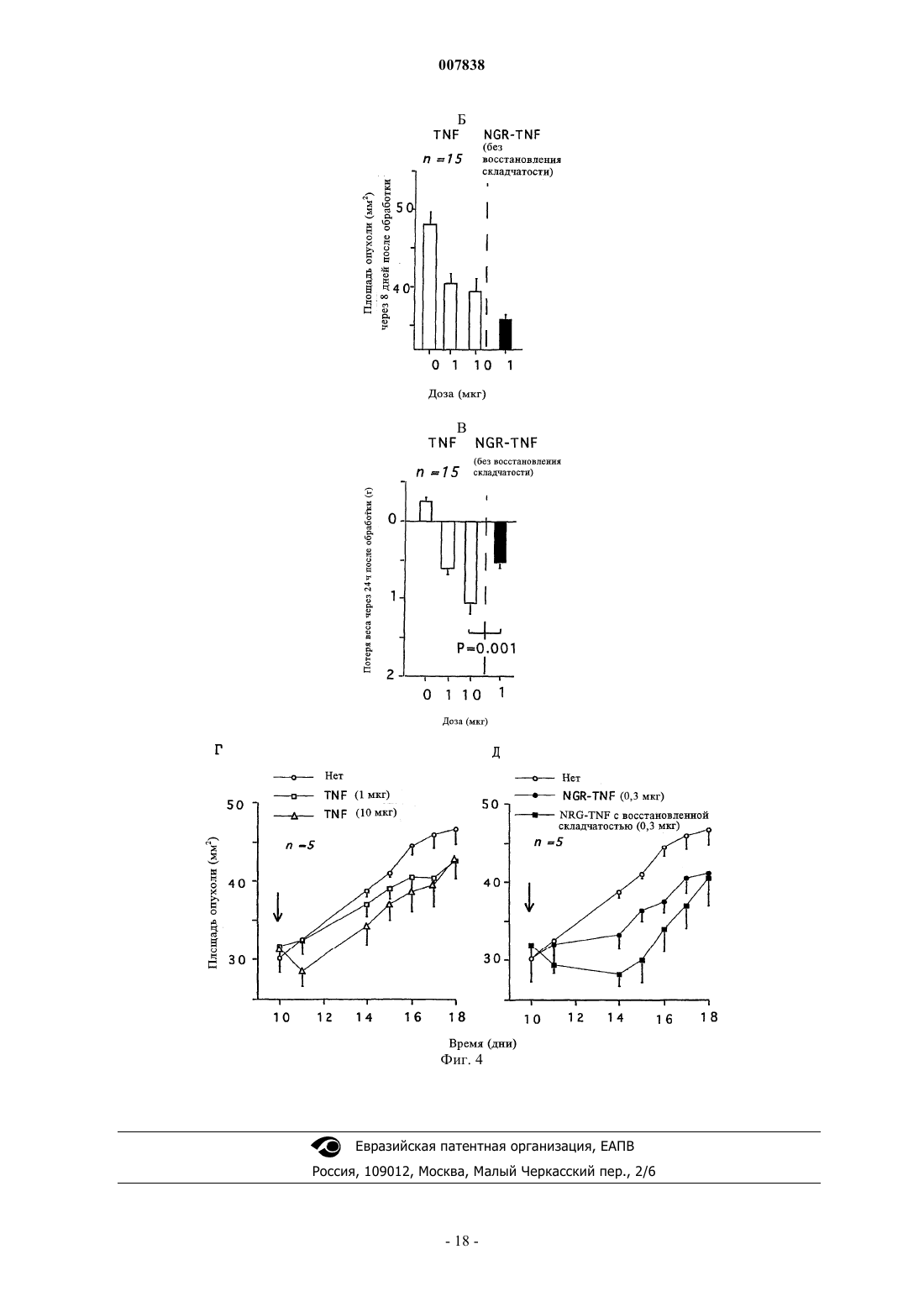
007838 Настоящее изобретение относится к модифицированным цитокинам, предназначенным для применения в терапии рака. Более конкретно изобретение относится к производным цитокинов, которые обладают способностью воздействовать (возвращать в исходное состояние) на сосуды опухоли и антигенпрезентирующие клетки ("хоминг"-цитокины). Противоопухолевая активность некоторых цитокинов хорошо известна и описана. Некоторые цитокины уже применяются для лечения, в том числе людей (29). Например, для некоторых цитокинов, таких как интерлейкин-2 (IL-2) и интерферон(INF), выявлена позитивная противоопухолевая активность при лечении пациентов с различными типами опухолей, такими как почечная метастатическая карцинома, лейкемический ретикулез, саркома Капоши, меланома, множественная миелома и т.п. Установлено,что другие цитокины, такие как IFN, фактор некроза опухоли (TNF), TNF, IL-1, 4, 6, 12, 15 и колониестимулирующие факторы (CFS), обладают определенной противоопухолевой активностью в отношении некоторых типов опухолей и вследствие этого являются объектом дополнительных исследований. В целом, терапевтическое применение цитокинов в значительной степени ограничено их системной токсичностью. Для TNF, например, первоначально была выявлена способность индуцировать геморрагический некроз некоторых опухолей (1) и его цитотоксическое действие in vitro на различные линии опухолей (2), однако, затем была обнаружена выраженная противоспалительная активность, которая в случае условий, обеспечивающих сверхпродуктивность, может оказывать вредное воздействие на человеческий организм (3). Поскольку системная токсичность является основной проблемой при применении фармакологически активных количеств цитокинов для лечения людей, в настоящее время исследуются новые производные и терапевтические стратегии, способствующие снижению токсических воздействий этого класса биологических эффекторов с сохранением их терапевтической эффективности. Некоторые новые подходы включают: а) создание слитых протеинов, которые могут переносить TNF в опухоль и повышать его локальную концентрацию. Например, были созданы слитые протеины, включающие TNF и специфические для опухоли антитела (4); б) создание мутантов TNF, которые сохраняют противоопухолевую активность и обладают уменьшенной системной токсичностью. Так, уже созданы мутанты, которые обладают избирательной способностью распознавать только один рецептор (р 55 или р 75) (5); в) применение антител к TNF, которые обладают способностью снижать некоторые токсические воздействия TNF без потери его противоопухолевой активности. Такие антитела уже описаны в литературе (30); г) применение производных TNF, обладающих большим временем полужизни (например, TNF,конъюгированных с полиэтиленгликолем). В настоящее время описано получение производных TNF, которые обладают способностью к избирательному направленному переносу к месту расположения опухоли. Например, описан слитый протеин,полученный слиянием гена тяжелой цепи МАт к рецептору трансферрина и гена TNF (4), или слитый протеин TNF с шарнирной областью моноклонального антитела к опухолеспецифическому антигенуTAG72 (6) или слитый протеин Fv-TNF (6). В ЕР 251494 описана система, предназначенная для введения диагностического или терапевтического агента, которая включает антитело, конъюгированное с авидином или стрептавидином, агент, который обладает способностью образовывать комплекс с конъюгированным антителом, и соединение,которое включает диагностический или терапевтический агент, конъюгированный с биотином, их вводят последовательно и с соответствующим запаздыванием так, чтобы посредством взаимодействия биотинстрептавидин позволить локализовать терапевтический или диагностический агент на клетке-мишени,распознаваемой антителом. Описанные терапевтические или диагностические агенты включают хелаты металлов, в частности хелаты радионуклидов и низкомолекулярных противоопухолевых агентов, таких как цис-платин, доксорубицин и т.д. В ЕР 496074 описан способ, заключающийся в последовательном введении биотинилированного антитела, авидина или стрептавидина и биотинилированного диагностического или терапевтического агента. Хотя в этом документе в качестве примера упоминаются цитотоксические агенты типа рицина,главным образом, описаны соединения, меченные с помощью радиоактивных изотопов. В WO 95/15979 описан способ локализации высокотоксичных агентов на клеточных мишенях, который предусматривает введение первого конъюгата, который включает специфическую молекулумишень, конъюгированную с лигандом или антилигандом, и последующее введение второго конъюгата,который включает токсический агент, связанный в антилигандом или лигандом. В WO 99/13329 описан способ направленного переноса молекулы к опухолевым ангиогенным сосудам, основанный на конъюгации указанной молекулы с лигандами рецепторов NGR. В качестве возможных кандидатов рассматривался целый ряд молекул, но конкретно описан только доксорубицин. Не описано применение лигандов рецепторов NGR в качестве носителей цитокинов с целью индукции иммунных ответов.-1 007838 При создании изобретения неожиданно было установлено, что можно существенно улучшить терапевтический индекс некоторых цитокинов и увеличить их иммунотерапевтические свойства путем слияния с лигандом рецептора, такого как аминопептидаза-N (CD13). CD13 представляет собой трансмембранный гликопротеин с молекулярной массой 150 кДа, который обладает высокой консервативностью у различных видов. Он экспрессируется на поверхности здоровых клеток, а также линий клеток миелоидных опухолей, в ангиогенном эндотелии и в некоторой степени является эпителиальным. Рецептор CD13, как правило, обозначают как "NGR-рецептор, поскольку его пептидные лиганды несут аминокислотный мотив "NGR". Таким образом, первым объектом изобретения является конъюгированный продукт, обладающий противоопухолевой активностью, включающий цитокин, выбранный из TNF и IFN, и лиганд, содержащий NGR-мотив. Этот лиганд может представлять собой лиганд рецептора СD13, который выбирают из группы, включающей антитела или их фрагменты, такие как Fab, Fv, одноцепочечный Fv, пептиды или миметики пептидов. В предпочтительном варианте осуществления изобретения лиганд представляет собой пептид, такой как CNGRCVSGCAGRC, NGRAHA, GNGRG, циклoCVLNGRMEC и линейный или циклический CNGRC CNGRC. Пептид может быть сшит с цитокином непосредственно или посредством спейсера, который может представлять собой одну аминокислоту, аминокислотную последовательность или органический остаток, такой как 6-аминокаприл-N-гидроксисукцинимид. Методы создания сшивок таких молекул известны специалистам в данной области и включают методы генной инженерии или химического синтеза. Пептидный лиганд предпочтительно связывают с N-концом цитокина, минимизируя тем самым любое воздействие на связывание модифицированного цитокина с его рецептором. В альтернативном варианте пептид можно связывать с аминокислотными остатками, представляющими собой акцепторы амидо- или карбоксильных связей, которые встречаются в молекуле в естественных условиях или которые искусственно встраивают с помощью методов генной инженерии. Модифицированный цитокин предпочтительно получают с помощью кДНК, включающей примыкающую к 5'-концу последовательность, которая кодирует пептид. Предпочтительным вариантом осуществления изобретения является продукт, полученный в результате конъюгации различных субъединиц TNF с лигандом рецептора CD13, так и либо антителом или его фрагментом, либо с биотином. Более предпочтительно N-конец TNF связывают с пептидом CNGRC посредством спейсера G (глицин). С использованием в качестве моделей животных установлено, что образовавшийся продукт (NGRTNF) более активен в отношении лимфом RMA-Т, чем TNF. Кроме того, животные, обработанные NGRTNF, оказались способны отторгать дополнительные онкогенные дозы RMA-T- или RMA-клеток. Повышение противоопухолевой активности по сравнению с активностью обычного TNF было обнаружено у иммунокомпетентных животных, но не выявлено у животных с иммунодефицитом. Этот факт свидетельствует о том, что повышение противоопухолевой активности TNF, конъюгированного с "NGR"пептидами, связано с более выраженным иммунным ответом, а не с непосредственной цитотоксической активностью конъюгата. Было продемонстрировано также, что иммунные ответы, индуцированные NGR-TNF in vivo, непосредственно связаны с рецептором CD13. Например, было установлено, что антитело к рецептору CD13,а также лиганд CNGRC конкурируют с NGR-TNF in vivo, что позволяет предположить участие рецептора в механизме направленного переноса при использовании NGR-TNF. Терапевтический индекс конъюгатов TNF/лиганд CD13 можно дополнительно повышать путем применения мутантной формы TNF, которая обладает способностью избирательно связываться с одним из двух рецепторов TNF, т.е. с p75TNFR и p55TNFR. Такой мутант TNF можно получать путем сайтнаправленного мутагеназа (5; 7). Фармакокинетические свойства модифицированных цитокинов по изобретению можно улучшать путем дериватизации полиэтиленгликольным или ацильным фрагментомпроизводных, что позволяет удлинять период полужизни в плазме самих цитокинов. Кроме того, объектами изобретения являются кДНК, кодирующая заявленный конъюгированный продукт, предназначенный для генной терапии вектор, включающий указанную кДНК, а также фармацевтическая композиция, включающая эффективное количество описанного в данной заявке конъюгированного продукта в сочетании с фармацевтически приемлемыми носителями и эксципиентами. Предпочтительно композиция имеет форму инъецируемого раствора, или суспензии, или жидкости для инфузий,наиболее предпочтительно форму липосом. Еще одним объектом изобретения является применение конъюгированного продукта для приготовления противоопухолевых лекарственных средств или диагностических агентов. Предпочтительно этот продукт можно использовать в сочетании с другими противораковыми или диагностическими агентами,предназначенными для визуализации опухоли. Так же объектом изобретения является применение кДНК для приготовления лекарственных средств или диагностических агентов, предназначенных для применения в терапии рака, предпочтительно в сочетании с другими противораковыми или диагностическими агентами, предназначенными для-2 007838 визуализации опухоли. Итак, в заявке описаны конъюгированные продукты, в которых цитокины, модифицированные с помощью лиганда CD13, дополнительно конъюгируют с антителом или его фрагментом к опухолевому антигену, опухолевому ангиогенному маркеру, например, таким как v-интегрины, металлопротеазы или сосудистый фактор роста, или с антителом или их фрагментом к компоненту внеклеточного матрикса,такими как антитела к тенасцину или EDB-домену фибронектина, или с биотином. Ранее описано получение слитого продукта, включающего TNF и шарнирную область МАт к опухолеспецифическому антигену TAG72, экспрессируемому аденокарциномой желудка и яичника (6). Описанные в заявке конъюгаты можно применять в способе предварительного обеспечения направленного переноса в опухоль с использованием системы биотин/авидин. Согласно этому подходу в опухолевом антигенном сайте на разных стадиях создают тройной комплекс, образованный с помощью 1) биотинилированного МАт, 2) авидина (или стрептавидина) и 3) бивалентного цитокина, модифицированного с помощью лиганда CD13 и биотина. В многочисленных публикациях представлены данные о том, что подход, основанный на применении предварительного направленного переноса, по сравнению с общепринятым направленным переносом с использованием иммуноконъюгатов, может в значительной степени повышать соотношение между активными молекулами, достигшими мишени, и свободными активными молекулами, снижая, тем самым, токсичность лечения (11, 10, 9, 8). Этот подход позволил получить очень хорошие результаты при использовании биотинилированного TNF, который обладал способностью индуцировать цитотоксичность in vitro и снижать рост опухолевых клеток в условиях, когда обычный TNF был неактивным (14, 26). Подход, основанный на предварительном направленном переносе, можно осуществлять также с помощью двухстадийной процедуры с использованием биспецифического антитела, которое одновременно связывается с опухолевым антигеном и модифицированным цитокином. Применение биспецифического антитела к карциноэмбриональному антигену и TNF в настоящее время описано как средство для предварительного направленного переноса TNF в опухоль (31). Получение молекул TNF, в которой различные субъединицы TNF конъюгированы как с лигандомCD13, так и с антителом или его фрагментом (прямо или косвенно через мостик биотин-авидин), при этом антитело или его фрагменты направлены к антигену, экспрессирующемуся на поверхности опухолевых клеток, или к другим компонентам стромы опухоли, например тенасцину и EDB-домену фибронектина, обеспечивает дополнительное повышение способности модифицированного цитокина воздействовать (возвращать в исходное состояние) на опухоль и замедляет высвобождение цитокина в микросреду опухоли в результате переходов тример-мономер-тример. Как установлено в предыдущих исследованиях, фактически модифицированные субъединицы конъюгатов TNF могут диссоциировать из комплексов, предназначенных для направленно переноса, и повторно диссоциировать с образованием немодифицированных тримерных молекул TNF, которые далее диффундируют в микросреду опухоли. Установлено, что высвобождение биологически активного TNF происходит через 24-48 ч после направленного переноса (21). Для применения модифицированных цитокинов по изобретению в терапии необходимо получить соответствующие фармацевтические композиции для перорального или парентерального введения. Композиции для парентерального введения являются предпочтительными, и они представляют собой инъецируемые растворы или суспензии и жидкости для инфузий. Для приготовления парентеральных форм эффективное количество действующего вещества растворяют или суспендируют в стерильном носителе,необязательно добавляют эксципиенты, такие как солюбилизаторы, агенты, придающие изотоничность,консерванты, стабилизаторы, эмульгаторы или диспергирующие агенты, и затем расфасовывают в запечатываемые пузырьки или ампулы. Приготовление цитокинов в форме липосом может повысить их биологическую активность. Так,было установлено, что ацилирование аминогрупп TNF приводит к повышению его гидрофобности без потери биологической активности in vitro. Кроме того, имеются данные о том, что связанный с липидамиTNF обладает неизмененной цитотоксичностью in vitro, иммуномодулирующими свойствами и пониженной токсичностью in vivo (12, 13). Максимальная переносимая для людей доза TNF при применении в виде болюса составляет 218-410 мкг/м 2 (32), что примерно в 10 раз ниже эффективной дозы для животных. Основываясь на данных, полученных при использовании в качестве моделей мышей, предсказано, что для достижения противоопухолевых действий для людей дозу необходимо увеличивать по меньшей мере в 10 раз (15). В первом клиническом исследовании при использовании ограниченной перфузии в конечность в условиях повышенных температур установлено, что высокая эффективность достигается при применении одной дозы (4 мг)TNF в сочетании с мелфаланом и интерфероном(16). В других исследованиях установлено, что интерферонможет быть исключен и даже еще более низкая доза TNF может оказаться достаточной для индуцирования терапевтического действия (17, 18). Поскольку комбинация двух цитокинов обладает синергетическим действием в отношении эндотелиальных клеток, их избирательный направленный перенос, вероятно, должен приводить к более выраженной противоопухолевой активности, что позволяет устранить проблемы, связанные с системной токсичностью, характерные для терапии рака при использо-3 007838 вании комбинации этих же цитокинов. Кроме того, известно, что TNF может снижать барьерную функцию эндотелиальной выстилки сосудов, повышая, тем самым, их проницаемость для макромолекул. Принимая во внимание преимущество, связанное с низкой токсичностью при лечении модифицированными молекулами TNF по изобретению, и их способность воздействовать (возвращать в исходное состояние) на сосуды опухоли, предложен еще один путь их применения для повышения проницаемости сосудов опухоли для других соединений в терапевтических или диагностических целях. Например, модифицированный TNF можно применять для повышения проникновения в опухоль меченных радиоактивными изотопами антител или гормонов (визуализирующих опухоль соединений) при радиоиммуносцинтиграфии или радиоиммунотерапии опухолей. В альтернативном варианте можно также увеличивать проникновение химиотерапевтических лекарственных средств, иммунотоксинов, липосом, несущих лекарственные средства или гены, или других противораковых лекарственных средств, в результате чего повышается их противораковая активность. Таким образом, композиции на основе цитокинов по изобретению можно применять вместе, по отдельности или последовательно, а также в сочетании с другими диагностическими или терапевтическими субстанциями, предназначенными для лечения или диагностики рака. И, наконец, кДНК, кодирующую конъюгированные цитокины по изобретению, можно получать из кДНК цитокинов путем добавления примыкающей к 5'- или 3'-концу последовательности ДНК, кодирующей лиганд CD13, предпочтительно описанные выше хоминг-пептиды. Комбинированную кДНК можно применять индивидуально или после встраивания в векторы, предназначенные для генной терапии. Получение и терапевтические применения приемлемых векторов известно из литературы (19), публикация включена в настоящее описание в качестве ссылки. Описание чертежей Фиг. 1 - воздействие TNF и NGR-TNF на рост лимфом RMA-T (а и б) и на вес животных (в и г). Группы животных, состоящие из 5 особей, обрабатывали однократной дозой TNF или NGR-TNF(внутрибрюшинно, i.p.) через 10 дней после имплантации опухоли. Зависимости площади опухоли от дозы на 14 день (б) и потерю веса после лечения (средние значения для дней 11 и 12) (г) интерполировали с помощью логарифмических кривых. Противоопухолевые действия, вызванные 1 или 9 мкг NGRTNF на 14-й день, оказались выше, чем действие аналогичных количеств TNF (Р=0,024 и Р=0,032 соответственно), в то время как потеря веса после указанных обработок оказалась аналогичной. Стрелками показаны экстраполированные дозы TNF и NGR-TNF, вызывающие сопоставимые действия. Фиг. 2 - воздействие МАт R3-63 и CNGRC на противоопухолевую активность NGR-TNF (а) и TNF (б). МАт R3-63 или CNGRC смешивали с NGR-TNF или TNF и вводили животным, несущим опухоль линии RMA-T, через 12 дней после имплантации опухоли (n=5 животных/группу). В другом эксперименте (в) TNF и NGR-TNF вводили совместно с CNGRC или CARAC (контрольный пептид) животным, несущим 11-дневные опухоли (n=5). Противоопухолевое действие 1 мкг NGR-TNF оказалось более сильным, чем действие 9 мкг TNF (Р=0,009, t-критерий, день 20) и в значительной степени ингибировалосьCNGRC (P=0,035) и МАт R3-63 (Р=0,011). Фиг. 3 - воздействие ограниченного расщепления трипсином NGR-TNF и TNF на их массу (а) и противоопухолевую активность (б). Комплекс трипсин-агароза получали путем связывания 1 мг трипсина с 1 мл активированной СН Сефарозы (фирма Pharmacia-Upjohn) согласно инструкциям производителя. NGR-TNF и TNF (по 170 мкг каждого в 300 мкл 0,15 М хлорида натрия, 0,05 М фосфата натрия, рН 7,3) смешивали с 15 мкл суспензии смолы (1:4) или только буфера и переворачивали вверх-вниз при 37 С в течение определенного времени. Все 4 продукта фильтровали с помощью устройства типа Spin-X (фирма Costar, Кэмбридж, штат Массачусетс) с размером пор 0,22 мкм и хранили при -20 С до применения.(а) Масс-спектрометрический анализ на основе электроспрея. Для каждого пика определяли значения молекулярных масс и соответствующие им продукты (N-концевые последовательности). Стрелками на последовательностях обозначены сайты расщепления.(б) Воздействие 1 или 3 мкг NGR-TNF и TNF при инкубации без трипсина (верхние панели) или с трипсином (нижние панели) на рост опухолей линии RMA-T и вес животных (средние значенияСКО для групп, обработанных дозами 1 и 3 мкг). Животных обрабатывали через 13 дней после имплантации опухолей (n=5 животных/группу). Фиг. 4 - ДСН-ПААГ и противоопухолевая активность человеческого NGR-TNF до и после денатурации/восстановления складчатости. ДСН-ПААГ в невосстанавливающих условиях (А) человеческого TNF (а) и NGR-TNF до (б) и после(в) процесса денатурации/восстановления складчатости описан в примере V. На панели Б показано воздействие TNF и нескладчатого NGR-TNF на рост лимфом RMA-T, а на панели В - на вес тела. На панели Г показано воздействие человеческого TNF, а на панели Д - NGR-TNF с восстановленной складчатостью (включающего 95% тримеров с дисульфидными мостиками внутри цепи) на рост опухоли. Животных (15 или 5 мышей/группу, что указано для каждой панели) обрабатывали одной дозой TNF или NGR-TNF i.p. через 10 дней после имплантации опухоли. Ниже изобретение проиллюстрировано с помощью примеров. Пример I. Получение мышиного TNF и NGR-TNF.-4 007838 Мышиный рекомбинантный TNF и Cys-Asn-Gly-Arg-Cys-Gly-TNF (NGR-TNF) получали путем цитоплазматической экспрессии кДНК в Е. coli. кДНК, кодирующую мышиный Met-TNF1-156 (20) получали путем полимерной цепной реакции с обратной транскриптазой (ОТ-ПЦР) на основе мРНК, выделенной из стимулированной липополисахаридом клеточной линии моноцитов-макрофагов RAW 264.7, с использованием 5'-CTGGATCCTCACAGAGCAATGATCCCAAAG-3' и 5'-TGCCTCACATATGCTCAGATCATCTTCTC-3' в качестве 3'- и 5'-праймеров. Амплифицированный фрагмент расщепляли с помощью NdeI и BamHI (фирма New England Biolabs,Беверли, штат Массачусетс) и клонировали в плазмиде рЕТ-11b (фирма Novagen, Мэдисон, Висконсин),предварительно расщепленной этими же ферментами (pTNF). кДНК, кодирующую Cys-Asn-Gly-Arg-Cys-Gly-TNF1-156, амплифицировали с помощью ПЦР на основе pTNF с использованием 5'-GCAGATCATATGTGCAACGGCCGTTGCGGCCTCAGATCАТСТТСТС 3' в качестве 5'-праймера и указанного выше 3'-праймера. Амплифицированный фрагмент расщепляли и клонировали в плазмиде рЕТ-11b, как описано выше, и применяли для трансформации клеток Е. coliBL21(DE3) (фирма Novagen). Экспрессию TNF и NGR-TNF индуцировали изопропилDтиогалактозидом согласно инструкции производителя плазмиды рЕТ-11b. Растворимый TNF и NGR-TNF выделяли из двухлитровых культур путем облучения бактерий ультразвуком в 2 мМ этилендиаминотетрауксусной кислоте, 20 мМ Трис-HCl, рН 8,0 с последующим центрифугированием (15000 х g, 20 мин,4 С). Оба экстракта смешивали с сульфатом аммония (25%-ное насыщение), выдерживали в течение 1 ч при 4 С и дополнительно центрифугировали в описанных выше условиях. Сульфат аммония в супернатантах затем доводили до 65%-ного насыщения, выдерживали в течение 24 ч при 4 С и затем центрифугировали. Каждый дебрис растворяли в 200 мл 1 М сульфата аммония, 50 мМ Трис-HCl, рН 8,0 и очищали с помощью основанной на гидрофобном взаимодействии хроматографии на Phenyl-Sepharose 6 FastFlow (фирма Pharmacia-Upjohn) (градиентное элюирование, буфер А: 50 мМ фосфат натрия, рН 8,0, содержащий 1 М сульфат аммония; буфер Б: 20% глицерина, 5% метанола, 50 мМ фосфат натрия, рН 8,0). Фракции, содержащие иммунореактивный в отношении TNF продукт (что установлено методом Нозернблоттинга) объединяли, подвергали диализу в противотоке 2 мМ этилендиаминотетрауксусной кислоты,20 мМ Трис-HCl, рН 8,0 и далее очищали с помощью ионообменной хроматографии на DEAE-Sepharose 6 Fast Flow (фирма Pharmacia-Upjohn) (градиентное элюирование, буфер А: 20 мМ Трис-HCl, рН 8,0; буфер Б: 1 мМ хлорид натрия, 20 мМ Трис-HCl, рН 8,0). Фракции, содержащие TNF-иммунореактивность,объединяли и очищали гель-фильтрацией на Sephacryl-S-300 HR фирма Pharmacia-Upjohn) с предварительным уравновешиванием и элюировали 150 мМ хлоридом натрия, 50 мМ натрий-фосфтаным буфером, рН 7,3 (ЗФР). Объединяли фракции, соответствующие продуктам с Mr 40000-50000, разделяли на аликвоты и хранили в замороженном состоянии при -20 С. Все растворы, применяемые на хроматографических стадиях, готовили с использованием стерильной и не содержащей эндотоксинов воды (фирмаSalf, Бергамо, Италия). Конечные выходы составили: 45 мг TNF и 34,5 мг NGR-TNF. Молекулярную массу очищенных TNF и NGR-TNF оценивали с помощью масс-спектрометрического анализа на основе электроспрея. Содержание протеина измеряли с помощью имеющего в продаже набора для анализа протеина (фирма Pierce, Рокфорд, штат Иллинойс). Содержание эндотоксина в NGRTNF и TNF составляло 0,75 ед./мкг и 1,38 ед./мкг соответственно, что установлено с помощью хромогенной пробы с лизатом амебоцитов (LAL) (фирма BioWhittaker). Гель-электрофорез в полиакриламидном геле с добавлением додецилсульфата натрия (ДСН-ПАА) и анализ методом Вестерн-блоттинга осуществляли с использованием 12,5 или 15%-ных полиакриламидных гелей с помощью стандартных методов. Небольшое количество TNF и NGR-TNF дополнительно очищали с помощью аффинной хроматографии на рецепторе TNF p55 (sTNF-R1)-Sepharose следующим образом: 5 мг рекомбинантного sTNF-R1 получали согласно описанному ранее методу (22) и связывали с 2 мл активированной СН-сефарозы (Activated-CH-Sepharose) (фирма Pharmacia) согласно инструкции производителя. Две различные колонки(каждая объемом 1 мл) интенсивно промывали стерильными и несодержащими эндотоксинов растворами, вносили очищенный TNF или NGR-TNF в ЗФР и осуществляли десорбцию путем градиентного элюирования (1 ч, буфер А: ЗФР; буфер Б: 0,5 М хлорид натрий, 0,2 М глицин-HCl). Фракции, содержащие антиген TNF нейтрализовали и подвергали диализу в противотоке стерильного физиологического раствора. Перед диализом вносили несодержащий эндотоксин человеческий сывороточный альбумин(0,5 мг/мл) для предотвращения адсорбции протеина на мембранах. Содержание TNF в каждой фракции оценивали с помощью ELISA и цитолитического анализа. Невосстанавливающий ДСН-ПААГ TNF показал наличие одной полосы, соответствующей 17-18 кДа, характерной для мономерного TNF (данные не приведены). В противоположность этому при анализе NGR-TNF с помощью невосстанавливающего ДСН-ПААГ и Вестерн-блоттинга выявлены различные иммунореактивные формы с молекулярной массой 18, 36 и 50 кДа, соответствующие мономерам, димерам и тримерам. В восстанавливающих условиях большая часть полос, соответствующих 50 и 36 кДа,превращалась в форму с молекулярной массой 18 кДа, что свидетельствует о наличии молекул NGR-TNF с дисульфидными мостиками между цепями. На долю полосы, соответствующей 18 кДа, приходилось примерно 2/3 общего продукта, в то время как на долю 36 кДа приходилась большая часть остального-5 007838 продукта. Эти электрофоретические схемы позволяют предположить, что NGR-TNF представляет собой смесь тримеров, состоящих из трех мономерных субъединиц с правильными дисульфидными мостиками внутри цепи (по меньшей мере 50%), а оставшаяся часть, в основном, представлена тримерами с одним или несколькими дисульфидными мостиками между цепями. Сохранение полосы 36 кДа при применении восстанавливающего ДСН-ПААГ позволяет предположить, что NGR-TNF также содержит необратимо денатурированный димер (примерно 10% от общего количества). По данным масс-спектрометрии на основе электроспрея молекулярная масса мономеров TNF иNGR-TNF составила 17386,12,0 Да и 17843,72,5 Да соответственно. Эти величины очень хорошо соответствуют ожидаемой массе Met-TNF1-156 (17386,7 Да) и CNGRC-TNF1-156 (17844,2 Да). Пример II. Цитотоксическая активность in vitro мышиных TNF и NGR-TNF. Биологическую активность TNF и NGR-TNF оценивали с помощью стандартного цитолитического анализа, основанного на использовании мышиных фибробластов линии L-M (ATCC CCL1.2), согласно описанному ранее методу (23). Цитолитическую активность TNF и NGR-TNF в отношении клеток линииRMA-T тестировали в присутствии 30 нг/мл актиномицина D. Каждый образец анализировали с дублированием в трех различных разведениях. Результаты выражали в виде среднего значенияСКО, полученного по 2-3 независимым анализам. Цитотоксическая активность in vitro при оценке TNF и NGR-TNF стандартным цитолитическим анализом с использованием L-M-клеток составила (1,20,14)108 ед./мг и (1,80,7)108 ед./мг соответственно. Эти результаты свидетельствуют о том, что фрагменты CNGRCG в молекуле NGR-TNF не препятствуют образованию складок, олигомеризации и связыванию с рецепторами TNF. В предыдущем исследовании установлено, что клетки линии RMA-T можно уничтожать с помощьюTNF в присутствии 30 нг/мл актиномицина D, однако, в отсутствие ингибиторов транскрипции эти клетки устойчивы к TNF даже после нескольких дней инкубации. Цитотоксическая активность NGR-TNF invitro в отношении клеток линии RMA-T в присутствии актиномицина D составила (1,40,8)108 ед./мг,эти исследования проводились с использованием TNF 1,20,14)10 ед./мг) в качестве стандарта. Таким образом, цитотоксические активности NGR-TNF и TNF оказались аналогичными как в отношении L-M-,так и в отношении RMA-T-клеток. Пример III. Характеристика терапевтической и токсической активности мышиных TNF и NGR-TNF. Индуцированную вирусом Rausher лимфому RMA, полученную в мышах линии C57BL/6, поддерживали in vitro в среде RPMI 1640, содержащей 5% фетальной бычьей сыворотки (ФБС), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина В, 2 мМ глутамин и 50 мкМ 2 меркаптоэтанол. RMA-T получали из клеток линии RMA путем трансфекции конструкцией, кодирующей аллель Thy 1.1 и культивировали согласно описанному ранее методу (14). Клетки меланомы B16F1 культивировали в среде RPMI 1640, содержащей 5% ФБС, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина В, 2 мМ глутамин, 1% содержащей незаменимые аминокислотами среды MEM (фирма BioWhittaker Europe, Вервиерс, Бельгия). Опыты in vivo на модельных животных были разрешены комитетом по этике научного института Сан Раффаэля (Ethical Committee of the San Rafaele H Scientific Institute) и их осуществляли согласно установленным правилам. Мышей линии C57BL/6 (Charles River Laboratories, Калко, Италия) (16-18 г) подвергали контрольному заражению, используя 5104 живых клеток RMA-T или B16F1 соответственно,подкожно (s.c.) в левый бок. Через 10-12 дней после имплантации опухоли мышей обрабатывали 250 мкл(i.p.) растворов TNF или NGR-TNF, разведенных несодержащим эндотоксина 0,9%-ным хлоридом натрия. С помощью предварительных экспериментов было установлено, что противоопухолевая активность не изменяется при добавлении к растворам TNF и NGR-TNF человеческого сывороточного альбумина в качестве носителя. Для каждого эксперимента использовали по 5 мышей на группу. Рост опухоли оценивали ежедневно, измеряя размер опухоли с помощью кронциркуля. Площадь опухоли рассчитывали какr1r2, а объем опухоли как r12 r34/3, где r1 и r2 обозначают продольный и поперечный радиусы, а r3 обозначает толщину опухолей, выступающих над поверхностью здоровой кожи. Животных умерщвляли до того, как опухоли достигали 1,0-1,3 см в диаметре. Размеры опухолей представлены в виде среднего значенияСКО (5-10 животных в группе, что указано в надписях на чертежах), сравнение проводили с использованием t-критерия. Противораковую активность и токсичность NGR-TNF сравнивали с указанными характеристикамиTNF, используя модели RMA-T-лимфомы и B16F1- меланомы на мышах линии C57BL/6. Поскольку модель RMA-T ранее была охарактеризована и применялась для изучения противоопухолевой активностиTNF с использованием различных протоколов направленного переноса (26), то эта модель также была использована в данном исследовании. Введение мышиного TNF животным, несущим созданные путем подкожной имплантации RMA-Tопухоли, через 24 ч приводило к снижению массы опухоли и к геморрагическому некрозу центральной части опухоли с последующим заметным замедлением роста через несколько дней (26). Однократная обработка TNF даже в дозе, близкой к величине LD50, не приводила к полному регрессу опухоли указан-6 007838 ного типа, поскольку живые клетки, сохранившиеся вокруг области некроза, возобновляли рост через несколько дней после обработки. При создании изобретения в первой серии экспериментов оценивали воздействие различных доз(i.p.) TNF и NGR-TNF на выживаемость животных. Для того чтобы избежать избыточных страданий животных, их умерщвляли, когда диаметр опухоли превышал 1-1,3 см. Летальное действие TNF и NGRTNF через 3 дня после обработки оказалось аналогичным (LD50 60 и 45 мкг соответственно), в то время как противоопухолевая активность существенно различалась (табл. 1). Таблица 1 Выживаемость мышей с RMA-T-лимфомой, обработанных TNF или NGR-TNF Животных, несущих опухоль, обрабатывали TNF или NGR-TNF (i.p.) на 10 день после имплантации опухоли. Животных умерщвляли, когда диаметр опухоли превышал 1-1,3 см. б Выживших животных повторно заражали 50000 RMA-T-клеток (второе заражение) или 50000RMA (третье заражение) в указанные моменты времени. Онкогенность инъецируемых клеток оценивали в каждый момент времени с использованием 5 здоровых животных. У всех контрольных животных опухоль развилась в течение 10 дней (данные не приведены). Например, обработка 1 или 3 мкг NGR-TNF замедляла рост опухоли более эффективно, чем обработка с помощью 27 мкг TNF, что свидетельствует о том, что активность NGR-TNF выше, по меньшей мере, на порядок. Интересно отметить, что некоторые животные оказались исцеленными при использовании доз NGR-TNF более низких, чем значение LD50, в то время, как ни одно из всех животных не было исцелено при использовании TNF. Вылечившихся животных повторно заражали путем инъекции онкогенными дозами либо клеток RMA-T, либо RMA дикого типа, предполагая, что однократная обработкаNGR-TNF может индуцировать защитный иммунитет. Следует отметить, что увеличение доз TNF илиNGR-TNF выше 9-27 мкг приводило к заметному повышению токсичности и незначительно увеличивало терапевтическую активность или не увеличивало ее вообще. Снижение веса в результате обработки TNF является хорошо известным симптомом системной токсичности (26). Поэтому для дополнительного сравнения соотношения эффективности/токсичности TNF иNGR-TNF оценивали рост опухоли и вес животных после лечения. Воздействие 1 мкг NGR-TNF на рост-7 007838 опухоли оказалось таким же или более эффективным, чем воздействие 9 мкг TNF (фиг. 1 а), в то время как потеря веса через 1-2 дня после обработки соответствовало потери веса при использовании 1 мкгTNF (фиг. 1 в). При интерполяции данных с использованием логарифмической кривой зависимости реакции от дозы было установлено, что терапевтическое действие, соответствующе действию 9 мкг TNF на 14-ый день, можно получить при использовании дозы NGR-TNF всего лишь 0,6 мкг (фиг. 1 б). В противоположность этому для получения сопоставимого токсического действия необходимо 8,5 мкг (фиг. 1 г). Таким образом, в этих условиях рассчитанное соотношение эффективности/токсичности NGR-TNF в 14 выше, чем этот показатель для TNF. Аналогичные результаты были получены при использовании модели меланомы B16F1. Обработка 1 мкг NGR-TNF в день 11 и день 17 индуцировала более выраженное противоопухолевое действие на 19-й день, чем обработка 4 мкг TNF и приводила к аналогичному действию, полученному при использовании 12 мкг TNF (данные не приведены). В противоположность этому потеря веса, вызванная 1 мкг NGR-TNF,оказалось существенно ниже, чем потеря веса, вызванная 4 и 12 мкг TNF. Обработка 12 мкг NGR-TNF вызывала еще более выраженное противоопухолевой действие, при этом токсическое действие соответствовало токсическому действию 12 мкг TNF. При введении на 19-й день третьей инъекции некоторые животные во всех группах погибли через 12 дня (2 из 5 в группе, обработанной физиологическим раствором и 12 мкг NGR-TNF, и 1 из 5 в остальных группах). Следует отметить, что у одного животного, обработанного 12 мкг NGR-TNF, наблюдали полное отторжение опухоли. Когда животных подвергали заражению второй онкогенной дозой клеток линии B16F1, то обнаруживаемая пальпацией опухоль развилась через 18 дней, в то время как у контрольных животных опухоль развилась через 6-7 дней. Эти результаты, в целом, позволяют предположить, что эффективность NGR-TNF в отношении ингибирования роста опухоли в 10-15 раз выше, чем эффективность TNF, а токсичность является аналогичной. Кроме того, NGR-TNF может индуцировать защитные иммунные реакции более эффективно, чем TNF. Пример IV. Механизм действия NGR-TNF. МАт к мышиному CD13, т.е. R3-63, выделяли из асцитической жидкости с помощью хроматографии на протеин-G-сефарозе (фирма Pharmacia-Upjohn, Уппсала, Швеция) и подвергали диализу в противотоке 0,9%-ного раствора хлорида натрия. Кроличью поликлональную антисыворотку получали от фирмы Primm srl (Милан, Италия) и очищали аффинной хроматографией на протеин-А-сефарозе (фирма Pharmacia-Upjohn). Пептиды CNGRC иCARAC получали согласно описанному ранее методу (28). Для доказательства того, что повышенная активность NGR-TNF связана с направленным переносом в опухоль, опосредованным фрагментом NGR, был изучен вопрос о том, может ли активность NGR-TNFin vivo частично конкурировать с CNGRC. Для этой цели мышам, несущим опухоль RMA-T, вводилиNGR-TNF (1 мкг) с добавлением молярного избытка CNGRC или без него. В параллельных опытах других животных обрабатывали TNF (3 или 9 мкг) и этом случае с добавлением CNGRC или без него. Как и ожидалось, присутствие CNGRC в значительной степени снижало противоопухолевую активность NGRTNF (фиг. 2 а), но не влияло на активность TNF (фиг. 2 б). В противоположность этому, контрольный пептид CARAC не вызывал заметного снижения активности NGR-TNF (фиг. 2 в). Эти результаты позволят предположить, что CNGRC конкурирует за связывание NGR-TNF с рецептором CNGRC и подтверждает гипотезу о механизме направленного переноса, обуславливающего повышение активности. Следует отметить, что CNGRC не обладает способностью снижать цитотоксическое действие NGR-TNF in vitro(данные не приведены). Поскольку к настоящему времени известно, что аминопептидаза N (CD13) является рецептором пептидов CNGRC, далее был изучен вклад этого рецептора в механизм направленного переноса NGRTNF. Для этой цели изучено воздействие МАт к мышиному CD13 (R3-63) на противоопухолевую активность NGR-TNF и TNF. МАт R3-63 в значительной степени ингибировало противоопухолевую активность NGR-TNF (фиг. 2 а), но не влияло на активность TNF (фиг. 2 б), что свидетельствует о том, чтоCD13 действительно имеет решающее значение для проявления противоопухолевой активности NGRTNF. С помощью FACS-анализа (анализ с использованием клеточного сортера с возбуждением флуоресценции) клеток, культивируемых в присутствии МАт R3-63 (данные не представлены) не выявлено экспрессии CD13 на поверхности клеток RMA-T, что позволяет предположить, что in vivo антителом распознаются другие клетки. Хотя приведенные данные свидетельствуют о том, что CD13 представляет собой важный рецептор для NGR-TNF, нельзя полностью исключить, что связывание с другими, еще не обнаруженными рецепторами NGR, также играет роль (хотя и в меньшей степени) в механизм направленного переноса. С помощью предварительных экспериментов по оценке частичного протеолиза установлено, что связь Arg-Ser в N-концевом сегменте TNF (остатки 2-3) очень чувствительна к действию трипсина, в то время как остальная часть молекулы существенно более устойчива. Так, для получения дальнейшего доказательства того, что повышенная активность NGR-TNF связана с его NGR-фрагметом, была предпринята попытка отщепить NGR-домен от N-концевой области мутеина путем частичного расщепления с помощью иммобилизованного трипсина. Эта обработка привела к превращению как NGR-TNF, так иTNF в молекулу, соответствующую ТNF3-156-фрагменту (ожидаемая масса 16986,2 Да; данные о измеренной массе и ожидаемых последовательностях см. на фиг. 3 а). Хотя расщепление не понизило цитолитическую активность in vitro NGR-TNF в отношении L-Mклеток (2,3l,4)108 ед./мг), его противоопухолевая активность снизилась до уровня TNF (фиг. 3 б). Следует отметить, что токсичность NGR-TNF была такой же, что и токсичность TNF как до, так и после расщепления, что следует из данных о потере веса животных через 1 день после обработки (фиг. 3 б, правая панель), что позволяет предположить, что связанный с NGR механизм направленного переноса не приводит к изменению токсичности. Пример V. Получение и характеристики человеческих TNF и NGR-TNF. Человеческие рекомбинантные TNF и NGR-TNF (включающий человеческий TNF1-157, слитый с С-концом CNGRCG) получали методом рекомбинантной ДНК и очищали в целом согласно методу, описанному для мышиных TNF и NGR-TNF. кДНК, кодирующую человеческий NGR-TNF, получали с помощью ПЦР с использованием плазмиды pET11b/hTNF, содержащей кодирующую последовательностьTCT CG 3',NGR-hTNF/2 (антисмысловой): 5'-ТСА GGA ТСС TCA CAG GGC AAT GAT ССС AAA GTA GAC-3'. Амплифицированный фрагмент расщепляли и клонировали в рЕТ-11b (NdeI/BamHI) и применяли для трансформации клеток Е. coli BL21 (DE3) (фирма Novagen). Экспрессию NGR-hTNF индуцировали изопропилD-тиогалактозидом согласно инструкции производителя плазмиды pET11b. РастворимыйNGR-TNF выделяли из 2-литровых культур путем облучения бактерий ультразвуком в 2 мМ этилендиаминотетрауксусной кислоте, 20 мМ Трис-HCl, рН 8,0 с последующим центрифугированием (15000 х g,20 мин, 4 С). Экстракт смешивали с сульфатом аммония (35%-ное насыщение), выдерживали в течение 1 ч при 4 С и дополнительно центрифугировали в описанных выше условиях. Затем сульфат аммония в супернатантах доводили до 65%-ного насыщения, выдерживали в течение 24 ч при 4 С, после чего центрифугировали. Каждый дебрис растворяли в 1 М сульфате аммония, 50 мМ Трис-HCl, рН 8,0 и очищали с помощью основанной на гидрофобном взаимодействии хроматографии на Phenyl-Sepharose 6 Fast Flow (фирма Pharmacia-Upjohn) (градиентное элюирование, буфер А: 100 мМ фосфат натрия, рН 8,0, содержащий 1 М сульфат аммония; буфер Б: 70% этиленгликоля, 5% метанола, 50 мМ фосфат натрия, рН 8,0). Фракции, содержащие иммунореактивный в отношении hTNF продукт (что установлено методом ELISA),объединяли, подвергали диализу в противотоке 20 мМ Трис-HCl, рН 8,0 и далее очищали с помощью ионообменной хроматографии на DEAE-Sepharose Fast Flow (фирма Pharmacia-Upjohn) (градиентное элюирование, буфер А: 20 мМ Трис-HCl, рН 8,0; буфер Б: 1 мМ хлорид натрия, 20 мМ Трис-HCl, рН 8,0). Все растворы, применяемые на хроматографических стадиях, готовили с использованием стерильной и не содержащей эндотоксинов воде (фирма Salf, Бергамо, Италия). Этим методом из 2-литровых культур получали примерно 30 мг TNF и 32 мг NGR-TNF. Невосстанавливающий ДСН-ПААГ показал наличие полос, соответствующих мономерам, димерам и тримерам,что позволяет предположить, что человеческий NGR-TNF также представляет собой смесь тримеров,несущих правильные дисульфидные мостики внутри цепи, и тримеров с одним или несколькими дисульфидными мостиками между цепями (фиг. 4 А, полоса б), что ранее установлено для мышиного NGRTNF. Тримеры с правильными дисульфидными мостиками внутри цепи выделяли из этой смеси с помощью следующего четырехстадийного процесса денатурации-восстановления складчатости: очищенный человеческий NGR-TNF денатурировали 7 М мочевиной и подвергали гель-фильтрации с использованием колонки типа HR Sephacryl S-300 (объем 1025 мл) (фирма Pharmacia), предварительно уравновешенной 7 М мочевиной, 100 мМ Трис-HCl, рН 8,0. Фракции, соответствующие мономерному TNF, объединяли,подвергали ультрафильтрации через мембрану типа YM MWCO, 10 кДа (фирма Amicon) и восстанавливали складчатость путем диализа в противотоке 33 объемов 2,33 М мочевины, 100 мМ Трис-HCl, рН 8 при 4 С (140 мин), а затем 1,55 М мочевины, 100 мМ Трис-HCl, рН 8 (140 мин) и 1 М мочевины, 100 мМ Трис-HCl, рН 8 (140 мин). И наконец, продукт подвергали диализу в противотоке 80 объемов 100 мМ Трис-HCl (16 ч), центрифугировали при 13000 х g (30 мин), фильтровали через мембрану типа SFCA, 045 мкм (фирма Nalgene) и подвергали гель-фильтрации с использованием колонки типа HR Sephacryl S-300(ЗФР). Получали примерно 23 мг протеина с восстановленной складчатостью. По данным невосстанавливающего ДСН-ПААГ (фиг. 4 А, полоса в) конечный продукт, в основном,являлся мономерным, по данным аналитической гель-фильтрации ЖХВР на колонке типа Superdex 75HR (данные не приведены) имел гидродинамический объем, аналогичный объему тримерного человеческого TNF, и по данным масс-спектрометрического анализа на основе электроспрея имел молекулярную массу 17937,81,8 Да (ожидаемую для CNGRCG-TNF1-157, 17939,4 Да). Цитотоксическая активность in(6,11107)+4,9 и (5,09107)+0,3 ед./мг соответственно, а очищенного человеческого TNF-(5,45107)+3,1 ед./мг. Эти результаты позволяют предположить, что процесс денатурации-восстановления складчатости не влияет на взаимодействие человеческого NGR-TNF с мышиным рецептором р 55. Противоопухолевая активность in vivo 1 мкг человеческого NGR-TNF (с невосстановленной складчатостью) оказалась выше, чем активность 10 мкг TNF (фиг. 4 Б), в то время как токсичность, оцененная по потере веса животных, оказалась значительно более низкой (фиг. 4 В). Оказалось, что после восстановления складчатости 0,3 мкг NGR-TNF оказалось достаточно для индукции противоопухолевой активности более высокой, чем активность, достигаемая при использовании 10 мкг TNF (фиг. 4 Г, 4 Д). Эти результаты свидетельствуют о том, что противоопухолевая активность человеческого NGRTNF выше, чем человеческого TNF. Кроме того, было установлено, что человеческий и мышиный NGR-TNF с восстановленной складчатостью могут индуцировать выраженную противоопухолевую активность в отношении мышей, несущих RMA-T, даже в очень низких дозах (1-10 нг/мышь) без проявления токсических действий, в то время как TNF в этих дозах не обладает выраженной активностью (данные не приведены). Пример VI. Получение и характеристики мышиного NGR-IFN. Рекомбинантный мышиный интерферон (IFN) , слитый с CNGRCG (NGR-IFN) получали методом рекомбинантной ДНК, в целом, согласно методу, описанному для NGR-TNF. CNGRC-домен сливали с Сконцом IFN. Кроме того, цистеин в положении 134 заменяли серином; для экспрессии в клетках Е. coli метионин интродуцировали с положение -1. Для получения кДНК NGR-IFN применяли следующие ПЦР-праймеры: 5'-А ТАТ СТА CAT ATG CAC GGC АСА GTC ATT GAA AGC С (смысловой) и 5'-ТСGGA ТСС ТСА GCA ACG GCC GTT GCA GCC GGA GCG ACT CCT TTT CCG CTT CCT GAG GC. кДНК клонировали в рЕТ-11b (NdeI/BamHI) и применяли для трансформации клеток Е. coli BL21(DE3)(фирма Novagen). Экспрессию протеина индуцировали изопропилD-тиогалактозидом согласно инструкции производителя плазмиды рЕТ 11b. Продукт выделяли из экстрактов Е. coli иммуноаффинной хроматографией, используя МАт к мышиному NGR-IFN (AN18), иммобилизованный на агарозе согласно общепринятым методикам. Восстанавливающий и невосстанавливающий ДСН-ПААГ конечного продукта показал наличие одной полосы, соответствующей 16 кДа. С помощью масс-спектрометрического анализа на основе электроспрея установлено, что молекулярная масса составляет 16223+3,6 Да (ожидаемая 1625,5 Да), что соответствует мышиному Met-IFN1-134(C134S)CNGRC (NGR-IFN). Способность NGR-IFN и NGR-TNF конкурировать с антителом к CD13 за связывание с сосудами опухоли оценивали с помощью иммуногистохимического анализа. Свежие полученные хирургическим путем образцы клеток карциномы почки человека получали из отделения гистопалогии научно-исследовательского института Сан-Раффаэля (Histopathology Department(4-5 ч) залитых в парафин образцов и наносили на покрытые полилизином предметные стекла. АнтигенCD13 выявляли с использованием комплекса авидин-биотин, следующим методом: срезы ткани повторно гидрировали с помощью ксилолов и ступенчато изменяющихся серийных разведений спирта согласно стандартным методикам. Срезы ткани помещали в сосуд, содержащий 1 мМ ЭДТК, и кипятили в течение 7 мин, используя микроволновую печь (1000 В). Затем в сосуд вновь вносили 1 мМ ЭДТК и кипятили в течение 5 мин. Срезам ткани давали охладиться и инкубировали в ЗФР, содержащем 0,3% перекиси водорода, в течение 15 мин для подавления эндогенной пероксидазы. Затем образцы промывали ЗФР и инкубировали с 100-200 мкл ЗФР-БСА (1 ч при комнатой температуре), а затем инкубировали только с МАт WM15 (к hCD13) или также с различными конкурентами (см. табл. 2) в ЗФР-БСА (в течение ночи при 4 С). Затем предметные стекла промывали трижды (каждый раз по 3 мин) ЗФР и инкубировали с ЗФР-БСА, содержащим 2% нормальной лошадиной сыворотки (ЗФР-БСА-NHS) (фирма Vector Laboratories, Бурлингам, штат Калифорния) в течение 5 мин. Затем раствор заменяли раствором, содержащим 3 мкг/мл биотинилированного лошадиного антимышиного IgG (H+L) (фирма Vector Laboratories, Бурлингам, штат Калифорния) в ЗФР-БСА-NHS и далее инкубировали в течение 1 ч при комнатной температуре. Предметные стекла вновь промывали и инкубировали в течение 30 мин с реагентом Vectastain Elite(фирма Vector Laboratories, Бурлингам, штат Калифорния), разбавленным в соотношении 1:100 ЗФР. Затем таблетку 3,3'-диаминобензидинтетрагидрохлорида (фирма Merck, Дармштадт, Германия) растворяли в 10 мл деионизированной воды, содержащей 0,03% перекиси водорода, фильтровали через мембрану с размером пор 0,2 мкм и наносили на срезы ткани на 5-10 мин. Затем предметные стекла промывали, как описано выше и подвергали контрастному окрашиванию гематоксилином Гарриса. Связанные с опухолью сосуды выявляли окрашиванием серийных срезов ткани с помощью МАт к CD31 (МАт JC/70A, антитело к человеческому CD31, IgG1, фирма DAKO, Копенгаген, Дания). Полученные результаты обобщены в табл. 2. Как видно из таблицы, связывание WM15 с сосудами опухоли ингибировалось избытком NGR-TNF, NGR-IFN и CNGRC, но не ингибировалось другими реагентами, применяемыми в качестве контроля, у которых отсутствовал мотив NGR. Это позволяет предположить, что сайт связывания NGR на CD13 стерически перекрывается с эпитопом WM15. В противоположность этому NGR-TNF не может конкурировать с 13 С 03 за связывание с эпителиальными клетка- 10007838 ми. Отсюда можно заключить, что фрагмент NGR в NGR-IFN и NGR-TNF может взаимодействовать с формой CD13, распознаваемой МАт WM15 сосудов, связанных с опухолью. Кроме того, эти результаты свидетельствуют о том, что мотив CNGRC является функционально активным, когда он связан как с Nконцом, так и с С-концом цитокина. Таблица 2 Связывание WM15 с клетками срезов рака почки в присутствии различных конкурентов Конкурент a Связывание WM15 с сосудами опухоли б Нет+ Человеческий сывороточный альбумин (25 мкг/мл)+ а Конкурент в ЗФР, содержащем 2% БСА, добавляли на стадии блокады и смешивали с первичным антителом. б МАт WM15 (антитело к человеческому CD 13, IgGl) получали от фирмы Pharmingen (Сан Диего,штат Калифорния). в Синтетический пептид CgA(60-68) соответствует хромогранину А, фрагмент 60-68. Пример VII. Направленный перенос биотинилированного NGR-TNF в опухоли с использованием противоопухолевых антител и авидина (предварительный направленный перенос). Ниже в примере проиллюстрирована возможность "двухэтапного" направленного переноса TNF,основанного на использовании комбинации хоминг-антитела опухоли и пептида CNGRC. Конъюгат биотин-NGR-TNF получали, смешивая NGR-TNF с N-гидроксисукцинимидиновым эфиром D-биотинил-6-аминокапроновой кислоты (фирма Societa Prodotti Antibiotici S.p.A., Милан, Италия) в 1 М натрий-карбонатном буфере, рН 6,8 (3 ч при комнатной температуре) (21). Реакцию блокировали,добавляя 1 М Трис-HCl, рН 7,5. Конъюгат характеризовали с помощью масс-спектрометрии, и было установлено, что он содержит(в среднем) 1 молекулу биотина на тример. Затем мышей линии C57BL (фирма Charles River Laboratoties,Калко, Италия) подвергали контрольному заражению живыми клетками линии RMA-T (5104), s.c. в левый бок. Когда площадь опухоли достигала 40 мм 2, мышам последовательно путем инъекций вводили биотинилированное антитело, авидины и биотин-TNF согласно описанному ранее трехдневному протоколу (26). Для инъекций использовали: 40 мкг комплекса биотин-МАт 19 Е 12 (i.p., стадия I), 60 мкг авидина и 60 мкг стрептавидина спустя 18 и 19 ч соответственно (i.p., стадия II), 3 мкг комплекса биотинNGR-TNF, через 24 ч (i.p., стадия III). Каждый компонент растворяли в стерильном 0,9%-ном растворе хлорида натрия. В контрольном эксперименте не применяли авидин и стрептавидин. Каждый эксперимент осуществляли, используя по 5 мышей/группу. Рост опухоли оценивали ежедневно, измеряя размер опухоли с помощью кронциркуля. Площади опухолей до обработки и через 10 дней после обработки составляли 394 и 85 мм 2 соответственно в группе, обработанной МАт 19 Е 12-биотин/авидин/ стрептавидин/биотин-NGR-ТNF (5 животных, среднее значениеСКО). В контрольной группе (обработанной только МАт 19E12-биотин/биотин-NGR-TNF) площади опухолей до обработки и через 10 дней после обработки составляли 404 и 205 мм 2 соответственно, эти результаты свидетельствуют о том, что предварительный направленный перенос с использованием хоминг-антитела опухоли и авидина значительно повышает активность NGR-TNF. Литература 1. Carswell E.А. и др., An endotoxin-induced serum factor that causes necrosis of tumors. Proc. Natl. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгированный продукт, обладающий противоопухолевой активностью, включающий цитокин, выбранный из TNF или IFN, и лиганд, содержащий NGR-мотив. 2. Конъюгированный продукт по п.1, где цитокин представляет собой TNF или TNF. 3. Конъюгированный продукт по пп.1-2, где лиганд представляет собой лиганд рецептора CD13, который выбирают из группы, включающей антитела или их активные фрагменты, пептиды или миметики пептидов. 4. Конъюгированный продукт по п.3, где лиганд представляет собой пептид. 5. Конъюгированный продукт по п.4, где пептид выбирают из группы, включающейCNGRCVSGCAGRC, NGRAHA, GNGRG, циклoCVLNGRMEC, линейный или циклический CNGRC. 6. Конъюгированный продукт по любому из пп.1-5, где цитокин дериватизирован полиэтиленгликольным или ацильным фрагментом. 7. Конъюгированный продукт по любому из пп.1-6, где цитокин дополнительно конъюгирован с антителом или его фрагментом, которые направлены к опухолевому антигену, опухолевому ангиогенному маркеру или компоненту внеклеточного матрикса, или с биотином. 8. Конъюгированный продукт по п.7, где цитокин представляет собой TNF, различные субъединицы которого конъюгированы как с лигандом рецептора CD13, так и либо с антителом или его фрагментом, либо с биотином. 9. кДНК, кодирующая конъюгированный продукт по п.1. 10. кДНК по п.9, кодирующая конъюгированный продукт по п.5. 11. Предназначенный для генной терапии вектор, включающий кДНК по любому из пп.9-10. 12. Фармацевтическая композиция, включающая эффективное количество конъюгированного продукта по любому из пп.1-8 в сочетании с фармацевтически приемлемыми носителями и наполнителями. 13. Композиция по п.12 в форме инъецируемого раствора или суспензии, или жидкости для инфузий. 14. Композиция по любому из пп.12-13 в форме липосом. 15. Применение конъюгированного продукта по любому из пп.1-8 для приготовления противоопухолевых лекарственных средств или диагностических агентов. 16. Применение конъюгированного продукта по любому из пп.1-8 в сочетании с другими противораковыми или диагностическими агентами, предназначенными для визуализации опухоли. 17. Применение кДНК по любому из пп.9-10 для приготовления лекарственных средств или диагностических агентов, предназначенных для применения в терапии рака.- 14007838 18. Применение кДНК по п.17 в сочетании с другими противораковыми или диагностическими агентами, предназначенными для визуализации опухоли. а
МПК / Метки
МПК: C12N 15/28, C07K 7/00, C12N 15/23, C07K 14/57, A61K 38/19, A61K 31/70, A61K 38/21, C07K 5/08, C07K 14/525, C07K 16/28, C12N 15/62
Метки: используемые, терапии, конъюгированные, опухолей, цитокины
Код ссылки
<a href="https://eas.patents.su/20-7838-konyugirovannye-citokiny-ispolzuemye-dlya-terapii-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгированные цитокины, используемые для терапии опухолей</a>
Предыдущий патент: Система и способ для детектирования состояния буровой установки
Следующий патент: Иммуностимулятор противоопухолевого действия и способ его получения
Случайный патент: Способы приготовления выпечного продукта, используемые для этого композиции и выпечной продукт