Способ получения дигидроптеридинонов и их промежуточных продуктов
Формула / Реферат
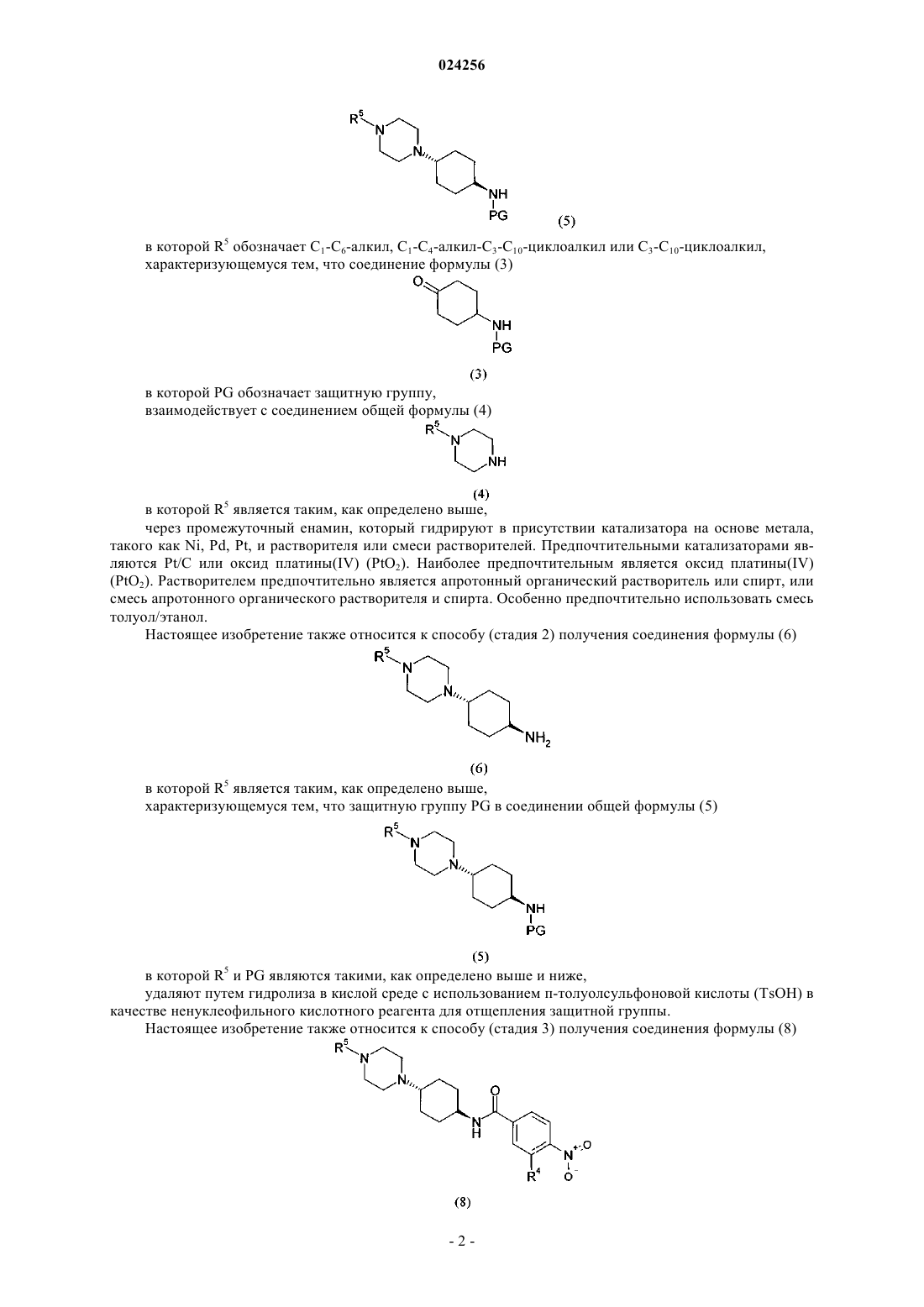
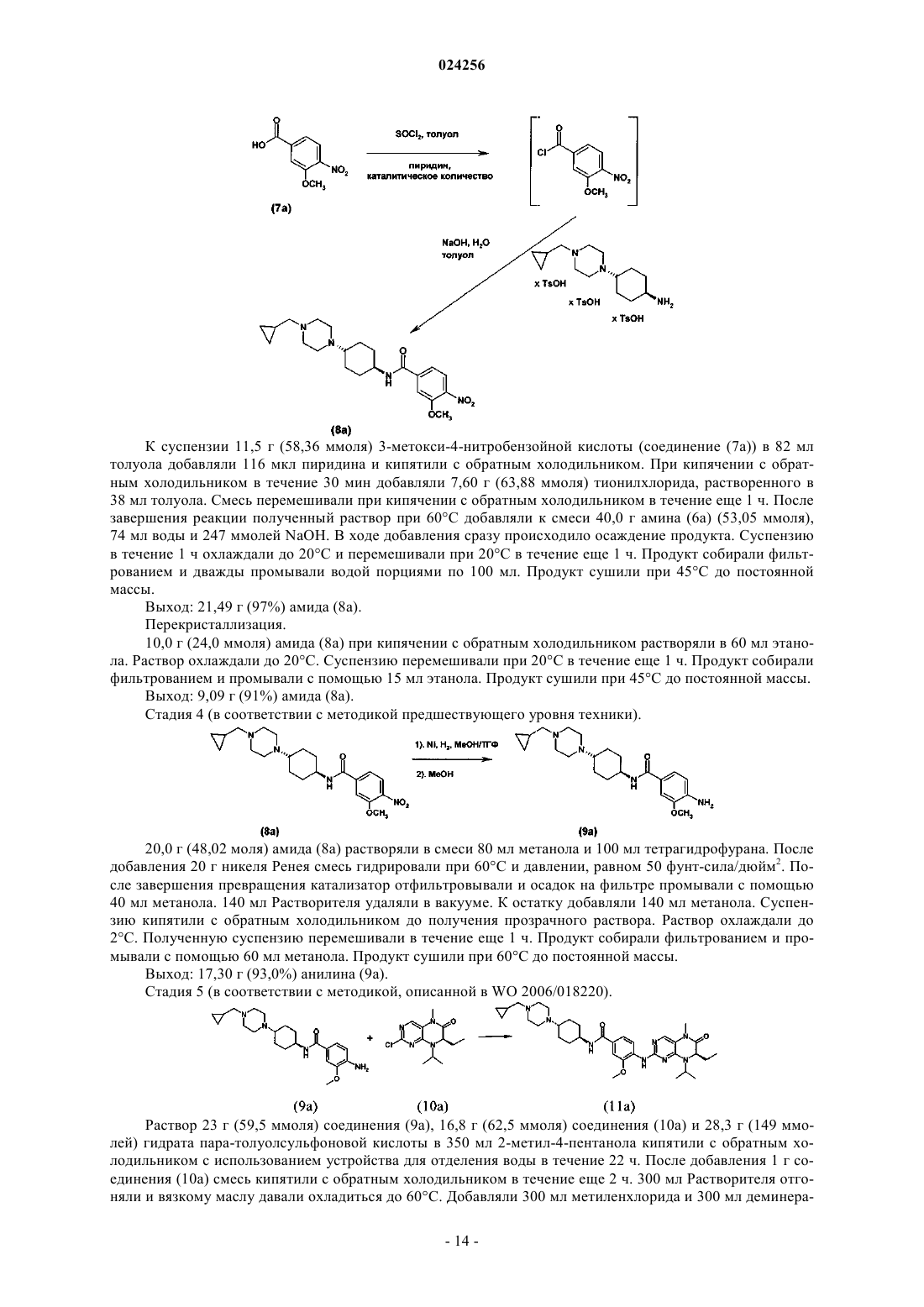
1. Способ получения соединения формулы (8)
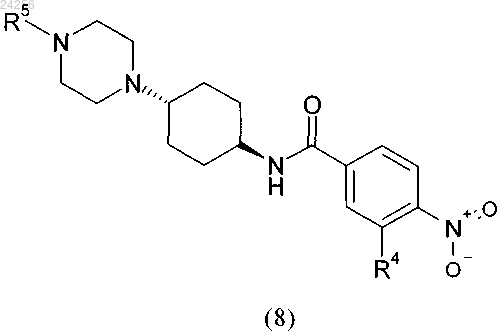
в которой R5 обозначает C1-C6-алкил, C1-C4-алкил-C3-C10-циклоалкил или C3-C10-циклоалкил;
R4 обозначает водород или группу, выбранную из -CN, гидроксигруппы, C1-C6-алкила, C1-C5-алкилоксигруппы и C1-C6-алкилтиогруппы;
характеризующийся тем, что соединение общей формулы (7)
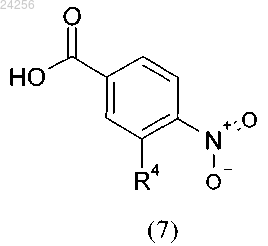
в которой R4 является таким, как определено выше,
взаимодействует с амином формулы (6)
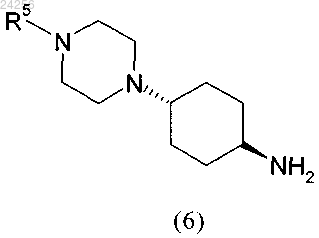
в которой R5 является таким, как определено выше,
с использованием гидроксида щелочного или щелочно-земельного металла в качестве основания и протонного растворителя.
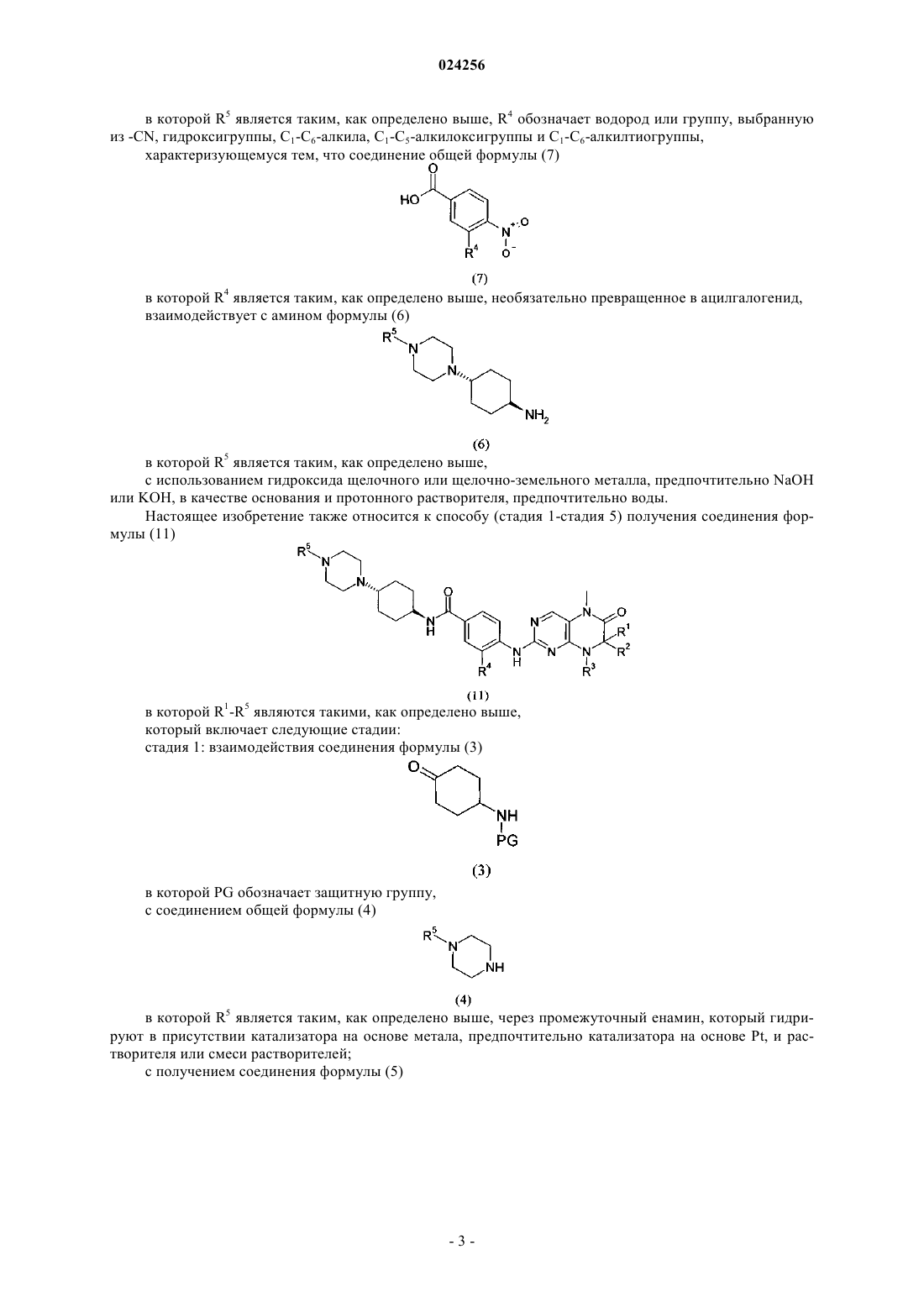
2. Способ по п.1, характеризующийся тем, что соединение формулы (6)
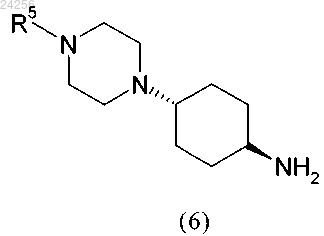
получают путем удаления защитной группы PG в соединении общей формулы (5)

путем гидролиза в кислой среде с использованием п-толуолсульфоновой кислоты (TsOH).
3. Способ по п.2, характеризующийся тем, что соединение формулы (5)
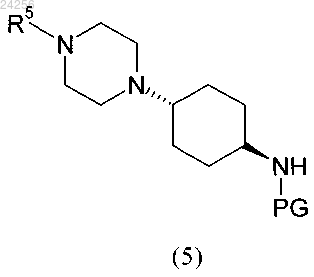
получают путем взаимодействия соединения формулы (3)
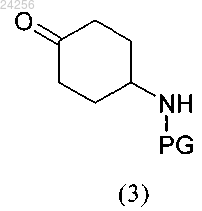
в которой PG обозначает защитную группу,
с соединением общей формулы (4)
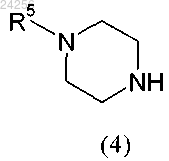
через промежуточный енамин, который гидрируют в присутствии катализатора на основе метала и растворителя или смеси растворителей.
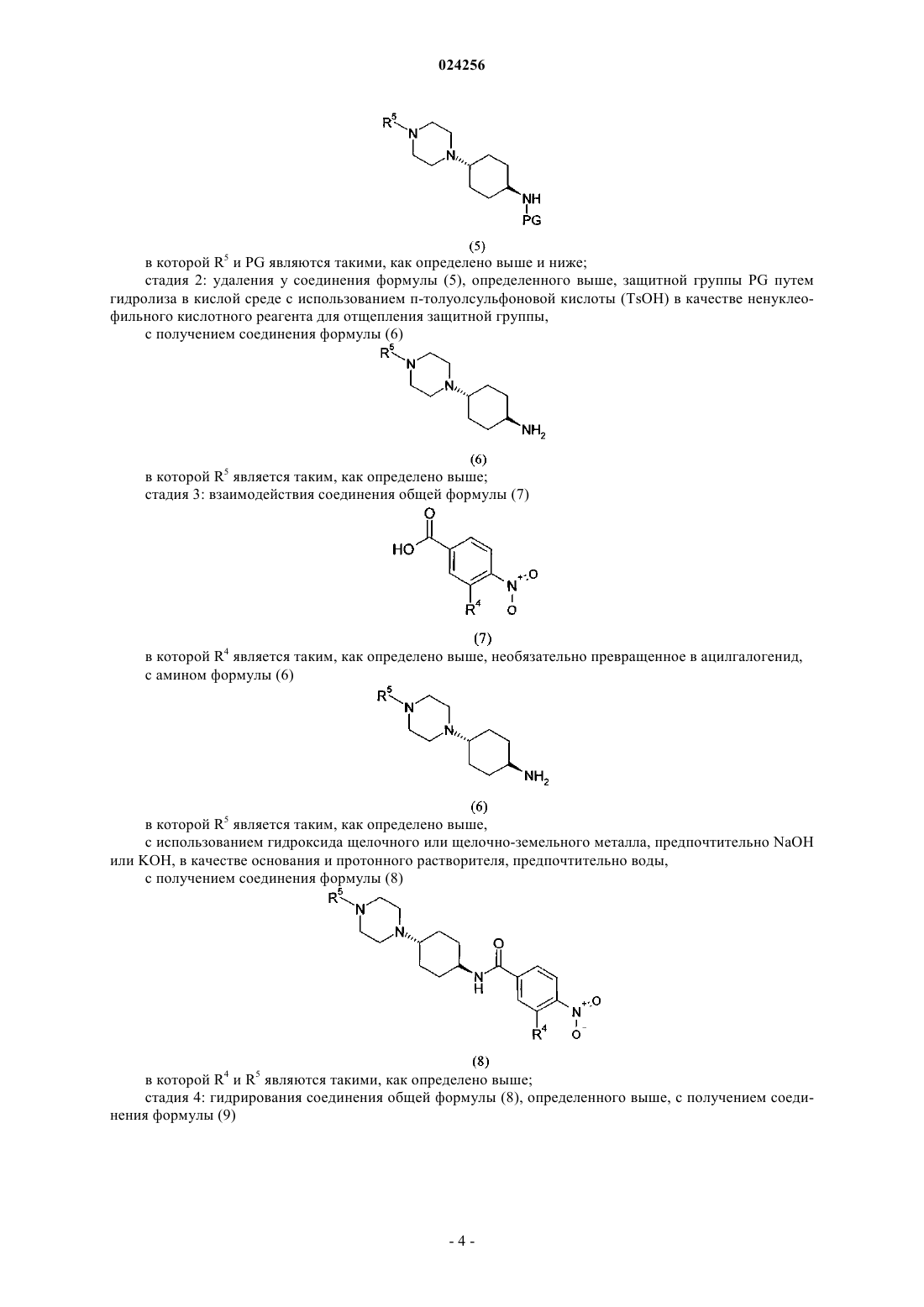
4. Способ по любому из пп.1-3, в котором превращенное в ацилгалогенид соединение формулы (7) взаимодействует с амином формулы (6).
5. Способ по любому из пп.1-4, в котором используемые основания, гидроксид щелочного или щелочно-земельного металла представляют собой NaOH или KOH.
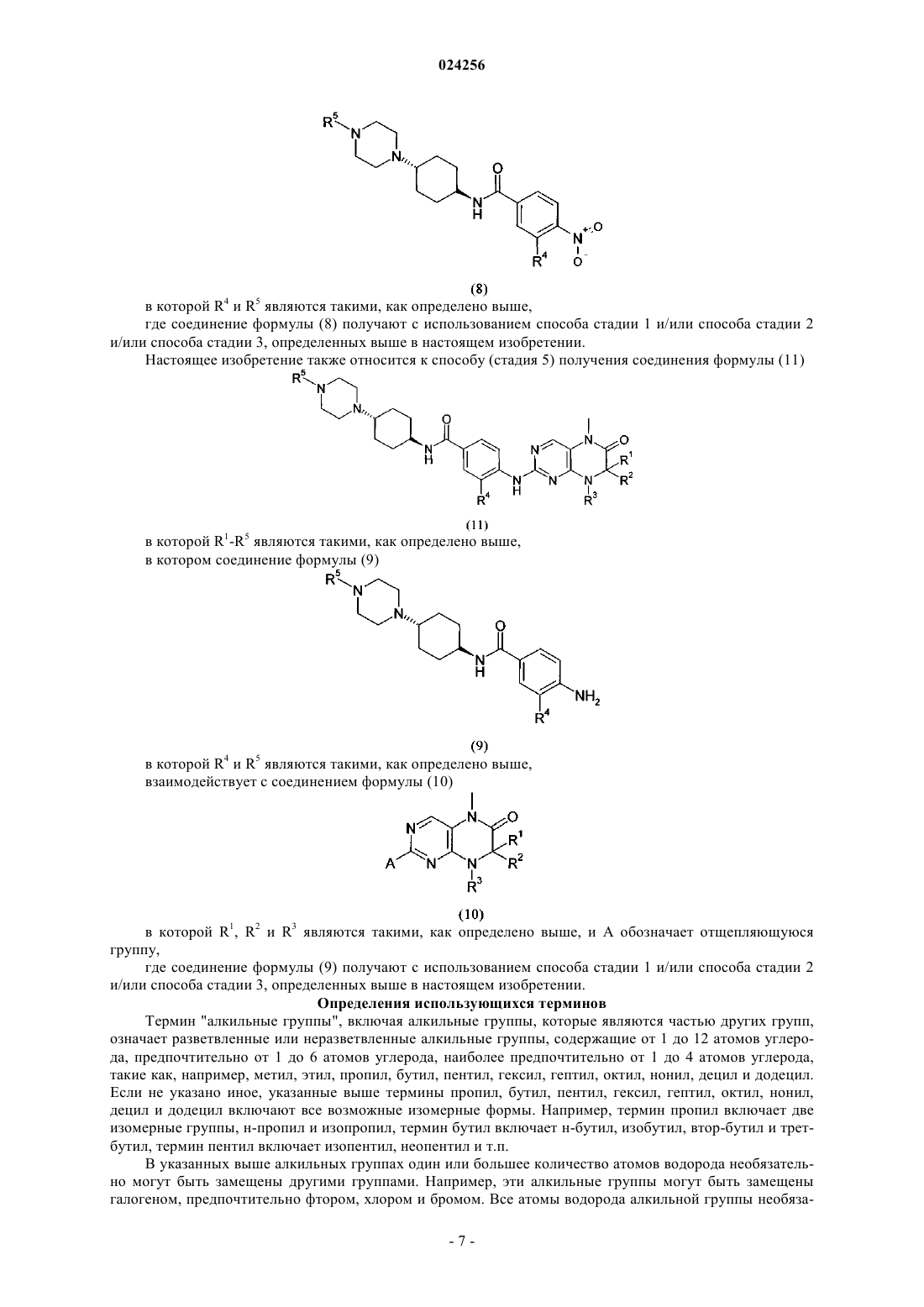
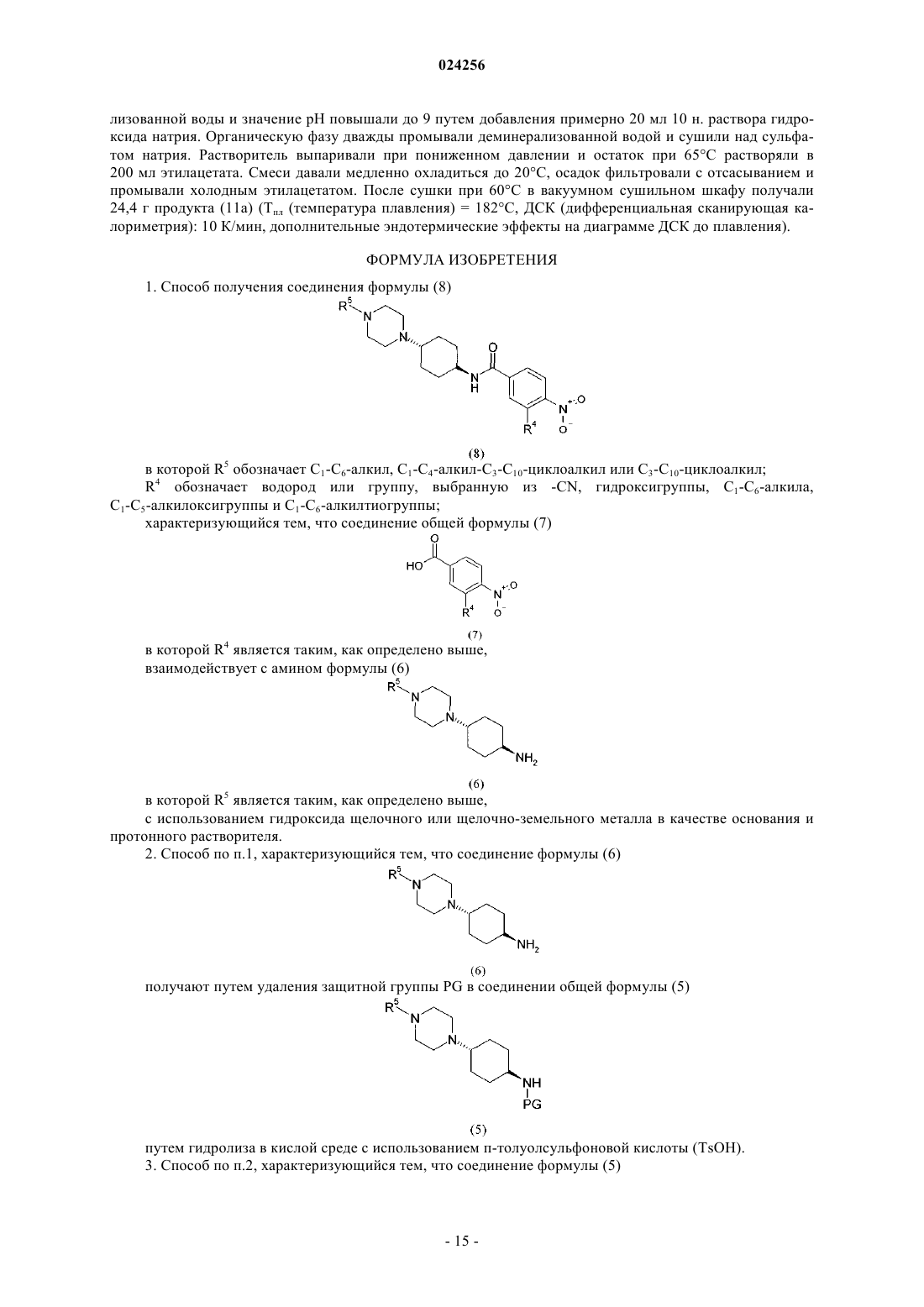
6. Способ получения соединения формулы (9)
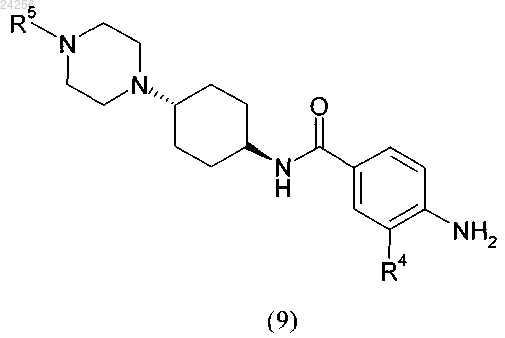
в котором соединение общей формулы (8)
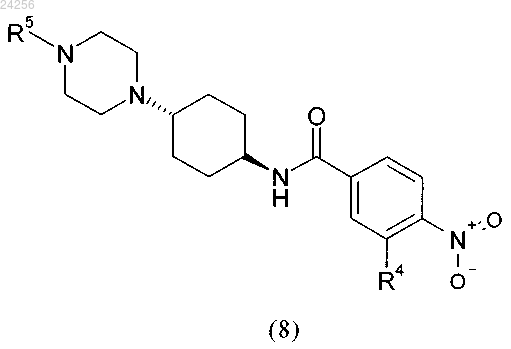
в которой R4 и R5 являются такими, как определено выше,
гидрируют, характеризующийся тем, что соединение формулы (8) получают с использованием способа по любому из предыдущих пп.1-5.
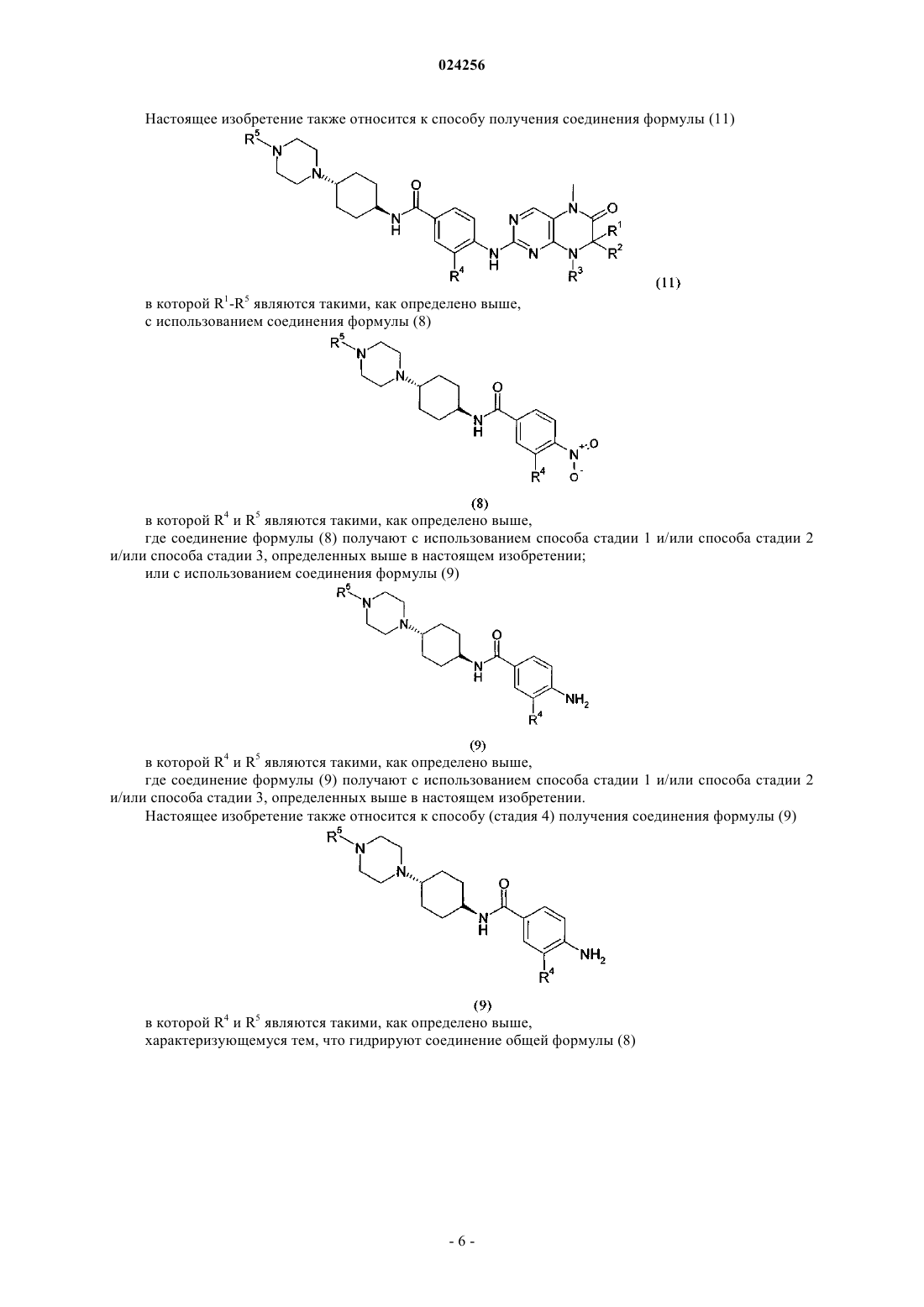
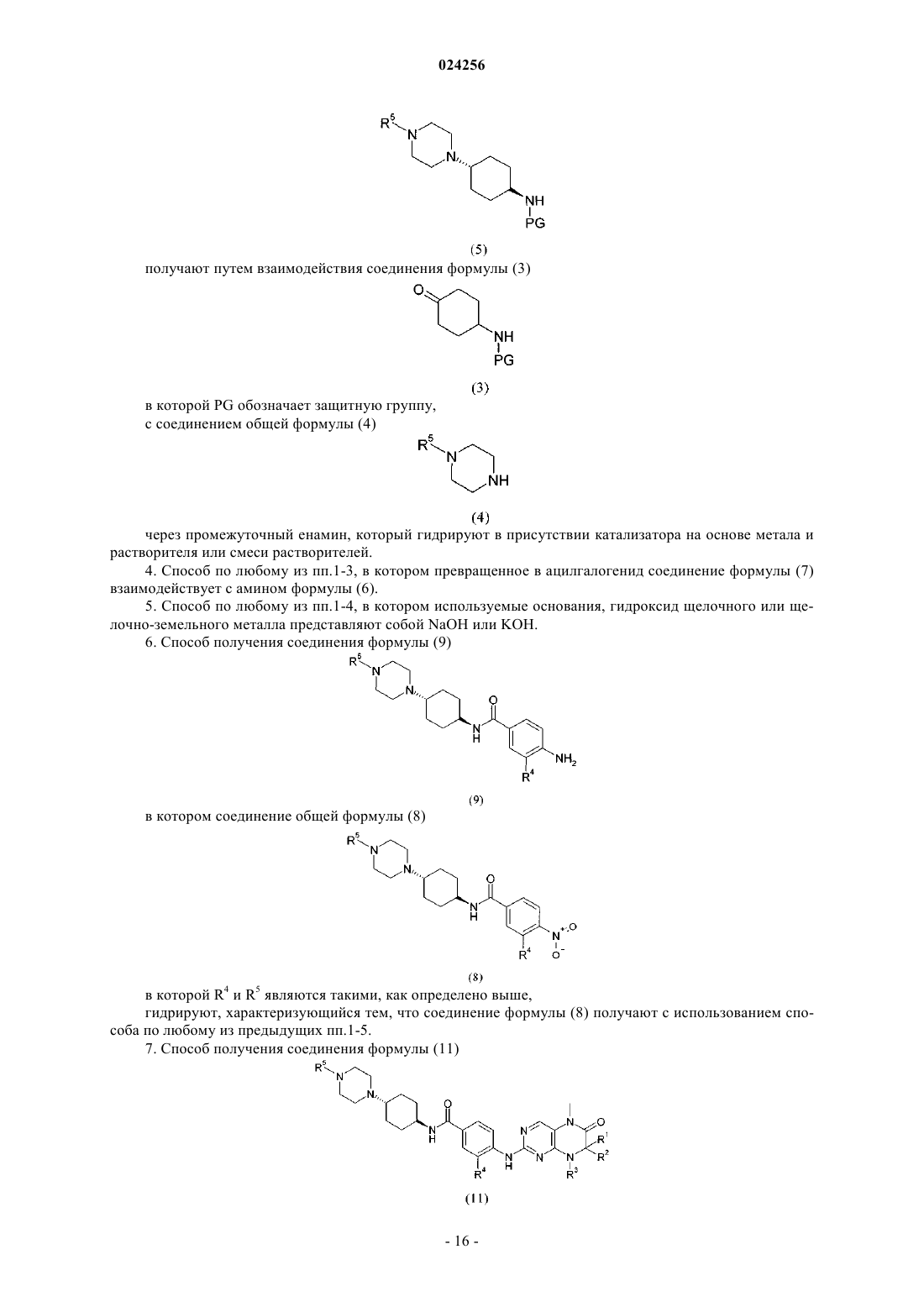
7. Способ получения соединения формулы (11)
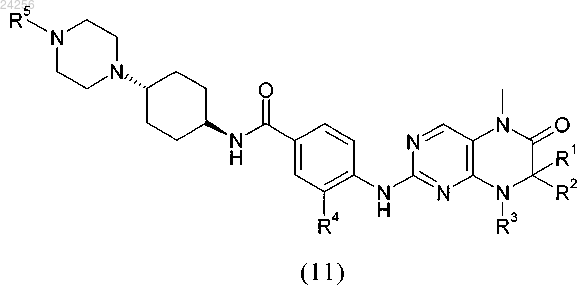
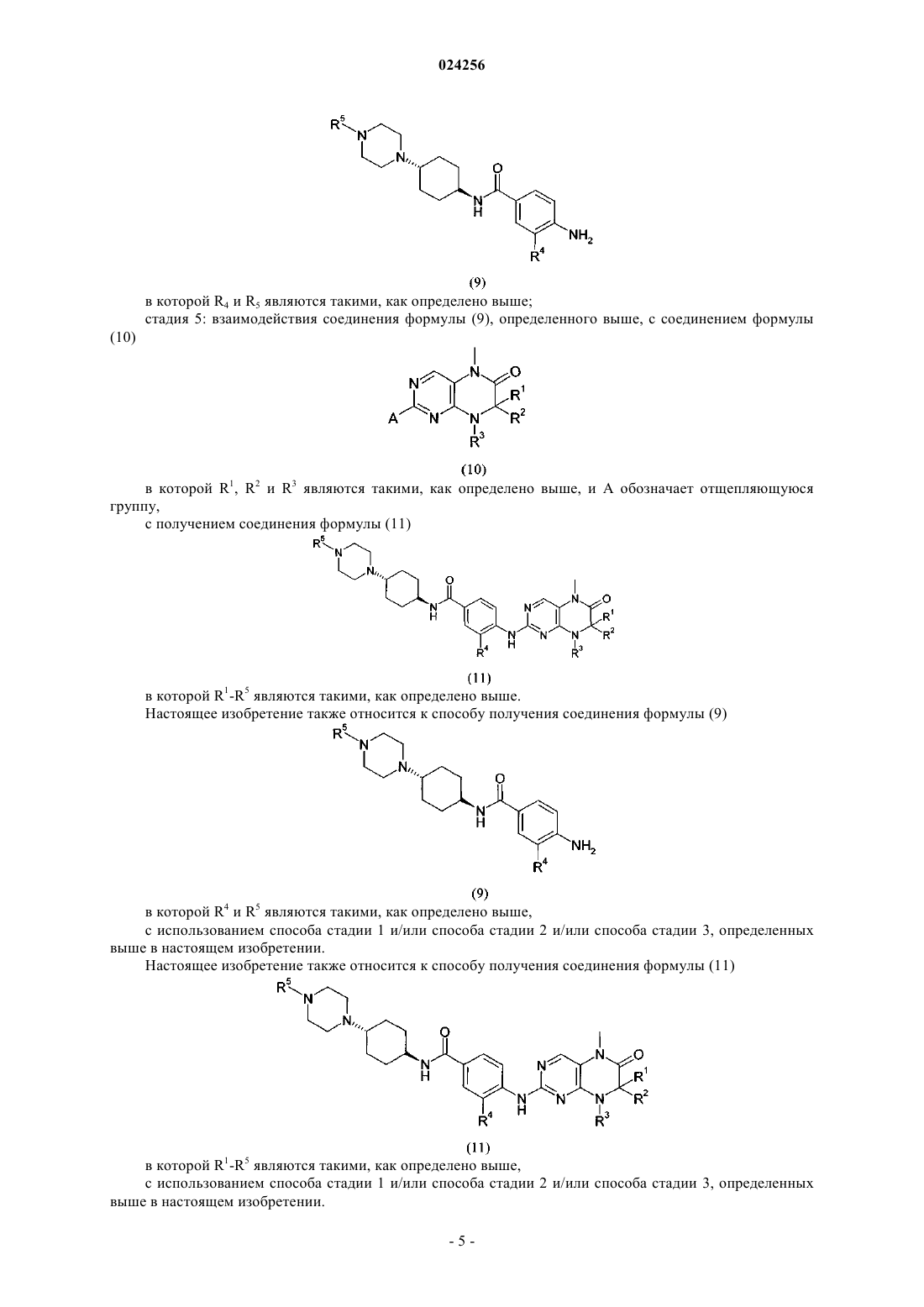
в которой R1 и R2 независимо друг от друга обозначают водород или C1-C6-алкил;
R3 обозначает водород или группу, выбранную из C1-C6-алкила и C3-C8-циклоалкила;
R4 и R5 являются такими, как определено выше,
где соединение формулы (9)
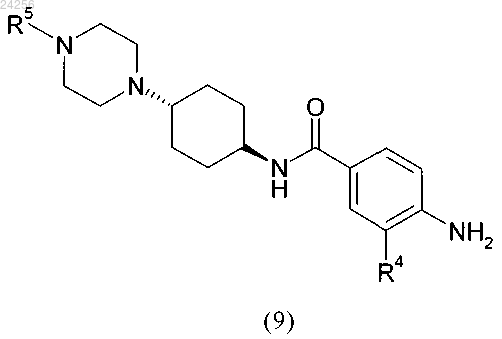
в которой R4 и R5 являются такими, как определено выше,
взаимодействует в кислой среде в растворителе с соединением формулы
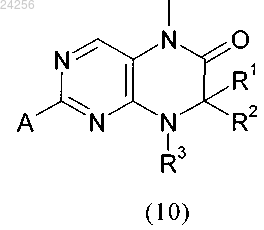
в которой R1, R2 и R3 являются такими, как определено выше, и А обозначает отщепляющуюся группу,
характеризующийся тем, что соединение формулы (9) получают с использованием способа по п.6.
8. Способ получения соединения формулы (11)

в которой R1-R5 являются такими, как определено выше,
который включает следующие стадии:
стадия 1: взаимодействия соединения формулы (3)
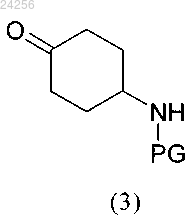
в которой PG обозначает защитную группу,
с соединением общей формулы (4)
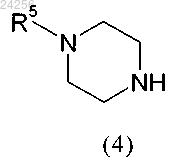
в которой R5 является таким, как определено выше,
через промежуточный енамин, который гидрируют в присутствии катализатора на основе метала и растворителя или смеси растворителей, с получением соединения формулы (5)
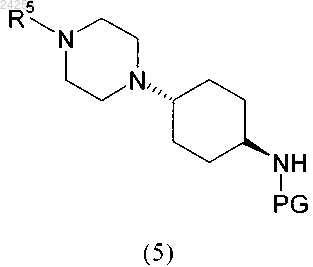
в которой R5 и PG являются такими, как определено выше и ниже;
стадия 2: удаления у соединения формулы (5), определенного выше, защитной группы PG путем гидролиза в кислой среде с использованием п-тоуолсульфоновой кислоты (TsOH) с получением соединения формулы (6)
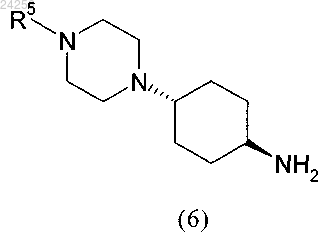
в которой R5 является таким, как определено выше;
стадия 3: взаимодействия соединения общей формулы (7)
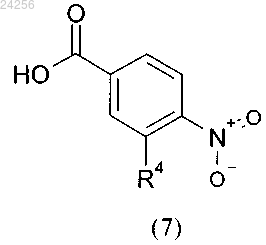
в которой R4 является таким, как определено выше,
необязательно превращенное в ацилгалогенид, с амином формулы (6)
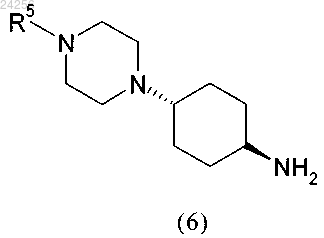
в которой R5 является таким, как определено выше,
с использованием гидроксида щелочного или щелочно-земельного металла в качестве основания и протонного растворителя с получением соединения формулы (8)
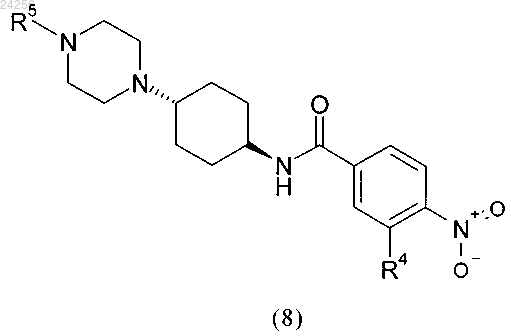
в которой R4 и R5 являются такими, как определено выше;
стадия 4: гидрирования соединения общей формулы (8), определенного выше, с получением соединения формулы (9)
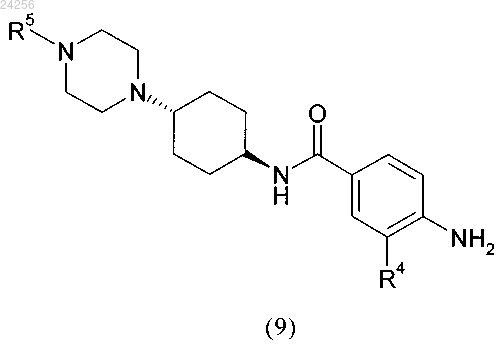
в которой R4 и R5 являются такими, как определено выше;
стадия 5: взаимодействия соединения формулы (9), определенного выше, с соединением формулы (10)
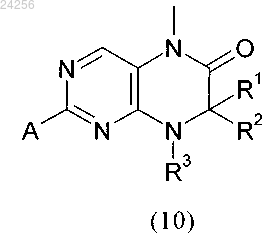
в которой R1, R2 и R3 являются такими, как определено выше, и А обозначает отщепляющуюся группу,
с получением соединения формулы (11)
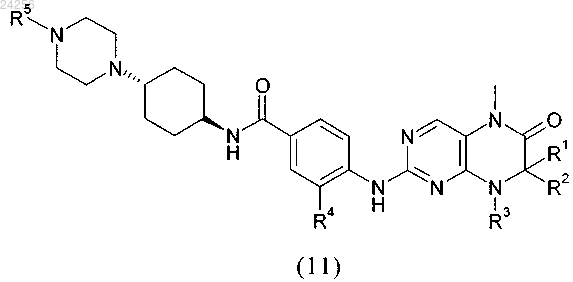
в которой R1-R5 являются такими, как определено выше.
9. Способ по п.3 или 8, характеризующийся тем, что катализатор на основе металла выбран из Pt/C или оксида платины(IV) (PtO2), предпочтительно оксида платины(IV) (PtO2).
10. Способ по п.3 или 8, в котором на стадии 1 растворитель выбран из
апротонного органического растворителя, который предпочтительно выбран из группы, включающей дихлорметан, ацетон, диметиловый эфир этиленгликоля, диглим, толуол, тетрагидрофуран (THF), более предпочтительно толуол или THF, наиболее предпочтительно толуол; или
спирта, который предпочтительно выбран из группы, включающей этанол, метанол, изопропанол, н-пропанол, н-бутанол и/или трет-бутанол, более предпочтительно этанол или метанол; или
смеси апротонного растворителя и спирта, предпочтительно смеси толуола и спирта, наиболее предпочтительно смеси толуол/этанол.
11. Способ по п.9, в котором соотношение толуол:спирт, предпочтительно толуол:этанол, находится в интервале 4-5:1.
12. Способ по любому из предыдущих пунктов, в котором полученные соединения могут находиться в форме их таутомеров, рацематов, энантиомеров, диастереоизомеров и их смесей и необязательно в форме их солей.
13. Способ по любому из предыдущих пунктов, характеризующийся тем, что катализатор на основе металла выбран из группы, включающей катализатор на основе Ni, катализатор на основе Pd или катализатор на основе Pt.
14. Способ по любому из предыдущих пунктов, характеризующийся тем, что катализатором на основе металла является Pt/C или оксид платины(IV) (PtO2).
Текст
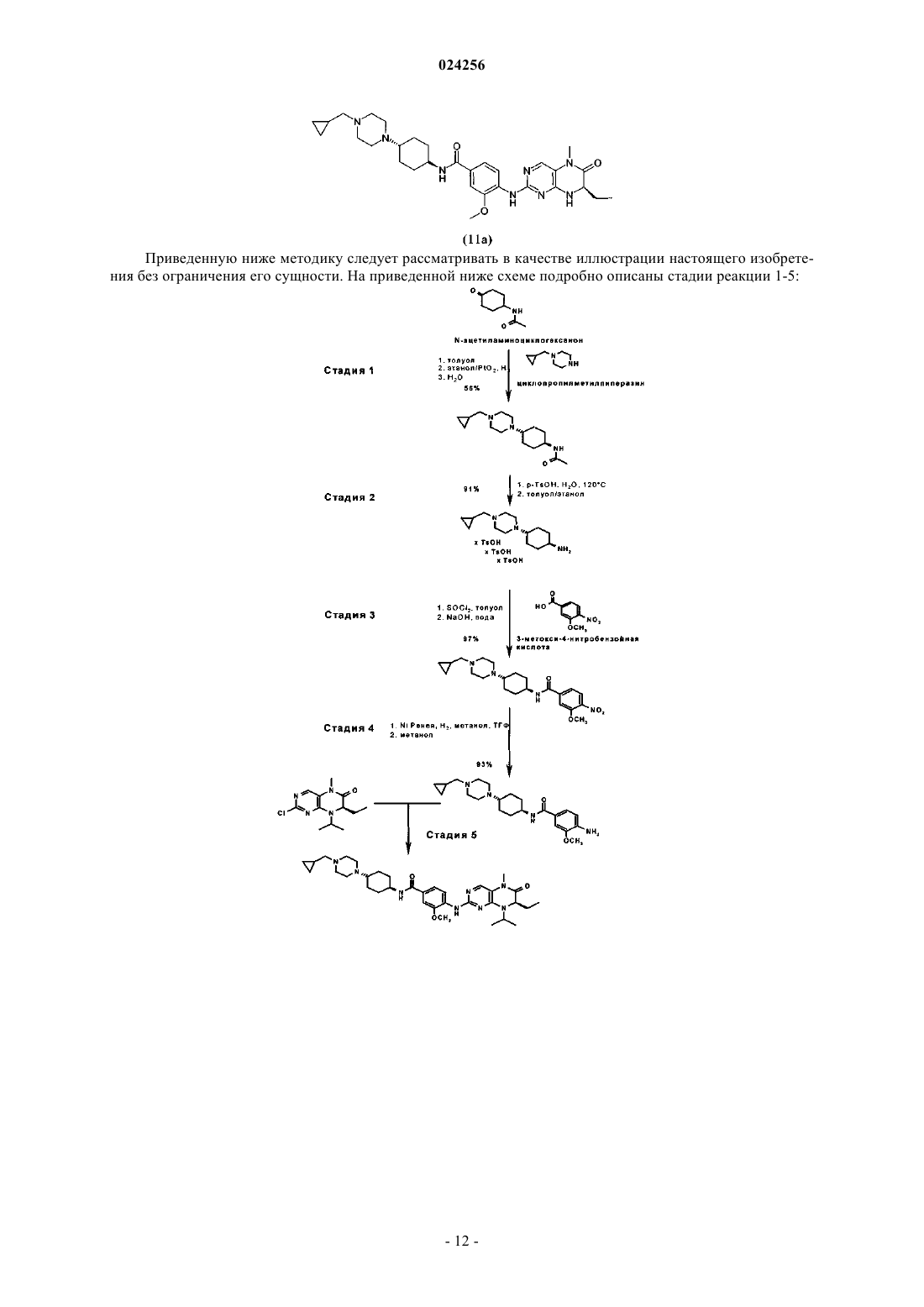
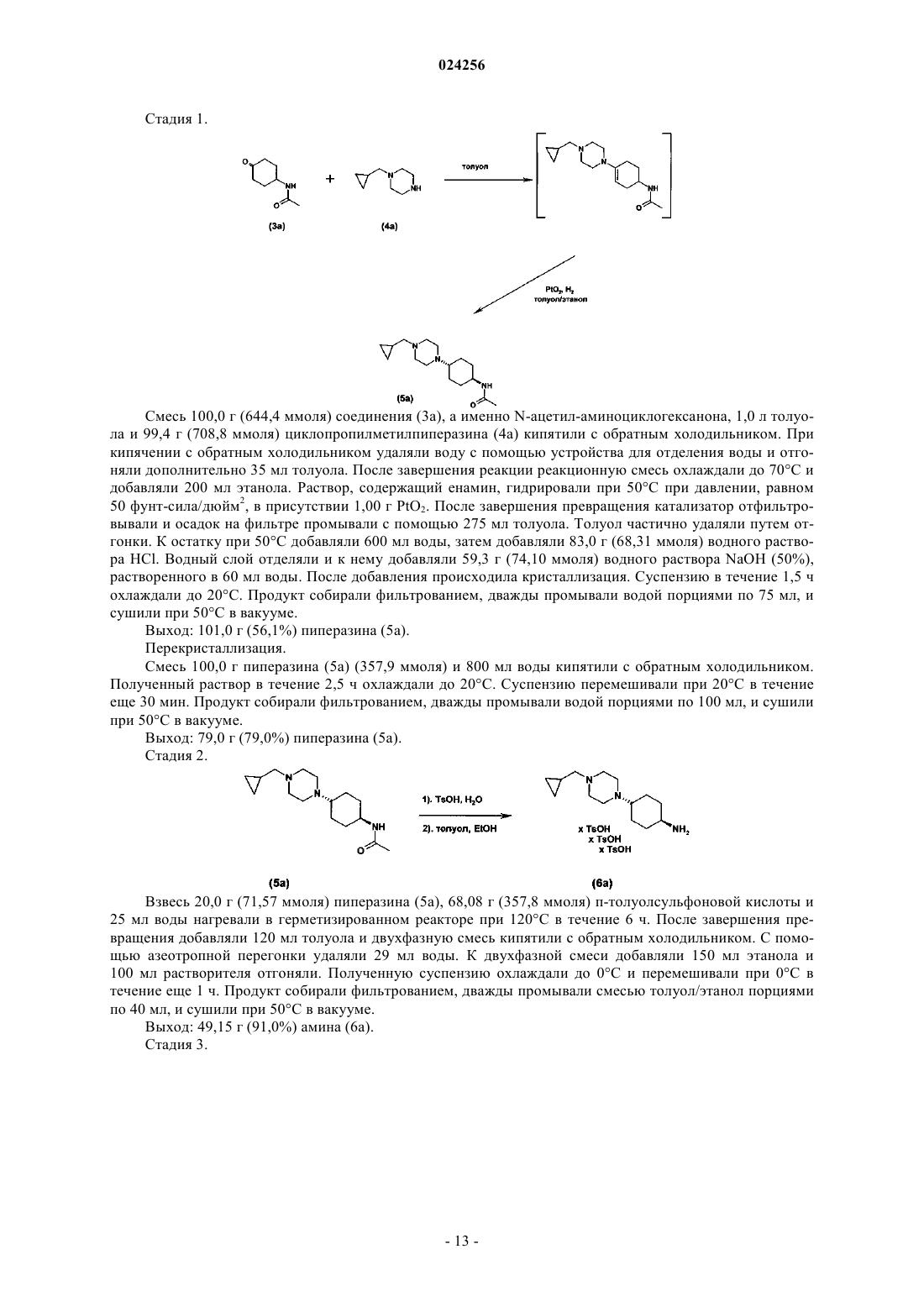
СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОПТЕРИДИНОНОВ И ИХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ Настоящее изобретение относится к улучшенному способу получения дигидроптеридинонов общей формулы (11), а также необходимых для этого промежуточных продуктов, где группы R1, R2,R3, R4 и R5 обладают значениями, указанными в формуле изобретения и описании:(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к способу получения дигидроптеридинонов общей формулы (11) в которой группы R1, R2, R3, R4 и R5 обладают значениями, указанными в формуле изобретения и описании, а также соответствующих промежуточных продуктов, необязательно в форме их таутомеров,рацематов, энантиомеров, диастереоизомеров и их смесей, и необязательно в форме их солей. Уровень техники Птеридинон и производные птеридинона известны в предшествующем уровне техники как активные вещества, обладающие антипролиферативной активностью, в особенности при использовании для лечения заболеваний, характеризующихся аномальной пролиферацией клеток, и действующие путем ингибирования polo-подобных киназ как регуляторов митоза, в особенности в случае если polo-подобной киназой является PLK-1, предпочтительно для лечения и/или предупреждения рака, инфекций, воспалительных и аутоиммунных заболеваний. Например, в WO 01/019825 А 1 раскрыты конкретные птеридиноны, для которых описано, что они являются активными ингибиторами циклинзависимых киназ (cdks) и киназ, опосредуемых фактором роста, и они применимы для лечения пролиферативных заболеваний и нарушений клеток, в особенности опухолей и вирусных заболеваний. В WO 03/020711 также раскрыто применение производных дигидроптеридинонов для лечения опухолевых заболеваний. Кроме того, WO 2006/018185A2 относится к применению дигидроптеридинонов для лечения рака. В предшествующем уровне техники также описан ряд способов получения птеридонов. Например, в WO 2004/076454A1 и WO 2006/018220 раскрыты конкретные дигидроптеридиноны,способы их получения и их применение. Несмотря на это, необходим улучшенный способ получения дигидроптеридинонов, в котором устранены описанные выше недостатки. Поэтому объектом настоящего изобретения является разработка способа, в соответствии с которым можно получить дигидроптеридиноны с высоким выходом и обладающие более высокой чистотой, который можно легко осуществить при крупномасштабном производстве. Подробное описание изобретения Настоящее изобретение относится к способу получения дигидроптеридинонов и соответствующих промежуточных продуктов. Согласно настоящему изобретению получаемые соединения общей формулы (11) являются следующими: в которой R1 и R2 независимо друг от друга обозначают водород или C1-C6-алкил;R3 обозначает водород или группу, выбранную из C1-C6-алкила и C3-C8-циклоалкила;R4 обозначает водород или группу, выбранную из -CN, гидроксигруппы, C1-C6-алкила,C1-C5-алкилоксигруппы и C1-C6-алкилтиогруппы;R5 обозначает C1-C6-алкил, C1-C4-алкил-C3-C8-циклоалкил или C3-C8-циклоалкил,необязательно в форме их таутомеров, рацематов, энантиомеров, диастереоизомеров и их смесей и необязательно в форме их солей. Способ, предлагаемый в настоящем изобретении, может быть одностадийным способом (стадия 1,или стадия 2, или стадия 3) или может быть многостадийным способом, включающим комбинацию стадий. Стадии способа и соединения, которые можно получить в соответствии со способом, предлагаемым в настоящем изобретении, являются такими, как указано ниже. Настоящее изобретение относится к способу (стадия 1) получения соединения формулы (5) в которой R5 обозначает C1-C6-алкил, C1-C4-алкил-C3-C10-циклоалкил или C3-C10-циклоалкил,характеризующемуся тем, что соединение формулы (3) в которой PG обозначает защитную группу,взаимодействует с соединением общей формулы (4) в которой R5 является таким, как определено выше,через промежуточный енамин, который гидрируют в присутствии катализатора на основе метала,такого как Ni, Pd, Pt, и растворителя или смеси растворителей. Предпочтительными катализаторами являются Pt/C или оксид платины(IV) (PtO2). Наиболее предпочтительным является оксид платины(IV)(PtO2). Растворителем предпочтительно является апротонный органический растворитель или спирт, или смесь апротонного органического растворителя и спирта. Особенно предпочтительно использовать смесь толуол/этанол. Настоящее изобретение также относится к способу (стадия 2) получения соединения формулы (6) в которой R5 является таким, как определено выше,характеризующемуся тем, что защитную группу PG в соединении общей формулы (5) в которой R5 и PG являются такими, как определено выше и ниже,удаляют путем гидролиза в кислой среде с использованием п-толуолсульфоновой кислоты (TsOH) в качестве ненуклеофильного кислотного реагента для отщепления защитной группы. Настоящее изобретение также относится к способу (стадия 3) получения соединения формулы (8)-2 024256 в которой R5 является таким, как определено выше, R4 обозначает водород или группу, выбранную из -CN, гидроксигруппы, C1-C6-алкила, C1-C5-алкилоксигруппы и C1-C6-алкилтиогруппы,характеризующемуся тем, что соединение общей формулы (7) в которой R5 является таким, как определено выше,с использованием гидроксида щелочного или щелочно-земельного металла, предпочтительно NaOH или KOH, в качестве основания и протонного растворителя, предпочтительно воды. Настоящее изобретение также относится к способу (стадия 1-стадия 5) получения соединения формулы (11) в которой R1-R5 являются такими, как определено выше,который включает следующие стадии: стадия 1: взаимодействия соединения формулы (3) в которой PG обозначает защитную группу,с соединением общей формулы (4) в которой R5 является таким, как определено выше, через промежуточный енамин, который гидрируют в присутствии катализатора на основе метала, предпочтительно катализатора на основе Pt, и растворителя или смеси растворителей; с получением соединения формулы (5) в которой R5 и PG являются такими, как определено выше и ниже; стадия 2: удаления у соединения формулы (5), определенного выше, защитной группы PG путем гидролиза в кислой среде с использованием п-толуолсульфоновой кислоты (TsOH) в качестве ненуклеофильного кислотного реагента для отщепления защитной группы,с получением соединения формулы (6) в которой R5 является таким, как определено выше; стадия 3: взаимодействия соединения общей формулы (7) в которой R5 является таким, как определено выше,с использованием гидроксида щелочного или щелочно-земельного металла, предпочтительно NaOH или KOH, в качестве основания и протонного растворителя, предпочтительно воды,с получением соединения формулы (8) в которой R4 и R5 являются такими, как определено выше; стадия 4: гидрирования соединения общей формулы (8), определенного выше, с получением соединения формулы (9) в которой R4 и R5 являются такими, как определено выше; стадия 5: взаимодействия соединения формулы (9), определенного выше, с соединением формулы в которой R1, R2 и R3 являются такими, как определено выше, и А обозначает отщепляющуюся группу,с получением соединения формулы (11) в которой R1-R5 являются такими, как определено выше. Настоящее изобретение также относится к способу получения соединения формулы (9) в которой R4 и R5 являются такими, как определено выше,с использованием способа стадии 1 и/или способа стадии 2 и/или способа стадии 3, определенных выше в настоящем изобретении. Настоящее изобретение также относится к способу получения соединения формулы (11) в которой R1-R5 являются такими, как определено выше,с использованием способа стадии 1 и/или способа стадии 2 и/или способа стадии 3, определенных выше в настоящем изобретении. Настоящее изобретение также относится к способу получения соединения формулы (11) в которой R1-R5 являются такими, как определено выше,с использованием соединения формулы (8) в которой R4 и R5 являются такими, как определено выше,где соединение формулы (8) получают с использованием способа стадии 1 и/или способа стадии 2 и/или способа стадии 3, определенных выше в настоящем изобретении; или с использованием соединения формулы (9) в которой R4 и R5 являются такими, как определено выше,где соединение формулы (9) получают с использованием способа стадии 1 и/или способа стадии 2 и/или способа стадии 3, определенных выше в настоящем изобретении. Настоящее изобретение также относится к способу (стадия 4) получения соединения формулы (9) в которой R4 и R5 являются такими, как определено выше,характеризующемуся тем, что гидрируют соединение общей формулы (8) в которой R4 и R5 являются такими, как определено выше,где соединение формулы (8) получают с использованием способа стадии 1 и/или способа стадии 2 и/или способа стадии 3, определенных выше в настоящем изобретении. Настоящее изобретение также относится к способу (стадия 5) получения соединения формулы (11) в которой R1-R5 являются такими, как определено выше,в котором соединение формулы (9) в которой R1, R2 и R3 являются такими, как определено выше, и А обозначает отщепляющуюся группу,где соединение формулы (9) получают с использованием способа стадии 1 и/или способа стадии 2 и/или способа стадии 3, определенных выше в настоящем изобретении. Определения использующихся терминов Термин "алкильные группы", включая алкильные группы, которые являются частью других групп,означает разветвленные или неразветвленные алкильные группы, содержащие от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода, наиболее предпочтительно от 1 до 4 атомов углерода,такиекак, например, метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил и додецил. Если не указано иное, указанные выше термины пропил, бутил, пентил, гексил, гептил, октил, нонил,децил и додецил включают все возможные изомерные формы. Например, термин пропил включает две изомерные группы, н-пропил и изопропил, термин бутил включает н-бутил, изобутил, втор-бутил и третбутил, термин пентил включает изопентил, неопентил и т.п. В указанных выше алкильных группах один или большее количество атомов водорода необязательно могут быть замещены другими группами. Например, эти алкильные группы могут быть замещены галогеном, предпочтительно фтором, хлором и бромом. Все атомы водорода алкильной группы необяза-7 024256 тельно могут быть замещены. Примерами "циклоалкильных групп" являются циклоалкильные группы, содержащие от 3 до 8 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, предпочтительно циклопропил, циклопентил или циклогексил, при этом каждая из указанных выше циклоалкильных групп также необязательно может содержать заместители, например ОН, NO2,CN, OMe, -OCHF2, -OCF3, -NH2 или галоген, предпочтительно фтор или хлор, C1-C10-алкил, предпочтительно C1-C5-алкил, предпочтительно C1-C3-алкил, более предпочтительно метил или этил,-О-C1-C3-алкил, предпочтительно -О-метил или -О-этил, -СООН, -СОО-C1-C4-алкил, предпочтительно СОО-метил или -СОО-этил, или -CONH2. особенно предпочтительными заместителями циклоалкильных групп являются =O, ОН, NH2, метил или F. Обычно термин "галоген" означает фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром, наиболее предпочтительно хлор."Отщепляющаяся группа А" означает отщепляющуюся группу, такую как, например, -О-метил, SCN, фтор, хлор, бром, йод, метансульфонил, этансульфонил, трифторметансульфонил или п-толуопсульфонил, предпочтительно хлор. Защитная группа "PG" означает защитную группу, такую как, например, метилкарбамат, этилкарбамат,2,2,2-трихлорэтилкарбамат,2-триметилсилилэтилкарбамат,2-хлорэтилкарбамат,третбутилкарбамат,винилкарбамат,аллилкарбамат,бензилкарбамат,п-метоксибензилкарбамат,N-формиламид, N-ацетиламид, N-трифторацетиламид, N-фенилацетиламид, N-бензоиламид и бензилоксикарбониламид. Другие защитные группы, пригодные для защиты аминогруппы, содержащейся в соединении формулы (5), описаны в публикации: Protective Groups in Organic Synthesis, Third Edition. Theodora W. Greene, Peter G.M. Wuts, 1999, John WileySons, Inc., Chapter 7, p. 494-653; Предпочтительные варианты осуществления настоящего изобретения Предпочтительные полученные соединения. В предпочтительном варианте осуществления R3-R5 являются такими, как определено выше в настоящем изобретении, и R1 и R2 независимо друг от друга обозначают водород или C1-C3-алкил. Более предпочтительно, если R1 и R2 независимо друг от друга обозначают водород, метил или этил. Наиболее предпочтительно, если R1 обозначает водород и R2 обозначает этил. В предпочтительном варианте осуществления R1, R2, R4 и R5 являются такими, как определено выше в настоящем изобретении, и R3 предпочтительно обозначает водород или группу, выбранную из группы, включающей C1-C3-алкил и C3-C6-циклоалкил. Более предпочтительно, если R3 обозначает метил, этил, пропил или изопропил. Наиболее предпочтительно, если заместитель R3 обозначает изопропил. В предпочтительном варианте осуществления R1, R2, R3 и R5 являются такими, как определено выше в настоящем изобретении, и R4 предпочтительно обозначает водород или группу, выбранную из группы,включающейC1-C3-алкилтиогруппу. Более предпочтительно, если R4 обозначает, метоксигруппу, этоксигруппу, метилтиогруппу и этилтиогруппу. Наиболее предпочтительно, если заместитель R4 обозначает метоксигруппу. В предпочтительном варианте осуществления R1-R4 являются такими, как определено выше в настоящем изобретении, и R5 предпочтительно обозначает C1-C4-алкил, C1-C2-алкил-C3-C6-циклоалкил илиC3-C6-циклоалкил. Более предпочтительно, если R5 обозначает метил, этил, пропил или -СН 2-циклопропил. Наиболее предпочтительно, если заместитель R обозначает -СН 2-циклопропил. Особенно предпочтительные соединения формулы (11), которые можно получить в соответствии со способом, предлагаемым в настоящем изобретении, содержат особенно предпочтительные группы R1, R2,R3, R4 и R5, которые раскрыты в документах предшествующего уровня техники WO 2006/018220A2 иWO 2004/076454A1, полное раскрытие обоих документов соответственно включено в содержание настоящего описания в качестве ссылки. Все группы, указанные в определениях для R1-R5, необязательно могут являться разветвленными и/или замещенными. В контексте настоящего изобретения соединения общей формулы (5), (6), (8), (9) или (11), полученные в соответствии с предлагаемым способом, необязательно могут находиться в форме их таутомеров,рацематов, энантиомеров, диастереоизомеров и их смесей, и необязательно в форме их солей. Соединения общей формулы (11) также включают их физиологически приемлемые или фармакологически приемлемые соли, сольваты, гидраты или полиморфные формы. Соединения формулы (5), (6), (8) и (9) представляют собой важные промежуточные продукты для получения соединений формулы (11). Соединения, получаемые в соответствии с настоящим изобретением, можно получить по методикам синтеза, описанным ниже в настоящем изобретении, где заместители в общих формулах (3)-(11) обладают значениями, приведенными выше в настоящем изобретении. В случае, если объединяют несколько стадий, например 2 стадии, продукт, полученный на каждой стадии, можно очистить по известным методикам, предпочтительно путем перекристаллизации, или полученный продукт можно использовать на следующей стадии без обработки. Предпочтительные методики получения. Стадия 1. В соответствии со стадией 1 соединение формулы (3) взаимодействует с соединением формулы (4) и получают соединение формулы (5) (см. диаграмму 1). Соединение (3) и соединение (4) имеются в продаже или их можно получить по методикам, известным из химической литературы. Диаграмма 1 На стадии 1 соединение (3) - аминоциклогексанон, в котором атом азота защищен защитной группой PG, взаимодействует с гетероциклическим соединением общей формулы (4) в подходящем растворителе или смеси растворителей. Реакцию предпочтительно проводят при кипячении с обратным холодильником. Затем полученный енамин гидрируют с использованием катализатора на основе металла,предпочтительно катализатора на основе Pt, предпочтительно выбранного из группы, включающей Pt/C и оксид платины(IV) (PtO2), наиболее предпочтительным является оксид платины(IV) (PtO2), в подходящем растворителе, таком как THF, толуол, этанол, метанол, этилацетат или их смесь, при подходящем давлении водорода, например равном от 30 до 60 фунт-сила/дюйм 2. Реакцию обычно проводят при температуре выше комнатной температуры, например в диапазоне от 35 до 65 С. Затем катализатор удаляют. Продукт реакции получают в форме смеси цис- и транс-изомера (свободное основание) и его можно обработать обычным образом (например, путем добавления воды и последующего разбавления кислотой,такой как хлористоводородная кислота). Цис- и транс-соединения разделяют путем кристаллизации из воды. Например, неочищенный продукт можно перекристаллизовать из подходящего растворителя для получения чистого транс-продукта. В способе, известном из предшествующего уровня техники, например описанном в WO 2006/018220, восстановительное аминирование енамина проводят с использованием NaBH4 в качестве источника водорода и затем добавляют хлористоводородную кислоту. Однако использование борогидрида натрия может быть неблагоприятным, что может привести к негомогенности реакции способа с низким выходом и образованием побочных продуктов. В отличие от способа предшествующего уровня, на стадии 1, предлагаемой в настоящем изобретении, используют методику гетерогенного катализа с применением водорода. Согласно изобретению установлено, что подходящим катализатором является катализатор на основе металла, предпочтительно катализатор на основе Pt. Предпочтительными катализаторами являются Pt/C и оксид платины(IV)(PtO2). Наиболее предпочтительным является оксид платины(IV) (PtO2). Растворителем предпочтительно является апротонный органический растворитель, например дихлорметан, ацетон, этиленгликоль диметиловый эфир, диглим, толуол, тетрагидрофуран (THF), предпочтительно толуол или THF, наиболее предпочтительно толуол. Предпочтительным растворителем также является спирт, такой как этанол, метанол, изопропанол, н-пропанол, н-бутанол и/или трет-бутанол, наиболее предпочтительно этанол или метанол. Более предпочтительно, если растворителем является смесь апротонного растворителя и спирта. Предпочтительно, если растворителем является смесь толуола и спирта. Особенно предпочтительно использовать смесь толуол/этанол. Соотношение толуол/спирт в смеси, предпочтительно соотношение толуол/этанол, предпочтительно устанавливают составляющим примерно 4-5:1. Стадия 1, предлагаемая в настоящем изобретении, обеспечивает значительно улучшенное соотношение транс-соединение:циссоединение, которое составляет примерно 3:1. Поэтому обеспечивается стереоселективное восстановительное аминирование. Наилучшие результаты обеспечиваются при использовании оксида платины(IV) в качестве катализатора в смеси толуол/этанол в соотношении, предпочтительно находящемся в диапазоне примерно 4-5:1. Таким образом, можно обеспечить выход выделенного продукта 50% (транс-изомер). Также можно провести гидрирование енамина с использованием других катализаторов, таких как Pd/C или Ni Ренея, соотношения транс:цис приведены в представленной ниже таблице: Стадия 2. В соответствии со стадией 2 у соединения (5) полученного на стадии 1, удаляют защитную группу и получают соединение (6) (см. диаграмму 2). Диаграмма 2 Отщепление защитной группы PG является реакцией, хорошо известной из предшествующего уровня техники. Обычно защитной группой PG аминогруппы может являться любая подходящая защитная группа аминогруппы, известная в данной области техники. Типичные примеры защитных групп описаны выше и ими являются такие группы, как трет-бутоксикарбонил (Boc), ацетил и формил. Стадию отщепления защитной группы атома азота обычно проводят по методикам, хорошо известным из предшествующего уровня техники. Обычно используют гидролиз в кислой среде с помощью органической или неорганической кислоты, такой как HCl, H2SO4, ТФК (трифторуксусная кислота), АсОН, MeSO3H или TsOH, в ряде протонных или полярных апротонных растворителей, таких как спирты, простые эфиры или дихлорметан (ДХМ). Однако в способе предшествующего уровня техники удаление защитной группы обычно проводят с использованием хлористоводородной кислоты при кипячении с обратным холодильником в течение нескольких часов. Полученный амин выделяют в виде его соли с HCl. Недостатком этого способа является возможное образование примесей, поскольку хлористоводородная кислота может вступать в реакцию с заместителями, которые содержит гетероатом. На стадии 2 способа, предлагаемого в настоящем изобретении, устраняется образование такой примеси. Гидролиз в кислой среде проводят с использованием п-толуолсульфоновой кислоты (TsOH) в качестве ненуклеофильного кислотного реагента для отщепления защитной группы. Ненуклеофильный кислотный реагент такого типа не вступает в реакцию ни с какими заместителями и не происходит разложение соединения при нежелательных побочных реакциях. Предпочтительными защитными группами,использующимися на стадии 2, предлагаемой в настоящем изобретении, являются ацетильная, формильная, трифторацетильная, этоксикарбонильная, трет-бутоксикарбонильная, бензилоксикарбонильная, бензильная, метоксибензильная или 2,4-диметоксибензильная группа. Поэтому продукт, полученный на стадии 2, является кристаллическим тритозилатом, который обычно получают с хорошим выходом. Стадия 3. В соответствии со стадией 3 соединение формулы (6), полученное на стадии 2, взаимодействует с соединением общей формулы (7) и получают соединение общей формулы (8) (см. диаграмму 3). Диаграмма 3 На стадии 3 бензойную кислоту (7) сначала необязательно превращенную в ацилгалогенид, взаимодействует с амином формулы (6) с использованием основания и растворителя. Реакцию обычно проводят при температуре выше комнатной температуры, предпочтительно в диапазоне от 35 до 75 С. Продукт реакции (соединение (8 осаждается и его обрабатывают обычным образом. Полученное соединение (6) можно очистить с помощью хроматографии или с помощью кристаллизации, или использовать в качестве неочищенного продукта на следующей стадии синтеза, стадии 4. В способе предшествующего уровня техники в качестве основания обычно используютN-этилдиизопропиламин (основание Хюнига) и в качестве растворителя обычно используют THF. Согласно изобретению установлено, что эффективным является использование в качестве основания гидроксида щелочного или щелочно-земельного металла, такого как NaOH или KOH, вместо использования в качестве основания N-этилдиизопропиламина, и протонного растворителя, такого как вода, вместо апротонного растворителя THF. Согласно изобретению неожиданно оказалось, что выход может увеличиться от 83 до 97%. Стадия 4. В соответствии со стадией 4 соединение формулы (8), полученное на стадии 3, гидрируют и получают соединение формулы (9) (см. диаграмму 4). Эту стадию можно провести по методикам, известным из химической литературы. На стадии 4 соединение формулы (8) гидрируют с использованием катализатора в растворителе при подходящем давлении водорода (20-100 фунт-сила/дюйм 2), предпочтительно в диапазоне от 30 до 60 фунт-сила/дюйм 2. Реакцию гидрирования обычно проводят при температуре выше комнатной температуры, например в диапазоне от 40 до 70 С. Катализатором может являться любой катализатор, известный из предшествующего уровня техники, особенно предпочтительным является никель Ренея. После завершения реакции катализатор удаляют. Полученное соединение формулы (9) можно очистить или использовать на следующей стадии без дополнительной очистки. Стадия 5. В соответствии со стадией 5 реакцию соединения формулы (9), полученного на стадии 4, с получением соединения формулы (11) (диаграмма 5) можно провести по методикам, известным из химической литературы, например описанным в WO 2009/019205, WO 2007/090844, WO 2006/021378, WO 2006/018220 и WO 2004/076454. Диаграмма 5 Например, на стадии 5 соединение формулы (10) и соединение формулы (9) перемешивают с кислотой, например хлористоводородной кислотой или п-толуолсульфоновой кислотой, в растворителе, например этаноле, пропаноле, бутаноле, пентаноле, 4-метил-2-пентаноле, при кипячении с обратным холодильником в течение нескольких часов. Осадившийся продукт (11) отделяют и обрабатывают обычным образом, необязательно промывают водой и сушат. Полученное соединение (11) можно очистить с помощью хроматографии или с помощью кристаллизации. Разумеется, любую из описанных выше стадий можно использовать по отдельности или две или несколько стадий можно объединить и получить необходимые продукты реакций. Оптимальные условия проведения реакций и длительности проведения каждой отдельной стадии могут меняться в зависимости от конкретных использующихся реагентов. Если не указано иное, растворители, температуры и другие условия проведения реакций может легко выбрать специалист с общей подготовкой в данной области техники. Конкретные методики описаны в разделе "Примеры синтеза". Обычно за протеканием реакции при необходимости можно следить с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Промежуточные продукты и продукты можно очистить путем кристаллизации. Если не указано иное, то исходные вещества и реагенты имеются в продаже или их может получить специалист с общей подготовкой в данной области техники из имеющихся в продаже веществ по методикам, описанным в химической литературе. Примеры синтеза. Аббревиатуры:p-TsOH - п-толуолсульфоновая кислота. Синтез соединения (11 а). Для полноты ниже в настоящем изобретении подробно описан способ получения соединения общей формулы (11 а) Приведенную ниже методику следует рассматривать в качестве иллюстрации настоящего изобретения без ограничения его сущности. На приведенной ниже схеме подробно описаны стадии реакции 1-5: Смесь 100,0 г (644,4 ммоля) соединения (3 а), а именно N-ацетил-аминоциклогексанона, 1,0 л толуола и 99,4 г (708,8 ммоля) циклопропилметилпиперазина (4 а) кипятили с обратным холодильником. При кипячении с обратным холодильником удаляли воду с помощью устройства для отделения воды и отгоняли дополнительно 35 мл толуола. После завершения реакции реакционную смесь охлаждали до 70 С и добавляли 200 мл этанола. Раствор, содержащий енамин, гидрировали при 50 С при давлении, равном 50 фунт-сила/дюйм 2, в присутствии 1,00 г PtO2. После завершения превращения катализатор отфильтровывали и осадок на фильтре промывали с помощью 275 мл толуола. Толуол частично удаляли путем отгонки. К остатку при 50 С добавляли 600 мл воды, затем добавляли 83,0 г (68,31 ммоля) водного раствора HCl. Водный слой отделяли и к нему добавляли 59,3 г (74,10 ммоля) водного раствора NaOH (50%),растворенного в 60 мл воды. После добавления происходила кристаллизация. Суспензию в течение 1,5 ч охлаждали до 20 С. Продукт собирали фильтрованием, дважды промывали водой порциями по 75 мл, и сушили при 50 С в вакууме. Выход: 101,0 г (56,1%) пиперазина (5 а). Перекристаллизация. Смесь 100,0 г пиперазина (5 а) (357,9 ммоля) и 800 мл воды кипятили с обратным холодильником. Полученный раствор в течение 2,5 ч охлаждали до 20 С. Суспензию перемешивали при 20 С в течение еще 30 мин. Продукт собирали фильтрованием, дважды промывали водой порциями по 100 мл, и сушили при 50 С в вакууме. Выход: 79,0 г (79,0%) пиперазина (5 а). Стадия 2. Взвесь 20,0 г (71,57 ммоля) пиперазина (5 а), 68,08 г (357,8 ммоля) п-толуолсульфоновой кислоты и 25 мл воды нагревали в герметизированном реакторе при 120 С в течение 6 ч. После завершения превращения добавляли 120 мл толуола и двухфазную смесь кипятили с обратным холодильником. С помощью азеотропной перегонки удаляли 29 мл воды. К двухфазной смеси добавляли 150 мл этанола и 100 мл растворителя отгоняли. Полученную суспензию охлаждали до 0 С и перемешивали при 0 С в течение еще 1 ч. Продукт собирали фильтрованием, дважды промывали смесью толуол/этанол порциями по 40 мл, и сушили при 50 С в вакууме. Выход: 49,15 г (91,0%) амина (6 а). Стадия 3. К суспензии 11,5 г (58,36 ммоля) 3-метокси-4-нитробензойной кислоты (соединение (7 а в 82 мл толуола добавляли 116 мкл пиридина и кипятили с обратным холодильником. При кипячении с обратным холодильником в течение 30 мин добавляли 7,60 г (63,88 ммоля) тионилхлорида, растворенного в 38 мл толуола. Смесь перемешивали при кипячении с обратным холодильником в течение еще 1 ч. После завершения реакции полученный раствор при 60 С добавляли к смеси 40,0 г амина (6 а) (53,05 ммоля),74 мл воды и 247 ммолей NaOH. В ходе добавления сразу происходило осаждение продукта. Суспензию в течение 1 ч охлаждали до 20 С и перемешивали при 20 С в течение еще 1 ч. Продукт собирали фильтрованием и дважды промывали водой порциями по 100 мл. Продукт сушили при 45 С до постоянной массы. Выход: 21,49 г (97%) амида (8 а). Перекристаллизация. 10,0 г (24,0 ммоля) амида (8 а) при кипячении с обратным холодильником растворяли в 60 мл этанола. Раствор охлаждали до 20 С. Суспензию перемешивали при 20 С в течение еще 1 ч. Продукт собирали фильтрованием и промывали с помощью 15 мл этанола. Продукт сушили при 45 С до постоянной массы. Выход: 9,09 г (91%) амида (8 а). Стадия 4 (в соответствии с методикой предшествующего уровня техники). 20,0 г (48,02 моля) амида (8 а) растворяли в смеси 80 мл метанола и 100 мл тетрагидрофурана. После добавления 20 г никеля Ренея смесь гидрировали при 60 С и давлении, равном 50 фунт-сила/дюйм 2. После завершения превращения катализатор отфильтровывали и осадок на фильтре промывали с помощью 40 мл метанола. 140 мл Растворителя удаляли в вакууме. К остатку добавляли 140 мл метанола. Суспензию кипятили с обратным холодильником до получения прозрачного раствора. Раствор охлаждали до 2 С. Полученную суспензию перемешивали в течение еще 1 ч. Продукт собирали фильтрованием и промывали с помощью 60 мл метанола. Продукт сушили при 60 С до постоянной массы. Выход: 17,30 г (93,0%) анилина (9 а). Стадия 5 (в соответствии с методикой, описанной в WO 2006/018220). Раствор 23 г (59,5 ммоля) соединения (9 а), 16,8 г (62,5 ммоля) соединения (10 а) и 28,3 г (149 ммолей) гидрата пара-толуолсульфоновой кислоты в 350 мл 2-метил-4-пентанола кипятили с обратным холодильником с использованием устройства для отделения воды в течение22 ч. После добавления 1 г соединения (10 а) смесь кипятили с обратным холодильником в течение еще 2 ч. 300 мл Растворителя отгоняли и вязкому маслу давали охладиться до 60 С. Добавляли 300 мл метиленхлорида и 300 мл деминера- 14024256 лизованной воды и значение pH повышали до 9 путем добавления примерно 20 мл 10 н. раствора гидроксида натрия. Органическую фазу дважды промывали деминерализованной водой и сушили над сульфатом натрия. Растворитель выпаривали при пониженном давлении и остаток при 65 С растворяли в 200 мл этилацетата. Смеси давали медленно охладиться до 20 С, осадок фильтровали с отсасыванием и промывали холодным этилацетатом. После сушки при 60 С в вакуумном сушильном шкафу получали 24,4 г продукта (11a) (Тпл (температура плавления) = 182 С, ДСК (дифференциальная сканирующая калориметрия): 10 К/мин, дополнительные эндотермические эффекты на диаграмме ДСК до плавления). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (8)R4 обозначает водород или группу, выбранную из -CN, гидроксигруппы, C1-C6-алкила,C1-C5-алкилоксигруппы и C1-C6-алкилтиогруппы; характеризующийся тем, что соединение общей формулы (7) в которой R5 является таким, как определено выше,с использованием гидроксида щелочного или щелочно-земельного металла в качестве основания и протонного растворителя. 2. Способ по п.1, характеризующийся тем, что соединение формулы (6) получают путем удаления защитной группы PG в соединении общей формулы (5) путем гидролиза в кислой среде с использованием п-толуолсульфоновой кислоты (TsOH). 3. Способ по п.2, характеризующийся тем, что соединение формулы (5) получают путем взаимодействия соединения формулы (3) в которой PG обозначает защитную группу,с соединением общей формулы (4) через промежуточный енамин, который гидрируют в присутствии катализатора на основе метала и растворителя или смеси растворителей. 4. Способ по любому из пп.1-3, в котором превращенное в ацилгалогенид соединение формулы (7) взаимодействует с амином формулы (6). 5. Способ по любому из пп.1-4, в котором используемые основания, гидроксид щелочного или щелочно-земельного металла представляют собой NaOH или KOH. 6. Способ получения соединения формулы (9) в котором соединение общей формулы (8) в которой R4 и R5 являются такими, как определено выше,гидрируют, характеризующийся тем, что соединение формулы (8) получают с использованием способа по любому из предыдущих пп.1-5. 7. Способ получения соединения формулы (11)- 16024256 в которой R1 и R2 независимо друг от друга обозначают водород или C1-C6-алкил;R3 обозначает водород или группу, выбранную из C1-C6-алкила и C3-C8-циклоалкила; в которой R1, R2 и R3 являются такими, как определено выше, и А обозначает отщепляющуюся группу,характеризующийся тем, что соединение формулы (9) получают с использованием способа по п.6. 8. Способ получения соединения формулы (11) в которой R1-R5 являются такими, как определено выше,который включает следующие стадии: стадия 1: взаимодействия соединения формулы (3) в которой PG обозначает защитную группу,с соединением общей формулы (4) в которой R5 является таким, как определено выше,через промежуточный енамин, который гидрируют в присутствии катализатора на основе метала и растворителя или смеси растворителей, с получением соединения формулы (5) в которой R5 и PG являются такими, как определено выше и ниже; стадия 2: удаления у соединения формулы (5), определенного выше, защитной группы PG путем гидролиза в кислой среде с использованием п-толуолсульфоновой кислоты (TsOH) с получением соединения формулы (6) в которой R5 является таким, как определено выше; стадия 3: взаимодействия соединения общей формулы (7) в которой R5 является таким, как определено выше,с использованием гидроксида щелочного или щелочно-земельного металла в качестве основания и протонного растворителя с получением соединения формулы (8) в которой R4 и R5 являются такими, как определено выше; стадия 4: гидрирования соединения общей формулы (8), определенного выше, с получением соединения формулы (9) в которой R4 и R5 являются такими, как определено выше; стадия 5: взаимодействия соединения формулы (9), определенного выше, с соединением формулы в которой R1, R2 и R3 являются такими, как определено выше, и А обозначает отщепляющуюся группу,с получением соединения формулы (11)- 18024256 в которой R1-R5 являются такими, как определено выше. 9. Способ по п.3 или 8, характеризующийся тем, что катализатор на основе металла выбран из Pt/C или оксида платины(IV) (PtO2), предпочтительно оксида платины(IV) (PtO2). 10. Способ по п.3 или 8, в котором на стадии 1 растворитель выбран из апротонного органического растворителя, который предпочтительно выбран из группы, включающей дихлорметан, ацетон, диметиловый эфир этиленгликоля, диглим, толуол, тетрагидрофуран (THF),более предпочтительно толуол или THF, наиболее предпочтительно толуол; или спирта, который предпочтительно выбран из группы, включающей этанол, метанол, изопропанол,н-пропанол, н-бутанол и/или трет-бутанол, более предпочтительно этанол или метанол; или смеси апротонного растворителя и спирта, предпочтительно смеси толуола и спирта, наиболее предпочтительно смеси толуол/этанол. 11. Способ по п.9, в котором соотношение толуол:спирт, предпочтительно толуол:этанол, находится в интервале 4-5:1. 12. Способ по любому из предыдущих пунктов, в котором полученные соединения могут находиться в форме их таутомеров, рацематов, энантиомеров, диастереоизомеров и их смесей и необязательно в форме их солей. 13. Способ по любому из предыдущих пунктов, характеризующийся тем, что катализатор на основе металла выбран из группы, включающей катализатор на основе Ni, катализатор на основе Pd или катализатор на основе Pt. 14. Способ по любому из предыдущих пунктов, характеризующийся тем, что катализатором на основе металла является Pt/C или оксид платины(IV) (PtO2).
МПК / Метки
МПК: C07D 475/00, A61K 31/525
Метки: получения, дигидроптеридинонов, промежуточных, продуктов, способ
Код ссылки
<a href="https://eas.patents.su/20-24256-sposob-polucheniya-digidropteridinonov-i-ih-promezhutochnyh-produktov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения дигидроптеридинонов и их промежуточных продуктов</a>
Предыдущий патент: Синтез ингибиторов тирозинкиназы брутона
Следующий патент: Способ активации целлюлозы
Случайный патент: Крыша транспортного средства, по меньшей мере, с одним люком