Средство, обладающее свойством формировать клеточный иммунитет против mycobacterium tuberculosis h37 rv, способ получения его (варианты), рекомбинантный штамм и средство для диагностики туберкулеза
Формула / Реферат
1. Рекомбинантный штамм 2-9XL Acinetobacter johnsonii VKPM-9312 - продуцент видоспецифического гликопротеинового туберкулезного комплекса M. tuberculosis Н37 Rv (ТБ-антигена), депонирован в ВКПМ ФГУП ГосНИИГенетика.
2. Способ получения видоспецифического гликопротеинового туберкулезного комплекса Mycobacterium tuberculosis H37 Rv (ТБ-антигена), характеризующийся тем, что культуру рекомбинантного штамма 2-9XL Acinetobacter johnsonii выращивают на питательной среде при 32°С в течение 2-3 суток, смывают физиологическим раствором, полученную суспензию бактерий центрифугируют, осадок суспендируют в воде при +4°С, обрабатывают раствором NaOH до рН 6,0-9,0, через 15-16 ч полученную суспензию центрифугируют, осадок подвергают повторной процедуре обработки раствором NaOH, а надосадочную жидкость, содержащую растворенную капсулу бактерий штамма 2-9 XL, нейтрализуют 0,5 N раствором ТХУ до рН 6,0, центрифугируют, к надосадочной жидкости добавляют 0,5 N раствор ТХУ до рН 3,0-3,5, раствор выдерживают 15-16 ч до получения комплекса ТБ-антигена, при этом с порцией осадка, повторно обработанного раствором NaOH, проводят нейтрализацию раствором ТХУ с вышеуказанной последовательностью, 1 и 2 растворы с комплексом ТБ-антигена, выпавшим после обработки ТХУ, центрифугируют полученные осадки, содержащие ТБ-антиген, растворяют в PBS-буфере, растворы объединяют и подвергают очистке путем фракционирования гель-фильтрацией на Сефадексе G-200 или с помощью ионообменной хроматографии, элюаты содержат очищенный ТБ-антиген с молекулярной массой от 55,0 до 75,0 кДа и наличием углеводов от 20 до 50%.
3. Способ получения видоспецифического гликопротеинового туберкулезного комплекса Mycobacterium tuberculosis H37 Rv (ТБ-антигена), характеризующийся тем, что культуру рекомбинантного штамма 2-9XL Acinetobacter johnsonii выращивают на питательной среде при 32°С в течение 3 суток, смывают физиологическим раствором, полученную суспензию бактерий центрифугируют, осадок суспендируют в воде при +4°С, обрабатывают раствором NaOH до рН 6,0-9,0, через 15-16 ч полученную суспензию центрифугируют, осадок подвергают повторной процедуре обработки раствором NaOH, а надосадочную жидкость, содержащую растворенную капсулу бактерий штамма 2-9 XL, нейтрализуют 0,5 N раствором ТХУ до рН 6,0, добавляют сульфат аммония до 30% насыщения, выдерживают при +4°С, центрифугируют, к надосадочной жидкости добавляют сульфат аммония до 100% насыщения, выдерживают при +4°С, при этом с порцией осадка повторно обработанного раствором NaOH проводят нейтрализацию с помощью ТХУ и осаждения сульфатом аммония в вышеуказанной последовательности, два осадка, полученные после 100% насыщения сульфатом аммония, растворяют в PBS буфере рН 7,0, диализируют против большого объема PBS буфера, сконцентрированные растворы, содержащие ТБ-антиген, объединяют и подвергают очистке путем фракционирования гель-фильтрацией на Сефадексе G-200 или с помощью ионообменной хроматографии, элюаты содержат очищенный ТБ-антиген с молекулярной массой от 55,0 до 75,0 кДа и наличием углеводов от 20 до 50%.
4. Средство для формирования В- и Т-клеточного иммунитета против Mucobacterium tuberculosis H37 Rv, содержащее видоспецифический гликопротеиновый туберкулезный комплекс (ТБ-антиген) Mycobacterium tuberculosis H37 Rv, продуцируемый штаммом 2-9XL Acinetobacter johnsonii, охарактеризованным в п.1.
5. Средство для диагностики туберкулеза, содержащее видоспецифический гликопротеиновый туберкулезный комплекс (ТБ-антигена) Mycobacterium tuberculosis H37 Rv, полученный способом по п.2.
Текст
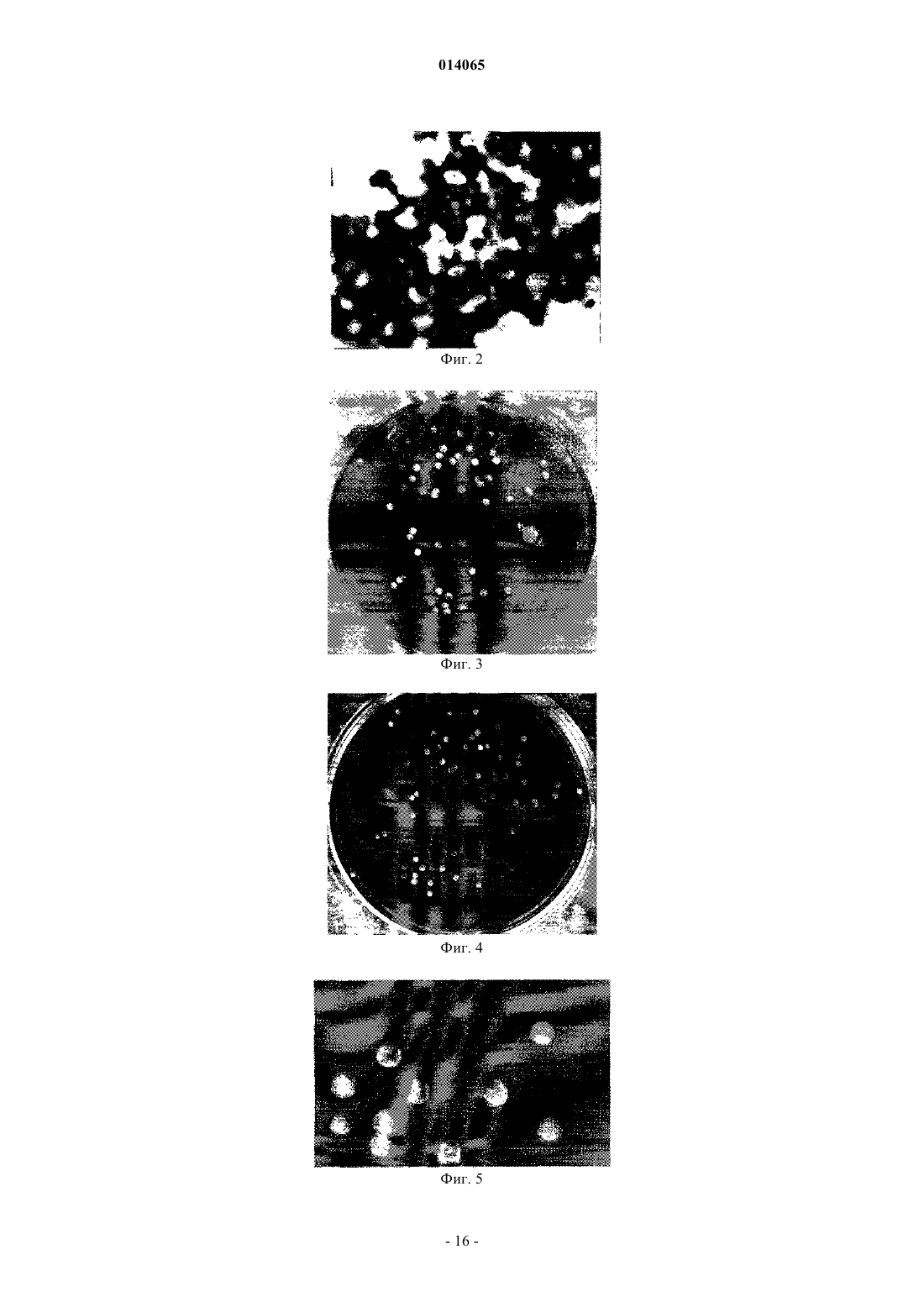
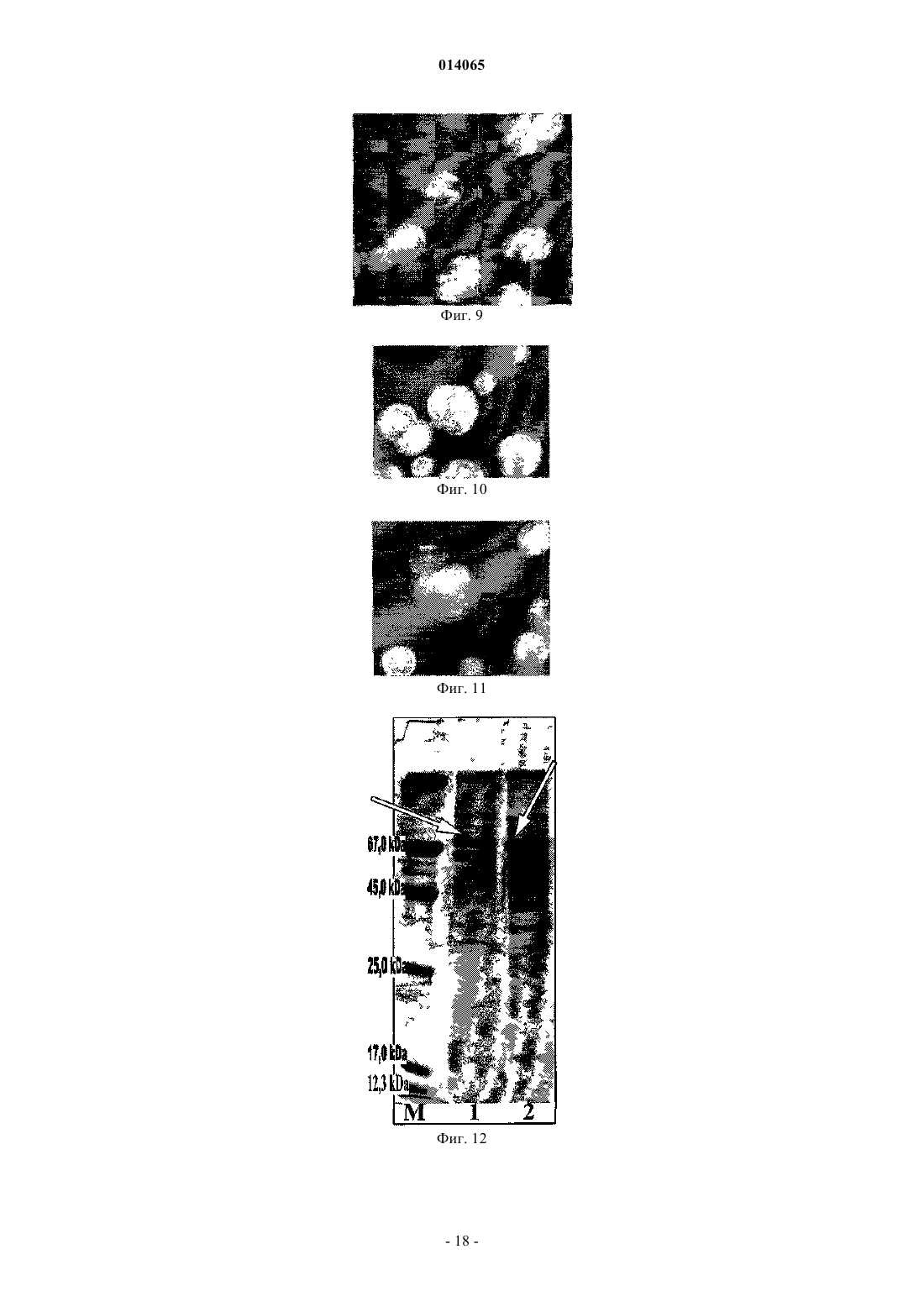
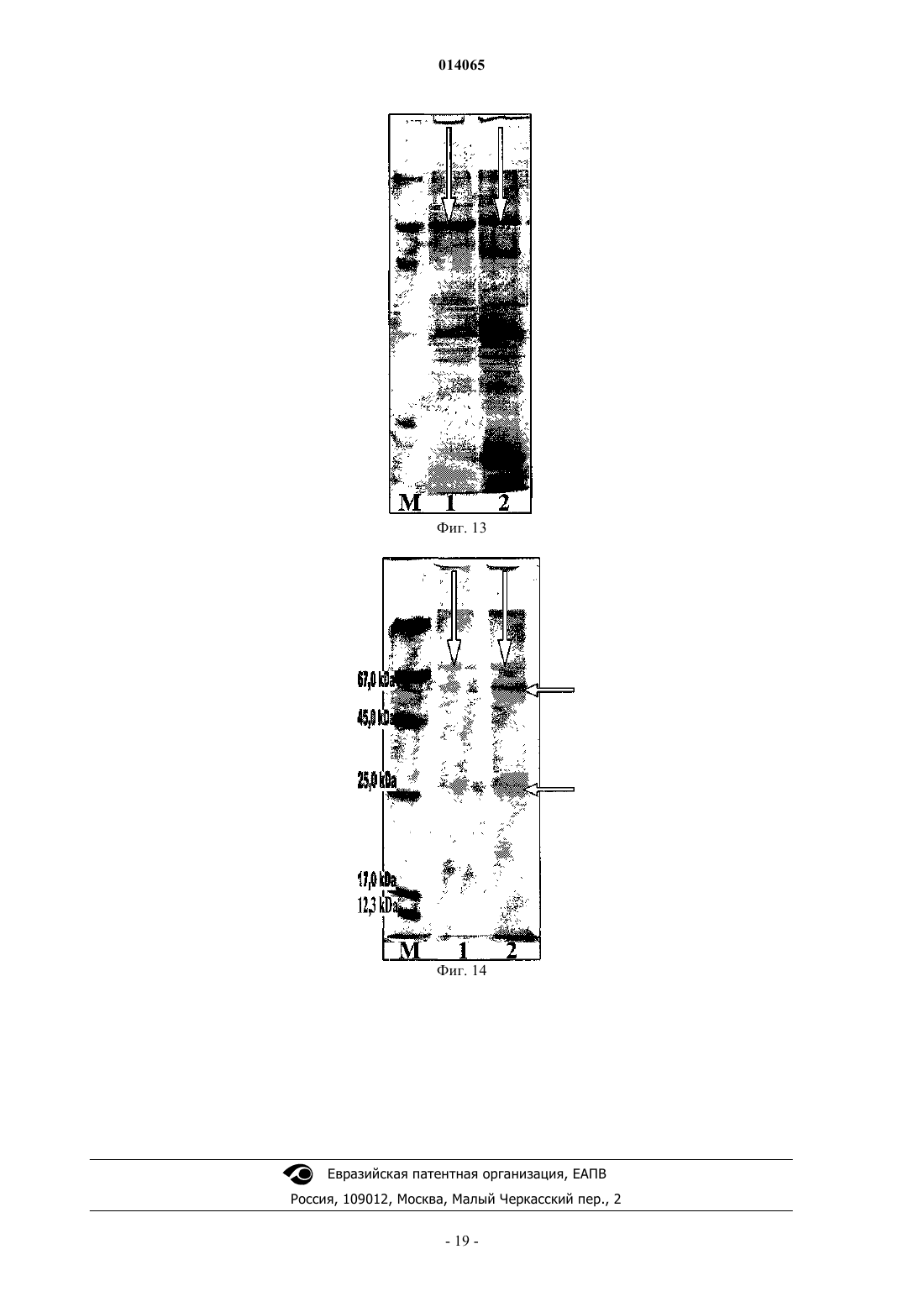
СРЕДСТВО, ОБЛАДАЮЩЕЕ СВОЙСТВОМ ФОРМИРОВАТЬ КЛЕТОЧНЫЙ ИММУНИТЕТ ПРОТИВ MYCOBACTERIUM TUBERCULOSIS H37 RV, СПОСОБ ПОЛУЧЕНИЯ ЕГО (ВАРИАНТЫ),РЕКОМБИНАНТНЫЙ ШТАММ И СРЕДСТВО ДЛЯ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА Кисличкин Николай Николаевич (RU) Представитель: Изобретение относится к области биофармакологии, препаративной биохимии, медицине и касается создания средства на основе туберкулезного комплекса, продуцируемого микроорганизмом,которое может найти применение в профилактике, лечении и диагностике туберкулеза. Безопасный для человека, животных и окружающей среды рекомбинантный штамм 2-9XL Acinetobacterjohnsonii в составе своей хромосомы содержит фрагмент(ы) хромосомной ДНК М. tuberculosisH37 Rv, при помощи которого одновременно синтезируются несколько белков, формирующих во внешней мембране и капсульном веществе бактерии - стабильный видоспецифический туберкулезный гликопротеиновый комплекс. Простота работы с рекомбинантным штаммом 2-9XL, использование стандартных сред, стабильность синтеза видоспецифического туберкулезного комплекса, экономичная безопасная технология выделения и очистки туберкулезного комплекса делают данный микроорганизм перспективным продуцентом средства, обладающего свойством формировать Т- и В-клеточный иммунитет против возбудителя М. tuberculosis. 014065 Изобретение относится к области биофармакологии, препаративной биохимии, медицине и касается создания средства на основе туберкулезного комплекса, продуцируемого микроорганизмом, которое может найти применение в лечении и диагностике туберкулеза. Важным звеном в решении проблемы туберкулеза является создание биологических вакцин и разработка методов быстрой и недорогой диагностики. Очевидно, что необходимо идентифицировать в возбудителе туберкулеза такие белки и формируемые ими комплексы, которые отвечали бы самым современным требованиям для достижения этих целей. У биологических вакцин основным критерием является безопасность для человека, наряду с высокой эффективностью, у диагностических препаратов - чувствительность и специфичность. Главными направлениями решения поставленной задачи являются: а) клонирование генов микобактерий в безопасном реципиенте и изучение свойств синтезируемых туберкулезных белков, б) выделение из микобактерий белков и их комплексов с последующей характеристикой свойств. В литературе описана возможность создания геномной библиотеки М. tuberculosis H37 Ra и передачи фрагментов хромосомной ДНК возбудителя туберкулеза в реципиентные бактерии Е. coli XL1-Blue. Показано, что с определенного фрагмента хромосомной ДНК М. tuberculosis H37 Ra, который состоит из 1535 пар оснований и находится в составе плазмидного вектора pZx7, возможен синтез туберкулезного белка с приблизительной массой 52,0 кДа. Этот белок локализуется на внешней мембране Е. coli XL1-Blue,наделяет рекомбинантный штамм возможностью проникать внутрь эукариотических клеток HeLa и размножаться в них, что характерно для патогенных микобактерий. Однако авторами не указывается, что данный белок является индивидуальным (видоспецифичным) и может быть использован для диагностики возбудителя туберкулеза. Наоборот, аминокислотная последовательность изученного белка имеет гомологию как с патогенными микроорганизмами (Listeria monocytosis, Shigella, Jersinia pseudotuberculosis), так и с рядом белков человека, например -адаптином (1). Из фильтратов культуры М. tuberculosis выделен и охарактеризован секретируемый белок МРТ 63,имеющий молекулярную массу 18,0 кДа. Анализ нуклеотидной последовательности mp+63 гена показал,что он имеет открытую рамку считывания, кодирующую белок из 159 аминокислот и состоящую из 29 аминокислот сигнального пептида и 130 аминокислот зрелого МРТ 63 белка. Рекомбинантный МРТ 63 белок из клеток Е. coli и очищенный из культуральных фильтратов М. tuberculosis были неразличимы в серологических реакциях и оказывали сильное воздействие на гуморальный иммунитет морских свинок,инфицированных вирулентным штаммом М. tuberculosis. Предполагалось использовать этот белок в качестве специфического реагента для диагностики кожного тестирования при заболевании туберкулезом,однако до настоящего времени этот белок и комплекс белка с сигнальным пептидом не нашли широкого применения (2). Известно также описание и характеристика 4 главных секретируемых внеклеточных белков М. tuberculosis, выделенных из непатогенных быстро растущих микобактерий, которые обладают ферментативной активностью и присутствуют также в патогенных штаммах. Эти белки предполагается использовать для конструирования биологических вакцин, так как они индуцируют защитный иммунитет, однако до настоящего времени они не получили признания (3). Таким образом, к настоящему времени не создан генно-инженерный микроорганизм, который мог бы синтезировать туберкулезные видоспецифические белки или их комплексы, пригодные для использования в диагностических целях или являться основой для создания биологической вакцины. Белки, выделяемые из патогенного штамма М. tuberculosis или не патогенных микобактерий, также до настоящего времени не позволяют создать на их основе высокоспецифичные и чувствительные диагностические препараты или сконструировать биологические вакцины. Задача изобретения заключается в получении генно-инженерным и микробиологическим способом рекомбинантного штамма 2-9XL Acinetobacter johnsonii - продуцента специфического туберкулезного комплекса М. tuberculosis H37 Rv, который может быть основой биологической вакцины против возбудителя туберкулеза и диагностикума для выявления больных туберкулезом людей с самыми разными формами заболевания и в различных стадиях болезни. Для решения поставленной задачи предложен рекомбинантный штамм 2-9XL Acinetobacter johnsonii, полученный генно-инженерным способом с последующей селекцией микробиологическим способом, являющийся продуцентом видоспецифического гликопротеинового туберкулезного комплекса(ТБ-антигена), который локализован на внешней мембране и в капсульном веществе бактерии и при выделении может быть использован как основа для получения биологической вакцины, диагностических и лекарственных средств. Технический результат - получение высокоспецифичных и чувствительных препаратов. Для решения поставленной задачи предложена группа изобретений, объединенных общим изобретательским замыслом. Заявлено изобретение, представляющее собой средство, обладающее свойством формировать клеточный иммунитет против М. tuberculosis H37 Rv. Средство содержит видоспецифический гликопротеиновый туберкулезный комплекс M. tuberculosis H37 Rv (ТБ-антиген). Кроме того, заявлены варианты способов получения видоспецифического гликопротеинового ту-1 014065 беркулезного комплекса M. tuberculosis H37 Rv (ТБ-антиген), а также рекомбинантный штамм 2-9XLAcinetobacter johnsonii VKPM-9312 - продуцент видоспецифического гликопротеинового туберкулезного комплекса M. tuberculosis Н 37 Rv (ТБ-антигена) и средство для диагностики туберкулеза, содержащее вышеуказанный видоспецифический гликопротеиновый туберкулезный комплекс. 2-9XL Acinetobacter johnsonii является генно-инженерным штаммом, полученным путем передачи в бактерии R-формы F. tularensis в составе векторной плазмиды pRT двух фрагментов хромосомной ДНК М. tuberculosis H37 Rv и последующей селекции микробиологическим способом. До настоящего времени при клонировании генов возбудителя туберкулеза (ТБ) в составе векторных плазмид использовали бактерий-хозяев, которые могли синтезировать только единичные белки ТБ. Выделение и изучение генно-инженерных белков ТБ (как и природных белков возбудителя туберкулеза) не привели к желаемому результату - созданию биологических вакцин, лекарственных препаратов, высокоспецифичных и чувствительных диагностикумов. Поэтому в мире продолжаются поиски новых белков микобактерий, с помощью которых возможно решение поставленных задач. Вероятно, данное направление может быть ошибочным, так как видоспецифичность возбудителя туберкулеза формируется на уровне комплекса из нескольких белков (не менее трех), часть из которых должна быть гликозилирована, то есть содержать полисахаридную часть. Показано, что при передаче фрагментов ДНК М. tuberculosis H37 Rv в составе векторной плазмидыpRT в реципиент R-форму F. tularensis и последующей селекции трансформанта определенным микробиологическим способом перенесенные фрагменты (фрагмент) встраиваются в хромосомную ДНК бактерии-реципиента и вызывают синтез туберкулезного полипептида. Первоначально этот полипептид формирует в бактерии-хозяине специфический рекомбинантный туляремийно-туберкулезный комплекс,связываясь с туляремийными белками, имеющими более высокую молекулярную массу. Однако данная конструкция, вероятно, для бактерии-хозяина неудобна и при дальнейшей селекции рекомбинантного штамма начинается синтез ТБ-белков более высокой молекулярной массы, которые замещают туляремийные. При такой серьезной "реконструкции" в бактерии происходят не только изменения биохимических и фенотипических свойств рекомбинантного микроорганизма (по ряду свойств он становится похож на туберкулезные микобактерии), но меняется также и структура ДНК бактерии. Заключение о видовой принадлежности штамма "9 ха" (2-9XL) с помощью анализа 16S РНК получено в ВКПМ ФГУП ГосНИИГенетика. Анализ последовательностей 16S рРНК показал, что исследуемый штамм, заявленный как "9 ха"(2-9XL), принадлежит к виду бактерий Acinetobacter johnsonii, причем со штаммом Acinetobacter johnsonii strain 42 гомология составляет 99%. Основные свойства штамма 2-9XL Acinetobacter johnsonii - суперпродуцента рекомбинантного туберкулезного антигена. Культурально-морфологические свойства При световой микроскопии (фиг. 1, 2. Световая микроскопия бактерий 2-9XL Acinetobacter johnsonii. Окраска по Граму (набор красителей фирмы "Serva"). Культура 2-9XL Acinetobacter johnsonii выращена на туляремийной среде (FT-агар с 1% глюкозой и добавками, рН 6,6) в течение трех суток при+32 С. А-Ув. 100X3; В-100 Х 9,3 Х (микроскоп "Биомед-2", Россия). На представленных чертежах хорошо видно, что рекомбинантные бактерии 2-9XL устойчивы к обесцвечиванию и склонны к агрегации(склеиванию). Капсула бактерий окрашивается сафранином в красный цвет) бактерии представляют собой неподвижные полиморфные мелкие кокковидные и палочковидные клетки размерами 0,4-1,0 мкм. При окраске по Граму бактерии устойчивы к обесцвечиванию, что производит впечатление грамположительного окрашивания. Образуют разнообразные по размерам и форме скопления клеток, что указывает на их высокую степень агрегации (склеивания). Агрегация бактерий связана с образованием специфической капсулы, которая хорошо прокрашивается сафранином. При утрате рекомбинантного туберкулезного антигена бактерии становятся истинно грамотрицательными. Штамм 2-9XL аэроб растет на простых и богатых средах (ауксотроф) при +32 С, однако может расти в интервале от +28 до +37 С. При росте бактерий на простых средах культура прекращает синтез рекомбинантного туберкулезного антигена. Необходимым фактором роста 2-9XL является цистеин. Для максимального синтеза специфической капсулы, содержащей рекомбинантный туберкулезный антиген,предпочтительны богатые среды с витаминными и другими добавками. В качестве стимулятора роста бактерий и формирования специфической капсулы возможно добавление в питательную среду 1% суспензии автоклавированных бактерий 2-9XL и/или 10% автоклавированного капсульного вещества. Наиболее удобны для выращивания рекомбинантного штамма 2-9XL питательные среды, используемые для выращивания туляремии, чумы, бруцеллеза и т.д. Посев культуры на питательные среды выдерживают в термостате от двух до семи суток. При росте бактерий 2-9XL появляется характерный специфический нераздражающий запах. Штамм 2-9XL плохо растет на жидких питательных средах и быстро теряет способность продуцировать рекомбинантный туберкулезный антиген. На плотных питательных средах бактерии 2-9XL образуют колонии серо-белого цвета с желтоватым отливом. При титровании культуры до отдельных изолированных колоний возможна задержка роста-2 014065 до двух суток. По мере роста размеры колоний могут достигать диаметра 5-7 мм. Если чашки с посевом выдержать 2-3 суток в холодильнике (+4 С), колонии приобретают преимущественно желто-серую окраску. Колонии выпуклые с неровными краями, неблестящие, непрозрачные, при взятии петлей консистенция колоний плотная, легко снимается с поверхности питательного агара. При титровании культуры 2-9XL на плотных питательных средах невозможно приготовить стандартную взвесь из-за высокой способности клеток к склеиванию (спонтанная агглютинация), поэтому титр бактерий не соответствует стандартному разведению (фиг. 3-5. Культурально-морфологические свойства 2-9XL Acinetobacter johnsonii. Изолированные колонии рекомбинантного штамма 2-9XL Acinetobacter johnsonii, выросшие на FTагаре с цистеином и 1% глюкозой, рН 6,6 в течение трех суток при +32 С. Хранение в холодильнике(4 С) в течение пяти суток. Фиг. 3 - обычный фон; фиг. 4, 5 - белый фон; фиг. 5 - увеличенный фрагмент чашки Петри). Стабильность популяции штамма 2-9XL При последовательных пересевах на плотных питательных средах, выращивании при различных температурных режимах, после хранения в лиофильно высушенном состоянии, ухудшении питательных свойств среды для выращивания и других неблагоприятных условиях, штамм 2-9XL становится нестабильным и диссоциирует в другие формы. Диссоциация наиболее заметна после длительного выращивания изолированных колоний (фиг. 6-11). Диссоциация культуры 2-9XL Acinetobacter johnsonii по культурально-морфологическим признакам. Чашка Петри с диссоциациированной культурой 2-9XL. Рост колоний различной морфологии при титровании культуры из лиофильно высушенного состояния. FT-агар с 1% глюкозой, цистеином, рН 6,6. Время инкубации при +32 С 10 суток, хранение в холодильнике (+4 С). Фиг. 6 - чашка Петри сфотографирована на белом фоне; фиг. 7 - чашка Петри сфотографирована на сером фоне. Фиг. 8-11 - увеличенные фрагменты чашки Петри с колониями 2-9XL различной морфологии. Фиг. 8 (1) - крупная круглая белая непрозрачная плоская с выпуклым центром и ровным краем блестящая колония, легко снимется с агара петлей. Фиг. 8 (2) - маленькая круглая серо-желтая непрозрачная выпуклая с ровным краем не блестящая колония, легко снимается петлей с агара. Фиг. 9 - средняя круглая серо-желто-белая непрозрачная с выпуклым хорошо обозначенным центром и выраженным валиком по ровному краю не блестящая колония, легко снимается петлей с агара. Фиг. 10 - средняя некруглая желтая непрозрачная с выраженным выпуклым центром неровной поверхностью и краем не блестящая колония, легко снимается петлей с агара. Фиг. 11 - крупная некруглая желто-серая непрозрачная с выраженным выпуклым центром неровной поверхностью и краем неблестящая колония, легко снимается петлей с агара. Биохимические свойства штамма 2-9XL Бактерии при росте на плотных питательных средах расщепляют белки с выделением специфического не раздражающего запаха. При росте на богатых питательных средах способны синтезировать рекомбинантный туберкулезный антиген. Оксидазоположительные и каталазоотрицательные. Биохимические свойства рекомбинантного штамма 2-9XL Acinetobacter johnsonii до конца не изучены. Иммунохимические свойства Бактерии 2-9XL обладают очень высокой адгезивностью (способностью склеиваться) (см. фиг. 1, 2),что не позволяет проверить их агглютинабельность в реакции агглютинации. В реакциях иммунодиффузии (РИД) и иммуноэлектрофореза с экспериментальными сыворотками,полученными на ультразвуковые дезинтеграты микобактерий вирулентного штамма туберкулеза М. tuberculosis H37 Rv, антигены рекомбинантных бактерий 2-9XL не формируют линий преципитации. Вероятно, это связано с тем, что антитела на рекомбинантный ТБ-антиген возникают только в процессе развития инфекции в организме человека или животных и их титр не бывает большим. В случае выращивания микобактерий на питательных средах и последующей инактивации их ацетоном (или другими жесткими бактерицидными препаратами) этот антиген разрушается и поэтому на него нельзя получить специфические антитела. В иммуноферментном анализе (ИФА) ТБ-антиген в ультразвуковых дезинтегратах бактерий и в очищенном виде взаимодействует с антителами сывороток крови больных туберкулезом людей и не взаимодействует с антителами в сыворотках крови здоровых людей. В иммуноблотинге ТБ-антиген не взаимодействует с антителами больных туберкулезом, так как не переносится на нитроцеллюлозную мембрану. Отношение к фагам данного вида Для рекомбинантного штамма 2-9XL Acinetobacter johnsonii до настоящего времени собственные фаги не обнаружены. Генетические особенности Штамм 2-9XL Acinetobacter johnsonii в составе хромосомной ДНК содержит как минимум одну вставку фрагмента хромосомной ДНК М. tuberculosis H37 Rv, но возможны и две вставки.-3 014065 Продуктивность Рекомбинантный штамм 2-9XL является продуцентом туберкулезного антигена (ТБ-антигена) гликопротеиновой природы. Белки, синтезирующиеся с фрагмента хромосомной ДНК М. tuberculosis H37 Rv,формируют на внешней мембране бактерии 2-9XL и в ее капсульном веществе видоспецифический гликопротеиновый комплекс (фиг. 12-14). При получении ультразвуковых дезинтегратов бактерий (УЗД) этот комплекс разбивается и присутствует в виде нескольких белков. При концентрировании УЗД трихлоруксусной кислотой белки ТБ-антигена собираются в специфический рекомбинантный туберкулезный комплекс. При щадящем выделении рекомбинантного ТБ-антигена из бактерий 2-9XL его молекулярная масса в денатурирующемSDS-PAAG находится в интервале от 55,0 до 75,0 кДа (фиг. 12-14). На представленный гликопротеиновый комплекс у лабораторных животных формируется длительный напряженный В- и Т-клеточный иммунитет против М. tuberculosis H37 Rv. При изучении антителопродукции (формирования В-клеточного иммунитета) на рекомбинантный ТВ-антиген проводили иммунизацию морских свинок и кроликов с целью получения гипериммунных сывороток. Для иммунизации использовали кроликов весом 2,5-3 кг. 1 мл ТБ-антигена в концентрации 1 мг, смешанный с равным объемом неполного адъюванта Фрейнда, вводили подкожно в отдел спины в области лопаток. Иммунизацию повторяли три раза с недельным интервалом и двукратным увеличением дозы. По окончании первичного цикла иммунизации через 4 недели проводили внутримышечно повторное введение препаратов, начиная с 2 мг и кратно увеличивая дозу до 8 мг. Иммунизацию морских свинок проводили подкожно в отдел спины в область лопаток ТВ-антигеном в дозе 300 мкг/мл с неполным адъювантом Фрейнда. Через три недели введение препарата повторяли. Антительный ответ у лабораторных животных оценивали через 21 день после последнего введения ТВ-антигена. Для этого проводили забор крови, получали сыворотку и проверяли наличие специфических ТВ-антител в реакции диффузной преципитации и иммуноферментным методом. Показано, что выработка специфических антител происходит уже после первичного введения препарата. При дальнейших инъекциях титры антител в сыворотках возрастали. По завершению циклов иммунизации были получены гипериммунные сыворотки с высоким содержанием ТВ-антител. В иммуноферментном анализе с использованием ТВ-антигена, взятого для иммунизации, титры антител у морских свинок составили 1:6400, а у кроликов - 1:409600 и выше, в реакции диффузной преципитации титры были 1:8 и 1:16-1:32 соответственно. Таким образом, присутствие рекомбинантного ТВ-антигена в организме животных вызывает перестройку их иммунной системы по В-типу. Длительное присутствие ТБ-антигена или повторное его введение делает перестройку иммунной системы стойкой, на что указывает возрастание титров специфических антител в сыворотках крови животных. У больных туберкулезом людей и бактерионосителей специфический В-клеточный иммунитет определяется с помощью ТБ-антигена в иммуноферментных тест-системах (ИФА), на нитроцеллюлозных фильтрах (иммуноблотинг, дот-блот) и в других реакциях с использованием клинических жидкостей (сыворотка крови, мокрота, плевральная жидкость, спинно-мозговая жидкость и другие), содержащих специфические антитела. Изучение образцов сывороток крови больных туберкулезом и здоровых людей на наличие специфических антител представлено в табл. 1.-4 014065 Таблица 1 Определение наличия антител к возбудителю туберкулеза человека в образцах сывороток крови разных групп людей иммуноферментным методом (метод определения представлен в примере 4). Примечание: образцы сывороток представлены Гос. НИИ стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасевича (ГИСК) и ООО "БИОНОМ". Обследовано 460 человек. ОП 0,6 - указывает на наличие антител в сыворотках крови к возбудителю туберкулеза; 0,3 ОП 0,6 сомнительный результат ("серая зона"); ОП 0,3 - указывает на отсутствие антител к возбудителю туберкулеза; МБТ+ - диагноз "туберкулез" подтвержден выделением микобактерий от больного; МБТ- - диагноз "туберкулез" подтвержден клинико-рентгенологическими методами. ВИЧ - вирус иммунодефицита человека; ВГВ - вирус гепатита В; ВГС - вирус гепатита С. Выводы 1. Из 227 образцов сывороток крови больных туберкулезом в 71,4% обнаружены антитела к возбудителю туберкулеза М. tuberculosis Н 37 Rv. 2. В 45 образцах сывороток крови доноров (здоровых людей) не обнаружено антител к возбудителю туберкулеза М. tuberculosis H37 Rv. 3. В группах риска в образцах сывороток крови наличие антител к возбудителю туберкулеза М. tuberculosis H37 Rv варьирует от 2,3 до 18,2%. Изучение специфической активности ТВ-антигена в формировании Т-клеточного иммунитета про-5 014065 водили путем постановки кожных туберкулиновых проб на морских свинках. Для этого группам морских свинок вводили туберкулезную вакцину BCG (внутрикожно по 0,5 мг в 0,2 мл разводящей жидкости) и взвеси микробных клеток вирулентных штаммов Mycobacterium tuberculosis H37Rv, R1Rv, a также атипичных штаммов М. kansassi, M. marinum (внутрибрюшинно в дозе 106 микробных клеток на животное). Через 4 недели после инфицирования опытных и контрольных морских свинок использовали для постановки внутрикожной пробы Манту по общепринятой методике (Инструкция по применению аллергена туберкулезного очищенного сухого для накожного, подкожного и внутрикожного применения (сухого очищенного туберкулина). Главное управление лечебно-профилактической помощи Минздрава СССР. Москва. 11 августа 1986 г.). Концентрация препаратов, вводимых внутрикожно, составляла 10 мкг по общему белку в 100 мкл разводящей жидкости. Специфическую аллергическую реакцию замедленного типа в виде местной реакции возникающего клеточного инфильтрата (папулы) учитывали в миллиметрах через 24 ч. Препаратом сравнения служил сухой очищенный туберкулин (Tuberculinum depuratum siccum) производства РАО "БИОПРЕПАРАТ", Санкт-Петербургского НИИ Вакцин и Сывороток - PPD-L-2(доза для внутрикожного введения-25 ТЕ). Результаты экспериментов показали, что ТВ-антиген, полученный из рекомбинантного штамма 2-9XL, вызывает местную кожную реакцию у сенсибилизированных свинок (реакция гиперчувствительности замедленного типа), причем некоторые из них по размерам папулы (12-15 мм) были сопоставимы с референс-препаратом. Отмечена достоверная разница в размерах кожной реакции у животных, инфицированных вирулентным туберкулезным штаммом, атипичными штаммами и BCG, что указывает на видовую специфичность ТВ-антигена. Но, в отличие от туберкулина, местная аллергическая реакция в ответ на внутрикожное введение ТБ-антигена возникала и у части контрольных животных, что, вероятно,связано с недостаточной очисткой ТВ-антигена как сложного гликопротеинового комплекса. Однако очевидно, что на исследуемый ТБ-антиген формируется стойкий видоспецифический Т-клеточный иммунитет. Следовательно, ТВ-антиген весьма перспективен как диагностический препарат для определения наличия специфического Т-клеточного иммунитета у больных и инфицированных туберкулезом людей и как биологическая вакцина. Патогенность для лабораторных животных Рекомбинантный штамм 2-9XL не обладает остаточной вирулентностью для всех видов лабораторных животных. Согласно "Заключению по проверке на остаточную вирулентность лиофильно высушенной культуры штамма 2-9XL Acinetobacter johnsonii ", проведенному в НИЦ Токсикологии и гигиенической регламентации биопрепаратов, значение LD50 для линейных мышей Balb/c и золотистых хомяков превышает 1107 микробных клеток и 5107 микробных клеток соответственно. Штамм 2-9XL Acinetobacter johnsonii авирулентен для морских свинок и кроликов (значение LD501109 микробных клеток на животное). Таким образом, на основании показателя остаточной вирулентности (патогенности) штамм 2-9XLAcinetobacter johnsonii может быть отнесен к 4 группе микроорганизмов по Международной классификации. Копии "Заключения по проверке на остаточную вирулентность лиофильно высушенной культуры 2-9XL Acinetobacter" НИЦ ТБП прилагаются. Условия и состав сред для хранения и поддержания штамма Музейная культура штамма 2-9XL Acinetobacter хранится при температуре +4 С на косякахFT-среды с добавками глюкозы и цистеина до 2 месяцев, а в лиофильно высушенном состоянии в сахарозо-желатиновой среде до 5 лет. Среда для культивирования Рекомбинантный штамм 2-9XL Acinetobacter johnsonii культивируется на плотной FT-среде с добавками глюкозы и цистеина при +32 С. Технологические особенности при культивировании Рекомбинантный штамм 2-9XL плохо растет в жидких питательных средах и быстро теряет способность продуцировать ТБ-антиген. Поэтому наращивание биомассы для последующего выделения ТБ-антигена проводят только на плотных питательных средах. Матричную культуру выращивают на косячках при +32 С в течение 2-3 суток, затем смывают бактерии физиологическим раствором и с одного косячка засевают один-два матраса. Матрасы инкубируют в термостате в при +32 С в течение 3-4 суток, затем выросшую биологическую массу смывают дистиллированной водой и центрифугированием освобождаются от растворимых компонентов питательной среды. Из очищенной от компонентов питательной среды биологической массы начинают выделение рекомбинантного ТБ-антигена. Изобретение иллюстрируется следующими примерами. Пример 1. Получение видоспецифического гликопротеинового туберкулезного комплекса(ТБ-антигена) из рекомбинантного штамма 2-9XL Acinetobacter johnsonii. На плотную питательную среду (косячки) рН 6,6, состоящую из сердечно-мозгового агара, гидролизованного гемоглобина, цистеина и глюкозы в соответствующих пропорциях или FT-агара рН 6,6 (про-6 014065 изводство ФГУП ГНЦ ПМ, Оболенск, Россия) с добавлением цистеина и глюкозы петлей делают посев культуры 2-9XL. Посев инкубируют в термостате при +32 С в течение двух суток. Двухсуточную культуру смывают физиологическим раствором и готовят суспензию бактерий в концентрации 510 микробных клеток (м.к.) в одном миллилитре. [Получение суспензии бактерий 2-9XL весьма сложно, так как культура смывается хлопьями, которые при перемешивании очень плохо разбиваются]. Для получения большого количества биологической массы полученную суспензию высевают на матрасы из расчета один косячок на 1-2 матраса (в один матрас наливают 400,0 мл питательной среды). Посев инкубируют в термостате при +32 С в течение трех суток. С одного матраса трехсуточную культуру 2-9XL смывают 30 мл физиологического раствора. Из взвеси смытой культуры готовят мазок для световой микроскопии и окрашивают его по Граму. [Популяция бактерий рекомбинантного штамма 2-9XL при небольших изменениях состава питательной среды, температурного режима или иных условий может быстро диссоциировать в формы, которые не продуцируют ТБ-антигена. При окраске по Граму эти бактерии грамотрицательные, бактерии-продуценты ТБ-антигена - устойчивы к обесцвечиванию и выглядят как грамположительные (фиг. 1, 2). В выросшей биомассе 2-9XL количество грамотрицательных бактерий не должно превышать 5-10%]. Суспензию смытых с матраса бактерий центрифугируют ("Beckman" G2-21, USA) при 9000 об/мин в течение 30 мин. Надосадочную жидкость, содержащую растворимые компоненты питательной среды,отбрасывают, а осадок суспендируют в 40 мл охлажденной деионизованной воды и все последующие процедуры делают при +4 С. Далее проводят обработку культуры 2-9XL 0,5 N раствором NaOH, доводя рН от 6,0 до 9,0. Происходящее при этом растворение капсулы бактерий, содержащих видоспецифический рекомбинантный ТБ-антиген, ведут дробно, добавляя NaOH небольшими порциями и тщательно перемешивая суспензию в течение нескольких часов. Обработанную таким образом суспензию бактерий оставляют в холодильнике (+4 С) на ночь (15-16 ч). На следующий день суспензию бактерий 2-9XL центрифугируют при 12000 об/мин в течение 40 мин. Водную фракцию, содержащую растворенную капсулу рекомбинантного штамма 2-9XL, отделяют от осадка. В связи с неполным растворением капсулы повторяют процедуру обработки осадка щелочью в той же последовательности. Полученную первую порцию препарата капсулы 2-9XL на холоде нейтрализуют 0,5 N раствором трихлоруксусной кислоты (ТХУ) до рН 6,0 и, так как он содержит достаточно большое количество бактерий, центрифугируют при 15000 об/мин в течение 40 мин. Осадок отбрасывают, а надосадочную жидкость закисляют 0,5 N ТХУ до рН 3,0-3,5. При этом ТБ-антиген собирается в комплекс и начинает выпадать в осадок. Препарат оставляют в холодильнике (+4 С) на ночь (15-16 ч). Выпавший за ночь ТХУ-осадок в этом растворе может храниться при +4 С до двух недель без утраты специфической активности находящегося в нем ТБ-антигена. На ночь в холодильнике оставляют вторую порцию препарата для формирования осадка ТБ-антигена. На третий день первую порцию препарата с выпавшим осадком центрифугируют при 9000 об/мин в течение 30 мин. Надосадок отбрасывают. Из расчета на один матрас осадок растворяют в 1-2 млPBS-буфера содержится преимущественно видоспецифический ТБ-антиген (фиг. 12. Электрофорез ТБ-антигена рекомбинантного штамма 2-9XL Acinetobacter johnsonii. 16% SDS-PAAG электрофорез белков рекомбинантного штамма 2-9XL. 60-170v. 60 мин. Трис-глициновый буфер рН 8,3. М - маркеры: 67,0; 45,0; 25,0; 17,0; 12,3 кДа. 1 - белки ультразвукового дезинтеграта 2-9XL. Стрелкой указан двойной белок ТБ-антигена, который не проявляет специфической активности. 2 белки ультразвукового дезинтеграта, переосажденного трихлоруксусной кислотой (ТХУ). Стрелкой указан ТБ-антиген в сборке. Этот белковый комплекс проявляет специфическую активность.), который уже проявляет специфическую активность, но требует дополнительной очистки). С оставленной на ночь второй порцией препарата повторяют все необходимые процедуры (нейтрализуют 0,5 N ТХУ до рН 6,0, освобождаются от оставшихся клеток, закисляют 0,5 N ТХУ до рН 3,0-3,5 и раствор с выпадающим осадком оставляют на ночь). Выпавший за ночь ТХУ-осадок может храниться при +4 С до двух недель без утраты специфической активности находящегося в нем ТБ-антигена. На следующий день вторую порцию препарата растворяют в 1-2 мл PBS-буфера. Он содержит преимущественно видоспецифический ТБ-антиген. Наличие ТБ-антигена, полученного вышеописанным способом, регистрируют в SDS-PAAG электрофорезном геле (фиг. 12). ТБ-антигены первой и второй порций объединяют и подвергают дальнейшей очистке. В результате проведенных экспериментов установлено, что а) рекомбинантный видоспецифический ТБ-антиген локализуется во внешних структурах бактерий 2-9XL (внешняя мембрана и капсульное вещество) и может быть выделен и сконцентрирован путем вышеописанных процедур, б) при проведении вышеописанных процедур бактерии рекомбинантного штамма 2-9XL практически не разрушаются и доля получаемого ТБ-антигена достаточно высока в сравнении с другими, присутствующими в растворе белками, липидами и полисахаридами бактерий. Таким образом, можно считать, что приведенный при-7 014065 мер является наиболее экономичным получением ТБ-антигена из рекомбинантного штамма 2-9XL Acinetobacter johnsonii, но он не исключает возможности получения его любым другим способом (разрушение бактерий с помощью ультразвука, или путем замораживания-оттаивания, или иным способом с последующей концентрацией ТБ-антигена). Пример 2. Получение видоспецифического гликопротеинового туберкулезного комплекса(ТБ-антигена) из рекомбинантного штамма 2-9XL Acinetobacter johnsonii. На плотную питательную среду (косячки) с рН 6,6, состоящую из сердечно-мозгового агара, гидролизованного гемоглобина, цистеина и глюкозы в соответствующих пропорциях или FT-агара рН 6,6 (производство ФГУП ГНЦ ПМ, Оболенск, Россия) петлей делают посев культуры 2-9XL. Посев инкубируют в термостате при +32 С в течение трех суток. Трехсуточную культуру смывают физиологическим раствором и готовят суспензию бактерий в концентрации 5109 микробных клеток (м.к.) в одном миллилитре. Полученную суспензию высевают на матрасы из расчета один косячок на 1-2 матраса (в один матрас наливают 400,0 мл питательной среды). Посев инкубируют в термостате при +32 С в течение трех суток. С одного матраса трехсуточную культуру 2-9XL смывают 30 мл физиологического раствора. Из взвеси смытой культуры готовят мазок для световой микроскопии и окрашивают его по Граму (контроль наличия ТБ-антигена в рекомбинантных бактериях 2-9XL). Суспензию смытых с матраса бактерий центрифугируют ("Beckman" G2-21, USA) при 9000 об/мин в течение 30 мин. Надосадочную жидкость, содержащую растворимые компоненты питательной среды,отбрасывают, а осадок суспендируют в 40 мл охлажденной деионизованной воды и все последующие процедуры делают при +4 С. Далее проводят обработку культуры 2-9XL 0,5 N раствором NaOH, доводя рН от 6,0 до 9,0. Происходящую при этом процедуру растворения капсулы бактерий, содержащих видоспецифический рекомбинантный ТБ-антиген, ведут дробно, добавляя NaOH небольшими порциями и тщательно перемешивая суспензию в течение нескольких часов. Обработанную таким образом суспензию бактерий оставляют в холодильнике (+4 С) на ночь (15-16 ч). На второй день суспензию бактерий 2-9XL центрифугируют при 12000 об/мин в течение 40 мин. Надосадочную жидкость (частично растворенную капсулу рекомбинантного штамма 2-9XL, содержащую ТБ-антиген), отделяют от осадка (бактерии 2-9XL, сохранившие и не сохранившие капсулу). К осадку добавляют 40 мл деионизованной воды и повторяют процедуру растворения капсулы, получая вторую порцию препарата. Полученный препарат капсулы 2-9XL нейтрализуют 0,5 N раствором трихлоруксусной кислоты(ТХУ) до рН 6,0, а затем добавляют сульфат аммония [(NH4)2SO4] до 30% насыщения. Раствор оставляют на ночь при +4 С для выпадения осадка. На следующий день препарат центрифугируют при 12000 об/мин в течение 40 мин. Осадок отбрасывают (он преимущественно содержит целые бактерии и их крупные фрагменты). К надосадочной жидкости, содержащей преимущественно ТБ-антиген, добавляют сульфат аммония до 100% насыщения. Препарат оставляют на ночь при +4 С для выпадения осадка. Вторую порцию препарата капсулы 2-9XL нейтрализуют 0,5 N раствором трихлоруксусной кислоты (ТХУ) до рН 6,0, а затем добавляют сульфат аммония [(NH4)2SO4] до 30% насыщения, оставляют на ночь при +4 С для выпадения осадка. На следующий день препарат ТБ-антигена, выпавшего в осадок при 100% осаждении сульфатом аммония, центрифугируют при 12000 об/мин в течение 40 мин. Надосадок отбрасывают, осадок растворяют в 2,0 мл PBS-буфера рН 7,0 (из расчета на один матрас) и диализуют против большого объемаPBS-буфера. В течение суток объемы PBS-буфера меняют не менее трех раз для полного удаления из диализного мешка сульфата аммония. Вторую порцию препарата, содержащего 30% сульфата аммония, центрифугируют при 12000 об/мин в течение 40 мин и осадок отбрасывают, надосадок насыщают до 100% сульфатом аммония и оставляют на ночь при +4 С. На следующий день препарат второй порции ТБ-антигена, выпавшего в осадок при 100% осаждении сульфатом аммония, центрифугируют при 12000 об/мин в течение 40 мин. Надосадок отбрасывают,осадок растворяют в 2,0 мл PBS-буфера рН 7,0 (из расчета на один матрас) и диализуют против большого объема PBS-буфера. В течение суток объемы PBS-буфера меняют не менее трех раз для полного удаления из диализного мешка сульфата аммония. Присутствие сконцентрированного ТБ-антигена в PBS-буфере после диализа первой и второй порций препарата контролируют в SDS-PAAG электрофорезе (фиг. 13. Электрофорез ТБ-антигена рекомбинантного штамма 2-9XL Acinetobacter johnsonii. 16% SDS-PAAG электрофорез белкового комплекса 2-9XL, выделенного сульфатным переосаждением. 60-170v. 60 мин. Трис-глициновый буфер рН 8,3. М - маркеры: 67,0; 45,0; 25,0; 17,0; 12,3 кДа. 1-2 - белки очищенного ТБ-антигена на Sephadex G200. Стрелками указан белковый ТБ-антигена в сборке. Этот белковый комплекс проявляет специфическую активность). ТБ-антигены первой и второй порций объединяют и подвергают дальнейшей очистке.-8 014065 Таким образом, получение и концентрирование видоспецифического гликопротеинового туберкулезного комплекса (ТБ-антигена) из рекомбинантного штамма 2-9XL возможно не только с помощью осаждения его из щелочных лизатов трихлоруксусной кислотой до рН 3,5-4,0, как показано в примере 1. Возможно использование методов осаждения ТБ-антигена с помощью различных солей, например сульфата аммония, или иных методов, элюаты содержат очищенный ТБ-антиген с молекулярной массой от 55,0 до 75,0 кДа и наличием углеводов от 20 до 50%. Пример 3. Очистка видоспецифического гликопротеинового туберкулезного комплекса (ТБ-антигена), полученного из рекомбинантного штамма 2-9XL Acinetobacter johnsonii. Дальнейшую очистку специфического туберкулезного антигена 2-9 Х проводят путем фракционирования макромолекул гель-фильтрацией при низком давлении с использованием в качестве матрицы Сефадекса G-200. Объединенные сконцентрированные ТБ-антигены в PBS-буфере, полученные путем осаждения лизатов 0,5 N ТХУ или 100% осаждением сульфатом аммония (пример 2.), наносят на колонку размером 25600. В качестве элюента используют 50 мМ раствор трис-HCl, рН 7,5, с добавлением 100 мМ NaCl,скорость элюции - 25 мл/ч. Пики собирают, измеряют белок по методу, описанному Брэдфордом (4). Общее содержание углеводов определяют фенольным методом (5). В зависимости от способа осаждения ТБ-антигена из растворенной капсулы микробной клетки (примеры 1 и 2), объема наносимого образца и концентрации белка элюаты содержат очищенный ТБ-антиген с молекулярной массой от 55,0 до 75,0 кДа и наличием углеводов от 20 до 50%. Специфические туберкулезные рекомбинантные антигены хранят при +4 С в лиофильно высушенном состоянии. Наличие очищенного ТБ-антигена и его структуру, полученного вышеописанным способом, регистрируют в SDS-PAAG электрофорезном геле (фиг. 14. Электрофорез ТБ-антигена рекомбинантного штамма 2-9XL Acinetobacter johnsonii. 17% SDS-PAAG электрофорез рекомбинантного белкового ТБ-комплекса 2-9XL по Лэмли. 60-170v. 60 мин. Трис-глициновый буфер рН 8,3. М - маркеры: 67,0; 45,0; 25,0; 17,0; 12,3 кДа. 1-2 - белки очищенного ТБ-антигена на Sephadex G200. Вертикальными стрелками указан ТБ-антиген в сборке. Этот белковый комплекс проявляет специфическую активность. Боковыми стрелками указаны компоненты белкового комплекса). Получение очищенного ТБ-антигена возможно не только путем фракционирования макромолекул гель-фильтрацией с использованием в качестве матрицы различных носителей, но и с помощью ионообменной хроматографии. Пример 4. Использование очищенного видоспецифического ТБ-антигена в диагностике туберкулеза человека. При латентных, хронических и острых формах заболевания человека туберкулезом в его крови формируются антитела, являющиеся специфическими для данного возбудителя - М. tuberculosis H37 Rv,что позволяет проводить диагностику заболевания по указанному признаку. Для поиска специфических антител используют тест-систему, которая представляет собой непрямой иммуноферментный анализ с разделением фаз, где в качестве твердого носителя используют 96-луночные планшеты. Подложкой для ELISA служит туберкулезный антиген, полученный из рекомбинантного штамма 2-9 Х путем хроматографического фракционирования. В лунки планшет вносят по 100 мкл антигена в концентрации 10 мкг/мл в фосфатном буфере и инкубируют 18 ч при комнатной температуре. Ячейки троекратно отмывают забуференным физиологическим раствором, рН 7,2, (ЗФР) с 0,05% Tween 20 и "забивают" в течение часа 1% раствором бычьего сывороточного альбумина в ЗФР. После троекратной отмывки в лунки 1-го вертикального ряда планшета вносят по 100 мкл нативной сыворотки крови, несодержащей специфических антител в разведении 1:200(отрицательный контроль), а с 3-го по 12-й вертикальные ряды - ЗФР в том же объеме. Затем в каждую лунку 2-го вертикального ряда добавляют по 200 мкл исследуемых сывороток в разведении 1:100 и восьмиканальной автоматической пипеткой титруют двукратным шагом, из последнего ряда удаляют 100 мкл. Для разведения сывороток использовали ЗФР рН 7,2. Планшеты инкубируют 1 ч при 37 С. В качестве положительного контроля используют сыворотку крови с заведомо известным высоким титром специфических антител (калибровка). Одну из лунок планшета (последнюю) отводят для контроля субстрата, прибавляя к 10 мкл конъюгата 100 мкл субстрата. После удаления несвязавшихся антител пятикратной отмывкой планшета ЗФР-0,05% Tween 20 в объеме 170 мкл к иммуноглобулинам добавляют для вторичного связывания по 100 мкл антивидовых IgG антител к иммуноглобулинам А, М,G, конъюгированных пероксидазой хрена (Sigma), в рабочем разведении 1:5000. Реакционную смесь инкубируют 1 ч при 37 С, после чего ячейки пятикратно отмывают ЗФР-Tween 20. Раствор субстрата готовят добавлением 3 мкл 30% Н 2 О 2 к 10 мл свежеприготовленного 0,04% хромогена AzBTS (ApliHem) в 0,1 М цитратно-фосфатном буфере, рН 5,0 и по 100 мкл раствора добавляют в каждую лунку. Для проявления цветной реакции планшету инкубируют при +37 С в течение часа, вносят по 100 мкл 1% SDS для остановки ферментативной реакции и измеряют величину светоадсорбции при-9 014065 405 нм на вертикальном фотометре фирмы Bio-Rad, модель 680. Результаты сравнивают с бланком лунок вертикального ряда, в которых находилась сыворотка, несодержащая специфических антител. Очищенный рекомбинантный ТБ-антиген взаимодействует только с антителами сывороток крови больных туберкулезом людей и не взаимодействует с антителами сывороток крови здоровых людей. Таким образом, рекомбинантный ТБ-антиген 2-9XL можно использовать в диагностических целях на твердофазном носителе, нитроцеллюлозной мембране и в других тест-системах, с помощью которых идентифицируются специфические антитела, которые вырабатываются организмом человека на присутствие или размножение в нем возбудителя туберкулеза - М. tuberculosis H37 Rv. Специфические антитела, вырабатываемые человеком в ответ на проникновение и развитие в нем возбудителя туберкулеза, могут быть не только в сыворотке крови, но и в других клинических жидкостях (мокроте, экссудате, моче и т.д.). Полученные на очищенный рекомбинантный ТБ-антиген моноклональные антитела или гипериммунные сыворотки различных животных (кроликов, мышей, морских свинок и другие) можно использовать в диагностических методах при поиске в клинических жидкостях человека (мокрота, экссудат, материал при микробиопсии и т.д.) как микобактерий туберкулеза, так и их специфических компонентов. Приведенные выше примеры выделения и использования рекомбинантного видоспецифического туберкулезного антигена, полученного из безопасного для человека и животных генно-инженерного штамма 2-9XL Acinetobacter johnsonii указывают на то, что данный микроорганизм найдет широкое применение в здравоохранении и медицине как источник полезного продукта, используемого в диагностике,профилактике и лечении туберкулеза человека. Учитывая свойства рекомбинантного штамма Acinetobacter johnsonii 9XL, данный микроорганизм депонирован 29.11.05 во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) ФГУП ГосНИИГенетика за индексом VKPM B-9312. Список литературы 1. S. Arruda, G. Bomfim, R. Rnights, T. Huima-Byron, L.W. Riley "Cloning of M. tuberculosis DNA ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный штамм 2-9XL Acinetobacter johnsonii VKPM-9312 - продуцент видоспецифического гликопротеинового туберкулезного комплекса M. tuberculosis Н 37 Rv (ТБ-антигена), депонирован в ВКПМ ФГУП ГосНИИГенетика. 2. Способ получения видоспецифического гликопротеинового туберкулезного комплекса Mycobacterium tuberculosis H37 Rv (ТБ-антигена), характеризующийся тем, что культуру рекомбинантного штамма 2-9XL Acinetobacter johnsonii выращивают на питательной среде при 32 С в течение 2-3 суток, смывают физиологическим раствором, полученную суспензию бактерий центрифугируют, осадок суспендируют в воде при +4 С, обрабатывают раствором NaOH до рН 6,0-9,0, через 15-16 ч полученную суспензию центрифугируют, осадок подвергают повторной процедуре обработки раствором NaOH, а надосадочную жидкость, содержащую растворенную капсулу бактерий штамма 2-9 XL, нейтрализуют 0,5 N раствором ТХУ до рН 6,0, центрифугируют, к надосадочной жидкости добавляют 0,5 N раствор ТХУ до рН 3,0-3,5, раствор выдерживают 15-16 ч до получения комплекса ТБ-антигена, при этом с порцией осадка, повторно обработанного раствором NaOH, проводят нейтрализацию раствором ТХУ с вышеуказанной последовательностью, 1 и 2 растворы с комплексом ТБ-антигена, выпавшим после обработки ТХУ, центрифугируют полученные осадки, содержащие ТБ-антиген, растворяют в PBS-буфере, растворы объединяют и подвергают очистке путем фракционирования гель-фильтрацией на Сефадексе G-200 или с помощью ионообменной хроматографии, элюаты содержат очищенный ТБ-антиген с молекулярной массой от 55,0 до 75,0 кДа и наличием углеводов от 20 до 50%. 3. Способ получения видоспецифического гликопротеинового туберкулезного комплекса Mycobacterium tuberculosis H37 Rv (ТБ-антигена), характеризующийся тем, что культуру рекомбинантного штамма 2-9XL Acinetobacter johnsonii выращивают на питательной среде при 32 С в течение 3 суток, смывают физиологическим раствором, полученную суспензию бактерий центрифугируют, осадок суспендируют в воде при +4 С, обрабатывают раствором NaOH до рН 6,0-9,0, через 15-16 ч полученную суспензию центрифугируют, осадок подвергают повторной процедуре обработки раствором NaOH, а надосадочную жидкость, содержащую растворенную капсулу бактерий штамма 2-9 XL, нейтрализуют 0,5 N раствором ТХУ до рН 6,0, добавляют сульфат аммония до 30% насыщения, выдерживают при +4 С, центрифугируют, к надосадочной жидкости добавляют сульфат аммония до 100% насыщения, выдерживают при+4 С, при этом с порцией осадка повторно обработанного раствором NaOH проводят нейтрализацию с помощью ТХУ и осаждения сульфатом аммония в вышеуказанной последовательности, два осадка, полученные после 100% насыщения сульфатом аммония, растворяют в PBS буфере рН 7,0, диализируют против большого объема PBS буфера, сконцентрированные растворы, содержащие ТБ-антиген, объединяют и подвергают очистке путем фракционирования гель-фильтрацией на Сефадексе G-200 или с помощью ионообменной хроматографии, элюаты содержат очищенный ТБ-антиген с молекулярной массой от 55,0 до 75,0 кДа и наличием углеводов от 20 до 50%. 4. Средство для формирования В- и Т-клеточного иммунитета против Mucobacterium tuberculosisH37 Rv, содержащее видоспецифический гликопротеиновый туберкулезный комплекс (ТБ-антиген) Mycobacterium tuberculosis H37 Rv, продуцируемый штаммом 2-9XL Acinetobacter johnsonii, охарактеризованным в п.1. 5. Средство для диагностики туберкулеза, содержащее видоспецифический гликопротеиновый туберкулезный комплекс (ТБ-антигена) Mycobacterium tuberculosis H37 Rv, полученный способом по п.2.
МПК / Метки
МПК: C12P 21/00, A61K 39/04, C12N 1/21, G01N 33/531
Метки: способ, свойством, варианты, tuberculosis, туберкулеза, против, иммунитет, средство, mycobacterium, клеточный, формировать, рекомбинантный, получения, обладающее, диагностики, штамм
Код ссылки
<a href="https://eas.patents.su/20-14065-sredstvo-obladayushhee-svojjstvom-formirovat-kletochnyjj-immunitet-protiv-mycobacterium-tuberculosis-h37-rv-sposob-polucheniya-ego-varianty-rekombinantnyjj-shtamm-i-sredstvo-dlya-d.html" rel="bookmark" title="База патентов Евразийского Союза">Средство, обладающее свойством формировать клеточный иммунитет против mycobacterium tuberculosis h37 rv, способ получения его (варианты), рекомбинантный штамм и средство для диагностики туберкулеза</a>
Предыдущий патент: Жидкие препаративные формы карбоксамидов для борьбы с членистоногими вредителями
Следующий патент: Жидкие фармацевтические композиции палоносетрона
Случайный патент: Инсектициды на основе неоникотиноидов и защитных веществ