Твёрдые пероральные фармацевтические композиции для введения один раз в сутки, содержащие прегабалин, матрицеобразующий агент и агент набухания
Номер патента: 12377
Опубликовано: 30.10.2009
Авторы: Шао Зежи Джесс, Маджур Маджид, Шао Пушпа Ганапати, Бокбрадер Хауард Норман, Диас Сантьяго Стивен, Рейнолдз Томас Дэниел, Ван Джианшенг, Чо Юн Хьюнг
Формула / Реферат
1. Фармацевтическая композиция, представляющая собой активный фармацевтический ингредиент и эксципиенты, причем активный фармацевтический ингредиент представляет собой прегабалин или его фармацевтически приемлемый комплекс, соль, сольват или гидрат, а эксципиенты включают матрицеобразующий агент и агент набухания, причем матрицеобразующий агент представляет собой поливинилацетат и поливинилпирролидон, а агент набухания включает поперечно-сшитый поливинилпирролидон, где указанная фармацевтическая композиция адаптирована для перорального введения один раз в сутки.
2. Фармацевтическая композиция по п.1, которая набухает до размера примерно 9 мм или более при контакте с водой.
3. Фармацевтическая композиция по любому из пп.1-2, которая удерживается в желудке субъекта в течение от примерно 3 до примерно 14 ч после перорального введения.
4. Фармацевтическая композиция по любому из пп.1-3, где активный фармацевтический ингредиент высвобождается в течение периода времени, который примерно на 4-6 ч дольше, чем период времени, в течение которого фармацевтическая композиция удерживается в желудке субъекта после перорального введения.
5. Фармацевтическая композиция по любому из пп.1-4, где активный фармацевтический ингредиент высвобождается в течение периода времени от примерно 12 до примерно 20 ч.
6. Фармацевтическая композиция по любому из пп.1-5, в которой активный фармацевтический ингредиент демонстрирует равновесную in vivo CMAX примерно 9 мкг/мл или менее, или равновесную in vivo CMIN примерно 0,7 мкг/мл или более, или равновесную in vivo CMAX примерно 9 мкг/мл или менее и равновесную in vivo CMIN примерно 0,7 мкг/мл или более.
7. Фармацевтическая композиция по любому из пп.1-6, где агент набухания дополнительно включает полиэтиленоксид.
8. Фармацевтическая композиция по любому из пп.1-7, которая биоэквивалентна лекарственному препарату с немедленным высвобождением, содержащему прегабалин, моногидрат лактозы, кукурузный крахмал и тальк.
9. Фармацевтическая композиция по любому из пп.1-8 для лечения состояния или расстройства у субъекта, чувствительного к прегабалину.
10. Фармацевтическая композиция по п.9, где состояние или расстройство выбрано из эпилепсии, боли, диабетической периферической невропатии, постгерпетической невралгии, физиологических состояний, связанных с психомоторными стимуляторами, воспаления, повреждения желудочно-кишечного тракта, алкоголизма, бессонницы, фибромиалгии, тревоги, депрессии, мании и биполярного расстройства.
11. Способ лечения состояния или расстройства у субъекта, чувствительного к прегабалину, включающий введение субъекту фармацевтической композиции по любому из пп.1-8, где указанную фармацевтическую композицию вводят перорально один раз в сутки.
12. Способ по п.11, где состояние или расстройство выбрано из эпилепсии, боли, диабетической периферической невропатии, постгерпетической невралгии, физиологических состояний, связанных с психомоторными стимуляторами, воспаления, повреждения желудочно-кишечного тракта, алкоголизма, бессонницы, фибромиалгии, тревоги, депрессии, мании и биполярного расстройства.
Текст
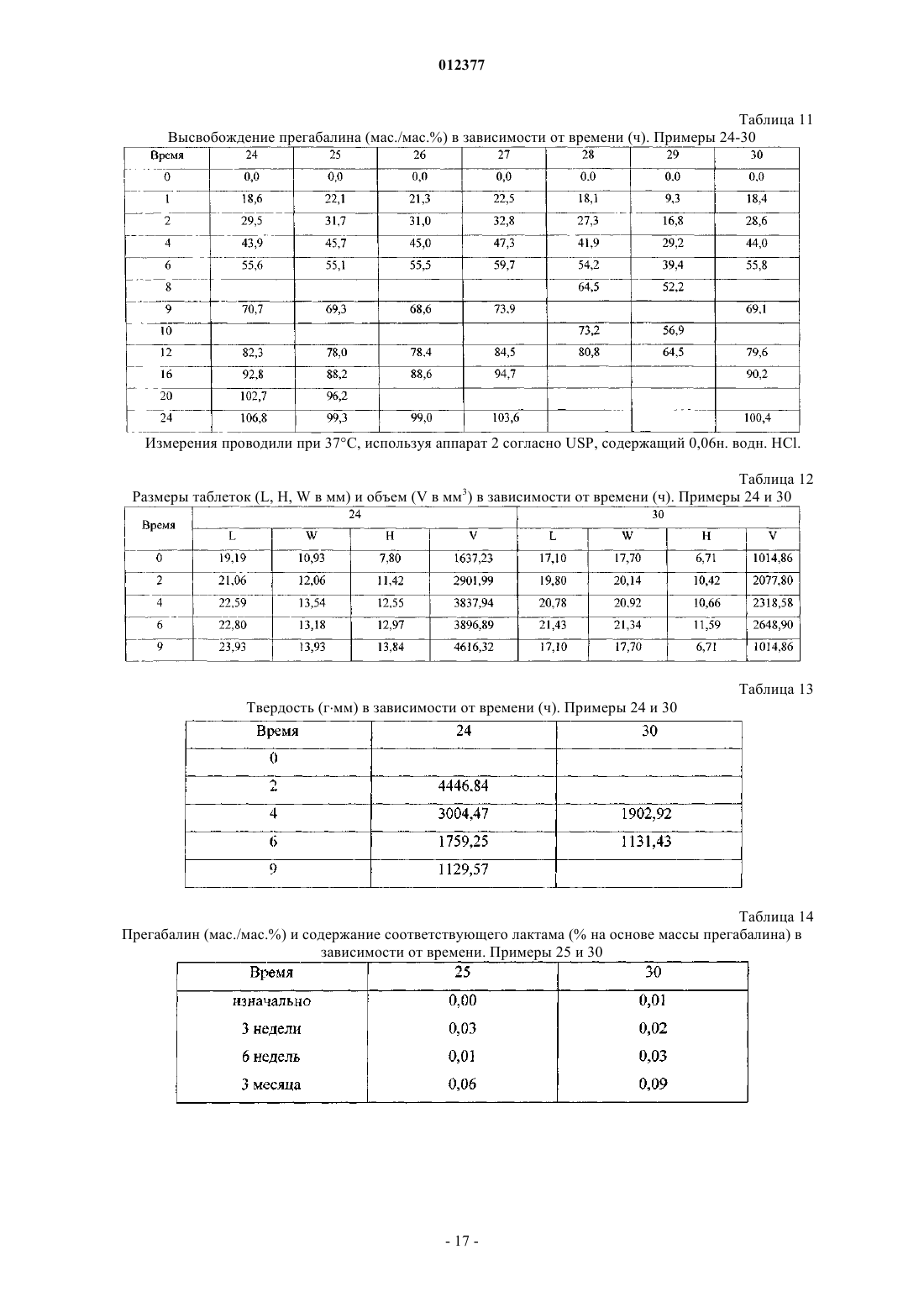
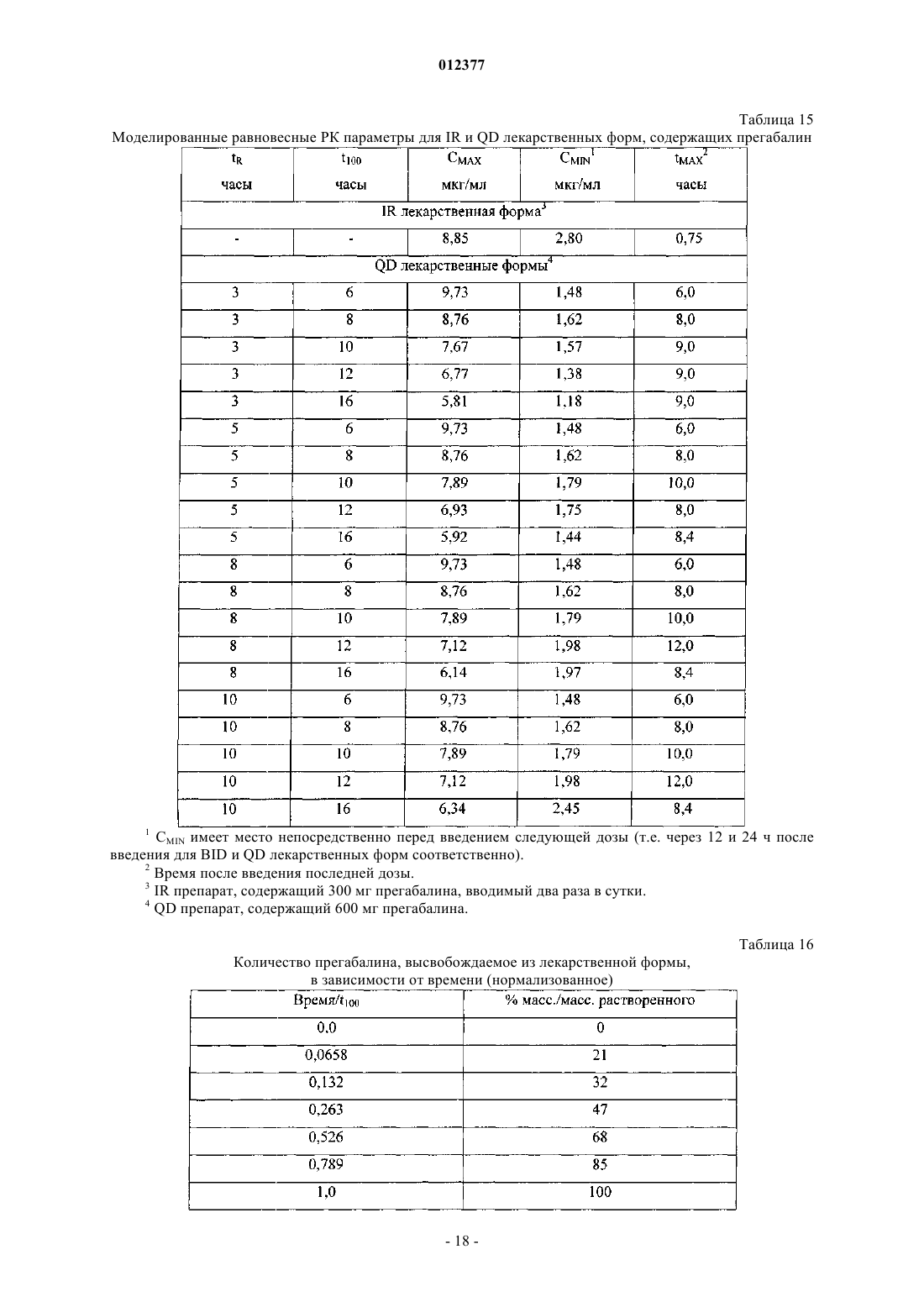
012377 Предшествующий уровень техники Данное изобретение относится к твердым фармацевтическим композициям, содержащим прегабалин, которые подходят для перорального введения один раз в сутки (QD). Прегабалин, или (S)-(+)-3-аминометил-5-метилкапроновая кислота, связывается с альфа-2-дельта(2) субъединицей кальциевого канала и относится к эндогенной ингибиторной нейротрансмиттерной-аминомасляной кислоте (ГАМК), которая вовлечена в регуляцию нейрональной активности головного мозга. Прегабалин проявляет противосудорожную активность, как обсуждается в патенте США 5563175 (R.B. Silverman и др.), и полезен для лечения в числе прочих состояний эпилепсии, боли, физиологических состояний, ассоциированных с психомоторными стимуляторами, воспаления, повреждения желудочно-кишечного тракта, алкоголизма, бессонницы, фибромиалгии и различных психиатрических расстройств, включая тревогу, депрессию, манию и биполярное расстройство. В Соединенных Штатах прегабалин был одобрен для лечения диабетической периферической невропатии, постгерпетической невралгии и в качестве дополнительного лечения для отдельных приступов судорог у взрослых. Прегабалин доступен в виде препарата с немедленным высвобождением (IR, от англ. immediate release) в капсулах и вводится пациентам два или три раза в сутки (BID или TID). Многие пациенты, получающие прегабалин или другие лекарства, которые вводятся два или более раз в сутки, возможно, получили бы пользу от введения один раз в сутки. Удобство QD введения обычно улучшает соблюдение пациентом режима и схемы лечения, особенно это касается пожилых пациентов и пациентов, принимающих разные лекарства. Введение один раз в сутки также может сокращать или предотвращать потенциально нежелательные дозозависимые эффекты посредством уменьшения максимальных уровней в крови (СМАХ), а также может повышать эффективность лекарственного средства посредством повышения минимальных концентраций в плазме (CMIN). Однако введение прегабалина один раз в сутки представляет многочисленные проблемы. Традиционные композиции с продолжительным высвобождением (ER от англ. extended release) являются проблематичными для QD введения, поскольку прегабалин неравномерно всасывается в желудочнокишечном (ЖК) тракте. Клинические исследования показывают, что прегабалин всасывается у людей в тонкой кишке и восходящей ободочной кишке, но плохо всасывается после печеночного изгиба ободочной кишки. Это означает, что среднее окно всасывания для прегабалина составляет в среднем около 6 ч или менее - любое высвобождение лекарственного средства из традиционной ER лекарственной формы свыше 6 ч было бы, таким образом, бесполезным, поскольку лекарственная форма уже пройдет печеночный изгиб. Кроме того, прегабалин является -аминокислотой, которая при нормальных условиях хранения может подвергаться внутримолекулярной циклизации с образованием лактама, 4-изобутилпирролидин-2-она. См., например, WO 99/10186 и WO 99/59573, оба A. Aomatsu. Хотя известно, что неактивные компоненты фармацевтической композиции могут влиять на образование лактама, трудно предсказать, какие эксципиенты могут приводить к нежелательному образованию лактама. Краткое описание сущности изобретения Согласно настоящему изобретению предложена стабильная фармацевтическая композиция, содержащая прегабалин, которая полезна для перорального введения один раз в сутки. При введении в виде твердой лекарственной формы, такой как таблетка, фармацевтическая композиция удерживается в желудке в течение более длительного периода времени, чем IR лекарственная форма. Пока фармацевтическая композиция удерживается в желудке, она непрерывно высвобождает прегабалин. В конце концов,фармацевтическая композиция выходит из желудка в тонкую кишку, где она может продолжить высвобождение прегабалина. Увеличение периода времени, в течение которого прегабалин высвобождается в желудке, эффективно расширяет окно всасывания, связанное с IR введением, допуская таким образомQD введение. Кроме того, исследования стабильности говорят о том, что ни один из компонентов фармацевтической композиции не способствует нежелательному образованию лактама. Согласно одному аспекту изобретения предложена фармацевтическая композиция, которая подходит для QD введения и включает в себя активный фармацевтический ингредиент и эксципиенты. Активный фармацевтический ингредиент включает прегабалин или фармацевтически приемлемый комплекс,соль, сольват или гидрат прегабалина, а эксципиенты включают матрицеобразующий агент и агент набухания. Матрицеобразующий агент включает в себя поливинилацетат (PVAc) и поливинилпирролидон(PVP), а агент набухания включает в себя поперечно-сшитый поливинилпирролидон. Активный фармацевтический ингредиент типично составляет от примерно 5 до примерно 60 мас.% фармацевтической композиции, матрицеобразующий агент типично составляет от примерно 5 до примерно 45 мас.% фармацевтической композиции, и агент набухания типично составляет от примерно 5 до примерно 70 мас.% фармацевтической композиции. Согласно еще одному аспекту изобретения предложена твердая лекарственная форма, такая как таблетка, которая адаптирована для перорального введения один раз в сутки. Твердая лекарственная форма включает фармацевтическую композицию, описанную выше. При контакте с водой, которая присутствует, например, в желудочном соке людей, лекарственная форма набухает или увеличивается до размеров примерно 9 мм или более.-1 012377 Согласно дополнительному аспекту изобретения предложен способ лечения состояния или расстройства у субъекта, чувствительного к прегабалину. Способ включает пероральное введение субъекту один раз в сутки фармацевтической композиции, описанной выше. Согласно другому аспекту изобретения предложен способ лечения состояния или расстройства у субъекта, чувствительного к прегабалину, включающий пероральное введение субъекту фармацевтической композиции один раз в сутки. Фармацевтическая композиция содержит прегабалин и один или более чем один эксципиент. Композиция адаптирована для обеспечения субъекта в любой 24-часовой период единой равновесной максимальной концентрацией прегабалина 9 мкг/мл или менее и равновесной минимальной концентрацией прегабалина примерно 0,7 мкг/мл или более. Подробное описание Определения и сокращения. Если не указано иное, в данном описании используют следующие определения. Термины "примерно", "приблизительно" и т.п. при использовании в отношении численной переменной обычно относятся к значению переменной и ко всем значениям переменной, которые находятся в пределах экспериментальной ошибки (например, в пределах 95% доверительного интервала для среднего значения) или в пределах 10% указанного значения, независимо от того, какое из них больше. Термин "субъект" относится к млекопитающему, включая человека. Термин "фармацевтически приемлемые" вещества относится к тем веществам, которые в рамках тщательной медицинской оценки подходят для применения в контакте с тканями субъектов без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, соответствуют разумному соотношению между пользой и риском и эффективны для предполагаемого применения. Термин "проведение лечения" обычно относится к реверсированию, облегчению, ингибированию развития или предупреждению расстройства или состояния у субъекта или к предупреждению одного или более симптомов такого расстройства или состояния у субъекта. Термин "лечение" относится к действию по "проведению лечения", как определено непосредственно выше. Термины "лекарственное средство", "лекарственное вещество", "активный фармацевтический ингредиент" и т.п. относятся к соединению (например, прегабалину), которое может быть использовано для лечения субъекта, нуждающегося в лечении. Термин "терапевтически эффективное количество" лекарственного средства относится к количеству лекарственного средства, которое может быть использовано для лечения субъекта, и находится обычно в диапазоне от примерно 0,001 до примерно 100 мг/кг/сутки для взрослого и часто находится в диапазоне от примерно 0,1 до примерно 50 мг/кг/сутки для взрослого. Для взрослого человека обычная суточная доза лекарственного средства находится в диапазоне от примерно 1 до примерно 1000 мг. Для прегабалина суточная доза для взрослого человека может находиться в диапазоне от примерно 50 до примерно 1800 мг и часто находится в диапазоне от примерно 50 до примерно 900 мг. Термин "инертные" вещества относится к тем веществам, которые могут влиять на биодоступность лекарственного средства, но во всем остальном являются фармацевтически неактивными. Термин "эксципиент" или "адъювант" относится к любому инертному веществу. Термин "фармацевтическая композиция" относится к комбинации одного или более чем одного лекарственного средства и одного или более чем одного эксципиента. Термины "лекарственный препарат", "фармацевтическая лекарственная форма", "лекарственная форма", "конечная лекарственная форма" и т.п. относятся к фармацевтической композиции, которую вводят субъекту, нуждающемуся в лечении, и которая может обычно находиться в форме таблеток, капсул, саше, содержащих порошок или гранулы, жидких растворов или суспензий, пластырей и т.п. Термин "сольват" описывает молекулярный комплекс, включающий лекарственное средство (например, прегабалин) и стехиометрическое или нестехиометрическое количество молекул одного или более чем одного фармацевтически приемлемого растворителя (например, этанола). Когда растворитель тесно связан с лекарственным средством, тогда полученный комплекс будет иметь хорошо определенную стехиометрию, которая не зависит от влажности. Однако когда растворитель будет слабо связан, как в сольватах с каналами и гигроскопичных соединениях, содержание растворителя будет зависеть от влажности и условий сушки. В таких случаях комплекс часто будет нестехиометрическим. Термин "гидрат" описывает сольват, включающий лекарственное вещество и стехиометрическое или нестехиометрическое количество воды. Термин "удерживается в желудке", при использовании в отношении фармацевтической композиции или лекарственной формы, означает, что по меньшей мере часть лекарственной формы остается в желудке субъекта после перорального введения в течение примерно 3 или более часов, что существенно дольше чем среднее время удерживания соответствующей IR лекарственной формы. Пока лекарственная форма удерживается в желудке, она непрерывно высвобождает лекарственное средство. Термин "высвобождение", "высвобождающаяся" и т.п. при использовании в отношении фармацевтической композиции или лекарственной формы относится к части лекарственного вещества, которая выходит из лекарственной формы после контакта с водной средой. Если не указано иное, то количество-2 012377 лекарственного средства, высвобождающегося из лекарственной формы, измеряют с помощью тестирования растворения в воде (37 С, начальное значение рН 6,8, при использовании аппарата 2), как описано в Фармакопее Соединенных Штатов, издание 28, переработанное и исправленное, глава 711, дополнение второе (1 августа 2005-31 декабря 2005). Результаты тестирования растворения представляют в виде %(мас./мас.), высвобожденного как функция времени или в виде времени высвобождения tN, где N представляет собой % (мас./мас.) высвобожденного или растворенного лекарственного средства. Для целей данного описания полное высвобождение лекарственного средства происходит, когда по меньшей мере 90% лекарственного средства высвобождается из лекарственной формы (т.е. при t90). Термин "равновесная" при использовании в отношении фармакокинетических (ФК) параметров, таких как минимальная (CMIN) и максимальная (СМАХ) концентрации лекарственного вещества в плазме крови субъекта, относится к приблизительно постоянным значениям РК параметров, которые являются следствием повторяющегося введения лекарственной формы при одинаковых интервалах дозирования. Для лекарственных форм, содержащих прегабалин, равновесные значения СМАХ и CMIN обычно составляют от примерно 24 до 48 ч после первого введения. Тестируемая лекарственная форма "биоэквивалентна" эталонной лекарственной форме, если оценка 90%-ного доверительного интервала для отношения среднего значения общего воздействия от лечения тестируемой лекарственной формой к среднему значению общего воздействия от лечения эталонной лекарственной формой лежит в диапазоне от 80 до 125%. В данном описании соотношение выражено в виде процентной доли (100%тест/эталон), а 90%-ный доверительный интервал выражен в виде процентной доли эталонного среднего значения. Для исследований с использованием однократной дозы общее воздействие представляет собой площадь под кривой "концентрация в плазме в зависимости от времени" от начала отсчета времени (время введения) до бесконечности; для равновесных исследований общее воздействие представляет собой площадь под кривой "концентрация в плазме в зависимости от времени" в течение интервала между приемами лекарственного средства. См. Министерство здравоохранения и социального обеспечения США, Управление по контролю за пищевыми продуктами и лекарственными средствами, Центр по оценке и исследованию лекарственных средств, Guidance for Industry,Bioavailability and Bioequivalence Studies for Orally Administered Drug Products - General Considerations"Плохорастворимые" вещества представляют собой вещества, которые классифицируют как "умеренно растворимые", "слаборастворимые", "очень слаборастворимые" или "практически нерастворимые",т.е. соединения, имеющие растворимость одной части воды к примерно 30-100 частям воды, примерно 100-1000 частей воды, примерно 1000-10000 частей воды или примерно 10000 или более частей воды,соответственно, когда измеряют при комнатной температуре и рН от 5 до 7. В табл. 1 приведены сокращения, используемые во всем описании. Любая ссылка в этом описании на температурный диапазон, диапазон рН, массовый (весовой) диапазон, диапазон молекулярных масс, процентный диапазон и т.д., в которой прямо используется любое из слов "диапазон" или "диапазоны", включает в себя указанные конечные точки и точки между этими конечными точками. Как указано выше, пероральная фармацевтическая композиция содержит активный фармацевтический ингредиент (API) и эксципиенты. Активный фармацевтический ингредиент включает в себя прегабалин или его фармацевтически приемлемый комплекс, соль, сольват или гидрат. API обычно составляет от примерно 5 до примерно 60 мас.% фармацевтической композиции, что обычно будет соответствовать твердой лекарственной форме (например, таблетке), которая содержит от примерно 50 до примерно 600 мг прегабалина. Другие полезные активные фармацевтические ингредиенты могут включать, помимо прегабалина, ингредиенты, имеющие сходные период полувыведения (например, около 9 ч или менее) и характеристики всасывания в ЖК тракте.-5 012377 Прегабалин может быть получен с использованием известных способов. В некоторых из этих способов рацемическую смесь 3-аминометил-5-метилгексановой кислоты синтезируют и потом разделяют на R- и S-энантиомеры. Такие способы описаны в патенте США 5563175 R.В. Silverman др., патенте США 6046353 Т.М. Grote и др., патенте США . 5840956 Т.М. Grote и др., патенте США 5637767 Т.М. Grote и др., патенте США 5629447 B.K. HuckabeeD.M. Sobieray, и патенте США 5616793B.K. HuckabeeD.M. Sobieray. В каждом из этих способов рацемат подвергают взаимодействию с хиральной кислотой (разделяющий агент) с образованием пары диастереоизомерных солей, которые разделяют известными методами, такими как фракционированная кристаллизация и хроматография. В других способах прегабалин синтезируют непосредственно с использованием хирального вспомогательного вещества (4R,5S)-4-метил-5-фенил-2-оксазолидинона. См., например, патент США 6359169; 6028214; 5847151; 5710304; 5684189; 5608090 и 5599973, все Silverman и др. В другом способе прегабалин получают с помощью ассиметрического гидрирования цианозамещенных олефинов с получением хирального циано-предшественника (S)-3-аминометил-5-метилгексановой кислоты, которую затем восстанавливают с получением прегабалина. См. заявку на патент США 2003/0212290 A1 Burk и др. В фармацевтической композиции можно использовать любую фармацевтически приемлемую форму прегабалина, включая его свободную форму (цвиттер-ион), и его фармацевтически приемлемые комплексы, соли, сольваты, гидраты и полиморфы. Соли включают в себя, без ограничения, соли присоединения кислот и соли присоединения оснований, включая полусоли. Фармацевтически приемлемые соли присоединения кислот могут включать в себя нетоксичные соли, производные неорганических кислот,таких как соляная, азотная, фосфорная, серная, бромисто-водородная, йодисто-водородная, фтористоводородная, фосфористая и т.п., а также нетоксичные соли, производные органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандикарбоновые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.д. Потенциально полезные соли включают в себя ацетат, аспартат, бензоат, хлорбензоат, метилбензоат, динитробензоат, безилат, бикарбонат, карбонат, бисульфат, сульфат, пиросульфат,бисульфит, сульфит, борат, камсилат, каприлат, цитрат, эдизилат, эзилат, формиат, фумарат, глуцептат,глюконат, глюкуронат, гексофторфосфат, гибензат, гидрохлорид, хлорид, гидробромид, бромид, гидройодид, йодид, изетионат, изобутират, лактат, малат, малеат, малонат, манделат, мезилат, метилсульфат,нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат, дигидрофосфат,гидрофосфат, метафосфат, пирофосфат, фталат, пропионат, сахарат, себакат, стеарат, суберат, сукцинат,тартрат, тозилат, трифторацетат и т.п. Фармацевтически приемлемые соли оснований могут включать в себя нетоксичные соли, производные оснований, включая катионы металлов, такие как катион щелочного или щелочно-земельного металла, а также амины. Примеры потенциально полезных солей включают в себя, без ограничения, соли алюминия, аргинина, N/N'-дибензилэтилендиамина, кальция, хлорпрокаина, холина, диэтаноламина, диэтиламина, дициклогексиламина, этилендиамина, глицина, лизина, магния, N-метилглюкамина, оламина,калия, прокаина, натрия, трометамина, цинка и т.п. Для рассмотрения полезных солей присоединения кислот и оснований см. S.M. Berge et al., J. of Pharm. Sci., 66:1-19 (1977); см. также Stahl and Wermuth,Handbook of Pharmaceutical Salts: Properties, Selection, and Use (2002). Фармацевтически приемлемые соли прегабалина могут быть получены путем взаимодействия его свободной (или цвиттер-ионной) формы с желаемой кислотой или основанием; посредством удаления кислото- или щелочно-лабильной защитной группы с подходящего предшественника прегабалина; посредством раскрытия кольца подходящего циклического (лактамного) предшественника при использовании желаемой кислоты или основания; или посредством превращения одной соли прегабалина в другую посредством взаимодействия с соответствующей кислотой или основанием или посредством контактирования с подходящей ионообменной колонкой. Все эти преобразования типично проводят в растворителе. Полученная соль может выпасть в осадок и может быть собрана фильтрацией или может быть извлечена посредством выпаривания растворителя. Степень ионизации полученной соли может варьировать от полностью ионизированной до почти неионизированной. Прегабалин может существовать в несольватированной и сольватированной формах (включая гидраты) и в форме других многокомпонентных комплексов, в которых лекарственное средство и по меньшей мере один дополнительный компонент присутствуют в стехиометрических или нестехиометрических количествах. Многокомпонентные комплексы (кроме солей и сольватов) включают в себя клатраты(комплексы включения лекарственное средство-хозяин) и фармацевтические сокристаллы. Последние определяют как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны друг с другом посредством нековалентных взаимодействий. Сокристаллы могут быть получены посредством кристаллизации из расплава, посредством перекристаллизации из растворителей или посредством физического растирания компонентов друг с другом. См., например, О. AlmarssonМ.J. Zaworotko,Chem. Comm. 1889-1896 (2004). Для общего обзора многокомпонентных комплексов см. J.K. Haleblian, J.Pharm. Sci. 64(8): 1269-88 (1975). Полезные формы прегабалина включают в себя все его полиморфы и кристаллические формы, соответствующий R-энантиомер прегабалина и различные смеси прегабалина и R-энантиомера, включая-6 012377 рацемическую смесь прегабалина и R-энантиомера. Кроме того, в фармацевтической композиции могут быть использованы пролекарства прегабалина. Такие пролекарства могут быть получены путем замещения соответствующих функциональных групп прегабалина функциональными группировками, известными как "прогруппировки", как описано, например, в H. Bundgaar, Design of Prodrugs (1985). Таким образом, примеры пролекарств будут включать в себя производные прегабалина, в которых сложноэфирная группа замещает карбоксикислотную группу,или амидная группа замещает аминогруппу. Полезные формы прегабалина могут также включать в себя фармацевтически приемлемые, меченые изотопами соединения, в которых один или более чем один атом замещен атомами, имеющими такой же атомный номер, но атомная масса или массовое число отличается от атомной массы или массового числа, которое преобладает в природе. Примеры изотопов, подходящих для включения в прегабалин,включают в себя изотопы водорода (2 Н и 3 Н), углерода (11 С, 13 С и 14 С) и азота (13N и 15N). Меченые изотопами формы прегабалина обычно могут быть получены с помощью методов, известных специалистам в данной области техники. В дополнение к API, фармацевтическая композиция содержит различные эксципиенты, включая матрицеобразующий агент и агент набухания. Для пероральных твердых лекарственных форм (например, таблеток) матрицеобразующий агент придает структурную целостность и помогает контролировать или замедлять скорость высвобождения лекарственного средства наряду с другими функциями. Матрицеобразующий агент может составлять от примерно 5 до примерно 45 мас.% фармацевтической композиции и часто составляет от примерно 20 до примерно 35 мас.% фармацевтической композиции. Полезные матрицеобразующие агенты включают в себя физические смеси поливинилацетата(PVAc) и поливинилпирролидона (PVP). Поливинилпирролидон (PVP), который также известен как повидон или повидонум, представляет собой гомополимер 1-винилпирролидин-2-она, типично имеющий молекулярную массу (Mw) от примерно 1103 до примерно 1107, от примерно 2,5103 до примерно 3106 или от примерно 1104 до примерно 1105. Поливинилпирролидон поставляется BASF под торговым наименованием KOLLIDON и ISP под торговым наименованием PLASDONE. Поливинилацетат(PVAc) представляет собой гомополимер винилацетата, типично имеющий молекулярную массу (Mw) от примерно 1105 до примерно 1106. На основании общей массы PVAc и PVP матрицеобразующий агент может содержать от примерно 0 до примерно 90 мас.% PVAc, от примерно 20 до примерно 90 мас.%PVAc, от примерно 40 до примерно 90 мас.% PVAc, от примерно 60 до примерно 90 мас.% PVAc, от примерно 70 до примерно 90 мас.% PVAc или от примерно 80 до примерно 90 мас.% PVAc. Во многих случаях матрицеобразующий агент включает от примерно 70 до примерно 85 мас. % PVAc на основании общей массы PVAc и PVP. Полезный матрицеобразующий агент поставляется BASF под торговым наименованием KOLLIDON SR, который номинально представляет собой 80/19 (мас./мас.) смесь PVAc иPVP соответственно. Фармацевтическая композиция содержит другие эксципиенты, включая агент набухания. Как следует из его названия, агент набухания абсорбирует воду из желудочного сока, что вызывает набухание твердой лекарственной формы и может также влиять на скорость высвобождения лекарственного средства, например, путем создания каналов или путем образования гидроколлоида. Агенты набухания могут быть растворимыми или не растворимыми в воде. Агент набухания может составлять от примерно 5 до примерно 70 мас.% фармацевтической композиции, от примерно 10 до примерно 70 мас.% фармацевтической композиции или от примерно 15 до примерно 70 мас.% фармацевтической композиции. Во многих случаях агент набухания может составлять от примерно 10 до примерно 55 мас.% фармацевтической композиции, от примерно 20 до примерно 55 мас.% фармацевтической композиции или от примерно 30 до примерно 55 мас.% фармацевтической композиции. Полезные агенты набухания включают в себя поперечно-сшитые гомополимеры 1 винилпирролидин-2-она, которые известны как кросповидон, кросповидонум, поперечно-сшитый повидон и поливинилполипирролидон (PVPP). Кросповидоны, которые не растворимы в воде, поставляютсяBASF под торговыми наименованиями KOLLIDON CL и KOLLIDON CL-10 и ISP под торговыми наименованиями POLYPLASDONE XL и POLYPLASDONE XL-10. Помимо кросповидонов агент набухания может включать в себя полиэтиленоксид (РЕО), который также известен как полиоксиран и полиоксиэтилен. Полиэтиленоксиды представляют собой гомополимеры этиленоксида, типично имеющие молекулярную массу (Mw) от примерно 1105 до примерно 1107 или от примерно 1106 до примерно 1107. Полиэтиленоксиды разных марок на основании молекулярной массы имеются и поставляются Union Carbide под торговым наименованием POLYOX. При использовании совместно с кросповидоном РЕО типично составляет от примерно 5 до примерно 35% или от примерно 10 до примерно 25 мас.% фармацевтической композиции, а кросповидон типично составляет от примерно 10 до примерно 35% или от примерно 20 до примерно 30 мас.% фармацевтической композиции. Кроме матрицеобразующего агента и агента набухания фармацевтическая композиция может возможно содержать желатинирующий агент, который модифицирует (например, продлевает) свойства вы-7 012377 свобождения лекарственного средства из лекарственной формы. Желатинирующие агенты, которые также известны как гидроколлоиды, включают в себя синтетические и природные полимеры, которые обычно плохо растворимы (например, от слаборастворимых до труднорастворимых) в воде. Под воздействием воды желатинирующий агент образует вязкую смесь (т.е. с вязкостью, большей чем у воды), которая замедляет диффузию лекарственного средства из лекарственной формы, продлевая, таким образом,время высвобождения лекарственного средства из лекарственной формы. Желатинирующий агент типично составляет от примерно 0 до примерно 25%, от примерно 5 до примерно 25% или от примерно 5 до примерно 20 мас.% фармацевтической композиции. Полезные желатинирующие агенты включают в себя карбомеры, полисахариды или и то, и другое. Карбомеры представляют собой полимеры акриловой кислоты, которые поперечно сшиты аллилсахарозой или аллиловыми эфирами пентаэритритола, и известны под разными названиями как карбоксиполиметилен, полиакриловая кислота и карбоксивинилполимеры. Карбомеры имеют от примерно 56 до примерно 68% карбоксильных группировок по сухой массе и имеют среднечисленные молекулярные массы от примерно 1105 до примерно 11010 или от примерно 7105 до примерно 4109. Карбомеры поставляются RITA под торговым наименованием ACRITAMER и Noveon под торговыми наименованиями CARBOPOL и PEMULEN. Типичные полисахариды включают в себя ксантановую камедь, инулин, гуаровую камедь, хитозан,камедь рожкового дерева и каррагинан либо отдельно, либо в комбинации. Ксантановая камедь, которая также известна как камедь кукурузного сахара, является полисахаридом, имеющим молекулярную массу(Mw) примерно 2106. Полимер состоит из первичной цепи остатков -D-глюкозы, связанных посредством (14) гликозидных связей, а также боковых трисахаридных цепей, которые присоединены к чередующимся остаткам глюкопиранозы. Каждая из боковых цепей состоит из остатка -D-глюкуроновой кислоты, который связан с остатком -D-маннозы и остатком -D-маннозы посредством (14) и (12) гликозидных связей соответственно. Остаток -D-маннозы связан с первичной цепью посредством(13) гликозидной связи, а большинство терминальных остатков -D-маннозы связаны с остатками пирувата. Ксантановую камедь типично получают в виде натриевой, калиевой или кальциевой соли, и разные марки, имеющие разные размеры частиц, поставляются СР Kelco под торговыми наименованиямиKELTROL и XANTURAL, Rhodia под торговым наименованием RHODIGEL и R.T. Vanderbilt Company, Inc. под торговым наименованием VANZAN. Инулин, который также известен как олигофруктоза и полифруктоза, представляет собой класс природных полисахаридов, состоящих из линейной цепи остатков -D-фруктозы, связанных посредством(21) гликозидных связей, которая обычно заканчивается молекулой глюкозы. Число остатков Dфруктозы может варьировать от 2 до примерно 140, но типично варьирует от примерно 25 до примерно 30. Инулины поставляются Sensus Operations CV под торговым наименованием FRUTAFIT. Гуаровая камедь, которая также известна как гуаровый галактоманнан, гуаровая мука и ягуаровая смола, представляет собой гидроколлоидный полисахарид, имеющий молекулярную массу (Mw) примерно 2105. Гуаровая камедь состоит из линейной цепи остатков -D-маннозы, связанных посредством(14) гликозидных связей и имеющих боковые моносахаридные цепи, состоящие из остатков -Dгалактозы, связанных с остатками глюкопиранозы посредством (16) гликозидных связей. Отношение остатков -D-маннозы к остаткам -D-галактозы обычно варьирует от примерно 1:1,4 до примерно 1:2, а среднечисленная молекулярная масса типично составляет примерно 2105. Гуаровую камедь получают из природных источников, но синтетические производные также доступны, включая ацетат гуара, фталат гуара, фталат ацетата гуара, окисленную гуаровую камедь и гуара карбоксиметил натрия. Гуаровая камедь с разным размером частиц поставляется Aqualon под торговым наименованием GALACTASOL иDanisco под торговыми наименованиями MEYPRO Guar и MEYPRODOR. Хитозан известен под различными названиями, включая гидрохлорид хитозана, гидрохлорид хитозония, деацетилированный хитин, деацетилхитин, поли-Р-(1,4)-2-амино-2-дезокси-D-глюкоза, 2-амино-2 дезокси-(1,4)D-глюкопиранан, -1,4-поли-D-глюкозамин, поли-D-глюкозамин и поли-(1,4Dглюкопиранозамин). Хитозан представляет собой класс труднорастворимых в воде полисахаридов, состоящих из сополимеров -D-глюкозамина и N-ацетилD-глюкозамина, которые получают посредством деацетилирования и деполимеризации хитина. Степень деацетилирования и деполимеризации варьирует в зависимости от производителя, но типичными являются деацетилирование на примерно 80% или более и среднечисленные молекулярные массы от примерно 1104 до примерно 1106. Камедь рожкового дерева представляет собой природный полисахарид, который также известен как камедь бобов рожкового дерева, мука рожкового дерева, камедь из плодов цератонии, чеширская камедь,камедь плодов рожкового дерева и Иоаннов хлеб. Подобно гуаровой камеди камедь рожкового дерева представляет собой галактоманнан. Она состоит из первичной цепи остатков P-D-маннозы, связанных посредством (14) гликозидных связей, и включает в себя боковые цепи, состоящие из единичных остатков -D-галактозы, которые связаны с каждым четвертым или пятым остатком D-маннопиранозы посредством (16) гликозидных связей. Молекулярная масса (Mw) камеди рожкового дерева может коле-8 012377 баться в пределах от примерно 5104 до примерно 3106. Камедь рожкового дерева с разными размерами частиц поставляется Danisco под торговыми наименованиями GRINDSTED LBG и MEYPRO LBG. Каррагинан, который также известен как экстракт хондруса и экстракт ирландского мха, представляет собой гидроколлоидный полисахарид, состоящий в основном из сополимеров калиевых, натриевых,кальциевых, магниевых и аммонийных солей сульфоэфиров D-галактозы и 3,6-ангидро-D-галактозы. Остатки пиранозы связаны посредством чередующихся (13) и (14) гликозидных связей. Существует по меньшей мере три типа каррагинана, известных как -каррагинан, -каррагинан и -каррагинан,которые отличаются количеством остатков сульфоэфира и 3,6-ангидрогалактопиранозы. -Каррагинан представляет собой негелеобразующий полимер, который содержит примерно 35 мас.% сульфоэфирных групп и не содержит остатков 3,6-ангидрогалактозы; -каррагинан представляет собой гелеобразующий полимер, который содержит примерно 32 мас.% сульфоэфирных групп и примерно 30% остатков 3,6 ангидрогалактозы; и -каррагинан представляет собой сравнительно более прочный (т.е. неэластичный,хрупкий или плотный) гелеобразующий полимер, который содержит примерно 25 мас.% сульфоэфирных остатков и примерно 34% остатков 3,6-ангидрогалактозы. Каррагинан представлен в нескольких марках на основе типа гелеобразования, растворимости в воде и вязкости при смешивании с водой и может быть приобретен у FMC Corporation под торговыми наименованиями GELCARIN, VISCARIN иSEASPEN. Другие полезные полисахариды включают в себя производные целлюлозы, которые демонстрируют растворимость в воде свыше по меньшей мере одной порции в диапазоне рН от 1 до 8 включительно. Полезные полимеры, таким образом, включают ионизирующиеся и неионизирующиеся целлюлозные полимеры, включая те, которые имеют эфирные или сложноэфирные или и эфирные, и сложноэфирные заместители и их сополимеры, включая так называемые "энтеральные" и "неэнтеральные" полимеры. Типичные ионные целлюлозные полимеры включают в себя карбоксиметилцеллюлозу (CMC) и ее натриевую или кальциевую соль; карбоксиэтилцеллюлозу (СЕС); карбоксиметилэтилцеллюлозу (СМЕС); фталат ацетата гидроксиэтилметилцеллюлозы; сукцинат ацетата гидроксиэтилметилцеллюлозы; фталат гидроксипропилметилцеллюлозы (НРМСР); сукцинат гидроксипропилметилцеллюлозы; фталат ацетата гидроксипропилцеллюлозы (НРСАР); сукцинат ацетата гидроксипропилцеллюлозы (HPCAS); фталат ацетата гидроксипропилметилцеллюлозы (НРМСАР); сукцинат ацетата гидроксипропилметилцеллюлозы(HPMCAS); тримеллитат ацетата гидроксипропилметилцеллюлозы (НРМСАТ); фталат бутирата гидроксипропилцеллюлозы; карбоксиметилэтилцеллюлозу и ее натриевую соль; фталат ацетата целлюлозы(САР); фталат ацетата метилцеллюлозы; тримеллитат ацетата целлюлозы (CAT); терефталат ацетата целлюлозы; изофталат ацетата целлюлозы; фталат пропионата целлюлозы; тримеллитат пропионата целлюлозы; тримеллитат бутирата целлюлозы и их смеси. Ионные целлюлозные полимеры доступны от многих торговых поставщиков. Например, натрий-CMC можно приобрести у Hercules под торговыми наименованиями AQUALON и BLONASE различных марок, в зависимости от размера частиц и степени (например, от примерно 0,7 до примерно 1,2) замещения карбоксиметильных групп в ангидроглюкозных звеньях. Типичные неионные целлюлозные полимеры включают в себя метилцеллюлозу (МС); этилцеллюлозу (ЕС); гидроксиэтилцеллюлозу (НЕС); гидроксипропилцеллюлозу (НРС); гидроксипропилметилцеллюлозу (НРМС); ацетат гидроксипропилметилцеллюлозы; гидроксиэтилметилцеллюлозу; ацетат гидроксиэтилцеллюлозы; гидроксиэтилэтилцеллюлозу и их смеси. Неионные целлюлозные полимеры доступны от многих торговых поставщиков. Например, МС можно приобрести у Dow Chemical Company под торговым наименованием METHOCEL А, она имеет от примерно 27,5 до примерно 31,5% метоксигрупп на ангидроглюкозное звено в зависимости от массы; НРС можно приобрести у Hercules под торговым наименованием KLUCEL различных марок (например EF, EXF, LF, JF, GF, MF, HF и HXF), которые имеют молекулярные массы, изменяющиеся в диапазоне от примерно 8104 до примерно 1,2106(Mw); НЕС можно приобрести у Hercules под торговым наименованием NATROSOL 250 различных марок (например L, G, М, Н, Н и ННХ), которые имеют молекулярные массы, изменяющиеся в диапазоне от примерно 9104 до примерно 1,3106 (Mv); HPMC можно приобрести у Hercules под торговым наименованием BENECEL различных марок (например, МР 843, МР 814, МР 824, МР 844 и МР 874) в зависимости от вязкости водного раствора и у DOW Chemical Company под торговым наименованиемMETHOCEL различных марок (например, Е, F, J, K и 310), которые имеют от примерно 18 до примерно 29% и от примерно 5 до примерно 27% метокси- и 2-гидроксипропоксигрупп на ангидроглюкозное звено в зависимости от массы соответственно. Фармацевтическая композиция может возможно содержать одно или более чем одно смазывающее вещество, которое помогает на различных технологических стадиях, включая смешивание компонентов и таблетирование. Когда они присутствуют, смазывающие вещества типично составляют от примерно 0,5 до примерно 2 мас.% фармацевтической композиции. Типичные смазывающие вещества включают в себя тальк, стеариновую кислоту и ее металлические соли, включая стеарат кальция, стеарат магния и стеарат цинка; сложные эфиры стеариновой кислоты, включая полиоксиэтиленстеарат, глицерилмоно-9 012377 стеарат, глицерилпальмитостеарат и т.п.; глицерилбегенат (например, COMPRITOL, который поставляется Gattefosse Inc.), лаурилсульфат натрия, гидрированное растительное масло, минеральное масло,полоксамеры (сополимеры этиленоксида и пропиленоксида), полиэтиленгликоль, хлорид натрия и их смеси. Фармацевтическая композиция может содержать другие эксципиенты, такие как разбавители и наполнители, которые составляют от примерно 0 до примерно 30 мас.% композиции. Разбавители могут улучшать реологические свойства фармацевтической композиции во время смешивания компонентов и таблетирования и могут улучшать физические свойства таблеток, обеспечивая, например, повышенные предел прочности или твердость при сжатии, пониженную хрупкость и т.д. Типичные разбавители включают в себя моносахариды, дисахариды, многоатомные спирты и их смеси, такие как декстроза, моногидрат лактозы, высушенный распылением моногидрат лактозы, безводная лактоза, сахароза, маннит,высушенный распылением маннит, ксилит и сорбит. Другие полезные разбавители могут включать в себя микрокристаллическую целлюлозу, крахмал, прежелатинизированный крахмал, дигидрофосфат кальция, безводный дикальцийфосфат и их смеси. Для приготовления лекарственного препарата компоненты фармацевтической композиции типично смешивают в сухом виде, используя, например, v-образный смеситель. Полученную смесь затем прессуют на прессе с получением индивидуальных (стандартных) дозировок (таблеток). Для улучшения гомогенности продукта компоненты можно объединять и смешивать постадийно. Например, API можно гранулировать с одним или более компонентами посредством, например, гранулирования в псевдоожиженном слое или экструзионного гранулирования, а затем смешивать с остальными компонентами. Аналогично, API можно сначала смешать в сухом виде с одним или более матрицеобразующими агентами, тогда как другие эксципиенты, такие как агенты набухания, желатинирующие агенты, разбавители, смазывающие вещества и т.п. могут быть добавлены в смесь позднее за одну или более чем одну операцию смешивания. При необходимости, перед смешиванием один или более компонентов можно сортировать по размеру посредством просеивания, или размельчения, или и того, и другого. Для приготовления лекарственного препарата прессованные лекарственные формы могут быть подвергнуты дальнейшей обработке, такой как полировка, нанесение покрытия и т.п. Для рассмотрения сухого смешивания, влажного и сухого гранулирования, измельчения, просеивания, таблетирования, нанесения покрытия и т.п., а также описания альтернативных методик приготовления лекарственных препаратов см. A.R. Gennaro (ed.),Remington: The Science and Practice of Pharmacy (20th ed., 2000); H.A. Lieberman et al. (ed.), PharmaceuticalGranulation Technology, Vol. 57(1997). Фармацевтическая композиция проглатывается целиком и начинает набухать или расширяться при контакте с желудочным соком (водой) в желудке субъекта. Лекарственная форма может иметь любую форму и включает в себя дисковидные или овальные таблетки, ограниченные парой округлых или эллиптических выпуклых или плоских поверхностей, которые соединены сплошной, по существу, плоской боковой поверхностью; многоугольные (например, треугольные, четырехугольные, пятиугольные, шестиугольные и т.д.), которые имеют закругленные углы и края и ограничены парой выпуклых или плоских многогранных поверхностей (например, треугольников, четырехугольников, пятиугольников, шестиугольников и т.д.), которые соединены, по существу, плоскими боковыми поверхностями; и цилиндрические таблетки, имеющие полусферические или полусфероидальные края и имеющие округлые или эллиптические поперечные сечения.QD лекарственная форма может удерживаться в желудке посредством эксклюзии по размеру, введения с пищей, введения перед сном или какой-либо комбинацией этих механизмов. Для удержания при помощи только эксклюзии по размеру лекарственная форма набухает до размера, который препятствует ее выходу из желудка через привратник. Поскольку средний диаметр привратника у взрослого человека составляет примерно 13 мм, размер лекарственной формы после увеличения должен изменяться в диапазоне от примерно 13 до примерно 20 мм или более, от примерно 15 до примерно 20 мм или более или от примерно 17 до примерно 20 мм или более. В данном описании термин "размер" лекарственной формы соответствует наибольшему линейному размеру поперечного сечения лекарственной формы, имеющего наименьшую площадь. Например, размер дисковидной таблетки соответствует ее диаметру, а размер цилиндрической таблетки соответствует диаметру ее кругового поперечного сечения или продольной оси ее эллиптического поперечного сечения. Для достижения QD введения, лекарственная форма удерживается в желудке в течение нескольких часов (например, tR 3, 4, 5 или 6 ч) и высвобождает прегабалин в течение длительного периода времени(например, t90 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 ч). Лекарственная форма обычно удерживается в желудке субъекта в течение периода времени, который варьирует в диапазоне от примерно 3 до примерно 11 ч (3tR11), от примерно 6 до примерно 14 ч (6tR14) или от примерно 8 до примерно 14 ч(8tR14), и она высвобождает прегабалин в течение периода времени, который варьирует в диапазоне от примерно 12 до примерно 16 ч (12t9016), от примерно 12 до примерно 18 ч (12t9018), от примерно 12 до примерно 20 ч (12t9020), от примерно 14 до примерно 20 ч (14t9020) или от примерно 16 до при- 10012377 мерно 20 ч (16t9020). Как описано в РК имитационном моделировании в примерах ниже, оказывается,что QD лекарственные формы, которые высвобождают прегабалин в течение периода времени, который примерно на 4-6 ч больше, чем период времени, в течение которого лекарственная форма удерживается в желудке, сводят к минимуму вариабельность среди пациентов. Поскольку прием пищи замедляет опорожнение желудка, а сон снижает моторику ЖК тракта, лекарственную форму можно вводить один раз в сутки после еды или перед сном (например, в пределах примерно одного часа перед сном). Чтобы использовать оба эффекта и дополнительно продлить высвобождение лекарственного средства, QD лекарственную форму можно принимать после последнего приема пищи перед сном (например, после ужина). Что касается QD лекарственных форм, принимаемых с пищей, или принимаемых перед сном, или принимаемых с пищей и перед сном, то лекарственная форма может удерживаться в желудке с небольшим увеличением или без увеличения размера. В таких случаях,например, размер лекарственной формы после набухания может составлять примерно 9 мм или более. В течение любого 24-часового периода QD лекарственная форма достигает равновесной СМАХ, которая примерно равна или меньше чем равновесная СMAX соответствующего лекарственного препарата с немедленным высвобождением API, который принимают два или три раза в сутки. Аналогично, QD препарат идеально достигает равновесной CMIN, которая примерно равна или больше чем равновесная CMINIR препарата, который принимают два или три раза в сутки. IR препарат, содержащий 300 мг прегабалина, который принимают два раза в сутки, демонстрирует среднюю равновесную СMAX примерно 8,9 мкг/мл и среднюю равновесную CMIN примерно 2,8 мкг/мл, a IR препарат, содержащий 150 мг прегабалина, который принимают два раза в сутки, демонстрирует среднюю равновесную СMAX примерно 4,4 мкг/мл и среднюю равновесную CMIN примерно 1,4 мкг/мл. QD препарат, содержащий прегабалин, должен идеально достигать средней равновесной СMAX примерно 9 мкг/мл или менее и средней равновеснойCMIN примерно 0,7 мкг/мл или более. Примеры Следующие примеры предназначены для иллюстрации, а не для ограничения изобретения. Если не указано иное, следующие методики используют для оценки высвобождения лекарственного средства(растворения в воде), набухания, твердости и стабильности лекарственного препарата в зависимости от времени. Растворение лекарственного препарата. Количество API, высвобождаемого из образцов лекарственных препаратов, погруженных в водные среды для растворения (0,06 н. HCl или 0,5 М ацетатный буфер) при 37 С, оценивают с помощью аппарата 2 согласно USP (лопастные мешалки) или аппарата 3 (поршневой цилиндр), которые функционируют при 50 rpm или 5 dpm соответственно. Образцы сред для растворения (1 мл) типично отбирают через 1, 2,4, 6, 9, 12, 16 и 24 ч и анализируют с помощью HPLC при следующих условиях: колонка: Zorbax SB-CN,150 мм 4,6 мм, размер частиц 5 мкм; температура колонки 23 С; длина волны детектора 210 нм; скорость потока 1 мл/мин; вводимый объем: 25 мкл; состав подвижной фазы: 0,05 М сульфоновая кислота/гексан и 2 мл Et3N; pH доводят до 3,1 с помошью смеси ортофосфорная кислота:ACN (880:130); время прохождения 8 мин. Набухание лекарственного препарата. Увеличение размера лекарственного препарата в зависимости от времени после погружения в 0,06 н.HCl водные среды для растворения осуществляют с помощью аппарата 2 согласно USP (лопастные мешалки). Образцы лекарственного препарата периодически извлекают из сред для растворения и измеряют их размеры с помощью штангенциркуля. Твердость лекарственного препарата. Образцы лекарственного препарата помещают в аппарат 2 согласно USP (лопастные мешалки), содержащий 0,06 н. HCl водные среды для растворения. Образцы лекарственного препарата периодически извлекают и измеряют их твердость с помощью текстурного анализатора (ТА 132) со следующими параметрами установки: загрузочная ячейка 5 кг; наконечник с шариком ТА-8 1/4" (6,35 мм); усилие включения 0,5 г; скорость тестирования 0,2 мм/с; скорость обегания 10 точек/с; расстояние 10 мм. Стабильность лекарственного препарата. Тестирование стабильности проводят путем помещения образцов лекарственного препарата в открытые бутылки из HDPE или индукционно запаянные бутылки из HDPE, которые хранят при 40 С и относительной влажности 75%. Образцы лекарственного препарата извлекают через различные промежутки времени например через 2 недели для начального отбора и через 3 недели, 6 недель или 3 месяца для последующей проверки, и анализируют на содержание прегабалина (мас./мас.%) и содержание лактама (%, масса лактама/начальная масса прегабалина) с помощью HPLC. Примеры 1-11. Табл. 2 и 3 показывают композиции из лабораторных партий (25 г), содержащие прегабалин и различные эксципиенты; табл. 4 и 5 показывают результаты высвобождения лекарственного средства в зависимости от времени. Для каждого из препаратов готовую лекарственную форму приготавливали посредством смешивания всех компонентов таблетки, за исключением стеарата магния, в смесителе TUR- 11012377BULA в течение примерно 15 мин. Стеарат магния просеивали через стандартное сито 20 и объединяли с содержимым смесителя TURBULA с помощью шпателя. Полученную грубую смесь затем перемешивали в смесителе TURBULA в течение еще 4 мин с получением конечной смеси. Каждую из конечных смесей прессовали на прессе CARVER при использовании усилия прессования 3000 фунтов(13,34 кН) (примеры 1-5) или 2000 фунтов (8,9 кН) (примеры 6-11) и времени воздействия 0,1 мин, получая таблетки со средними значениями прочности примерно 30 килофунтов (133,4 кН) и номинальными массами таблеток 1 и 1,125 г соответственно. Что касается некоторых лекарственных препаратов (примеры 1-5), прегабалин покрывали COMPRITOL 888 посредством грануляции с большим усилием сдвига перед смешиванием с другими эксципиентами. Примеры 12-14. Табл. 6 показывает композиции из лабораторных партий (100 г), содержащие прегабалин и эксципиенты, а табл. 7 показывает высвобождение лекарственного средства в зависимости от времени. Для каждой из композиций лекарственный препарат приготавливали сначала путем объединения прегабалина с COMPRITOL 888 в экструдере-грануляторе. За исключением стеарата магния, остальные компоненты таблетки смешивали с полученными гранулами прегабалина в V-образном смесителе объемом 1 пинта(0,55 л) в течение примерно 15 мин. Стеарат магния просеивали через стандартное сито 20 и объединяли с содержимым V-образного смесителя с помощью шпателя. Полученную грубую смесь затем перемешивали в V-образном смесителе в течение еще 4 мин с получением конечной смеси. Каждую из конечных смесей прессовали с помощью моделированного пресса KORSCH XL 400 (т.е. устройства, моделирующего прессование, PRESSTER), используя среднее усилие прессования примерно 21 кН и среднее время воздействия 12 мс. Таблетки демонстрировали среднюю прочность примерно 20 килофунтов (89 кН) и номинальную массу таблетки примерно 1 г. Примеры 15-23. Табл. 8 показывает композиции из лабораторных партий, которые содержат прегабалин и эксципиенты; табл. 9 показывает образование лактама в зависимости от времени. Каждый из лекарственных препаратов получали при использовании процесса, сходного с процессом, описанным выше в примерах 1214. Примеры 24-30. Табл. 10 показывает композиции из лабораторных партий (вплоть до 4 кг), которые содержат прегабалин и эксципиенты; табл. 11 показывает высвобождение лекарственного средства в зависимости от времени; табл. 12-13 показывают набухание таблеток и изменения твердости таблеток после погружения в водный раствор; и табл. 14 показывает образование лактама в зависимости от времени. Лекарственные препараты из некоторых композиций (примеры с 25 по 29) получали при использовании процессов,сходных с процессами, описанными в примерах с 12-14. Лекарственный препарат из примера 24 приготавливали путем смешивания всех компонентов таблетки, за исключением стеарата магния, в V-образном смесителе объемом 16 кварт (16,6 л) в течение 15 мин. Стеарат магния просеивали через стандартное сито 30 и объединяли с содержимым V-образного смесителя с помощью шпателя. Полученную грубодисперсную смесь затем перемешивали в V-образном смесителе в течение еще 5 мин с получением конечной смеси. Конечную смесь прессовали на прессе(0,6665" 0,6906" (17 мм 17,5 мм), глубина отпечатка 0,0600" (1,5 мм), отжимной край 0,0040" (0,1 мм. Для ромбовидного пресс-инструмента средняя прочность таблетки 8,6 килофунта (38,25 кН) была обнаружена у 10 таблеток при установке усилия предварительного прессования примерно 2,1 кН и установке нижнего предела основного прессования примерно 36 кН. Для треугольного пресс-инструмента средняя прочность таблетки 9,0 килофунтов (40 кН) была обнаружена у 10 таблеток при установке усилия предварительного прессования примерно 2,2 кН и установке нижнего предела основного прессования примерно 39,8 кН. Потеря в массе при испытании на ломкость составила 0,3% для ромбовидных таблеток и 0,2% для треугольных таблеток соответственно. Таблетки, приготовленные с помощью пресса MANESTY Betapress (пример 24), демонстрировали существенно более низкую прочность таблеток, чем те, которые были приготовлены в предыдущих примерах. В результате содержание стеарата магния в композиции снизили с 1 до 0,5% для улучшения прочности таблеток (пример 30). Лекарственный продукт приготавливали способом, сходным с примером 24, за исключением того, что размер партии уменьшили с 4 до 2 кг, и время смешивания после добавления стеарата магния уменьшили до 4 мин. Конечную смесь прессовали на прессе MANESTY Betapress с помощью треугольного пресс-инструмента. При установке усилия предварительного прессования 2,8 кН и установке нижнего предела усилия основного прессования 41,5 кН таблетки имели среднюю(n=10) прочность 15,2 килофунта (67,6 кН) и демонстрировали потерю в массе 0% при испытании на ломкость. Когда изменили установку усилия предварительного прессования и установку нижнего предела усилия основного прессования до 3,1 и 33,2 кН соответственно, таблетки имели среднюю (n=10) прочность 12,1 килофунта (53,82 кН) и демонстрировали потерю в массе 0,07% при испытании на лом- 12012377 кость. Пример 31. Табл. 15 показывает моделированные равновесные минимальные (CMIN) и максимальные (СMAX) концентрации прегабалина в плазме, а также время достижения СMAX (tMAX) для QD фармацевтических композиций, которые содержат 600 мг прегабалина. Композиции удерживаются в желудке в течение tR = 3, 5, 8 или 10 ч и имеют время полного растворения t100 = 6, 8, 10, 12 или 16 ч. С целью сравнения таблица 15 также показывает равновесные РК параметры для IR фармацевтической композиции, содержащей 300 мг прегабалина, которую вводят два раза в сутки. РК имитационное моделирование основано на QD лекарственной форме, имеющей нормализованный профиль растворения, представленный в табл. 16. Кроме того, РК имитационное моделирование,показанное в табл. 15, предполагает, что (1) фармацевтическая композиция находится в желудке в течение заданного периода времени (tR) для каждой модели; (2) общее время (окно) эффективного всасывания составляет 6 ч - среднее окно всасывания для тонкой кишки и восходящей части толстой кишки(время в желудке) - плюс tR; (3) скорость всасывания в нижней части тонкой кишки сходна со скоростью в верхней части; и (4) эффект приема фармацевтической композиции с пищей, перед сном или с пищей и перед сном не влияет на скорость всасывания. Показано, что пища задерживает tMAX IR препаратов, но,по-видимому, не влияет на степень всасывания лекарственного средства. Однако сон, вероятно, будет снижать скорость всасывания лекарственного средства, так что имитационное моделирование может недооценить задержку в tMAX. Как отмечено выше, результаты в табл. 15 основаны на 6-часовом среднем окне всасывания, связанном с IR лекарственным препаратом - РК профили отдельных пациентов, получающих QD дозу, могут различаться. Действительно, РК имитационное моделирование для QD лекарственной формы, содержащей 600 мг прегабалина и обнаруживающей t100 12 ч, a tR 5 ч, и в которой tR варьирует от 3,4 до 7,7 ч,говорит о том, что t100 (или t90), которое приблизительно на 4-6 ч больше чем tR, уменьшает вариабельность среди субъектов. Пример 32. Фармакокинетические исследования с использованием разовой дозы проводили, чтобы определить действие QD препарата из примера 30. QD Лекарственную форму давали (1) натощак, (2) после завтрака с высоким содержанием жира (утреннее лечение) и (3) после ужина с высоким содержанием жира (вечернее лечение) в соответствии с нормативами, установленными Управлением по контролю за пищевыми продуктами и лекарственными средствами США. См. Министерство здравоохранения и социальных служб США, Управление по контролю за пищевыми продуктами и лекарственными средствами, Центр по оценке и исследованию лекарственных средств, Guidance for Industry, Food-Effect Bioavailability andFed Bioequivalence Studies (December 2002). В данном описании термин "с высоким содержанием жира" означает, что приблизительно 50% общей калорийности еды обеспечивались за счет жиров. Фармакокинетические результаты этих трех схем лечения сравнивали с результатами, полученными для идентичной дозы (300 мг) препарата с немедленным высвобождением (капсула), содержащего прегабалин, моногидрат лактозы, кукурузный крахмал и тальк. На основании значений CMAX и tMAX для прегабалина, максимальное воздействие было меньше и наблюдалось позже для всех трех схем лечения QD препаратом относительно IR капсулы, что указывает на более низкую скорость всасывания из QD препарата. Среднее tMAX для QD препарата составляло примерно 4 ч при лечении натощак, более чем в 2 раза дольше чем среднее tMAX 1,5 ч для IR капсулы. После приема внутрь еды с высоким содержанием жира tMAX для QD препарата увеличилось приблизительно до 10 ч (9,7 ч для утреннего лечения и 10,7 ч для вечернего лечения). На основании средней площади под кривой зависимости концентрации в плазме от времени от нулевого момента времени до бесконечности,общее воздействие прегабалина для QD препарата, вводимого натощак, составляло менее половины воздействия для IR капсулы. Однако когда QD препарат вводили после еды с высоким содержанием жира,общее воздействие прегабалина как для утреннего, так и для вечернего лечения были сходны с воздействием для IR капсулы. Общее воздействие, достигнутое, когда QD препарат вводили после еды с высоким содержанием жира, было биоэквивалентным IR препарату и должно было достичь приемлемого профиля для введения один раз в сутки. Ссылка на композицию, содержащую "соединение", может включать в себя одно соединение или два или более соединений. Следует понимать, что вышеизложенное описание предназначено для иллюстрации, а не для ограничения. Многие воплощения будут очевидны специалистам в данной области техники при чтении вышеизложенного описания. Поэтому объем изобретения следует определять ссылкой на прилагаемую формулу изобретения, наряду с полным объемом эквивалентов, которые озаглавлены в такой формуле изобретения. Раскрытие сущности всех статей и ссылок, включая патенты, заявки на патенты и публикации, включено в данное описание посредством ссылок во всей их полноте и для любых целей. Таблица 4 Высвобождение прегабалина (мас./мас.%) в зависимости от времени (ч). Примеры 1-5 Измерения проводили при 37 С, используя аппарат 3 согласно USP, содержащий 0,06 н. водн. HCl. Каждое из этих данных по высвобождению для примеров 1-3 представляет собой среднее для двух образцов; данные по высвобождению для примеров 4 и 5 представлены для одного образца.- 14012377 Таблица 5 Высвобождение прегабалина (мас./мас.%) в зависимости от времени (ч). Примеры 6-11 Измерения проводили при 37 С, используя аппарат 3 согласно USP, содержащий 0,05 М водн. ацетатный буфер (рН 4,5). Каждое из этих данных по высвобождению для примеров 8-11 является средним для 2 образцов; данные по высвобождению для примеров 6 и 7 представлены для одного образца. Таблица 6 Фармацевтические композиции, содержащие прегабалин (мас./мас.%). Примеры 12-14 Таблица 7 Высвобождение прегабалина (мас./мас.%) в зависимости от времени (ч). Примеры 12-14 Измерения проводили при 37 С, используя аппарат 3 согласно USP, содержащий 0,06 н. водн. HCl. Каждое из этих данных по высвобождению для примеров 12-14 является средним для 2 образцов. Все образцы хранили в открытых бутылках при 40 С и относительной влажности 75%, кроме образца примера 19, который хранили в открытой бутылке. Таблица 10 Фармацевтические композиции, содержащие прегабалин (мас./мас.%). Примеры с 24 по 30- 16012377 Таблица 11 Высвобождение прегабалина (мас./мас.%) в зависимости от времени (ч). Примеры 24-30 Измерения проводили при 37 С, используя аппарат 2 согласно USP, содержащий 0,06 н. водн. HCl. Таблица 12 Размеры таблеток (L, H, W в мм) и объем (V в мм 3) в зависимости от времени (ч). Примеры 24 и 30 Таблица 13 Твердость (гмм) в зависимости от времени (ч). Примеры 24 и 30 Таблица 14 Прегабалин (мас./мас.%) и содержание соответствующего лактама (% на основе массы прегабалина) в зависимости от времени. Примеры 25 и 30- 17012377 Таблица 15 Моделированные равновесные РК параметры для IR и QD лекарственных форм, содержащих прегабалинCMIN имеет место непосредственно перед введением следующей дозы (т.е. через 12 и 24 ч после введения для BID и QD лекарственных форм соответственно). 2 Время после введения последней дозы. 3IR препарат, содержащий 300 мг прегабалина, вводимый два раза в сутки. 4QD препарат, содержащий 600 мг прегабалина. Таблица 16 Количество прегабалина, высвобождаемое из лекарственной формы,в зависимости от времени (нормализованное)- 18012377 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, представляющая собой активный фармацевтический ингредиент и эксципиенты, причем активный фармацевтический ингредиент представляет собой прегабалин или его фармацевтически приемлемый комплекс, соль, сольват или гидрат, а эксципиенты включают матрицеобразующий агент и агент набухания, причем матрицеобразующий агент представляет собой поливинилацетат и поливинилпирролидон, а агент набухания включает поперечно-сшитый поливинилпирролидон,где указанная фармацевтическая композиция адаптирована для перорального введения один раз в сутки. 2. Фармацевтическая композиция по п.1, которая набухает до размера примерно 9 мм или более при контакте с водой. 3. Фармацевтическая композиция по любому из пп.1-2, которая удерживается в желудке субъекта в течение от примерно 3 до примерно 14 ч после перорального введения. 4. Фармацевтическая композиция по любому из пп.1-3, где активный фармацевтический ингредиент высвобождается в течение периода времени, который примерно на 4-6 ч дольше, чем период времени, в течение которого фармацевтическая композиция удерживается в желудке субъекта после перорального введения. 5. Фармацевтическая композиция по любому из пп.1-4, где активный фармацевтический ингредиент высвобождается в течение периода времени от примерно 12 до примерно 20 ч. 6. Фармацевтическая композиция по любому из пп.1-5, в которой активный фармацевтический ингредиент демонстрирует равновесную in vivo CMAX примерно 9 мкг/мл или менее, или равновесную invivo CMIN примерно 0,7 мкг/мл или более, или равновесную in vivo CMAX примерно 9 мкг/мл или менее и равновесную in vivo CMIN примерно 0,7 мкг/мл или более. 7. Фармацевтическая композиция по любому из пп.1-6, где агент набухания дополнительно включает полиэтиленоксид. 8. Фармацевтическая композиция по любому из пп.1-7, которая биоэквивалентна лекарственному препарату с немедленным высвобождением, содержащему прегабалин, моногидрат лактозы, кукурузный крахмал и тальк. 9. Фармацевтическая композиция по любому из пп.1-8 для лечения состояния или расстройства у субъекта, чувствительного к прегабалину. 10. Фармацевтическая композиция по п.9, где состояние или расстройство выбрано из эпилепсии,боли, диабетической периферической невропатии, постгерпетической невралгии, физиологических состояний, связанных с психомоторными стимуляторами, воспаления, повреждения желудочно-кишечного тракта, алкоголизма, бессонницы, фибромиалгии, тревоги, депрессии, мании и биполярного расстройства. 11. Способ лечения состояния или расстройства у субъекта, чувствительного к прегабалину, включающий введение субъекту фармацевтической композиции по любому из пп.1-8, где указанную фармацевтическую композицию вводят перорально один раз в сутки. 12. Способ по п.11, где состояние или расстройство выбрано из эпилепсии, боли, диабетической периферической невропатии, постгерпетической невралгии, физиологических состояний, связанных с психомоторными стимуляторами, воспаления, повреждения желудочно-кишечного тракта, алкоголизма,бессонницы, фибромиалгии, тревоги, депрессии, мании и биполярного расстройства.
МПК / Метки
МПК: A61K 9/20, A61P 25/00, A61K 31/197
Метки: пероральные, прегабалин, введения, содержащие, один, матрицеобразующий, набухания, композиции, сутки, агент, фармацевтические, твёрдые
Код ссылки
<a href="https://eas.patents.su/20-12377-tvyordye-peroralnye-farmacevticheskie-kompozicii-dlya-vvedeniya-odin-raz-v-sutki-soderzhashhie-pregabalin-matriceobrazuyushhijj-agent-i-agent-nabuhaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Твёрдые пероральные фармацевтические композиции для введения один раз в сутки, содержащие прегабалин, матрицеобразующий агент и агент набухания</a>
Предыдущий патент: Иммуно-адъювантная эмульсия
Следующий патент: 1-дезокси-1-n-метиламмония-d-глюцитола сукцинат
Случайный патент: Устройство для утилизации медицинских отходов и способ уплотнения и стерилизации медицинских отходов