Твердая форма целекоксиба, имеющего повышенную биодоступность
Номер патента: 3612
Опубликовано: 26.06.2003
Авторы: Макин Лесли А., Хе Ксиаоронг, Мияке Патрисия Дж., Рорс Брайан Р., Карарли Тугрул Т., Хейджман Майкл Дж., Стефански Кевин Дж.
Формула / Реферат
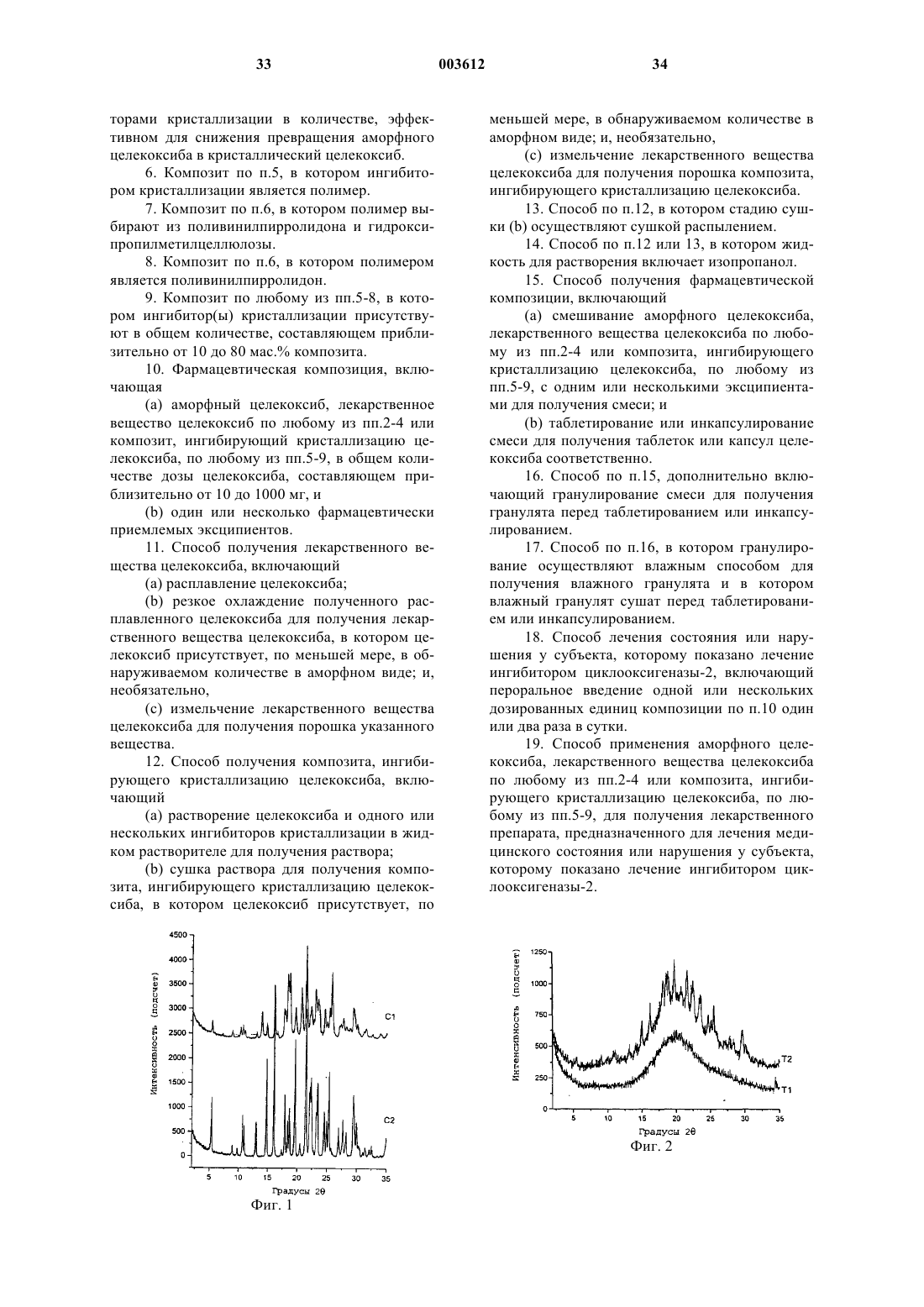
1. Аморфный целекоксиб.
2. Лекарственное вещество целекоксиб, в котором целекоксиб присутствует, по меньшей мере, в обнаруживаемом количестве, в виде аморфного целекоксиба.
3. Лекарственное вещество по п.2, в котором аморфный целекоксиб присутствует в количестве, составляющем приблизительно от 10 до 100 маc.% от всего целекоксиба.
4. Лекарственное вещество по п.2, включающее, по существу, чистофазный аморфный целекоксиб.
5. Композит, ингибирующий кристаллизацию целекоксиба, включающий частицы аморфного целекоксиба или лекарственного вещества целекоксиба по любому из пп.2-4 в ассоциации с одним или несколькими ингибиторами кристаллизации в количестве, эффективном для снижения превращения аморфного целекоксиба в кристаллический целекоксиб.
6. Композит по п.5, в котором ингибитором кристаллизации является полимер.
7. Композит по п.6, в котором полимер выбирают из поливинилпирролидона и гидроксипропилметилцеллюлозы.
8. Композит по п.6, в котором полимером является поливинилпирролидон.
9. Композит по любому из пп.5-8, в котором ингибитор(ы) кристаллизации присутствуют в общем количестве, составляющем приблизительно от 10 до 80 маc.% композита.
10. Фармацевтическая композиция, включающая (a) аморфный целекоксиб, лекарственное вещество целекоксиб по любому из пп.2-4 или композит, ингибирующий кристаллизацию целекоксиба, по любому из пп.5-9, в общем количестве дозы целекоксиба, составляющем приблизительно от 10 до 1000 мг, и (b) один или несколько фармацевтически приемлемых эксципиентов.
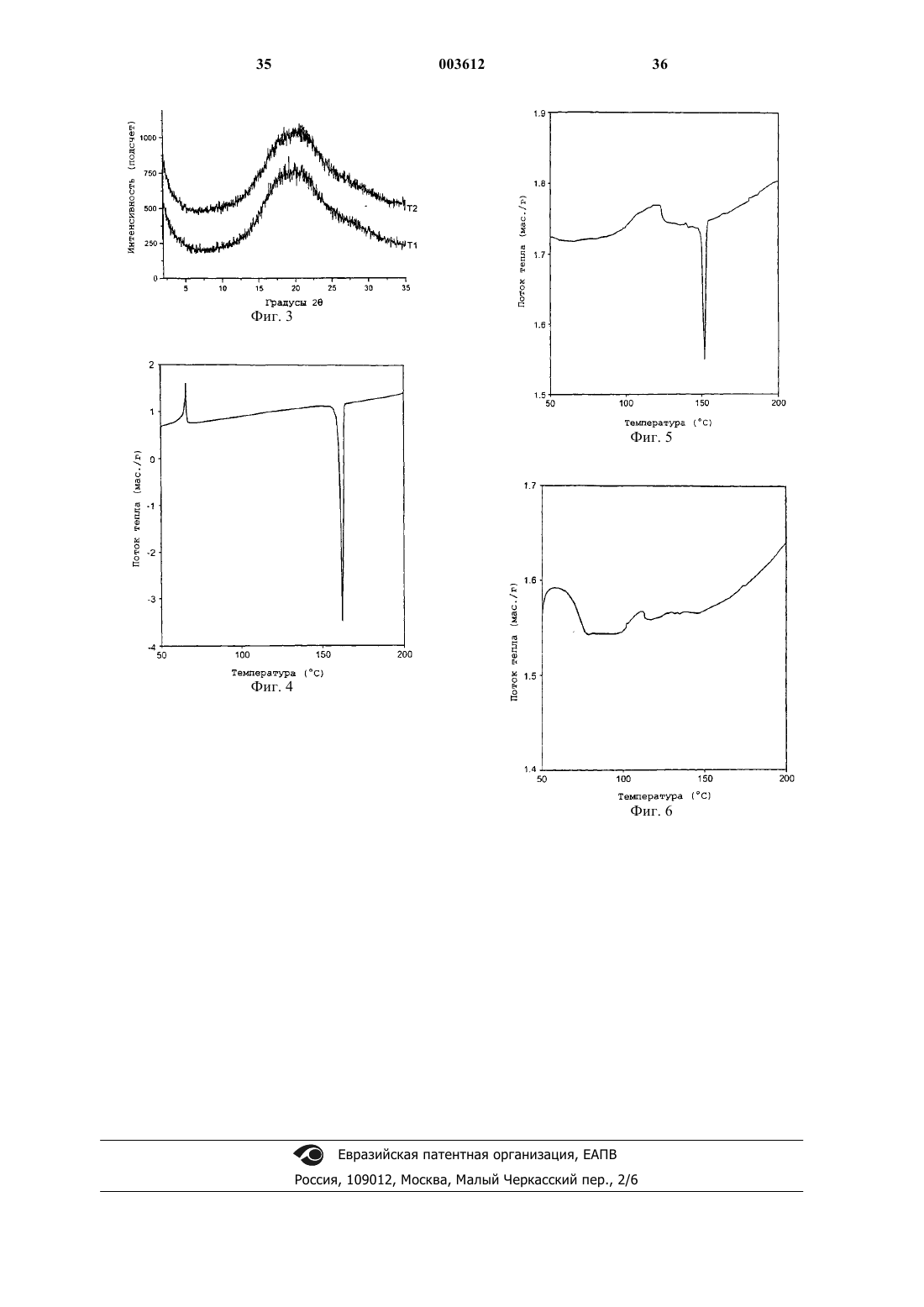
11. Способ получения лекарственного вещества целекоксиба, включающий
(a) расплавление целекоксиба;
(b) резкое охлаждение полученного расплавленного целекоксиба для получения лекарственного вещества целекоксиба, в котором целекоксиб присутствует, по меньшей мере, в обнаруживаемом количестве в аморфном виде; и, необязательно,
(c) измельчение лекарственного вещества целекоксиба для получения порошка указанного вещества.
12. Способ получения композита, ингибирующего кристаллизацию целекоксиба, включающий
(a) растворение целекоксиба и одного или нескольких ингибиторов кристаллизации в жидком растворителе для получения раствора;
(b) сушка раствора для получения композита, ингибирующего кристаллизацию целекоксиба, в котором целекоксиб присутствует, по меньшей мере, в обнаруживаемом количестве в аморфном виде; и, необязательно,
(c) измельчение лекарственного вещества целекоксиба для получения порошка композита, ингибирующего кристаллизацию целекоксиба.
13. Способ по п.12, в котором стадию сушки (b) осуществляют сушкой распылением.
14. Способ по п.12 или 13, в котором жидкость для растворения включает изопропанол.
15. Способ получения фармацевтической композиции, включающий
(a) смешивание аморфного целекоксиба, лекарственного вещества целекоксиба по любому из пп.2-4 или композита, ингибирующего кристаллизацию целекоксиба, по любому из пп.5-9, с одним или несколькими эксципиентами для получения смеси; и
(b) таблетирование или инкапсулирование смеси для получения таблеток или капсул целекоксиба соответственно.
16. Способ по п.15, дополнительно включающий гранулирование смеси для получения гранулята перед таблетированием или инкапсулированием.
17. Способ по п.16, в котором гранулирование осуществляют влажным способом для получения влажного гранулята и в котором влажный гранулят сушат перед таблетированием или инкапсулированием.
18. Способ лечения состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2, включающий пероральное введение одной или нескольких дозированных единиц композиции по п.10 один или два раза в сутки.
19. Способ применения аморфного целекоксиба, лекарственного вещества целекоксиба по любому из пп.2-4 или композита, ингибирующего кристаллизацию целекоксиба, по любому из пп.5-9, для получения лекарственного препарата, предназначенного для лечения медицинского состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2.
Текст
1 Область изобретения Настоящее изобретение относится к селективному лекарственному препарату целекоксибу, ингибирующему циклооксигеназу-2 и, в частности, к твердым формам данного препарата,к фармацевтическим композициям, включающим такие твердые формы, а также к способам их получения. Изобретение также относится к способам лечения опосредованных циклооксигеназой-2 нарушений, включающим введение таких твердых форм или их композиций пациенту, а также применение таких твердых форм для получения лекарственных средств. Предпосылки изобретения Целекоксиб, известный также как 4-[5-(4 метилфенил)-3-(трифторметил)-1 Н-пиразол-1 ил]бензолсульфонамид (I), активный ингредиент Celebrex, выпускаемый Pharmacia Copr.,обладает терапевтически и профилактически полезным, селективным, ингибирующим циклооксигеназу-2 действием и может быть использован для лечения и профилактики специфических, опосредуемых циклооксигеназой-2 нарушений и в целом подобных нарушений. Целекоксиб имеет следующую структуру: Способы получения целекоксиба описаны в патенте США 5466823 Talley et al., а также в патенте США 5892053 ZhiNewaz, включенных в описание в качестве ссылки. В международной патентной публикацииWO 00/32189, включенной в качестве ссылки, указано, что целекоксиб имеет кристаллическую морфологию, проявляющую тенденцию к образованию длинных, когезионных игл. В международной патентной публикацииWO 00/42021, приводимой в качестве ссылки, описана сольватированная кристаллическая форма целекоксиба и способ десольватации такой кристаллической формы. Существует потребность в новых формах целекоксиба, особенно в формах, подходящих для получения быстродействующих композиций. Системы доставки быстродействующих лекарственных препаратов могут обеспечить существенные преимущества по сравнению с обычными лекарственными формами. Обычно быстродействующие препараты обеспечивают короткий период для терапевтического или профилактического ответа по сравнению с известными лекарственными формами с немедленным или пролонгированным высвобождением. Например, при лечении острой боли быстродействующая лекарственная форма целекок 003612 2 сиба обеспечивает быстрое освобождение от боли. Однако целекоксиб представляет определенные трудности при получении быстродействующих лекарственных форм, особенно пероральной быстродействующей лекарственной формы. Например, целекоксиб имеет очень низкую растворимость в водной среде и поэтому нелегко растворяется и диспергируется для быстрого всасывания в желудочно-кишечном тракте при пероральном введении, к примеру, в виде таблеток или капсул. Кроме того, доза целекоксиба сравнительно велика, усугубляя трудности введения достаточной терапевтически активной дозы для быстрого всасывания. Кристаллы целекоксиба также представляют трудности при получении препарата в результате уникальных физических и химических характеристик, таких как электростатические и когезионные свойства, низкий объемный вес,низкая сжимаемость и текучесть. По меньшей мере, частично из-за указанных свойств кристаллы целекоксиба проявляют тенденцию к расслоению и агломерации во время смешивания, что приводит к получению неравномерно перемешанной композиции, содержащей нежелательно большие, нерастворимые агрегаты целекоксиба. Указанные и другие причины затрудняют получение вводимой перорально, быстродействующей композиции, содержащей целекоксиб и имеющей желательную однородность смеси. Биодоступность перорально вводимого лекарственного препарата, измеряемая его поступлением в большой круг кровообращения в кровотоке, зависит, по меньшей мере, от двух основных процессов: растворения лекарственного препарата в желудочно-кишечных жидкостяхvivo) и последующего всасывания растворенного лекарственного препарата. На растворение лекарственного препарата из его носителя влияют несколько факторов, включая площадь поверхности лекарственного препарата, попадающего в среду с растворителем, растворимость лекарственного вещества в конкретной среде с растворителем и движущие силы концентрации насыщения растворенных материалов в среде растворителя. Несмотря на указанные факторы, была установлена сильная корреляция между продолжительностью растворенияin vitro, определяемой стандартными процедурами анализа пероральной лекарственной формы, и скоростью высвобождения лекарственного препарата in vivo. Указанная корреляция установилась в данной области настолько твердо,что продолжительность растворения стала в целом описательной для эффективности высвобождения лекарственного препарата относительно активного компонента конкретной дозированной лекарственной композиции. 3 Если процесс высвобождения лекарственного препарата in vivo медленнее процесса всасывания, то говорят, что всасывание имеет ограниченную скорость растворения. Поскольку растворение предшествует всасыванию в общем процессе, то любое изменение процесса высвобождения лекарственного препарата или растворения впоследствии влияет на всасывание лекарственного препарата. См., например, Lieberman et al. (1989), Pharmaceutical DosageForms: Tablets, Vol. 1, pp. 34-36. Marcel Dekker,New York. Поэтому понятно, что определяемая для композиции продолжительность растворения является одной из важных основных характеристик, принимаемых во внимание при оценке композиций, предназначенных для быстрого действия, особенно в том случае, когда всасывание лекарственного препарата имеет ограниченную скорость растворения. Благодаря своим высокоорганизованным,решеткоподобным структурам кристаллические твердые вещества обычно требуют для растворения значительного количества энергии. Например, энергия, необходимая для освобождения молекулы лекарственного препарата из кристалла, превышает энергию, необходимую для освобождения такой же молекулы лекарственного препарата из некристаллической, аморфной формы. Однако важен тот факт, что кристаллические лекарственные формы, которые были превращены в аморфные формы, со временем возвращаются в устойчивое состояние низкой энергии, а именно, в кристаллическую форму, и, таким образом, могут нарушать надлежащий срок хранения. Аморфная форма целекоксиба до настоящего времени не была известна в данной области. Как описано ниже, лечение целекоксибом подходит для очень широкого спектра состояний и нарушений, опосредуемых циклооксигеназой-2. Поэтому получение аморфной формы целекоксиба, в частности, устойчивой при хранении композиции, включающей такую аморфную форму целекоксиба, имеющей повышенную биодоступность, например, в результате быстрого растворения лекарственного препарата, обеспечит существенный прогресс при лечении опосредуемых циклоогсигеназой-2 состояний и нарушений, особенно при лечении острых нарушений, когда необходимо быстрое освобождение от боли или других симптомов. Краткое описание изобретения Целекоксиб обеспечивает более быстрое наступление лечебного действия, если после перорального введения композиции, включающей целекоксиб, проявляются фармакокинетические свойства, обеспечивающие более высокую максимальную концентрацию сыворотки в крови (Сmax) и/или более короткое время после введения до достижения указанного максимума(Тmax). Предполагается, что более высокая Сmax и/или более короткое Тmax могут быть обеспече 003612 4 ны более быстрым растворением целекоксиба в аморфной форме, чем в кристаллической форме. Соответственно, настоящее изобретение предусматривает аморфный целекоксиб. Также предусматривается лекарственное вещество целекоксиба, в котором присутствует целекоксиб,по меньшей мере. в определяемом количестве в виде аморфного целекоксиба. Термин "лекарственное вещество целекоксиба" в данном описании означает целекоксиб per se, определяемый контекстом, в котором применяется данный термин, и может относиться к не входящему в состав целекоксибу или к целекоксибу, присутствующему в качестве ингредиента фармацевтической композиции. Следующий вариант осуществления настоящего изобретения предусматривает композит, ингибирующий кристаллизацию целекоксиба, включающий частицы аморфного целекоксиба лекарственного вещества целекоксиба в соответствии с данным изобретением, ассоциированные с одним и более ингибиторами кристаллизации. Ингибиторы кристаллизации выбраны и присутствуют в количестве, достаточном, чтобы существенно снизить превращение аморфного целекоксиба в кристаллический целекоксиб. Предпочтительными ингибиторами кристаллизации являются полимеры, образующие с целекоксибом композит целекоксибполимер. Также предусматривается композиция,включающая композит, ингибирующий кристаллизацию целекоксиба, например, композит из целекоксиба-полимера. Композиция включает лекарственные формы, которые могут иметь вид дискретных твердых форм, таких как таблетки, каплеты, пилюли, твердые или мягкие капсулы, лепешки, саше или пастилки; альтернативно, композиция может иметь вид, по существу, гомогенной текучей массы, такой как состоящая из микрочастиц или гранул твердая или жидкая суспензия, например, впитывающая дисперсия, от которой отмеряют разовые лекарственные единицы. Также предусматриваются способы получения аморфного целекоксиба, получения лекарственного вещества целекоксиба в соответствии с данным изобретением и получения композита, ингибирующего кристаллизацию целекоксиба, например, композит целекоксибполимер в соответствии с данным изобретением. Предпочтительный способ получения лекарственного вещества целекоксиба в соответствии с данным изобретением включает (а) стадию плавления целекоксиба, например, кристаллического целекоксиба; и (b) стадию быстрого охлаждения получаемого расплавленного целекоксиба с получением лекарственного вещества целекоксиба, в котором присутствует целекоксиб, по меньшей мере, в определяемом количестве, в аморфном виде. Данный способ 5 может также необязательно включать (с) стадию измельчения лекарственного вещества целекоксиба для получения порошка целекоксиба. Композит, ингибирующий кристаллизацию целекоксиба в соответствии с данным изобретением может быть получен способом,включающим (а) стадию растворения целекоксиба и одного или нескольких ингибиторов кристаллизации в растворяющей жидкости для получения раствора; и (b) стадию сушки раствора для получения композита, ингибирующего кристаллизацию целекоксиба, в котором целекоксиб и ингибитор кристаллизации находятся в тесной связи и в котором существенная часть целекоксиба присутствует в аморфном виде. Данный способ может также необязательно включать (с) стадию измельчения композита,ингибирующего кристаллизацию целекоксиба,для получения порошка композита, ингибирующего кристаллизацию целекоксиба. Лекарственное вещество целекоксиба или его порошок, или композит, ингибирующий кристаллизацию целекоксиба, или его порошок,полученные в соответствии с вышеуказанными процессами, могут быть также включены в состав для получения фармацевтической лекарственной формы. Также предусматривается способ лечения медицинского состояния или нарушения у пациента, которому назначено лечение ингибитором циклооксигеназы-2, включающий введение,например, перорально, композиции в соответствии с данным изобретением в терапевтически эффективном количестве. Такой способ особенно применим в тех случаях, когда медицинское состояние или нарушение сопровождается острой болью. Другие признаки данного изобретения частично станут очевидны, а частично будут описаны ниже. Краткое описание чертежей Фиг. 1 представляет профиль порошковой рентгеновской дифрактограммы лекарственного вещества целекоксиба С 1, полученного в примере 1, по сравнению с кристаллическим целекоксибом С 2; фиг. 2 - профиль порошковой рентгеновской дифрактограммы композита целекоксибаполимера С 3 в соответствии с данным изобретением сразу же после получения (Т 1) и после двухнедельного хранения при 40 С и относительной влажности 75% (Т 2); фиг. 3 - профиль порошковой рентгеновской дифрактограммы композита целекоксибаполимера С 4 в соответствии с данным изобретением сразу же после получения (Т 1) и после двухнедельного хранения при 40 С и относительной влажности 75% (Т 2); фиг. 4 - термограмму дифференциальной сканирующей калориметрии (DSC) лекарственного вещества целекоксиба С 1, не содержащего полимер; 6 фиг. 5 - термограмму DSC композита целекоксиба-полимера С 3 в соответствии с данным изобретением, в котором полимер представляет гидроксипропилметилцеллюлозу; фиг. 6 - термограмму DSC композита целекоксиба-полимера С 4 в соответствии с данным изобретением, в котором полимер представляет поливинилпирролидон. Подробное описание изобретения Аморфный целекоксиб Данное изобретение предусматривает новую аморфную форму целекоксиба. Термин"аморфный" в данном описании относится к находящимся в твердом состоянии частицам, не имеющим правильной кристаллической структуры. Авторы полагают, что аморфные частицы целекоксиба требуют для растворения меньше энергии, чем кристаллические частицы целекоксиба таких же размеров, и что такое уменьшение энергии, необходимой для растворения,способствует, по меньшей мере частично, увеличению скорости растворения и/или сокращению времени начала терапевтического действия,оказываемого аморфным целекоксибом и его композициями. Лекарственное вещество целекоксиба в соответствии с данным изобретением Помимо аморфного целекоксиба per se,данное изобретение предусматривает лекарственное вещество целекоксиба, включающее аморфный целекоксиб. Присутствует, по меньшей мере, обнаруживаемое количество аморфного целекоксиба. Предпочтительно приблизительно от 10 до 100%, более предпочтительно приблизительно от 25 до 100%, еще более предпочтительно приблизительно от 60 до 100% и наиболее предпочтительно приблизительно от 80 до 100 маc.% целекоксиба в лекарственном веществе целекоксиба в соответствии с данным изобретением являются аморфными. В соответствии с конкретным вариантом осуществления данного изобретения по существу весь целекоксиб является аморфным, т.е. лекарственное вещество целекоксиба, по существу, представляет собой чистофазный аморфный целекоксиб. Предпочтительное лекарственное вещество целекоксиба полностью представляет собой вещество в твердом состоянии, в котором фракция целекоксиба, которая не является аморфной(если таковая имеется), является кристаллической. Например, состоящее из микро- или наночастиц лекарственное вещество целекоксиба в соответствии с данным вариантом, может содержать, помимо аморфной фракции целекоксиба, фракцию микрокристаллического или нанокристаллического целекоксиба, хотя такая кристаллическая фракция предпочтительно невелика и составляет, например, менее чем около 50%, более предпочтительно менее чем около 25% и еще более предпочтительно менее чем около 10 маc.% от общего содержания присутствующего целекоксиба. 7 В соответствии с одним из вариантов осуществления данного изобретения количество аморфного целекоксиба в лекарственном веществе целекоксиба достаточно, чтобы обеспечить повышенную скорость растворения, измеряемую в стандартном анализе на растворение invitro, и/или повышенную биодоступность (например, более короткое время для достижения пороговой лечебной концентрации в плазме крови, более высокая Сmax и/или более короткое Тmax), измеряемую во время стандартного фармакокинетического исследования in vivo, по сравнению с другим подобным лекарственным веществом целекоксиба, в котором весь целекоксиб или его существенная часть является кристаллической. Аморфный целекоксиб или лекарственное вещество целекоксиба в соответствии с данным изобретением может быть получено любым подходящим способом без ограничения описываемыми в заявке способами. Один из иллюстративных способов включает (а) стадию плавления целекоксиба, находящегося в твердом состоянии, например, кристаллического целекоксиба; и (b) стадию быстрого охлаждения получаемого расплавленного целекоксиба с получением лекарственного вещества целекоксиба, в котором присутствует целекоксиб, по меньшей мере, в определяемом количестве, в аморфном виде. Данный способ также необязательно включает (с) стадию измельчения лекарственного вещества целекоксиба, получаемого на стадии (b), для получения порошка лекарственного препарата. Стадия плавления (а) может быть осуществлена любым методом, известным в данной области, например, нагреванием целекоксиба в печи при температуре приблизительно от 150 до 180 С. Стадия охлаждения (b) может быть осуществлена любым подходящим способом, например, путем флотации емкости, содержащей расплавленный целекоксиб, в жидком азоте. Необязательная стадия измельчения (с) может быть осуществлена любым подходящим способом, например, измельчением в ступке пестиком или в мельнице, например, media мельнице. Лекарственное вещество целекоксиба или порошок, полученный в соответствии с вышеописанным или любым другим способом, могут быть введены перорально, ректально или парентерально без дальнейшего приготовления, либо в простой суспензии в воде или другой фармацевтически приемлемой жидкости. Альтернативно, лекарственное вещество целекоксиба или его порошок могут быть непосредственно помещены в капсулы для перорального введения. Однако предпочтительно лекарственное вещество целекоксиба или его порошок подвергают дальнейшей обработке, обычно с одним или несколькими эксципиентами, для получения фармацевтической композиции, например, пе 003612 8 роральной лекарственной формы, описанной ниже. Композиты, ингибирующие кристаллизацию целекоксиба Предпочтительный в настоящее время вариант осуществления данного изобретения предусматривает композит, ингибирующий кристаллизацию целекоксиба, включающий частицы аморфного целекоксиба или лекарственного вещества целекоксиба, содержащего, по меньшей мере, обнаруживаемое количество аморфного целекоксиба, в тесной связи с одним или несколькими ингибиторами кристаллизации."Тесная связь" в данном контексте, например,означает целекоксиб, смешанный с ингибитором кристаллизации, заложенный или введенный в ингибитор кристаллизации, образующий покрытие на частицах ингибитора кристаллизации либо vice versa, а также, по существу, гомогенную дисперсию целекоксиба, распределенную по всему ингибитору кристаллизации. Термин "по существу гомогенный" в данном описании относительно композита или фармацевтической композиции, содержащей множество компонентов, означает, что данные компоненты правильно смешаны таким образом, чтобы отдельные компоненты не присутствовали в виде дискретных слоев и не образовывали градиенты концентрации в композиции. Композит, ингибирующий кристаллизацию целекоксиба, в соответствии с данным вариантом предпочтительно включает приблизительно от 1 до 95%, предпочтительно от 10 до 90%, более предпочтительно приблизительно от 25 до 85%, еще более предпочтительно приблизительно от 30 до 80 маc.% целекоксиба. Как указано выше, целекоксиб в таком композите присутствует, по меньшей мере, в обнаруживаемом количестве, в аморфном виде. Предпочтительно приблизительно от 10 до 100%, более предпочтительно приблизительно от 50 до 100%, еще более предпочтительно приблизительно от 75 до 100 маc.% от общего количества целекоксиба в композите составляет аморфный целекоксиб. В композитах в соответствии с данным вариантом фракция целекоксиба может присутствовать в виде микрокристаллического или нанокристаллического целекоксиба, несмотря на то, что указанная фракция предпочтительно невелика, например, составляет менее приблизительно 50%, более предпочтительно менее чем около 25%, еще более предпочтительно приблизительно менее чем около 10 мас.% от общего содержания целекоксиба в композите. Ингибиторы кристаллизации включают любой материал, существенно снижающий превращение аморфного целекоксиба в кристаллический целекоксиб, например, полимеры, углеводы, липиды и т.д. Термин "существенно" относительно снижения указанной конверсии включает полное ингибирование, предотвраще 9 ние, замедление, задержку, снижение или ограничение кристаллизации целекоксиба до измеряемой степени. Следует подчеркнуть, что как отбор ингибитора (ингибиторов) кристаллизации, так и количество ингибитора (ингибиторов) кристаллизации влияют на стабильность содержащегося в нем целекоксиба. Ингибиторами кристаллизации предпочтительно являются полимеры, более предпочтительно полимеры, слаборастворимые в воде. Еще более предпочтительно такие полимеры представляют собой, по существу, непоперечносшитые полимеры. Неограничивающие примеры подходящих полимеров, которые могут быть использованы в качестве ингибиторов кристаллизации, включают, по отдельности или в сочетании, поливинилпирролидон (PVP или повидон, например,Kollidon CLM от BASF), гидроксипропилметилцеллюлозу (НРМС, например MethocelE5 Premium), фталат НРМС, этилцеллюлозу,гидроксиэтилцеллюлозу,натрийкарбоксиметилцеллюлозу (натрийкармеллозу), кальцийкарбоксиметилцеллюлозу, декстран, акацию, крахмалы, такие как натриевый гликолят крахмала(PEG). Повидон и НРМС являются предпочтительными полимерами, применяемыми в качестве ингибиторов кристаллизации и для получения композитов целекоксиб-полимер в соответствии с данным изобретением. НРМС различаются по длине цепи целлюлозной основы и, следовательно, по вязкости,измеряемой, например, при 2 маc.% концентрации в воде. НРМС, применяемая в композитах целекоксиб-полимер в соответствии с данным изобретением, должна иметь вязкость, 2% в воде, составляющую приблизительно от 100 до 100000 сПз (сР), предпочтительно приблизительно от 1000 до 15000 сР, например, около 4000 сР. Молекулярный вес НРМС, применяемой в композитах целекоксиб-полимер в соответствии с данным изобретением, предпочтительно выше чем около 10000, однако, предпочтительно не выше чем около 1500000, более предпочтительно не выше чем около 1000000,еще более предпочтительно не выше чем около 500000, наиболее предпочтительно не выше чем около 150000. НРМС также различаются по относительной степени замещения доступных гидроксильных групп в целлюлозной основе метокси- и гидроксипропоксигруппами. С повышением гидроксипропоксизамещения получаемая НРМС становится более гидрофильной по природе. В композитах целекоксиб-НРМС в соответствии с настоящим изобретением предпочтительно применять НРМС, имеющую приблизи 003612 10 тельно от 15 до 35%, предпочтительно приблизительно от 19 до 32%, более предпочтительно приблизительно от 22 до 30% метоксизамещение и имеющую приблизительно от 3 до 15%, предпочтительно от 4 до 12%, более предпочтительно приблизительно от 7 до 12% гидроксипропоксизамещения. НРМС, которые могут быть использованы в соответствии с настоящим изобретением, доступны под зарегистрированными названиямиShin-Etsu Chemical Co. Примеры особенно подходящих НРМС, имеющих среднюю вязкость,включают Methocel E4M и Methocel К 4 М,которые имеют вязкость, 2% в воде, составляющую около 4000 сР. Примеры НРМС,имеющих более высокую вязкость, включаютMethocel E10M, Methocel K15M и Methocel K100M, которые имеют вязкость, 2% в воде, составляющую 10000 сР, 15000 сР и 100000 сР соответственно. Предпочтительные повидоны, применяемые в композитах целекоксиб-полимер в соответствии с данным изобретением, имеют молекулярную массу, составляющую приблизительно от 2500 до 3000000, предпочтительно приблизительно от 8000 до 1000000 и более предпочтительно приблизительно от 10000 до 400000, например около 50000. Повидон, применяемый в композитах целекоксиб-полимер,предпочтительно имеет динамическую вязкость 10% в воде при 20 С, составляющую приблизительно от 1,3 до 700, предпочтительно приблизительно от 1,5 до 300 и более предпочтительно приблизительно от 3,5 до 8,5 mPa. В композитах, ингибирующих кристаллизацию целекоксиба, например, композитах целекоксиб-полимер, в соответствии с данным изобретением, количество кристаллизационного ингибитора предпочтительно достаточно для того, чтобы при хранении в открытой емкости при комнатной температуре в течение 7 дней превращение аморфного целекоксиба в кристаллический целекоксиб не превышало около 50%, предпочтительно не превышало около 25% и более предпочтительно не превышало около 10 маc.% от всего содержания целекоксиба в композите. Обычно в зависимости от конкретного применяемого полимера (полимеров), в получаемом композите целекоксиб-полимер присутствуют один или несколько полимеров в общем количестве, составляющем приблизительно от 10 до 80%, предпочтительно приблизительно от 15 до 75% и более предпочтительно приблизительно от 25 до 65 маc.%. Массовое отношение целекоксиба к полимеру предпочтительно составляет приблизительно от 1:1000 до 10:1, более предпочтительно приблизительно от 1:10 до 1:5, а еще более предпочтительно приблизительно от 1:2 до 2,5:1. 11 Композит, ингибирующий кристаллизацию, в соответствии с данным изобретением может быть получен любым подходящим способом, не ограничиваемым описываемыми здесь способами. Один из иллюстративных способов включает (а) стадию растворения целекоксиба и одного или нескольких ингибиторов кристаллизации в жидком растворителе с получением раствора; и (b) стадию сушки раствора с получением композита, ингибирующего кристаллизацию целекоксиба, в котором целекоксиб и ингибитор кристаллизации находятся в тесной связи и в котором, по меньшей мере, обнаруживаемая фракция целекоксиба находится в аморфном виде. Данный способ может также необязательно включать стадию (с) измельчения композита,ингибирующего кристаллизацию целекоксиба,для получения порошка композита, ингибирующего кристаллизацию целекоксиба. Подходящие жидкие растворители, которые могут быть использованы для получения композита, ингибирующего кристаллизацию целекоксиба, например, композита целекоксибполимер, могут включать любой фармацевтически приемлемый растворитель, в котором может быть растворен целекоксиб. Для облегчения растворения лекарственного препарата в жидком растворителе могут быть использованы нагревание и перемешивание. Жидкий растворитель может также включать нерастворяющую фракцию, например, воду. Неограничивающие примеры подходящих растворителей, которые могут быть использованы в растворяющих жидкостях в соответствии с данным изобретением,включают, например, смеси вода-спирт, метанол, этанол, изопропанол, высшие спирты, пропиленгликоль, этилкаприлат, пропиленгликольлаурат, PEG, моноэтиловый эфир диэтиленгликоля (DGME), диметиловый эфир тетраэтиленгликоля, моноэтиловый эфир триэтиленгликоля,полисорбат 80 и т.д. Предпочтительными растворителями являются этанол и изопропанол. Неожиданно было обнаружено, что применение изопропанола в качестве растворителя обеспечивает сравнительно высокую нагрузку целекоксиба и полимера в подвергаемом сушке растворе; соответственно изопропанол является в настоящее время особенно предпочтительным растворителем. Стадия сушки (b) может быть осуществлена любым подходящим способом, например,выпариванием, лиофилизацией, обычной сушкой (например, в печи), сушкой распылением и т.д. Сушка распылением является предпочтительным способом сушки. Может быть использован любой подходящий способ сушки распылением, известный в данной области. В целом,сушка распылением представляет метод, при помощи которого раствор, содержащий растворенный лекарственный препарат и ингибитор кристаллизации, быстро распыляют над пото 003612 12 ком теплого воздуха, что приводит к получению сухого порошка. Необязательная стадия измельчения (с) может быть осуществлена любым подходящим способом, например, измельчением пестиком в ступке илимельнице, например, media мельнице. Композит, ингибирующий кристаллизацию целекоксиба, например, композит целекоксиба-полимера или его порошок, полученный в соответствии с вышеописанным способом или любым другим способом, может быть введен перорально, ректально или парентерально без дальнейшего приготовления либо в простой суспензии в воде или иной фармацевтически приемлемой жидкости. Альтернативно, композит или его порошок могут быть непосредственно помещены в капсулы для перорального введения. Однако композит или его порошок предпочтительно подвергают дальнейшей обработке, обычно одним или несколькими дополнительными формообразующими веществами,получая фармацевтическую композицию, например, лекарственную форму для перорального применения, как описано ниже. Фармацевтическая композиция Аморфный целекоксиб, лекарственное вещество целекоксиба или композит, ингибирующий кристаллизацию целекоксиба, предусматриваемые в данном изобретении, могут быть также составлены с одним или несколькими фармацевтически приемлемыми эксципиентами для получения фармацевтической композиции. Термин "эксципиент" в данном описании означает любое вещество, не лечебный агент, применяемое в качестве носителя или наполнителя для доставки лечебного агента пациенту, либо добавляемое к фармацевтической композиции для улучшения ее свойств при обработке или хранении, либо позволяющее или облегчающее получение лекарственной формы композиции в виде отдельного изделия, такого как капсула или таблетка, подходящего для перорального введения. Эксципиенты включают (в качестве иллюстрации, а не ограничения) разбавители,дезинтегрирующие агенты, связующие агенты,адгезивы, увлажняющие агенты, смазывающие агенты, вещества, способствующие скольжению, ингибиторы кристаллизации, агенты, модифицирующие поверхность, вещества, добавляемые для маскировки или устранения неприятного вкуса или запаха, вкусовые вещества,красители, ароматизаторы, а также вещества,добавляемые для улучшения внешнего вида композиции. Эксципиенты, применяемые в композициях в соответствии с данным изобретением, могут быть твердыми или жидкими либо теми и другими вместе. Композиции в соответствии с данным изобретением, содержащие эксципиенты, могут быть получены любым известным в фармации способом, включающим смешивание 13 эксципиента с лекарственным препаратом или терапевтическим агентом. Композиция в соответствии с данным изобретением содержит необходимое количество целекоксиба на лекарственную единицу, и если она предназначена для перорального введения, композиция может быть в виде, например, таблетки, каплеты, пилюли,твердой или мягкой капсулы, лепешки, крахмальной облатки, расфасованного порошка,гранул, суспензии, эликсира, жидкости или любом другом виде, подходящем для такого введения. Если композиция предназначена для парентерального введения, она может быть в виде,например, суспензии. Если композиция предназначена для ректального введения, она может быть в виде, например, суппозитория. В настоящее время предпочтительными являются пероральные лекарственные формы, каждая из которых содержит заранее установленное количество лекарственного препарата, такие как таблетки или капсулы. Ниже приведены неограничивающие примеры эксципиентов, которые могут быть использованы для получения фармацевтических композиций в соответствии с данным изобретением. Композиции в соответствии с данным изобретением необязательно включают один или несколько фармацевтически приемлемых разбавителей в качестве эксципиентов. Подходящие разбавители включают, по отдельности или в сочетании, лактозу, включая безводную лактозу и моногидрат лактозы; крахмал, включая непосредственно прессуемый крахмал и гидролизованные крахмалы (например, Celutab и Emdex); маннит; сорбит; ксилит; декстрозу (например, Cerelose 2000) и моногидрат декстрозы; двуосновный дигидрат фосфата кальция; разбавители на основе сахарозы; кондитерский сахар; одноосновный моногидрат сульфата кальция; дигидрат сульфата кальция; гранулированный тригидрат лактата кальция; декстраты; инозит; гидролизованные твердые вещества зерновых культур; амилозу; целлюлозы, включая микрокристаллическую целлюлозу, источники пищевых сортов - и аморфной целлюлозы (например, Rexcel) и порошковую целлюлозу; карбонат кальция; глицин; бентонит; поливинилпирролидон и т.п. Такие разбавители,при их наличии, составляют в целом приблизительно от 5 до 99%, предпочтительно приблизительно от 10 до 85%, а более предпочтительно приблизительно от 20 до 80% от общей массы композиции. Выбираемый разбавитель или разбавители предпочтительно должны обладать подходящими свойствами текучести, а при получении таблеток - прессуемостью. Лактоза и микрокристаллическая целлюлоза, по отдельности или в сочетании, являются предпочтительными разбавителями. Оба разбавителя химически совместимы с целекоксибом. Сверхгранулированная микрокристаллическая 14 целлюлоза (т.е. микрокристаллическая целлюлоза, добавленная к гранулированной мокрым способом композиции после стадии сушки) может быть использована для улучшения твердости(для таблеток) и/или периода распадаемости. Особенно предпочтительной является лактоза, в частности, моногидрат лактозы. Лактозу обычно применяют для получения композиций, имеющих подходящую скорость высвобождения целекоксиба, устойчивость, докомпрессионную текучесть и/или свойства при высушивании при сравнительно низкой стоимости разбавителя. Она обеспечивает субстрат высокой плотности, способствующий загущению во время гранулирования (при использовании мокрого гранулирования), и благодаря этому улучшает текучие свойства смеси. Композиции в соответствии с данным изобретением необязательно включают один и более фармацевтически приемлемых расщепляющих агентов в качестве эксципиентов, особенно при получении таблеток. Подходящие расщепляющие агенты включают, по отдельности или в сочетании, крахмалы, включая натриевый гликолят крахмала (например, Explotab от PenWest) и предварительно желатинизированные кукурузные крахмалы (например, National 1551, National 1550 и Colocorn 1500), глины(например, Veegum HV), целлюлозы, такие как очищенная целлюлоза, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза и натрийкарбоксиметилцеллюлоза, натрийкроскармеллоза (например, Ac-DiSol от FMC), альгинаты, кросповидон и смолы, такие как агаровая, гуаровая смола, смола из бобов рожкового дерева, смола karaya, пектиновая смола и трагакант. Дезинтегрирующие агенты могут быть добавлены на любой подходящей стадии во время получения композиции, особенно перед гранулированием или во время стадии смазывания перед прессованием. Такие расщепляющие агенты, при их наличии, составляют в целом приблизительно от 0,2 до 30%, предпочтительно приблизительно от 0,2 до 10%, а более предпочтительно приблизительно от 0,2 до 5% от общей массы композиции. Натрийкроскармеллоза является предпочтительным расщепляющим агентом для расщепления таблеток или капсул и, при ее наличии,предпочтительно составляет приблизительно от 0,2 до 10%, более предпочтительно приблизительно от 0,2 до 7%, а еще более предпочтительно приблизительно от 0,2 до 5% от общей массы композиции. Натрийкроскармеллоза обеспечивает хорошее внутригранулярное расщепление гранулированных композиций в соответствии с настоящим изобретением. Композиции в соответствии с данным изобретением необязательно включают в качестве эксципиентов один или несколько фармацевтически приемлемых связывающих агентов или 15 адгезивов, особенно при получении таблеток. Такие связывающие агенты и адгезивы предпочтительно придают таблетируемому порошку достаточную силу сцепления, обеспечивая нормальную обработку, такую как калибровка,смазка, прессование и упаковка, но все-таки не препятствуют расщеплению таблетки и всасыванию композиции при проглатывании. Подходящие связывающие агенты и адгезивы включают, по отдельности или в сочетании, акацию; трагакант; сахарозу; желатин; глюкозу; крахмалы, такие как, но не ограничиваемые ими, предварительно желатинизированные крахмалы (например, National 1511 и National 1500); целлюлозы, такие как, но не ограничиваемые ими,натрий метилцеллюлоза и кармеллоза (например, Tylose); альгиновую кислоту и ее соли; алюмосиликат магния; PEG; гуаровую смолу; полисахаридные кислоты; бентониты; повидон,например, повидон К-15, К-30 и К-29/32; полиметакрилаты; НРМС; гидроксипропилцеллюлозу (например, Klucel); и этилцеллюлозу (например, Ethocel). Такие связывающие агенты и/или адгезивы, при их наличии, составляют в целом приблизительно от 0,5 до 25%, предпочтительно приблизительно от 0,75 до 15%, а еще более предпочтительно приблизительно от 1 до 10% от общей массы композиции. Композиции в соответствии с данным изобретением необязательно включают в качестве эксципиентов один или несколько фармацевтически приемлемых увлажняющих агентов. Предпочтительно выбирают увлажняющие агенты, способные поддерживать тесную связь целекоксиба с водой, т.е. состояние, которое предпочтительно улучшает биодоступность композиции. Неограничивающие примеры поверхностно-активных веществ, которые могут быть использованы в качестве увлажняющих агентов в композициях в соответствии с данным изобретением, включают соединения четвертичного аммония, например, бензалконийхлорид, бензэтонийхлорид и цетилпиридинийхлорид, диоктилнатрий сульфосукцинат, полиоксиэтиленалкилфениловые эфиры, например, ноноксинол 9,ноноксинол 10 и октоксинол 9, полоксамеры(блок-сополимеры полиоксиэтилена и полиоксипропилена), глицериды и масла полиоксиэтиленовой жирной кислоты, например, полиоксиэтилен (8) каприловые/каприновые моно- и диглицериды (например, Labrasol от Gattefosse),полиоксиэтилен (35) касторовое масло и полиоксиэтилен (40) гидрированное касторовое масло; полиоксиэтиленалкиловые эфиры, например, полиоксиэтилен (20) кетостеариловый эфир, сложные эфиры полиоксиэтиленовых жирных кислот, например, полиоксиэтилен (40) стеарат, полиоксиэтиленовые сорбитановые сложные эфиры, например полисорбат 20 и полисорбат 80 (к примеру, Tween 80 от ICI),сложные эфиры пропиленгликолевых жирных 16 кислот, например пропиленгликоль лаурат (к примеру, Lauroglycol от Gattefosse), натрий лаурилсульфат, их жирные кислоты и соли, например олеиновая кислота, натрий олеат и триэтаноламинолеат, сложные эфиры жирных кислот глицерина, например моностеарат глицерина, сложные эфиры сорбитана, например сорбитан монолаурат, сорбитан монопальмитат и сорбитан моностеарат, тилоксапол, а также их смеси. Такие увлажняющие агенты, при их наличии, составляют в целом приблизительно от 0,25 до 15%, предпочтительно приблизительно от 0,4 до 10%, а более предпочтительно приблизительно от 0,5 до 5% от общей массы композиции. Предпочтительными являются увлажняющие агенты, представляющие собой анионные поверхностно-активные вещества. Особенно предпочтительным увлажняющим агентом является лаурилсульфат натрия. Лаурилсульфат натрия, при его наличии, составляет приблизительно от 0,25 до 7%, более предпочтительно приблизительно от 0,4 до 4%, а еще более предпочтительно приблизительно от 0,5 до 2% от общей массы композиции. Композиции в соответствии с данным изобретением необязательно включают один или несколько фармацевтически приемлемых смазывающих агентов (включая антиадгезивы и/или вещества, способствующие скольжению) в качестве эксципиентов. Подходящие смазывающие агенты включают, отдельно или в сочетании, бегапат глицерина (например, Compritol 888); стеариновую кислоту и ее соли,включая стеараты магния, кальция и натрия; гидрированные растительные масла (например,Sterotex); коллоидальную двуокись кремния; тальк; воски; борную кислоту; бензоат натрия; ацетат натрия; фумарат натрия; хлорид натрия;Carbowax 6000); олеат натрия; лаурилсульфат натрия; и лаурилсульфат магния. Такие смазывающие агенты, при их наличии, в целом составляют приблизительно от 0,1 до 10%, предпочтительно приблизительно от 0,2 до 8%, а более предпочтительно приблизительно от 0,25 до 5% от общей массы композиции. Стеарат магния является предпочтительным смазывающим агентом, например, применяемым для уменьшения трения между оборудованием и гранулированной смесью во время прессования составов для таблеток. Подходящие антиадгезивы включают тальк, кукурузный крахмал, DL-лейкин, лаурилсульфат натрия и стеараты металлов. Тальк является предпочтительным антиадгезивом или веществом, способствующим скольжению, например, применяемым для уменьшения прилипания состава к поверхностям оборудования, а также для снижения статики в смеси. Тальк, при его наличии, составляет приблизительно от 0,1 до 10%, более предпочтительно приблизительно 17 от 0,25 до 5%, а еще более предпочтительно приблизительно от 0,5 до 2% от общей массы композиции. В области фармацевтики известны и другие эксципиенты, такие как красители, вкусовые вещества и подсластители, которые могут быть использованы в композициях в соответствии с данным изобретением. Таблетки могут иметь покрытие, например, энтеросолюбильное покрытие, или не иметь его. Композиции в соответствии с данным изобретением могут также включать, например, буферные агенты. Один или несколько шипучих агентов могут быть необязательно использованы в качестве дезинтегрирующих веществ и/или для улучшения органолептических свойств композиций в соответствии с данным изобретением. Один или несколько шипучих агентов предпочтительно присутствуют в общем количестве, составляющем приблизительно от 30 до 75%, более предпочтительно приблизительно от 45 до 70%, например, около 60 маc.% от всей композиции, для улучшения дезинтеграции лекарственной формы. В соответствии с особенно предпочтительным вариантом осуществления данного изобретения шипучий агент, присутствующий в твердой лекарственной форме в количестве, меньшем, чем количество, необходимое для улучшения дезинтеграции лекарственной формы, обеспечивает улучшенное диспергирование целекоксиба в водной среде. Без привязывания к теории авторы полагают, что шипучий агент способствует ускорению диспергирования целекоксиба из лекарственной формы в желудочнокишечном тракте, тем самым дополнительно способствуя всасыванию и быстрому наступлению терапевтического действия. Будучи включенным в фармацевтическую композицию в соответствии с данным изобретением для обеспечения диспергирования в желудочнокишечном тракте, но не для улучшения дезинтегрирования, один или несколько шипучих агентов предпочтительно присутствуют в количестве, составляющем приблизительно от 2,5 до 15%, более предпочтительно приблизительно от 5 до 10 маc.% от всей композиции. Подходящие шипучие агенты включают,например, по отдельности или в сочетании, бикарбонат натрия, безводную лимонную кислоту,винную кислоту и вторичный кислый фосфат натрия. Бикарбонат натрия и безводная лимонная кислота являются предпочтительными шипучими агентами. Твердые лекарственные формы в соответствии с данным изобретением могут быть получены любым подходящим способом, не ограниченным описываемыми в заявке способами. Иллюстративный способ включает (а) стадию смешивания аморфного целекоксиба, лекарственного вещества целекоксиба или композита, ингибирующего кристаллизацию целекок 003612 18 сиба, в соответствии с данным изобретением с одним или несколькими эксципиентами с получением смеси, и (b) стадию таблетирования или инкапсулирования смеси для получения таблеток или капсул соответственно. В соответствии с предпочтительным способом твердые лекарственные формы получают способом, включающим (а) стадию смешивания аморфного целекоксиба, лекарственного вещества целекоксиба или композита, ингибирующего кристаллизацию целекоксиба, по данному изобретению с одним или несколькими эксципиентами с получением смеси, (b) стадию гранулирования смеси для получения гранулята, и(с) стадию таблетирования или инкапсулирования смеси для получения таблеток или капсул,соответственно. Стадия (b) может быть осуществлена любым способом сухого или мокрого гранулирования, известным в данной области,предпочтительно, мокрым гранулированием с последующей стадией сушки полученного гранулята перед таблетированием или инкапсулированием. Один или несколько разбавителей,один или несколько дезинтегрирующих агентов и один или несколько связывающих агентов предпочтительно добавляют, например, на стадии смешивания; увлажняющий агент может быть необязательно добавлен, например, на стадии гранулирования; а один или несколько дезинтегрирующих агентов предпочтительно добавляют после гранулирования, но перед таблетированием или инкапсулированием. Смазывающий агент предпочтительно добавляют перед таблетированием. Смешивание и гранулирование могут быть осуществлены по отдельности с незначительными или большими сдвиговыми усилиями. Предпочтительно выбирают процесс, приводящий к получению гранулята,имеющего равномерное содержание лекарственного препарата, который легко дезинтегрируется, имеет достаточно высокую текучесть,позволяющую осуществлять надежный контроль над изменением массы во время наполнения капсул или таблетирования, и который достаточно плотен в массе для того, чтобы позволять обрабатывать партию с применением выбранного оборудования и отдельных доз, подходящих для конкретных капсул или штампов для таблеток. В соответствии с альтернативным вариантом осуществления данного изобретения твердые лекарственные формы получают способом,включающим стадию сушки распылением, на которой аморфный целекоксиб, лекарственное вещество целекоксиба или композит, ингибирующий кристаллизацию целекоксиба, суспендируют с одним или несколькими эксципиентами в одной или нескольких распыляемых жидкостях, предпочтительно неводной распыляемой жидкости, а затем быстро сушат распылением над потоком теплого воздуха. Такая стадия сушки распылением для получения фармацев 19 тической композиции может быть проведена в дополнение к любому процессу сушки распылением, применяемому для получения композита,ингибирующего кристаллизацию целекоксиба,как описано выше, при этом получение указанного композита предпочтительно сочетают со стадией сушки распылением для получения фармацевтической композиции. Гранулят или высушенный распылением порошок, полученный в результате осуществления любого из вышеописанных иллюстративных способов, может быть спрессован или отлит с получением таблеток, либо инкапсулирован с получением капсул. Могут быть использованы обычные способы таблетирования и инкапсулирования, известные в данной области. При необходимости получения таблеток с покрытием применяют общепринятые способы нанесения покрытий. Для таблетируемых композиций в соответствии с данным изобретением предпочтительно выбирают эксципиенты, обеспечивающие период дезинтегрирования, составляющий менее около 30 мин, предпочтительно около 25 мин и менее, более предпочтительно около 20 мин и менее, а еще более предпочтительно около 15 мин и менее, определяемый в результате проведения стандартного испытания на дезинтегрирование. Твердость таблетки может быть любой,подходящей с точки зрения ее обработки, изготовления, хранения и проглатывания. Например,для 100-миллиграммовых таблеток целекоксиба твердость предпочтительно составляет, по меньшей мере, около 4 кР, более предпочтительно, по меньшей мере, около 5 кР, а еще более предпочтительно, по меньшей мере, около 6 кР. Для 200-миллиграммовых таблеток целекоксиба твердость предпочтительно составляет, по меньшей мере, около 7 кР, более предпочтительно, по меньшей мере, около 9 кР, а еще более предпочтительно, по меньшей мере, около 11 кР. Однако таблетируемый материал не должен быть спрессован до такой степени, чтобы впоследствии возникали трудности с гидратацией при воздействии желудочной жидкости. Ломкость таблеток предпочтительно составляет менее около 1,0%, более предпочтительно менее около 0,8%, а еще более предпочтительно менее чем около 0,5%, определяемая в результате проведения стандартного теста. Дозирование целекоксиба Лекарственные формы целекоксиба в соответствии с данным изобретением предпочтительно включают целекоксиб в суточной дозе,составляющей приблизительно от 10 до 1000 мг,более предпочтительно приблизительно от 25 до 400 мг, и наиболее предпочтительно приблизительно от 50 до 200 мг. Композиции в соответствии с данным изобретением включают одну или несколько перорально вводимых лекарственных единиц. Каж 003612 20 дая лекарственная единица включает терапевтически эффективное количество целекоксиба,предпочтительно составляющее приблизительно от 10 до 1000 мг. Термин "лекарственная единица" в данном описании означает порцию фармацевтической композиции, содержащей количество терапевтического или профилактического агента, в данном случае, целекоксиба, подходящее для разового перорального введения и оказывающее терапевтическое действие. Обычно одна лекарственная единица или небольшое количество (приблизительно до 4) лекарственных единиц для разового введения составляет дозу, включающую достаточное количество агента, оказывающего желательное действие. Введение таких доз может быть по необходимости повторено, обычно с частотой, составляющей приблизительно от 1 до 4 раз в сутки. Подразумевается, что терапевтически эффективное количество целекоксиба для субъекта зависит, кроме прочего, от массы его тела. Термин "субъект" в данном описании, которому может быть введен терапевтический агент или его композиция, относится к пациенту-человеку любого пола и возраста, а также относится к любому животному, особенно теплокровному животному, более конкретно к домашнему животному, например кошке, собаке или лошади. Когда субъектом является ребенок или небольшое животное (например, собака), например,сравнительно небольшое количество целекоксиба в предпочтительном интервале, составляющем приблизительно от 10 до 1000, скорее всего, обеспечивает концентрацию в сыворотке крови, соответствующую терапевтической эффективности. Когда субъектом является взрослый человек или большое животное (например,лошадь), то достижение такой концентрации целекоксиба в сыворотке крови, скорее всего,требует введения лекарственных единиц, содержащих сравнительно большее количество целекоксиба. Обычные лекарственные единицы композиции в соответствии с данным изобретением содержат около 10, 20, 25, 37,5, 50, 75, 100, 125,150, 175, 200, 250, 300, 350 или 400 мг целекоксиба. Для взрослого человека терапевтически эффективное количество целекоксиба на лекарственную единицу композиции в соответствии с данным изобретением обычно составляет приблизительно от 50 до 400 мг. Особенно предпочтительное количество целекоксиба на лекарственную единицу составляет приблизительно от 100 до 200 мг, например, приблизительно 100 мг или приблизительно 200 мг. Может быть выбрана лекарственная единица, содержащая определенное количество целекоксиба, соответствующее любой необходимой частоте введения, применяемой для обеспечения желаемой суточной дозы. Суточная доза и частота введения, и, следовательно, выбор соответствующей лекарственной единицы 21 зависят от множества факторов, включая возраст, массу, пол и медицинское состояние субъекта, а также от природы и тяжести состояния или нарушения, и, таким образом, могут широко варьироваться. При введении перорально натощак взрослому человеку 100 мг лекарственная единица предпочтительно достигает Тmax менее чем приблизительно за 90 мин, более предпочтительно менее чем приблизительно за 60 мин и наиболее предпочтительно менее чем приблизительно за 45 мин, при этом Сmax составляет, по меньшей мере, около 100 нг/мл, более предпочтительно,по меньшей мере, около 200 нг/мл. Обычно композиция в соответствии с данным изобретением обеспечивает концентрацию целекоксиба в сыворотке крови, составляющую, по меньшей мере, около 50 нг/мл в течение 30 мин после перорального введения; предпочтительные композиции обеспечивают такую концентрацию всего за 15 мин. Предполагается, что такое быстрое повышение концентрации в сыворотке крови связано с быстрым началом терапевтического действия, оказываемого композициями в соответствии с настоящим изобретением. Термин "пероральное введение" в данном описании означает любую форму доставки терапевтического агента или его композиции субъекту, при которой агент или композицию помещают в ротовую полость субъекта, независимо от того, проглатывается агент или композиция немедленно. Таким образом, "пероральное введение" включает трансбукальное и подъязычное, а также пищеводное введение. Всасывание агента может происходить в любой части или частях желудочно-кишечного тракта, включая ротовую полость, пищевод, желудок, двенадцатиперстную кишку, подвздошную кишку и ободочную кишку. Термин "доставляемый перорально" в данном описании означает "подходящий для перорального введения". Применимость композиций в соответствии с данным изобретением Композиции в соответствии с данным изобретением могут быть использованы для лечения и профилактики весьма широкого спектра нарушений, опосредуемых СОХ-2, включая, но не ограничиваясь ими, нарушения, характеризуемые воспалением, болью и/или лихорадкой. Такие композиции особенно применимы в качестве противовоспалительных веществ, например, при лечении артрита, при этом их дополнительное преимущество заключается в том, что они оказывают существенно менее вредное побочное действие, чем композиции известных нестероидных противовоспалительных лекарственных препаратов (NSAIDs), не обладающих селективностью относительно СОХ-2 через СОХ-1. В частности, композиции в соответствии с данным изобретением обладают пониженной желудочно-кишечной токсичностью и раздражительностью, включая изъязвление и кро 003612 22 вотечение в верхней части желудочнокишечного тракта, оказывают пониженное побочное действие на почки, такое как снижение почечной функции, ведущее к удержанию жидкости и обострению гипертензии, пониженное действие на кровотечение, включая ингибирование функции тромбоцитов, и, возможно, пониженной способностью вызывать приступы астмы у чувствительных к аспирину астматиков,по сравнению с композициями известныхNSAIDs. Таким образом, композиции в соответствии с данным изобретением особенно применимы в качестве альтернативы известнымNSAIDs в тех случаях, когда такие препараты противопоказаны, например, для пациентов с пептическими язвами, гастритом, регионарным энтеритом, язвенным колитом, дивертикулитом или с рецидивами желудочно-кишечных поражений; желудочно-кишечным кровотечением,нарушениями коагуляции, включая анемию,такую как гипопротромбинемия, гемофилия и другие проблемы с кровотечением; заболеванием почек; либо для пациентов перед хирургической операцией или пациентов, принимающих антикоагулянты. Предлагаемые композиции могут быть использованы для лечения различных артритических нарушений, включая, но не ограничиваясь ими, ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит, системная красная волчанка и ювенильный артрит. Такие композиции могут быть использованы для лечения астмы, бронхита, менструальных спазмов, преждевременных родов, тендинита, бурсита, аллергического неврита, инфективности цитомегаловируса, апоптоза, включая ВИЧ-индуцируемый апоптоз, люмбаго, заболеваний печени, включая гепатит, состояний, связанных с заболеваниями кожи, такими как псориаз, экзема, акне, ожоги, дерматит и повреждения, вызванные ультрафиолетовым излучением,включая солнечные ожоги, а также послеоперационные воспаления, включая воспаления после офтальмологических операций, таких как операция по удалению катаракты или операция по поводу рефракции. Такие композиции могут быть использованы для лечения заболеваний желудочнокишечного тракта, таких как воспалительное заболевание кишечника, болезнь Крона, гастрит,слизистый колит и язвенный колит. Такие композиции могут быть использованы для лечения воспалений при таких заболеваниях, как головная боль при мигрени, узелковый периартериит, тиреоидит, гипопластическая анемия, болезнь Ходжкина, склеродермия, ревматическая лихорадка, диабет I типа, заболевание нейромышечного соединения, включая тяжелую миастению, заболевания белого вещества, включая рассеянный склероз, саркоидоз,нефротический синдром, болезнь Бехчета, полимиозит, гингивит, нефрит, гиперчувствитель 23 ность, набухание, возникающее после повреждений, включая отек мозга, ишемию миокарда и т.п. Такие композиции могут быть использованы для лечения офтальмологических заболеваний, таких как ретинит, конъюнктивит, ретинопатии, увенит, глазная фотофобия, а также острое повреждение глазной ткани. Такие композиции могут быть использованы для лечения легочных воспалений, например, воспалений, связанных с вирусными инфекциями и муковисцидозом, а также резорбции костей, например, связанной с остеопорозом. Такие композиции могут быть использованы для лечения некоторых нарушений центральной нервной системы, таких как корковое слабоумие, включая болезнь Альцгеймера, нейродегенерацию, а также повреждений центральной нервной системы в результате удара, ишемии и травмы. Термин "лечение" в данном контексте включает частичное или полное ингибирование слабоумия, включая болезнь Альцгеймера, сосудистую деменцию, деменцию после нескольких инфарктов, пресенильную, алкогольную и старческую деменцию. Такие композиции могут быть использованы для лечения аллергического ринита, респираторного дистресс-синдрома, синдрома в результате эндотоксинового шока и заболеваний печени. Такие композиции могут быть использованы для лечения боли, включая, но не ограничиваясь ими, послеоперационную, зубную и мышечную боль, а также боль от рака. Например,такие композиции могут быть использованы для облегчения боли, лихорадки и воспаления при различных состояниях, включая ревматическую лихорадку, грипп и другие вирусные инфекции,включая насморк, боль в нижней части спины и шее, дисменорею, головную боль, зубную боль,растяжения и напряжения, миозит, невралгию,синовит, артрит, включая ревматоидный артрит,дегенеративные заболевания суставов (остеоартрит), подагрический и анкилозирующий спондилит, бурсит, ожоги и травмы после хирургических и стоматологических процедур. Такие композиции могут быть использованы для лечения и профилактики связанных с воспалением сердечно-сосудистых нарушений,включая сосудистые заболевания, заболевание коронарной артерии, аневризму, сосудистое отторжение, артериосклероз, атеросклероз,включая атеросклероз, вызванный пересадкой сердца, инфаркт миокарда, эмболизм, удар,тромбоз, включая венозный тромбоз, стенокардии, включая нестабильную стенокардию, воспаление коронарных бляшек, индуцированные бактериями воспаления, включая индуцированное хламидиями воспаление, индуцированныевирусами воспаления, а также воспаления, связанные с хирургическими процедурами, такими как сосудистая трансплантация, включая шун 003612 24 тирование коронарной артерии, реваскуляризационные процедуры, включая ангиопластику,введение стента, эндартерэктомию, или иными инвазивными процедурами на артериях, венах и капиллярах. Такие композиции могут быть использованы для лечения связанных с ангиогенезом нарушений у субъекта, например, для ингибирования ангиогенеза опухоли. Такие композиции могут быть использованы для лечения неоплазии, включая метастазы; офтальмологических состояний, таких как отторжение роговичного трансплантата, образование новых сосудов в глазах, сетчатке, включая образование новых сосудов после повреждения или инфекции, диабетическую ретинопатию, дегенерацию желтого пятна, ретролентальную фиброплазию и неоваскулярную глаукому; язвенных заболеваний,таких как язва желудка; патологичиеских, но доброкачественных состояний, таких как гемангиомы, включая гемангиомы у детей, ангиофибромы носоглотки и бессосудистый некроз костей; а также нарушения женской репродуктивной системы, такие как эндометриоз. Такие композиции могут быть использованы для профилактики и лечения доброкачественных и злокачественных опухолей и неоплазии, включая рак, такой как колоректальный рак, рак мозга, костей, эпителиальная клеточная неоплазия (эпителиальная карцинома), такая как карцинома базальных клеток, аденокарцинома,рак желудочно-кишечного тракта, такой как рак губ, рта, пищевода, тонкой кишки, желудка,ободочной кишки, печени, мочевого пузыря,поджелудочной железы, яичников, цервикальный рак, рак легких, молочной железы, кожи,такой как рак сквамозных и базальных клеток,рак предстательной железы, карцинома клеток почек, и другие известные виды рака, поражающие эпителиальные клетки во всем организме. Неоплазии, для которых композиции в соответствии с данным изобретением особенно применимы,включают рак желудочнокишечного тракта, пищевод Баррета (Barret), рак печени, мочевого пузыря, поджелудочной железы, яичников, предстательной железы, цервикальный рак, рак легких, молочной железы и кожи. Такие композиции могут быть также использованы для лечения фиброзов, возникающих в результате радиационного лечения. Такие композиции могут быть использованы для лечения субъектов, имеющих аденоматозные полипы, включая больных с врожденным семейным полипозом (FAP). Кроме того, такие композиции могут быть использованы для профилактики возникновения полипов у пациентов с риском заболевания FAP. Такие композиции ингибируют индуцируемое простаноидами сокращение гладких мышц, ингибируя синтез контрактильных простаноидов, и, следовательно, могут быть использованы для лечения дисменореи, прежде 25 временных родов, астмы и нарушений, связанных с эозинофилами. Они также могут быть использованы для снижения разрежения костей,особенно у женщин, находящихся в менопаузе(например, лечение остеопороза), а также для лечения глаукомы. Композиции в соответствии с данным изобретением предпочтительно применимы для лечения ревматоидного артрита и остеоартрита,для снятия боли в целом (особенно боли после ротоглоточной, общей и ортопедической хирургической операции, а также обострения остеоартрита), для лечения болезни Альцгеймера и химиопрофилактики рака ободочной кишки. Помимо использования для лечения людей, композиции в соответствии с данным изобретением могут быть использованы для ветеринарного лечения домашних, экзотических,сельскохозяйственных животных и т.д., особенно млекопитающих. Более конкретно, композиции в соответствии с данным изобретением могут быть использованы для лечения опосредуемых СОХ-2 нарушений у лошадей, собак и кошек. Способ лечения Настоящее изобретение также предусматривает терапевтический способ лечения состояния или нарушения, при котором показано лечение лекарственным препаратом, ингибирующим СОХ-2, при этом указанный способ включает пероральное введение композиции в соответствии с данным изобретением нуждающемуся в этом субъекту. Схема приема лекарственного средства для профилактики, облегчения или улучшения состояния или нарушения предпочтительно включает его введение один или два раза в сутки, однако она может быть изменена в соответствии с различными факторами. Такие факторы включают тип, возраст, массу, пол,диету и медицинское состояние больного, а также природу и тяжесть нарушения. Таким образом, применяемые в действительности схемы приема лекарственного средства могут широко варьироваться и, следовательно, отличаться от вышеуказанных предпочтительных схем. Вначале лечение может быть начато с применением вышеуказанной схемы приема лекарственного средства. Обычно лечение при необходимости продолжают на протяжении периода времени от нескольких недель до нескольких месяцев или лет до тех пор, пока состояние или нарушение не станет контролируемым или не будет устранено. Субъекты, подвергаемые лечению с применением композиции в соответствии с данным изобретением, могут быть обследованы в установленном порядке при помощи любого способа определения эффективности лечения, хорошо известного в данной области. Непрерывный анализ результатов таких обследований позволяет изменить схему приема во время лечения таким образом, что оптимально эффективные дозы могут быть вве 003612 26 дены в любое время и может быть установлена продолжительность лечения. Таким образом, в ходе лечения могут быть рационально изменены режим лечения и схема приема лекарственного средства так, чтобы вводить наименьшее количество композиции, оказывающее удовлетворительное действие, и чтобы введение продолжалось только на протяжении периода времени,необходимого для успешного лечения указанного состояния или нарушения. Данные композиции могут быть использованы в сочетании с опиоидами и другими аналгетиками, включающими, среди прочих, наркотические аналгетики, агонисты рецептора Мu,агонисты Каппа-рецепторов, ненаркотические(т.е. не вызывающие привыкание) аналгетики,ингибиторы усвоения моноамина, аденозинорегулирующие агенты, производные каннабиноидов, антагонисты вещества Р, антагонисты рецептора нейрокинин-1 и блокаторы натриевых каналов. Предпочтительное сочетанное лечение включает применение композиции в соответствии с данным изобретением вместе с одним или несколькими соединениями, выбранными из следующих соединений: ацеклофенак, ацеметацин, е-ацетамидокапроновая кислота, ацетаминофен, ацетаминосалол, ацетанилид, ацетилсалициловая кислота (аспирин), S-аденозилметионин, алклофенак, алфентанил, аллилпродин,алминопрофен, алоксиприн, альфапродин, алюминий бис(ацетилсалицилат), амфенак, аминохлортеноксазин, 3-амино-4-гидроксимасляная кислота, 2-амино-4-пиколин, аминопропилон,аминопирин, амиксетрин, аммоний салицилат,ампироксикам, амтолметин гуацил, анилеридин,антипирин, антипиринсалицилат, антрафенин,апазон, бендазак, бенорилат, беноксапрофен,бензпиперилон, бензидамин, бензилморфин,бермопрофен, безитрамид, -бисаболол, бромфенак, п-бромацетанилид, ацетат 5-бромсалициловой кислоты, бромсалигенин, буцетин, буклоксиновая (bucloxic) кислота, буколом, буфексамак, бумадизон, бупренорфин, бутацетин,бутибуфен, бутофанол, кальций ацетилсалицилат, карбамазепин, карбифен, карпрофен, карсалам, хлорбутанол, хлортеноксазин, холинсалицилат, цинчофен, цинметацин, цирамадол, клиданак, клометацин, клонитазин, клониксин,клопирак, клов, кодеин, кодеинметилбромид,кодиенфосфат, кодеинсульфат, кропропамид,кротетамид, дезоморфин, дексоксадрол, декстроморамид, дезоцин, диампромид, диклофенак натрий, дифенамизол, дифенпирамид, дифлунизал, дигидрокодеин, дигидрокодеинон энолацетат, дигидроморфин, дигидроксиалюминий ацетилсалицилат, дименоксадол, димефептанол,диметилтиамбутен, диоксафетилбутират, дипипанон, дипроцетил, дипирон, дитазол, дроксикам, эморфазон, энфенамовая (enfenamic) кислота, эпиризол, эптазоцин, этерсалат, этензамид, этогептазин, этоксазин, этилметилтиамбутен, этилморфин, этодолак, этофенамат, этони 27 тазин, эугенол, фелбинак, фенбуфен, фенклозовая (fenclozic) кислота, фендозал, фенопрофен,фентанил, фентиазак, фепрадинол, фепразон,флоктафенин, флуфенамовая (flufenamic) кислота, флуноксапрофен, флуорезон, флупиртин,флупроквазон, флурбипрофен, фосфозал, гентизиновая (gentisic) кислота, глафенин, глукаметацин, гликольсалицилат, гуаиазулен, гидрокодон,гидроморфон, гидроксипетидин, ибуфенак, ибупрофен, ибупроксам, имидазолсалицилат, индометацин, индопрофен, изофезолак, изоладол,изометадон, изониксин, изоксепак, изоксикам,кетобемидон, кетопрофен, кеторолак, плактофенетид, лефетамин, леворфанол, лофентанил, лоназолак, лорноксикам, локсопрофен,лизинацетилсалицилат, магний ацетилсалицилат, меклофенамовая (meclofenamic) кислота,мефенамовая (mefenamic) кислота, меперидин,мептазинол, мезаламин, метазоцин, метадонгидрохлорид, метотримепразин, метиазиноваяand Ther-12 (Analgesic (Dental), Analgesic (Narcotic), Analgesic (Non-narcotic), Anti-inflammatory (Nonsteroidal. Особенно предпочтительные виды комбинационного лечения включают применение композиции в соответствии с данным изобретением с опиоидным соединением, более кон 003612 28 кретно, когда опиоидное соединение представляет собой кодеин, меперидин, морфин или их производное. Композиция целекоксиба в соответствии с данным изобретением может также быть введена в сочетании со вторым селективным лекарственным препаратом, ингибирующим СОХ-2,например, валдекоксибом, рофекоксибом и т.д. Соединение, вводимое в сочетании с целекоксибом, может быть получено отдельно от целекоксиба или вместе с ним в композиции по данному изобретению. Если целекоксиб получают вместе со вторым лекарственным препаратом, например, опиоидным лекарственным препаратом, то второй лекарственный препарат может быть немедленно высвобождаемым, быстродействующим, пролонгированно высвобождаемым или совместно высвобождаемым. Примеры Нижеследующие примеры иллюстрируют различные аспекты настоящего изобретения,однако они не должны рассматриваться как ограничивающие. Пример 1. Лекарственное вещество целекоксиб С 1 и композиты целекоксиба-полимера С 3 и С 4 получают в результате осуществления следующего способа сушки распылением. К растворителю при перемешивании и температуре 70-75 С добавляют целекоксиб в кристаллической форме(известное лекарственное вещество целекоксиб С 2), получая растворы S1, S3 и S4, имеющие состав, указанный в табл. 1. Растворы S1 и S4 получают в 95% этаноле. Раствор S3 получают в 70% изопропаноле. Таблица 1 Состав (мг/мл) растворов S1, S3 и S4 КомпонентS4 Целекоксиб 30 100 30 НРМС 50 Повидон 15 Каждый из растворов S1, S3 и S4 сушат распылением по отдельности при комнатной температуре, применяя распылительную сушилку Yamato GB-21 для получения порошковS1, S3 и S4 соответственно в следующих условиях: (а) скорость потока жидкости - 10 мл/мин;(b) температура воздуха на входе - 115 С; (с) температура воздуха на выходе - 75 С; и (d) высушивающий поток воздуха - 3,75 TMF. Порошки С 3 и С 4 представляют собой композиты целекоксиба-полимера в соответствии с данным изобретением, при этом каждый из них включает 67% целекоксиба и 33% полимера. Пример 2. Лекарственное вещество целекоксиб С 10 получают, осуществляя следующий способ плавления/охлаждения гашением. Приблизительно 5 г кристаллического целекоксиба (известное лекарственное вещество 29 целекоксиб С 2) отвешивают в поднос из металлической фольги и помещают в печь при 180 С на 5 мин, чтобы расплавить целекоксиб. Затем его охлаждают гашением, флотируя поднос из фольги, содержащий расплавленный целекоксиб, на жидком азоте, что приводит к получению лекарственного вещества целекоксиб С 10 в соответствии с настоящим изобретением. Полученное лекарственное вещество может быть осторожно измельчено пестиком в ступке для получения порошка лекарственного вещества целекоксиб. Пример 3. Для определения относительного содержания кристаллического и аморфного целекоксиба в лекарственном веществе целекоксиб С 1 и композитах целекоксиба-полимера С 3 и С 4, полученных в примере 1, применяют порошковый рентгеновский дифракционный (PXRD) анализ,сравниваемый с кристаллическим лекарственным веществом целекоксиб С 2. Данные получают с применением усовершенствованной дифракционной системы Scintag, работающей с математическим обеспечением Scintag DMS/NT. Данная система включает охлаждаемый peltier детектор в твердом состоянии и медный источник рентгеновских лучей, работающий при 45 кВ и 40 мА для получения эмиссии CuK1 при 1,5406 . Отверстие для луча регулируют, применяя расхождение труб и противорассеивающие щели размером 2 и 4 мм соответственно, в то время как противорассеивающие и принимающие щели детектора настраивают на 0,5 и 0,3 мм соответственно. Данные получают от 2 до 35 два-тета (2), применяя сканирующий шаг, составляющий 0,03/точку и время интеграции, составляющее 1 с/точку. Образцы готовят, применяя круглые, загружаемые сверху чашки для образцов из нержавеющей сталиScintag, которые помещают в алюминиевые вставки диаметром 12 мм, чтобы разместить небольшие объемы образца. Результаты анализов PXRD представлены в виде полос на фиг. 1-3. Появление более высоких острых пиков на полосе означает степень кристаллизации, в то время как уплощенные пики означают аморфный материал. Фиг. 1 показывает, что только целекоксиб(без полимера), высушенный распылением из раствора этанола (С 1), дает сильный кристаллический сигнал, подобный сигналу кристаллического контрольного целекоксиба (С 2). Если в лекарственном веществе целекоксиб С 1 и присутствует аморфный компонент, то такой компонент незначителен. Фиг. 2 показывает, что когда целекоксиб сушат распылением с применением НРМС (соотношение маc. 2:1), то получаемый композит целекоксиба-полимера С 3 первоначально (во время Т 1) является некристаллическим, т.е. целекоксиб в данном композите представляет со 003612 30 бой, по существу, чистофазный аморфный целекоксиб. Анализ образца, хранившегося в течение двух недель при 40 С и 75% относительной влажности (во время Т 2), показывает некоторую перекристаллизацию, подтверждаемую наличием кристаллических пиков. Фиг. 3 показывает, что когда целекоксиб сушат распылением с применением повидона(соотношение маc. 2:1), то получаемый композит целекоксиба-полимера С 4 первоначально(во время Т 1) является некристаллическим, т.е. целекоксиб в данном композите представляет собой, по существу, чистофазный аморфный целекоксиб. Анализ образца, хранившегося в течение двух недель при 40 С и 75% относительной влажности (во время Т 2), по существу,не показывает никакой кристаллизации, что подтверждается отсутствием кристаллических пиков. Пример 4. Для определения относительного содержания кристаллического и аморфного целекоксиба в лекарственном веществе целекоксиб С 1 и композитах целекоксиба-полимера С 3 и С 4, полученных в примере 1, применяют дифференциальную сканирующую калориметрию (DSC).DSC осуществляют, применяя калориметр для дифференциального сканирования DSC 2920,ТА Instruments, со следующими параметрами:(а) интервал температур - 50-200 С; (b) скорость нагревания - 2 С/мин, модулирование 0,5 С каждые 30 с; (с) масса образца - 3 мг; (d) герметически запечатанные алюминиевые емкости. Фиг. 4-6 представляют DSC-термограммы высушенных распылением порошков из примера 1. Фиг. 4 представляет термограмму лекарственного продукта целекоксиб С 1, показывающего большую эндотерму плавления при 159,4 С (начало), имеющую площадь 96,42 J/g. Других переходов не наблюдается. Величина эндотермы дает возможность предположить, что существенная часть С 1 является кристаллической. Присутствие аморфного целекоксиба в образце данным способом не обнаруживается. Фиг. 5 представляет термограмму композита целекоксиба-полимера С 3 (соотношение целекоксиба:НРМС составляет 2:1). Данный материал имеет кажущуюся температуру стеклования, составляющую 122,9 С (начало), с последующей небольшой эндотермой плавления при 150,1 С площадью 4,379 J/g. Такая эндотерма показывает, что большая часть целекоксиба в С 3 является аморфной, однако, присутствует небольшое количество кристаллического целекоксиба. Фиг. 6 представляет термограмму композита целекоксиба-полимера С 4 (соотношение целекоксиба и повидона составляет 2:1). Данный материал имеет кажущуюся температуру стеклования, составляющую 111,4 С (начало). Других переходов не наблюдается, подтверждая тем самым, что данный материал, по существу,представляет собой чистофазный аморфный целекоксиб. Пример 5.DSC также применяют для определения относительного содержания кристаллического и аморфного лекарственного вещества целекоксиба С 10, полученного в соответствии с примером 2. DSC осуществляют, применяя калориметр для дифференциального сканирования MDSC, ТАInstrument, со скоростью сканирования, составляющей 5 С/мин. Первое существенное термическое явление наблюдают при температуре, составляющей приблизительно 54 С, которая является температурой стеклования, характерной для аморфного целекоксиба. Экзотермический пик, наблюдаемый при 100-105 С, соответствует явлению кристаллизации и представляет переход аморфного целекоксиба в кристаллическое состояние. Как показывает эндотермический пик, полученный кристаллический целекоксиб плавится приблизительно при 165 С. Пример 6. Таблетки, имеющие состав, указанный в табл. 2, получают из композита целекоксибаполимера С 4, применяя следующую процедуру. Композит С 4, лаурилсульфат натрия и шипучие агенты (лимонная кислота и бикарбонат натрия) смешивают и измельчают в течение 10 мин в мельнице МсСrоnе, получая порошковую смесь. Данную смесь растирают вместе с лактозой,микрокристаллической целлюлозой и натриевым гликолятом крахмала, применяя ступку и пестик для получения измельченной порошковой смеси. Затем данную смесь подвергают прессованию, применяя пресс Carver, для получения таблеток, иллюстрирующих фармацевтическую композицию в соответствии с данным изобретением. Таблица 2 Состав таблеток, полученных из композита целекоксиба-полимера С 4 Компонент Композит С 4 Лаурилсульфат натрия Лимонная кислота Бикарбонат натрия Лактоза Микрокристаллическая целлюлоза Натриевый гликолят крахмала Всего Пример 7. Таблетки, полученные в соответствии с описанием, приведенным в примере 6, сравнивают с капсулой с кристаллическим целекоксибом в исследовании на биодоступность in vivo на собаках. В перекрестном исследовании каждая из шести гончих собак получает 200 мг дозу 32 целекоксиба в виде таблетки, имеющей состав в соответствии с примером 6, а затем после периода вымывания каждая из собак получает 200 мг дозу целекоксиба в виде коммерческой 200 мг капсулы Celebrex, содержащей целекоксиб только в кристаллическом виде. Плазму крови забирают перед введением дозы и через 0,25,0,5, 0,75, 1, 1,5, 2, 3, 5, 8 и 24 ч после ее введения. Измеряют концентрацию целекоксиба в плазме, применяя жидкостную хроматографию/масс-спектрометрию. В соответствии со стандартной процедурой, известной в данной области, полученные данные используют для определения Сmах, Тmах и AUC (площадь под кривой, мера общей биодоступности). Средние результаты для всех собак представлены в табл. 3. Таблетка из примера 6, полученная из аморфного целекоксиба, обеспечивает существенно более высокую Сmах (максимальная концентрация в плазме крови), сравнимую Тmах и существенно более высокую AUC, чем капсула,полученная из кристаллического целекоксиба. В качестве меры сравнительного начала действия,время, необходимое для таблетки в соответствии с данным изобретением, чтобы обеспечить концентрацию в плазме, равную Сmах, обеспечиваемой капсулой из кристаллического целекоксиба, составляет всего лишь 0,5 ч по сравнению с 1,2 ч (Тmах для капсулы из кристаллического целекоксиба). Таблица 3 Биодоступность таблетки из аморфного целекоксиба в соответствии с примером 6 по сравнению с капсулой из кристаллического целекоксибаAUC, нг/млч Относительное время начала действия, ч Таблетка из аморфного целекоксиба 1,4 2130 17900 Капсула из кристаллического целекоксиба 1,2 1011 8470 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Аморфный целекоксиб. 2. Лекарственное вещество целекоксиб, в котором целекоксиб присутствует, по меньшей мере, в обнаруживаемом количестве, в виде аморфного целекоксиба. 3. Лекарственное вещество по п.2, в котором аморфный целекоксиб присутствует в количестве, составляющем приблизительно от 10 до 100 маc.% от всего целекоксиба. 4. Лекарственное вещество по п.2, включающее, по существу, чистофазный аморфный целекоксиб. 5. Композит, ингибирующий кристаллизацию целекоксиба, включающий частицы аморфного целекоксиба или лекарственного вещества целекоксиба по любому из пп.2-4 в ассоциации с одним или несколькими ингиби 33 торами кристаллизации в количестве, эффективном для снижения превращения аморфного целекоксиба в кристаллический целекоксиб. 6. Композит по п.5, в котором ингибитором кристаллизации является полимер. 7. Композит по п.6, в котором полимер выбирают из поливинилпирролидона и гидроксипропилметилцеллюлозы. 8. Композит по п.6, в котором полимером является поливинилпирролидон. 9. Композит по любому из пп.5-8, в котором ингибитор(ы) кристаллизации присутствуют в общем количестве, составляющем приблизительно от 10 до 80 маc.% композита. 10. Фармацевтическая композиция, включающая(а) аморфный целекоксиб, лекарственное вещество целекоксиб по любому из пп.2-4 или композит, ингибирующий кристаллизацию целекоксиба, по любому из пп.5-9, в общем количестве дозы целекоксиба, составляющем приблизительно от 10 до 1000 мг, и(b) один или несколько фармацевтически приемлемых эксципиентов. 11. Способ получения лекарственного вещества целекоксиба, включающий(b) резкое охлаждение полученного расплавленного целекоксиба для получения лекарственного вещества целекоксиба, в котором целекоксиб присутствует, по меньшей мере, в обнаруживаемом количестве в аморфном виде; и,необязательно,(с) измельчение лекарственного вещества целекоксиба для получения порошка указанного вещества. 12. Способ получения композита, ингибирующего кристаллизацию целекоксиба, включающий(a) растворение целекоксиба и одного или нескольких ингибиторов кристаллизации в жидком растворителе для получения раствора;(b) сушка раствора для получения композита, ингибирующего кристаллизацию целекоксиба, в котором целекоксиб присутствует, по 34 меньшей мере, в обнаруживаемом количестве в аморфном виде; и, необязательно,(c) измельчение лекарственного вещества целекоксиба для получения порошка композита,ингибирующего кристаллизацию целекоксиба. 13. Способ по п.12, в котором стадию сушки (b) осуществляют сушкой распылением. 14. Способ по п.12 или 13, в котором жидкость для растворения включает изопропанол. 15. Способ получения фармацевтической композиции, включающий(a) смешивание аморфного целекоксиба,лекарственного вещества целекоксиба по любому из пп.2-4 или композита, ингибирующего кристаллизацию целекоксиба, по любому из пп.5-9, с одним или несколькими эксципиентами для получения смеси; и(b) таблетирование или инкапсулирование смеси для получения таблеток или капсул целекоксиба соответственно. 16. Способ по п.15, дополнительно включающий гранулирование смеси для получения гранулята перед таблетированием или инкапсулированием. 17. Способ по п.16, в котором гранулирование осуществляют влажным способом для получения влажного гранулята и в котором влажный гранулят сушат перед таблетированием или инкапсулированием. 18. Способ лечения состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2, включающий пероральное введение одной или нескольких дозированных единиц композиции по п.10 один или два раза в сутки. 19. Способ применения аморфного целекоксиба, лекарственного вещества целекоксиба по любому из пп.2-4 или композита, ингибирующего кристаллизацию целекоксиба, по любому из пп.5-9, для получения лекарственного препарата, предназначенного для лечения медицинского состояния или нарушения у субъекта,которому показано лечение ингибитором циклооксигеназы-2.
МПК / Метки
МПК: A61P 29/00, A61K 31/415, C07D 231/12
Метки: биодоступность, твердая, форма, имеющего, повышенную, целекоксиба
Код ссылки
<a href="https://eas.patents.su/19-3612-tverdaya-forma-celekoksiba-imeyushhego-povyshennuyu-biodostupnost.html" rel="bookmark" title="База патентов Евразийского Союза">Твердая форма целекоксиба, имеющего повышенную биодоступность</a>
Предыдущий патент: Комбинационная терапия для лечения биполярных расстройств
Следующий патент: Уреидопиперидиновые производные как селективные антагонисты nk3 – рецепторов человека
Случайный патент: Устройство для каротажа скважин